Диарилалканы в качестве эффективных ингибиторов двухъядерных ферментов - RU2466981C1
Код документа: RU2466981C1
Чертежи












Описание
Перекрестная ссылка на родственную заявку
Настоящая заявка претендует на приоритет предварительной заявки на патент США сер. №60/575599, поданной 28 мая 2004 г., озаглавленной «Диарилалканы в качестве эффективных ингибиторов двухъядерных ферментов», которая полностью включена в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к предупреждению и лечению заболеваний и состояний, опосредуемых двухъядерными ферментами. Более конкретно настоящее изобретение относится к способу ингибирования активности фермента, имеющего двухъядерный активный сайт. Настоящее изобретение относится к новым композициям, содержащим один или несколько диарилалкан(ов). Диарилалканы, предлагаемые в настоящем изобретении, можно выделять из одного или нескольких источников растительного происхождения или их можно получать с помощью органического синтеза. Настоящее изобретение относится также к способам выделения указанных соединений из источников естественного происхождения и способам синтеза указанных соединений. В одном из вариантов осуществления изобретения диарилалканы получают путем синтетической модификации встречающегося в естественных условиях соединения, выделенного из источника растительного происхождения.
Предпосылки создания изобретения
Существует большая потребность в продуктах, обладающих способностью ингибировать или предупреждать избыточную пигментацию кожи. Меланин, естественный пигмент кожи, является азотсодержащим полимером, синтезируемым в меланосомах, которые представляют собой связанные с мембраной органеллы, присутствующие в меланоцитах. В зависимости от типа кожи (генетический признак) и условий окружающей среды образуются различные концентрации меланина. Меланоциты представляют собой клетки, присутствующие в базальной мембране эпидермиса, и на их долю приходится от 5 до 10% общего содержания клеток (примерно 1200-1500 меланоцитов на см2). При стимуляции такими факторами как ультрафиолетовый (УФ) свет, происходит быстрое деление меланоцитов, что приводит к производству больших количеств меланина. Затем меланин транспортируется зрелыми меланосомами к кератиноцитам внутри эпидермиса, где проявляется в виде коричневого цвета кожи.
Количество меланоцитов в человеческой коже является более или менее одинаковым вне зависимости от цвета кожи. Цвет кожи зависит в основном от количества и типа продуцируемого меланина (коричневый эумеланин или феомеланин, имеющий цвет от желтого до красновато-коричневого). У азиатов и людей с белой кожей более низкие уровни эумеланина по сравнению с темнокожими людьми и соответственно меньшая защита от воздействия излучения. У людей с рыжими волосами пигментация осуществляется с помощью феомеланина и для них характерен низкий уровень или отсутствие фотопротекции (защита от УФ-облучения). Кроме того, варьируется также распределение меланина в коже. У людей со светлой кожей большая часть пигмента находится в базальном слое, а у людей с темной кожей меланин распространен в коже повсеместно, достигая рогового слоя.
Сверхпроизводство меланина может вызывать различные типы аномальной окраски кожи, окраски волос и другие кожные заболевания и состояния. Известно два основных состояния, связанных с нарушениями пигментации кожи. Потемнение кожи, включающее аномальное повышение уровня меланина, вызванное УФ-облучением и старением; и аномальное распределение кожных пигментов, приводящее к появлению возрастных пятен, печеночных пятен и индуцируемая лекарственным средством и ранением/заболеванием гиперпигментация (Seiberg и др., J. Invest. Dermatol. 115, 2000, с.162; Paine и др., J. Invest. Dermatol. 116, 2001, с.587).
Можно создавать или выбирать модуляторы меланогенеза (производство меланина), обладающие различными механизмами действия, что проиллюстрировано на фиг.1. Как видно из фиг.1, они могут непосредственно вызывать модуляцию структуры и функции меланосомы до синтеза меланина, они могут ингибировать производство или функцию ферментов, таких как тирозиназа, которые участвуют в синтезе меланина, они могут изменять соотношение эумеланина/феомеланина или их функция может заключаться в торможении механизмов, ответственных за перенос меланосом от меланоцитов к кератиноцитам (Briganti и др., Pigment Cell Research 16, 2003, с.101-110).
Тирозиназа представляет собой фермент, имеющий решающее значение для производства меланина. Она катализирует три реакции: гидроксилирование тирозина с образованием 3,4-дигидрофенилаланина (ДОФА), окисление ДОФА с образованием ДОФА-хинона и окисление ДГИ (5,6-дигидроксииндол) с образованием индолхинона (Hearing и др., FASEB, 53, 1991, с.515). Было установлено, что для проявления каталитической активности тирозиназы необходимы как субстрат, так и ионы двухвалентного металла. Процессы, которые в настоящее время используют для ингибирования синтеза меланина с целью отбеливания кожи, основаны прежде всего на применении субстанций, которые ингибируют тирозинкиназную активность либо непосредственно путем взаимодействия с самой тирозинкиназой, либо косвенно, например, путем образования комплекса с требуемыми ионами металлов.
Тирозиназа принадлежит к семейству типа 3 медьсодержащих белков, которые содержат два иона меди в активном сайте. Изучение структуры активного сайта тирозинкиназы показало, что два иона меди имеют близкое пространственное расположение и каждый ион координирован с тремя остатками гистидана через N-ε-атом азота боковой цепи, что проиллюстрировано на фиг.2 (Pfiffner и Lerch, Biochem. 20, 1981, с.6029; Cuff и др., J. Mol. Biol. 278, 1998, с.855). Двухъядерные ионы меди могут находиться в трех основных окислительно-восстановительных формах: восстановленная форма CuI-CuI, форма CuII-О2-CuII, обратимо связанная с О2 в виде пероксида, и покоящаяся форма фермента, в которой ионы Cu2+ обычно связаны небольшим лигандом. Установлено, что окислительно-восстановительное состояние CuII-O2-CuII имеет решающее значение для ферментативной активности тирозиназы. В этом состоянии тирозиназа катализирует интродукцию второй гидрокисльной группы в орто-положение монофенола (такого как тирозин), эта реакция имеет решающее значение для биосинтеза меланина.
Любое соединение, которое препятствует доступу, формированию лиганда или окислению монофенолов в активном сайте тирозиназы, может представлять собой эффективный ингибитор тирозиназы, который может приводить к снижению производства меланина и осветлению цвета кожи. В целом, ионы меди в активном сайте тирозинкиназы можно легко хилатировать с помощью одной пары электронов кислорода, азота, серы и галогенов (Weder и др., Inorg. Chem. 38, 1999, с.1736). На фиг.3 представлены структуры и механизмы действия нескольких известных ингибиторов тирозинкиназы (Briganti и др., Pigment Cell Research 16, 2003, c.101-110; Seo и др., J. Agric. Food Chem. 51, 2003, c.2837).
Из фиг.3 видно, что соединения, имеющие структуры, аналогичные 3,4-дигидроксифенилаланину (ДОФА), такие как гидрохинон, являются как ингибиторами тирозинкиназы, так и меланоцитолитическими агентами (U.S. 5523077). Например, арбутин, выделенный из листьев толокнянки обыкновенной, Uvae ursi, представляет собой встречающийся в естественных условиях бета-глюкопиранозид гидрохинона, который ингибирует тирозинкиназу и оказывает воздействие на синтез меланина в человеческих меланоцитах (Chakraborty и др.. Pigment Cell Res. 11. 1998, с.206; U.S. 5980904). Механизм действия арбутина включает конкуренцию с L-тирозином или L-ДОФА за связывание с активным сайтом тирозинкиназы. Он не подавляет экспрессию или синтез белка (Maeda и Fukuda, J. Pharmacol. Exp.276, 1996, с.765). Синтетические соединения типа арбутина также являются сильными ингибиторами человеческой тирозинкиназы (Sugimoto и др., Chem. Pharm. Bull. 51, 2003, с.798). Кинобеон А, новый дихинон, выделенный из культивируемых клеток сафлора красильного (Carthamus tinctorius L), обладает более высокой ингибирующей активностью в отношении тирозинкиназы, чем койевая кислота (Kanehira и др., Planta Med. 69, 2003, с.457). При применении в течение длительных периодов времени или в высокий концентрациях гидрохиноны обладают серьезными побочными действиями. Кроме того, гидрохиноны могут приводить к депигментации и в результате повышать светочувствительность кожи к воздействию УФ-света.
Наиболее хорошо переносимые отбеливающие субстанции, применяемые в настоящее время, имеют естественное происхождение. Например, койевая кислота представляет собой встречающийся в естественных условиях гидроксил-γ-пирон, получаемый из углеводных растворов, содержащих определенные бактерии. Как видно из фиг.3, койевая acid представляет собой окисленный орто-дигидроксифенол. Известно, что койевая кислота обладает выраженной способностью образовывать хелаты с ионами металлов, прежде всего CuII. (Gerard and Hugel Bull. Soc. Chim, Fr. 42, 1975, с.2404). Она представляет собой выраженный конкрентный ингибитор тирозиназы, но обладающий низкой способностью к связыванию (Cabanes и др., J. Pharm. Pharmacol. 46, 1994, с.982). В современных исследованиях установлено, что койевая кислота действует в качестве образующего мостик лиганда, обладая выраженной способностью к связыванию как с комплексом димеди(II), так и с аддуктом димедь-дикислород, препятствуя тем самым связыванию катехольного субстрата с ферментом (Battaini и др., JBIC 5, 2000, с.262). В указанных ниже патентах заявлено применение койевой кислоты и ее эфиров в качестве отбеливателей кожи (см. U.S. 4369174; 4771060; 5824327; 5427775; 4990330).
Флавоноиды представляют собой другой класс встречающихся в естественных условиях веществ, которые описаны в качестве ингибиторов тирозиназы (Shimizu и др., Planta Med. 66, 2000, с.11; Xie и др., Biochem. 68, 2003, с.487). Активными ингибиторами тирозиназы являются флавоны (Likhitwitayawuid и др., Planta Med. 66, 2002, с.275), флавонолы (Kubo и Kinst-Hori, J. Agric. Food Chem. 47, 1999, с.4121), пренилированные флавоноиды (Kuniyoshi и др., Planta Med. 68, 2002, с.79; Son, Planta Med. 69, 2003, с.559; Kim Biol. Pharm. Bull. 26, 2003, c.1348), флаваны (No, Life Sci. 65, 1999, PL241; Kim, Biomacromolecules 5, 2004, с.474) и дигидрохалконы (Shoji, Biosci. Biotechnol. Biochem. 61, 1997, с.1963).
Другие типы ингибиторов тирозиназы включают: фенольные производные (Sakuma Arch. Pharm. Res. 22, 1999, с.335; Kerry и Rice-Evans, J. Neurochem. 73, 1999, с.247; Battaini, J. Biol. Chem. 277, 2002, с.144606), бензальдегиды (Kubo и Kinst-Hori, Plant Medica 65, 1999, с.19; Chen, J. Enzyme Inhib. Med. Chem. 18, 2003, с.491; Nihei, Bioorg. Med. Chem. 14, 2004, с.681), производные бензойной кислоты (Curto, Biochem Pharmacol. 57, 1999, с.663; Chen и др., J. Protein Chem. 22, 2003, с.607; Miyazawa и др., J. Agric. Food Chem. 51, 2003, с.9653; Kubo и др., Z. Naturforsch [С] 58, 2003, с.713), купферрон (Xie и др., Int. J. Biochem. Cell Biol. 35, 2003, с.1658), бензодипиран из корней Glycyrrhiza uralensis (Yokota и др., Pigment Cell Res. 11, 1998, с.335), тиогидроксильные производные (Park и др., J. Protein Chem. 22, 2003, с.613), терпеноиды (Oh и др., Planta Med. 68, 2002, с.832) и оксазолдинетионы (Seo и др., Planta Med. 65, 1999, с.683). Наиболее эффективными известными встречающимися в естественных условиях ингибиторами тирозиназы являются стилбены (IC50=0,3-5 мкМ) (Shin и др. Biochem Biophys. Res. Commun. 243, 1998, с.801; Ohguchi и др., Biosci. Biotechnol. Biochem. 67, 2003, с.1587), стилбеновые гликозиды (Iida и др., Planta Med. 61, 1995, с.425) и 4-замещенные резорцинолы (Shimizu и др., Planta Med. 66, 2000, с.11).
Изучение зависимости активности от структуры 4-замещенных резорцинолов позволило установить, что гидрофобные и имеющие меньшие по объему заместители, такие как -CH2C6H5, и алкильные группы, т.е. -СН2СН2СН3, обладают наиболее высокой эффективностью, характеризующейся значениями IC50 менее 10 мкМ (Shimizu и др., Planta Med. 66, 2000, с.11). Механизм действия 4-замещенных резорцинолов описан как характеризующееся медленным связыванием конкурентное ингибирование окисления DL-β-(3,4-дигидроксифенил)аланина (DL-ДОФА) (Jimenez и Garcia-Carmona, J. Agric. Food Chem. 45, 1997, с.2061) без какого-либо дополнительного рассмотрения хелатирующих воздействий на металлы, в том числе на двухъядерные ионы меди.
Aloe, представитель семейства лилейных (Lily), является обладающим важными свойствами растением, которое содержит многие биологически активные субстанции (Cohen и др. в: Wound Healing/Biochemical and Clinical Aspects, 10-ое изд. 1992 г., W В Saunders, Philadelphia). Известно около 360 видов Aloe, многие из которых произрастают только в Африке. Исторически получаемые из Aloe продукты применяли в дерматологии для лечения ожогов, язв и других ран. Такое применение стимулировало целый ряд исследований, касающихся идентификации соединений из растений Aloe, которые обладали бы активностью в клинических условиях (см., например, Grindlay и Reynolds, J. of Ethnopharmacology 16, 1986, с.117-151; Hart и др. J. of Ethnopharmacology 23, 1988, c.61-71).
Yagi с соавторами описали группу соединений, выделенных из Aloe, прежде всего алоэзин и одно из его производных 2''-O-ферулоилалоэзин, которые являются эффективными ингибиторами тирозиназы (Yagi и др., Plant Medica, 1987, c. 515-517; Yagi и др., Z. Naturforsch 32 с, 1977, с.731-734). Алоэзин, т.е. С-глюкозилированный 5-метилхромон, ингибирует гидроксилазную активность человеческой тирозиназы в зависимости от дозы, при этом значение IC50 составляет 0,92 мМ, а также ингибирует оксидазную активность в отношении ДОФА в зависимости от дозы, при этом значение IC50 составляет 0,70 мМ, для сравнения значение IC50 койевой кислоты составляет 0,41 мМ, а значение IC50 арбутина составляет 3,02 мМ. Ингибирование алоэзином ферментативной активности тирозиназы и последующего образования меланина подтверждали с помощью клеточного анализа с использованием клеток мышиной меланомы В16 F1. Алоэзин ингибировал биосинтез меланина (IC50=0,167 мМ) в зависимости от дозы (Jones и др.. Pigment. Cell Res. 15, 2002, с.335). Вероятно, механизм действия хромонов алоэ в отношении ингибирования тирозиназы связан с восстановлением ионов меди. Запатентованы как встречающиеся в естественных условиях (U.S. 6451357), так и полусинтетические (U.S. 5801256; U.S. 6083976) хромоны алоэ, а также препаративные формы на основе хромонов алоэ (U.S. 6123959) в качестве отбеливателей кожи.
Для отбеливания кожи применяют также аскорбиновую кислоту (витамин С из синтетических и встречающихся в естественных условиях источников, таких как плоды цитрусовых) и ее производные. Во многих случаях витамин С включают в препаративную форму в сочетании с койевой кислотой или другими ингибиторами тирозиназы (U.S. 4919921; 6458379 и 5916915). Другие известные отбеливатели кожи включают экстракты растений оливы (U.S. 6682763), ненасыщенные жирные кислоты с длинной цепью (U.S. 6669932), куркумины (U.S. 6641845), обладающие ферментативной активностью экстракты (U.S. 6514506), коуместрол (U.S. 6503941), гидроксикарбоновые кислоты (U.S. 6417226; 6365137; 5609875; 5262153), бета-глюканы (U.S. 6251877), хромоны алоэ (U.S. 6083976), фенилаланиновые производные (U.S. 5767158), рутин (U.S. 5145782), эсцинол (U.S. 5728683), салициловые кислоты (U.S. 5700784), ангиогенин (U.S. 5698185), меркаптодекстран (U.S. 6077503), эллаговую кислоту (U.S. 6066312), фосфиновые кислоты (U.S. 6280715), борсодержащие соединения (U.S. 5993835), растительные экстракты (из Pueraria, U.S. 6352685; Morus, U.S. 6197304; 6066312; и 5872254; продукт ферментации мальпигии гранатолистной U.S. 5747006; фураноны U.S. 5602256; и другие соединения U.S. 5773014).
Диарилалканы представляют собой редкий класс встречающихся в естественных условиях веществ. К настоящему времени более 179000 встречающихся в естественных условиях соединений перечислены в Dictionary of Natural Products на CD-ROM (Chapman и Hall/CRC, версия 12:2, январь 2004 г.), из которых только 82 относятся к диарилпропанам (n=3). Broussonetia papyrifera представляет собой лиственное растение семейства тутовых (Moracea) и только из этого рода выделено более 20 диарилпропанов (Keto и др., Chem. Pharm. Bull. 34, 1986, с.2448; Ikuta и др., Chem. Pharm. Bull. 34, 1986, с.1968; Takasugi и др., Chem, Lett. 1984, с.689; Gonzalez и др., Phytochem. 32, 1993, с.433). Биологический анализ, целью которого являлось фракционирование экстракта Broussonetia papyrifera, позволили выявить четыре диарилпропана, которые не обладали способностью ингибировать ароматазу (Lee и др., J. Nat. Prod. 64, 2001, с.1286). Однако два пренилированных диарилпропана, выделенных из этого растения, обладали цитотоксичностью в отношении нескольких раковых клеточных линий (Ко и др., J. Nat. Prod. 62, 1999, с.164), а броуссонин А обладал противогрибковой активностью (Iida и др., Yakugaku Zasshi. 119, 1999, с.964).
Ряд диарилалканов также был выделен из видов р. Iryanthera (Myristicaceae, мускатниковые) (Alvea и др., Phytochem. 14, 1975, с.2832; de Almeida и др., Phytochem. 18, 1979, с.1015; Braz и др., Phytochem. 19, 1980, с.1195; Diaz и др., Phytochem. 25, 1986, с.2395). Четыре дигидрохалкона, выделенные из Iryanthera lancifolia, обладали антиоксидантной активностью (Silva и др., J. Nat. Prod. 62, 1999, с.1475). Ряд диарилпропанов был выделен также из видов р. Virola Myristicaceae (Braz и др., Phytochem. 15, 1976, с.567; Hagos и др., Plant Med. 53, 1987, с.57; Gonzalez и др., Phytochem. 32, 1993, с.433; Kijjoa и др., Phytochem. 20, 1981, с.1385; Talukdar и др., Phytochem. 53, 2000, c.155).
К другим диарилпропанам, выделенным их встречающихся в естественных условиях источников, относятся диарилпропаны, выделенные из Pterocarpus marsupium (Fabaceae, бобовые) (Rao и др., Phytochem. 23, 1984, с.897; Maurya и др., J. Nat. Prod. 48, 1985, с.313), Lindera umbellate (Lauraceae, лавровишня) (Morimoto и др., Chem. Pharm. Bull. 33, 1985, с.2281), Helichrysum mundii (Compositae, сложноцветные) (Bohlmann и др., Phytochem. 17, 1978, с.1935), Viscum angulatum (Loranthaceae, ремнецветниковые) (Lin и др., J. Nat. Prod, 65, 2002, с.638), из Acacia tortilis (Leguminosae, бобовые), которые обладают расслабляющим действием на гладкие мышцы (Hagos и др., Planta Med. 53, 1987, с.27), Xanthocercis zambesiaca (Leguminosae) (Bezuidenhout и др., Phytochem. 27, 1988, с.2329), а также цитотоксические соединения из Knema glomerata (Myristicaceae) (Zeng и др., J. Nat. Prod. 57, 1994, с.376).
В японском патенте JP 05213729 A описано применение синтетических дигидрохалконов в качестве ингибиторов меланина для лечения кожных воспалений, пятен, веснушек и пигментации в результате солнечного ожога. Заявлены соединения, имеющие следующую общую формулу:

в которой X выбирают из Н, ОН или =O; R обозначает Н или Me; и R1-R5независимо друг от друга выбирают из Н, OR и NH2. Таким образом, описанные дигидрохалконы содержат один гидроксильный/метоксильный заместитель на первом фенильном кольце и пять неспецифических заместителей (R1-R5) на втором кольце. Никакую ингибирующую в отношении ферментов активность не выявляли ни для одной из заявленных композиций, в то время как ингибирование меланина определяли по количеству меланина, продуцируемого культивируемыми кожными клетками, и по изменению цвета кожи животных после УФ-стимуляции. При создании настоящего изобретения синтезировали одно из соединений, описанных в JP 05213729 A, а именно 1-(4-гидроксифенил)-3-(4'-гидроксифенил)-1-пропанол, и определяли его способность ингибировать тирозиназу. У этого соединения обнаружена лишь умеренная способность ингибировать тирозиназу (IC50=305 мкМ, таблица 2.) В настоящем изобретении описаны новые диарилалканы, имеющие уникальную схему замещения, в которой по меньшей мере одно из двух ароматических колец Ar1 или Ar2 замещены 1-5 R'-группами


Краткое изложение сущности изобретения
Настоящее изобретение относится к способу ингибирования активности фермента с двухъядерным активным сайтом, который обозначен в настоящем описании как двухъядерный фермент, заключающемуся в том, что пациенту (хозяину), который нуждается в этом, вводят в эффективном количестве один или несколько диарилалкан(ов), где диарилалканы синтезируют и/или выделяют из одного или нескольких видов растений. Примерами двухъядерных ферментов в контексте настоящего описания являются (но не ограничиваясь ими) тирозиназа, аргиназа, уреаза, цитохром-с-оксидаза, оксидаза протонного насоса гема-меди, бифункциональная дегидрогеназа окиси углерода/ацетил-СоА-синтаза, рибонуклеотидредуктаза, метало-бета-лактамаза, Н(+)-АТФаза и другие оксидазы и бактериальная фосфотриэстераза. В одном из вариантов осуществления изобретения двухъядерный фермент представляет собой тирозиназу.
Настоящее изобретение относится также к способу предупреждения и лечения заболеваний и состояний, связанных с активностью двухъядерных ферментов. Способ предупреждения и лечения, предлагаемый в настоящем изобретении, заключается в том, что вводят внутрь или наносят местно пациенту, нуждающемуся в этом, один или несколько диарилалкан(ов) в терапевтически эффективном количестве. В зависимости от ингибируемого двухъядерного фермента диарилалкан можно применять в качестве антимикробного, противогрибкового, антималярийного или антивирусного агента, регулятора производства оксида азота в качестве средств, контролирующих сексуальное возбуждение у мужчин и женщин, противовоспалительного лекарственного средства, антиоксиданта, регулятора метаболизма лекарственных средств и ингибитора роста различных типов рака и плотных опухолей. Диарилалкан можно применять также для предупреждения и лечения болезней периодонта, предракововых состояний ротовой полости, различных типов рака ротовой полости и других злокачественных заболеваний ротовой полости, чувствительности десен и зубов, осложнения после болезни, пульпита, болезненной чувствительности, боли и воспаления, вызванных физической имплантацией оральных зубных протезов, травмой, повреждениями, бруксизмом и другими небольшими ранениями в полости рта, на деснах или на языке, зубным налетом и зубным камнем, декальцификацией зубов, протеолизом и кариесом (кариесный распад).
Настоящее изобретение относится также к способам предупреждения и лечения заболеваний и состояний, связанных со сверхпроизводством или неравномерным распределением меланина, который заключается в том, что вводят внутрь или наносят местно пациенту, нуждающемуся в этом, один или несколько диарилалкан(ов) в терапевтически эффективном количестве. Болезни и состояния, связанные со сверхпроизводством или неравномерным распределением меланина, включают (но не ограничиваясь ими) загар, гиперпигментированные пятна, связанные со старением кожи, болезнями печени, термическими ожогами и местными ранами, пигментацию кожи, связанную с воспалительными состояниями, обусловленными грибными, микробными и вирусными инфекциями, витилиго, карциному, меланому, а также другие состояния кожи млекопитающих.
Способ можно применять также для предупреждения и лечения потемнения и повреждения кожи в результате воздействия ультрафиолетового (УФ) облучения, химических агентов, нагревания, ветра и сухости окружающей среды. И, наконец, способ можно применять для предупреждения и лечения морщин, кожи, напоминающей крупу саго, полос и темных кругов вокруг глаз, смягчения чувствительной кожи и предупреждения и лечения дерматитов и других родственных аллергии состояний кожи. Помимо их применения для предупреждения и лечения указанных выше заболеваний и состояний кожи терапевтические композиции, представленные в настоящем описании, представляют собой эффективные композиции, которые оказывают благоприятное воздействие на гладкость и омоложение кожи, что сопровождается улучшением цвета кожи, повышенной эластичностью, снижением и замедлением старения, заметным омоложением и улучшением текстуры кожи и повышением эластичности, плотности, гладкости и мягкости.
Путем хелатирования с ионами металлов диарилалканы можно применять также для введения важных ионов металлов в кровоток пациента и/или переноса ионов металлов через кожный или гематоэнцефалический барьер, а также через другие мембраны. В этом варианте осуществления изобретения способ заключается в том, что пациенту, нуждающемуся в этом, вводят в терапевтически эффективном количестве один или несколько диарилалкан(ов) в сочетании с ионами металлов, подлежащих введению. Эту способность диарилалканов можно использовать для лечения заболеваний и состояний, включающих (но не ограничиваясь ими) анемию и другие состояния, связанные с дефицитом железа, воспаление; ожирение и сахарный диабет, болезни периодонта, предракововые состояния ротовой полости, различные типы рака ротовой полости и другие злокачественные заболевания ротовой полости, чувствительность десен и зубов, осложнение после болезни, пульпит, болезненную чувствительность, боль и воспаление, вызванные физической имплантацией оральных зубных протезов, травмой, повреждениями, бруксизмом и другими небольшими ранениями в полости рта, на деснах или на зубах, зубным налетом и зубным камнем, декальцификацией зубов, протеолизом и кариесом (кариесный распад), вирусные инфекции, бессонницу, подавленную иммунную функцию, остеопороз, аменорею, дисменорею, эпилепсию, гипертензию, холестеринемию, коронарные и церебральные вазоспазмы, диарею, болезнь Паркинсона, болезнь Альцгеймера, разные типы рака, ревматоидный артрит, мужское бесплодие и дегенерацию желтого пятна. Ионы металлов выбирают из группы, включающей (но не ограничиваясь ими) медь, хром, железо, цинк, бор, литий, селен, кальций, марганец, молибден, магний ионы других металлов.
Согласно следующему варианту осуществления изобретения диалкилалканы и диалкилалканолы можно применять в пищевой промышленности для предупреждения побурения и изменения цвета фруктов, грибов и других пищевых продуктов.
Настоящее изобретение относится также к новой композиции, содержащей один или несколько диарилалканов, где диарилалканы выбирают из группы соединений, представленных следующей общей структурой:
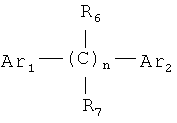
в которой
Ar1 и Ar2 независимо друг от друга выбирают из группы, включающей замещенное 5- или 6-членное ароматическое или гетероароматическое кольцо, где каждое 6-членное ароматическое или гетероароматическое кольцо независимо замещено 1-5 R'-группами




где
R' независимо выбирают из группы, включающей -H, -ОН, -SH, -OR, -CN, -SR, -NH2, -NHR, -NR2, X и гликозид моносахарида или олигосахарида, состоящего из 2-6 моносахаридов, где моносахарид(ы) независимо выбирают из группы, включающей альдопентозу, метилальдопентозу, альдогексозу, кетогексозу и их химические производные; где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I;
R6 и R7 независимо выбирают из группы, включающей -Н, -ОН, -OR, -CN, -NHR, -NH2 и -X, где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I; и
n обозначает 1-10. В предпочтительном варианте осуществления изобретения n обозначает 2-4.
В одном из вариантов осуществления изобретения диарилалканы выбирают из группы, включающей соединения, представленные следующей общей структурой:

в которой
R1, R2, R3, R4, R5,






R6 и R7 независимо друг от друга выбирают из группы, включающей -Н,
-ОН, -OR, -CN, -NHR, -NH2 и -X, где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I; и
n обозначает 1-10. В предпочтительном варианте осуществления изобретения n обозначает 2-4.
В одном из вариантов осуществления изобретения диарилалканы, предлагаемые в настоящем изобретении, выделяют из одного или нескольких растений, выбранных из семейств растений, включая (но не ограничиваясь ими) семейства Compositae, Fabaceae, Lauraceae, Leguminosae, Liliaceae, Loranthaceae, Moracea и Myristicaceae. Диарилалканы, предлагаемые в настоящем изобретении, можно также экстрагировать, концентрировать и очищать из родов высших растений, включая (но не ограничиваясь ими) Acacia, Broussonetia, Dianella, Helichrysum, Iryanthera, Knema, Lindera, Pterocarpus, Viscum и Xanthocercis. Диарилалканы могут находиться в различных частях растений, включая (но не ограничиваясь ими) стебли, кору стеблей, сердцевину деревьев, стволы, кору стволов, ветки, клубни, корни, кору корней, молодые побеги, семена, корневища, цветки и другие репродуктивные органы, листья и другие надземные части. В предпочтительном варианте осуществления изобретения диарилалканы выделяют из растения или растений родов Broussonetia, Dianella и Iryanthera.
В другом варианте осуществления изобретения диарилалканы, предлагаемые в настоящем изобретении, получают с помощью методов синтеза. Под объем настоящего изобретения подпадает способ синтеза диарилалканов и диарилалканолов, заключающийся в восстановлении соединения, которое имеет следующую общую структуру:

в которой
R1-R5 и

В другом варианте осуществления изобретения диарилалканы получают путем синтетической модификации встречающегося в естественных условиях соединения, выделенного из растительного источника. Например, встречающийся в естественных условиях бутеин выделяют из растительного источника, дегидратируют и восстанавливают с получением соответствующего диарилалканола.
В следующем варианте осуществления изобретения диарилалканы получают путем взаимодействия двух соответствующим образом замещенных ароматических соединений. Приемлемыми химическими реакциями для синтеза этих соединений из двух замещенных ароматических соединений являются (но не ограничиваясь ими) альдольная конденсация замещенного бензальдегида и замещенного ацетофенона; реакция Кляйзена-Шмидта или перекрестная альдольная конденсация альдегида и кетона; реакция Гриньяра с использованием галогенида органического магния одного замещенного ароматического кольца для связи с вторым замещенным ароматическим кольцом путем дополнительного взаимодействия карбонильной группы молекулы; перегруппировка Кляйзена путем внутримолекулярной изомеризации, при которой этерифицированный до сложного эфира фенол с соответствующими группами-заместителями должен быть изомеризован для связи с вторыми ароматическими кольцами в орто-положении фенола с последующей реакцией восстановления; и реакция сочетания Сузуки, в которой два замещенных ароматических кольца превращают в арилбороновые кислоты, а затем связывают с помощью галоидного алкила с использованием тщательно подобранного палладиевого катализатора. Эти реакции хорошо известны специалистам в данной области, а условия таких реакций можно определять на основе приведенной в настоящем описании информации, касающейся синтеза указанных соединений.
В настоящем изобретении предложена стратегия объединения анализа ингибирования и химического процесса дерепликации для идентификации активных растительных экстрактов и конкретных соединений среди тех экстрактов, которые специфически ингибируют двухъядерные ферменты. Этот подход включает объединение методов выделения встречающегося в естественных условиях продукта, органического синтеза, молекулярного моделирования и анализов ингибирования ферментов для оптимизации структуры и максимального увеличения эффективности лекарственного средства. Этот метод описан в заявке на патент США сер. №10/185758, поданной 27 июня 2002 г., озаглавленной «Способ получения, скрининга и дерепликации библиотек встречающихся в естественных условиях продуктов для создания терапевтических агентов» («Method for Generating, Screening and Dereplicating Natural Product Libraries for the Discovery of Therapeutic Agents»), которая полностью включена в настоящее описание в качестве ссылки. Эффективность этого метода продемонстрирована с помощью анализа ингибирования тирозиназы, описанного ниже в разделе «Примеры». Чистота диарилалканов, оцененная с помощью способа, предлагаемого в настоящем изобретении, составляет от 0,01 до 100% в зависимости от метода, применяемого для получения соединения(ий).
В предпочтительном варианте осуществления изобретения доза диарилалкана, вводимая пациенту, который нуждается в этом, представляет собой эффективное нетоксичное количество, как правило, составляющее от 0,001 до 100% в пересчете на общую массу конечной композиции и/или от 0,01 до 200 мг на килограмм в пересчете на вес пациента. Специалисты в данной области с помощью обычных клинических тестов могут определять оптимальные дозы для конкретного недомогания, подлежащего лечению. В настоящем изобретении предложены коммерчески приемлемые пути синтеза и/или выделения, очистки и приготовления препаративных форм диарилалканов с получением композиции, предлагаемой в изобретении, которая обладает требуемой физиологической активностью. Композиции, предлагаемые в настоящем изобретении, можно вводить любым методом, известным обычному специалисту в данной области. Пути введения включают (но не ограничиваясь ими) энтеральное (оральное) введение, парентеральное (внутривенное, подкожное и внутримышечное) введение и местное нанесение. Способ лечения, предлагаемый в настоящем изобретении, заключается в том, что пациенту, который нуждается в этом, вводят внутрь или наносят местно в терапевтически эффективном количестве чистые диарилалканы или смесь диарилалканов, синтезированных и/или выделенных из одного растения или нескольких видов растений. В предпочтительном варианте осуществления изобретения композицию применяют местно.
Должно быть очевидно, что как вышеизложенное краткое описание, так и приведенное ниже подробное описание и примеры, даны только с целью иллюстрации и не направлены на ограничение формулы изобретения.
Краткое описание чертежей
На чертежах показано:
на фиг.1 проиллюстрирован процесс меланогенеза, а также различные возможные механизмы регуляции этого процесса;
на фиг.2 - проиллюстрировано строение активного сайта тирозиназы. Как видно из этого чертежа, два иона меди имеют близкое пространственное расположение и каждый ион координирован с тремя остатками гистидана через N-ε-атом азота боковой цепи;
на фиг.3 (а,б) - структура, название, механизм действия и другие эффекты известных ингибиторов тирозиназы;
на фиг.4 - иллюстрации ЖХВР/УФ-хроматограмм ВПО-фракции, которая содержит UP288 (1-(2-метокси-4-гидроксифенил)-3-(2'-гидрокси-5'-метоксифенил)пропан (1) в качестве основного компонента;
на фиг.5 - химическое строение и13С-ЯМР-спектр UP288 (1);
на фиг.6 - кривые зависимости ингибирующей активности в отношении тирозиназы от дозы и значения IC50 UP288 и койевой кислоты;
на фиг.7 - схема выделения с проведением биологического анализа двух активных соединений (UP302a и UP302b) из Dianella ensifolia (P0389) (все растение целиком);
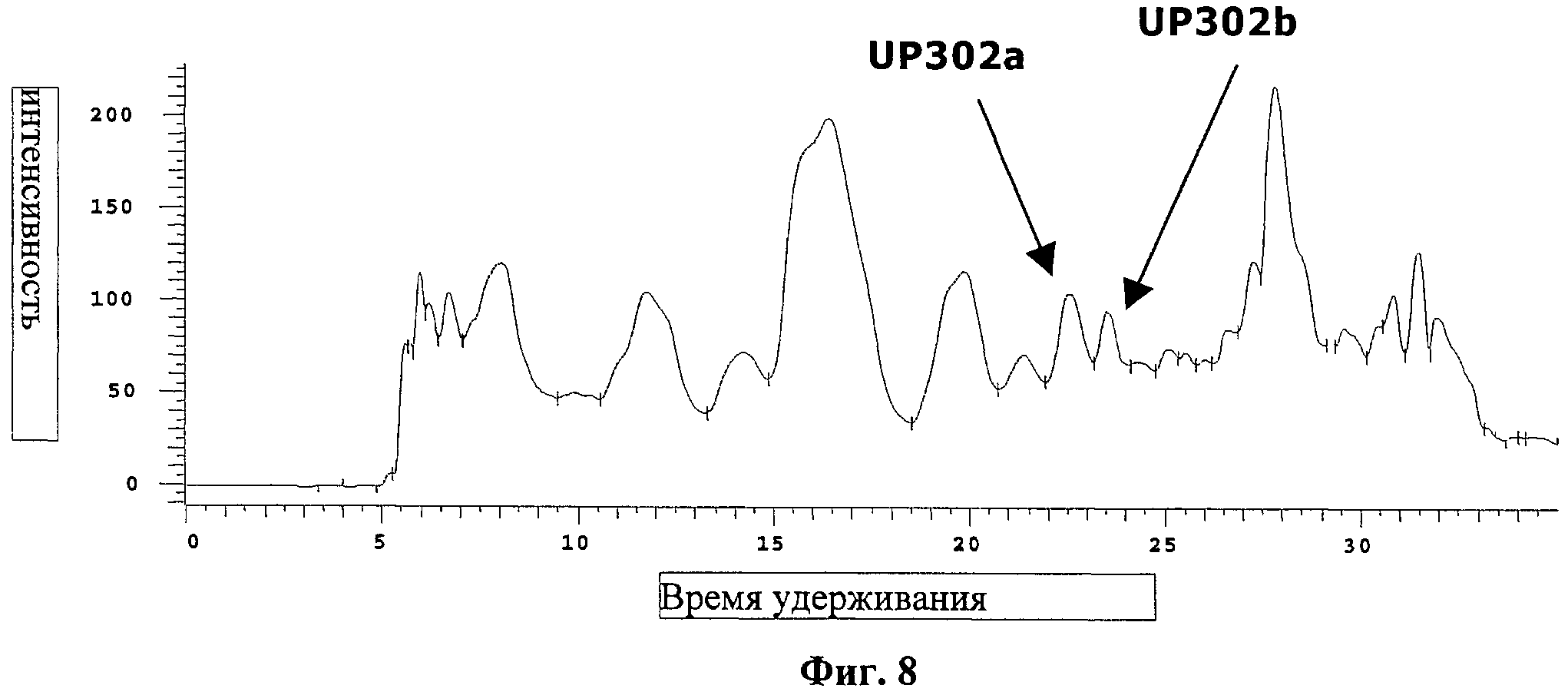
на фиг.8 - ЖХВР/УФ-хроматограмма обогащенной UP302-фракции после нескольких разделений на колонке;
на фиг.9 - gHSQC-спектр UP302a (2), иллюстрирующий связи между протонами и углеродами;
на фиг.10 - графическая иллюстрация ингибирования активности тирозиназы при использовании различных концентраций ингибитора UP302a и субстрата L-ДОФА. Этот кинетический анализ показал, что UP302a является конкурентным ингибитором фермента тирозиназы;
на фиг.11 - иллюстрация ингибирования производства эндогенного меланина в клетках мышей линии В16 F1 койевой кислотой и UP302a (2). Каждый образец оценивали в трех повторностях с использованием 10 различных концентраций;
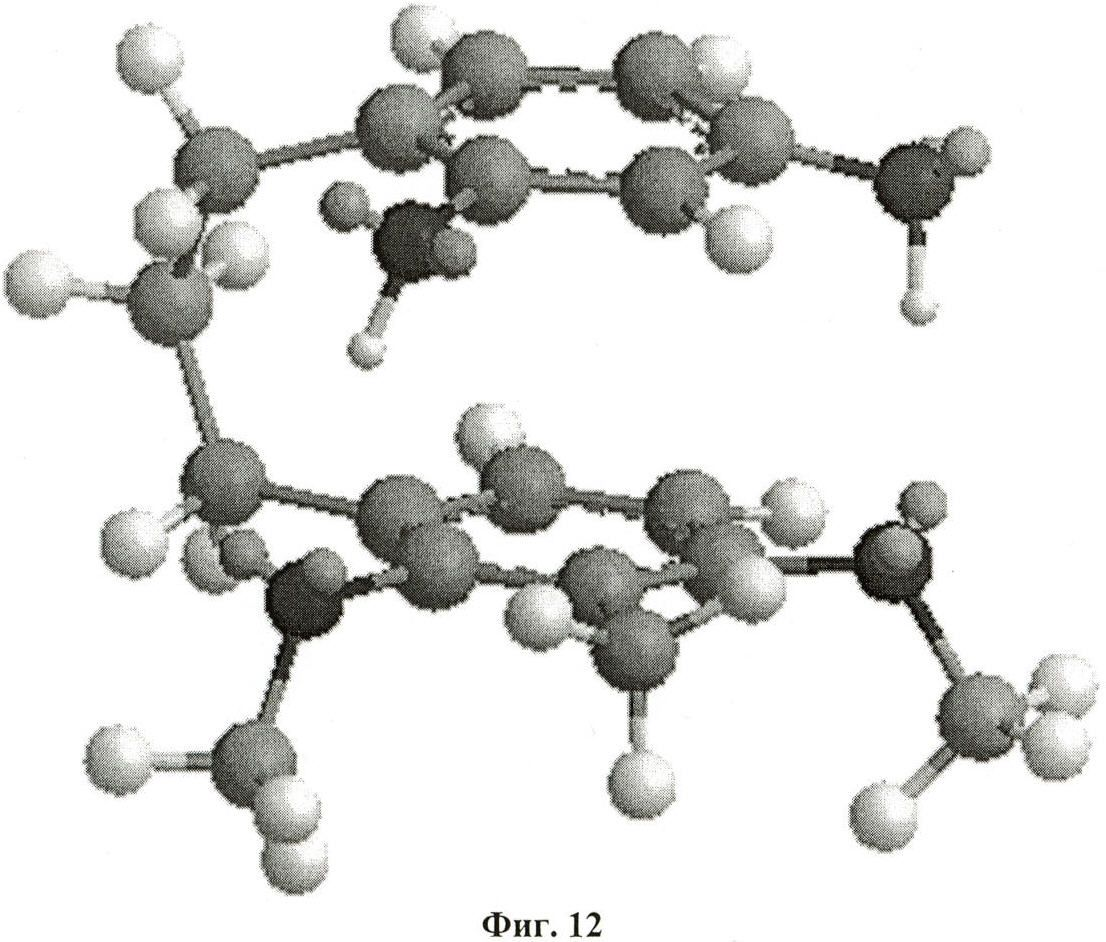
на фиг.12 - трехмерная конформация UP302a после минимизации энергии ММ2;
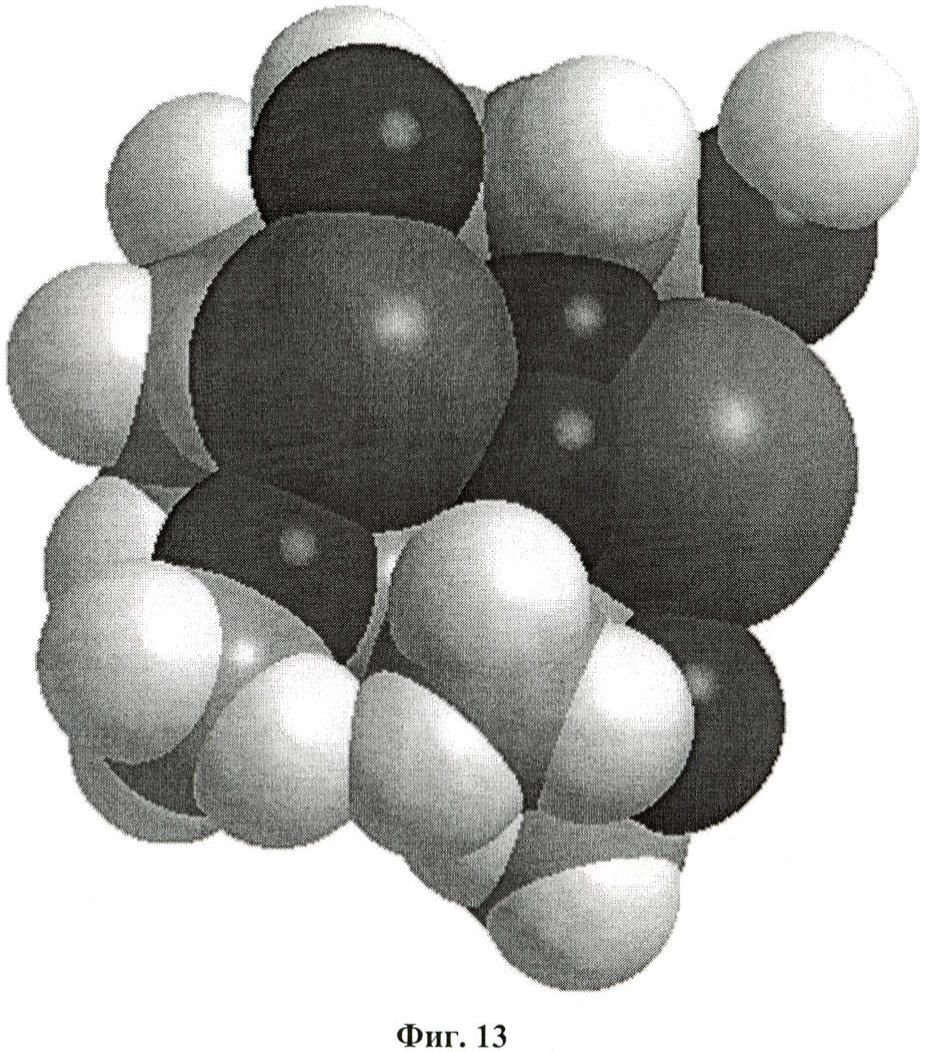
на фиг.13 - трехмерная конформация UP302a при координации с двумя ионами меди в окисленном состоянии CuII-O2-CuII;
на фиг.14 - расстояния между соседними атомами UP302a при образовании хелатного комплекса с ионами меди в пероксидной форме (CuII-О2-CuII), рассчитанные согласно методу, изложенному в примере 17.
Подробное описание предпочтительного варианта осуществления изобретения
Настоящее изобретение относится в целом к предупреждению и лечению заболеваний и состояний, опосредуемых двухъядерными ферментами. В частности, настоящее изобретение относится к способу ингибирования активности фермента, который имеет двухъядерный активный сайт. Настоящее изобретение относится к новым композициям, содержащим один или несколько диарилалкан(ов). Диарилалканы, предлагаемые в настоящем изобретении, можно выделять из одного или нескольких источников растительного происхождения или их можно получать с помощью органического синтеза. Настоящее изобретение относится также к способам выделения указанных соединений из встречающегося в естественных условиях источника и способам синтеза таких соединений. Согласно одному из вариантов осуществления изобретения диарилалканы получают путем синтетической модификации встречающегося в естественных условиях соединения, выделенного из источника растительного происхождения.
В описании настоящего изобретения используют целый ряд понятий. С целью облегчения понимания описания компонентов различных аспектов настоящего изобретения ниже приведены определения. Если не указано иное, то все технические и научные понятия имеют общепринятые значения, известные обычному специалисту в области, к которой относится настоящее изобретение.
Следует отметить, что любые понятия, употребляемые как в единственном, так и во множественном числе, являются равнозначными; например, диарилалкан относится к одному или нескольким диарилалканам. Аналогично этому понятие, употребляемое без конкретизации количества или в сочетании с выражением «один или более» и «по меньшей мере один» в контексте настоящего описания являются взаимозаменяемыми.
Понятие «диарилалканы» в контексте настоящего описания обозначает определенный класс ароматических соединений, которые имеют указанную ниже общую структуру. Настоящее изобретение относится также к новой композиции, предлагаемой в изобретении, которая содержит один или несколько диарилалканов, где диарилалканы выбирают из группы соединений, представленных следующей общей структурой:
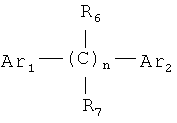
в которой
Ar1 и Ar2 независимо друг от друга выбирают из группы, включающей замещенное 5- или 6-членное ароматическое или гетероароматическое кольцо, где каждое 6-членное ароматическое или гетероароматическое кольцо независимо замещено 1-5 R'-группами




где
R' независимо выбирают из группы, включающей -Н, -ОН, -SH, -OR, -CN, -SR, -NH2, -NHR, -NR2, X и гликозид моносахарида или олигосахарида, состоящего из 2-6 моносахаридов, где моносахарид(ы) независимо выбирают из группы, включающей альдопентозу, метилальдопентозу, альдогексозу, кетогексозу и их химические производные; где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F и I;
R6 и R7 независимо выбирают из группы, включающей -Н, -ОН, -OR, -CN, -NHR, -NH2 и -X, где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F, I; и
n обозначает 1-10. В предпочтительном варианте осуществления изобретения n обозначает 2-4.
В одном из вариантов осуществления изобретения диарилалканы и диарилалканолы выбирают из группы, включающей соединения, представленные следующей общей структурой:

в которой
R1, R2, R3, R4, R5,






R6 и R7 независимо друг от друга выбирают из группы, включающей -Н,
-ОН, -OR, -CN, -NHR, -NH2 и -X, где R обозначает алкильную группу, имеющую от 1 до 20 атомов углерода, и Х обозначает галоген, выбранный из группы, включающей Cl, Br, F и I; и
n обозначает 1-10. В предпочтительном варианте осуществления изобретения n обозначает 2-4.
Понятие «диарилалканолы» в контексте настоящего описания относится к определенному типу «диарилалканов», у которых по меньшей мере одна гидроксильная группа (R6 и/или R7 обозначает -ОН) присоединена к атомам углерода алкильной группы между двумя ароматическими кольцами.
Понятие «двухъядерный фермент» в контексте настоящего описания означает фермент, который имеет двухъядерный активный сайт, примером которого является тирозиназа, имеющая, как указано выше, два иона меди в активном сайте. К двухъядерным ферментам относятся (но не ограничиваясь ими) тирозиназа, аргиназа, уреаза, цитохром-с-оксидаза, оксидаза протонного насоса гема-меди, бифункциональная дегидрогеназа окиси углерода/ацетил-СоА-синтаза, рибонуклеотидредуктаза, метало-бета-лактамаза, Н(+)-АТФаза и другие оксидазы и бактериальная фосфотриэстераза.
Понятие «терапевтический» в контексте настоящего описания включает предупреждение, лечение и/или профилактику. Понятие терапевтический можно применять как по отношению к человеку, так и другим животным.
Понятие «фармацевтически или терапевтически эффективная доза или количество» относится к уровню доз, достаточному для индукции требуемого биологического ответа. Ответ может представлять собой облегчение признаков, симптомов или причин болезни или любое другое требуемое изменение биологической системы. Точная доза может варьироваться в зависимости от различных факторов, которые включают (но не ограничиваясь ими) возраст и размер индивидуума, заболевание и эффективность лечения.
Понятие «плацебо» означает замену на неактивную субстанцию фармацевтически или терапевтически эффективной дозы или количества, достаточного для индукции требуемого биологического ответа, который может облегчать признаки, симптомы или причины заболевания.
Понятия «хозяин», или «пациент», или «индивидуум» относятся к живому млекопитающему, человеку или животному, для которого показана терапия. Понятие «хозяин», «пациент» или «индивидуум», как правило, относится к реципиенту терапии, осуществляемой согласно способу, предлагаемому в изобретении. Следует отметить, что настоящее изобретение можно применять в ветеринарии, а также для лечения человека и что понятие «хозяин» не следует рассматривать как ограничивающее. При применении в ветеринарии диапазон доз можно определять с помощью описанного ниже метода с учетом веса тела животного.
В контексте настоящего описания понятие «фармацевтически приемлемый носитель» относится к любому носителю, который не влияет на биологическую эффективность действующего вещества и который не является токсичным для пациента, которому его вводят. Примерами «фармацевтически приемлемых носителей» являются (но не ограничиваясь ими) любые стандартные фармацевтические носители, такие как физиологический раствор, т.е. раствор Рингера, забуференный физиологический раствор, воду, раствор декстрозы, сывороточный альбумин и другие эксципиенты и консерванты, применяемые для препаративных форм в виде таблеток и капсул.
Настоящее изобретение относится к способу ингибирования активности фермента с двухъядерным активным сайтом, заключающемуся в том, что пациенту, который нуждается в этом, вводят в эффективном количестве один или несколько диарилалкан(ов), где диарилалканы синтезируют и/или выделяют из одного или нескольких видов растений. Примерами двухъядерных ферментов, подпадающих под объем настоящего изобретения, являются (но не ограничиваясь ими) тирозиназа, аргиназа, уреаза, цитохром-с-оксидаза, оксидаза протонного насоса гема-меди, бифункциональная дегидрогеназа окиси углерода/ацетил-СоА-синтаза, рибонуклеотидредуктаза, метало-бета-лактамаза, Н(+)-АТФаза и другие оксидазы и бактериальная фосфотриэстераза. В одном из вариантов осуществления изобретения двухъядерный фермент представляет собой тирозиназу.
Настоящее изобретение относится также к способу предупреждения и лечения заболевания и состояния, связанного с активностью двухъядерных ферментов. Способ предупреждения и лечения, предлагаемый в настоящем изобретении, заключается в том, что вводят внутрь или наносят местно пациенту, нуждающемуся в этом, один или несколько диарилалкан(ов) в терапевтически эффективном количестве. В зависимости от ингибируемого двухъядерного фермента диарилалкан можно применять в качестве антимикробного, противогрибкового, антималярийного или антивирусного агента, регулятора производства оксида азота в качестве средств, контролирующих сексуальное возбуждение у мужчин и женщин, противовоспалительного лекарственного средства, антиоксиданта, регулятора метаболизма лекарственных средств для предупреждения и лечения болезней периодонта, предракововых состояний ротовой полости, различных типов рака ротовой полости и других злокачественных заболеваний ротовой полости, чувствительности десен и зубов, осложнения после болезни, пульпита, болезненной чувствительности, боли и воспаления, вызванных физической имплантацией оральных зубных протезов, травмой, повреждениями, бруксизмом и другими небольшими ранениями в полости рта, на деснах или на языке, зубным налетом и зубным камнем, декальцификацией зубов, протеолизом и кариеса (кариесный распад) и в качестве ингибитора роста различных типов рака и плотных опухолей.
Настоящее изобретение относится также к способам предупреждения и лечения заболеваний и состояний, связанных со сверхпроизводством или неравномерным распределением меланина, который заключается в том, что вводят внутрь или наносят местно пациенту, нуждающемуся в этом, один или несколько диарилалкан(ов) в терапевтически эффективном количестве. Болезни и состояния, связанные со сверхпроизводством или неравномерным распределением меланина, включают (но не ограничиваясь ими) загар, гиперпигментированные пятна, связанные со старением кожи, болезнями печени, термическими ожогами и местными ранами, пигментацию кожи, связанную с воспалительными состояниями, обусловленными грибными, микробными и вирусными инфекциями, витилиго, карциному, меланому, а также другие состояния кожи млекопитающих.
Способ можно применять также для предупреждения и лечения потемнения и повреждения кожи в результате воздействия ультрафиолетового (УФ) облучения, химических агентов, нагревания, ветра и сухости окружающей среды. И, наконец, способ можно применять для предупреждения и лечения морщин, кожи, напоминающей крупу саго, полос и темных кругов вокруг глаз, смягчения чувствительной кожи и предупреждения и лечения дерматитов и других родственных аллергии состояний кожи. Помимо их применения для предупреждения и лечения указанных выше заболеваний и состояний кожи, терапевтические композиции, предлагаемые в настоящем описании, представляют собой эффективные композиции, которые оказывают благоприятное воздействие на гладкость и омоложение кожи, что сопровождается улучшением цвета кожи, повышенной эластичностью, снижением и замедлением старения, заметным омоложением и улучшением текстуры кожи и повышением эластичности, плотности, гладкости и мягкости.
Путем хелатирования с ионами металлов диарилалканы можно применять также для введения важных ионов металлов в кровоток пациента и/или переноса ионов металлов через кожный или гематоэнцефалический барьер, а также через другие мембраны. В этом варианте осуществления изобретения способ заключается в том, что вводят пациенту, нуждающемуся в этом, в терапевтически эффективном количестве один или несколько диарилалкан(ов) в сочетании с ионами металлов, подлежащих введению. Эту способность диарилалканов можно использовать для лечения заболеваний и состояний, включающих (но не ограничиваясь ими), анемию и другие состояния, связанные с дефицитом железа, воспаление; ожирение и сахарный диабет, болезни периодонта, предракововые состояний ротовой полости, различные типы рака ротовой полости и другие злокачественные заболевания ротовой полости, чувствительность десен и зубов, осложнение после болезни, пульпит, болезненную чувствительность, боль и воспаление, вызванные физической имплантацией оральных зубных протезов, травмой, повреждениями, бруксизмом и другими небольшими ранениями в полости рта, на деснах или на языке, зубным налетом и зубным камнем, декальцификацией зубов, протеолизом и кариесом (кариесный распад) и вирусными инфекциями. Ионы металлов выбирают из группы, включающей (но не ограничиваясь ими) медь, железо, цинк, селен, магний и ионы других металлов.
Согласно следующему варианту осуществления изобретения диалкилалканы можно применять в пищевой промышленности для предупреждения побурения и изменения цвета фруктов, грибов и других пищевых продуктов.
Диарилалканы, которые можно применять согласно изобретению, включают соединения, которые имеют представленную выше общую структуру. Диарилалканы, предлагаемые в настоящем изобретении, можно получать с помощью методов синтеза или можно выделять из одного или нескольких растений, выбранных из семейств растений, включая (но не ограничиваясь ими) семейства Compositae, Fabaceae, Lauraceae, Leguminosae, Liliaceae, Loranthaceae, Moracea и Myristicaceae. Диарилалканы, предлагаемые в настоящем изобретении, можно также экстрагировать, концентрировать и очищать из родов высших растений, включая (но не ограничиваясь ими) Acacia, Broussonetia, Dianella, Helichrysum, Iryanthera, Knema, Lindera, Pterocarpus, Viscum и Xanthocercis. Диарилалканы могут находиться в различных частях растений, включая (но не ограничиваясь ими) стебли, кору стеблей, сердцевину деревьев, стволы, кору стволов, ветки, клубни, корни, кору корней, молодые побеги, семена, корневища, цветки и другие репродуктивные органы, листья и другие надземные части. В одном из вариантов осуществления изобретения диарилалканы выделяют из растения или растений родов Broussonetia, Dianella и Iryanthera.
В другом варианте осуществления изобретения диарилалканы, предлагаемые в настоящем изобретении, получают с помощью методов синтеза. Под объем настоящего изобретения подпадает способ синтеза диарилалканов и диарилалканолов, заключающийся в восстановлении соединения, которое имеет следующую общую структуру:

в которой
R1-R5 и

В другом варианте осуществления изобретения диарилалканы получают путем синтетической модификации встречающегося в естественных условиях соединения, выделенного из растительного источника. Например, встречающийся в естественных условиях бутеин выделяют из источника растительного происхождения, дегидратируют и восстанавливают с получением соответствующего диарилалканола.
В следующем варианте осуществления изобретения диарилалканы получают путем взаимодействия двух соответствующим образом замещенных ароматических соединений. Приемлемыми химическими реакциями для синтеза этих соединений из двух замещенных ароматических соединений являются (но не ограничиваясь ими) альдольная конденсация замещенного бензальдегида и замещенного ацетофенона; реакция Кляйзена-Шмидта или перекрестная альдольная конденсация альдегида и кетона; реакция Гриньяра с использованием галогенида органического магния одного замещенного ароматического кольца для связи с вторым замещенным ароматическим кольцом путем дополнительного взаимодействия карбонильной группы молекулы; перегруппировка Кляйзена путем внутримолекулярной изомеризации, при которой этерифицированный до сложного эфира фенол с соответствующими группами-заместителями должен быть изомеризован для связи с вторыми ароматическими кольцами в орто-положении фенола с последующей реакцией восстановления; и реакция сочетания Сузуки, в которой два замещенных ароматических кольца превращают в арилбороновые кислоты, а затем связывают с помощью галоидного алкила с использованием тщательно подобранного палладиевого катализатора. Эти реакции хорошо известны специалистам в данной области, а условия таких реакций можно определять на основе приведенной в настоящем описании информации, касающейся синтеза указанных соединений.
Следует отметить, что в настоящем описании делаются ссылки на различные публикации. Каждая из процитированных публикаций полностью включена в настоящее описание в качестве ссылки.
В настоящем изобретении предложена стратегия, основанная на объединении анализа ингибирования и химического процесса дерепликации для идентификации активных растительных экстрактов и конкретных соединений среди тех экстрактов, которые специфически ингибируют двухъядерные ферменты. Как отмечалось выше, ферменты, которые ингибируют тирозиназу, могут приводить к снижению производства меланина, тем самым осуществляя эффективное отбеливание кожи. Для создания библиотеки растительных экстрактов применяли экстракцию высушенного растительного порошка с помощью органического растворителя согласно методу, описанному в примере 1. Анализ ингибирования тирозиназы осуществляли с помощью метода, описанного у Jones и др. Pigment. Cell Res. 15, 2002, с.335 и приведенного в примере 2. С помощью этого анализа подвергали скринингу всего 1144 растительных экстракта в отношении способности ингибировать активность тирозиназы из грибов. С помощью такого первичного скрининга идентифицировали 20 растительных экстрактов (коэффициент попадания 1,75%), обладающих выраженной ингибирующей активностью в отношении тирозиназы. В таблице 1 представлены данные об ингибировании тирозиназы (в процентах) с использованием четырех таких экстрактов, выделенных из представителей четырех различных родов.
Для эффективной идентификации активных соединений из обладающих активностью растительных экстрактов использовали высокопроизводительный процесс фракционирования, описанный в примере 3. В целом, метод состоит в следующем: активные экстракты фракционировали с помощью высокопроизводительной системы очистки (ВПО). Затем у каждой фракции определяли способность ингибировать тирозиназную активность с помощью первичного анализа, описанного в примере 2. После дерепликации с использованием комбинации ЖХВР с PDA (усилитель-распределитель импульсов)- и МС-детекторами в сочетании с поиском в базе данных структур исключали фракции, которые содержали известные ингибиторы тирозиназы, такие как полифенолы и хромоны, отобрали всего семь экстрактов для крупномасштабного выделения и очистки с проведением биологического контроля согласно методу, описанному в примерах 4-6, с использованием взятых с целью иллюстрации экстрактов Broussonetia kazinoki Sieb. Et Zucc (Moraceae) и Dianella ensifolia (L.) DC. (Liliaceae).
В примере 4 описана экстракция, отделение и очистка нового диарилпропана: 1-(2-метокси-4-гидроксифенил)-3-(2'-гидрокси-5'-метоксифенил)пропан (UP288) (1) из Broussonetia kazinoki Sieb. Et Zucc (Moraceae) (растение целиком) с использованием общего метода, изложенного в примерах 1-3. На фиг.4 представлена ЖХВР/УФ-хроматограмма ВПО-фракции, содержащей UP288. Структуру активного соединения UP288 определяли с помощью комбинации спектроскопических методов, изложенных в примере 4. На фиг.5 представлена химическая структура и13С-ЯМР-спектр UP288. На фиг.6 приведена кривая зависимости ингибирующей активности в отношении тирозиназы от дозы и значение IC50 UP288 относительно койевой кислоты. Из чертежа видно, что UP288 (1) является таким же эффективным ингибитором тирозиназы, что и койевая кислота, значение IC50 которого составляет 24 мкМ.
При создании изобретения неожиданно было установлено, что два аналогичных диарилалкана выделены и идентифицированы из растения, принадлежащего к совершенно другому семейству, а именно из Dianella ensifolia (L.) DC. (Liliaceae), что описано в примере 5. На фиг.7 схематически представлено выделение с проведением биологического контроля этих двух активных веществ (UP302a (2) и UP302b (3)) из Dianella ensifolia (P0389) (все растение). Из данных, приведенных на фиг.7, можно увидеть, что только 15 полученных из колонки фракций из всего 264 собранных образцов обладали выраженной способностью ингибировать тирозиназу. ЖХВР-анализ (фиг.8) объединенных активных экстрактов позволил установить, что активные соединения представляли собой минорные компоненты в большом пуле, который уже был существенно обогащен. После трудоемких разделения и очистки получили два новых активных соединения, которые были полностью охарактеризованы с помощью ЯМР и других спектроскопических методов, проиллюстрированных в примере 5 и на фиг.9, такие как 1-(3-метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропан (UP302a, IC50=0,24 мкМ) (2) и 1-(3-метил-2,4-диметоксифенил)-3-(2',5'-дигидроксифенил)пропан (IP302b, IC50=1,2 мкМ) (3).
В примере 6 описан метод полупромышленного выделения UP302a (2), наиболее эффективного ингибитора тирозиназы, выделенного из Dianella ensifolia (DE) (все растение). Из примера 6 видно, что 4,3 кг высушенной биомассы получали всего 30 мг чистого UP302a (2) после нескольких фракционирований на колонке на силикагеле, смолах CG-161 и С-18. Подтверждали структуру и биологическую функцию выделенного соединения.
Из-за низкой встречаемости диарилалканов/диарилалканолов в природе были разработаны методы синтеза этих биологически активных соединений в качестве дополнительного имеющего коммерческое значение источника этого класса соединений. В примере 7 описан общий метод синтеза диарилалканов путем восстановления замещенных халконов. В качестве иллюстрации описано восстановление 2,4-(дигидроксифенил)-3',4'-диметоксифенилхалкона (4) до 1-(2,4-дигидроксифенил)-3-(3',4'-диметоксифенил)-1-пропанола (5) с использованием борогидрида натрия. Однако, как указано в примере 7, целый ряд других диарилалканов синтезировали с использованием этого общего метода. У всех синтезированных соединений обнаружена ингибирующая активность в отношении тирозиназы от высокого до среднего уровня. Согласно общему методу, описанному в примере 7, для осуществления восстановления можно применять любые другие известные восстановители, включая (но не ограничиваясь ими) другие борогидриды, H2 в присутствии катализатора, NaH и LiAlH4.
С помощью общей реакции, описанной в примере 7, несколько других замещенных диарилпропанонов превращали в диарилпропаны и/или диарилпропанолы, что продемонстрировано в примерах 8, 9 и 10. В примере 11 описан синтез диарилпропанола с использованием в качестве исходного продукта флавоноидного гликозида, выделенного из встречающегося в естественных условиях источника.
Другим вариантом осуществления настоящего изобретения являются способы синтеза этого класса соединений путем взаимодействия двух соответствующим образом замещенных ароматических соединений. Этот вариант осуществления изобретения представлен в примере 12, в котором в качестве иллюстрации использовали взаимодействие резорцинола с 3-метокси-4-гидроксикоричной кислотой. Приемлемыми химическими реакциями для синтеза этих соединений из двух замещенных ароматических соединений являются (но не ограничиваясь ими) альдольная конденсация замещенного бензальдегида и замещенного ацетофенона; реакция Кляйзена-Шмидта или перекрестная альдольная конденсация альдегида и кетона; реакция Гриньяра с использованием галогенида органического магния одного замещенного ароматического кольца для связи с вторым замещенным ароматическим кольцом путем дополнительного взаимодействия карбонильной группы молекулы; перегруппировка Кляйзена путем внутримолекулярной изомеризации, при которой этерифицированный до сложного эфира фенол с соответствующими группами-заместителями должен быть изомеризован для связи с вторыми ароматическими кольцами в орто-положении фенола с последующей реакцией восстановления; и реакция сочетания Сузуки, в которой два замещенных ароматических кольца превращают в арилбороновые кислоты, а затем связывают с помощью галоидного алкила с использованием тщательно подобранного палладиевого катализатора. Эти реакции хорошо известны специалистам в данной области, а условия таких реакций можно определять на основе приведенной в настоящем описании информации, касающейся синтеза указанных соединений.
В примере 13 представлены значения IC50 для целого ряда диарилалканов и диарилалканолов, синтезированных с помощью способов, предлагаемых в настоящем изобретении. Соединения оценивали с помощью общего метода, описанного в примере 2. Значение IC50 для каждого образца рассчитывали с помощью программы для анализа кинетики для подтверждения того, что реакция являлась линейной в конкретный момент времени и при конкретной концентрации. С помощью методов, описанных в примерах 7-12, синтезировали всего 24 соединения и оценивали их способность ингибировать тирозиназу. Результаты представлены в таблице 2. Из таблицы 2 видно, что значения IC50 синтетических диарилалканолов были сопоставимы со значениями IC50 встречающихся в естественных условиях диарилпропанов. Таким образом, эти два класса соединений обладают способностью ингибировать тирозиназу примерно в одинаковой степени. Наиболее активные диарилалканы и/или диарилалканолы имели 3 атома углерода между двумя ароматическими кольцами. С помощью расчетов, описанных в примере 17, было продемонстрировано, что эта структурная особенность имеет решающее значение для создания параллельных и накладывающихся внутримолекулярных конформаций. Однако диарилалканолы, содержащие 2 и 4 атома углерода между ароматическими кольцами, такие как 1-(2,4-дигидроксифенил)-2-(4'-метоксифенил)-1-этанол (IC50=77 мкМ) и 1,4-бис(3,4-дигидроксифенил)-2,3-диметилбутан (IC50=700 мкМ), также обладали выраженной способностью ингибировать тирозиназу.
С использованием метода, описанного в примере 2, ингибирование тирозиназы с помощью UP302a (2) оценивали с использованием L-ДОФА в качестве субстрата, что изложено в примере 14. Результаты представлены на фиг.10. Это исследование подтвердило, что UP302a (2) является сильным конкурентным ингибитором продолжительного действия. Интересно отметить, что тирозиназная активность не возобновлялась в течение нескольких дней после инкубации с помощью UP302a. В противоположность этому тирозиназная активность полностью восстанавливалась всего лишь через 1 ч после инкубации с койевой кислотой. Поскольку двумя заместителями ароматических колец UP302a являлись метоксигруппы, ингибитор нельзя легко гидроксилировать и/или окислять. Это может объяснять как эффективность, так и продолжительность ингибирующего действия UP302a. Таким образом, можно сделать заключение о том, что эти соединения должны обладать продолжительным действием.
Эффективность заявляемой композиции демонстрировали также, оценивая ингибирование продуцируемого меланина в опыте in vitro на клетках линии В-16, согласно методу, описанному в примере 15. Результаты представлены на фиг.11. UP302a (2) обладал почти в 6 раз более высокой способностью снижать уровень эндогенного меланина по сравнению с койевой кислотой. Кроме того, ингибирование UP302a MSH (меланоцитстимулирующий гормон), индуцирующего производство меланина, также существенно выше по сравнению с койевой кислотой. Как и ожидалось, UP288 (1) сопоставим по активности с койевой кислотой при использовании в качестве модели клеток линии В-16.
В примере 16 описан анализ оценки цитотоксичности двух диарилпропанов UP288 (1) и UP302a (2) по сравнению с койевой кислотой. При концентрации 250 мкМ, превышающей значение IC50 для всех трех тестируемых соединений профили безопасности диарилпропанов оказались такими же, что и у койевой кислоты.
В примере 17 описаны анализы, основанные на молекулярном моделировании, которые осуществляли для определения наиболее стабильной 3-D-конформации активных диарилалканов и диарилалканолов. Расчеты молекулярной механики осуществляли с помощью программы Chem3D. Эти расчеты позволили установить, что наиболее эффективный ингибитор тирозиназы, а именно 1-(3-метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропана (UP302a (2), IC50=0,24 мкМ), характеризуется уникальной 3-мерной конформацией, в которой 2 ароматических кольца накладываются друг на друга, как это видно из фиг.12. Минимизированная общая энергия для этой конформации составляет -4,7034 кДж/моль и расстояние между двумя ароматическими кольцами составляет 3,28 Å. Фенольные гидроксильные группы первого ароматического кольца находятся непосредственно над двумя метоксигруппами второго ароматического кольца, при этом расстояние между двумя атомами кислорода составляет 2,99 Å и 3,16 Å соответственно, что видно из фиг.14. Активный сайт двухъядерного фермента тирозиназы содержит 2 иона меди в комплексе с молекулой кислорода в пероксидном окисленном состоянии [CuII-О2-CuII], которое имеет решающее значение для механизма, посредством которого тирозиназа катализирует встраивание гидроксильной группы в орто-положение ароматического кольца монофенола (такого как тирозин) (Decker и др., Angew. Chem. Int. Ed. 39, 2000, с.1591). Установлено, что межатомные расстояния составляют 3,56 Å для Cu-Cu, 1,90 Å для Cu-O и 1,41 Å для O-O (Kitajima и др., J. Am. Chem. Soc. 111, 199, с.8975). Параллельная конформация 1-(3-метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропана (UP302a, IC50=0,24 мкМ) оказалась точно соответствующей хелатному комплексу, содержащему оба иона меди комплекса [CuII-O2-CuII] как сверху, так и снизу, как проиллюстрировано на фиг.13 и 14. Это двойное хелатообразование ингибитора с двумя ионами меди активного сайта должно полностью блокировать доступность для фермента субстрата, такого как L-ДОФА, что эффективно ингибирует функцию белка. С использованием такого же подхода анализировали выделенные и синтетические диарилалканы и диарилалканолы, представленные в таблице 2. Результаты такого анализа позволили установить, что соединения с изогнутой или непараллельной конформацией либо вообще не обладают активностью, либо обладают лишь слабой способностью ингибировать активность тирозиназы.
На основе этих исследований было установлено, что наиболее эффективные диарилалкановые ингибиторы имеют 2-3 заместителя в первом ароматическом кольце и от 0 до нескольких заместителей во втором ароматическом кольце. Наиболее предпочтительными являются структуры, в которых по меньшей мере одно ароматическое кольцо замещено в положениях 2 и 4. Предпочтительными кольцами являются 6-членные ароматические и/или гетероароматические кольца, что продемонстрировано на примере двух выделенных соединений 1-(2-гидрокси-4-метоксифенил)-3-(2',3',4',5'-тетрагидробензо(b)диоксицин-8-ил)-1-пропанола (IC50=72 мкМ) и 3-(5'-хлор-1'-метил-1'-гидроимидазол-2'-ил)-1-(2-гидрокси-4-метоксифенил)-1-пропанола (IC50=225 мкМ).
Композиции, предлагаемые в настоящем изобретении, можно вводить с помощью любого метода, известного обычному специалисту в данной области. Пути введения включают (но не ограничиваясь ими), энтеральное (оральное) введение, парентеральное (внутривенное, подкожное и внутримышечное) введение и местное введение. Способ лечения, предлагаемый в настоящем изобретении, заключается в том, что пациенту, который нуждается в этом, вводят внутрь или наносят местно в терапевтически эффективном количестве диарилалкан или смесь, содержащую два или большее количество диарилалканов.
Композиции, предлагаемые в настоящем изобретении, можно приготавливать в виде фармацевтических композиций, которые содержат другие компоненты, такие как фармацевтически и/или косметически приемлемый эксципиент, адъювант и/или носитель. Например, композицию, предлагаемую в настоящем изобретении, можно приготавливать в эксципиенте, который является переносимым для пациента, подлежащего лечению. Эксципиент представляет собой инертное вещество, применяемое в качестве разбавителя или наполнителя для терапевтического агента, такого как диарилалкан или смесь диарилалканов. Примерами таких эксципиентов являются (но не ограничиваясь ими) вода, буферы, физиологический раствор, раствор Рингера, раствор декстрозы, маннит, раствор Хэнкса, консерванты и другие водные физиологически сблансированные солевые растворы. Можно применять также неводные наполнители, такие как жировые масла, кунжутное масло, этилолеат или триглицериды. Другие приемлемые препаративные формы представляют собой суспензии, содержащие усиливающие вязкость агенты, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Эксципиенты могут содержать также минорные количества добавок, таких как вещества, повышающие изотоничность и химическую стабильность. Примерами буферов являются фосфатный буфер, бикарбонатный буфер, трио-буфер, гистидин, цитрат и глицин или их смеси, а примерами консервантов являются (но не ограничиваясь ими) ЭДТК, динатрий ЭДТК, БГА (трет-бутил-4-метоксифенол), БГТ (2,6-ди-трет-бутил-пара-крезол), витамин С, витамин Е, бисульфит натрия, SnCl2, тимеросал, мета- или орта-крезол, формалин и бензиловый спирт. Стандартные препаративные формы могут быть либо жидкими, либо твердыми, которые перед введением можно растворять в приемлемой жидкости с получением суспензии или раствора. Таким образом, в неводной препаративной форме эксципиент может представлять собой декстрозу, человеческий сывороточный альбумин, консерванты и т.д., при этом перед введением к форме добавляют стерильную воду или физиологический раствор.
В одном из вариантов осуществления настоящего изобретения композиция может содержать также адъювант или носитель. Адъюванты, как правило, представляют собой субстанции, которые обычно усиливают биологический ответ хозяина на конкретное биологически активное вещество. Приемлемыми адъювантами являются (но не ограничиваясь ими) адъювант Фрейнда, другие компоненты оболочки бактериальной клетки, алюминий, магний, медь, цинк, железо, кальций и другие соли на основе ионов металлов, диоксид кремния, полинуклеотиды, токсоиды, сывороточные белки, белки вирусной оболочки, другие полученные из бактерий препараты, гамма-интерферон; адъюванты на основе блок-сополимеров, такие как адъювант Hunter's Titermax (фирма Vaxcel. TM., Inc. Норкросс, шт.Джорджия), адъюванты Ribi (поставляемые фирмой Ribi ImmunoChem Research, Inc., Хамильтон, шт.Монтата); и сапонины и их производные, такие как Quil А (поставляемый фирмой Superfos Biosector A/S, Дания). Носители, как правило, представляют собой соединения, которые увеличивают время полужизни терапевтической композиции в обработанном хозяине. Приемлемыми носителями являются (но не ограничиваясь ими) полимерные контролирующие высвобождение формы, биоразложимые имплантаты, липосомы, бактерии, вирусы, масла, сложные эфиры и гликоли.
В одном из вариантов осуществления изобретения композицию приготавливают в виде препаративной формы с контролируемым высвобождением, из которой происходит медленное высвобождение композиции, предлагаемой в настоящем изобретении, в организме хозяина. В контексте настоящего описания препаративная форма с контролируемым высвобождением содержит композицию, предлагаемую в настоящем изобретении, в наполнителе с контролируемым высвобождением. Приемлемые наполнители с контролируемым высвобождением известны специалистам в данной области. Предпочтительные препаративные формы с контролируемым высвобождением являются биоразложимыми (т.е. биоразрушаемыми).
Терапевтические агенты, предлагаемые в настоящем изобретении, наносят местно с помощью любого приемлемого средства, известного специалистам в данной области, предназначенного для местного применения терапевтических композиций, включая (но не ограничиваясь ими) мазь, гель, лосьон или кремовую основу или зубную пасту, состав для полоскания рта или покрытие межзубной нити или эмульсию, бляшку, средство для ухода за волосами или маску, не прилипающую марлю, повязку, тампон или матерчатое полотенце. В примере 18 описано приготовление двух препаративных форм в виде крема с содержанием действующего вещества от 0,01 до 0,1% чистого диарилалкана и/или смеси диарилалканов в пересчете на общую массу состава. Такое местное применение можно осуществлять путем локального нанесения на любую пораженную область с помощью любого из стандартных средств, предназначенных для местного применения. Терапевтическую композицию можно применять в виде различных стандартных доз лекарственных средств в зависимости от пути введения. Для конкретных путей введения терапевтическую композицию, предлагаемую в настоящем изобретении, можно приготавливать в эксципиенте, предлагаемом в настоящем изобретении. Терапевтический реагент, предлагаемый в настоящем изобретении, можно вводить любому хозяину, предпочтительно млекопитающему и более предпочтительно человеку. Конкретный путь введения должен зависеть от состояния, подлежащего лечению.
Одним из вариантов осуществления изобретения является приемлемая мазь, содержащая в требуемой концентрации один диарилалкан или смесь двух или нескольких диарилалканов, представляющих собой эффективное нетоксичное количество, как правило, составляющее от 0,001 до 100% в пересчете на общую массу препаративной формы для местного применения, от 65 до 100% (предпочтительно от 75 до 96%) белого полутвердого парафина, от 0 до 15% жидкого парафина и от 0 до 7% (предпочтительно от 3 до 7%) ланолина или его производного или синтетического эквивалента. В другом варианте осуществления изобретения мазь может содержать полиэтилен - жидкую парафиновую основу.
Согласно другому варианту осуществления изобретения приемлемый крем состоит из эмульгирующейся системы в сочетании с взятым(ыми) в требуемой концентрации одним диарилалканом или смеси двух или большего количества диарилалканов, указанных выше. Эмульгирующаяся система предпочтительно содержит от 2 до 10% полиоксиэтиленовых спиртов (например, смесь, которая поступает в продажу под товарным знаком Cetomacrogol™ 1000), от 10 до 25% стеарилового спирта, от 20 до 60% жидкого парафина и от 10 до 65% воды; в сочетании с одним или несколькими консервантами, например от 0,1 до 1% N,N''-метиленбис[N'-[3-(гидроксиметил)-2,5-диоксо-4-имидазолидинил]мочевины (поступающей в продажу под названием Imidurea USNF), от 0,1 до 1% алкил 4-гидроксибензоатов (например, смесь, поступающая в продажу от фирмы Nipa Laboratories под товарным знаком Nipastat), от 0,01 до 0,1% бутил-4-гидроксибензоата натрия (поступает в продажу от фирмы Nipa Laboratories под товарным знаком Nipabutyl sodium) и от 0,1 до 2% феноксиэтанола.
Согласно еще одному варианту осуществления изобретения приемлемый гель представляет собой полутвердую систему, в которой жидкая фаза заключена в трехмерную полимерную матрицу с высоким уровнем поперечных связей. В жидкую фазу может входить вода в сочетании с требуемым количеством одного диарилалкана или смеси двух или большего количества диарилалканов, от 0 до 20% смешивающихся с водой добавок, например глицерина, полиэтиленгликоля или пропиленгликоля, и от 0,1 до 10%, предпочтительно от 0,5 до 2% загустителя, который может представлять собой встречающийся в естественных условиях продукт, выбранный из группы, включающей (но не ограничиваясь ими) трагакант, пектин, карраген, агар и альгиновую кислоту, или синтетическое или полусинтетическое соединение, выбранное из группы, включающей (но не ограничиваясь ими) метилцеллюлозу и карбоксиполиметилен (карбопол); в сочетании с одним или несколькими консервантами, выбранными из группы, включающей (но не ограничиваясь ими), например, от 0,1 до 2% метил-4-гидроксибензоата (метилпарабен) или феноксиэтанола. Другая приемлемая основа содержит требуемое количество одного диарилалкана или смеси диарилалканов в сочетании с от 70 до 90% полиэтитиленгликоля (например, полиэтиленгликольная мазь, содержащая 40% полиэтиленгликоля 3350 и 60% полиэтиленгликоля 400, полученная согласно U.S. National Formulary (USNF)), от 5 до 20% воды, от 0,02 до 0,25% антиоксиданта (например, бутилированного гидрокситолуола) и от 0,005 до 0,1% хелатирующего агента (например, этилендиаминтетрауксусной кислоты (ЭДТК)).
Упомянутое выше понятие полутвердый парафин относится к применяемому в качестве основы для кремов или мазей белому полутвердому парафину и желтому полутвердому парафину. Понятие ланолин относится к нативному шерстяному жиру и очищенному шерстяному жиру. Производными ланолина являются, в частности, ланолины, химически модифицированные с целью изменения их физических или химических свойств, и синтетические эквиваленты ланолина, включающие синтетические или полусинтетические соединения и смеси, которые являются известными и которые применяют в области косметики в качестве альтернативы линолину и которые можно, например, обозначать как заменители ланолина.
Одним из приемлемых синтетических эквивалентов ланолина, который можно применять согласно изобретению, является продукт, поступающий в продажу под товарным знаком Softisan™, известный также как Softisan 649. Softisan 649, поступающий в продажу от фирмы Dynamit Nobel Aktiengesellschaft, он представляет собой сложный эфир глицерина и встречающихся в естественных условиях растительных жирных кислот, изостеариновой кислоты и адипиновой кислоты; его свойства описаны у Н.Hermsdorf в: Fette, Seifen, Anstrichmittel, Issue No. 84, No.3 (1982), c.3-6.
Другие вещества, указанные выше в качестве составляющих приемлемой основы мази или крема, и их свойства описаны в стандартных справочниках, например фармакопейных справочниках. Cetomacrogol 1000 имеет формулу СН3(СН2)m(ОСН2СН2)nOH, в которой m может иметь значение 15 или 17 и n иметь значение от 20 до 24. Бутилированный гидрокситолуол представляет собой 2,6-ди-трет-бутил-пара-крезоп. Нипастат представляет собой смесь метил-, этил-, пропил- и бутил-4-гидроксибензоатов.
Композиции, предлагаемые в изобретении, можно получать с помощью общепринятых фармацевтических методов. Так, вышеуказанные композиции, удобно получать смешением при повышенной температуре, предпочтительно при 60-70°С, полутвердого парафина, жидкого парафина, если он присутствует, и ланолина или его производного или синтетического эквивалента. Затем смесь можно охлаждать до комнатной температуры и после добавления гидратированной кристаллической кальциевой соли мупироцина в сочетании с кортикостероидом и любыми другими ингредиентами, перемешивать до достижения требуемой дисперсии.
Независимо от метода применения конкретную дозу рассчитывают в зависимости от примерного веса тела пациента. Дополнительное уточнение расчетов, необходимое для определения соответствующей дозы, которая требуется для лечения с использованием любой из вышеупомянутых препаративных форм, могут осуществлять обычные специалисты в данной области, и оно относится к разряду задач, которые обычно решают специалисты без проведения обширных экспериментов, особенно с учетом информации о дозах и с использованием анализов, представленных в настоящем описании. Эти дозы можно устанавливать с помощью общепринятых анализов, предназначенных для определения доз, используя в сочетании с ними соответствующие данные зависимости реакции от дозы.
Приведенные ниже примеры даны только с целью иллюстрации изобретения и не направлены на ограничение его объема.
Примеры
Пример 1. Получение органических экстрактов из сухих растений
Высушенный растительный материал измельчали до частиц размером не более 2 мм и часть (60 г) переносили в колбу Эрленмейера и экстрагировали 600 мл смеси метанол: дихлорметан (1:1). Смесь встряхивали в течение 1 ч, фильтровали и биомассу экстрагировали вновь с помощью смеси метанол:дихлорметан (1:1) (600 мл). Органические экстракты объединяли и упаривали в вакууме, получая органический экстракт каждого растительного материала. Затем каждый экстракт (примерно 75 мг) растворяли в 1,5 мл ДМСО до концентрации 50 мг/мл, затем хранили при -70°С в морозильнике. Аликвоту раствора экстракта применяли для определения тирозиназной активности согласно методу, описанному в примере 2.
Пример 2. Анализ ингибирования тирозиназы
Анализ ингибирования тирозиназы осуществляли с помощью метода, описанного у Jones и др., Pigment. Cell Res. 15, 2002, с.335. С помощью этого метода осуществляли превращение субстрата тирозиназы L-ДОФА в допахром, оценивая абсорбцию при 450 нм. Тирозиназу готовили в 50 мМ калий-фосфатном буфере, рН 6,8 (буфер для анализа) в концентрации 2000 ед./мл и хранили до применения при -20°С в виде аликвот объемом 1 мл. Для проведения анализов маточные растворы фермента подвергали оттаиванию и разбавляли до концентрации 200 ед./мл с помощью буфера для анализа. Для каждого анализа готовили 2 мМ рабочий раствор субстрата, т.е. L-ДОФА, в буфере для анализа. Образцы растворяли в 10% ДМСО (0,5 мл) и разбавляли до 5 мл с помощью буфера для анализа. Реакционная смесь содержала 0,050 мл 2 мМ L-ДОФА, 0,050 мл 200 ед./мл грибной тирозиназы и 0,050 мл ингибитора. Реакционный объем доводили до 200 мкл с помощью буфера для анализа. Анализы осуществляли в 96-луночных плоскодонных титрационных микропланшетах Falcon 3097 (фирма Beckton Dickinson, шт.Нью-Джерси). Появление допахрома оценивали с помощью счетчика для нескольких меток типа WALLAC 1420 Multilable Counter (фирма Turku, Финляндия). Определяли среднюю скорость линейной ферментативной реакции по изменению абсорбции (ΔА450) при 450 нм в мин. Ингибирование тирозиназы (в процентах) в опытных образцах определяли путем сравнения абсорбции образца с использованием контроля с помощью формулы (1):

Результаты представлены в таблице 1.

Пример 3. ВПО-фракционирование активных растительных экстрактов
Обладающий активностью органический экстракт (400 мг) вносили на предварительно упакованную колонку для экспресс-хроматографии с нормальной фазой (2 см ID (внутренний диаметр) 8,2 см, 10 г силикагеля). Колонку элюировали с помощью высокопроизводительной системы очистки (ВПО) фирмы Hitachii с использованием градиента подвижной фазы (А) 50:50 EtOAc : гексан и (Б) метанол от 100% А до 100% Б в течение 30 мин при скорости потока 5 мл/мин. Осуществляли мониторинг разделения с помощью УФ-детектора с широким диапазоном длин волн и собирали фракции в глубокий 96-луночный планшет из расчета 1,9 мл/лунку с помощью коллектора для фракций типа Gilson. Планшет с образцами сушили при слабом вакууме и центрифугировали. Для растворения образцов в каждой ячейке использовали ДМСО (1,5 мл) и часть (100 мкл) брали для осуществления анализа по оценке ингибирования тирозиназы, который проводили с дублированием.
Пример 4. Экстракция, разделение и очистка 1-(2-метокси-4-гидроксифенил)-3-(2'-гидрокси-5'-метоксифенил)пропана (1) из Broussonetia kazinoki (BK) (растение целиком)

Broussonetia kazinoki (100 г, растение целиком) измельчали и экстрагировали трижды с помощью 800 мл МеОН:ДХМ (1:2). Высушенный экстракт (6 г) фракционировали с использованием колонки с силикагелем с элюированием в градиенте растворителей от гексана/этилацетата (50/50) до МеОН. Фракции собирали, создавая 2 набора по 88 пробирок. ЖХ/MC/PDA использовали для контроля каждой фракции, которые затем объединяли на основе сходства состава. Объединенные фракции упаривали для удаления растворителя, сушили и оценивали их ингибирующую активность в отношении тирозиназы с помощью метода, описанного в примере 2. Было обнаружено, что фракции (P0346-HTP-F2 - P0346-HTP-F4) обладали наиболее высокой активностью и их объединяли и обозначали как BK-F2--4. После выпаривания растворителя BK-F2--4 дополнительно разделяли на предварительно упакованной колонке с обращенной фазой (колонка С-18), используя градиент вода/МеОН. После последующего разделения было выделено 18 соответствующих соединениям пиков. Осуществляли 14 опытов на колонках с обращенной фазой и объединяли аналогичные фракции из каждого погона. Пик, соответствующий одному соединению, обозначенному как UP288, в объединенной и обогащенной фракции, обладал выраженной ингибирующей активностью в отношении тирозиназы (фиг.4). После разделения и очистки с помощью препаративной ЖХВР получили 6 мг 1-(2-метокси-4-гидроксифенил)-3-(2'-гидрокси-5'-метоксифенил)пропана (UP288) (1). Структуру этого соединения оценивали с помощью МС и ЯМР-спектроскопии (1Н,13С, HMQC и НМВС). На фиг.15 показана химическая структура и13С-ЯМР-спектр UP288. UP288 представляет собой ингибитор тирозиназы, сопоставимый по активности с койевой кислотой, значение IC50 которого составляет 24 мкМ. На фиг.6 проиллюстрированы кривые зависимости способности ингибировать тирозиназу от дозы и значения IC50 UP288 и койевой кислоты.
1-(2-Метокси-4-гидроксифенил)-3-(2'-гидрокси-5'-метоксифенил)пропан (UP288). Выход 0,006% (чистота >96%, ЖХВР); УФ λMax: 281,0 нм; МС (суперзвуковая ионизация, выявление положительных ионов): m/z 289 (М+1, 100%);1Н-ЯМР (400 МГц, (CD3)2SO): δ 1,70 (2H, m, CH2), 2,46 (4H, m, 2 CH2), 3,68 (3Н, s, ОСН3), 3,73 (3Н, s, ОСН3), 6,26 (1Н, q, H-5), 6,35 (1H, d, H-3), 6,55 (1Н, q, Н-14), 6,65 (1Н, d, Н-13), 6,72 (1Н, d, Н-16), 6,86 (1Н, d, Н-6), 8,69 (1Н, s, ОН), 9,20 (1Н, s, ОН);13С-ЯМР (100 МГц, (CD3)2SO): δ 28,5 (С-8), 31,6 (С-9), 34,5 (С-10), 55,0 (С-7), 55,6 (С-17), 98,9 (С-3), 106,4 (С-5), 112,4 (С-16), 115,2 (С-13), 119,7 (C-1), 119,8 (С-14), 120,3 (C-11), 120,4 (С-6), 132,9 (С-12), 144,6 (С-4), 147,2 (С-17) и 158,3 (С-7).
Пример 5. Экстракция, разделение и очистка 1-(3-метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропана (UP302a) (2) и 1-(3-метил-2,4-диметоксифенил)-3-(2',5'-дигидроксифенил)пропана (UP302b) (3) из Dianella ensifolia (Р0389) (растение целиком)

Dianella ensifolia (Р0389, 300 г, растение целиком) измельчали и экстрагировали трижды с помощью 800 мл МеОН: ДХМ (1:2). Высушенный экстракт (5 г) фракционировали с использованием колонки с силикагелем с элюированием в градиенте растворителей от гексана/этилацетата (50/50) до МеОН. Фракции собирали, создавая 2 набора по 264 пробирки. ЖХ/MC/PDA использовали для контроля каждой фракции, которые затем объединяли в 22 фракции на основе сходства их состава (фиг.7). Объединенные фракции упаривали для удаления растворителя, сушили и оценивали их ингибирующую активность в отношении тирозиназы с помощью метода, описанного в примере 2. Было обнаружено, что фракции P0389-HTP-F12, P0389-HTP-F13 и Р0389-НТР-F14 обладали наиболее высокой активностью и эти фракции объединяли и обозначали как DE-F12--14. После выпаривания растворителя DE-F12--14 дополнительно очищали на предварительно упакованной колонке с обращенной фазой (ОФ-колонка), используя градиент вода/МеОН. После разделения было выявлено 2 основных и 11 минорных пиков, соответствующих соединениям. Соединения, которые соответствовали каждому из этих пиков, выделяли после 7 дополнительных разделений на ОФ-колонках. Все собранные соединения сушили и тестировали на способность ингибировать тирозиназу. Два из 11 минорных пиков, которые обозначили как UP302a и UP302b соответственно, обладали выраженной ингибирующей активностью в отношении тирозиназы (фиг.8). После разделения и очистки получили два активных соединения: 1-(3-метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропан (UP302a, 10 мг) (2) и 1-(3-метил-2,4-диметоксифенил)-3-(2',5'-дигидроксифенил)пропан (UP302b, 6 мг) (3). Структуры этих двух соединений оценивали с помощью МС и ЯМР-спектроскопии (1Н,13С, gHSQC и НМВС). На фиг.9 представлен gHSQC-спектр UP302a. Анализы ингибирующей активности в отношении тирозиназы показали, что UP302a является наиболее эффективным ингибитором, значение IC50 которого составляет 0,24 мкМ, в то время как для UP302b значение IC50 составляет 12 мкМ.
1-(3-Метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропан (UP302a) (2). Выход 0,02% (чистота >98%, ЖХВР); УФ λMax: 279,8 нм; МС (суперзвуковая ионизация, выявление положительных ионов): m/z 303 (М+1, 100%);1Н-ЯМР (400 МГц, (CD3)2SO): δ 1,70 (2H, m, СН2), 2,03 (3Н, s, СН3), 2,43 (2H, m, CH2), 2,49 (2H, m, CH2), 3,58 (3Н, s, ОСН3), 3,73 (3Н, s, ОСН3), 6,11 (1Н, q, H-16), 6,25 (1Н, d, H-14), 6,65 (1Н, d, H-5), 6,76 (1Н, d, H-17), 6,97 (1Н, d, H-6), 8,93 (1Н, s, OH), 9,03 (1Н, s, ОН);13С-ЯМР (100 МГц, (CD3)2SO): δ 28,8 (С-9), 29,3 (C-11), 31,1 (С-10), 55,3 (С-7), 55,9 (С-8), 102,4 (С-14), 105,8 (С-16), 106,1 (С-5), 118,4 (C-1), 118,6 (С-12), 126,9 (С-3), 127,0 (С-6), 130,1 (С-17), 155,7 (С-13), 156,2 (С-15), 156,3 (С-4) и 156,8 (С-2).
1-(3-Метил-2,4-диметоксифенил)-3-(2',5'-дигидроксифенил)пропан (UP302b) (3). Выход 0,01% (чистота >95%, ЖХВР); УФ λMax: 279,8 нм; МС (суперзвуковая ионизация, выявление положительных ионов): m/z 303 (M+1, 100%);1Н-ЯМР (400 МГц, (CD3COCD3): δ 1,82 (2H, m, СН2), 2,07 (3Н, s, СН3), 2,52 (2H, m, CH2), 2,56 (2H, m, CH2), 3,63 (3Н, s, ОСН3), 3,77 (3Н, s, ОСН3), 6,64 (1Н, q, H-15), 6,72 (1Н, d, H-14), 6,64 (1Н, d, H-5), 6,70 (1Н, d, H-17), 7,00 (1Н, d, H-6), 7,65 (1Н, s, ОН) и 7,69 (1Н, s, ОН).
Пример 6. Полупромышленное выделение 1-(3-метил-2,4-диметоксифенил)-3-(2',4'-дигидроксифенил)пропана (UP302a) (2) из Dianella ensifolia (DE) (растение целиком)
Собирали Dianella ensifolia (4,3 кг, все растение), измельчали и экстрагировали трижды с помощью экстрактора с фильтром, с использованием метанола в качестве растворителя. Экстракты объединяли и упаривали для удаления метанола. Затем неочищенный экстракт суспендировали в воде и разделяли с помощью ДХМ. Слои разделяли и ДХМ-слой упаривали, получая 60 г продукта. ЖХ-МС/PDA-анализ обоих слоев позволил установить, что основная часть UP302a находилась в ДХМ-слое и только незначительное количество находилось в водном слое. ДХМ-экстракт фракционировали на трех различных колонках с силикагелем, элюируя градиентом гексан-EtOAc. Получали всего 15 подфракций и анализировали с помощью ЖХВР-MC/PDA. Требуемое соединение (UP302a) было обнаружено в фракциях 6-9, которые объединяли, получая всего 3 г обогащенного UP302a. Обогащенное соединение UP302a дополнительно разделяли на открытой колонке, заполненной смолой CG-161, осуществляя элюирование с помощью градиента вода/МеОН. Всего собирали 23 фракции, при этом UP302a элюировалось в фракциях 15-21. Затем фракции 15-21 объединяли и растворитель выпаривали, получая 700 мг твердого вещества, которое дополнительно очищали препаративной ЖХВР на колонке С-18, получая 30 мг UP302a. Структуру, ингибирующую активность в отношении тирозиназы и чистоту очищенного продукта подтверждали с помощью ЯМР, анализа ингибирования фермента и ЖХ-MC/PDA.
Пример 7. Синтез диарилалканов путем восстановления борогидридом замещенных халконов
Ниже описан общий метод синтеза диарилалканов путем восстановления борогидридом замещенных халконов на примере восстановления 2,4-дигидрокси-3',4'-диметоксихалкона (4).

2,4-Дигидрокси-3',4'-диметоксихалкон (4) (40 мг) растворяли в 1-пропаноле 25 (5 мл), затем добавляли борогидрид натрия (15 мг) и смеси давали прореагировать при комнатной температуре в течение 2 ч. После завершения реакции добавляли 20%-ную уксусную кислоту (0,2 мл) и смесь выдерживали при 80°С в течение 5 мин и охлаждали. Затем смесь разделяли на предварительно упакованной колонке C18, элюируя в градиенте МеОН/Н2О, с получением 1-(2,4-дигидроксифенил)-3-(3,4-диметоксифенил)-1-пропанола (5). Структуру соединения (5) подтверждали с помощью МС, УФ-спектроскопии, 1D и 2D1Н-ЯМР.
1-(2,4-Дигидроксифенил)-3-(3',4'-диметоксифенил)-1-пропанол (5). Выход 60% (чистота >98%, ЖХВР); УФ λMax: 278,5 нм; МС (суперзвуковая ионизация, выявление положительных ионов): m/z 305 (М+1, 100%);1Н-ЯМР (400 МГц, (CD3)2SO): δ 1,93 (2H, m, СН2), 2,60 (2Н, m, CH2), 4,49 (1Н, m, CH-OH), 3,78 (3Н, s, ОСН3), 3,80 (3Н, s, ОСН3), 6,28 (1Н, q, H-5), 6,31 (1Н, d, H-3), 6,98 (1Н, d, H-6), 671 (1Н, q, H-5'), 6,77 (1Н, d, H-2'), 6,83 (1Н, d, H-6').
С помощью описанного выше общего метода синтеза следующие соединения восстанавливали до соответствующих спиртов: 2,4-дигидрокси-2'-гидроксихалкон, 2'-гидрокси-4'-метокси-2,4-диметоксихалкон, 4'-гидрокси-4-гидроксихалкон, 2',4'-дигидрокси-2-гидроксихалкон, 2',4'-дигидрокси-3,4-диметоксихалкон, 2',4',6'-триметокси-3,4-диметоксихалкон и 2'-гидрокси-4'-метокси-3,4,5-триметоксихалкон, получая 1-(2,4-дигидроксифенил)-3-(2'-гидроксифенил)-1-пропанол, 1 -(2-гидрокси-4-метоксифенил)-3-(2',4'-диметоксифенил)-1-пропанол, 1-(4-гидроксифенил)-3-(4'-гидроксифенил)-1-пропанол, 1-(2,4-дигидроксифенил)-3-(2'-гидроксифенил)-1-пропанол, 1-(2,4-дигидроксифенил)-3-(3',4'-диметоксифенил)-1-пропанол, 1-(2,4,6-триметоксифенил)-3-(3',4'-диметоксифенил)-1-пропанол и 1-(2-гидрокси-4-метоксифенил)-3-(3',4',5'-триметоксифенил)-1-пропанол.
Пример 8. Синтез замещенных дифенилпропанолов путем восстановления борогидридом натрия замещенных диарилпропанонов
Ниже описан общий метод синтеза замещенных дифенилпропанолов путем восстановления борогидридом замещенных диарилпропанонов на примере восстановления 1-(2-гидрокси-5-метоксифенил)-3-(2',4'-диметоксифенил)-1-пропанона (6).

1-(2-гидрокси-5-метоксифенил)-3-(2',4'-диметоксифенил)-1-пропанон (6) (5 мг) растворяли в 1-пропаноле (1 мл), затем добавляли борогидрид натрия (2 мг) и смеси давали прореагировать при комнатной температуре в течение 5 ч. После завершения реакции добавляли 20%-ную уксусную кислоту (0,2 мл) для нейтрализации избытка борогидрида натрия. Затем смесь разделяли на предварительно упакованной колонке C18, элюируя в градиенте МеОН/Н2О с получением 1-(2-гидрокси-5-метоксифенил)-3-(2',4'-диметоксифенил)-1-пропанола (7).
С помощью описанного выше общего метода синтеза восстанавливали следующие диарилалканы: 1-(2-гидрокси-4,6-диметоксифенил)-3-(3'-метокси-4'-гидроксифенил)-1-пропанон, 3-(5'-бензилокси-4'-метокси-2'-метилфенил)-1-(2-гидрокси-4,5-диметоксифенил)-1-пропанон, 1-(2-гидрокси-4-метоксифенил)-3-(2',3',4',5'-тетрагидробензо(b)диоксоцин-8'-ил)-1-пропанон и 3-(5'-хлор-1'-метил-1'-гидроимидазол-2'-ил)-1-(2-гидрокси-4-метоксифенил)-1-пропанон, получая 1-(2-гидрокси-4,6-диметоксифенил)-3-(3'-метокси-4'-гидроксифенил)-1-пропанол, 3-(5'-бензилокси-4'-метокси-2'-метилфенил)-1-(2-гидрокси-4,5-диметоксифенил)-1-пропанол, 1-(2-гидрокси-4-метоксифенил)-3-(2',3',4',5'-тетрагидробензо(b)диоксоцин-8-ил)-1-пропанол и 3-(5'-хлор-1'-метил-1'-гидроимидазол-2'-ил)-1-(2-гидрокси-4-метоксифенил)-1-пропанол соответственно.
Пример 9. Синтез 1,3-бис(2,4-диметоксифенил)пропан-1,3-диола (9)

1,3-Бис(2,4-диметоксифенил)пропан-1,3-дион (8) (5 мг) растворяли в 1-пропаноле (1 мл), затем добавляли борогидрид натрия (3 мг) и смеси давали прореагировать при комнатной температуре в течение 3 ч. После завершения реакции добавляли 20%-ную уксусную кислоту (0,2 мл) для нейтрализации избытка борогидрида натрия. Затем смесь разделяли на предварительно упакованной колонке C18, элюируя в градиенте МеОН/Н2О, с получением 1,3-бис(2,4-диметоксифенил)пропан-1,3-диола (9).
Пример 10. Синтез 1-(2,4,6-тригидроксифенил)-3-(3'-гидрокси-4'-метоксифенил)-1-пропанола (11) из неохесперидина

Неохесперидин представляет собой гликозид дигидрохалкона. Всего 100 мг неохесперидина суспендировали в 10 мл 1н. НС1 и выдерживали при 80°С в течение 2 ч. Гидролизованный продукт (10) охлаждали и экстрагировали этилацетатом (3×10 мл). Этилацетатные слои объединяли, упаривали для удаления этилацетата и растворяли в 1-пропаноле (5 мл). К пропанольному раствору добавляли борогидрид натрия (25 мг) и перемешивали при комнатной температуре в течение 2 ч. После завершения реакции смесь разделяли на предварительно упакованной колонке C18, элюируя в градиенте МеОН/Н2О, с получением 1-(2,4,6-тригидроксифенил)-3-(3'-гидрокси-4'-метоксифенил)-1-пропанола (11).
Пример 11. Экстракция, очистка и структурная модификация бутрина для синтеза 1-(2,4-дигидроксифенил)-3-(3',4'-дигидроксифенил)-1-пропанола (14)

Бутрин представляет собой гликозид с высоким содержанием флаванона, который экстрагировали метанолом из высушенных цветков Butea frondosa и очищали путем нескольких хроматографических разделений на колонке с обращенной фазой. После удаления сахаров путем гидролиза с помощью HCl получали бутин (12) и очищали с помощью ОФ-ВПО (выход из всего растения 1,5%). Затем бутин обрабатывали 10%-ным гидроксидом натрия при 80°С с получением бутеина (13), который восстанавливали борогидридом натрия, получая 1-(2,4-дигидроксифенил)-3-(3',4'-дигидроксифенил)-1-пропанол (14) (IC50=250 нМ).
Пример 12. Синтез 1-(2,4-дигидроксифенил)-3-(3'-метокси-4'-гидроксифенил)-1-пропанола (19)

Резорцинол (15), 3-метокси-4-гидроксикоричную кислоту (16) и H2SO4 (5%) кипятили с обратным холодильником в ТГФ в течение 4 ч, получая 7,4'-дигидрокси-3'-метоксифлаванон (17) (выход 90%). Затем продукт, 7,4'-дигидрокси-3'-метоксифлаванон (17), обрабатывали 10%-ным гидроксидом натрия при 80°С в течение 1 ч, а затем восстанавливали борогидридом натрия в пропаноле, получая, что подтверждено с помощью ЖХ-MC/PDA, 1-(2,4-дигидроксифенил)-3-(3'-метокси-4'-гидроксифенил)-1-пропанол (19). Неочищенный продукт обладал достаточно сильной ингибирующей активностью в отношении тирозиназы. Затем смесь очищали с помощью ВПО.
Пример 13. Оценка IC50 синтетических диарилалканов, являющихся ингибиторами тирозиназы
Ингибирование тирозиназы синтетическими диарилалканами оценивали методом, описанным в примере 2. Значение IC50 каждого образца рассчитывали с помощью программы для оценки кинетических характеристик для подтверждения того, что реакция в конкретный момент времени и при конкретной концентрации является линейной. С помощью методов, описанных в примерах 7-12, синтезировали всего 24 соединения и оценивали их способность ингибировать тирозиназу. Результаты представлены в Таблице 2.
Пример 14. Кинетические характеристики ингибирования фермента
С помощью метода, описанного в примере 2, оценивали ингибирование тирозиназы при использовании различных концентраций (0, 261, 522, 1044 нМ) ингибитора (UP302a) и различных концентраций L-ДОФА 0,75, 1,25 и 2,5 мМ в качестве субстрата. Как видно из фиг.10, установлено, что UP302a является конкурентным ингибитором, характеризующимся эффективным и продолжительным ингибирующим действием. Тирозиназная активность не возобновлялась в течение нескольких дней после инкубации с UP302a. В противоположность этому тирозиназная активность полностью восстанавливалась уже через 1 ч после инкубации с койевой кислотой.
Пример 15. Ингибирование производства меланина в клетках линии В-16
Ингибирование производства меланина оценивали с помощью двух различных анализов. В первом анализе ингибирование производства меланина оценивали без индукции β-MSH; а во втором анализе ингибирование производства меланина оценивали в присутствии β-MSH в среде для культуры клеток. В целом, метод состоит в следующем: клетки В16 F1 (ATCC № CRL-622) выращивали до конфлюэнтности и затем высевали по 40000 клеток на лунку. Клеткам давали прикрепиться в течение ночи при 37°С во влажной среде, содержащей 5% СО2. В день 2 к клеткам добавляли ингибиторы в концентрациях от 0 до 1000 мкМ в трех повторностях и инкубировали в течение 4 дней. Определяли количество β-MSH, необходимое для индукции образования меланина, путем добавления гормона в концентрациях от 0 до 1000 нМ с десятикратным возрастанием. После определения соответствующей концентрации β-MSH клетки высевали согласно вышеуказанной процедуре, позволяли прикрепиться в течение ночи и затем совместно инкубировали с ингибиторами тирозиназы в концентрациях от 0 до 1000 мкМ. Появление цветового окрашивания оценивали визуально каждое утро. После появления цветового окрашивания 200 мкл клеточного супернатанта брали из каждой лунки и оценивали абсорбцию при 450 нм. Полученные данные использовали для расчета значений IC50, характеризующих формирования меланина, в анализе на клетках при индукции β-MSH и без индукции. При начальном сравнении цитотоксичности лунки, обработанные 250 мкМ, применяли для анализа лактатдегидрогеназы (ЛДГ). ЛДГ представляет собой связанный с метаболизмом фермент, который отсутствует в поврежденных или погибших клетках. Фермент превращает хромофор в присутствии НАД+ с изменением цвета, которое можно оценивать спектрофотометрически.
Результаты этого анализа позволили установить, что все изученные встречающиеся в естественных условиях ингибиторы (UP288, UP302a и UP302b) являются эффективными ингибиторами, активность которых близка или превышает активность койевой кислоты. Обнаружены некоторые различия в значениях IC50 при использовании двух различных вариантов условий. Значение IC50 при ингибировании койевой кислотой изменялось от 170 мкМ для эксперимента в эндогенных условиях до 67 мкМ для эксперимента в условиях индукции. Из всех изученных в сравнении с койевой кислотой ингибиторов только у соединения UP302b выявлено повышение значения IC50 в аналогичных двух вариантах условий, значение IC50 повышалось с 5,2 мкМ до 34 мкМ. Значения IC50, характеризующие ингибирование тирозиназы, оказались близкими для всех изученных соединений за исключением двух соединений, UP302 и UP302b, которые имели более низкие значения IC50 0,2 мкМ и 0,3 мкМ соответственно по сравнению с 28 мкМ и 5,2 мкМ в анализе в эндогенных условиях и 40 мкМ и 34 мкМ для анализа в условиях индукции. Эти различия могут быть следствием пониженной способности проникать в клетки у UP302a (2) и UP302b (3) по сравнению с другими ингибиторами. Однако этот недостаток нивелируется их высокой способностью ингибировать фермент.
В таблице 3 представлены результаты этих двух анализов ингибиторов UP288 и UP302a в сравнении с койевой кислотой.
Пример 16. Анализ цитотоксичности
Анализ лактатдегидрогеназы (ЛДГ) осуществляли в лунках, обработанных соединениями. ЛДГ представляет собой связанный с метаболизмом фермент, который отсутствует в поврежденных или погибших клетках. Фермент превращает хромофор в присутствии НАД+ с изменением цвета, которое можно оценивать спектрофотометрическим методом. Цитотоксичность оценивали при использовании концентрации 250 мкМ. В этой концентрации ни у одного из соединений не обнаружена существенно более высокая цитотоксичность по сравнению с койевой кислотой. Однако следует заметить, что оценивали цитотоксичность соединений только в одной концентрации (250 мкМ). Как видно из таблицы 3, у UP288 (1) и UP302a (2) обнаружена умеренная цитотоксичность, сопоставимая с койевой кислотой.
Пример 17. Расчет молекулярной механики (ММ2)
Расчеты молекулярной механики осуществляли с использованием программы Chem3D, предназначенной для минимизации энергии и определения наиболее стабильной 3-D-конформации (трехмерной конформации). Использовали следующие параметры: размер шага = 2,0 фс, размер кадра = 10 фс, окончание после 10000 шагов, скорость нагревания/охлаждения = 1000 ккал/атом/PS, температура мишени = 3000 K. Характеристики: порядки pi-связи и суммарная стерическая энергия. Анализировали все встречающиеся в естественных условиях и синтетические соединения и другие диарилалкановые и диарилалканольные структуры. Установлено, что наиболее эффективный ингибитор тирозиназы, т.е. 1-(3-метил-2,4-диметоксифенил)-3-(2,4-дигидроксифенил)пропан (UP302a (2), IC50=0,24 мкМ), выделенный из всех частей растений Dianella ensifolia (L.) DC, имел выраженную уникальную 3-мерную конформацию, в которой два ароматических кольца были наложены друг на друга. Минимальная общая энергия для конформации составляла -4,7034 кДж/моль. Расстояние между двумя ароматическими кольцами составляло 3,28 Å. Фенольные гидроксильные группы первого ароматического кольца располагались непосредственно над двумя метоксильными группами второго ароматического кольца, при этом расстояние между двумя атомами кислорода составляло 2,99 и 3,16 Å соответственно, что проиллюстрировано на фиг.12-14. Такая внутримолекулярная параллельная конформация идеально подходит для образования хелатного комплекса этого соединения с обоими ионами меди, находящимися как сверху, так и снизу, двухъядерного фермента, когда он находится в пероксидной форме [CuII-O2-CuII].
Пример 18. Приготовление на основе диарилалканов композиции в виде крема
UP302a включает замещенный диарилпропан в качестве наиболее активного компонента. Эти соединения растворимы в высоко полярных растворителях, таких как (но не ограничиваясь ими) этанол, пропиленгликоль и этиленгликоль. На их основе можно приготавливать формы в сочетании с фармацевтически и/или косметически приемлемым эксципиентом, адъювантом и/или носителем. Примерами таких эксципиентов являются (но не ограничиваясь ими) вода, буферы, раствор Рингера, раствор декстрозы, маннит, раствор Хэнкса, консерванты и другие водные физиологически сблансированные солевые растворы. Можно применять также неводные наполнители, такие как (но не ограничиваясь ими) жировые масла, кунжутное масло, этилолеат или триглицериды. Другие приемлемые препаративные формы представляют собой (но не ограничиваясь ими) суспензии, содержащие усиливающие вязкость агенты, такие как (но не ограничиваясь ими) карбоксиметилцеллюлоза натрия, сорбит или декстран. Эксципиенты могут содержать также минорные количества добавок или консервантов, таких как вещества, повышающие изотоничность и химическую стабильность. UP302 можно включать также в форму в виде липосома для повышения его способности проникать через кожу или в виде формы с контролируемым высвобождением, из которой медленно происходит медленное высвобождение композиции активного вещества в организм хозяина. UP302a предпочтительно наносят местно в виде мази, геля, лосьона или кремовой основы или в виде эмульсии, бляшки, средства ухода за волосами или маски, не прилипающей марли, повязки, тампона или матерчатого полотенца. Такое местное применение можно осуществлять путем локального нанесения на любую пораженную область с помощью любого из стандартных средств, предназначенных для местного применения. UP302 можно применять для обработки как человека, так и животных.
Терапевтическую композицию, содержащую UP302a, можно применять в виде различных стандартных доз в зависимости от пути введения и требуемых показаний. Эффективное нетоксичное рекомендованное количество, как правило, составляет от 0,01 до 5% в пересчете на общую массу препаративной формы, предназначенной для местного применения. С использованием двух различных концентраций UP302a (0,01 и 0,5 мас.%) приготавливали препаративные формы в виде крема, проиллюстрированные в таблицах 4 и 5. Для приготовления кремов диарилалкан растворяли в воде при комнатной температуре и гомогенизировали в смесителе до полного диспергирования в растворе (примерно 5 мин) с получением композиции А. При комнатной температуре и без перемешивания или взбалтывания к гомогенизированному раствору добавляли карбомер Ultrez-21 путем разбрызгивания на поверхность и давали полностью высохнуть (отсутствие видимых областей белого цвета) и вливали в раствор. Затем раствор нагревали до 40°С при осторожном перемешивании и добавляли глицерин и состав перемешивали в течение еще 5 мин с получением композиции Б. При 40°С композицию А добавляли к композиции Б и состав перемешивали до полностью гомогенного состояния (примерно 5 мин). Образовавшуюся эмульсию охлаждали до 30°С и значение рН доводили примерно до 5,5 (от 5,3 до 5,7) титрованием с нейтрализатором при перемешивании с помощью палочки для перемешивания и/или шпателя. Эмульсия становилась очень вязкой из-за вызванного нейтрализатором изменения конформации карбомера. После перемешивания эмульсия достигала вязкости, приемлемой для эмульсионного крема. Состав смешивали до однородности, заливали с чистые сосуды для хранения и хранили при температуре от 2°С до 8°С.
Реферат
Настоящее изобретение относится к новым индивидуальным диарилалканам, к способу предупреждения лечения заболеваний и состояний, связанных с тирозиназами, способу предупреждения лечения заболеваний и состояний, связанных со сверхпроизводством или неравномерным распределением меламина, способу ингибирования активности тирозиназы и способу супрессии синтеза меламина, в которых используются предлагаемые диарилалканы, а также к композиции для местного применения на основе новых диарилалканов. 6 н. и 24 з.п. ф-лы, 5 табл., 14 ил., 18 пр.

Комментарии