Трехфазный пероральный контрацептив - RU2225207C2
Код документа: RU2225207C2
Чертежи


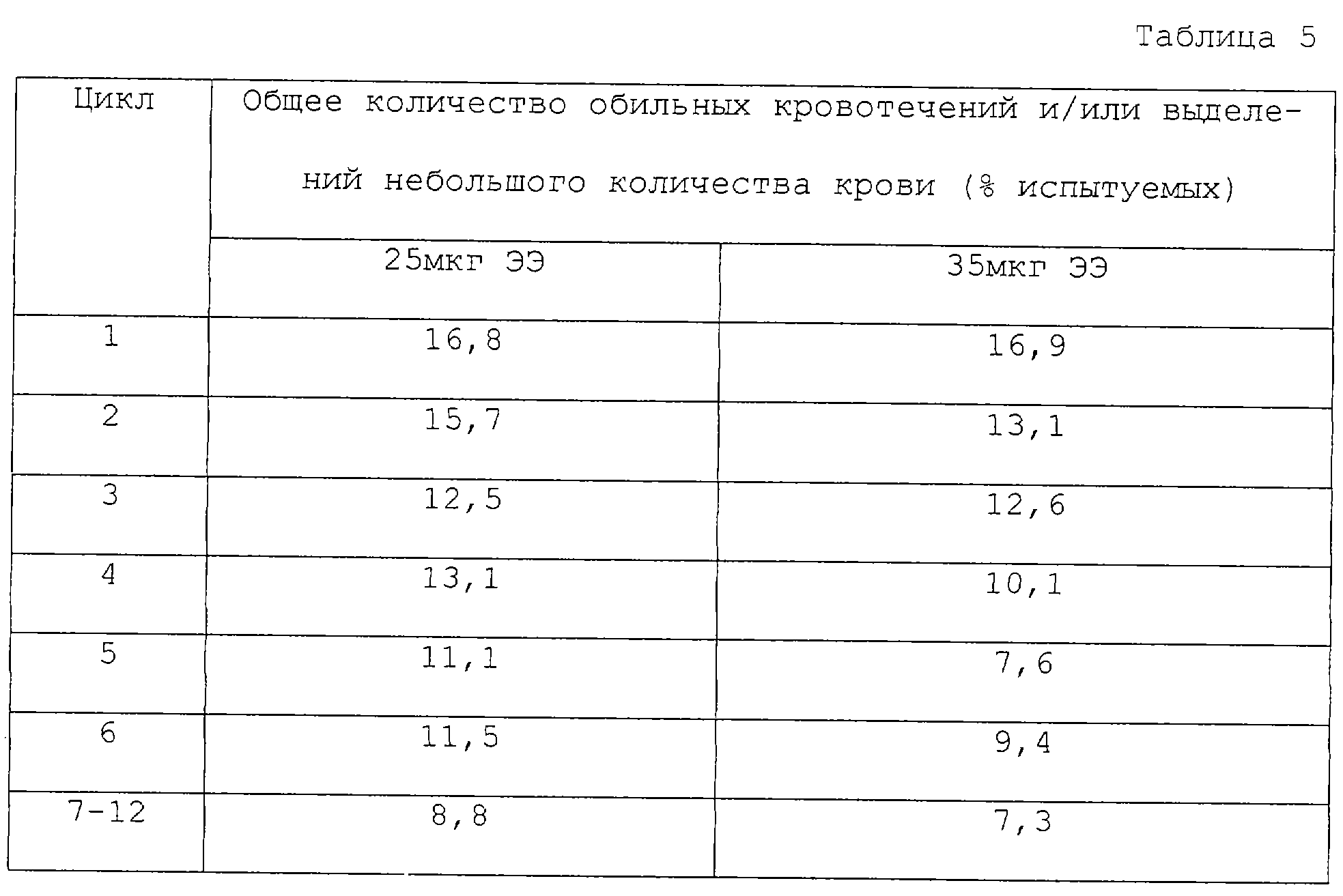
Описание
Изобретение относится к схемам приема перорального трехфазного стероидного контрацептивного средства. Более подробно, настоящее изобретение относится к схеме приема перорального трехфазного контрацептивного средства, содержащего прогестин и низкие дозы этинилэстрадиола (ЭЭ).
Предпосылки изобретения
а. Схемы приема препаратов,
содержащих низкие дозы эстрогена
В прошлом было установлено, что существует определенное преимущество, связанное со стероидными пероральными контрацептивами, т.е. ПК, содержащими небольшие
количества прогестина и, особенно, небольшие количества эстрогена. Такое преимущество низких доз эстрогена включает снижение количества нежелательных побочных эффектов, таких как тошнота, рвота,
расстройство желудка, так же как и снижение числа серьезных побочных эффектов, таких как тромбоэмболия, инсульт и инфаркт миокарда. Таким образом, хотя преимущества стероидных контрацептивных
препаратов хорошо известны в области медицины, желательно вводить наименьшую эффективную дозу стероидов для конкретного пациента для сведения к минимуму количества побочных эффектов данных типов.
Принципиальной проблемой, касающейся приема ПК с низкими дозами эстрогена, является недостаточный контроль цикла и проблемы согласия пациента, связанные с недостаточным контролем цикла. При дозах эстрогена ниже 30 мкг в сутки установлено, что число обильных кровотечений и/или выделения небольшого количества крови из влагалища возрастает до такого уровня, что многие женщины могут ожидать возникновение дополнительного дискомфорта вследствие нерегулярных кровотечений. Данный недостаток в контроле цикла будет заставлять многих женщин излишне обращаться к более высоким дозам эстрогена, прекращать прием контрацептивных препаратов или не придерживаться предписанной схемы приема. Широко признано, что симптомы недостаточного контроля цикла влияют на случаи нежелательной беременности, поскольку способствуют прекращению приема ПК женщинами, не желающими беременности.
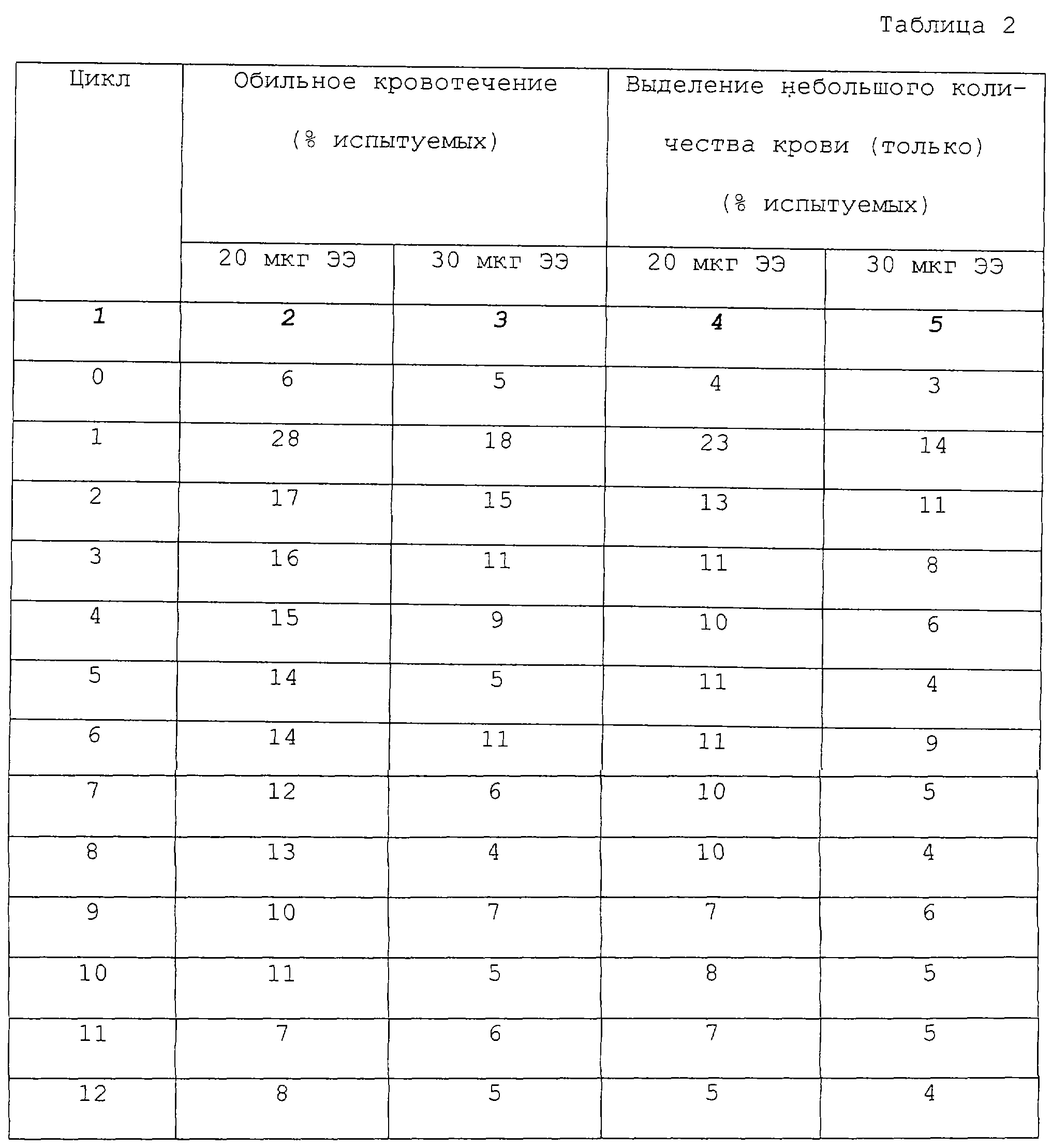
Endrikat, J.; U. Muller и B.Dusterberg; Contraception, 1997; 55:131-137, сравнили влияние приема монофазного препарата, содержащего 20 мкг и 30 мкг этинилэстрадиола (ЭЭ) на контроль цикла. Согласно данной схеме, женщины получали таблетки, содержащие 20 мкг ЭЭ и 75 мкг гестодена или 30 мкг ЭЭ и 75 мкг гестодена. Схема приема являлась монофазной с активным приемом таблеток в течение 21 дня и последующим 7-дневным перерывом. Более высокий уровень возникновения обильных кровотечений и/или выделений небольшого количества крови из влагалища наблюдался при схеме приема 20 мкг ЭЭ. Результаты в виде обильных кровотечений и/или выделений небольшого количества крови из влагалища, раскрытые в данной статье, более полно представлены ниже в виде сравнительного примера А.
Tuimala, R.; M. Saranen и U. Alapiessa; Acta Obstet Gynecol Scand, 1994; 144: 7-12, сравнили влияние приема монофазного препарата, содержащего 20 мкг и 30 мкг этинилэстрадиола (ЭЭ), на контроль цикла. Согласно данной схеме женщины получали таблетки, содержащие 20 мкг ЭЭ и 150 мкг дезогестрела или 30 мкг ЭЭ и 150 мкг дезогестрела. Схема приема являлась монофазной с активным приемом таблеток в течение 21 дня и последующим 7-дневным перерывом. Более высокий уровень возникновения обильных кровотечений и/или выделения небольшого количества крови из влагалища был очевиден при схеме приема 20 мкг ЭЭ. Результаты в виде обильных кровотечений и/или выделений небольшого количества крови из влагалища, раскрытые в данной статье, более полно представлены ниже в виде сравнительного примера В.
Akerlund, M. ; A. Robe и J. Westergaard; Brit J Obstet Gynecol, September, 1993; 100:832-838, сравнили влияние приема монофазного препарата, содержащего 20 мкг и 30 мкг этинилэстрадиола (ЭЭ), на контроль цикла. Согласно данной схеме женщины получали таблетки, содержащие 20 мкг ЭЭ и 150 мкг дезогестрела или 30 мкг ЭЭ и 150 мкг дезогестрела. Схема приема являлась монофазной с активным приемом таблеток в течение 21 дня и последующим 7-дневным перерывом. Более высокий уровень возникновения обильных кровотечений и/или выделения небольшого количества крови из влагалища являлся очевидным при схеме приема 20 мкг ЭЭ. Результаты в виде обильных кровотечений и/или выделений небольшого количества крови из влагалища, раскрытые в данной статье, более полно представлены ниже в виде сравнительного примера С.
Darney, P. и С. Klaisle; Dialogues in Contraception; Vol.5, Number 5, Univ. of Southern California School of Medicine исследовали ряд литературных источников и пришли к выводу, что ПК, содержащие 20 мкг эстрогена, такие как монофазная схема, включающая 20 мкг ЭЭ и 100 мкг левоноргестрела, имеют более высокий уровень обильных кровотечений и/или выделений небольшого количества крови из влагалища, чем препараты, содержащие 30 или 35 мкг эстрогена.
Task Force on Oral Contraceptives-WHO Special Program of Research, Development и Research Training in Human Reproduction; Contraception, 1982; Vol.25, Number 3, показал, что сочетание 1 мг норэтиндронацетата и 50 мкг ЭЭ обладает лучшим контролем цикла по сравнению с сочетанием 1 мг норэтиндронацетата и 20 мкг ЭЭ.
Таким образом, существует необходимость в ПК, содержащих эстроген в дозе меньшей, чем 30 мкг в сутки, способными контролировать цикл эквивалентно ПК с более высоким содержанием эстрогена.
b. Трехфазная схема приема
Известны
контрацептивные препараты трехстадийного или трехфазного типа. Трехфазная схема приема различных типов описана в US Pat. Nos. 4390531; 4066757; 3957982; 3795734 и 2431704.
Недавно Pasquale S. , US Pat. Nos. 4530839; 4544554; 4616006 и 4628051 описали трехфазную схему контрацепции, включающую введение последовательно в течение 21 дня женщинам детородного возраста комбинации эстрогена и прогестогена в низкой, но эффективной в отношении контрацепции суточной дозе, соответствующей по эстрогенной активности 20-50 мкг 17α-этинилэстрадиола и по прогестогенной активности 0,065-0,75 мг норэтиндрона, в течение 5-8 дней; в течение следующих 7-11 дней эстрогенная суточная доза равнялась 20-50 мкг 17α-этинилэстрадиола и по прогестогенной активности 0,250-1,0 мг норэтиндрона и в течение следующих 3-7 дней эстрогенная суточная доза равнялась 20-50 мкг 17α-этинилэстрадиола и по прогестогенной активности 0,35-2,0 мг норэтиндрона; с последующим 6-8-дневным перерывом введения эстрогена и прогестогена, при условии, что суточная доза эстрогена являлась одинаковой в каждом периоде. Целью данной схемы приема является снижение общей ежемесячной дозы стероидов при приеме пероральных контрацептивов, в то же время еще обеспечивая эквивалентность профилей кровотечений и предупреждение наступления беременности со стандартными пероральными контрацептивами.
Особая трехфазная схема приема по Pasquale завоевала значительный коммерческий успех. Один коммерческий препарат, содержащий норгестимат, производится Ortho-McNeil Pharmaceutical Inc. в США под названием ORTHO TRI-CYCLEN. Согласно данной схеме в течение 7 дней принимают таблетки, содержащие 35 мкг 17α-этинилэстрадиола и 0,180 мг норгестимата, следующие 7 дней принимают таблетки, содержащие 35 мкг 17α-этинилэстрадиола и 0,215 мг норгестимата, следующие 7 дней принимают таблетки, содержащие 35 мкг 17α-этинилэстрадиола и 0,250 мг норгестимата, с последующим 7-дневным приемом плацебо. Другой коммерческий препарат, содержащий норэтиндрон, производится Ortho-McNeil Pharmaceutical Inc. в США под названием ORTHO-NOVUM 7/7/7. Согласно данной схеме в течение 7 дней принимают таблетки, содержащие 35 мкг 17α-этинилэстрадиола и 0,5 мг норэтиндрона, следующие 7 дней принимают таблетки, содержащие 35 мкг 17α-этинилэстрадиола и 0,75 мг норэтиндрона, следующие 7 дней принимают таблетки, содержащие 35 мкг 17α-этинилэстрадиола и 1,0 мг норэтиндрона с последующим 7-дневным приемом плацебо. Данные схемы показали особенную эффективность как контроля цикла у женщин, так и предупреждения наступления беременности при относительно низкой общей ежемесячной дозе стероидов.
Однако существует необходимость в комбинированном типе контрацептивного препарата, содержащем низкую общую ежемесячную дозу стероидов, но, тем не менее, эффективном в отношении предупреждения наступления беременности и поддерживающем высокий уровень контроля цикла.
Остается необходимость в трехфазной схеме приема контрацептивного препарата с существенно низкой дозой эстрогена, но при этом без существенной потери контроля цикла.
Сущность изобретения
Согласно настоящему изобретению достигнут способ надежной контрацепции при низкой дозе эстрогена с помощью введения последовательно в течение в сумме 20-24
дней женщинам детородного возраста комбинации эстрогена и прогестогена в контрацептивно эффективной суточной дозе, в котором первая фаза составляет 5-8 дней, при этом комбинация включает эквивалент по
прогестогенной активности 0,065-0,75 мг норэтиндрона и эквивалент по эстрогенной активности 23-28 мкг этинилэстрадиола; последующая вторая фаза составляет 7-11 дней, при которой комбинация включает
эквивалент по прогестогенной активности 0,25-1,0 мг норэтиндрона и эквивалент по эстрогенной активности 23-28 мкг этинилэстрадиола; последующая третья фаза составляет 3-7 дней, при которой комбинация
включает эквивалент по прогестогенной активности 0,35-2,0 мг норэтиндрона и эквивалент по эстрогенной активности 23-28 мкг этинилэстрадиола; с последующим 4-8-дневным перерывом введения гормонов; при
условии, что доза прогестина нарастала от первой фазы ко второй фазе и далее к третьей фазе и доза эстрогена оставалась постоянной в каждой фазе. Реальная масса дозы на каждом уровне дозировки будет
зависеть от активности эстрогена и прогестогена соответственно, выбранных компонентов для дозированной формы.
Авторами для данной трехфазной схемы приема неожиданно установлено и представлено ниже, что снижение уровня вводимого эстрогена не приводит к пропорциональному снижению эффективности контроля цикла.
Подробное описание изобретения
Суммарное
количество дней, в течение которых вводится комбинация прогестогена и эстрогена, предпочтительно составляет 21 день. Далее следуют 4-8 дней перерыва введения гормонов для приближения к естественному
28-дневному менструальному циклу женщин. Первый день цикла определяют как первый день менструации и с этого момента последовательно нумеруют дни до наступления менструации снова. Обычно цикл длится 28
дней, но он может быть немного длиннее или короче. На практике плацебо или любая из содержащих гормоны таблеток может включать пищевые добавки, такие как, например, железо, фолиевая кислота, кальций и
т.п. Таким образом, согласно предпочтительной схеме, первая фаза будет начинаться где-нибудь между 1-м днем и 7-м днем менструального цикла и длиться 5-8 дней, предпочтительно 7 дней, вторая фаза
будет составлять 7-11 дней, предпочтительно 7 дней, третья фаза будет составлять 3-7 дней, предпочтительно 7 дней.
Контрацептивная композиция согласно настоящему изобретению включает отдельные суточные дозированные единицы, содержащие суточную дозу и рассчитанные на последовательное ежедневное пероральное применение. Композиция в основном включает для первой фазы 5-8 дозированных единиц, содержащих комбинацию эстрогена и прогестогена в сочетании с фармацевтически приемлемой основой, для следующей второй фазы 7-11 дозированных единиц, содержащих комбинацию эстрогена и прогестогена, для следующей третьей фазы 3-7 дозированных единиц, содержащих комбинацию эстрогена и прогестогена, и необязательно последующие 4-8 дозированных единиц, не содержащих эстрогена и прогестогена. Суточная доза эстрогена остается постоянной для всех трех фаз.
В качестве подходящего компонента для контрацептивного препарата согласно данному изобретению может быть применен любой стандартный эстроген. Отдельная схема приема, содержащая отдельные суточные дозы, должна быть одинаковой по контрацептивной активности для каждой фазы с суточной дозой около 23-28 мкг 17α-этинилэстрадиола. Предпочтительная доза равна суточной дозе, содержащей 25 мкг 17α-этинилэстрадиола.
Кроме 17α-этинилэстрадиола в качестве эстрогенного компонента также могут использоваться сложные и простые эфиры 17α-этинилэстрадиола, такие как, например, 17α-этинилэстрадиол-3-диметиламинопропионат, 17α -этинилэстрадиол-3-циклопентиловый эфир (хинестрол) и 17α-этинилэстрадиол-3-метиловый эфир (местранол). Также могут использоваться как естественные эстрогены, такие как эстрон, эстронсульфат, пиперазиновая соль эстрон-сульфата, эстрадиол и эстриол и их сложные эфиры, так и синтетические эстрогены. Предпочтительным эстрогеном является 17α-этинилэстрадиол или 17α -этинилэстрадиол-3-метиловый эфир.
В качестве прогестогенового компонента может быть применено любое прогестогенно активное соединение. Предпочтительно прогестоген вводят на первой фазе в суточной дозе, соответствующей по прогестогенной активности 0,065-0,75 мг норэтиндрона в сутки, в ходе второй фазы в суточной дозе, соответствующей по прогестогенной активности 0,25-1,0 мг норэтиндрона в сутки, и в ходе третьей фазы в суточной дозе, соответствующей по прогестогенной активности 0,35-2,0 мг норэтиндрона в сутки. Согласно аспекту настоящего изобретения доза прогестина должна существенно увеличиваться от первой фазы ко второй фазе и далее к третьей фазе. Прогестоген более предпочтительно вводят на первой фазе в суточной дозе, соответствующей по прогестогенной активности 0,25-0,65 мг норэтиндрона в сутки и наиболее предпочтительно 0,40-0,60 мг норэтиндрона в сутки, в течение второй фазы в суточной дозе, соответствующей по прогестогенной активности 0,35-0,9 мг норэтиндрона в сутки и наиболее предпочтительно 0,65-0,85 мг норэтиндрона в сутки и в течение третьей фазы в суточной дозе, соответствующей по прогестогенной активности 0,50-1,50 мг норэтиндрона в сутки и наиболее предпочтительно 0,9-1,1 мг норэтиндрона в сутки. Для примера, доза норэтиндрона может составлять для первой фазы 0,50 мг, для второй фазы 0,75 мг и для третьей фазы 1,0 мг.
Прогестогены, которые могут применяться в качестве компонента по настоящему изобретению, включают прогестерон и его производные, такие как, например, сложные эфиры 17-гидроксипрогестерона и сложные эфиры 19-нор-17-гидроксипрогестерона, 17α-этинилтэстостерон, 17α-этинил-19-нортестостерона и его производные, норэтиндрон, D-норгестрел, Δ15-левоноргестрел, Δ15-левоноргестрелацетат, оксим Δ15-левоноргестрелацетата, В-17β-ацетокси-β-этил-17α-этинилгон-4-ен-3-он оксим (норгестимат), дезогестрел, этинодиолдиацетат, дидрогестерон, медроксипрогестеронацетат, норэтинодрел, аллилэстренол, линоэстренол, хингестранолацетат, медрогестон, норгестриенон, диметистерон, этистерон, ципротеронацетат, хлормадинонацетат и магестролацетат. Предпочтительными прогестогенами являются норэтиндрон и норгестимат.
Соответствие прогестогенной активности между прогестогенами в общем и норэтиндром в частности хорошо освещено в литературе. Таблица 1, представленная ниже, взята из литературы и показана здесь для убедительности.
В случае, когда прогестогеном является норгестимат, предпочтительно его вводить на первой фазе в суточной дозе 0,03-0,25 мг в сутки, в течение второй фазы в суточной дозе 0,1-0,35 мг в сутки и в течение третьей фазы в суточной дозе 0,15-0, 50 мг в сутки. Норгестимат более предпочтительно вводить в течение первой фазы в суточной дозе 0,1-0,22 мг в сутки и наиболее предпочтительно 0,15-0,20 мг в сутки, в течение второй фазы предпочтительная суточная доза 0,15-0,30 мг в сутки и наиболее предпочтительно 0,2-0,23 мг в сутки, и в течение третьей фазы в суточной дозе 0,20-0,40 мг в сутки и наиболее предпочтительно 0,23-0,3 мг в сутки. Примерная доза норнгестимата может составлять для первой фазы 0,180 мг, для второй фазы 0,215 мг и для третьей фазы 0,250 мг.
Эстрогенный и прогестогенный компоненты предпочтительно вводят перорально вместе с фармацевтически приемлемым нетоксичным носителем, но их можно вводить отдельно или парентерально. В основном эффективные вещества обрабатывают вместе с добавками, носителями и/или ароматизирующими веществами, обычно применяемыми в галеновой фармации согласно обычно приемлемой фармацевтической практике. Для предпочтительного перорального применения пригодными в основном являются таблетки, драже, капсулы, пилюли, суспензии или растворы; для парентерального применения только растворы, такие как, например, растворы в кунжутном масле или касторовом масле, которые могут необязательно дополнительно содержать разбавитель, такой как, например, бензилбензоат или бензиловый спирт.
В случае предпочтительного перорального введения, трехфазные контрацептивы комбинированного типа, предпочтительно, упаковывают в виде фармацевтического набора или упаковки, в которых суточные дозы упорядочены для приема в правильном порядке. Данное изобретение, поэтому, также относится к фармацевтической единице, содержащей контрацептивный препарат комбинированного типа в дозированных единицах в упорядоченной фиксированной последовательности, где последовательность или порядок дозированных единиц соответствует стадии ежедневного приема.
Фармацевтическая единица может быть, например, в виде прозрачной упаковки, содержащей дозированные единицы, упорядоченные в определенной последовательности, и состоящей из таблеток, предназначенных для первой фазы, таблеток для последующей второй фазы, таблеток для последующей третьей фазы и наконец необязательно последующего плацебо. Каждый день берут отдельную таблетку в течение всего периода цикла.
Без дополнительного уточнения предполагается, что специалист в данной области с помощью предшествующего описания может применить настоящее изобретение в полном объеме. Предпочтительные последующие специфические воплощения представлены в качестве только иллюстрации к изобретению и не ограничивают изобретение в любом отношении.
Сравнительный пример А
Испытуемые и способы
Данное двойное слепое рандомизированное
сравнительное исследование проводили в 10 центрах Германии в течение периода, включающего 12 циклов, как полностью описано Endrikat, J. ; U.Muller и В.Dusterberg; Contraception, 1997; 55: 131-137.
Здесь представлены следующие данные для удобства в неполном объеме по сравнению с полным текстом статьи.
Для исследования были подобраны в целом 649 здоровых, сексуально активных женщин в возрасте от 18 до 39 лет, нуждающихся в приеме контрацептивов по крайней мере в течение 12 месяцев. Добровольцы включали как женщин, ранее не применявших контрацептивы, так и женщин, применявших другой пероральный контрацептивный препарат. Из исследования исключали женщин, применявших имплантируемые контрацептивы в течение последних шести месяцев, имеющих заболевания печени, сосудистые или метаболические нарушения, опухоли, беременность, диагностически неклассифицированное генитальное кровотечение и все другие противопоказания для применения ПК. Желание приема контрацептивов в течение, по крайней мере, 12 месяцев считали основным. Женщины получали стрипы с пилюлями, включающими как 21 покрытую сахарной оболочкой таблетку с испытуемым препаратом, содержащим 20 мкг ЭЭ и 75 мкг GSD (SH D 543 A, Schering AG), так и препарат сравнения, включающий 21 таблетку, содержащую 30 мкг ЭЭ и 75 мкг GSD (FEMODENE, SH D 356 С, Schering AG). Женщины начинали принимать испытуемые препараты с первого дня наступления следующего менструального цикла.
Замечания, касающиеся контроля цикла и нежелательных реакций, записывались испытуемыми в их картах менструации. Кровотечение, возникшее между менструальными циклами, классифицировали как выделение небольшого количества крови (скудное кровотечение), которое не требует гигиенической защиты, или как обильное кровотечение (нормальное/избыточное кровотечение), которое требует гигиенической защиты.
Результаты
Во всех 428 случаях, включающих в сумме 4470 циклов применения,
оценивали пероральный контрацептив, содержащий 20 мкг ЭЭ и 75 мкг GSD (SH D 543 А - испытуемый препарат; препарат, содержащий 20 мкг ЭЭ), и в 221 случае, включающем в сумме 2377 циклов, оценивали
пероральный контрацептив, содержащий 30 мкг ЭЭ и 75 мкг GSD (SH D 356 С - препарат сравнения; препарат, содержащий 30 мкг ЭЭ). Во все анализируемые данные включали максимум 12 циклов. В общем 74,6%
испытуемых применяли препарат, содержащий 20 мкг ЭЭ, и 76,6% женщин, принимающих препарат, содержащий 30 мкг ЭЭ, закончили 12 циклов применения. Около 95% добровольцев не пропускали прием какой-либо
пилюли в ходе исследования. В общем 5,1% женщин, принимающих препарат, содержащий 20 мкг ЭЭ, и 4,9% женщин, принимающих препарат сравнения (30 мкг ЭЭ), пропустили прием одной или нескольких пилюль в
ходе исследования.
В ходе курса исследования 161 доброволец вышли из исследования по различным причинам. В общем 93 женщины (21,7%) в группе, принимающей препарат с 20 мкг ЭЭ, и 40 (18, 0%) в группе, принимающей по 30 мкг ЭЭ, были исключены по собственному желанию или врачом. Шестнадцать женщин (3,7%) (20 мкг ЭЭ) и 12 женщин (5,4%) (30 мкг ЭЭ) были исключены спонсором. В данных случаях завершали исследование, поскольку протокол нарушителей соглашения или (в некоторых случаях) добровольцев не содержал полностью все циклы приема препарата, включающие запланированное время оценки исследования.
Следование соглашению в ходе исследования было в основном хорошим и схожим в двух группах. При анализе пропуска приема пилюли за цикл установлено, что от 92,9 до 96,9% женщин в группе, принимающей препарат, содержащий 20 мкг ЭЭ, не пропускали ни одного приема. Соответствующие цифры для группы, принимающей по 30 мкг ЭЭ, составили от 92,6 до 97,7% в любом взятом цикле.
Частота появления любого кровотечения между менструальными циклами (как небольшого выделения крови, так и нормального или чрезмерно обильного кровотечения) в основном увеличивалась для обоих препаратов с первых трех циклов до 12 цикла (таблица 2). Наибольшее число возникновения выделений небольшого количества крови (только выделения небольшого количества крови) было отмечено у 22,6% испытуемых, принимавших содержащий 20 мкг ЭЭ препарат (SH D 543 А), и у 13,8% испытуемых, принимавших контрацептив, содержащий 30 мкг ЭЭ (FEMONDENE), в ходе первого цикла (таблица 2). Наибольшее число появления нормального или чрезмерно обильного кровотечения (только обильного кровотечения) было отмечено у 2,4% испытуемых в ходе третьего цикла в группе, принимавшей по 20 мкг ЭЭ. С этого момента количество женщин с любым типом кровотечения между менструальными циклами непрерывно уменьшалось до низких уровней, меньших 7 и 5% соответственно. Большинство женщин имели менее чем два цикла приема препарата с появлением обильного кровотечения. Данные, представленные в таблице 2, получили при ознакомлении или оценке данных, взятых из гистограммы в оригинальной статье.
В общем 47,4% всех женщин, принимающих препарат, содержащий 20 мкг ЭЭ, отметили выделение небольшого количества крови, по крайней мере, один раз в течение всего исследования, но не при каждом цикле. Соответствующая цифра для препарата, содержащего 30 мкг ЭЭ, составила 35,5%. Данные уровни сравнивали с помощью критериев Фишера и определили существенный разброс (р< 0, 05). Соответствующие уровни для обильных кровотечений составили 14,5 и 11,5% женщин и не имели существенного разброса (р>0,05).
Сравнительный пример В
Испытуемые и
способы
В данном исследовании сравнивали результаты двух отдельно проведенных открытых мультицентровых испытаний в общем 270 женщин, отобранных в 20 амбулаторных клиниках в различных частях
Финляндии, как врачами общей практики, так и гинекологами. Результаты полностью представлены в (Tuimala, R.; M.Saranen и U. Alapiessa; Acta Obstet Gynecol Scand, 1994; 144: 7-12). Здесь для удобства
представлены следующие данные в неполном объеме по сравнению с полным текстом статьи.
В исследование отбирали только женщин детородного возраста с нормальным контролем цикла и обычно подвергающихся риску возникновения беременности. Женщины, применявшие ранее другие контрацептивные препараты, должны были завершить прием предыдущего препарата, по крайней мере, за 2 месяца до начала исследования и должны были иметь, по крайней мере, два естественных менструальных периода. Женщин с любыми известными противопоказаниями для проведения пероральной контрацепции исключали.
Из 270 женщин, принявших участие в двух испытаниях, 91 женщина применяли пероральную контрацептивную комбинацию, включающую 0,150 мг дезогестрела и 30 мкг этинилэстрадиола (Marvelon®), в течение в общем 964 циклов (приема препарата) для одного исследования, в то время как 179 женщин применяли комбинацию, включающую 0,150 мг дезогестрела и 20 мкг этинилэстрадиола (Mercilon®), в течение в общем 2096 циклов для другого исследования. Поскольку оба испытания проводили как отдельные исследования, не было рандомизированного распределения женщин по двум испытуемым группам. Оба исследования являлись монофазными. Каждый исследуемый цикл состоял из 21-дневного периода с ежедневным приемом таблеток (1 таблетка в сутки) с последующим 7-дневным периодом перерыва приема.
Результаты
Эффективность как 0,150/0,030, так и 0,150/0,020 мг комбинации дезогестрела/ЭЭ была хорошей. Не наблюдалось случаев возникновения
беременности при применении обоих сравниваемых препаратов.
По отчетам оба препарата показали хороший уровень подавления нерегулярности кровотечения (таблица 3). Для обоих препаратов частота или отсутствие нерегулярного кровотечения возрастало от почти 80% для первого цикла до приблизительно 85-90% для последующих циклов исследования. В основном менее чем 5% женщин испытывали неприемлемые нерегулярные кровотечения при применении того или другого препарата.
Сравнительный пример С
Испытуемые и способы
Пероральные контрацептивы, содержащие 0,
150 мг дезогестрела и 20 или 30 мкг ЭЭ на таблетку (Mercilon® и Marvelon®/Desolett® соответственно), сравнивали на 1000 женщин в течение периода
приема препарата, равного одному году, что полностью описано в Akerlund, M.; A.Rode и J.Westergaard; Brit J Obstet Gynecol, September 1993; 100: 832-838. Пробный размер исследования (2•500
участников) определяли так, чтобы было возможно показать минимальность различий в отношении возникновения нерегулярных кровотечений. Здесь для удобства представлены следующие данные в неполном объеме
по сравнению с полным текстом статьи.
Для исследования отбирали женщин, нуждающихся в пероральной контрацепции. В Норвегии отобрали 300 женщин для исследования (шесть центров, все принадлежащие к частной гинекологической практике), 500 женщин в Швеции (две университетские клиники, два центральных госпиталя, одна частная практика) и 200 женщин в Дании (одна университетская клиника). Возраст принявших участие в исследовании женщин составил от 18 до 35 (Норвегия) или от 18 до 40 лет (Швеция и Дания). Женщин распределяли для исследования действия препаратов случайным образом согласно списку, представленному Organon International bv (Oss, The Netherlands): 485 женщин принимали комбинацию 150/20 мкг и 497 принимали 150/30 мкг. Таблетки были предоставлены Organon International в стандартных немаркированных блистерах, рассчитанных на 21 день. Женщины как перешедшие с приема другого ПК на исследуемый препарат (переключенные), так и не принимавшие каких-либо гормональных контрацептивных препаратов, по крайней мере, в течение двух месяцев (новички).
Женщины начинали прием исследуемых препаратов с первого дня менструального цикла или кровотечения после отмены ранее применяемого ПК. Таблетки принимали последовательно в течение 21 дня с последующим семидневным перерывом. Контрольные наблюдения проводили после трех, шести и 12 месяцев применения ПК, ведя протоколы кровяного давления и массы тела. Кроме того, в ходе исследования женщины отмечали все вагинальные кровотечения в специально составленных картах пациента, в которых также отмечались каждый прием таблетки и все побочные реакции. Собирали заполненные карты пациента и раздавали новые карты пациента при контрольных наблюдениях, так же как и новые исследуемые лекарственные препараты. При заключительном наблюдении проводили снова гинекологическое обследование и определяли концентрацию гемоглобина.
Кровотечение считали нормальным кровотечением при отмене, если оно возникало во время периода перерыва приема таблеток и продолжалось не более чем восемь дней. Любое другое кровотечение, возникающее в течение периода приема таблеток, определяли как нерегулярное кровотечение. Кровотечение далее подразделяли на выделение небольшого количества крови (требующее применения самое большее одной гигиенической прокладки или тампона в сутки) или обильное кровотечение (требующее применения больше чем одной гигиенической прокладки или тампона в сутки). Подсчитывали количество и продолжительность данных двух типов нерегулярных кровотечений. Все дни, в течение которых наблюдалось одновременно обильное кровотечение и выделение небольшого количества крови, засчитывали как дни с обильным кровотечением.
Получили данные по 4543 циклам с приемом комбинации 150/20 мкг и по 4688 циклам с приемом 150/30 мкг. Снижение количества числа испытуемых от начала исследования до первого цикла происходило за счет женщин, решивших участвовать в исследовании и получивших исследуемый препарат, но далее не начавших прием лекарственного препарата.
Результаты
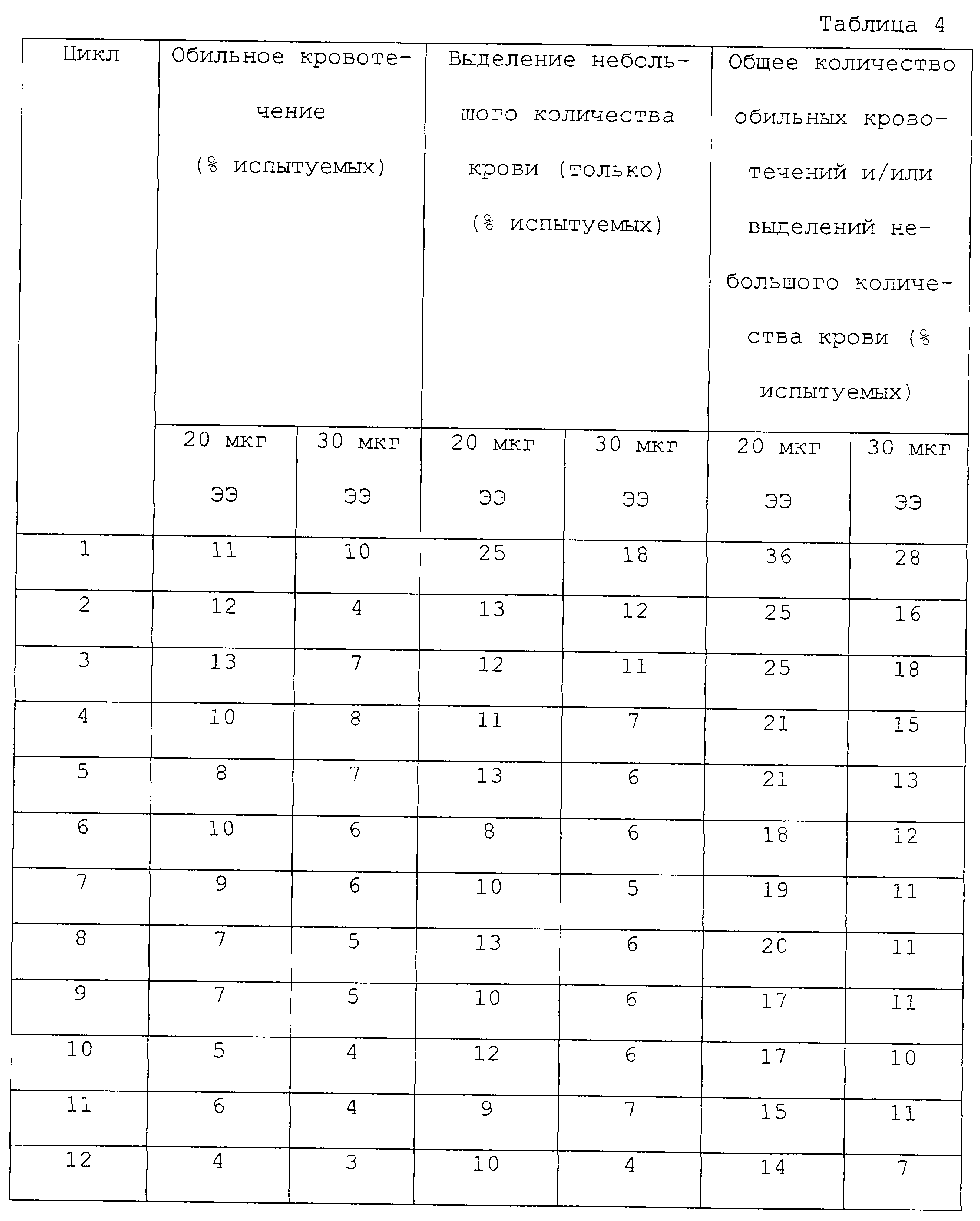
После завершения исследования в наличии
имелось 8900 циклов, записанных в картах пациента. После проверки пригодности данных 8573 циклов могли быть включены в анализ. Количество нерегулярных кровотечений (обильных кровотечений или выделений
большого количества крови) представлено в таблице 4 для всех исследуемых циклов. Нерегулярные кровотечения наблюдались более часто при низкой дозе ЭЭ, чем при высокой дозе. Различие было статистически
значимым для двух-трех циклов, случайно выбранных в течение одного года исследования. Число выделений небольшого количества крови и обильных кровотечений уменьшалось с увеличением продолжительности
применения обоих ПК. Подобная тенденция наблюдалась при предварительном анализе тех женщин, которые завершили исследование. Однако первые шесть месяцев исследования показали более низкую частоту
возникновения нерегулярных кровотечений в данной группе, сравниваемой с общим количеством испытуемых, за счет женщин, вышедших из исследования. Значения, представленные в таблице 4, получили при
ознакомлении или оценке данных, взятых из гистограммы в оригинальной статье.
Пример 1
Испытуемые и способы
Проводили рандомизированные многоцентровые исследования для
оценки трех слепых схем приема перорального контрацептива, содержащего норгестимат и этинилэстрадиол (НГЭ/ЭЭ), и одной открытой контрольной схемы приема. Одна из данных трех слепых схем приема
представляла собой трехфазную схему приема согласно настоящему изобретению. В данной трехфазной схеме приема вводили в ходе первой фазы таблетку, содержащую 0,180 мг норгестимата и 25 мкг ЭЭ, один раз
в сутки в течение 7 дней; в ходе второй фазы таблетку, содержащую 0,215 мг норгестимата и 25 мкг ЭЭ, один раз в сутки в течение 7 дней и в ходе третьей фазы таблетку, содержащую 0,250 мг норгестимата
и 25 мкг ЭЭ; с последующим 7-дневным периодом приема таблеток-плацебо. Приблизительно 6300 испытуемых вошли в полное исследование. Соотношение испытуемых, набранных в каждую из трех групп со слепым
режимом приема, и в контрольную группу с открытой схемой приема составило 3:2. Первые 500 испытуемых в каждой из трех групп со слепым режимом приема предполагали завершить 13 циклов. Все другие
испытуемые были набраны на период из 6 циклов. Для рандомизированного включения испытуемых в исследовании применяли Interactive Voice Randomization System (IVRS).
В исследование отбирали испытуемых, удовлетворяющих следующим критериям включения и не имеющих какого-либо из критериев исключения.
Критерии включения:
- возраст от 18 до 45 лет. Женщины в
возрасте от 35 до 45 лет должны быть некурящими;
- сексуально активные, живущие регулярной половой жизнью;
- имеющие регулярный менструальный цикл, наблюдающийся каждые 25-35 дней;
- имеющие приемлемый индекс массы тела;
- имеющие, по крайней мере, два нормальных менструальных цикла (обычных по продолжительности и количеству выделений для данного испытуемого),
которые наблюдались после последней беременности;
- имеющие, по крайней мере, один нормальный менструальный цикл (обычный по продолжительности и количеству выделений для данного испытуемого)
с момента удаления ВМПС или Nor-plant;
- находящиеся в состоянии после беременности, по крайней мере, в течение 42 дней до включения в исследовании;
- не кормящие грудью;
- здоровые, что устанавливается исследователем после ознакомления со следующими данными:
медицинский анамнез;
результаты физикального обследования (включая основные жизненные
параметры);
результаты гинекологического обследования (включая осмотр молочных желез);
результаты лабораторных исследований;
- имеющие в покое систолическое давление <
140 мм рт. ст. и диастолическое кровяное давление <90 мм рт. ст.;
- не находящиеся в состоянии беременности, что определяли по отрицательному результату РИА теста на беременность на
наличие сывороточной β-субъединицы HCG в течение 7 дней до приема препарата;
- не имеющие в настоящий момент проявлений дисплазии шейки матки;
- согласные принимать только
предписанный исследуемый препарат в качестве контрацептива в течение 13 исследуемых циклов, исключая случаи, когда требуется дублирование контрацепции или STD-защита;
- ознакомившиеся и
подписавшие информированное соглашение после подробного объяснения характера исследования.
Критерии исключения:
- наличие в настоящий момент или в прошлом заболеваний,
являющихся общепризнанными противопоказаниями для применения комбинированных пероральных контрацептивов, включая следующий неполный список:
тромбофлебит глубоких вен или наклонность к
тромбоэмболиям;
нарушения мозгового кровообращения и коронарного кровообращения, гипертоническая болезнь или сильные мигрени;
доброкачественная или злокачественная опухоли печени,
развивающиеся при применении пероральных контрацептивов или других препаратов, одержащих эстроген;
обнаруженная или подозреваемая карцинома в любой системе организма, включая молочные железы
или генитальный тракт;
инсулин-зависимый сахарный диабет;
обнаруженная или подозреваемая эстроген-зависимая неоплазия;
холестатическая желтуха;
- наличие
заболеваний, являющихся общепризнанными противопоказаниями для применения пероральных контрацептивов, включая следующий неполный список:
недиагностированное патологическое влагалищное
кровотечение;
любое нейроваскулярное поражение глаза или серьезное нарушение зрения;
любое нарушение функции печени или заболевание печени или заболевание почек;
любое
недавнее (в пределах 12 месяцев до визита перед исследованием) злоупотребление алкоголем или другими веществами;
- прием любого экспериментального препарата и/или применение любого
экспериментального прибора в пределах 30 дней до визита перед исследованием;
- применение инъекций депо-контрацептивного препарата про-вера (или любой другой инъекции пролонгированного
гормонального препарата) в пределах 6 месяцев до визита перед исследованием;
- применение барбитуратов, противоэпилептических препаратов, рифампицина, гризеофульвина или других лекарственных
препаратов, вызывающих индукцию ферментов печени, в пределах 30 дней до визита перед исследованием;
- незалеченные заболевания щитовидной железы;
- применение этретината (Tegison);
- сопутствующее применение изотретиноина (Accutane), третиноина (Renova или RETIN-A), их применение в 30-дневный период непосредственно до наблюдения перед исследованием;
- сомнение
исследователя в способности испытуемой заносить записи в протокол и обеспечить точную информацию.
При визите перед исследованием для каждого испытуемого собирали полный медицинский анамнез, придавая особое значение менструальному анамнезу и применению гормональных контрацептивов. Кроме того, проводили полное физикальное и гинекологическое обследование, включая исследование основных жизненных параметров, молочных желез и тазовых органов. Брали мазок Papanicolaou (PAP), хотя являлось допустимым взятие мазка в пределах 2 месяцев до начала исследования с составлением отчета. Также выполняли оценку индекса массы тела. При начальном визите испытуемым проводили экспресс-определение гематологического профиля, клинической биохимии, анализа мочи и РИА-тест на наличие β-субъединицы HCG на беременность. Испытуемых распределяли случайным образом на три группы со слепой схемой приема, начиная прием исследуемого препарата с первого дня менструального цикла. Испытуемых наблюдали во время контрольных визитов в конце 1, 3, 6, 9 и 13 циклов. При каждом визите определяли основные жизненные параметры и просматривали карты пациента и упаковки с исследуемым препаратом. При визитах в конце 6 цикла и 13 цикла проводили исследование крови на определение гематологического профиля и клинической биохимии. Испытуемые, не имеющие начала менструаций в течение периода приема таблеток-плацебо в любом цикле, немедленно связывались с исследователем и подвергались РИА-тесту на наличие β-субъединицы HCG. В ходе исследования не допускался прием следующих лекарственных препаратов, поскольку они влияли на действие исследуемого препарата: стероидные гормоны, барбитураты, противоэпилептические препараты, рифампицин, гризеофульвин или другие лекарственные препараты, вызывающие индукцию ферментов печени.
Контроль цикла оценивали по возникновению обильного кровотечения и/или выделения небольшого количества крови. Обильным кровотечением и/или выделением небольшого количества крови при каждом цикле считали обильное кровотечение и/или выделение небольшого количества крови, возникшее в период приема препарата, которое не являлось продолжением обильного кровотечения и/или выделения небольшого количества крови в период перерыва приема таблеток предыдущего цикла и не продолжалось без перерыва в периоде перерыва приема препарата.
Результаты
Исследование включило всего 10990 циклов, которые могли быть использованы для анализа трехфазной схемы приема 25 мкг ЭЭ. Среднее значение индекса массы
тела женщин, вошедших в исследование, составило 23,7 и их средний возраст составил 28,1 лет. Для данных исследованных циклов количество нерегулярных кровотечений (обильных кровотечений и/или выделений
небольшого количества крови) представлено в таблице 5. Как видно, случаи возникновения нерегулярных кровотечений для данной трехфазной схемы приема 25 мкг ЭЭ неожиданно сравнимы со случаями
возникновения нерегулярных кровотечений для данной трехфазной схемы приема 35 мкг ЭЭ, что описано в сравнительном примере 1.
Сравнительный пример 1
Испытуемые и способы
В ранее проведенном и отличном от описанного в примере 1 исследовании проводили рандомизированное многоцентровое одноячеечное трехфазное исследование для оценки трехфазной схемы приема
перорального контрацептива, содержащего норгестимат и этинил эстрадиол (NGE/EE). В данной трехфазной схеме приема вводили в течение первой фазы таблетку, содержащую 0,180 мг норгестимата и 35 мкг ЭЭ,
один раз в сутки в течение 7 дней; в ходе второй фазы таблетку, содержащую 0,215 мг норгестимата и 35 мкг ЭЭ, один раз в сутки в течение 7 дней и в ходе третьей фазы таблетку, содержащую 0,250 мг
норгестимата и 35 мкг ЭЭ; с последующим 7-дневным периодом приема таблеток плацебо. Все исследователи применяли общий протокол и установленные формы записи. Каждый исследователь составлял список из 50
испытуемых при общем количестве испытуемых 1800. Исследователей отбирали на основе их опыта работы в области планированиия семьи. Выбирали места исследования для включения всех регионов Соединенных
Штатов в клиниках и частных практиках, для уменьшения демографического различия. Каждый испытуемый предполагал завершить 24 последовательных цикла терапии и был включен в исследование в течение
максимального периода, составляющего 28 месяцев (включая контрольное наблюдение после терапии).
Для включения в исследование каждая женщина должна удовлетворять критериям включения и не иметь ни одного из критериев исключения, включая противопоказания к применению пероральных контрацептивов.
Для избрания каждая женщина должна удовлетворять критериям включения:
1. Здоровые без подозрений на бесплодность, что устанавливается с помощью медицинского анамнеза, физикального (включая основные жизненные параметры) и гинекологического обследования.
2. Возраст от 18 до 38 лет.
3. Не беременные: испытуемые, находящиеся в состоянии после родов и после аборта, могли быть включены в исследование на первой естественной менструации после окончания беременности.
4. Имеющие регулярный менструальный цикл.
5. Живущие регулярной половой жизнью.
6. Имеющие мазок Papanicolau без подозрений на дисплазию.
7. Выразившие согласие прекратить применение всех других способов контрацепции в течение циклов применения исследуемого препарата.
8.
Имеющие, по крайней мере, один нормальный менструальный цикл после удаления внутриматочного контрацептива Критериями исключения, включающими общепринятые противопоказания для стероидной гормональной
терапии и дополнительные пункты, касающиеся исследования, являются следующие:
1. Тромбофлебит или предрасположенность к тромбоэмболиям.
2. Тромбофлебит глубоких вен или предрасположенность к тромбоэмболиям в анамнезе.
3. Нарушения мозгового кровообращения и коронарного кровообращения.
4. Обнаруженная или подозреваемая карцинома молочной железы.
5. Обнаруженное или подозреваемое эстроген-зависимое новообразование.
6. Не диагностированное патологическое влагалищное кровотечение.
7. Доброкачественная или злокачественная опухоли печени, развивающиеся при применении пероральных контрацептивов или других эстроген-содержащих препаратов.
8. Любое нейроваскулярное поражение глаз или серьезное нарушение зрения, обнаруженное при обследовании перед терапией.
Также исключали тех женщин, которые применяли любой исследуемый препарат в пределах 30 дней перед включением в исследование за исключением норгестимата.
Результаты
Исследование включило в общем 16718 циклов, которые могли быть использованы для анализа трехфазной
схемы приема 35 мкг ЭЭ. Среднее значение массы тела женщин, вошедших в исследование, составило 135,8 фунтов и их средний возраст составил 24,8 лет. Для данных исследованных циклов количество
нерегулярных кровотечений (обильных кровотечений и/или выделений небольшого количества крови) представлено в таблице 5.
Имея подробное описание изобретения и примеры способов его практического воплощения, специалистам в данной области будет очевидно, что могут быть выполнены бесчисленные вариации, применения, модификации и добавления к основным включенным принципам без отклонения от сущности или пределов изобретения. Понятно, что предшествующее описание является только примером и настоящее изобретение не ограничивается специфической формой или расположенными разделами, описанными и представленными здесь.
Реферат
Изобретение относится к области медицины. Сущность состоит в том, что описан способ контрацепции, в котором эстроген и прогестоген вводят ежедневно в трехфазной последовательности в течение 21 дня. На первой фазе сочетание эстрогена и прогестогена вводят в течение 5-8 дней в низкой, но контрацептивно эффективной ежедневной дозе, соответствующей по эстрогенной активности 23-28 мкг 17α-этинилэстрадиола и по прогестогенной активности 0,065-0,75 мг норэтиндрона, с последующим введением в течение 7-11 дней той же дозы эстрогена и дозы прогестогена, соответствующей по прогестогенной активности 0,25-1,0 мг норэтиндона, с последующим введением в течение 3-7 дней той же дозы эстрогена и дозы прогестогена, соответствующей по прогестогенной активности 0,35-2,0 мг норэтиндона, с последующим перерывом во введении как эстрогена, так и прогестогена на 4-8 дней. Технический результат - расширение арсенала средств контрацепции. 3 с. и 24 з.п.ф-лы, 5 табл.

Комментарии