Новые композиции в форме подкожных имплантатов на основе производных нормегестрола, способ их получения и применения - RU2120797C1
Код документа: RU2120797C1
Чертежи




Описание
Данное изобретение относится к новым композициям, обладающим прогестативным действием, и способам их получения.
В частности, предметом изобретения являются новые композиции, предназначенные для обеспечения продолжительной контрацепции.
А также получение подкожного имплантата, содержащего
эффективное количество производного 3-замещенного 6-метил-17a-OR1 20-оксо 19-норпрегна 4,6-диена, выбранного из группы, состоящей из
a) 3,20-диоксо 6-метил 17a-OR1
19-норпрегна 4,6-диенов общей формулы I.
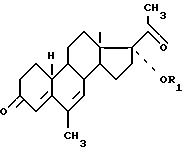
где
R1 - водород или ацильная часть органической алифатической, ароматической или циклановой карбоновой кислоты, имеющей от 2 до 16 углеродных атомов. b) замещенных 3-OR2 6-метил 17a-OR1 20-оксо 19-норпрегна 4,6-диенов общей формулы II

где
R1 определен выше;
R2 - водород, ацильная часть карбоновой кислоты, или алкильный радикал, имеющий от 1 до 8 углеродных атомов и
c) 6-метил 17a-OR1 19-норпрегна 4,6-диенов общей формулы III

где
R1 такой, как определен выше;
R3 и R4 вместе образуют либо оксимидную группировку формулы =N-O-R5, в которой R5 является водородом, низшим алкилом или карбоксиалкильной группой или представляет собой алкилендиокси группировку, которая может быть замещенной, или каждый из них являются низшим алкоксирадикалом, в смеси или в связи с носителем и с биологическим приемлемым разбавителем.
Известно, что с целью нахождения эффективной и продолжительной концентрации проводят испытание с имеющими очень важное значение инъецируемыми суспензиями прогестативов (Provera® .....), срок действия которых сохраняется на протяжении около 6 месяцев, часто сопровождаясь значительными побочными действиями.
Это и явилось причиной разработки имплантатов с биосоместимыми полимерами, которые вводят либо в маточную полость (Progestasert (R)) или в подкожные ткани (имплантаты).
Испытаны имплантаты, содержащие многочисленные стероидные активные ингредиенты с прогестагенной активностью, такие как норгестриенон, норэтиндрон или левоноргестрол.
Однако для этих продуктов необходимо для получения значительного срока действия включение в имплантат большого количества активного ингредиента или лучше введение нескольких имплантатов.
Так, Norplant®, который содержит в качестве активного ингредиента Норгестрел, имеет среднюю продолжительность активности порядка пяти лет для набора из 6 имплантатов Silastic®. Каждый имплантат наполнен 36 мг кристаллизованного норгестрела, что составляет общую нагрузку активного ингредиента в количестве 216 мг.
Данное изобретение позволяет избежать указанных выше неудобств.
Композиции данного изобретения требуют введения только одного имплантата размером от 30 до 45 мм в соответствии с типом имплантата, который выбран. Этот путь имплантации значительно проще и имплантат легче переносим. Использование в качестве активного ингредиента норпрегнадиенового производного, имеющего общие формулы I, II или III, определенные ранее, позволяет достичь эффективной концентрации, обремененной минимальными побочными действиями. Это использование обеспечивает персистенцию периодических кровотечений подобных менструации.
Поставленная цель достигается новой
композицией, содержащей эффективное количество производного 3/замещенного 6-метил 17a-OR1 20-оксо 19-норпрегна 4,6-диена, выбранного из группы, состоящей из
а) 3,20-диоксо 6-метил
17a-OR1 19-норпрегна 4,6-диенов общей формулы I:

значения R1 указаны выше,
б) замещенных 3-OR2 6-метил 17a-OR1 20-оксо 4,6-диенов общей формулы II

значения радикалов указаны выше,
в) 6-метил 17a-OR1 19-норпрегна 4,6-диенов общей формулы III:

значения радикалов указаны выше.
Имплантаты согласно данному изобретению приготавливают из полимерных материалов (гидрофобных, гидрофильных или биоразлагаемых), используемых в качестве векторов фармакологически активных соединений, предварительно включенных в формулах I, II и III.
Имплантаты бывают контейнерного типа или матричного типа.
К имплантатам, в которых используют гидрофобные материалы, могут быть отнесены:
- имплантаты контейнерного типа, получаемые из полиметилсилоксанов, таких как,
например, SILASTIC®, производимого компанией Dow Corning. Этот тип имплантата выполнен в форме трубки, имеющей наружный диаметр между 2 и 4 мм и толщину стенки около 0,4 мм. Трубку
нарезают на части заданной длины как функцию количества норпрегнадиенового соединения, которое желательно ввести. Концы этих частей трубки закрывают, используя клей медицинского назначения, также
поставляемый компанией Dow Corning, и который относится к группе силиконов ВКТ (вулканизующихся при комнатной температуре).
Количество противозачаточного соединения формул I, II или III, содержащегося в части трубки, колеблется от 30 до 80 мг, предпочтительно от 45 до 65 мг. Это содержание активного ингредиента определяется гранулометрическими свойствами активного ингредиента, который может быть тонкоизмельченным или микрокристаллическим, и его физико-химическими характеристиками (молекулярная масса, растворимость, диффузия, индекс разделения). Способ включения активного ингредиента может быть проведен либо в твердом состоянии, либо осуществляться путем диспергирования в биологически приемлемом и инертном носителе.
Способ получения и выделения микрокристаллизуемых форм соединений данного изобретения уже описан в патенте Франции N 2668945.
- имплантаты контейнерного типа, получаемые из этиленвинилацетатных сополимеров, такого как, например, материал, поставляемый под торговой маркой ELVAX® MD 40 компанией DUPONT de NEMOURS.
Этот тип имплантата уже используется для внутриматочного
устройства Progtstasert®, изготовляемого ALZA, но в противоположность устройству Progestasert в случае имплантатов данного изобретения активный ингредиент вводят в твердой форме;
- имплантаты матричного типа, получаемые из полидиметилсилоксанов.
Этот тип имплантата уже используют на людях (Nash Robertson and cowork - Contraception 18 (1978), p. 367). Этот имплантат матричного типа неудобен из-за высокой скорости освобождения активного ингредиента. Для того чтобы компенсировать этот недостаток, имплантаты согласно данному изобретению следует получать путем введения одного из производных согласно формулам I, II и III, суспендированных в гидрофильной жидкости, в которой активный ингредиент нерастворим.
Эту суспензию примешивают к
полидиметилсилоксанам, затем всю массу подвергают сшиванию, до того как перейти к экструзии эластомера в форме цилиндрической нити, имеющей заданные размеры. Этот способ позволяет получить кинетику
освобождения нулевого порядка и не более чем функция квадратного корня от времени, такую как для матрицы, цитируемой Nash и сотр.;
- имплантаты матричного типа, получаемые из сополимеров
этилен-винилацетат. В этом случае имплантат получают высушиванием. Благодаря своей монолитной структуре этот имплантат освобождает активный ингредиент по кинетике квадратного корня от времени.
Частичное покрытие, использующее мембрану, которое служит для контроля выделения из матрицы, может быть реализовано либо с помощью ЭВА полимера, имеющего более низкую концентрацию винилацетата, либо
при введении матрицы в трубку полидиметилсилоксана (типа SILASTIC), для того чтобы получить кривые освобождения нулевого порядка.
Среди имплантатов, использующих гидрофильные материалы,
можно выделить:
- имплантаты матричного типа, получаемые из гидроксиэтилполиметакрилатов, такого как, например HYDRON®, производимого компанией HYDRON HED SCIENCES.
Этот тип имплантата получают полимеризацией в спирте с последующей сшивкой при помощи этиленгликольдиметакрилата. После десольватации в расплаве получают в сухом виде (стекловидном) имплантат, кинетика которого близка к нулевому порядку.
Способ получения является до некоторой степени инспирированным способом, описанным GHIEN Y.W. для Norgestomet (J.Pharm. Sci. 65 (1976) 488).
Среди имплантатов, использующих биоразлагаемые материалы, можно выделить:
- имплантаты контейнерного типа, получаемые из поликапролактонов, производимых по
способу, раскрытому PITT and Cowork (J.Pharm. Sci. 68 (1979) 1534). Эти цилиндрические имплантаты, полученные путем экструзии, содержат от 30 до 50 мг одного из норпрегнадиеновых производных формул I,
II или III, суспендированных в инертном растворителе. Они имеют диаметр 2,4 мм;
- имплантаты матричного типа, получаемые из системы полимер молочной кислоты-полигликолевая кислота 50/50,
имеющей молекулярную массу порядка 180 000.
Этот тип имплантата включает от 20 до 40% норпрегнадиенового производного формул I, II или III. Имплантат получают растворением биоразлагаемой системы в метиленхлориде, к которой добавляют активный ингредиент, после чего растворитель вакуумируют.
Имплантат согласно данному изобретению помещают в надлежащее место, используя очень большую иглу, после локальной анестезии в подкожную основу области ягодиц или предплечья у женщин. По окончании лечения или в любое время имплантат может быть извлечен, используя ограниченное хирургическое вмешательство в условиях легкой местной анестезии.
К числу фармакологически активных соединений, которые согласно данному изобретению могут быть
включены в имплантаты, могут быть отнесены:
- 3,20-диоксо 6-метил 17a-гидрокси 19-норпрегна 4,6-диен,
- 3,20-диоксо 6-метил 17a-ацетокси 19-норпрегна 4,6-диен,
- 3 -гидрокси
6-метил 17a-ацетокси 20-оксо 19-норпрегна 4,6-диен,
- 3,17a -диацетокси 6-метил 20-оксо 19-нопрегна 4,6-диен,
-3 -пивалоилокси 6-метил 17a -ацетокси 20-оксо 19-норпрегна 4,6-диен,
-3,3-этилендиокси 6-метил 17a-ацетокси 20-оксо 19-норпрегна 4,6-диен,
-3-метоксиимино 6-метил 17a-ацетокси 20-оксо 19-норпрегна 4,6-диен,
-3-карбоксиметоксиимино 6-метил
17a-ацетокси 20-оксо- 19 норпрегна 4,6-диен,
-3,3- 1,2-(R)(R)диэтоксикарбонилэтилендиокси 6-метил- 17a -ацетокси 20-оксо 19-норпрегна 4,6-диен.
Биологически совместимые разбавители представляют собой фармакологически инертные порошки или наполнители, которые постепенно разлагаются под действием биологической среды и которые служат для разбавления, разделения или распределения активного ингредиента. Примерами разбавителей или наполнителей являются лактоза, маннит, мочевина, оливковое масло или арахисовое масло.
Более точные клинические испытания показали, что описанный ранее имплантат контейнерного типа на основе Silastic®, содержащий в качестве активного ингредиента ацетат нормегестрола, демонстрирует контрацептивную активность на протяжении по крайней мере 12 месяцев.
Кроме того, период 12 месяцев позволяет лучше контролировать субъекты.
Следующие примеры иллюстрируют данное изобретение, не ограничивая его.
Пример 1. Получение имплантатов контейнерного типа на основе Silastic® и клинические результаты.
Используемый материал представляет собой трубку из диметилполисилоксана, производимого компанией Dow Corning типа 602-265 (ссылка на каталог).
Трубки нарезают на кусочки заданного размера. Концы каждого отрезка герметизируют адгезивным материалом медицинского назначения, таким как Silastic® типа A или типа ВТК.
Отрезки наполняют заданным количеством ацетата нормегестрола, имеющего контролируемое гранулометрическое качество. Затем их закрывают при помощи адгезивного материала. Полученные таким путем имплантаты после этого стерилизируют.
Выбор определенного размера для данного имплантата, сделанного из Silastic®, производят исходя из апробации имплантатов различных размеров (20, 30 или
40 мм) на добровольцах в соответствии с примером 1:
- в случае имплантатов с длиной 20 мм имели место две беременности,
- в случае размера имплантата 30 мм беременность также
наступала,
- в случае размера имплантата 40 мм оплодотворения яйцеклетки не происходило, но процент аменореи оказался высоким.
Поэтому предпочтителен имплантат с 35-мм длиной заполнения, содержащей (50 ± 5) мг ацетата нормегестрола.
Этот имплантат был объектом исследования, проводимом на 100 женщинах, т. е. 1085 месяцев/женщин. Имплантаты вводились подкожным путем в область ягодиц после местной анестезии, используя 2%-ный раствор прокаина. Субъектами были женщины, обладающие половой активностью, молодые (86% были моложе 30 лет), во время овариальной активности с устойчивыми циклами.
80 субъектов участвовали в этом исследовании спустя один год. 11 субъектов изъяли имплантат между 6 и 11 месяцами и только 9 субъектов до 6 месяцев.
Причинами для абстиненции были:
- 9 случаев: предпочтение другого способа,
- 3 случая: наличие менструальной непунктуальности,
- 2 случая:
прибавка в весе,
- 3 случая: желание забеременеть,
- 3 случая: побочные действия (головокружения, дисменорея, головные боли).
В общем на 1085 месяцев/женщин наступила только одна беременность, что составляет Pearl's индекс 1,1%.
Кровотечение, подобное менструации, имело место у всех женщин, однако ритм его варьировался для каждой женщины. Из 80 женщин, которые были подвергнуты имплантации на год, среднее число периодов кровотечения составляло около 12,24 ± 0,29 со средней продолжительностью (в днях) 5,24 ± 0,11. Табл. 1 суммирует характеристики такого воздействия на женщин, подвергнутых лечению.
Фиг. 1 суммирует менструальные аномалии (аменорея, метроррагин, образование пятен) у первых двадцати женщин, которые были подвергнуты имплантации на протяжении года.
Аменорея наблюдалась у 19 женщин из 100 на первом месяце, затем ее проявление уменьшается со временем (4,7% на 11-м месяце). Частота месячных кровотечений также уменьшается со временем (от 11% на первом цикле до 1% на последнем месяце использования).
Фиг. 2 показывает изменение веса тела (n = 77) и артериального давления (n = 79) у женщин, которые подвергнуты имплантации на протяжении одного года. Представляется статистически значительное падение систолического кровяного давления (p = 0,02). Вес тела увеличивается в среднем на 1,1 кг (p = 0,05).
Проведено определение гормонов у женщин, имеющих имплантат.
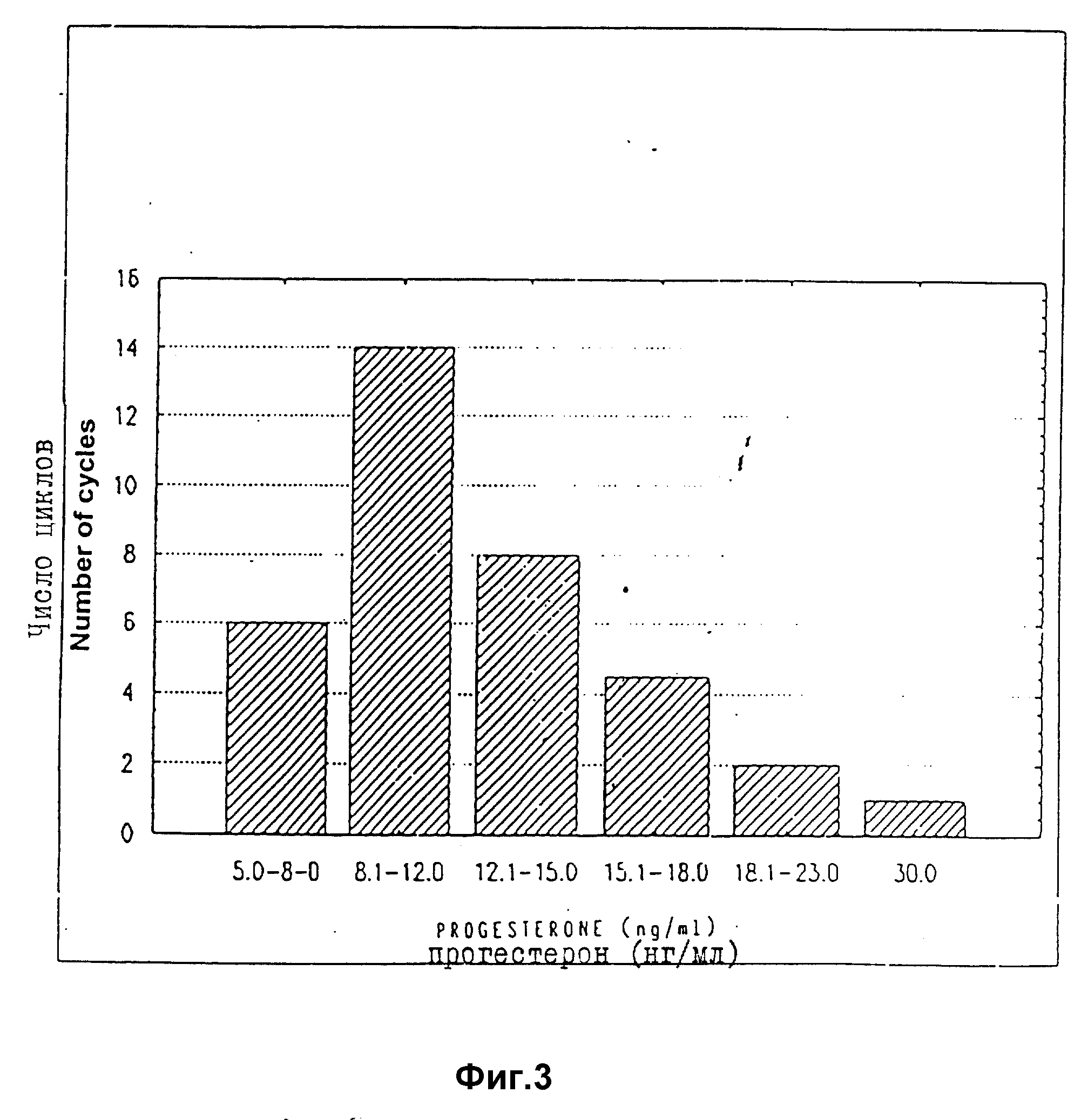
а) Проведены точные определения прогестерона во второй части "цикла" у двенадцати субъектов в шестидесяти циклах.
В тридцати шести циклах уровень прогестерона выше 3 нг/мл свидетельствует о наличии овуляции. Эти значения представлены на фиг. 3.
b) У пяти женщин по крайней мере еженедельно проводят отбор проб на эстрадиол и прогестерон во время контрольного цикла в течение пяти или шести первых циклов лечения, затем в течение одиннадцатого и двенадцатого циклов.
Перед имплантацией указанного имплантата циклы были всегда с уровнем прогестерона (8,1 ± 4,2) нг/мл и (10,1 ± 3,5) нг/мл соответственно на 18-й и на 24-й день цикла. В условиях лечения имплантата с ацетатом нормегестрола уровни прогестерона понижались, однако различие в сравнении с уровнями включения действительно становится значительным только с 24-го дня второго цикла (p < 0,05).
В целом наименьшие уровни достигаются в ходе первых четырех циклов лечения. На двенадцатом цикле лечения средние значения были нормальными, соответственно 7,1 ± 1,1 и 15,6 ± 4,7 нг/мл на 18-й и на 24-й день.
Во время исследуемых тридцати восьми циклов в условиях изучения доказана только одна овуляция (уровень прогестерона выше или равен 5 нг/мл) из 24 случаев (64,2%).
В течение первых циклов лечения каждой из пяти пациенток уровни прогестерона всегда были ниже, чем 5 нг/мл. В течение 12-го цикла уровни прогестерона в плазме всегда были совместимы с наличием овуляции.
Убедительно показано, что имплантат размером 35 мм, содержащий 48 мг ацетат нормегестрола, представляет собой эффективное контрацептивное вещество на протяжении периода по крайней мере двенадцати месяцев, не вызывая аменореи, которая тяжело переносится женщинами.
Толерантность, так же как и гинекология, в целом была хорошей.
Пример 2. Имплантаты ацетата нормегестрола матричного типа.
Получают цельную массу, которая формируется из эластомера с от 70 до 75% полиорганосилоксанового производного, имеющего силаноловые концевые группировки, и из от 24 до 29% силикагеля, содержащего от 0,2 до 0,5% выбранного катализатора.
С другой стороны, получают смесь, содержащую 50% одного из активных ингредиентов, имеющих формулы I, II или III, суспендированного в гидрофильном растворителе, и все перемешивают в 50%-ном полидиорганосилоксане.
Смесь, содержащую активный ингредиент, вводят в композицию, которая образует эластомер, в соответствии с классическими способами, известными в данной области.
Всю смесь загружают в экструдер для получения непрерывного экструдата, имеющего диаметр в диапазоне от 2 до 3 мм в зависимости от типа имплантата.
Этот экструдат смешивают при прохождении его через вентилируемую нагревательную печь при температуре в диапазоне от 30 до 80oC.
Этот экструдат затем нарезают на кусочки заданных размеров для того, чтобы получить имплантаты трубчатого типа, содержащие от 30 до 60 мг активного ингредиента.
Для испытаний "in vitro" используются имплантаты весом приблизительно 120 мг, содержащие 25% активного ингредиента.
Пример 3. Изучение "in vitro" освобождения ацетата нормегестрола (3,20-диоксо 6-метил-17a-ацетокси 19-норпрегна 4,6-диен) в нескольких имплантатах.
Проведено сравнение скорости освобождения активного ингредиента, который включен в три различных имплантата матричного типа и в один имплантат контейнерного типа.
Эти имплантаты помещают в контейнеры, содержащие известное количество воды, которую предварительно фильтруют и дегазируют. Эту среду меняют каждые 24 часа и испытания продолжают на протяжении 4 дней.
Ацетат нормегестрола, освобождаемый в этой среде, определяют при помощи УФ-спектрофотометрии при 296 нм. Для каждой формуляции определение повторяют три раза. Результат выражают в виде среднего трех определений и в мкг активного ингредиента, освобождаемого за 24 ч. Эти результаты суммированы в табл. 2 и 3.
Два из трех имплантатов матричного типа демонстрируют очень близкий профиль выделения с освобождением 110 мкг/день в состоянии равновесия. Через 14 дней около 14% активного ингредиента освобождается.
Освобождение активного ингредиента в имплантате контейнерного типа в два раза ниже. Во всех случаях, однако, кинетики были параллельны.
Третий имплантат матричного типа имеет профиль освобождения несколько отличный с более значительным промежуточным выделением.
Пример 4. Получение имплантата матричного типа на основе сополимера этилен/винилацетат (ЭВА). Результаты изучения освобождения "in vitro" ацетата нормегестрола.
Имплантаты получают путем измельчения и промывания ЭВА, затем сушки и перемешивания с ацетатом нормегестрола в пропорциях 165 мг ЭВА на 35 мг активного ингредиента (т.е. 3 части ЭВА на одну часть ацетата нормегестрола). Смесь после гомогенизации отливают, экструдируют и прессуют при температурах в диапазоне от 50 до 65oC, получая цилиндрический экструдат с диаметром 2,3 мм.
Этот экструдат разрезают на кусочки 40 мм, чтобы получить имплантат требуемой длины. Этот имплантат имеет вес, близкий к 220 мг ± 10 кг, и содержит 55 мг ацетата нормегестрола (± 5 мг).
Эта матрица готова, чтобы быть покрытой пористой мембраной для того, чтобы скорость освобождения могла быть контролируемой (ПДМС или ЭВА).
Изучение матричного освобождения.
Каждый имплантат помещают в 20-мл контейнер, содержащий некоторое количество деионизованной водой (на 24 ч).
Эта среду заменяют каждые 24 ч, и эксперимент продолжают в зависимости от испытаний от 15 до 31 дней. Содержание ацетата нормегестрола в среде определяют спектрофотометрически при 296 нм.
Результаты выражают в мкг активного ингредиента, освобождаемого за 24 ч. Эти результаты суммированы на фиг. 4 в сравнении с имплантатом на основе ЭВА-сополимера. Они демонстрируют регулярность освобождения активного ингредиента после инкапсулирования пористой мембраной и в то же самое время более низкое освобождение ацетата нормегестрола как функции времени.
Пример 5. Получение имплантатов матричного типа на основе сополимера этилен/винилацетат, помещенного в трубке полидиметилсилоксана.
Матрицу получают в соответствии с примером 2 и вводят в трубку из полидиметилсилоксана Медицинского сорта (Silastic), закрытую с обоих концов Silastic стерильным клеем типа A, Медицинский адгезивный силикон.
Конечный имплантат имеет диаметр 3 мм и содержится в матрице цилиндрической формы из этиленвинилацетатного сополимера, имеющей диаметр около 2,3 мм и 40 мм длины. Общая длина составляет 42 мм после закрытия клеем c обоих концов.
Изучение освобождения проводят согласно способу эксплуатации способу дозировки, описанному в примере 3.
Результаты выражены в мкг ацетата нормегестрола, освобождаемого за 24 ч. Эти результаты представлены на фиг. 5 в сравнении с результатами, полученными в матрице на основе только ЭВА.
Реферат
Изобретение относится к области терапевтической химии, а именно к композициям, приспособленным для локального введения, а также к формам, предназначаемым для помещения в подкожные ткани. Данные имплантаты включают эффективную дозу производного 3,20-диоксо 6-метил 17-ацетокси 19-норпрегна 4,6-диена, произвольно замещенного в 3 и/или 17 положении, связанного или смешанного с биологически приемлeмым инертным носителем. Они являются эффективными и контрацептивными средствами, имеющими продолжительное активное действие по крайней мере в течение одного года, с минимальными побочными эффектами. 3 с. и 13 з.п. ф-лы, 3 табл., 5 ил.

Формула

где R1 - водород или ацильная часть алифатической, ароматической или циклановой органической карбоновой кислоты с содержанием углеродных атомов от 2 до 16,
или 3-OR2-6-метил 20-оксо 17a-OR119-норпрегна 4,6-диенов, выбранных из группы соединений формулы II
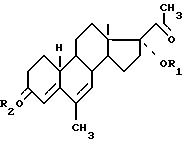
где R1 соответствует R1 в формуле I,
R2 - водород или ацильная часть карбоновой кислоты, или алкильный радикалссодержаниемуглеродныхатомовот1до8,или3-R3 ,R46-метил-17a-OR120-оксо-19-норпрегна 4,6-диенов, выбранных из группы соединений формулы III

где R1 соответствует R1 в формуле I,
R3 и R4 вместе образуют оксиимидогруппу =N-OR5, где R5 - водород, или низший алкил, или карбоксиалкильная группа, или алкилендиокси группа, которая при необходимости может быть замещена, или каждый из замещенных R3 и R4 - низший алкоксирадикал,
в смеси или в связи с физиологически приемлемым разбавителем в физиологически совместимом носителе, причем количество активного компонента составляет от 35 до 80 мг на подкожный имплантат.

Комментарии