Композиции и способы модулирования экспрессии фактора комплемента в - RU2016147047A
Код документа: RU2016147047A
Формула
1. Соединение, содержащее модифицированный олигонуклеотид и группу конъюгата, причем модифицированный олигонуклеотид состоит из 10-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 440, 198, 228, 237, 444, 448, 450, 453, 455, 549, 598, 6-197, 199-227, 229-236, 238-439, 441-443, 445-447, 449, 451, 452, 454, 456-548, 550-597 или 599-808, и где группа конъюгата включает:
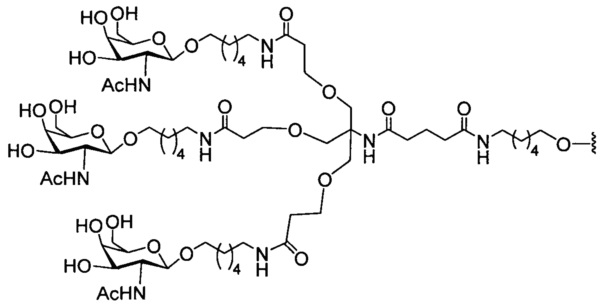
2. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из 10-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую:
a) по меньшей мере 9 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 6-808;
b) по меньшей мере 10 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 6-808;
c) по меньшей мере 11 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 6-808; или
d) по меньшей мере 12 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 6-808.
3. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из 10-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую последовательность азотистых оснований любой из SEQ ID NO: 6-808.
4. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из последовательности азотистых оснований любой из SEQ ID NO: 6-808.
5. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую часть из по меньшей мере 8 азотистых оснований любой из SEQ ID NO: 84, 238, 239, 317, 412, 413, 420, 421, 426, 434, 436, 437, 438, 439, 440, 442, 443, 444, 445, 446, 448, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 464, 465, 472, 473, 514, 515, 542, 543, 544, 545, 546, 551, 553, 555, 556, 599, 600, 601, 602, 610, 616, 617, 618, 662, 666, 670, 676, 677, 678, 688, 689, 713, 723, 729, 730, 740, 741, 742, 743, 744, 745, 746, 747, 748, 749, 755, 756, 768, 783, 793, 833 и 867.
6. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из 10-30 связанных нуклеозидов, имеющих последовательность азотистых оснований, содержащую любую из SEQ ID NO: 198, 228, 237, 440, 444, 448, 450, 453, 455, 549 и 598, причем модифицированный олигонуклеотид содержит:
сегмент гэп, состоящий из связанных дезоксинуклеозидов;
сегмент 5'-крыла, состоящий из связанных нуклеозидов; и
сегмент 3'-крыла, состоящий из связанных нуклеозидов;
при этом сегмент гэп расположен между сегментом 5'-крыла и сегментом 3'-крыла и, при этом каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
7. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов, имеющих последовательность азотистых оснований, состоящую из последовательности, указанной в SEQ ID NO: 198, 228, 237, 440, 444, 448, 450, 453 или 455, причем модифицированный олигонуклеотид содержит:
сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов;
сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; и
сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов;
при этом каждый сегмент гэп расположен между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтильный сахар; где каждая межнуклеозидная связь представляет собой тиофосфатную связь, и где каждый цитозин представляет собой 5-метилцитозин.
8. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, имеющих последовательность азотистых оснований, состоящую из последовательности, указанной в SEQ ID NO: 598, причем модифицированный олигонуклеотид содержит:
сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов;
сегмент 5'-крыла, состоящий из трех связанных нуклеозидов; и
сегмент 3'-крыла, состоящий из трех связанных нуклеозидов;
при этом сегмент гэп расположен между сегментом 5'-крыла и сегментом 3'-крыла; где сегмент 5'-крыла содержит 2'-O-метоксиэтильный сахар, 2'-O-метоксиэтильный сахар и cEt сахар в направлении от 5' к 3'; где сегмент 3'-крыла содержит cEt сахар, cEt сахар и 2'-О-метоксиэтильный сахар в направлении от 5' к 3'; где каждая межнуклеозидная связь представляет собой тиофосфатную связь; и где каждый цитозин представляет собой 5-метилцитозин.
9. Соединение по п. 1, отличающееся тем, что модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов, имеющих последовательность азотистых оснований, состоящую из последовательности, указанной в SEQ ID NO: 549, причем модифицированный олигонуклеотид содержит:
сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов;
сегмент 5'-крыла, состоящий из трех связанных нуклеозидов; и
сегмент 3'-крыла, состоящий из трех связанных нуклеозидов;
при этом сегмент гэп расположен между сегментом 5'-крыла и сегментом 3'-крыла; причем каждый нуклеозид каждого сегмента крыла содержит cEt сахар; где каждая межнуклеозидная связь представляет собой тиофосфатную связь; и где каждый цитозин представляет собой 5-метилцитозин.
10. Соединение по любому из пп. 1-9, отличающееся тем, что олигонуклеотид по меньшей мере на 80%, 85%, 90%, 95% или 100% комплементарен SEQ ID NO: 1 или 2.
11. Соединение по любому из пп. 1-10, отличающееся тем, что модифицированный олигонуклеотид содержит по меньшей мере одну модифицированную межнуклеозидную связь, по меньшей мере один модифицированный сахар или по меньшей мере одно модифицированное азотистое основание.
12. Соединение по п. 11, отличающееся тем, что модифицированная межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь.
13. Соединение по п. 12, отличающееся тем, что модифицированный олигонуклеотид содержит:
a) по меньшей мере 1 фосфодиэфирную межнуклеозидную связь;
b) по меньшей мере 2 фосфодиэфирные межнуклеозидные связи;
c) по меньшей мере 3 фосфодиэфирные межнуклеозидные связи;
d) по меньшей мере 4 фосфодиэфирные межнуклеозидные связи;
e) по меньшей мере 5 фосфодиэфирных межнуклеозидных связей;
f) по меньшей мере 6 фосфодиэфирных межнуклеозидных связей; или
g) по меньшей мере 7 фосфодиэфирных межнуклеозидных связей.
14. Соединение по п. 13, отличающееся тем, что каждая межнуклеозидная связь модифицированного олигонуклеотида выбрана из фосфодиэфирной межнуклеозидной связи и тиофосфатной межнуклеозидной связи.
15. Соединение по п. 12, отличающееся тем, что каждая межнуклеозидная связь модифицированного олигонуклеотида содержит тиофосфатную межнуклеозидную связь.
16. Соединение по любому из пп. 11-15, отличающееся тем, что модифицированный сахар представляет собой:
a) бициклический сахар, при этом необязательно бициклический сахар выбран из группы, состоящей из: 4'-(СН2)-O-2' (LNA); 4'-(СН2)2-O-2' (ENA) и 4'-СН(СН3)-O-2' (cEt); или
b) модифицированный сахар, который представляет собой 2'-O-метоксиэтил.
17. Соединение по любому из пп. 11-16, отличающееся тем, что модифицированное азотистое основание представляет собой 5-метилцитозин.
18. Соединение по любому из пп. 1-17, отличающееся тем, что модифицированный олигонуклеотид содержит:
(a) сегмент гэп, состоящий из связанных дезоксинуклеозидов;
(b) сегмент 5'-крыла, состоящий из связанных нуклеозидов; и
(c) сегмент 3'-крыла, состоящий из связанных нуклеозидов;
при этом сегмент гэп расположен непосредственно рядом и между сегментом 5' крыла и сегментом 3' крыла, и при этом каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
19. Соединение по любому из пп. 1-18, отличающееся тем, что соединение является:
a) одноцепочечным; или
b) двухцепочечным.
20. Соединение по любому из пп. 1-19, отличающееся тем, что соединение содержит:
a) рибонуклеотиды; или
b) дезоксирибонуклеотиды.
21. Соединение по любому из пп. 1-20, отличающееся тем, что модифицированный олигонуклеотид:
a) состоит из 15-20 связанных нуклеозидов;
b) состоит из 12-30 связанных нуклеозидов; или
c) состоит из 15-30 связанных нуклеозидов.
22. Соединение по любому из пп. 1-21, отличающееся тем, что группа конъюгата связана с модифицированным олигонуклеотидом:
a) на 5' конце модифицированного олигонуклеотида; или
b) на 3' конце модифицированного олигонуклеотида.
23. Соединение, характеризующееся формулой:
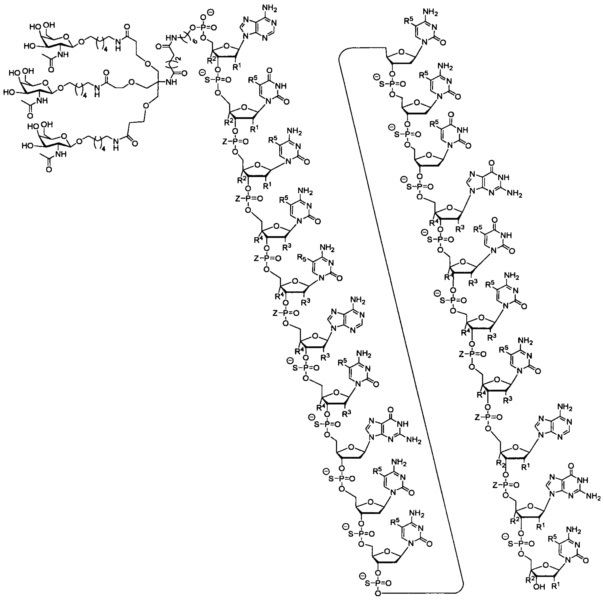
где любой R1 представляет собой -ОСН2СН2ОСН3 (МОЕ), и R2 представляет собой Н; или R1 и R2 вместе образуют мостик, где R1 представляет собой -О- и R2 представляет собой -СН2-, -СН(СН3)- или -СН2СН2-, и R1 и R2 напрямую связаны так, что полученный мостик выбран из: -O-CH2-, -О-СН(СН3)- и -О-CH2CH2-;
и для каждой пары R3 и R4 в одном кольце, независимо для каждого кольца: каждый R3 выбран из Н и -ОСН2СН2ОСН3 и R4 представляет собой Н; или R3 и R4 вместе образуют мостик, где R3 представляет собой -О-, и R4 представляет собой -СН2-, -СН(СН3)- или -СН2СН2-, и R3 и R4 напрямую соединены так, что полученный мостик выбран из: -О-СН2-, -О-СН(СН3)- и -О-СН2СН2-;
и R5 выбран из Н и -СН3;
и Z выбран из S- и О-.
24. Соединение, характеризующееся формулой:
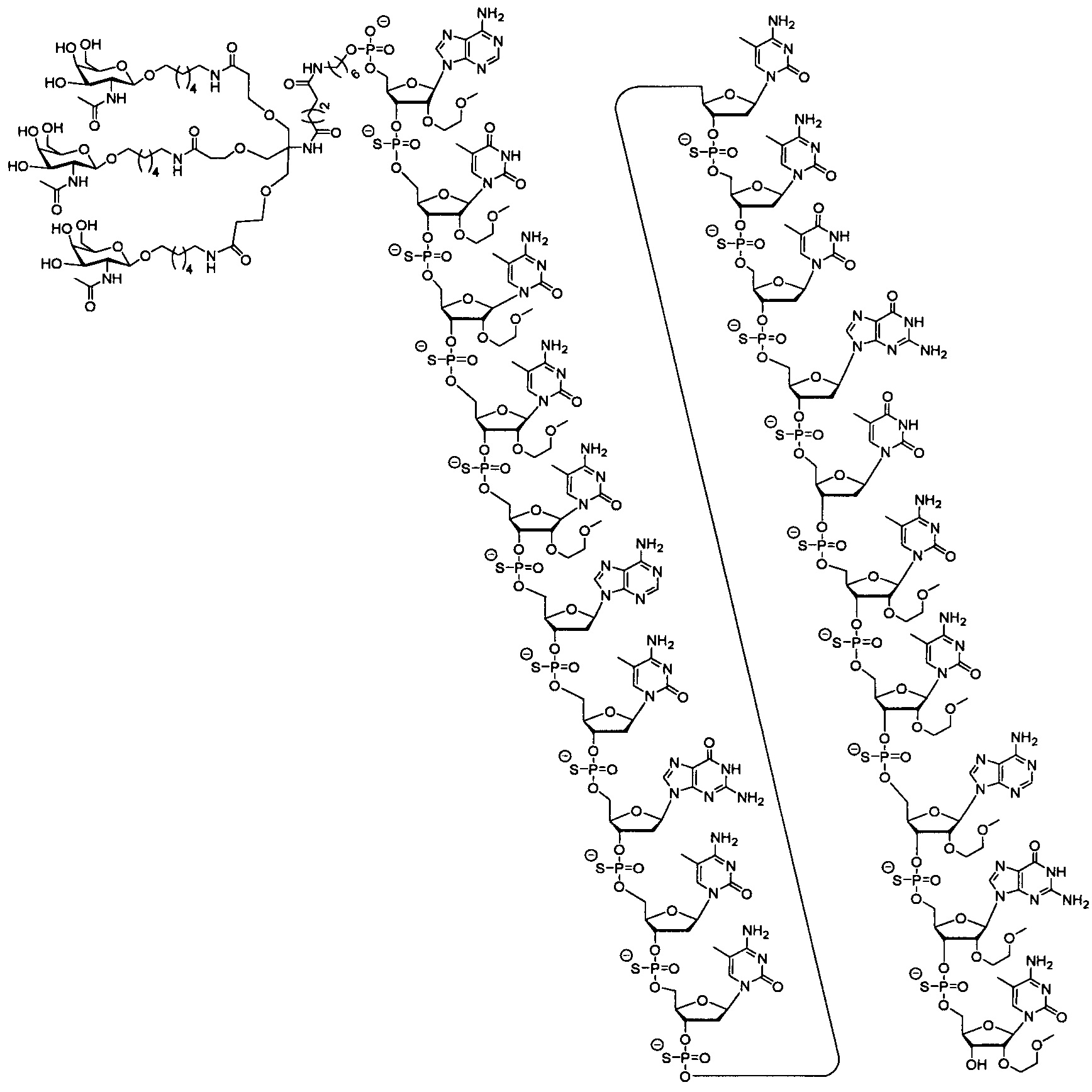
25. Соединение, характеризующееся формулой:
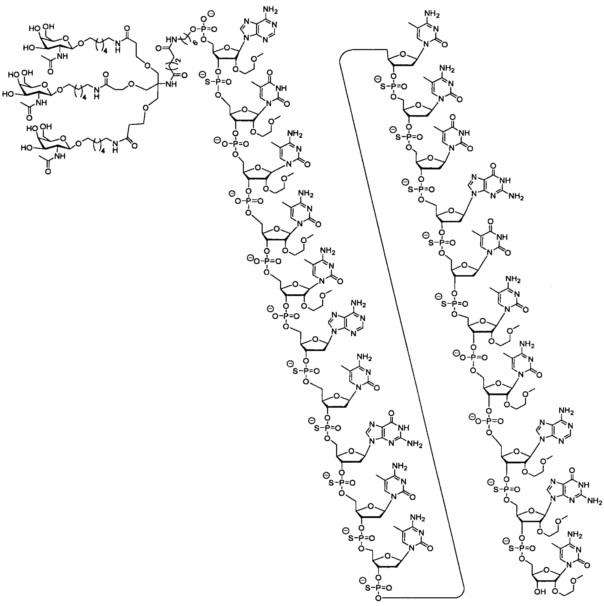
26. Соединение, характеризующееся формулой:
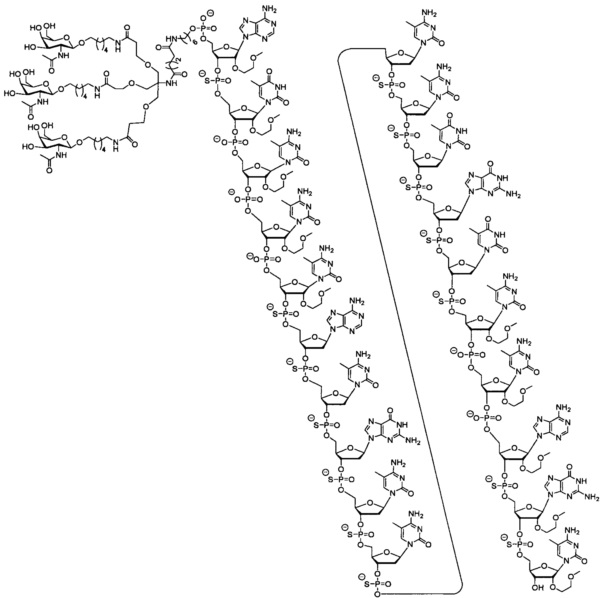
27. Соединение, характеризующееся формулой:
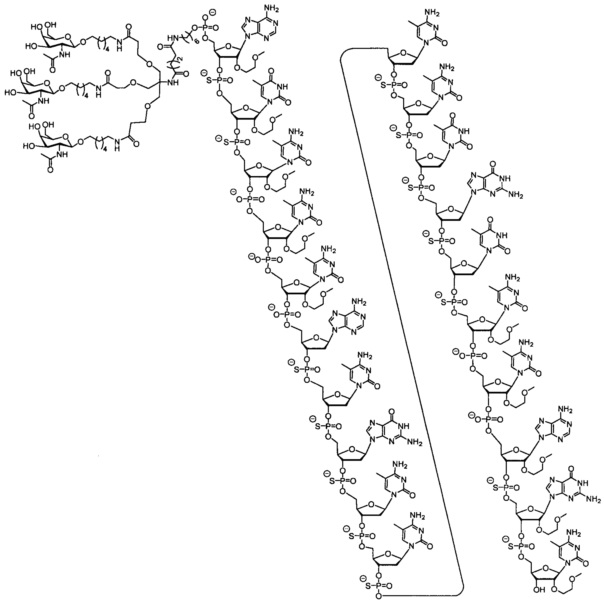
28. Композиция, содержащая соединение по любому из пп. 1-27 или его соль и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
29. Способ лечения, предупреждения или облегчения заболевания, связанного с дисрегуляцией альтернативного пути комплемента у субъекта, причем способ предусматривает введение субъекту соединения по любому из пп. 1-27 или композиции по п. 28, тем самым обеспечивая лечение, предупреждение или облегчение заболевания.
30. Способ по п. 29, отличающийся тем, что заболевание представляет собой дегенерацию желтого пятна, возрастную дегенерацию желтого пятна (AMD), влажную AMD, сухую AMD или географическую атрофию.
31. Способ по п. 29, отличающийся тем, что заболевание представляет собой болезнь почек.
32. Способ по п. 31, отличающийся тем, что болезнь почек представляет собой волчаночный нефрит, системную красную волчанку (SLE), болезнь плотного осадка (DDD), С3 гломерулонефрит (C3GN), CFHR5 нефропатию или атипичный гемолитико-уремический синдром (aHUS).
33. Применение соединения по любому из пп. 1-27 или композиции по п. 28 для лечения, предупреждения или облегчения заболевания, связанного с дисрегуляцией альтернативного пути комплемента.
34. Применение по п. 33, отличающееся тем, что заболевание представляет собой дегенерацию желтого пятна, возрастную дегенерацию желтого пятна (AMD), влажную AMD, сухую AMD или географическую атрофию.
35. Применение по п. 33, отличающееся тем, что заболевание представляет собой болезнь почек.
36. Применение по п. 35, отличающееся тем, что болезнь почек представляет собой волчаночный нефрит, болезнь плотного осадка (DDD), С3 гломерулонефрит (C3GN), CFHR5 нефропатию или атипический гемолитико-уремический синдром (aHUS).
37. Соединение по любому из пп. 1-27 или композиция по п. 28 для применения при способе лечения, предупреждения или облегчения заболевания, связанного с дисрегуляцией альтернативного пути комплемента.
38. Соединение или композиция для применения по п. 37, отличающиеся тем, что заболевание представляет собой дегенерацию желтого пятна, возрастную дегенерацию желтого пятна (AMD), влажную AMD, сухую AMD или географическую атрофию.
39. Соединение или композиция для применения по п. 37, отличающиеся тем, что заболевание представляет собой болезнь почек.
40. Соединение или композиция для применения по п. 39, отличающиеся тем, что болезнь почек представляет собой волчаночный нефрит, болезнь плотного осадка (DDD), С3 гломерулонефрит (C3GN), CFHR5 нефропатию или атипический гемолитико-уремический синдром (aHUS).
41. Применение соединения по любому из пп. 1-27 или композиции по п. 28 при изготовлении лекарственного средства для лечения, предупреждения или облегчения заболевания, связанного с дисрегуляцией альтернативного пути комплемента.
42. Применение соединения или композиции при изготовлении лекарственного средства по п. 41, отличающееся тем, что заболевание представляет собой дегенерацию желтого пятна, возрастную дегенерацию желтого пятна (AMD), влажную AMD, сухую AMD или географическую атрофию.
43. Применение соединения или композиции при изготовлении лекарственного средства по п. 41, отличающееся тем, что заболевание представляет собой болезнь почек.
44. Применение соединения или композиции при изготовлении лекарственного средства по п. 43, отличающееся тем, что болезнь почек представляет собой волчаночный нефрит, болезнь плотного осадка (DDD), С3 гломерулонефрит (C3GN), CFHR5 нефропатию или атипический гемолитико-уремический синдром (aHUS).
