Гибридный олигонуклеотид, содержащий фосфоротиоатную и/или фосфородитиоатную связи, терапевтическая фармацевтическая композиция, способ ингибирования генной экспрессии - RU2115658C1
Код документа: RU2115658C1
Чертежи




Описание
Изобретение относится к синтетическим олигонуклеотидам, которые полезны в исследованиях генной экспрессии, и возможности использования антисмысловых олигонуклеотидов в терапевтических целях. Более конкретно, изобретение относится к синтетическим олигонуклеотидам, которые обладают улучшенными качествами для таких применений, являющимися результатом модификаций сахарофосфатного остова олигонуклеидов.
Возможность разработки терапевтического применения антисмысловых олигонуклеотидов была впервые предложена в трех статьях, опубликованных в 1977 и 1978 г, Paterson и др. Proc. Natl. Acad. Sci. США 74: 4370-4374 (1987) раскрывает, что трансляция мРНК в бесклеточной системе может быть ингибирована связыванием олигонуклеотида, комплементарного мРНК. Zamecnik и Stephenson, Proc. Natl. Acad. Sci. США 75: 280-284 и 285-288 (1978) раскрывает, что 13-мерный синтетический олигонуклеотид, который является комплементарным части генома вируса саркомы Рауса (RSV), ингибирует репликацию RSV в инфицированных фибробластах цыплят и ингибирует RSV - опосредованную трансформацию первичных фибробластов цыплят в злокачественные клетки саркомы.
Эти ранние указания того, что синтетические олигонуклеотиды можно использовать для ингибирования размножения вируса и неоплазии, сопровождались использованием синтетических олигонуклеотидов в ингибировании многих вирусов. Goodchild и др., патент США N 4806463 раскрывает ингибирование вируса иммунодефицита человека (ВИЧ) синтетическими олигодезоксинуклеотидами, комплементарными разным областям генома ВИЧ. Leiter и др. Proc. Natl. Acad. Sci США 87; 3430-3434 (1990) раскрывает торможение вируса гриппа синтетическими олигонуклеотидами. Agris и др. Biochemistry 25: 6268-6275 (1986) раскрывает использование синтетических олигонуклеотидов в торможении вируса везикулярного стоматита (VSV). GaO и др. Antimicrob. Agents Chem. 34: 808-812 (1990) раскрывает торможение вируса простого герпеса синтетическими олигонуклеотидами. Birg и др. Nucleic Acids Res. 18: 2901-2908 (1990) раскрывает торможение вируса обезьян (SV40) синтетическими олигонуклеотидами. Storey и др. Nucleic Acids Res. 19: 4109-4114 (1991) раскрывает торможение вируса папилломы человека (HPV) синтетическими олигонуклеотидами. Применение синтетических олигонуклеотидов и их аналогов в качестве противовирусных агентов недавно было подробно описано Agrawal, Tibtech 10: 152-158 (1992).
Кроме того, синтетические олигонуклеотиды использовались для торможения множества невирусных патогенов, а также селективного торможения экспрессии некоторых клеточных генов.
Таким образом, полезность синтетических олигонуклеотидов как агентов в торможении размножения вирусов, размножения невирусных патогенов и селективной экспрессии клеточных генов конкретно установлена. Однако существует необходимость в улучшенных олигонуклеотидах, которые обладали бы большей эффективностью в торможении таких вирусов, патогенов и селективной экспрессии генов. Исследователи делали попытки получить и тестировать олигонуклеотиды с модификациями в их межнуклеотидных связях. Некоторые исследователи показали, что такие модифицированные олигонуклеотиды были эффективны, чем их немодифицированные аналоги. Sarin и др., Proc. Natl. Acad. Sci. США 85: 7448-7451 (1988) указывает, что метилфосфонаты олигодеоксинуклеозида более активны как ингибиторы ВИЧ-1, нежели обычные олигодеоксинуклеотиды. Agrawal и др., Proc. Natl. Acad. Sci. США 85: 7079-7083 (1988) утверждает, что фосфоротиоаты олигонуклеотидов и различные фосфорамидаты олигонуклеотидов более эффективны в торможении ВИЧ-1, чем обычные олигодезоксинуклеотиды. Agrawal и др. Proc. Natl. Acad. Sci. США 86: 7790-7794 (1989) раскрывает преимущество фосфоротиоатов олигонуклеотидов в торможении ВИЧ-1 в ранних и хронически инфицированных клетках.
Кроме того, были получены химерные олигонуклеотиды, имеющие более одного типа межнуклеотидной связи внутри олигонуклеотида. Химерные олигонуклеотиды содержат только деоксирибонуклеозиды, но имеют области, содержащие различные межнуклеотидные связи. Pederson и др. (патент США N 5XXXXXX /Сер. N 07/480269, выданный 12.24.91) раскрывает химерные олигонуклеотиды, имеющие сердцевинный олигонуклеотид с фосфодиэфирной или фосфоротиоатной связями, фланкированный фосфорамидатами, метилфосфонатами или фосфорамидатами олигонуклеотидов Furdon и др. Nucleic Acids Res. 17: 9193-9204 (1989) раскрывает химерные олигонуклеотиды, имеющие области фосфодиэфироволигонуклеотида в дополнение к другим областям фосфоротиоата или метилфосфоната олигонуклеотида. Quartin и др. Nucleic Acids Res. 17: 7523-7562 (1989) раскрывает химерные олигонуклеотиды, имеющие области фосфодиэфиров олигонуклеотида и метидфосфонатов олигонуклеотида. Каждое из вышеупомянутых соединений использует фосфоротиоаты деоксирибонуклеотида, которые снижают стабильность дуплекса. Atabekov и др. FEBS Letters 232: 9698 (1988) раскрывает химерные олигонуклеотиды, в которых все межнуклеотидные связи являются фосфодиэфирными связями, но в которых области олигорибонуклеотидов и олигодезоксирибонуклеотидов смешаны. Inoune и др. FEBS Letters 215: 237-250 (1967) раскрывает химерные олигонуклеотиды, имеющие только фосфодиэфирные связи, и области олигодезоксирибонуклеотидов и 2'-OMe-рибонуклеотидов. Ни одно из этих соединений, имеющих только фосфодиэфирные связи, не демонстрируют устойчивости ни к эндонуклеазе, ни к экзонуклеазе.
Многие из этих модифицированных олигонуклеотидов улучшили потенциальную эффективность терапевтического аспекта антисмыслового олигонуклеотида. Однако в известных олигонуклеотидах имеются определенные недостатки и эти недостатки могут ограничивать эффективность таких олигонуклеотидов как терапевтических агентов. Wickstrom, J. Biochem. Biophys. Methods 13: 97-0102 (1986) указывает, что олигонуклеиды с фосфодиэфирными связями восприимчивы к действию нуклеазы. Такая восприимчивость к нуклеазе может ограничить биопригодность олигонуклеидов ин виво. Agrawal и др. Proc. Natl. Acad. Sci. США 87: 1401-1405 (1990) указывает, что фосфорамидаты или метилфосфонаты олигонуклеотида при гибридизации с РНК не активируют РНКазу H, активация которой может быть важной для функции антисмысловых олигонуклеотидов. Agrawal и др. Nucleosides и Nucleotides 8: 5-6 (1989) утверждает, что фосфоротиоаты олигодезоксирибонуклеотида снижают стабильность дуплекса при гибридизации с РНК.
Следовательно существует потребность в улучшенных олигонуклеотидах, которые будут свободны от недостатков? известных в данной области техники. В идеале такие олигонуклеотиды должны быть устойчивы к нуклеолитическому распаду, должны образовывать стабильные дуплексы с РНК, и должны активировать РНКазу H при гибридизации с РНК.
Изобретение предлагает гибридные олигонуклеотиды, которые устойчивы к нуклеолитическому расщеплению, образуют стабильные дуплексы с РНК или ДНК, и активируют РНКазу H при гибридизации с РНК. Олигонуклеотидам в соответствии с изобретением такие характерные признаки прида.т наличие фосфоротиоатных или/и фосфородитиоатных межнуклеотидных связей и сегментов из олигодезоксирибонуклеотидов, а также сегментов из других олигорибонуклеотидов или 2'-замещенных-олигорибонуклеотидов. Для целей изобретения термин "2'-замещенный" означает замещение 2'-ОН молекулы рибозы, например, 2'-OMe, 2'-аллилом, 2'-арилом, 2'-алкилом, 2'-гало, или 2'-амино, но не 2'-H, в которых аллильные, арильные или алкильные группы могут быть незамещенными или замещенными, например, гало-, гидрокси-, трифторметилом-, циано-, нитро-, ацильной, ацилокси-, алкокси-, карбоксильной, карболкоксильной или аминогруппами.
Целью изобретения является получение олигонуклеотидов, которые можно использовать для анализа и объяснения важности эффективности параметров устойчивости к нуклеазе, стабильности дуплекса и активации РНКазы H в дантисмысловых олигонуклеотидах.
Другой целью изобретения является получение олигонуклеотидов, которые эффективны в регулировании клеточной, патогенной или вирусной генной экспрессии на уровне мРНК.
И еще одна цель изобретения - получение терапевтических олигонуклеотидов, которые обладают большей эффективностью.
Олигонуклеотиды по изобретению удовлетворяют всем поставленным целям и задачам изобретения.
На фиг. 1 показан ионообменный анализ ЖХВР олигонуклеотидов, обработанных нуклеазой. На панели A представлены профили A, B и C олигонуклеотидов F, C и A, соответственно после расщепления SVPD в течение 420 мин.
На фиг. 2 (панель B) профиль A представляет собой нерасщепленный олигонуклеотид с фосфодиэфирными связями профиль B - того же олигонуклеотида после 1-минутного расщепления SVPD.
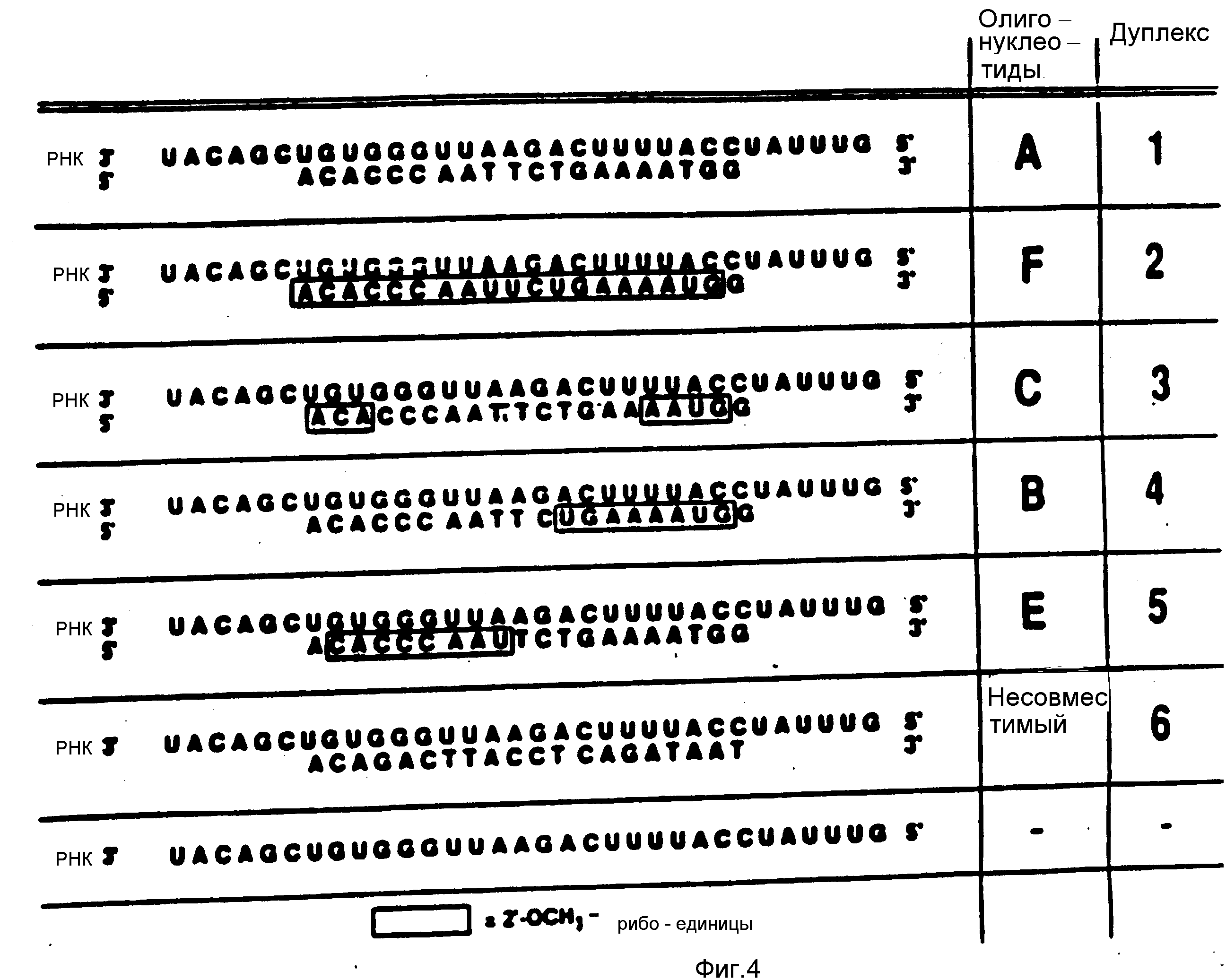
На фиг. 3 и 4 представлены результаты исследований активации РНКазы H для олигонуклеотидов, как описано в примере 4.
В первом аспекте изобретение предусматривает олигонуклеотиды, которые нужны для изучения параметров, важных для эффективного действия антисмысловых олигонуклеотидов. Для целей изобретения термин олигонуклеотид включает полимеры из двух или нескольких рибонуклеотидов, дезоксирибонуклеотидов или тех и других с мономерами рибонуклеотида и/или деоксирибонуклеотида, соединенными через 5' - 3' связи, которые могут включать любые из связей, известных для антисмысловых олигонуклеотидов. Кроме того, термин олигонуклеотиды включает такие молекулы, которые имеют модифицированные основания нуклеиновой кислоты и/или сахара, а также молекулы с дополнительными заместителями, такими, как диамины, холестерил или другие липофильные группы. Некоторые предпочтительные комбинации мономеров и межмономерных связей подробно обсуждаются ниже.
Обычно считается, что активность антисмыслового олигонуклеотида зависит от связывания олигонуклеотида с целевой нуклеиновой кислотой, что нарушает функцию мишени либо остановкой гибридизации, либо разрушением целевой РНК РНКазой H. Эти механизмы действия предполагают, что для активности антисмыслового олигонуклеотида должны быть важны два параметра: стабильность дуплекса и активация РНКазы H. Стабильность дуплекса важна, поскольку предполагается, что олигонуклеотид должен образовать дуплекс (или триплекс в механизме хугстиновского спаривания) с целевой нуклеиновой кислотой, который направлен либо на остановку гибридизации, либо на разрушение мишени посредством РНКазы H. Активация РНКазы H (способность активировать РНКазу H при гибридизации с целевой РНК) имеет место, когда мишенью-нуклеиновой кислотой является РНК, и эта активация может повлечь эффективное разрушение молекулы мишени РНК. Кроме того, для того, чтобы антисмысловой олигонуклеотид действовал ин виво, он должен достаточно долго сохраняться, чтобы взаимодействовать с целевой нуклеиновой кислотой. Учитывая факт, что в среде ин виво сохраняется активность эндонуклеазы и экзонуклеазы, отсюда возникает третий параметр: а именно то, что антисмысловой олигонуклеотид должен быть устойчивым к нуклеолитическому расщеплению.
Чтобы проанализировать и объяснить важность каждого из этих параметров для эффективности антисмысловых олигонуклеотидов, нужно иметь олигонуклеотиды, которые меняются в каждом из этих параметров. Свойства нескольких известных олигонуклеотидов показаны в табл. 1.
1. Стабильность дуплекса олигонуклеотида к комплементарному олигорибонуклеотиду в физиологических условиях в сравнении с ДНК-РНК стабильностью.
2. Сравнение с ДНК (переваривание фосфодиэестеразой).
3. Активация РНКазы дуплексом, образованным между олигонуклеотидом и РНК.
Гибридные олигонуклеотиды по изобретению образуют более стабильные дуплексы с комплементарной РНК, чем фосфоротиоаты олигодезоксирибонуклеотида. Кроме того, они более устойчивы к эндонуклеазному и экзонуклеазному расщеплению, чем фосфоротиоаты олигодезоксирибонуклеотида, и они нормально активируют РНКазу H. Следовательно, олигонуклеотиды по изобретению дополняют олигонуклеотиды, показанные в табл.1 по параметрам, участвующим в эффективности антисмысловых олигонуклеотидов.
Что касается первого аспекта изобретения, олигонуклеотиды по изобретению могут иметь любую последовательность олигонуклеотида, так как комплементарные олигонуклеотиды, используемые в этом исследовании, можно получить с любой последовательностью олигонуклеотида. Олигонуклеотиды в соответствии с этим аспектом изобретения характеризуются только следующими характерными признаками. Первый, по меньшей мере некоторые из межнуклеотидных связей, присутствующих в олигонуклеотидах по изобретению, представляют собой фосфоротиоатные и/или фосфородитиоатные связи. В различных вариантах число межнуклеотидных связей фосфоротиоата и/или фосфородитиоата может колебаться от 1 до той цифры межнуклеотидных связей, которые присутствуют в олигонуклеотиде. Таким образом, для целей изобретения термин фосфоротиоат и/или фосфородитиоат охватывает любой такой вариант. В предпочтительном варианте число нуклеотидов по изобретению будет колебаться от около 2 до около 50 нуклеотидов, и более предпочтительно от около 6 до около 50 нуклеотидов. Таким образом, в этом предпочтительном варианте олигонуклеотиды по изобретению будут иметь от около 1 до 49 межнуклеотидных из фосфоротиоатных и/или фосфородитиоатных связей.
Второй чертой олигонуклеотидов по этому аспекту изобретения является наличие дезоксирибонуклеозидов. Олигонуклеотиды по изобретению содержат по меньшей мере один дезоксирибонуклеозид. Предпочтительно олигонуклеотиды по изобретению содержат четыре или больше дезоксирибонуклеозидов в смежном блоке, с тем, чтобы обеспечить активирующий сегмент для РНКазы H. В некоторых предпочтительных вариантах такой активирующий сегмент может быть не один, а несколько. Такие сегменты могут присутствовать в любом месте внутри олигонуклеотида. В олигонуклеотидах большинство может составлять дезоксирибонуклеозиды. В действительности нуклеозидами могут быть все, кроме одного, нуклеозида, который является дезоксирибонуклеозидом. Итак, в предпочтительном варианте при количестве от 2 до 50 нуклеозидов или лучше от 6 до 50 нуклеозидов, число присутствующих дезоксирибонуклеозидов будет составлять от 1 до около 49 деоксирибонуклеозидов.
Третьей характерной чертой олигонуклеотидов по этому аспекту изобретения является наличие рибонуклеозидов, 2'-замещенных рибонуклеозидов или их комбинаций. Для целей изобретения термин "2'-замещенный" означает замещение 2' - OH в молекуле рибозы, например, 2' - OMe, 2'- аллилом, 2'- арилом, 2' - алкилом, 2' - гало или 2' - амино, но не 2' - H, где аллильные, арильные или алкильные группы могут быть незамещенными или замещенными, например, гало-, гидрокси-, трифторметил-, циано-, нитро-, ацил-, ацилокси-, карбоксил-, карбалкоксил-, или аминогруппами. Олигонуклеотиды по изобретению содержат по меньшей мере один рибонуклеозид и/или 2'-замещенный рибонуклеозид. В предпочтительном варианте такие олигонуклеотиды имеют 6 или больше рибонуклеозидов и/или 2'-замещенных рибонуклеозидов для усиления стабильности дуплекса. Такие рибонуклеозиды и/или 2'-замещенные рибонуклеозиды могут присутствовать как единицы, парами или большими смежными сегментами, и могут находиться в любой позиции внутри олигонуклеотида или во множественных позициях внутри олигонуклеотида. Такими рибонуклеозидами и/или 2'-замещенными рибонуклеозидами могут быть все, кроме одного нуклеозида внутри олигонуклеозидов. Таким образом, в предпочтительном варианте с числом от 2 до 50 нуклеозидов, количество рибонуклеозидов или 2'-замещенных рибонуклеозидов будет колебаться от около 1 до около 49 деоксирибонуклеозидов.
Возможность изменять количества и позиции фосфоротиоатных и/или фосфородитиоатных межнуклеотидных сцеплений, деоксирибонуклеозидов и рибонуклеозидов или 2'-замещенных рибонуклеозидов позволяет исследователю подробно рассмотреть, как каждая из этих переменных влияет на параметры устойчивости к нуклеазе, стабильности дуплекса и активации РНКазы H. Способность менять размер олигонуклеотида позволяет рассмотреть еще один параметр. Кроме того, небольшие олиго (например, димеры) можно использовать как строительные блоки для более крупных олиго. Таким образом, каждый такой возможный вариант, описанный выше, полезен в таких исследованиях.
Во втором аспекте изобретение предусматривает гибридные олигонуклеотиды, которые эффективны в ингибировании вирусов, патогенных организмов или экспрессии клеточных генов. Способность ингибировать такие агенты очень важна для лечения ряда болезней. Олигонуклеотиды по этому аспекту изобретения разделяют характеристики вышеописанных олигонуклеотидов, за исключением того, что последовательность олигонуклеотидов по этому аспекту изобретения является комплементарной последовательности нуклеиновой кислоты вируса, патогенного организма или клеточного гена. Предпочтительно такие олигонуклеотиды по длине составляют от 6 до около 50 нуклеотидов. Для целей изобретения термин "последовательность олигонуклеотида, которая комплементарна последовательности нуклеиновой кислоты" означает последовательность олигонуклеотида (2 - около 50 нуклеотидов), которая гибридизируется с последовательностью нуклеиновой кислоты в физиологических условиях, например, спариванием оснований по Уотсону-Крику (взаимодействие между олигонуклеотидом и одноцепочечной нуклеиновой кислотой) или хугстиновским спариванием оснований (взаимодействие между олигонуклеотидом и двухцепочечной нуклеиновой кислотой) или другими способами. Такая гибридизация в физиологических условиях измеряется практически наблюдением интерференции с функцией последовательности нуклеиновой кислоты.
Последовательность нуклеиновой кислоты, к которой по изобретению олигонуклеотид является комплементарным, будет меняться в зависимости от агента, который тормозится.
Во многих случаях последовательность нуклеиновой кислоты будет последовательностью вирусной нуклеиновой кислоты. Использование антисмысловых олигонуклеотидов для торможения активности различных вирусов хорошо известно и недавно упоминалось в Agrawal, Tibteеh 10:152 - 158 (1992). Последовательности вирусной нуклеиновой кислоты, которые комплементарны эффективным антисмысловым олигонуклеотидам, описывались для многих вирусов, включая вирус иммунодефицита человека типа I (патент США N 4806463), вирус простого герпеса (патент США N 4689320), вирус гриппа (патент США N 5XXXXXX сер N 07/516275, выданный 30.06.92), вирус папилломы человека (Storey и др., Nucleic Acids Res. 19:4109 - 4114 (1991)). Последовательности, комплементарные любой из последовательностей нуклеиновой кислоты, можно использовать для олигонуклеотидов по изобретению, как и последовательности олигонуклеотида могут быть комплементарными последовательностями нуклеиновой кислоты из любого другого вируса. Дополнительные вирусы, которые имеют известные последовательности нуклеиновой кислоты, против которых можно получить антисмысловые олигонуклеотиды, включают вирус ящура (cм. Robertson и др., J. Virology 54:651 /1985/; Harris и др. J. Virology 36:659/1980/), вирус желтой лихорадки (cм. Rice и др. Science 229:726 /1985/), вирус ветряной оспы (c м. Davison и Scott, J. Gen. Virology 67:2279 /1986/), и вирус мозаики огурца (см. Richards и др., Virology 89:395 /1978/).
В другом варианте олигонуклеотиды по изобретению могут иметь олигонуклеотидную последовательность, комплементарную последовательность нуклеиновой кислоты патогенного организма. Были описаны последовательности нуклеиновой кислоты многих патогенных организмов, включая малярийный патоген, Plasmodium falciparum многих патогенных бактерий. Олигонуклеотидные последовательности, комплементарные последовательностям нуклеиновой кислоты из любого такого патогенного организма, можно использовать в олигонуклеотидах по изобретению. Примеры патогенных эукариотов, имеющих известные последовательности нуклеиновой кислоты, против которых можно получить антисмысловые олигонуклеотиды, включают Trypanosoma brucei gambience и Leishmania (см. Campbell и др., Nature 311: 350 /1984/), Fasciola hepatica см, Zurita и др. Proc. Natl. Acad. Sci. США 84: 2340 /1987/). Противогрибковые олигонуклеотиды могут быть приготовлены, используя гибридизующийся район, имеющий олигонуклеотидную последовательность, которая комплементарна нуклеотидной последовательности, например, гена хитинсинтетазы, и противобактериальные олигонуклеотиды можно получить, используя, например, ген аланинрацемазы.
Еще в одном варианте олигонуклеотиды по изобретению могут иметь олигонуклеотидную последовательность, комплементарную клеточному гену или транскрипту гена, аномальная экспрессия или продукт которого приводит к состоянию заболевания. Были описаны нуклеотидные последовательности нескольких таких клеточных генов, включая прион-белок (Stahl и Prosiner, FASEB J.5: 2799 - 2807 /1991/), амилоидподобный белок, связанный с болезнью Альцгеймера (патент США N 5015570), и различные хорошо известные онкогены и прото-онкогены, такие как c-myb, c-myc, c-abe и n-ras. Кроме того, олигонуклеотиды, которые тормозят синтез структурных белков или ферментов, исключительно или значительно вовлеченных в сперматогенез, подвижность спермы и связанные спермы с яйцеклеткой или любую другую стадию, влияющую на жизнеспособность спермы, можно использовать как контрацептивы для мужчин. Аналогичным образом контрацептивами для женщин могут быть олигонуклеотиды, которые тормозят белки или ферменты, вовлеченные в овуляцию, оплодотворение, имплантацию или в биосинтез гормонов, участвующих в этих процессах.
Гипертензию можно контролировать олигодезоксинуклеотидами, которые подавляют синтез фермента, преобразующего ангиотензин или родственные ферменты в системе ренин/ангиотензин; агрегацию тромбоцитов можно контролировать подавлением синтеза ферментов, необходимых для синтеза тромбоксана A2 для использования в миокардических и церебральных нарушениях кровообращения, при инфарктах, атеросклерозе, эмболии и тромбозе; отложения холестерина в артериальных стенках можно затормозить подавлением синтеза ко-фермента A: холестеролацилтрансферазы при артериосклерозе; торможение синтеза холинфосфотрансферазы может быть полезным в гиполипидемии.
Существует много нервных расстройств, для которых остановка гибридизации может использоваться для снижения или снятия вредных воздействий расстройств. Например, подавление синтеза моноаминоксидазы можно использовать в болезни Паркинсона; подавление катехол о-метилтрансферазы можно использовать в лечении депрессии; и подавление индол N-метилтрансферазы можно использовать в лечении шизофрении.
Подавление выбранных ферментов в каскаде активации арахидоновой кислоты, который ведет к простагландинам и лейкотриенам, может быть полезным в контроле агрегации тромбоцитов, аллергии, воспалений, боли и астмы.
Подавление белка, экспрессированного геном устойчивости ко многим лекарствам (mdr), который отвечает за развитие устойчивости к множеству противораковых лекарственных средств и является основным сдерживающим фактором в химиотерапии, может оказаться полезным в лечении рака. Последовательности олигонуклеотида, комплементарные нуклеотидным последовательностям любого из этих генов, можно использовать для олигонуклеотидов по изобретению, как и последовательности олигонуклеотида могут быть комплементарными любому другому клеточному гену или транскрипту гена, аномальная экспрессия или продукт которого приводит к состоянию болезни.
Антисмысловая регуляция экспрессии гена в клетках растений была описана в патенте США N 5107065.
В третьем аспекте изобретение предлагает терапевтические фармацевтические препараты олигонуклеотидов, которые эффективны в лечении вирусных инфекций, инфекций, вызванных патогенными организмами, или заболевания, являющегося результатом аномальной экспрессии гена или экспрессии продукта аномального гена. Такие фармацевтические терапевтические препараты включают олигонуклеотиды в соответствии со вторым аспектом изобретения в фармацевтически приемлемом носителе.
В четвертом аспекте изобретение предусматривает способ торможения экспрессии гена вируса, патогенного организма или клеточного гена, при этом способ включает этап задачи олигонуклеотидов к клеткам, зараженным вирусом или патогенным организмом в первых двух случаях, или к клеткам вообще в последнем случае. Такие методы полезны в изучении генной экспрессии и функции специфических генов.
В пятом аспекте изобретение предусматривает метод лечения больного человека или животного, болезнь которого является результатом заражения вирусом или патогенным организмом, или аномальной экспрессии или аномального продукта клеточного гена. Метод включает назначение терапевтических фармацевтических препаратов олигонуклеотидов в соответствии с изобретением заболевшему человеку или животному. Предпочтительно способы такого назначения будут включать оральное, внутриносовое, ректальное и местное назначения. В таких методах лечения по изобретению олигонуклеотиды могут назначаться вместе с другими терапевтическими агентами, например AZT в случае СПИДА.
Множество вирусных заболеваний можно лечить методом в соответствии с изобретением, включая СПИД, ARC, оральный или генитальный герпес, бородавки папилломы, грипп, ящур, желтую лихорадку, ветряную оспу, опоясывающий лишай, лейкемию, вызванную вирусом человеческого T-клеточного лейкоза и гепатит. Среди грибковых заболеваний, поддающихся лечению методом по изобретению, такие заболевания, как кандидоз, криптококкоз, гистоплазмоз, бластомикоз, аспергиллез, споротрихоз, хромомикоз, дерматофитоз и кокцидиоидоз. Метод может также использоваться для лечения заболеваний, вызванных риккетсиями (например, тифа, американского клещевого риккетсиоза), а также заболеваний, передающихся половым путем, вызванных Chlamydia trachomatis или Lymphogranuloma venereum. Многие паразитарные заболевания можно лечить способом по изобретению, включая амебиаз, болезнь Шагаса, токсоплазмоз, пневмоцистоз, лямблиоз, криптоспоридиоз, трихомоноз и пневмонию Pheumocystis carini, а также гельминтозы, такие как аскаридоз, филяриатоз, трихинеллез, шистосомоз и заражения нематодами и цестодами. Малярию можно лечить способом, который предлагает изобретение, независимо от того, вызывается ли она P. falciparum, P. vivax, P. orale или P. malarial.
Все инфекционные заболевания, указанные выше, можно лечить способом по изобретению, поскольку инфекционные агенты этих заболеваний известны и можно получить олигонуклеотиды в соответствии с изобретением с такой нуклеотидной последовательностью, которая комплементарна нуклеотидной последовательности, являющейся существенной для размножения инфекционного агента, такой как существенный ген.
Другие состояния болезни, которые лечатся способом по изобретению, являются результатом аномальной экспрессии или аномального продукта клеточного гена. Эти состояния можно лечить назначением олигонуклеотидов по изобретению и обсуждалось в этом раскрытии выше.
Олигонуклеотиды по изобретению можно синтезировать процедурами, которые хорошо известны в области техники. Другим предпочтительным способом синтеза таких олигонуклеотидов является способ, использующий подход H-фосфоната, описанный в патенте США N 5XXXXXX, Сер. N 07/334679, выданный 10.03.92, и в Agrawal и Tang, Tetrahedron Lett. 31: 7541-7544 (1990). Олигонуклеотиды по изобретению можно сделать еще более устойчивыми к нуклеолитическому расщеплению добавлением кэп-структур на 5' и/или 3' конца.
Следующие примеры далее иллюстрируют некоторые предпочтительные варианты изобретения и не являются ограничительными.
Пример 1. Синтез гибридных олигонуклеотидов с фосфоротионатными связями.
Гибридные олигонуклеотидфосфоротиоаты были синтезированы на CPG на 5-6 μ мольной шкале автоматизированного синтезатора/модель 8700, Millipore, Milford МА/ с использованием подхода H-фосфоната, описанного в патенте США N 5XXXXXX (Сер. N 07/344679, выдан 19.03.92 г), H-фосфонаты деоксинуклеозида были получены от Millipore 2' - OMe H-фосфонаты рибонуклеотида были синтезированы стандартными процедурами. Сегменты олигонуклеотидов, содержащих 2'-OMe нуклеозид, собирались с использованием H-фосфонатов 2'-OMe рибонуклеозида для нужных циклов. Аналогичным образом сегменты олигонуклеотидов, содержащих деоксирибонуклеозиды, собирались с использованием H-фосфонатов деоксинуклеозида для нужных циклов. После сборки связанный с CPC H-фосфонат олигонуклеотида окислялся серой, чтобы образовать фосфоротиоатную связь. Затем олигонуклеотиды подвергались снятию защиты в концентрированной H4OH при 40oC 48 ч.
Сырой олигонуклеотид (около A260 единиц) анализировался жидкостной хроматографией низкого давления с обращенной фазой на среде обращенной фазы C18. Группы ДМТ удалялись обработкой 80%-ной водной уксусной кислотой, затем олигонуклеотиды диализовались против дистиллированной воды и лиофилизировались.
Пример 2. Относительная устойчивость к нуклеазе гибридных олигонуклеотидов с фосфоротиоатными связями.
Чтобы проверить относительную устойчивость к нуклеазе гибридных олигонуклеотидов с фосфонотиоатными связями олигонуклеотиды обрабатывались фосфодиэстеразой змеиного яда (SVPD). Около 0.2 A260 единиц олигонуклеотидов A, C и F растворялись в 500 μл буфера (49 мМ NH4CO3, pH 0.4 + 20 мМ MgCl2) и смешивались с 0.002 единицами SVPD. Смесь инкубировалась при 37oC 420 мин. После 0, 200 и 420 мин брались аликвоты в 165 μл и анализировались с использованием ионообменной ЖХВР. Результаты показаны на фиг.1. Олигонуклеотид F был очень устойчив к фосфодиэстеразе, в то время как олигонуклеотид A расщеплялся почти полностью и олигонуклеотид C расщеплялся на 50% (панель A).
Олигонуклеотид с фосфодиэкрирными связями расщеплялся примерно на 80% в течение минуты с использованием 1/10 части концентрации SVPD.
Эти результаты показывают, что присутствие 2'-OMe рибонуклеозидов в фосфоротиоате олигонуклеотида усиливает устойчивость к экзонуклеазному расщеплению, и что эта усиленная устойчивость повышается при использовании большей пропорции 2'-OMe рибонуклеотидов. Учитывая схожий характер и поведение рибонуклеотидов, других 2'-замещенных рибонуклеотидов и 2'-OMe рибонуклеотидов, эти результаты также предполагают, что подобное усиление устойчивости к нуклеазе будет иметь место и в фосфоротиоатах и/или фосфородитиоатах гибридного олигонуклеотида, имеющего рибонуклеотиды, 2'-замещенные рибонуклеотиды или смесь рибонуклеотидов и 2'-замещенных рибонуклеотидов.
Пример 3. Относительная стабильность дуплекса гибридных олигонуклеотидов с фосфоротиоатными связями.
Олигонуклеотиды A - F тестировались на относительную стабильность дуплексов, образованных с комплементарными олигодезоксирибонуклеотидами, и с комплементарными олигорибонуклеотидами. В отдельных реакциях каждый олигонуклеотид A - F смешивался с эквивалентным количеством (0.2 A260 единиц) его комплементарного олигонуклеотида в 150 мМ NaCl, 10 мМ Na2PO4, 1 мМ ЭТДК, pH 7. Смесь нагревалась до 85oC 5 мин, затем охлаждалась до 30oC. Затем температура повышалась с 30 до 80oC со скоростью 1oC в минуту и A260 регистрировалась как функция температуры. Результаты показаны в табл.3.
Эти результаты выявляют, что если комплементарным олигонуклеотидом является олигорибонуклеотид, присутствие 2'-OMe рибонуклеотидов усиливает стабильность дуплекса, и что это усиление повышается с увеличением пропорций 2'-OMe рибонуклеозидов. Эти результаты следует аналогичным образом относить и к фосфоротиоатам и/или фосфородитиоатам гибридного олигонуклеотида, содержащим рибонуклеотиды, 2'-замещенные рибонуклеотиды или смеси рибонуклеотидов и 2'-замещенных рибонуклеотидов. Таким образом, фосфоротиоаты и/или фосфородитиоаты гибридного олигонуклеотида по изобретению должны связывать вирусную РНК или вирус, патогенный организм или клеточную мРНК с большим сродством, чем обычные фосфоротиоаты олигодеоксинуклеотида.
Пример 4. Активация РНКазы H гибридными
олигонуклеотидами с
фосфоротиоатными связями
Олигонуклеотидфосфоротиоаты и различные гибридные олигонуклеотидфосфоротиоаты исследовались на свои свойства активации РНКазы H. Олигонуклеотид A
(табл. 2),
фосфоротиоат олигонуклеотида, который, как известно, активирует РНКазу H, использовался как контроль. Олигонуклеотид F/2'-OMe аналог фосфоротиоата олигонуклеотида/ и олигонуклеотиды C, B и
E,
гибридные олигонуклеотиды, исследовались на способность активировать РНКазу H.
Для проведения эксперимента комплементарный 32-мерный олигорибонуклеотид был синтезирован (фиг. 3) и обрабатывался киназой на 5'-конце,32P-меченая 32-мерная РНК /0.003 A260 единиц; 0.01 μг / и олигонуклеотиды /0.0635 A260 единиц; 1.9 μг / смешивались в 20 μл буфера /0.15 М NaCl, 0.01 MgCl2, 0.01 М хлорида Трис, pH 7.9/, содержащие 0.001М ДТТ. Смесь инкубировалась с 6 единицами РНКазы H /E.coli/ при 37oC. Аликвоты в 4.5 μл отбирались на 0, 15, 30 и 60 мин и анализировались электрофорезом на полиакриламидном геле.
Олигонуклеотид A (Дуплекс A) показал сайт-специфическое расщепление РНК РНКазой H. Олигонуклеотид F/2'-OMe аналог; Дуплекс B/ не показал расщепления РНК в присутствии РНКазы H. Гибридные олигонуклеотиды B, C и E /Дуплексы C, D, E соответственно/ показали сайт-специфическое расщепление РНК РНКазой H. Дуплекс F, в котором исследовался несовместимый фосфоротиоат олигонуклеотида, не показал расщепления РНК. Ряд C показывает, что в присутствии РНКазы H РНК не расщепилась.
Пример 5. Торможение ВИЧ гибридными олигонуклеотидами с фосфоротиоатными связями
Гибридные олигонуклеотидфосфоротиоаты тестировались на их способность тормозить
ВИЧ-1 в тканевой
культуре, H9 лимфоциты инфицировались вирионами ВИЧ-1 /=0.01 - 0.1 TCID50/ клетку/ 1ч при 37oC. После 1 ч неадсорбированные варионы смывались и инфицированные
клетки делились по
лункам 24-луночного планшета. К инфицированным клеткам добавлялась соответствующая концентрация (из исходного раствора) олигонуклеотида, чтобы получить нужную концентрацию в среде
2 мл. В
положительном контрольном эксперименте добавлялись ddC или AZT. Затем клетки культивировались 3 дня. В конце трех дней надосадочный слой с инфицированной культуры собирался и измерялся на
экспрессию p
24 твердофазным иммуноферментным анализом (ELISA). Уровень экспрессии p24 сравнивался между обработанными и необработанными (без лекарств) инфицированными клетками олигонуклеотида.
Все тестируемые гибридные олигонуклеотидфосфоротиоаты показали значительное торможение экспрессии p 24 при μг г/мл концентрациях без значительной цитотоксичности (данные не показаны). Эти результаты указывают, что фосфоротиоаты гибридного олигонуклеотида, содержащие 2'-OMe рибонуклеотиды, эффективны как ингибиторы экспрессии генов. Аналогичной эффективности следует ожидать от фосфоротиоатов и/или фосфородитиоатов олигонуклеотида, содержащих рибонуклеозиды, 2'-замещенные рибонуклеозиды или смесь рибонуклеозидов и 2'-замещенных рибуноклеозидов.
Реферат
Гибридный олигонуклеотид относится к синтетическим олигонуклеотидам, которые используются при исследовании генной экспрессии, а также в терапевтических целях. Олигонуклеотид содержит фосфоротиоатные и/или фосфородитиоатные связи и включает дезоксирибонуклеозид, рибонуклеозид или 2'-замещенный рибонуклеозид и фосфоротиоатную и/или фосфородитиоатную межнуклеотидную связь. При использовании в терапевтической композиции используют эффективное количество олигонуклеотида, имеющего последовательность, комплементарную последовательности нуклеиновой кислоты вируса, патогенного организма или клеточного гена, и фармацевтически приемлемый носитель. Олигонуклеотид имеет фосфоротиоатную и/или фосфородитиоатную связи, а также дезоксирибонуклеозид, рибонуклеозид или 2'-замещенный рибонуклеозид. Полученный гибридный олигонуклеотид позволяет эффективно регулировать генную экспрессию. 3 с. и 9 з.п. ф-лы, 4 ил., 3 табл.


Комментарии