Способ определения биологической активности дефибротида - RU2323979C2
Код документа: RU2323979C2
Чертежи

Описание
Область техники, к которой относится изобретение
Данное изобретение относится к способу определения биологической активности дефибротида и более конкретно к непрямому ферментативному способу определения биологической активности дефибротида.
Уровень техники
Дефибротид (Merck Index, 1996, no. 2915) является веществом природного происхождения, которое получают экстракцией из органов животных и которое состоит из натриевой соли полидезоксирибонуклеотидов, имеющих низкую молекулярную массу.
Дефибротид был предметом многочисленных фармакологических исследований, которые позволили предположить, что он может применяться в терапии в качестве антитромботического агента (патент США US 3829567).
Кроме того, дефибротид также успешно использовался в лечении периферических артериопатий, при острой почечной недостаточности (патент США US 4694134) или при острой ишемии миокарда (патент США US 4693995).
Подобно другим биологическим веществам, которые получают экстракцией, дефибротид является также предметом ограниченной вариабельности состава, которая является типичной для природных биополимеров. Классическим примером этой ситуации является гепарин, вариабельность которого от партии к партии в отношении длины цепи, молекулярной массы, состава, степени сульфатированя и т.д. хорошо известна. Следствием этого является то, что одни и те же количества по массе дефибротида могут быть фактически неэквивалентными с точки зрения специфической биологической активности.
Процесс экстракции, выделения и очистки не может per se гарантировать абсолютную воспроизводимость этого продукта именно вследствие присущей ему биополимерной структуры.
Однако при хорошем контроле можно уменьшить эту вариабельность: для этой цели проводились исследования стандартизованных промышленных процессов для выделения дефибротида экстракцией из органов, такие как, например, исследования, описанные в патенте США US 4985552.
Продукт, полученный в соответствии с вышеупомянутым процессом, характеризуется путем определения некоторых специфических физико-химических параметров, таких как, например, электрофоретическая подвижность, коэффициент экстинкции, способность к оптическому вращению и обратимая гиперхромность. Однако эти параметры зависят, в основном, от структуры дефибротида и не могут обеспечить информацию о его биологической активности.
Насколько известно авторам данного изобретения, единственными способами, которые, как сообщалось до настоящего времени, использовались для оценки биологической активности дефибротида, являются чашечный тест определения лизиса фибрина и тромбоэластографическая регистрация времени лизиса эуглобулина (Prino G., Mantovani М., Niada R., Coccheri S., Butti A., Indagini preliminari sull'attivita fibrinolitica, nell'animale e nell'uomo, di una nuova sostanza presente in diversi organi animali, Simposio Internazionale: La ricerca scientifica nell'industria farmaceutica in Italia, Rome, 2-4 October 1975 - II Farmaco, Ed. Prat. (1969), 24, 552-561).
Однако вышеупомянутые способы отличаются значительной экспериментальной сложностью, неудовлетворительной воспроизводимостью и точностью и, в конкретном случае тромбоэластографической регистрации, линейностью ответа, ограниченной очень узкими диапазонами концентраций.
Таким образом, до настоящего времени не были известны достоверные, точные и воспроизводимые способы определения биологической активности дефибротида.
Авторы данного изобретения разработали простой и надежный способ определения биологической активности дефибротида, который позволяет контролировать образцы, получаемые экстракцией и, следовательно, позволяет стандартизировать медицинские препараты на основе дефибротида.
Способ, к которому относится данное изобретение, позволяет определять специфическую биологическую активность дефибротида в сравнении со стандартным эталоном с высокой точностью, с большой скоростью и воспроизводимостью.
Раскрытие изобретения
Таким образом, данное изобретение относится к способу определения специфической биологической активности образцов дефибротида, предусматривающему стадии:
a) приведения в контакт дефибротида, плазмина и субстрата, специфичного для плазмина, который посредством реакции с плазмином обеспечивает измеряемый продукт, и
b) измерения количества образованного продукта в последовательных временных точках.
Способ данного изобретения является непрямым in vitro способом для определения активности дефибротида, который основан на функциональном взаимодействии между дефибротидом и плазмином.
Из литературы известно, что плазмин является протеолитическим ферментом в каскаде свертывания/фибринолиза, способным расщеплять фибрин, фибриноген и другие белки плазмы.
Ферментативную активность плазмина обычно определяют различными стандартными тестами in vitro. Одним из наиболее часто используемых способов является определение при помощи спектрофотометрии или флуориметрии хромогенных или флуорогенных соединений, которые высвобождаются посредством действия плазмина на различные субстраты (Haemostasis, (1978), 7, 138-145). Обычно используют пептидные субстраты, имеющие формулу A1-А2-А3-Х, в которой A1 и А2 являются аминокислотами, которые являются преимущественно неполярными, А3 является лизином или аргинином и Х представляет измеряемое высвобождающееся соединение, например, пара-нитроанилин (pNa) или 2-нафтиламин (NA) (Haemostasis, (1978), 7, 146-149). Кроме вышеупомянутых пептидных субстратов, успех был достигнут с использованием других, более простых, соединений, таких как, например, п-нитробензил-п-толуолсульфонил-L-аргинин (Haemostasis, (1978), 7, 105-108).
В этих тестах скорость, с которой соединение Х высвобождается в инкубационную среду, пропорциональна активности (в Международных Единицах) плазмина, присутствующего в пробе.
Теперь было обнаружено, и это является принципом, на котором основывается данное изобретение, что в тестах, основанных на оценке плазмина, описанных выше, дефибротид увеличивает скорость высвобождения соединения Х пропорционально его концентрации.
Способ, к которому относится данное изобретение, предусматривает прежде всего приведение образца дефибротида, плазмина и субстрата плазмина в контакт друг с другом.
Образец дефибротида, используемый для определения в соответствии с данным изобретением, обычно получают экстракцией из органов согласно известным процедурам, таким как, например, процедуры, описанные в патенте США US 4985552, который уже упоминался.
Партию обычного, изготовляемого промышленным путем дефибротида выбирали в качестве эталонного образца (стандарта) и использовали для построения калибровочных кривых в соответствии со способом данного изобретения.
Обычно данный способ обеспечивает точные и правильные измерения дефибротида даже в присутствии примесей, таких как, например, РНК, гепарин, деградированный дефибротид (дефибротид, из которого был удален пурин или пиримидин) или этанол, при условии, что они находятся в концентрациях, обычно меньших, чем 10% по массе, таких, чтобы не нарушить систему.
Кроме возможности определения дефибротида этот способ позволяет также определять другие биологически эквивалентные вещества, образующиеся из дефибротида, такие как, например, деаминированный дефибротид или, более просто, дефибротид, денатурированный нагреванием.
Данный способ является достаточно чувствительным для обнаружения концентраций дефибротида, равных или меньших, чем 0,1 мкг/мл (конечная концентрация в этой системе определения), и обычно дает хорошую корреляцию до максимальных величин концентраций, равных или более высоких, чем 100 мкг/мл.
Используемый плазмин является обычно плазмином любого млекопитающего, таким как, например, бычий, свиной или человеческий плазмин, причем предпочтительным является плазмин человека.
Однако, хотя плазмин является предпочтительным ферментом, использование других эквивалентных ферментных систем, таких как, например, предшественники плазмина, такие как плазминоген, или ферменты - аналоги плазмина, которые являются химически родственными и имеют сходную функциональность, находится также в рамках данного изобретения.
В способе данного изобретения под субстратом для плазмина может пониматься любой субстрат, специфичный для плазмина, который, в условиях данного способа, высвобождает детектируемый продукт гидролиза X.
В зависимости от природы детектируемой группы Х могут использоваться равным образом успешно альтернативные системы детектирования, обычно известные специалисту в данной области.
Спектрофотометрические или флуорометрические системы детектирования являются особенно предпочтительными, в особенности спектрофотометрические системы.
Обычно используемыми субстратами являются субстраты, которые являются специфичными для плазмина. Предпочтительно использовать пептиды формулы A1-А2-A3-X, в которой A1 и A2 являются аминокислотами, которые являются преимущественно неполярными, А3 является лизином или аргинином и Х является детектируемой группой. Примерами таких субстратов являются Val-Leu-Lys-pNa, Val-Phe-Lys-pNa или пироGlu-Phe-Lys-pNa, в которых группа X, детектируемая при помощи спектрофотометрии, является пара-нитроанилином (pNa). Другие подходящие субстраты, например, Val-Gly-Arg-2NA, содержат 2-нафтиламин, который измеряют флуорометрией. Особенно предпочтительным субстратом является соединение H-D-валил-L-лейцил-L-лизин-п-нитроанилин (H-D-Val-Leu-Lys-pNa).
Плазмины и специфичные субстраты, используемые для определения дефибротида, являются обычно коммерчески доступными.
Способ определения данного изобретения проводят помещением этих реагентов и образца дефибротида в водный раствор при специфических рН и молярности.
В частности, концентрация плазмина может варьировать обычно от 0,0016 до 0,20 М.Е./мл, предпочтительно от 0,0064 до 0,050 М.Е./мл и еще более предпочтительно равна приблизительно 0,0125 М.Е./мл.
Однако, что касается субстрата для плазмина, концентрации от 0,3 до 4 мМ, предпочтительно от 2,5 до 3,5 мМ и наиболее предпочтительно 3 мМ используют обычно в случае хромогенного субстрата, тогда как концентрации от 0,05 до 0,15 мМ используют в случае флуорогенного субстрата.
Способ определения данного изобретения, подобно другим ферментативным способам, является чувствительным к рН среды.
Фактически он не может применяться при экстремальных значениях рН, при которых ферментативная система была бы инактивирована.
Предпочтительно также, чтобы рН среды не подвергался изменению в любой временной точке во время периода проведения измерений, и, следовательно, раствор обычно забуферивают с использованием буферных систем, выбранных из систем, обычно используемых в тестах определения плазмина. Например, подходящими буферными системами могут быть фосфатный буфер, цитратный буфер или трис(гидроксиметил)аминометан-гидрохлоридный (ТРИС) буфер. Операцию проводят предпочтительно в присутствии ТРИСа.
В данном способе обычно предпочтительно поддерживать рН среды в диапазоне приблизительно от 7 до 8, более предпочтительно при приблизительно 7,4.
Кроме того, предпочтительно поддерживать концентрацию буферной системы в диапазоне от 10 до 200 мМ, предпочтительно при приблизительно 50 мМ.
Способ данного изобретения для определения дефибротида предусматривает, что плазмин, субстрат для плазмина и дефибротид смешивают. В частности, для обеспечения правильного проведения измерений, предусмотренных данным способом, предпочтительно добавлять плазмин или специфичный субстрат или оба к буферному раствору, содержащему образец дефибротида, перед началом стадии измерения. Субстрат для плазмина предпочтительно добавляют в последнюю очередь.
Важным параметром данного способа определения является температура. Предпочтительно поддерживать одну и ту же температуру на протяжении всей продолжительности измерений и для всех измеряемых образцов как при построении калибровочных кривых, так и во время стадии измерений. Для этой цели предпочтительно использовать прибор с контролируемой температурой, а также, когда необходимо, можно проводить несколько серий измерений, изменяя положение образцов подходящим образом, чтобы гарантировать, что данная система имеет максимальную температурную гомогенность.
Обычно этот способ определения используют в диапазоне температур, например, от 25 до 40°С, предпочтительно от 35 до 39°С и еще более предпочтительно при 37°С.
Согласно данному изобретению измерение концентрации соединения X, высвобождающегося в среду под действием плазмина, начинают тогда, когда все реагенты были добавлены, и продолжают в течение заранее заданного времени и при заранее заданной частоте в зависимости от химической природы Х и системы детектирования.
Подобно другим способам биологического определения способ данного изобретения также предусматривает стадию калибрования и стадию измерения, которые предпочтительно проводят параллельно для уменьшения, насколько это возможно, встречаемости экспериментальной изменчивости.
Стадия калибровки включает в себя получение данных оптической плотности, относящихся к пробам с известными увеличивающимися концентрациями дефибротида (стандарта), статистическую обработку этих данных и экстраполяцию калибровочных кривых, которые выражают корреляцию между увеличением скорости ферментативной реакции данного изобретения и концентрацией дефибротида, присутствующего в среде. На стадии измерения благодаря корреляции, полученной на стадии калибрования, возможно определить неизвестные биологические активности образцов дефибротида на основе величин оптической плотности, измеренных и обработанных при тех же самых условиях.
Более подробно, экспериментальный протокол обычно предусматривает подготовку нескольких образцов, как стандартных, так и неизвестных, при различных известных концентрациях дефибротида. Образцы дефибротида готовят последовательным разведением исходных растворов в соответствии с заданным заранее фактором разведения.
В данном способе предпочтительно готовить, по меньшей мере, 5 концентраций стандарта и 5 концентраций тестируемого образца с получением 5 повторов или более предпочтительно 10 повторов для каждой концентрации стандарта и, сходным образом, для каждой концентрации анализируемого образца, обычно при последовательном разведении 1:2 исходных растворов.
Концентрации как стандарта, так и анализируемого образца дефибротида обычно равны от 0,1 до 100 мкг/мл, предпочтительно от 0,3 до 50 мкг/мл, более предпочтительно от 0,5 до 8 мкг/мл.
Концентрации анализируемого образца имеют предпочтительно тот же самый порядок величин, что и концентрации стандарта.
Согласно приведенной выше иллюстрации измерения для каждой концентрации предпочтительно проводят на двух микропланшетах, где размещение каждого образца, стандарта и анализируемого образца, соответственно, при соответствующей концентрации на одном планшете является предпочтительно обратным размещению на другом планшете. Согласно этой схеме для расположения образцов, которая объясняется более подробно в экспериментальной части, для каждой концентрации как стандарта дефибротида, так и анализируемого образца дефибротида измеряют, по меньшей мере, 5 или предпочтительно 10 значений оптической плотности для каждой временной точки.
Серию измерений, описанных выше, проводят в заданных заранее временных точках, то есть прежде всего во время t0, то есть когда все компоненты были добавлены, перед началом ферментативной реакции изобретения и затем через точные интервалы и в течение времени, достаточного для получения необходимых данных.
Предпочтительно измерения оптической плотности продолжаются максимально до 90 минут со снятиями показаний, производимыми каждые 1-10 минут. Более предпочтительно снятия показаний производят во время t0 и затем в течение от 20 до 50 минут каждые 5 минут. Фотометрические снятия показаний оптической плотности проводят при длине волны, которая зависит от характера детектируемой группы X, высвобождаемой в ходе ферментативной гидролитической реакции. В конкретном случае, когда Х является pNA, оптическую плотность измеряют при 405 нм.
Показания оптической плотности стандартных и неизвестных образцов дефибротида, известные как исходные данные, обычно напрямую происходят из одного и того же прибора, который обеспечивает операцию снятия показаний; их сводят в таблицу таким образом, что значение оптической плотности выражено для каждой временной точки и для каждой лунки.
Затем эти исходные данные подвергают обработке с использованием, например, электронной таблицы Microsoft Excel®. Эта первая операция обработки данных приводит к расчету средней оптической плотности и связанного с ней стандартного отклонения в каждой временной точке и для каждой серии показаний, причем каждая серия показаний содержит, по меньшей мере, 5 и предпочтительно 10 повторов для каждой концентрации как стандарта, так и анализируемого образца дефибротида.
Дальнейшую статистическую обработку данных проводят с использованием программы типа Sigma Plot Computer Program® (SPSS, Chicago, USA), которая преобразует математическую зависимость, существующую между значениями оптической плотности этих проб и временем, для каждой серии концентраций дефибротида, для получения прямых линий, наклон которых пропорционален концентрации дефибротида.
Более точно в интервале, в котором имеется линейность ответа, предпочтительно от 20 до 50 минут и для каждого из 5 или предпочтительно 10 повторов одной и той же концентрации эта программа рассчитывает линию регрессии, которая характеризуется коэффициентом линейной регрессии b, коэффициентом корреляции r2 и отсекаемым на координатной оси отрезком а.
Прямые линии, полученные в соответствии с данной процедурой, обычно имеют хорошую корреляцию, выражаемую высокими значениями r2, обычно не менее 0,97, предпочтительно r2≥0,99.
Данные, полученные при помощи этой программы, могут быть воспроизведены в виде табличных цифровых данных или могут быть представлены графически для каждой серии концентраций.
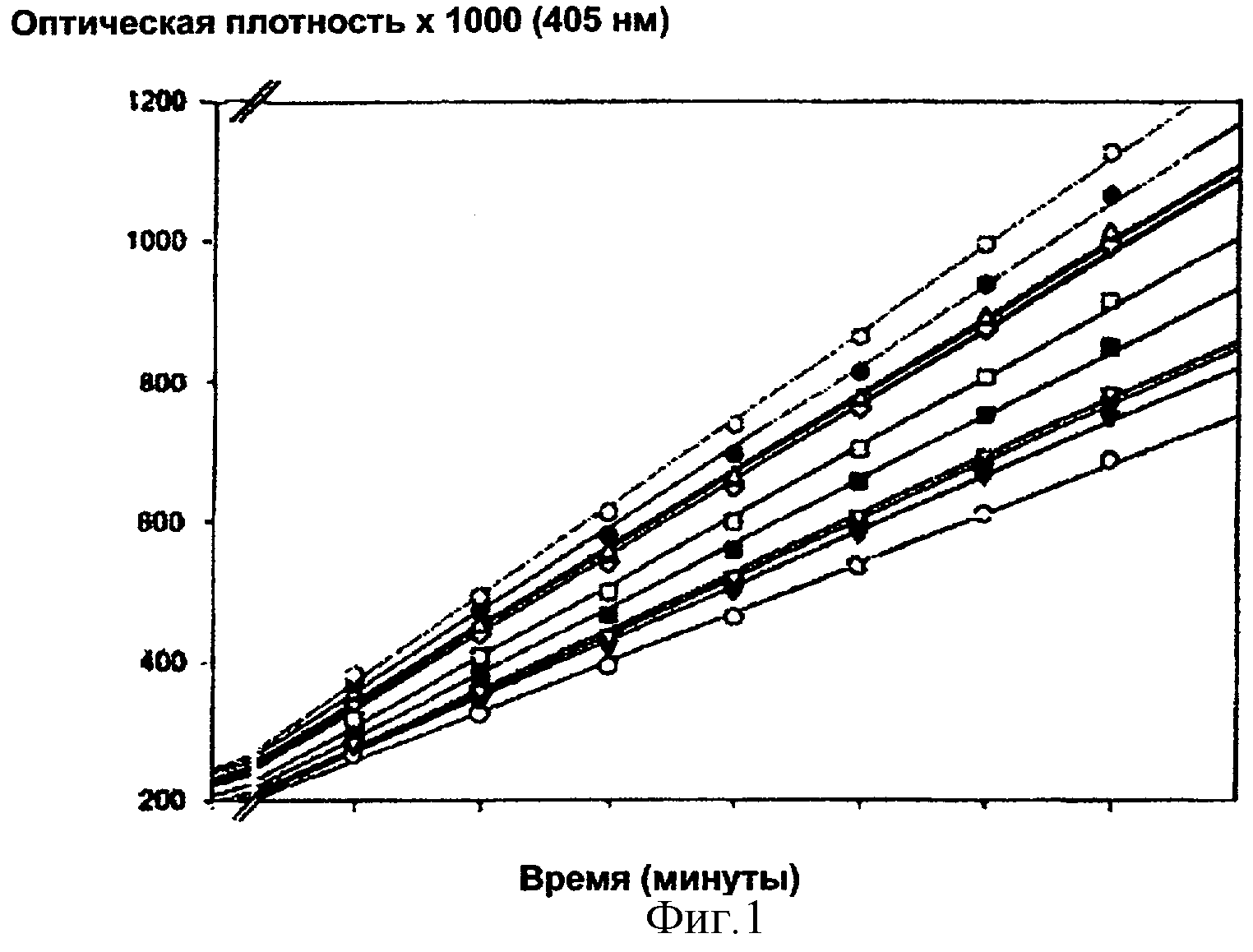
Как показано на фигуре 1, посредством откладывания времени по абсциссе, а оптической плотности по ординате получают прямые линии, наклон которых b будет пропорционален скорости ферментативной реакции: при увеличении концентрации дефибротида будет увеличиваться скорость гидролиза и пропорционально будет увеличиваться величина b. Наконец, величины наклона, рассчитанные, как описано выше, для каждой серии повторов стандарта дефибротида и анализируемого образца дефибротида, коррелируют с десятичным логарифмом концентрации дефибротида, к которой они относятся.
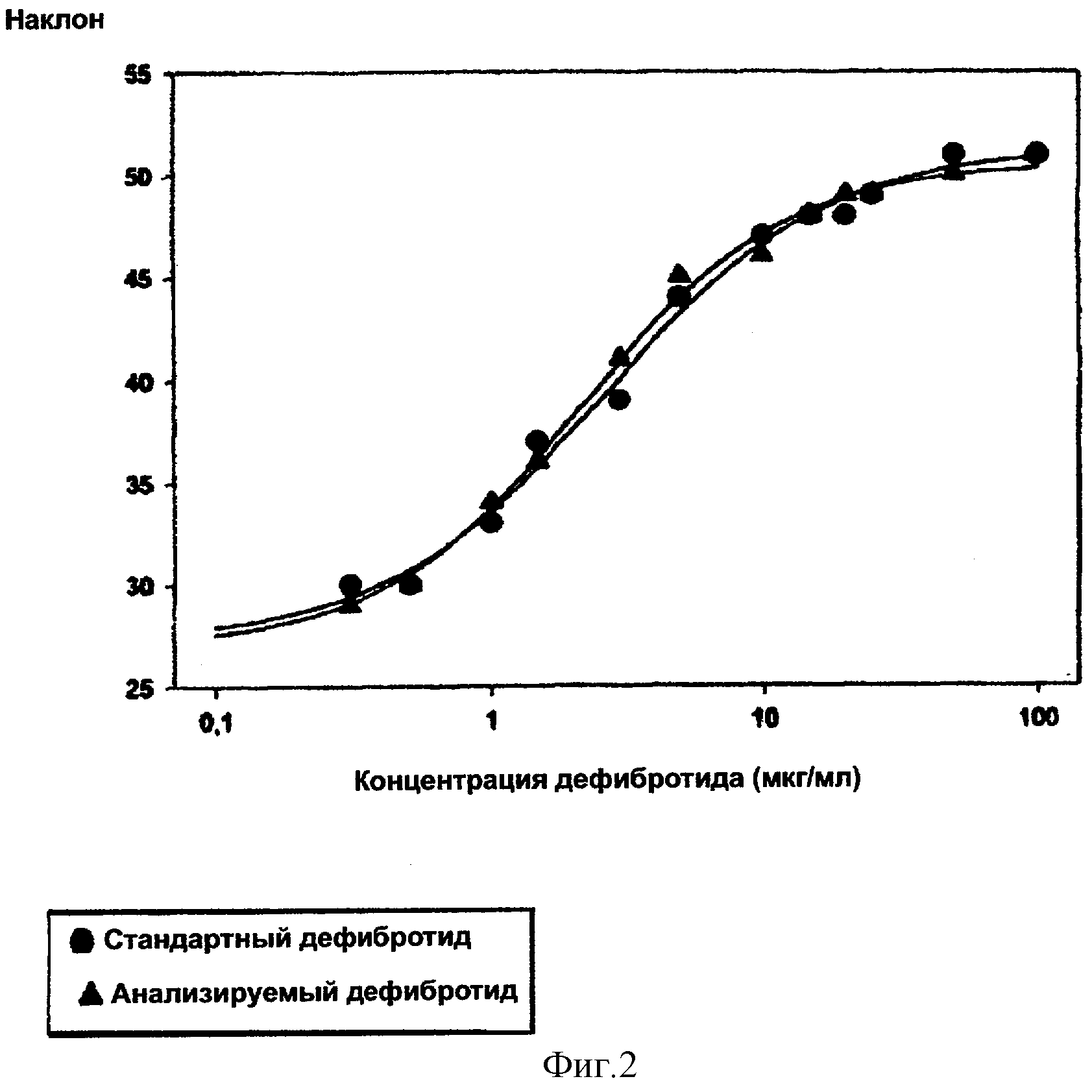
Графически эта корреляция дает сигмоидальную кривую для стандарта и сигмоидальную кривую для анализируемого образца (фигура 2); центральные части этих сигмоидальных кривых дают две прямые линии, которые обычно являются параллельными и расстояние между которыми является функцией разности между биологическими активностями анализируемого образца и стандарта.
В этом интервале линейности определяют активность неизвестного образца дефибротида в сравнении с активностью стандарта в соответствии с методологией биологического определения с использованием параллельных линий, описанной Finney DJ, Statistical Method in Biological Assay, 2nd ed. Ch. Griffin, London.
Эта методология может применяться, когда, как в данном изобретении, биологический ответ является линейной функцией логарифма концентрации определяемого вещества и когда имеется параллелизм и линейность между прямыми линиями, связанными со стандартными и, соответственно, неизвестными концентрациями.
Предпочтительно статистическую обработку этих данных, расчет отношения этих активностей и, следовательно, определение неизвестной активности дефибротида проводят при помощи специализированных программ, созданных на основе вышеупомянутой методологии.
Однако статистическая обработка данных, которая, в химическом анализе вообще и в данном способе более конкретно, позволяет минимизировать частоту ошибок и экспериментальную вариабельность, не является обязательной для способа данного изобретения, а просто представляет способ оценки результатов, который хорошо известен специалистам в данной области и который обычно используется в данной области.
Данное изобретение относится также к наборам для определения биологической активности дефибротида в соответствии со способом данного изобретения, содержащим по меньшей мере:
a) измеренное количество субстрата для плазмина, как определено выше, и
b) измеренное количество плазмина.
Предпочтительные наборы содержат 20-30 мг субстрата, специфичного для плазмина, на единицу плазмина и даже более предпочтительно 25 мг субстрата на единицу плазмина.
В соответствии с данным изобретением наборы, содержащие H-D-Val-Leu-Lys-pNA в качестве субстрата, специфичного для плазмина, и плазмин человека, являются особенно предпочтительными.
Наборы данного изобретения могут также содержать забуференный водный раствор, предпочтительно раствор, забуференный 50 мМ ТРИС-HCl при рН 7,4.
При необходимости наборы данного изобретения содержат также измеренное количество дефибротида (стандарта) для обеспечения возможности контрольных измерений.
В предпочтительном воплощении данного изобретения стандартные растворы и растворы образцов дефибротида, которые подлежат определению, вводят в соответствующие лунки микропланшетов. Раствор плазмина готовят в момент использования и распределяют по лункам, содержащим дефибротид, и, наконец, добавляют раствор, содержащий субстрат для плазмина. Затем этот микропланшет помещают в термостатированный планшет-ридер и после быстрого перемешивания снимают показания оптической плотности этой системы через заданные предварительно интервалы и в течение предварительно заданного периода времени. Затем полученные исходные данные обрабатывают, определяя, таким образом, неизвестные активности образцов дефибротида.
Эти и другие аспекты данного изобретения будут проиллюстрированы более подробно в следующих примерах, которые, однако, не должны рассматриваться как ограничивающие данное изобретение.
Краткое описание фигур
Фигура 1:
Кинетика высвобождения pNA из субстрата S-2251 под действием плазмина, который активирован и не активирован дефибротидом (концентрация 0-100 мкг/мл, 0-20 минут).
Фигура 2:
Зависимость наклона прямых линий, соответствующих стандарту и анализируемому образцу дефибротида, от концентрации дефибротида.
Фигура 3:
Кинетика высвобождения pNA из хромогенного субстрата S-2251 под действием плазмина в присутствии дефибротида (концентрация 0,5 мкг/мл, 5 повторов).
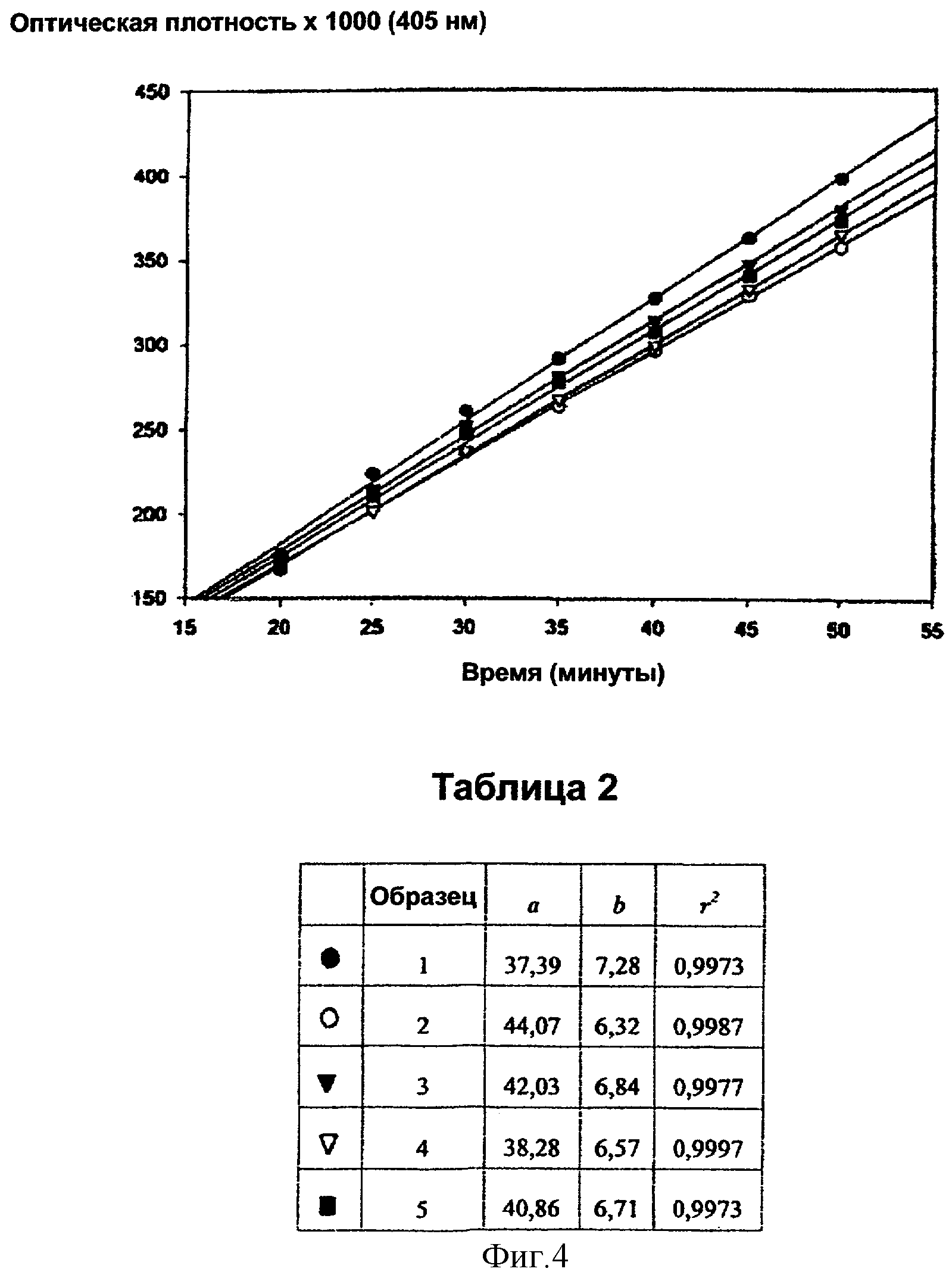
Фигура 4:
Кинетика высвобождения pNA из субстрата S-2251 под действием плазмина в присутствии дефибротида (концентрация 2,0 мкг/мл, 5 повторов).
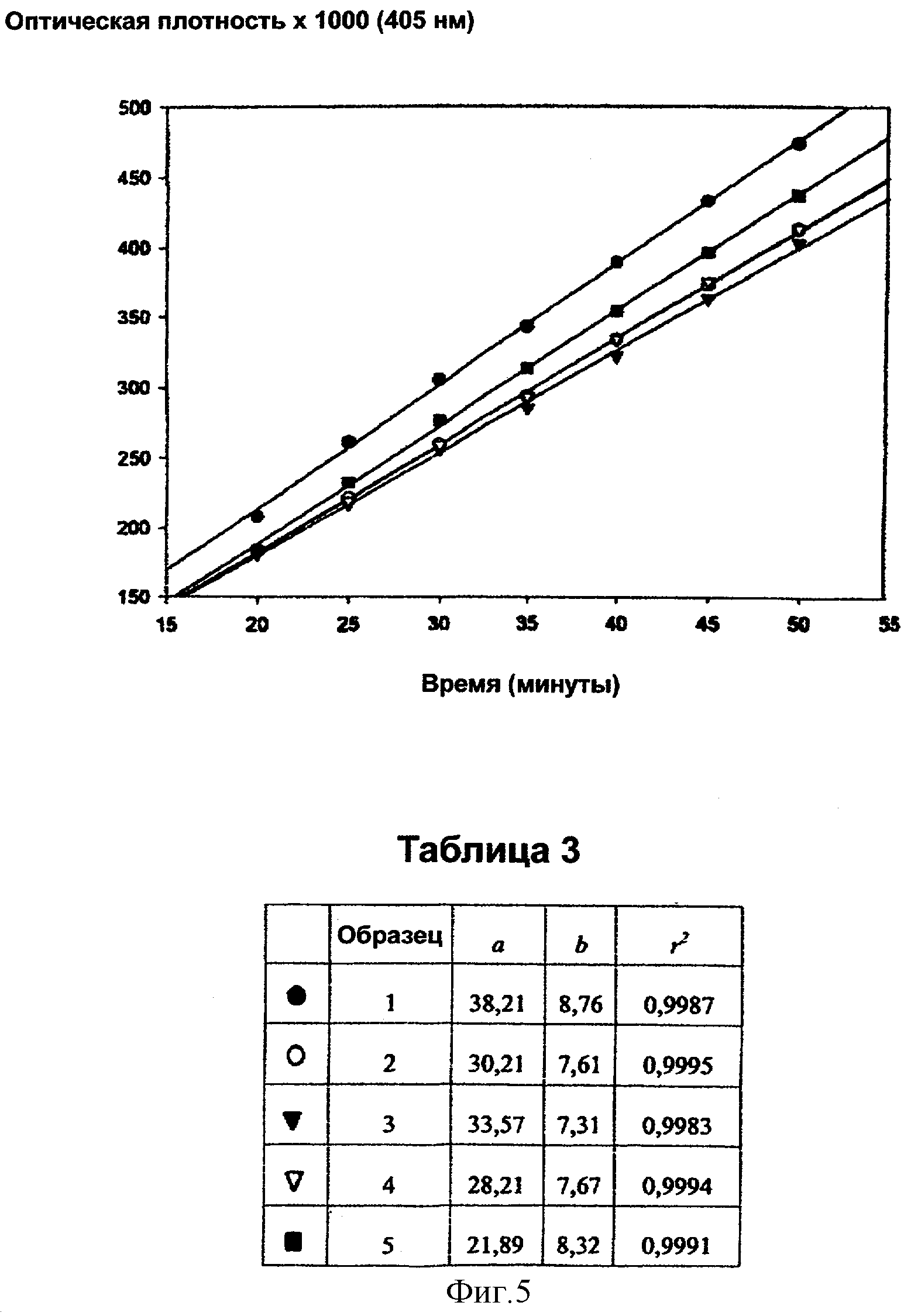
Фигура 5:
Кинетика высвобождения pNA из субстрата S-2251 под действием плазмина в присутствии дефибротида (концентрация 8,0 мкг/мл, 5 повторов).
Фигура 6:
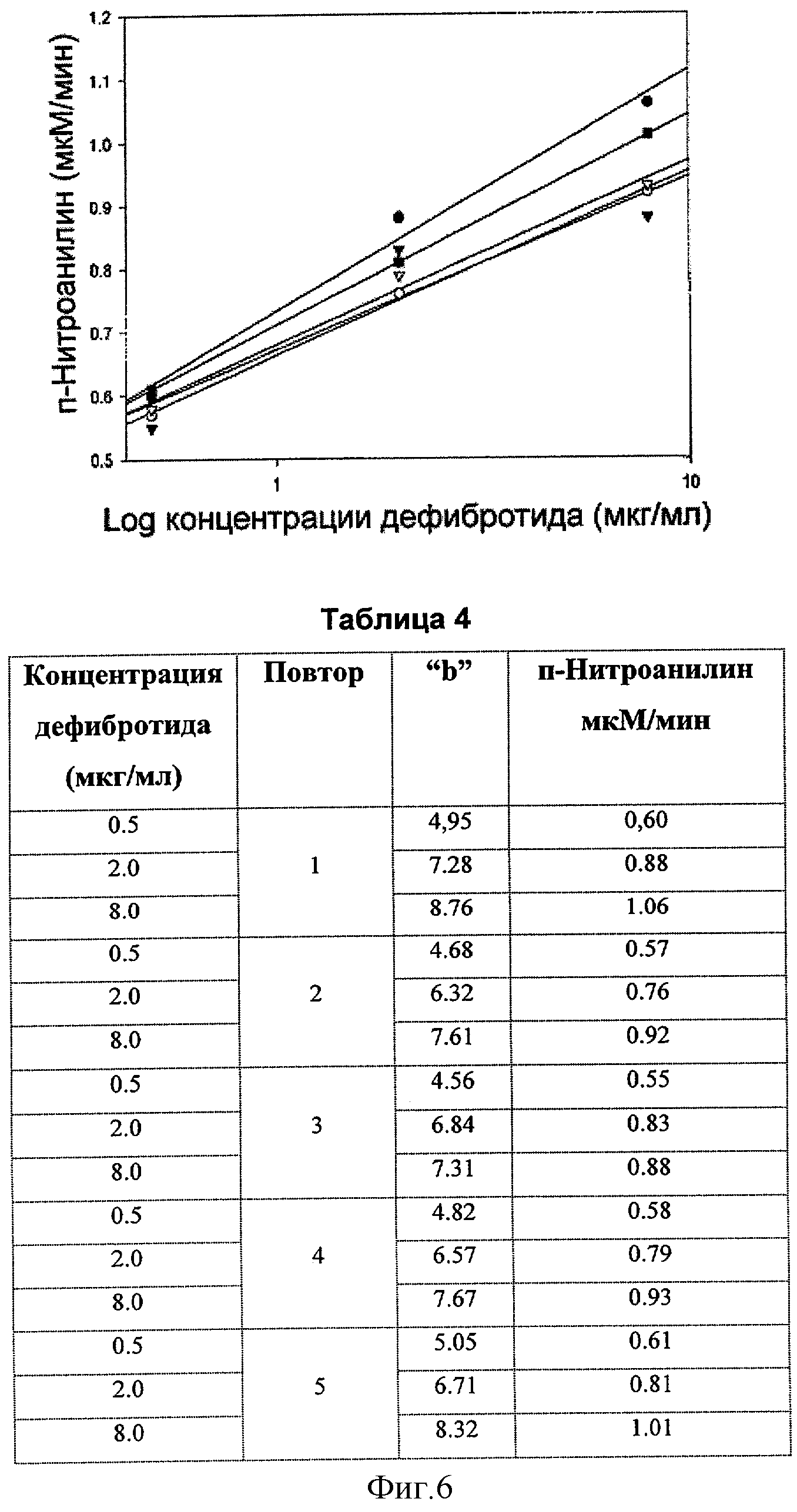
Зависимость высвобождения пара-нитроанилина от концентрации дефибротида.
Осуществление изобретения
ПРИМЕРЫ
В приведенных здесь примерах использовали следующие материалы.
Оборудование
- Детектор для микропланшета, имеющего 96 лунок, MRX TCII (Dynex Technologies, Chantilly, VA, USA), термостатированный и снабженный программой ферментативной кинетики
- Микропланшеты, имеющие 96 лунок с плоским основанием (Greiner L., Kremunster, Austria, cat. 655101)
- Пипетки с непрерывно регулируемым объемом Pipetman P200 (30-200 мкл) и 8×200 (20-200 мкл) и наконечники для пипеток на 200 мкл сертифицированного качества (Gilson, Milan, Italy)
- рН-метр РНМ85 Radiometer (Analitica De Mori, Milan, Italy)
Программы
- Microsoft Excel® (Microsoft Corporation, Redmond, WA, USA)
- Sigma Plot Computer Program® (SPSS, Chicago, USA)
Вещества
- Дефибротид (Gentium)
- Плазмин человека, 1 единица, Р-4895 (Sigma Aldrich, Milan, Italy)
- Хромогенный субстрат S-2251, 820332-39 (Chromogenix Instrumentation Laboratory S.p.A., Milan, Italy)
- Трис(гидроксиметил)аминометан (ТРИС), 255285-9 (Sigma-Aldrich, Milan, Italy)
- 1 н HCl 1090571000 (Merck)
-1 н NaOH 1091411000 (Merck)
Растворы
ТРИС-HCl-буфер
2,42 г ТРИСа растворяют в дистиллированной воде и разбавляют до объема 100 мл. 16 мл 1 н HCl добавляют к этому раствору с последующим добавлением дополнительного количества воды с получением конечного объема 400 мл. рН этого последнего раствора равен 7,40. Если эти величины являются другими, рН корректируют с получением желаемой величины добавлением 1 н HCl или 1 н NaOH.
Раствор плазмина
Одну единицу (1 М.Е.) плазмина человека растворяют в 4 мл ТРИС-HCl-буфера при 0°С. Затем, работая всегда на льду, этот раствор делят на аликвоты по 200 мкл, которые хранят при -20°С в пластиковых пробирках на 10 мл.
Раствор хромогенного субстрата S-2251
25 мг S-2251 растворяют в 15,15 мл дистиллированной воды и хранят при +4/+8°С.
Стандартные растворы дефибротида
Приготовление стандартных растворов
- (Конечные) концентрации от 0,1 до 100 мкг/мл
60 мг дефибротида растворяют в 3 мл ТРИС-HCl-буфера и разбавляют 1:15 ТРИС-HCl-буферным раствором. Полученный таким образом раствор, имеющий концентрацию 1,333 мг/мл, подвергают последовательным разведениям 1:2 с получением растворов дефибротида, имеющих концентрацию 666 мкг/мл, 333 мкг/мл и 166 мкг/мл. Этот последний раствор, который использовали в качестве исходного раствора, дополнительно разводят с получением растворов, имеющих концентрации 83,33, 41,67, 33,33, 25, 16,66, 8,33, 5, 2,5, 1,66, 0,83, 0,5 и, наконец, 0,16 мкг/мл.
- (Конечные) концентрации от 0,5 до 8 мкг/мл.
60 мг дефибротида растворяют в 3 мл ТРИС-HCl-буфера и разбавляют 1:1500 ТРИС-HCl-буферным раствором. Полученный таким образом раствор, имеющий концентрацию 13,33 мг/мл, подвергают последовательным разведениям 1:2 с получением растворов дефибротида, имеющих концентрацию 6,66, 3,33, 1,66 и 0,83 мкг/мл соответственно.
Процедура
Берут 150 мкл каждого из стандартных растворов дефибротида, описанных выше, и вносят в лунки микропланшетов.
Затем готовят быстро раствор плазмина добавлением при 0°С 3,8 мл ТРИС-HCl-буфера в пробирку, содержащую 0,2 мл раствора плазмина человека. Все осторожно перемешивают, пока не произойдет растворение, берут 50 мкл и вносят в лунки микропланшета с последующим добавлением 50 мкл S-2251 для каждой лунки.
Микропланшет, помещенный в MRX TCII-ридер, установленный на 37°С, перемешивают в течение приблизительно 10 секунд; снятие показаний оптической плотности проводят при 405 нм в начальный момент времени t0 и затем каждые две минуты в интервале от 10 до 20 минут в соответствии с программой ферментативной кинетики.
Затем экспериментальные данные, измеренные для концентраций дефибротида от 0,1 до 100 мкг/мл, обрабатывают (программы Excel и Sigma Plot) и представляют на графике (линии регрессии), как показано в качестве примера на следующих фигурах 1 и 2.
Величины угловых коэффициентов b (наклон) этих прямых линий, соответствующих стандарту и анализируемому образцу дефибротида (фигура 1), откладывают относительно концентраций дефибротида (логарифмическая шкала) (фигура 2).
Как можно видеть из этого графика, линейный ответ, который позволяет идентифицировать прямую линию, наблюдают в центральной части этой кривой. В этом интервале линейности определяют активность неизвестной пробы дефибротида в сравнении со стандартом в соответствии с уже упомянутой методологией биологического определения с использованием параллельных линий, описанной Finney DJ, Statistical Method in Biological Assay, 2nd ed. Ch. Griffin, London. Для того, чтобы эта методология была применимой, важно, чтобы был, кроме линейности, параллелизм между прямыми линиями, относящимися к стандарту и, соответственно, к дефибротиду, подлежащему тестированию.
Тест для определения биологической активности неизвестного образца дефибротида, в сравнении со стандартным дефибротидом, проводят предпочтительно с использованием концентраций, которые дают прямолинейную часть сигмоидальной кривой, определенной выше. В частности, предпочтительными являются концентрации стандартного и неизвестного дефибротида в диапазоне от 0,5 до 8 мкг/мл.
Размещение в лунках планшета повторов различных концентраций дефибротида для стандарта и для испытуемого образца приводится далее.
Стандартные растворы дефибротида помещают в столбцы 2-6, тогда как образцы дефибротида, которые должны быть определены, помещают в столбцы 7-11, в указанных концентрациях. На втором планшете положения этих проб предпочтительно являются обратными. Наружные столбцы и строки микропланшета не используют для процесса определения, но заполняют водой для гарантии максимальной температурной гомогенности во всей этой системе.
Микропланшет, помещенный в MRX ТСII-ридер, установленный на 37°С, перемешивают в течение приблизительно 10 секунд; снятие показаний оптической плотности проводят при 405 нм в начальный момент времени t0 и затем каждые 5 минут в течение периода с 20- до 50-й минуты в соответствии с программой ферментативной кинетики.
Затем величины оптической плотности обрабатывают (программы Excel и Sigma Plot), сводят в таблицу и представляют на графике (линии регрессии).
Затем можно рассчитать отношение активности и определить активность неизвестного образца дефибротида в сравнении со стандартом с использованием той же самой системы расчета, которая описана выше.
В качестве примера далее приведены таблицы (1, 2 и 3) и графики (фигуры 3, 4 и 5), относящиеся к образцам дефибротида, испытанным при концентрации 0,5, 2,0 и 8,0 мкг/мл соответственно.
Дополнительно с учетом данных, представленных в таблицах 1, 2 и 3, мы рассчитали высвобождение пара-нитроанилина в мкМ/мин при действии плазмина на хромогенный субстрат в присутствии дефибротида.
Величины b, приведенные в таблицах 1, 2 и 3, иными словами, наклоны кинетических кривых представляют собой изменение поглощения в минуту, умноженное на 1000 (ΔО.Е./мин × 1000) (обычно исключительно с целью избежать цифр со знаками после запятой, для шкалы для спектрофотометрических измерений на фигурах 3, 4 и 5 вводили множитель 1000; вследствие этого действительные спектрофотометрические показания поглощения получают, деля b на 1000).
Из знания из литературы коэффициента молярной экстинкции для пара-нитроанилина (8270 М-1см-1 , что соответствует 0,00827 О.Е. на мкМ пара-нитроанилин) следует, что 1 мкМ пара-нитроанилин: 0,00827 (Поглощение) = Х мкМ пара-нитроанилин: Спектрофотометрическое показание (b/1000).
Таким образом мы рассчитали по предыдущим экспериментам количество высвобожденного пара-нитроанилина в микромолях и свели полученные значения в таблицу 4.
Корреляция между концентрацией дефибротида и высвобожденным пара-нитроанилином в мкМ представлена на соответствующем полулогарифмическом графике (фиг.6)
Линии регрессии, полученные путем корреляционного анализа для 5 повторов, описываются следующими уравнениями:
Повтор 1 пара-Нитроанилин в мкМ/мин = 0.7317+0.3820 logX
Повтор 2 пара-Нитроанилин в мкМ/мин = 0.6625+0.2907 logX
Повтор 3 пара-Нитроанилин в мкМ/мин = 0.6708+0.2741 logX
Повтор 4 пара-Нитроанилин в мкМ/мин = 0.6792+0.2907 logX
Повтор 5 пара-Нитроанилин в мкМ/мин = 0.7100+0.3323 logX
В более общем виде высвобождение пара-нитроаналина описывается уравнением:
pNA(мкМ/мин)=а+b logX,
где:
а=0.6908±0.0291 (Среднее ± Стандартное отклонение)
b=0.3140±0.0437 (Среднее ± Стандартное отклонение)
Х = концентрация дефибротида (мкг/мл)
или
а (отсекаемый отрезок) может варьировать от 0.6625 до 0.7317,
b (наклон) может варьировать от 0.2741 до 0.3820.
Реферат
Изобретение относится к биотехнологии. Способ основан на способности дефибротида увеличивать ферментативную активность плазмина и предусматривает стадии: а) приведения в контакт в реакционной среде дефибротида, плазмина и субстрата, специфичного для плазмина, который за счет реакции с плазмином обеспечивает измеряемый продукт, и b) измерения количества образовавшегося продукта в последовательных временных точках. Изобретение позволяет определять биологическую активность дефибротида в сравнении со стандартным эталоном с высокой точностью, с большой скоростью и воспроизводимостью. 8 з.п. ф-лы, 6 ил., 4 табл.

Комментарии