Производные 3-дезоксиолигосахаридов, способ их получения (варианты), промежуточные соединения и фармацевтическая композиция - RU2133752C1
Код документа: RU2133752C1
Описание
Настоящее изобретение относится к новым производным 3-дезоксиолигосахаридов, способам их получения и содержащим их фармацевтическим композициям.
Гепарин представляет собой полисахарид группы гликозаминогликанов, известных своими антикоагулирующими свойствами. Известно [I.Bjork и U.Lindahl, "Moleculer and Cellular Biochemistry", /1982/, Dr.W.Junk Publishers-Pays-Ba] , что коагуляция крови представляет собой сложное физиологическое явление. Некоторые стимулы, такие, как контактная активация и тканевые факторы, вызывают последовательную активацию ряда коагулирующих факторов, присутствующих в плазме крови. Какова бы ни была природа стимула, конечные стадии идентичны: активированный фактор X /Xa/ активирует фактор II /также называемый протромбином/, который в своей активированной форме /фактор IIа, также называемый тромбином/ вызывает частичный протеолиз растворимого фибриногена и высвобождением нерастворимого фибрина, образующего основу сгустка крови.
В нормальных физиологических условиях активность факторов коагуляции регулируется протеинами, такими, как антитромбин III /AT-III/ и кофактор II гепарина /HC-II/, которые также присутствуют в плазме. AT-III оказывает ингибирующее воздействие на некоторое число факторов коагуляции и особенно на факторы Xa и IIа.
Ингибирование фактора Xa или фактора IIа, следовательно представляет собой преимущественную возможность достижения антикоагулирующей и антитромботической активности, поскольку эти оба фактора принимают участие в двух последних этапах коагуляции, которые независимы от исходного стимула.
Пентасахарид формулы /a/:

I/R = -COCH3; /2/ R = -SO3-; представляет собой минимальную последовательность гепарина, требуемую для связывания с АТ-III. Это соединение /R = -SO3-/ получено около десятка лет назад путем полностью химического синтеза [P. Sinaij и др., Carbohydrate Research /1984/, 132, с. 5]. С тех пор в литературе было описано некоторое число синтетических олигосахаридов, полученных путем полностью химического синтеза и обладающих антитромботическими и антикоагулирующими активностями.
В европейском патенте ЕР-0084999 описываются производные, образованные моносахаридными единицами уроновых кислот [глюкуроновой или идуроновой] и глюкозамина и обладающие интересными антитромботическими свойствами. Кроме гидроксильных групп в качестве заместителей эти соединения содержат N-сульфатные группы, N-ацетильные группы и в некоторых случаях аномерные гидроксильные группы заменены метокси-группами.
В европейском патенте EP-0165134 также описываются синтетические олигосахариды, обладающие антитромботическими активностями. Эти соединения образованы моносахаридными единицами уроновых кислот и глюкозамина и содержит O-сульфатные или O-фосфатные группы. Производные уроновых кислот и глюкозамина, содержащие в положении 3 глюкозаминовой единицы O-сульфатную группу, также описаны в европейской заявке на патент EP-0301618. Эти соединения обладают улучшенными антитромботическими и антикоагулирующими свойствами. В европейской заявке на патент EP-0454220 описываются производные уроновых кислот и глюкозы, содержащие в качестве заместителей O-алкильные или O-сульфатные группы. Эти последние соединения также обладают антитромботическими и антикоагулирующими свойствами.
Сульфатированные гликозаминогликаноидные производные, в которых функциональные N-сульфатные, N-ацетатные или гидроксильные группы заменены алкоксильными, арилокси-, аралкилокси- или O-сульфатными группами, также описываются в европейской заявке на патент EP-0529715. Эти соединения обладают интересными антитромботическими свойствами. Эти последние также являются ингибиторами пролиферации гладких мышечных клеток.
Олигосахариды, и особенно пентасахариды, аналогичные минимальной последовательности гепарина, требуемой для связывания с AT-III, описаны в Angew. Chem. Int. Ed. Engl. /1993/, 32 /3/, с. 434-436. Эти соединения содержат единицы /звенья/ глюкуроновых кислот или глюкозы, гидроксильные функции которых заменены O-сульфатными или O-метильными группами.
В настоящее время найдено, что заменяя один или несколько гидроксильных радикалов или O-алкильных или O-сультфатных групп в положении 3 атомами водорода, в одной или нескольких сахаридных единицах, получают олигосахариды, обладающие интересными биологическими свойствами. В самом деле, соединения настоящего изобретения отличаются от других, описанных в литературе, синтетических гепариноидов своими оригинальными структурами и своими многочисленными и неожиданными биологическими свойствами. Соединения изобретения представляют собой 3-дезокси-олигосахариды, обладающие очень большой анти-факторной Xa активностью и большим сродством к AT-III. Кроме того, соединения изобретения хорошо адсорбируются в пищеварительном тракте. Следовательно, это продукты, которые могут вводиться перорально.
Более конкретно, предметом настоящего изобретения являются соединения
формулы /I/:
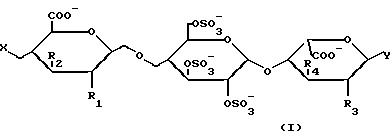
в которой X обозначает радикал -OS3-, радикал формулы /A/: R - O/A/, радикал формулы /B/:

или радикал формулы /C/:

Y обозначает радикал формулы /D/:

R обозначает линейный или разветвленный алкильный радикал с 1 - 6 C-атомами;
R1, R3, R5, R7, R8, R10, R12 и R13, одинаковые или разные, обозначают, каждый, гидроксильный радикал; линейный или разветвленный алкоксильный радикал с 1-6 C-атомами; или радикал -OSO3-;
R2, R4, R6, R9 и R11, одинаковые или разные, обозначают, каждый атом водорода; гидрксильный радикал, линейный или разветвленный алкоксильный радикал с 1-6 C-атомами; или радикал - -OSO3-; однако, при условии, что по крайней мере один из имеющихся заместителей R2, или R4, или R6, или R9, или R11 обозначает атом водорода;
в форме фармацевтически приемлемых солей или соответствующих кислот.
Впоследствии, термин
"моносахаридная единица" будет использоваться для
обозначения озидной единицы:

независимо от заместителей, которые будут связаны с этой единицей в положениях 2,3 или 5.
Что касается радикалов B, C и D то связь "

Соединения настоящего изобретения представляют собой производные 3-дезоксисахаридов.
Следовательно, нужно, чтобы по крайней мере одна из моносахаридных единиц, из которых образованы соединения изобретения, соответствовала структуре 3-дезоксимоносахарида.
Из этого следует, что в формуле /1/ по крайней мере один из заместителей R2, или R4, или R6, или R9, или R11 обозначает атом водорода.
Соединения формулы /I/, а которой R2 обозначает атом водорода, представляют собой предпочтительные продукты изобретения.
Предпочтительными продуктами настоящего изобретения также являются соединения формулы /I/, в которой X обозначает радикал формулы /B/ или радикал формулы /C/.
Эти соединения отвечают
следующим формулам /Ia/ и /Ib/:


в которых R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12 и R13 имеют такое же значение, что и в формуле /I/
Особенно предпочтительны соединения формулы /Ia/.
Соединения формулы /I/ и преимущественно таковые формул /Iа/ и /Ib/, в которых R1, R3, R5, R7, R8 и R10 и R13, одинаковые или разные, обозначают, каждый, линейный или разветвленный алкоксильный радикал с 1-6 C-атомами или -OSO3- - радикал; R2, R4, R6 и R9, одинаковые или разные, обозначают, каждый, атом водорода или линейный или разветвленный алкоксильный радикал с 1-6 C-атомами; R11 обозначает атом водорода, линейный или разветвленный алкоксильный радикал с 1-6 C-атомами или радикал - OSO3-; однако, при условии, что по крайней мере R2, или R4, или R6, или R9, или R11 обозначает атом водорода; R12 обозначает гидроксильный радикал или радикал -OSO3- , являются предпочтительными соединениями изобретения.
Преимущественно предпочтительны соединения формулы /I/ и особенно таковые формул /Iа/ и /Ib/, в которых R2 и R6 обозначает атом водорода; R3, R11 и R12 обозначают радикал -OSO3-; R13 обозначает линейный или разветвленный алкоксильный радикал с 1-6 C-атомами.
Преимущественно также предпочтительны соединения формулы /I/ и особенно таковые формул /Iа/ и /Ib/, в которых алкоксильный радикал представляет собой метокси-радикал.
Предметом настоящего
изобретения также
является способ получения соединений формулы /I/, отличающийся тем, что соединение формулы /II/:

в которой X' обозначает хлорацетокси-, левулинилокси-радикал, радикал формулы /A/, радикал формулы /B1/:

или радикал формулы /C1/:

P1, P2, P3 и P5, одинаковые или разные, обозначают, каждый, защитную группу, такую, как ациклический ацильный радикал с 1-6 C-атомами, предпочтительно ацетильный радикал; ароматический ацильный радикал, предпочтительно бензоильный радикал; алк-2-енильный радикал с 2-7 C-атомами, предпочтительно аллильный радикал; или бензильный радикал;
P4, P6, одинаковые или разные, обозначают, каждый, защитную группу, такую, как алкильный радикал с 1-6 C-атомами, предпочтительно метильный радикал; или бензильный радикал;
R'1, R'5, R'8, одинаковые или разные, обозначают, каждый, линейный или разветвленный алкоксильный радикал с 1-6 C-атомами; ациклический ацилокси-радикал с 1-6 C-атомами, предпочтительно ацетоксирадикал; ароматический ацилокси-радикал, предпочтительно бензоилокси-радикал; или алк-2-анилокси-радикал с 2-7 C-атомами, предпочтительно аллилокси-радикал;
R'7, R'10, одинаковые или разные, имеют указанные для R'1 значения; или они обозначают хлорацетокси- или левулинилокси-радикал;
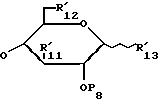
R'2, R'6 и R'9, одинаковые или разные, обозначают, каждый, атом водорода или имеют значения, указанные для R'1; вводят во взаимодействие с соединением формулы /III/:

в которой P7 имеет значения, указанные для P4 в формуле /II/;
P8 имеет значения, указанные для P1 в формуле /II/;
R'4 и R'11, одинаковые или разные, имеют те же значения, что и R'2 в формуле /II/; и
R'3, R'12 и R'13, одинаковые или разные, имеют значения, указанные для R'1 в формуле /II/;
для получения соединений формулы /IV/:
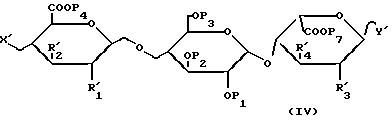
в которой X', P1, P2, P3, P4, R'1 и R'2 имеют такое же значение, что и указанное для формулы /II/;
P7, R'3 и R'4 имеют такое же значение, что и для формулы /III/;
Y' обозначает радикал формулы /D1/;
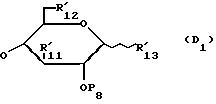
в которой P8, R'11, R'12 и R'13 имеют такое же значение, что и для формулы /III/;
которые затем подвергают либо каталитическому гидрированию, затем омылению и сульфатации; либо сначала омылению, затем сульфатации и после этого каталитическому гидрированию; либо сначала каталитическому гидрированию, затем сульфатации и после этого омылению, для получения соединения формулы /I/.
Вышеописанный способ представляет собой предпочтительный способ изобретения. Однако соединения формулы /I/ могут быть получены другими, известными из химии сахаров, способами, и особенно путем введения во взаимодействие моносахарида, содержащего защитные группы, такие, как описанные J. W. Gren b. Protective Groups in Organic Synthesis /Wiley, n.y. 1981/, у гидроксильных радикалов и в известных случаях у карбоксильных радикалов, если они имеются с другим защищенным моносахаридом для получения дисахарида, который затем вводят во взаимодействие со следующим защищенным моносахаридом для получения защищенного трисахарида, из которого можно получать защищенный тетрасахарид, затем защищенный пентасахарид и после этого защищенный гексасахарид [приближение "шаг за шагом"].
У защищенных олигосахаридов /тетра, пента и гексасахаридов/ затем удаляют защитные группы и в известных случаях их сульфатируют или сначала частично удаляют защитные группы, затем сульфатируют и затем удаляют защитные группы, для получения соединения формулы /I/.
Такие способы известны в химии углеводов и особенно описаны: G. Jaurand и др. в Bioorganic and Medicinal Chemistiy Letters, /1992/, 2 /N 9/, c. 897-900; J. Basten и др. b Bioorganic and Medicinal Chemistry Letters, /1992/, 2 /N 9/, c. 901-904; J. Basten и др., в Bioorganic and Mesicinal Chemisty Letters, /1992/, 2 /N 9/ c. 905-910, и M. Petitou и C.A.C. van Boeckel b "Cnemical Syntheses of heparin fragments and analogues" c. 203-210 - Progress in the Chemistry of Organic Natural Products. Ed. Springer Verlag Wien - n.y. /1992/.
Соединения
формулы /II/, когда X' обозначает радикал формулы /B1/, могут быть получены путем
введения во взаимодействие активированного по его
аномерному углероду моносахарида, как, например,
соединения формулы /V/:

в которой P5, R'5, R'6 и R'7 имеют указанные в формуле /B1/ значение; с соединением формулы /VI/:

в которой R'1, R'2, P1, P2 и P4 имеют указанное для формулы /II/ значение;
для получения таким образом соединения формулы /VII/:

в которой P5, R'5, R'6 и R'7 имеют указанное для формулы /V/ значение;
R'1, R'2, P1, P2 и P4 имеют указанное для формулы /II/ значение;
согласно способу, описанному T. Peters и др. в Can. J. Chem. /1989/, 67, c. 491-496; и G.H.Veeneman и J.H.van Boom в Tetrahedron Letters, /1990/, 31, c. 275-278.
Обрабатывая это соединение известными способами [R. Schmidt, Angew, Chem. Int. Ed. England /1986/, 25/3/, c. 212-235], и особенно путем ацетолиза, с помощью бензиламина, затем трихлорацетонитрила, получают соединения формулы /II/, в которой X' обозначает радикал формулы /B1/.
Получение некоторых соединений формулы /VII/ и особенно соединений, для которых R'2 и R'6 имеют указанные для R'1 значения, но не означают атома водорода, описано J. Basten и др., Bioorganic and Medicinal Chemistry Letters, /1992/, 2 /N 9/, c. 905-910.
Соединения формулы
/VII/ также могут быть получены путем введения во взаимодействие соединений формулы /VI/ с другими активированными
моносахаридами, например, с
соединениями формулы /V'/:

в которой P5, R'5 , R'6 и R'7 имеют указанное для формулы /V/ значение.
Соединения формулы /V'/, для которых R'6 имеет указанные для R'1 значения и не обозначает атома водорода, представляют собой известные соединения, описанные M. Petitou и C.A.A.van Boeckel в "Chemical Synthesis of heparin fragments and analogues", c. 203-210- Progress in the Chemistry of Organic Natural Products, Ed. Springer Verlag Wien- n.y. /1992/.
Соединения формулы /V/, в которой R'6 обозначает атом водорода, могут быть получены из
соединения формулы /VIII/:

в которой Bz обозначает бензоильный радикал.
Соединение формулы /VIII/ получают из 3-дезокси-β -D-рибогексопиранозы [полученной по методу T. V. Rajanbabu, описанному в J. Org. Chem. /1988/, 53, c. 4522-4530], которую подвергают воздействию бензоилхлорида в основном органическом растворителе. Таким образом, полученное соединение подвергают воздействию энантиола с целью получения соединений формулы /VIII/.
Соединения формулы /VI/, когда R'2 обозначает атом водорода, также могут быть получены из соединения формулы /VIII/, которое вводят во взаимодействие с 1,6: 2,3-ди-ангидро

в которой Bz обозначает бензоильный радикал.
Это соединение затем подвергают воздействию сильного основания для
получения 1,6:2,
3-ди-ангидридо-4-O-/3-дезокси-β
-D-рибогексопиранозил-β-D-маннопиранозы, соединения формулы /X/:

Из соединения формулы /X/ и при использовании классических способов [G. Jaurand и др., Bioorganic and Medicinal Chemistry Letters, /1992/, 2/ N 9/, c. 897-900; J. Basten и др., Bioorganic and Medicinal Chemistry Letters, /1992/, 2 /N 9/, с. 901-904; J. Basten и др., Bioorganic and Medicinal Chemistry Letters, /1992/, 2 /N 9/, c. 905-910; M. Petitou и C.A.C. van Boeckel "Chemical Synthesis of Heparin fradments and analagues" c.203-210 - Progress in the Chemistry of Organic Natural Products, Ed, Springer Verlag, Wien - n.y. /1992/].
получают соединения
формулы /XI/:
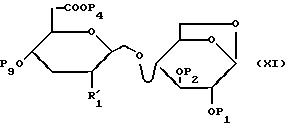
в которой R'1, P1, P2 и P4 имеют такое значение, как и указанное для формулы (VII);
P9 обозначает левулинильный или хлорацетильный радикал.
Соединение формулы /XI/ затем подвергают воздействию гидразина для получения соединений формулы /VI/, в которой R'2 обозначает атом водорода.
Соединения формул /IX/, /X/ и /XI/ являются новыми продуктами и также составляют часть изобретения.
Соединения формулы /VI/, для которых R'2 имеет указанные для R'1 значения и не обозначает атома водорода, могут быть получены аналогичным образом, используя в качестве исходных продуктов защищенные производные глюкозы, активированные на уровне их аномерного углерода, вместо соединений формулы /VIII/. Получение таких соединений описано M.Petitou и C.A.C. van Boeckel в "Chemical Synthesis of heparin fragments and analogues" с. 203-210 - Progress in the Chemistry of Organic Natural Products, Ed. Springer Verlag Wien-n. y. /1992/. Те же авторы описывают также аналогичное получение соединений формулы /IX/, содержащих в положении 3 защищенный гидроксильный радикал.
Соединения
формулы /II/, когда X' обозначает радикал
формулы /C1a
/:

в которой: R'5, R'6, R'8, R'9, R'10 , P5 и P6 имеют указанное для формулы /C1/ значение,
могут быть получены путем введения во взаимодействие соединения формулы /VI/ с соединением формулы /XIIa/:

в которой R'5, R'6, R'8 , R'9, R'10, P5 и P6 имеют указанное для формулы /C1/ значение; для получения соединения формулы /XIIIa/:

в которой:
R'5, R'6, R'8, R'9, R'10, P5 и P6 имеют указанное для формулы /C1/ значение; и
- R'1, R'2, P1, P2 и P4 имеют указанные для формулы /II/ значения.
Соединения формулы /XIIIa/ затем обрабатывают, как указано в случае соединения /VII/, с целью получения соединений формулы /II/, в которой X' обозначает радикал формулы /C1a /.
Соединения формулы /XIIa/, когда R'9 обозначает атом водорода, получают из соединений формулы /XIV/:
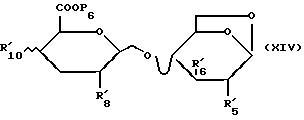
в которой R'5, R'6, R'8, R'10 и P6 имеют указанное для формулы /C1/ значение; которые подвергают ацетолизу, затем удаляют защитные группы и после этого подвергают воздействию трихлорацетонитрила. Соединения формулы /XIV/ могут быть получены из соединений формулы /X/ согласно способу, описанному для соединений формулы /XI/.
Соединения формулы /XIIa/, когда R'9 имеет указанные для R'1 значения и не обозначает атома водорода, получают из производных 1,6:2,3-ди-ангидро-4-O-/β-D-глюкопиранозил /-β-D-маннопиранозы согласно вышеописанному способу. Производные 1,6: 2, 3-ди-ангидро-4-O-/-β-D-глюкопиранозил/-β -D-маннопиранозы представляют собой известные продукты, описанные J.Basten и др. в Bioorganic and Medicinal Chemistry Letters /1992/, 2 /N 9/, с. 905-910.
Соединения формулы /II/,
когда X' обозначает радикал формулы /CIb/

в которой R'5, R'6 , R'8, R'9, R'10, P5 и P6 имеют указанное для формулы /C1/ значение, могут быть получены путем введения во взаимодействие соединения формулы /XIIb/:

в которой R'5, R'6, R'8, R'9, R'10, P5 и P6 имеют указанные для формулы /C1/ значения, с соединением формулы /VI/ для получения соединений формулы /XIIIb/:

в которой R'1, R'2, R'5, R'6, R'8, R'9, R'10, P1, P2, P4, P5 и P6 имеют указанные для формулы /XIIIа/ значения.
Соединения формулы /XIIIb/ затем обрабатывают, как указано для соединений формулы /XIIIа/, с целью получения соединений формулы /II/, в которой X' обозначает радикал формулы /C1b/.
Соединение формулы
/XIIb/, когда
R'9 обозначает атом водорода, могут быть получены из соединений формулы /X/. Это соединение превращают в соединение формулы /XV/:

согласно способу, эквивалентному таковому, описанному Ishikawa и др., в Carbohydrate Research, /1988/, 172, с. 37-64.
Из этого
соединения и при
использовании известных способов, описанных G. Jaurand и др. в Bioorganic and Medicinal Chemistry Letters /1992/ 2 /N 9/, с. 897-900; J. Basten и
др., в Bioorganic and
Medicinal
Chemistry Letters,
/1992/, 2 /N 9/, с. 901-904; J.Basten и др., в Bioorganic and Medicinal Chemistry Letters /1992, 2 /N 9/, с. 905-910; и M. Petitou и C.A.A. van
Boeckel "Chemical
Synthesis of
heparin fragment and
analogues" с. 203-210 - Progress in the Chemistry of Organic Natural Products, Ed. Springer Verlag Wien-n.y. /1992/; получают соединения формулы
/XVI/:
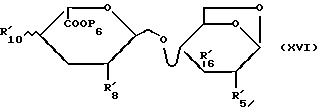
в которой R'5, R'6, R'8, R'10 и P6 имеют указанное для формулы /XIIb/ значение.
Эти соединения затем подвергают ацетолизу, после чего обрабатывают бензиламином и трихлорацетонитрилом, для получения соединений формулы /XIIb/.
Соединения формулы /XIIb/, для которых R'9 не обозначает атома водорода, но имеет указанные для R'1 значения, могут быть получены таким же образом.
Различные промежуточные соединения, позволяющие получать соединения формулы /ХIIb/, в которой R'5, R'6, R'8, R'10 , P5 и P6 имеют указанное для формулы /С1 / значение, а R'9 имеет указанные для R'1 значения и не обозначает атома водорода, представляют собой известные продукты, получение которых описано G. Jaurand и др. в Bioorganic and Medicinal Chemistry Letters /1992/, 2 /N9/, c. 897-900.
Соединения формулы /II/, когда X' обозначает радикал
формулы
/A/ и R'2
обозначает атом водорода, могут быть
получены из соединения формулы /X/, которое превращают в соединение формулы /XVII/:

Соединение формулы /XVII/ впоследствии либо обрабатывают бензилатом натрия, затем ацилируют; либо обрабатывают аралкилгалогенидом, предпочтительно бензилбромидом, алк-2-енилгалогендом, предпочтительно аллилбромидом, затем обрабатывают бензилатом натрия и после этого ацилируют, для получения соединений формулы /XVIII/:

в которой R'1, P1 и P2 имеют указанное для формулы /II/ значение.
Соединения формулы /XVIII/ затем обрабатывают
в кислой среде с целью получения соединений формулы /XIX/:

в которой R'1, P1 и P2 имеют указанные для формулы /II/ значения.
Соединения формулы /XIX/ затем подвергают селективному силилированию в положение 6', обрабатывают левулиновым ангидридом, окисляют согласно условиям Jones и этерифицируют до сложных эфиров с помощью алкилгалогенида, подвергают реакции удаления левулинильного радикала и алкилируют в кислой или нейтральной среде, для получения соединений формулы /II/, в которой X' обозначает радикал формулы /A/ и R'2 обозначает атом водорода.
Таким же образом могут быть получены соединения формулы /II/, когда X' обозначает радикал формулы /A/ и R'2 имеет указанные для R'1 значения. Промежуточные соединения, необходимые для получения этих соединений, описаны в литературе и особенно G.Basten и др. в Bioorganic and Medicinal Chemistry Letters, /1992/, 2 /N9/, с. 905-910; и С.А.А. van Boeckel и др. в J.Carbohydrate Chem. /1985/, 4, с.293.
Соединения формулы /III/, когда R'4 обозначает атом водорода, могут быть получены из соединений формулы
/XX/:

в которой R'3, R'11, P7 и P8 имеют указанные для формулы /III/ значения; и P10 обозначает левулинильный или хлорацетильный радикал.
Соединения формулы /XX/ подвергают ацетолизу, затем обрабатывают бензиламином, вводят во взаимодействие с реактивом Вильсмейера, обрабатывают спиртом в присутствии карбоната серебра и после этого подвергают воздействию гидразина, для получения целевых соединений формулы /III/ /R'4 = H/.
Соединения формулы /III/, когда R'4 имеет указанные для R'1 значения, представляют собой известные соединения. Получение таких соединений описано в литературе J. Basten и др. в Bioorganic and Medicinal Chemistry Letters, /1992/, 2 /N 9/, с. 905-910.
Вышеописанный способ позволяет получать соединения изобретения в форме солей. Для соединения соответствующих кислот соединения изобретения в форме солей вводят в контакт с катионообменной смолой в кислой форме.
Соединения изобретения в форме кислот затем можно нейтрализовать основанием для получения желательной соли.
Для получения солей соединений формулы /I/, можно использовать любое неорганическое или органическое основание, дающее с соединениями формулы /I/ фармацевтически приемлемые соли.
Предпочтительно используют гидроксид натрия, калия, кальция или магния. Натриевые и кальциевые соли соединений формулы /I/ являются предпочтительными солями.
Соединения формулы /I/, составляющие предмет настоящего изобретения, обладают интересными фармакологическими и биохимическими свойствами. Преимущественно они обладают высокой активностью анти-фактор Xa и высоким сродством к АТ-III.
Как это было указано выше, фактор Xa активирует в каскаде коагуляции протромбин в тромбин, который протеолизует растворимый фибриноген с высвобождением нерастворимого фибрина, образующего основу сгустка крови. Ингибирование фактора Xa, следовательно, представляет собой преимущественную возможность достижения антикоагулирующей и антитромботической активности.
Активность анти-фактор Xa [анти-Xa] продуктов изобретения оценивали при pH 8,4 согласно методу, описанному Teien A.N. и Lie M. в Thrombosis Research /1977/, 10, c. 399-410, и было показано, что продукты изобретения обладают активностью анти-Xa, равной или выше таковой уже известных синтетических гепариноидов.
Сродство соединений формулы /I/ к АТ-III определялось путем спектрофлуорометрии в условиях, описанных D.Atha и др. в Biochemistry, /1987/, 26, c. 6454-6461. Результаты опытов показали, что соединения изобретения обладают очень высоким сродством к АТ-III.
Кроме того, общую антитромботическую активность продуктов формулы /I/ оценивали на крысе, путем модели веностаза и индукции за счет тромбопластина, согласно методу, описанному J. Reyers и др. в Thrombosis Research /1980/ 18, с. 669-674. ЭД50 соединений изобретения по крайней мере того же порядка или ниже таковой других, уже известных синтетических гепариноидов. Соединения изобретения следовательно, обладают особенно интересными специфичностью действия и антикоагулирующей и антитромботической активностью.
Результаты, полученные во время различных фармакологических исследований, осуществленных с продуктами изобретения, показали, что они очень хорошо абсорбируются и их период полураспада большой. Это позволяет предусматривать, во время их использования в терапии, возможность ежедневного разового введения.
Эти исследования также показали, что продукты формулы /I/, составляющие предмет настоящего изобретения, абсорбируются пищеварительным трактом, причем вводимые количества не запрещены для использования в терапии человека. Соединения изобретения, следовательно, пригодны для приготовления фармацевтических композиций, вводимых также хорошо парентерально, как и перорально.
Соединения формулы /I/ очень малотоксичны; их токсичность вполне совместима с их использованием в качестве медикаментов.
Соединения изобретения также могут найти свое применение при лечении пролиферации гладких мышечных клеток, поскольку показано, что они проявляют ингибирующий эффект, в заметной степени выше такого гепарина, в отношении роста гладких мышечных клеток.
Соединения изобретения также эффективны в отношении ангиогенеза и пригодны для лечения некоторых инфекций, вызванных ретровирусами.
Кроме того, соединения изобретения оказывают также защитное и регенерирующее воздействие на нервные волокна.
Соединения изобретения очень стабильны, следовательно, таким образом особенно пригодны в качестве действующего начала медикаментов.
Изобретение также распространяется на фармацевтические композиции, содержащие в качестве действующего начала соединение формулы /I/ или одну из его фармацевтически приемлемых солей, в известных случаях в ассоциации с одним или несколькими соответствующими и инертными эксципиентами.
Таким образом полученные фармацевтические композиции предпочтительно находятся в различных формах, таких, как например, растворы для инъекции или питья, драже, таблетки или желатиновые капсулы с лекарством. Растворы для инъекции представляют собой предпочтительные фармацевтические формы.
Фармацевтические композиции, содержащие в качестве действующего начала по крайней мере одно соединение формулы /I/ или одну из его солей, особенно пригодны для лечения, в качестве предохранительного или лечебного средства, заболеваний стенок сосудов, таких, как атеросклероз и артериосклероз; состояний гиперкоагулируемости, наблюдаемых, например, вследствие хирургических операций, роста опухолей или нарушений коагуляции, вызванных вирусными бактериальными или ферментативными активаторами.
Дозировка может изменяться в широких пределах в зависимости от возраста, веса и состояния здоровья пациента, природы и тяжести заболевания, также, как пути введения. Эта дозировка включает введение одной или нескольких доз около 0,5 кг - 1000 мг в день, предпочтительно 1-100 мг в день, например, порядка 20 мг в день, внутримышечно или подкожно, причем введения осуществляют периодически или в регулярные интервалы, или суточная доза составляет порядка 200-1000 мг в день перорально.
Эти дозы, естественно, могут быть подобраны для каждого пациента в зависимости от наблюдаемых результатов и предварительно осуществляемых анализов крови. Предпочтительным путем введения является подкожный путь введения.
Изобретение иллюстрируется нижеприведенными примерами.
Получения
Получение
I
Этил-2,4,
6-три-O-бензоил-3-дезокси-1-тио-D-рибогексопиранозид [соединение формулы /VIII/].
Стадия А: 1,2,4,6-тетра-O-бензоил-3-дезокси-β-D-рибогексопираноза 66 моль 3-дезокси-1,2: 5, 6-ди-O-изопропилиден-D-рибогексофуранозы [T.V.Rajanbabu, J. Org.Chem. /1988/, 53, с. 4522-4530] в виде раствора в смеси воды с этанолом и в присутствии кислой смолы Doweх нагревают в течение 4 часов при 60oC для получения 3-дезокси-D-рибогексопиранозы. Выпаривают досуха, затем высушивают, выпаривая в присутствии пиридина.
Таким образом полученный сироп растворяют в 150 мл пиридина и добавляют 356 ммоль бензоилхлорида. Оставляют при перемешивании в течение 3 часов при комнатной температуре. Выпаривают досуха, разбавляют дихлорметаном, промывают водой и кристаллизуют из этилацетата с получением 7,66 г 1,2,4,6-тетра-O-бензоил-3-дезокси-β -D-рибогексопиранозы. Выход = 30%. Т. пл. 164oC. [α] = +1o /c = 1, 33, CH2Cl2/.
Стадия Б:
4,51 ммоль полученного в
предыдущей стадии соединения
растворяют в безводном толуоле и в атмосфере аргона при 20oC,
затем добавляют 9,03 ммоль
этантиола. Добавляют 4,51 ммоль трифторида бора в виде раствора в
диэтиловом эфире и оставляют при
перемешивании в течение 3 часов. После промывки водой выпаривают досуха
и полученный остаток в виде
сиропа очищают на колонке с диоксидом кремния. Таким образом
получают 1,64 г смеси аномеров α
и β этил-2,4,
6-три-O-бензоил-3-дезокси-1-тио-D-рибогексопиранозида. Это соединение
используют без осуществления другой очистки. Выход = 70%.
Получение II
Этил-2,4,
6-три-O-бензил-3-дезокси-1-тио-D-рибогексопиранозид [соединение формулы /V/].
5,82 ммоль полученного в получении I соединения растворяют в смеси метанола с дихлорметаном /1:1 по объему/. Добавляют 0,90 ммоль метилата натрия. Реакционную смесь оставляют при перемешивании в течение 3 часов при 20oC, затем нейтрализуют с помощью кислой смолы Dowex /AG 50 WX 2/. Отфильтровывают и выпаривают досуха. Остаток растворяют в 18 мл безводного диметилформамида, затем, при 0oC, добавляют 19,7 ммоль гидрида натрия и 17,0 ммоль бензоилбромида. Оставляют при перемешивании в течение 2 часов, затем добавляют 34,1 ммоль метанола. Реакционные растворители выпаривают и очищают на колонке с диоксидом кремния, получая 2,12 г целевого продукта в виде смеси аномеров. Выход: 76%.
Получение III
1,6:2,3-Ди-ангидро-4-O-/2,4,
6-три-O-бензоил-3-дезокси-β-D-рибогексопиранозил/-β
-D-маннопираноза [соединение формулы
/IX/].
Согласно методу, описанному G.H.Veeneman и J.H.Boom в Tetrahedron Letters
/1990/, 31, с. 275-278, при -20oC, 8,53 ммоль продукта
из получения I и 7,25 ммоль 1,6:2,
3-ди-ангидро-β-D-маннопиранозы растворяют в 220 мл толуола в присутствии молекулярного сита
и 21,3 ммоль N-иодсукцинимида, затем добавляют по каплям 1,7 ммоль
0,04 М раствора
трифторметансульфокислоты. Оставляют реакционную среду при перемешивании в течение 2,5 часов, отфильтровывают и
очищают на колонке с диоксидом кремния, получая 3,07 г 1,6:2,
3-ди-ангидро-4-O-/2,
4-три-O-бензоил-3-дезокси-β-D-рибогексопиранозил/-β-D-маннопиранозы. Кристаллизуют из смеси этилацетата
с гексаном /90:10 по объему/. Выход = 65%. Т.пл. = 153oC. /α
/
Получение IV
1,6:2,3-Ди-ангидро-4-O-/3-дезокси-β-D-рибогексопиранозил/ -β-D-маннопираноза [соединение формулы /X/].
1,6:2,3-Ди-ангидро-4-O-/2,4,
6-три-O-бензоил-3-дезокси-β
-D-рибогексопиранозил/-β-D-маннопиранозу подвергают дебензоилированию с помощью метилата натрия, получая 1,6:2,
3-ди-ангидро-4-O-/3-дезокси-β
-D-рибогексопиранозил/-β
-D-маннопиранозу. Выход = 95%. /α/
Получение V
3-O-Ацетил-1,6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-β
-D-рибогексопиранозилуронат/-β-D-глюкопираноза
[соединение
формулы /VI/] .
Это соединение получают из 1,6:2,3-ди-ангидро-4-O-/3-дезокси-β-D-рибогексопиранозил/-β
-D-маннопиранозы, соединения, описанного в получении
IV, используя
способы, аналогичные
таковым, уже описанным M. Petitou и C. A.A. van Boeckel в "Chemical Synthesis of heparin fragment and
analogues" с. 203-210. - Progress in the Chemistry of
Organic Natural
Products, Ed. Springer
Verlag Wien - n.y. /1992/, а именно: получение 1,6:2,3-ди-ангидро-4-O-/3-дезокси-4,
6-O-изопропилиден-β-D-рибогексопиранозил /-β-D-маннопиранозы,
реакция с
бензилатом натрия,
ацетилирование, удаление изопропилиденового радикала с помощью уксусной кислоты,
силилирование, реакция с левулиновым ангидридом, окисление в условиях Jones,
этерификация
до сложного эфира с помощью
бензилбромида, и затем обработка гидразином.
Различные стадии
указаны ниже:
Стадия А:

К раствору 1,6:2,3-ди-ангидро-4-O-/3-дезокси-β -D-рибогексопиранозил-β-D-маннопиранозы в диметилформамиде /5 ммоль в 35 мл/ в атмосфере аргона прикапывают 1,5 ммоль п-толуолсульфокислоты /также может быть использована камфосульфокислота/ и 250 ммоль 2,2-диметоксипропана. Оставляют при перемешивании в течение 2,5 часов, затем добавляют 1,8 ммоль триэтиламина. Разбавляют дихлорметаном, промывают водой, сушат над безводным сульфатом натрия, отфильтровывают и выпаривают досуха, получая 1,6: 2, 3-ди-ангидро-4-O-/3-дезокси-4,6-O-изопропилиден -β- D-рибогексопиранозил/ -β- D-маннопиранозы. Это соединение используют в следующей стадии без осуществления очистки. Выход = 81%.
Стадия Б:

К 5,0 ммоль полученного на стадии А соединения добавляют 25 ммоль бензилата натрия /1М раствор в бензиловом спирте/. В течение 30 минут нагревают при 110oC. Охлаждают, нейтрализуют с помощью кислой смолы Dowex /AG 50 WX 2/, отфильтровывают и удаляют бензиловый спирт путем выпаривания под вакуумом. Остаток очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь толуола с ацетоном /3:1 по объему/. Целевой продукт получают в виде сиропа. Выход = 81%.
Стадия В

4,90 ммоль полученного в стадии Б соединения растворяют в 22 мл дихлорметана, охлажденного до 0oC, и добавляют 19.6 ммоль уксусного ангидрида, 1,96 ммоль 4-диметиламинопиридина и 9,81 ммоль триэтиламина. При комнатной температуре и в течение 45 минут реакционную смесь перемешивают. Добавляют метанол и выдерживают при перемешивании еще в течение 30 минут. Затем реакционную среду разбавляют дихлорметаном, промывают водным раствором KHSO4, затем водой, сушат над безводным сульфатом натрия, выпаривают досуха, получая целевой продукт в виде сиропа. Затем очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь толуола с ацетоном /9:1 по объему/.
Выход = 85%.
Стадия Г

4,11 ммоль полученного в предыдущей стадии соединения растворяют в 2,2 мл 1,1-дихлорэтана и добавляют 123 мл водного раствора уксусной кислоты /70%/. Оставляют при перемешивании в течение 35 минут при 50oC. Концентрируют, добавляют толуол и выпаривают, получая целевой продукт в виде сиропа. Очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с ацетоном /1:1 по объему/. Выход = 90%.
Стадия Д:

3,61 ммоль полученного в стадии Г соединения растворяют в 3,3 мл дихлорметана и добавляют 1,42 ммоль 4-диметиламинопиридина, 10,82 ммоль триэтиламина и 5,41 ммоль трет.-бутилдиметил-силил-хлорида. Оставляют при перемешивании в течение около 1 часа при 20oC, затем добавляют 43 мл безводного дихлорметана и 10,8 ммоль левулинового ангидрида. Оставляют при перемешивании в течение 2 часов, затем добавляют 150 мл дихлорметана, промывают сначала водным раствором KHSO4, затем водным раствором NaHSO4, сушат над безводным сульфатом натрия, отфильтровывают и выпаривают вплоть до получения коричневого сиропа. Продукт используют таким, какой есть в последующей стадии.
Стадия
E:

2,51 г полученного в предыдущей стадии сиропа растворяют в 26 мл ацетона, охлажденного до 0oC, затем добавляют 9,56 ммоль триоксида хрома и 4,2 мл 3, 5 М раствора серной кислоты. Оставляют при перемешивании при комнатной температуре в течение 4 часов. Затем добавляют 250 мл дихлорметана, промывают водой, сушат над безводным сульфатом натрия, отфильтровывают и выпаривают вплоть до получения коричневого сиропа.
Стадия Ж:
Получение 3-O-ацетил-1,
6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-4-O-левулинил-β-D-рибогексопирано-зилуронат/


2,15 г полученного в предыдущей стадии продукта растворяют в 22 мл безводного диметилформамида и в атмосфере аргона добавляют 7,22 ммоль бикарбоната калия и 10,83 ммоль бензилбромида. Оставляют при перемешивании в течение 3 часов, затем добавляют 0, 5 мл метанола и выдерживают при перемешивании в течение 1 часа при комнатной температуре. Реакционную смесь разбавляют этилацетатом, промывают водой, сушат над безводным сульфатом натрия, отфильтровывают и выпаривают вплоть до получения коричневого сиропа. Общий выход стадий Д, Е, Ж = 81%.
Стадия З:

3,61 ммоль 3-O-ацетил-1, 6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-4-O-левулинил-β-D-рибогексопиранозилуронат-β -D-глюкопиранозы, соединения, полученного в стадии Ж, растворяют в 13 мл пиридина. Охлаждают до 0oC и добавляют 18,1 ммоль гидразина [1М раствор в смеси пиридина с уксусной кислотой /3: 2 по объему/]. Реакционную смесь оставляют при перемешивании в течение 15 минут при комнатной температуре. Концентрируют, добавляют дихлорметан, промывают водным раствором KHSO4, затем водой и после этого водным раствором NaHCO3 и снова водой. Сушат над сульфатом натрия, отфильтровывают и выпаривают досуха, получая коричневый сироп. 3-O-Ацетил-1, 6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/-β -D-глюкопиранозу очищают на колонке с диоксидом кремния, используя в качестве растворителя смесь циклогексана с ацетоном /2:1 по объему/.
Выход = 86%. /α/
Получение VI
O-/Бензил-2-O-ацетил-3-дезокси-4-O-левулинил-β-D-рибогексопиранозилуронат/-/1--->4/-3,
6-ди-O-ацетил-2-O-бензил-D- глюкопиранозил/-трихлорацетимидат [соединение формулы /XIIa/].
Это соединение получают из 3-O-ацетил-1,
6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-4-O-левулинил-β-D-рибогексопиранозилуронат/-β-D-глюкопиранозы, соединения,
описанного в получении V, согласно известным методам,
а
именно ацетолиза, удаления аномерных защитных групп и получения имидата. Различные стадии приводятся ниже:

К 1,02 ммоль полученного в получении V продукта добавляют 102 ммоль уксусного ангидрида и 10,2 ммоль трифторацетамида. Смесь оставляют при перемешивании и в атмосфере аргона в течение 2 часов. Затем выпаривают вплоть до получения коричневого сиропа и очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом /2:3 по объему/.
Стадия Б:

1, 52 ммоль полученного в предыдущей стадии соединения растворяют в дихлорметане и добавляют 57,9 ммоль бензиламина. Оставляют при перемешивании в течение 4 часов при комнатной температуре, затем оставляют при -20oC в течение ночи. Добавляют диэтиловый эфир и промывают с помощью водного 1н. раствора соляной кислоты. Экстрагируют дихлорметаном, сушат над безводным сульфатом натрия и выпаривают вплоть до получения коричневого сиропа. Очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь толуола с ацетоном /5:1 по объему/.
Стадия В:

Используют 0,246 ммоль дисахарида, полученного в предыдущей стадии, в виде раствора в дихлорметане. В атмосфере аргона, добавляют 0, 39 ммоль карбоната калия и 1,23 ммоль трихлорацетонитрила. Оставляют при перемешивании в течение 16 часов, отфильтровывают и выпаривают досуха. O-/Бензил-2-O-ацетил-3-дезокси-4-О-левулинил-β -D-рибогексопиранозилуронат/-/1--->4/-3,6-ди-О-ацетил-2-О-бензил-D-глюкопиранозил/-трихлорацетимидат получают в виде смеси аномеров. Выход = 62% /общий/.
Получение VII
1,6: 2,3-Ди-ангидро-4-О-/3-дезокси-α-β-рибогексопиранозил/-β- D-маннопираноза [соединение формулы
/XV/ - смесь
глюко и идо].
Стадия A
1,6:2,
3-Ди-ангидро-4-О-/3-дезокси-6-идо-β-D-рибогексопиранозил/-β-D-маннопираноза.
К раствору 1,6: 2, 3-ди-ангидро-4-О-/3-дезокси-β-D-рибо-гексопиранозил/-β -D-маннопиранозы /22,81 ммоль/ в 400 мл смеси дихлорметана с ацетонитрилом добавляют 68,43 ммоль трифенилфосфина, 68,43 ммоль имидазола и 29,65 ммоль иода. Оставляют при перемешивании при 70oC в течение 4 часов. Раствор выпаривают и таким образом полученный сироп очищают на колонке с диоксидом кремния, используя в качестве растворителя смесь дихлорметана с ацетоном /10: 1 по объему/. Таким образом получают 1,6:2,3-ди-ангидро-4-О-/3-дезокси-6-идо-β--D-рибогексопиранозил/-β -D-маннопиранозу. Выход = 72%.
Стадия Б:
23,4 ммоль 1,6:2,
3-Ди-ангидро-4-О-/3-дезокси-6-идо-β-D-рибогексопиранозил/-β-D-маннопиранозы растворяют в 150 мл
метанола и добавляют
42 ммоль метилата натрия в виде раствора в метаноле /1М/. Смесь
нагревают в течение 9 часов при 80oC, охлаждают и очищают на колонке с Сефадексом LH-20, элюируя
смесью дихлорметана с
метанолом /1:1 по объему/. Таким образом получают 1,6:2,
3-ди-ангидро-4-О-/3-дезокси-5,6-экзо-метилен-β-D-рибогексопиранозил/-β-D-маннопиранозу. 13,3 ммоль этого
соединения растворяют в
100 мл тетрагидрофурана и при 20oC
прикапывают
54,4 ммоль диборана в виде раствора в тетрагидрофуране. Оставляют в течение 2 часов при перемешивании, затем
добавляют 65,28 ммоль этанола.
Оставляют при перемешивании в течение 1 часа,
затем
добавляют 24 мл 3М раствора гидроксида натрия и 24 мл 30%-ного раствора пероксида водорода. Нагревают до 50oC, нейтрализуют с помощью
кислой смолы Dowex /AC 50WX4/ и выпаривают
досуха,
получая 1,6: 2,3-ди-ангидро-4-О-/3-дезокси-α-D-рибогексопиранозил/-β-D-маннопиранозу в виде смеси
глико- и идодисахаридов. /1:6,
25/.
Получение VIII
3-О-Ацетил-1,
6-ангидро-2-О-бензил-4-О-/бензил-2-О-ацетил-3-дезокси-4-О-левулинил-α
-L-ликсо-гексопиранозилуронат/-β-D-глюкопираноза
[соединение формулы /XVI/].
3-О-Ацетил-1, 6-ангидро-2-О-бензил-4-О-/бензил-2-О-ацетил-3-дезокси-4-О-левулинил-α -L-ликсо-гексопиранозилуронат/

Различные стадии
приводятся ниже:
Стадия А:

3,6 ммоль 1,6:2, 3-Ди-ангидро-4-О-/3-дезокси-α -D-рибогексопиранозил/-β-D-маннопиранозы растворяют в 25 мл диметилформамида и добавляют 21,64 ммоль диметоксипропана и 3,96 ммоль п-толуолсульфокислоты /также может быть использована камфосульфокислота/. Оставляют при перемешивании в течение 1,5 часов и вводят 5,94 ммоль триэтиламина. Концентрируют вплоть до получения сиропа и очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь толуола с этилацетатом /2:3 по объему/. Выход = 70%.
Стадия Б:

К 6,81 ммоль полученного в стадии А соединения добавляют 29,7 ммоль бензилата натрия в виде раствора в бензиловом спирте /1М/. Нагревают при 110oC и при перемешивании в течение 1 часа. Затем разбавляют с помощью 200 мл дихлорметана, после чего нейтрализуют с помощью кислой смолы Dowex /AG 50WX4/, отфильтровывают и выпаривают под вакуумом, получая коричневый сироп. Очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь дихлорметана с ацетоном /10:1 по объему/. Выход = 85%.
Стадия В:

5,76 ммоль полученного в стадии Б соединения растворяют в дихлорметане и добавляют 3,92 ммоль 4-диметиламинопиридина, 72,27 ммоль триэтиламина и 65,7 ммоль уксусного ангидрида. Оставляют при перемешивании при комнатной температуре в течение 2,5 часов, затем добавляют 100 мл дихлорметана, промывают водным 10%-ным раствором KHSO4, сушат над безводным сульфатом натрия, затем отфильтровывают. Концентрируют и очищают таким образом полученный сироп на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь дихлорметана с ацетоном /10:1 по объему/. /α/
Стадия Г:
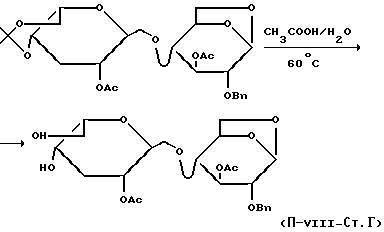
К 5,74 ммоль полученного в стадии В соединения добавляют 25 мл водного 70%-ного раствора уксусной кислоты. Нагревают при 80oC в течение 6 часов. Концентрируют за счет выпаривания в присутствии толуола, получая порошок желтого цвета.
Стадия Д:


Сокращения к реакционной схеме:
DMAP = 4-диметиламинопиридин; tBOMSCl = трет.-бутил-диметилсилилхлорид; BnBr = бензилбромид; LevO2 = левулиновый ангидрид; DMF - диметилформамид; Bn = бензильный радикал; Ac = ацетильный радикал, Lev = левулинильный радикал; tBDMSi = трет.-бутил-диметил-силильный радикал.
Используя полученный в предыдущей стадии продукт, поступая как описано в получении V, стадии Д, Е и Ж, получают 3-O-ацетил-1, 6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-4-O-левулинил-α-L-ликсо-гексопиранозилуронат/-β-D-глюкопиранозу. Общий выход: 59%.
Получение
IX
Метил-3,
6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-α-L-ликсо-гексопиранозилуронат/-β-D-глюкопиранозид [соединение формулы /III/].
Полученный в получении VIII дисахарид подвергают ацетолизу, обрабатывают с помощью бензиламина, вводят во взаимодействие с реактивом Вильсмейера, затем с метанолом в присутствии карбоната серебра. Затем полученное соединение обрабатывают с помощью гидразина, получая метил-3,6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-α-L-ликсо-гексопиранозилуронат/

Различные стадии приводятся ниже:
Стадия А

К 1,02 ммоль полученного в получении VII дисахарида добавляют 102 ммоль уксусного ангидрида и 10,2 ммоль трифторуксусной кислоты, нагревают при 50oC в течение 2 часов в атмосфере аргона. Затем выпаривают вплоть до получения коричневого сиропа и очищают как описано в получении VI, стадия А, получая целевой продукт. Выход = 92%.
Стадия Б:
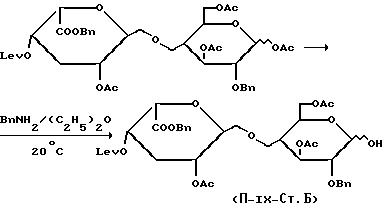
1,52 ммоль полученного в стадии А соединения растворяют в безводном диэтиловом эфире и добавляют 57,9 ммоль бензиламина. Поступают как описано в стадии Б получения VI, получая целевой продукт. Выход = 70%.
Стадия В:
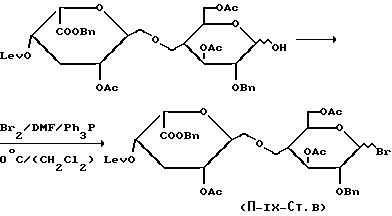
Готовят реактив Вильсмейера, смешивая, при 0oC, 2,15 ммоль брома с 2,15 ммоль трифенилфосфина в 5 мл диметилформамида. Осадок белого цвета отфильтровывают в атмосфере аргона и добавляют, поддерживая ту же температуру, 0,269 ммоль полученного в стадии Б продукта в виде раствора в 15 мл безводного дихлорметана. Оставляют реакционную смесь при перемешивании в течение 2 дней при комнатной температуре. Затем разбавляют дихлорметаном, промывают водой, охлажденной до 0oC, вплоть до достижения pH 6, сушат над безводным сульфатом натрия и концентрируют вплоть до получения сиропа. Очищают на колонке с диоксидом кремния, используя смесь дихлорметана с диэтиловым эфиром /5:1 по объему/. Выход = 77%.
Стадия Г:

0,46 мл метанола, 0,34 ммоль карбоната серебра и 150 мг сульфата кальция в 3 мл дихлорметана смешивают в течение 1 часа в атмосфере аргона при 0oC. 0,227 ммоль полученного в стадии В соединения растворяют в 8 мл дихлорметана. Этот раствор прикапывают к реакционной смеси и оставляют при перемешивании в течение 20 часов при 20oC. Защищают от света. Затем разбавляют дихлорметаном, отфильтровывают и концентрируют, получая метил-3,6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-4-O-левулинил-α-L-ликсо-гексопиранозилуронат/-β-D-глюкопиранозид в виде сиропа. Очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь дихлорметана с диэтиловым эфиром /5:1 по объему/. Выход = 75%. /α/
Стадия Д:

0,276 ммоль полученного в предыдущей стадии продукта растворяют в 2 мл охлажденного до 0oC пиридина и добавляют 1,38 мл 1М раствора гидразингидрата в смеси пиридина с уксусной кислотой /3:2 по объему/. Затем реакционную смесь концентрируют, добавляют метиленхлорид, промывают водным раствором KHSO4, сушат над безводным сульфатом натрия, отфильтровывают и концентрируют вплоть до получения сиропа. Очищают на колонке с диоксидом кремния, используя смесь дихлорметана с диэтиловым эфиром /3:1 по объему/. Выход = 87%.
/α/
Получение X
O-/2,4,6-Три-O-бензил-3-дезокси-α-D-рибогексопиранозил-/1--->4/-/O-бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/-/1--->
4/-3-O-ацетил-1,6-ангидро-2-O-бензил-β-D-глюкопираноза /соединение формулы /VII/./.
2,03 ммоль Этил-2,4,6-три-O-бензил-3-дезокси-1-тио-D-рибогексопиранозида /получение II/ и 1, 69 ммоль 3-O-ацетил-1,6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/-β-D-глюкопиранозы /получение V/ растворяют в 2,03 ммоль дихлорметана, при 20oC добавляют молекулярное сито, затем, 5,07 ммоль трифторметансульфоната серебра и 1,52 ммоль брома. Оставляют при перемешивании в течение 45 минут и затем, реакционную смесь отфильтровывают, промывают водой, выпаривают досуха. Очищают на колонке с диоксидом кремния, получая целевой продукт. Выход = 35%.
Получение XI
O-/6-O-Ацетил-2,
4-ди-O-бензил-3-дезокси-α
-D-рибогексопиранозил/-/1--->4/-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/-/1--->4/-3,6-ди-O-ацетил-2-O-бензил-β
-D-глюкопиранозил-трихлорацетимидат
[соединение формулы /II/].
0,51 ммоль полученного в получении X соединения в виде раствора в смеси трифторуксусной кислоты с уксусным ангидридом подвергают ацетолизу, затем обрабатывают бензиламином в диэтиловом эфире, после этого обрабатывают трихлорацетонитрилом в дихлорметане в присутствии карбоната калия, получая целевой продукт. Выход = 50%.
Пример 1.
Метил-O-/3-дезокси-2,4,6-три-O-сульфо-α-D-рибогексопиранозил/-/1--->4/-O-/3-дезокси-2-O-сульфо-β -D-рибо-гексопиранозилуронат/-/1--->4/-O-/2,3, 6-три-O-сульфо-α-D-глюкопиранозил/-/1--->4/-O-/3-дезокси-2-O-сульфо-α-D-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфо-β-D-глюкопиранозид, тридека-кис-натриевая соль.
Стадия А
Метил-O-/6,О-ацетил-2,4-O-бензил-3-дезокси-α-D-рибогексопиранозил/-/1--->
4/-O-/бензил-2-O-ацетил-3-дезокси-β
-D-рибогексопиранозилуронат/-/1--->4/-O-/3,6-ди-O-ацетил-2-O-бензил-α-D-глюкопиранозил/-/1--->
4/-O-/бензил-2-O-ацетил-3-дезокси-α
-L-ликсо-гексопиранозилуронат/-/1--->
4/-O-ацетил-2-O-бензил-β-D-глюкопиранозид. 0,121 ммоль описанного в получении XI соединения и 0,093
ммоль соединения из получения IX растворяют в 3,
2 мл дихлорметана. Охлаждают до -20oC в присутствии молекулярного сита и, в атмосфере аргона, добавляют 0,470 мл раствора
триметилсилилтрифторметансульфоната в дихлорметане. Оставляют при
перемешивании при -20oC в
течение 1 часа, затем реакционную среду отфильтровывают, промывают водой, выпаривают и очищают
на колонке с Сефадексом 1.Н-20, используя в качестве растворителя
смесь дихлорметана с метанолом /1:1 по
объему/, затем на колонке с диоксидом кремния, используя в качестве растворителя смесь
циклогексана с этилацетатом /3:2 по объему/, получая целевой продукт.
Выход = 62%.
Стадия Б:
0,052 ммоль полученного в предыдущей стадии продукта растворяют в смеси
дихлорметана /0,43 мл/ с метанолом /1,7 мл/. Затем добавляют 85 мг 10%-ного
палладия-на-угле и смесь оставляют на 4 часа
при 20oC и при небольшом давлении водорода. Отфильтровывают и
выпаривают досуха, получая метил-O-/6-O-ацетил-3-дезокси-α
-D-рибогексапиранозил/-/1--->
4/-O-/2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуроновая кислота /-/1--->4/-O-/3,
6-ди-O-ацетил-α-D-глюкопиранозил/-/1--->
4/-O-/2-O-ацетил-3-дезокси-α
-L-ликсо-гексопиранозилуроновая кислота /-/1--->4/-3,6-ди-O-ацетил-β--D-глюкопиранозид. Это
соединение растворяют в 0,96 мл этанола, охлаждают до
0oC, затем добавляют 0,30 мл
5М гидроксида натрия. Оставляют при перемешивании при 0oC в течение 5 часов, очищают на
колонке с Сефадексом G-25, используя в качестве элюирующего
средства воду. Выпаривают досуха, получая
метил-O-/3-дезокси-α--D-рибогексопиранозил/-/1--->4/-O-/-3-дезокси-β
-D-рибо-гексопиранозилуроновая кислота /-/1--->
4/-O-/-α
-D-глюкопиранозил/1/1--->
4/-O-/3-дезокси--α-L-ликсо-гексопиранозилуроновая кислота -/1--->4/-β
-D-глюкопиранозид.
Это соединение растворяют в 5 мл диметилформамида, выпаривают досуха, затем снова, в атмосфере аргона, растворяют в 2,6 мл безводного диметилформамид. Добавляют 302 мг комплекса триоксид серы - триэтиламин и в течение 20 часов при 55oC перемешивают. Реакционную смесь охлаждают, добавляют 491 мг бикарбоната натрия в виде водного раствора и оставляют при перемешивании в течение 3 часов. Очищают на колонке с Сефадексом G-25, используя в качестве растворителя воду, затем лиофилизуют, получая метил-O-/3-дезокси-2,4-6-три-O-сульфо-α -D-рибогексопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α-D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-α -L-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфо-β-D-глюкопиранозид, тридека-кис-натриевая соль. Выход = 65%.
/α
/
/α/
Спектр ядерного протонного магнитного резонанса: /500 МГц, растворитель D2O/: H 1: 4,78 м.д., J1-2 = 7,2 Гц; H'1 : 5,22 м.д., J1'-2':1,8 Гц; H'' 1: 5,26 м.д., J1''-2''=3,5 Гц; H'''1: 4,78 м.д., J1'''-2'''=5,4 Гц; H'''': 5,16 м.д., J1''''-2'''' =3,3 Uц.
Пример 2.
Метил-O-/3-дезокси-2,4, 6-три-O-сульфо-α -D-рибогексопиранозил/-/1--->4/-O-/3-дезокси-2-O-сульфо-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α -D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-метил-α-L-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 66-три-O-сульфо-β-D-глюкопиранозид, додека-кис-натриевая соль.
Это соединение получают из
O-/6-O-ацетил-2,4-ди-O-бензил-3-дезокси-α-D-рибогексопиранозил/-/1--->
4/-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат
/-/1--->4/-3,
6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетимидата и метил --3,
6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-метил-3-дезокси -α
- L-ликсо-гексопиранозиларонат/-β-D-глюкопиранозида
согласно способу, описанному в примере 1. Метил-3,
6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-метил-3-дезокси-α
-L-ликсо-гексопиранозилуронат/-β-D-глюкопиранозид получают из 1,6: 2,
3-ди-ангидро-4-O/3-дезокси-β
-D-рибогексопиранозил/-β-D-маннопиранозы согласно способу, подобному таковым,
описанным в получениях VII, VIII и IX. /α/
Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2O/: H 1 : 4,82 м.д., J =1-2:4,2 Гц; H' 1: 5,08 м.д., J1'-2'=1,0 Гц; H''1: 5,27 м.д., J1''-2''=3,7 Гц; H'''1:4,76 м.д., J1'''-2'''=7,7 Гц; H'''':5,15м. д., J1''''-2'''' =3,5 Гц.
Пример 3.
Метил-O-/3-дезокси-2,4-ди-O-метил-6-O-сульфо
Это соединение получают из O-/6-O-бензил-2, 4-ди-O-метил-3-дезокси-α-D-рибогексопиранозил/-/1--->4/-O-/бензил-2-O-ацетил-3-дезокси-β -D-рибогексопиранозилуронат/-/1--->4/-3, 6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетимидата и метил-3,6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-α -L- ликсо-гексопиранозилуронат/-β-D-глюкопиранозида согласно способу, описанному в примере 1. O-/6-О-Бензил-2,4-ди-O-метил-3-дезокси-α-D-рибогексопиранозил-/-/1---> 4/-O/-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат /-/1--->4/-3,6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетамидат получают из этил--6-O-бензил-2, 4-ди-O-метил-3-дезокси-1-тио-β-D-рибогексопиранозида и 3-O-ацетил-1, 6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/-β-D-глюкопиранозы согласно способу, описанному в получениях X.
/α/
Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2O: H1 : 4,77 м.д., J1-2=5,0 Гц; H'1:5,22 м.д., J1'-2'=2,2 Гц; 5,24 м.д. J1''-2''= 3,7 Гц, H'''1: 4,76 м. д., J1'''-2''' =7,5 Гц; H'''':5,10 м.д., J1''''-2''''=3,6 Гц.
Пример 4.
Метил--O-/3-дезокси-4-O-метил-2,6-ди-O-сульфо-α -D-рибогексопиранозил/-/1--->4/-O-/3-дезокси-2-O-сульфо-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α-D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-α-L-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфо-β-D-глюкопиранозид додекакис-натриевая соль.
Это соединение получают согласно способу, описанному в примере 1, из соединения, описанного в получении IX, и O-/2, 6-ди-O-бензил-4-O-метил-3-дезокси-α-D-рибогексапиранозил/-/1---> 4/-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/-/1--->4/-3, 6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетимидата. Это последнее трисахаридное производное получают из этил-2,6-ди-O-бензил-4-O-метил-3-дезокси-1-тио-D-рибогексопиранозида и соединения, описанного в получении V, согласно способу, описанному в получениях X и XI.
/α
/
Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2O/: H1:4,78 м.д. J1-2 = 5,1 Гц; H'1:5,22 м.д., J1'-2' = 2,6 Гц; H''1:5,27 м.д., J1''-2" = 3,9 Гц; H''' 1:4,75 м.д., J1'''-2''' = 7,9 Гц; H'''':5,11 м. д., J1''''-2''''=3,5 Гц.
Пример 5.
Метил-O-/3-дезокси-2,4, 6-три-O-сульфо-α-D-рибогексопиранозил/-/1---> 4/-O-/3-дезокси-2-O-метил-β-D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α -D-гликопиранозил/-/1---> 4/-O-/3-дезокси-2-O-метил-α -L-ликсо-гексопиранозилуронат/-/1--->4/-2,3,6-три-O-сульфо-β-D-глюкопиранозид-ундекакис-натриевая соль.
Это соединение получают из метил-3, 6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-метил-3-дезокси-α-L-ликсо-гексопиранозилуронат/-β-D-глюкопиранозида и O/6-O-ацетил-2, 4-ди-O-бензил-3-дезокси-α -D-рибогексопиранозил/-/1--->4/-O-/бензил-2-O-метил-3-дезокси-β-D-рибогексопиранозилуронат/-/1--->4/-3, 6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетимидата согласно способу, описанному в примере 1. Используемый в качестве исходного продукта трисахарид получают из 3-O-ацетил-1, 6-ангидро-2-O-бензил-4-O-/бензил-2-O- метил-3-дезокси-β -D-рибогексопиранозилуронат-β-D-глюкопиранозы и соединения, описанного в получении II, согласно способу, описанному в получениях X и XI.
/α/
Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2O/: H 1 : 4,83 м.д., J 1-2=3,0 Гц, H' 1: 5,11 м.д., J 1' - 2' = 2,6 Гц; H''1: 5,31 м. д., J 1'' - 2'' = 3,3 Гц; H'''1 = 4,68 м.д., J 1''' - 2''' = 7,7 Гц; H'''' : 5, 18 м.д., J 1'''' - 2'''' = 3,2 Гц.
Пример 6.
Метил-O-/3-дезокси-2,4,6-три-O-сульфо-α -D-рибогексопиранозил/-/1--->4/-O-/3-дезокси-2-O-метил-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α-D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-α-L-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфо-β-D-глюкопиранозид, додекакис-натриевая соль.
Это соединение получают
согласно способу, описанному в примере 1 из O-/6-O-ацетил-2,
4-ди-O-бензил-3-дезокси-α
-D-рибогексопиранозил/-/1--->4/-O-/бензил-2-O-метил-3-дезокси-β
-D-рибогексопиранозилуронат-/1--->4/-3,
6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетимидата и соединения,
описанного в получении IX. /α/
Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2O/: H 1 : 4,77 м.д., J 1-2=5,0 Гц, H'1: 5,20 м.д., J 1' - 2' = 2,5 Гц; H''1: 5,27 м. д., J 1'' - 2'' = 4,0 Гц; H'''1 : 4,67 м.д., J 1''' - 2''' = 8,0 Гц; H'''' : 5,14 м.д., J 1'''' - 2'''' = 3,5 Гц.
Пример 7.
Метил-O-/3-дезокси-2,4,6-три-O-сульфо-α-D-рибогексопиранозил/-/1---> 4/-O-/3-дезокси-2-O-метил-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3, 6-три-O-сульфо-α -D-глюкопиранозил/-/1--->4/-O-/3-O-метил-2-O-сульфо-α -L-идопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфо-α-D-глюкопиранозид, додекакис-натриевая соль.
Это соединение получают согласно способу, описанному в примере 1 из O-/6-O-ацетил-2, 4-ди-O-бензил-3-дезокси-α-D-рибогексопиранозил/-/1---> 4/-O-/бензил-2-O-метил-3-дезокси-β -D-рибогексопиранозилуронат/-/1--->4/-3, 6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил-трихлорацетимидата и метил-2,3, 6-три-O-бензил-4-O-/бензил-2-O-бензил-3-O-метил-α -L-идопиранозилуронат/

Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2 O/: H 1 : 5,10 м.д., J 1-2=3,0 Гц, H'1: 5,10 м.д., J 1' - 2' = 5,0 Гц; H''1: 5,48 м.д., J 1'' - 2'' = 3,60 Гц; H'''1 = 4,68 м.д., J 1''' - 2''' = 7,5 Гц; H'''' : 5,16 м.д., J 1'''' - 2'''' = 3,6 Гц.
Пример 8.
Метил-O-/3-дезокси-2, 4-ди-три-O-сульфо-β-D-рибогексопиранозилуронат/-/1---> 4/-O-/2,3,6-три-O-сульфо-α -D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α -D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-α -L-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфо-β-D-глюкопиранозид, гексадекакис-натриевая соль.
Это соединение получают
из
O-/бензил-2-O-ацетил-3-дезокси-4-O-левулинил-β
-D-рибогексопиранозилуронат/-/1--->4/-3,6-ди-O-ацетил-2-O-бензил-D-глюкопиранозил/-трихлорацетимидата
/получение VI/ и 3-O-ацетил-1,
6-ангидро-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-β-D-рибогексопиранозилуронат/--β-D-глюкопиранозы /получение V/. Вводя во взаимодействие эти оба
соединения в условиях, описанных
в
примере 1, стадия A, получают соединение:
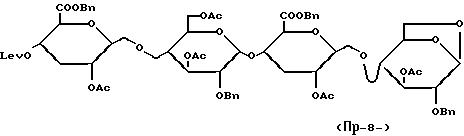
Выход = 64%.
Таким образом полученный продукт подвергают ацетолизу согласно способу, описанному в получении VI, стадия А, затем воздействию бензиламина в условиях, описанных в стадии Б получения VI для высвобождения аномерного гидроксила. Соответствующий имидат получают затем путем взаимодействия с трихлорацетонитрилом в присутствии карбоната калия согласно способу, описанному в получении VI, стадия В.
Вводя во взаимодействие этот последний продукт с метил-3,6-ди-O-ацетил-2-O-бензил-4-O-/бензил-2-O-ацетил-3-дезокси-α -L-ликсогексопиранозилуронат/-β-D-глюкопиранозидом /получение IX/ получаютметил-O-/3-дезокси-2,4-ди-O-сульфо-β-D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α -D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-β -D-рибогексопиранозилуронат/-/1--->4/-O-/2,3,6-три-O-сульфо-α-D-глюкопиранозил/-/1---> 4/-O-/3-дезокси-2-O-сульфо-α - L-ликсо-гексопиранозилуронат/-/1--->4/-2,3, 6-три-O-сульфоD-глюкопиранозид, гексадекакис-натриевая соль.
Спектр ядерного магнитного протонного резонанса /500 МГц, растворитель D2O/: H 1: 4,78 м.д., J 1-2 = 7,0 Гц; H' 1 : 5,22 м.д., J 1'-2' = 1,9 Гц; H'' 1 : 5,25 м.д., J 1''-2'' = 3,50 Гц; H''' 1 : 4,79 м.д., J 1'''-2''' = 5,6 Гц; H'''' 1 : 5,31 м.д., J 1''''-2'''' = 3,50 Гц; H''''': 4,80 м.д., J 1'''''-2''''' = 5, 9 Гц.
Реферат
Изобретение относится к
новым производным 3-дезоксиолигосахаридов формулы I, в которой Х
обозначает радикал формулы В или радикал формулы С; Y обозначает радикал формулы D; R1, R3, R5, R7, R8, R10, R13
- одинаковые или разные, обозначают каждый линейный или разветвленный алкоксильный радикал с 1-6 С-атомами или радикал -OSO
Формула

в которой Х обозначает радикал формулы В

или радикал формулы С

Y обозначает радикал формулы D

R1, R3, R5, R7, R8, R10, R13, одинаковые или разные, обозначают каждый линейный или разветвленный алкоксильный радикал с 1-6 С-атомами или радикал - OSO3-;
R2, R4, R6, R9, R11, одинаковые или разные, обозначают каждый атом водорода, линейный или разветвленный алкоксильный радикал с 1-6 С-атомами или радикал - OSO3-;
R12 - гидроксильный радикал или радикал -OSO3- при условии, что по крайней мере один из заместителей R2, или R4, или R6, или R9, или R11 обозначает атом водорода,
в виде фармацевтически приемлемых солей и соответствующих кислот.

в которой R1, R2, R3, R4, R5, R6, R7, R11, R12 и R13 имеют значения, указанные в п.1 для формулы I.

в которой R1, R2, R3, R4, R5, R6, R8, R9, R10, R11, R12 и R13 имеют значения, указанные в п.1, для формулы I.
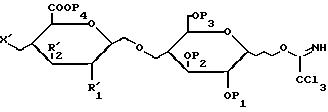
в которой X' обозначает хлорацетокси-, левулинилоксирадикал, радикал формулы В1

или радикал формулы С1

R'1 означает ациклический ацилоксирадикал с 1-6 С-атомами, предпочтительно ацетоксирадикал,
Р1, Р2, одинаковые или разные, обозначают каждый защитную группу, выбранную из ациклического ацильного радикала с 1-6 С-атомами, предпочтительно ацетильного радикала или бензильного радикала,
Р4 означает бензильный радикал;
Р3 и Р5 одинаковые или разные, обозначают каждый защитную группу, такую, как ациклический ацильный радикал с 1-6 С-атомами, предпочтительно ацетильный радикал, ароматический ацильный радикал, предпочтительно бензоильный радикал, алк-2-енильный радикал с 2-7 С-атомами, предпочтительно алкильный радикал, или бензильный радикал;
Р6 обозначает защитную группу, такую, как алкильный радикал с 1-6 С-атомами, предпочтительно метильный радикал, или бензильный радикал,
R'5, R'6, одинаковые или разные, обозначают каждый линейный или разветвленный алкоксильный радикал с 1-6 С-атомами, ациклический ацилоксирадикал с 1-6 С-атомами, предпочтительно ацетоксирадикал, ароматический ацилоксирадикал, предпочтительно бензоилоксирадикал, или алк-2-енилоксирадикал с 2-7 С-атомами, предпочтительно аллил оксирадикал,
R'7, R'10, одинаковые или разные, имеют указанные для R'1 значения или они обозначают хлорацетоксирадикал или левулинилоксирадикал,
R'2, R'6, R'9, одинаковые или разные, обозначают каждый атом водорода или имеют указанные для R'1 значения, вводят во взаимодействие с соединением формулы III

в которой Р7 имеет указанные для Р4 в формуле II значения;
Р8 имеет указанные для Р1 в формуле II значения,
R'4 и R'11, одинаковые или разные, имеют указанные для R'2 в формуле II значения,
R'3, R'12, и R'13, одинаковые или разные, имеют указанные для R'1 в формуле II значения,
с получением соединения формулы IV

в которой Х ', Р1, Р2, Р3, Р4, R'1 и R'2 имеют указанное в формуле II значение,
Р7, R'3 и R'4 имеют указанное для формулы III значение,
Y' обозначает радикал формулы D1
в которой Р8, R'11, R'12 и R'13 имеют указанное для формулы III значение,
которое затем подвергают либо каталитическому гидрированию, затем омылению и сульфатации, либо сначала омылению, затем сульфатации и после этого каталитическому гидрированию, либо сначала каталитическому гидрированию, затем сульфатации и после этого омылению, с получением соединения формулы I.

в котором М означает водород или бензоил.

в которой R'1 обозначает ациклический ацилоксирадикал с 1-6 С-атомами, предпочтительно ацетоксирадикал;
Р1, Р2, одинаковые или разные, обозначают каждый защитную группу, выбираемую среди ациклического ацильного радикала с 1-6 С-атомами, предпочтительно ацетильного радикала, или бензильного радикала;
Р4 обозначает бензильный радикал;
Р9 обозначает левулинильный радикал.

Комментарии