Полипептид с биологической активностью ингибитораиндуцируемой коллагеном адгезии тромбоцитов, его получение и применение - RU2292351C2
Код документа: RU2292351C2
Чертежи







Описание
В настоящем изобретении описан природный протеин, выделенный из слюны медицинской пиявки Hirudo medicinalis, который активно связывается с коллагеном, действуя, таким образом, в качестве ингибитора естественной адгезии тромбоцитов с коллагеном. Протеин обладает молекулярной массой около 12 000, имеет кислотную изоэлектрическую точку и содержит шесть цистеинов. Протеин секвенировали с последующим клонированием гена из библиотеки кДНК Н. medicinalis. Кроме того, раскрываются методики получения такого полипептида путем рекомбинации. Рекомбинантные и природные протеины являются сильными ингибиторами индуцируемой коллагеном адгезии тромбоцитов и, таким образом, могут применяться в терапии различных состояний, связанных с закупоркой сосудов и заболеваниями кровеносной системы. Наконец, этим протеином можно покрывать поверхности природных или искусственных коллагенов, лишая их способности слипаться с клетками и не давая последним активироваться.
Область техники изобретения
При гемостазе или тромбозе тромбоциты слипаются с внеклеточным матриксом поврежденного сосуда и покрывают поверхность пострадавшего участка. Препятствование этому процессу, являющемуся начальной стадией патогенеза тромбоза и закупорки артерий, должно стать новым шагом к решению проблемы предупреждения тромботических заболеваний.
Коллаген считается наиболее тромбогенным поверхностным компонентом. Установлено, что он активно стимулирует адгезию тромбоцитов, а также агрегацию и высвобождение тромбоцитарных гранул, что приводит к привлечению (Ruggeri, Z.M. и др.; Seminars in Hematology, 1994, 31, 229-39) к участку, где происходит этот процесс, дополнительных тромбоцитов и, в результате, образованию агрегатов или тромба. Первичное взаимодействие тромбоцитов с поверхностью сосуда происходит при участии связанного с коллагеном фактора фон Виллебранда (ФфВ) и специфического рецептора ФфВ на тромбоцитах, гликопротеинового комплекса Ib-V-IX. В то же время, АДФ, эпинефрин и факторы свертывания крови активируют тромбоциты, и в результате повышения тромбиновой активности образуется перекрестносшитый фибриновый сгусток. Этому процессу способствует агрегация тромбоцитов, опосредованная фибриногеном, соединяющим клетки в рецепторе гликопротеина IIb/IIIa (мостиковые связи).
Эта нормальная физиологическая реакция становится весьма опасной, если имеет место в ходе патологического процесса, когда тромбоциты слипаются с образующимися на участках склеротических повреждений коллагенами (Van der Rest M. и др.; FASEB Journal, 1991, 5, 2814-23) и начинают агрегироваться в окклюзии. В зависимости от местоположения и размера окклюзии, она может привести к серьезным осложнениям, таким как инфаркт миокарда, удар, воспаление или легочная эмболия.
Сегодня наиболее известным лекарственным средством, применяемым для устранения тромботических заболеваний, является прямодействующий антитромбин гепарин, блокирующий активность тромбина и, таким образом, препятствующий образованию фибриновых тромбов. Гепарин широко применяется при таких заболеваниях, как прогрессирующая ангина и острый инфаркт миокарда. Однако, несмотря на это, он также имеет ряд недостатков. Вот они: его можно вводить только внутривенно, он имеет пониженное сродство со связанным со сгустком тромбином, может инактивироваться некоторыми плазматическими протеинами, иногда вызывает тромбоцитопению, биологически гетерогенен и не действует без кофактора, в качестве которого приходится применять антитромбин-III. Таким образом, применение гепарина в клинических условиях не дало ожидаемых результатов.
Недавно был получен низкомолекулярный гепарин, который можно вводить подкожно. Однако, подобная терапия оказалась не намного действеннее таковой с применением стандартного гепарина. К сожалению, то же самое можно сказать и о других прямодействующих антитромбинах, таких как гирудин, гирулог и варфарин. Есть все основания полагать, что одна из главных проблем заключается в тромбине, производство которого в ходе устранения тромбов резко повышается (Rao, А.К и др., Circulation, 1996, 94, 389-2395).
Таким образом, в последнее время особое внимание уделялось торможению процесса активации протромбина, управляемого фактором Ха. Первоочередной задачей является получение ингибиторов этого фактора, однако перспективы их применения в терапии еще не изучены.
Кроме того, существуют также тромболитические методы. При этом основной задачей является получение активатора плазминогена типа стафилокиназы, стрептокиназы, урокиназы, активатора плазминогена тканевого типа и активаторного комплекса анизоилированный плазминогенстрептокиназа. Эти тромболитические средства существенно разнятся по времени, которое им необходимо для возобновления перфузии, однако показатель общей смертности не зависит от применения того или иного из них. Кроме того, нередко в результате их введения имеют место осложнения, такие как повторная окклюзия или длительное кровотечение. Это можно объяснить низкой специфичностью к фибрину и коротким периодом полураспада этих соединений. В настоящее время с целью устранения недостатков, которые все еще дают о себе знать при проведении тромболитической терапии, испытываются различные способы применения и комбинации целого ряда фибринолитических действующих начал. Однако от этих исследований не ожидают особых результатов.
Недавно появилась новая группа пациентов с такими проблемами, как острая тромботическая окклюзия и поздний рестеноз в результате ангиопластики, артериэктемии, трансплантации артерии или имплантации стента в стенку сосуда. Терапию можно проводить, применяя антитромбоцитные, антитромботические и тромболитические средства. Способностью прямого воздействия на активность тромбоцитов также обладает целый ряд других веществ, являющихся антагонистами АДФ, таких как тиклопдин или кальциевый ионофор А-23187 и, в частности, аспирин. Эти вещества либо предлагали применять, либо применяли с целью предупреждения или минимизации процесса агрегации тромбоцитов. Новое вещество по настоящему изобретению, блокирующее адгезию тромбоцитов, также может помочь избежать агрегации последних в ходе хирургических операций.
Еще одна проблема возникает при взаимодействии искусственных поверхностей с кровью. Искусственные материалы обладают тенденцией индуцировать тромботические процессы, активируя тромбоциты и/или индуцируя коагуляцию. Это может привести к нарушению функций трансплантатов сосудов, сердечных клапанов, стентов, катетеров или любых других устройств либо материалов, взаимодействующих с кровью. Таким образом, протеин по настоящему изобретению, благодаря его способности образовывать нетромбогенные поверхности, можно также применять, иммобилизуя его на вышеописанных материалах и устройствах. Подобная обработка должна послужить обеспечению биологической совместимости и резистентности таких материалов или устройств к образованию тромбов.
При применении имеющихся в наличии антитромботических средств приходится считаться с целым рядом ограничений. Таким образом, возникает реальная потребность в разработке новых альтернативных методик и лекарственных средств.
Предпосылки создания изобретения
Залогом новых успехов в лечении сердечно-сосудистых заболеваний могут быть раскрытые в настоящем изобретении методы, направленные непосредственно на блокирование адгезии тромбоцитов, индуцируемой коллагеном и/или ФфВ.
Некоторые новые ингибиторы, блокирующие адгезию тромбоцитов, представляют собой моноклональные антитела против ФфВ. Также было высказано предположение, что ингибиторы гликопротеина IIb/IIIa с тем же успехом можно применять для ингибирования адгезии тромбоцитов.
Некоторые из этих ингибиторов, например моноклональный Ab с7Е3, успели пройти клинические испытания, тогда как другие, такие как ингибиторы KGD и RGDF, все еще являются предметом пристального изучения. Специфичность большинства из этих новых ингибиторов еще не до конца изучена, таким образом, о побочных действиях, которыми может сопровождаться их применение, пока ничего не известно.
Новые соединения, блокирующие индуцируемую коллагеном адгезию тромбоцитов, не требуют долгих поисков. Они просто изобилуют в природе, а именно, в организмах кровососущих. В литературе описано несколько ингибиторов, выделенных из природного материала: протеин с молекулярной массой 65 кД под названием калин, выделенный из Hirudo medicinalis (US 5537360, WO 92/07005) (Munro, R. и др., Blood Coagulation and Fibrinolysis, 1991, 2, 179-184), и протеин с молекулярной массой 16 кД (LAPP), выделенный из слюнных желез пиявки Haementeria officinalis (US 5324715). Оба протеина описаны как ингибиторы агрегации, к которым они причислены на основании результатов исследований индуцируемой коллагеном агрегации тромбоцитов в статических условиях.
Несмотря на доказанное наличие активности in vitro, LAPP бездействовал на ряде хорошо зарекомендовавших себя прежде моделей in vivo (Schaffer L.W. и др.; Arterioscler. Thromb., 1993, 13, 1593-1601) и Connolly Т.М. и др.; Thromb. Haemostas., 1993, 69, 589). В мягком клеще Ornithodoros moubata также содержится антитромбоцитный протеин (маубатин), способный блокировать стимулируемую коллагеном агрегацию тромбоцитов (Waxman, L. и др.; J. Biol. Chem., 1993, 268, 5445-49). Другой ингибитор агрегации тромбоцитов, выделенный из клопа, описан Noeske-Jungblut С и др. в WO 9309137. Smith и др. выделили из змеиного яда протеин с молекулярной массой 50 кД и из слюны клопа Triatoma pallidipennis таковой с молекулярной массой 19 кД. Было установлено, что протеин содержит фактор, специфически ингибирующий агрегацию тромбоцитов, индуцируемую коллагеном. Протеин с молекулярной массой 19 кД, названный паллидипином, ингибирует опосредованную коллагеном агрегацию тромбоцитов в плазме. Ингибирования агрегации, стимулированной другими эффекторами (АДФ, тромбином, имитатором тромбоксана А2 U46619, сложным форболовым эфиром), не обнаружено. Паллидипин не воздействовал на адгезию тромбоцитов с коллагеном, однако при этом ингибировал высвобождение из тромбоцитов АТФ. Он обратимо взаимодействует с тромбоцитами, не мешая при этом коллагену. Точный механизм действия и терапевтическая ценность этого протеина в настоящее время изучаются. У Gan и др. описан эхристатин, который, по мнению авторов, является ингибитором, связывающимся с рецептором фибриногена GP IIa/IIIb (J. Biol. Chem, 1988, 263, 19827-32).
Однако, несмотря на все эти несомненные успехи, существует одна проблема, все еще требующая решения. Заключается она в получении новых антикоагулянтов и антитромбина, которые обладали бы повышенной способностью ингибирования образования сгустков, индуцируемой ФфВ активации тромбоцитов и активации эндотелиальных клеток, могли бы применяться в фармацевтике и производиться в количествах, позволяющих говорить об их коммерческой ценности.
Поскольку ни один из описанных до сих пор протеинов нельзя назвать идеальным с точки зрения терапевтического применения, создатели настоящего изобретения решили прибегнуть к новой методике скрининга, чтобы с ее помощью найти соединения, которые позволили бы приблизиться к решению этой проблемы.
Описание изобретения
В настоящем изобретении описан выделенный из Н. medicinalis ингибитор, воздействующий непосредственно на взаимодействие коллагена с тромбоцитами и, таким образом, ингибирующий активацию тромбоцитов и их взаимодействие на начальной стадии.
В литературе нет ни одного примера нового антиадгезионного механизма или соединения, идентифицированного методом скрининга, предполагающим исключение из природного источника ингибиторов агрегации и литических протеинов. Тем не менее, именно эта методика применялась при создании настоящего изобретения. На первых порах в возможность идентификации новых ингибиторов адгезии верилось с трудом, поскольку известно, что как минимум шесть тромбоцитарных поверхностных гликопротеинов принимают участие в адгезии с коллагеном и, кроме того, несколько соединений тромбоцитарного происхождения, такие как фактор фон Виллебранда, фибронектин и тромбоспондин, являются непрямыми медиаторами адгезии коллагена с тромбоцитами.
Тем не менее, сознавая невозможность исключения всех описанных или неизвестных ингибиторов ФфВ и соединений, действующих непосредственно на рецепторы тромбоцитов, скрининг слюны Hirudo medicinalis осуществляли именно этим методом. Результат превзошел все ожидания - получили новый протеин, который назвали саратином. Этот протеин, способный блокировать адгезию тромбоцитов, можно выделить из тканей и секреций хорошо изученной пиявки вида Hirudo medicinalis
Настоящее изобретение относится к активному полипептиду саратину, выделенному из пиявки Hirudo medicinalis Этот протеин был выделен из слюны последней методом, представляющим собой комбинацию диализа с повышенным давлением, как минимум одной стадии хроматографии, например, анионообменной, и по меньшей мере одного этапа высокоразрешающей хроматографии с обращенной фазой (ЖХВР с ОФ). Диализ под давлением в этом случае был просто необходим - повышенная концентрация слюны помогла избежать весьма существенных потерь биологически активного саратина. Выделенный саратин активно связывается с несколькими коллагенами и, в зависимости от дозы, в той или иной степени блокирует адгезию тромбоцитов с коллагеном.
С целью оптимизации каскада скрининга имеющиеся в наличии методики были модифицированы с четким разграничением адгезивности тромбоцитов и их тенденции к агрегации. Подобные модификации включают оценку способности тромбоцитов замедлять или останавливать прохождение потока через волокна, определение степени участия тромбоцитов в образовании сгустка in vitro, оценку адгезивности со стеклянной дробью или фильтрование цельной крови и определение степени слипания тромбоцитов обработанной антикоагулянтом плазмы с повышенной концентрацией тромбоцитов с фильтрами, состоящими из стеклянных волокон или коллагена, в регулируемом градиенте давления.
Протеин (под названием саратин) характеризуется аминокислотными последовательностями, приведенными в последовательности (SEQ. ID. NO. 2), и состоит из 103 аминокислот с теоретической относительной молекулярной массой, составляющей около 12068 дальтонов ± 1 кД. Протеин обладает уникальной первичной структурой, не имеющей заметного сходства с другими последовательностями, описанными ранее. Протеин содержит большие количества аспарагиновой и глутаминовой кислот, благодаря чему его молекула отличается низкой изоэлектрической точкой (рН 3,7±0,5, определена методом электрофореза в полиакриламидном геле с изоэлектрическим фокусированием).
Проведя электрофорез в полиакриламидном геле додецилсульфатом натрия предварительно восстановленного протеина, обнаружили резкое изменение его подвижности, что свидетельствовало о посттрансляционных модификациях. В результате секвенирования полипептида получили шесть молекул цистеина, которые и могли составлять посттрансляционные модификации протеина. Методом электронно-лучевой масс-спектрометрии была определена фактическая молекулярная масса саратина, равная 12061, что указывало на участие в образовании вторичной структуры нативной формы протеина от одной до трех дисульфидных связей.
Ингибитор адгезии по настоящему изобретению является новым, поскольку отличается от известных, выделенных из пиявок ингибиторов агрегации, в частности, калина или LAPP, молекулярной массой, изоэлектрической точкой, аминокислотной последовательностью и биологической активностью.
Кроме того, данное изобретение относится к выделенной ДНК, включающей полинуклеотид, кодирующий полученный из пиявки ингибитор адгезии тромбоцитов с аминокислотной последовательностью, аналогичной таковой, приведенной для протеина. Нуклеотидная последовательность, представляющая собой клон кДНК, показана в SEQ. ID. NO. 1. Положение 1-63 этой нуклеотидной последовательности - это предполагаемая лидирующая последовательность из 21 аминокислоты, а положение 64-372 содержит открытую рамку считывания, кодирующую полипептид, состоящий из 103 аминокислотных остатков, и аминокислотную последовательность, приведенную для зрелого протеина в SEQ. ID. NO. 2.
Настоящее изобретение также относится к рекомбинантным векторам, включающим синтетический ген, кодирующий полученный из пиявки ингибитор адгезии тромбоцитов по данному изобретению, и клетке-хозяину, содержащей рекомбинантные векторы. В основу методов отбора и выделения экспрессированных протеинов были положены методики мечения либо адаптировались таковые из схемы очистки природного саратина. То, каким образом осуществляется отбор рекомбинантного протеина из надосадочной жидкости или осадка, определяется схемой его внеклеточной или внутриклеточной экспрессии в клетках, например, дрожжевых клетках, клетках насекомых, клетках почки хомячка и таковых Е. coli, трансформированных соответствующими векторами. Каким именно образом связать эти процессы должно быть известно специалисту в данной области. Прекрасная экспрессия имела место, когда в роли хозяина выступал Е. coli. В этом случае периплазматическая экспрессия инициировалась путем инсерции лидирующей последовательности pelB. Получению продукта (около 5 мг/л) из Escherichia coli (Е. coli) предшествовали осмолиз и центрифугирование. Параллельно проводился эксперимент над Saccharomyces cerevisiae (S. cerevisiae) (>10 мг/л культуральной жидкости) с вектором, адаптированным к дрожжам. Вещество из секреции выделяли путем центрифугирования. Очистку осуществляли методом поперечноточной фильтрации и ионообменной хроматографии. При использовании клеток COS или СНО экспрессия продукта составляла около 750 нг/мл. Результаты электрофоретического и хроматографического анализов свидетельствовали о чистоте и гомогенности очищенного материала, секвенировав же аминокислоту и определив молекулярную массу, смогли убедиться в его идентичности полученному из слюны саратину. Кроме того, настоящее изобретение относится к способам очистки активного протеина из слюны пиявки и оценки уровня его антитромбоцитной активности с помощью статического и динамического анализа, а также применению этих способов для выделения рекомбинантного протеина.
Методики получения саратина описаны в Примерах 6, 7, 8 и 13. Здесь следует отметить, что способы экспрессии этими примерами не ограничиваются. Например, экспрессировать саратин также можно в трансгенных мышах или других организмах, в том числе млекопитающих.
К протеинам по настоящему изобретению также относятся вариации, сохраняющие активность раскрытых здесь последовательностей, в том числе фрагменты или субъединицы, природные вариации, аллельные вариации, случайные искусственные мутанты и направленные вариации последовательностей, как, например, полученные в результате наращивания, сохраняющие указанную активность. Фрагментом или субъединицей может быть любой участок последовательности, содержащий меньше аминокислот, чем полный протеин, например неполные последовательности, не содержащие N- и/или С-концевых участков протеина.
Кроме того, настоящее изобретение относится к гибридным протеинам, таким как слитые протеины или протеины, образующиеся в результате экспрессии нескольких генов в пределах вектора экспрессии, которые могут включать полипептид, обладающий специфической активностью протеина по данному изобретению, связанный посредством пептидных связей со вторым полипептидом. Кроме того, настоящее изобретение относится к другим вариациям протеинов по данному изобретению, главным образом, к любым вариациям, отличающимся от выделенного протеина исключительно консервативными заменами аминокислот. Последние описаны у Taylor и др., J. Mol. Biol., 1986, 188, 233.
Настоящее изобретение также относится к способам применения протеинов для блокирования или замедления активации тромбоцитов путем ингибирования взаимодействия коллагена с тромбоцитами. Протеин можно применять для предупреждения, профилактики, терапии и лечения тромботических заболеваний. Механизм действия протеина по данному изобретению отличается от такового всех ранее описанных протеинов, которые воздействуют на различные тромбоцитарные поверхностные протеины. Он прочно связывается с поверхностью коллагена и, в одном из вариантов, покрывает ее специфические участки, таким образом, лишая их возможности взаимодействия с тромбоцитами и связывания последних. Преимущество этого варианта нового механизма действия заключается в полном сохранении функциональной активности тромбоцитов, что позволяет почти или даже вовсе избежать кровотечения после введения протеина.
Этот протеин также можно применять, что весьма существенно, для обработки различных поверхностей, тем самым наделяя их способностью отталкивать тромбоциты, что позволяет говорить о создании совместимых с кровью устройств.
Как указывалось выше, полипептиды по настоящему изобретению можно применять в качестве фармацевтически эффективных соединений в составе фармацевтических композиций и комбинированных препаратов.
Фармацевтические композиции по данному изобретению могут содержать дополнительные активные компоненты, например аспирин, антикоагулянты, такие как гирудин или гепарин, либо тромболитические средства, такие как активатор плазминогена или стрептокиназа.
С любой нетоксичной, органической или неорганической кислотой новый полипептид по настоящему изобретению может образовывать фармацевтически приемлемые соли. В качестве примеров неорганических кислот можно привести соляную, бромистоводородную, серную или фосфорную кислоту, а также кислые соли металлов, такие как вторичный кислый фосфат натрия и кислый сернокислый калий. Примеры органических кислот - моно-, ди- и трикарбоновые кислоты, такие как уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, оксималеиновая, бензойная, оксибензойная, фенилуксусная, коричная, салициловая кислоты и сульфокислоты, такие как метансульфоновая кислота. К солям карбоксиконцевых аминокислотных остатков относятся соли нетоксичной карбоновой кислоты, получаемые с использованием любых подходящих неорганических или органических оснований. Эти соли включают, например, соли щелочных металлов, таких как натрий и калий, щелочноземельных металлов, таких как кальций и магний, легких металлов Группы 111А, в том числе алюминия, а также соли органических первичных, вторичных и третичных аминов, таких как триалкиламины, включая триэтиламин, прокаин, дибензиламин, 1-этиленамин, N,N'-дибензилэтилендиамин, дигидроабиэтиламин и N-алкилпиперидин.
В контексте этого описания термин "фармацевтически приемлемый носитель" относится к нетоксичному твердому или жидкому наполнителю, растворитель либо вещество, образующее оболочку капсулы, которое не реагирует с активным соединением и не может повредить пациенту. Подходящие, в предпочтительном варианте жидкие носители, широко известны в данной области. Такими носителями могут служить стерильная вода, соль, водная декстроза, сахарные растворы, этанол, гликоли и масла, получаемые в результате переработки нефти, а также таковые животного или растительного происхождения, либо синтетические, например, арахисовое масло, соевое масло и минеральное масло.
Соединения по настоящему изобретению можно вводить в разовых дозах, содержащих обычные нетоксичные фармацевтически приемлемые носители, растворители, адъюванты и связующие, типичные для парентерального введения.
Под термином "парентеральный" здесь подразумеваются подкожная, внутривенная, внутрисуставная и внутритрахеальная инъекции, а также вливания. Кроме того, приемлемы другие формы применения, такие как оральная и местная. Композиции и комбинированные препараты для парентерального применения в наиболее предпочтительном варианте вводят внутривенно в форме болюса или в качестве постоянных фузий, пользуясь при этом известными методами.
Таблетки и капсулы, предназначенные для орального введения, содержат обычные эксципиенты, такие как связующие вещества, наполнители, растворители, агенты таблетирования, смазочные материалы, вещества, способствующие освобождению действующего начала, и поверхностно-активные вещества. С помощью широко известных в данной области методов таблетки можно покрывать оболочкой.
Жидкие препараты для орального применения могут иметь форму водных или масляных суспензий, растворов, эмульсий, сиропов либо эликсиров или выпускаться в качестве сухого продукта, который перед применением следует довести до необходимой консистенции, добавив воду либо иное подходящее связующее. Подобные жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, неводные связующие и антикоагулянты.
Препараты для местного применения могут иметь форму водных или масляных суспензий, растворов, эмульсий, гелей либо, что является предпочтительным, эмульсионных мазей.
Разовые дозы по настоящему изобретению могут содержать суточные количества протеина по данному изобретению или его дольные единицы, составляющие необходимую дозу. Какая дозировка будет оптимальной для того или иного пациента (млекопитающие, в том числе человек), зависит от целого ряда факторов, таких как активность применяемого действующего вещества, возраст, масса тела, общее состояние здоровья, пол, диета, время и способ введения, скорость выведения, цель применения препарата, т.е. предназначен ли он для терапии либо профилактического лечения, характер тромботического заболевания, а также активность действующего начала, которое может действовать в качестве антитромбоцитного средства или антикоагулянта.
Таким образом, фармацевтически эффективная суточная доза пептидов по настоящему изобретению в композициях и комбинированных препаратах, вводимых в организм пациента (in vivo) в качестве антитромботических средств, составляет около 0,01-100 мг/кг, предпочтительно от 0,1 до 10 мг/кг массы тела. В зависимости от формы применения одна доза может содержать от 0,5 до 10 мг ингибитора тромбина. Чтобы добиться антисвертывающего действия в экстракорпоральной крови, в ней должно присутствовать 0,2-150 мг/л, предпочтительно 1-20 мг/л пептидов по настоящему изобретению.
Целью настоящего изобретения также является разработка вживляемого или экстракорпорального медицинского устройства для применения на участках, где он будет вступать во взаимодействие с циркулирующими в теле жидкостями, поверхность которого путем ее покрытия иммобилизованным полипептидом, приведенным выше и в пунктах формулы изобретения, делается, в основном, резистентной к образованию тромбов. Полипептид по настоящему изобретению иммобилизуют на медицинском устройстве, тем самым обеспечивая биологическую совместимость поверхности последнего и ее резистентность к образованию тромбов. Поверхности подобных устройств иногда обладают свойствами, как правило, индуцирующими агрегацию тромбоцитов, из-за чего возникают серьезные проблемы с их применением на участках, предполагающих взаимодействие с кровью или другими присутствующими в теле жидкостями. В качестве примеров таких устройств, как правило, изготовляемых из пластмасс и синтетических волокон, можно привести протезы, искусственные органы, глазные линзы, сутуры, искусственные сегменты сосудов, катетеры, диализаторы, трубки и сосуды для транспортировки крови.
Помутнение задней капсулы хрусталика (ПЗКХ) является обычным осложнением после экстракции катаракты, избежать которого не удается даже с помощью современных хирургических методик и линз, применяемых в ходе этой операции. ПЗКХ возникает вследствие пролиферации и миграции эпителиальных клеток хрусталика в его заднюю капсулу, что понижает остроту зрения. С целью облегчения ПЗКХ предлагалось применять методы физиотерапии и химически модифицированные линзы. Так, использовалось гепариновое покрытие для линз или гепариновые глазные капли, из чего можно сделать вывод, что ПЗКХ имеет тромбогенную природу.
Было установлено, что саратин во многом превосходит гепарин с точки зрения предупреждения и блокирования тромбогенности. Таким образом, еще одним отличительным признаком настоящего изобретения является получение покрытия, содержащего саратин, которое позволило бы снизить тромбогенность материала, используемого в преломляющих имплантатах, хирургическим путем вживляемых в переднюю или заднюю камеру. Это новое покрытие помогает избежать проблем, возникающих вследствие стимулированного роста клеток. В комбинации с другими лекарственными средствами, например, вызывающими гибель клеток, саратиновое покрытие дает возможность полностью устранить помутнение задней капсулы хрусталика.
Краткое описание фигур
Более подробно фигуры разъясняются в примерах 1-10.
Фиг.1
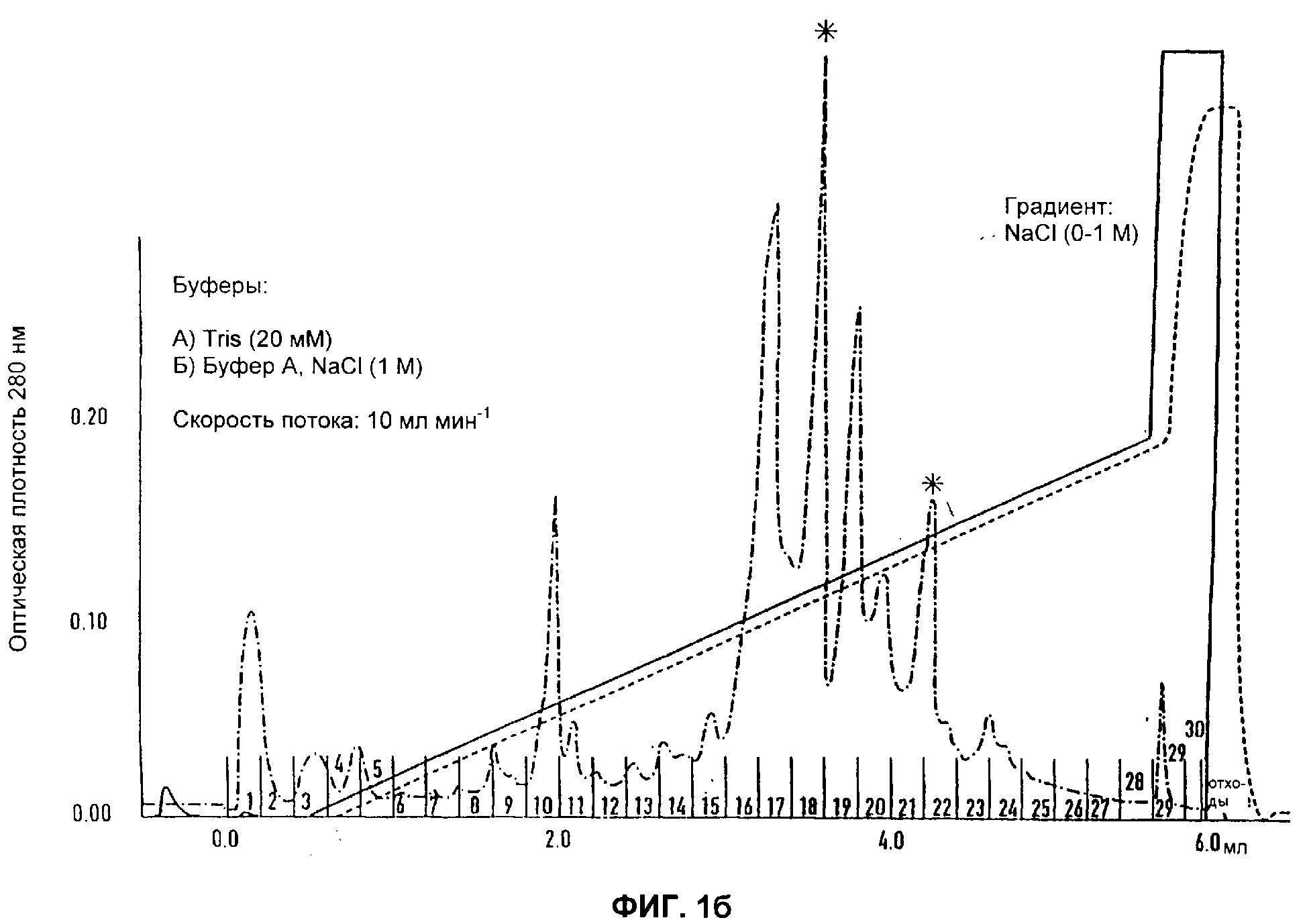
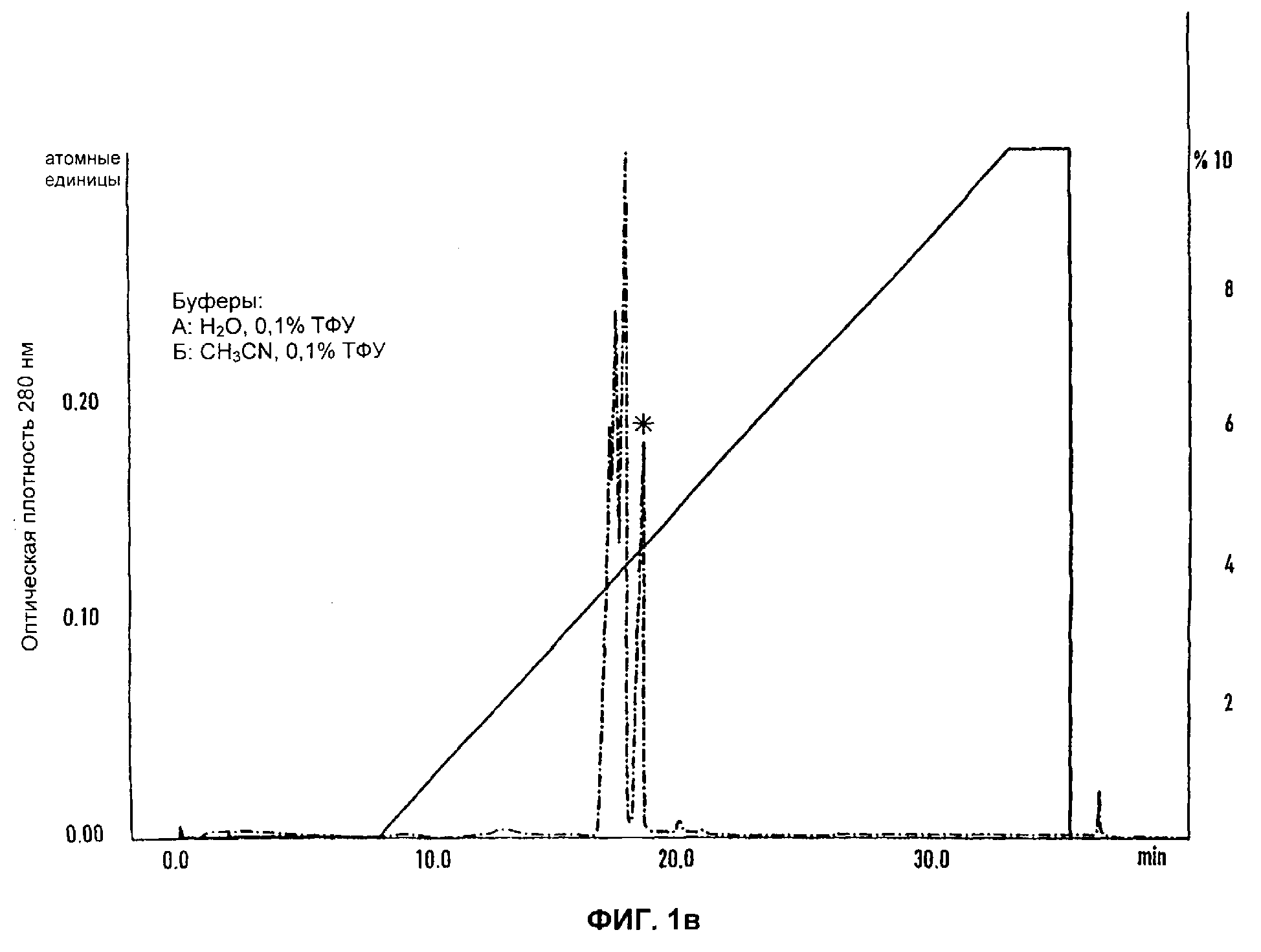
Разделение компонентов слюны. Элюирование саратина помечено *
а) профиль разделения слюны после анионообмена с ДЭАЭ. Фракции саратина собирали в пике 3 (Пример 2).
б) повторное хроматографирование объединенных фракций на Mono Q HR5/5. Образцы собирали в последней части главного пика, как показано чертой (Пример 2).
в) последняя стадия полупрепаративной аналитической ЖХВР с ОФ саратин-положительных фракций, собранных с Mono Q HR5/5 (Пример 2). Активный саратин отбирали в главном пике (пик 3).
Фиг.2
Электрофорез в полиакриламидном геле додецилсульфатом натрия фракций, собранных на стадии ЖХВР с ОФ. Положительные фракции саратина отмечены * (Примеры 2 и 3).
Фиг.3
Вектор экспрессии саратина в Е. coli (Пример 7).
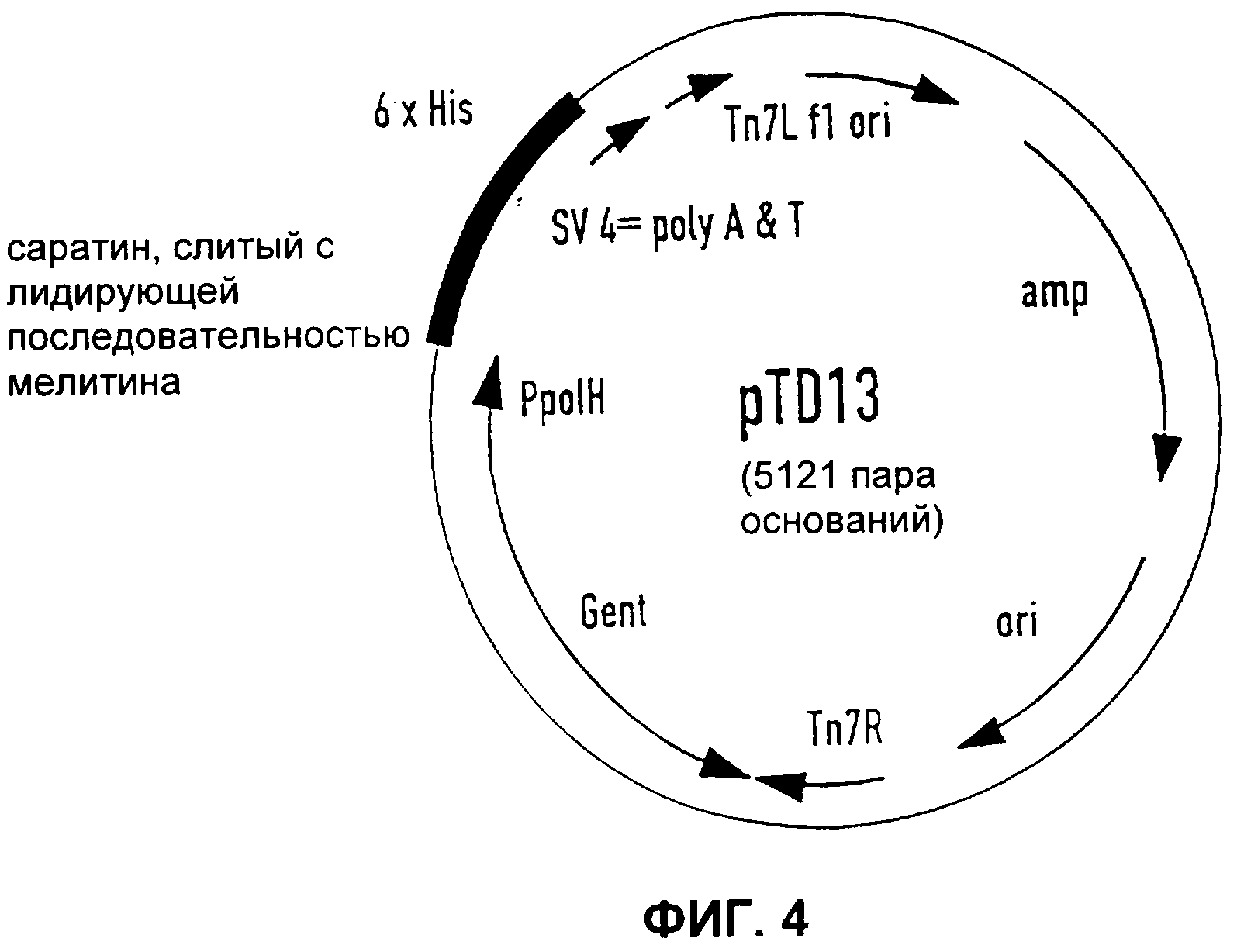
Фиг.4
Бакуловирусная донорская плазмида саратина (Пример 8).
Фиг.5
Цельная кровь введена во взаимодействие с поверхностью искусственного коллагена с визуализацией адгезии тромбоцитов путем окрашивания. Саратин применяли в качестве ингибитора (протеин #607) (Пример 9).
Фиг.6
Ингибирование адгезии тромбоцитов на покровных стеклах, покрытых коллагеном типа III, в условиях сдвигового потока. Сравнение ингибирующего действия слюны и саратина (Пример 9).
Фиг.7
Ингибирование саратином адгезии тромбоцитов с покровными стеклами, покрытыми коллагеном типа III, в условиях сдвигового потока. Активность саратина зависит от дозировки (Пример 9).
Фиг.8
Вектор экспрессии саратина в дрожжах (Пример 13).
Подробное описание изобретения
Пример 1
Скрининг ингибиторов адгезии
Адгезия тромбоцитов с коллагеном была принята в качестве критерия, по которому осуществляли скрининг компонентов слюны. Кроме того, чтобы исключить проявление последними функциональных свойств, которые нельзя отнести на счет ингибитора адгезии, были проведены четыре дополнительных исследования, имеющих своей целью оценку действия различных антитромботических средств: анализ AZOCOLL, оценка активности амидазы, испытание связывания при участии фактора фон Виллебранда и анализ агрегации тромбоцитов. Все эти испытания, в основном, являются стандартными, однако анализ адгезии тромбоцитов нам пришлось модифицировать. Если коротко, модификация состоит в следующем: коллагеном Horm. (фирма Nycomed) покрывали 96-ячейковые планшеты (фирма Nunc) (при этом использовали подкисленный коллаген в концентрации 20 мкг/мл и планшеты инкубировали в течение ночи). Трижды промыв планшеты сополимером стирола и бутадиена, коллаген, оставшийся на дне ячеек, блокировали 1%-ным сывороточным альбумином крупного рогатого скота. Затем добавляли свежие тромбоциты, выделенные из цитронилированной человеческой крови, и, параллельно с ними, фракции, полученные на отдельных стадиях колоночной хроматографии. При необходимости, перед использованием тромбоциты реактивировали, инкубируя в третбутилстироле в присутствии ионов двухвалентного оксида магния. Исходный материал слюны с общей концентрацией протеина, стабилизированной на отметке 200 мкг/мл, использовался в качестве эталона сравнения ингибирующего действия. Как оказалось, с точки зрения активности ингибиторы тромбоцитов высокочувствительны к изменениям в буфере и повышенным концентрациям соли. Все образцы обрабатывались методом ионообменной хроматографии, а потому проведение непосредственного исследования фракций в процессе анализа ингибирования оказалось весьма затруднительным и не могло дать точных результатов. По этой причине все подлежащие исследованию образцы прошли стадию концентрирования (на оборудовании Centricon), что позволило уменьшить ионную силу и в то же время стабилизировать концентрацию перед проведением измерений.
Пример 2
Очистка природного ингибитора
В настоящем изобретении использовалась слюна, выделенная из Н. medicinalis. Известно, что она содержит целый ряд биологически активных протеинов, таких как гирудин, ингибиторы эластазы, коллагеназы и ингибиторы агрегации тромбоцитов, такие как калин (Munro, R. и др.; Blood Coagulation and Fibrinolysis, 1991, 2, 179-184) и LAPP (Schaffer, L.W. и др.; Arterioscler. Thromb., 1993, 13, 1593-1601). Эти протеины хорошо изучены, однако о большей части приблизительно восьмидесяти протеинов, которые можно обнаружить методом электрофореза в полиакриламидном геле додецилсульфатом натрия, все еще ничего не известно. При создании данного изобретения, применяя методику, описанную в примере 1, проводили скрининг фракционированной слюны на предмет нахождения новых протеинов, непосредственно блокирующих взаимодействие тромбоцитов с коллагеном.
Основной задачей оказалось отделение ингибитора адгезии от исходного материала слюны, что обусловливалось, главным образом, тем, что на первой стадии хроматографического разделения ингибитор необратимо лишался почти всей своей активности. Ситуация нисколько не улучшилась и после введения добавок (Munro, R. и др.), таких как 12%-ный этанол и двухвалентные катионы. В то же время, высокая концентрация соли в слюне при низкой общей концентрации протеина (190-250 мкг/мл) требовала предварительного концентрирования или замены буфера. Таким образом, было опробовано несколько методик обогащения, концентрирования или замены буфера. Традиционный диализ привел к полной потере активности. Большая часть других стандартных методик, таких как ионообменная или аффинная хроматография и разделение молекул по размеру* (*Эксклюзионная хроматография (прим. перев.)) (потеря не зависела от полимера, содержавшегося в колонке), не дали результатов, несмотря на применение различных способов разделения и использование целого ряда буферов и добавок. К удивлению авторов настоящего изобретения выяснилось, что путем диализа с повышенным давлением 500 мл слюны можно добиться повышения концентрации в ней протеинов (приблизительно в 30-40 раз) и в то же время избавиться от нежелательных компонентов буфера. Также было обнаружено, что обработанный таким образом исходный материал слюны становился идеальным для проведения с ним дальнейшей очистки. Таким образом, отбор биологически активных антиадгезионных компонентов слюны переставал быть проблемой. Поскольку катионообменники или колонки для аффинной хроматографии не позволяли добиться желаемой степени очистки, перешли к использованию слабого анионообменника, такого как DEAE-Fastflow или EMD-DEAE-Fractogel. Были опробованы 12%-ный этанол и двухвалентные катионы, однако как с использованием этих добавок, так и без них результаты оставались неизменными. Как на оптимальном варианте хроматографического разделения остановились на следующей последовательности: колонка DEAE, колонка Mono Q и в завершение колонка RP18 для хроматографии с обращенной фазой. Условия хроматографического разделения оптимизировали, применяя хроматографическую систему BiaCore с аналитическими колонками, поставляемыми фирмой Pharmacia. Градиенты, использовавшиеся для работы на колонках DEAE, Mono Q и RP18, приведены на Фигурах 1а, б, в. Разделение в системе BiaCore масштабировали с помощью методов жидкостной хроматографии с программированием потока. Следуя инструкциям производителя, от оптимизированных рабочих условий, за исключением стадии с использованием колонки RP18, на которой, чтобы минимизировать потери очищенного материала, продолжали работать в режиме, предусмотренном для методики Biacore, переходили непосредственно к полупрепаративному разделению. Отбор очищенного протеина, полученного на заключительной стадии хроматографии с обращенной фазой, осуществляли методом скоростного вакуумного центрифугирования. Образцы, собранные на упомянутой стадии, объединяли и анализировали с помощью электрофореза в полиакриламидном геле додецилсульфатом натрия (Фигура 2). Затем образцы повторно суспендировали в сополимере стирола и бутадиена, после чего их использовали для проведения аналитических и функциональных анализов. Как правило, выход саратина из необработанной слюны составлял около 750 мкг/л.
Пример 3
Биохимическое исследование
Как описано в Примере 1, в результате очистки саратина был получен в основном чистый протеин со средней молекулярной массой около 21 кД (определялась в восстановительных условиях методом электрофореза в полиакриламидном геле додецилсульфатом натрия) (Фигура 2). Полную аминокислотную последовательность получили путем прямого секвенирования первых 48 аминокислот очищенного протеина. Эта последовательность была завершена путем секвенирования нескольких внутренних пептидов, образованных в результате ферментативного расщепления. Полная последовательность протеина приведена в SEQ. ID. NO.2.
Протеин состоит из 103 аминокислот с расчетной молекулярной массой 12067,9 и таковой фактической 12061,9 (определена методом электронно-лучевой масс-спектрометрии). Из такой разницы между теоретической и измеренной молекулярными массами можно заключить, что в образовании мостиков S-S принимают участие все шесть идентифицированных в саратине цистеинов. Это подтверждается и результатами хроматографического анализа протеина методом электрофореза в полиакриламидном геле додецилсульфатом натрия как в восстановительных условиях, так и в отсутствие таковых, когда наблюдается резкое изменение его подвижности. Кроме того, протеин богат кислыми аминокислотами, такими, как Glu и Asp. Электрофорез в полиакриламидном геле с изоэлектрическим фокусированием (фирма Immobiline) позволил определить изоэлектрическую точку, составившую рН 3,7±0,5. В сравнительном анализе в качестве эталона мы использовали очищенный протеин пиявки, сличая его физико-химические свойства с таковыми рекомбинантного саратина, полученного из экспрессирующих его бакуловируса, дрожжей и Е. coli. Свойства всех трех протеинов оказались идентичными.
С помощью электрофореза в полиакриламидном геле додецилсульфатом натрия с визуализацией путем окрашивания методом Кумасси (Фигура 2) или серебрения и/или вестерн-блоттинга было установлено, что протеин гомогенен и не гликозилирован.
Пример 4
Получение мРНК и синтез кДНК
РНК получали из медицинской пиявки Hirudo medicinalis с использованием тиоцианата гуанидиния. мРНК из полной РНК выделяли с помощью набора "Oligotex mRNA kit" (фирма QIAGEN).
кДНК синтезировали с использованием набора "Marathon cDNA Amplification kit" (фирма CLONTECH). Затем последовательность ДНК, кодирующую саратин, следуя инструкциям поставщика, амплифицировали олигонуклеотидными праймерами ПЦР (полимеразная цепная реакция). По завершении синтеза кДНК с обеими ее концами лигировали универсальный адаптер. Последовательности универсального адаптера и универсальных праймеров АР1 или АР2 выбирали в соответствии с инструкциями поставщика упомянутого набора.
Пример 5
Амплификация и выделение гена саратина методом ПЦР
Вырожденные праймеры синтезировали на базе ближайшего N-конца обратно транслированной аминокислотной последовательности саратина.
Эти праймеры 01 и 02 предназначены для специфической гибридизации с 5'-концом кДНК саратина. В основу конструкции праймеров была положена обратно транслированная аминокислотная последовательность восьми N-концевых аминокислот очищенного протеина саратина, которые были определены экспериментально. Праймеры 01 и 02 синтезировали с целью стабилизации вырожденности на как можно более низком уровне и удлинения праймеров на критическом 3'-конце на 8 комплементарных пар оснований, идеально согласующихся с последовательностью кДНК саратина, что обеспечит эффективную и специфическую амплификацию матричной кДНК. В вырожденном алфавите ДНК (код ИЮПАК) R=А или G; М=А или С; Y=С или Т; и N=А или G либо С или Т.
ПЦР 3'-RACE проводили с использованием смеси праймеров 01 и 02 с одним универсальным праймером, АР1 или АР2. Продукты ПЦР клонировали в клонирующем векторе ТА pCR2.1 или векторе pCR Script SK(+) и секвенировали. Секвенировав несколько имеющихся фрагментов ПЦР 3'-RACE, получили последовательность гена саратина (за исключением нетранслированной области 5', сигнальной пептидной последовательности и последовательности, кодирующей первые 8 аминокислот N-конца зрелого протеина). Чтобы получить информацию, содержавшуюся в этих недостающих последовательностях кДНК саратина, был проведен эксперимент с 5'-RACE, в ходе которого использовали ген-специфический праймер из середины кДНК саратина и один из универсальных праймеров АР1 или АР2. Секвенировав несколько образовавшихся в результате фрагментов ПЦР 5'-RACE, получили полную последовательность гена саратина. В результате амплификации гена саратина путем ПЦР с использованием ген-специфических, невырожденных праймеров как из 3'-, так и из 5'-конца гена саратина получили полный ген саратина.
В секвенировании ДНК участвовало более 15 различных клонов продуктов ПЦР. При этом было выявлено только одно существенное изменение аминокислотной последовательности в единственном клоне. Весьма вероятно, что это изменение было вызвано ПЦР. Кроме того, было обнаружено еще пять молчащих изменений, никак не подействовавших на структуру аминокислотной последовательности. Эти изменения вряд ли могли быть следствием ПЦР, поскольку одни и те же модификации были выявлены в различных клонах.
Ген ORF саратина имеет длину, составляющую 372 комплементарные пары оснований, и содержит сигнальную последовательность, состоящую из 21 аминокислоты, и последовательность, кодирующую зрелый протеин, в состав которой входит 103 аминокислоты. Было обнаружено, что аминокислотная последовательность, выведенная из клона продукта ПЦР, идентична последовательности, полученной в результате секвенирования природного протеина, выделенного из слюны.
Пример 6
Экспрессия в клетках COS и обнаружение экспрессированного протеина
С целью экспрессии гена саратина в клетках млекопитающих, таких как COS или СНО, его с помощью Xhol + Xbal вырезали из вектора pCR Script SK(+) и клонировали в вектор экспрессии pCl-neo (фирма Promega) клетки млекопитающего. Последний был выбран, поскольку он содержит промоторы Т7 и Т3, что позволяет проводить экспрессию in vitro, и ген стойкости к неомицину, необходимый для отбора G418, а также может применяться как в клетках COS, так и СНО.
Помимо сигнальной последовательности и последовательности зрелого протеина, на 5'-конце инсерция содержит последовательность Koz., позволяющую провести эффективную трансляцию, а на 3'-конце (С-конец) - метку his MRGS(H)6 для выявления экспрессии и отслеживания очистки и концентрирования протеина. Плазмидную конструкцию назвали pNC-31.
ДНК плазмиды pNC-31 использовали для трансфекции клеток COS. Клетки COS, находившиеся в фазе логарифмического роста, дважды промывали сополимером стирола и бутадиена и растворяли в последнем в концентрации 1× 107/мл. Затем в 0,7-0,8 мл суспензии COS добавляли 12 мкг плазмидной ДНК (менее 50 мкл в Н2О или буфере ТЕ) и перемешивали в кювете для электропорации. Электропорацию осуществляли при 1,9 кВ, 25 микрофарад в течение 10 мин. Затем клетки переносили на 90-миллиметровую пластину. Добавив 8 мл среды DMEM, содержавшей 10% FCS и антибиотики, клеткам давали расти в течение трех дней. Надосадочные жидкости и клетки использовались для дальнейшего выделения и обнаружения протеина. Экспрессированный протеин выявляли методом вестерн-блоттинга с помощью антитела против MRGS(H)6. Для очистки использовали комплексоны, такие как НТУ или имидоуксусная кислота, иммобилизованные на матрице колонки и модифицированные ионами металлов, такими как Со, Mi или Cu.
Пример 7
Конструирование вектора экспрессии в Е. coli и экспрессия
Поскольку в тех или иных биологических системах используются различные кодоны, в E. coli некоторые из них встречаются крайне редко. Чтобы экспрессировать оптимизированную версию в Е. coli, пользуясь стандартными методиками, ген сперва следовало привести к соответствию с кодоном Е. coli.
Экспрессию в Е. coli осуществляли с помощью модифицированной версии плазмиды pASK75, несущей промоторную область tet (Skerra, А. и др., Gene, 1994, 151, 131 -135). Модификация, если не вдаваться в подробности, была произведена путем клонирования нового линкера между сайтами Xbal и Hind III (Фигура 3). Новый линкер содержит лидирующую последовательность ompA, другой сайт множественного клонирования и метку 6 × His вместо strep.
Чтобы сконструировать вектор экспрессии саратина, методом ПЦР было необходимо ввести сайты рестрикции 5' Cla I и 3' Eco47III.
Для этого использовали 5'-прамер 03 и 3'-праймер 04. Продукт ПЦР сперва клонировали в векторную систему PCR II (фирма Invitrogen) и секвенировали.
На второй стадии ген саратина, используя сайты рестрикции 5'Clal и 3' HindIII, клонировали в модифицированный вектор pASK75.
По завершении экспрессии, удостоверившись в наличии у этого рекомбинантного саратина активности, в ходе второй ПЦР удаляли метку His и непосредственно с лидирующей последовательностью omp A сливали стартовый кодон гена саратина. 5'-праймер 05 и 3'-праймер 06, использованные в этой ПЦР, приведены в перечне последовательностей.
В качестве примера экспрессии в Е. coli можно привести трансформирование вектора экспрессии pRG72 (Фигура 3), содержащего структурный ген саратина, слитый с лидирующей последовательностью ompA, в компетентные клетки W3110. По достижении последними середины логарифмического роста их возбуждали. Через 1 час можно было легко обнаружить рекомбинантный сарастатин.
Пример 8
Конструирование бакуловирусной донорской плазмиды и экспрессия
С целью экспрессии саратина в бакуловирусной системе экспрессии пользовались системой Вас-То-Вас™, поставляемой фирмой Gibco Life Technologies. Чтобы получить систему отбора, с геном саратина сливали лидирующую последовательность мелитина медоносной пчелы, а с целью введения сайтов рестрикции 5' BamHl и 3' Kpnl провели единственную ПЦР с использованием 5'-праймера 07 и 3'-праймера 08.
Соответствующий продукт ПЦР клонировали в вектор PCR II (фирма Invitrogen) и секвенировали. Продукт слияния мелитина с саратином с помощью сайтов рестрикции 5'BamHl и 3'Kpnl клонировали в вектор pFastBac, получая pTD13 (Фигура 4). Формирование рекомбинантных бакуловирусов и экспрессия саратина осуществлялись с использованием системы экспрессии Вас-То-Вас. Донорскую плазмиду pTD13 трансформировали в компетентные клетки DHIOBac, содержавшие бакмид с сайтом-мишенью mini-attTn7 и плазмиду-помощник. В присутствии протеинов транспозиции из плазмиды-помощника элемент mini-Tn7 на донорской плазмиде транспозировался в сайт-мишень mini-attTn7 на бакмиде. Колонии, содержащие рекомбинантные бакмиды, идентифицировали путем разрыва гена lacZ. Из отобранных клонов Е. coli, содержавших рекомбинантный бакмид, получали низкомолекулярную мини-ДНК, которую затем использовали для трансфекции клеток насекомых. Подробнее все это изложено в руководстве по эксплуатации набора для экспрессии.
Пример 9
Адгезия тромбоцитов с коллагеном в условиях потока (динамический анализ)
В процессе анализа адгезии тромбоцитов цельную человеческую кровь пропускают через прямоточную камеру, оценивая адгезионную активность тромбоцитов в отношении коллагена на покрытых последним покровных стеклах в условиях сдвигового потока (моделируя условия, при которых происходит перфузия в артерии in vivo), как это описано у Sakariassen и др. (Mette. Enz., 1988, 169, 37-70). Коллаген из плаценты человека, тип III (фирма Sigma), растворенный в 50 ммоль/л уксусной кислоты, с помощью ретушерного аэрографа распыляли на чистые покровные стекла (18 мм × 18 мм). Последние в течение ночи при 4°С выдерживали в сополимере стирола и бутадиена.
Перед использованием свежую цельную человеческую кровь (в качестве антикоагулянта вводили низкомолекулярный гепарин; 20 ед./мл) нагревали при 37° С в течение 10 мин. Препараты из протеинов по настоящему изобретению с помощью пипетки наносили на покровные стекла (30 мкл на покровное стекло) и, перед помещением в перфузионную камеру, инкубировали в течение 10 мин в камере с влажной средой при комнатной температуре. Затем кровь пропускали через перфузионную камеру (при 37°С в течение 5 мин со скоростью сдвига 1300 с-1).
Затем покровные стекла извлекали, промывали сополимером стирола и бутадиена, в течение 30 мин. закрепляли в 0,25%-ном глутеровом альдегиде и окрашивали методом May-Grünwald Giemsa (Фигура 9). По необработанной контрольной поверхности окрашенные тромбоциты распространялись на весьма обширную площадь, тогда как на сравнительной поверхности, предварительно обработанной саратином, наблюдалось резкое понижение (на 80%) способности последних к связыванию. Количественный анализ адгезивности тромбоцитов проводили с помощью оптического микроскопа (Фигура 5, 1000-кратное увеличение), подключенного к анализатору изображения с управлением от ЭВМ (фирма Leica). Результаты выражали в проценте агрегатов тромбоцитов от покрытой последними поверхности.
Ингибирующее действие слюны сравнивали с таковой очищенного протеина (Фигура 6). Ингибирование необработанной слюной (#616) адгезии тромбоцитов на покровных стеклах, покрытых коллагеном типа III, при скорости сдвига 1300 с-1 по сравнению с контролем составило около 48%. При использовании очищенного протеина (#607; саратин) в нормализованных концентрациях процесс отложения тромбоцитов блокировался приблизительно на 81%. Ингибирующее действие саратина повышается с увеличением дозировки и повышением концентраций протеина (Фигура 7).
Пример 10
Иммунизация и антитела
Получив первую партию природного протеина высокой чистоты, немедленно приступили к иммунизации животных. Иммунные сыворотки выделяли из кроликов. В наличии имелись реагенты с высоким титром, позволявшие проводить дальнейший скрининг. Получение дополнительных антисывороток стало возможным с завершением пептидной последовательности полного протеина. Синтезировали три пептида (аминокислотная последовательность 83-103, 13-30, 58-69), посредством стандартного линкера связанные с KLH, которые затем использовали для иммунизации. Были получены три сыворотки против N-концевого пептидного сегмента и две против С-концевых пептидов. Иммунные сыворотки с высоким титром позволяли управлять процессом очистки как природного, так и рекомбинантного протеина, а также осуществлять количественный анализ очищенного вещества методом ЭЛИЗА. Таким образом, отпадала необходимость в трудоемком и длительном анализе ингибирования тромбоцитов, к которому прибегли исключительно для того, чтобы убедиться в наличии у конечного очищенного протеина потенциала ингибитора.
Пример 11
Иммунологические испытания связывания саратина
Подкисленным коллагеном Horm (фирма Nycomed) покрывали 96-ячейковые микротитровальные планшеты (фирма Nunc) (50 мкл раствора коллагена в концентрации 20 мкг/мл, инкубирование в течение ночи). Приступая к анализу, планшеты трижды промывали сополимером стирола и бутадиена и, во избежание неспецифической адгезии, инкубировали в растворе сывороточного альбумина крупного рогатого скота (1%). Затем в серийном разведении добавляли 50 мкл саратина и инкубировали в течение одного часа. Прежде чем приступить к анализу с использованием антитела против саратина, планшеты трижды промывали. Проведя дополнительное инкубирование, избыток антитела удаляли и продолжали испытание со вторым антителом, меченым биотином. Считывание осуществлялось путем проведения цветной реакции с катализом стрептавидин-POD с подложками, такими как таблетки ODB (фирма Dako) (длина волны 490 нм).
Пример 12
Конкурентный анализ скрининга ингибиторов
Способность рекомбинантного меченого саратина (метка His) из Примера 7 к связыванию с коллагеном сравнивали с таковой нативного немеченого саратина. Планшеты с покрытием из подкисленного коллагена Horm (фирма Nycomed) подготавливали, как это описано в Примере 11. Обнаружение осуществляли с помощью антител против саратина кролика. Меченый и немеченый саратины проявили идентичную способность к сцеплению. В качестве альтернативы немеченый саратин модифицировали путем биотинилирования (фирма Pierce, набор для биотинилирования) и сравнивали с немодифицированным саратином. Оба протеина имели одинаковую способность к связыванию с коллагеном. Далее проводили эксперименты с перекрестной конкуренцией биотинилированного саратина с немодифицированным саратином, пептидами, саратином, выделенным из слюны, слюной или антителами против саратина. Анализ связывания различных "конкурентов" с коллагеном осуществляли, оценивая способность к сцеплению биотинилированного саратина (реакция с подложкой ODB с использованием конъюгата стрептавидин-POD). Этот эксперимент с биотинилированным саратином, как правило, применяли для определения концентрации саратина в слюне (750 мкг/л), картирования антигенных детерминант антител против саратина, оценки биологически активного и мутировавшего саратина. Чтобы получше изучить возможности, открывающиеся при проведении этого эксперимента, применяли как блокирующие, так и неблокирующие антитела против саратина, полученные с помощью специфических пептидов саратина.
Пример 13
Вектор экспрессии и экспрессия в дрожжах
Использовалась система экспрессии pichia multi copy (фирма Invitrogen), типичный пример экспрессии в дрожжах. Конструкция дрожжевого вектора экспрессии изображена на Фигуре 8. При создании вектора экспрессии саратина прибегли к амплификации методом ПЦР, позволявшей сформировать концы рестрикции (5' EcoR I, 3' Not I), которые можно лигировать в соответствующий вектор (рРIC9K). При этом использовали 5'-праймер 09 и 3'-праймер 10.
Перед трансформированием сферопластов Pichia вектор экспрессии линеаризовали Sal I. Чтобы убедиться в интеграции гена саратина, с колониями провели скрининг на предмет His+ Mut+-положительных мутантов. Условия роста: 28-30°С, оптическая плотность до 2-6. Экспрессию индуцировали путем повторного суспендирования центрифугированных клеток в среде и добавления метанола в конечной концентрации до 0,5%. Эти условия поддерживались, как правило, в течение 24 часов. Через 6 дней ферментации продукт отбирали из надосадочной жидкости и анализировали методами электрофореза в полиакриламидном геле додецилсульфатом натрия и ЭЛИЗА.




Реферат
Изобретение относится к области биохимии и биотехнологии и может быть использовано в медицине, а также в производстве медицинской техники. Из слюны медицинской пиявки Hirudo medicinalis выделен белок с молекулярной массой 12000 дальтон, характеризующийся наличием 6 цистеиновых остатков, способных образовывать -S-S- связи, и значением pI около 3,7. Новый белок обладает способностью блокировать адгезию тромбоцитов, индуцируемую коллагеном. В результате скрининга кДНК-библиотеки Н. medicinalis идентифицирован ген нового ингибитора адгезии и определена его нуклеотидная последовательность. Описан способ получения рекомбинантной формы белка, предусматривающий трансформацию подходящих клеток-хозяев вектором, включающим кодирующую ингибитор последовательность ДНК, культивирование клеток в пригодных для ее экспрессии условиях и выделение экспрессированного белкового продукта. Предложено использование природной и рекомбинантной форм ингибитора по изобретению в терапии состояний, связанных с закупоркой сосудов и заболеваниями кровеносной системы, а также для обработки поверхности изделий из природного и искусственного коллагена. 6 н. и 10 з.п. ф-лы, 10 ил.

Комментарии