Гормональные или негормональные стероидные соединения, способ терапевтического лечения - RU2230071C2
Код документа: RU2230071C2
Описание
Область изобретения
Данное изобретение относится к новому классу 17β -ацил-17α -пропиниловых стероидов, которые, как полагают, связываются с прогестиновым рецептором и которые демонстрируют сильную антипрогестиновую активность. Такие соединения могут использоваться для лечения фиброидных опухолей, эндометриоза и некоторых опухолей, для ускорения созревания шейки матки перед родоразрешением, при гормонозаместительной терапии и для контроля за рождаемостью и репродукции.
Обсуждение предпосылок изобретения
Прогестерон играет ведущую роль в репродуктивном здоровье и функционировании репродуктивных органов. Его действие, например, на матку, молочные железы, шейку матки и гипоталамо-гипофизарную систему хорошо определены. Он также оказывает экстра-репродуктивное действие, которое менее изучено, такое как воздействие на мозг, иммунную систему, сосудисто-эндотелиальную систему и на метаболизм липидов. Совокупность этих эффектов указывает на то, что соединения, которые обладают схожими эффектами с эффектами прогестерона (агонисты), антагонизмом к этим эффектам (антагонисты) или демонстрируют смешанные эффекты (частичные агонисты или смесь агонистов/антагонистов) могут быть использованы для лечения различных болезненных состояний и условий.
Стероидные гормоны оказывают свое действие, частично, присоединяясь к внутриклеточным рецепторам. Соединения, которые связываются с соответствующими рецепторами и являются антагонистами или частичными агонистами эстрогенных и андрогенных гормонов, давно известны, но до приблизительно 1982 не были открыты соединения, которые связываются с прогестероновым рецептором, и не были известны антагонистические эффекты прогестерона. С тех пор о многих таких соединениях сообщалось в специфической и патентной литературе и их эффекты in vitro были изучены у животных и у человека. Хотя соединения, такие как эстрогены и некоторые ингибиторы ферментов, могут препятствовать физиологическим эффектам эндогенных прогестеронов, в данном обсуждении "антипрогестин" относится к таким соединениям, которые связываются с прогестиновым рецептором.
В настоящее время доступна информация, свидетельствущая о том, что антипрогестины могли бы быть эффективными для ряда медицинских состояний. Эти данные были суммированы в статье Institute of Medicine (Donaldson, Molly S.; Dorflinger, L; Brown, Sarah S.; Benet, Leslie Z., Editors, Clinical Applications of Mifepristone (RU 486) и Other Antiprogestines, Committee on Antiprogestines: Assessing the Science, Institute of Medicine, National Academy Press, 1993). С учетом центральной роли, которую прогестины играют в репродукции, не удивительно, что антипрогестины могут играть частичную роль в контроле над фертильностью, включая контрацепцию (длительную и для случая крайней необходимости, или посткоитальную), стимулирование менструации и медицинское прерывание беременности, и, кроме того, множество других возможностей использования, которые были подтверждены ограниченными клиническими или предклиническими исследованиями. В том числе для следующих целей:
1. Роды и родовспоможение - антипрогестины могут быть использованы для ускорения созревания шейки матки для стимулирования родов, как в срок, так и тогда, когда роды стимулируются из-за смерти плода. Они могут также использоваться в стимулирования родов в срок или при переношенной беременности.
2. Лечение лейомиомы матки (фиброиды) - эти незлокачественные опухоли могут беспокоить до 20% женщин в возрасте после 30 лет и являются одной из наиболее распространенных причин хирургического вмешательства у женщин в репродуктивном периоде. Гистерэктомия, общепринятое лечение в случае стойких симптомов, является результатом стерильности.
3. Лечение эндометриоза - это распространенное (от 5 до 15% случаев, гораздо чаще у бесплодных женщин) и часто болезненное состояние в настоящее время лечат лекарственными препаратами, такими как даназол, или аналогами гонадотропного-релизинг гормона, которые вызывают значительные побочные эффекты, или удаляют хирургическими методами.
4. Гормонозаместительная терапия, когда их можно назначать для прекращения или снижения деятельности прогестинов.
5. Злокачественные новообразования, в частности, опухоли молочной железы - наличие прогестиновых рецепторов во многих злокачественных опухолях молочной железы наводит на мысль об использовании антипрогестинов для лечения метастазирования опухоли или предотвращении рецидивов, или начального развитие злокачественной опухоли.
6. Другие опухоли, такие как менингиома - эта опухоль мозговых оболочек, хотя не является злокачественной, приводит к смерти пациентов и невозможности нехирургического лечения.
7. Мужская контрацепция - антипрогестины могут влиять на жизнеспособность спермы, хотя, так или иначе, этот антипрогестативный эффект ставиться под сомнение, поскольку он может относиться к антиглюкокортикоидному действию этих соединений.
8. Антиэстрогенные эффекты - по крайней мере, некоторые антипрогестины препятствуют действию эстрогенов в некоторых испытаниях, но, очевидно, с помощью механизма, который не вовлекает классические гормональные рецепторы. Это открывает широкие возможности для их медицинского использования.
9. Антиглюкокортикоидные эффекты - этот побочные эффекты антипрогестинов, которые могут использоваться в некоторых случаях, таких как лечение синдрома Кушинга, и могут играть роль, например, при иммунных расстройствах. В других случаях эти эффекты желательно минимизировать.
Эффекты и использование агонистов прогестерона тщательно задокументированы. Кроме того, недавно показано, что некоторые соединения, структурно-подобные известным антипрогестинам, имеют сильную агонистическую активность в некоторых биологических системах (например, классические эффекты прогестина на неполовозрелую матку кролика в начальной-эстрагенной фазе цикла; сравни С.Е. Cook et al. Life Sciences, 52, 155-162 (1993)). Такие соединения представляют собой частичные агонисты клеточной рецепторной системы, которые связываются с сайтом, отличным от сайтов прогестина и антипрогестина (Wagner et al., Proc. Natl. Acad. Sci., 93, 8739-8744 (1996)). Таким образом, общий класс антипрогестинов может иметь подклассы, которые могут различаться по своему клиническому профилю.
Как правило, антипрогестативная активность связана с присутствием 11β -арильного заместителя на стероидном кольце вместе с Δ4,9-3-кетонной или Δ4-3-кетонной группой. Однако было показано, что заместители на D-кольце стероида могут иметь заметное влияние на биологический профиль этих соединений (смотри выше). Ранние антипрогестины были замещены 17β -гидроксильной группой и различными 17α -заместителями. (Смотри например, Teutsch, Jean G.; Costerousse, Germain; Philibert, Daniel, and Deraedt, Roger. Новые стероиды. Патент США 4386085. 1983; Philibert, Daniel; Teutsch, Jean G.; Costerousse, Gennain, and Deraedt, Roger. 3-кето-19-нор-Δ -4,9-стероиды. Патент США 4477445. 1983; Teutsch, Jean G.; Pantin, Germain; Costerousse, Saint-Maurice; Daniel Philibert; La Varenne Saint Hilaire; Roger Deraedt, inventors. Steroid derivatives. Roussel Uclaf, assignee. U.S. 4447424. 1984; Cook, С. Edgar, Tallent, C. Ray; Reel, Jerry R., и Wani, Mansukh С. 17α -(Замещенный-метил) -17β -гидрокси/этерифицированные гидроксистероиды и фармацевтические композиции, содержащие их. Патент США 4774236 (1988) и 4861763 (1989)). Затем было обнаружено, что 17β -ацетильная, 17α -ацилоксигруппа может также вызывать антипрогестативные эффекты (Cook, С. Edgar; Lee, Y.W.; Reel, Jerry R.; Wani, Mansukh C., Rector, Douglas. 11β -Замещенные прогестероновые аналоги. Патент США 4954490 (1990) и 5073548 (1991)), и были достаточно изучены различные перестановки этих обнаруженных заместителей. Однако, введение 16α -этильной группы или водородного заместителя в 17α -положение в 17β -ацильном ряду соединений приводит к агонистической или частичной агонистической активности (С.Е. Cook et al.. Life Sciences, 52, 155-162 (1993)). Таким образом, изменения в D-кольце стероида приводят к широкому разнообразию воздействий количеству эффектов на биологическую активность. В соответствие с этими недостатками существует необходимость в антипрогестиновых соединениях, которые демонстрировали бы более высокую специфичность.
Cook et al., патент США 5073548, сообщают о 17α -алкинил-11β -(замещенный фенил) -19-норпрегна-4,9-диен-3,20-дионовых соединениях, но не иллюстрируют 17β -ацил-17α (-пропин-1-иловые соединения.
Cook et al., в одновременно поданном патенте США 09/035,949, зарегистрированным 16 марта, 1998, сообщают о 17β -ацил-11β -циклических аминофенилстероидах.
Поэтому целью настоящего изобретения являются новые и эффективные антагонисты прогестина (антипрогестины) и смеси, или частичные агонисты прогестина, способы медицинского применения у млекопитающих, включая людей, и способы их синтеза.
Несмотря на клиническую перспективу антипрогестинов, таких, которые описаны 1 ноября 1998, в США и других странах нет прогестиновых препаратов. Только один антипрогестиновый препарат одобрен и доступен для клинического использования в мире, и этот препарат, мифепристон, является основным при медицинском прерывании беременности. Множество факторов является причиной этой ситуации, но существует потребность в новых антипрогестативных препаратах, которые могут быть использованы при состояниях, описанных выше.
Поэтому целью настоящего изобретения является новые и эффективные антагонисты прогестинов (антипрогестины) и смесь, или частичные агонисты прогестина, и способы медицинского применения у млекопитающих, включая людей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к группе новых 17β -ацил-17α -пропиниловых стероидов, которые характеризуются 11β -(4-замещенный фенил) замещением.
В соответствии с первым воплощением, настоящее изобретение относится к гормональным или негормональным стероидным соединением структуры I,

где R1 представляет собой (CH3)2N-, CH3 NH-, NH2-;
R2 представляет собой СН3-, СF3-, HOCH2-;
R3 представляет собой Н-, СН3-, СН3О-, СН3СОО-;
R4 представляет собой Н-, СН3-, F-, Cl-; и
Х представляет собой О, (Н,Н), NOH, NОСН3,
и его фармацевтически приемлемые соли.
В соответствии с другим воплощением, настоящее изобретение относится к гормональным или негормональным стероидным соединениям структуры II,

где R5 представляет собой СН3СО-, СН3S-, СН3S(О)-, СН3S(O)2-, СН3О-;
R6 представляет собой СН3-, СF3-, HOCH2-;
R7 представляет собой Н-, СН3-, СН3О-, СН3СОО-;
R8 представляет собой Н-, СН3-, F-, Сl-; и
Х представляет собой О, (Н, Н), NOH, NОСН3,
и их фармацевтически приемлемые соли.
Эти и другие объекты по настоящему изобретению стали возможны благодаря обнаружению, что 17β -ацил-17α -пропинил-11β -(4-замещенный фенил)стероиды демонстрируют исключительную агонистическую или антагонистическую гормональную активность.
КРАТКОЕ ОПИСАНИЕ СХЕМ
Более полное понимание изобретения и многих его сопутствующих преимуществ, станут более понятыми из следующего подробного описания, которое рассматривается вместе с прилагаемыми схемами, где:
Схема 1 представляет реакционную схему получения 17β -ацил-17α -пропинильного производного по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Вышеуказанные соединения формулы I в частности включают соединения, которые замещены на кольце А в 3-положении двумя атомами водорода. Эти соединения, как полагают, подвергаются окислению in vivo в соответствующие карбонильные соединения.
В соответствие с одним воплощением, настоящее изобретение относится к гормональному или негормональному стероидному соединению структуры I,
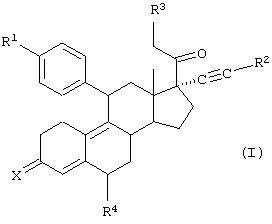
где R1 представляет собой (CH3)2N-, CH3 NH-, NH2-;
R2 представляет собой СН3-, СF3-, HOCH2-;
R3 представляет собой Н-, СН3-, СН3О-, СН3СОО-;
R4 представляет собой Н-, СН3-, F-, Cl-; и
Х представляет собой О, (Н,Н), NOH, NОСН3,
и их фармацевтически приемлемые соли.
В соответствии с другим воплощением, настоящее изобретение относится к гормональному или негормональному стероидному соединению структуры II,

где R5 представляет собой СН3СО-, СН3S-, СН3S(О)-, СН3S(O)2-, СН3О-;
R6 представляет собой СН3 -, СF3-, HOCH2-;
R7 представляет собой Н-, СН3-, СН3О-, СН3СОО-;
R8 представляет собой Н-, СН3-, F-, C1-; и
Х представляет собой О, (Н, Н), NOH, NОСН3,
и их фармацевтически приемлемые соли.
В объем настоящего изобретения входят, в частности, производные 17α -(1-пропинил) -11β -(4-аминофенил) -19-норпрегна-4,9-диен-3,20-диона формулы (III)

где R1 представляет собой (CH3)2N-, СН3NН-, NH2-.
Особенно предпочтительным является соединение формулы (IV)
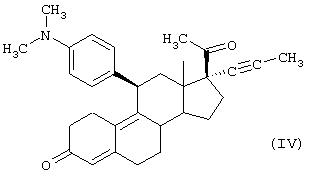
Соединения по настоящему изобретению могут также включать соль, образованную амином. Подходящие фармацевтически приемлемые соли известны специалистам в данной области и включают карбоксилаты, сульфаты, фосфаты и галогениды.
В контексте настоящего изобретения, группа R4 структуры I и R8 структуры II могут быть либо α , либо β стереохимической конфигурации.
Конкретные соединения формулы I представляют собой
1. 11β -(4-аминофенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
2. 11β -(4-аминофенил)-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
3. 11β -(4-аминофенил)-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
4. 11β -(4-аминофенил)-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
5. 11β -(4-аминофенил)-21-метокси-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
6. 11β -(4-аминофенил)-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
7. 11β -(4-аминофенил)-21-метокси-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
8. 11β -(4-аминофенил)-21-метокси-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
9. 11β -(4-аминофенил)-21-метокси-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
10. 11β -(4-аминофенил)-21-метокси-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
11. 11β -(4-аминофенил)-21-метокси-6-фтор-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
12. 11β -(4-аминофенил)-21-метокси-6-фтор-17α (-(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
13. 11β -(4-аминофенил)-21-метокси-6-фтор-3-оксимино-17α (-(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
14. 11β -(4-аминофенил)-21-метокси-6-фтор-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
15. 11β -(4-аминофенил)-21-метокси-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
16. 11β -(4-аминофенил)-21-метокси-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
17. 11β -(4-аминофенил)-21-метокси-6-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
18. 11β -(4-аминофенил)-21-метокси-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
19. 11β -(4-аминофенил)-21-метокси-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
20. 11β -(4-аминофенил)-21-метокси-6-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
21. 11β -(4-аминофенил)-21-метокси-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
22. 11β -(4-аминофенил)-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
23. 11β -(4-аминофенил)-21-метил-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
24. 11β -(4-аминофенил)-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
25. 11β -(4-аминофенил)-21-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
26. 11β -(4-аминофенил)-21-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
27. 11β -(4-аминофенил)-21-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
28. 11β -(4-аминофенил)-21-метил-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
29. 11β -(4-аминофенил)-21-метил-6-фтор-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
30. 11β -(4-аминофенил)-21-метил-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
31. 11β -(4-аминофенил)-21-метил-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
32. 11β -(4-аминофенил)-21-метил-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
33. 11β -(4-аминофенил)-21-метил-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
34. 11β -(4-аминофенил)-6, 21-диметил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
35. 11β -(4-аминофенил)-6,21-диметил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
36. 11β -(4-аминофенил)-6,21-диметил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
37. 11β -(4-аминофенил)-6, 21-диметил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
38. 11β -(4-аминофенил)-6,21-диметил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
39. 11β -(4-аминофенил)-6, 21-диметил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
40. 11β -(4-аминофенил)-3-оксимино-17α -(1-пропинил)-19норпрегна-4,9-диен-3, 20-дион;
41. 11β -(4-аминофенил)-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
42. 11β -(4-аминофенил)-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
43. 11β -(4-аминофенил)-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3, 20-дион;
44. 11β -(4-аминофенил)-6-фтор-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
45. 11β -(4-аминофенил)-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
46. 11β -(4-аминофенил)-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
47. 11β -(4-аминофенил)-6-фтор-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
48. 11β -(4-аминофенил)-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
49. 11β -(4-аминофенил)-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
50. 11β -(4-аминофенил)-6-метил-17α -(3, 33-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
51. 11β -(4-аминофенил)-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
52. 11β -(4-аминофенил)-6-метил-3-оксимино-17α (-(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
53. 11β -(4-аминофенил)-6-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
54. 11β -(4-аминофенил)-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
55. 11β -[4-(N,N-диметиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
56. 11β -[4-(N,N-диметиламино)фенил]-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
57. 11β -[4-(N,N-диметиламино)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
58. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
59. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
60. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
61. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
62. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
63. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
64. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
65. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-6-фтор-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
66. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
67. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
68. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
69. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
70. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
71. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-6-метил-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
72. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
73. 11β -[4-(N,N-диметиламино)фенил]-21-метокси-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
74. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-метил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
75. 11β -[4-(N, N-диметиламино)фенил]-21-метокси-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
76. 11β -[4-(N,N-диметиламино)фенил]-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
77. 11β -[4-(N,N-диметиламино)фенил]-21-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
78. 11β -[4-(N,N-диметиламино)фенил]-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
79. 11β -[4-(N, N-диметиламино)фенил]-21-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
80. 11β -[4-(N,N-диметиламино)фенил]-21-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
81. 11β -[4-(N,N-диметиламино)фенил]-21-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
82. 11β -[4-(N,N-диметиламино)фенил]-21-метил-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
83. 11β -[4-(N, N-диметиламино)фенил]-21-метил-6-фтор-17α -(3,33-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
84. 11β -[4-(N,N-диметиламино)фенил]-21-метил-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
85. 11β -[4-(N,N-диметиламино)фенил]-21-метил-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3, 20-дион;
86. 11β -[4-(N,N-диметиламино)фенил]-21-метил-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
87. 11β -[4-(N,N-диметиламино)фенил]-21-метил-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
88. 11β -[4-(N,N-диметиламино)фенил]-6, 21-диметил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
89. 11β -[4-(N,N-диметиламино)фенил]-6,21-диметил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
90. 11β -[4-(N,N-диметиламино)фенил]-6,21-диметил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
91. 11β -[4-(N, N-диметиламино)фенил]-6,21-диметил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
92. 11β -[4-(N,N-диметиламино)фенил]-6,21-диметил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
93. 11β -[4-(N,N-диметиламино)фенил)-6,21-диметил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
94. 11β -[4-(N,N-диметиламино)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
95. 11β -[4-(N, N-диметиламино)фенил]-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
96. 11β -[4-(N,N-диметиламино)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
97. 11β -[4-(N,N-диметиламино)фенил]-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
98. 11β -[4-(N,N-диметиламино)фенил]-6-фтор-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
99. 11β -[4-(N,N-диметиламино)фенил]-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
100. 11β -[4-(N,N-диметиламино)фенил]-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
101. 11β -[4-(N,N-диметиламино)фенил]-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
102. 11β -[4-(N, N-диметиламино)фенил]-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
103. 11β -[4-(N,N-диметиламино)фенил]-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
104. 11β -[4-(N,N-диметиламино)фенил]-6-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
105. 11β -[4-(N,N-диметиламино)фенил]-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
106. 11β -[4-(N, N-диметиламино)фенил]-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
107. 11β -[4-(N,N-диметиламино)фенил]-6-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
108. 11β -[4-(N,N-диметиламино)фенил]-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
109. 11β -[4-(N-метиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
110. 11β -[4-(N-метиламино)фенил]-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
111. 11β -[4-(N-метиламино)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
112. 11β -[4-(N-метиламино)фенил]-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
113. 11β -[4-(N-метиламино)фенил]-21-метокси-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
114. 11β -[4-(N-метиламино)фенил]-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
115. 11β -[4-(N-метиламино)фенил]-21-метокси-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
116. 11β -[4-(N-метиламино)фенил]-21-метокси-3-оксимино-17α -(3,3,3-трифторпропил-1-ил)-19-норпрегна-4,9-диен-3,20-дион; гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
118. 11β -[4-(N-метиламино)фенил]-21-метокси-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
119. 11β -[4-(N-метиламино)фенил]-21-метокси-6-фтор-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
120. 11β -[4-(N-метиламино)фенил]-21-метокси-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
121. 11β -[4-(N-метиламино)фенил]-21-метокси-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4, 9-диен-3,20-дион;
122. 11β -[4-(N-метиламино)фенил]-21-метокси-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
123. 11β -[4-(N-метиламино)фенил]-21-метокси-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
124. 11β -[4-(N-метиламино)фенил]-21-метокси-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
125. 11β -[4-(N-метиламино)фенил]-21-метокси-6-метил-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
126. 11β -[4-(N-метиламино)фенил]-21-метокси-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
127. 11β -[4-(N-метиламино)фенил]-21-метокси-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
128. 11β -[4-(N-метиламино)фенил]-21-метокси-6-метил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
129. 11β -[4-(N-метиламино)фенил]-21-метокси-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен 3,20-дион;
130. 11β -[4-(N-метиламино)фенил]-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
131. 11β -[4-(N-метиламино)фенил]-21-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
132. 11β -[4-(N-метиламино)фенил]-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
133. 11β -[4-(N-метиламино)фенил]-21-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
134. 11β -[4-(N-метиламино)фенил]-21-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
135. 11β -[4-(N-метиламино)фенил]-21-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
136. 11β -[4-(N-метиламино)фенил]-21-метил-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
137. 11β -[4-(N-метиламино)фенил]-21-метил-6-фтор-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
138. 11β -[4-(N-метиламино)фенил]-21-метил-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
139. 11β -[4-(N-метиламино)фенил]-21-метил-6-фтор-3-оксимино-17α -(1-пропинил) -19-норпрегна-4,9-диен-3,20-дион;
140. 11β -[4-(N-метиламино)фенил]-21-метил-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
141. 11β -[4-(N-метиламино)фенил]-21-метил-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
142. 11β -[4-(N-метиламино)фенил]-6, 21-диметил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
143. 11β -[4-(N-метиламино)фенил]-6,21-диметил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
144. 11β -[4-(N-метиламино)фенил]-6,21-диметил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
145. 11β -[4-(N-метиламино)фенил]-6, 21-диметил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
146. 11β -[4-(N-метиламино)фенил]-6,21-диметил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
147. 11β -[4-(N-метиламино)фенил]-6,21-диметил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4, 9-диен-3, 20-дион;
148. 11β -[4-(N-метиламино)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
149. 11β -[4-(N-метиламино)фенил]-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
150. 11β -[4-(N-метиламино)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
151. 11β -[4-(N-метиламино)фенил]-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
152. 11β -[4-(N-метиламино)фенил]-6-фтор-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
153. 11β -[4-(N-метиламино)фенил]-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
154. 11β -[4-(N-метиламино)фенил]-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
155. 11β -[4-(N-метиламино)фенил]-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
156. 11β -[4-(N-метиламино)фенил]-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
157. 11β -[4-(N-метиламино)фенил]-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
158. 11β -[4-(N-метиламино)фенил]-6-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
159. 11β -[4-(N-метиламино)фенил]-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
160. 11β -[4-(N-метиламино)фенил]-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
161. 11β -[4-(N-метиламино)фенил]-6-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
162. 11β -[4-(N-метиламино)фенил]-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
163. 21-ацетокси-11β -(4-аминофенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
164. 21-ацетокси-11β -(4-аминофенил)-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
165. 21-ацетокси-11β -(4-аминофенил)-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
166. 21-ацетокси-11β -(4-аминофенил)-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
167. 21-ацетокси-11β -(4-аминофенил)-3-оксимино-17α -(3, 3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
168. 21-ацетокси-11β -(4-аминофенил)-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
169. 21-ацетокси-11β -(4аминофенил)-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
170. 21-ацетокси-11β -(4-аминофенил)-6-фтор-17α -(3, 3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
171. 21-ацетокси-11β -(4-аминофенил)-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
172. 21-ацетокси-11β -(4-аминофенил)-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
173. 21-ацетокси-11β -(4-аминофенил)-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
174. 21-ацетокси-11β -(4-аминофенил)-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
175. 21-ацетокси-11β -(4-аминофенил)-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
176. 21-ацетокси-11β -(4-аминофенил)-6-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
177. 21-ацетокси-11β -(4-аминофенил)-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
178. 21-ацетокси-11β -(4-аминофенил)-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
179. 21-ацетокси-11β -(4-аминофенил)-6-метил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
180. 21-ацетокси-11β -(4-аминофенил)-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
181. 21-ацетокси-11β -[4-(N, N-диметиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
182. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
183. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
184. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
185. 21-ацетокси-11β -[4-(N, N-диметиламино)фенил]-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
186. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
187. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
188. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-фтор-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
189. 21-ацетокси-11β -[4-(N, N-диметиламино)фенил]-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
190. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
191. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-фтор-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3, 20-дион;
192. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
193. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
194. 21-ацетокси-11β -[4-(N, N-диметиламино)фенил]-6-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
195. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
196. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3, 20-дион;
197. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-метил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
198. 21-ацетокси-11β -[4-(N,N-диметиламино)фенил]-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
199. 21-ацетокси-11β -[4-(N-метиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
200. 21-ацетокси-11β -[4-(N-метиламино)фенил]-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
201. 21-ацетокси-11β -[4-(N-метиламино)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
202. 21-ацетокси-11β -[4-(N-метиламино)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
203. 21-ацетокси-11β -[4-(N-метиламино)фенил]-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
204. 21-ацетокси-11β -[4-(N-метиламино)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
205. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-фтор-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
206. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-фтор-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
207. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-фтор-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
208. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-фтор-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
209. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-фтор-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
210. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-фтор-3-оксимино-17α (-(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
211. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
212. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
213. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
214. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3, 20-дион;
215. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
216. 21-ацетокси-11β -[4-(N-метиламино)фенил]-6-метил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион.
Конкретные соединения формулы II представляют собой
1. 11β -(4-ацетилфенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
2. 11β -(4-ацетилфенил)-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
3. 11β -(4-ацетилфенил)-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
4. 11β -(4-ацетилфенил)-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
5. 11β -(4-ацетилфенил)-21-метокси-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
6. 11β -(4-ацетилфенил)-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
7. 11β -(4-ацетилфенил)-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
8. 11β -(4-ацетилфенил)-21-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
9. 11β -(4-ацетилфенил)-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
10. 11β -(4-метоксифенил)-17α -(1-пропинил)-19-норпрегна-4, 9-диен-3,20-дион;
11. 11β -(4-метоксифенил)-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
12. 11β -(4-метоксифенил)-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
13. 11β -(4-метоксифенил)-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
14. 11β -(4-метоксифенил)-21-метокси-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
15. 11β -(4-метоксифенил)-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
16. 11β -(4-метоксифенил)-21-метокси-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
17. 11β -(4-метоксифенил)-21-метокси-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
18. 11β -(4-метоксифенил)-21-метокси-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
19. 11β -(4-метоксифенил)-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
20. 11β -(4-метоксифенил)-21-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
21. 11β -(4-метоксифенил)-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
22. 11β -(4-метоксифенил)-21-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
23. 11β -(4-метоксифенил)-21-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
24. 11β -(4-метоксифенил)-21-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
25. 11β -(4-метоксифенил)-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
26. 11β -(4-метоксифенил)-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
27. 11β -(4-метоксифенил)-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
28. 11β -[4-(метилсульфонил)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
29. 11β -[4-(метилсульфинил)фенил]-17α -(3,3, 3-трифторпропин-1ил)-19-норпрегна-4, 9-диен-3,20-дион;
30. 11β -[4-(метилсульфинил)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
31. 11β -[4-(метилсульфинил)фенил]-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
32. 11β -[4-(метилсульфинил)фенил]-21-метокси-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
33. 11β -[4-(метилсульфинил)фенил]-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
34. 11β -[4-(метилсульфинил)фенил]-21-метокси-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
35. 11β -[4-(метилсульфинил)фенил]-21-метокси-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
36. 11β -[4-(метилсульфинил)фенил]-21-метокси-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
37. 11β -[4-(метилсульфинил)фенил]-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
38. 11β -[4-(метилсульфинил)фенил]-21-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
39. 11β -[4-(метилсульфинил)фенил]-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
40. 11β -[4-(метилсульфинил)фенил]-21-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
41. 11β -[4-(метилсульфинил)фенил]-21-метил-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
42. 11β -[4-(метилсульфинил)фенил]-21-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион;
43. 11β -[4-(метилсульфинил)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
44. 11β -[4-(метилсульфинил)фенил]-3-оксимино-17α -(3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
45. 11β -[4-(метилсульфинил)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
46. 11β -[4-(метилтио)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
47. 11β -[4-(метилтио)фенил]-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
48. 11β -[4-(метилтио)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
49. 11β -[4-(метилтио)фенил]-21-метокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
50. 11β -[4-(метилтио)фенил]-21-метокси-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
51. 11β -[4-(метилтио)фенил]-21-метокси-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
52. 11β -[4-(метилтио)фенил]-21-метокси-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
53. 11β -[4-(метилтио)фенил]-21-метокси-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
54. 11β -[4-(метилтио)фенил]-21-метокси-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
55. 11β -[4-(метилтио)фенил]-21-метил-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
56. 11β -[4-(метилтио)фенил]-21-метил-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
57. 11β -[4-(метилтио)фенил]-21-метил-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
58. 11β -[4-(метилтио)фенил]-21-метил-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
59. 11β -[4-(метилтио)фенил]-21-метил-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
60. 11β -[4-(метилтио)фенил]-21-метил-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
61. 11β -[4-(метилтио)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
62. 11β -[4-(метилтио)фенил]-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
63. 11β -[4-(метилтио)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
64. 21-ацетокси-11β -(4-ацетилфенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,2-дион;
65. 21-ацетокси-11β -(4-ацетилфенил)-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
66. 21-ацетокси-11β -(4-ацетилфенил)-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
67. 21-ацетокси-11β -(4-метоксифенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
68. 21-ацетокси-11β -(4-метоксифенил)-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
69. 21-ацетокси-11β -(4-метоксифенил)-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
70. 21-ацетокси-11β -(4-метоксифенил)-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
71. 21-ацетокси-11β -(4-метоксифенил)-3-оксимино-17α -(3, 3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
72. 21-ацетокси-11β -(4-метоксифенил)-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
73. 21-ацетокси-11β -[4-(метилсульфинил)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
74. 21-ацетокси-11β -[4-(метилсульфинил)фенил]-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
75. 21-ацетокси-11β -[4-(метилсульфинил)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
76. 21-ацетокси-11β -[4-(метилсульфинил)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
77. 21-ацетокси-11β -[4-(метилсульфинил)фенил]-3-оксимино-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
78. 21-ацетокси-11β -[4-(метилсульфинил)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
79. 21-ацетокси-11β -[4-(метилтио)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
80. 21-ацетокси-11β -[4-(метилтио)фенил]-17α -(3,3,3-трифторпропин-1-ил)-19-норпрегна-4, 9-диен-3,20-дион;
81. 21-ацетокси-11β -[4-(метилтио)фенил]-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
82. 21-ацетокси-11β -[4-(метилтио)фенил]-3-оксимино-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион;
83. 21-ацетокси-11β -[4-(метилтио)фенил]-3-оксимино-17α -(3,3, 3-трифторпропин-1-ил)-19-норпрегна-4,9-диен-3,20-дион;
84. 21-ацетокси-11β -[4-(метилтио)фенил]-3-оксимино-17α -(3-гидроксипропин-1-ил)-19-норпрегна-4,9-диен-3, 20-дион.
Соединения по данному изобретению могут быть синтезированы обычными способами, известными специалистами в данной области, такими, которые схематически представлены на схеме 1, исходя из эстрона, который преобразовывали в его метиловый эфир (2) с количественным выходом, путем взаимодействия К2СО3 и МеI в МеОН. Метиловый эфир эстрона затем преобразовывали в соответствующее 17-цианосоединение (3) взаимодействием кетона трет-ВиОК и TosMIC В ДМЭ (Oldenziel О.Н. and van Leusen A.М. Tetrahedron Lett., 13, 1357-1360 (1973); Bull. J. R. and Tuinman A. Tetrahedron, 31, 2151-2155 (1975). 17-Карбонитрил получали с 76% выходом в виде смеси 17α и 17β -изомеров. Используя МеМgВr при кипячении с обратным холодильником в ТГФ, 17-карбонитрил преобразовывали в соответствующее 17-ацетильное соединение (4) с количественным выходом (сравни Bull and Tuinman, 1975). Кипячение с обратным холодильником 4 в толуоле с уксусным ангидридом и п-TsOH давало ацетат енола 5 в виде смеси Е и Z изомеров с 70%-ным выходом.
Ацетат енола преобразовывали в 17β -ацетил-17α -гидроксиметильное соединение (6) с 65%-ным выходом, используя свежерасплавленный ZnCl2 и газообразный формальдегид в сухом эфире [сравни, J.R. Reel and C.E. Cook, патент США 4512986 (1985)].
20-Кетон восстанавливали в соответствующую смесь эпимеров 20-спирт с 90%-ным выходом с помощью алюмогидрида лития (LAH) всухом тетрагидрофуране (ТГФ). Нет необходимости разделения этой смеси и смесь могла быть использована в последующих трех стадиях по схеме синтеза без очистки промежуточных продуктов. Восстановление по Birch литием и жидким NН3 в ТГФ и трет-ВuОН давало эфир энола 8, который обрабатывали щавелевой кислотой с получением 5(10)-ен-3-она (9). Обработка этого соединения трибромидом пиридина в сухом пиридине позволяла окислить его в желаемый 4,9-диен-3-он (10) с общим 3-стадийным с получением 55-60% после очистки.
Окисление двух спиртовых групп в кетон и альдегид достигалось взаимодействием 10 в условиях Swern с получением желаемого 17β -ацетил-17α -формильного соединения (11) с 70-75%-ным выходом после очистки. Альдегид взаимодействовал (сравни Reel and Cook, 1985) с Seyferth/Gilbert реагентом (Brown D.G.; Velthuisen, E.J.; Commenford, J.R.; Brisbois R. G.; and Hoye T.R.J. Org. Chem., 61, 2540-2541 (1996)) с получением 17β -ацетил-17α -этинильного соединения (12) с 78%-ным выходом.
Монокетализация 12 достигала с 80%-ного выхода обработкой дикетона в бензоле этиленгликолем и каталитическим количеством п-TsOH с получением производного 3-кеталь-5(10), 9(11)-диен-20-она (13). Восстановление 20-кетона с помощью NaBH4 и обработка полученного спирта 14 в сухом пиридине триметилсилилхлоридом (TMSCl) дает эфир TMS 15 с 80%-ным выходом. Обработка этого соединения литий N-трет-бутил-N-триметилсилиламидом и метилйодидом приводила к пропинильному соединению (16) с 80-90%-ным выходом.
Получение 5(10)а-эпоксида 17 легко достигали путем обработки 16 гексафторацетоном, H2O2 и Na2HPO4 в CH2Cl2 при 0° С в течение ночи. Это взаимодействие давало оба а и β эпоксида, но при очистке α -эпоксид выделяли с приблизительно 60%-ным выходом и 90%-ной чистотой. Взаимодействие эпоксида с арильным реагентом Гриньяра, полученным из п-N,N-диметиламинофенилбромида и CuCl, дает арильное соединение 18а с получением 70-75%.
Декетализация по 3 положению, дегидратация С5-гидроксила и удаление защиты у 20-гидроксидиенона достигали одностадийно путем обработки соединения 18а водной трифторуксусной кислотой в СН2Сl2. После очистки получали желаемое 20-гидроксисоединение 19а с получением до 90%. Окисление 20-кетона А-1 затем осуществляли обработкой о-йодоксибензойной кислотой (IBX) (сравни Frigerio M. and Santagostino M. Tetrahedron Lett., 35(43), 8019-8022 (1994)), хотя сообщалось что IBX не действует в присутствии анилина (Frigerio M.; Santagostino M.; Sputore S.; Palmisano G.J. Org. Chem., 60, 7272-7276 (1995)). Использование большого избытка IBX приводило к получению желаемого продукта (А-1) вместе с 10-20% соответствующего N-формильного соединения, полученного путем окисления одной из метильных групп N,N-диметиламинофенильного фрагмента до формила. При использовании диметилсульфоксида (ДМСО) в качестве единственного растворителя и только 1,52 эквивалента IBX, А-1 получали с 43-51% выходом при 20-25% регенерации исходного спирта (19а), который может быть рециклизован для повышения общего выхода.
Синтез других 17α -пропинильных соединений может быть осуществлен аналогичными способами (смотри примеры).
Стероиды, обладающие прогестативной, антипрогестативной и/или антиглюкокортикоидной активностью используются для контроля за уровнем рождаемости у людей и млекопитающих, таких как приматы, домашние животные и сельскохозяйственные животные, и при лечении медицинских состояний у животных или людей, при которых желательны эти виды активности. Таким образом, они могут использоваться при лечении состояний, такие как фиброиды, синдром Кушинга, глаукома, эндометриоз, усиление созревания шейки матки до родоразрешения, в гормонозаместительной терапии, при предменструальном синдроме и злокачественных новообразованиях, в дополнение к их использованию для контроля за уровнем рождаемости и репродукцией.
Соединения по настоящему изобретению могут вводиться различными способами. Таким образом, продукты по изобретению, которые активны при пероральном пути введения, могут вводиться в виде раствора, суспензии, эмульсии, таблеток, включая подъязычные и интрабуккальные таблетки, мягких желатиновых капсул, включая растворы, используемые в мягких желатиновых капсулах, водной или масляной суспензии, эмульсии, пилюли, пастилки, троше, таблетки, сиропы или эликсиры и тому подобное. Продукты по изобретению, которые активны при парентеральном пути введения, могут быть введены с помощью инъекции депо-препарата, имплантов, включая Silastic™ и биодеградирующие имплантанты, внутримышечных и внутривенных инъекций.
Композиции могут быть получены любым способом, известным специалистам в данной области для приготовления фармацевтической композиции, и такие композиции могут содержать один или несколько агентов, выбранных из группы, включающей подсластители, ароматизаторы, окрашивающие средства и консерванты. Приемлемыми являются таблетки, содержащие активный ингредиент в смеси нетоксичными фармацевтически приемлемыми эксципиентами, который подходят для производства таблеток. Этими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие или разрыхляющие агенты, такие как кукурузный крахмал или альгиновая кислота; связывающие агенты, такие как крахмал, желатин или гуммиарабик; и смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми или могут быть покрыты известными методами для задержки разрушения и адсорбции в желудочно-кишечном тракте, что обеспечивает пролонгированное действие в течение длительного периода. Например, могут быть использованы задерживающее высвобождение вещество, такое как глицерилмоностеарат или глицирилдистеарат, само по себе или вместе с воском.
Составы для перорального использования могут также быть представлены твердыми желатиновыми капсулами, в которых активный ингредиент находится в виде смеси с инертным твердым растворителем, например карбонатом кальция, фосфатом кальция или каолином, или мягкими желатиновыми капсулами, в которых активный ингредиент представляет собой смесь водной или масляной сред, такой как арахисовое масло, жидкий парафин или оливковое масло.
Водные суспензии по данному изобретению содержат активный ингредиент в смеси с эксципиентом, подходящим для получения водных суспензий. Такие эксципиенты включают суспендирующий агент, такой как натрий карбометилцеллюлоза, метилцеллюлоза, гидроксипропилэтилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь, и диспергирующий или увлажняющий агенты, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинно-цепочечным алифатическим спиртом (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с частичным эфирным производным жирной кислоты и гекситолом (например, моноолеат полиоксиэтиленсорбитола) или продукт конденсации этиленоксида с частичным эфирным производным жирной кислоты и ангидрида гекситола (например, моноолеат полиоксиэтиленсорбитана). Водная суспензия может также содержать один или несколько консервантов, таких как этил или н-пропил п-гидроксибензоата, один или несколько красителей, один или несколько вкусовых агентов и один или несколько подсластителей, таких как сахароза, аспартам или сахарин. Офтальмологические составы, как известно специалистам в данной области, должны быть доведены до осмотического давления.
Масляные суспензии могут быть получены суспендированием активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Подсластители могут добавляться для улучшения вкусового качества пероральных составов. Эти композиции могут быть представлены дополнительным количеством антиоксиданта, таким как аскорбиновая кислота.
Дисперсные порошки и гранулы по настоящему изобретению, подходящие для получения водных суспензий при добавлении воды, получают из активных ингредиентов в смеси с диспергатором, суспендирующим и/или увлажняющим агентом, и одним или несколькими консерваторами. Подходящие диспергирующие или увлажняющие агенты и суспердирующие агенты представляет собой, например, такие как указано выше. Дополнительные эксципиенты, например подсластители, ароматизаторы и красители, также могут быть представлены.
Фармацевтическая композиция по настоящему изобретению также может быть получена в виде масляно-водных эмульсий. Масляная фаза представляет собой растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как жидкий парафин, или их смесь. Подходящие эмульгирующие агенты включают натуральные камеди, такие как гуммиарабик и трагакантовая камедь, натуральные фосфатиды, такие как лецитин сои, эфиры или частичные эфирные производные жирных кислот и ангидриды гекситола, такие как моноолеат сорбитана и конденсированные продукты этих частичных эфиров с этиленоксидом, такие как моноолеат полиоксиэтиленсорбитана. Эмульсии могут также содержать подсластители и ораматизаторы.
Сиропы и элексиры могут быть изготовлены с подсластителями, такими как глицерин, сорбитол или сахароза. Такие композиции могут также содержать болеутоляющие агенты, консерванты, ароматизаторы или красители.
Фармацевтические композиции по настоящему изобретению могут быть также в виде стерильных составов для инъекций, таких как стерильная инъекционная водная или масляная суспензия. Эта суспензия может быть приготовлена в соответствии с известным специалистам в данной области способом с использованием таких подходящих диспергирующих или увлажняющих агентов, которые указаны выше. Стерильные составы для инъекции могут также быть стерильным инъекционным раствором или суспензией в нетоксичном парентеральном подходящем разбавителе, таком как раствор 1,3-бутандиола. Среди подходящих носителей и растворителей, которые могут быть использованы, можно указать воду и среду Рингера, изотонический хлорид натрия. Кроме того, стерильные неразведенные масла могут быть соответственно использованы в качестве растворителя или суспендирующей среды. Для этих целей может быть использовано любое мягкое неразведенное масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, могут также быть использованы для получения инъекций. Стерилизация может проводиться обычными способами, известными специалистам в данной области, такими как асептическая фильтрация, иррадиирующая или термическая стерилизация (например, автоклавирование).
Водные составы (например, масляно-водные эмульсии, сиропы, эликсиры и составы для инъекций) могут быть получены доведением до рН оптимальной стабильности. Достижение оптимальной рН может быть произведено обычными способами, известными специалистам в данной области. Подходящие буферы для достижения рН составов также могут быть использованы.
Соединения по данному изобретению могут быть также введены в виде суппозиториев для ректального введения препарата. Эти композиции могут быть получены смешением препарата с подходящим нераздражающим эксципиентом, который представляет собой при обычной температуре твердое вещество, а при ректальной температуре становится жидким и тает при ректальном введении с высвобождением препарата. Неограничивающими примерами таких веществ являются масло какао и полиэтиленгликоли.
Они также могут вводиться интраназальным, интраокулярным, интравагинальным и интраректальными путями, включающими введение суппозиториев, порошков, аэрозольных композиций и составов для вдувания.
Продукты по изобретению, которые предпочтительно наносятся местно, могут быть нанесены как аппликаторные пластыри, растворы, суспензии, эмульсии, гели, кремы, мази, пасты, желе, краски, порошки и аэрозоли.
Продукты, имеющие антиглюкокортикоидную активность, имеют особую ценность при патологических состояниях, характеризующихся резким повышением эндогенных глюкокортикоидов, таких как синдром Кушинга, гирсуитизм, в частности, тогда, когда он связан с адреногенитальным синдромом, глазные болезни, связанные с резким повышением глюкокортикоидов, такие как глаукома, стресс-симптомы, связанные с резким повышением глюкокортикоидной секреции, и тому подобное.
Продукты, имеющие прогестативную активность, имеют особую ценность в качестве прогестативных агентов, ингибиторов овуляции, регуляции менструации, контрацептивных агентов, агентов синхронизирующих фертильный период у крупного рогатого скота и тому подобное. При использовании в контрацептивных целях, они могут быть подходящим образом смешаны с эстрогенными агентами, такими как, например, эфиры этинилэстрадиола или эстрадиола.
Продукты, имеющие антипрогестативную активность, характеризуются антагонистическими эффектами прогестерона. По существу, они имеют значение для родовспоможения и родоразрешения, при лечении фиброидов и эндометриоза и в гормонозаместительной терапии.
Соединения по изобретению могут быть использованы для контроля за фертильностью в течение всего репродуктивного цикла. Они имеют особую ценность в качестве посткоитальных контрацептивов, для приведения состоянии матки в состояние, неблагоприятное для имплантации, и в качестве ежемесячного контрацептивного агента. Они могут быть использованы для связывания с простагландинами, окситоцитами, эстрогенами и тому подобное.
Дальнейшее важное использование продуктов по изобретению связано с их способностью к медленному снижению роста гормоносвязанных злокачественных опухолей. Такие злокачественные опухоли включают опухоли почек, молочных желез, эндометрия, яичников и опухоль простаты, которые характеризуются содержанием прогестеронных рецепторов и могут вероятно иметь ответ на продукты по данному изобретению. Другие применения антипрогестативных агентов включают лечение фиброкистозного заболевания молочных желез. Некоторые злокачественные опухоли, и, в частности, меланома, могут быть успешно подвергнуты антикортикоидной терапии.
Соединения по настоящему изобретению могут вводиться любому теплокровному млекопитающему, такому как человек, домашнее животное и сельскохозяйственные животные. Домашние животные включают собак, котов и так далее. Сельскохозяйственные животные включают коров, лошадей, свиней, овец, коз и так далее.
Количество активного ингредиента, которое может быть объединено с материалом носителя для получения стандартной лекарственной формы, будет меняться в зависимости от подвергаемого лечению заболевания, вида млекопитающего и конкретного пути введения. Терапевтически эффективное количество может быть определено с помощью обычного исследования и по аналогии с количествами, используемыми для лечения тех же болезненных состояний аналогичными стероидными соединениями. Например, лекарственная форма стероида может предпочтительно содержать от 0,1 миллиграмма до 1 грамма активного ингредиента. Более предпочтительная лекарственная форма содержит от 0,001 до 0,5 грамма. Для конкретного лечения эндометриоза или фиброида может вводиться количество от 0,01 до 10 мг/кг массы тела, предпочтительно от 0, 1 до 3 мг/кг. Подобные дозировки могут быть использованы для других терапевтических целей данного изобретения. Обычно соединения могут вводиться ежедневно от 1 до 4 раз в день, предпочтительно от 1 до 2 раз в день, но при использовании, например, в гормонозаместительной терапии, они могут вводиться в циклофазном режиме. В любом случае частота и время введения дозы будут зависеть от факторов, таких как время конкретного полувыведения в организме, от вида дозированного препарата и путей введения. Следует учесть, однако, что конкретный уровень доз для любого конкретного пациента будет зависеть от различных факторов, включая активность конкретного используемого соединения; возраста, массы тела, общего состояния здоровья, пола и питания субъекта, подвергаемого лечению; времени и пути введения; скорости выведения; других лекарств, которые вводились ранее; и серьезности конкретного заболевания, подвергаемого лечению, что хорошо понятно специалисту в данной области.
Такие соединения могут быть использованы при лечении эндометриоза, лейомиомы матки (фиброиды) и некоторых злокачественных заболеваний и опухолей, в гормонозаместительной терапии, а также при контроле за различными стадиями репродукции и фертильности, такие как контрацепция. Более подробное описание возможного использования таких соединений приведено Donaldson, Molly S.; Dorflinger L.; Brown, Sarah S.; Benet, Leslie Z., Editors, Clinical Applications of Mifepristone (RU 486) and Other Antiprogestins. Committee on Antiprogestins: Assessing the Science, Institute of Medicine, National Academy Press, 1993. Они также могут использоваться в качестве промежуточных соединений в синтезе других стероидов.
Методы синтеза
Описывая в целом данное изобретение, дальнейшее его понимание может быть достигнуто с помощью ссылок на конкретные примеры, которые даны здесь только в целях иллюстрации и не предназначены для его ограничения каким-либо образом. Соединения по настоящему изобретению могут быть получены обычными способами, известными специалистам в данной области, без излишнего экспериментирования.
Примеры
Общие методы. Если не указано иного, исходные продукты с реакционной степенью чистоты были получены из коммерческих источников и использовались без дополнительной очистки. Эфир и тетрагидрофуран (ТГФ) были свежеперегнаны над натрий бензофенонкетильной парой в атмосфере азота. Все чувствительные к влаге и воздуху реакции и преобразования реагентов проводились в атмосфере сухого азота или аргона. Тонкослойную хроматографию (ТСХ) осуществляли на пластинках 60 F254, покрытых силикагелем ЕМ Science. Соединения обычно визуализировали с помощью обрызгивания УФ света (254 нм) или с помощью пара-анисальдегидом. В препаративной колоночной хроматографии использовали силикагель ЕМ Science, 60

Пример 1. Синтез 11β -[4-(N,N-диметиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион (А-1). 3-Метоксиэстра-1,3, 5(10)-триен-17-он (2).
Эстрон (1, 100,0 г, 370 ммоль) растворяли в МеОН (1,5 л), после чего добавляли К2СО3 (300,0 г, 2,17 моль). Добавляли МеI (310 мл, 4,98 моль) и смесь перемешивали при комнатной температуре в течение 70 ч. Реакционную смесь концентрировали в вакууме для удаления некоторого количества МеОН и затем выливали в ледяную воду с получением осадка. Твердое вещество собирали, экстрагируя СН2Сl2, Органический слой сушили над Мg2SO4, и растворитель удаляли в вакууме с получением соединения 2 (105, 0 г) в виде белых кристаллов с количественным выходом.1Н ЯМР δ 0,91 (с, 3, С-18 Н), 3,78 (с, 3, МеО), 6,65 (с, 1, С-4 Н), 6,72 (д, 1, J=8,6 Гц, С-2 Н), 7,21 (д, 1, J=8,6 Гц, С-1 Н).
17-Циан-3-метоксиэстра-1,3,5 (10) - триен (3).
Соединение 2 (50,0 г, 176,0 ммоль) растворяли в диметоксиэтане (ДМЭ, 1,2 L) в инертной атмосфере. Добавляли трет-ВuОН (170 мл), и затем трет-ВuОК (197,0 г, 1,76 моль) в ДМЭ (50 мл). Медленно добавляли п-толуолсульфонилизоцианат (TosMIC, 68,7 г, 352,0 ммоль) в ДМЭ (600 мл) и трет-ВuОН (50 мл) в течение 1,5 ч. Реакционную смесь гасили через 1,3 ч насыщенным NH4Cl (2 л). После перемешивания в течение нескольких часов реакционную смесь экстрагировали CH2Cl2, органические слои объединяли и промывали насыщенным солевым раствором, сушили над MgSO4 и растворитель удаляли в вакууме с выходом коричневого маслянистого твердого продукта. Очистка колоночной флэш-хроматографией (SiO2; 3:1 EtOAc/гексан повышая до 5:1 EtOAc/гексан) давало соединение 3 (39,8 г) в виде смеси 17α /β изомеров с 76%-ным выходом.1H ЯМР δ 0,86 (с, 3, С-18 Н, основной), 0,96 (с, 3, С-18 Н, побочный), 3,78 (с, 3, МеО), 6,64 (с, 1, С-4 Н), 6,71 (д, 1, J = 8,5 Гц, С-2 Н), 7, 21 (д, 1, J = 8,7 Гц, С-1 Н).
3-Метокси-19-норпрегна-1,3,5(10)-триен-20-он (4).
Соединение 3 (73,0 г, 247 ммоль) растворяли в сухом ТГФ (800 мл) в инертной атмосфере. Добавляли MeMgBr в ТГФ (800 мл, 1,12 моль) и реакционную смесь кипятили с обратным холодильником в течение 3,5 ч, затем охлаждали до комнатной температуры. Реакционную смесь гасили холодным насыщенным NH4Cl и затем подкисляли НСl, реакционную смесь экстрагировали CH2Cl2 (2 × 300 мл). Органические слои объединяли и промывали насыщенным солевым раствором, сушили над МgSO4 и концентрировали в вакууме с выходом соединения 4 (77,0 г) в виде светло-желтого твердого продукта с количественным выходом. Продукт представлял собой смесь 17α /β изомеров, и его выделяли без дополнительной очистки.1H ЯМР δ 0,65 (с, 3, С-18 Н, основной), 0,94 (с, 3, С-18 Н, побочный), 2,16 (с, 3, С-21 Н), 3,78 (с, 3, МеО), 6,63 (д, 1, J = 2,7 Гц, С-4 Н), 6,71 (дд, 1, J = 8,6, 2,8 Гц, С-2 Н), 7,21 (д, 1, J = 8,7 Гц, С-1 Н).
20-Ацетокси-3-метокси-19-норпрегна-1,3,5(10), 17(20)-тетраен (5).
Неочищенное соединение 4 (56,0 г, 179,0 ммоль) растворяли в толуоле (900 мл), и затем добавляли Ас2О (300 мл, 3,17 моль) и п-TsOH (5,0 г,45 ммоль). Смесь кипятили с обратным холодильником и отгоняли 500 мл толуола. Реакционную смесь охлаждали и добавляли еще Ас2О (210 мл, 2,22 моль) и п-TsOH (5,0 г, 45 ммоль). Реакционную смесь затем кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и гасили охлажденной на льду смесью NaOH и NaHCO3 до тех пор, пока реакционная смесь не переставала быть кислой. Водные и органические слои разделяли. Водный слой экстрагировали CH2Cl2, органические слои объединяли, промывали насыщенным солевым раствором и сушили над MgSO4, растворитель удаляли в вакууме с получением коричневого маслянистого твердого продукта. Очистка колоночной флэш-хроматографией (SiO2; 4:1 СН2Сl/гексан) давало соединение 5 (44,5 г) в виде смеси E/Z изомеров с 70%-ным выходом.1H ЯМР δ 0,87 (с, 3, С-18 Н, основной), 0,92 (с, 3, С-18 Н, побочный), 2,11 (с, 3, С-21 Н, побочный), 2,14 (с, 3, С-21 Н, основной), 3,77 (с, 3, МеО), 6,63 (с, 1Н, С-4 Н), 6,71 (д, 1, J = 8,4 Гц, С-2 Н), 7,21 (д, 1, J = 8,5 Гц, С-1 Н).
17α -Гидроксиметил-3-метоксипрегна-1,3,5 (10) -триен-20-он (6).
Соединение 5 (49,0 г,138,4 ммоль) растворяли в сухом эфире (1,3 л) в инертной атмосфере и охлаждали до 0° С. Медленно добавляли MeLi (252 мл, 352,8 ммоль) в течение 5 мин и перемешивали при 0° С в течение 20 мин, после чего добавляли свежерасплавленный ZnCl (39,0 г, 286,1 ммоль) в сухом эфире (250 мл). После дополнительных 20 мин перемешивания при 0° С, параформальдегид (20,0 г, 605 ммоль) нагревали и барботировали в реакционную смесь, которая становилась мутной, кремового цвета. Реакционную смесь нагревали до комнатной температуры, гасили NH4Cl и экстрагировали CH2Cl2, органические слои объединяли, промывали насыщенным солевым раствором и сушили над MgSO4, Растворитель удаляли в вакууме с получением желтого твердого продукта. Очистка колоночной флэш-хроматографией (чистый СН2Сl2 повышая до 5% ацетона) давала 6 (32,4 г) в виде белого твердого продукта с 68%-ным выходом.1Н ЯМР δ 7,18 (д, 1, J-8,5 Гц, С-1 Н), 6,70 (д, 1, J = 8,6 Гц, С-2 Н), 6,63 (с, 1, С-4 Н), 4,24 (дд, 1, J = 4,2, 10,2 Гц, СН2OН), 3,77 (с, 3, МеО), 3,64 (дд, 1, J = 3,7, 10,4 Гц, СН2ОН), 2,26 (с, 3, С-21 Н), 0, 71 (с, 3, С-18 Н).
17α -Гидроксиметил-3-метокси-19-норпрегна-1,3,5(10)-триен-20-ол (7).
Соединение 6 (12,0 г,35,0 ммоль) растворяли в сухом ТГФ (300 мл) в инертной атмосфере и охлаждали до 0° С. LAH (2,7 г, 71,1 ммоль) порционно добавляли в течение 10 мин. Реакционную смесь перемешивали при 0° С в течение 1,5 ч и затем медленно гасили насыщенным раствором соли Rochelle (60 мл). Органический и водный слои разделяли. Водный слой экстрагировали эфиром (5× 75 мл). Органические слои объединяли и сушили над MgSO4, растворитель удаляли в вакууме с получением белого твердого продукта в виде смеси С-20 эпимеров. Очистка колоночной флэш-хроматографией (SiO2; CH2Cl2 очищенный свыше 10% ацетон) давала три фракции [менее очищенный изомер (3,7 г, 31%), смесь менее и более полярного изомера (3,45 г, 26%) и более чистый полярный изомер (3,85 г, 32%)] с получением соединения 7 с общим выходом 89%.1H ЯМР (менее полярный изомер) δ 1,01 (с, 3, С-18 Н), 1,34 (д, 3, J = 6,5 Гц, С-21 Н), 3,78 (с, 3, МеО), 6,62 (дд, 1, J = 2,7 Гц, С-4 Н), 6,75 (д, 1, J = 2,75, 8,6 Гц, С-2 Н), 7,21 (д, 1, J = 8,53 Гц, С-1 Н).
17α -Гидроксиметил-3-метокси-19-норпрегна-2, 5(10)-диен-20-ол (8) (менее полярный изомер).
Жидкий NH.3 (250 мл) конденсировали при -78° С в инертной атмосфере. Соединение 7 (менее очищенный полярный изомер; 2,75 г, 7,98 ммоль) в ТГФ (150 мл) и трет-ВuОН (30 мл) медленно добавляли в течение 20 минут и затем добавляли литиевую проволоку (1,0 г, 144,0 ммоль). Реакционная смесь становилась синей и ее перемешивали в течение 2 ч при -78° С. Осадок медленно гасили МеОН (30 мл) и нагревали до комнатной температуры для упаривания NН3. Реакционную смесь обрабатывали ненасыщенным NH4Cl и водный слой экстрагировали EtOAc. Органические слои объединяли, промывали NH4Cl и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме с получением соединения 8 в виде белого твердого продукта. Его использовали сразу без дополнительной очистки. 20-Гидрокси-17α -гидроксиметил-19-норпрегна-5(10)-ен-3-он (9, менее полярный изомер).
Неочищенное соединение 8 (исходные 7,98 ммоль) растворяли в смеси ТГФ и диоксана и затем добавляли щавелевую кислоту (1,8 г, 20,0 ммоль) в воде (50 мл). Смесь перемешивали при комнатной температуре в течение ночи и медленно гасили разбавленным NaHCO3. Водный слой экстрагировали CH2Cl2. Органические слои объединяли, промывали NH4Cl, Н2O и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме с получением соединения 9 в виде белого твердого продукта. Его использовали без дополнительного очищения.
20-Гидрокси-17α -гидроксиметил-19-норпрегна-4,9-диен-3-он (10) (менее полярный изомер).
Неочищенное соединение 9 (исходные 7,98 ммоль) растворяли в сухом пиридине (75 мл) в инертной атмосфере и охлаждали до 0° С. Добавляли трибромидпиридин (3,11 г, 9,72 ммоль), реакционная смесь становилась оранжевой. Реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакционную смесь гасили 5% Na2SО3 (100 мл) и смесь экстрагировали три раза CH2Cl2. Органические слои объединяли и промывали разбавленным НСl, разбавленным CuSO4, H2O и насыщенным солевым раствором. Сушили над Na2SO4 и растворитель удаляли в вакууме с получением коричневого твердого продукта. Очистка колоночной флэш-хроматографией (SiO2; 1:1 EtOAc/гексан повышая до 3:2 EtOAc/гексан) давала соединение 10 (1,38 г) в виде белого твердого продукта с общим выходом 53% в течение 3 стадий.
17α -Гидроксиметил-3-метокси-19-норпрегна-2,5 (10)-диен-20-ол (8) (изомерная смесь).
Жидкий NН3 (1,5 л) конденсировали при -78° С в инертной атмосфере. Соединение 7 (изомерная смесь; 39,0 г, 113,2 ммоль) в ТГФ (1,1 л) и трет-ВuОН (400 мл) медленно добавляли в течение 50 мин, и затем добавляли литиевую проволоку (8,3 г, 1,195 моль). Синюю реакционную смесь перемешивали в течение 3 ч при -78° С. Реакционную смесь медленно гасили МеОН (250 мл) и нагревали до комнатной температуры для упаривания NН3, в течение ночи. Реакционную смесь обрабатывали водным NH4Cl, и водный слой экстрагировали EtOAc (3 × 500 мл). Органические слои объединяли, промывали Н2О и насыщенным солевым раствором, и сушили над МgSO4, растворитель удаляли в вакууме с получением соединения 8 в виде белого твердого продукта с количественным выходом сырого продукта. Его использовали сразу без дополнительной очистки.
20-Гидрокси-17α -гидрокиметил-19-норпрегн-5 (10) -ен-3-он (9) (изомерная смесь).
Неочищенное соединение 8 (исходные 113,2 ммоль) растворяли в смеси ТГФ (650 мл) и диоксане (800 мл), и затем добавляли щавелевую кислоту (22,5 г, 250,0 ммоль) в воде (500 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и медленно гасили разбавленной NаНСО3. Водный слой экстрагировали три раза СН2Сl2. Органические слои объединяли, промывали насыщенным NaHCO3 и насыщенным солевым раствором, и сушили над MgSO4. Растворитель удаляли в вакууме с получением соединения 9 в виде белого твердого продукта. Очистка колоночной флэш-хроматографией (1:1 EtOAc/гексан) давала 9 (35,7 г) в виде белого твердого продукта с 95% выходом в течение двух стадий.
20-Гидрокси-17α -гидроксиметил-19-норпрегна-4,9-диен-3-он (10) (изомерная смесь).
Неочищенное соединение 9 (35,5 г,106,7 ммоль) растворяли в сухом пиридин (600 мл) в инертной атмосфере и охлаждали до -20° С. Добавляли трибромид пиридина (41,7 г,117,3 ммоль) и реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакционную смесь гасили Na2SO3. Основной растворитель удаляли в вакууме. Оставшуюся взвесь разводили водой и экстрагировали три раза CH2Cl2. Органические слои объединяли и промывали Н2О, разбавленной CuSO4, H2O и насыщенным солевым раствором, сушили над Na2SO4 и растворитель удаляли в вакууме с получением оранжевого твердого продукта. Очистка колоночной флэш-хроматографией (1:1 EtOAc/гексан до 2:1 EtOAc/гексан) давало соединение 10 (22,32 г, 63%-ный выход) в виде белого твердого продукта.1 H ЯМР (менее полярный изомер) δ 1,14 (с, 3, С-18 Н), 1,33 (д, 3,7 = 6,47 Гц, С-21 Н), 3,74 (д, 1, J = 9,2 Гц), 3,97 (дд, 1, J = 3,3, 8,0 Гц), 5,67 (с, 1, С-4 Н); (более полярный изомер) 5 0,93 (с, 3, С-18 Н), 1,35 (д, 3, J = 6,42 Гц, С-21 Н), 3,52 (т, 1, J=3,52 Гц), 5, 67 (с, 1, С-4 Н).
17α -Формил-19-норпрегна-4,9-диен-3,20-дион (11).
Оксалилхлорид (31,8 мл, 63,6 ммоль) в CH2Cl2 (10 мл) охлаждали в инертной атмосфере до 60° С. По каплям добавляли диметилсульфоксид (ДМСО, 6,0 мл, 84,6 ммоль); наблюдали выделение газа. Реакционную смесь перемешивали в течение 30 минут, после чего медленно добавляли соединение 10 (7,0 г, 21,2 ммоль; изомерная смесь) в сухом CH2Cl2 (44 мл). Реакционную смесь перемешивали в течение 30 мин при 60° С. Затем добавляли Et3N (19,5 мл, 140,0 ммоль) и смесь перемешивали в течение 20 мин при 60° С и затем медленно нагревали до комнатной температуры в течение 1 часа. Реакционную смесь гасили Н2O, экстрагировали три раза CH2Cl2 и промывали H2O и насыщенным солевым раствором. Органический слой сушили над MgSO4 и растворитель удаляли в вакууме с получением коричневого маслянистого твердого продукта. Продукт использовали непосредственно в следующей стадии.1H ЯМР 5 9,84 (с, 1, формил Н), 5,68 (с, 1, С-4 Н), 2,34 (с, 3, С-21 Н), 0,96 (с, 3, С-18 Н).
17α -Этинил-19-норпрегна-4,9-диен-3,20-дион (12).
Трет-BuOK (3,08 г, 25,2 ммоль) в сухом ТГФ (50 мл) и (CH3O)2POCHN2 (3,78 г, 25,18 ммоль; Seyferth/Gilbert реагент) в сухом ТГФ (25 мл) охлаждали отдельно в инертной атмосфере до -78° С. Реагент Seyferth/Gilbert затем медленно обрабатывали раствором трет-BuOK и перемешивали в течение 10 мин при -78° С. Медленно добавляли соединение 11, полученное в результате вышеуказанного взаимодействия (исходные 19,0 ммоль) в сухом ТГФ (80 мл). Реакционную смесь перемешивали при -78° С и медленно нагревали до комнатной температуры в течение ночи. Реакционную смесь гасили Н2O и экстрагировали четыре раза CH2Cl2. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над MgSO4. Растворитель удаляли в вакууме с получением коричневого твердого продукта. Очистка колоночной флэш-хроматографией (1:1 EtOAc/гексан) давало желаемый продукт 12 в виде светло-желтого твердого продукта (4,98 г) с общим выходом 10, равным 73%.1H ЯМР δ 5,70 (с, 1, С-4 Н), 2,45 (с, 1, этинил Н), 2,32 (с, 3, С-21 Н), 0,76 (с, 3, С-18 Н).
3,3-[1,2-этиандиилбис(окси)]-17α -этинил-19-норпрегна-5 (10),9(11)-диен-20-он (13).
Соединение 12 (5,67 г, 17,6 ммоль) растворяли в бензоле (300 мл) и обрабатывали этиленгликолем (11,8 мл, 211,8 ммоль) и п-TsOH (330 мг, 1,74 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 1,5 ч, охлаждали до комнатной температуры и гасили водным NаНСО3. Водный слой экстрагировали дважды EtOAc. Органические слои объединяли, промывали Н2О и насыщенным солевым раствором и сушили над MgSO4. Растворитель удаляли в вакууме с получением желтого твердого продукта. Очистка с помощью колоночной флэш-хроматографии (1:1 EtOAc/гексан) давало желаемое продукт 13 (6,11 г, 95%-ный выход).1H ЯМР δ 5,60 (ушир. с, 1, С-11 Н), 4,04 (с, 4, кетал), 2,43 (с, 1, этинил Н), 2,31 (с, 3, С-21 Н), 0,59 (с, 3, С-18 Н).
3,3-[1,2-Этандиилбис (окси)]-17α -этинил-19-норпрегна-5(10),9(11)-диен-20-ол (14).
Соединение 13 (6,1 г, 16, 6 ммоль) растворяли в сухом ТГФ (90 мл) и EtOH (50 мл) в инертной атмосфере. Добавляли NaBH4 (1,26 г,33,3 ммоль) и реакционную смесь нагревали в течение 8 ч. Реакционную смесь гасили водным NH2OH-HCl (доводили рН до 7). Реакционную смесь экстрагировали три раза СН2Сl2. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме с получением белого твердого продукта. Выход сырого продукта был количественный и вещество использовали без дополнительной очистки в следующей стадии.lH- ЯМР δ 5,59 (ушир. с, 1, С-11 Н), 3,99 (с, 4, кетал), 3,94 (м, 1, С-20 Н), 2,29 (с, 1, этинил Н), 1,27 (д, 3, J = 6,2 Гц, С-21 Н), 0,82 (с, 3, С-18 Н).
3,3-[1,2-Этандиилбис (окси)]-17α -этинил-20-триметилсилилокси-19-норпрегна-5(10), 9(11)-диен (15).
Триметилсилилхлорид (TMSCl, 10,6 мл, 83,5 ммоль) добавляли по каплям в раствор соединения 14 (16,64 ммоль) в сухом пиридине (60 мл) в инертной атмосфере. Реакционную смесь медленно нагревали до комнатной температуры в течение 2 ч и гасили H2O. Водный слой экстрагировали три раза EtOAc, промывали Н2O и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме. Соединение очищали колоночной флэш-хроматографией (3:1 гексан/EtOAc) с получением соединения 15 (6,33 г) с общим выходом 13, равным 85%.1Н ЯМР δ 5,58 (ушир. с, 1, С-11 Н), 3,95 (с, 4, кетал), 3,85 (кв, 1, J = 6, 1 Гц, С-20 Н), 2,24 (с, 1, этинил Н), 1,22 (д, 3, J = 6,2 Гц, С-21 Н), 0,73 (с, 3, С-18 Н), 0,11 (с, 9, (СН3)3Si).
3,3-[1,2-Этандиилбис(окси))-17α -(1-пропинил)-20-триметилсилилокси-19-норпрегна-5(10), 9(11)-диен (16) (метод A).
Соединение 15 (280 мг, 0,64 ммоль) растворяли в сухом ТГФ (3,5 мл) и охлаждали до -78° С в атмосфере аргона. Затем добавляли 1 мл свежеприготовленного диизопропиламида лития (ДАЛ, 0,75 ммоль). Реакционную смесь перемешивали при -78° С в течение 1,5 ч и затем добавляли МеI (0,2 мл, 3, 2 ммоль). Реакционную смесь медленно нагревали до -40° С в течение 2 ч. Реакционную смесь гасили насыщенным NH4Cl и экстрагировали дважды СН2Сl2. Органические слои объединяли, промывали водой и насыщенным солевым раствором, и сушили над NB2SO4. Растворитель удаляли в вакууме с получением светло-желтого масла. Согласно данным1H ЯМР 33% этинильного соединения было метилировано. Смесь продукт/исходное вещество еще раз подвергали тем же условиям, которые описаны выше, для увеличения выхода желаемого продукта (16) в смеси.
3,3-[1,2-Этандиилбис(окси)]-17α -(1-пропинил)-20-триметилсилилокси-19-норпрегна-5(10), 9(11)-диен (16) (метод B).
N-Трет-бутилтриметилсилиламин (6,2 мл, 32,5 ммоль), растворенный в сухом ТГФ (31 мл), охлаждали до -78° С в инертной атмосфере. При добавлении н-BuLi (13,0 мл, 32,5 ммоль) в течение 3 мин раствор становился светло-желтым. Анионный раствор перемешивали в течение 20 мин при -78° С и затем нагревали до 0° С в течение 40 мин перед использованием.
Соединение 15 (5,7 г, 12,93 ммоль) растворяли в сухом ТГФ (40 мл) и охлаждали до -78° С в инертной атмосфере. Затем добавляли 25 мл свежеприготовленного анионного раствора, описанного выше (16,25 ммоль). Реакционную смесь перемешивали при -78° С в течение 1,75 ч и затем добавляли МеI (5,0 мл, 80,34 ммоль). Реакционную смесь медленно нагревали в течение 2,25 ч. Реакционную смесь гасили насыщенным NH4Cl и смесь экстрагировали четыре раза CH2Cl2. Органические слои объединяли, промывали водой и насыщенным солевым раствором, и сушили над Na2SO4, растворитель удаляли в вакууме с получением светло-желтого твердого продукта. Очистка колоночной флэш-хроматографией (3:1 гексан/EtOAc) давала соединение 16 (5,40 г) с 92% выходом.1H ЯМР δ 5,60 (ушир. с, 1, С-11 Н), 3,97 (с, 4, кетал), 3,82 (кв., 1, J = 6,1 Гц, С-20 Н), 1,80 (с, 3, пропинил СН3), 1,19 (д, 3, J = 6,2 Гц, С-21 Н), 0,72 (с, 3, С-18 Н), 0,12 (с, 9, (СН3)3Si). МС (El, m/z) 454 (М+).
3,3-[1, 2-Этандиилбис(окси)]-5,10α -оксидо-17α -(1-пропинил)-20-триметолсилилокси-19-норпрегн-9(11)-ен (17).
Соединение 16 (3,68 г, 8,1 ммоль) растворяли в СН2Сl2 (80 мл) охлаждали до 0° С в инертной атмосфере, после чего добавляли твердый Na2HPO4 (575 мг, 4,05 ммоль). Через 5 мин добавляли гексафторацетон (0,63 мл, 4,5 ммоль) и 50% H2O2 (1,10 мл, 16,2 ммоль). Реакционную смесь медленно нагревали до комнатной температуры в течение ночи. Реакционную смесь гасили насыщенным NaHCO3 и смесь экстрагировали три раза CH2Cl2. Органические слои объединяли, промывали насыщенным NаНСО3 и насыщенным солевым раствором и сушили над Na2SO4 . Растворитель удаляли в вакууме с получением смеси а и β эпоксидов с количественным выходом сырого продукта. Сырой продукт использовали в следующей стадии.1H ЯМР δ 6,02 (ушир. с, 1, С-11 Н), 3,92 (м, 4, кетал), 3,82 (д, 1, J = 6,1 Гц, С-20 Н), 1,80 (с, 3, пропинил СН3), 1,18 (д, 3, J = 6,2 Гц, С-21 Н), 0,70 (с, 3, С-18 Н), 0,10 (с, 9, (СН3)3Si).
11β -[4-(N,N-Диметиламино)фенил]-3,3-[1,2-этандиилбис(окси)]-5α -гидрокси-17β -(1-пропинил) -20-триметилсилилокси-19-норпрегн-9-ен (18а).
CuCl (1,45 г,14,64 ммоль) растворяли в сухом ТГФ (30 мл) и охлаждали до 0° С в инертной атмосфере. Медленно добавляли 2,0 М раствор свежеприготовленного из 4-бром-N,N-диметиланилина (36,0 мл, 72 ммоль) реагента Гриньяра. Спустя 10 мин через конюлю добавляли соединение 17 (3,35 г, 7,12 ммоль) в сухом ТГФ (35 мл). Реакционную смесь медленно нагревали до комнатной температуры в течение 1,5 ч и гасили насыщенным NH4Cl, водный слой экстрагировали три раза EtOAc. Органические слои объединяли, промывали насыщенным NH4Cl и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме с получением зеленого твердого продукта. Очистка колоночной флэш-хроматографией (3:1 гексан/ЕtOАс) давала соединение 18а (2,52 г) с 60%-ным выходом в течение двух стадий.1H ЯМР δ 7,04 (д, 2, J = 8,5 Гц, ArH), 6,62 (д, 2, J = 8,8 Гц, ArH), 4, 38 (с, 1, С-5 ОН), 4,16 (ушир. с, 1, С-11 Н), 3,95 (м, 4, кетал), 3, 68 (д, 1, J = 6,1 Гц, С-20 Н), 2,89 (с, 6, (СН3)2N), 1,86 (с, 3, пропинил СН3), 1,14 (д, 3, J = 6, 2 Гц, С-21 Н), 0,38 (с, 3, С-18 Н), 0,11 (с, 9, (СН3)3Si).
11β -[4-(N,N-Диметиламино) фенил] -17α -(1-пропинил) -19-норпрегна-4,9-диен-20-ол (19а).
Соединение 18а (2,85 г, 4,81 ммоль) растворяли в CH2Cl2 (200 мл) и охлаждали до 0° С. После этого добавляли H2O (5 мл) и трифторуксусную кислоту (ТФА, 6 мл). Реакционную смесь гасили через 45 мин насыщенным NаНСО3 и смесь экстрагировали дважды СН2Сl2. Органические слои объединяли, промывали Н2О и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме с получением желтого твердого продукта. Очистка колоночной флэш-хроматографией (1:1 EtOAc/гексан) давало соединение 19а (1,9 г) с 86,4% выходом.1H ЯМР δ 7,02 (д, 2, J = 8,6 Гц, АrН), 6,64 (д, 2, J = 8,8 Гц, АrН), 5,75 (с, 1, С-4 Н), 4,29 (ушир. д, 1, J = 6,6 Гц, С-11 Н), 3,70 (д, 1, J = 4,2, 6,1 Гц, С-20 Н), 2,90 (с, 6, (СН3 )2N), 1,90 (с, 3, пропинил СН3), 1,19 (д, 3, J = 6,2 Гц, С-21 Н), 0,51 (с, 3, С-18 Н).
11β -(4-(N/N-Диметиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион (А-1).
Соединение 19а (1,9 г, 4,15 ммоль) растворяли в ДМСО (30 мл) и затем добавляли твердую о-йодоксибензойную кислоту (IBX, 1,75 г, 6, 25 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. ТСХ показывала смесь продукта и исходного вещества. Реакционную смесь гасили разбавленной NаНСО3 (рН = 9). Полученную смесь экстрагировали пять раз эфиром. Органические слои объединяли, промывали Н2O и насыщенным солевым раствором и сушили над Na2SO4, растворитель удаляли в вакууме с получением неочищенной смеси продукта и исходного вещества. Очистка и разделение колоночной флэш-хроматографией (2:1 гексан/EtOAc) давали соединение А-1 (800 мг) с 43%-ным выходом и также выделяли исходное вещество 19а (500 мг, 26% регенерировано). Для А-1:1H ЯМР δ 7,00 (д, 2, J = 8,6 Гц, ArH), 6,64 (д, 2, J = 8,8 Гц, АrН), 5,76 (с, 1, С-4 Н), 4,39 (ушир. д, 1, J = 6,6 Гц, С-11 Н), 2,91 (с, 6, (СН3)2N), 2,29 (с, 3, С-21 Н), 1,89 (с, 3, пропинил СН,), 0,31 (с, 3, С-18 Н).
Этот продукт объединяли с ранее выделенным (общее количество 900 мг) и очищали препаративной ВЭЖХ с обратной фазой (85% МеОН:15% H2O в качестве элюента на колонке С-18) с получением 700 мг А-1, более 97% чистоты по данным аналитической ВЭЖХ. МС (El, m/z) 455 (М+). Аналитически рассчитано для C13H37NO2: С 81,72; Н 8,19; N 3, 07. Найдено: С 81,55, Н 8,24, N 3,06.
Пример 2. Синтез 11β -(4-ацетилфенил) -17α -(1-пропинил) -19-норпрегна-4,9-диен-3,20-дион (А-16).
3,3-[1, 2-Этандиилбис(окси)]-11β -{4-{1,1-[1, 2-этандиилбис(окси)]этил}фенил)-5α -гидрокси-17α -(1-пропинил)-20-триметилсилилокси-19-норпрегн-9-ен (18b).
CuCl (461 мг, 4, 66 ммоль) перемешивали в сухом ТГФ (7 мл) и охлаждали до 0° С в инертной атмосфере. Медленно добавляли 0,5 М раствор свежеприготовленного из бромацетофенонэтиленкетала реагента Grignard (46,1 мл, 23,0 ммоль). Через 10 мин через канюлю добавляли эпоксид 17 (1,095 г, 2,33 ммоль) в сухом ТГФ (18 мл). Реакционную смесь медленно нагревали до комнатной температуры в течение 1,5 ч и гасили насыщенным раствором NH4Cl. Водный слой экстрагировали три раза EtOAc. Органические слои объединяли, промывали водой и насыщенным солевым раствором и сушили над Na2SO4 . Растворитель удаляли в вакууме. Очистка сырого продукта очищали колоночной флэш-хроматографией (3:2 гексан-EtOAc) давала соединение 18b, которое использовали непосредственно в следующей стадии.
11β -(4-Ацетилфенил)-20-гидрокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3-он (19b).
Сырое соединение 18b (исходный 2,0 ммоль) растворяли в CH2 Cl2 (100 мл) и охлаждали до 0° С. Добавляли Н2О (4 мл) и трифторуксусную кислоту (3,0 мл). Реакционную смесь гасили через 1 ч насыщенным раствором NаНСО3 и смесь экстрагировали дважды СН2Сl2. Органические слои объединяли, промывали водой и насыщенным солевым раствором, и сушили над Na2SO4. Растворитель удаляли в вакууме с получением зеленовато-желтого твердого продукта. Очистка твердого продукта колоночной флэш-хроматографией (3:2 EtOAc-гексан) давала соединение 19b (690 мг) с 62%-ным выходом в течение трех стадий.lH ЯМР δ 7,87 (д, 2, J = 8,2 Гц, ArH), 7,29 (д, 2, J = 8,0 Гц, АrН), 5,79 (с, 1, С-4 Н), 4,40 (д, 1, J = 5,9 Гц, С-11α Н), 3,68 (м, 1, С-20 Н), 2,57 (с, 3, арилацетил СН3), 1,92 (с, 3, пропинил СН3), 1,20 (д, 3, J = 6,1 Гц, С-21 Н), 0,45 (с, 3, С-18 Н).
11β -(4-Ацетилфенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион (А-16).
Соединение 19b (690 мг, 1,51 ммоль) растворяли в сухом ДМСО (15 мл) и затем добавляли твердую о-йодоксибензойную кислоту (IBX) (2, 95 г, 10,53 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакцию не доводили до конца. Смесь разбавляли H2O и экстрагировали четыре раза эфиром. Органические слои объединяли, промывали водой и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме с получением оранжевого твердого продукта. Очистка колоночной флэш-хроматографией (3:2 EtOAc-гексан) давала соединение А-16 (480 мг) с 70%-ным выходом и некоторое количество повторно регенерированного исходного вещества. Соединение затем очищали препаративной ВЭЖХ (80% МеОН/20% Н2O) с получением соединения А-16 в виде белого твердого продукта со степенью чистоты более чем 97%. Т.пл. 113-118° С;1H ЯМР δ 7,88 (д, 2, J = 8,4 Гц, АrН), 7,28 (д, 2, J = 8,5 Гц, АrН), 5,80 (с, 1, С-4 Н), 4,50 (д, 1, J = 7,7 Гц, С-11 Н), 2,57 (с, 3, арилацетил СН3), 2,28 (с, 3, С-21 Н), 1,90 (с, 3, пропинил СН3), 0,25(с, 3, С-18Н). МС (El, m/z) 454 (М+). Аналитически вычислено С31Н34O3·0,25Н2O: С 81,10; Н 7,57. Найдено: С 81,15; Н 7,60.
Пример 3. Синтез 11β -[4-(метилтио) фенил] -17α -(1-пропинил) -19-норпрегна-4,9-диен-3,20-диона (А-31). 3,3-[1,2-Этандиилбис (окси)] -5α -гидрокси-11β -[4-(метилтио)фенил]-17α -(1-пропинил)-20-триметилсилилокси-19-норпрегн-9-ен (18с).
CuCl (400 мг, 4,0 ммоль) перемешивали в сухом ТГФ (8 мл) и охлаждали до 0° С в инертной атмосфере. Медленно добавляли 1,0 М свежеприготовленного раствора реагента Гриньяра из бромтиоанизола (20,0 мл, 20 ммоль). Через 10 минут через канюлю добавляли сырое соединение 17 (исходные 2,0 ммоль) в сухом ТГФ (15 мл). Реакционную смесь медленно нагревали до комнатной температуры в течение 1,5 ч и гасили насыщенным раствором NH4Cl. Водный слой экстрагировали три раза EtOAc. Органические слои объединяли, промывали насыщенным NH4Cl и насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли в вакууме. Немедленная очистка колоночной флэш-хроматографией (3:1 гексан-EtOAc) давала соединение 18с, который использовали непосредственно в следующей стадии. 11β -[4-(Метилтио)фенил]-20-гидрокси-17α -(1-пропинил)-19-норпрегна-4,9-диен-3-он (19с).
Соединение 18с (исходные 2,0 ммоль) растворяли в CH2Cl2 (80 мл) и охлаждали до 0° С. Добавляли Н2О (3 мл) и трифторуксусную кислоту (2,5 мл). Реакционную смесь гасили через 1 ч насыщенным раствором NaHCO3 и смесь экстрагировали три раза СН2Сl2. Органические слои объединяли, промывали водой и насыщенным солевым раствором и сушили над МgSO4. Растворитель удаляли в вакууме. Очистка осадка колоночной флэш-хроматографией (1:2 EtOAc-гексан) давало соединение 19с (495 мг) с 46%-ным выходом в течение трех стадий.1H ЯМР δ 7,15 (д, 2, J = 8,7 Гц, ArH), 7,09 (д, 2, J = 8,5 Гц, АrН), 5, 76 (с, 1 С-4 Н), 4,32 (д, 1, J = 6,6 Гц, С-11 Н), 3,69 (ушир. т, 1, С-20 Н), 2,45 (с, 3, SСН3), 1,91 (с, 3, пропинил СН3), 1,19 (д, 3,7 = 6,15 Гц, С-21 Н), 0,48 (с, 3, С-18 Н).
11β -[4-(Метилтио) фенил] -17α -(1-пропинил) -19-норпрегна-4, 9-диен-3,20-дион (А-31).
Соединение 19с (495 мг, 1,07 ммоль) растворяли в сухом ДМСО (15 мл) и затем добавляли твердый IBX (1,5 г, 5,36 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь гасили Н2О и смесь экстрагировали четыре раза эфиром. Органические слои объединяли, промывали водой и насыщенным солевым раствором и сушили над Na2SO4, растворитель удаляли в вакууме. Очистка осадка колоночной флэш-хроматографией (3:2 гексан-EtOAc) давала соединение А-31, чистота которого по данной препаративной ВЭЖХ более 97%. Дальнейшая очистка препаративной ВЭЖХ (85% МеОН-15% H2O) давала чистый А-31 (340 мг) с 69%-ным выходом. Т.пл. 164-167,5° С;1H ЯМР δ 7, 16 (д, 2, J = 8,5 Гц, ArH), 7,08 (д, 2, J = 8,5 Гц, АrН), 5,78 (с, 1, С-4Н), 4,35 (д, 1, J = 7,3 Гц, С-11α Н), 2, (с, 3, SCH,), 2,28 (с, 3, С-21 Н), 1,89 (с, 3, пропинил СН3), 0,28 (с, 3, С-18 Н). МС (EI, m/z) 458 (М+). Аналитические вычисления для С30Н34O2S: С 78,56; Н 7,47; S 6,99. Найдено С 78,48; Н 7,50, S 6,91.
Биологическую активность соединений по данному изобретению исследовали с помощью in vitro и in vivo методов.
Связывание рецепторов. Сродство соединения к гормональным рецепторам определяли обычными методами, подобными тем, которые были описаны, среди прочих, Wagner et al., Proc. Natl. Acad. Sci., 93, 8739-8744 (1996) для клеток COS-1. Клетки линии карциномы молочной железы человека (T-47D) использовали для оценки RBA прогестиновых рецепторов. Используемую клеточную линию получили от АТСС (American Type Culture Collection) и хранили замороженную при -135° С в течение недели до за неделю до проведения исследования. Клетки размораживали и культурировали для достижения желательного числа клеток (в среднем от 5 до 7 дней). Их поддерживали при 37° С в среде для роста, пока они не образовывали 90-100% конфлюент, после чего их выделяли из колб для роста клеток и диспергировали в отдельных лунках 12-луночного планшета для культуры ткани в количестве 4, 0 × 105 клеток на один мл среды в лунке. Через 24 ч клетки адгезировались на дно 12-луночного планшета. В это время начинали проведение исследования на рецепторное связывание путем добавления испытуемого или стандартного соединений с3H-R5020 (промегестон). После инкубации в течение ночи, среду удаляли, клетки промывали и солюбилизировали, и радиоактивность измеряли с помощью жидкого сцинциляционного спектрометра. Неспецифическое связывание определяли инкубированием с избытком немеченого R5020 и вычитали из общего связывания для расчета специфического связывания.
Исследование связывания прогестерона проводили несколькими концентрациями указанного стандарта (промегестон, R-5020) и внутреннего стандарта (прогестерон). Эти гормоны оставляли для конкурентного связывания с обработанным конкурентом (3 H-промегестон,3H-R5020} для оценки относительного связывания. Тестируемые стероиды были исследованы при трех или нескольких концентрациях. Если 50%-ное смещение3H-R5020 от рецептора не достигалось искомым веществом, для достижения цели исследовали высокие или низкие концентрации, по необходимости. Все соединения исследовали дважды, по крайней мере, двумя испытаниями.
Процент специфически связанного3H-R5020 был рассчитан для каждой исследуемой концентрации, и кривые связывания были представлены путем отображения процента специфического связывания3H-R5020 относительно концентрации конкурента. Относительную связывающую активность (RBA) исследуемых соединений относительно указанного стандарта (R5020), а также внутреннего стандарта, определяли по отношению концентраций, вызывающих 50%-ное замещение для каждого неизвестного и стандарта, и выражали в процентном значении. Эти концентрации получены графическим интерполированием кривых. В результате было обнаружено, что соединение 11β -[4-(N/N-диметиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион (А-1) имеет RBA 313% относительно R-5020. Аналогичное соединение 11β -[4-ацетилфенил]-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион (А-16) имеет RBA 439% относительно R-5020.
In vivo исследование. Антипрогестативую активность определяли in vivo путем изучения ответа на дозу у неполовозрелых кроликов женского пола в начальной-эстрагенной фазе цикла и результаты определяли согласно McPhail (McPhail, J. Physiol., 83: 146 (1934)). Эти исследования являются стандартными методами, хорошо известными специалистам в данной области. Для определения антипрогестативной (антогонистической) активности соединение вводили перорально вместе с подкожным введением прогестерона. Исследования проводили при пероральном введении при общей дозе 0,5, 1 и 2 мг у неполовозрелых кроликов женского пола в начальной-эстрагенной фазе цикла, которым одновременно подкожно вводили прогестерон. Кролики, весом около 1,5 кг, находились в эстрогенной фазе цикла от одного до шести дней и им один раз в день в течение 5 дней вводили всего 0,8 мг прогестерона, то есть 160 мкг/в день, наряду с этим в то же самое время вводили исследуемое соединение перорально один раз в день в разбавителе, который представлял собой 10%-ное этанол/кунжутное масло (объем 0,5 мл). Вскрытие осуществляли спустя день после введения последней дозы. Эндометриальное действие на матку определяли согласно McPhail и силу оценивали статистическим сравнением со стандартным соединением 17α -ацетокси-11β -[4-(N,N-диметиламино)фенил]-19-норпрегна-4,9-диен-3,20-дионом. Введение 17α -пропинильной группы неожиданно давало исключительно сильный антипрогестивный ответ, поскольку соединение 11β -[4-(N,N-диметиламино)фенил]-17α -(1-пропинил)-19-норпрегна-4, 9-диен-3,20-дион (А-1) при пероральном введении было в 5 раз эффективнее стандартного соединения. В свою очередь (смотри С. Е. Cook et al, Human Reproduction, 9, Supplement 1, 32-39, June 1994) стандартное соединение является приблизительно в 3 раза более сильным, чем препарат мифепристон, который в настоящее время используется для лечения людей в качестве препарата с антипрогестивной активностью, делая пропинильное соединение по данному изобретению в 15 раз сильнее мифепристона.
Аналогичное соединение, 11β -(4-ацетилфенил)-17α -(1-пропинил)-19-норпрегна-4,9-диен-3,20-дион (А-16), также обладает антипрогестивной активностью, и было от 0,15 до 0,23 раз эффективнее стандартного соединения. Гораздо меньшее действие, по сравнению со стандартным и особенно диметиламиновым аналогом, по связывающей аффинности к прогестиновому рецептору предполагает, что соединение А-16 имеет агонистическую активность, а также слабую антогонистическую активность.
В свете вышеуказанных исследований очевидна возможность многочисленных модификаций и изменений по настоящему изобретению. Поэтому должно быть ясно, что в пределах представленной формулы, изобретение может быть осуществлено иными способами, чем определено здесь.


a) Mel, K2SO4, MeOH
b) TosMIC, трет-BuOK, трет-BuOH, DME
c) MeMgBr, ТГФ, кипячение с обратным холодильником
d) Ac20, п-TsOH, толуол, кипячение с обратным холодильником
e) MeLi, эфир, 0°С
f) ZnСL2(плавленный), эфир, 0°С
g) формальдегид (газ), эфир, 0°С
h) LАН, ТГФ, 0°С
i) LiNH3 (I), ТГФ, трет-BuOH, -78°С
j) (COOH)2, ТГФ, диоксан, Н2О
k) трибромид пиримидина, пиридин, -78°С
1) СlСОСОСl, ДМСО, Et3N, CH,Cl2, -60°C
m) (CH3O)2POCHN2, трет-BuOK, ТГФ, -78°С
n) HOCH2CH20H, n-TsOH, бензол, кипячение с обратным холодильником
о) NaBH4, ТГФ, ЕtOН
р) TMSCl, пиридин, от 0°С до комнатной температуры
q) (СН3)3СNНSi(СН3)3, n-BuLi
г) Ме1
s) Гексафторацетон, Н2О2, Na2HPO4, 0°C
t) R'-C6H4MgBr, CuCt, ТГФ, 0°C
и) ТФУ, СН2Сl2, Н2О, 0°C
v) IBX, ДМСО, комнатная температура
Реферат
Изобретение относится к новому классу 17β -ацил-17α -пропинильных стероидов формулы I, где R1 - (CH3)2N-, CH3NH-, NH2-, CH3CO- или CH3S-; R2 - CH3- или CF3-; R3 - H, CH3-, CH3O-, CH3COO-; R4 - H, CH3-, F- или Cl-, и X - О, которые обладают антипрогестиновой активностью. 4 с. и 8 з. п. ф-лы.

Формула





Комментарии