Мутации enos, используемые для генной терапии и терапевтического скрининга - RU2257226C2
Код документа: RU2257226C2
Чертежи

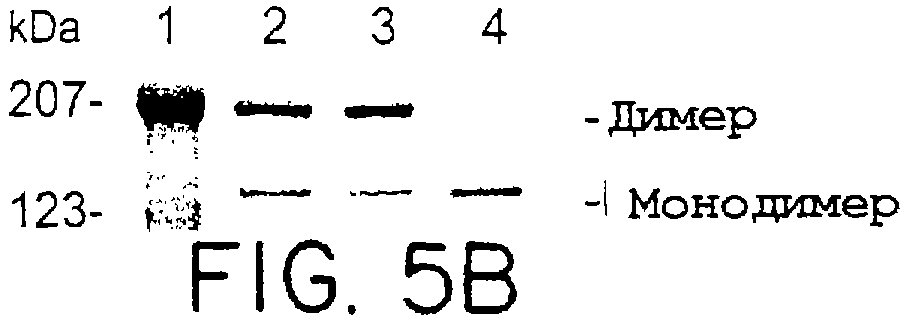
Описание
Перекрестные ссылки на родственные заявки
В настоящей заявке испрашивается приоритет Предварительной заявки США №60/129550, поданной 16 апреля 1999 г., которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Подтверждение о государственной дотации
Исследования для разработки настоящего изобретения проводились частично на средства федерального правительства, выделенные в соответствии с грантом NL 57665 и HL 61371.
Область, к которой относится изобретение
Настоящее изобретение относится к новым NOS-вариантам или мутантам, которые содержат структурные модификации в сайте Akt-зависимого фосфорилирования. Модифицированные NOS-белки или пептиды и кодирующие их молекулы нуклеиновых кислот могут быть использованы в генной терапии в качестве агентов для лечения заболеваний, включая рестеноз после ангиопластики, гипертензия, атеросклероз, сердечная недостаточность, диабет и заболевания с дефектным ангиогенезом.
Предпосылки создания изобретения
Атеросклероз и сосудистый тромбоз являются главной причиной патологий и смертности, являющихся следствием поражения коронарной артерии, инфаркта миокарда и инсульта. Атеросклероз начинается с изменения в эндотелии, выстилающем кровеносные сосуды. Изменение в эндотелии может, в конечном счете, приводить к развитию эндотелиального поражения, вызываемого отчасти поглощением окисленного холестерина липопротеина низкой плотности (ЛНП). Разрыв в участке этого поражения может приводить к тромбозу и окклюзии кровеносного сосуда. В случае поражения коронарной артерии разрыв в месте комбинированного поражения может приводить к инфаркту миокарда, а в случае поражения сонной артерии он может приводить к инсульту.
При ишемической болезни сердца, сопровождающейся атеросклерозом, эндотелиальная дисфункция может приводить к снижению продуцирования сосудорасширяющих веществ, таких как окись азота. Ишемия миокарда возникает при нарушении саморегулирующегося расширения сосудов независимо от того, является ли оно следствием кровотокограничивающего стеноза коронарной артерии или эндотелиальной дисфункции. В обоих случаях артериальный кровоток не может больше увеличиваться пропорционально возникающей потребности в кислороде. В других ситуациях ишемия миокарда может возникать в случае постоянной потребности в кислороде, но на фоне первичного снижения коронарного кровотока, опосредованного спазмом коронарной артерии, быстрым развитием атеросклеротических бляшек, образующихся на внутренней стенке сосуда и приводящих к сужению просвета коронарного артериального сосуда, и/или периодическим образованием пробок в капиллярах вследствие агрегации тромбоцитов.
Баллонная ангиопластика, в основном, используется для открытия кровеносного сосуда, суженного бляшкой. Хотя в большинстве случаев баллонная ангиопластика является достаточной для открытия сосуда, однако часто этот процесс приводит к удалению эндотелия и повреждению сосуда. Такое повреждение вызывает миграцию и пролиферацию клеток гладкой мускулатуры кровеносного сосуда в область повреждения с образованием патологии, известной как гиперплазия миоинтимы или рестеноз. Эта вновь образовавшаяся патология приводит к рецидиву симптомов через три-шесть месяцев после ангиопластики у значительного числа пациентов.
При атеросклерозе, тромбозе и рестенозе происходит также нарушение нормальной функции сосудов с тенденцией скорее к их сужению, чем расширению. Чрезмерное сужение сосуда, кроме того, приводит к уменьшению просвета сосуда, ограничивая, тем самым, кровоток. Это может приводить к возникновению симптомов, таких как стенокардия (при повреждении артерии сердца) или преходящая ишемия мозга (то есть "микроинсульт" при повреждении сосуда головного мозга). Такое нарушение функции сосудов.(чрезмерное сужение сосудов или неадекватное расширение сосудов) также возникает и при других патологических состояниях. Гипертензия (высокое кровяное давление) вызывается чрезмерным сужением сосудов, а также утолщением стенок сосудов, и в частности стенок мелких сосудов в системе кровообращения. Этот процесс может влиять на сосуды легких и может также вызывать пульмонарную (легочную) гипертензию. Другими нарушениями, которые, как известно, ассоциируются с чрезмерным сужением сосудов или с неадекватным расширением сосудов, являются атеросклероз сосуда-трансплантата, застойная сердечная недостаточность, токсикоз беременности, феномен Рейно, стенокардия Принцметала (коронарный вазоспазм), церебральный вазоспазм, гемолитическая уремия и импотенция.
Вещество, высвобождаемое эндотелием, первоначально названное "эндотелиальным фактором релаксации" (EDRF), играет важную роль в ингибировании указанных патологических процессов. В настоящее время известно, что EDRF представляет собой окись азота (NO). NO имеет много функций в физиологии человека, включая релаксацию гладкой мускулатуры сосудов, ингибирование агрегации тромбоцитов, ингибирование митогенеза, пролиферацию гладкой мускулатуры сосудов и адгезию лейкоцитов. Поскольку NO является самым сильным эндогенным вазодилататором и поскольку он является в высокой степени ответственным за индуцированное физической нагрузкой расширение артерий резервуров, усиление синтеза NO должно также способствовать улучшению способности к перенесению физической нагрузки у нормальных индивидуумов и у индивидуумов с сосудистым заболеванием.
Эндотелиальная синтаза оксида азота (eNOS) представляет собой изоформу синтазы оксида азота (NOS), ответственной за поддержание системного кровяного давления, ремоделирования сосудов и ангиогенеза (Shesely et al., 1996; Huang et al., 1995; Rudic et al., 1998; Murohara et al., 1998). Поскольку дефицит продуцирования NO в эндотелии является ранним устойчивым признаком атеросклероза и поражения сосудов, было подтверждено, что eNOS представляет собой привлекательный объект для сосудистой генной терапии. Хотя механизм регуляции активации eNOS, в основном, не определен, известно, что eNOS фосфорилируется в ответ на различные формы стимуляции клеток (Michel et al., 1993; Garcia-Cardena et al., 1996; Corson et al., 1996), однако, какую роль играет фосфорилирование в регуляции продуцирования окиси азота (NO) и какая киназа(ы) ответственна за это пока еще не выяснено.
Краткое описание изобретения
Настоящее изобретение частично основано на обнаружении того факта, что сериновая/треонининовая протеинкиназа, Akt (протеинкиназа В), может непосредственно фосфорилировать eNOS по сериновому остатку, соответствующему остатку 1179 в бычьем eNOS или остатку 1177 в eNOS человека, и активировать данный фермент, что приводит к продуцированию NO. Мутантный eNOS (S1179A или S1177A) является резистентным к фосфорилированию и активации с помощью Akt, а мутантный eNOS (S1179D и S1177D) или (S1179E и S1177E) является конститутивно активным. Кроме того, Akt, активированная переносом гена, опосредованным аденовирусом, увеличивает базальное высвобождение NO из эндотелиальных клеток, а Akt с дефицитом активации ослабляет VEGF-стимулированное продуцирование NO. Таким образом, eNOS представляет собой только что описанный субстрат для Akt, опосредующий передачу сигнала посредством Akt с высвобождением газообразного вторичного передатчика NO. Настоящее изобретение также частично основано на обнаружении того факта, что мутантный eNOS (S1179D) характеризуется увеличенной скоростью продуцирования NO и повышенной редуктазной активности.
Настоящее изобретение относится к NOS, полипептидам или белкам и к кодирующим их изолированным молекулам нуклеиновой кислоты, где указанный полипептид или белок NOS содержит замененный аминокислотный остаток, соответствующий остатку 1179 бычьего eNOS, остатку 1177 человеческого eNOS, остатку 1412 крысиного nNOS или остатку 1415 человеческого nNOS. Предпочтительными заменами являются аминокислоты с отрицательно заряженными группами R, включая аспарагиновую кислоту и глутаминовую кислоту.
Настоящее изобретение также относится к полипептидам или белкам NOS и к кодирующим их изолированным молекулам нуклеиновой кислоты, где указанный полипептид или белок NOS содержит замененный аминокислотный остаток, сооответствугощий остатку 1179 бычьего eNOS, остатку 1177 человеческого eNOS, остатку 1412 крысиного nNOS или остатку 1415 человеческого nNOS. Предпочтительными заменами являются аминокислоты с положительно заряженными группами R, такие как аланин.
Настоящее изобретение относится к способам стимуляции развития коллатеральных сосудов при ишемических заболеваниях с дефицитом эндогенного ангиогенеза, а в частности при заболеваниях периферических сосудов и/или ишемии миокарда у пациента, где указанный способ предусматривает доставку трансгена, кодирующего полипептид NOS настоящего изобретения или полипептид Akt.
Настоящее изобретение, кроме того, относится к трансгенному животному, не являющееся человеком, которое экспрессирует полипептид NOS настоящего изобретения.
И, наконец, настоящее изобретение относится к способам идентификации агента, который модулирует Akt-регулируемую активность NOS, где указанные способы включают общие стадии: (а) обработки этим агентом очищенного NOS, предпочтительно eNOS или nNOS, или клетки, экспрессирующей NOS, а предпочтительно eNOS или nNOS, и Akt; и (b) измерение Akt-регулируемой активности NOS, а предпочтительно eNOS или nNOS.
Краткое описание графического материала
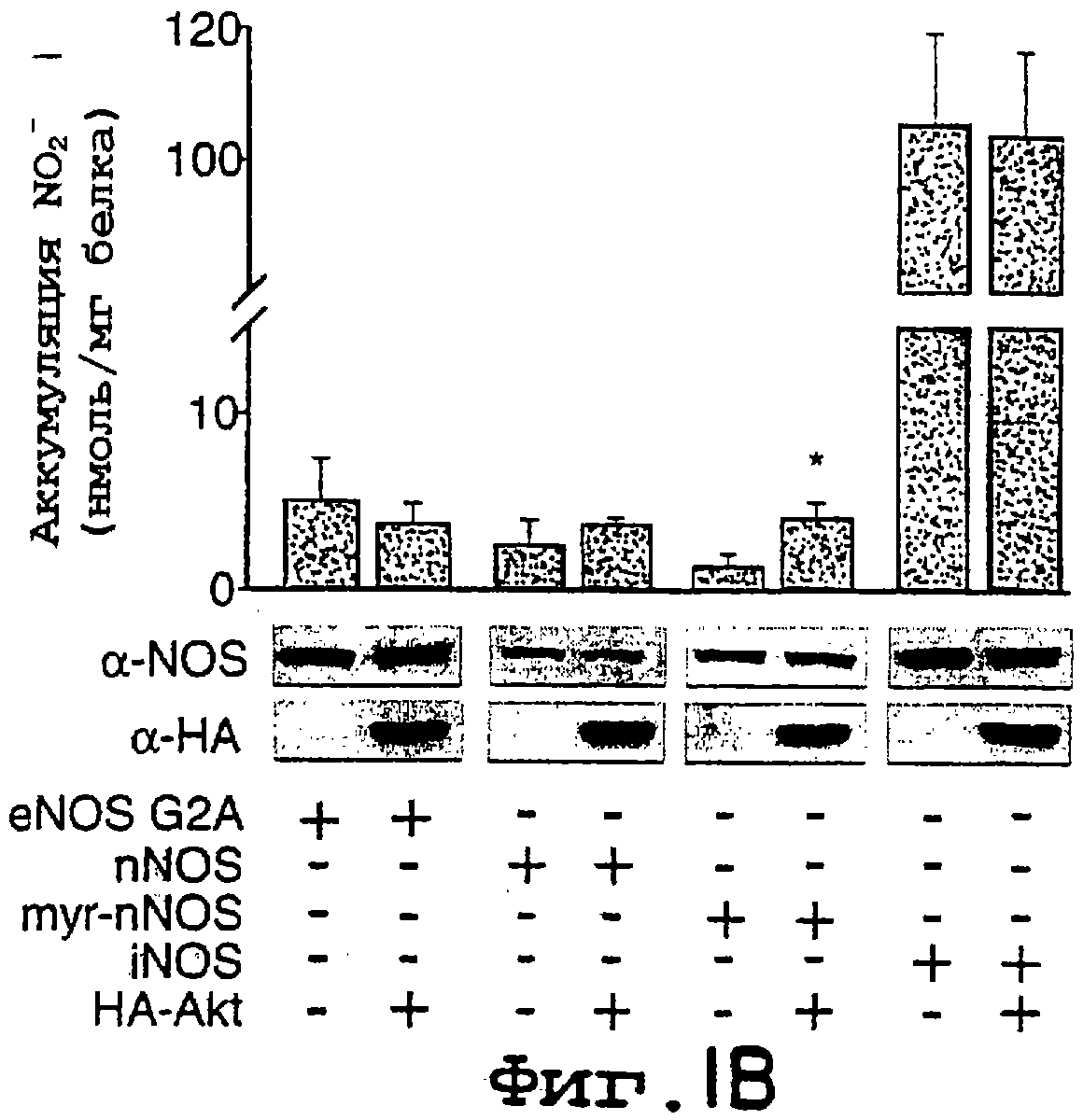
Фиг.1А-1В. Akt дикого типа, но не неактивная киназа Akt, способствует увеличению высвобождения NO из клеток, экспрессирующих мембрано-ассоциированный eNOS. На фиг.1А клетки COS трансфецировали плазмидами для eNOS в отсутствии или в присутствии Akt или неактивной киназы Akt (K179M), и продуцирование NO (анализируемого как NO2-) определяли с помощью хемилюминисценции. На фиг.1В клетки COS трансфецировали различными NOS-плазмидами, описанными выше. На фиг.1А и на фиг.1В величины для продуцирования NO2- вычитали из уровней, полученных от клеток, трансфецированных только кДНК β-галактозидазы. Вставка иллюстрирует экспрессию белков в полных лизатах клеток. Данные представляют собой среднее ± ср.кв.от., n=3-7 экспериментов; * означает р<0,05.
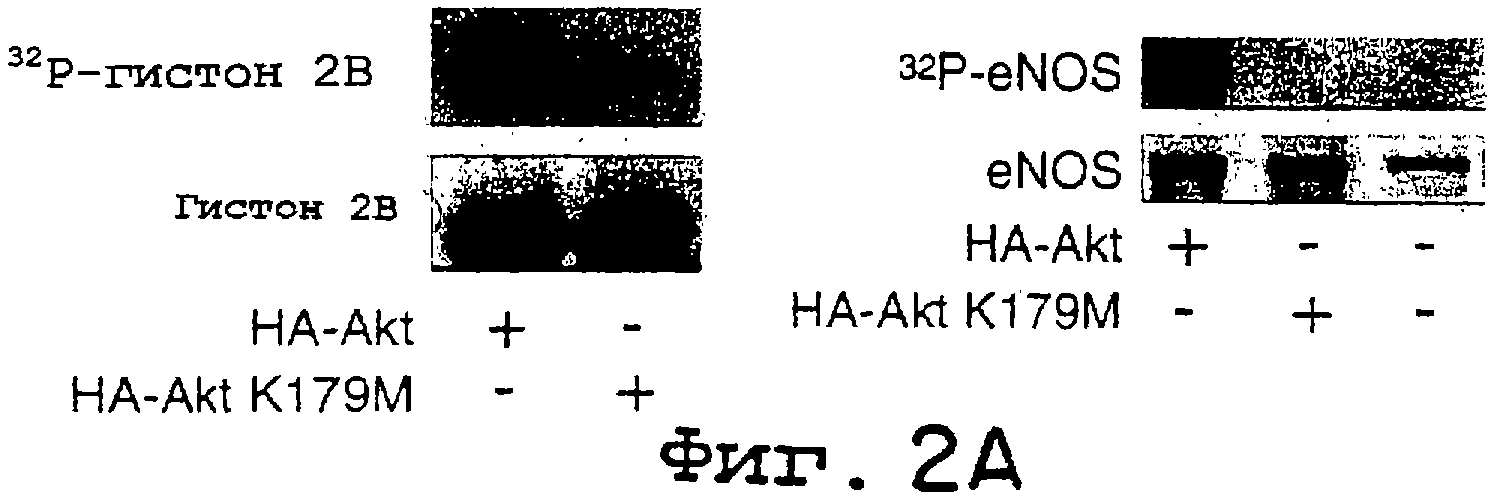
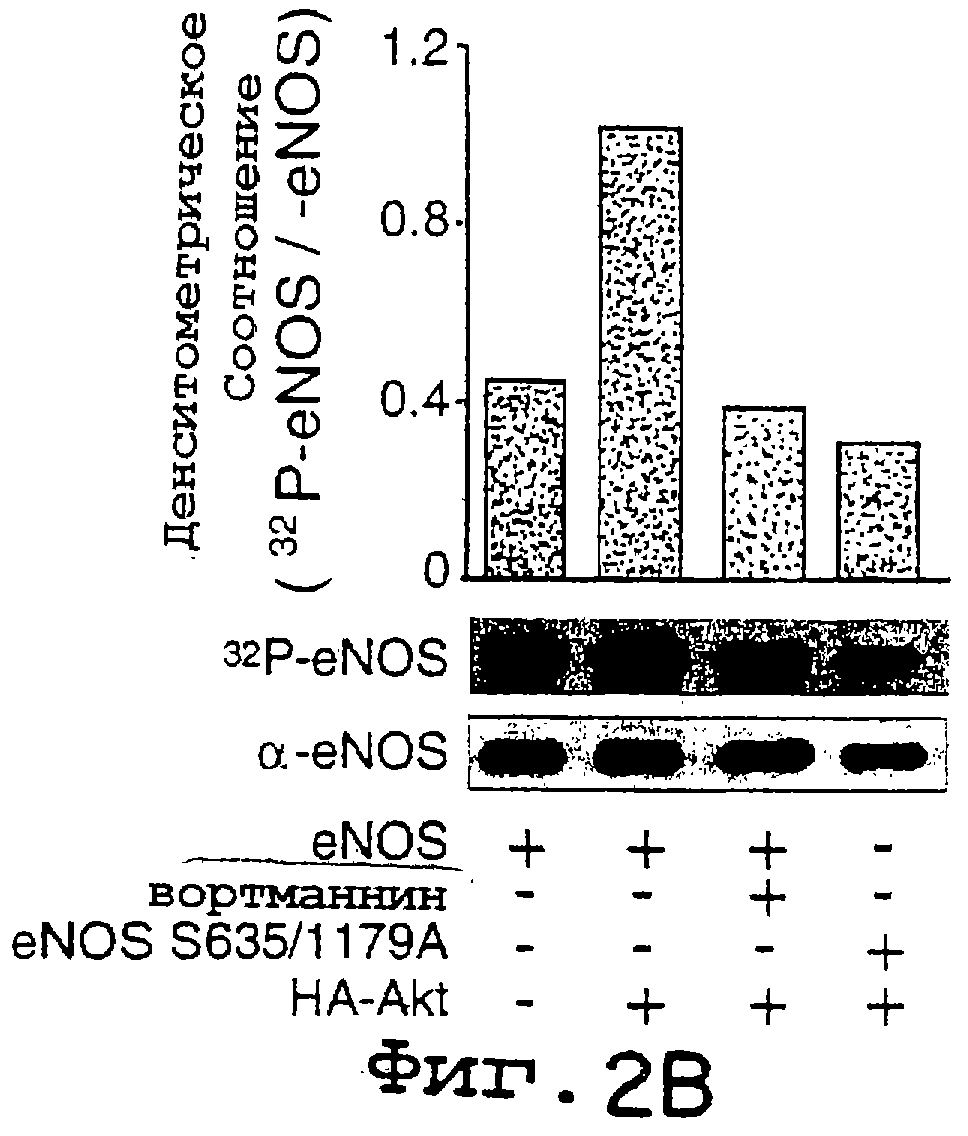
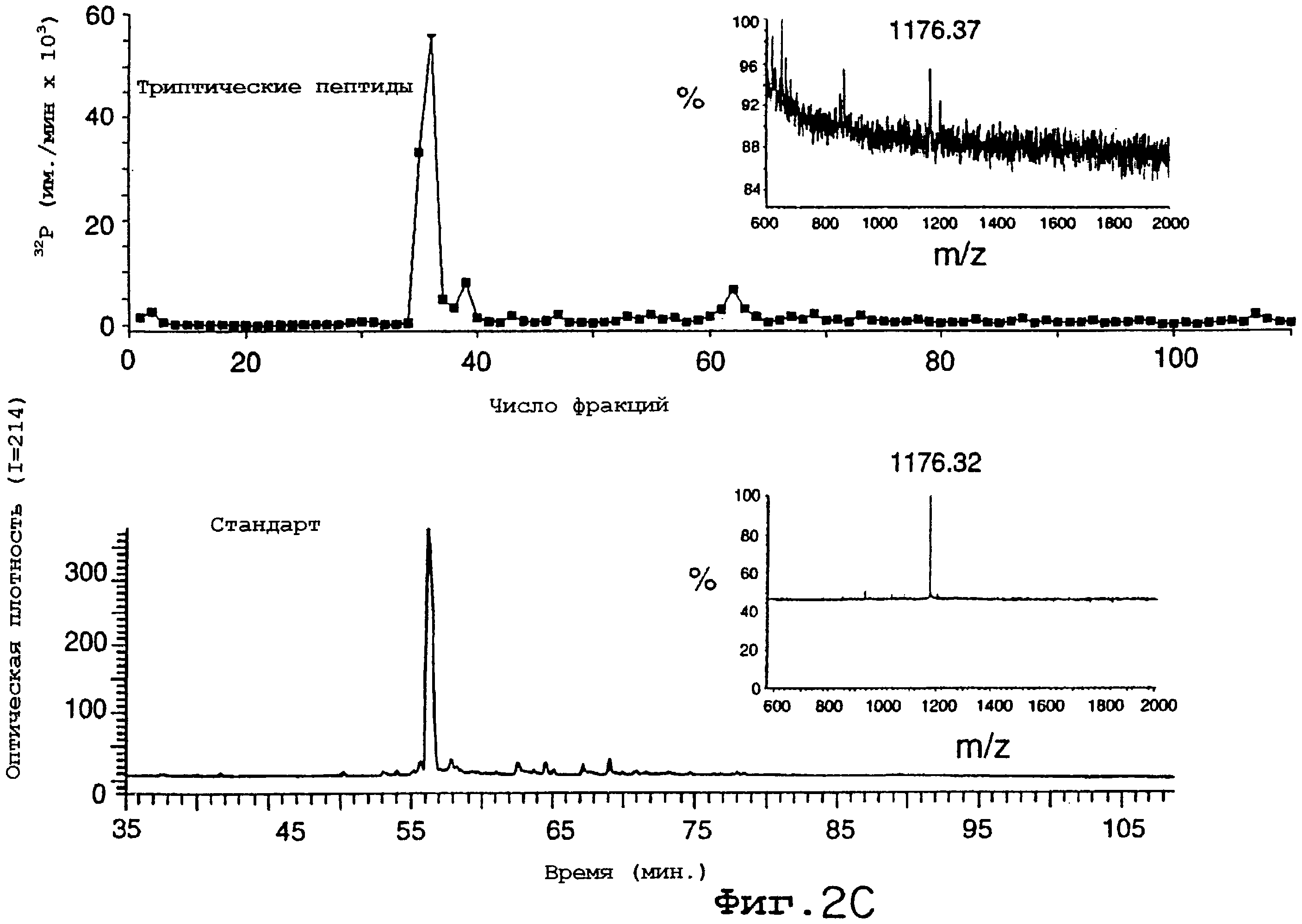
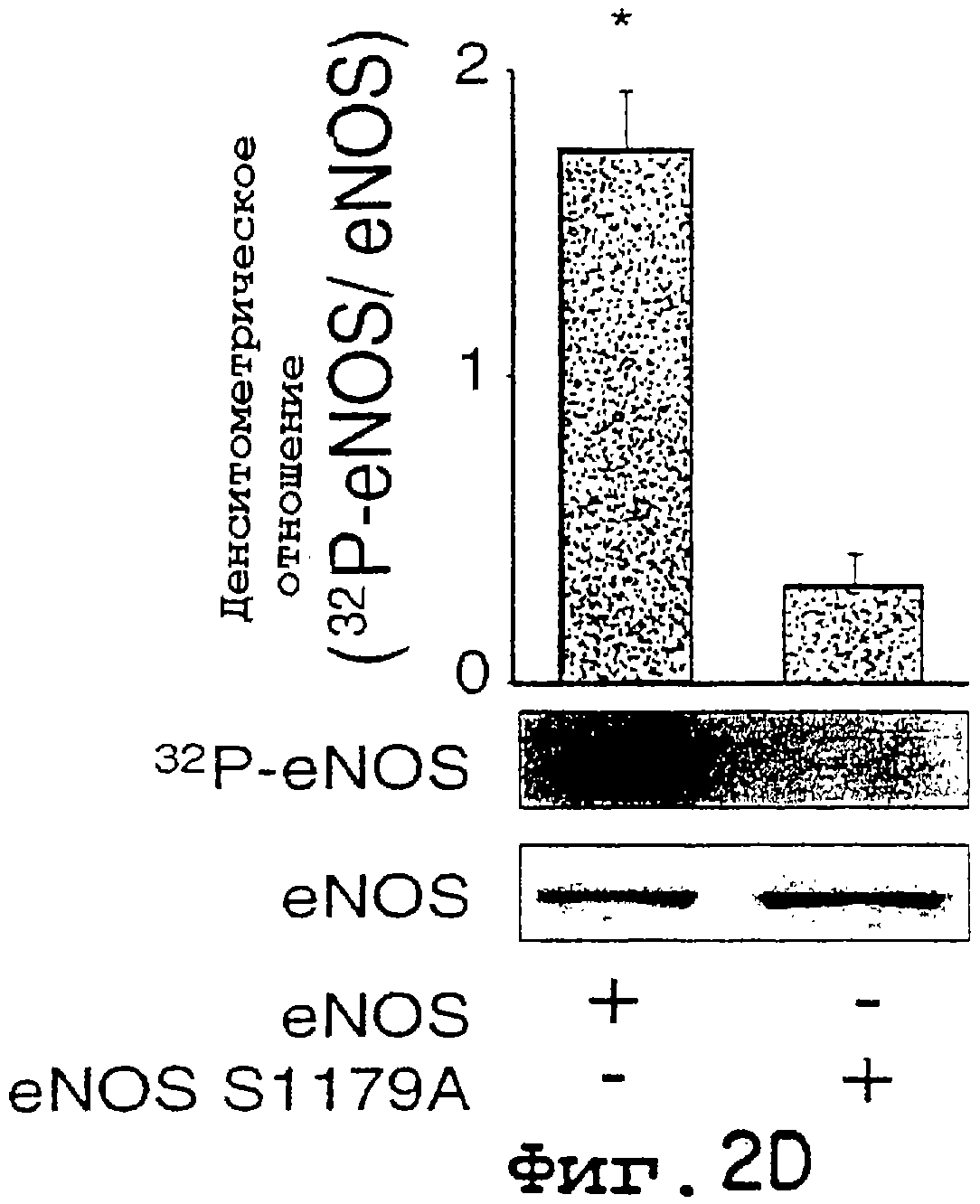
Фиг.2А-2D. Фосфорилирование eNOS активной киназой Akt in vitro и in vivo. На фиг.2А клетки COS трансфецировали HA-Akt или HA-Akt(K179M), лизаты подвергали иммунопреципитации и помещали в киназную реакцию in vitro с гистоном 2В (25 мг) или рекомбинантным eNOS (3 мг), используемыми в качестве субстратов. На верхней панели показано включение32 P в субстраты, на нижней панели показано количество субстрата при окрашивании геля кумасси-синим. На фиг.2В32Р-меченый eNOS дикого типа или двойной сериновый мутант eNOS (eNOS S635/1179) подвергали аффинной очистке из трансфецированных клеток COS, а затем авторадиографии (верхняя панель) или Вестерн-блот-анализу (нижняя панель). Графические данные на фиг.2В показывают относительное количество меченого белка по отношению к количеству иммунореактивного eNOS в геле. На фиг.2С меченые eNOS гидролизовали трипсином и пептиды разделяли с помощью ОФ-ВЭЖХ. На верхней хроматограмме показан предварительно меченый триптический пептид, который мигрирует вместе с немеченным синтетическим фосфопептидным стандартом (нижняя хроматограмма). Вставки демонстрируют линейный характер МС меченого пептида (вверху) и фосфопептидные стандарнтые идентичные масс-ионы. На фиг.2D рекомбинантный eNOS дикого типа или eNOS S1179A очищали и равные количества (2,4 мг) добавляли в киназную реакцию in vitro с рекомбинантным Akt, как описано в "Методах". На верхней панели 2D показано включение32P в eNOS, на нижней панели показано количество субстрата при окрашивании геля кумасси-синим. Графические данные (n=3) показывают относительное количество меченого eNOS по отношению к массе eNOS (кумасси) в киназной реакции in vitro.
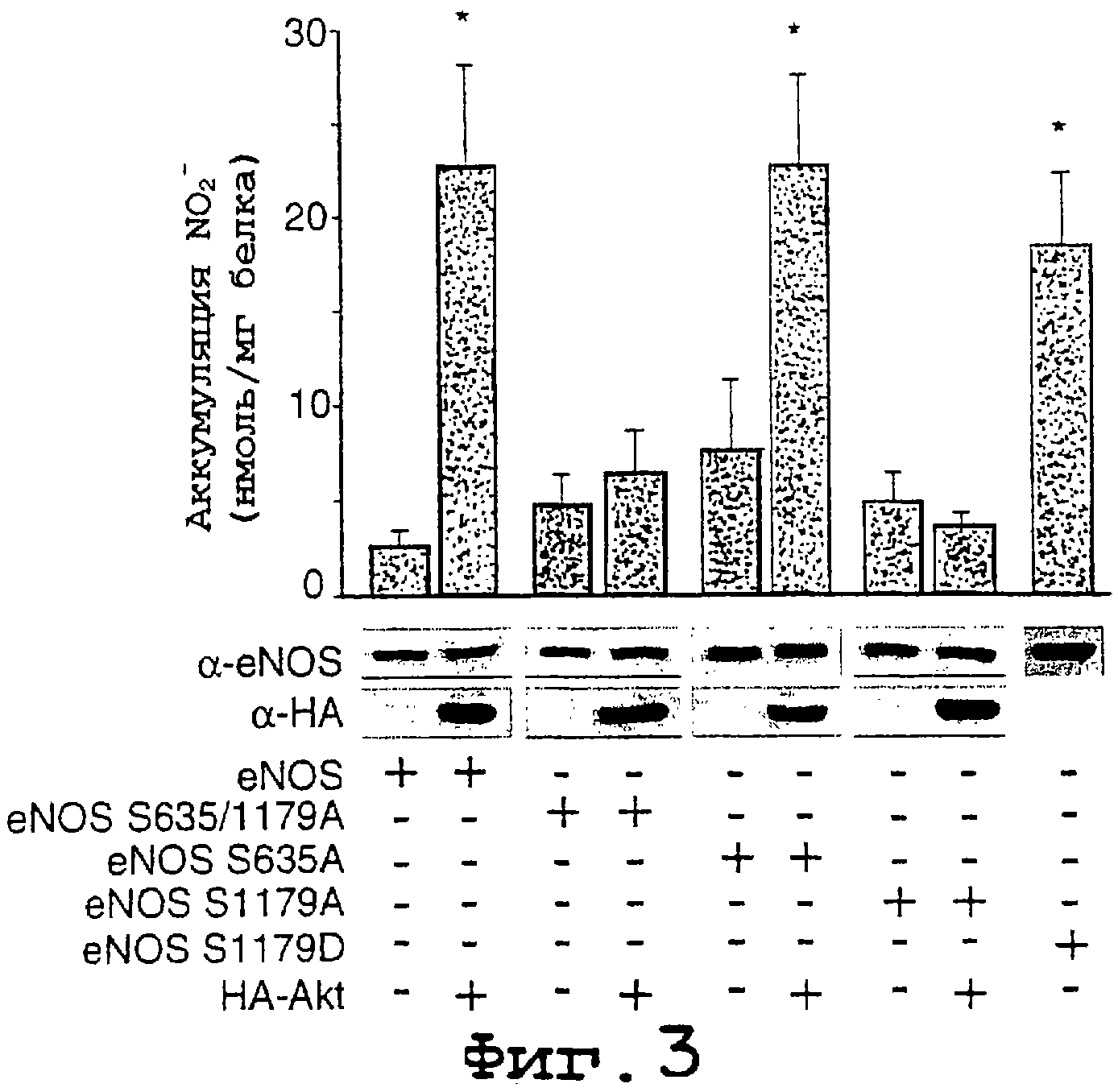
Фиг.3. Иллюстрируется, что серин 1179 играет функционально важную роль в Akt-стимулированном высвобождении NO. Клетки COS трансфецировали плазмидами для eNOS дикого типа или для eNOS-мутантов в отсутствии или в присутствии Akt и определяли экспрессию белков и уровень продуцирования NO (анализировали как NO2-). Интересно отметить, что конструкции с мутацией S1179 в А не активировались Akt, а мутация S1179 в D приводила к увеличению функции. Для А данные представляют собой среднее ± ср.кв.от., n=4-7 экспериментов; * означает значимые различия (р<0,05).
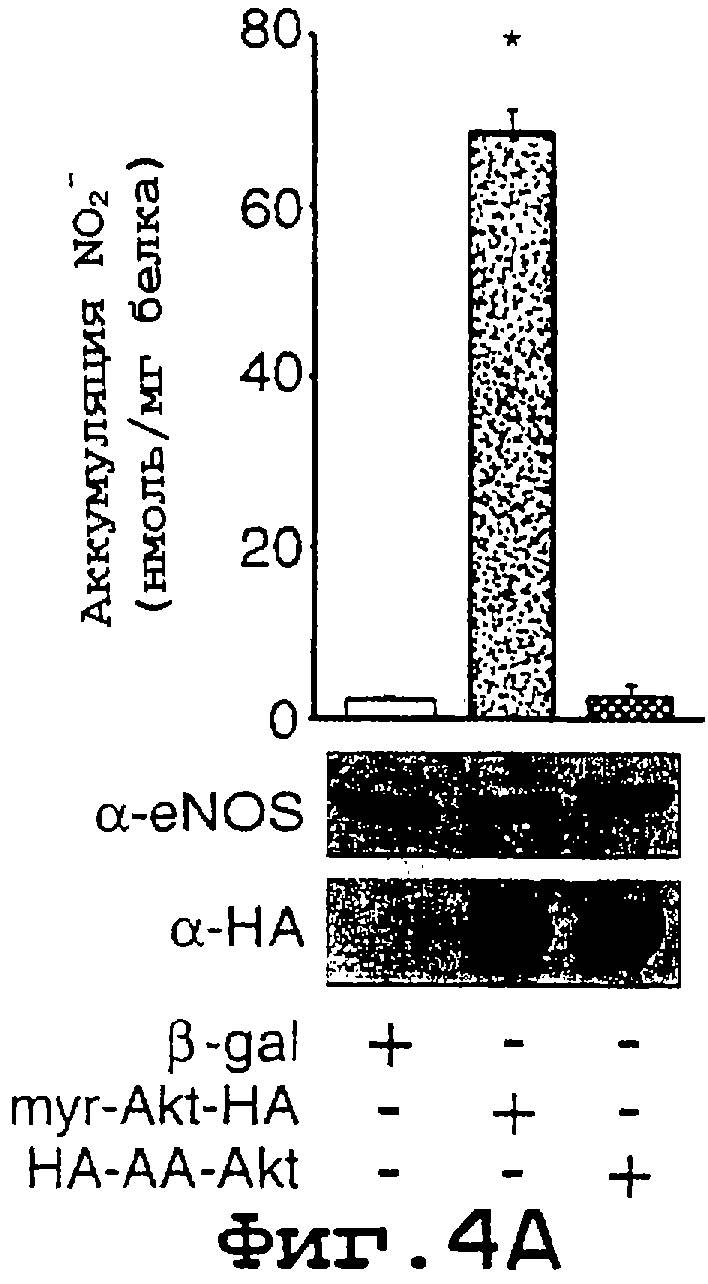
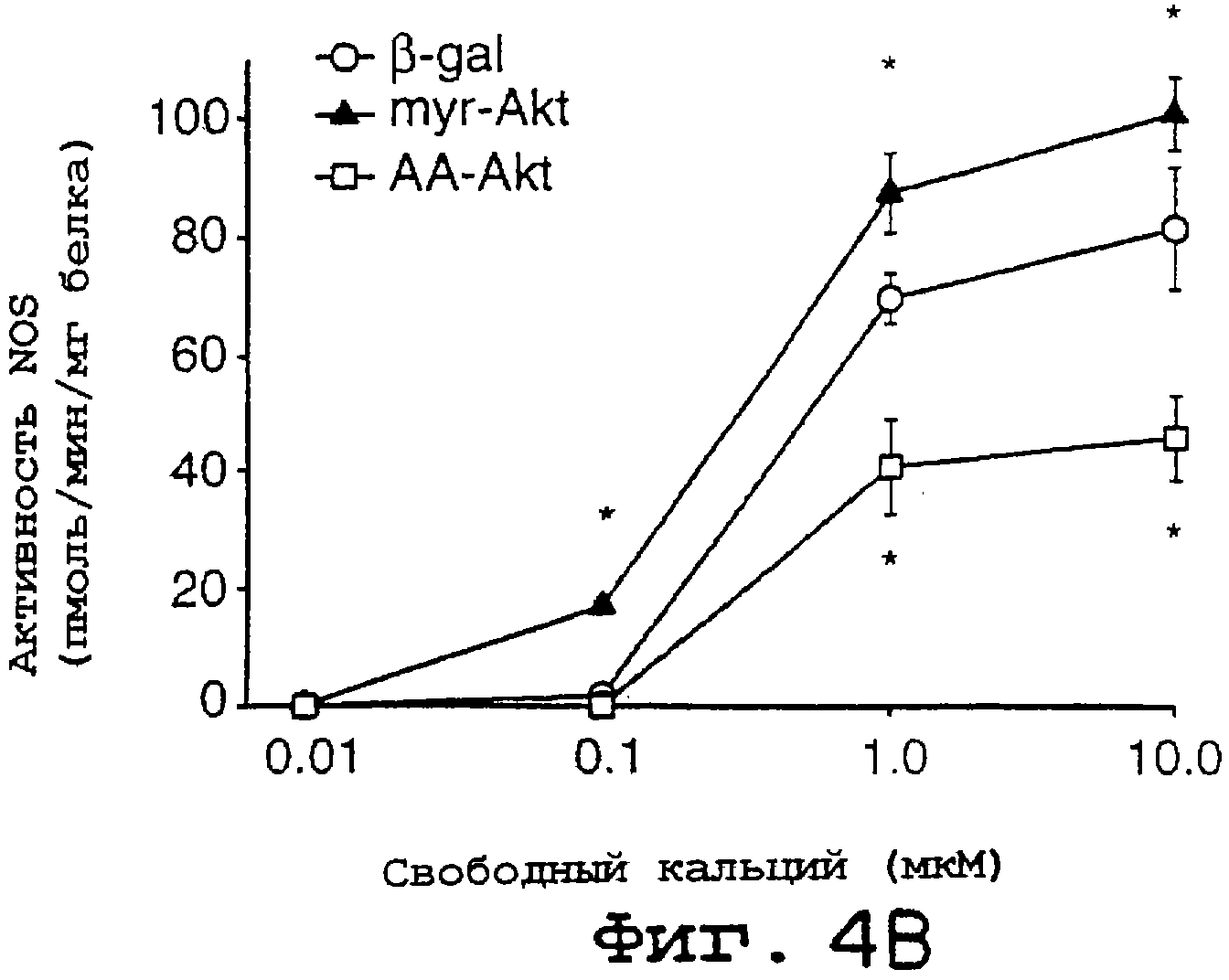
ФИГ.4А-4С. Akt регулирует базальное и стимулированное продуцирование NO в эндотелиальных клетках. На фиг.4А BLMVEC инфицировали аденовирусными конструкциями (β-gal в качестве контроля, mуr Akt и AA-Akt) и определяли количество NO2-, продуцированного за 24 часа (n=3). Вставки показывают экспрессию eNOS и Akt. На фиг.4В лизаты от инфицированных аденовирусом клеток BLMVEC оценивали на активность NOS. Равные количества белка (50 мг) инкубировали с различными концентрациями свободного кальция и определяли активность NOS (n=3 эксперимента). На фиг.4С BLMVEC инфицировали аденовирусами, как описано выше, с последующей стимуляцией VEGF (40 нг/мл) в течение 30 минут и высвобождение NO2- количественно оценивали с помощью хемилюминесценции. Данные представлены как VEGF-стимулированное высвобождение NO2- после вычитания базальных уровней. Данные представляют собой среднее ± ср.кв.от., n=4 экспериментов; * означает значимые различия (р<0, 05).
Фиг.5А и 5В. Чистота и отношение димера/мономера eNOS дикого типа и eNOS S1179D. В А и В анализ с помощью электрофореза в ПААГ с ДСН осуществляли на 7,5% полиакриламидных гелях, окрашенных кумасси синим. Слева показаны стандарты молекулярных масс (дорожка 1) и их размер в кДа. eNOS дикого типа (дорожка 2) и eNOS S1179D (дорожка 3)(1 мкг каждый) были разделены, как показано стрелками. На В белки (2 мкг каждого) разделяли с помощью электрофореза в ПААГ с ДСН при 4°С. Стандарты молекулярных масс показаны на дорожке 1. Некипяченые образцы дикого типа и eNOS S1179D были разделены на дорожках 2 и 3 соответственно. На дорожке 4 eNOS-дикого типа кипятили в буфере с ДСН для образца.
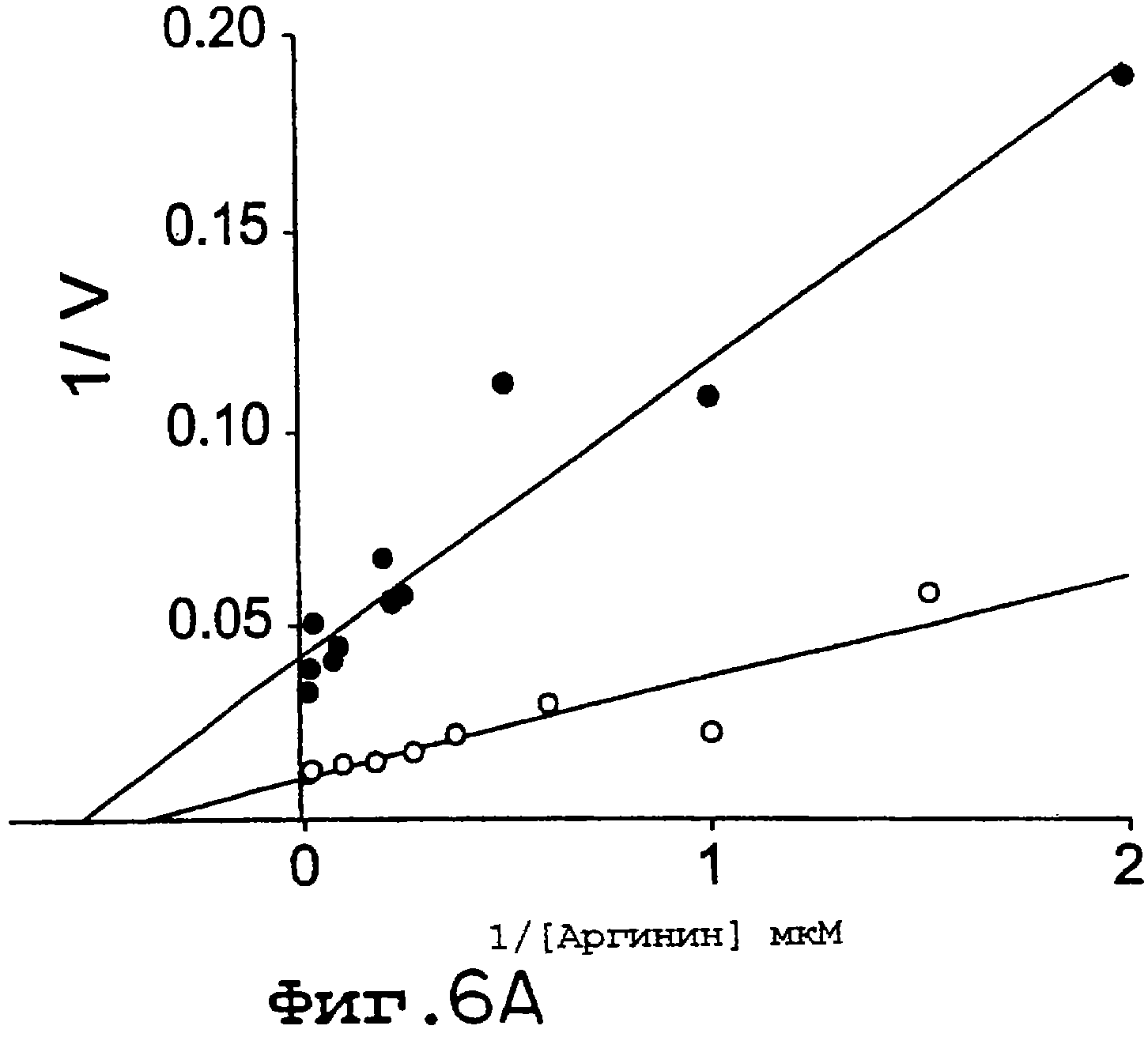
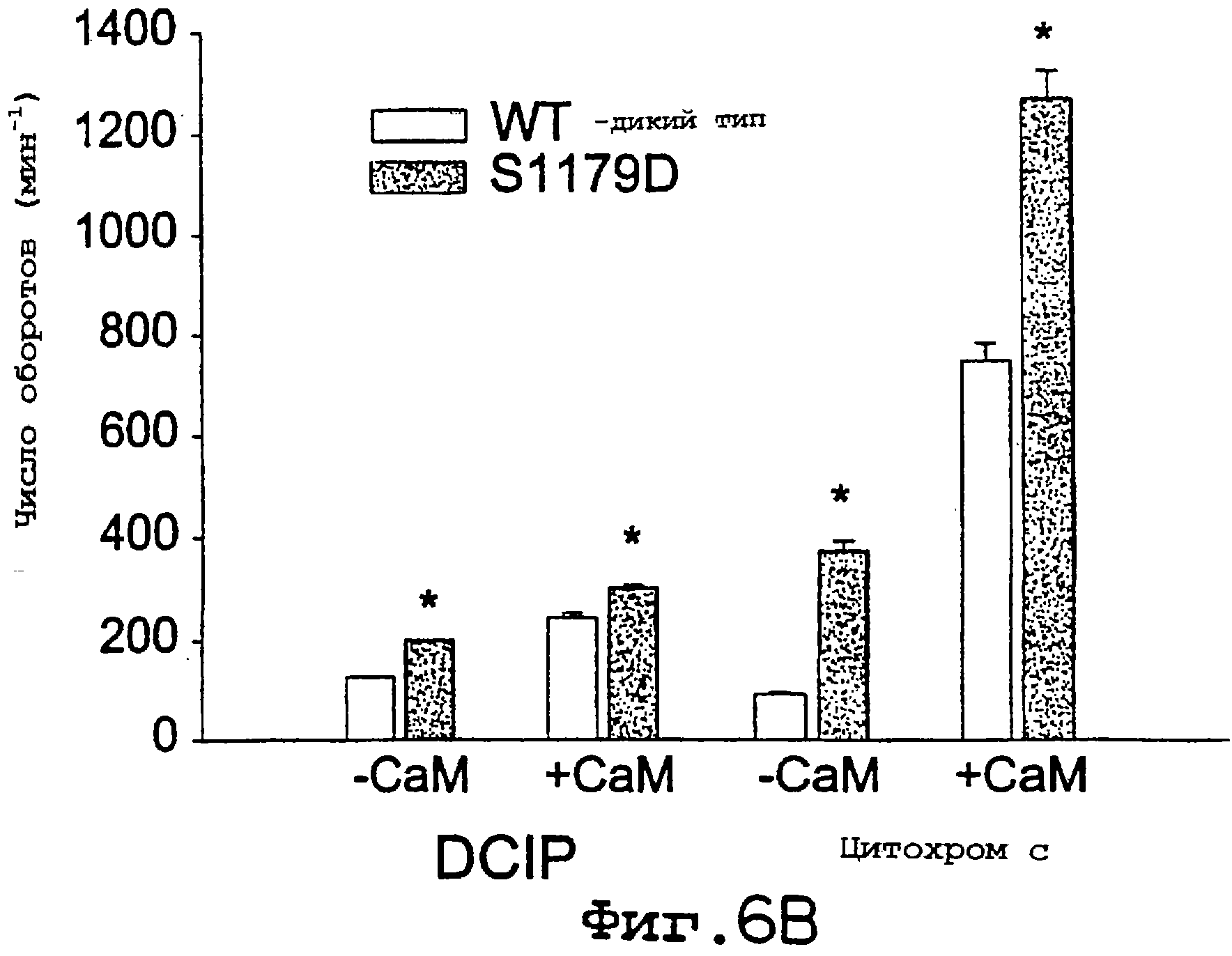
Фиг.6А и 6В. eNOS S1179D имеет более высокий уровень продуцирования NO (А) и редуктазной активности (В), чем eNOS дикого типа. На А скорость NO, продуцированного из eNOS дикого типа (• ) и eNOS S1179D (O), определяли с помощью анализа на захват гемоглобина в зависимости от концентрации L-аргинина, и данные представлены двумя кривыми обратной зависимости. На В анализы на DCIP и цитохром с осуществляли в присутствии или в отсутствие СаМ. Величины представлены как среднее ± ср.кв.от., n=4-6 определений. Аналогичные результаты были получены с использованием, по крайней мере, трех ферментных препаратов. Значимые различия (р<0,05) между eNOS дикого типа и eNOS S1179D показаны звездочками.
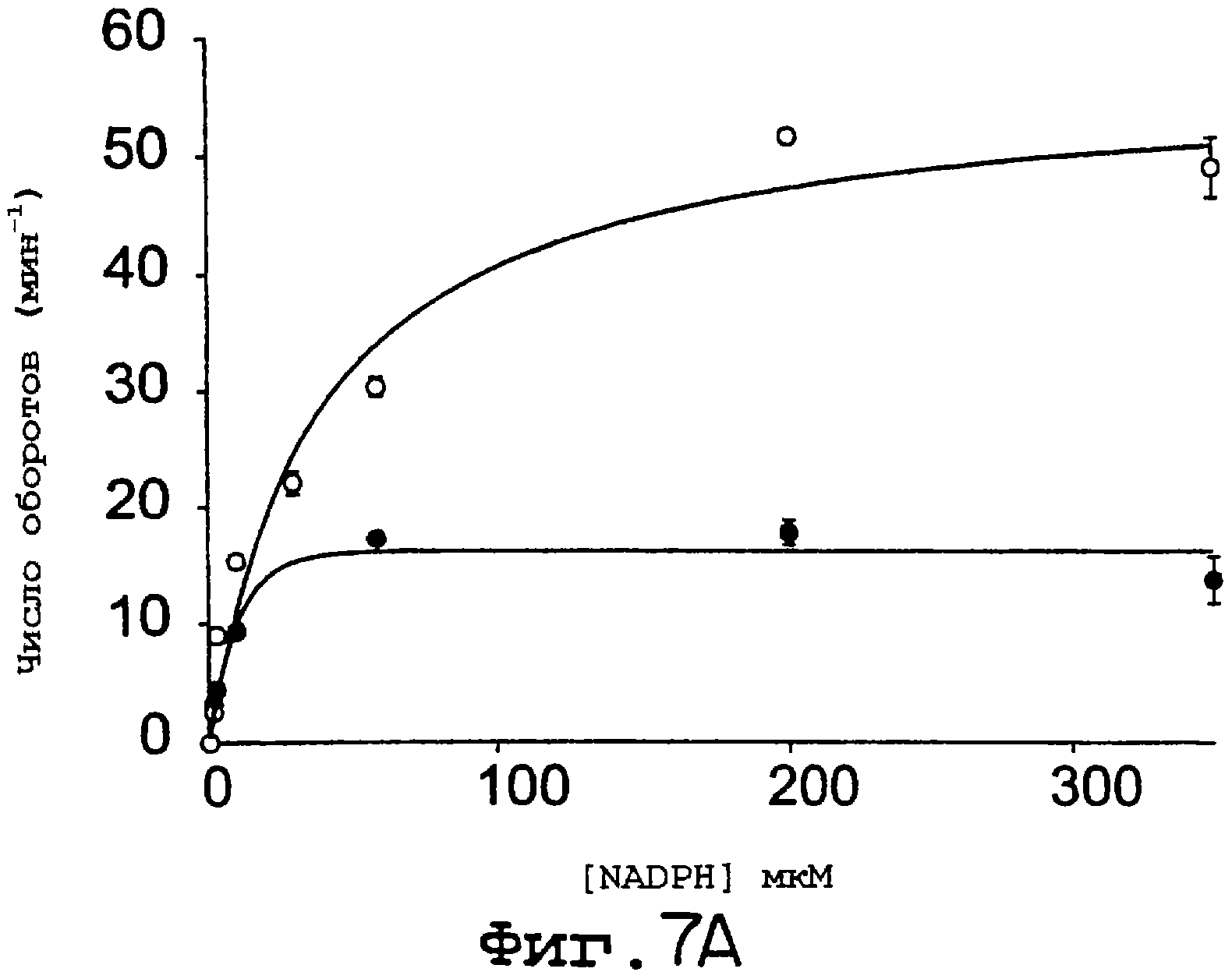
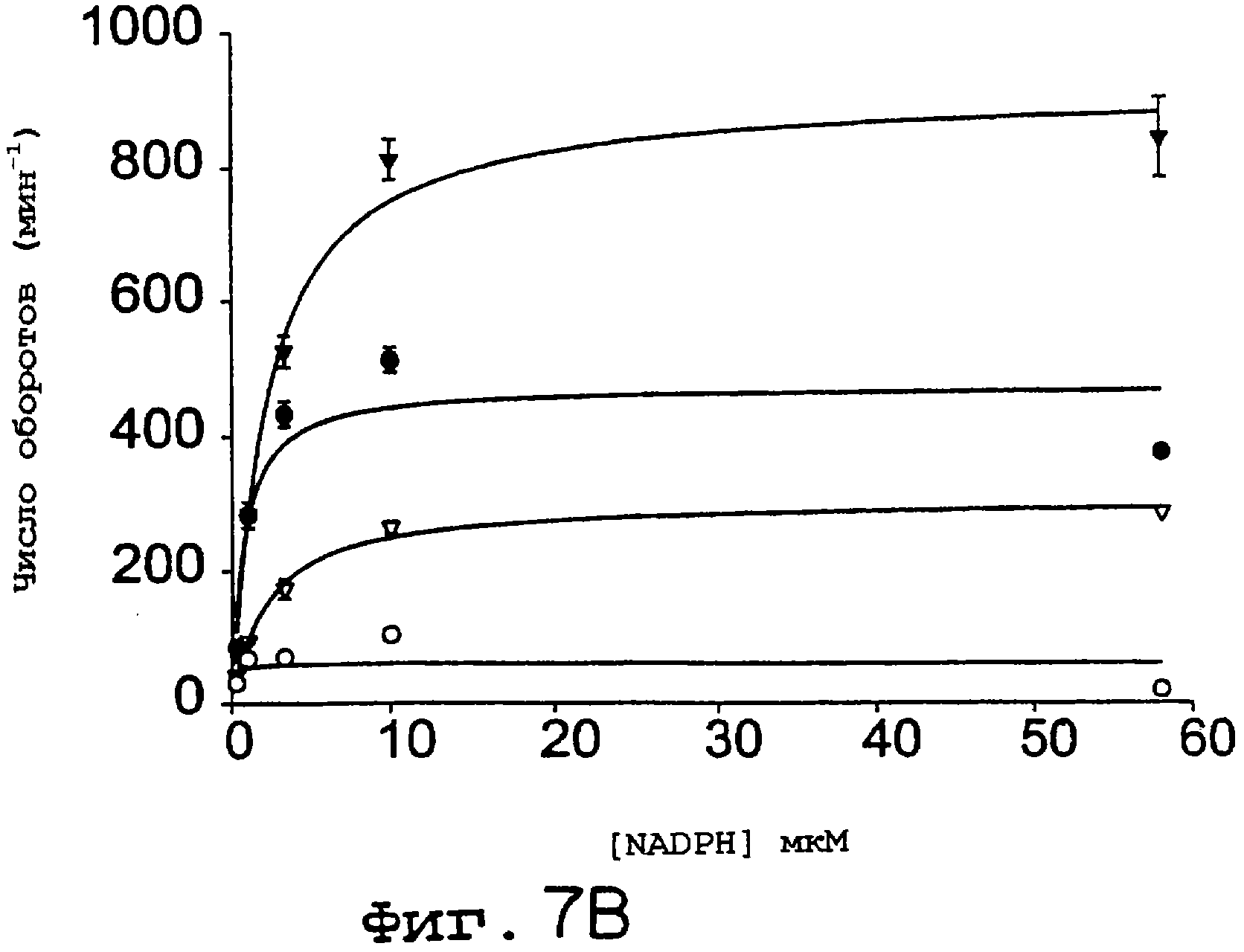
Фиг.7А и 7В. NOS-активности (А) и активность NADPH-зависимой редуктазы (В) увеличивается при использовании eNOS S1179D по сравнению с ферментом дикого типа. Анализы на захват гемоглобина (А) и на NADPH-зависимое восстановление цитохрома с (В) осуществляли с использованием как eNOS дикого типа, так и eNOS S1179D. На А скорость продуцирования NO определяли в присутствии всех кофакторов NOS (eNOS дикого типа (заштрихованные символы) и eNOS S1179D (незаштрихованные символы). Уровень восстановления цитохрома с определяли в отсутствие аргинина и ВН4 (А) для фермента дикого типа (кружки) и для S1179D (треугольники) в отсутствие (незаштрихованные символы) или в присутствии 120 нМ кальмодулина (заштрихованные символы). Величины представлены как среднее ± ср.кв.от., n=3-6 определений, по крайней мере, для трех ферментных препаратов.
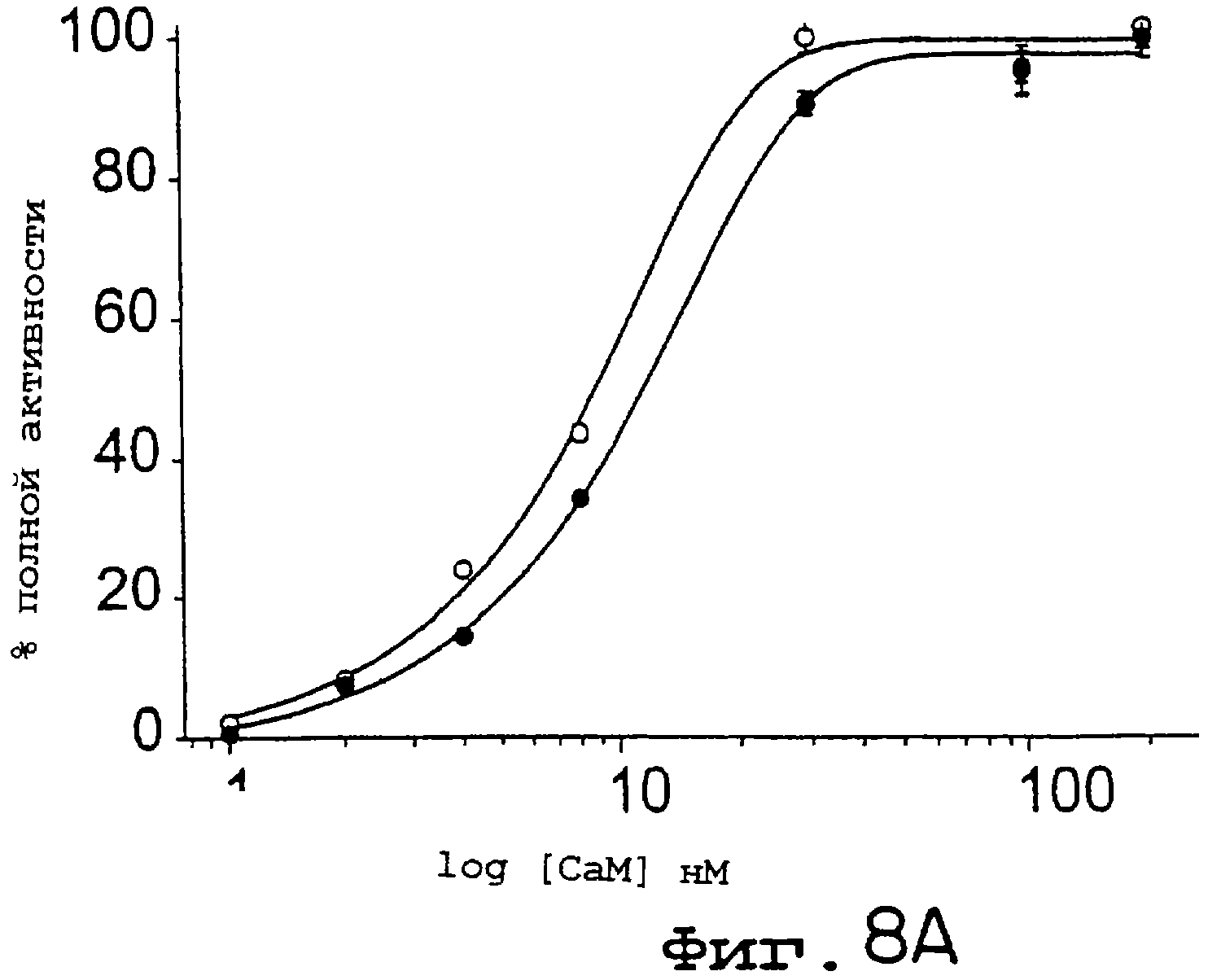
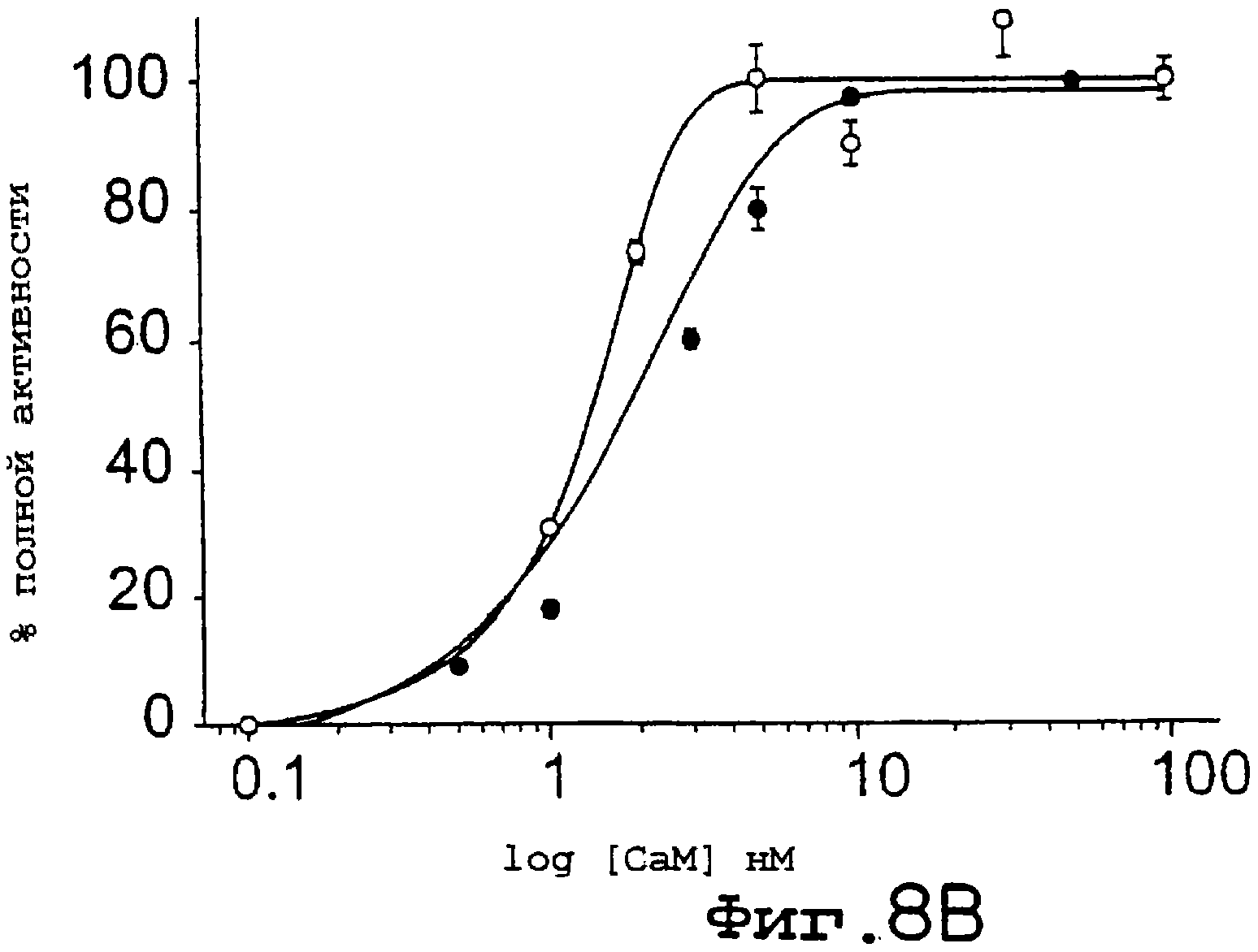
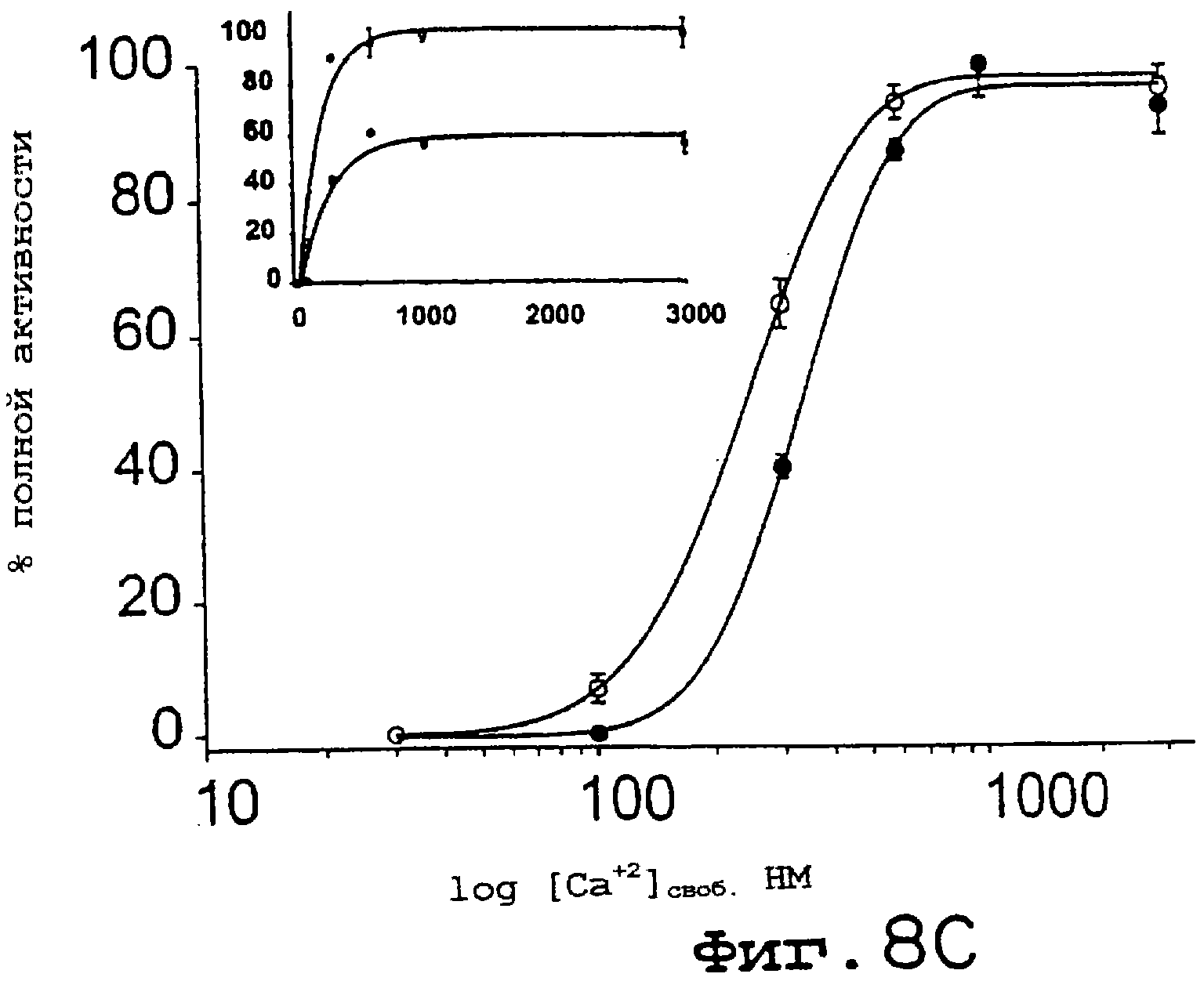
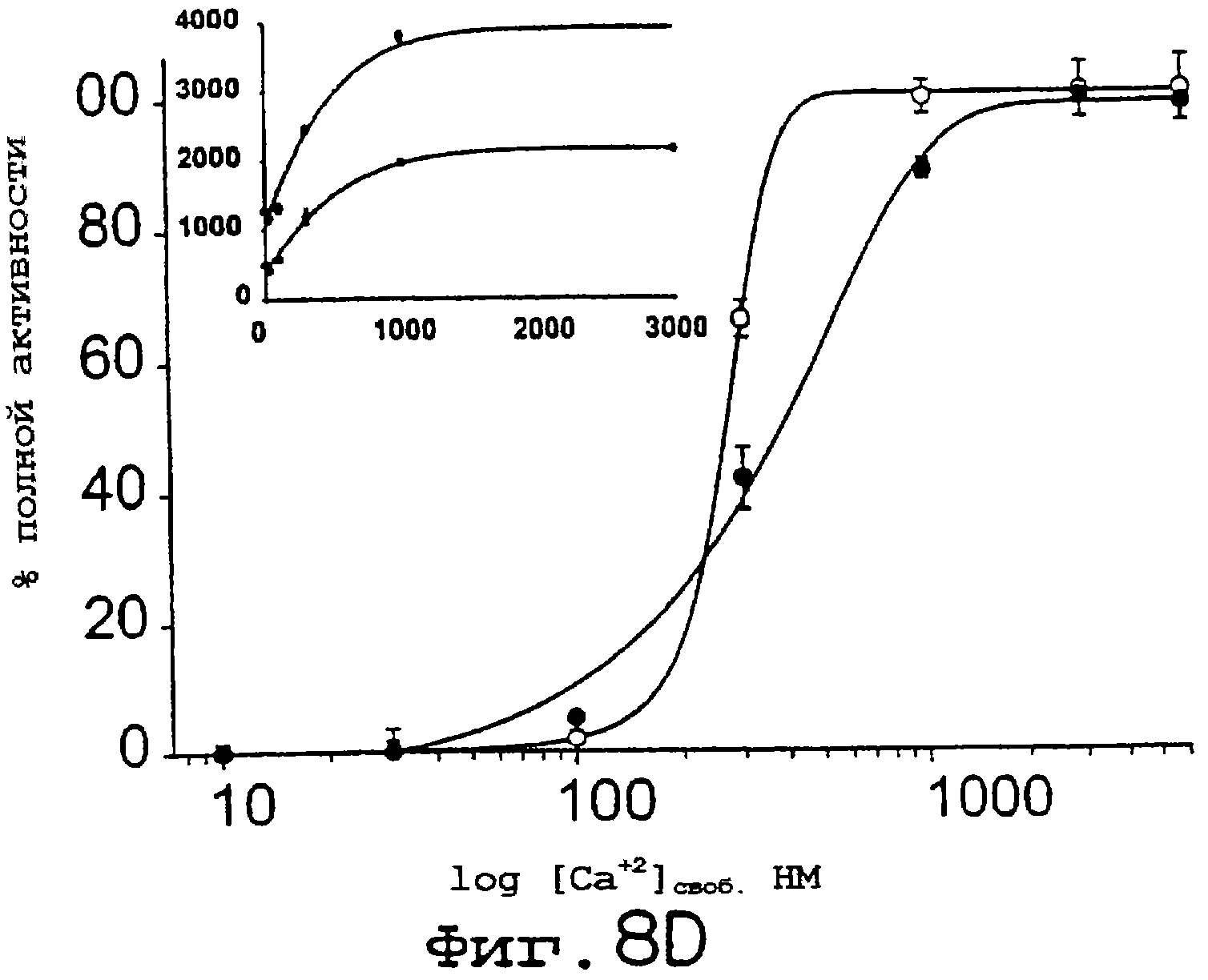
Фиг.8А-8D. Кальмодулин- и кальцийзависимая активация NOS и редуктазных активностей несколько увеличивается для eNOS S1179D. Анализы на кальмодулинзависимый захват гемоглобина (А) и восстановление цитохрома с (В) проводили с использованием как eNOS дикого типа (заштрихованные символы), так и eNOS S1179D (незаштрихованные символы). Уровень продуцирования NO, детектированного методом захвата гемоглобина, определяли в присутствии всех кофакторов NOS, тогда как восстановление цитохрома с определяли в отсутствие аргинина и ВН4. На С и D идентичные эксперименты осуществляли в присутствии возрастающих концентраций свободного кальция. На вставках С и D показан кальцийзависимый цикл превращения eNOS дикого типа и eNOS S1179D как в анализе на продуцирование NO, так и в анализе на цитохром с. Максимальные скорости превращений для eNOS дикого типа и S1179D составляли соответственно А 22 и 43 мин-1; В 620 и 1400 мин1; С 58 и 100 мин1; D 1930 и 3810 мин-1. Величины представлены как среднее ± ср.кв.от., n=3-6 определений, по крайней мере, для трех ферментных препаратов.
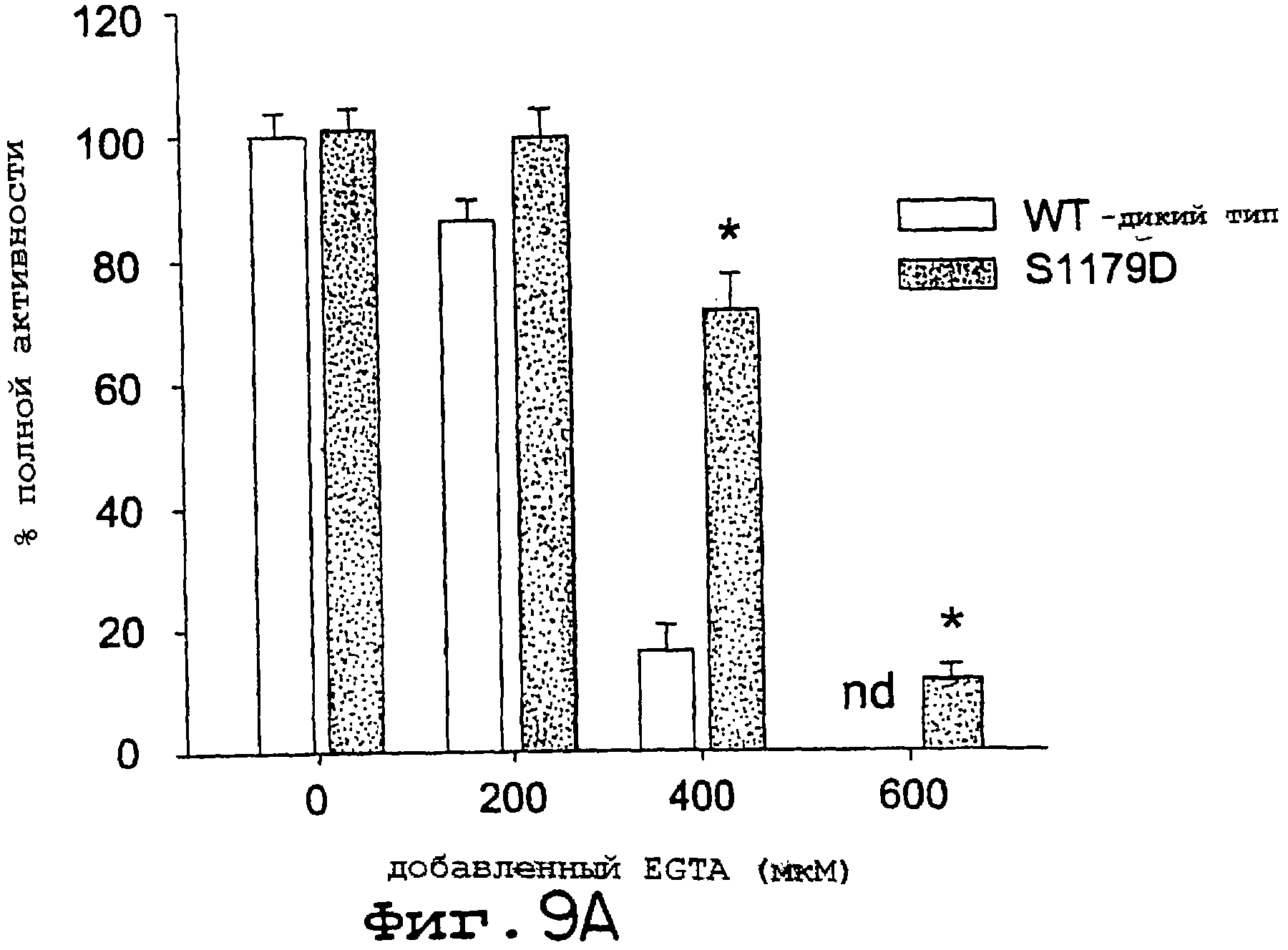
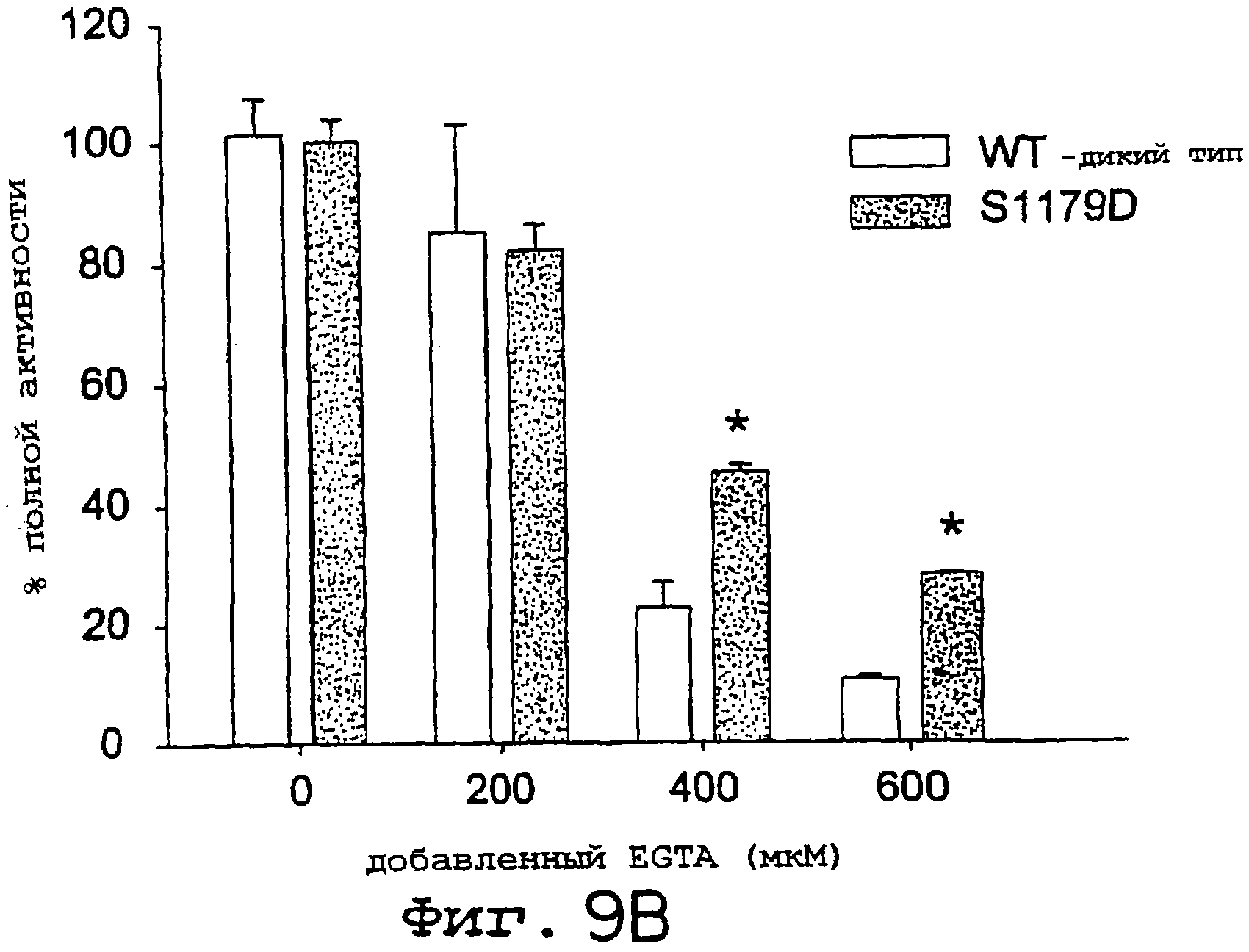
Фиг.9А и 9В. EGTA-инициированная инактивация NOS снижается для eNOS S1179D. Анализы на захват гемоглобина (А) и на редуктазу (В) осуществляли, как описано ранее со следующими модификациями. Для определения скорости инициации проводили мониторинг реакции в течение 1 минуты; а затем к реакционной смеси добавляли EGTA и скорость реакции прослеживали в течение еще 1 минуты. Концентрация свободного кальция в реакции составляла 200 мкМ, а количество добавленного EGTA давало конечные концентрации 0, 200, 400 и 600 мкМ хелатообразующего агента. Удельные активности нормализовали к 100% для eNOS дикого типа и S1179D. Величины представлены как среднее ± ср.кв.от., n=3-6 определений, по крайней мере, для трех ферментных препаратов; nd означает, что активность для eNOS дикого типа не детектировали.
Подробное описание изобретения А
А. Общее описание
Настоящее изобретение частично основано на обнаружении того факта, что сериновая/треонининовая протеинкиназа, Akt (протеинкиназа В), может непосредственно фосфорилировать eNOS по сериновому остатку (серии 1177 в человеческом eNOS) и активировать данный фермент, что приводит к продуцированию NO, тогда как мутантный eNOS (S1179A) является резистентым к Akt-фосфорилированию и -активации. Кроме того, Akt, активированная переносом гена, опосредованным аденовирусом, увеличивает базальное высвобождение NO из эндотелиальных клеток, а дефицитная по активации Akt снижает VEGF-стимулированное продуцирование NO. Таким образом, eNOS представляет собой недавно описанный субстрат Akt, опосредующий передачу сигнала посредством Akt с высвобождением газообразного вторичного переносчика NO. Настоящие изобретения также основаны частично на обнаружении того факта, что мутантный eNOS, например S1179D, способствует увеличению скорости продуцирования NO и повышению редуктазной активности.
Обнаружение того факта, что продуцирование NO регулируется Akt-зависимым фосфорилированием eNOS, дает возможность использовать новые конститутивно активные eNOS-мутанты в генной терапии для улучшения эндотелиальной функции при сердечно-сосудистых заболеваниях, ассоциированных с нарушением синтеза или биологической активности NO. Такими заболеваниями являются рестеноз после ангиопластики, гипертензия, атеросклероз, сердечная недостаточность, включая инфаркт миокарда, диабет и заболевания с недостаточным ангиогенезом. Обнаружение этого факта также позволяет получить новую терапевтическую мишень для разработки нужных лекарственных средств, которые могут быть использованы для лечения заболеваний, ассоциированных с нарушением синтеза или биологической активности NO.
Настоящее изобретение также относится к новым конститутивно активным nNOS-мутантам, в которых аминокислота, соответствующая остатку 1412 крысиного nNOS или 1415 человеческого nNOS, была заменена в целях осуществления генной терапии для лечения заболеваний.
В. Конкретные варианты осуществления изобретения
Продуцирование мутантных белков NOS или полипептидов
Настоящее изобретение относится к белкам или полипептидам NOS, аллельным вариантам белков NOS и к заменам консервативных аминокислот белков NOS, все из которых содержат мутацию серинового остатка, присутствующего в сайте Akt-опосредованного фосфорилирования. Так, например, белками или полипептидами настоящего изобретения являются, но не ограничиваются ими (1) человеческие белки eNOS, которые содержат мутацию по остатку 1177 (Janssens et al. (1992) J.Biol.Chem. 267:14519-14522, эта работа во всей своей полноте вводится в настоящее описание посредством ссылки), как представлено в SEQ ID NO: 3 и соответствующей нуклеотидной последовательности, представленной SEQ ID NO: 8 (GenBank-номер доступа М93718), с заменой серина на другую аминокислоту, такую как аланин, и которые являются резистентными к Akt-опосредованному фосфорилированию; (2) бычьи белки eNOS, которые содержат мутацию по остатку 1179 (SEQ ID NO:2 патент США 5498539, который во всей своей полноте вводится в настоящее описание посредством ссылки), как представлено в SEQ ID NO:4, с заменой серина на другую аминокислоту, такую как аланин, и которые являются резистентными к Akt-опосредованному фосфорилированию; (3) человеческие белки nNOS, которые содержат мутацию по остатку 1415 с заменой серина на другую аминокислоту, такую как аланин, и которые являются резистентными к Akt-опосредованному фосфорилированию; (4) крысиные белки nNOS, которые содержат мутацию по остатку 1412 с заменой серина на другую аминокислоту, такую как аланин, и которые являются резистентными к Akt-опосредованному фосфорилированию; (5) человеческие белки eNOS, которые содержат мутацию по остатку 1177, как представлено в SEQ ID NO:5, с заменой серина на аминокислоту, содержащую отрицательно заряженную группу R, такую как аспарагиновая (как представлено в SEQ ID NO:6) или глутаминовая кислота (как представлено в SEQ ID NO:7), и которые являются конститутивно активными и способствуют увеличению продуцирования NO и повышению редуктазной активности; (6) бычьи белки eNOS, которые содержат мутацию по остатку 1179 с заменой серина на аминокислоту, содержащую отрицательно заряженную группу R, такую как аспарагиновая или глутаминовая кислота, и которые являются конститутивно активными и способствуют увеличению продуцирования NO и повышению редуктазной активности; (7) человеческие белки nNOS, которые содержат мутацию по остатку 1415 с заменой серина на аминокислоту, содержащую отрицательно заряженную группу R, такую как аспарагиновая или глутаминовая кислота, и которые являются конститутивно активными и способствуют увеличению продуцирования NO и повышению редуктазной активности; (8) крысиные белки nNOS, которые содержат мутацию по остатку 1412 с заменой серина на аминокислоту, содержащую отрицательно заряженную группу R, такую как аспарагиновая или глутаминовая кислота, и которые являются конститутивно активными и способствуют увеличению продуцирования NO и повышению редуктазной активности и (9) белки NOS, которые не являются человеческими, бычьими или крысиными белками, и модифицированы так, что в положении, соответствующем серину 1177 человеческого eNOS, или серину в положении 1179 бычьего eNOS, серину в положении 1412 крысиного nNOS и серину в положении 1415 человеческого nNOS, они содержат аминокислоту, не являющуюся серином, и которые являются или резистентными к Akt-фосфорилированию, или являются конститутивно активными, способствуют увеличению продуцирования NO и увеличению редуктазной активности. Мутанты NOS могут быть также продуцированы путем введения мутаций других аминокислот в мотиве фосфорилирования RXRXXS/T.
Настоящее изобретение относится к конститутивно активным полипептидам NOS, предпочтительно eNOS или nNOS, характеризующимся повышенным продуцированием NO и увеличенной редуктазной активностью, и содержащим мутацию по сериновому остатку в сайте Akt-опосредованного фосфорилирования. Следует также отметить, что каждый специалист может получить консервативные варианты, такие как мутанты с заменами, делеционные мутанты и инсерционные мутанты указанных полипетидов NOS, обладающие способностью к повышенному продуцированию NO и к увеличению редуктазной активности. Используемый здесь термин "консервативный вариант" означает такие модификации аминокислотной последовательности, которые не оказывают негативного воздействия на способность контитутивно активной NOS, предпочтительно eNOS или nNOS, продуцировать NO или на редуктазную активность контитутивно активного NOS, предпочтительно eNOS или nNOS. Считается, что замена, вставка или делеция оказывает негативное воздействие на конститутивно активный полипептид NOS, если данная модифицированная последовательность влияет на функцию конститутивной NOS, в результате чего он не может продуцировать повышенные уровни NO и не способен к увеличению редуктазной активности по сравнению с NOS дикого типа. Так, например, суммарный заряд, структура или гидрофобные/гидрофильные свойства конститутивного NOS могут быть модифицированы без негативного воздействия на активность конститутивного NOS. В соответствии с этим аминокислотная последовательность полипептида NOS может быть модифицирована, например, так, чтобы данный полипептид был более гидрофобным или гидрофильным, но чтобы это не оказывало негативного воздействия на активность NOS.
Используемый здесь термин "конститутивно активный" мутант или вариант NOS независимо от того, является ли он модифицированным или выделенным из природного источника, означает белок NOS, предпочтительно, eNOS или nNOS, который продуцирует NO на более высоком уровне, чем нативный NOS, содержащий серин в его нефосфорилированной форме в положении аминокислотного остатка, соответствующего остатку 1177 в человеческом NOS или остатку 1179 в бычьем NOS. Предпочтительные конститутивно активные варианты содержат аминокислоту с отрицательно заряженной группой R, такую как аспрагиновая или глутаминовая кислота, в аминокислотном остатке, соответствующем серину в положении 1177 человеческого cNOS или серину в положении 1179 бычьего NOS.
Настоящее изобретение относится к белкам или полипептидам NOS, аллельным вариантам белков NOS и к белкам NOS с консервативными аминокислотными заменами, которые содержат замененный аминокислотный остаток вместо соответствующего остатка 1179 в бычьем eNOS, остатка 1177 в человеческом eNOS, остатка 1412 в крысином nNOS, и остатка 1415 в человеческом nNOS, где указанный замененный аминокислотный остаток содержит неотрицательно заряженную группу R, такую как аланин.
Белки NOS, предпочтительно белки eNOS или nNOS, настоящего изобретения могут быть использованы в изолированной форме. Говорят, что используемый здесь белок является изолированным, если для отделения этого белка от клеточных компонентов, обычно ассоциированных с этим белком, используются физические, механические или химические методы. Каждый специалист может легко использовать стандартные методы очистки для получения изолированного белка.
Настоящее изобретение также относится к пептидами NOS, включающие сайт фосфорилирования, соответствующий остатку 1179 в бычьем eNOS, остатку 1177 в человеческом eNOS, остатку 1412 в крысином nNOS, или остатку в 1415 человеческом nNOS. Пептиды могут содержать серин в сайте фосфорилирования или предпочтительно они могут содержать замену серина в положении, соответствующем остатку 1179 в бычьем eNOS, остатку 1177 в человеческом eNOS, остатку 1412 в крысином nNOS или остатку в 1415 человеческом nNOS. Такими заменами являются, но не ограничиваются ими аминокислоты с группой R, которые имитируют серин в его фосфорилированном состоянии, таким как аспарагиновая кислота или глутаминовая кислота. Такими заменами также являются аминокислоты с неотрицательно заряженной группой R, такой как аланин. Пептиды, включающие данный сайт, могут иметь длину примерно в 3, 5, 7, 10, 12, 15, 17, 20, 25, 30, 40, 50 или более аминокислот.
Белки, полипептиды или пептиды NOS настоящего изобретения могут быть получены любыми доступными способами, включая рекомбинантную экспрессию из кДНК NOS, которая была модифицирована с заменой или изменением нуклеотидного триплета, кодирующего серин, соответствующий серину в положении 1177 человеческого eNOS, в положении 1179 бычьего eNOS, остатку 1412 в крысином nNOS или остатку 1415 в человеческом nNOS. Для введения мутации в нуклеотидный триплет, кодирующий сериновый остаток, могут быть использованы любые подходящие методы, такие как го-мологичная рекомбинация, сайт-направленный мутагенез или ПЦР-мутагенез (см., Sambrook et al.. Molecular Cloning, Cold Spring Harbor Laboratory Press, 1989). В случае кДНК могут быть использованы человеческая или бычья кДНК NOS, а также кДНК, кодирующая белки NOS животных других видов, включая, но не ограничиваясь ими, кролика, крысу, мышь, свинью, овцу, лошадь и приматов, не относящиеся к человеку.
Используемую здесь молекулу нуклеиновой кислоты, кодирующую белок или полипептид NOS, а предпочтительно белок или полипетид eNOS или nNOS, настоящего изобретения называют "изолированной", если указанная молекула нуклеиновой кислоты, в основном, отделена от примесной нуклеиновой кислоты, кодирующей другие полипептиды, и выделена из данного источника нуклеиновой кислоты.
Настоящее изобретение, кроме того, относится к фрагментам кодирующей молекулы нуклеиновой кислоты. Используемый здесь термин "фрагмент кодирующей молекулы нуклеиновой кислоты" означает небольшую часть полной кодирующей белок последовательности. Размер данного фрагмента определяется в соответствии с целями его использования. Так, например, если данный фрагмент выбран так, чтобы он кодировал активную часть белка, то этот фрагмент должен быть достаточно крупным, чтобы он кодировал функциональную часть (части) данного белка, включая сайт Akt-фосфорилирования. Если данный фрагмент используется в качестве нуклеотидного зонда или ПЦР-праймера, то длина фрагмента должна быть выбрана так, чтобы имело место относительно небольшое число ложноположительных событий во время зондирования/праймирования по отношению к области, которая включает или фланкирует сайт Akt-фосфорилирования NOS.
Фрагменты кодирующих молекул нуклеиновых кислот настоящего изобретения (то есть синтетические олигонуклеотиды), которые используются в качестве зондов или специфических праймеров для полимеразной цепной реакции (ПЦР), или для синтеза генных последовательностей, кодирующих белки настоящего изобретения, могут быть легко синтезированы химическими методами, например фосфотриэфирным методом, описанным Matteucci и др. 1981, J.Am.Chem.Soc. 103:3185-3191), или методами автоматического синтеза. Кроме того, более крупные ДНК-сегменты могут быть легко получены хорошо известными методами, такими как синтез группы олигонуклеотидов, которые определяют различные модульные сегменты гена, с последующим лигированием олигонуклеотидов для конструирования полного модифицированного гена.
Кодирующие молекулы нуклеиновой кислоты настоящего изобретения могут быть, кроме того, модифицированы так, чтобы они содержали детектируемую метку для диагностических целей и для зондирования. Ряд таких меток известен специалистам и эти метки могут быть легко использованы с описанными здесь кодирующими молекулами. Подходящими метками являются, но не ограничиваются ими, биотин, радиоактивно меченные нуклеотиды и т.п. Каждый специалист может использовать любую из этих известных меток для получения меченой кодирующей молекулы нуклеиновой кислоты.
Настоящее изобретение, кроме того, относится к рекомбинантным ДНК-молекулам (рДНК), которые содержат NOS-кодирующую последовательность, описанную выше. Используемая здесь молекула рДНК представляет собой ДНК-молекулу, которая была подвергнута молекулярным манипуляциям. Методы генерирования молекул рДНК хорошо известны специалистам и описаны, например, у Sambrook et al., Molecular Cloning (1989). В предпочтительных молекулах рДНК кодирующая последовательность ДНК функционально присоединена к регулирующим экспрессию последовательностям и/или векторным последовательностям.
Выбор векторных и/или регулирующих экспрессию последовательностей, к которым функционально присоединена одна из последовательностей, кодирующих семейство белков настоящего изобретения, непосредственно зависит, как хорошо известно специалистам, от желательных функциональных свойств, например от экспрессии белка и от трансформируемой клетки-хозяина. Вектор, рассматриваемый в настоящем изобретении, по крайней мере, способен направлять репликацию или встраивание в хромосому хозяина, а предпочтительно также регулировать экспрессию структурного гена, включенного в рДНК-молекулу.
Регулирующие экспрессию элементы, используемые для регуляции экспрессии функционально присоединенной кодирующей белок последовательности, известны специалистам, и такими элементами являются, но не ограничиваются ими, индуцибельные промоторы, конститутивные промоторы, сигналы секреции и другие регуляторные элементы. Предпочтительно, чтобы индуцибельный промотор был легко регулируемым, т.е. чтобы он был восприимчивым к питательному веществу, присутствующему в среде клетки-хозяина.
В одном из вариантов осуществления настоящего изобретения вектор, содержащий кодирующую молекулу нуклеиновой кислоты, включает прокориотический репликон, то есть последовательность ДНК, обладающую способностью направлять автономную репликацию и поддерживать внехромосомно рекомбинантную молекулу ДНК в прокариотической клетке-хозяине, такой как бактериальная клетка-хозяин, трансформированная этой молекулой. Такие репликоны известны специалистам. Кроме того, векторы, содержащие прокариотический репликон, могут также включать ген, экспрессия которого сообщает ему детектируемый маркер, такой как резистентность к лекарственному средству. Типичными бактериальными генами резистентности к лекарственному средству являются гены, которые сообщают резистентность к ампициллину или тетрациклину.
Векторы, содержащие прокариотический репликон, могут, кроме того, включать прокариотический или бактериофаговый промотор, способный направлять экспрессию (транскрипцию или трансляцию) последовательностей кодирующего гена в бактериальной клетке-хозяине, такой как E.coli. Промотор представляет собой элемент, регулирующий экспрессию и образованный последовательностью ДНК, которая делает возможным связывание РНК-полимеразы, в результате чего происходит транскрипция. Промоторные последовательности, совместимые с бактериальными хозяевами, обычно исходятся в плазмидных векторах, содержащих подходящие рестрикционные сайты для встраивания сегмента ДНК настоящего изобретения. Обычно, такими векторными плазмидами являются pUC8, pUC9, pBR322 и pBR329, поставляемые Biorad Laboratories (Richmond, CA), pPL и рКК223, поставляемые Pharmacia Piscataway, NJ.
Экспрессирующие векторы, совместимые с эукариотическими клетками, а предпочтительно совместимые с клетками позвоночных могут быть также использованы для получения рДНК-молекул, содержащих кодирующую последовательность. Экспрессирующие векторы эукариотических клеток хорошо известны специалистам и поставляются несколькими коммерческими фирмами. Обычно такие векторы содержат подходящие рестрикционные сайты для встраивания желательного сегмента ДНК. Типичными векторами являются pSVL и pKSV-10 (Pharmacia), pBPV-l/pML2d (International Biotechnologies, Inc.), pTDT1 (ATCC #31225) и подобные эукариотические экспрессирующие векторы.
Экспрессирующие векторы эукариотических клеток, используемые для конструирования рДНК-молекул настоящего изобретения, могут, кроме того, включать селектируемый маркер, который является эффективным в эукариотической клетке, а предпочтительно маркер для отбора на резистентность к лекарственному средству. Предпочтительным маркером резистентности к лекарственному средству является ген, экспрессия которого приводит к резистентности к неомицину, то есть ген неомицин-фосфотрансферазы (neo) (Southern et al. (1982), J.Mol.Anal.Genet.1:327-341). Альтернативно, данный селектируемый маркер может присутствовать на отдельной плазмиде, и эти два вектора могут быть введены путем котрансфекции вклетки-хозяина с последующим отбором на данный селективный маркер путем культивирования в среде с соответствующим лекарственным средством.
Настоящее изобретение также относится к клеткам-хозяевам, трансформированным или трансфецированным молекулой нуклеиновой кислоты, которая кодирует белок NOS, а предпочтительно белок eNOS или nNOS настоящего изобретения. Клетка-хозяин может быть либо прокариотической, либо эукариотической. Эукариотические клетки, используемые для экспрессии белка настоящего изобретения, не имеют конкретных ограничений при условии, что данная клеточная линия совместима с методами культивирования и размножения экспрессирующего вектора и с экспрессией генного продукта. Предпочтительными эукариотическими клетками-хозяевами являются, но не ограничиваются ими, дрожжевые клетки, клетки насекомых и клетки млекопитающих, предпочтительно позвоночных, такие как мышиные, крысиные, обезьяньи или человеческие клеточные линии. Предпочтительными эукариотическими клетками-хозяевами являются клетки яичника китайского хомячка (СНО), депонированные в АТСС как CCL61, клетки эмбрионов мышей NIH Swiss, NIH/3T3, депонированные в АТСС как CCL 1658, клетки почек детенышей хомячка (ВНК) и клеточные линии подобных эукариотических тканевых культур. Для экспрессии молекулы рДНК, кодирующей белок настоящего изобретения, может быть использован любой прокариотический хозяин. Предпочтительным прокариотическим хозяином, особенно для конститутивно активных NOS-мутантов, является E.coli.
Трансформацию или трансфекцию соответствующих клеток-хозяев молекулой рДНК настоящего изобретения осуществляют хорошо известными методами, которые обычно зависят от типа используемого вектора и от используемой системы-хозяина. Что касается трансформации прокариотических клеток-хозяев, обычно используются методы электропорации и обработки солью, см., например, Cohen et al., (1972) Proc. Natl. Acad. Sci. USA 69:2110; и Maniatis et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1982). В случае трансформации клеток позвоночных вектором, содержащим рДНК, обычно применяются методы электропорации и методы обработки катионными липидами и солью, см., например, Graham et al. (1983) Virol. 52:456; Wigler et al., (1979) Proc. Natl. Acad. Sci. USA 76:1373-76. Успешно трансформированные или трансфецированные клетки, то есть клетки, которые содержат молекулу рДНК настоящего изобретения, могут быть идентифицированы хорошо известными методами, включая отбор на селектируемый маркер. Так, например, клетки, полученные путем введения рДНК настоящего изобретения, могут быть клонированы с получением одиночных колоний. Клетки от этих колоний могут быть собраны, лизированы, а их ДНК-содержимое оценено на присутствие рДНК методами, описаннами Southern et al. (1975), J.Mol.Biol. 98:503 или Berent et al., (1985) Biotech. 3:208, либо белки, продуцированные из этих клеток, могут быть проанализированы иммунологическим методом.
Настоящее изобретение, кроме того, относится к методам продуцирования белка NOS, предпочтительно белка eNOS или белка nNOS настоящего изобретения, с использованием молекул нуклеиновой кислоты, описанных в настоящей заявке. В общих чертах, продуцирование рекомбинантной формы белка обычно включает следующие стадии. Сначала получают молекулу нуклеиновой кислоты, которая кодирует белок настоящего изобретения. Если данная кодирующая последовательность не прерывается интронами, то она является подходящей для экспрессии в любом хозяине. Затем эту молекулу нуклеиновой кислоты предпочтительно функционально присоединяют к подходящим регуляторным последовательностям, как описано выше, с образованием экспрессирующего элемента, содержащего открытую рамку считывания для данного белка. Этот экспрессирующий элемент используют для трансформации или трансфекции подходящего хозяина, и данного трансформированного или трансфецированного хозяина подвергают культивированию в условиях, подходящих для продуцирования рекомбинантного белка. Этот рекомбинантный белок может быть, но необязательно, выделен из среды или из клеток; причем, в некоторых случаях, там, где допустимо присутствие некоторых примесей, выделение и очистка белка необязательны.
Каждая из вышеуказанных стадий может быть осуществлена различными способами. Так, например, нужные кодирующие последовательности могут быть получены из геномных фрагментов и использованы непосредственно в подходящих хозяевах. Конструирование экспрессирующих векторов, которые функционируют в различных хозяевах, осуществляют с использованием соответствующих репликонов и регуляторных последовательностей, указанных выше. Конкретные регуляторные последовательности, экспрессирующие векторы и методы трансформации или трансфекции, зависят от типа клетки-хозяина, используемой для экспрессии данного гена, и подробно обсуждались выше. Подходящие рестрикционные сайты, если они изначально не присутствуют в данной последовательности, могут быть добавлены к концам кодирующей последовательности с получением вырезаемого гена для встраивания в данные векторы. Каждый специалист может легко адаптировать любую известную систему хозяин/экспрессирующий вектор для манипуляции с молекулами нуклеиновой кислоты настоящего изобретения в целях продуцирования рекомбинантного белка.
Генная терапия
Настоящее изобретение охватывает любую подходящую систему доставки генов, объединенную с подходящей системой экспрессии гена, с использованием большинства подходящих способов доставки. Так, например, мутант NOS или гены-варианты, предпочтительно вариантные или мутантные гены eNOS или nNOS настоящего изобретения или гены Akt, могут быть трасфецированы в клетки сердца (или скелетной мышцы, включая миоциты сердца и миоциты скелетных мышцы) in vitro или in vivo для прямого продуцирования кодированного белка. Особенно эффективными являются гены Akt человека и NOS-мутанты, предпочтительно eNOS человека, содержащие аминокислоту с отрицательно заряженной группой R, такую как аспарагиновая или глутаминовая кислота, в положении, соответствующем серину 1177 в eNOS человека. Способами введения мутантных или вариантных генов NOS являются, но не ограничиваются ими, внутрисосудистая, внутримышечная, внутрибрюшинная, внутрикожная и внутриартериальная инъекция.
Система доставки гена с помощью аденовируса имеет несколько преимуществ: аденовирус (i) позволяет вводить относительно большие вставки ДНК; (ii) может расти до высокого титра; (iii) способен инфицировать клетки млекопитающих широкого ряда; и (iv) может быть использован с большим числом имеющихся векторов, содержащих различные промоторы. Кроме того, поскольку аденовирусы являются стабильными в кровотоке, они могут быть введены путем внутривенной инъекции. Предпочтительным вектором для доставки является человеческий аденовирус 5, дефектный по хелпер-независимой репликации, хотя существуют и могут быть использованы и другие способы доставки, включая прямую доставку нуклеиновых кислот непосредственно в нужные клетки (см. Sawa et al. (1998) Gene Ther. 5 (11): 1472-80; Labhasetwar et al. (1998) J. Pharm. Sci. 87 (11): 1347-50; Lin et al. (1997) Hypertension 30:307-313; Chen et al. (1997) Circ.Res. 80(3):327-335; Channon et al. (1996) Cardiovasc. Res. 32:962-972; Harv.Heart. Lett. (1999)9(8):5-6; и Nabel et al.(1999) Nat.Med. 5(2):141-2.
С использованием системы аденовируса 5 частота трансфекции более чем 60% была продемонстрирована в клетках миокарда in vivo посредством одной внутрикоронарной инъекции (Giordano & Hammond (1994) Clin. Res. 42:123A). Нерепликативные рекомби-нантные аденовирусные векторы являются особенно эффективными при трансфекции коронарного эндотелия и кардиальных миоцитов и обеспечивают высокоэффективную трансфекцию после внутрикоронарной инъекции. Нерепликативные рекомбинантные аденовирусные векторы также являются эффективными для трансфекции желательных клеток периферической сосудистой системы (см. патент США 5792453, который во всей своей полноте вводятся в настоящее описание посредством ссылки).
Аденовирусные векторы, используемые в настоящем изобретении, могут быть сконструировании методом “спасательной” рекомбинации, описанным Graham et al. (1988) Virology 163:614-617. Вкратце, трансген eNOS клонируют в "челночный" вектор, который содержит промотор, полилинкер и неполные фланкирующие аденовирусные последовательности, в которых были делегированы гены Е1А/Е1В. Примерами челночного вектора могут служить плазмида pAC1 (Virology 163:614-617, 1988) (или ее аналог), которая кодирует фрагменты левого конца генома человеческого аденовируса 5 (Virology 163:614-617, 1988) без ранних кодирующих белок последовательностей Е1А и Е1В, которые играют важную роль в репликации вируса, и плазмида ACCMVPLPA (J.Bio.Chem. 267:25129-25134, 1992), которая содержит полилинкер, промотор CMV и сигнал полиаденилирования SV40, фланкированный неполными аденовирусными последовательностями, из которых были делегированы гены ЕА/Е1В. Использование плазмиды PAC1 или ACCMVPLPA облегчает процесс клонирования. Затем, челночный вектор котрансфецируют с плазмидой, содержащей целый геном человеческого аденовируса 5, который является слишком крупным для инкапсидирования, в клетки 293. Котрансфекция может быть осуществлена путем преципитации фосфатом кальция или липофекции (Biotechniques, 15:868-872, 1993). Плазмида JM17 кодирует полный геном человеческого аденовируса 5 плюс фрагменты вектора pBR322, включая ген резистентности к ампициллину (4,3 т.п.н.). Хотя JM17 кодирует все аденовирусные белки, необходимые для получения зрелых вирусных частиц, она является слишком крупной для инкапсидирования (40 т.п.н. по сравнению с 36 т.п.н. для дикого типа). В небольшой подсерии котрансфецированных клеток, спасательная рекомбинация между трансгенсодержащим челночным вектором, таким как плазмида рАС1, и плазмидой, имеющей полный геном аденовируса 5, такой как плазмида pJM17, приводит к получению рекомбинантного генома, который является дефицитным по последовательностям Е1А/Е1В и который содержит представляющий интерес трансген, но вторично в процессе рекомбинации он теряет дополнительную последовательность, такую как последовательности pBR322, а поэтому он становится достаточно малым, чтобы быть инкапсулированным. Регулируемый промотором CMV и кодирующий бета-галактозидазу аденовирус HCMVSP1 lacZ (Clin.Res. 42:123F, 1994) может быть использован для оценки эффективности переноса гена путем обработки X-gal.
В другом варианте осуществления изобретения ген, кодирующий NOS, предпочтительно eNOS или nNOS, может быть введен in vivo посредством аттенюированного или дефектного ДНК-вируса, неограничивающими примерами которого являются вирус простого герпеса (HSV), папилломавирус, вирус Эпштейна-Барра (EBV), аденовирус и аденоассоциированный вирус (AAV). Предпочтительными являются дефектные вирусы, у которых полностью или почти полностью отсутствуют вирусные гены. Дефектный вирус после его введения в клетку является неинфекционным. Использование дефектных вирусных векторов позволяет вводить их в клетки в конкретные локальные области, не опасаясь того, что этот вектор может инфицировать другие клетки. Таким образом, данный вектор может быть специфически нацелен на конкретную область, например в головном мозге или в позвоночнике. В конкретном варианте осуществления изобретения может быть использован дефектный герпесвирус 1 (HSV1) (Kaplitt et al., (1991) Molec.Cell. Neurosci. 2:320-330). В другом варианте осуществления изобретения вирусным вектором является вектор на основе аттенюированного аденовируса, такой как вектор, описанный Statford-Perricaudet et al. (J.Clin.Invest.90:626-630 (1992)). Еще в одном варианте осуществления изобретения указанным вектором является вектор на основе дефектного аденоассоциированного вируса (Samulski et al. (1987) J. Virol. 61:3096-3101; Samulski et al. (1989) J.Virol. 63:3822-3828).
В настоящем изобретении также рассматривается использование направленной доставки в клетку не только путем доставки трансгена в коронарную артерию или, например, в бедренную артерию, но также и путем использования тканеспецифических промоторов. Так, например, при присоединении тканеспецифических транскрипционных регуляторных последовательностей легкой цепи 2 миозина левого желудочка (MLC[2V]) или тяжелой цепи миозина (МНС) к трансгену, такому как гены NOS настоящего изобретения в аденовирусной конструкции, экспрессия трансгена ограничивается миоцитами желудочков сердца. Эффективность экспрессии гена и степень специфичности, обеспечиваемая промоторами MLC[2V] и МНС с lacZ, были определены с использованием рекомбинантной аденовирусной системы настоящего изобретения. Экспрессия, специфичная для сердца, была описана ранее Lee et al. (J. Biol.Chem. 267:15875-15885 (1992)). Промотор MLC[2V] состоит из 250 т.п.н. и легко подходит под ограничения упаковки аденовируса 5. Промотор тяжелой цепи миозина, известный сильный промотор транскрипции, представляет собой подходящий альтернативный промотор, специфичный для сердца, и состоит менее чем из 300 п.н. Подходящими также являются промоторы клеток гладкой мускулатуры, такие как альфа-промотор SM22 (Kemp et al., (1995) Biochem. J.310 (Pt 3):1037-43) и промотор альфа-актина SM (Shimizu et al. (1995) J. Biol. Chem. 270 (13):7631-43). Другие промоторы, такие как промотор тропонина-С, несмотря на высокую эффективность и достаточно малые размеры, не обладают адекватной тканеспецифичностью. При использовании промоторов MLC[2V] или МНС и доставки трансгена in vivo очевидно, что лишь один кардиальный миоцит (то есть без сопутствующей экспрессии в эндотелиальных клетках, клетках гладкой мускулатуры и фибробластах сердца) может обеспечивать адекватную экспрессию белка NOS.
Ограничение экспрессии миоцитами сердца также имеет преимущества с точки зрения применимости переноса гена для лечения клинической ишемии миокарда. При ограничении экспрессии областью сердца можно избежать возможных нежелательных эффектов ангиогенеза в несердечных тканях, таких как сетчатка глаза. Кроме того, из всех клеток сердца миоциты должны, вероятно, обеспечивать самую продолжительную экспрессию трансгена, поскольку эти клетки не подвергаются быстрому обновлению; а поэтому экспрессия не должна было бы снижаться при делении и гибели клеток, как это обычно происходит в случае эндотелиальных клеток. Эндотелийспецифические промоторы уже имеются в распоряжениии для этих целей. Примерами эндотелийспецифических промоторов являются промотор Tie-2 (Schlaeger et al. (1997) Proc.Natl. Acad. Sci. 1:94 (7): 3058-63), промотор эндотелина (Lee et al. (1990) J.Bio.Chem. 265:10446-10450) и промотор eNOS (Zhang et al. (1995) J.Bio.Chem. 270 (25):15320-6).
В случае лечения болезней сердца настоящее изобретение относится к доставке в сердце вектора с высоким титром путем внутрикоронарной или внутримышечной инъекции, а предпочтительно путем трансфекции клеток всех типов. Такие заболевания, как нарушение эрекции и сердечно-сосудистые заболевания, включая инфаркт миокарда, ишемия миокарда, сердечная недостаточность, рестеноз, стенозстента, рестеноз после ангиопластики и повреждение при обходимом сосудистом шунтировании, могут быть подвергнуты лечению с использованием трансгенов NOS, предпочтительно трансгенов eNOS или nNOS.
Подходящие рекомбинантные векторы могут быть очищены методом бляшек в соответствии со стандартной методикой. Полученные вирусные векторы размножают в клетках 293, которые обеспечивают функции Е1А и Е1В in trans до титров предпочтительно в диапазоне приблизительно 1010 -1012 вирусных частиц/мл. Клетки можно инфицировать до уровня 80% конфлюентности и собирать через 48 часов. После проведения 3 циклов замораживания-оттаивания клеточный дебрис осаждают путем центрифугирования и вирус очищают путем ультрацентрифугирования в градиенте CsCl (предпочтительно путем ультрацентрифугирования дважды в градиенте CsCl). Перед in vivo-инъекцией, вирусные исходные препараты обессоливают путем гель-фильтрации на колонке с сефадексом, таким как сефадекс G25. Затем этот продукт фильтруют через 30-микронный фильтр, что позволяет уменьшить побочные эффекты внутрикоронарной инъекции неотфильтрованного вируса (опасная для жизни аритмия сердца) и обеспечивать эффективный перенос гена. Полученный исходный препарат вируса имеет конечный титр в пределах 1010-1012 вирусных частиц/мл. Рекомбинантный аденовирус должен иметь высокую степень очистки без загрязнения вирусом дикого типа (потенциально репликативным вирусом). Загрязненные конструкции могут вызывать интенсивный иммунный ответ у животного-хозяина. Исходя из этого, для удаления примесей и вируса дикого типа могут быть осуществлены размножение и очистка полученного вируса, например, путем идентификации нужных рекомбинантов с помощью ПЦР с использованием соответствующих праймеров, путем проведения двух циклов очистки методом бляшек и путем ультрацентрифугирования дважды в градиенте CsCl. Кроме того, проблемы, связанные с возникновением аритмии сердца, индуцированной введением аденовирусного вектора пациенту, могут быть решены с помощью фильтрации рекомбинантного аденовируса через фильтр соответствующих размеров, проводимой до внутрикоронарной инъекции. Эта стратегия также позволяет существенно повысить эффективность переноса гена и экспрессии.
Исходный препарат вируса может быть получен в форме инъецируемого препарата, содержащего фармацевтически приемлемый носитель, такой как физиологический раствор, если это необходимо. Конечный титр данного вектора в указанном препарате для инъекций предпочтительно составляет в пределах примерно 107-1013 вирусных частиц и способствует эффективному переносу гена. Другие фармацевтические носители, композиции и дозы описаны ниже. Аденовирусные трансгенные конструкции доставляют в миокард путем прямой инъекции через коронарную артерию (или сосудистый трансплантат) стандартными методами с использованием чрескожного катетера под рентгеноскопическим контролем в количестве, достаточном для экспрессии трансгена до той степени, которая позволяет осуществлять высокоэффективную терапию. Эта инъекция может быть сделана глубоко (примерно на 1 см) в просвет коронарной артерии (или сосуда-трансплантата), а предпочтительно она может быть сделана в обе коронарные артерии, поскольку развитие коллатеральных кровеносных сосудов в высокой степени варьируется у каждого отдельного пациента. При инъекции данного материала непосредственно в просвет коронарной артерии с помощью коронарных катетеров доставка нужного гена может оказаться достаточно эффективной и может минимизировать потерю рекомбинантных векторов в проксимальной аорте в процессе инъекции. Известно, что при доставке указанным способом, экспрессия гена в гепатоцитах не происходит, а вирусная РНК не обнаруживается в моче ни в какое время после внутрикоронарной инъекции. В настоящем изобретении может быть использован, например, любой тип коронарного катетера или перфузионный катетер Стэка. Кроме того, для переноса генов NOS, а предпочтительно eNOS или nNOS, в стенку артерии могут быть использованы и другие известные специалистам методы.
Для лечения заболевания периферических сосудов, а именно заболевания, характеризующегося недостаточным кровоснабжением ног, рекомбинантный аденовирус, экспрессирующий NOS, а предпочтительно пептид или белок eNOS или nNOS настоящего изобретения, может быть доставлен с помощью катетера, вставленного в проксимальную часть бедренной артерии или артерий, в результате чего обеспечивается эффективный перенос гена в клетки скелетных мышц вместе с потоком крови, поступающим из бедренных артерий.
В случаях, когда трансген или нуклеиновая кислота, кодирующая NOS, а предпочтительно eNOS или nNOS, или белок Akt настоящего изобретения сначала переносятся в клетки эндотелия или гладкой мускулатуры сосудов in vitro, включая собственные клетки пациента, то ДНК может быть трансфецирована непосредственно в клетки (см., патент США 5658565). В основном, для трансфекции клеток-мишеней плазмидный вектор, содержащий последовательность ДНК, кодирующую Akt или NOS настоящего изобретения, или ее биологически активный фрагмент может быть использован в опосредованной липосомами трансфекции клетки-мишени. Стабильность липосом в сочетании с герметичной природой этих везикул делает их ценными везикулами для доставки терапевтических последовательностей ДНК (см. обзор Mannino & Gould-Forgerite (1988) BioTechniques 6 (7):682-690). Известно, что липосомы абсорбируются клетками многих типов путем слияния. В одном из вариантов осуществления изобретения могут быть использованы катионные липосомы, содержащие катионные производные холестерина, такие как SF-chol или DC-chol. Молекула DC-chol содержит третичную аминогруппу, спейсерную ножку средней длины и карбамоильную линкерную связь, как описано Gao & Huang (Biochem. Biophys. Res. Comm. 179:280-285, 1991).
В другом варианте осуществления изобретения, касающемся использования липосомной технологии, вирусный или невирусный вектор, содержащий последовательность ДНК, кодирующую биологически активный фрагмент белка NOS, а предпочтительно фрагмент белка eNOS или nNOS, доставляют в клетку-мишень путем ее трансфекции липофектамином (Bethesda Research Laboratory). Липофектамин представляет собой липосомную композицию, состоящую в отношении 3:1 из поликатионного липида 2, 3-диолеилокси-N-[2-(сперминкарбоксимидо)этил]-N, N-диметил-1-пропанаминийтрифторацетата (DOPSA) и нейтрального липида диолеолифосфатидилэтаноламина (DOPE).
Другими невирусными способами доставки генов являются, но не ограничиваются ими, (а) прямая инфекция "оголенной" (депротеинизированной) ДНК; (b) трансфекция клетки, опосредованная фосфатом кальция [Са3(РO4 )2]; (с) трансфекция клеток-хозяев млекопитающих путем электропорации; (d) DEAE-декстранопосредованная трансфекция клеток; (е) опосредованная полибреном доставка; (f) слияние протопластов; (g) микроинъекция; (h) трансформация, опосредованная полилизином, с последующим переносом генетически модифицированных клеток обратно млекопитающему-хозяину.
Продуцирование трансгенных животных
Настоящее изобретение также относится к трансгенным животным, содержащим мутантный ген NOS, а предпочтительно мутантный ген eNOS или nNOS, описанный в настоящей заявке. Трансгенные животные представляют собой генетически модифицированные животные, которым был экспериментально введен рекомбинантный, экзогенный или клонированный генетический материал. Такой генетический материал часто называют "трансгеном". Последовательность нуклеиновой кислоты трансгена в случае образования NOS может быть интегрирована либо в локус генома, где указанная конкретная последовательность нуклеиновой кислоты обычно не присутствует, либо в нормальный локус для данного трансгена. Данный трансген может состоять их последовательностей нуклеиновых кислот, происходящих от генома того же самого вида или от вида, отличающегося от вида животного-мишени.
Термин "трансгенное животное зародышевой клеточной линии" означает трансгенное животное, у которого в зародышевую клеточную линию было введен генетическое изменение или генетическая информация, в результате чего этому трансгенному животному была сообщена способность передачи генетической информации потомству. Если такое потомство действительно обладает некоторыми или всеми из указанных изменений или генетической информации, то оно также является трансгенными животными.
Изменение или генетическая информация может быть чужеродным для животного данного вида, к которому принадлежит данный реципиент, чужеродным только для данного конкретного реципиента, либо оно может представлять собой генетическую информацию, уже имеющуюся у реципиента. В последнем случае, модифицированный или введенный ген может быть экспрессирован иначе, чем нативный ген.
Трансгенные животные могут быть продуцированы различными методами, включая трансфекцию, электропорацию, микроинъекцию, доставку гена в эмбриональные стволовые клетки и инфицирование рекомбинантным вирусом и ретровирусом (см., например, патент США №4736866; патент США №5602307; Mullins et al. (1993) Hypertension 22 (4):630-633; Brenin et al. (1977) Surg. Oncol. 6(2)99-110; Tuan (ed), Recombinant Gene Expression Protocols, Methods in Molecular Biology №62, Humana Press (1977)).
Был продуцирован ряд рекомбинантных или трансгенных мышей, включая мышей, которые экспрессируют активированную онкогенную последовательность (патент США №4736866); которые экспрессируют Т-антиген обезьяньего SV40 (патент США №5728915); у которых отсутствует экспрессия интерферонового регуляторного фактора 1 (IRF-1) (патент США №5731490); у которых обнаруживается допаминергическая дисфункция (патент США №5723719); которые экспрессируют, по крайней мере, один человеческий ген, участвующий в регуляции кровяного давления (патент США №5731489); которые обнаруживают большее сходство с симптомами, обычно присутствующими при болезни Альцгеймера, возникающей в естественных условиях (патент США №5720936); которые обладают пониженной способностью к опосредованию клеточной адгезии (патент США №5602307); которые имеют ген бычьего гормона роста (Clutter et al. (1996) Genetics 143 (4):1753-1760); или которые обладают способностью генерировать полный гуморальный ответ на введение человеческого антитела (McCarthy (1997) The Lancet 349(9049): 405).
Хотя мыши и крысы остаются предпочтительными животными для большинства экспериментов с использованием трансгенов, однако, в некоторых случаях предпочтительно или даже необходимо использовать альтернативные виды животных. Кроме мышей способы с применением трансгенов были успешно использованы и на других животных, включая овец, коз, свиней, собак, кошек, обезьян, шимпанзе, хомяков, кроликов, коров и морских свинок (см., например, Kim et al. (1997) Mol.Reprod. Dev. 46(4):515-526; Houdebine (1995) Reprod. Nutr. Dev. 35 (6):609-617; Petters (1994) Reprod. Pertil. Dev. 6(5):643-645; Schnieke et al. (1997) Science 278 (5346):2130-2133; и Amoah (1977) J.Animal Science 75 (2):578-585).
Методом введения фрагментов нуклеиновой кислоты в рекомбинантные компетентные клетки млекопитающих может быть любой метод, который благоприятствует котрансформации множества молекул нуклеиновой кислоты. Подробные описания способов продуцирования трансгенных животных легко доступны каждому специалисту, включая описания в патенте США №5489743 и в патенте США №5602307. Кроме того, хорошо разработан способ продуцирования NOS-трансгенных животных. Так, например, были продуцированы трансгенные мыши, которые индуцибельно экспрессируют или сверхэкспрессируют eNOS дикого типа (см. Ohashi et al. (1998) J.Clin. Invest. 102 (12):2061-71; и Drurnmond. et al. (1988) J.Clin.Invest. 102 (12):2033-4). Эти способы могут быть использованы для продуцирования трансгенных мышей, которые экспрессируют мутанты NOS настоящего изобретения.
Анализы терапевтического скрининга
Обнаружение того факта, что фосфорилирование eNOS регулирует его активность, позволяет разработать анализы скрининга для идентификации агентов, которые модулируют Akt-регулируемую активность или экспрессию NOS, а предпочтительно eNOS или nNOS. Может быть использован любой подходящий формат, включая анализ in vivo трансгенных животных, анализ белков in vitro, анализы клеточных культур и высокоэффективный формат.
Во многих программах скрининга лекарственных средств, в которых тестируются библиотеки соединений, желательно проводить высокоэффективные анализы для максимизации количества соединений, испытываемых в данный период времени. Анализы, которые осуществляют в бесклеточных системах, такие, которые могут быть осуществлены с очищенными или полуочищенными белками, могут оказаться часто предпочтительными в качестве "первичного" скрининга, который может быть разработан для быстрого выявления и относительно легкой детекции модификации в молекулярной мишени, опосредуемой тестируемым соединением. Кроме того, влияние клеточной токсичности и/или биологической доступности тестируемого соединения может, в основном, не приниматься к сведению в системе in vitro, поскольку данный анализ направлен главным образом на оценку воздействия лекарственного средства на молекулярную мишень, что может проявляться в ингибировании, например связывания между молекулами.
Анализ, основанный на клеточной или тканевой культуре, может быть осуществлен, например, путем посева клеток CОS-7 (на 100 мм-чашку) и трансфекции этих клеток плазмидами для NOS (7,5-30 мг) и Akt (1 мг) с использованием фосфата кальция. Для баланса всех трансфекций может быть котрансфецирован экспрессирующий вектор для кДНК β-галактозидазы. Через двадцать четыре-сорок восемь часов после трансфекции экспрессия соответствующих белков (40-80 мг) может быть подтверждена анализом метода Вестерн-блота с использованием антитела (mAb) к eNOS (9D10, Zymed), mAb к НА (12СА5, Boehringer Mannheiem), поликлонального антитела (рАb) к iNOS (Zymed Laboratories) или mAb к nNOS (Zymed Laboratories).
Через двадцать четыре-сорок восемь часов после трансфекции среду обрабатывают для измерения уровня нитрита (NO2-), стабильного продукта разложения NO в водном растворе путем NO-специфической хемилюминесценции, как описано Sessa et al., 1995. Среду подвергают депротеинизации и образцы, содержащие NO2-, кипятят с обратным холодильником в ледяной уксусной кислоте, содержащей иодид натрия. В этих условиях NO2- количественно восстанавливается до NO, количество которого оценивают на хемилюминесцентном детекторе после реакции с озоном в NO-анализаторе (Sievers, Boulders, CO). Во всех экспериментах контроли могут быть получены путем ингибирования высвобождения NO2- с использованием ингибитора NOS. Кроме того, высвобождение NO2- из клеток, трансфецированных кДНК β-галактозидазы может быть вычтено для учета фоновых уровней NO2-, присутствующих в сыворотке или в среде. Аккумуляция cGMP в клетках COS может быть также использована в биоанализе на продуцирование NO, как уже было описано. В альтернативном формате превращение3H-L-аргинина в3H-L-цитруллин может быть использовано для определения активности NOS в лизатах клеток COS или эндотелиальных клеток, как описано ранее (Garcia-Cardena et al., 1998).
Для исследований фосфорилирования in vivo клетки COS могут быть трансфецированы кДНК дикого типа или S635 (контроль), бычьего eNOS 1179A, D или Е, человеческого eNOS 1177D или Е, крысиного nNOS 1412D или Е, человеческого nNOS 1415D или Е, и HA-Akt в течение ночи. Через 36 часов после трансфекции клетки помещают в обогащенную диализованной сывороткой и не содержащую фосфата минимальную поддерживающую среду Дульбекко, в которую было добавлено 80 мкКи/мл32Р-ортофосфорной кислоты, на 3 часа. Клеточная аликвота может быть предварительно обработана вортманнином (500 нМ) в не содержащей фосфат среде в течение 1 часа и во время мечения. Затем лизаты собирают, NOS солюбилизируют и частично очищают с помощью аффинной хромато-графии на ADP-сефарозе, как было описано ранее, и после электрофореза в ДСН-ПААГ (7,5%) включение32P в NOS визуализируют посредством авторадиографии, а количество белка NOS подтверждают с помощью анализа методом Вестерн-блота на NOS.
Для исследований фосфорилирования in vitro рекомбинантный NOS, очищенный из E.coli, eNOS, очищенный из другого источника, или пептиды NOS, включающие сайт Akt-фосфорилирования, инкубируют с Akt дикого типа или неактивной киназой Akt, иммунопреципитированных из трансфецированных клеток COS. Вкратце, белки или пептиды NOS инкубируют с32Р-g-АТР (2 мл, удельная активность 3000 Ки/ммоль), АТР (50 мМ), DTT (1 мМ) в буфере, содержащем HEPES (20 мМ, рН 7,4), MnCl2 (10 мМ), MgCl2 (10 мМ) и иммунопреципитированную Akt, в течение 20 минут при комнатной температуре.
В экспериментах по оценке фосфорилирования in vitro NOS дикого типа и мутантного NOS рекомбинантную Akt (1 мг), очищенную из инфицированных бакуловирусом клеток SF9, инкубируют с NOS дикого типа, бычьего eNOS S1179A, человеческого eNOS S1177A, бычьего eNOS S1179D или Е, человеческого eNOS S1177D или Е, крысиного nNOS S1412D или Е, или человеческого nNOS S1415D или Е, с использованием, в основном, тех же условий, которые были описаны выше. Белки могут быть разделены с помощью электрофореза в ДСН-ПААГ, а включение32P и количество белка определяют по окрашиванию кумасси, как описано выше.
Вышеописанные анализы скрининга, которые позволяют проанализировать Akt-зависимое фосфорилирование или активацию NOS, а предпочтительно eNOS или nNOS, могут быть использованы для скрининга агентов широкого ряда. Так, например, агенты, которые ингибируют дефосфорилирование NOS (ингибиторы фосфатазы) по аминокислоте, соответствующей серину 1179 в бычьем eNOS, остатку 1177 в человеческом eNOS, остатку 1412 в крысином nNOS или остатку 1415 в человеческом nNOS, могут быть использованы в качестве терапевтических молекул. Аналогичным образом агенты, которые активируют Akt или имитируют сайт Akt-фосфорилирования на eNOS, могут быть использованы в качестве терапевтических молекул.
Агенты, которые были проанализированы вышеуказанными методами, могут быть произвольно отобраны, или направленно отобраны, или сконструированы. Используемый здесь агент считается произвольно отобранным, если этот агент был произвольно выбран без учета его специфических последовательностей, участвующих в связывании белка настоящего изобретения, взятого отдельно или с ассоциированными с ним субстратами, с его партнерами по связыванию и т.п. Примером произвольного отбора агентов является использование химической библиотеки, или комбинаторной пептидной библиотеки, или среды для культивирования организма.
Используемый здесь агент считается направленно отобранным или сконструированным, если этот агент был выбран не произвольно, а с учетом последовательности сайта-мишени и/или ее конформации в связи с действием этого агента. Так, например, направленно выбранным пептидным агентом может быть пептид, аминокислотная последовательность которого аналогична сайту Akt-фосфорилирования в NOS, а в частности пептиды или небольшие молекулы, имитирующие состояние фосфорилирования NOS.
Агентами настоящего изобретения могут быть, например, пептиды, небольшие молекулы, производные витаминов, а также углеводы. Для любого специалиста очевидно, что структурная природа агентов настоящего изобретения не имеет каких-либо ограничений.
Пептидные агенты настоящего изобретения могут быть получены стандартными методами твердофазного (или синтеза в растворе) синтеза пептидов известными специалистам. Кроме того, ДНК, кодирующая указанные пептиды, может быть синтезирована с использованием коммерчески доступного оборудования для синтеза олигонуклеотидов и продуцирована рекомбинантными методами с использованием стандартных систем получения рекомбинантных ДНК. Продуцирование методами твердофазного пептидного синтеза необходимо в том случае, когда требуется включение не кодируемых данным геном аминокислот.
Другим классом агентов настоящего изобретения являются антитела, обладающие иммунореактивностью с главными положениями в белках настоящего изобретения. Агенты в виде антител получают путем иммунизации подходящих млекопитающих пептидами, содержащими антигенные области, то есть те части белков, на которые направлены данные антитела.
Использование агентов, идентифицированных как агенты, модулирующие активность eNOS
Агенты настоящего изобретения, такие как агенты, ингибирующие дефосфорилирование NOS (ингибиторы фосфатазы) по аминокислоте, соответствующей серину 1179 в бычьем eNOS, остатку 1177 в человеческом eNOS, остатку 1412 в крысином nNOS или остатку 1415 в человеческом nNOS, а также агенты, активирующие Akt или имитирующие сайт Akt-фосфорилирования на NOS, могут быть введены парентерально, подкожно, внутривенно, внутримышечно, внутрибрюшинно, внутрикожно или трансбуккально. Альтернативно или одновременно введение может быть осуществлено перорально. Вводимая доза будет зависеть от возраста, состояния здоровья и веса реципиента, типа сопутствующего лечения, если оно проводится, частоты введения и желаемого эффекта. Как описано ниже, существует много методов, которые могут быть легко адаптированы для введения указанных агентов.
Настоящее изобретение, кроме того, относится к композициям, содержащим один или несколько агентов настоящего изобретения. Хотя вводимое количество может варьироваться для каждого индивидуума, однако, каждый специалист может самостоятельно определить оптимальные диапазоны эффективных количеств каждого компонента. Обычные дозы составляют 0,1-100 мг/кг массы тела. Предпочтительные дозы составляют 0,1-10 мг/кг массы тела. Наиболее предпочтительные дозы составляют 0,1-1 мг/кг массы тела.
Помимо фармокологически активного агента композиции настоящего изобретения могут содержать подходящие фармацевтически приемлемые носители, включая наполнители и добавки, которые облегчают обработку данных активных соединений с получением препаратов, которые могут быть фармацевтически приемлемыми для доставки в нужный участок. Подходящими композициями для парентерального введения являются водные растворы активных соединений в водорастворимой форме, например в форме водорастворимых солей. Кроме того, могут быть введены суспензии активных соединений в виде соответствующих масляных суспензий для инъекций. Подходящими липофильными растворителями или носителями являются жирные масла, например кунжутное масло, или синтетические сложные эфиры жирных кислот, например этилолеат или триглицериды. Водные суспензии для инъекций могут содержать вещества, повышающие вязкость данной суспензии, включая, например, натрийсодержащую карбоксиметилцеллюлозу, сорбит и/или декстран. Данная суспензия может также, но необязательно, содержать стабилизаторы. Для инкапсуляции данного агента в целях его доставки в клетку могут быть также использованы липосомы.
Фармацевтическая композиция для системного введения по настоящему изобретению может быть приготовлена для внутрикишечного, парентерального или топического введения. В действительности, все эти три типа композиций могут быть одновременно использованы для достижения системного введения активного ингредиента.
Подходящими композициями для перорального введения являются жесткие или мягкие желатиновые капсулы, драже, таблетки, включая таблетки с покрытием, эликсиры, суспензии, сиропы или ингаляции и их формы регулируемого высвобождения.
При осуществлении способов настоящего изобретения соединения настоящего изобретения могут быть использованы отдельно или в комбинации, либо в комбинации с другими терапевтическими или диагностическими агентами. В некоторых предпочтительных вариантах осуществления изобретения соединения настоящего изобретения могут быть введены вместе с другими соединениями, обычно прописываемыми при данных состояниях в соответствии с общепринятой медицинской практикой, такими как противосвертывающие агенты, тромболитические агенты или другие противотромботические агенты, включая ингибиторы агрегации тромбоцитов, тканевые активаторы плазминогена, урокиназа, проурокиназа, стрептокиназа, гепарин, аспирин и варфарин. Соединения настоящего изобретения могут быть использованы in vivo обычно для млекопитающих, таких как человек, овцы, лошади, крупный рогатый скот, свиньи, собаки, кошки, крысы и мыши, или in vitro.
Нижеследующие рабочие примеры, в частности, иллюстрируют предпочтительные варианты осуществления настоящего изобретения и не должны рассматриваться как ограничение всего описания изобретения. Другие общие конфигурации будут очевидны для каждого специалиста.
Примеры
В примерах 1-12 были осуществлены нижеследующие процедуры.
Трансфекция клеток: кДНК бычьего eNOS, человеческого iNOS, крысиного nNOS в pcDNA3 и НА-меченый Akt дикого типа, Akt (K179M) или myr-Akt в pCMV6 генерировали стандартными методами клонирования. myr-nNOS в pcDNA3 генерировали с помощью ПЦР с включением новых аминоконцов, содержащих консенсусный сайт N-миристоилирования eNOS (MGNLKSVG, SEQ ID N0:l), присоединенный с сохранением рамки считывания ко второй аминокислоте nNOS-кодирующей последовательности. В предварительных экспериментах на клетках COS эту конструкцию подвергали N-миристоилированию путем включения3H-миристиновой кислоты, тогда как нативную nNOS не подвергали такому миристолированию, в результате чего получали приблизительно 60% общего белка, направленного на мембранную фракцию клеток, тогда как только 5-10% nNOS были мембрано-ассоциированы в клетках COS. Мутация предполагаемых сайтов Akt-фосфорилирования в eNOS была генерирована с использованием набора для сайтнаправленного мутагенеза Quick Change (Stratagene) в соответствии с инструкциями производителей. Все мутанты были подтверждены путем ДНК-секвенирования. Клетки COS-7 высевали (на 100 мм-чашку) и трансфецировали плазмидами NOS (7,5-30 мг) и Akt (1 мг) плазмидами с использованием фосфата кальция. Для баланса всех трансфекций был использован экспрессирующий вектор для кДНК β -галактозидазы. Через двадцать четыре-сорок восемь часов после трансфекций экспрессию соответствующих белков (40-80 мг) подтверждали анализом метода Вестерн-блотинга с использованием антитела (mAb) к eNOS (9D10, Zymed), mAb к НА (12СА5, Boehringer Mannheiem), поликлонального антитела (pAb) к iNOS (Zymed Laboratories) или mAb против nNOS (Zymed Laboratories).
Высвобождение NO из трансфекцированных клеток COS: Через 24-48 часов после трансфекций среду обрабатывали для измерения уровня нитрита (N02-), стабильного продукта разложения NO в водном растворе, с помощью NO-специфической хемилюминесценции, как описано Sessa et al., 1995. Среду подвергали депротеинизации и образцы, содержащие NO2-, кипятили с обратным холодильником в ледяной уксусной кислоте, содержащей иодид натрия. В этих условиях NO2- количественно восстанавливался до NO, количество которого оценивали на хемилюминесцентном детекторе после реакции с озоном в NO-анализаторе (Sievers, Boulders, СО). Во всех экспериментах высвобождение NO2- ингибировалось ингибитором NOS. Кроме того высвобождение NO2- из клеток, трансфецированных кДНК β-галактозидазы, вычитали для учета фоновых уровней NO2-, присутствующих в сыворотке или в среде. В некоторых экспериментах аккумуляция cGMP в клетках COS была использована в биоанализе на продуцирование NO, как уже было описано.
Анализы на активность NОS: Превращение3H-L-аргинина в3H-L-цитруллин было использовано для определения активности NOS в лизатах клеток COS или эндотелиальных клеток, как описано ранее (Garcia-Cardena et al., 1998).
Исследования фосфорилирования in vivo и in vitro: Для исследований фосфорилирования in vivo клетки COS могут быть трансфецированы кДНК дикого типа или S635, eNOS 1179A и HA-Akt в течение ночи. Через 36 часов после трансфекции, клетки помещали в обогащенную диализованной сывороткой и не содержащую фосфата минимальную поддерживающую среду Дульбекко, в которую было добавлено 80 мкКи/мл32Р-ортофосфорной кислоты, на 3 часа. Некоторые клетки предварительно обрабатывали вортманнином (500 нМ) в не содержащей фосфата среде в течение 1 часа и во время мечения. Затем лизаты собирали, NOS солюбилизировали и частично очищали с помощью аффинной хроматографии на ADP-сефарозе, как было описано ранее, и после электрофореза в ДСН-ПААГ (7,5%) включение32Р в NOS визуализировали посредством авторадиографии, и количество белка eNOS подтверждали с помощью анализа методом Вестерн-блотинга на eNOS. Для исследований фосфорилирования in vitro рекомбинантный eNOS, выделенный из E.coli, инкубировали с Akt дикого типа или неактивной киназой Akt, иммунопреципитированных из трансфецированных клеток COS. eNOS инкубировали с32Р-g-АТР (2 мл, удельная активность 3000 Ки/ммоль), АТР (50 мМ), DTT (1 мМ) в буфере, содержащем HEPES (20 мМ, рН 7,4), MnCl2 (10 мМ), MgCl2 (10 мМ) и иммунопреципи-тированную Akt, в течение 20 минут при комнатной температуре.
В экспериментах на оценку фосфорилирования in vitro eNOS дикого типа и мутантного eNOS рекомбинантную Akt (1 мг), очищенную из инфицированных бакуловирусом клеток SF9, инкубировали с NOS дикого типа или eNOS S1179A (2,4 мг, очищенной из E.coli) с использованием, в основном, тех же условий, которые были описаны выше. Белки разделяли с помощью электрофореза на ДСН-ПААГ, а включение32P и количество белка определяли по окрашиванию кумасси, как описано выше.
В исследованиях на идентифицирование меченого пептида eNOS иммунопреципитированную Akt инкубировали с рекомбинантным eNOS, как описано выше. Образец подвергали электрофорезу в ДСН-ПААГ, и полосу с eNOS гидролизовали в геле и полученные триптические фрагменты очищали с помощью ОФ-ВЭЖХ. Затем проводили мониторинг массы пептида и включения32P и заметный меченый пик затем анализировали с помощью масс-спектрометрии. В других экспериментах пептиды, соответствующие возможному сайту Akt-фосфорилирования, синтезировали, очищали с помощью ВЭЖХ и подтверждали масс-спектрометрией (W.M. Keck Biotechnology Resource Center, Yale University School of Medicine). Пептид дикого типа представлял собой 1174RIRTQSFSLQERHLRGAVPWA1194 (SEQ ID NO:2), а мутантный пептид был идентичным за исключением того, что S1179 был заменен аланином. В киназных реакциях in vitro, проводимых, в основном, как описано выше, инкубировали пептиды (25 мг) с рекомбинантным Akt (1 мг). Затем продукты реакций наносили пятнами на фосфоцеллюлозные фильтры и количество включенного фосфата измеряли на счетчике Черенкова.
Инфицирование аденовирусами и высвобождение NO в эндотелиальных клетках: Микроваскулярные эндотелиальные клетки бычьего легкого (BLMVEC) культивировали либо в 100 мм-чашках (для анализов на базальное высвобождение NO и на активность NOS), либо в 96-луночных планшетах (для стимулированного высвобождения NO), как описано ранее (Garcia-Cardena et al., 1996a). BLMVEC инфицировали аденовирусом при множественности заражения 200, содержащим β-галактозидазу 29, НА-меченый неактивный по фосфорилированию мутант Akt (AA-Akt; Alessi et al., 1996) или карбокси-концевой НА-меченый конститутивно активный Akt (myr-Akt) в течение 4 часов. Вирус удаляли и клетки оставляли для восстановления на 18 часов в полной среде. В предварительных экспериментах с использованием вируса, содержащего β -галактозидазу, эти условия были оптимальными для инфицирования 100% культур. Для измерения продуцирования базальных уровней NO среды собирали через 24 часа после первоначального инфицирования вирусом. Для измерения стимулированного высвобождения NO клетки промывали бессывороточной средой, а затем стимулировали VEGF (40 нг/мл) в течение 30 минут. В некоторых экспериментах через 24 часа после инфицирования аденовирусом определяли степень зависимости NOS от кальция. Инфицированные клетки лизировали в буфере для анализа NOS, содержащем 1% NP40, и растворимый в детергенте материал использовали для измерения активности. Лизаты инкубировали с EGTA-забуференным кальцием с получением соответствующих количеств свободного кальция при инкубировании.
Статистика: Данные выражали как среднее + ср.кв.от. Сравнение проводили с использованием двустороннего критерия Стьюдента или дисперсионного анализа (ANOVA) с применением критерия post-hoc (лат. - "после этого"), если это необходимо. Различия считались значимыми при р<0,05.
Пример 1: Akt модулирует продуцирование NO из eNOS
Для исследования возможности того, что ингибирующий эффектор киназы PI-3, Akt, может непосредственно влиять на продуцирование NO, клетки COS-7 (которые не экспрессируют NOS) подвергали котрансфекции с eNOS и Akt дикого типа (HA-Akt), или неактивной киназы Akt (Ha-Akt K179M), и аккумуляцию нитрита (NO2-) измеряли по NO-специфической хемилюминесценции. Трансфекция eNOS приводила к увеличению аккумуляции NO2-, то есть это действие заметно усиливалось при котрансфекции с Akt дикого типа, но не с неактивным вариантом киназы (фиг.1А). Идентичные результаты были получены с использованием cGMP в качестве биологического анализа на биологически активную NO. В этих экспериментальных условиях Akt был каталитически активным, как было определено с помощью анализа методом Вестерн-блотинга с использованием фосфо-Akt-специфического антитела (Аb)(которое распознает серин 473; данные не приводятся) и анализа на активность Akt (см., фиг.2А). Трансфекция конститутивно активной формы Akt (myr-Akt) приводила к увеличению аккумуляции cGMP (проанализированной в клетках COS) от 5,5±0,8 до 11,6±0,9 пмоль cGMP/мг белка (в клетках, трансфецированных одним eNOS или eNOS с myr-Akt соответственно), тогда как неактивная киназа Akt не оказывала какого-либо влияния на аккумуляцию cGMP (5,8±0,8 пмоль cGMP, n=4 экспериментов). Как показано на вставке, в лизатах клеток COS экспрессировались равные уровни eNOS и Akt, что позволяет сделать предположение о том, что Akt модулирует eNOS и тем самым способствует увеличению продуцирования NO в базальных условиях.
eNOS представляет собой вдвойне ацилированный периферический мембранный белок, который направляется в аппарат Гольджи и плазматическую мембрану эндотелиальных клеток (Liu et al., 1997; Garcia-Cardena et al., 1996a; Shaal et al., 1996), и компартментализация необходима для эффективного продуцирования NO в ответ на стимуляцию агонистом (Sessa et al., 1995; Liu et al., 1996; Kantor et al., 1996). Для того чтобы оценить, необходима ли мембраннная компартментализация для активации eNOS с помощью Akt, клетки COS-7 котрансфецировали кДНК для Akt и количественно оценивали миристоилирование, пальмитоилирование дефектного мутанта eNOS (G2A eNOS) и высвобождение NO. Как видно из фиг.1В, Akt не активирует неацилированную форму eNOS, что позволяет предположить, что для функционального взаимодействия обоих белков необходима их компартментализация в мембрану (Downward et al., 1998). Затем было определено, может ли Akt активировать структурно схожие, но отличающиеся растворимые изоформы NOS, нейронный и индуцибельный NOS (nNOS и iNOS соответственно). Котрансфекция Akt с формами nNOS и iNOS не приводила к дополнительному повышению уровня высвобождения NO, что свидетельствовало о специфичности Akt по отношению к eNOS. Однако, добавление сайта N-миристоилирования к nNOS в целях усиления его взаимодействия с биологическими мембранами, приводило к стимуляции nNOS с помощью Akt по тому же типу, как это наблюдалось с eNOS, что дает основание предположить, что обе изоформы могут быть восприимчивыми к активации киназой Akt при заякоривании в мембране.
Пример 2: Продуцирование мутаций eNOS
Вышеописанные эксперименты наводят на мысль, что Akt, вероятно, посредством фосфорилирования eNOS могут модулировать высвобождение NO из интактных клеток. Действительно, два предполагаемые мотива Akt-фосфорилирования (RXRXXS/T) присутствуют в eNOS (серины 635 и 1179 в бычьем eNOS или серины 633 и 1177 в человеческом eNOS) и один мотив присутствует в nNOS (серины 1412 в крысином nNOS и 1415 в человеческом nNOS), причем очевидные мотивы не были обнаружены в iNOS. Для того чтобы определить, является ли eNOS потенциальным субстратом для Akt-фосфорилирования in vitro, клетки COS трансфецировали HA-Akt или HA-Akt (K179M) и киназную активность оценивали с использованием рекомбинантного eNOS в качестве субстрата. Как видно на фиг.2А, активная киназа фосфорилирует гистон 2А и eNOS (69±2,9 и 115,4±3,8 пмоль АТР/нмоль субстрата, соответственно n=3), тогда как неактивная Akt не способствует значительному увеличению фосфорилирования гистона или eNOS. Для того чтобы выяснить, являются ли предполагаемые сайты Akt-фосфорилирования в eNOS ответственными за включение32P, два серина были мутированы с заменой на аланиновые остатки, и способность Akt стимулировать фосфорилирование eNOS дикого типа и мутанта оценивали в интактных клетках COS. Трансфецированные клетки метили32Р-ортофосфатом, eNOS частично очищали с помощью аффинной хроматографии на ADP-сефарозе и количественно оценивали состояние фосфорилирования и уровени белков. Как видно из фиг.2В, коэкспрессия с Akt приводит к 2-кратному увеличению уровня фосфорилирования eNOS по сравнению с нестимулированными клетками. Предварительная обработка eNOS/Akt-трансфецированных клеток вотманнином приводит к отмене Akt-индуцированного увеличения фосфорилирования. Кроме того, мутация серинов 635 и 1179 с их заменой на аланиновые остатки отменяет Akt-зависимое фосфорилирование eNOS, что дает основание предположить, что эти остатки могут служить потенциальными сайгами фосфорилирования в интактных клетках.
Для идентификации непосредственно остатков, фосфорилированных Akt, eNOS дикого типа инкубировали с иммуноочищенным Akt, и сайты фосфорилирования определяли посредством ВЭЖХ с последующей MALDi-масс-спектрометрией (MALDi-MC). Как видно из фиг.2С, предварительно32Р-меченый триптический фосфопептид элюировался вместе с синтетическим фосфопептидом (аминокислоты 1177-1185 с фосфосерином в положении 1179) и имел идентиные масс-ионы, как было определено с помощью линейной МС. С использованием мониторинга посредством MALDi-MC отражательного типа как меченый триптический пептид, так и стандартный фосфопептид обнаруживали потерю НР3O4, что указывало на то, что триптический пептид был фосфорилирован. Кроме того, мутация S1179 с заменой на А приводила к снижению уровня Akt-зависимого фосфорилирования eNOS по сравнению с белком дикого типа (фиг.2D). Идентичные результаты были получены с использованием пептидов (аминокислоты 1174-1194), происходящих от белка дикого типа или eNOS S1179A, в качестве субстратов для рекомбинантного Akt (пептид дикого типа включал 24,6±3, 7 нмоль фосфата/мг по сравнению с аланиновым мутантным пептидом, который включал 0,22+0,02 нмоль фосфат/мг; n=5). В целом, эти данные демонстрируют, что eNOS является субстратом для Akt и что главным сайтом фосфорилирования является серин 1179 (серин 1177 в человеческом eNOS).
Затем, авторами настоящего изобретения была оценена функциональная значимость предполагаемого сайта Akt-фосфорилирования по серину 635 и идентифицированного сайта по серину 1179. Трансфекция клеток COS двойным мутантом eNOS S635/1179A отменяет Akt-зависимое высвобождение NO. Мутация серина 635 с заменой на аланин не приводит к снижению высвобождения NO, тогда как eNOS S1179A отменяет Akt-зависимую активацию eNOS (фиг.3). Эти результаты дают основание предполагать, что серии 1179 играет функционально важную роль для высвобождения NO. Мутация серина 1179 в аспарагиновую кислоту (eNOS S1177D) для замены отрицательного заряда, сообщаемого добавлением фосфата, частично имитирует состояние активации, индуцированное Akt (S1177D в eNOS человека). Все мутанты, полученные путем сайт-направленного мутагенеза, экспрессировались в высокой степени (см. вставку Вестерн-блотов) и сохраняли каталитическую активность NOS в клеточных лизатах (в клетках COS, трансфецированных только eNOS, активность NOS составляла 85,3±27,0, 71,9±2,9, 80, 8±23,2 и 131,8± 36,7 пмоль генерированного L-цитруллина/мг белка от лизатов клеток COS, экспрессирующих дикий тип, eNOS S1179A, S635, 1179А и S1179D, соответственно n=3 экспериментов).
Для того чтобы определить, опосредует ли Akt высвобождение NO из эндотелиальных клеток, эндотелиальные клетки капиллярных сосудов бычьего легкого (BLMVEC) инфицировали аденовирусами, экспрессирующими активированный Akt (myr-Akt), дефектный по активации Akt (AA-Akt) или β-галактозидазу в качестве контроля, и измеряли аккумуляцию NO. Как видно из фиг.4А, myr-Akt стимулирует базальное продуцирование NO из BLMVEC, тогда как клетки, инфицированные β-галактозидазой или дефектной по активации Akt, высвобождали низкие уровни NO, которые приближались к пределам детекции. Эти данные в совокупности с похожими результатами, полученными для клеток COS, дают основание предполагать, что фосфорилирование eNOS с помощью Akt является достаточным для регуляции продуцирования NO при остаточных уровнях кальция. Действительно, активность NOS, измеренная в лизатах от myr-Akt-инфицированных BLMVEC, продемонстрировала, что чувствительность данного фермента к активации кальцием, проанализированная при фиксированной концентрации кальмодулина, является более высокой по отношению к активности NOS, наблюдаемой в BLMVEC, инфицированных указанным вирусом, содержащим β-галактозидазу (фиг.4В). Интересно отметить, что чувствительность к кальцию активности NOS в клетках, инфицированных дефицитной по активации Akt, в значительной степени подавлялась по сравнению с клетками, инфицированными myr-Akt и β-галактозидазой.
Известно, что VEGF-обработка эндотелиальных клеток способствует активации Akt 23 и высвобождению NO посредством механизма, частично блокируемого ингибиторами киназы PI-3 (Papapetropoulos et al., 1997). Для определения функциональной связи между VEGF как агониста высвобождения NO и Akt-активацией BLMVEC инфицировали аденовирусами для myr-Akt, AA-Akt или β-галактозидазы, и проводили количественную оценку VEGF-стимулированного высвобождения NO. Как видно из фиг.4С, инфицирование эндотелиальных клеток ферментом myr-Akt приводит к усилению VEGF-регулируемого продуцирования NO, тогда как АА-Akt подавляет высвобождение NO. Эти результаты дают основание предположить, что Akt участвует в событиях передачи сигнала, необходимых как для базального, так и для стимулированного продуцирования NO в эндотелиальных клетках.
В целом, эти данные продемонстрировали, что Akt может фосфорилировать eNOS по серину 1179 (серину 1177 человеческого eNOS) и что такое фосфорилирование повышает способность данного фермента генерировать NO.
Пример 3: Материалы и методы
eNOS-Конструкции и очистка белка - Бычий eNOS дикого типа в плазмиде pCW экспрессировали с groELS в клетках BL21 E.coli, как описано ранее (Martasek et al., 1996). Мутантный eNOS S1179D для экспрессии в E.coli генерировали следующим образом. eNOS S1179D в pcDNAS (Fulton et al., 1999) расщепляли с помощью Xhol/XbaI, субклонировали в идентичные сайты eNOS в pCW и коэкспрессировали с groELS. Выделение рекомбинантного eNOS проводили, как описано ранее (Roman et al., 1995; Martasek et al., 1999) со следующими модификациями. eNOS элюировали с 2',5'-АDР-сефарозы либо 10 мМ NADPH, либо 10 мМ 2'-АМР. Количество eNOS оценивали с использованием максимальной оптической плотности при 409-412 нм, с коэффициентом экстинкции для содержания гема 0,1 мкМ-1см-1. Чистота eNOS была определена с помощью электрофореза в 7,5% ДСН-ПААГ с последующим окрашиванием кумасси. Электрофорез в ПААГ с ДСН при низкой температуре осуществляли аналогичным образом за исключением того, что образцы не кипятили, а электрофорез проводили при 4°С в суспензии из воды со льдом (Klatt et al., 1995). В экспериментах, при которых кофакторы NOS (L-аргинин, кальмодулин и NADPH) подвергали титрованию, очистку и хранение не проводили, а инкубирование осуществляли, как описано ниже.
Анализ на активность NOS - Продуцирование NO определяли путем проведения анализа на захват гемоглобина (Kelm et al., 1988). Вкратце, реакционная смесь содержала eNOS (0,5-2,5 мкг), оксигемоглобин (8 мкМ), L-аргинин (100 мкМ), ВН4 (5 мкМ), CaCl2 (120 мкМ), кальмодулин (120-200 нМ) и NADPH (100 мкМ) в буфере HEPES (50 мМ), рН 7,4. При определении величины EC50 для кальция в случае eNOS вышеуказанную реакционную смесь модифицировали следующим образом: буфер MOPS (10 мМ, рН 7,6), КСl (100 мМ) и СаМ (250 нМ) были заменены. В этих условиях свободный кальций вычисляли с использованием программы WinMAXC версии 1.8 (Stanford University) с Kd=2,2×10-8 M. Точная концентрация свободного кальция была достигнута путем смешивания соответствующих пропорций исходных растворов в 10 мМ K2EGTA и 10 мМ CaEGTA (Molecular Probes). Активность NOS прослеживали на линейную зависимость в течение 2 минут при 401 нМ, и продуцирование NO вычисляли исходя из изменения оптической плотности с использованием коэффициента экстинкции 60 мМ-1 см-1. Все реакции проводили при 23°С, и каждое значение представляло данные от 3-8 экспериментов. Для определения концентрации кальфодулина был использован коэффициент экстинкции 0,0033 мкМ-1 см-1 при 276 нМ. В этом методе продуцирование NO полностью блокировалось добавлением нитро-L-аргинина (1 мМ). В случае, когда инактивацию eNOS определяли путем добавления в реакционную смесь EGTA (200-800 мкМ), то через 1 минуту после инициации реакции с помощью NADPH добавляли хелатор. Идентичные условия были использованы при оценке редуктазной активности NADPH-цитохрома с. Эти реакционные смеси содержали СаМ (120 нМ) и CaCl2 (200 мкМ) в 0,5-мл объеме с eNOS (0/5 мкг).
Превращение L-аргинина в L-цитруллин анализировали, как описано ранее Bredt и др. (1990). Вкратце, eNOS (0,25-2 мкг) инкубировали в течение 3-10 минут при 23°С в нижеследующей реакционной смеси: 3 пмоль L-[3Н]аргинина (55 Ки/ммоль), 10-300 мкМ аргинина, 1 мМ NADPH, 120-200 нМ кальмодулина, 2 мМ CaCl2 и 30 мкМ ВН4 в конечном реакционном объеме 50-100 мкл. Реакцию завершали добавлением 0,5 мл 20 мМ HEPES, рН 5,5, содержащего 2 мМ EGTA и EDTA. Реакционную смесь наносили на смолу Dowex AG50WX8, и проходящий поток регистрировали на жидкостном сцинтилляционном анализаторе Packard 1500.
Анализ на редуктазную активность - Редуктазную активность NADPH-цитохрома с и восстановление 2, 6-дихлорфенолиндофенола (DCIP) определяли как изменение оптической плотности при 550 нМ, как было описано ранее Martasek et al. (1999) и Masters et al. (1967), с использованием коэффициента экстинкции 0,021 мкМ-1 см-1 как для цитохрома с, так и для DCIP. Вкратце, реакционная смесь (1 мл) содержала либо цитохром с (90 мкМ); DCIP (36 мкМ), буфер HEPES (50 мМ), рН 7,6, NaCl (250 мМ), NADPH (100 мкМ), кальмодулин (120 нМ) и CaCl2 (200 мкМ), либо другие вещества, как было указано. После добавления eNOS проводили мониторинг реакции в течение 60 сек (при 23°С). Если инактивацию редуктазной активности определяли добавлением EGTA (200-800 мкМ), то через 1 минуту после инициации реакции добавляли хелатор и проводили мониторинг реакции еще 1 мин. Реакционная смесь содержала буфер HEPES (50 мМ), рН 7,6; СаМ (120 нМ) и CaCl2 (200 мкМ) и реакцию инициировали с помощью NADPH (100 мкМ). В экспериментах, в которых оценивали EGTA-инактивацию eNOS, для имитации условий, используемых в экспериментах на захват гемоглобина, NaCl не добавляли. Добавление ингибиторов NOS не влияло на скорость восстановления цитохрома с (данные не приводится). Определение EC50 для кальция в случае eNOS определяли как описано выше в анализе на захват гемоглобина.
Данные анализа и статистика - Все данные выражены как среднее ± ср.кв.от. Определения проводили, по крайней мере, с тремя повторностями и минимум с тремя различными партиями ферментов для каждой серии данных. Ферменты дикого типа и мутантные ферменты очищали одновременно для контроля вариации активности различных препаратов. Статистическую значимость определяли с использованием т-критерия Стьюдента и различия считались значимыми при р<0,05.
Результаты
Экспрессия и очистка eNOS - eNOS дикого типа и eNOS S1179D экспрессировали и выделяли из E.coli. Из 1,6 литров культуры обычно выделяли приблизительно 2,5-4,0 мг eNOS с использованием хроматографии на 2'5'-ADP-сефарозе 4В. Как видно из фиг.5А, оба фермента имели чистоту >90%, определенную исходя из окрашивания кумасси. Эти результаты являются типичными, как видно из семи независимых препаратов как для eNOS дикого типа, так и для eNOS S1179D, полученных последовательно друг за другом. Оба фермента присутствовали, главным образом, в их димерной форме, как было показано с помощью электрофореза в ПААГ с ДСН (фиг.5В).
eN05 S1179D имеет большую NO-синтазную и редуктазную активность,
чем eNOS дикого типа - Затем активности eNOS дикого типа и eNOS S1179D сравнивали путем измерения скорости продуцирования NO. eNOS S1179D обнаруживал более высокое число оборотов (при оптимальных условиях) по сравнению с ферментом дикого типа (84±6 по сравнению с 27±1 мин-1, n=6 отдельных и попарных препаратов ферментов). Величины Km для препаратов с L-аргинином были аналогичны величинам, полученным для препаратов eNOS дикого типа и eNOS S1179D (фиг.6А, 1,8 по сравнению с 2,5 мкМ соответственно; см., таблицу 1).
Поскольку скорость потока электронов из редуктазного домена в оксигеназный домен имеет важное значение для NOS-катализа, то оценивали увеличение активности eNOS S1179D для того, чтобы определить, можно ли это увеличение приписать увеличению редуктазной активности. При оценке восстановления как DCIP, так и цитохрома с наблюдалось значительное увеличение активности S1179D по сравнению с активностью eNOS дикого типа (фиг.6В). Кроме того, это увеличение акцентировалось в присутствии СаМ, который способствовал увеличению общей активности обоих ферментов. В случае S1179D базальное восстановление цитохрома с в отсутствии СаМ было в 4 раза больше, чем в случае eNOS дикого типа. Значение СаМ-стимулированного восстановления цитохрома с было выше для eNOS S1179D (749±35 и 1272±55 мин-1 для дикого типа и для eNOS S1179D, соответственно n=3-5); однако 8x-стимуляциях с помощью СаМ наблюдалась для eNOS дикого типа по сравнению с 3х-стимуляцией для eNOS S1179D.
Затем определяли, продуцирует ли eNOS S1179D большее количество супероксида, который должен восстанавливать цитохром с, по сравнению с eNOS дикого типа. Как и ожидалось, какого либо ингибируемого супероксид-дисмутазой восстановления цитохрома с не наблюдалось (как показатель генерирования аниона супероксида) в отсутствии СаМ, как эта сообщалось ранее для eNOS дикого типа (86±6 по сравнению с 95±8 мин-1) и для eNOS S1179D (278+9 по сравнению с 288±7 мин-1; n=3-5). Однако в присутствии СаМ супероксид-дисмутаза способствует снижению уровня восстановления цитохрома с как в случае eNOS дикого типа (610±51 по сравнению с 866±8 мин-1), так и в случае eNOS S1179D (1179±43 по сравнению с 1518±19 мин-1). Относительное снижение активности цитохрома с в присутствии супероксид-дисмутазы было похожим для обоих ферментов (30% для eNOS дикого типа и 22% для eNOS S1179D), что позволяет предположить, что повышенная редуктазная активность eNOS S1179D по сравнению с активностью eNOS дикого типа (как показал анализ на восстановление цитохрома с) не обусловлена отсутствием связывания фермента.
NADPH-зависимое образование NO и редуктазные активности не отличаются для eNOS дикого типа и для eNOS S1179D - Поскольку сайт связывания с NADPH находится в непосредственной близости от Ser-1179 в eNOS, то оценивали NADPH-зависимость продуцирования NO и восстановление цитохрома с. eNOS S1179D имеет более высокое максимальное число оборотов (Ксat), чем eNOS дикого типа, на что указывает продуцирование NO, проанализированное в присутствии СаМ (фиг.7А). Увеличение Kcat ассоциируется с 4-кратным увеличением Km для NADPH в случае eNOS S1179D по сравнению с eNOS дикого типа (36 и 8 мкм, соответственно). Ксаt для NADPH-зависимого восстановления цитохрома с в отсутствие СаМ выше для eNOS S1179D, чем для eNOS дикого типа (290 и 70 мин-1 соответственно; фиг.7В). В случае восстановления цитохрома с в присутствии СаМ Ксаt значительно выше для eNOS S1179D по сравнению с eNOS дикого типа (840 и 460 мин-1 соответственно). Величины Km для NADPH не изменялись в зависимости от отсутствия или присутствия СаМ (0,40 и 0,75 мкМ для eNOS дикого типа и 2,0 и 1,9 для eNOS S1179D в отсутстии и в присутствии СаМ соответственно).
Величины EC50 для СаМ оставались неизменными для eNOS дикого типа и для eNOS S1179D - Для того чтобы определить, обусловлена ли повышенная активность eNOS S1179D изменениями аффинности фермента по отношению к СаМ, кинетика активности NOS и восстановления цитохрома с была проанализирована в присутствии всех кофакторов NOS в избыточном количестве в зависимости от концентрации СаМ. Kcat для СаМ-активации активности NOS составлял 22 мин-1 для eNOS дикого типа и 43 мин-1 для eNOS S1179D. Преобразование этих данных, нормализованных за различия в Kcat, выявили небольшой сдвиг в кривой влево для eNOS S1179D и небольшие различия в величинах EC50 для СаМ, что совпадало с имеющимися ранее данными относительно фосфо-eNOS (Mitchell et al., 1999). Величины EC50 составляли 8 нМ для дикого типа и 7 нМ для eNOS S1179D (фиг.8А). Было измерено NADPH-опосредованное восстановление цитохрома с. Ксat для активации с помощью СаМ восстановления цитохрома с был примерно в 2 раза выше для eNOS S1179D по сравнению с ферментом дикого типа (1140 и 620 мин-1 для eNOS S1179D и для eNOS дикого типа соответственно). Преобразование данных, нормализованных за различия в Ксаt выявили небольшие различия в величинах EC50 для СаМ в случае eNOS дикого типа и eNOS S1179D (21 по сравлению с 13 нМ; фиг.8В).
Сравнение активации с помощью кальция и инактивации eNOS - В предыдущих экспериментах было продемонстрировано, что "кажущаяся чувствительность к кальцию" eNOS усиливалась в клетках, экспрессирующих либо большое количество фосфо-eNOS, либо eNOS S1179D, что дало основание предположить, что фосфорилирование приводит к изменению аффинности активации с помощью кальция/СаМ (Dimmeler et al., 1999; Fulton et al., 1999). Как видно из фиг.8С, после нормализации за различия в максимольной активности зависимость от кальция слегка увеличивалась для eNOS S1179D (р<0,05, двусторонний дисперсионный анализ). Величины ЕС50 для кальция в случае eNOS дикого типа и eNOS S1179D также слегка отличались (310 и 250 нМ кальция соответственно), как было определено по продуцированию NO (в присутствии 250 нМ СаМ). Как видно из вставки на фиг.8С, увеличение концентрация свободного кальция действительно приводит к усилению оборота eNOS S1179D в более значительной степени, чем это можно наблюдать в случае фермента дикого типа. Кроме того, величины EC50 для кальция, полученные при анализе на восстановление цитохрома с, были аналогичны величинам, полученным при измерении продуцирования NO (фиг.8D; 290 и 220 нМ для eNOS дикого типа и eNOS S1179D соответственно). И в этом случае величина Vmax для кальцийопосредованной активации оборота eNOS S1179D превышала эту величину для фермента дикого типа (Фиг.4D, вставка).
Для того чтобы определить, отличается ли инактивация eNOS S1179D от инактивации фермента дикого типа, было измерено снижение активности eNOS после образования хелатного комплекса кальция с EGTA. В этих экспериментах все кофакторы NOS были добавлены в присутствии кальция (200 мкМ) и мониторинг продуцирования NO проводили еще 1 минуту, после чего добавляли различные концентрации EGTA и снова проводили мониторинг в течение 1 мин. Как видно из фиг.9А, добавление EGTA к ферменту дикого типа и к eNOS S1179D приводило к снижению продуцирования NO зависимым от концентрации образом. Однако продуцирование NO от eNOS S1179D оказалось менее чувствительным к добавлению EGTA; то есть активность eNOS дикого типа снижалась гораздо быстрее при низких концентрациях EGTA, чем активность eNOS S1179D. Наибольшие различия в активностях ферментов наблюдались при концентрации EGTA в 400 мкМ. Кроме того, при 600 мкМ EGTA какой-либо активности для eNOS дикого типа вообще не наблюдалось, но при этом все же наблюдалась остаточная активность для eNOS S1179D. Похожие результаты были получены в анализах по восстановлению цитохрома с (Фиг.9В), при этом значимые различия в активностях наблюдались при добавлении в реакцию 400 и 600 мкМ хелатора. Однако при наибольшей концентрации EGTA остаточная редуктазная активность обнаруживалась как для eNOS дикого типа, так и для eNOS S1179D.
В заключение можно сказать, что бычья эндотелиальная синтаза оксида азота (eNOS) фосфорилируется непосредственно протеин-киназой Akt по серину 1179 (Fulton et al., 1999), а человеческая эндотелиальная синтаза оксида азота (eNOS) фосфорилируется непосредственно протеинкиназой Akt по серину 1177 (Dimmeler et al., 1999). Мутация остатка 1179 в бычьей eNOS с заменой на отрицательно заряженный аспартат конститутивно увеличивает продуцирование окиси азота (NO) в отсутствии стимуляции агонистом.
Следует отметить, что вышепривиденные дискуссии и примеры представляют лишь подробное описание некоторых предпочтительных вариантов осуществления изобретения. При этом для каждого специалиста очевидно, что могут быть использованы различные модификации и эквиваленты, не выходящие, однако, за рамки объема и сущности изобретения. Все ссылки, статьи и патенты, упомянутые выше или ниже, во всей своей полноте вводятся в настоящее описание посредством ссылки.
Литература
1. Alessi et al, Embo J 15, 6541-6551 (1996).
2. Bredt et at., Proc. Natl. Acad. Sd. U.S.A. 87, 682-685 (1990).
3. Corson et at. Circulation Research 79, 984-991 (1996).
4. Dimmeler et al., Nature 399, 601-605 (1999).
5. Downward, Curr Opin Cell Biol 10, 262-267 (1998).
6. Fulton et al., Nature 399, 597-601 (1999).
7. Garcia-Cardena et al., Nature 392, 821-824 (1998).
8. Garcia-Cardena et al., J Biol Chem 271, 27237-27240 (1996).
9. Garcia-Cardena et al., Proc. Natl. Acad. Sci. USA 93, 6448-6453 (1996a).
10. Huang et al., Nature 377, 239-242 (1995).
11. Kantor et al. Science 274, 1744-1748 (1996).
12. Kelm et al., Biochem. Biophys. Res. Commun. 154, 236-244 (1988).
13. Klatt et al., EMBO J. 14, 3687-3695 (1995).
14. Liu et al., Biochemistry 35, 13277-13281 (1996).
15. Liu et al., J. Cell Biol. 137, 1525-1535 (1997).
16. Martasek et al., Methods Enzymol. 301, 70-78 (1999).
17. Martasek et al., Biochem Biophys Res Commun 219, 359-365 (1996).
18. Masters et al., Methods Enzymol. 10, 565-573 (1967).
19. Michel et al., Proc. Natl. Acad. Sci. 90, 6252-6256 (1993).
20. Michell et al., Curr. Biol. 9, 845-848 (1999).
21. Murohara et al., J Clin Invest 101, 2567-2578 (1998).
22. Papapetropoulos et al., J Clin Invest 100, 3131-3139 (1997).
23. Roman et al., Proc. Natl. Acad. Sci. U.S.A. 92, 8428-8432 (1995).
24. Rudic et al., J Clin Invest 101, 731-736 (1998).
25. Sessa et al., J Biol Chem 270, 17641-17644 (1995).
26. Shaul et al., J Biol Chem 271, 6518-6522 (1996).
27. Shesely et al., Proc Natl Acad Sci USA 93, 13176-13181 (1996).
28. Yano et al., Nature 396, 584-587 (1998).

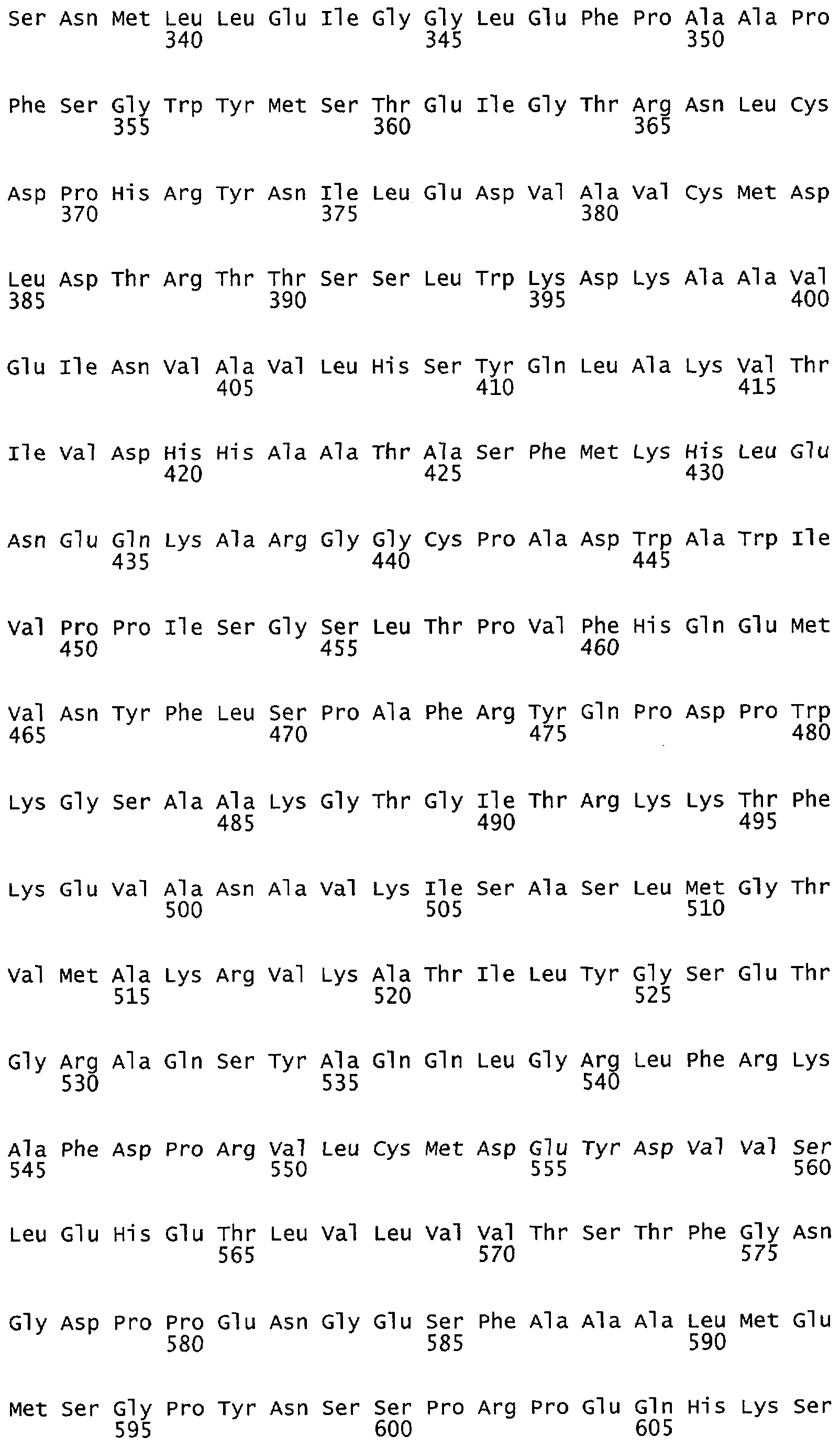
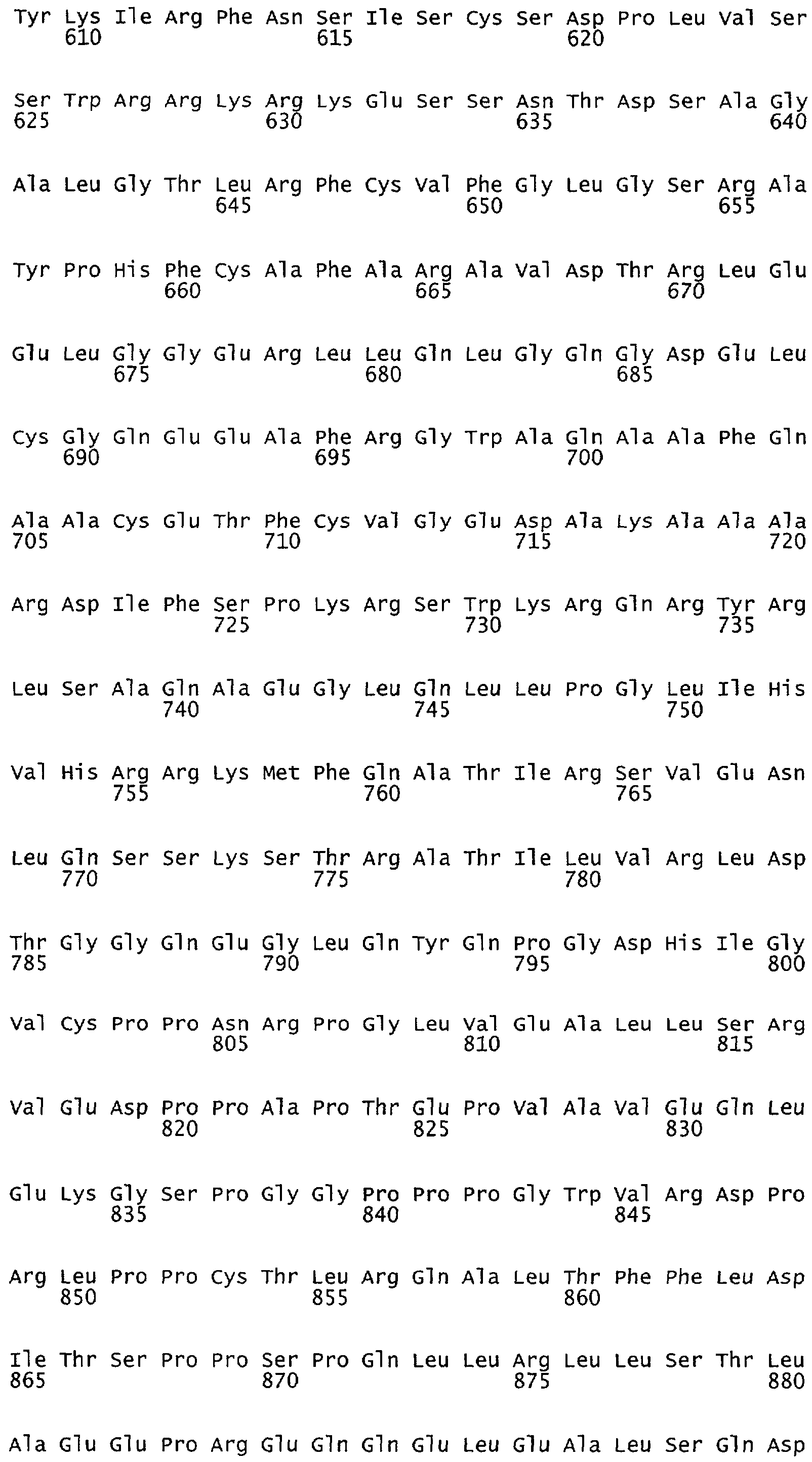
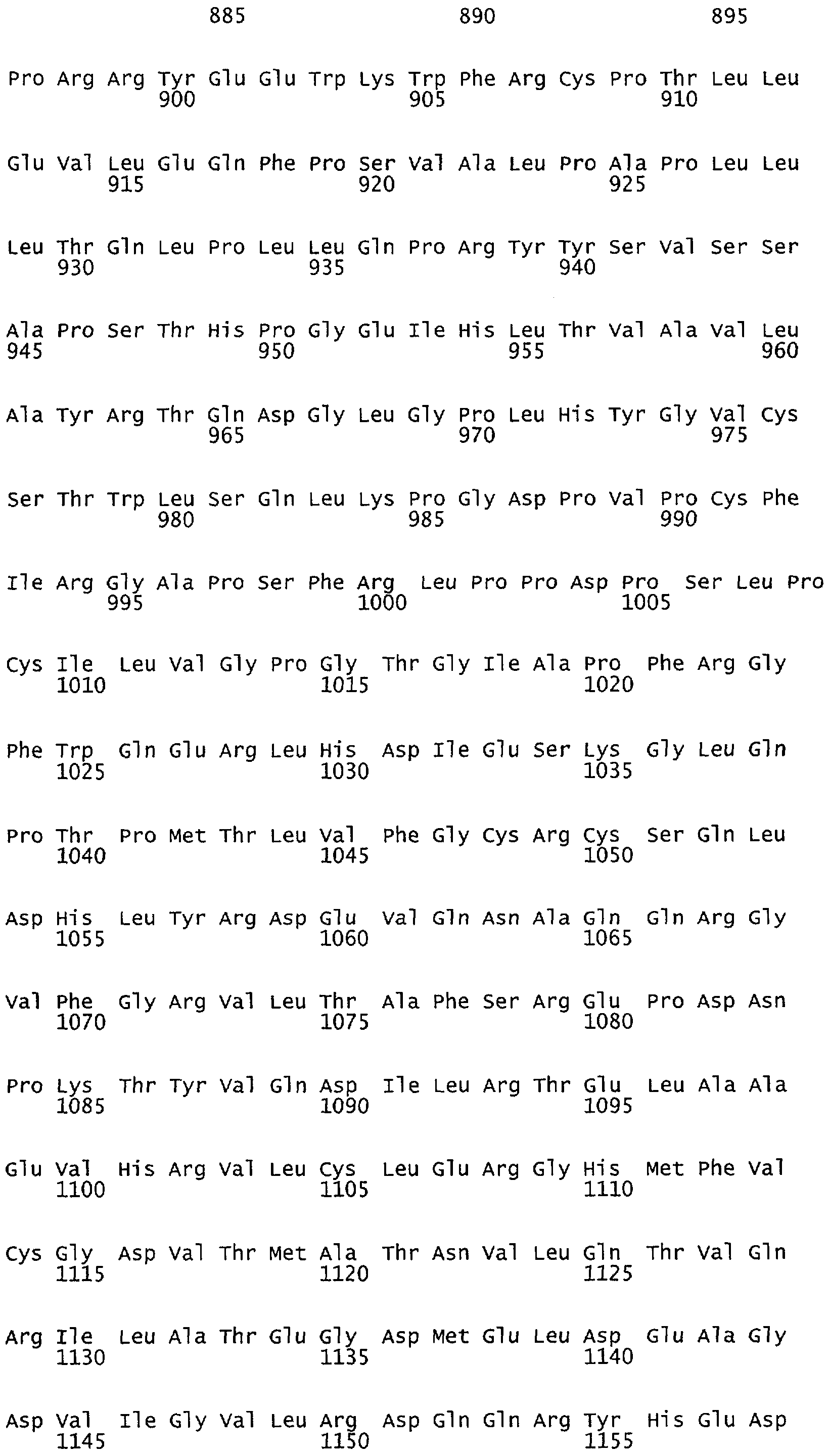

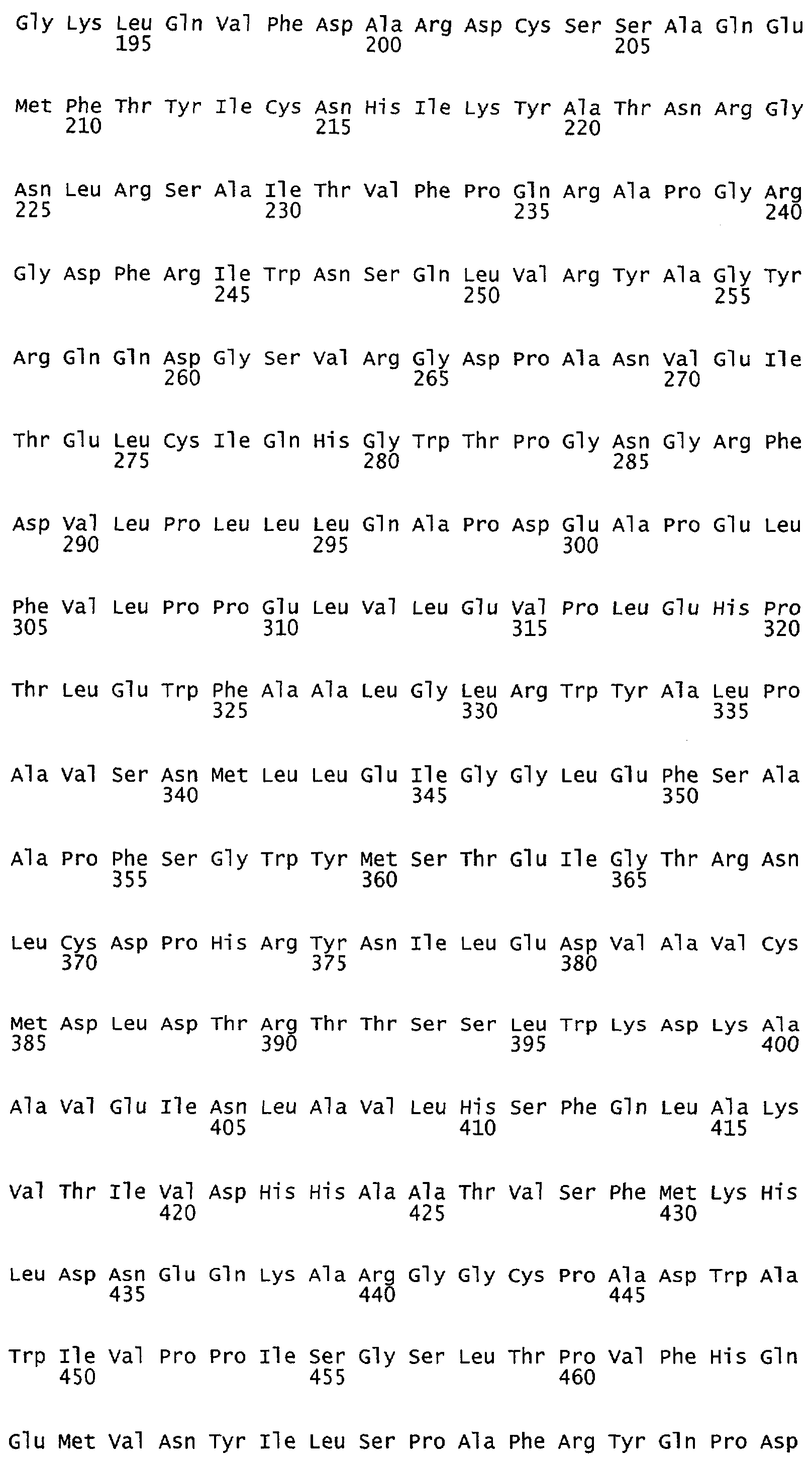
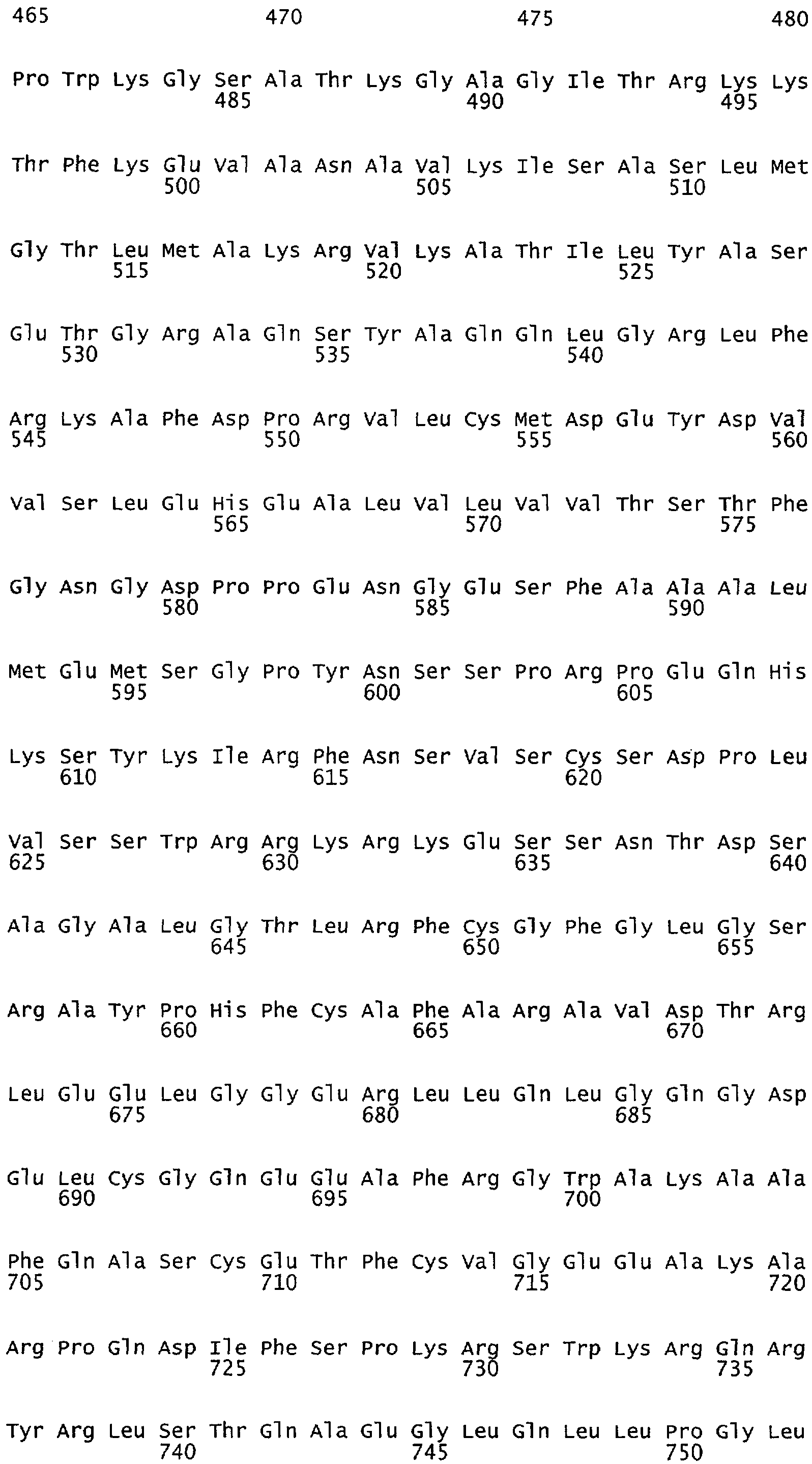
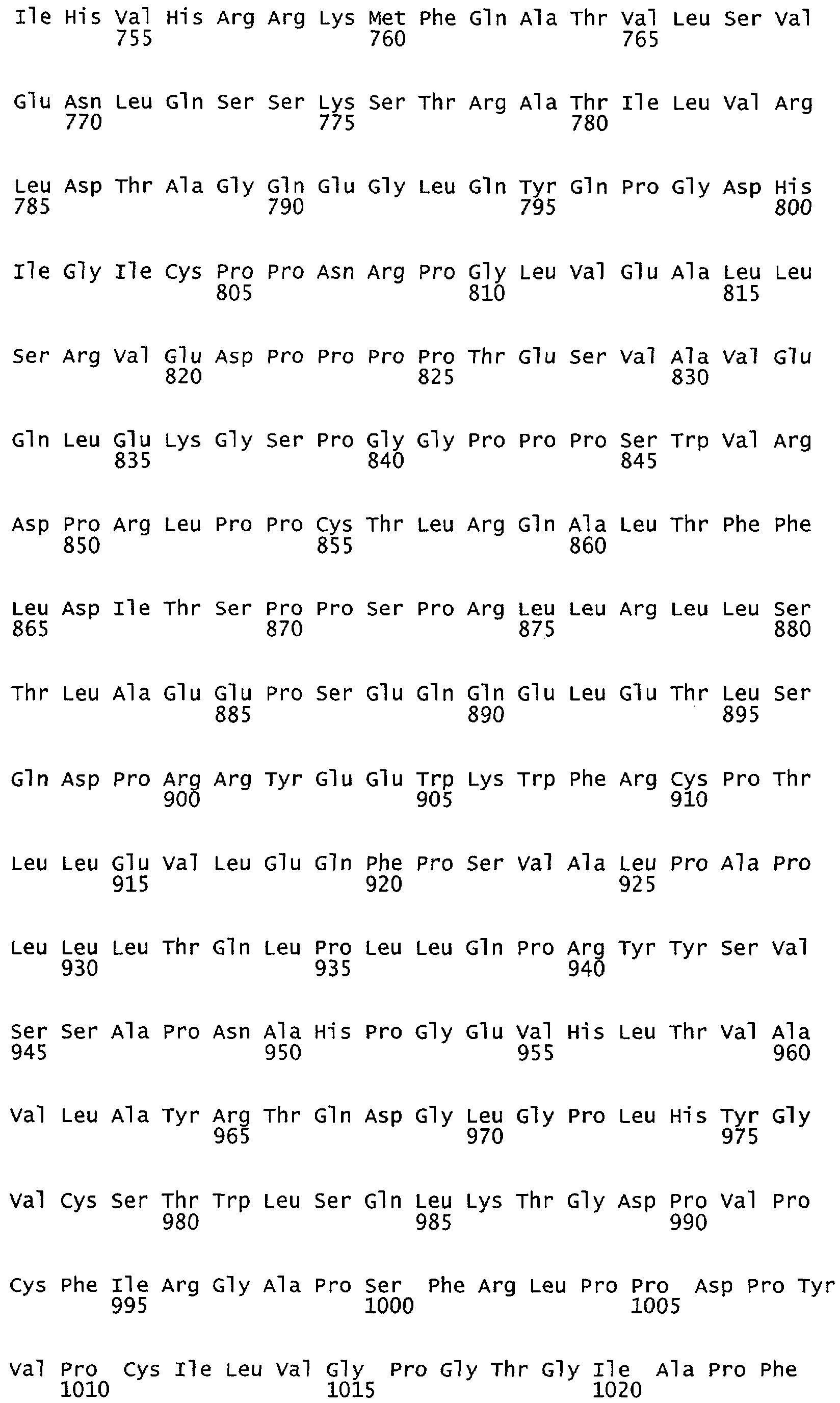
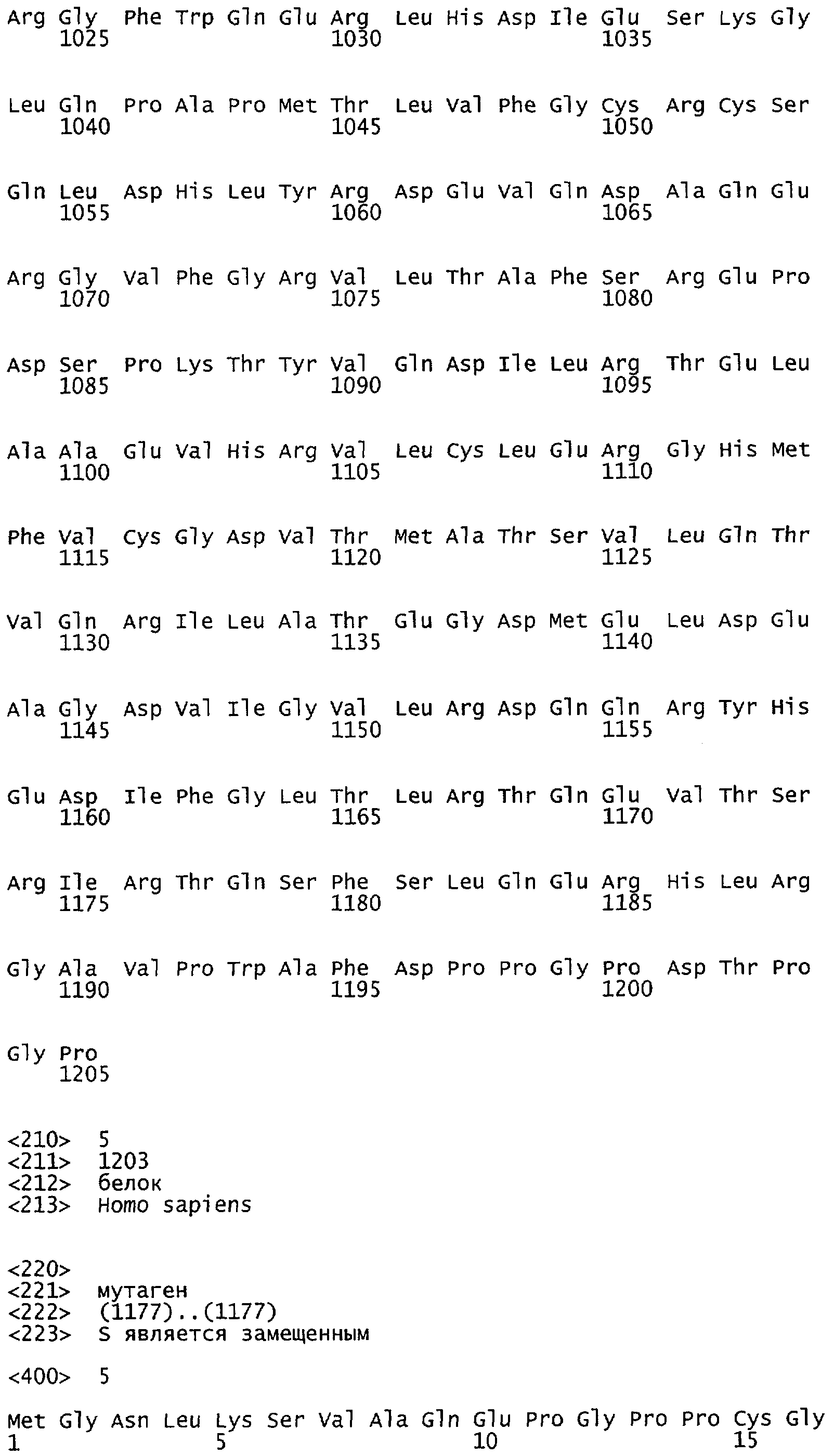
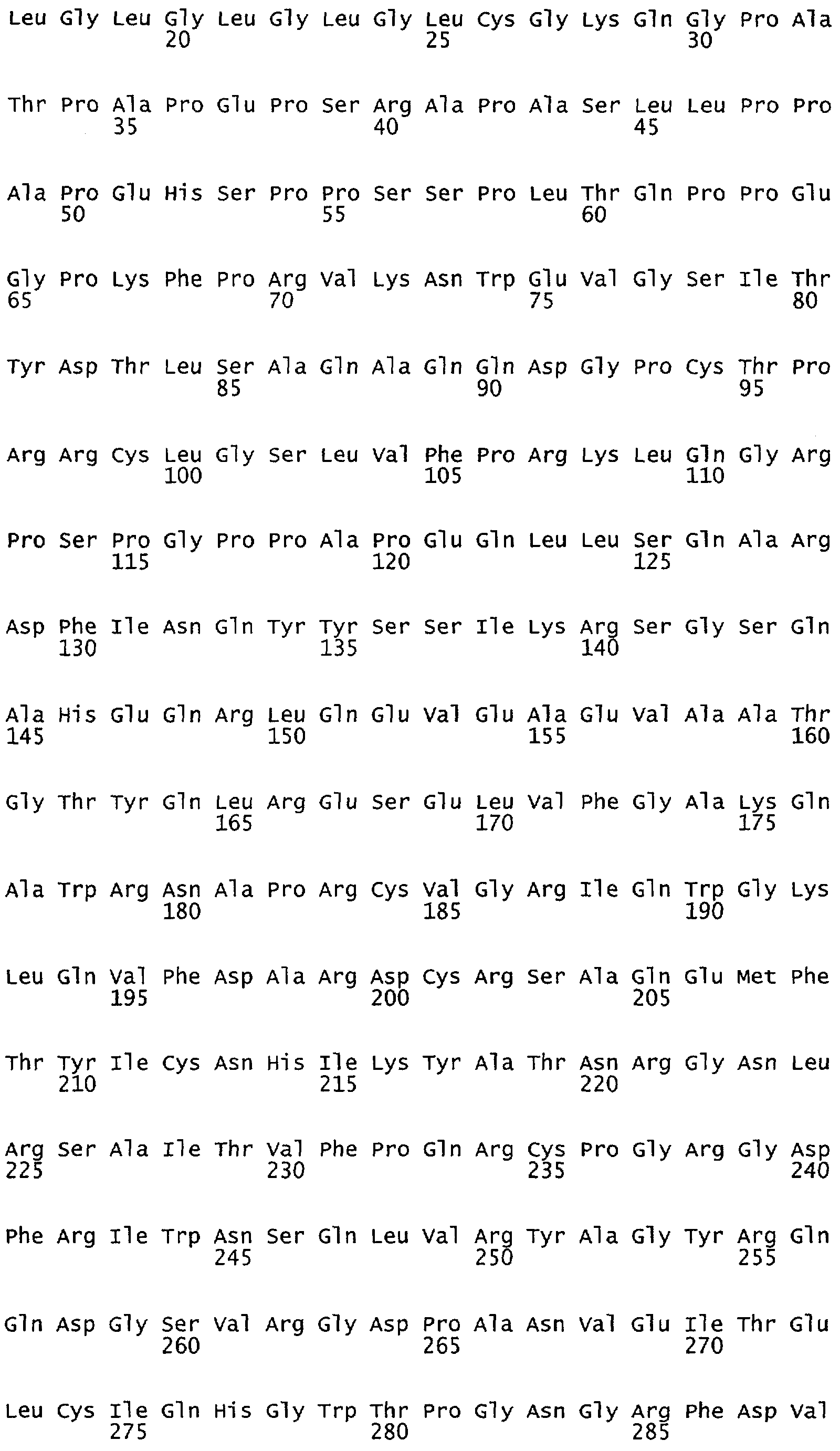
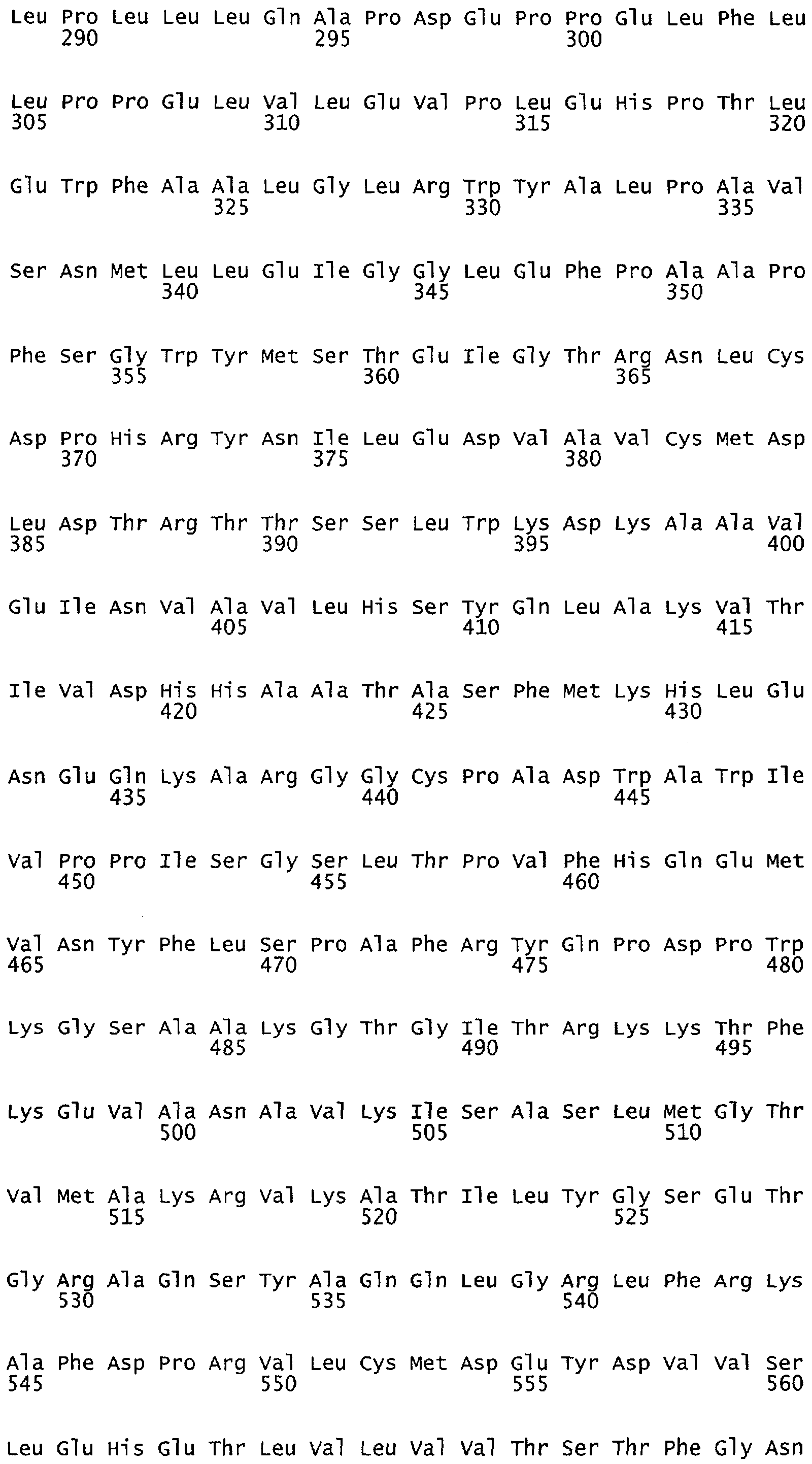
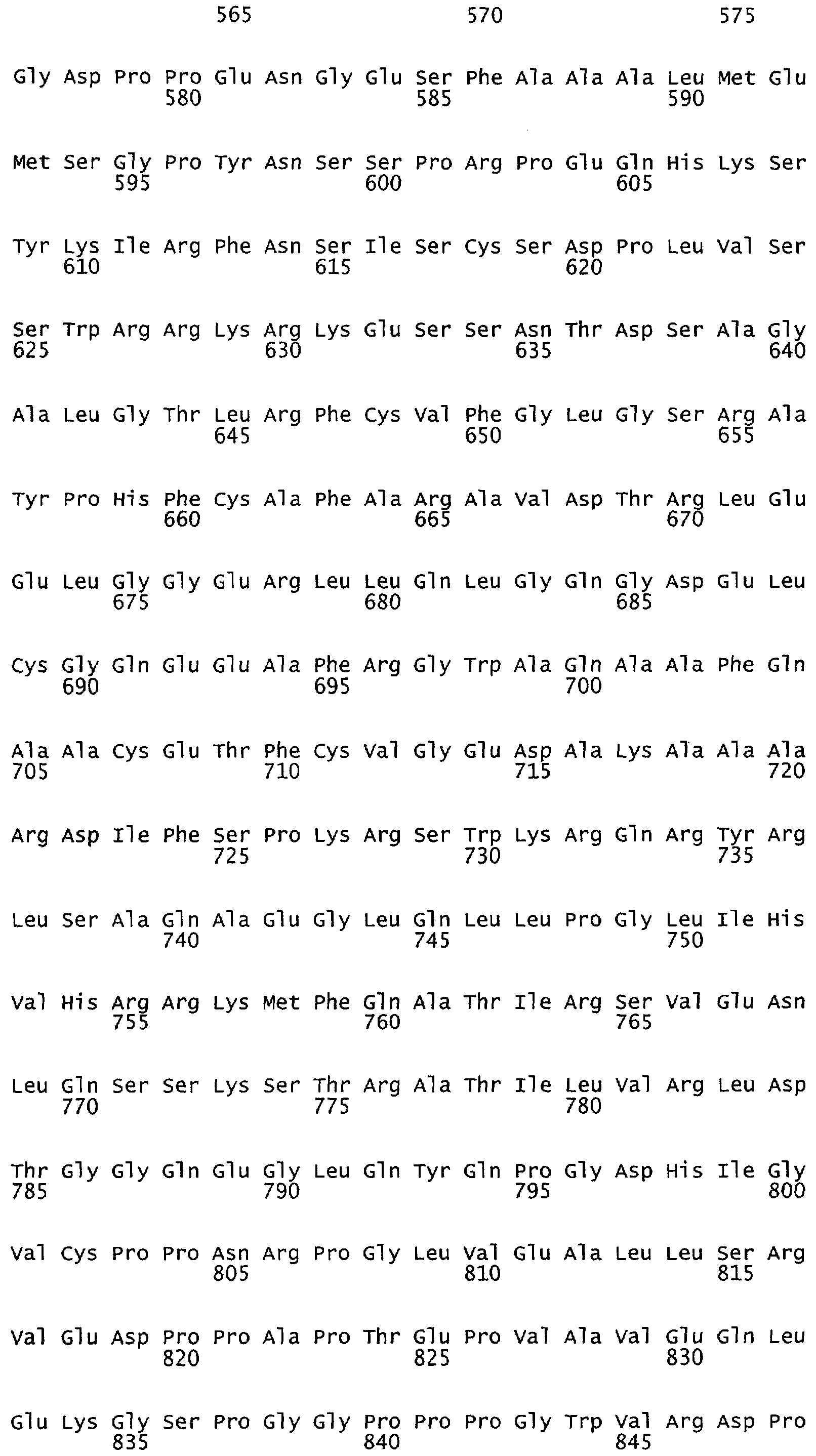
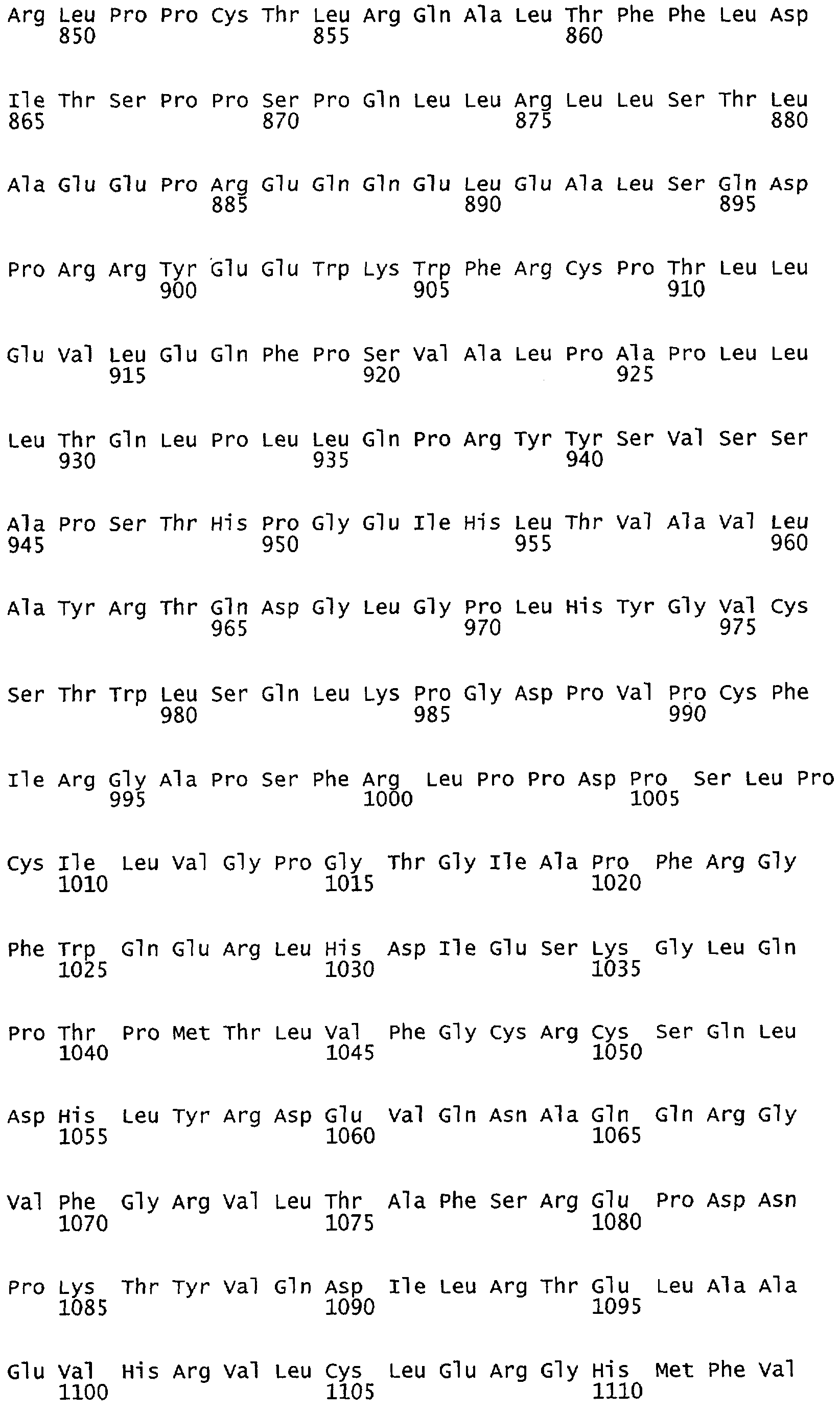
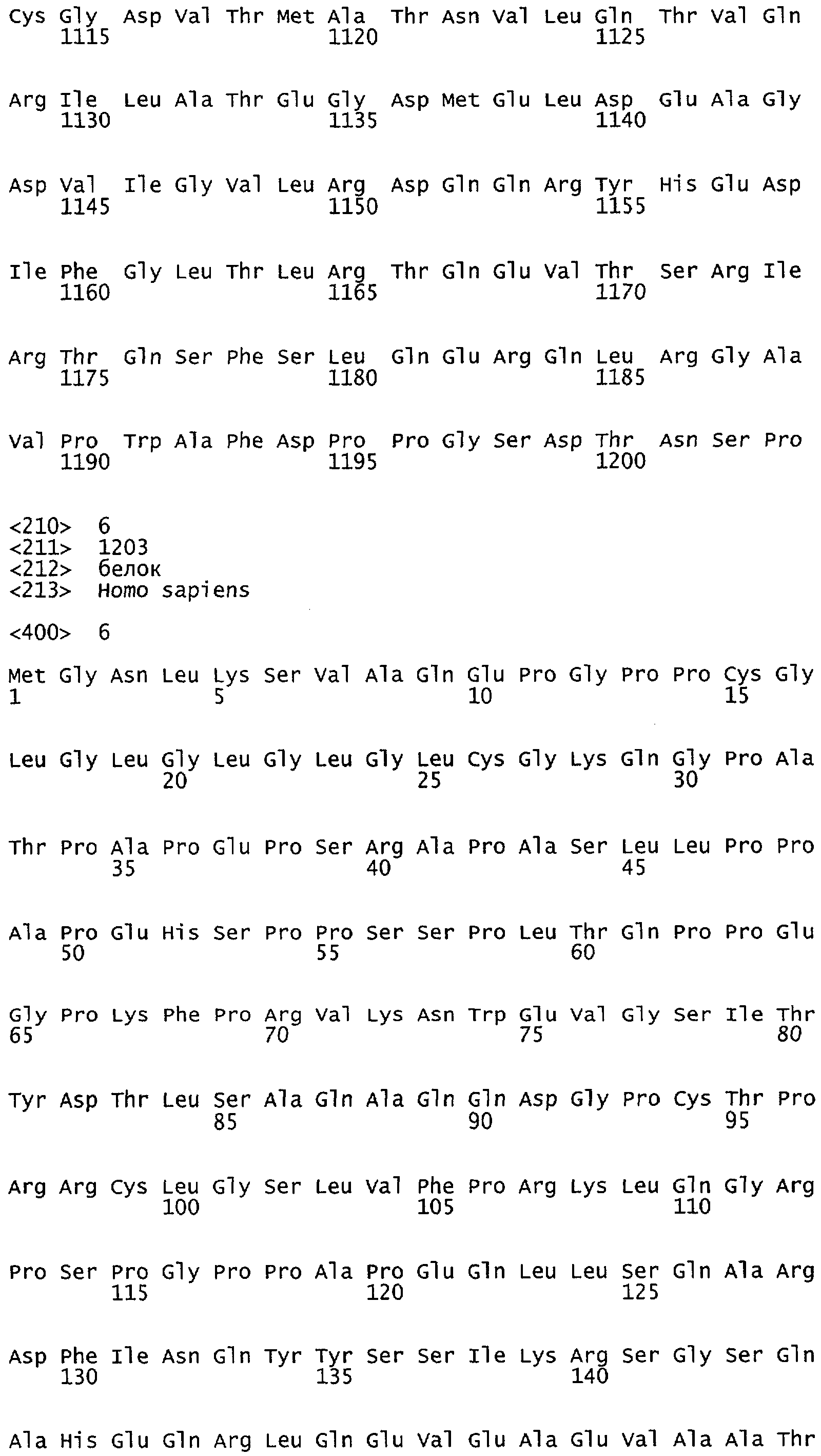
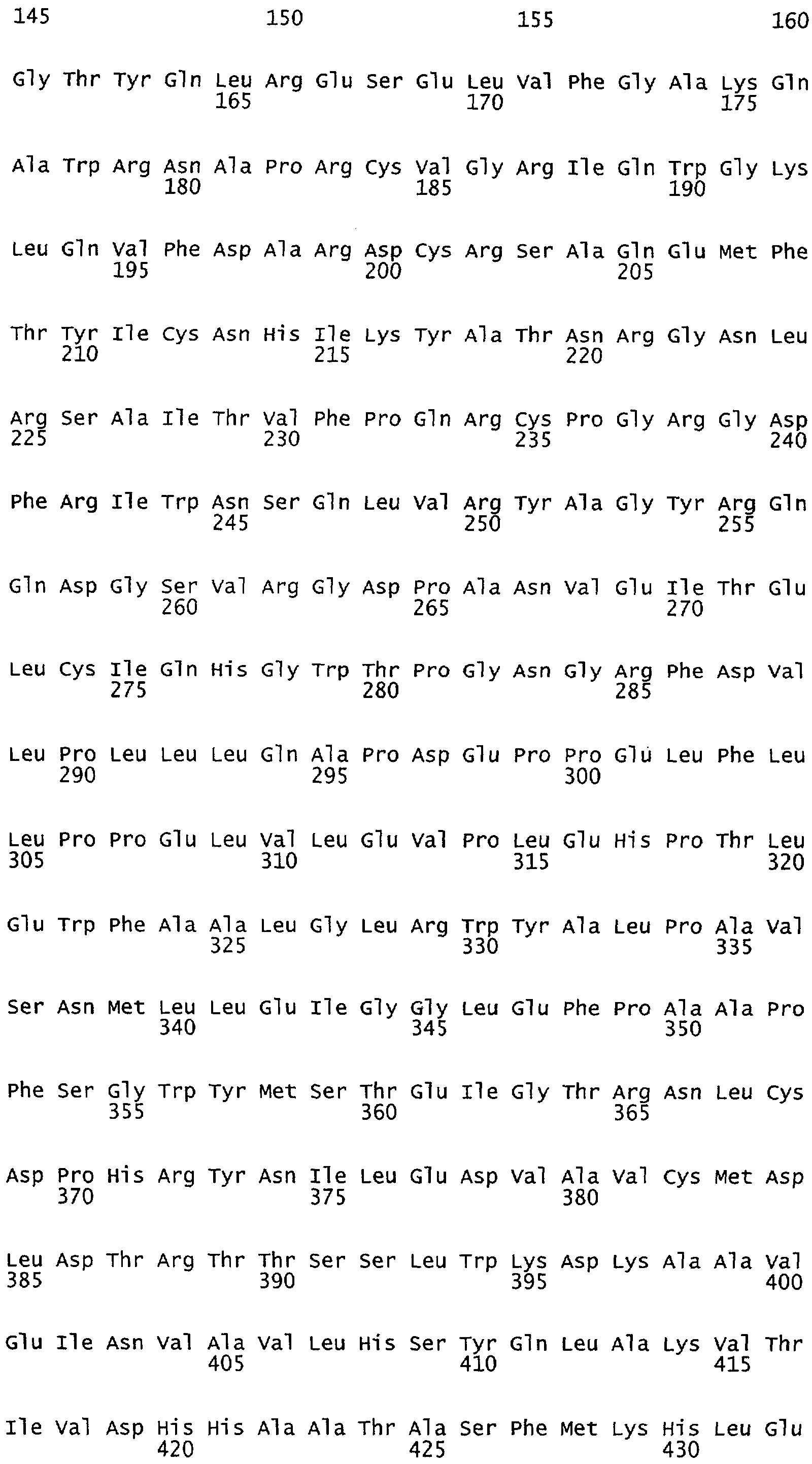


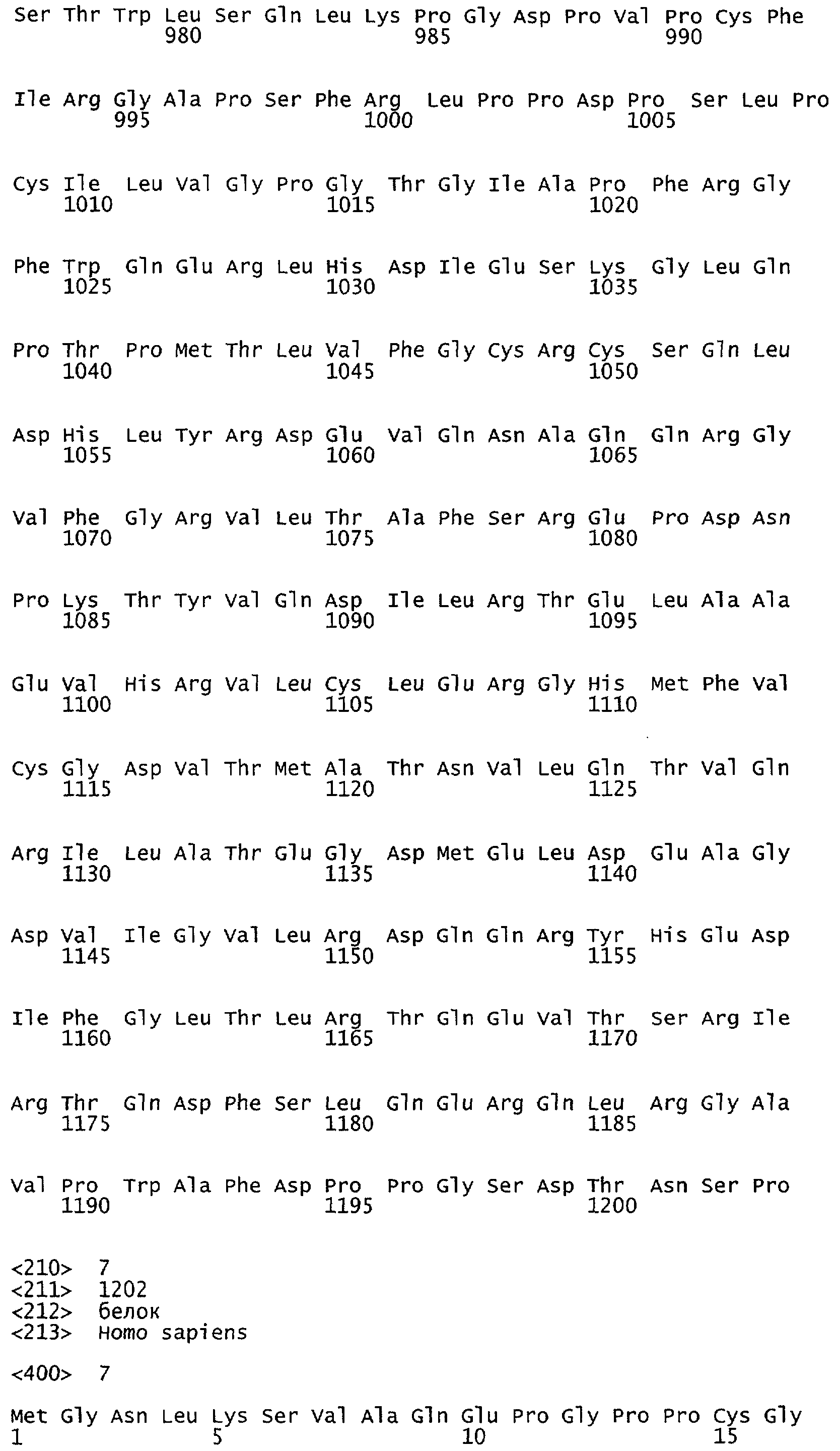
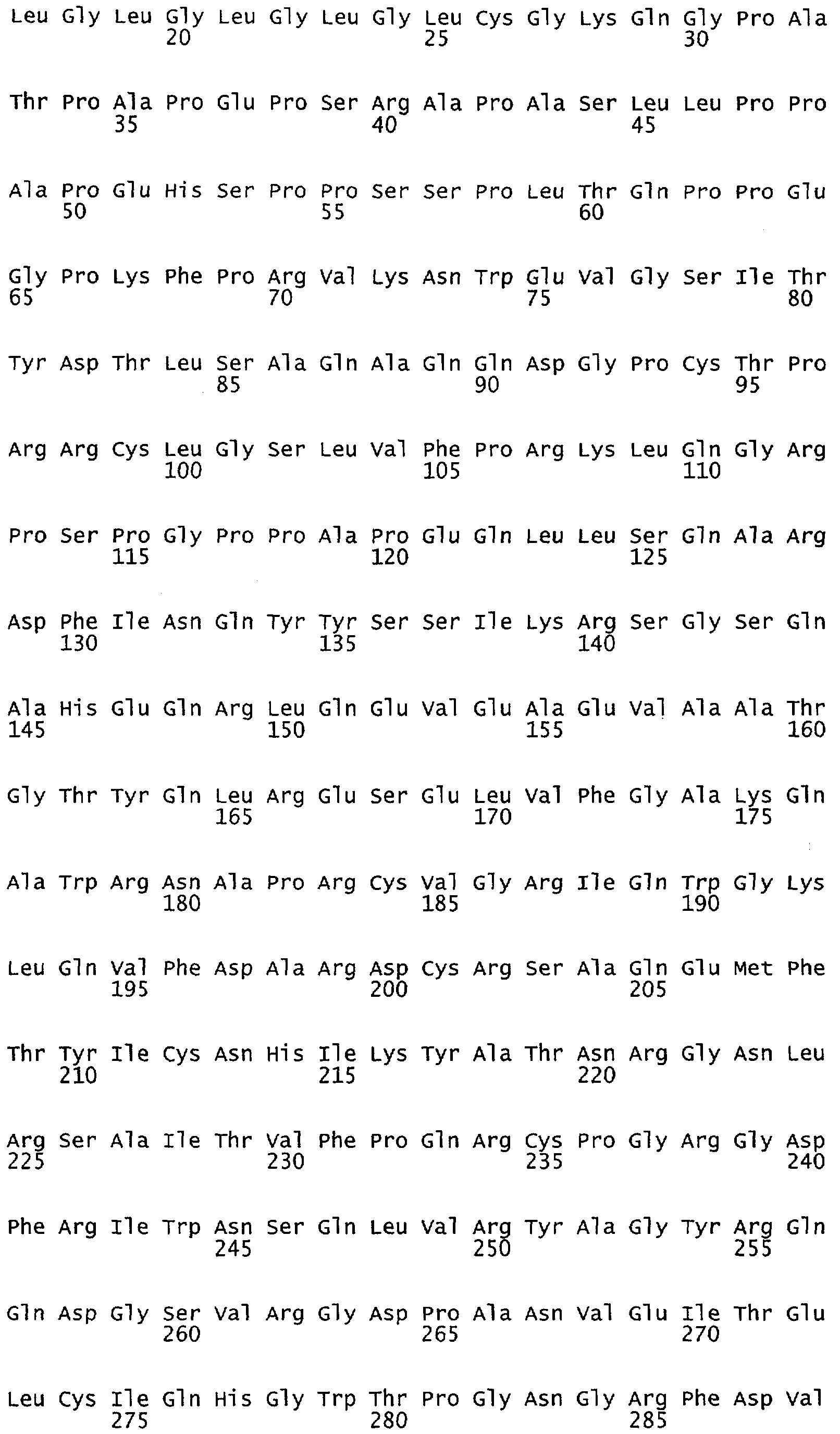
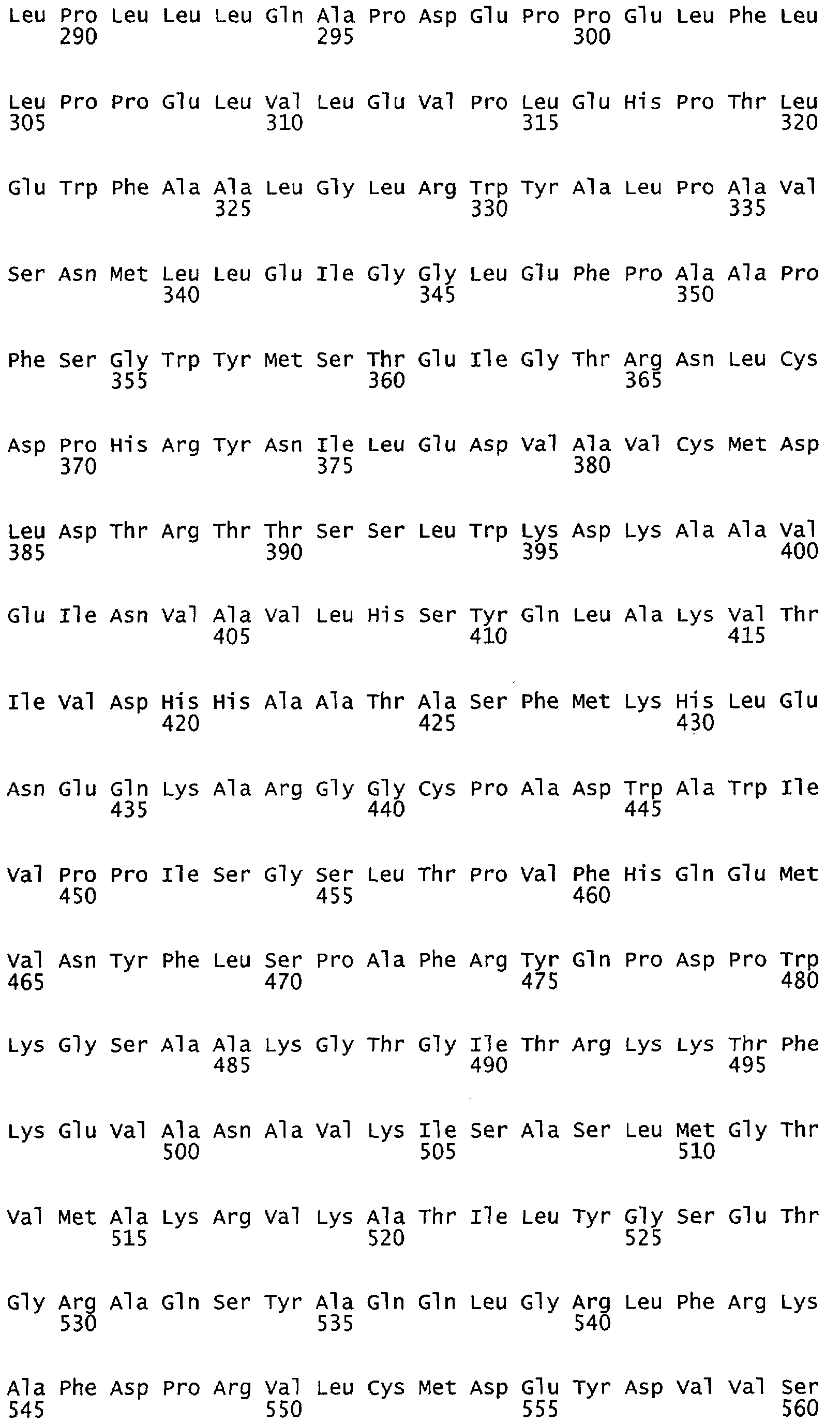





Реферат
Изобретение относится к медицине, а именно к новым NOS-вариантам или мутантам, которые содержат структурные модификации в сайте Akt-зависимого фосфорилирования. Модифицированные NOS-белки или пептиды, а в частности человеческие белки или пептиды eNOS, имеющие замену аминокислотного остатка, соответствующего S/T в мотиве консенсус-последовательности RXRXXS/T полипептида NOS дикого типа, и кодирующие их молекулы нуклеиновых кислот могут быть использованы в генной терапии, а белки и пептиды NOS могут быть также использованы в методах скрининга агентов, модулирующих активность NOS. Преимущество изобретения заключается в создании новых NOS-вариантов или мутантов, которые могут быть использованы в генной терапии, 7 н. и 18 з.п. ф-лы, 1 табл., 9 ил.
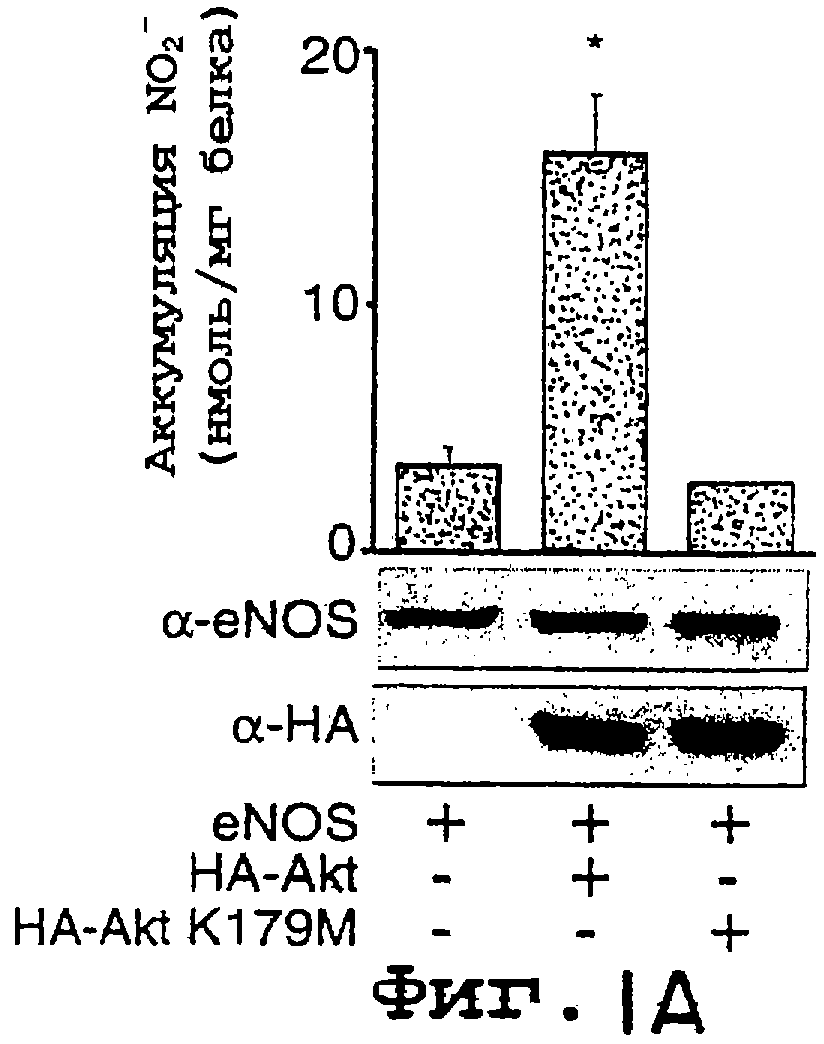

Комментарии