Производное индола - RU2137759C1
Код документа: RU2137759C1
Чертежи





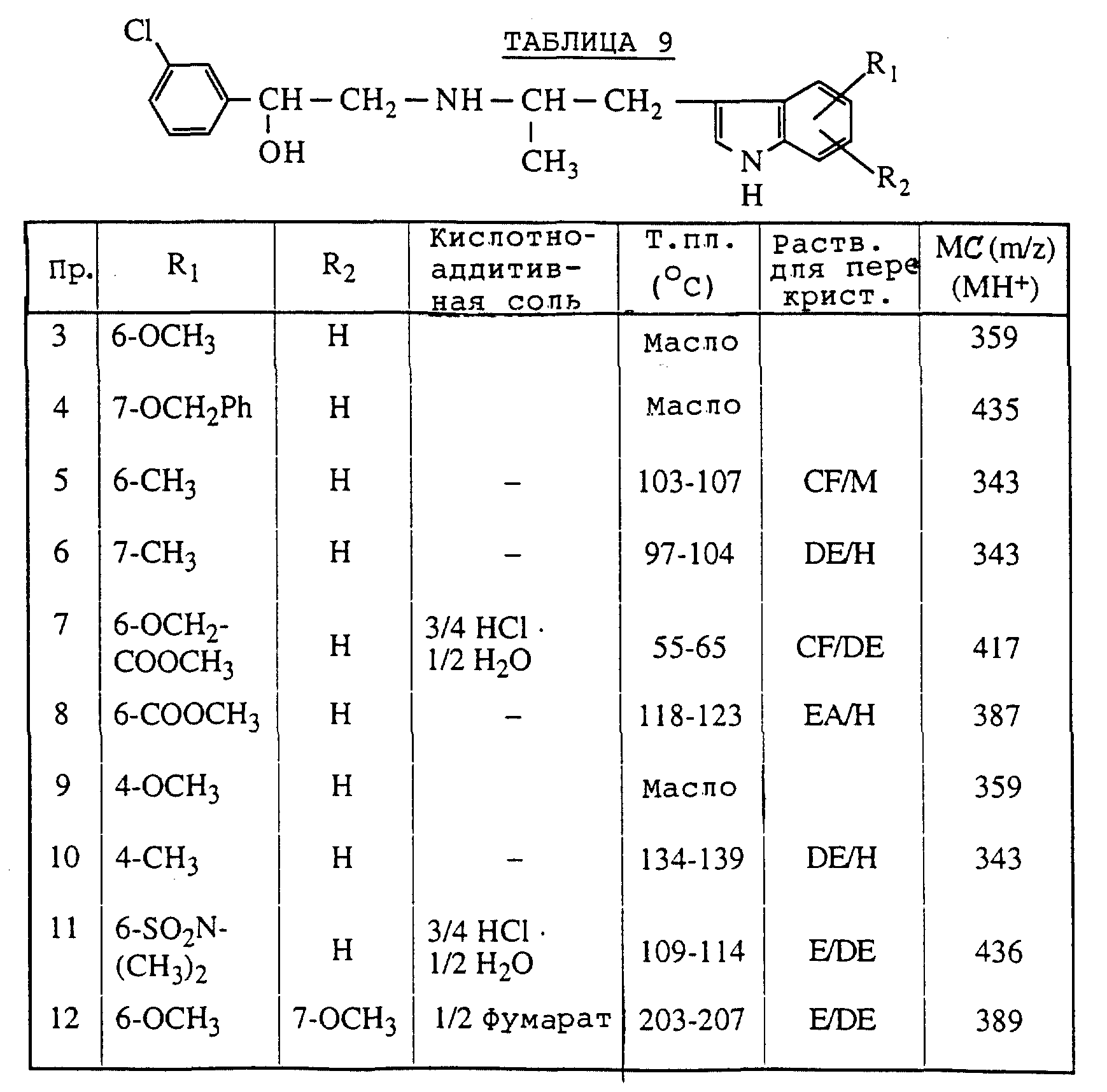



Описание
Данное изобретение относится к новому производному индола, имеющему сильную активность, стимулирующую β3-адренергический рецептор, с превосходной адренорецепторной селективностью.
Предпосылки создания изобретения
Было известно, что β -рецептор симпатического нерва имеет два подтипа, т. е. β1-рецептор и β2-рецептор. В
настоящее
время средства, стимулирующие β1-адренергический рецептор, клинически используют в качестве стимулятора сердечной деятельности или сосудосуживающего средства, а средства,
стимулирующие β2-адренергический рецептор, используют в качестве бронхолитического средства соответственно.
Недавно был найден и выделен в качестве третьего подтипа β-адренергического рецептора β3-адренергический рецептор, который отличается от вышеуказанных двух подтипов [Emorine, L.J. et al; Science, 245, 1118-1121 (1989)] . β3-Адренергический рецептор существует у коричневых жировых клеток и, как было установлено, проявляет термогенетическую активность путем разложения липидов белых жировых клеток, прилипающих к подкожным тканям или внутренним органам, и поэтому было предположено, что β3-адренергический рецептор связан с одним из случаев ожирения. Кроме того, сообщалось, что кризис инсулин-независимого сахарного диабета может также быть связан с β3-адренергическим рецептором.
Когда средство, стимулирующее β3-адренергический рецептор, действует на подтипы, β1-адренергический рецептор и β2-адренергический рецептор. Могут быть некоторые побочные действия, например гиперфункция сердца, дрожание рук и ног и т. д. Таким образом, было желательно разработать лекарственное средство, имеющее сильную активность, стимулирующую β3-адренергический рецептор, и не имеющее активность, стимулирующую β1-адренергический рецептор и β2-адренергический рецептор, или имеющее слабую активность, стимулирующую β1- и β2-адренергические рецепторы. В данном описании и формуле изобретения соединение, имеющее такие свойства, иногда называют как "соединение, имеющее превосходную адренорецепторную селективность".
В качестве средства, стимулирующего β3-адренергический рецептор, были описаныBRL35135гидробромидметиловогоэфира{(R*,R*)-(± )-[4-[2-[2-(3-хлорфенил)- 2-гидроксиэтиламино] -пропил] фенокси] уксусной кислоты; вторая публикация патента Японии (kokoku) N 26744/1988 и публикация Европейского патента N 23385}, SR-58611A {гидрохлорид (R,S)-N-(7-этоксикарбонилметокси- 1,2,3,4-тетрагидронафт- 2-ил)-2-(3-фторфенил)- 2-гидроксиэтанамина; первая публикация патента Японии (kokai) N 66152/1989 и публикация Европейского патента N 255415} и т.д. Однако эти соединения BRL35135 и SR-58611A полностью отличаются от соединений данного изобретения, указываемых ниже, тем, что эти соединения не являются производными индола.
Соединения индола, перечисляемые в табл. 1, также известны.
Однако эти соединения по химической структуре отличаются от соединений данного изобретения в том, что имеют два заместителя на бензольном кольце и не имеют заместителей на ядре индола. Кроме того, эти литературные источники ни разу не предполагали, что эти соединения имеют активность, стимулирующую β3-адренергический рецептор.
Известно, что следующие соединения имеют химическую структуру, более близкую к соединениям данного изобретения, чем соединения, перечисленные в табл. 1.
Например, в J.Pharm.Pharmacol., 17, 742-746 (1965), описывается следующее соединение A
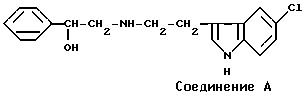
Acta Polon.Pharm., 38, 407-410 (1981) (Chem. Abstr., 96, 142543k (1982)) описывается следующее соединение B
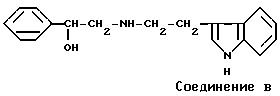
Указанные выше соединения A и B отличаются по химической структуре от соединений данного изобретения тем, что не имеют заместитель на ядре бензола и не имеют заместитель, соответствующий заместителю R5 указываемых ниже соединений данного изобретения. Кроме того, в этих литературных источниках никогда не сообщали или даже не предполагали о фармакологической активности соединений A и B.
Далее в Chem.Abstr., 109, 128763n (1988) описывается производное N-индолилалкиламино-1-арилзамещенного алканола следующей
формулы [VIII]:
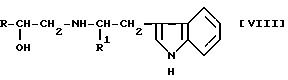
где R представляет фенильную группу, m- или n-нитрофенильную группу и т. д. и R1 представляет атом водорода или метильную группу.
Указанное выше соединение имеет химическую структуру, отличающуюся от соединений данного изобретения тем, что
заместителем на бензольном кольце является нитрогруппа, и тем, что он не имеет заместитель на ядре индола. Соединения указанной выше формулы [VIII] особенно включают следующее соединение C

Соединение данного изобретения превосходит в качестве средства, стимулирующего β3 -адренергический рецептор, соединения A, B и C, как показано в фармакологических экспериментах, упоминаемых ниже.
Таким образом, целью данного изобретения является представление нового производного индола, имеющего сильную активность, стимулирующую β3/-адренергический рецептор, с превосходной адренорецепторной селективностью, или соли его.
Описание
изобретения
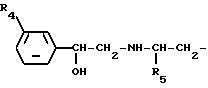
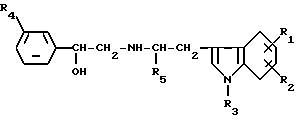
Данное изобретение относится к производному индола следующей формулы [I] :
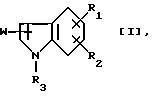
где R1 представляет низшую алкильную группу, необязательно замещенную гидроксигруппой, фенилсульфониламиногруппу, низшую алкилсульфониламиногруппу, моно- или ди-(низший алкил)аминосульфонильную группу или группу, выбранную из последующих групп (а) - (d), или R1 в комбинации с R2 образует метилендиоксигруппу, причем эта метилендиоксигруппа необязательно замещена карбоксигруппой или низшей алкоксикарбонильной группой;
(а) группа формулы -X-Ra (где X представляет О, S или NH, Ra представляет атом водорода или низшую алкильную группу, при условии, что, когда X представляет S, тогда Ra представляет низшую алкильную группу);
(b) группа формулы
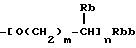
(где Rb представляет атом водорода, низшую алкильную группу, низшую алкоксикарбонильную группу или карбоксигруппу, Rbb представляет низшую алкоксикарбонильную группу или карбоксигруппу, m представляет целое число от 0 до 3 и n представляет 0 или 1);
(с) группа формулы -O(CH2)p-Rc (где Rc представляет низшую алканоильную группу, гидроксигруппу, цианогруппу, фенильную группу, моно- или ди-(низший алкил)аминокарбонильную группу или группу формулы

(где RA представляет атом водорода или низшую алкильную группу) и p представляет целое число от 1 до 4);
d) группа формулы -Y-(CH2 )q-Rd (где Y представляет NH или S, Rd представляет карбоксильную группу или низшую алкоксикарбонильную группу, q представляет целое число от 1 до 4);
R2 представляет атом водорода, атом галогена, низшую алкильную группу, необязательно замещенную гидроксигруппой, гидроксигруппу, низшую алкоксигруппу или указанную выше группу (b) или (с) или R2, в комбинации с R1 образуют метилендиоксигруппу, причем эта метилендиоксигруппа необязательно замещена карбоксильной группой или низшей алкоксикарбонильной группой;
R3 представляет атом водорода или низшую алкильную группу;
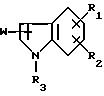
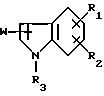
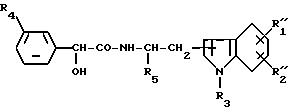
W представляет группу формулы [II], которая соединяется с положением 2 или 3 ядра индола:
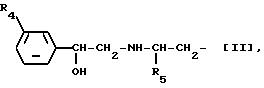
где R4 представляет атом галогена или трифторметильную группу и R5 представляет низшую алкильную группу,
или соли его.
Структурными характерными признаками соединений [I] данного изобретения являются:
(1) наличие определенного атома или определенной группы в положении 3 ядра
бензола в заместителе W;
(2) заместитель R5, представляющий низшую алкильную группу;
(3) наличие определенных заместителей R1 и R2 в положениях 4-7
ядра индола;
(4) наличие заместителя W в положении 2 или 3 ядра индола.
Сильная активность, стимулирующая β3-адренергический рецептор, и превосходная адренорецепторная селективность соединений данного изобретения основываются на указанных выше структурных характерных признаках данных соединений или их комбинациях.
Термины, используемые в данном описании и формуле изобретения, объясняются ниже.
Группа, к которой прилагается определение "низший", означает группы, имеющие 1-4 атомов углерода. "Низшая алкильная группа" включает, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и т. д. , но метил, этил, пропил и изопропил более предпочтительны. "Низшая алкильная группа, замещенная гидроксигруппой" включает, например, гидроксиметил, 2-гидроксиэтил и т.д. "Низшая алкилсульфониламиногруппа" включает, например, метилсульфониламино, этилсульфониламино и т.д. "Моно- или ди-низший алкиламиносульфонильная группа" включает, например, монометиламиносульфонил, диметиламиносульфонил, моноэтиламиносульфонил, диэтиламиносульфонил и т.д. "Низшая алкоксикарбонильная группа" включает, например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил и т.д. "Низшая алканоильная группа" включает, например, ацетил, пропионил и т.д. "Моно- или ди-низший алкиламинокарбонильная группа" включает, например, метиламинокарбонил, диметиламинокарбонил, метилэтиламинокарбонил и т.д. "Атом галогена" обозначает фтор, хлор, бром, йод, предпочтительным галогеном является фтор, хлор, бром и наиболее предпочтительным галогеном является фтор и хлор. "Низшая алкоксигруппа" включает, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.д. "Низший алкоксикарбонил-низшая алкоксигруппа" включает, например, метоксикарбонилметокси, 1-метоксикарбонилэтокси, 2-метоксикарбонилэтокси, 1-метоксикарбонилпропокси, 3-метоксикарбонилпропокси и т.д. "Карбокси-низшая алкоксигруппа" включает, например, карбоксиметокси, 1-карбоксиэтокси, 2-карбоксиэтокси, 1-карбоксипропокси, 3-карбоксипропокси и т.д. "Фенил-низшая алкоксигруппа" включает, например, бензилокси, фенетилокси и т.д.
Соль настоящих соединений формулы [I] является, например, кислотно-аддитивной солью, особенно предпочтительна фармацевтически приемлемая кислотно-аддитивная соль. Кислотно-аддитивная соль включает, например, соли с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота, и соли с органической кислотой, такой как щавелевая кислота, малеиновая кислота, фумаровая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, бензойная кислота, метансульфокислота и т.д. Кроме того, соединения данного изобретения, имеющие карбоксильную группу в определении для заместителя R1 или R2, могут существовать в форме соли щелочного металла или соли с органическим основанием, например соли со щелочным металлом, таким как натрий, калий и т.д., или соли с органическим основанием, таким как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, дициклогексиламин и т.д.
Эти кислотно-аддитивные соли, соли щелочных металлов или соли с органическим основанием могут существовать в форме ее гидрата или сольвата, данное изобретение включает также, кроме того, эти гидраты и сольваты.
Соединение данного изобретения формулы [I] имеют два асимметричных атома углерода. То есть в формуле [II] атом углерода, с которым соединяется гидроксигруппа, и атом углерода, к которому присоединяется R5, являются асимметричными атомами углерода. Таким образом, соединение данного изобретения имеет четыре стереоизомера и данное изобретение включает также эти оптически активные соединения, рацемические соединения и их смеси.
Предпочтительным соединением данного изобретения является соединение формулы [I] , у в которой заместитель W присоединен к ядру индола в положении
3, т.е. соединение
формулы [I-а]
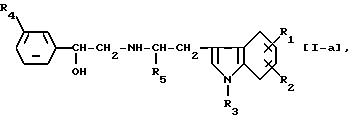
в которой R1, R2, R3, R4 и R5 такие, как определено выше, или соль его. Среди других более предпочтительным соединением данного изобретения является соединение формулы [I-а] , где R1 присоединен в положении 5, 6 или 7 индольного кольца и R2 представляет атом водорода, или его соль или соединение формулы [I-а], где R2 представляет группы, другие, чем атом водорода, и один из R1 и R2 присоединяется к индольному кольцу в положении 6, а другой - в положении 7, или его соль.
Другим предпочтительным соединением данного
изобретения является производное
индола формулы [I-а], в которой R1 представляет низшую алкильную группу, замещенную гидроксигруппой, фенилсульфониламиногруппу, низший
алкилсульфониламиногруппу, ди-низший
алкиламиносульфонильную группу или группу из следующих групп (а), (b-1), (с-1) или (d);
(а) группа формулы -X-Ra (где X и Ra такие же, как определено
выше);
(b-1) группа формулы
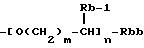
(где Rb-1 представляет атом водорода или низшую алкильную группу, Rbb, m и n такие же, как определено выше);
(с-1) группа формулы -O(CH2)p-Rc-1 (где Rc-1 представляет низшую алканоильную группу, фенильную группу, моно-низший алкиламинокарбонильную группу и p такой же, как определено выше);
(d) группа формулы -Y-(CH2)q-Rd (где Y, Rd и q такие же, как определено выше);
R2 представляет атом водорода, атом галогена, низшую алкильную группу, необязательно замещенную гидроксигруппой, гидроксигруппу, низшую алкоксигруппу или группу из указанной выше группы (b-1) или (с-1), или соль его. Среди указанных выше соединений следующим предпочтительным соединением является производное индола формулы [I-а], где R1 представляет низшую алкоксигруппу, низшую алкильную группу, низшую алкоксикарбонильную группу, низшую алкоксикарбонил-низшую алкоксигруппу, карбокси-низшую алкоксигруппу, фенил-низшую алкоксигруппу или ди-низший алкиламиносульфонильную группу, R2 представляет атом водорода, атом галогена, низшую алкоксигруппу, низшую алкильную группу, низшую алкоксикарбонильную группу, низший алкоксикарбонил-низшую алкоксигруппу, карбокси-низшую алкоксигруппу или фенил-низшую алкоксигруппу, R3 представляет атом водорода, R4 представляет атом галогена и R5 представляет метильную группу, или соль его.
Особенно предпочтительным соединением является производное индола формулы [I-а], где R1 представляет собой метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, метильную группу, метоксикарбонильную группу, метоксикарбонилметоксигруппу, карбоксиметоксигруппу, бензилоксигруппу или диметиламиносульфонильную группу, R2 представляет атом водорода или метоксигруппу, R3 представляет атом водорода, R4 представляет собой атом хлора, R5 представляет метильную группу, или соль его.
Наиболее предпочтительным соединением данного изобретения является производное индола формулы [I-а], где R1 представляет метоксигруппу, этоксигруппу, метоксикарбонильную группу, метоксикарбонилметоксигруппу или карбоксилметоксигруппу, которая присоединяется в положении 6 или 7 к индольному кольцу, R2 и R3 представляют атом водорода, R4 представляет атом хлора, R5 представляет метильную группу, или соль его.
Представителями наиболее предпочтительных соединений являются:
(1)
2-[3-(7-Метоксииндол-3-ил)-2-пропиламино]-1-(3- хлорфенил)этанол,
(2) 2-[3-(7-Этоксииндол-3-ил)-2-пропиламино]-1-(3- хлорфенил)этанол,
(3)
2-[3-(7-Метоксикарбонилметоксииндол-3-ил)-2- пропиламино] -1-(3-хлорфенил)этанол,
(4) 2-[3-(7-Карбоксиметоксииндол-3-ил)-2-пропиламино] -1- (3-хлорфенил)этанол
и их оптические
изомеры или их соли.
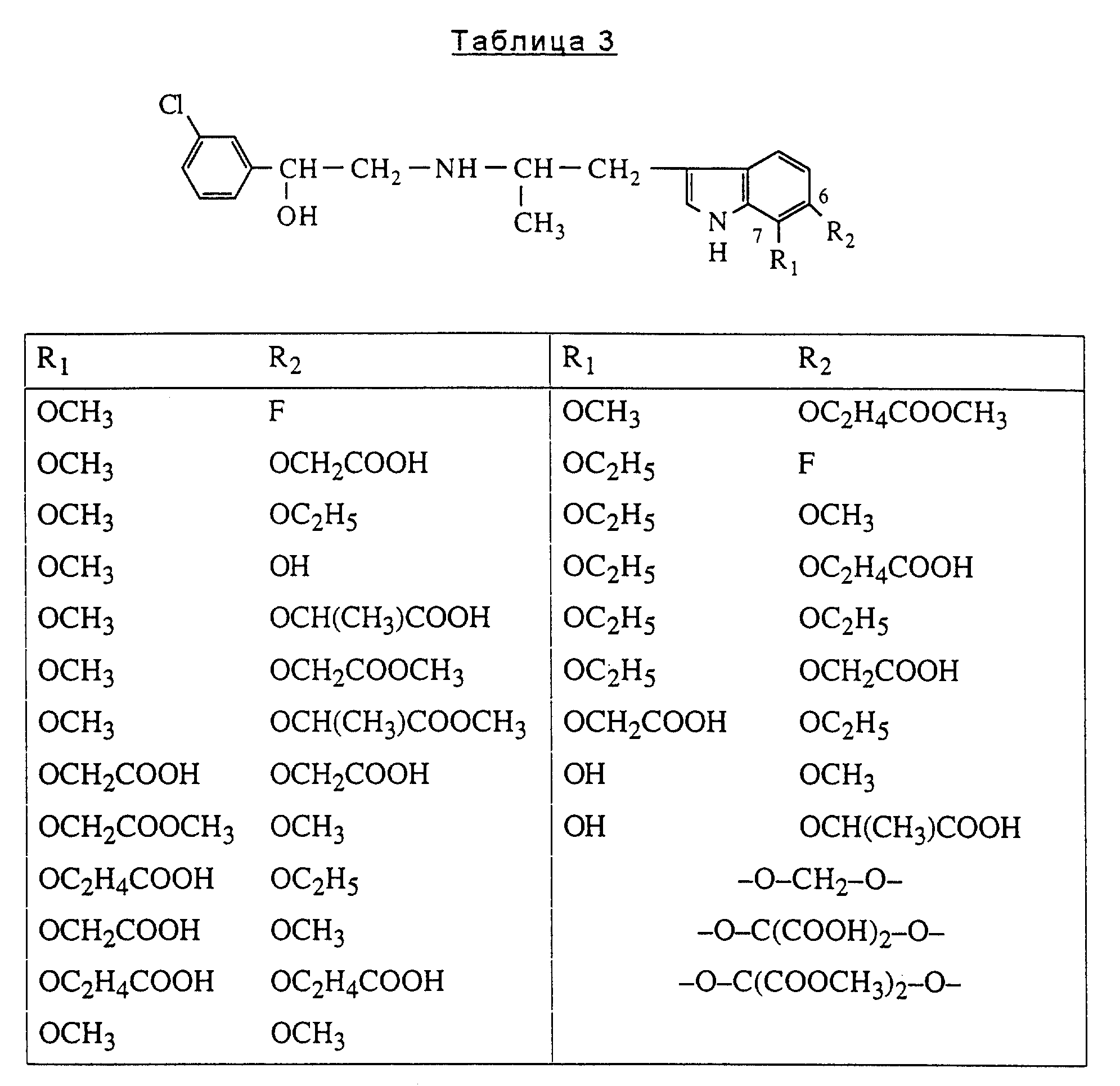
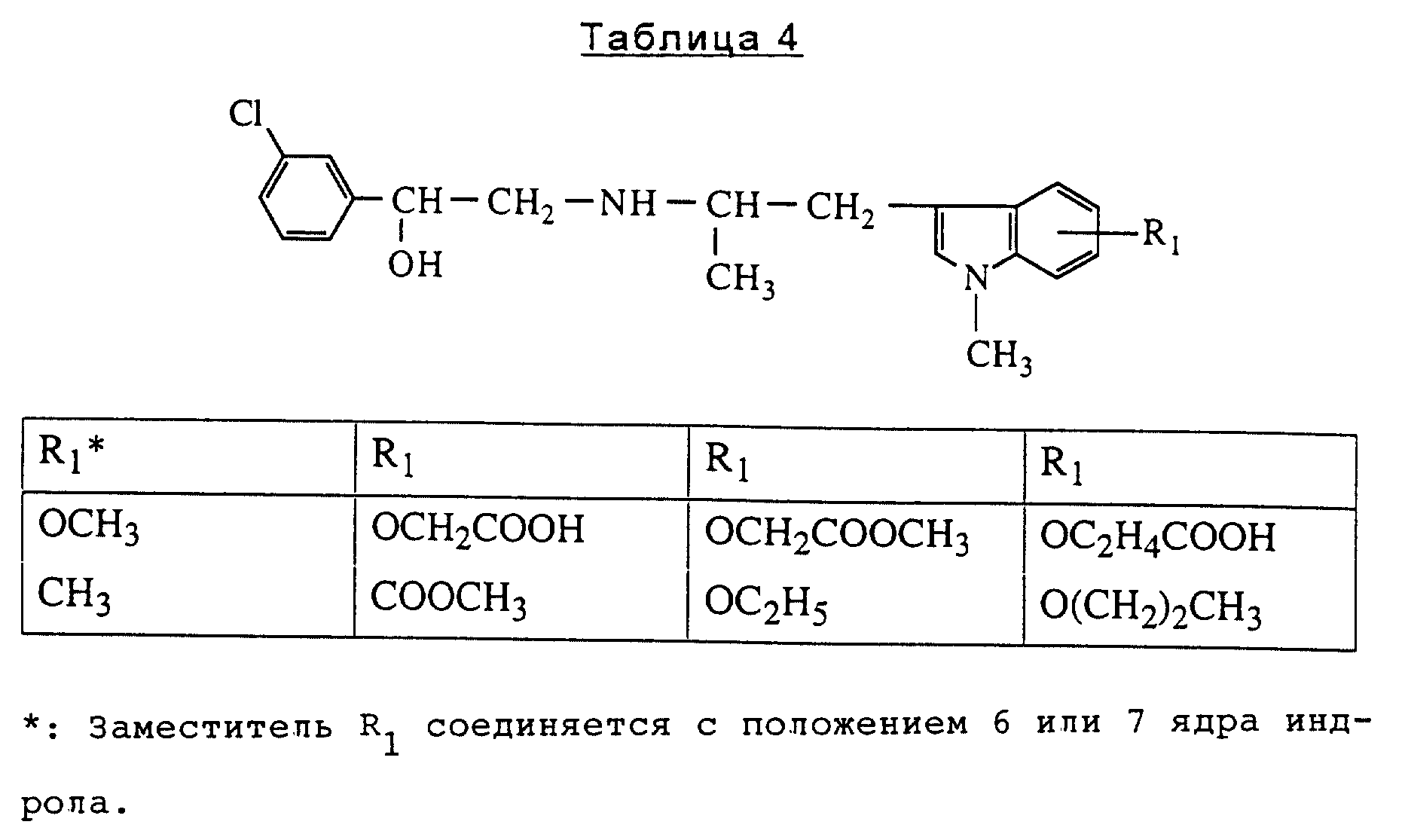
Представители, включенные в данное изобретение, являются соединениями, перечисленными в табл. 2, 3 и 4, и их солями.
Соединение данного изобретения можно получить следующими способами.
Способ (а):
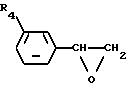
Соединение формулы [I] данного изобретения можно получить реакцией соединения формулы [III]
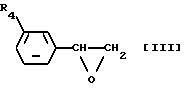
где R4 такой же, как определено выше, с соединением формулы [IV]
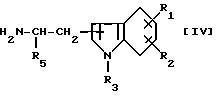
где R1, R2, R4 и R5 такие же, как определено выше, или с солью его.
Реакцию проводят в подходящем растворителе или без растворителя. Растворитель следует выбирать в соответствии с типами используемых исходных соединений, они включают, например спирты (например, метанол, этанол, изопропанол и т.д.), кетоны (например, ацетон, метилэтилкетон и т.д.), галогенированные углеводороды (например, хлористый метилен, хлороформ и т.д.), простые эфиры (например, диэтиловый эфир, тетрагидрофуран, диоксан и т.д.), ароматические углеводороды (например, бензол, толуол и т.д.), этилацетат, N, N-диметилформамид, диметилсульфоксид и тому подобные, эти растворители можно использовать по отдельности или комбинацию двух или более их. Кроме того, когда соединение [IV] находится в форме кислотно-аддитивной соли, например соли с неорганической кислотой, такой как гидрохлорид, гидробромид и т.д., или соли с органической кислотой, например, оксалата, малеата, фумарата и т. д. , реакцию проводят в присутствии основания. Основание включает, например, бикарбонат щелочного металла, такой как бикарбонат натрия, бикарбонат калия и т.д., карбонат щелочного металла, такой как карбонат натрия, карбонат калия и т.д., или органическое основание, например триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин и т.д. Кроме того, когда в заместитель R1 или R2 включена карбоксильная группа, реакцию проводят в присутствии основания, упоминаемого выше.
Температура реакции варьируется в соответствии с типом используемых исходных соединений, но обычно она находится в диапазоне от комнатной температуры до около 150oC, предпочтительно в диапазоне от около 25oC до около 100oC.
В способе (а) оба исходных соединения [III] и [IV] имеют асимметричный атом углерода и реакция проходит с сохранением стереоконфигурации асимметричного атома углерода, давая целевое соединение [I], имеющее такую же стереоконфигурацию. То есть, например, целевое соединение [I], имеющее (R,R)-конфигурацию, получают из исходного соединения [III], имеющего R-конфигурацию, и исходного соединения [IV], имеющего R -конфигурацию.
Оптически активное соединение формулы [III] можно получить, например, способом, сходным со способом, описанным в Bloom, J.D. et.al., J. Med. Chem. 35, 3081-3084 (1992) или в Eliel E.L. and Delmonte, D.W.J.Orq.Chem., 21, 596-697 (1956). Оптически активное соединение формулы [IV] можно получить, например, способом, сходным со способом, описанным в Repke, D.B. and Ferquson, W.J., J.Heterocycl., Chem., 13, 775-778 (1976).
Исходное соединение формулы [IV] можно получить, например, способом, описанным в J.Orq.Chem., 25, 1548-1558 (1960).
Среди соединений формулы [IV] соединение формулы [IV], у
которого
остаток следующей структуры:
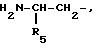
где R5 такой же, как определено выше, соединяется с положением 3 ядра индола, можно получить в соответствии со способом, описанным в J.Orq.Chem., 51, 4294- 4295 (1986).
Способ (b):
Соединение формулы [I] данного
изобретения,
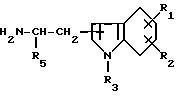
где заместитель R1 представляет более ограниченную группу R'1, т.е. соединение формулы [I-b]:
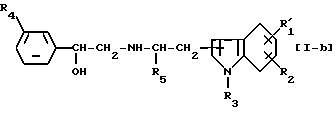
где R'1 представляет низший алкил, необязательно замещенный гидроксигруппой, фенилсульфониламиногруппу, низший алкилсульфониламиногруппу, моно- или ди-низший алкиламиносульфонильную группу или группу, выбранную из следующих групп (а)', (b), (с) и (d)', или R'1, в комбинации с R2 образует метилендиоксигруппу, причем эта метилендиоксигруппа необязательно замещена карбоксильной группой или низшей алкоксикарбонильной группой,
(а)' группа формулы -X'-Ra (где X' представляет О или S, Ra такой же, как определено выше, при условии, что, когда X' представляет S, тогда Ra представляет низшую алкильную группу);
(b) группа формулы
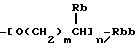
(где Rb, Rbb, m и n такие же, как определено выше);
(с) группа формулы -O(CH2)p-Rc (где Rc и p такие же, как определено выше);
d)' группа формулы -Y'-(CH2)q-Rd (где Y' представляет S, Rd и q такие же, как определено выше);
можно получить реакцией соединения формулы [V]

где R4 такой же, как определено выше, с соединением формулы [VI]
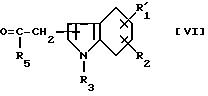
где R'1, R2, R4 и R5 такие же, как определено выше, в условиях восстановления.
"Реакция в условиях восстановления" в данном изобретении означает реакцию соединения [V] и соединения [VI] в присутствии восстановителя или катализатора, который может восстанавливать только иминогруппу, образованную в процессе реакции, но совсем не затрагивает карбонильную группу.
Восстановитель включает, например, цианоборогидрид натрия и катализатор включает, например, палладий, оксид платины и т.д.
Реакцию проводят в присутствии восстановителя или катализатора в подходящем растворителе. Растворитель предпочтительно представляет спирты, например метанол, этанол и т.д. Реакцию обычно проводят при температуре от около 20oC до около 80oC, когда используют восстановитель и когда используют катализатор, ее обычно проводят при температуре от около 10oC до около 25oC.
Способ (c)
Соединение формулы [I], где в заместитель R1 или
R2 не включена карбонильная группа или цианогруппа, т.е. соединение формулы [I-c]
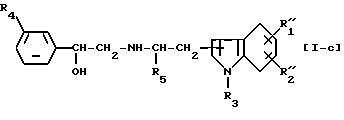
где R''1 представляет низший алкил, необязательно замещенный гидроксигруппой, фенилсульфониламиногруппу, низший алкилсульфониламиногруппу, моно- или ди-низший алкиламиносульфонильную группу или группу, выбранную из следующей группы (а) или (с)'', или R''1 вместе с R''2 образуют метилендиоксигруппу,
(а) группа формулы -X-Ra (где X и Ra такие же, как определено выше);
(с)'' группа формулы -O(CH2)p-Rc'' (где Rc'' представляет гидроксигруппу, фенильную группу или группу формулы
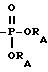
(где RA представляет атом водорода или низшую алкильную группу и p такой же, как определено выше), R''2 представляет атом водорода, атом галогена, низшую алкильную группу, которая необязательно замещена гидроксигруппой, гидроксигруппу, низшую алкоксигруппу или определенную выше группу (с)'' или R''2 вместе с R''1 образуют метилендиоксигруппу и R3, R4 и R5 такие же, как определено выше, можно получить восстановлением соединения формулы [VII]
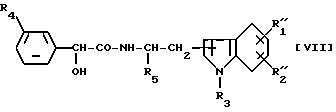
где R''1, R''2, R3, R4 и R5 такие же, как указано выше.
Реакцию проводят в присутствии восстановителя в подходящем растворителе. Восстановитель включает, например, диборан, литийалюминийгидрид или его алкоксикомплекс, его соль переходного металла, борогидрид натрия, в который добавлен хлорид алюминия, трехфтористый бор, оксихлорид фосфора или карбоновая кислота (например, уксусная кислота, трифторуксусная кислота) и т.д. Растворитель включает, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диметоксиэтан, диоксан, диглим и т.д. Температура реакции варьируется в соответствии с типом используемого восстановителя, но обычно она находится в интервале от около 0oC до около 160oC.
В указанном выше способе стереоконфигурация асимметричного атома углерода исходного соединения [VII] остается в конечном продукте.
Исходное соединение [VII] является новым соединением, его получают, например, реакцией соединения формулы [IX]
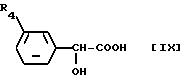
где R4 такой же, как определен выше, с соединением формулы [X]
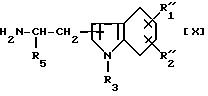
где R''1, R''2, R3 и R5 такие же, как указано выше, или с его солью.
Реакцию соединения [IX] и соединения [X] проводят в присутствии конденсирующего средства, например N,N'-дициклогексилкарбодиимида, гидрохлорида 1-этил-3-(3-диметиламинопропил) карбодиимида, N,N'-кapбoнилдиимидaзoлa, N, N'-карбонилдисукцинимида, 1-этоксикарбонил-2-этокси- 1,2-дигидрохинолина, дифенилфосфорилазида, пропанфосфонового ангидрида (ангидрид пропанфосфоновой кислоты) и т.д. Когда в качестве конденсирующего средства используют N,N'-дициклогексилкарбодиимид или гидрохлорид 1-этил-3-(3-диметиламинопропил) карбодиимида, реакцию можно проводить с добавлением в нее N-гидроксисукцинимида, 1-гидроксибензотриазола и т.д.
Реакцию обычно проводят в подходящем растворителе. Растворитель включает, например, те же растворители, которые упомянуты для способа (а). Кроме того, соединение [X] можно использовать в форме его кислотно-аддитивной соли, как упоминается в способе (а), и, когда используют кислотно-аддитивную соль соединения [X], реакцию проводят в присутствии органического основания, например триэтиламина, трибутиламина, диизопропилэтиламина, N-метилморфолина и т.д. Реакцию обычно проводят при температуре от около 20oC до около 50oC.
Стереоконфигурация соединения [IX] и соединения [X] остается в целевом соединении [VII].
Оптически активное соединение [IX] получают, например, способом, похожим на способ, описанный в Collet, A. and Jacques. J., Bull.Soc.Chim.France, 3330-3334 (1973).
Оптически активное соединение [X] получают, например, способом, похожим на способ, описанный в первой публикации патента Японии (Kokai) - 22559/1988.
Продукты, полученные в указанных выше способах, можно выделить и очистить обычным способом, например хроматографией, перекристаллизацией, переосаждением и т.д.
Продукты, полученные указанными выше способами, можно получить в форме кислотно-аддитивной соли или свободного основания согласно используемым условиям реакции. Эти продукты можно превратить в кислотно-аддитивную соль или свободное основание обычным способом.
В каждом из указанных выше
способов, когда
заместитель R1 или R2 представляет аминогруппу или низшую алкоксигруппу, замещенную группой формулы

или когда заместитель R1 или R2 содержит карбоксильную группу или гидроксигруппу, целевое соединение можно эффективно получить реакцией исходных соединений, у которых этот заместитель защищен обычной защитной группой, и затем с последующим удалением защитных групп у продукта.
Когда соединения данного изобретения, полученные указанными выше способами, или исходные соединения являются рацемическим соединением или находятся в форме смеси диастереомеров, каждый стереоизомер отделяют обычным способом, например способом, описанным в публикации N 455006 Европейского патента.
Лучший способ осуществления изобретения
Фармакологические эксперименты:
Следующие
эксперименты были
выполнены для того, чтобы оценить активность представительных соединений данного изобретения в виде:
(1) Активностей, стимулирующих β3- и β2
- адренергические рецепторы человека;
(2) Активности, снижающей содержание глюкозы в крови;
(3) Активности против ожирения.
Сначала объясняется создание клеточных линий, сильно экспрессирующих β3- и β2- адренергические рецепторы человека, и затем приводятся примеры экспериментов с их использованием.
Создание
клеточной линии, сильно экспрессирующей β3-адренергический рецептор человека:
(1) Конструирование экспрессирующего вектора:
Экспрессирующий вектор
животных клеток,
pKCRH2 [Mishina et al. Nature 307: 604-608 (1984)], расщепляли рестрикционной эндонуклеазой SalI и затупляли с использованием набора для затупления ДНК (Takara Shuzo Co., Ltd).
Отдельно другой
экспрессирующий вектор для животных клеток pSV2-neo [Southern and Berq, J. Mol. Appl.Genet. 1:327-341 (1982)] расщепляли рестрикционными эндонуклеазами AccI и AatII и затупляли при
помощи набора для
затупления ДНК. Эти ДНК лигировали при помощи набора для лигирования ДНК (Takara Shuzo Co. , Ltd) и вставляли в E.Coli HB 101 общепринятым способом, получая трансформанты.
Плазмидные ДНК получали из
трансформантов и расщепляли рестрикционной эндонуклеазой PstI. Был выбран клон, который продуцировал фрагменты, имеющие приблизительно 3,8 т.п.н. (тысяч пар нуклеотидов), 2,
2 т.п.н., 1,4 т. п.н и 0,9
т.п.н, чтобы получить плазмиду, названную pKCNO. Плазмиду pKCNO расщепляли рестрикционной эндонуклеазой HindIII и лигировали следующим синтетическим адаптером 1,
представленным SEQ ID N:1, при помощи
набора лигирования ДНК.
5'-AGCTCCTGCAGGCGCGCCGATA TCTCGAGCGGCCGCGGTACCA-3'
3'-GACGTCCGCGCGGCTATAGAG CTCGCCGGCGCCATGGTTCGA-5'
Реакционную смесь использовали для
трансформации E.coli HB101 и из выбранных трансформантов получали плазмидную ДНК. Плазмидную ДНК расщепляли рестрикционными эндонуклеазами DraI и HindIII и выбирали
клон, который продуцировал фрагмент,
имеющий приблизительно 430 п.н., чтобы получить плазмиду, названную pKCNl, в качестве экспрессирующего вектора.
(2) Конструирование экспрессионной
плазмиды:
Общую ДНК
экстрагировали из клеточной линии нейробластом человека SK-N-MC (АТСС НТВ 10) и кДНК синтезировали с использованием SuperScript-системы (Life Technologies), кДНК
амплифицировали набором для
полимеразной реакции синтеза цепи GeneAmp (Perkin-Elmer) с использованием в качестве праймеров следующих олигонуклеотидов 1 и 2, представленных SeQ ID N 2 и N 3
соответственно. В реакционную смесь
полимеразной реакции синтеза цепи добавляли 10% диметилсульфоксид.
5'-CCACCTGCAGGTGATTTGGGAGACCCC-3' --- олигонуклеотид 1
5'-TTCTCGAGCCGGGGAATCCCATGGGAC-3' --- олигонуклеотид
2
После расщепления реакционной смеси рестрикционными эндонуклеазами Sse 83871 и StuI электрофорезом был выделен фрагмент, имеющий
приблизительно 1,3 т. п.н. Этот фрагмент лигировали
экспрессирующим вектором pKCNl, который был расщеплен рестрикционными эндонуклеазами Sse83871 и EcoRV, и продукт лигирования вставляли в E.coli
HB101 общепринятым способом. Плазмидную ДНК получали из
выбранного трансформанта и определяли нуклеотидную последовательность фрагмента, имеющего приблизительно 1,3 т.п.н., полученного расщеплением
плазмидной ДНК рестрикционными эндонуклеазами Sse83871 и
XhoI. Последовательность была идентична последовательности кДНК β3-адренергического рецептора человека, сообщенной Leilas et
al. [FEBS Lett. 324:127-130 (1994)]. Эта плазмида для
экспрессии β3-адренергического рецептора человека, была названа pKREX10.
(3) Создание сильно экспрессирующей
клеточной линии:
Клеточную линию яичников
китайских хомяков CHO-K1 (АТСС CCL 61) трансформировали плазмидой, экспрессирующей β3-адренергический рецептор человека, способом
фосфата кальция и трансформанты выбирали с
применением 600 мкг/мл G-418 (Life Technologies) в минимальной поддерживающей среде Дульбекко (ICN Biochemicals), дополненной 10% фетальной бычьей
сывороткой и 11,5 мкг/мл пролина. В культурах 69
G-418-устойчивых клонов эти клетки отделяли инкубированием с забуференным фосфатом в солевом растворе, содержащем 0,5 мМ этилендиаминтетраацетата
(ЭДТА), при 37o в течение 10 минут после
удаления среды. Клетки собирали центрифугированием и суспендировали в 10 мМ Трис-HCl-буфера (pH 7,5), содержащего 1 мМ ЭДТА, при концентрации
5•106 клеток/мл. Эту суспензию (20 мкл)
и (-)-3-[125I] йодцианопиндолол (1,5 нМ) (Амстердам) смешивали в среде RPMI-1640 (200 мкл) (ICN Biomedicals), содержащей 1% бычий
сывороточный альбумин, 0,1% NaN3 и 20 мМ
HEPES-буфера (pH 7,4), и смесь инкубировали при 4oC в течение 2 часов. Реакционную смесь фильтровали через стеклянный фильтр GF/C
(Whatman), предварительно пропитанный 0,3% полиэтиленимином
и промытый, с использованием устройства BIO-DOT (Bio-Rad Laboratories) и радиоактивность на фильтре подсчитывали счетчиком гамма-лучей.
Один клон, названный CHO/pKREX10-36, который показал наивысшую
радиоактивность, использовали в качестве клеточной линии, экспрессирующей β3/-адренергический рецептор человека.
Создание клеточной линии, сильно экспрессирующей β3-адренергический рецептор человека.
кДНК была синтезирована при помощи Поли (A)+ -РНК,
полученной из головного мозга человека (Clontech: торговый номер;
CL6516-1), с использованием SuperScrip -систем (Life Technologies). Эту кДНК амплифицировали набором для полимеразной реакции синтеза
цели GeneAmp (Perkin-Elmer) с использованием в качестве праймеров
следующих олигонуклеотидов, представленных SEQ ID N 4 и N 5 соответственно
5'-ACACCTGCAGGTGAGGCTTCCAGGCGTCC-3'
--- олигонуклеотид 3
5'-TGTAAGCTTCTGCTTTACAGCAGTGAGTC-3'
--- олигонуклеотид 4
После расщепления реакционной смеси рестрикционными эндонуклеазами Sse83871 и HindIII электрофорезом
выделяли фрагмент, имеющий приблизительно 1,4 т.п.н. Этот фрагмент
лигировали экспрессионным вектором pKCNl, расщепленным рестрикционными эндонуклеазами Sse83871 и HindIII, и вставляли в E.coli HB101
общепринятым способом. Плазмидную ДНК получали из выбранного
трансформанта и определяли нуклеотидную последовательность фрагмента, имеющего приблизительно 1,4 т. п. н. , полученного расщеплением этой
плазмидной ДНК рестрикционными эндонуклеазами Sse83871 и
HindIII. Последовательность была идентична последовательности кДНК β2-адренергического рецептора человека, сообщенной
Kobilka B.K. et al. [Proc.Natl.Acad. Sci USA 84: 46-50 (1987)].
Эта плазмида была названа как pKREX21 для сильно экспрессирующего β2-адренергический рецептор человека, ее вводили в
CHO-K1 таким же образом, как в способе создания клеточной линии,
экспрессирующей β3-адренергический рецептор человека. Один клон, названный CHO/pKREX21-8, который показывал
наивысшую радиоактивность, использовали для клеточной линии,
экспрессирующей β2-адренергический рецептор человека.
Эксперимент 1: Активность, стимулирующая β
-адренергический рецептор человека:
Клеточную линию
CHO/pKREX10-36, сильно экспрессирующую β3-адренергический рецептор человека, культивировали в течение 3 дней с
минимальной поддерживающей средой Дульбекко, дополненной 10% фетальной
бычьей сывороткой, 11,5 мкг/мл пролина и 200 мкг/мл G-418. Клетки отделяли инкубированием с забуференным фосфатом солевым
раствором, содержащим 0,5 мМ ЭДТА, при 37oC в течение 10 минут
после удаления указанной выше среды. Клетки CHO/pKREX10-36 собирали центрифугированием и суспендировали в сбалансированных
солях Ханка (ICN Biomedicals), содержащих 1 мМ L-аскорбиновой кислоты и 1 мМ
3-изобутил-1-метилксантина, до концентрации 2•106 клеток/мл. Эту суспензию (100 мкл) и испытуемое
соединение смешивали в той же сбалансированной соли (500 мкл) и инкубировали при
37oC в течение 30 минут с последующим кипячением в течение 5 минут для окончания реакции. После
центрифугирования реакционной смеси количество цАМФ в супернатанте измеряли с использованием
системы цАМФ ElA (Амстердам).
Аналогично количество цАМФ измеряли с использованием CHO/pKREX21-8 в качестве сильно экспрессирующего β2-адренергический рецептор человека вместе с CHO/pKREX10-36 в качестве сильно экспрессирующего β3-адренергический рецептор человека.
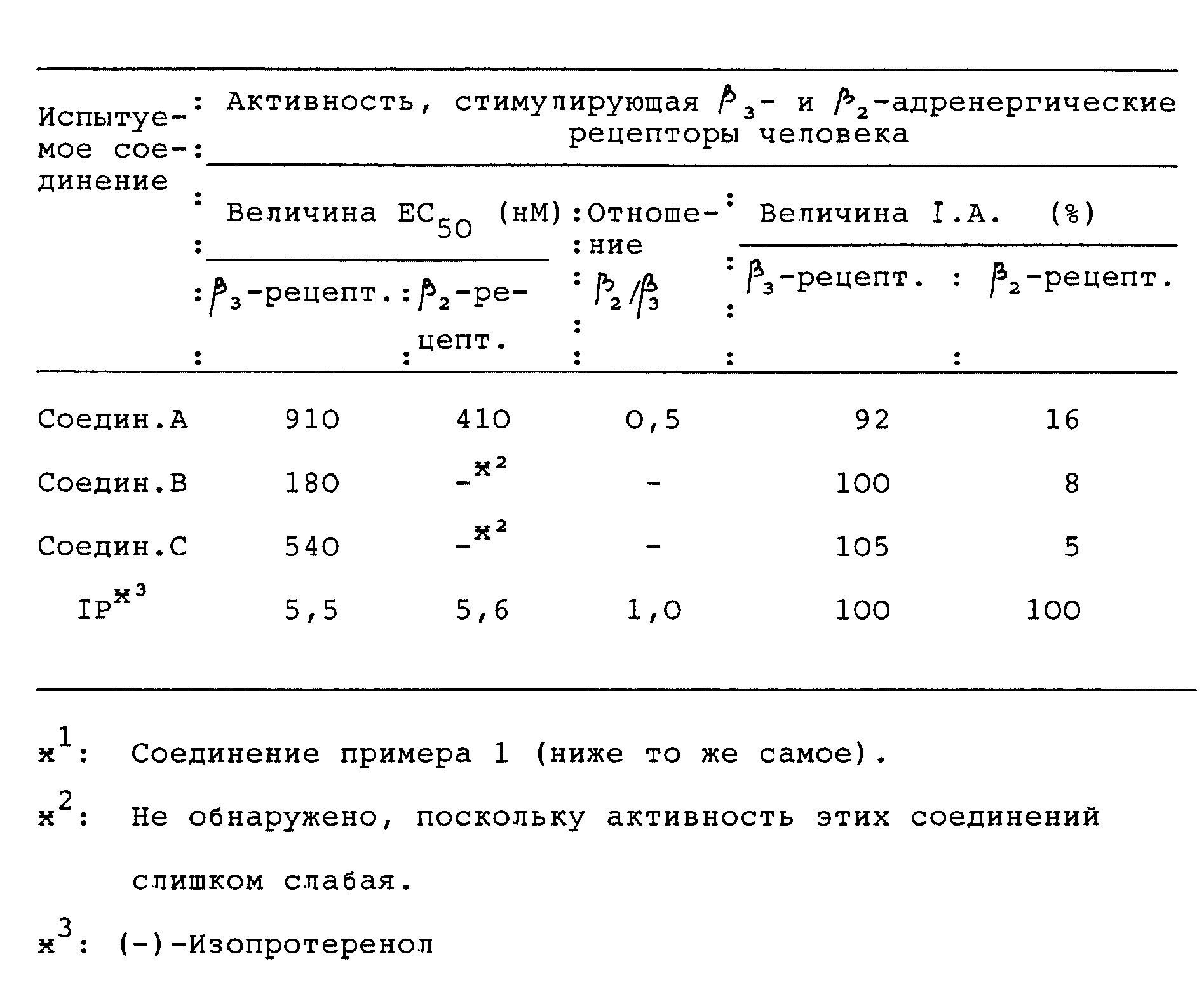
Количество цАМФ, когда добавляли 10-5 М (-)-изопротеренола в реакционную смесь или не добавляли совсем, принимали за 100% и 0% соответственно, и относительный максимальный ответ каждого соединения данного изобретения выражали как % присущей активности [I.A. (%)].
Величину EC50, которая является концентрацией испытуемого соединения, требуемой для достижения аккумулирования 50% цАМФ, рассчитывали методом регрессии наименьших квадратов кривых концентрация-ответ каждого соединения.
Результаты приводятся в табл. 5. Упомянутые выше соединения A, B и C использовали в качестве эталонного соединения.
Считается, что соединение, имеющее низкую величину EC50 и высокую величину I.A., имеет сильную активность, стимулирующую β3- или β2--адренергический рецептор человека. Таким образом, как показано в таблице 5, доказывается, что соединения данного изобретения, в особенности соединения примера 1, 1-A, 1-A-b, 2, 2-A и 14, имеют сильную активность, стимулирующую β3-адренергический рецептор человека. Кроме того, активность данных соединений, стимулирующая β3-адренергический рецептор человека, сильнее, чем его активность, стимулирующая β2-адренергический рецептор человека. В частности, соединения примера 1, 1-A, 1-A-b, 2, 2-A и 14 имеют превосходную адренорецепторную селективность для β3-адренергического рецептора человека.
С другой стороны, эталонные соединения A, B и C, указываемые здесь ранее, показывают совсем слабую активность, стимулирующую β3-адренергический рецептор человека, по сравнению с соединениями данного изобретения.
Кроме того, при изучении активности по увеличению скорости самопроизвольного сокращения в выделенном правом предсердии морских свинок, показано, что соединения данного изобретения едва ли показывают активность, стимулирующую β1-адренергический рецептор человека.
Как показано в приведенных выше результатах, соединения данного изобретения могут быть средством, стимулирующим β3 -адренергический рецептор человека, с превосходной адренорецепторной активностью.
Эксперимент 2. Активность,
снижающая содержание глюкозы в крови у голодающих мышей:
Испытуемое соединение, суспендированное в 0,5% растворе трагаканта, перорально вводили самцам мышей ddY (масса: 20-30 г) в условиях
голодания и до и через три часа после введения испытуемого
соединения отбирали пробы крови. Уровень глюкозы в крови определяли способом Kunst A., et al. (способ гексокиназы/G6PDH) [Berqmeyer, H.U.
(eds.). Methods in Enzymoloqy, vol. Yl, 3rd edition, Verlag
Chemie Gmbh, Weinheim-Deerfield Beach, Florida-Basel, 163-172 (1984)] . Активность испытуемого соединения по снижению глюкозы крови
выражали величиной ED25, которая представляет
концентрацию испытуемого соединения, требуемого для снижения уровня глюкозы в крови до введения испытуемого соединения на 25%. В качестве
эталонного соединения использовали гликлазид, который является
коммерчески доступным лекарственным средством для лечения сахарного диабета. Результаты приводятся в табл. 6.
Эксперимент 3. Активность против ожирения на мышах, страдающих диабетическим ожирением.
Испытуемое соединение, суспендированное в 0,5% растворе трагаканта, перорально вводили страдающим диабетическим ожирением мышам (KK-Ay/Ta, Jcl. самки; 50-60 г, Clea Japan Inc.) при дозе 0,3 мг/кг/день в течение трех недель и затем отбирали ретроперитонеальную жировую ткань и межлопаточную жировую ткань, массы их измеряли как белую жировую ткань и коричневую жировую ткань соответственно. Результаты приводятся в табл. 7.
Соединения данного изобретения показывают низкую токсичность, например соединение примера 1-A совсем не проявляло токсичность при пероральном введении при дозе 300 мг/кг (масса) в экспериментах по острой токсичности с использованием мышей. Таким образом, если принимать во внимание терапевтически эффективную дозу, соединения данного изобретения не создают проблем, связанных с безопасностью для живого организма.
Соединения данного изобретения являются превосходными средствами, стимулирующими β3-адренергический рецептор, с высокой адренорецепторной селективностью, их используют для профилактики или лечения ожирения и сахарного диабета у млекопитающих, включая людей. Кроме того, соединения данного изобретения можно также использовать при лечении синдрома раздраженной толстой кишки, острой или хронической диареи или для ослабления симптомов, например брюшинной боли, тошноты, рвоты, абдоминального дискомфорта и т.д., сопровождаемых петической язвой, острым или хроническим гастритом, дискинезией желчных путей, холециститом и т.д.
Соединение [I] данного изобретения или его фармацевтически приемную соль можно вводить в качестве средства, стимулирующего β3-адренергический рецептор, перорально, парентерально или ректально, но предпочтительно пероральным путем. Доза соединений данного изобретения варьируется в соответствии с путем введения, условий, возраста пациентов или конкретных целей (профилактика или лечение) и т.д., но обычно она находится в диапазоне 0,01-20 мг/кг/день, предпочтительно в диапазоне 0,05-10 мг/кг/день.
Соединения данного изобретения обычно вводят в форме фармацевтического препарата, который получают смешиванием его с фармацевтически приемлемым носителем или разбавителем. Фармацевтически приемлемый носитель или разбавитель может быть общепринятым носителем или разбавителем, который обычно используют в фармацевтической области и который не реагирует с соединениями данного изобретения. Подходящими примерами фармацевтически приемлемого носителя или разбавителя являются, например, лактоза, глюкоза, маннит, декстрин, крахмал, белый сахар, метасиликат-алюминат магния, синтетический силикат алюминия, кристаллическая целлюлоза, натриевая соль карбоксиметилцеллюлозы, гидроксипропилкрахмал, кальциевая соль карбоксиметилцеллюлозы, ионообменная смола, метилцеллюлоза, желатин, гуммиарабик, гидроксипропилцеллюлоза, слабозамещенная гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, поливиниловый спирт, рыхлая безводная кремневая кислота, стеарат магния, тальк, карбоксивиниловый полимер, оксид титана, эфир жирной кислоты и сорбитана (ангидросорбита), лаурилсульфат натрия, глицерин, эфир глицерина и жирной кислоты, очищенный ланолин, глицерожелатин, полисорбат, макрогель, растительное масло, воск, неионогенное поверхностно-активное вещество, пропиленгликоль, вода и т.д.
Фармацевтический препарат представляет, например, таблетки, капсулы, гранулы, порошки, сиропы, суспензии, суппозитории, гелеобразные препараты, инъекционные препараты и т.д. Эти препараты можно получить обычным способом. Для получения жидкостей соединение данного изобретения до введения растворяют или суспендируют в воде или другом подходящем растворителе. Таблетки и гранулы могут быть покрыты обычным способом. В инъекционных препаратах предпочтительно растворение фармацевтически приемлемой кислотно-аддитивной соли соединения [1] данного изобретения в воде, но, если необходимо, ее можно растворить в изотоническом средстве и затем добавлять в раствор средство для регулирования pH, буферный агент или консервант.
Эти препараты могут содержать соединение данного изобретения в пропорции по меньшей мере 0,01%, предпочтительно в пропорции 0,05-70%. Эти препараты могут содержать также другие фармацевтически эффективные соединения.
Примеры
Данное
изобретение иллюстрируется более подробно следующими ссылочными примерами и примерами, но они не должны
истолковываться как ограничение изобретения.
Идентификацию соединений осуществляли элементарным анализом, масс-спектром, ИК-спектром, ЯМР-спектром и т.д.
Для упрощения описания в данном изобретении можно использовать следующие сокращения.
Me: Метил
Et: Этил
Ph: Фенил
E: Этанол
M: Метанол
H: н-Гексан
DE: Диэтиловый эфир
CF: Хлороформ
EA: Этилацетат
ДМФ:
Диметилформамид
с: Синглет
д: Дублет
дт: Двойной триплет
дд: Двойной
дублет
т: Триплет
к: Квартет
MC: Масс-спектр
Ссылочный
пример
Получение 3-(2-аминопропил)-7-метоксииндола:
Заглавное соединение получали
следующими способами в соответствии с методом, описанным в публикации патента Великобритании N
974893.
(1) Диметилформамид (ДМФ, 16 мл) охлаждают в ледяной бане и в него по каплям добавляют оксихлорид фосфора (5 мл) и смесь перемешивают в течение 10 минут. Раствор 7-метоксииндола (6,5 г), который получали из 3-метил-2-нитроанизола в соответствии со способом, описанным в Heterocycles, 16, 1119-1124 (1981), в ДМФ (16 мл) добавляют по каплям в эту смесь и смесь перемешивают при комнатной температуре в течение двух часов. В смесь добавляют 30% водный раствор гидрооксида натрия (30 мл) при охлаждении льдом и смесь нагревают при около 80oC в течение пяти минут на горячей бане и оставляют для охлаждения. Осадок собирают фильтрованием, промывают водой и сушат, получая неочищенный 7-метоксииндол-3-альдегид (4,6 г).
(2) Смесь ацетата аммония (3,6 г), уксусного ангидрида (1 мл) и уксусной кислоты (3,2 мл) нагревают при перемешивании при 50oC в течение 20 минут и в нее добавляют продукт (4,5 г), полученный в (1), уксусную кислоту (19,2 мл) и нитроэтан (16 мл). Смесь нагревают до 100oC и в нее добавляют ацетат натрия (2, 25 г). Смесь кипятят с обратным холодильником в течение двух часов при постепенном добавлении в нее по каплям уксусного ангидрида (3,2 мл). После охлаждения при стоянии в смесь добавляют воду и осажденный твердый продукт собирают фильтрованием, промывают водой и сушат, получая неочищенный 1-(7-метоксииндол-3-ил)-2-нитропропен (3,35 г).
(3) Раствор нитропропенового соединения (3,2 г), полученного в (2), в тетрагидрофуране (60 мл) добавляют по каплям в суспензию алюминийгидрида лития (3,2 г) в диэтиловом эфире (60 мл) при охлаждении льдом и смесь кипятят с обратным холодильником в течение 5,5 часа. В смесь при охлаждении льдом добавляют насыщенный водный раствор смешанного тартрата натрия и калия и нерастворимые материалы удаляют фильтрованием и фильтрат сушат над безводным сульфатом магния. Эту смесь выпаривают для удаления растворителя при пониженном давлении, получая неочищенное целевое соединение (3,2 г) в виде маслянистого продукта, который используют в качестве исходного соединения в примере 1.
MC (m/z): 205 (MH+).
Ссылочный пример 2
Получение 3-(2-аминопропил)-6-метоксикарбонилметоксиидола
(1) 6-Гидроксииндол (2,9 г), метилхлорацетат (2,7 г),
карбонат калия (5,5 г) и йодид калия (0,2 г) добавляют в ацетон (100 мл) и смесь кипятят с обратным холодильником в течение 8 часов.
Реакционную смесь охлаждают до комнатной температуры и
нерастворимые материалы удаляют фильтрованием. Фильтрат выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на
силикагеле (элюент: хлороформ), получая
6-метоксикарбонилметоксииндол (2,83 г).
1H ЯМР-спектр (CDCl3): 3,78 (3H, с, COOCH3), 4,67 (2H, с, OCH2 ), 6,49 (1H, м), 6,83 (1H, м), 6,88 (1H, с), 7,11 (1H, м), 7,53 (1H, м), 8,2 (1H, с, NH).
(2) В раствор указанного выше продукта (2,77 г) в бензоле (50 мл) добавляют раствор 2-нитропропена (3,56 г) в бензоле (17,8 мл) и смесь кипятят с обратным холодильником в течение 15 часов. Смесь выпаривают для удаления растворителя при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ), получая 3-(2-нитропропил)-6- метоксикарбонилметоксииндол (2,15 г) в виде маслянистого продукта.
1H ЯМР-спектр (CDCl3): 1,56 (3H, д, J=7 Гц, CHCH3), 3,10-3,48 (2H, м, CH2CHNO2), 3,77 (3H, с, COOCH3), 4,64 (2H, с, OCH2), 4,92 (1H, м, CHNO2), 6, 76-7,05 (3H, м), 7,48 (1H, м), 8,08 (1H, с, NH).
(3) Указанный выше продукт (2,1 г) растворяют в этаноле (50 мл) и в раствор добавляют никель Ренея, смесь восстанавливают при 50oC при атмосферном давлении. После потребления теоретического количества водорода никель Ренея удаляют фильтрованием. Фильтрат выпаривают для удаления растворителя, получая неочищенный 3-(2-аминопропил)-6- метоксикарбонилметоксииндол (1,98 г) в виде маслянистого продукта, который используют в качестве исходного соединения в примере 7.
MC (m/z): 263 (MH+ ).
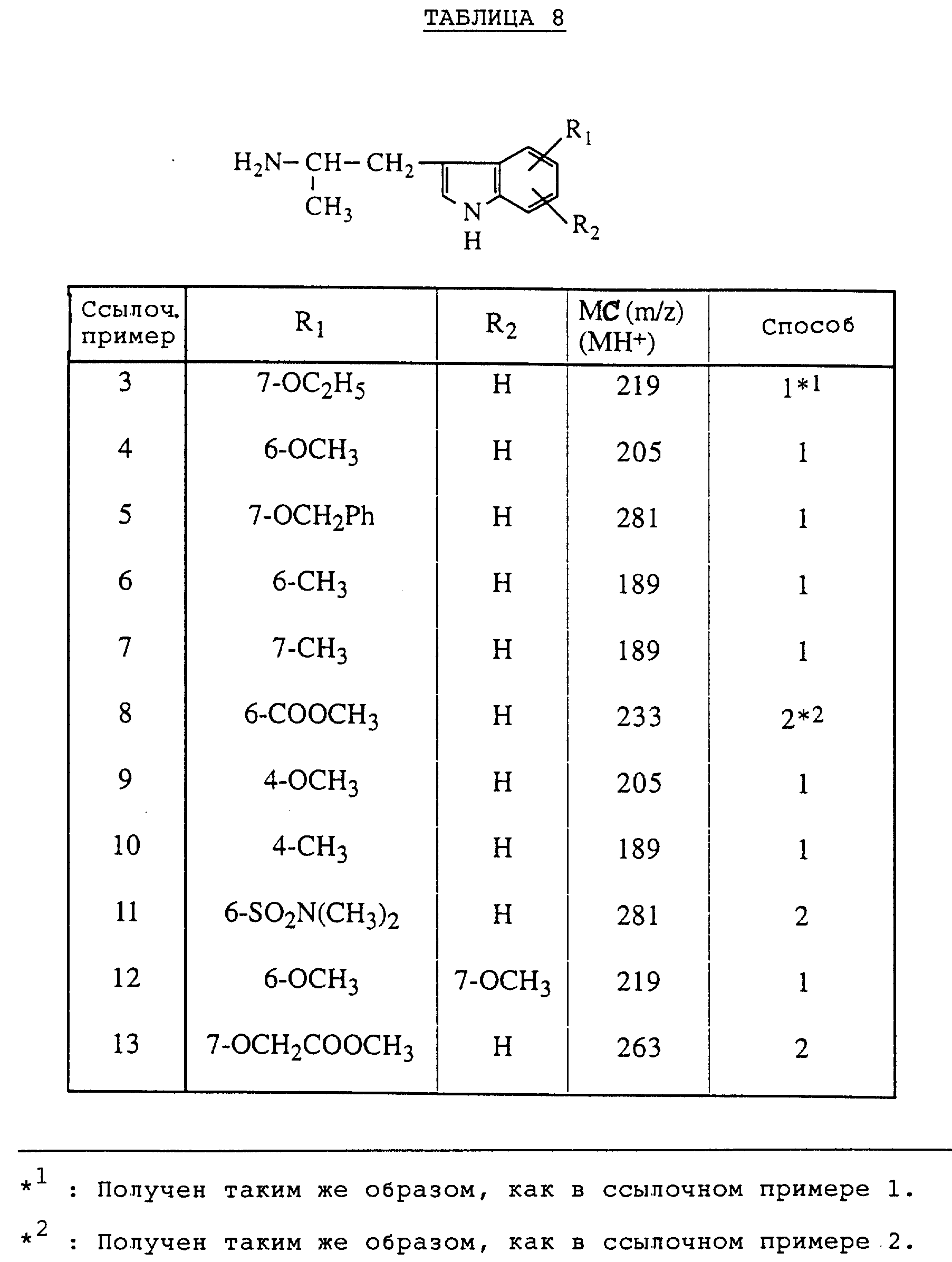
Ссылочные примеры 3-13
Таким же образом, как в ссылочном примере 1 или 2, получают исходные соединения, перечисленные в таблице 8.
Пример 1
Получение 2-[3-(7-метоксииндол-3-ил)-2-пропиламино]
-1-(3- хлорфенил)этинола
Способ (a):
В метанол (20 мл) добавляют (3-хлорфенил)оксиран (0,77 г) и 3-(2-аминопропил)-7-метоксииндол
(2,16 г) и смесь перемешивают при комнатной
температуре в течение 64 часов. Смесь выпаривают для удаления растворителя при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле
(элюент: хлороформ/метанол = 12:1),
фракции, содержащие целевой продукт, объединяют и концентрируют при пониженном давлении, получая маслянистый продукт (1,06 г).
1H ЯМР-спектр (CDCl3): 1,12 (3H, д, J= 7 Гц, CHCH3), 2,61 (1H, м), 2,78-2,86 (2H, м), 2,88-3,12 (2H, м), 3,95 (3H, с, OCH3), 4,56 (1H, м, CHOH), 6,65 (1H, м), 6,93-7,09 (2H, м), 7,11-7,29 (4H, м), 7,33 (1H, м), 8, 25 (1H, с, индол-NH).
Указанный выше маслянистый продукт (0,3 г) обрабатывают фумаровой кислотой, получая фумарат целевого соединения (0,15 г) (фумарат соединения примера 1). Т.пл. 143-147oC (перекристаллизован из смеси этанол/диэтиловый эфир).
Способ (b):
В метанол (10 мл) добавляют
7-метоксииндол-3-ацетон (0,4 г), который получали способом,
описанным в патенте Великобритании N 974893, и в смесь при охлаждении льдом добавляют гидрохлорид 2-(3-хлорфенил)этаноламина (0,45 г) и
цианоборогидрид натрия (0,2 г). Смесь перемешивают в течение
пяти минут и затем перемешивают при комнатной температуре в течение 18 часов. Смесь выпаривают для удаления растворителя при пониженном
давлении и в остаток добавляют насыщенный водный раствор
бикарбоната натрия. Смесь экстрагируют этилацетатом и экстракт промывают последовательно водой и насыщенным водным раствором хлорида натрия и
сушат над сульфатом магния. Получаемую смесь выпаривают
для удаления растворителя при пониженном давлении и получаемый остаток очищают колоночной хроматографией на силикагеле (элюент: смесь
хлороформ/метанол = 15:1), получая целевое соединение (0,58 г) в
виде маслянистого продукта.
Способ (с):
(1) В раствор ДМФ (80 мл), содержащий
3-(2-аминопропил)-7- метоксииндол (12,24 г) и 3-хлорминдальную кислоту (7,46 г), добавляют
гексафторфосфат бензотриазол-N-окситрис(диметиламино) фосфония (17,68 г) и затем по каплям триэтиламин (9,8
мл). Смесь перемешивают при комнатной температуре в течение пяти часов и в реакционную
смесь добавляют этилацетат. Смесь промывают последовательно водой, 10% водным раствором лимонной кислоты,
насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида
натрия и сушат над безводным сульфатом магния. Смесь выпаривают для удаления растворителя при пониженном
давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: смесь
этилацетат/н-гексан = 1:1-->2:1), получая N-[3-(7-мeтoкcииндoл-3-ил)-2-пpoпил] -3-xлopминдaльaмид (14,02 г) в
виде маслянистого продукта.
1ЯМР-спектр (CDCl3 ): 1,12, 1,18 (3H, д, J=7 Гц, CHCH3), 2,82-2,95 (2H, м, CH2CH), 3,97 (3H, с, OCH3), 4,33 (1H, м, CHCH3), 4,85 (1H, с, CHOH), 6,65 (1H, м), 6,86-7,37 (7H, м), 8,26 (1H, д, J=13 Гц, CONH).
(2) Раствор указанного выше амидного соединения (13,4 г) в тетрагидрофуране (144 мл) добавляют по каплям в 1 М раствор комплекса боран-тетрагидрофуран (144 мл) при 20oC и смесь кипятят с обратным холодильником в течение четырех часов. В смесь при охлаждении льдом по каплям добавляют метанол (150 мл). Смесь кипятят с обратным холодильником в течение одного часа для разложения избытка борана. Смесь выпаривают для удаления растворителя при пониженном давлении. В остаток добавляют хлороформ и смесь промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Смесь выпаривают для удаления растворителя при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 20: 1--->10: 1), получая целевое соединение (7,35 г) в виде маслянистого продукта.
Пример 1-A
Получение 2-[3-(7-метоксииндол-3-ил)-2-пропиламино]-(1R)-1- (3-хлорфенил)этанола
Применяя (R)-(3-хлорфенил)оксиран (произведен SEPRACO, Ltd.; оптическая
чистота: 99,2% энантиомерного избытка) вместо (3-хлорфенил)оксирана в примере 1 целевое соединение получают таким же образом,
как в примере 1, способ (а), в виде маслянистого продукта.
MC (m/z): 359 (MH+).
Пример 1-A-a и 1-A-b
Получение 2-[(2R или
2S)-3-(7-метоксииндол-3-ил)- 2-пропиламино-(1R)-1-(3-хлорфенил)этанола и 2-[(2S или
2R)-3-(7- метоксииндол-3-ил)-2-пропиламино]-(1R)-1-(3-хлорфенил)этанола
2-[3-(7-Метоксииндол-3-ил])-2- пропиламино]-(1R)-1- (3-хлорфенил) этанол (3,0 г), полученный в примере 1-A, который
является смесью двух диастереоизомеров, разделяют колоночной хроматографией, получая
соединение (1A-a) (0,82 г), при элюировании менее полярным растворителем и соединение (1-A-b) (1,12 г) при
элюировании более полярным растворителем.
Соединение (1-A-a):
Время
удерживания его при высокоэффективной жидкостной хроматографии (ВЭЖХ) 20,3 мин (оптическая чистота:
> 99% диастереомерного избытка).
Условия разделения для ВЭЖХ:
1.
Колонка: CHIRALPAK AD (внутренний диаметр 4,6 мм, длина 250 мм, Daicel Chemical Industries, Ltd.).
2. Элюент: н-гексан/этанол/диэтиламин = 85:15:0,1.
3. Скорость потока: 0,4 мл/мин.
4. Температура: 40oC.
5. Длина волны для детектирования: 254 нм.
Т.пл. 129-130oC (перекристаллизован из смеси этилацетат/н-гексан).
1H ЯМР-спектр (CDCl3): 1,12 (3H, т, J=7 Гц, CHCH3), 2,57 (1H, дд, J=12,7 Гц), 2,81 (2H, д, J=7 Гц, CH2CH), 2, 91-3,09 (2H, м), 3,95 (3H, с, JCH3), 4,59 (1H, дд, J=8,4 Гц, CHOH), 6,64 (1H, д, J=8 Гц), 6,95 (1H, д, J=2 Гц), 7,03 (1H, т, J=8 Гц), 7,10-7,24 (4H,м), 7,32 (1H, м), 8,25 (1H, с, индол-NH).
Соединение (1-A-b)
Время удерживания его при ВЭЖХ: 24,5 мин (оптическая чистота:
> 99% диастереомерного избытка). Условия разделения для ВЭЖХ: такие же, как
условия при разделении соединения (1-A-a).
Т.пл. 86-87oC (перекристаллизован из смеси этилацетат/н-гексан).
1H ЯМР-спектр (CDCl3): 1, 12 (3H, д, J=7 Гц, CHCH3), 2,62 (1H, дд, J=12,9 Гц), 2,82 (2H, д, J=7 Гц, CH2CH), 2,87 (1H, дд, J=12,4 Гц), 3,05 (1H, м, CHCH3), 3,96 (3H, с, OCH3), 4,49 (1H, дд, J=9,4 Гц, CHOH), 6,65 (1H, д, J=8 Гц), 6,99 (1H, д, J=2 Гц), 7,04 (1H, т, J=8 Гц), 7,12-7,25 (4H, м), 7,33 (1H, м), 8,26 (1H, с, индол-NH).
Пример 2
Получение
2-[3-(7-этоксииндол-3-ил)-2-пропиламино] -1-(3- хлорфенил)этанола
(3-Хлорфенил)оксиран (0,92 г) и
3-(2-аминопропил)-7- этоксииндол (2,18 г) обрабатывают таким же образом, как в примере 1,
способ (а), получая целевое соединение (1,16 г) в виде маслянистого продукта.
1H ЯМР-спектр (CDCl3): 1,12 (3H, д, J=6 Гц, CHCH3), 1,48 (3H, т, J=7 Гц, CH2CH3), 2,4 (2,4 (2H, шир., NH, OH), 2,60 (1H, д, т, J=12,8 Гц), 2,77-2,96 (3H, м), 3,04 (1H, м), 4,20 (2H, к, J=7 Гц, CH2CH3), 4,55 (1H, дд, J=9,4 Гц, CHOH), 6,63 (1H, д, J=7 Гц), 6,91-7,06 (2H, м), 7,10-7,25 (4H, м), 7,32 (1H, м), 8,27 (1H, с, индол-NH).
Пример 2-A
Получение
2-[3-(7-этоксииндол-3-ил)-2-пропиламино]-(1R)-1- (3-хлорфенил)этанола
(R)-(3-Хлорфенил)оксиран и 3-(2-аминопропил)-7-этоксииндол, полученный в
приведенном выше ссылочном примере 3,
обрабатывают таким же образом, как в примере 1-A, получая целевое соединение в виде маслянистого продукта.
MC (m/z): 373 (MH+).
Примеры 3-12
Применяя соответствующие соединения индола, полученные в ссылочных примерах 2 и 4-12, вместо 3-(2-аминопропил)-7- метоксииндола в примере 1, получали таким же образом,
как в примере 1, способ (a),
соединения, перечисленные в таблице 9.
Пример 13
Получение натриевой соли
2-[3-(6-карбоксиметоксииндол-3- ил)-2-пропиламино]-1-(3-хлорфенил)этанола
Соединение
примера 7 (0,42 г) и гидрооксид натрия (0,3 г) добавляют в водный раствор метанола (метанол/вода=2:1,9
мл) и смесь кипятят с обратным холодильником в течение четырех часов. Затем смесь оставляют
стоять при 0oC в течение двух часов, осажденные кристаллы собирают фильтрованием, получая
целевое соединение (0,24 г) в виде 1/2-гидрата.
Т.пл. 236-242oC.
Пример 14
Получение 2-[3-(7-метоксикарбонилметоксииндол-3-ил)-2- пропиламино]
-(1R)-1-(3-хлорфенил)этанола
(R)-(3-Хлорфенил)оксиран и
3-(2-аминопропил)-7- метоксикарбонилметоксииндол, полученный в ссылочном примере 13, обрабатывают таким же образом, как в примере 1-A,
получая целевое соединение в виде маслянистого продукта.
MC (m/z): 417 (MH+).
1H-ЯМР-спектр (CDCl3): 1,13 (3H, д, J=6 Гц, CHCH3), 2,62 (1H, дт, J=12,8 Гц), 2,77-3,13 (4H, м), 3,81 (3H, с, CO2CH3), 4,47-4,68 (1H, м, CHOH), 4,75 (2H, с, OCH2), 6,57 (1H, д, J=8 Гц), 6,92-7,06 (2H, м), 7, 11-7,36 (5H, м), 8,77 (1H, с, индол-NH).
Пример
15
Получение 2-[3-(7-карбоксиметоксииндол-3-ил)-2-пропиламино] - (1R)-1-(3-хлорфенил)этанола
Соединение, полученное
в примере 14, и гидрооксид натрия добавляют в водный раствор
метанола (метанол/вода = 2:1) и смесь обрабатывают таким же образом, как в примере 13, получая целевое соединение.
MC (m/z): 403 (MH+).
Пример 16
(Получение таблеток)
Следующие компоненты смешивают и разминают обычным образом и смесь гранулируют, полученный продукт затем
прессуют для таблетирования, получая 1000 таблеток (каждая 100
мг).
Соединение примера 1 - 5 г
Кукурузный крахмал - 25 г
Лактоза - 54 г
Кристаллическая
целлюлоза - 11 г
Гидроксипропилцеллюлоза - 3 г
Рыхлая безводная кремневая кислота - 1 г
Стеарат магния - 1 г
Промышленное применение
Соединения данного
изобретения ценны в качестве лекарственного средства для
млекопитающих, включая людей, в особенности в качестве средства, стимулирующего β3-адренергический рецептор, их можно
использовать при лечении сахарного диабета и ожирения.
Реферат
Производное индола формулы I
гдe R1 - низший алкил, возможно замещенный гидроксилом, моно- или ди-(низший алкил) аминосульфонилом, -X-Ra, -[O(CH2)m-CHRb]nRbb, -O(CH2)p-Rc, Ra - низший алкил, X - О, Rb - Н, низший алкил, Rbb - алкоксикарбонил или карбоксильная группа, m=0, n=0 или 1, Rc - низший алканоил или фенил, р=1, R2, R3-Н, галоген, низший алкил, W - группа формулы II, которая соединяется с кольцом индола в положении 2 или 3, R4 - галоген, R5 - низший алкил, или его соль имеют сильную активность, стимулирующую β3-адренергический рецептор, с превосходной адренорецепторной селективностью. 6 с. и 9 з.п. ф-лы, 9 табл.
Формула
где R1 представляет низшую алкильную группу, необязательно замещенную гидроксигруппой, моно- или ди-(низший алкил)аминосульфонильную группу, или группу, выбранную из последующих групп (а) - (с), где (а) группа формулы -X-Ra, где X представляет O, Ra представляет низшую алкильную группу; (b) группа формулы
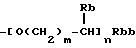
где Rb представляет атом водорода, низшую алкильную группу, Rbb представляет низшую алкоксикарбонильную группу или карбоксигруппу, m = 0, n = 0 или 1; (с) группа формулы -O(CH2)p-Rc, где Rc представляет низшую алканоильную группу или фенильную группу, и p = 1;
R2 представляет атом водорода, атом галогена, низшую алкильную группу, необязательно замещенную гидроксигруппой, низшую алкоксигруппу или указанную выше группу (b) или (c);
R3 представляет атом водорода или низшую алкильную группу;
W представляет группу формулы II, которая соединяется с кольцом индола в положении 2 или 3
где R4 представляет атом галогена и R5 представляет низшую алкильную группу, или соль его.
где R1, R2, R3, R4 и R5 такие же, как определено в п.1, или соль его.
где R4 представляет атом галогена с соединением формулы IV
где R1 представляет низшую алкильную группу, необязательно замещенную гидроксигруппой, моно- или ди-(низший алкил)аминосульфонильную группу или группу, выбранную из последующих групп (а) - (c), где (а) группа формулы: -X-Ra, где X представляет O, Ra представляет низшую алкильную группу; (b) группа формулы
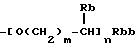
где Rb представляет атом водорода, низшую алкильную группу, Rbb представляет низшую алкоксикарбонильную группу или карбоксигруппу, m = 0 и n = 0 или 1; (с) группа формулы: -O(CH2)p-Rc, где Rc представляет низшую алканоильную группу, или фенильную группу, и p = 1;
R2 представляет атом водорода, атом галогена, низшую алкильную группу, необязательно замещенную гидроксигруппой, низшую алкоксигруппу или указанную выше группу (b) или (c);
R3 представляет атом водорода или низшую алкильную группу;
R5 представляет низшую алкильную группу,
или с его солью.

где R1' представляет низшую алкильную группу, необязательно замещенную гидроксигруппой, моно- или ди-низший алкиламиносульфонильную группу или группу, выбранную из следующих групп (a)', (b) и (c), где (a)' группа формулы -X-Ra, где X' представляет O, Ra представляет низшую алкильную группу; (b) группа формулы
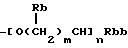
где Rb представляет атом водорода, низшую алкильную группу, Rbb представляет низшую алкоксикарбонильную группу или карбоксигруппу, m = 0 и n = 0 или 1; (с) группа формулы: -O(CH2)p-Rc, где Rc представляет низшую алканоильную группу, или фенильную группу, и p = 1;
R2 представляет атом водорода, атом галогена, низшую алкильную группу, необязательно замещенную гидроксигруппой, низшую алкоксигруппу или указанную выше группу (b) или (c),
R3 представляет атом водорода или низшую алкильную группу;
R4 представляет атом галогена;
R5 - низшая алкильная группа,
или его соли, отличающийся тем, что осуществляют реакцию соединения формулы V

где R4 такой же, как определено выше, с соединением формулы VI

где R1', R2, R3 и R5 такие же, как определено выше, в условиях восстановления.

где R1'' представляет низшую алкильную группу, которая необязательно замещена гидроксигруппой, моно- или ди-низший алкиламиносульфонильную группу или группу, выбранную из следующей группы (а) или (c)'', где а) группа формулы -X-Ra, где X представляет O, Ra представляет низшую алкильную группу; (c)'' группа формулы -O(CH2)p-Rc'', где Rc'' представляет фенильную группу и p = 1;
R2'' представляет атом водорода, атом галогена, низшую алкильную группу, которая необязательно замещена гидроксигруппой, низшую алкоксигруппу или указанную выше группу (c)'';
R3 представляет атом водорода или низшую алкильную группу, R4 представляет атом галогена, R5 представляет низшую алкильную группу,
или его соли,
отличающийся тем, что восстанавливают соединение формулы VII
где R1'' и R2'', R3, R4 и R5 такие же, как определено выше.

Комментарии