Глюкоолигосахариды, включающие (альфа 1-4) и (альфа-1-6) гликозидные связи, их применение и способы их получения - RU2571206C2
Код документа: RU2571206C2
Чертежи







Описание
Изобретение относится к области поли- и олигосахаридов и их пищевым воздействиям. В частности, оно относится к применению α-глюканотрансфераз в способах получения пищевых волокон, включая олигосахариды-пребиотики, и к новым олигосахаридам, получаемым с их помощью.
Термин «пищевое волокно» был впервые использован в 1953 г. Hipsley для описания компонентов пищи из клеточной стенки растений. В настоящее время используется много определений волокон, но до сих пор нет повсеместно принятого определения. В целом волокна происходят из углеводных источников, которые имеют неперевариваемый компонент. Волокна обычно подразделяются на две категории: нерастворимые волокна, такие как пшеничные отруби, устойчивый крахмал, гемицеллюлозы, лигнин и т.д., и растворимые волокна, которые могут быть дополнительно подразделены на два подраздела: растворимые волокна с короткой длиной цепи, включая полидекстрозу, инулин и олигосахариды, и растворимые волокна с длинной цепью, включая пектины, камеди (гуаровую камедь, смолу плодов рожкового дерева, каррагинан, ксантан) и β-глюкан (например, из дуба или ячменя).
Пребиотики представляют собой пищевые волокна, так как они не перевариваются ферментами человека, но сбраживаются флорой толстого кишечника. Таким образом, они повышают биомассу и частоту дефекации, в результате чего обладают позитивным эффектом в отношении запора и состояния слизистой оболочки толстого кишечника. Углеводы пребиотиков являются природными и могут находиться в многочисленных пищевых продуктах, включая спаржу, цикорий, помидоры и пшеницу, а также, будучи природным компонентом материнского молока.
Термин «пребиотик» был впервые определен Gibson and Roberfroid в 1995 г. Однако первоначальное определение создавало трудности для проверки, и поэтому затем авторы дополнительно разработали концепцию, предлагающую новое определение: «Пребиотик представляет собой избирательно ферментируемый ингредиент, который делает возможными специфические изменения и состава, и/или активности микрофлоры желудочно-кишечного тракта, которые благоприятно воздействуют на самочувствие и здоровье хозяина» (Nutr Res Rev 2004; 17: 259-275). Для того чтобы отвечать требованиям классификации в качестве пребиотика, ингредиенту, следовательно, требуется (i) быть устойчивым к перевариванию (кислотой желудочного сока, в результате гидролиза ферментами млекопитающих и всасывания в желудочно-кишечном тракте); (ii) сбраживаться микробиотой желудочно-кишечного тракта; и (iii) избирательно стимулировать рост и/или активность бактерий кишечника, сопутствующих здоровью и хорошему самочувствию. Более поздним критерием является главная особенность, отличающая пищевое волокно от пребиотика. Пребиотики обычно распознаются по их способности изменять микробиоту ободочной кишки, стимулируя ее более здоровый состав и/или активность путем повышения преобладания сахаролитических (сбраживающих углеводы) микроорганизмов, в то же время снижая гнилостные (сбраживающие белки) микроорганизмы.
Установленные неперевариваемые углеводы, которые соответствуют критериям пребиотиков, включают фруктоолигосахариды (FOS), галактоолигосахариды (GOS), лактулозу, инулин и полидекстрозу.
Полидекстроза представляет собой полисахарид, состоящий из беспорядочно поперечно сшитых единиц глюкозы со всеми типами гликозидных связей. Полидекстроза Litesse устойчива к перевариванию из-за своих уникально организованных гликозидных связей. В молекулярном отношении преобладают связи (α1→6), но приблизительно 13% полимера имеют связи (α1→4), которые могут гидролизоваться ферментами в тонком кишечнике человека. Она сбраживается на протяжении ободочной кишки и особенно эффективна как посредник эффекта пребиотика в дистальном отделе ободочной кишки. Исследования с участием людей показали, что полидекстроза Litesse повышает уровень как бифидобактерий, так и лактобацилл дозозависимым образом.
Крахмал является полисахаридом, находящимся в зеленых растениях - тех, которые содержат хлорофилл в качестве источника запасания энергии. Крахмал составляет интегративную часть многих миллионов пищевых ингредиентов, имеющихся на рынке, и отличается своей сложной и плотной структурой. Крахмал является идеальным примером важнейшего предмета потребления с широким спектром промышленного применения, которое включает производство бумаги и картона, ферментацию, биологическое топливо, биодеградируемые пластики и детергенты, биопестициды, поверхностно-активные вещества, полиуретан, смолы, связующие вещества и растворители. Однако именно пищевая промышленность обеспечивает наиболее широкий рынок для крахмала и его производных.
Крахмал либо полностью разрушается в тонком кишечнике до глюкозы и поступает в кровь, либо те части, которые избежали переваривания, поступают в толстый кишечник, где они служат в качестве общего субстрата для микробной флоры ободочной кишки. Крахмал и его производные сами по себе не стимулируют благоприятных специфических микробов ободочной кишки. Таким образом, крахмал сам по себе не является соединением-пребиотиком. Частичным решением проблемы является разрушение крахмала до дисахарида мальтозы, и затем использование фермента трансглюкозидазы для превращения мальтозы в (α1→6)-соединенные изомальтоолигосахариды (IMO) со степенью полимеризации от 2 до 4. Эти IMO продукты являются, однако, слишком короткими и в основном разрушаются в тонком кишечнике, в результате этого не достигая ободочной кишки. Та часть IMO продукта, которая достигает ободочной кишки, быстро разрушается кишечной микрофлорой в проксимальной части ободочной кишки и не достигает дистальной части, где находятся более вредные бактерии, разрушающие белки. Для вытеснения этих вредных бактерий путем стимуляции благоприятных бактериальных штаммов, в частности бифидобактерий, требуются более длинные изомальтоолигосахариды.
Ранее были разработаны различные методы для химической модификации мальтоолигосахаридов (MOS) и крахмала (амилозы, амилопектина). Позднее для модификации крахмала (амилозы, амилопектина) использовались также различные трансгликозилазные ферменты (глюканотрансфераза циклодекстринов, амиломальтаза, ветвящий крахмал фермент).
В настоящем изобретении предлагаются дополнительные средства и способы (ферментативной) модификации крахмала, производных крахмала и/или MOS с различной длиной цепей, для того, чтобы изменить их функциональные свойства и увеличить их пищевую ценность.
Неожиданно обнаружено, что этим целям может удовлетворять использование α-глюканотрансферазы типа GTFB глюканотрансфераз, члена семейства GH70 гидролаз гликозидов [http://www.cazy.org]. В то время как глюкансахаразные ферменты катализируют превращение сахарозы в α-глюкан-поли- и олигосахариды, ранее сообщалось, что GTFB совсем не взаимодействует с сахарозой (Kralj 2004). В настоящем описании раскрыто, что GTFB проявляет высокую активность в отношении глюкоолигосахаридов, включающих (α1→4)-связанные остатки глюкозы, таких как мальтоолигосахариды (MOS). GTFB катализирует диспропорционирующий тип реакции, укорачивающий одну молекулу субстрата и удлиняющий вторую молекулу субстрата. Оба продукта могут опять быть субстратами в следующей реакции. В результате активности GTFB можно, таким образом, получать серии линейных глюкоолигосахаридов до, по меньшей мере, DP35. Структурный анализ продуктов выявил, что GTFB расщепляет (α1→4) гликозидные связи и создает новые (α1→4) и (α1→6) связи. Это является первым примером фермента с такой специфичностью реакции и продукта. Соответственно этот фермент обозначается как (1→4)-α-D-глюкан: (1→4)(1→6)-α-D-глюкан (α-D-глюканотрансфераза или альтернативно как α-глюканотрансфераза. Глюкансахаразные ферменты также используют MOS, но только в качестве акцепторных субстратов в присутствии сахарозы в качестве субстрата-донора. Это ведет к синтезу диапазона олигосахаридов, например мальтозы, удлиненной сериями глюкозных единиц, связанных через (α1→6) связи в случае декстрансахарозы. В случае глюкансахараз, однако, связи (α1→4) в MOS субстратах не расщепляются, и MOS используются только в качестве акцепторного субстрата. Это является главным отличием фермента GFTB, который не способен действовать на сахарозу и вместо этого использует MOS в качестве донорных и акцепторных субстратов, расщепляя связи (α1→4) и вводя путем диспропорционирующего типа реакции новые связи (α1→6) и (α1→4). Продукты, которые могут быть синтезированы под действием GTFB из крахмала или производных крахмала, содержат относительно длинные изомальтоолигосахаридные (IMO) боковые цепи, в частности IMO боковые цепи со степенью полимеризации 4 или выше. Часть IMO-мальтодекстрина (IMO-MALT) разрушается в тонком кишечнике, причем она является меньшей, чем те части, которые бы разрушались при употреблении немодифицированного крахмала/производных. Это происходит потому, что те части мальтодекстрина, которые примыкают к части IMO, не будут разрушаться амилазами кишечника, так как амилазам для того, чтобы подействовать, необходима определенная длина линейных остатков глюкозы, связанных (α1→4) связями. IMO-MALT может, следовательно, рассматриваться в качестве частично устойчивого производного крахмала, дающего меньшую продукцию глюкозы в тонком кишечнике, чем дал бы немодифицированный крахмал. Это рассматривается как благоприятное свойство и вносит вклад в здоровый образ жизни (снижает риск развития ожирения, диабета II типа и болезней сердца и его коронарных артерий, связанных с избыточным потреблением быстро деградируемых крахмала/производных). Часть IMO-MALT, которая проходит в ободочную кишку немодифицированной, будет дополнительно разрушаться под действием остаточной микрофлоры. Часть IMO в IMO-MALT, содержащая связи (α1→6), может действовать в качестве специфического субстрата для благоприятных бифидобактерий, делая IMO-MALT ингредиентом-пребиотиком. IMO-MALT, следовательно, имеет, по меньшей мере, следующие преимущества:
1. Является частично устойчивым мальтодекстрином/крахмалом, дающим меньшую продукцию глюкозы, и в результате этого вносящим вклад в профилактику ожирения и диабета II типа.
2. Обладает эффектом пребиотика, стимулируя полезные бифидобактерии пищеварительного тракта, и в результате этого способствуя здоровью пищеварительного тракта.
В первом варианте осуществления изобретение относится к способу получения смеси глюкоолигосахаридов, обладающих одной или более (α1→6) гликозидными связями и одной или более (α1→4) гликозидными связями, включающему введение в контакт поли- и/или олигосахаридного субстрата, включающего на своем невосстанавливающем конце, по меньшей мере, две (α1→4)-связанные D-глюкозные единицы, с ферментом α-глюканотрансферазой, способным расщеплять (α1→4) гликозидные связи и создавать новые (α1→4) и (α1→6) гликозидные связи. Альтернативно, или дополнительно α-глюканотрансфераза способна переносить мальтозильную, мальтотриозильную или мальтотетраозильную единицу на субстрат через новую (α1→6) гликозидную связь.
Удачно, особенно для применения в качестве пищевого волокна, что глюкоолигосахаридный(ные) продукт(ы) являются линейными или содержат линейные участки/части в первую очередь из (α1→4) и (α1→6) гликозидных связей, придавая им устойчивость к ферментативной атаке в тонком кишечнике. Соответственно α-глюканотрансфераза предпочтительно не вводит ни точки ветвления (α1→6), ни (α1→2), (α1→3) связи.
В конкретном аспекте α-глюканотрансфераза (GTFB) является новым членом семейства GH70 глюкансахараз [http://www.cazy.org] или его функциональным гомологом, обладающим указанной ферментативной активностью и предпочтительностью субстратов, как описано выше. Например, фермент выбран из ферментов, представленных в таблице 2, или из группы, состоящей из GTFB из Lactobacillus reuteri 121, GTF106B из Lactobacillus reuteri TMW 1.106, GTML4 из Lactobacillus reuteri ML1 и GTFDSM из Lactobacillus reuteri DSM 20016A, GTF из Lactobacillus fermentum ATCC 14931, которые все известны в данной области техники на уровне как белка, так и нуклеиновой кислоты. См., в частности, фиг.2 и таблицу 2 в настоящем описании ниже для номеров поступления. Конечно, также могут быть использованы природные или искусственные гомологи (мутанты) этих известных последовательностей, включая созданные генной инженерией варианты, проявляющие желаемые свойства в отношении температурной устойчивости, субстратной специфичности, ферментативной активности и тому подобного. В одном варианте осуществления используют гомолог GTFB, который обладает, по меньшей мере, 55%, предпочтительно, по меньшей мере, 60%, 75%, подобно 80%, 85% или, по меньшей мере, 90% идентичностью последовательности на аминокислотном уровне с GTFB из GTFB(-подобных) ферментов, перечисленных в таблице 2, или предпочтительно из Lactobacillus reuteran 121 (AAU08014), GTF106B из Lactobacillus reuteri TMW 1.106 (ABP88725), GTML4 из Lactobacillus reuteri ML1 (AAU08003), GTFDSM из Lactobacillus reuteri DSM 20016A (ABQ83597) или GTF из Lactobacillus fermentum ATCC 14931 (ZP_03945763). Например, используют гомолог GTFB, который обладает, по меньшей мере, 55%, предпочтительно, по меньшей мере, 60%, 75%, подобно 80%, 85% или, по меньшей мере, 90% идентичностью последовательности на аминокислотном уровне с GTFB из Lactobacillus reuteri 121.
Предпочтительно, чтобы фермент обладал, по меньшей мере, 45%, более предпочтительно, по меньшей мере, 50% или, по меньшей мере, 60% идентичностью на аминокислотном уровне с каталитическим ядром GTFB, причем каталитическое ядро представлено непрерывной аминокислотной последовательностью W790YRP....IVMNQ1484, как обнаружено в белковой последовательности GFTB L. reuteri 121: номер поступления в GenBank AAU08014 (белковый код).
Гомолог GTFB предпочтительно включает один или более из следующих консервативных аминокислотных остатков, где нумерация соответствует положению в GTFB Lactobacillus reuteri 121: Arg1013; Asp1015; Ala1017; Asn1019; Glu1053, Gly1054, Tyr1055, His1124, Asp1125, Gln1126, Arg1127, Lys1128, Asp1479; Ile1480, Met1482, Asn1483, Gln1484. Предпочтительно присутствуют, по меньшей мере, каталитические остатки Asp1015, Glu1053 и Asp1125. Более предпочтительно, присутствуют все эти остатки.
В каталитическом домене ферментов GTF идентифицировано четыре консервативные области. Предшествующие исследования по генной инженерии белка показали, что аминокислотные остатки, локализованные в областях III и IV консервативной последовательности (см. фиг.1 для выравнивания последовательностей), контролируют специфичность продукта ферментов GTF в отношении образованных типов гликозидных связей (Hellmuth et al. Biochemistry (2008); Kralj et al. (2005) Biochemistry 44, 9206-9216; Kralj et al. (2006) FEBS J. 273, 3735-3742). Также область I и область II содержат аминокислотные остатки, которые вносят вклад в активность фермента и специфичность реакции [Kralj et al. (2005); Swistowska et al. (2007) FEBS Lett. 581, 4036-4042]. В конкретном аспекте фермент включает, по меньшей мере, одну из следующих консенсусных последовательностей, где нумерация соответствует положению аминокислоты в GTFB (см. фиг.1):
A) (консервативная область II): F1009DGFRVDAADNIDADVLDQ1027
B) (консервативная область III): H1048L(S/V)YNEGYHSGAA1060
C) (консервативная область IV): W1118SFVTNHDQRKN(L/V)I1131
D) (консервативная область I): G1473LKVQED(I/L)VMNQ1484
В одном варианте осуществления фермент представляет собой член GTFA из группы глюкансахараз, например GTFA из Lactobacillus reuteri 121 (номер поступления в GenBank AX306822 или AY697435 (последовательность GTF + примыкающие последовательности аминокисл. ост. GTFB + транспозазы), который сконструирован методом генной инженерии для получения уникальной «GTFB-подобной» субстратной специфичности и активности, требуемой для применения способа настоящего изобретения. Изобретение, таким образом, относится также к генетически модифицированному ферменту, принадлежащему к типу gtfA ферментов-глюкансахараз, включающему, по меньшей мере, одну из мутаций из таблицы 1, причем указанный фермент способен расщеплять (α1→4) гликозидные связи и создавать новые (α1→4) и (α1→6) гликозидные связи и характеризуется субстратной предпочтительностью для поли- и/или олигосахаридных субстратов, включающих (α1→4)-связанные единицы D-глюкозы, в частности мальтоолигосахариды. Специалист в данной области техники должен понимать, что в гомологи фермента GTFA из других организмов могут быть введены мутации, эквивалентные мутациям, представленным в таблице 1. Например, в GTF180 из Lactobacillus reuteri 180, GTFML1 из Lactobacillus reuteri ML1, DSRS из Leuconostoc mesenteroides B512-F, GTFD из Streptococcus mutans GS-5 (см. также van Hijum et al 2006). Предпочтительно вводятся множественные мутации, выбранные из таблицы 1. В конкретном варианте осуществления изменяются все положения, представленные в таблице 1.
Предлагается также применение фермента, способного расщеплять (α1→4) гликозидные связи и создавать новые (α1→4) и (α1→6) гликозидные связи и/или переносить мальтозильную, мальтотриозильную или мальтотетраозильную единицы, создавая новую (α1→6) гликозидную связь, в способе получения производных крахмала, предпочтительно (частично) непереваривамых производных крахмала. В одном варианте осуществления фермент представляет собой тип GTFB глюкансахаразы, например, выбранный из таблицы 2 или из группы, состоящей из GTFB из Lactobacillus reuteri 121, GTF106B из Lactobacillus reuteri TMW 1.106, GTML4 из Lactobacillus reuteri ML1, GTFDSM из Lactobacillus reuteri DSM 20016A или GTF из Lactobacillus fermentum ATCC 14931, или его природный или искусственный гомолог (мутант). Предпочтительно фермент представляет собой GTFB из Lactobacillus reuteri 121.
Специалист в данной области техники способен определить подходящие условия процессов для осуществления предлагаемого в настоящем описании способа с помощью общепринятых экспериментальных методов, такие как температура, время инкубации, рН, количество фермента и т.д. Может быть использован диапазон рН 4-5, предпочтительно 4-4,5. В одном варианте осуществления используется температура, по меньшей мере, 30°С, предпочтительно 37°С. В другом варианте осуществления, например, учитывая свойства субстрата и/или стерильность, может быть желательной работа при более высокой температуре, такой как, по меньшей мере, 70°С, при условии, что фермент является достаточно термостабильным. Содержание сухого вещества в реакционной смеси может варьироваться. В одном варианте осуществления оно составляет, по меньшей мере, 10%, предпочтительно, по меньшей мере, 25%.
В способе по изобретению могут быть использованы различные олигосахаридные или глюкановые субстраты или смеси субстратов, предлагаемые так, что они включают поли- и/или олигосахариды, чей невосстанавливающий конец содержит (α1→4)-связанные остатки глюкозы. Предпочтительно указанный невосстанавливающий конец содержит 3 или более последовательных (α1→4)-связанных остатков глюкозы. Предпочтительны линейные субстраты. Соответственно также предлагается способ получения смеси линейных глюкоолигосахаридов, имеющих одну или более (α1→6) гликозидных связей, включающий введение в контакт, например, путем инкубации линейного поли- и/или олигосахаридного субстрата, включающего на своем невосстанавливающем конце, по меньшей мере, две (α1→4)-связанных единицы глюкозы, с ферментом α-глюканотрансферазой, способным расщеплять (α1→4) гликозидные связи и создавать новые (α1→4) и (α1→6) гликозидные связи.
Очень хорошие результаты наблюдаются, когда субстрат имеет степень полимеризации, по меньшей мере, 4, предпочтительно, по меньшей мере, 5, более предпочтительно, по меньшей мере, 6. Субстрат, например, выбран из группы, состоящей из природного крахмала, модифицированного крахмала, производных крахмала, мальтоолигосахаридов, амилозы, амилопектина, мальтодекстринов, (α1→4) глюканов, рейтерана или их сочетаний. Применяемый в настоящем описании термин «производное крахмала» относится к продукту природного крахмала, который подвергся одной или более модификациям, осуществленных с помощью физических и/или (био)химических методов. Модификации включают деполимеризацию, поперечную сшивку и замену. Крахмал или производное крахмала может происходить из различных растительных источников, включая помидоры, маис, тапиоку и пшеницу. Некоторые другие необработанные продукты включают: рис, маниоку, золотистую фасоль, лущеный горох, ячмень, овес, гречиху, банан, сорго и чечевицу. Предпочтителен крахмал (производное) из картофеля, маиса, тапиоки или пшеницы.
В конкретном аспекте в способе по изобретению в качестве субстрата используется обработанный амиломальтазой (AMазой) крахмал (ATS), предпочтительно картофельный крахмал. ATS имеется в продаже у AVEBE (Veendam The Netherlands) под торговой маркой Etenia™. В дополнительном конкретном варианте осуществления в качестве субстрата используется рейтеран, который представляет собой α-глюкановый продукт активности рейтерансахаразы и включает (α1→4) и (α1→6) связи. Очень хорошие результаты дает также смесь рейтерана и мальтоолигосахаридов (MOS). Предлагается также обработка продукта, получаемого путем инкубации крахмала, производного крахмала, мальтодекстрина или мальтоолигосахарида с GTFB или родственным GTFB ферментом, гидролитическим ферментом, который вызывает разрушение альфа,1-4-O-гликозидных связей, таким как альфа-амилаза, бета-амилаза, альфа-глюкозидаза или мальтогенная амилаза. Это дает неперевариваемые или медленно перевариваемые олигосахарид/волокна.
Как иллюстрируется в настоящем описании ниже, способ по изобретению, как описано выше, должен обычно давать смесь различных линейных глюкоолигосахаридов, обладающих одной или более последовательными (α1→6) гликозидными связями и одной или более, предпочтительно двумя или более последовательными (α1→4) гликозидными связями. Для многих промышленных вариантов применения (например, для пищевой промышленности) смесь может быть использована по существу как таковая и не требует дополнительной очистки. Однако, если это желательно, конечно, возможно выделить или удалить один или более из индивидуальных глюкоолигосахаридов из смеси. С этой целью могут быть использованы различные методы, известные в данной области техники, например методы преципитации-фракционирования или хроматографии. В одном варианте осуществления способ по изобретению включает подвергание смеси хроматографии, исключающей по размеру, и/или анионообменной хроматографии и выделение, по меньшей мере, одного глюкоолигосахарида, обладающего одной или более (α1→6) гликозидными связями и одной или более, предпочтительно двумя или более (α1→4) гликозидными связями.
Как указывалось, ферментативная активность, как раскрыто в настоящем описании, может давать прирост олигосахарида с уникальной структурой. Предлагаемый глюкоолигосахарид является линейным (т.е. неразветвленным) глюкоолигосахаридом общей формулы A-B, глюканом, включающим такую линейную часть, или смесью, включающей различные глюкоолигосахариды/части общей формулы A-B, где связь между частью A и частью B представляет собой (α1→6) гликозидную связь и где B включает, по меньшей мере, два, предпочтительно, по меньшей мере, три последовательных связанных (α1→4) связями остатка глюкозы. Предпочтительно присутствуют только (α1→6) и (α1→4) гликозидные связи. Линейная часть общей формулы A-B может быть присоединена к любому типу глюкана (является ли он разветвленным или неразветвленным), например к восковидному амилопектину.
В одном варианте осуществления линейный (т.е. неразветвленный) глюкоолигосахарид общей формулы A-B или смесь, включающая различные глюкоолигосахариды общей формулы A-B, отличается тем, что (i) связь между частью A и частью B представляет собой (α1→6) гликозидную связь, (ii) часть A включает две или более последовательные (α1→6) гликозидные связи, предпочтительно,где A включает изомальтоолигосахарид со степенью полимеризации, по меньшей мере, 4 остатка глюкозы, и (iii) B включает, по меньшей мере, два, предпочтительно, по меньшей мере, три последовательных (α1→4) связанных остатка глюкозы. Например, часть A состоит из серий последовательных (α1→6) связанных остатков глюкозы, а часть B состоит из серий последовательных (α1→4) связанных остатков глюкозы.
В другом варианте осуществления часть A включает одну или более последовательные (α1→4) гликозидные связи, предпочтительно,где A включает мальтоолигосахарид, по меньшей мере, с четырьмя (α1→4) связанными остатками глюкозы. Таким образом, участок (α1→4) связанных остатков может быть связан через (α1→6) связь с другим участком (α1→4) связанных остатков.
Предлагаются олигосахариды с различными длинами цепей. В одном варианте осуществления глюкоолигосахарид (часть) имеет степень полимеризации (DP), по меньшей мере, 7 (DP≥7), предпочтительно, по меньшей мере, 10 (DP≥10), более предпочтительно, по меньшей мере, 15 (DP≥15), до приблизительно 50. Олигосахариды длиной до более 30 остатков выявлялись с помощью MALDI-TOF-MS анализа. Обычно относительное количество продуктов с высокой молекулярной массой DP10-DP35 в смеси меньше, чем количество продуктов DP<10. Иллюстративная смесь имеет среднюю степень полимеризации, по меньшей мере, 5, предпочтительно, по меньшей мере, 6, такую как между 6 и 15.
Когда в качестве субстратов используются мальтоолигосахариды (например, DP7 или DP6), получают серии линейных глюкоолигосахаридов, и часто наблюдаются различные структуры данной DP. Например, идентифицированы, по меньшей мере, 4 структуры DP8, причем каждая отличается количеством (α1→6) и (α1→4) гликозидных связей. См. также фиг.6. Вообще говоря, отношение гликозидных связей (α1→6) к α→4) и структурное разнообразие повышаются с ростом длины цепи.
В одном аспекте, по меньшей мере, 20%, предпочтительно, по меньшей мере, 25% связей представляют собой (α1→6). Отношение между (α1→6) и (α1→4) гликозидными связями обычно находится в диапазоне между 20:80 и 90:10. Например, предлагаются линейный продукт DP7 с двумя последовательными (α1→6) связями и четырьмя последовательными (α1→4) связями; линейный продукт DP8 с двумя последовательными (α1→6) связями и пятью последовательными (α1→4) связями; или DP8 с тремя последовательными (α1→6) связями и четырьмя последовательными α1→4) связями; DP9 с пятью последовательными (α1→6) связями и тремя последовательными (α1→4) связями; DP9 с четырьмя последовательными (α1→6) связями и четырьмя последовательными (α1→4) связями; DP10 с пятью последовательными (α1→6) связями и четырьмя последовательными (α1→4) связями (см. фиг.6).
Для применения в качестве пищевого ингредиента, который предоставляет потребителю волокно-пребиотик, а также источник энергии, олигосахарид (смесь) предпочтительно включает существенные количества как (α1→6), так и (α1→4) гликозидных связей. Следовательно, в одном варианте осуществления отношение между (α1→6) и (α1→4) гликозидными связями составляет между 30:70 и 70:30.
Глюкоолигосахарид или смесь глюкоолигосахаридов по изобретению имеет важное промышленное применение, в частности в пищевых и диетических композициях. Предлагаемым является пищевой продукт (для человека или животного), включающий глюкоолигосахарид или глюкоолигосахаридную (смесь) по изобретению. Пищевой продукт может быть твердым, полутвердым или жидким пищевым продуктом. Пищевой продукт может представлять собой традиционный питательный продукт или диетический продукт. Он может быть пищевым изделием, готовым к употреблению, или пищевым продуктом, который требует дополнительной обработки перед употреблением, таким как выпекаемое хлебобулочное изделие. Иллюстративные продукты включают молочный продукт, состав для младенцев и детей, хлебопекарное изделие, продукт из макарон, продукт из лапши, кондитерский продукт, жидкий напиток, спортивный напиток, напиток и мороженое.
Дополнительный вариант осуществления относится к применению глюкоолигосахаридов или смеси глюкоолигосахаридов по изобретению в качестве пищевой добавки, например, в качестве волокна-пребиотика. Пребиотики могут применяться во многих используемых пищевых продуктах от применения в молочных продуктах до хлебопекарных, кондитерских продуктов и напитков. Благодаря своей химической и физической структуре они имеют тенденцию быть высокостабильными и обладать способностью улучшать состояние организма, ткани и вкусовые ощущения.
Другое полезное применение относится к ингибированию ферментов альфа-амилазного типа, таких как амилазы слюны и поджелудочной железы. Эти ферменты обычно действуют на (α1→4) мальтоолигосахаридную цепь с DP, варьирующей от 4-6. Предполагается, что присутствие в олигосахариде по изобретению (негидролизуемых) (α1→6) связей приводит только к связыванию с ферментом, но не к высвобождению глюкозы. Добавление таких олигосахаридов должно снижать скорость метаболизма (например, метаболизма крахмала), снижая тем самым гликемический индекс (GI) пищевого продукта. Глюкоолигосахарид (смесь) по изобретению может, следовательно, помочь также в снижении количества калорий и/или гликемической нагрузки пищевых продуктов. Это, следовательно, вносит вклад в диету с низким GI. Это представляет особый интерес для здоровья человека в целом, а также при конкретных метаболических заболеваниях, включая сахарный диабет и ожирение.
В дополнительном варианте осуществления глюкоолигосахарид (смесь) находит применение в терапевтическом или косметическом использовании, в частности для контролирования нормальной флоры кожи и содействия здоровью кожи. Олигосахарид может обладать эффектом пребиотика в том смысле, что он может предпочтительно селективно использоваться сапрофитными бактериями. Например, олигосахарид может стимулировать рост благоприятных для кожи бактерий (например, Micrococcus kristinae) по сравнению с ростом менее желательных бактерий, таких как Staphylococcus aureus и Corynebacterium xerosis. Предлагаемой является косметическая композиция, включающая глюкоолигосахарид или смесь глюкоолигосахаридов по изобретению и подходящий носитель. Можно также применять глюкоолигосахарид (смесь) в предметах личной гигиены, например, включать в поглощающее изделие, такое как одноразовая салфетка, гигиеническая салфетка или тому подобное, которое может понизить запах и дерматит (сыпь), когда такое поглощающее изделие является подержанным.
Подписи к фигурам
Фиг.1. Выравнивание аминокислотных последовательностей [http://www.cazy.org] консервативных областей (II, III, IV и I) в каталитических доменах (A) (предполагаемых) ферментов α-глюканотрансфераз, (B) DSRE и DSRP, глюкансахаразных ферментов, содержащих два каталитических домена (CD1 и CD2), и (C) декстран-, мутан-, альтернан- и рейтерансахаразных ферментов лактобактерий. Семь абсолютно консервативных аминокислотных остатков (1-7), обладающих важным вкладом в субсайты -1 и +1 в ферментах глюкансахаразах, также являются консервативными в ферментах α-глюканотрансферазах (показано подчеркиванием и в серой штриховке для GTFA и GTFB L. reuteri 121). Нумерация аминокислот (курсивом) соответствует GTF180 L. reuteri 180. Аминокислота D1015 GTFB (предполагаемый нуклеофильный остаток) показана жирным шрифтом.
Фиг.2. Филогенетическое древо GTFB-подобных белков, происходящее из филогенетического анализа всех 108 белковых последовательностей семейства 70 гидролаз гликозидов, доступных в базе данных Pfam. См. таблицу 2 выше для более подробного описания последовательностей в этом кластере.
Фиг.3. TLC анализ продуктов реакции 90 нМ GTFB, инкубированного в течение 13 часов в 50 мМ NaAc буфере, рН 4,7, 1 мМ CaCl2, с 25 мМ сахарозой или 25 мМ мальтоолигосахаридами. St=стандарт, Suc, сахароза; G1, глюкоза; G2, мальтоза; G3, мальтотриоза; G4, мальтотетраоза; G5, мальтопентаоза; G6, мальтогексаоза; G7, мальтогептаоза; Pol, полимер.
Фиг.4. Dionex анализ продуктов реакции 90 нМ GTFB, инкубированного либо 0, 1, 2 или 8 час в 50 мМ NaAc буфере, рН 4,7, 1 мМ CaCl2, с A) 25 мМ сахарозой или 25 мМ мальтогексаозой или B) 25 мМ мальтогептаозой.
Фиг.5. Dionex анализ инкубированных образцов субстратов без фермента (панели A) или с 90 нМ GTFB (панели B), проинкубированных в течение ночи при 37°С в 25 мМ NaAc, рН 4,7, 1 мМ CaCl2, только с амилозой-V (аббревиатура AMV) в качестве субстрата-донора и с амилозой-V совместно с 25 мМ глюкозой (G1) или 25 мМ мальтозой (G2) в качестве субстратов-акцепторов.
Фиг.6. Схематическое представление различных α-глюканов в смеси продуктов после инкубации мальтоолигосахарида DP7 с GTFB(-подобной) активностью.
Фиг.7. Спектр1H-ЯМР смеси продуктов после инкубации мальтоолигосахарида DP7 (100 мМ) с GTFB (250 мМ) в течение 120 час.
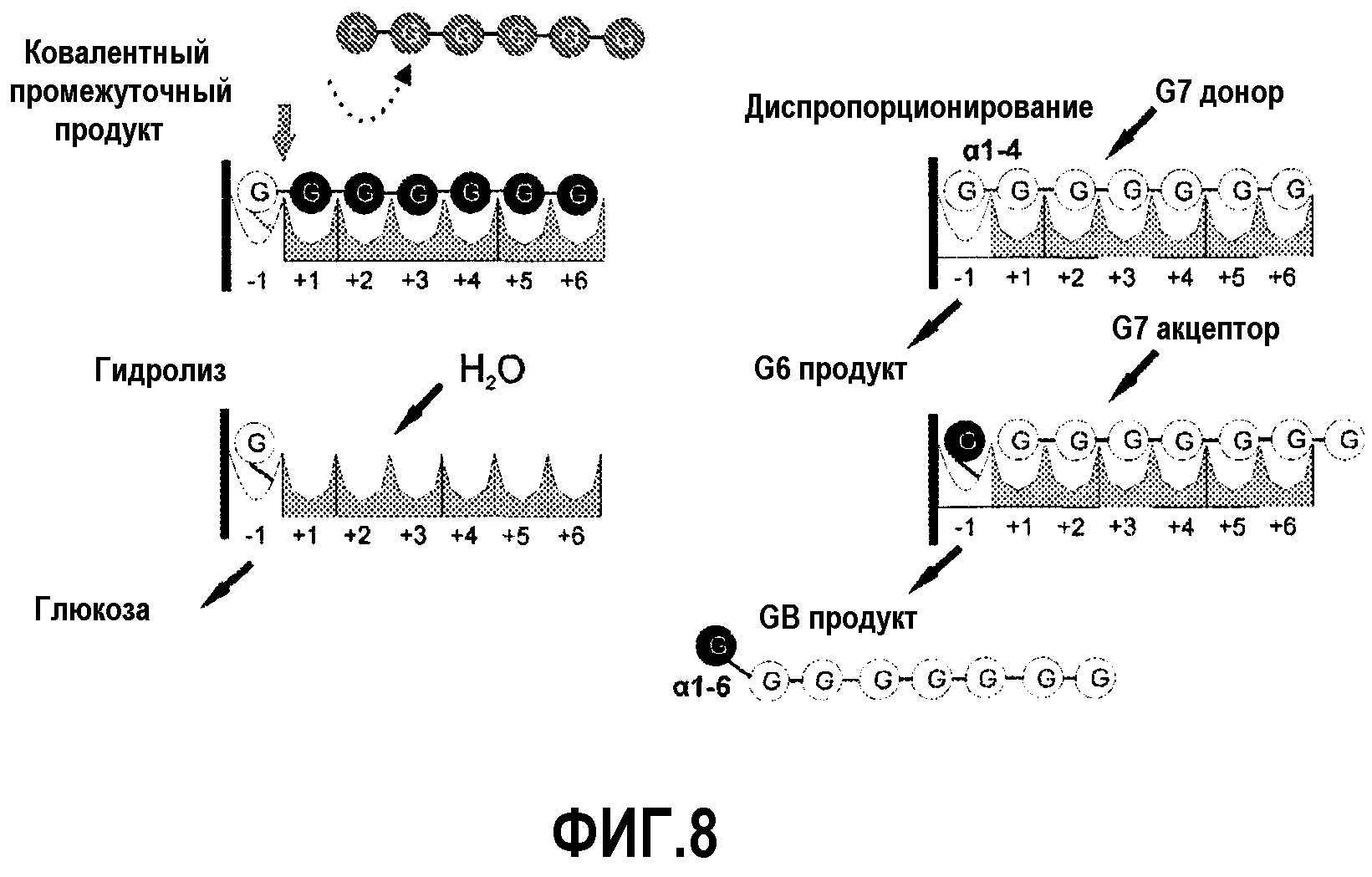
Фиг.8. Возможный способ действия GTFB. Схематическое представление последовательностей реакций, возникающих в активном сайте ферментов GTFB типа. Донорские и (акцепторные) субсайты ферментов типа GTFB картированы на основании доступной информации о 3D структуре ферментов глюкансахараз (с одним донорским (-1) субсайтом) и данных, полученных в настоящем исследовании. Связывание G7 с субсайтами -1 и с +1 до +6 ведет к расщеплению α-1,4-гликозидной связи (G6 высвобождается, показано серым) и к образованию (предполагаемого) ковалентного промежуточного продукта в субсайте -1 (показано серой линией). В зависимости от используемого субстрата-акцептора происходит гидролиз (с водой) или перенос гликозила на олигосахарид-акцептор (см. ниже). Фермент GTFB Lb. reuteri 121 катализирует также диспропорционирующую реакцию с мальтоолигосахаридами. Две молекулы мальтогептаозы (G7), например, превращаются в одну молекулу G6 и в продукт G8, содержащий 8 остатков глюкозы, но с заново синтезированной α-1,6-гликозидной связью на невосстанавливаемом конце.
Экспериментальная часть
Введение
Ферменты глюкансахаразы (GS) (или гликозилтрансферазы; GTF) (EC 2.4.1.5) кисломолочных бактерий (LAB) используют сахарозу для синтеза множества глюканов с гликозидными связями (α1→6) [декстран, обнаруживаемый главным образом в Leuconostoc], (α1→3) [мутан, обнаруживаемый главным образом в Streptococcus], перемежающимися (α1→3) и (α1→6) [альтернан, о котором сообщалось только для Leuconostoc mesenteroides], (α1→4) [рейтеран, синтезируемый с помощью GTFA и GTFO из штаммов Lactobacillus reuteri] {Monchois, 1999; van Hijum, 2006; Arguello-Morales, 2000; Kralj, 2002; Kralj, 2005}.
Lactobacillus reuteri 121 использует глюкансахаразу GTFA и сахарозу в качестве субстрата для синтеза рейтеранового продукта с большим количеством (α1→4) гликозидных связей. Выше этого гена gtfA был идентифицирован другой предполагаемый ген глюкансахаразы, обозначенный как gtfB. Ранее было показано, что после клонирования и экспрессии этого гена фермент не проявляет активности на сахарозе в качестве субстрата. В геноме L. reuteri ML1 выше gtfML1, кодирующего мутансахаразу, также был идентифицирован потенциальный каталитический и C-концевой домен гомолога gtfB, gtfML4 {Kralj, 2004}. В недавно выясненной последовательности генома L. reuteri DSM 20016 также удалось идентифицировать гомолог GTFB (73% идентичность и 85% сходство 883 аминокислот). Более того, L. reuteri TMW1.106 наряду с гомологом GTFA (GTFA106) также содержит гомолог GTFB (GTFB106). Этот фермент проявил 92% идентичность и 95% сходство 1383 аминокислот с GTFB из L. reuteri 121. Однако в отличие от GTFB GTFB106 показал низкую (после 27 час инкубации) гидролизующую активность в отношении сахарозы {Kaditzky, 2008}.
В настоящем описании показано, что GTFB обладает диспропорционирующим типом и полимеризующим типом активности на мальтоолигосахаридах. Фермент использует мальтоолигосахариды (содержащие только (α1→4) гликозидные связи) в качестве субстрата для синтеза олигосахаридов со степенью полимеризации (DP) до 35. Во время этого процесса элонгации/полимеризации в конечный продукт вводится большое количество (α1→6) гликозидных связей (~32%). Более того, заявители показали, что при использовании крупного амилозного субстрата (амилозы-V) в качестве донора и сахаридов меньшего размера (глюкозы, мальтозы) в качестве акцептора также синтезируются более крупные сахариды, соединенные посредством (α1→4) гликозидных связей, содержащие более пяти единиц глюкозы. Подробный анализ продукта, синтезированного из мальтогептаозы, с помощью анализа метилированием и 1H ЯМР показал, что в конечный продукт вводится до 32% (α1→6) гликозидных связей. Хотя первичная структура GTFB сходна с ферментами GH70, включая перемещенный барабан (β/α)8, его активность больше напоминает ферменты типа GH13 α-амилазы, использующих в качестве предпочтительного субстрата мальтоолигосахариды.
Материалы и методы
Штаммы бактерий, плазмиды, среды и условия выращивания. Для целей клонирования в качестве хозяина использовали Escherichia coli TOP 10 (Invitrogen, Carlsbad, Calif.). Для экспрессии (мутантных) генов gtfB в E. coli BL21 Star (DE3) (Invitrogen) использовали плазмиду pET15b (Novagen, Madison, WI). Штаммы E. coli выращивали в аэробных условиях при 37°С в среде LB {Ausubel, 1987}. Штаммы E. coli, содержащие рекомбинантные плазмиды, культивировали в среде LB с 100 мкг·мл-1 ампициллина. Чашки агара получали добавлением 1,5% агара в среду LB.
Выравнивание аминокислотной последовательности GTFB из L. reuteri. Было произведено множество операций выравнивания аминокислотной последовательности GTFB, известных глюкансахараз и потенциальных α-глюканотрансфераз из молочнокислых бактерий с помощью интерфейса Clusta1W в версии 4 MEGA (www.megasoftware. net) со штрафными баллами за открытие пропусков и расширения, равными 10 и 0,2 соответственно.
Молекулярные методы. Общие процедуры клонирования генов, трансформации ДНК E. coli, манипуляций с ДНК и электрофореза в агарозном геле были такими же, как описано в {Sambrook, 1989}. Гидролиз эндонуклеазами рестрикции и лигирование с помощью ДНК-лигазы T4 проводили, как рекомендовано поставщиками ферментов (New England Biolabs, Beverly, MA; Roche Biochemicals, Basel, Switzerland). Праймеры были получены от Eurogentec, Seraing, Belgium. Секвенирование производили с помощью GATC (Konstanz, Germany). ДНК амплифицировали с помощью ПЦР на DNA Thermal Cycler PTC-200 (MJ Research, Waltham, Massachusetts) с использованием ДНК-полимеразы Pwo (Roche Biochemicals) или полимеразы Expand High Fidelity (Fermentas). Плазмидную ДНК E. coli выделяли с использованием набора для экстракции плазмид Wizard Plus SV (Sigma).
Конструирование плазмид. Для создания двух разных экспрессионных конструктов с C-концевой меткой His использовали подходящие пары праймеров: для полного GTFB (1587 аминокислот), построенного с помощью трех отдельных реакций ПЦР с использованием метода, ранее описанного для GTFA из Lb. reuteri 121 (см. ниже) {Kralj, 2002}, и укороченного с N-конца варианта (без N-конца), соответствующего вариабельной области GTFB (889 аминокислот).
Для облегчения предстоящего мутагенеза и секвенирования нуклеотидов gtfB был разделен на три части и клонирован в виде трех частей. Первый из двух сайтов рестрикции PstI (1385 п.н., 1751 п.н.) был изменен с помощью мегапраймерного метода {Sarkar, 1990} и следующих праймеров: BpstIfor 5'-GTAAGTCGTTACTCAGCAGATGCTAATGG-3', содержащего мутантный сайт рестрикции PstI (подчеркнут, молчащая мутация путем изменения основания, показанного жирным шрифтом), и BpstI rev 5'-GGTCAGTAAATCCACCGTTATTAATTGG-3'. В следующей реакции ПЦР использовали амплифицированный продукт (420 п.н.) в качестве (обратного) праймера совместно с Bfor: 5'-GCAATTGTCGACCATGGATACAAATACTGGTGATCAGCAAACTGAACA-GG-3', содержащим сайты рестрикции SalI (курсив) и NcoI (жирный шрифт). Полученный продукт из 1700 п.н. гидролизовали с помощью SalI и PstI и лигировали с соответствующими сайтами pBluescript II SK+ с получением pBSP1600. Амплифицированный продукт 420 п.н. также использовали в качестве прямого праймера совместно с BrevBamHI 5'-GGACTGTTATCACTATTATTATTTCCGGCC-3', соответствующего последовательности, расположенной на 70 п.н. ниже сайта рестрикции BamHI. Полученный продукт (~1500 п.н.) гидролизовали с помощью PstI и BamHI и лигировали с соответствующими сайтами pBluescript II SK+ с получением pBPB1000. Третий фрагмент получали с помощью праймеров BforBamHI 5'-CGCTATGTAATTGAACAGAGTATTGCTGC-3', соответствующего последовательности, расположенной на 200 п.н. ниже сайта рестрикции BamHI, и BRevHis 5'-CCTCCTTTCTAGATCTATTAGTGATGGTGATGGTGATGGTTGTTAAAGTTTAATG AAATTGCAGTTGG-3', содержащего сайты XbaI (курсив) и BglI (жирный шрифт) и метку из 6 остатков гистидина (подчеркнуто). Полученный продукт из 2300 п.н. гидролизовали с помощью BamHI и XbaI и лигировали с соответствующими сайтами pBluescript II SK+ с получением pBBX2300. Полный ген собирали следующим образом: pBPB1000 гидролизовали с помощью PstI и BamHI, и полученный фрагмент лигировали в pBSP1600, гидролизованную теми же ферментами рестрикции, с получением pBSB2600 (содержащей первый и второй фрагмент). Затем плазмиду pBBX2300 гидролизовали с помощью BamHI и SacII (сайты, имеющиеся в плазмиде и используемые вместо XbaI), и фрагмент лигировали в pBSB2600 с получением pBSS4900, содержащей полноразмерный ген gtfB. Эту плазмиду гидролизовали с помощью NcoI и BglII, и ген gtfB лигировали в сайты NcoI и BamHI pET15b с получением pET15B-GTFB.
Экспрессия и очистка GTFB. Ночную культуру E. coli BL21star (DE3), содержащую (мутантный) GTFB {Kralj, 2004}, разбавляли 1/100. Клетки выращивали до ОП600 0,4 и индуцировали 0,2 мМ IPTG, и после 4 часов выращивания клетки собирали центрифугированием (10 мин при 4°С при 10000×g). Белки экстрагировали обработкой ультразвуком и очищали с помощью Ni-NTA и анионобменной хроматографии, как описано ранее для GTFA (рейтерансахаразы) из Lactobacillus reuteri 121 {Kralj, 2004}, со следующими модификациями: для анионообменной хроматографии использовали 1 мл колонку Hi-trapTM Q HP (Ge Healthcare).
(i) Оптимумы pH и температуры. Оптимумы pH и температуры были определены количественным определением с помощью ТСХ количества олиго- и полисахаридов, синтезированных из 25 мМ мальтотетраозы после инкубации в течение ночи (данные не показаны).
(ii) Продукты, синтезированные из мальтоолигосахаридов и других олигосахаридов. Инкубация с одним субстратом. 90 нМ GTFB инкубировали раздельно с 25 мМ сахарозы (Acros), раффинозы (Sigma), туранозы (Sigma), палатинозы (Sigma), панозы (Sigma), 0,25% амилозы-V (Avebe, Foxhol, The Netherlands), 0,25% амилопектина, 25 мМ изомальтопентаозы, изомальтогексаозы (Sigma), мальтоолигосахаридами с разной степенью полимеризации (G2-G7) в 25 мМ NaAc pH 4,7 1 мМ CaCl2 при 37°C и анализировали с помощью ТСХ. Продукты, синтезированные по прошествии длительного времени из G6 и G7, анализировали с помощью ТСХ и HPAEC.
Исследование доноров/акцепторов. 90 нМ GTFB и 25 мМ глюкозы и мальтоолигосахаридов с разной степенью полимеризации (G2-G7) инкубировали совместно с 0,25% амилозой-V в течение ночи в 25 мМ NaAc pH 4,7 1 мМ CaCl2 при 37°С и анализировали с помощью ТСХ.
(i) Характеристика олигосахаридов и полисахаридов, полученных из G7. Очищенные препараты фермента GTFB (90 нМ) инкубировали в течение 7 дней с 150 мМ G7 (Sigma) с использованием условий, описанных выше, для ферментного анализа. Олиго- и полисахариды, продуцированные очищенной рекомбинантной GTFB, разделяли осаждением 96% этанолом (осаждается наиболее крупный сахаридный продукт) {van Geel-Schutten, 1999}.
(ii) Анализ метилированием. Олиго- и полисахариды предварительно метилировали с использованием метилйодида и димезила натрия (CH3SOCH2·-Na+) в ДМСО при комнатной температуре {Kralj, 2004}.
Результаты
Выравнивание GTFB
GTFB является первым представителем группы гомологичных ферментов, обнаруженных в разных Lactobacilli. Выравнивание членов этой новой группы ферментов с другими глюкансахаразами выявило сходство, а также некоторые характерные различия. Три каталитических остатка, имеющихся в глюкансахаразах (D1024, E1061 и D1133, в описании используется нумерация GTFA L. reuteri 121, если это не указано иначе), присутствуют также в группе α-глюканотрансфераз (D1015, E1053 и D1125, нумерация GTFB L. reuteri 121). Тем не менее, большое количество аминокислотных остатков, консервативных для глюкансахаразы в областях I, II, III и IV, отсутствует в группе ферментов α-глюканотрансферазы (фиг.1). В области II (заключающей предполагаемый нуклеофильный остаток) консервативный V1025 (Pro в GTFA и GTFO) в α-глюканотрансферазах заменен аланином. Область III, расположенная ниже предполагаемого кислотно-основного катализатора E1061, в глюкансахаразах и α-глюканотрансферазах совершенно различна.
Тем не менее, большое количество аминокислотных остатков, консервативных для областей I, II, II и IV глюкансахараз, отсутствует в α-глюканотрансферазной группе ферментов (фиг.1). В области II (заключающей предполагаемый нуклеофильный остаток) консервативный P1025 (Pro в GTFA и GTFO, Val в большинстве GTF) в α-глюканотрансферазах заменен аланином. Область III, расположенная ниже предполагаемого кислотно-основного катализатора E1061, в глюкансахаразах и α-глюканотрансферазах совершенно различна. Консервативный триптофан 1063 в α-глюканотрансферазах заменен остатком тирозина (фиг.1). В области IV гомологи GTFB содержат пробел непосредственно выше расположения остатка Q1137, а на месте консервативного глутамина находится остаток лизина.
Поиски в банках данных последовательностей генов и белков позволили обнаружить несколько последовательностей, которые могут обладать теми же каталитическими свойствами, что и GTFB. Информация основывается на филогенетическом древе всех 70 членов семейства гликозидгидролаз (в базе данных Pfam на 27 апреля 2010 г доступно 108 последовательностей). На сервере Pfam также доступно филогенетическое древо, см. фиг.2.

Из 9 последовательностей, подобных GTFB, предполагаемая декстрансахараза из Lactobacillus reuteri DSM 20016 (№ 5 в таблице) была клонирована и экспрессирована в Escherichia coli. Рекомбинантный белок был очищен сочетанием аффинной и анионообменной хроматографии. Очищенный белок проявил GTFB-подобную активность при инкубации с мальтоолигосахаридами. Предполагаемая декстрансахараза из Lactobacillus reuteri DSM 20016 не проявила активности на сахарозе, но вместо этого она использует мальтозу, мальтотриозу, мальтотетраозу, мальтопентаозу, мальтогексаозу и мальтогептаозу в качестве субстрата с образованием лестницы из более коротких и более длинных продуктов. Протонный ЯМР анализ продуктов показал, что были введены α-1,6-гликозидные связи, как это наблюдалось также при инкубации с GTFB. Более того, предполагаемая декстрансахараза из Lactobacillus reuteri DSM 20016 также увеличивала процент α-1,6-гликозидных связей в растворимом картофельном крахмале от Sigma-Aldroch.
Клонирование и экспрессия GTFB
Полноразмерная GTFB, укороченная с N-конца версия и предполагаемый нуклеофильный мутант GTFB были последовательно сконструированы и экспрессированы. И полноразмерный, и укороченный с N-конца варианты проявили явную активность на мальтоолигосахаридах по данным измерений с помощью ТСХ (данные не показаны). Сконструированная укороченная версия GTFB (GTFB-ΔN) не экспрессировалась столь же эффективно, как полноразмерная GTFB, и поэтому все эксперименты проводили с использованием полноразмерной GTFB. Для исключения любой фоновой активности, возникающей от самой E. coli, была очищена пустая плазмида pET15b, и уже после очистки с помощью метки His не было выявлено активности на мальтоолигосахаридах (G2-G7) (данные не показаны). Более того, очищенный полноразмерный D1015N (предполагаемый) нуклеофильный мутант не проявил активности на мальтоолигосахаридах (G2-G7; данные не показаны).
Ферментативные свойства
Оптимальная активность GTFB на мальтотетраозе в качестве субстрата по данным количественного определения с помощью ТСХ наблюдалась при температуре 30-37°С и pH 4-5 (данные не показаны). Сочетания разных температур и pH буферов дали оптимальную активность при температуре 37°С и pH 4,7, которые использовали во всех последующих тестах.
Донорные субстраты
Поскольку ранее уже было показано, что GTFB неспособна использовать сахарозу в качестве донорного субстрата {Kralj, 2004}, активность тестировали на разных аналогах сахарозы (туранозе, палатинозе) и раффинозе. Заявители не смогли выявить активность на любом из этих субстратов (данные не показаны). Активность также не наблюдалась на изомальтоолигосахаридных (IG5 и IG6) субстратах (данные не показаны). Также не была обнаружена активность на олигосахаридах из частично очищенного гидролизата рейтерана (GTFA) и панозе (данные не показаны). Однако на линейных мальтоолигосахаридах явная активность наблюдалась уже после небольших периодов инкубации. Различные олигосахариды синтезировались в особенности на мальтоолигосахаридах со степенью полимеризации 4 и выше (фиг.3). Начиная с DP 6 и более, помимо олигосахаридов также начинало накапливаться более крупное полимерное вещество. На амилозе-V (Avebe, Foxhol, The Netherlands) также наблюдалась низкая активность (высвобождение преимущественно G1 и G2) (фиг.5). На одной мальтозе активность практически не наблюдалась. Однако при одновременной инкубации амилозы-V с глюкозой или мальтозой был синтезирован ряд олигосахаридов (фиг.5). При использовании амилозы-V в качестве донора и глюкозы в качестве акцептора были синтезированы большие количества мальтозы по сравнению с инкубацией только с амилозой-V, что указывает на способность синтеза (α1→4). На одной только амилозе-V G3 практически не высвобождалась. Инкубация амилозы-V с мальтозой в качестве акцептора явно дала панозу и G3, что указывает на способность GTFB синтезировать помимо панозы (указывающей на способность синтеза (α1→6)) также и мальтотриозы, что демонстрирует способность фермента синтезировать (α1→4) гликозидные связи.
Характеристика продукта G6 и G7 во времени
Первыми продуктами реакции на G6 были G1 (глюкоза) и G5 (мальтопентаоза) (фиг.4). Также на G7 первыми высвобожденными продуктами были G1 (глюкоза) и G6 (мальтогексаоза). Позднее на G6 появлялись также другие мальтоолигосахариды, такие как G2, G3 и G4. Были также идентифицированы неизвестные сахариды, следующие за G7 и G8, которые помимо (α1→4) гликозидных связей должны также содержать другие связи, на что указывает сдвиг во времени их задержки.
После инкубации мальтогептаозы с GTFB в течение 120 час 1D1H-ЯМР спектр суммарной смеси продуктов (фиг.7) указал на наличие вновь образованных (α1→6) связей по уширенному сигналу при δH-1~4,96. Сигнал (α1→4) находится в области δH-1~5,39. После 120 час инкубации отношение (α1→4): (α1→6) составляет 67:33 в смеси продуктов. Анализ смеси продуктов с помощью MALDI-TOF МС выявил наличие соединений в диапазоне от DP2 до DP35 (m/z 365 - m/z 5711, [M+Na]+).
В реакционной смеси, полученной после инкубации MOS DP7 с рекомбинантной GTFB, с помощью ЯМР спектроскопии можно было подробно выяснить структуру семнадцати соединений (фиг.6), варьирующих от DP2 до DP10. Выясненные структуры составляют лишь часть от общего количества образовавшихся соединений. Имеются продукты с большей молекулярной массой, включая полисахариды. Ясно, что олигосахариды, меньшие G7, должны возникать в результате гидролитической активности GTFB на субстрате [продукты, содержащие только (α1→4)], а также в результате гидролитической активности на образовавшихся олигосахаридах [продукты, содержащие (α1→4) и (α1→6)]. Следует отметить, что не было обнаружено структур, содержащих 6-замещенный восстанавливающий концевой остаток глюкозы. К настоящему времени была обнаружена лишь одна структура (DP8), содержащая (α1→6) присоединенный остаток глюкозы, удлиненный последовательно (α1→4)-присоединенными остатками глюкозы. В других случаях имело место лишь (последовательное) (α1→6) удлинение. Все олигосахариды содержат 4-замещенный остаток глюкозы на восстанавливающем конце. Однако в спектре 1D1H ЯМР (фиг.7) суммарной смеси продуктов была обнаружена концевая восстанавливающая -(1→)-D-Glc единица (H-1α при δ 5,240 и H-1β при δ 4,669), но эта единица не была обнаружена в выясненных структурах.
Таким образом, рекомбинантная GTFB катализирует расщепление лишь (α1→4) связей и инициирует образование новых (α1→4) и (α1→6) связей. Этим путем образуются многие продукты, варьирующие от моносахарида до полисахарида (DP>30). Продукт с данной молекулярной массой может иметь разные структуры, как четко показано для образующихся DP7- и DP8-олигосахаридов (-альдитолов). Более того, наблюдалось, что количество (α1→6) связей относительно (α1→4) связей возрастает при увеличении длины цепи вплоть до максимума 50:50. Не вводятся точки ветвления 4,6 или другого типа. Факт, что рекомбинантный фермент GTFB проявил сходную активность на свободных мальтоолигосахаридах и на их восстановленных формах (мальтоолигосахарид-альдитолах), демонстрирует механизм элонгации без восстанавливающего конца.
На основании представленных выше результатов могут быть сделаны следующие важные заключения:
- не обнаружено структур, содержащих 6-замещенный концевой восстанавливающий остаток глюкозы;
- GTFB катализирует расщепление лишь (α1→4) связей и инициирует образование новых (α1→4) и (α1→6) связей;
- количество (α1→6) связей относительно (α1→4) связей возрастает при повышении длины цепи до максимума 50:50;
- не вводятся 4,6- или другие типы точек ветвления;
- GTFB имеет механизм элонгации без восстанавливающего конца.
Введение GTFB-подобной активности в GTFA посредством белковой инженерии
Предшествующие исследования по белковой инженерии показали, что аминокислотные остатки, расположенные в консервативной области III и IV последовательности (см. фиг.1 на предмет выравнивания последовательности), контролируют специфичность в отношении продукта ферментов GTF в плане типа образующейся гликозидной связи. Кроме того, область I и область II содержат аминокислотные остатки, которые вносят вклад в активность фермента и специфичность реакции. Аминокислотные остатки консервативных областей последовательности формируют часть области связывания акцепторного субстрата ферментов GTF. В реакции полимеризации с использованием сахарозы в качестве субстрата эти остатки взаимодействуют с глюкозной (субсайт -1) и фруктозной (субсайт +1) частью сахарозы. Поскольку GTFB использует мальтогептаозу (и другие мальтоолигосахариды) в качестве субстрата, глюкозная часть должна взаимодействовать с акцепторными субсайтами фермента GTFB. Поэтому наиболее вероятно, что уникальная субстратная специфичность GTFB по сравнению с обычными GTF определяется различиями в акцепторных субсайтах. Таким образом, для введения GTFB-подобной активности в обычный фермент GTFA предусматривается замена остатков в акцепторных субсайтах, расположенных в областях I, II, III и IV, для придания сходства с ферментом GTFB.
Более того, 3D структура GTF180 (Vujicic, PhD thesis University of Groningen) показывает наличие нескольких дополнительных остатков, взаимодействующих в субсайтах -1 и +1, которые, по-видимому, важны для взаимопревращения реакционной специфичности GTF. Мутация 981 L→V основывается на взаимодействии, наблюдаемом в 3D-структуре GTF180, где Leu981 посредством сил Ван-дер-Ваальса взаимодействует с фруктозильной частью сахарозы. В GTFB это положение занято остатком валина, как и в других α-глюканотрансферазах GTFDSM, GTF106B, GTFML4. Мутации 1463 D→R, T или M предназначены для замены остатка аспартата, который высококонсервативен в глюкансахаразах, но не в GTFB и родственных ферментах, и взаимодействует с глюкозной частью в субсайте -1 в 3D структуре GTF180.
Кроме того, мутации можно комбинировать любым образом для получения более выраженного действия в отношении изменения реакционной специфичности ферментов GTF. Предлагаются следующие мутации:
Область I:
положение W1510:W→I/L
положение P1512:P→
положение D1513:D→N
Область II
положение 1026: P→A
Область III
положение 1062: D→G
положение 1063: W→Y
положение 1064: N→H
положение 1062-1064 DWN→GYH
Область IV
положение 1134: N→Q
положение 1135: N→R
положение 1136: S→делеция этого остатка
положение 1134-1136: NNS→QR
положение 1137: Q→К
3D структура
положение 981: L→V
положение 1414: N→L
положение 1463: D→R, T или M
Ссылки
Arguello-Morales M.A, Remaud-Simeon M, Pizzut S, Sarcabal P. & Monsan P. (2000) FEMS Microbiol. Lett. 182, 81-85.
Ausubel F.M., Brent R.E., Kingston D.D., Moore J.G., Seidman J.G., Smith J.A., & Struhl K. (1987) Current protocols in molecular biology. John Wiley & Sons, Inc, New York.
Barends T.R, Bultema J.B, Kaper T, van der Maarel M.J, Dijkhuizen L. & Dijkstra B.W. (2007) J. Biol. Chem. 282, 17242-17249.
Fabre E, Bozonnet S, Arcache A, Willemot R.M, Vignon M, Monsan P. & Remaud-Simeon M. (2005) J. Bacteriol. 187, 296-303.
van Geel-Schutten G.H, Faber E.J, Smit E, Bonting K, Smith M.R, Ten Brink B, Kamerling J.P, Vliegenthart J.F & Dijkhuizen L. (1999) Appl. Environ. Microbiol. 65, 3008-3014.
Hard K, Van Z.G, Moonen P, Kamerling J.P. & Vliegenthart F.G. (1992). Eur. J. Biochem. 209, 895-915.
Hondoh H, Kuriki T & Matsuura Y. (2003) J. Mol. Biol. 326, 177-188.
van Hijum S.A, Kralj S, Ozimek L.K, Dijkhuizen L. & van Geel-Schutten I.G. (2006). Microbiol. Mol. Biol. Rev. 70, 157-176.
Kaditzky S., Behr J., Stocker A., Kaden P., & Vogel R.F. Food Biotechnol. 22[4], 398-418, 2008.
Kamerling J.P. & Vliegenthart J.F. (1989) Mass Spectrometry. In Clinical Biochemistry - Principles, Methods, Applications. (Lawson A.M., ed), pp.176-263. Walter de Gruyter, Berlin.
Kelly R.M, Dijkhuizen L. & Leemhuis H. (2009). J. Biotechnol. 140, 184-193.
Kralj S, van Geel-Schutten GH, Rahaoui H, Leer R.J, Faber E.J, van der Maarel M.J. & Dijkhuizen L. (2002) Appl. Environ. Microbiol. 68, 4283-4291.
Kralj S, van Geel-Schutten G.H, van der Maarel M.J. & Dijkhuizen L. (2003). Biocatal. Biotransform. 21, 181-187.
Kralj S, van Geel-Schutten G.H, Dondorff M.M, Kirsanovs S, van der Maarel M.J. & Dijkhuizen L. (2004) Microbiology 150, 3681-3690.
Kralj S, van Geel-Schutten G.H, van der Maarel M.J. & Dijkhuizen L. (2004) Microbiology 150, 2099-2112.
Kralj S, Stripling E, Sanders P, van Geel-Schutten GH & Dijkhuizen L. (2005). Appl. Environ. Microbiol. 71, 3942-3950.
van Leeuwen S.S, Kralj S, van Geel-Schutten I.H, Gerwig G.J, Dijkhuizen L. & Kamerling J.P. (2008) Carbohydr. Res. 343, 1237-1250.
van Leeuwen S.S, Kralj S, van Geel-Schutten I.H, Gerwig G.J, Dijkhuizen L. & Kamerling J.P. (2008) Carbohydr. Res. 343, 1251-1265.
van Leeuwen S.S, Leeflang B.R, Gerwig G.J. & Kamerling J.P. (2008) Carbohydr. Res. 343, 1114-1119.
Linden A, Mayans O, Meyer-Klaucke W, Antranikian G. & Wilmanns M. (2003). J. Biol. Chem. 278, 9875-9884.
MacCregor E.A, Jespersen H.M. & Svensson B. (1996) FEBS Lett. 378, 263-266. MacGregor E.A, Janecek S. & Svensson B. (2001) Biochim. Biophys. Ada 1546, 1-20.
Monchois V, Willemot R.M. & Monsan P. (1999) FEMS Microbiol. Rev. 23, 131-151.
Moore A.D, Bjorklund A.K, Ekman D, Bornberg-Bauer E. & Elofsson A. (2008). Trends Biochem. Sci. 33, 444-451.
Peisajovich S.G, Rockah L. & Tawfik D.S. (2006) Nat. Genet. 38, 168-174.
Pijning T, Vuijicic-Zagar A, Kralj S, Eeuwema W, Dijkstra B.W. & Dijkhuizen L. (2008). Biocatal. Biotransform. 26, 12-17.
Przylas I, Tomoo K, Terada Y, Takaha T, Fujii K, Saenger W. & Strater N. (2000) J. Mol. Biol. 296, 873-886.
Rondeau-Mouro C, Veronese G. & Buleon A. (2006) Biomacromolecules. 7, 2455-2460.
Sambrook J., Fritsch E.F., & Maniates T. (1989) Molecular cloning: a laboratory manual, 2 edn. Cold Spring Harbor Laboratory Press, New York.
Sarkar G. & Sommer S.S. (1990). Biotechniques 8, 404-407.
Stam M.R, Danchin E.G, Rancurel C, Coutinho P.M. & Henrissat B. (2006) Protein Eng Des Sel. 19, 555-562.
Tokuriki N. & Tawfik D.S. (2009). Science. 324, 203-207.
Uitdehaag J.C, Mosi R, Kalk K.H, van der Veen B.A, Dijkhuizen L, Withers S.G. & Dijkstra B.W. (1999) Nat. Struct. Biol. 6, 432-436.
Vuijicic-Zagar A, 2007. University of Groningen. PhD Thesis/Dissertation.
Реферат
Группа изобретений относится к области биотехнологии. Предложен способ получения смеси глюкоолигосахаридов, содержащих две или более последовательных (α1→6) гликозидных связей и две или более последовательных (α1→4) гликозидных связей. Вводят в контакт поли- и/или олигосахарид, включающий на невосстанавливающем конце по меньшей мере две (α-1→4)-связанные единицы D-глюкозы, с ферментом α-глюканотрансферазой. Указанный фермент является GTFB типом фермента и расщепляет (α1→4) и создает новые (α1→4) и (α1→6) гликозидные связи. Предложены выделенные линейные глюкоолигосахариды и их смеси, получаемые указанным способом, их применение в качестве волокна-пребиотика, в том числе в пищевой композиции. Также предложен генетически модифицированный GTFA-подобный глюкансахаразный фермент, включающий по меньшей мере две мутации, указанные в формуле изобретения, и обладающий GTFB-подобной активностью. Указанный модифицированный фермент расщепляет (α1→4) и создает новые (α1→4) и (α1→6) гликозидные связи, используя в качестве субстрата поли- и/или олигосахариды, включающие (α1→4)-связанные единицы D-глюкозы на своем невосстанавливающем конце. Изобретения позволяют получать частично неперевариваемые производные крахмала, без введения точек ветвления (α1→6), (α1→2) или (α1→3) связи. 8 н. и 11 з.п. ф-лы, 2 табл., 8 ил.
Формула

где пронумерованное положение соответствует GTFA Lactobacillus reuteri 121, причем указанный мутантный фермент обладает GTFB-подобной активностью и способен расщеплять (α1→4) гликозидные связи и создавать новые (α1→4) и (α1→6) гликозидные связи и характеризуется субстратной предпочтительностью для поли- и/или олигосахаридных субстратов, включающих (α1→4)-связанные единицы D-глюкозы на своем невосстанавливающем конце, в частности мальтоолигосахариды.
Документы, цитированные в отчёте о поиске
Агент для образования термообратимого геля и продукт в форме термообратимого геля

Комментарии