Везикула, пригодная для лекарственного средства для наружного применения на коже, и лекарственное средство для наружного применения на коже, включающее везикулу - RU2449782C2
Код документа: RU2449782C2
Описание
Область техники
Настоящее изобретение относится к способу получения лекарственной формы для наружного применения на коже и особенно к применению везикулы. Настоящее изобретение также относится к лекарственному средству для наружного применения на коже, полученной способом получения лекарственной формы.
Уровень техники
Кожа является важной тканью, разделяющей живой организм и окружающий мир. Соответственно, если кожный покров подвергается нарушению, это означает, что защитный барьер живого организма разрушается и нарушение может быть причиной серьезного повреждения живого организма. В связи с этим такие нарушения, как повреждения кожного покрова должны быть быстро устранены. Однако функция защитного барьера кожи становится препятствием для проникновения лекарства для устранения нарушения в верхних кожных слоях, особенно в дермисе и, следовательно, условие, которое приводит к смягчению устранения нарушения происходит тяжело. Соответственно, необходимо разработать методику аккуратной доставки лекарства к дермису.
Учитывая вышеупомянутые условия в качестве уровня техники, проводятся различные разработки средств, ускоряющих впитывание через кожу. Примером служит способ, включающий применение структуры «карточного домика» или сетчатой структуры, образованной гелем на основе масла (патентный документ 1); способ, включающий использование звуковой волны в качестве движущей силы для впитывания через кожу (патентный документ 2); способ, включающий использование растворителя, такого, как N-метил-2-пирролидон (патентный документ 3); способ, включающий использование ингредиента, способствующего впитыванию через кожу, такого, как лаурил саркозин (патентный документ 4); и способ, позволяющий липосоме или ниосоме, которая представляет собой сферу, имеющую фосфолипидную бислойную структуру, включая водный слой, инкапсулировать лекарство в водном слое и смешивать получающийся в результате препарат для наружного применения на кожу (патентный документ 5). Эти методы способствуют улучшению в степени достаточно далекой от удовлетворительной и во многих случаях вышеупомянутые способы для ускорения впитывания через кожу ослабляют защитную функцию самого кожного покрова.
С другой стороны, в качестве способа получения лекарственной формы с использованием везикулы известен способ, в котором нерастворимые ингредиенты, такие, как церамид и фитостерол целенаправленно смешивают в лекарственном средстве для наружного применения на коже (патентный документ 6 и патентный документ 7). Кроме того, также известен способ, в котором ингредиент, способный вступать в реакцию с водой, инкапсулируют в везикулу для стабилизации содержания везикулы в препарате на водной основе (патентный документ 8). Однако в этих способах применения везикул поверхностно-активное вещество для образования везикулы представляет собой катионное поверхностно-активное вещество. Соответственно, его применение, за исключением в качестве моющего средства, затруднительно и было много случаев, когда стабильность самой везикулы была проблематичной. В результате возникает сложность при применении везикулы для лекарственного средства для наружного применения на коже, которое невозможно смыть.
С другой стороны, везикула, которая содержит α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин и/или его соль вообще не известна.
Необходимо отметить, что экстракт Сoptis (Ranunculaceae), экстракт Citrus aurantium (Rutaceae), экстракт красных водорослей и экстракт Houttuynia (Saururaceae) обладают способностью к регулированию концентрационного градиента ионов кальция в эпидермисе для усиления защитной функции кожного барьера (патентный документ 9). Известно, что экстракт Rosmarinus officinalis обладает способностью подавлять разложение эластина (патентный документ 10). Известно, что экстракт Betula alba обладает способностью подавлять реакцию Майларда (патентный документ 11). Известно, что экстракты Achillea и Ophiopogon обладают способностью удлинять дендрит в меланоците (патентный документ 12 и патентный документ 13). Известно, что экстракт Syzygium aromaticum и тритерпены, такие, как олеанолевая кислота, бетулиновая кислота и бетулин обладают способностью восстанавливать коллагеновые пучки волокон дермиса (патентный документ 14 и патентный документ 15). Известно, что природный белковый гидролизат обладает способностью ингибировать эластазу (патентный документ 16). Известно, что пантетеин сульфонат или его производное и глицерритиновая кислота или ее производное обладают способностью подавлять фактор аллергического воспаления. Известно, что гидрохинон или гликозид, эскулин, эскулетин, глабридин, метоксисалицилловая кислота, транексамовая кислота или их производные обладают способностью элиминировать активный кислород для предотвращения окислительного стресса, происходящего в дермисе (патентный документ 17).
[Патентный документ 1] JP 2000-103722 A.
[Патентный документ 2] JP H11-335271 A.
[Патентный документ 3] JP H10-265379 A.
[Патентный документ 4] JP H09-169637 A.
[Патентный документ 5] JP 2004-143080 A.
[Патентный документ 6] JP 2006-199635 A.
[Патентный документ 7] JP 2006-199634 A.
[Патентный документ 8] JP H09-40543 A.
[Патентный документ 9] JP 2006-331294 A.
[Патентный документ 10] JP 2005-132823 A.
[Патентный документ 11] JP 2005-35911 A.
[Патентный документ 12] JP 2003-113027 A.
[Патентный документ 13] JP 2004-250354 A.
[Патентный документ 14] JP 2002-29988 A.
[Патентный документ 15] JP H09-143050 A.
[Патентный документ 16] JP 2004-182687 A.
[Патентный документ 17] JP 2000-344653 A.
Раскрытие сущности изобретения
Настоящее изобретение может быть успешно выполнено, принимая во внимание вышеупомянутые обстоятельства, а объект по настоящему изобретению обеспечивает способ, который позволяет активному ингредиенту достичь дермиса для улучшения или поддержания кожной среды.
Принимая во внимание вышеупомянутые обстоятельства, авторы настоящего изобретения подробно изучили способ, который позволяет активному ингредиенту достигнуть дермиса для улучшения или поддержания кожной среды и в результате они обнаружили, что следующие везикулы имеют свойство проникать в дермис и превосходно инкапсулировать активный ингредиент и в дополнение к этому обладают способностью уравновешивать кожное окружение в самой везикуле везикула, включающая: 1) α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин и/или его соль, 2) церамид и/или его производное, и 3) один или более эфиров, выбранных из глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и глицеринового эфира пироглутаминовой кислоты. Таким образом, настоящее изобретение выполнено, а именно настоящее изобретение состоит в следующем.
(1) Везикула, включающая:
1) α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин и/или его соль;
2) церамид и/или его производное; и
3) один или более эфиров, выбранных из глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и глицеринового эфира пироглутаминовой кислоты.
(2) Везикула, в соответствии с п.(1), в которой ацильная группа в α,ε-бис(γ-N-(C10-30)ацилглутамил)лизине представляет собой лауроильную группу.
(3) Везикула в соответствии с п.(1) или (2), в которой церамид или его производное представляет собой церамид типа 2 или церамид типа 3.
(4) Везикула, в соответствии с одним из пп.(1)-(3), в которой один или более эфиров выбран из глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и глицеринового эфира пироглутаминовой кислоты, а глицериновый эфир пироглутаминовой кислоты представляет собой один или более эфиров, выбранных из моноолеата диглицерина, моноизостеарата декаглицерина, пентаолеата декаглицерина и пентаизостеарата декаглицерина.
(5) Везикула, в соответствии с одним из пп.(1)-(3), дополнительно включающая один или более следующих активных ингредиентов для улучшения или поддержания кожного окружения: экстракт Сoptis (Ranunculaceae); экстракт Citrus aurantium (Rutaceae); экстракт красных водорослей; экстракт Houttuynia (Saururaceae); экстракт Rosmarinus officenalis (Lamiaceae); экстракт Betula alba (Betulaceae); экстракт Achillea (Asteraceae); экстракт Syzygium aromaticum (Myrtaceae); экстракт Centella (Umbelliferae); экстракт Engelhardtia chrysolepis (Juglandaceae); экстракт Ophiopogon (Liliaceae); природный белковый гидролизат или его ациллированный продукт; олеанолевая кислота или ее производное; бетуллин; бетуллиновая кислота или ее производное; пантетеин сульфонат или его производное; глицерритиновая кислота или ее производное; гидрохинон или его гликозид; эскулин; эскулетин; глабридин; метоксисалицилловая кислота; транексамовая кислота или их производные; аскорбиновая кислота или ее производные; L-карнитин.
(6) Лекарственное средство для наружного нанесения на кожу, включающая везикулу в соответствии с любым из пп.(1)-(5).
Лучший вариант осуществления изобретения
(1) α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин, который представляет собой необходимый ингредиент везикулы по настоящему изобретению.
Лекарственное средство для наружного нанесения на кожу содержит α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин в качестве основного ингредиента. α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин может также содержаться в свободной форме или в виде соли. Его соль может быть использована без какого-либо ограничения при условии, что соль представляет собой любую, которая может быть использована для получения лекарственного средства для наружного нанесения на кожу. Например, предпочтительные варианты соли включают: соли щелочных металлов, такие, как натриевая соль или калиевая соль; соли щелочноземельных металлов, такие, как кальциевая соль и магниевая соль; соли органических аминов, такие, как аммониевая соль, триэтаноламиновая соль и моноэтаноламиновая соль; основные амино-кислотные соли, такие как соль лизина и соль альгиновой кислоты. Ацильная группа характеризуется включением в себя от 10 до 30 атомов углерода. Ацильная группа может быть линейной, разветвленной или циклической, или может быть насыщенной алифатической группой или ненасыщенной алифатической группой. Конкретные примеры ацильной группы включают деканоильную группу, лауроильную группу, миристоильную группу, стеароильную группу, бегеноильную группу, изостеароильную группу, олеоильную группу и линолеоильную группу. Из них лауроильная группа является наиболее предпочтительной. Однако α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин содержит две ацильные группы, а две ацильные группы могут быть одинаковыми или отличаться друг от друга. α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин может быть получен, например, по следующей процедуре, а именно процедура включает взаимодействие глутаминовой кислоты с хлорангидридом карбоновой кислоты в присутствии щелочи, такой, как триэтиламин с образованием в результате N-ацилглутаминовой кислоты и дальнейшее конденсирование N-ацилглутаминовой кислоты в присутствии лизина и реагента для пептидного синтеза, такого, как DCC в молярном соотношении 2:1. Полученный таким образом продукт реакции может быть очищен на колонке с силикагелем или подобной колонке. Растворитель для элюирования хроматографической колонки с силикагелем может быть предпочтительно представлять собой смесь хлороформ-метанол. Структура α,ε-бис(γ-N-(C10-30)ацилглутамил)лизина показана в формуле 1.
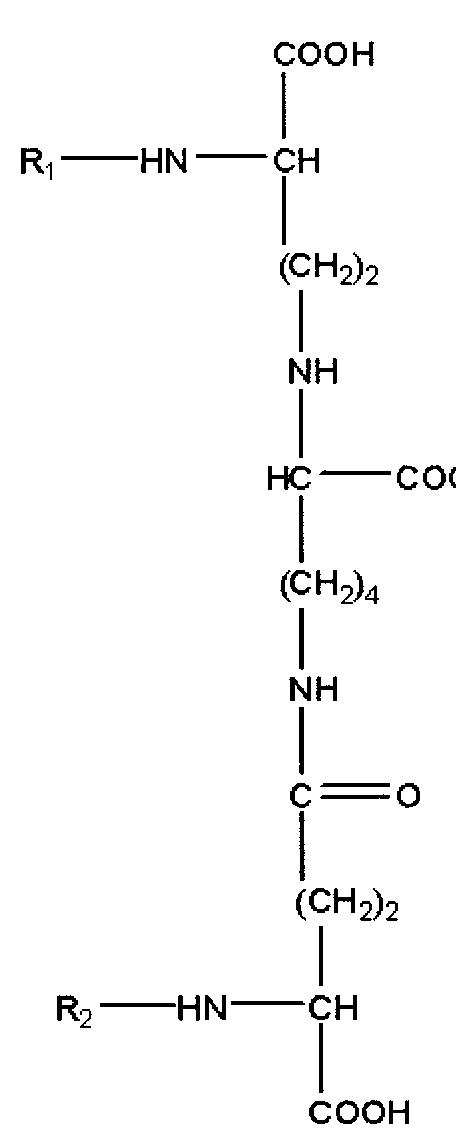
Формула 1 (однако, в формуле R1 и R2 каждый независимо друг от друга представляют собой ацильную группу, имеющую от 10 до 30 атомов углерода).
α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин может быть получен и использован в соответствии с вышеупомянутым способом. Однако в настоящее время существует коммерчески доступный α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин и коммерчески доступный продукт может быть приобретен и использован. Коммерчески доступный продукт, описанный выше, может быть предпочтительно представлен “Pellicer L-30” (производства фирмы Asahi Kasei Corporation; α,ε-бис(γ-N-лауроилглутамил)лизин). Таким образом, полученный α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин обладает свойством, которое способствует легкому образованию бислойной мембраны и таким образом, образованию везикулы, имеющей превосходную стабильность с остальными необходимыми ингредиентами, которые будут описаны далее. Везикула имеет физические свойства, приближающиеся к мембранной структуре эпидермальных клеток и, следовательно, превосходно увеличивает кожную проницаемость. В дополнение к этому везикула обладает превосходной функцией связывать активный ингредиент между липидным бислоем мембран. Это связано с амфифильным свойством самих липидных бислоев мембран. Кроме того, для того чтобы проявить такую функцию, везикула содержит один или более, выбранного из α,ε-бис(γ-N-(C10-30)ацилглутамил)лизина на суммарное количество везикулы, с учетом суммарного количества везикулы, предпочтительно 1 масс.% или более предпочтительно 5% в качестве нижнего предела содержания и предпочтительно 50 масс.% и наиболее предпочтительно 10 масс.% в качестве верхнего предела содержания. Это обусловлено тем, что имеются случаи, когда стабильная везикула может не образоваться даже, когда количество вышеупомянутых ингредиентов слишком велико или слишком мало.
(2) Церамид и его производное, которые представляют собой природные ингредиенты везикулы по настоящему изобретению.
Везикула по настоящему изобретению характеризуется содержанием церамида и его производного (в данном документе, иногда совместно именуемые, как «церамиды»). Известно, что существует семь основных типов церамидов, включающих от 1 типа до 7 типа (представлены следующими формулами 2-7), и каждый из них может быть использован. Среди них тип 2 особенно предпочтителен, а N-стеароилдигидроксисфингозин особенно предпочтителен. Эти церамиды являются коммерчески доступными и такие коммерчески доступные продукты могут быть закуплены и использованы. В качестве коммерчески доступных продуктов могут служить примером: «Церамид I»(производства фирмы Cosmo-Farm), cодержащий N-(27-октадеканоилоксигептакозаноил-)фитосфингозин, который является ингредиентом типа 1; «Церамид TIC-001» (производства фирмы Takasago International Corporation), содержащий N-cтеароил-дигидрокси-сфингозин, который является ингредиентом типа 2; «Церамид III» (производства фирмы Cosmo-Farm), содержащий N-cтеароил-фитосфингозин, который является ингредиентом типа 3; «Церамид IIIА» (производства фирмы Cosmo-Farm), cодержащий N-линолеоил-фитосфингозин, который является ингредиентом типа 3; «Церамид IIIВ» (производства фирмы Cosmo-Farm), содержащий N-олеоил-фитосфингозин, который является ингредиентом типа 3; и «Церамид IV» (производства фирмы Cosmo-Farm), содержащий N-2-гидроксистеароил-фитосфингозин, который является ингредиентом типа 6. Церамиды могут содержаться поодиночке или в комбинации по два или более. В везикуле по настоящему изобретению те ингредиенты, которые обладают способностью усиливать структуру везикулы, образованы α,ε-бис(γ-N-(C10-30)ацилглутамил)лизином. Для того чтобы проявить такой эффект везикула содержит церамиды в количестве по отношению к суммарному количеству везикулы, предпочтительно 1 масс.% или наиболее предпочтительно 5 масс.% в качестве нижнего предельного содержания и предпочтительно 50 масс.% или наиболее предпочтительно 10 масс.% в качестве верхнего предельного содержания. Если количество ингредиента слишком велико, то в некоторых случаях вышеупомянутый эффект может не проявляться. Кроме того, суммарное отношение массы церамидов к общей массе α,ε-бис(γ-N-(C10-30)ацилглутамил)лизина предпочтительно составляет от 2:1 до 1:50 и наиболее предпочтительно от 1:1 до 1:5.

Церамид типа 1
(R1представляет собой алкильную группу или алкенильную группу, а R2 представляет собой линолеоилоксиалкильную группу. Число атомов углерода в алкильной группе или алкенильной группе R1 обычно находится в диапазоне от 15 до 18, а число атомов углерода в линолеоилоксиалкильной группе R2 обычно находится в диапазоне от 45 до 50).
Церамид типа 2
(Каждый из R1и R2независимо друг от друга представляет собой алкильную группу или алкенильную группу. Число атомов углерода в алкильной группе или алкенильной группе, представленной R1или R2, обычно находится в диапазоне от 15 до 23).

Церамид типа 3
(Каждый из R1и R2независимо друг от друга представляет собой алкильную группу. Число атомов углерода в алкильной группе, представленной R1или R2, обычно находится в диапазоне от 15 до 23).

Церамид типа 4
(R1представляет собой алкильную группу, а R2 представляет собой линолеоилоксиалкильную группу. Число атомов углерода в алкильной группе, представленной R1, обычно находится в диапазоне от 15 до 23, а число атомов углерода в линолеоилоксиалкильной группе R2 обычно находится в диапазоне от 45 до 50).
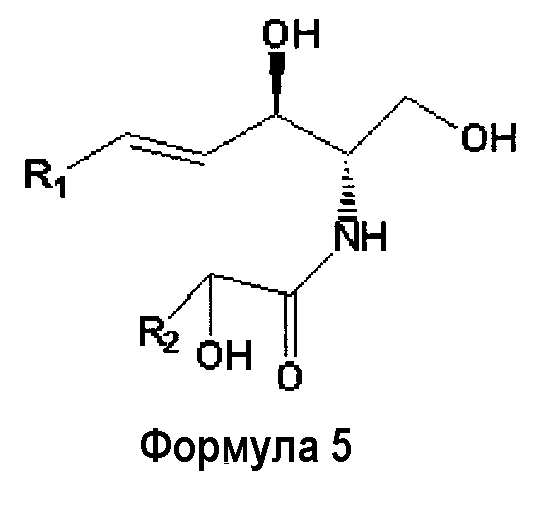
Церамид типа 5
(Каждый из R1и R2независимо друг от друга представляет собой алкильную группу. Число атомов углерода в алкильной группе, представленной R1или R2, обычно находится в диапазоне от 15 до 23).

Церамид типа 6
(Каждый из R1и R2независимо друг от друга представляет собой алкильную группу, а R3 представляет собой атом водорода или алкильную группу. Число атомов углерода в алкильной группе, представленной R1или R2, обычно находится в диапазоне от 15 до 22).

Церамид типа 7
(Каждый из R1и R2независимо друг от друга представляет собой алкильную группу. Число атомов углерода в алкильной группе, представленной R1или R2, обычно находится в диапазоне от 15 до 22).
Производные церамида, аналоги церамида или подобные, такие, как сфингозин, сфингомиелин, сфингозилфосфорилхолин, и те, что описаны, например в JP S64-228048 A, JP S63-216812 A, JP S63-227513 A, JP S64-29347 A, JP S64-31752 A и JP H8-319263 A являются предпочтительными примерами. Особенно примеры производных церамидов могут быть предпочтительно представлены ингредиентами следующей формулы 8 и ингредиентами следующей формулы 9.
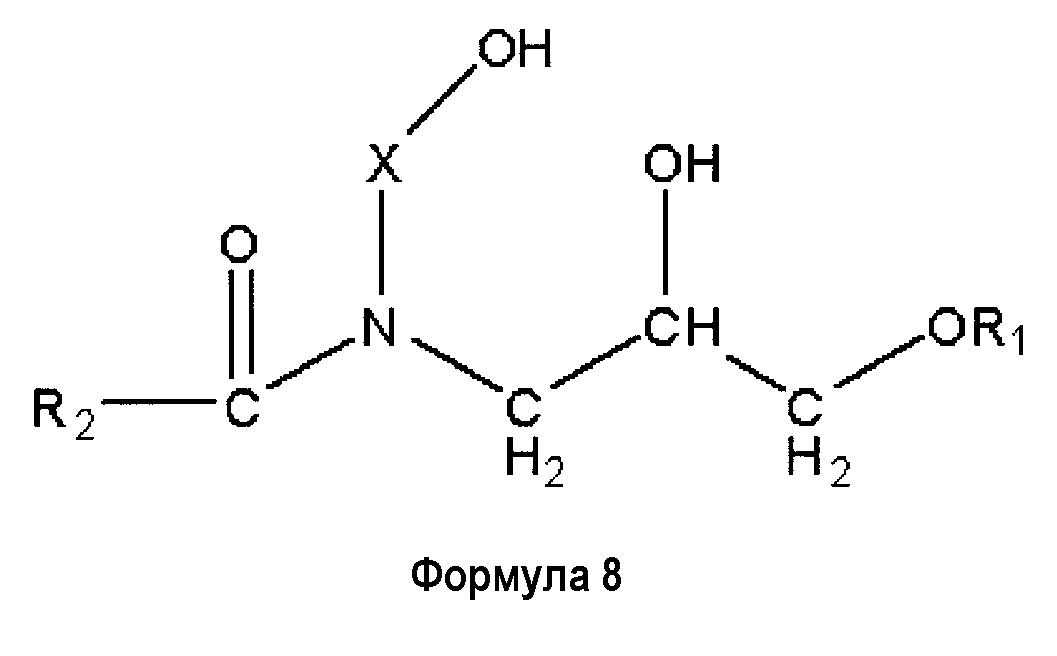
(но, в формуле, R1 представляет собой углеводородную группу, имеющую от 10 до 26 атомов углерода, R2 представляет собой углеводородную группу, имеющую от 9 до 25 атомов углерода, а Х представлен группой -(СН2)n-, в которой n имеет значение от 2 до 6).

(В формуле каждый из R1' и R2' независимо друг от друга представляет собой углеводородную группу, имеющую от 1 до 40 атомов углерода, который может быть гидроксилирован, R3представляет собой линейную или разветвленную алкиленовую группу, имеющую от 1 до 6 атомов углерода или простую связь, а R4представляет собой атом водорода, линейную или разветвленную алкоксильную группу, имеющую от 1 до 12 атомов углерода или 2,3-дигидроксипропильную группу. Однако R4представляет собой атом водорода, когда R3представляет собой простую связь).
Ингредиент, представленный формулой 8 или 9, может быть получен обычным методом в соответствии с контекстами вышеупомянутых патентных документов.
(3) Глицериновый эфир жирной кислоты, полиглицериновый эфир жирной кислоты и глицериновый эфир пироглутаминовой кислоты, которые представляют собой природные ингредиенты везикулы по настоящему изобретению.
Везикула по настоящему изобретению содержит в качестве природных ингредиентов один или более ингредиентов, выбранных из полиглицеринового эфира жирной кислоты и глицеринового эфира пироглутаминовой кислоты.
Предпочтительные примеры остатков жирной кислоты глицеринового эфира жирной кислоты включают остаток лауриновой кислоты, остаток миристиновой кислоты, остаток пальмитиновой кислоты, остаток стеариновой кислоты, остаток бегеновой кислоты, остаток изостеариновой кислоты, остаток олеиновой кислоты, остаток линолевой кислоты, а остаток линоленовой кислоты и остаток олеиновой кислоты, остаток стеариновой кислоты и остаток изостеариновой кислоты особенно предпочтительны.
Кроме того, степень полимеризации глицерина в полиглицерине полиглицеринового эфира жирной кислоты составляет предпочтительно от 2 до 20 и наиболее предпочтительно от 2 до 10. Кроме того, предпочтительные примеры остатков жирной кислоты включают остаток лауриновой кислоты, остаток миристиновой кислоты, остаток пальмитиновой кислоты, остаток стеариновой кислоты, остаток бегеновой кислоты, остаток изостеариновой кислоты, остаток олеиновой кислоты, остаток линолевой кислоты, а остаток линоленовой кислоты и остаток олеиновой кислоты, остаток стеариновой кислоты и остаток изостеариновой кислоты особенно предпочтительны. В полиглицериновом эфире жирной кислоты, описанном выше, предпочтительно, чтобы число жирнокислотных остатков на одну молекулу было больше, чем число свободных гидроксильных групп. Примерами таких специфических вариантов служат моно(ди)глицериновый эфир олеиновой кислоты, моно(ди)глицериновый эфир лауриновой кислоты, триглицериновый эфир дистеариновой кислоты, триглицериновый эфир диизостеариновой кислоты, три(пента)глицериновый эфир лауриновой кислоты, три(пента)глицериновый эфир стеариновой кислоты, три(пента)глицериновый эфир олеиновой кислоты, три(пента)глицериновый эфир изостеариновой кислоты, тетра(гепта)глицериновый эфир лауриновой кислоты, тетра(гепта)глицериновый эфир стеариновой кислоты, тетра(гепта)глицериновый эфир олеиновой кислоты, тетра(гепта)глицериновый эфир изостеариновой кислоты, пента(дека)глицериновый эфир лауриновой кислоты, пента(дека)глицериновый эфир стеариновой кислоты, пента(дека)глицериновый эфир олеиновой кислоты, а пента(дека)глицериновый эфир изостеариновой кислоты особенно предпочтителен.
Примеры ингредиентов, которые обладают таким же свойством, как и полиглицериновый эфир жирной кислоты включают глицериновые эфиры пироглутаминовой кислоты, такие, как глицериновый эфир пироглутамин-стеариновой кислоты и глицериновый эфир пироглутамин-олеиновой кислоты. Данные ингредиенты могут быть использованы в везикуле по настоящему изобретению.
Вышеупомянутые церамиды и α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин могут образовывать стабильную везикулу только в присутствии вышеупомянутого одного или более выбранного из глицеринового эфира жирной кислоты и пироглутаминового эфира жирной кислоты. Для того чтобы получить стабильную везикулу предпочтительно, чтобы суммарное количество содержащегося одного или более эфиров, выбранных из глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и пироглутаминового эфира жирной кислоты по отношению к общему количеству везикулы предпочтительно составляло от 5 до 30 масc.% и наиболее предпочтительно от 10 до 25 масc.%. Кроме того, отношение суммарной массы глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и пироглутаминового эфира жирной кислоты к общей массе α,ε-бис(γ-N-(C10-30)ацилглутамил)лизина составляло предпочтительно от 5:1 до 1:1 и наиболее предпочтительно от 4:1 до 2:1. Взаимодействие между двумя элементами приводит к упорядочению липидного бислоя мембраны. Таким образом, упорядоченные бислойные мембраны могут удерживать внутри себя активный ингредиент. Кроме того, данная совместимость между наружной стенкой бислойной мембраны и клеточным роговым слоем кожи дает везикуле превосходную проницаемость в роговом слое кожи. Кроме того, как церамиды, так и α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин проявляют предпочтительную функцию по отношению к дермису и, следовательно, даже когда везикула не содержит вышеупомянутый активный ингредиент, проявляющий превосходный эффект улучшения или поддержания кожного покрова.
Везикула по настоящему изобретению может быть везикулой, которая содержит один или более активных ингредиентов для улучшения или поддержания кожного покрова, в зависимости от ее назначения.
Фраза «улучшение или поддержание кожного покрова», в частности, охватывает следующее: усиление функции кожного барьера; блокирование распада эластина; блокирование реакции Майларда или корректирование неоднородности реакции Майларда; блокирование удлинения дендрита в меланоците; восстановление коллагенового пучка волокон дермиса; ингибирование эластазы; блокирование воспалительного фактора; этиминирование активного кислорода и аналогичное.
Специфические примеры вышеупомянутых активных ингредиентов включают, например, экстракт Сoptis (Ranunculaceae), экстракт Citrus aurantium (Rutaceae), экстракт красных водорослей (Раlmaria), экстракт Houttuynia (Saururaceae), экстракт Rosmarinus officinalis, экстракт Betula alba, экстракты Achillea millefolium, экстракт Syzygium (Myrtaceae), экстракт Hypericum (Clusiaceae), такой, как Hypericum perforatum,экстракт Centella (Apiaceae), экстракт Engelhardtia chrysolepis (Juglandaceae), экстракт Ophiopogon (Liliaceae), природные белковые гидролизаты или их ацилированные производные, гидролизаты протеинов шелка, гидролизат морского коллагена, олеанолевая кислота и ее производные, бетуллин, бетуллиновая кислота или ее производное, пантетеин сульфоновая кислота или ее производные, глицерритиновая кислота или ее производные; гидрохинон или его гликозид; эскулин; эскулетин; глабридин; метоксисалицилловая кислота; транексамовая кислота или их производные; аскорбиновая кислота или ее производные; L-карнитин.
Экстракт Сoptis (Ranunculaceae), экстракт Citrus aurantium (Rutaceae), экстракт красных водорослей, экстракт Houttuynia (Saururaceae) обладают способностью регулировать концентрационный градиент ионов кальция в эпидермисе для усиления защитной функции кожного барьера. Экстракт Rosmarinus officinalis обладает способностью подавлять разложение эластина, экстракт Betula alba обладает способностью подавлять реакцию Майларда. Экстракты Achillea и Ophiopogon обладают способностью удлинять дендрит в меланоците. Экстракт Syzygium aromaticum, эвгенол и тритерпены, такие, как олеанолевая кислота, бетулиновая кислота и бетулин обладают способностью восстанавливать коллагеновые пучки волокон дермиса. Природный белковый гидролизат обладает способностью ингибировать эластазу. Пантетеин сульфонат или его производное и глицерритиновая кислота или ее производное обладают способностью подавлять фактор аллергического воспаления. Гидрохинон или гликозид, эскулин, эскулетин, глабридин, метоксисалицилловая кислота, транексамовая кислота или их производные обладают способностью элиминировать активный кислород для предотвращения окислительного стресса, происходящего в дермисе. Содержание этого ингредиента в везикуле по настоящему изобретению может быть установлено до некоторой степени равным тому количеству, которое необходимо для того, чтобы проявились вышеупомянутые свойства и, например, содержание каждого активного ингредиента может быть предпочтительно от 0,1 до 30 масс.% и наиболее предпочтительно от 1 до 10 масс.% по отношению к общей массе везикулы.
Везикула по настоящему изобретению может содержать произвольный ингредиент, который обычно используется в везикуле и лекарственном средстве для наружного применения на коже в дополнение к вышеупомянутым природным ингредиентам и предпочтительным ингредиентам. Такие подходящие соединения могут предпочтительно включать поливалентные спирты, такие, как глицерин, диглицерин, дипропиленгликоль, 1,3-бутандиол, 1,2-пентандиол, изопренгликоль, 1,2-гександиол, 1,2-октандиол и полиэтиленликоль; циклические спирты, такие как холестерин, кампестерин, ситостерин, стигмастерин; фосфолипиды, такие, как лецитин, гидрогенизированный лецитин, гидроксилированный лецитин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилсерин и фосфатидилглицерин; жирные кислоты, такие, как олеиновая кислота, каприновая кислота, каприловая кислота и стеариновая кислота; высшие спирты, такие, как цетанол, стеариловый спирт и олеиловый спирт; метилпарабен и этилпарабен. Среди них особенно предпочтительные варианты включают циклические спирты, в частности фитостерины, такие, как кампестерин, ситостерин и стигмастерин; поливалентный спирт и даже глицерин. Содержание фитостерина предпочтительно составляет от 2:1 до 1:2 по отношению к α,ε-бис(γ-N-(C10-30)ацилглутамил)лизину, а содержание поливалентного спирта, который представляет собой природный ингредиент, предпочтительно от 5 до 15 раз больше по отношению к α,ε-бис(γ-N-(C10-30)ацилглутамил)лизину. Везикула по настоящему изобретению может быть использована для получения дисперсионного состава везикулы путем обработки природных ингредиентов основным способом, предпочтительных ингредиентов и произвольных ингредиентов.
(4) Лекарственное средство для наружного нанесения на кожу
Лекарственное средство для наружного нанесения на кожу по настоящему изобретению характеризуется содержанием вышеупомянутой везикулы. Поскольку лекарственное средство для наружного нанесения на кожу содержит везикулу, активный ингредиент доставляется к дермису и, кроме того, сам α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин, который является составной частью везикулы, воздействует на дермис, улучшая свойства дермиса. Для того чтобы проявлялись данные свойства, содержание везикулы предпочтительно составляет от 0,1 до 10 масс.% и наиболее предпочтительно от 0,5 до 5 масс.% по отношению к общей массе лекарственного средства для наружного применения на коже. Если содержание слишком мало, то достаточные количества α,ε-бис(γ-N-(C10-30)ацилглутамил)лизина, церамидов и активных ингредиентов не может достигнуть дермиса для проявления свойств, в то время, как, если содержание слишком велико, эффективный уровень достигает предела и вследствие этого ослабляется степень свободы для лекарственного средства.
Лекарственное средство для наружного нанесения на кожу по настоящему изобретению может применяться без какого-либо специального ограничения так долго, как это обычно применяется для наружного применения на кожу. Предпочтительные примеры лекарственного средства для наружного нанесения на кожу включают косметические средства, содержащие вещества общего воздействия, кожные лекарственные средства для наружного применения и пригодные для наружного применения дерматологические изделия. Среди них косметические средства особенно предпочтительны. Это связано с тем, что в косметических средствах достигается желаемый доступ к кожному покрову и в них содержится много активных ингредиентов с низким доступом к кожному покрову. Предпочтительные примеры косметических средств включают лосьоны, молочные лосьоны, косметические эфирные масла, косметические составы для удаления и очищающие косметические средства. Кроме того, лекарственные формы этих косметических средств особым образом не ограничены, поскольку являются давно известными в области косметических средств и могут предпочтительно применяться в форме лосьонов, эмульсий типа масло в воде, эмульсий типа вода в масле, сложных эмульсий эмульсифицирующихся лекарственных форм и им подобных.
Лекарственное средство для наружного нанесения на кожу по настоящему изобретению может содержать дополнительные ингредиенты, обычно применяемые в качестве природных ингредиентов для средства наружного применения на кожу. Предпочтительные примеры таких дополнительных ингредиентов включают: масла/воски, такие, как масло ореха макадамия, масло авокадо, кукурузное масло, оливковое масло, рапсовое масло, кунжутное масло, касторовое масло, сафлоровое масло, кокосовое масло, пальмовое масло, хлопковое масло, масло жожоба, масло вызревшего кокоса, восстановленное масло, масло плодов сумаха(растительный воск), восстановленное касторовое масло, пчелиный воск, канделильский воск, карнаубский воск, воск ибота, ланолин, восстановленный ланолин, твердый ланолин, воск жожоба; углеводороды, такие, как жидкий парафин, сквалан, пристан, озокерит, парафин, церезин, вазелин и микрокристаллический воск; высшие жирные кислоты, такие, как олеиновая кислота, изостеариновая, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, бегеновая кислота и ундециленовая кислота; высшие спирты, такие как цетиловый спирт, стеариловый спирт, изостеариловый спирт, бегениловый спирт, октилдодеканол, миристиловый спирт и цетостеариловый спирт; синтетические эфирные масла, такие как цетилизоцианат, изопропилмиристат, гексилдецилизостеарат, изопропилмиристат, гексилдецилизостеарат, диизопропиладипат, ди-2-этилгексилсебацинат, диизостеарилмалат, этиленгликоль ди-2-этилгексонат, нео-пентилгликольдикапрат, глицерил ди-2-гептилундеканоат, глицерил три-2-этилгексаноат, триметилолпропан три-2-этилгексаноат, три-метилолпропан триизостеарат и пентаэритрит тетра-2-этилгексаноат; цепочечные полисилоксаны, такие, как диметилполисилоксан, метилфенилполисилоксан и дифенилполисилоксан; циклические полисилоксаны, такие, как октаметилциклотетра-силоксан, декаметилциклопентасилоксан и додекаметилциклогексан-силоксан; модифицированные полисилоксаны, такие, как аминомодифицированный полисилоксан, полиэфир-модифицированный полисилоксан, алкил-модифицированный полисилоксан и фтор-модифицированный полисилоксан; масляные агенты, такие, как кремниевое масло; анионные поверхностно-активные вещества, такие, как мыла синтетических жирных кислот (такие, как лауреат натрия и пальмитат натрия), натрия лаурилсульфат и алкилсульфатный эфир триэтаноламина; катионные поверхностно-активные вещества, такие, как хлорид стеарил триметил аммония, бензалкония хлорид и лауриламин оксид; амфотерные поверхностно-активные вещества, такие, как амфотерные поверхностно-активные вещества на основе имидазолина (такие, как 2-кокоил-2-имидазолин гидроксид-1-карбоксиэтилоксидинатриевая соль), поверхностно-активные вещества на основе бетаина (такие, как алкилбетаин, амид бетаина и сульфобетаин) и ацилметилтаурин; неионные поверхностно-активные вещества, такие, как эфиры сорбита и жирных кислот (такой, как сорбитан моностеарат и сорбитан сесквиолеат), глицериновые эфиры жирных кислот (такие, как глицерин моностеарат), пропиленгликолевые эфиры жирных кислот (такие, как пропиленгликоль моностеарат), восстановленные производные касторового масла, алкиловый эфир глицерина, РОЕ-сорбитановые эфиры жирных кислот (такие, как РОЕ-сорбитан моноолеат и полиоксиэтилен сорбитан моностеарат), РОЕ-сорбитоловые эфиры жирных кислот (такие, как РОЕ-сорбитол монолаурат), РОЕ-глицериновые эфиры жирных кислот (такие, как РОЕ-глицерин моноизостеарат), РОЕ эфиры жирных кислот (такие, как полиэтиленгликоль моноолеат и РОЕ дистеарат), РОЕ-алкиловые эфиры (такие, как РОЕ2-октилдодециловый эфир), РОЕ-алкилфениловые эфиры (такие, как РОЕ-нонилфениловый эфир), представители поверхностно-активных веществ, РОЕ/РОР алкиловые эфиры, такие, как РОЕ/РОР2-децилтетрадециловый эфир), представители эмульгаторов, РОЕ-касторовое масло/восстановленные производные касторового масла (такие, как РОЕ-касторовое масло и восстановленные производные РОЕ-касторового масла), сложные эфиры жирных кислот и сахарозы и алкил гликозид; поливалентные спирты, такие, как полиэтиленгликоль, глицерин, 1,3-бутиленгликоль, эритрит, сорбит, ксилит, мальтит, пропиленгликоль, дипропиленгликоль, диглицерин, изопренгликоль, 1,2-пентандиол, 2,4-гександиол, 1,2-гександиол и 1,2-октандиол; увлажняющие ингредиенты, такие, как пирролидон карбоксилат натрия, лактат и лактат натрия; мелкодисперные частицы, такие, как слюда, тальк, каолин, синтетическая слюда, карбонат кальция, карбонат магния, ангидрид кремния (силикагель), оксид алюминия и сульфат бария, поверхности которых могут быть обработаны; неорганические пигменты, такие, как сурик железный, желтый железоксидный пигмент, черный железоксидный пигмент, оксид кобальта, ультрамариновый синий пигмент, берлинская лазурь, оксид титана и оксид цинка, поверхности которых могут быть обработаны; перламутровые агенты, такие, как титановая слюда, рыбная чешуя и оксихлорид висмута, поверхности которых могут быть обработаны; органические красители, такие, как красный № 202, красный № 228, красный № 226, желтый № 4, голубой № 404, желтый № 5, красный № 5, красный № 505, красный № 230, красный № 223, оранжевый № 201, красный № 213, желтый № 204, желтый № 203, голубой № 1, зеленый № 201, пурпурный № 201 и красный № 204, которые могут быть лаковыми; органические мелкодисперсные частицы, такие, как полиэтиленовый порошок, полиметилметакрилат, полиамидный порошок и полиорганосилоксановый эластомер; ультрафиолетовый абсорбент на основе п-аминобензоата; ультрафиолетовый абсорбент на основе антранилата; ультрафиолетовый абсорбент на основе циннамата; ультрафиолетовый абсорбент на основе бензофенона; ультрафиолетовый абсорбент на основе сахарозы, ультрафиолетовые абсорбенты такие, как 2-(2'-гидрокси-5'-трет-октилфенил)бензотриазол и 4-метокси-4'-трет-бутилдибензоилметан; низшие спирты такие, как этанол и изопропанол; витамины такие, как витамин А или его производные; витамины группы В такой, как витамин В6 трипальмитат, витамин В6 диоктаноат, витамин В2 или его производные, витамин В12 и витамин В15или его производные; витамины группы Е такие, как α-токоферол, β-токоферол, γ-токоферол и витамина Е ацетат, витамины группы D, витамин Н, пантотеновая кислота, пантетин, пирролохинолинхинон; и антибактериальные агенты, такие, как феноксиэтанол.
Лекарственное средство для наружного нанесения на кожу по настоящему изобретению может быть получено путем обработки природного ингредиента и дополнительного ингредиента традиционным способом.
В дальнейшем в этом документе настоящее изобретение описано в конкретных деталях примерами, но, само собой разумеется, что настоящее изобретение не ограничивается этими примерами.
Пример 1
Жидкая везикулярная дисперсия 1 по настоящему изобретению была получена в соответствии со следующей технологией, а именно ингредиенты А и ингредиенты В были нагреты до 70°С будучи гомогенно растворенными и ингредиенты В постепенно добавлялись к ингредиентам А при перемешивании, вследствие этого была получена жидкая везикулярная дисперсия. Часть жидкой везикулярной дисперсии была отделена и взвешена, а затем центрифугировалась, надосадочная жидкость была удалена, продукт был дважды промыт водой, высушен и взвешен, при этом было вычислено массовое содержание везикулы в жидкой везикулярной дисперсии, которое составило 9,3 масс.%. Кроме того, в том же процессе нижеследующее было обработано аналогичным образом: сравнительный образец 1, в котором лецитин был заменен на «Реllicer L-30»; сравнительный образец 2, в котором «Реllicer L-30» был заменен на «Церамид TIC-001»; и сравнительный образец 3, в котором полиоксиэтилен (2) олеат был заменен на диглицерин моноолеат. В результате наблюдения с применением поляризационного микроскопа, поляризованный свет не был идентифицирован в каком-либо из сравнительных образцов 1, 2 и 3 и, следовательно, было обнаружено, что сравнительный образец 1, сравнительный образец 2 и сравнительный образец 3 не образуют везикулярную дисперсионную систему.
Пример 2
Справочный пример 1
Цельное растение Palmaria palmat было высушено, а затем взвешено 100 г от высушенного продукта. Добавлено 2 л воды, продукт был постепенно нагрет до 60°С, температура поддерживалась в течение 3 часов, а затем продукт был отобран и выдерживался для остывания при комнатной температуре. После остывания нерастворимые примеси были удалены фильтрацией, а фильтрат был лиофилизован для того, чтобы получить экстракт 1 Раlmaria.
Вышеупомянутый экстракт 1 Раlmaria был использован для получения жидкой везикулярной дисперсии 2 таким же образом, как в примере 1. Кроме того, также как и в примере 1 нижеследующее было обработано аналогичным образом: сравнительный образец 4, в котором лецитин был заменен на «Реllicer L-30»; сравнительный образец 5, в котором «Реllicer L-30» был заменен на «Церамид TIC-001»; и сравнительный образец 6, в котором полиоксиэтилен (2) олеат был заменен на диглицерин моноолеат. В результате наблюдения с применением поляризационного микроскопа, поляризованный свет не был идентифицирован в каком-либо из сравнительных образцов 4, 5 и 6 и, следовательно, было обнаружено, что сравнительный образец 4, сравнительный образец 5 и сравнительный образец 6 не образуют везикулярную дисперсионную систему. Кроме того, масса везикулы, содержащейся в жидкой везикулярной дисперсии 2, была 9,8 масс.%.
Тестовый пример 1
Жидкая везикулярная дисперсия 1, жидкая везикулярная дисперсия 2, сравнительный образец 4, сравнительный образец 5 и сравнительный образец 6 были использованы в качестве пробы. Кожа была предварительно обработана и закупорена 1%-ным водным раствором лаурил сульфата в течение 24 часов для усиления трансэпидермальной (через кожу) потери влаги (ТЭПВ) и была обработана и закупорена образцом в течение 6 часов и 30 минут после удаления повязки, ТЭПВ была определена с помощью Теваметра (производства Integral Corporation). Необходимо отметить, что вода применялась в качестве контроля. Таблица 3 показывает результаты. Было найдено, что жидкая везикулярная дисперсия обладает дополнительным превосходным эффектом подавления ТЭПВ. Это возможно связано с тем, что экстракт 1 Рalmaria, который является активным ингредиентом, усиливает саму везикулу. Кроме того, было установлено, что «Реllicer L-30» сам по себе обладает свойством подавлять ТЭПВ.
Пример 3
Cравнительный пример 2
К 500 г измельченных частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), добавляют 3 л 50%-ного водного раствора этанола, смесь нагревают при перемешивании и нагревают в колбе с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры удаляют нерастворимые примеси фильтрацией. Полученный продукт подвергают концентрированию в вакууме и добавляют 1 л воды и 1 л этил ацетата для проведения жидкостной экстракции остатка. Слой этил ацетата отделяют и промывают его дважды 500 мл воды с последующей сушкой безводным сульфатом натрия. После этого полученный продукт подвергают концентрированию в вакууме для удаления растворителя и в результате получают экстракт 1 Сoptis japonica.
Cравнительный пример 3
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), была использована фруктовая кожура Citrus aurantium (Rutaceae) для того, чтобы получить экстракт 1 Citrus aurantium.
Cравнительный пример 4
Была проведена аналогичная обработка за исключением того, что была использована надземная часть Houttuynia cоrdata (Saururaceae) вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), для того, чтобы получить экстракт 1 Houttuynia cоrdata.
Cравнительный пример 5
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), была использована листва Rosmarinus officinalis (Lamiaceae) для того, чтобы получить экстракт 1 Rosmarinus officinalis.
Cравнительный пример 6
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), была использована древесная кора Betula alba (Betulaceae) для того, чтобы получить экстракт 1 Betula alba.
Cравнительный пример 7
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), была использована надземная часть Achillea millefolium (Compositae) для того, чтобы получить экстракт 1 Achillea millefolium.
Cравнительный пример 8
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), была использована надземная часть Centella asiatica (Apiaceae) для того, чтобы получить экстракт 1 Centella asiatica.
Cравнительный пример 9
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), была использована листва Engelgardtia chrysolepis (Juglandaceae) для того, чтобы получить экстракт 1 Engelgardtia chrysolepis.
Cравнительный пример 10
Была проведена аналогичная обработка за исключением того, что вместо частей корневища Сoptis japonica, принадлежащего к Сoptis (Ranunculaceae), были использованы корневища Ophiopogon japonicus (Liliaceae) и вместо этанола был использован 50% водный раствор этанола для того, чтобы получить экстракт 1 Ophiopogon japonicas.
Жидкая везикулярная дисперсия 1, в которой была диспергирована везикула по настоящему изобретению, была получена похожим способом, что и по примеру 2 в соответствии со следующим составом.
Пример 4
Были проведены те же самые стадии с применением различных поверхностно-активных веществ таким же образом, как в примере 3.
Пример 5
Жидкая везикулярная дисперсия 29 была получена таким же образом, как в примере 3 в соответствии со следующим составом. Также наблюдалось образование эмульсии в части везикул.
Пример 6
Жидкая везикулярная дисперсия 30 была получена таким же образом, как в примере 3 в соответствии со следующим составом. Это была везикулярная дисперсная система.
Пример 7
Были проведены те же самые стадии с применением различных типов церамидов таким же образом, как в примере 3.
Пример 8
Была получена молочная жидкость, которая является лекарственным средством для наружного применения на кожи в соответствии со следующим составом. Каждый из ингредиентов (А) были смешаны друг с другом и смесь была нагрета до 80°С. С другой стороны, каждый из ингредиентов (В) был нагрет до 80°С. Смесь ингредиентов (В) была добавлена к смеси ингредиентов (А) и перемешана для получения эмульсии. Более того, ингредиенты (С) были добавлены туда для нейтрализации смеси, а после этого смесь была перемешана и охлаждена до 35°С для того, чтобы получить молочные жидкости. Каждая из молочных жидкостей поддерживала везикулярную дисперсную систему после хранения в течение месяца при 5°С, 20°С или 40°С.
Промышленная применимость
В соответствии с настоящим изобретением может быть осуществлен способ, позволяющий активному ингредиенту достичь дермиса для улучшения или поддержания кожной среды.
Настоящее изобретение может быть использовано в качестве лекарственного средства для наружного применения на коже.
Реферат
Изобретение относится к фармацевтической и косметической промышленности, в частности к средству для нанесения на кожу. Везикула для нанесения на кожу, включающая α,ε-бис(γ-N-(C10-30)ацилглутамил)лизин и/или его соль; церамид и/или его производное; и один или более эфиров, выбранных из глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и глицеринового эфира пироглутаминовой кислоты, взятых в определенном количестве. Лекарственное средство для наружного нанесения на кожу, включающее определенное количество везикулы. Вышеописанная везикула и лекарственное средство на ее основе являются стабильными, эффективно инкапсулируют активный ингредиент, позволяя ему достичь дермиса, эффективно подавляют трансэпидермальную потерю влаги. 2 н. и 4 з.п. ф-лы, 13 табл., 8 пр.
Формула
1) от 1 до 50 мас.% α,ε-бис(γ-(С10-30)ацилглутамил)лизин и/или его соль;
2) от 1 до 50 мас.% церамида и/или его производного; и
3) от 5 до 30 мас.% одного или более эфиров, выбранных из глицеринового эфира жирной кислоты, полиглицеринового эфира жирной кислоты и глицеринового эфира пироглутаминовой кислоты.

Комментарии