Рекомбинантные предуоденальные липазы и полипептидные производные, продуцируемые растениями, способ их получения и их применение - RU2235129C2
Код документа: RU2235129C2
Чертежи



























Описание
Предметом настоящего изобретения является продуцирование растениями рекомбинантных предуоденальных липаз, в особенности рекомбинантных желудочных липаз и других полипептидных производных этих последних, обладающих липазной активностью, а также их применение, особенно, в качестве функциональных пищевых продуктов или в фармацевтических композициях, или в ферментативных препаративных формах для использования в индустрии или продовольственной промышленности.
Желудочная липаза собаки (LGC) представляет собой гликопротеин из 379 аминокислот (АА) с молекулярной массой около 50 килодальтонов (кДа), синтезируемый в виде предшественника, содержащего сигнальный пептид с концевой аминогруппой и секретируемый срединными клетками слизистой оболочки дна желудка собаки (
Человеческая желудочная липаза (LGH) легко синтезируется в виде предшественника и описана в публикации Boomer M.W. и др., 1987 г. Зрелый протеин LGH состоит из 379 аминокислот. Его сигнальный пептид (PSLGH) содержит 19 аминокислот.
Эти ферменты принадлежат к семейству так называемых “предуоденальных” липаз, некоторые члены которого уже получены в очищенном виде, а в некоторых случаях даже клонированы (Docherty A.J.P. и др., 1985 г.; Bodmer M.W. и др., 1987 г.; Moreau H. и др., 1988 г.; европейские патенты №0191061 и 0261016).
На протяжении длительного времени считалось, что гидролиз пищевых липидов происходит в тонкой кишке под действием ферментов, продуцируемых поджелудочной железой (Bernard С., 1849 г.).
Однако наблюдения позволяют полагать, что гидролиз триглицеридов может протекать в желудке под воздействием предуоденальных ферментов (Volhard F., 1901 г.; Shonheyder F., Volquartz K., 1945 г.). Такие ферменты, и особенно, желудочная липаза собаки, характеризуются ферментативными и физико-химическими свойствами, которые отличают их от панкреатических липаз млекопитающих. Эти различия между желудочными и панкреатическими липазами касаются, главным образом, следующих моментов: молекулярная масса, состав аминокислот, устойчивость к пепсину, специфичность субстрата, оптимальное значение рН при воздействии и стабильность в кислой среде.
Кроме того, ин витро, при определенных условиях, можно наблюдать синергизм при воздействии желудочных и панкреатических ферментов на гидролиз триглицеридов с длинными цепочками (Gargouri, Y. и др., 1989 г.).
Известен ряд патологических состояний (муковисцидоз, экзокринная панкреатическая недостаточность), при которых у пациентов, полностью или частично, отсутствует экзокринная панкреатическая секреция и, следовательно, они лишены ферментов, необходимых для гидролиза пищи (амилазы, липазы, протеазы). Отсутствие абсорбции жиров и, особенно, триглицеридов с длинными цепочками, в кишечнике ведет к очень значительному увеличению стеатореи у этих пациентов, а также к весьма существенному замедлению прибавки в весе у молодых больных. В целях корректировки в этих случаях этим субъектам вводят вытяжки из поджелудочной железы свиньи во время еды. Терапевтический эффект таких вытяжек может быть существенно усилен за счет одновременного назначения LGC вследствие специфичности ее воздействия на триглицериды с длинными цепочками.
В статье

Очевидные причины, связанные с трудностями обеспечения желудками собак, препятствуют всякому развитию данного способа как на лабораторном, так и промышленном уровнях. Отсюда следует необходимость в разработке способа, который позволяет получать LGC в большом количестве, не прибегая при этом к использованию собачьих желудков.
Нуклеотидная и пептидная последовательности LGC были определены с целью получения LGC в промышленном масштабе посредством способа, при котором используют методы генной инженерии. Такие работы составляют предмет международной заявки WO №94/13816, поданной 16 декабря 1993 года.
Способ получения рекомбинантной желудочной липазы собаки, описанный в этой международной заявке, основан на использовании Escherichia coli (E.coli) в качестве трансформированной клетки-хозяина, способной продуцировать LGC.
Определенные трудности, которые встречаются во время продуцирования рекомбинантной LGC с помощью E.coli, особенно необходимость в культивировании значительных количеств E.coli в ферментере, что связано с большими затратами, послужили причиной поиска изобретателями других способов получения этой LGC.
Клетки млекопитающих, априори, более приспособлены к экспрессии генов млекопитающих. Однако, при их применении возникают проблемы, связанные с созреванием протеинов. Набор ферментов, с помощью которых реализуется пост-трансляционное созревание, различается в зависимости от ткани, органа и вида. Так, например, сообщалось, что пост-трансляционное созревание плазматического протеина может быть различным, когда его получают из человеческой крови или когда он продуцируется рекомбинантной клеткой, как, например, клетки яичников китайского хомячка, или в молоке трансгенного животного. Кроме того, низкие уровни экспрессии, достигаемые при использовании клеток млекопитающих требуют культивировании ин витро в очень больших объемах, что связано с высокими затратами. Продуцирование рекомбинантных протеинов в молоке трансгенных животных (мыши, овцы и коровы) позволяет снизить производственные затраты и преодолеть проблемы, связанные с уровнем экспрессии. Однако остаются этические проблемы и проблемы вирусной и субвирусной (инфекционные части протеина) контаминации.
По этим причинам перенос генов млекопитающих в растительную клетку может открыть путь продуцирования в больших количествах новых рекомбинантных протеинов при снижении производственных затрат и без опасности вирусной или субвирусной контаминации.
В 1983 году в нескольких лабораториях было сделано открытие, согласно которому можно переносить гетерологичный ген в геном растительной клетки (Bevan и др.; Herrera-Estrella и др., 1983 г., а, b) и регенерировать трансгенные растения из этих генетически модифицированных клеток. Тогда все клетки растения обладают генетически измененным характером, передаваемым потомству путем полового оплодотворения.
Благодаря этим работам различные коллективы заинтересовались вопросом продуцирования рекомбинантных протеинов млекопитающих в растительных клетках или в трансгенных растениях (Barta и др., 1986 г.; Marx, 1982 г.). Одним из первых, действительно значимых результатов в этой области было получение антител в трансгенных табачных растениях (Hiatt и др., 1989 г.).
Для экспрессирования гетерологичного протеина в зерне - место хранения протеинов в растениях - коллектив Вандекеркхова (Vandekerckhove) (1989 г.) произвел слияние последовательности, кодирующей лей-энкефалин, с геном, кодирующим альбумин 23 Arabidopsis thaliana. С помощью этой конструкции были получены виды трансгенного рапса, которые специфически экспрессируют лей-энкефалин в зернах со степенями экспрессии порядка 0,1% от общего количества протеина. В 1990 году Sijmons и сотрудники осуществили перенос гена альбуминной человеческой сыворотки в клетки табака и картофеля. Каким бы ни было происхождение сигнальных пептидов (человеческое или растительное), количество содержащей альбумин человеческой сыворотки в листьях, стеблях и клубнях картофеля составило порядка 0,02% от общего количества протеинов.
Также были продуцированы в растениях и другие рекомбинантные протеины млекопитающих: поверхностный антиген гепатита В (Mason и др., 1992 г.); интерфероны (De Zoeten и др., 1989 г.; Edelbaum и др., 1992 г.; Truve и др., 1993 г.); антитела мыши против Streptococcus mutans; возбудитель кариеса зубов (Hiatt и Ма, 1992 г.; Ма и др., 1994 г.), фрагменты антител scFV против раковых клеток (Russel D., 1994 г.), антитело против герпеса (Russel D., 1994 г.), гирудин (Moloney и др., 1994 г.), токсин холеры (Hein R., 1994 г.) и фактор роста человеческого эпидермиса (E.G.F) (Higo и др., 1993 г.).
Совокупность данных этих исследований позволяет показать, что продуцирование рекомбинантных протеинов млекопитающих в растительных клетках возможно и что механизмы синтеза протеинов из последовательностей ДНК сходны между собой в животных и растительных клетках. Все же существуют некоторые различия между растительными и животными клетками, особенно на уровне созревания полиманнозидных гликанов до сложных гликанов, или еще на уровне мест расщепления сигнальных пептидов, что, следовательно, не позволяет гарантировать получение активных или достаточно активных протеинов млекопитающих путем трансформации растительных клеток.
Авторами изобретения было установлено, что использование растительных клеток, трансформированных с помощью соответствующей рекомбинантной нуклеотидной последовательности, позволяет получить рекомбинантную LGC или рекомбинантную LGH, или полипептидные производных этих последних, характеризующиеся ферментативной активностью, которая достаточна в отношении пригодности использования в промышленном масштабе.
Целью настоящего изобретения является разработка нового способа получения рекомбинантных предуоденальных липаз млекопитающих, и, в особенности, рекомбинантной LGC или LGH, с помощью растений или полипептидных производных LGC и LGH, характеризующихся ферментативной активностью, в особенности, липазной активностью, которая позволила бы использовать в промышленном масштабе указанные рекомбинантные липазы и их полипептидные производные.
Другой целью настоящего изобретения является создание инструментов для осуществления такого способа, особенно, для получения новых рекомбинантных нуклеотидных последовательностей, генетически трансформированных растительных клеток, генетически трансформированных растений или частей растений (в особенности, листьев, стеблей, плодов, семян или зерен, корней) и генетически трансформированных фрагментов этих растений или частей растений.
Целью изобретения также является получение новых рекомбинантных предуоденальных липаз (липазы) млекопитающих или любого полипептидного производного, которые ферментативно активны, и таких, какие получают из генетически трансформированных растительных клеток или растений.
Изобретение, кроме того, относится к получению новых ферментативных композиций, пригодных для использования в ферментативных реакциях, особенно в промышленном масштабе.
Еще одной целью изобретения является получение новых фармацевтических композиций, предназначенных, главным образом, для лечения патологий, связанных с дефицитом продуцирования липазы в организме, таких как, например, муковисцидоз.
Еще одна цель настоящего изобретения заключается в создании новых видов топлива, называемых еще биотопливом, характеризующихся тем преимуществом, что они меньше загрязняют окружающую среду по сравнению с топливом, получаемым из нефти и имеют меньшую себестоимость.
Ниже изобретение иллюстрируется следующими фигурами:
- на фиг.1 представлена нуклеотидная последовательность кДНК, нуклеотиды которой расположены в позициях 1-1137, кодируют желудочную липазу собаки (LGC), представленную на фиг.2 и соответствующую последовательности №2;
- на фиг.2 представлена аминокислотная последовательность желудочной липазы собаки, соответствующая последовательности №2;
- на фиг.3 представлена нуклеотидная последовательность, происходящая от кДНК, показанной на фиг.1 и соответствующей последовательности №1, причем нуклеотиды, расположенные в позициях 1-1137 вышеуказанной производной последовательности, кодируют желудочную липазу собаки, представленную на фиг.2 и соответствующую последовательности №2;
- на фиг.4 представлена нуклеотидная последовательность кДНК, нуклеотиды которой, расположенные в позициях 47-1240, кодируют предшественника желудочной липазы человека (LGH), состоящей из 398 аминокислот, а нуклеотиды, расположенные в позициях 104-1240, кодируют зрелую желудочную липазу человека из 379 аминокислот;
- на фиг.5 представлена аминокислотная последовательность желудочной липазы человека, причем предшественник LGH ограничен аминокислотами, расположенными в позициях 1 и 398, а зрелая желудочная липаза человека ограничена аминокислотами, расположенными в позициях 20 и 398,
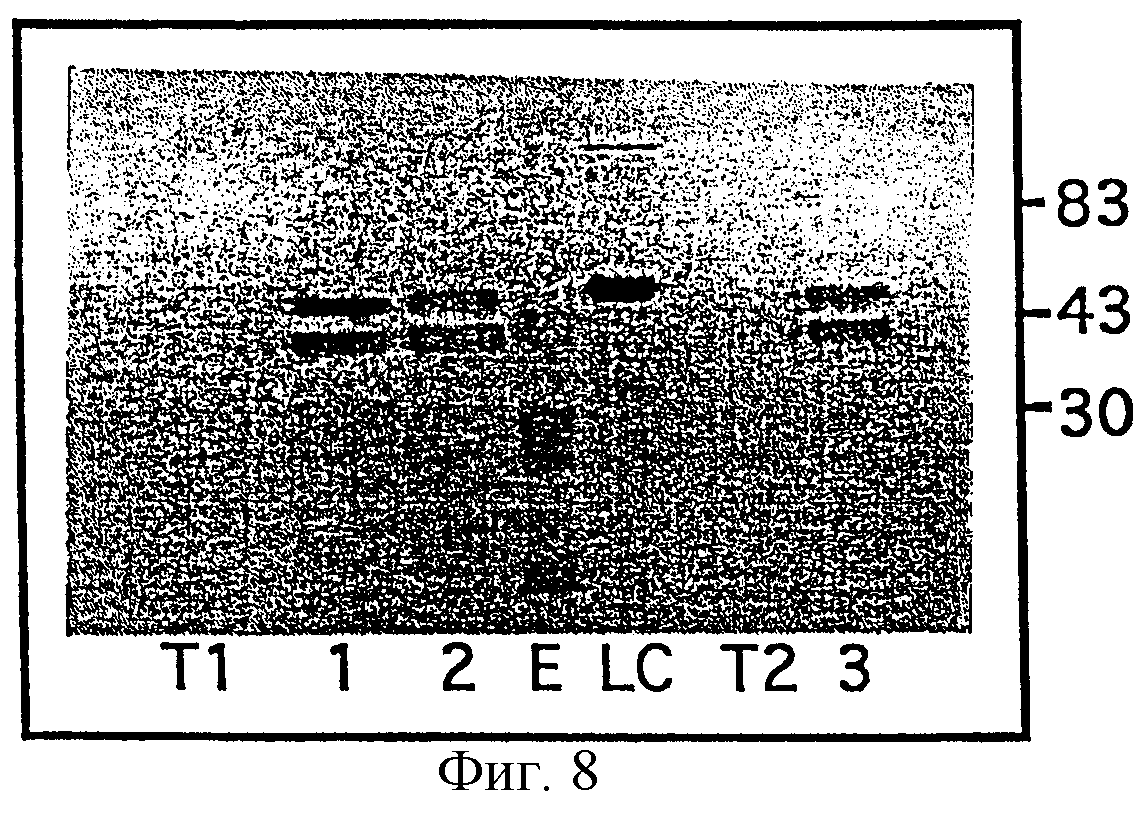
- на фигурах 6, 7 и 8 представлены результаты иммунологического анализа типа “вестерн-блокирования” рекомбинантных полипептидов, продуцированных листьями и семенами табака Xanthi, семенами рапса, листьями и плодами томата, трансформированными посредством рекомбинантных последовательностей согласно изобретению,
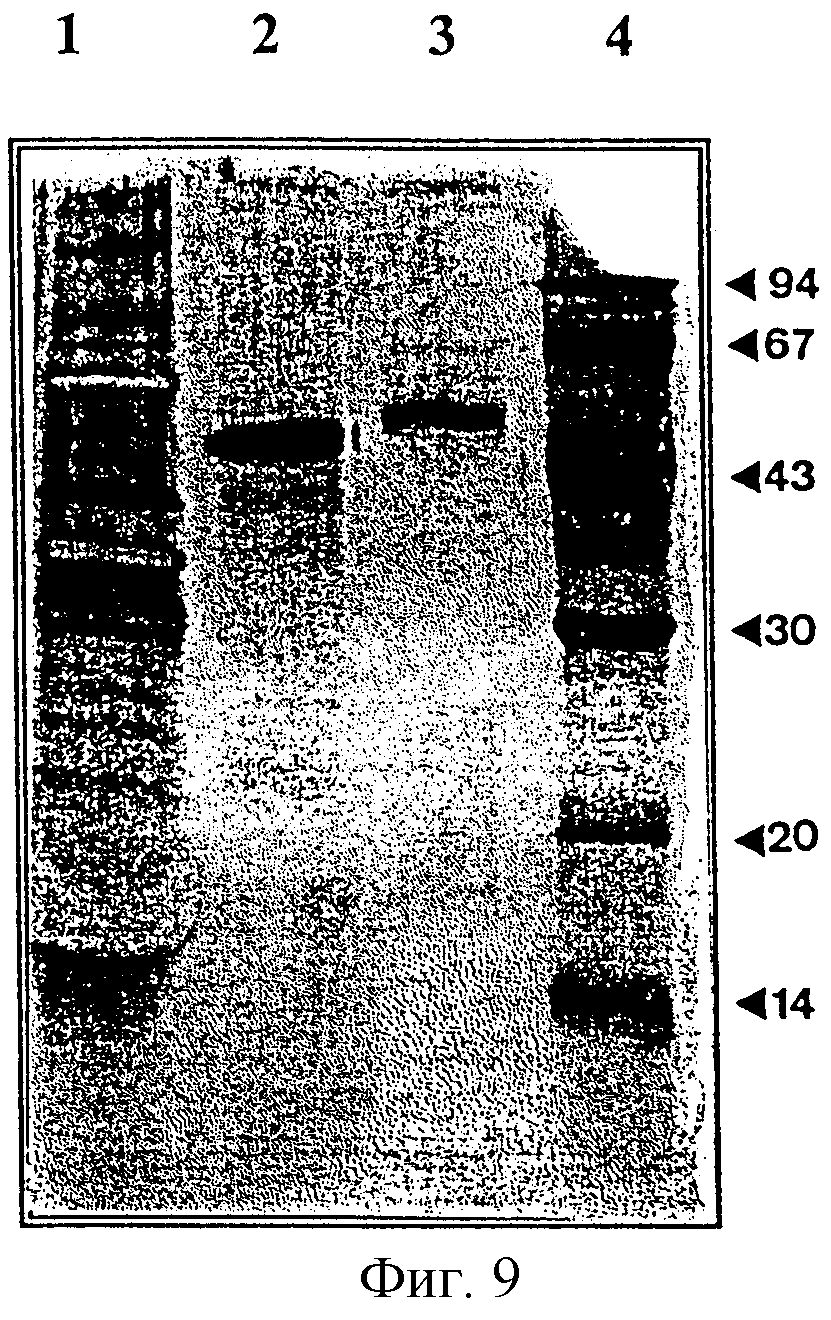
- на фигурах 9 и 10 представлены, соответственно, анализ посредством электрофореза на полиакриламидном геле и результат переноса этого геля на нитроцеллюлозную мембрану, а также обнаружение, исходя из антитела против желудочной липазы собаки, очищенной желудочной липазы собаки из листьев табака;
- на фиг.11 дан пример определения на мембране гликановых остатков рекомбинантной желудочной липазы собаки;
- на фиг.12 представлен анализ посредством электрофореза на полиакриламидном геле желудочной очищенной липазы собаки из семян рапса;
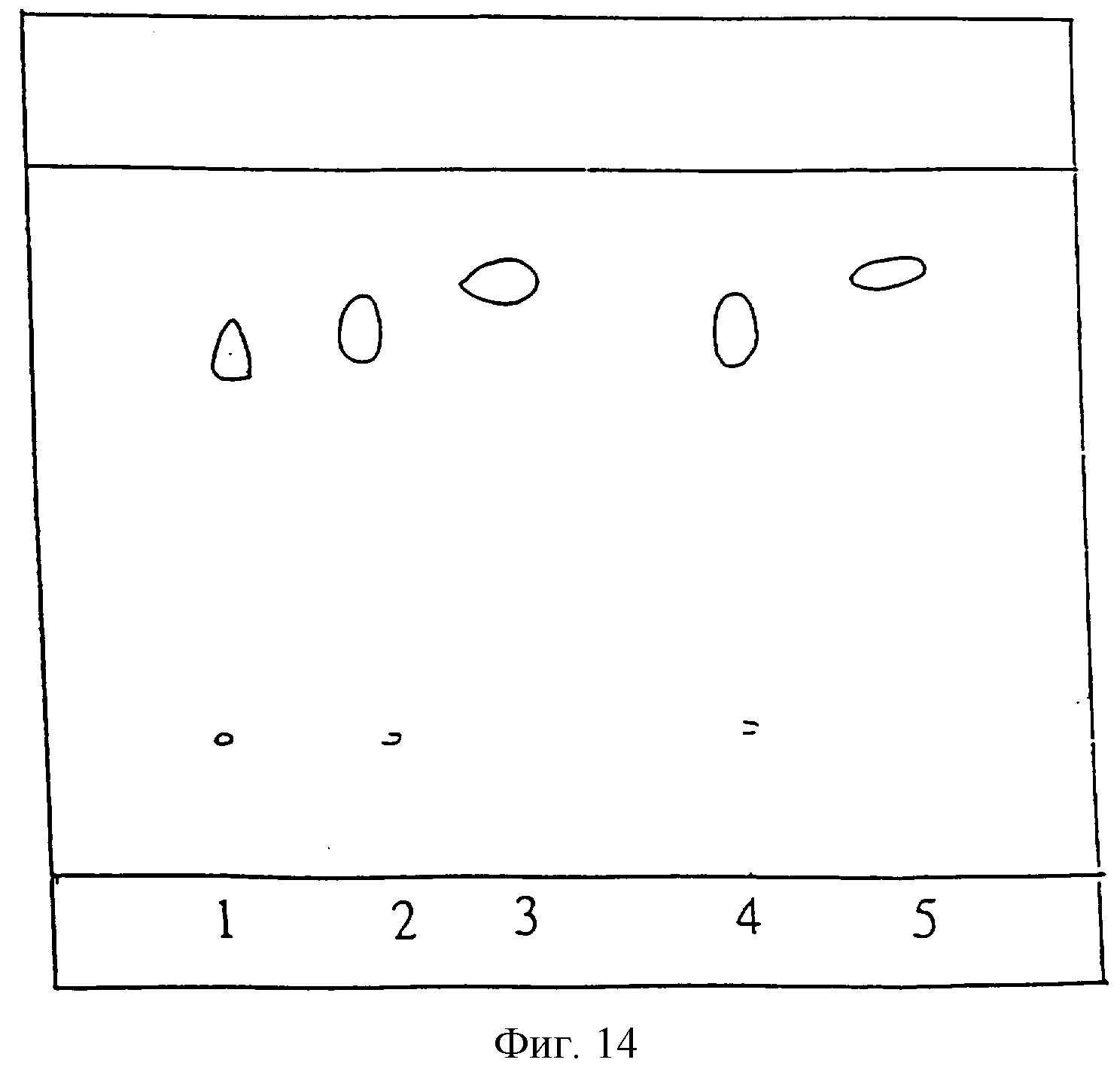
- фигуры 13, 14 и 15 иллюстрируют различные опыты, проводившиеся для получения метилового эфира олеиновой кислоты из трансформированных семян согласно изобретению.
Предметом настоящего изобретения является применение рекомбинантной нуклеотидной последовательности, содержащей, с одной стороны, кДНК, кодирующую любую предуоденальную липазу млекопитающих, а именно липазы, нуклеотидные последовательности которых, кодирующие эти последние, обладают между собой гомологией примерно, по крайней мере, на 75%, особенно, по крайней мере, примерно на 77-85% и аминокислотные последовательности которых обладают между собой гомологией, по крайней мере, примерно на 70%, особенно, по крайней мере. примерно на 80-90%, и которые являются кислотостойкими и активными при значении рН примерно от 1 до примерно 5, преимущественно при рН примерно от 1,5 до 2, особенно, кДНК, кодирующую любую желудочную липазу млекопитающих или кДНК, кодирующую любое полипептидное производное упомянутых выше предуоденальных липаз, получаемое посредством добавления и/или супрессии, и/или замены одной аминокислоты (или нескольких аминокислот), причем это указанное полипептидное производное обладает описанными выше свойствами предуоденальных липаз, и с другой стороны, элементы, позволяющие растительной клетке продуцировать предуоденальную липазу, кодированную упомянутой выше кДНК, или продуцировать полипептидное производное, как, например, указанные выше, в особенности, промотор и терминатор транскрипции, распознаваемые транскрипционным аппаратом растительных клеток, для трансформации растительных клеток с целью получения из этих клеток или растений, полученных из этих клеток, рекомбинантной предуоденальной липазы млекопитающих в виде активного фермента или полипептидного производного (или нескольких полипептидных производных) этого фермента, такого (таких), как указанное (указанные) выше.
Предпочтительно, предметом настоящего изобретения является, в особенности, применение рекомбинантной нуклеотидной последовательности, содержащей, с одной стороны, кДНК, представленную на фиг.1 и кодирующую желудочную липазу собаки (LGC), показанную на фиг.2, или нуклеотидную последовательность, происходящую от этой кДНК, особенно в результате добавления и/или супрессии, и/или замены одного нуклеотида (или нескольких нуклеотидов), причем вышеуказанная производная последовательность способна кодировать полипептид, аминокислотная последовательность которого идентична таковой желудочной липазы собаки, представленной на фиг.2, или полипептид, происходящий от желудочной липазы собаки в результате добавления и/или супрессии и/или замены одной аминокислоты (или нескольких аминокислот), причем это полипептидное производное характеризуется липазной активностью, и, с другой стороны, элементы, позволяющие растительной клетке продуцировать полипептид, кодированный вышеуказанной кДНК или указанной выше производной последовательностью, в особенности, как промотор и терминатор транскрипции, распознаваемые транскрипционным аппаратом растительных клеток (а именно, РНК-полимеразами этих клеток), для трансформации растительных клеток с целью получения из этих клеток или растений, полученных из этих клеток, рекомбинантной желудочной липазы собаки в виде активного фермента или полипептидного производного (или нескольких полипептидных производных) этого фермента, такого, как указанное (указанные) выше.
Изобретение относится также к любой рекомбинантной нуклеотидной последовательности, такой, как описанная выше, содержащей, в качестве кДНК, представленную на фиг.1 кДНК или нуклеотидную последовательность, происходящую от этой кДНК, такую, как указанная выше.
На этом основании, предметом изобретения преимущественно является любая рекомбинантная нуклеотидная последовательность, такая, как описанная выше, содержащая кДНК, представленную на фиг.1 и кодирующую желудочную липазу собаки, представленную на фиг.2.
Еще одним предметом изобретения, предпочтительно, является любая рекомбинантная нуклеотидная последовательность, такая, как описанная выше, содержащая нуклеотидную последовательность, происходящую от кДНК, представленной на фиг.1, причем вышеуказанная нуклеотидная производная последовательность является описанной выше последовательностью и кодирует желудочную липазу собаки, представленную на фиг.2. Такая производная последовательность, предпочтительно, является последовательностью, представленной на фиг.3, и соответствует последовательности, представленной на фиг.1, в которой нуклеотид А в позиции 12 заменен нуклеотидом G, нуклеотид Т в позиции 13 заменен нуклеотидом С, а нуклеотид А в позиции 15 заменен нуклеотидом Т.
Предпочтительно, рекомбинантные нуклеотидные последовательности согласно изобретению содержат одну (или несколько) последовательность (последовательностей), кодирующую пептид, ответственный за адресацию рекомбинантных полипептидов согласно изобретению (а именно, рекомбинантной желудочной липазы собаки или упомянутых выше полипептидных производных) в определенное место растительной клетки, особенно, в эндоплазматическую сеть или в вакуоли, или даже на поверхность клетки, в пектоцеллюлозную перегородку или в межклеточное пространство, называемое также апоплазмой.
Из терминаторов транскрипции, которые могут быть использованы для трансформации растительных клеток в рамках настоящего изобретения, можно указать на терминатор polyA 33S вируса мозаики цветной капусты (CaMV), описанный в статье Franck и др., 1980 г., или терминатор polyA NOS, соответствующий некодирующему участку 3’ гена нопалинсинтазы Ti-плазмиды Agrobacterium tumefaciens, штамма нопалина (Depicker и др., 1982 г.).
На этом основании предметом изобретения является любая рекомбинантная нуклеотидная последовательность, такая как описанная выше, содержащая ниже вышеуказанной кДНК или ее производной последовательности терминатор polyA 35S вируса CaMV или терминатор polya NOS Agrobacterium tumefaciens.
Из промоторов транскрипции, которые можно использовать для трансформации растительных клеток в рамках настоящего изобретения, можно назвать:
- промотор 35S или, предпочтительно, двойной конститутивный промотор 35S (pd35S) вируса CaMV, причем эти промоторы обеспечивают экспрессию рекомбинантных полипептидов согласно изобретению во всем растении, полученном из клеток, трансформированных согласно изобретению, и описаны в статье Каy и др., 1987 г.;
- промотор pCRU гена круциферина редьки, который позволяет протекать экспрессии рекомбинантных полипептидов согласно изобретению только в семенах (или зернах) растения, полученного из трансформированных согласно изобретению клеток, который описан в статье Depigny-This и др., 1992 г.;
- промоторы pGEAl и pGEA6, которые соответствуют некодирующему участку 5’ генов запасного протеина семян GEA1 и GEA6, соответственно, Arabidopsis thaliana (Gaubier и др., 1993 г.) и которые позволяют протекать специфической экспрессии в семенах;
- химерный суперпромотор pSP (PCT/US 94/12946), образованный в результате слияния, при тройном повторе транскрипционного активирующего элемента промотора гена октопин-синтазы Agrobacterium tumefaciens, транскрипционного активирующего элемента промотора гена маннопинсинтазы и промотора маннопинсинтазы Agrobacterium tumefaciens;
- актиновый промотор риса и следующий за ним актиновый интрон риса (pAR-IAR), содержащийся в плазмиде pActl-F4 и описанный авторами McElroy и др. (1991 г.);
- промотор гена γ-зеина кукурузы (рγ-зеин), содержащийся в плазмиде рγ63, описанной Reina и др., (1990 г.), и способствующий экспрессии в эндосперме кукурузных зерен.
На этом основании, предметом изобретения является любая рекомбинантная нуклеотидная последовательность, такая как описанная выше, содержащая выше вышеуказанной кДНК или происходящей от нее последовательности двойной конститутивный промотор 35S (pd35S) вируса CaMV, или промотор PCRU гена круциферина редьки, или промоторы pGEAl и pGEA6 Arabidopsis thaliana, или суперпромотор pSP бактерии Agrobacterium tumefaciens, или промотор pAR-IAR риса, или промотор рγ-зеина кукурузы.
Последовательности, кодирующие направляющий пептид и применяемые в рамках настоящего изобретения, могут быть животного, человеческого или растительного происхождения.
Из последовательностей, кодирующих направляющий пептид растительного происхождения, можно указать:
- нуклеотидную последовательность из 69 нуклеотидов (приводится в нижеследующих примерах), кодирующую препептид (сигнальный пептид) из 23 аминокислот спорамина А батата, причем этот сигнальный пептид позволяет вводить рекомбинантные полипептиды согласно изобретению в секреторную систему растительных клеток, трансформированных согласно изобретению (а именно, в эндоплазматическую сеть);
- нуклеотидную последовательность из 42 нуклеотидов (приводится в нижеследующих примерах), кодирующую N-концевой пропептид с вакуолярной адресацией из 14 аминокислот спорамина А батата и позволяющую аккумулировать рекомбинантные полипептиды согласно изобретению в вакуолях растительных клеток, трансформированных согласно изобретению;
- нуклеотидную последовательность из 111 нуклеотидов (приводится в нижеследующих примерах), кодирующую препропептид из 37 аминокислот спорамина А, образованный N-концевой частью в направлении к С-концевой части из 23 аминокислот упомянутого выше сигнального пептида, за которыми следуют 14 аминокислот вышеупомянутого пропептида, причем этот препропептид позволяет вводить рекомбинантные полипептиды согласно изобретению в секреторную систему и накапливать их в вакуолях растительных клеток, трансформированных согласно изобретению, причем три вышеуказанные последовательности описаны в работах Murakami и др., 1986 г., Matsuoka и Nakamura, 1991 г.;
- карбоксиконцевой пропептид лектина ячменя описан особенно в работах Schroeder и др., 1993 г., и Bednarek и Ralkhel, 1991 г.
Из последовательностей, кодирующих направляющий пептид человеческого или животного происхождения, можно назвать таковые, кодирующие сигнальный пептид желудочной липазы человека (LGH), такой как описанный в европейском патенте №0191061, или таковой желудочной липазы кролика (LGL), как описанный в европейской заявке на патент №0542629, последовательность которых указана в нижеследующих примерах, или таковой панкреатической липазы человека (LPH) или еще таковой желудочной липазы собаки (LGC).
Из кодирующих направляющий пептид последовательностей также можно назвать последовательность, кодирующую тетрапептид KDEL и обеспечивающую адресацию в плазматическую сеть.
На этом основании, предметом изобретения является любая рекомбинантная нуклеотидная последовательность, такая как описанная выше, содержащая последовательность, кодирующую весь или часть сигнального пептида, такого как сигнальный пептид спорамина А батата или сигнальный пептид желудочной липазы человека или желудочной липазы кролика или желудочной липазы собаки, причем эта последовательность, кодирующая сигнальный пептид, находится в вышеуказанной рекомбинантной нуклеотидной последовательности выше кДНК или происходящей от нее последовательности и ниже используемого промотора, таким образом, что последняя С-концевая аминокислота сигнального пептида связана с первой N-концевой аминокислотой полипептида, кодированного с помощью вышеуказанной кДНК или происходящей от нее последовательности, в протеине, кодированном вышеуказанной рекомбинантной нуклеотидной последовательностью.
Предметом изобретения также является любая рекомбинантная нуклеотидная последовательность, такая как описанная выше, содержащая последовательность, кодирующую весь или часть вакуолярного направляющего пептида, особенно, как пептид спорамина А батата, причем эта последовательность, кодирующая вакуолярный направляющий пептид, находится в вышеуказанной рекомбинантной нуклеотидной последовательности, между последовательностью, кодирующей сигнальный пептид, и последовательностью, кодирующей вышеуказанную кДНК или происходящую от нее последовательность, таким образом, что первая N-концевая аминокислота вакуолярного направляющего пептида оказывается связанной с последней С-концевой аминокислотой сигнального пептида и последняя С-концевая аминокислота упомянутого направляющего пептида оказывается связанной с первой N-концевой аминокислотой полипептида, кодированного кДНК или ее производной последовательностью, в протеине, кодированном указанной рекомбинантной нуклеотидной последовательностью.
Предметом изобретения является также любая рекомбинантная нуклеотидная последовательность, такая как описанная выше, содержащая последовательность, кодирующую весь или часть вакуолярного направляющего пептида, в частности, как пептид лектина ячменя, причем эта последовательность, кодирующая вакуолярный направляющий пептид, располагается в вышеуказанной рекомбинантной нуклеотидной последовательности, ниже последовательности, кодирующей вышеуказанную кДНК или ее производную последовательность таким образом, что первая N-концевая аминокислота вакуолярного направляющего пептида оказывается связанной с последней С-концевой аминокислотой полипептида, кодированного вышеупомянутой кДНК или ее производной последовательностью, в протеине, кодированном вышеуказанной рекомбинантной нуклеотидной последовательностью.
Предметом изобретения являются особенно следующие рекомбинантные нуклеотидные последовательности:
- последовательность (обозначаемая как pd35S-PS-LGC), содержащая в направлении 5’→3’ промотор pd35S CaMV, последовательность, которая кодирует сигнальный пептид спорамина А, за которой сразу следует нуклеотидная последовательность, представленная на фиг.3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pd35S-PPS-LGC), содержащая в направлении 5’→3’ промотор pd35S CaMV, последовательность, которая кодирует препропептид спорамина А, за которой сразу следует нуклеотидная последовательность, представленная на фиг.3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pd35S-PSLGL-LGC), содержащая в направлении 5’→3’ промотор pd35S CaMV, последовательность, которая кодирует часть сигнального пептида желудочной липазы кролика (LGL) (а именно, последовательность, состоящая из 19 первых аминокислот и указанная в приводимых ниже примерах, при этом 9 нуклеотидов, кодирующих 3 последние С-концевые аминокислоты, исключаются), за которой сразу следует кДНК, представленная на фиг.1, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pCRU-PS-LGC), содержащая в направлении 5’→3’ промотор pCRU круциферина, последовательность, которая кодирует сигнальный пептид спорамина А, за которой сразу следует нуклеотидная последовательность, представленная на фиг.3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pCRU-PPS-LGC), содержащая в направлении 5’→3’ промотор pCRU круциферина, последовательность, которая кодирует препропептид спорамина А, за которой сразу следует нуклеотидная последовательность, представленная на фиг.3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pCRU-PSLGL-LGC), содержащая в направлении 5’→3’ промотор pCRU круциферина, последовательность, которая кодирует часть сигнального пептида липазы LGL (такая, как описанная выше), за которой сразу следует кДНК, представленная на фиг.1 или 3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pGEAl-PSLGL-LGC), содержащая в направлении 5’→3’ промотор pGEAl Arabidopsis thaliana, последовательность, которая кодирует часть сигнального пептида липазы LGL (такая, как описанная выше), за которой сразу следует кДНК, представленная на фиг.1 или 3, затем -терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pGEA6-PSLGL-LGC), содержащая в направлении 5’→3’ промотор pGEA6 Arabidopsis thaliana, последовательность, которая кодирует часть сигнального пептида желудочной липазы кролика (LGL) (такая, как описанная выше), за которой сразу следует кДНК, представленная на фиг.1 или 3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pAR-IAR-PSLGL-LGC), содержащая в направлении 5’→3’ промотор pAR-IAR риса, последовательность, которая кодирует часть сигнального пептида липазы LGL (такая, как описанная выше), за которой сразу следует кДНК, представленная на фиг.1 или 3, затем - терминатор polyA 35S CaMV или терминатор polyA NOS бактерии Agrobacterium tumefaciens;
- последовательность (обозначаемая как рγ -зеин-РSLGL-LGC), содержащая в направлении 5’→3’ рγ-зеиновый промотор кукурузы, последовательность, которая кодирует часть сигнального пептида липазы LGL (такая, как описанная выше), за которой сразу следует кДНК, представленная на фиг.1 или.3, затем - терминатор polyA 35S вируса CaMV;
- последовательность (обозначаемая как pγ-зеин-PSLGL-LGC-KDEL), содержащая в направлении 5’→3’ рγ-зеиновый промотор кукурузы, последовательность, которая кодирует часть сигнального пептида липазы LGL (такая, как описанная выше), за которой сразу следует кДНК, представленная на фиг.1 или 3, затем последовательность, которая кодирует тетрапептид KDEL, и затем - терминатор polyA 35S вируса CaMV.
Рекомбинантные нуклеотидные последовательности согласно изобретению, предпочтительно, содержат также нуклеотидную последовательность, используемую в качестве маркера вышеуказанных рекомбинантных последовательностей, особенно для дифференциации (и, следовательно, селекционирования) растительных клеток, которые трансформированы вышеуказанными рекомбинантными последовательностями, от тех, которые не содержат этого маркера.
Предпочтительно, такую нуклеотидную последовательность, используемую в качестве маркера вышеуказанных рекомбинантных последовательностей, выбирают из устойчивых к антибиотикам генов, как особенно ген устойчивости к канамицину.
Предметом изобретения является также любой вектор, особенно, плазмидный, содержащий рекомбинантную нуклеотидную последовательность согласно изобретению, включенную в сайт, не являющийся необходимым для ее репликации.
Изобретение касается также любой клетки-хозяина, особенно любой бактерии, такой как Agrobacterium tumefaciens, трансформированной вектором, таким как описанный выше.
Предметом настоящего изобретения является также любой способ получения рекомбинантной желудочной липазы собаки (LGC) в виде активного фермента и/или одного или нескольких полипептидных производных этого фермента, в частности, в результате добавления и/или супрессии, и/или замены одной аминокислоты (или нескольких аминокислот), причем такое полипептидное производное (полипептидные производные) обладает (обладают) липазной активностью, отличающийся тем, что он включает:
- трансформацию растительных клеток для интеграции в геном этих клеток одной или нескольких рекомбинантных нуклеотидных последовательностей согласно изобретению;
- при необходимости, получение трансформированных растений из вышеуказанных трансформированных клеток;
- выделение рекомбинантной желудочной липазы собаки (LGC) и/или упомянутого выше полипептидного производного (или полипептидных производных), продуцированного (продуцированных) в вышеуказанных трансформированных клетках или вышеуказанных трансформированных растениях, особенно, путем экстракции с последующей, при необходимости, очисткой.
В соответствии с вариантом осуществления указанного выше способа согласно изобретению, трансформация растительных клеток может производиться путем переноса рекомбинантной нуклеотидной последовательности, согласно изобретению, в протопласты, в частности, после инкубации этих последних в растворе полиэтиленгликоля (ПЭГ) в присутствии двухвалентных катионов (Ca2+) по методу, описанному в статье Krens и др., 1982 г.
Трансформацию растительных клеток можно также осуществлять с помощью электропорации, в частности, методом, описанным в статье Fromm и др., 1986 г.
Трансформацию растительных клеток можно также осуществлять с помощью генной пушки, обеспечивающей выброс с очень большой скоростью металлических частиц с покрывающими их рекомбинантными нуклеотидными последовательностями согласно изобретению, доставляя таким образом гены внутрь ядра клетки, в частности, с помощью метода, описанного в статье Sanford, 1988 г.
Другим методом трансформации растительных клеток является метод нуклеарной или цитоплазматической микроинъекции, как, например, метод, описанный в статье De La Penna и др., 1987 г.
В соответствии с наиболее предпочтительным вариантом осуществления указанного выше способа согласно изобретению растительные клетки трансформируют путем сочетания их с клеткой-хозяином, трансформированной вектором, согласно изобретению, например, описанным выше вектором, причем вышеуказанная клетка-хозяин способна инфицировать вышеуказанные растительные клетки, обеспечивая интеграцию в геном этих последних рекомбинантных нуклеотидных последовательностей, согласно изобретению, содержащихся первоначально в геноме вышеуказанного вектора.
Предпочтительно, вышеуказанной используемой клеткой-хозяином является Agrobacterium tumefaciens, в частности, согласно методам, описанным в статьях Bevan, 1984 г., и An и др., 1986 г., или же Agrobacterium rhizogenes, в частности, согласно методу, описанному в статье Jouanin и др., 1987 г.
Из растительных клеток, способных к трансформации в рамках настоящего изобретения, можно указать клетки рапса, табака, кукурузы, гороха, томата, моркови, пшеницы, ячменя, картофеля, сои, подсолнечника, салата-латука, риса и люцерны.
В соответствии с вариантом осуществления указанного выше способа согласно изобретению растительные клетки, трансформированные согласно изобретению, культивируют ин витро, особенно в биореакторах, по методу, описанному в работе Brodelius, 1988 г., в жидкой среде или согласно методу, описанному в работе Вrodelius и др. 1979 г., в иммобилизованной форме или еще согласно методу, описанному в работе Deno и др., 1987 г., путем культивирования трансформированных корней ин витро.
Вышеуказанные культуральные среды ин витро затем извлекают для экстрагирования из них и при необходимости очистки особенно посредством хроматографии рекомбинантной желудочной липазы собаки и/или полипептидного производного (полипептидных производных), описанного (описанных) выше, продуцированных вышеуказанными трансформированными клетками, культивированными ин витро.
В соответствии с предпочтительным вариантом осуществления вышеуказанного способа получения рекомбинантной LGC и/или полипептидного производного (полипептидных производных) согласно изобретению трансформация растительных клеток сопровождается стадией получения трансформированных растений путем культивирования указанных трансформированных клеток в соответствующей среде. Рекомбинантная LGC и/или полипептидное производное (полипептидные производные), продуцированные в клетках полученных таким образом целых растений, извлекают путем экстракции из целых растений или частей этих растений (особенно из листьев - или стеблей, или плодов) или еще из семян этих растений, причем за этой экстракцией при необходимости следует стадия очистки рекомбинантной желудочной липазы собаки (LGC) и/или полипептидного производного (полипептидных производных).
Трансформированными растениями, используемыми для извлечения рекомбинантной LGC и/или полипептидного производного (полипептидных производных) в рамках вышеуказанного способа, являются растения генерации ТО, а именно растения, полученные путем культивирования трансформированных клеток согласно изобретению на соответствующей среде или, предпочтительно, растения последующих генераций (T1, T2 и т.д.), полученных посредством самоопыления растений предыдущей генерации, в которых рекомбинантные нуклеотидные последовательности согласно изобретению размножаются по закону Менделя.
Из полипептидных производных желудочной липазы собаки (LGC), которые могут быть получены в рамках осуществления способа согласно изобретению, можно указать:
- полипептид, ограниченный аминокислотами, расположенными в позициях 55 и 379 на фиг.2, называемый еще полипептидом (Δ54) и представленный последовательностью №4, причем вышеуказанный полипептид кодирован нуклеотидной последовательностью, представленной последовательностью №3;
- полипептид, ограниченный аминокислотами, расположенными в позициях 5 и 379 на фиг.2, называемый еще полипептидом (Δ4) и представленный последовательностью №6,
причем данный полипептид кодирован нуклеотидной последовательностью, представленной последовательностью №5.
В особенности, предметом изобретения является любой способ, такой как, описанный выше, получения рекомбинантной желудочной липазы собаки (LGC), представленной на фиг.2, и при необходимости получения полипептидного производного (или нескольких полипептидных производных), особенно упомянутых выше полипептида (Δ54) и/или полипептида (Δ4), причем вышеуказанный способ отличается тем, что стадию трансформации растительных клеток реализуют за счет интеграции в геном этих клеток рекомбинантной последовательности, такой, как описанная выше, содержащей с одной стороны, кДНК, представленную на фиг.1, и, с другой стороны, последовательность, кодирующую сигнальный пептид из 22 аминокислот желудочной липазы кролика (LGL), преимущественно такую, которая кодирует 19 первых аминокислот сигнального пептида желудочной липазы кролика.
Более предпочтительно, изобретение относится к способу, такому как описанный выше, получения рекомбинантной желудочной липазы собаки, представленной на фиг.2, при необходимости, в сочетании с полипептидом (Δ54) и/или (Δ4), отличающемуся тем, что он включает:
- трансформацию клеток эксплантатов листьев растения за счет сочетания этих последних со штаммом Agrobacterium tumefaciens, трансформированным посредством плазмиды, например, описанной выше плазмидой, содержащей указанную выше рекомбинантную нуклеотидную последовательность pd35S-PSLGL-LGC, в соответствующей культуральной среде;
- селекцию трансформированных эксплантатов при использовании среды, содержащей канамицин;
- получение трансформированных растений из вышеуказанных трансформированных эксплантатов путем их культивирования на соответствующих средах;
- экстрагирование рекомбинантной желудочной липазы собаки и при необходимости полипептида (Δ54) и/или полипептида (Δ4), посредством гомогенизации листьев, и/или семян, и/или плодов вышеупомянутых трансформированных растений в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости, образующей растительный экстракт, обладающий ферментативной активностью;
- при необходимости, очистку рекомбинантной желудочной липазы собаки, исходя из экстракта, полученного во время предыдущей стадии, особенно, путем хроматографии надосадочной жидкости, в результате чего получают рекомбинантную желудочную липазу собаки, по существу, в чистом виде.
Предметом изобретения также является применение указанного способа для получения полипептида (Δ54) или (Δ4), по существу, в чистом виде путем очистки этих последних, исходя из экстракта, полученного указанным выше способом, в частности путем хроматографии надосадочной жидкости после экстракции.
Предметом изобретения, более предпочтительно, является способ получения вышеупомянутого полипептида (Δ4), при необходимости, по существу, в чистом виде, посредством осуществления описанного выше способа, при котором клетки, трансформированные последовательностью pd35S-PSLGL-LGC, представляют собой клетки эксплантатов листьев пасленовых, в частности табака или томата.
Согласно варианту осуществления упомянутого способа полипептид (Δ4) может быть специфически получен путем экстракции из листьев вышеуказанных трансформированных табачных растений, особенно путем гомогенизации этих листьев в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости. Затем полипептид (Δ4) может быть очищен, исходя из экстракта указанных листьев, содержащего указанный полипептид (Δ4), в частности посредством хроматографии указанной надосадочной жидкости.
Предметом изобретения является, более предпочтительно, любой способ, как, например, описанный выше способ, получения рекомбинантной желудочной липазы собаки и/или полипептидного производного (или нескольких полипептидных производных) указанной липазы, таких как, описанные выше, отличающийся тем, что стадию трансформации растительных клеток осуществляют путем интеграции в геном этих последних, последовательности, содержащей, с одной стороны, нуклеотидную последовательность, представленную на фиг.3, и, с другой стороны, последовательность, кодирующую описанный выше сигнальный пептид спорамина А.
Из полипептидных производных рекомбинантной желудочной липазы собаки, которые могут быть получены описанным выше способом, можно указать выше упомянутые полипептиды (Δ54) и/или (Δ4).
Изобретение, в особенности, относится к способу получения рекомбинантной желудочной липазы собаки и/или упомянутого выше полипептида (Δ54) и/или (Δ4), отличающемуся тем, что он включает:
- трансформацию клеток эксплантатов растения (в частности, эксплантатов листьев) путем сочетания указанных клеток со штаммом Agrobacterium tumefaciens, трансформированным плазмидой, например, описанной выше плазмидой, содержащей указанную выше рекомбинантную нуклеотидную последовательность pd35S-PS-LGC и/или pd35S-PPS-LGC;
- селекцию трансформированных эксплантатов при использовании среды, содержащей канамицин,
- получение трансформированных растений из вышеуказанных трансформированных эксплантатов путем культивирования этих эксплантатов на соответствующих средах;
- экстрагирование рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4), в частности, посредством гомогенизации листьев и/или семян, и/или плодов вышеуказанных трансформированных растений в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости, представляющей собой растительный, обладающий ферментативной активностью экстракт;
- при необходимости, очистку рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4), исходя из полученного в предыдущей стадии экстракта, в частности, путем хроматографии надосадочной жидкости, в результате чего получают рекомбинантную желудочную липазу собаки и/или полипептид (Δ54) и/или полипептид (Δ4), по существу, в чистом виде.
Изобретение преимущественно относится к способу получения вышеупомянутых полипептида (Δ54) и/или (Δ 4), при осуществлении описанного выше способа, в котором трансформированными клетками являются клетки эксплантатов листьев пасленовых, в частности табака или томата.
В соответствии с особым вариантом осуществления упомянутого выше способа согласно изобретению полипептид (Δ54) может быть специфически получен путем экстракции из семян упомянутых трансформированных табачных растений, в частности, путем гомогенизации этих семян в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости. Затем полипептид (Δ54) можно очищать исходя из экстракта указанных семян, содержащего указанный полипептид (Δ54), в частности посредством хроматографии указанной надосадочной жидкости.
Изобретение, в особенности, относится к способу получения рекомбинантной желудочной липазы собаки и/или упомянутого выше полипептида (Δ54), и/или (Δ4), отличающемуся тем, что он включает:
- трансформацию клеток эксплантатов листьев растения в результате сочетания этих последних со штаммом Agrobacterium tumefaciens, трансформированным посредством плазмиды, например, описанной выше плазмидой, содержащей указанную выше рекомбинантную нуклеотидную последовательность pCRU-PPS-LGC и/или последовательность pCRU-PS-LGC, и/или последовательность pGEAl-PSLGL-LGC, и/или последовательность PGEA6-PSLGL-LGC, и/или последовательность pAR-IAR-PSLGL-LGC, и/или последовательность рγ-зеин-РSLGL-LGС, и/или последовательность pγ-зеин-PSLGL-LGC-KDEL;
- селекцию трансформированных эксплантатов при использовании среды, содержащей канамицин;
- получение трансформированных растений из вышеуказанных трансформированных эксплантатов путем их культивирования на соответствующих средах;
- экстрагирование рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4) особенно посредством гомогенизации семян упомянутых выше трансформированных растений в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости, образующей растительный, обладающий ферментативной активностью, экстракт;
- при необходимости очистку рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4), исходя из полученного в предыдущей стадии экстракта, в частности, путем хроматографии надосадочной жидкости, в результате чего получают рекомбинантную желудочную липазу собаки, по существу, в чистом виде.
Изобретение, более предпочтительно, относится к способу получения упомянутого выше полипептида (Δ54) путем осуществлении описанного выше способа, при котором трансформированными клетками являются клетки эксплантатов рапса или табака, а экстрагирование полипептида (Δ54) осуществляют, в частности, путем гомогенизации трансформированных семян.
Растительные клетки, трансформированные согласно описанным выше способам, предпочтительно, выбирают из клеток табака, рапса, кукурузы, гороха, томата, моркови, пшеницы, ячменя, картофеля, сои, подсолнечника, салата-латука, риса и люцерны.
Изобретение, преимущественно, относится к способу получения рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4), отличающемуся тем, что он включает:
- трансформацию клеток каллусов кукурузы путем бомбардировки этих клеток из пушки плазмидами с рекомбинантной нуклеотидной последовательностью pAR-IAR-PSLGL-LGC и/или последовательностью рγ-зеин-PSLGL-LGC, и/или последовательностью pγ-зеин-PSLGL-LGC-KDEL;
- селекцию трансформированных каллусов при использовании среды, содержащей селективный агент, например канамицин;
- получение трансформированных растений кукурузы из вышеуказанных трансформированных каллусов путем их культивирования на соответствующих средах;
- экстрагирование рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4), в частности посредством гомогенизации семян упомянутых трансформированных растений в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости, образующей растительный, обладающий ферментативной активностью экстракт;
- при необходимости, очистку рекомбинантной желудочной липазы собаки и/или полипептида (Δ54), и/или полипептида (Δ4), исходя из полученного в предыдущей стадии экстракта, в частности, путем хроматографии надосадочной жидкости, в результате чего получают рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Δ4), по существу, в чистом виде.
Изобретение относится также к любой трансгенной растительной клетке, такой как описанная выше, содержащей рекомбинантный полипептид (или несколько рекомбинантных полипептидов) согласно изобретению, такие, как рекомбинантная желудочная липаза собаки и/или полипептид (Δ54), и/или полипептид (Δ4), причем указанная растительная клетка называется еще растительной клеткой с ферментативной активностью, преимущественно, с липазной активностью, такая как описываемая ниже.
Предметом изобретения также являются генетически трансформированные семена, содержащие одну рекомбинантную нуклеотидную последовательность (или несколько рекомбинантных нуклеотидных последовательностей), такую как описанная (описанные) выше последовательность (последовательности), согласно изобретению стабильно интегрированную в геном.
Изобретение относится также к описанным выше трансгенным семенам, содержащим один рекомбинантный полипептид (или несколько рекомбинантных полипептидов) согласно изобретению, например, рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Δ 4), причем указанные семена называются еще семенами с ферментативной активностью, преимущественно, с липазной активностью, такой как описываемая ниже.
Трансформированными согласно изобретению семенами являются семена, полученные от генетически трансформированных согласно изобретению растений, причем этими трансформированными растениями являются либо растения вышеуказанной генерации ТО, полученные путем культивирования трансформированных согласно изобретению клеток, либо растения последующих генераций (T1, T2 и т.д.), полученные самоопылением или скрещиванием растений предшествующих генераций (как было указано выше).
Предметом изобретения также являются генетически трансформированные растения или части растений (особенно эксплантаты, стебли, листья, плоды, корни, пыльца и т.д.), отличающиеся тем, что они содержат одну или несколько рекомбинантных нуклеотидных последовательностей таких, как описанные выше, стабильно интегрированных, согласно изобретению, в их геном.
Изобретение касается также описанных выше трансгенных растений или их частей, содержащих один или несколько рекомбинантных полипептидов согласно изобретению, таких как рекомбинантная желудочная липаза собаки и/или полипептид (Δ54), и/или полипептид (Δ4), причем названные растения или их части еще называются растениями или частями растений с ферментативной активностью, преимущественно с липазной активностью, такой как описываемая ниже.
Предметом изобретения, преимущественно, являются упомянутые выше трансформированные растения, такие, которые получают путем культивирования клеток или семян согласно изобретению, такие как описанные выше.
Трансформированные согласно изобретению растения или их части, предпочтительно, выбирают из рапса, табака, кукурузы, гороха, томата, моркови, пшеницы, ячменя, картофеля, сои, подсолнечника, риса, салата-латука, люцерны и свеклы или из частей этих растений.
Предметом настоящего изобретения является любой растительный экстракт с ферментативной активностью, более конкретно, с описываемой ниже липазной активностью, например, экстракт, получаемый по одному из описанных выше способов согласно изобретению и содержащий в качестве активных ферментов один рекомбинантный полипептид (или несколько рекомбинантных полипептидов) согласно изобретению, таких как рекомбинантная желудочная липаза собаки и/или полипептид (Δ54), и/или полипептид (Δ4).
Липазную (или липолитическую) активность растений или их частей, а также растительных экстрактов с ферментативной активностью согласно изобретению, можно, в особенности, определять методом Гаргури (Gargouri и др., 1986 г.), при котором используют триглицерид с короткой цепочкой (например, трибутирин) в качестве субстрата. Ферментативная активность выражается в единицах (ед.), при этом одна единица (ед.) соответствует количеству фермента, необходимого для выделения 1 мкмоль свободных жирных кислот в минуту при температуре 37°С при оптимальном значении рН.
Растительными экстрактами с ферментативной активностью согласно изобретению, предпочтительно, являются такие, где массовый процент ферментативно активных рекомбинантных полипептидов составляет приблизительно от 0,1 до 20 мас.%, особенно от около 1 до около 15 мас.%, от общей массы присутствующих в этих экстрактах протеинов, что соответствует величине ферментативной активности около 0,5-1000 ед./г сырой массы листьев, особенно около 10-300 ед./г сырой массы листьев или еще около 1-5000 ед./г сырой массы семян, особенно приблизительно 10-1000 ед./г сырой массы семян.
Предметом изобретения, в особенности, являются следующие растительные экстракты с ферментативной активностью:
- экстракты из листьев и/или плодов, и/или семян растений, таких как получаемые путем трансформации клеток эксплантатов этих растений с помощью последовательности pd35S-PSLGL-LGC, или последовательности pd35S-PS-LGC. или последовательности pd35S-PPS-LGC, по одному из описанных выше способов и содержащие рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Δ4), особенно:
- экстракт из листьев табака, такого как, получаемый путем трансформации клеток эксплантатов листьев табака, с помощью последовательности pd35S-PS-LGC или последовательности pd35S-PPS-LGC, по описанному выше способу и содержащий полипептид (Δ54) в сочетании с полипептидом (Δ4), причем массовый процент смеси этих обоих полипептидов по отношению к общей массе содержащихся в указанном экстракте протеинов составляет приблизительно от 0,1 до 20 мас.%, ферментативная активность этого экстракта составляет около 100-300 ед./г сырой массы;
- экстракт из листьев или плодов томатов, таких как, получаемые путем трансформации клеток эксплантатов из листьев томата с помощью последовательности pd35S-PS-LGC или последовательности pd35S-PPS-LGC, по описанному выше способу и содержащие полипептид (Δ54) в сочетании с полипептидом (Δ4), причем массовый процент смеси этих обоих полипептидов по отношению к общей массе содержащихся в указанном экстракте протеинов составляет приблизительно от 0,1 до 20 мас.%, ферментативная активность этого экстракта составляет около 100-300 ед./г сырой массы;
- экстракт из листьев табака, такого как, получаемый путем трансформации клеток эксплантатов из листьев табака с помощью последовательности pd35S-PSLGL-LGC по описанному выше способу и содержащий полипептид (Δ4), причем массовый процент этого полипептида по отношению к общей массе содержащихся в указанном экстракте протеинов составляет приблизительно от 0,1 до 20 мас.%, ферментативная активность этого экстракта составляет около 100-300 ед./г сырой массы;
- экстракт из семян табака, такого как получаемый путем трансформации клеток эксплантатов из листьев табака с помощью последовательности pd35S-PS-LGC или последовательности pd35S-PPS-LGC, по описанному выше способу и содержащий полипептид (Δ 54), причем массовый процент полипептида (Δ54) по отношению к общей массе содержащихся в указанном экстракте протеинов составляет приблизительно от 0,1 до 1 мас.%, ферментативная активность этого экстракта составляет около 10-300 ед./г сырой массы;
- экстракты из семян растений, таких как получаемые путем трансформации клеток эксплантатов этих растений с помощью последовательности pCRU-PS-LGC или последовательности pCRU-PPS-LGC, или последовательности pGEA1-PSLGL-LGC, или последовательности pGEA6-PSLGL-LGC, по одному из описанных выше способов и содержащие рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Д4), особенно:
- экстракт из семян рапса, такого как получаемый путем трансформации клеток эксплантатов из листьев рапса с помощью последовательности pCRU-PS-LGC или последовательности pCRU-PPS-LGC, или последовательности pGEA1-PSLGL-LGC, или последовательности pGEA6-PSLGL-LGC,
описанным выше способом и содержащий полипептид (Δ54), причем массовый процент полипептида (Δ54) по отношению к общей массе содержащихся в указанном экстракте протеинов составляет приблизительно от 0,1 до около 1 мас.%, ферментативная активность этого экстракта составляет от примерно 10 до примерно 1000 ед./г сырой массы;
- экстракты из семян растений, таких как получаемые путем трансформации клеток эксплантатов этих растений с помощью последовательности pAR-IAR-PSLGL-LGC и/или последовательности рγ-зеин-PSLGL-LGC, и/или последовательности pγ-зеин-PSLGL-LGC-KDEL, по одному из описанных выше способов и содержащие рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Δ4), особенно:
- экстракт из зерен кукурузы, такой как получаемый путем трансформации клеток кукурузы (в частности, каллусов кукурузы) с помощью последовательности pAR-IAR-PSLGL-LGC и/или последовательности pγ-зеин-PSLGL-LGC, и/или последовательности рγ-зеин-PSLGL-LGC-KDEL, по описанному выше способу и содержащая полипептид (Δ54), причем массовый процент полипептида (Δ54) по отношению к общей массе содержащихся в указанном экстракте протеинов составляет примерно от 0,1 до примерно 1 мас.%, ферментативная активность этого экстракта составляет от примерно 10 до примерно 1000 ед./г сырой массы.
Предметом настоящего изобретения также является любая ферментативно активная рекомбинантная желудочная липаза собаки, аминокислотной последовательностью которой является таковая, представленная на фиг.2, или ее полипептидные производные, получаемые, особенно, посредством добавления и/или супрессии, и/или замены одной или нескольких аминокислот, причем эти полипептидные производные обладают липазной активностью, такие, которые получают, по существу, в чистом виде одним из описанных выше способов согласно изобретению, причем эти способы включают стадию очистки рекомбинантных полипептидов согласно изобретению, особенно путем хроматографии описанных выше ферментативных экстрактов.
Предметом изобретения, более конкретно, являются полипептиды (Δ54) и (Δ4), указанные выше в качестве полипептидных производных вышеуказанной рекомбинантной LGC, молекулярные массы которых составляют соответственно около 37 кДа и около 49 кДа.
Под ферментативно активной рекомбинантной желудочной липазой собаки или полипептидными производными с липазной активностью, такими как указанные выше, понимают любой рекомбинантный полипептид, характеризующийся липазной активностью, такой, которую определяют по указанному выше методу Гаргури.
В качестве иллюстрации рекомбинантные полипептиды согласно изобретению характеризуются липазной активностью примерно от 10 до примерно 1000 ед./мг рекомбинантных полипептидов, предпочтительно, примерно 100-600 ед./мг.
Изобретение относится, особенно, к рекомбинантной желудочной липазе собаки, такой, какую получают путем очистки ферментативного экстракта из листьев или семян табака, причем указанные листья или семена получают от трансформированных табачных растений, которые, в свою очередь, получают из клеток табака, трансформированных с помощью последовательности pd35S-PSLGL-LGC по описанному выше способу, причем указанная рекомбинантная желудочная липаза собаки характеризуется липазной активностью, такой, как описанная выше.
Предметом изобретения также являются полипептид (Δ54) и полипептид (Δ4), которые получают очисткой ферментативного экстракта из листьев и/или семян, и/или плодов растений, в частности пасленовых, таких как трансформированные табак или томат, причем эти последние сами получают из клеток растений, трансформированных с помощью последовательности pd35S-PS-LGC или последовательности pd35S-PPS-LGC, или последовательности pd35S-PSLGL-LGC, по описанному выше способу, причем вышеуказанные рекомбинантные полипетиды (Δ54) и (Δ4) характеризуются липазной активностью, например, такой, как указанная выше.
Изобретение относится также к полипептиду (Δ54), такому, который получают очисткой ферментативного экстракта из семян табака или семян рапса, причем указанные семена получают соответственно от трансформированных растений табака или рапса, которые, в свою очередь, получают соответственно из клеток табака или рапса, трансформированных с помощью последовательности pCRU-PS-LGC и/или последовательности pCRU-PPS-LGC, по описанным выше способам, причем рекомбинантный полипептид (Δ54) характеризуется липазной активностью, такой как описанная выше.
Предметом изобретения также являются полипептид (Δ54) и полипептид (Δ4), получаемые путем очистки ферментативного экстракта из семян рапса, причем эти семена происходят от трансформированных растений рапса, которые, в свою очередь, получают из клеток рапса, трансформированных с помощью последовательности pGEA1-PSLGL-LGC и/или последовательности pGEA6-PSLGL-LGC, по описанным выше способам, причем рекомбинантные полипептиды (Δ4) и (Δ54) характеризуются липазной активностью, такой как описанная выше.
Предметом изобретения также являются полипептид (Δ54) и полипептид (Δ4), получаемые путем очистки ферментативного экстракта из зерен кукурузы, причем эти зерна происходят от трансформированных кукурузных растений, которые, в свою очередь, получают из клеток кукурузы, трансформированных с помощью последовательности pAR-IAR-PSLGL-LGC и/или рγ-зеин-PSLGL-LGC, и/или pγ-зеин-PSLGL-LGC-KDEL, по описанным выше способам, причем рекомбинантные полипептиды (Δ4) и (Δ54) характеризуются липазной активностью, такой как описанная выше.
Кажущиеся молекулярные массы полипептидов (Δ54) и (Δ4) согласно изобретению составляют, соответственно 37 кДа и 49 кДа, когда их определяют путем анализа при использовании полиакриламидного геля и путем иммунологического анализа после электрофоретического переноса на нитроцеллюлозу (эти методы детально рассмотрены в примерах осуществления изобретения, приводимых ниже).
Изобретение относится к антителам, направленным против рекомбинантных полипептидов согласно изобретению, в особенности, к таковым, направленным против рекомбинантной желудочной липазы собаки согласно изобретению и/или против вышеуказанных полипептида (Δ54), и/или полипептида (Δ4), и способным распознавать желудочную липазу человека.
Такие антитела можно получать в результате иммунизации животного указанными полипептидами с последующим выделением образовавшихся антител.
Само собой разумеется, что это продуцирование не ограничивается поликлональными антителами.
Его можно применять и для любого моноклонального антитела, продуцируемого любой гибридомой, которая может быть получена классическими методами из селезеночных клеток животного, особенно мыши или крысы, иммунизированных против одного из очищенных полипептидов согласно изобретению, с одной стороны, а также из клеток соответствующей миеломы, с другой стороны, и может быть селекционирована благодаря своей способности к продуцированию моноклональных антител, распознающих указанный выше полипептид, используемый первоначально для иммунизации животных, также, как желудочную липазу человека.
Изобретение касается также применения растений, их частей, растительных клеток или семян, трансформированных согласно изобретению, для получения рекомбинантного полипептида (или нескольких рекомбинантных полипептидов) согласно изобретению, таких как рекомбинантная желудочная липаза собаки или ее полипептидные производные, такие как указанные выше, особенно путем осуществления одного из приведенных выше способов согласно изобретению, причем вышеуказанные рекомбинантные полипептиды находятся, по существу, в чистом виде или содержатся в растительных экстрактах с ферментативной активностью, таких как описанные выше.
Предметом изобретения также является применение, в области питания человека или животного, растений или их частей с ферментативной активностью согласно изобретению, или растительных экстрактов с ферментативной активностью, таких как описанные выше, или еще рекомбинантных полипептидов согласно изобретению, таких как рекомбинантная желудочная липаза собаки или ее полипептидные производные, такие как описанные выше.
Изобретение, предпочтительно, относится к применению в качестве продуктов питания растений, их частей, особенно, листьев, плодов, семян, с ферментативной активностью согласно изобретению.
На этом основании предметом изобретения является, в особенности, любой пищевой продукт, получаемый из растения с ферментативной активностью, такого как описанное выше или из его частей, особенно из листьев или плодов, или еще семян этого растения, являющийся (являющиеся) съедобным для человека или животного.
Изобретение также относится к любой пищевой композиции, содержащей растение (или несколько растений) с ферментативной активностью, такое (такие) как описанное (описанные) выше и/или части такого растения (таких растений, особенно, листья и/или семена, и/или плоды этого растения (этих растений), и/или растительный экстракт (растительные экстракты) с ферментативной активностью, как, например, описанный (описанные) выше, и/или рекомбинантный полипептид (или рекомбинантные полипептиды) согласно изобретению, в случае необходимости, в сочетании с другим съедобным соединением (или несколькими другими съедобными соединениями.
Предпочтительно, растения или их части, содержащиеся в указанной пищевой композиции, находятся в виде гомогената.
Пищевые продукты согласно изобретению, называемые также функциональными пищевыми продуктами, или пищевые композиции согласно изобретению, предназначены, особенно, для облегчения абсорбции растительных или животных жиров, попадающих в желудок индивидуума, здорового или пораженного одной или несколькими патологиями, влияющими или не влияющими на степень продуцирования желудочной и/или панкреатической липазы. На этом основании продукты питания или пищевые композиции согласно изобретению, предпочтительно, используют в качестве пищевых добавок.
Предметом изобретения также является применение растений или их частей, особенно листьев и/или плодов, и/или семян, или растительных клеток с ферментативной активностью согласно изобретению или растительных экстрактов с ферментативной активностью, таких как описанные выше, или еще рекомбинантных полипептидов согласно изобретению, таких как рекомбинантная желудочная липаза собаки, или ее полипептидные производные, такие как описанные выше, для получения медикаментов (или фармацевтических композиций), предназначенных для облегчения абсорбции растительных или животных жиров, попадающих в желудок индивидуума, здорового или пораженного одной или несколькими патологиями, влияющими или не влияющими на степень продуцирования желудочной и/или панкреатической липазы.
В частности, такие фармацевтические композиции, предпочтительно, используют для индивидуумов, подвергающихся лечению, приводящему к ухудшению механизма абсорбции жиров или еще для лиц пожилого возраста.
Фармацевтические композиции согласно изобретению также, преимущественно, предназначены для лечения патологий, связанных с недостатком липаз (особенно желудочной и/ или панкреатической липаз) в организме, и более конкретно, патологий, таких как муковисцидоз или экзокринная панкреатическая недостаточность.
Предметом изобретения, более конкретно, является любая фармацевтическая композиция, содержащая описанный выше растительный экстракт (растительные экстракты) с ферментативной активностью и/или рекомбинантный полипептид (или несколько рекомбинантных полипептидов) согласно изобретению, при необходимости, в сочетании с фармацевтически приемлемым эксципиентом.
Предметом изобретения, в особенности, является любая указанная выше фармацевтическая композиция, содержащая рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Δ4), по существу, в чистом виде или в виде ферментативных экстрактов, таких как описанные выше.
Фармацевтические композиции согласно изобретению, предпочтительно, вводят перорально и, предпочтительно находятся, в виде желатиновых капсул, таблеток или разбавляемых порошков.
Суточная доза для человека, предпочтительно, составляет приблизительно 200-1000 мг, которую вводят частями, предпочтительно, в момент основных приемов пищи, в том случае, когда вышеуказанные фармацевтические композиции содержат ферментативные экстракты, такие как описанные выше, и около 100-500 мг в том случае, когда вышеуказанные фармацевтические композиции содержат рекомбинантные полипептиды согласно изобретению преимущественно в чистом виде.
Предметом изобретения также является применение растений или их частей, особенно листьев, и/или плодов, и/или семян, или растительных клеток, с ферментативной активностью согласно изобретению или растительных экстрактов с ферментативной активностью, таких, как описанные выше, или еще рекомбинантных полипептидов согласно изобретению, такие как, рекомбинантная желудочная липаза собаки, или ее полипептидных производных, таких, как описанные выше, для проведения ферментативных реакций в области индустрии, продовольственной промышленности или агропромышленности, особенно, в промышленности по производству жиров, липохимии и молочной промышленности.
На этом основании изобретение относится к любому способу, особенно ферментативной биоконверсии или биокатализа, путем осуществления одной или нескольких ферментативных реакций в области индустрии, продовольственной промышленности или в агропромышленности, особенно в промышленности по производству жиров, липохимии и молочной промышленности, причем эти ферментативные реакции проводят с помощью растений, или их частей, в частности листьев, и/или плодов, и/или семян, и/или растительных клеток, с ферментативной активностью согласно изобретению или растительных экстрактов с ферментативной активностью, таких как описанные выше, или еще рекомбинантных полипептидов согласно изобретению, как, например, рекомбинантная желудочная липаза собаки или ее полипептидные производные, такие как описанные выше.
Предметом изобретения, в частности, являются ферментативные препараты, предназначенные для использования в области индустрии, продовольственной промышленности и в агропромышленности, которые можно применять в рамках осуществления способа, такого как описанные выше и которые содержат растительный экстракт (или несколько растительных экстрактов) с ферментативной активностью, как, например, описанные выше, и/или один или несколько рекомбинантных полипептидов согласно изобретению, в частности рекомбинантная желудочная липаза собаки и/или полипептид (Δ54), и/или полипептид (Δ4), при необходимости, в сочетании с одной или несколькими добавками или одним, или несколькими другими ферментами, пригодными для применения в промышленном масштабе.
Изобретение относится также к применению растений или их частей, в частности листьев, и/или плодов, и/или семян, или растительных клеток с ферментативной активностью согласно изобретению для осуществления в промышленном масштабе реакций ферментативных биопревращений или биокатализов, таких как ферментативный гидролиз или ферментативная переэтерификация.
Растения с ферментативной активностью или части этих растений, в частности листья, и/или плоды, и/или семена, или растительные клетки согласно изобретению, предпочтительно, используют одновременно в качестве ферментативного источника и реакционного субстрата.
Предметом изобретения также является любой способ биокатализа, при котором используют растения или их части, в частности листья, и/или плоды, и/или семена, или растительные клетки с ферментативной активностью согласно изобретению, и, в частности, растения, содержащие рекомбинантную желудочную липазу собаки и/или полипептид (Δ54), и/или полипептид (Δ4), причем вышеуказанные растения или их части применяют одновременно в качестве ферментативного источника и реакционного субстрата.
Изобретение относится преимущественно к применению растений с ферментативной активностью, или частей этих растений согласно изобретению с целью получения биотоплива.
На этом основании предметом настоящего изобретения является любой способ получения биотоплива путем добавки спирта, особенно метанола или этанола, к гомогенату из целых или частей растений, трансформированных согласно изобретению, предпочтительно, к гомогенату из семян рапса, подсолнечника или сои, трансформированных в соответствии с изобретением, и путем рекуперации биотоплива, особенно, путем фильтрации.
Изобретение относится также к эфирам растительных жирных кислот, которые получают указанным выше способом, особенно, как метиловый эфир олеиновой кислоты.
Предметом изобретения также является любое биотопливо, например биотопливо, получаемое способом, таким, как описанный выше, и, в особенности, любое вышеуказанное биотопливо, содержащее эфиры растительных жирных кислот.
Изобретение, в частности, относится к любому биотопливу, такому, которое получают путем осуществления вышеуказанного способа из семян рапса и которое содержит метиловый эфир олеиновой кислоты.
Изобретение также относится к применению указанных выше антител, направленных против рекобинантных полипептидов согласно изобретению, для осуществления метода обнаружения или количественного анализа желудочной липазы собаки или человека в биологической пробе, которая может содержать такую липазу.
Изобретение относится, в особенности, к применению указанных антител для осуществления метода диагностики ин витро патологий, связанных со сверхпродуцированием или наоборот с недостаточностью, даже с отсутствием продуцирования липазы в организме.
Такой метод диагностики ин витро, реализуемый на отобранной у пациента биологической пробе, включает стадию сочетания указанной пробы с одним или несколькими антителами согласно изобретения, за которой следует стадия обнаружения возможных комплексов антитело-LGH, образовавшихся во время предыдущей стадии.
На этом основании изобретение относится также к набору для осуществления упомянутого выше метода обнаружения или диагностики ин витро, включающему:
- антитела, такие как описанные выше, предпочтительно, радиоактивно или ферментативно маркированные, а также реактивы для создания благоприятной среды при проведении иммунологической реакции между этими антителами и желудочной липазой человека,
- реактивы для обнаружения иммунологических комплексов, образовавшихся между этими антителами и желудочной липазой человека.
Предметом настоящего изобретения, в особенности, является применение рекомбинантной нуклеотидной последовательности, содержащей с одной стороны, кДНК, представленную на фиг.4 и кодирующую желудочную липазу человека, представленную на фиг.5, или происходящую от этой кДНК нуклеотидную последовательность, особенно, в результате добавки и/или супрессии, и/или замены одного или нескольких нуклеотидов, причем вышеуказанная производная последовательность способна кодировать полипептид, аминокислотная последовательность которого идентична таковой желудочной липазы человека, представленной на фиг.5, или полипептидное производное желудочной липазы человека, получаемое посредством добавки и/или супрессии, и/или замены одной, или нескольких аминокислот, причем это полипептидное производное характеризуется липазной активностью, и, с другой стороны, элементы, способствующие растительной клетке продуцировать полипептид, кодированный посредством вышеуказанной кДНК или выше указанной производной последовательностью, особенно промотор и терминатор транскрипции, распознаваемые транскрипционным аппаратом растительных клеток (в особенности, посредством РНК-полимераз этих клеток), с целью трансформации растительных клеток для получения из этих клеток или растений, полученных из этих клеток, рекомбинантной желудочной липазы в виде активного фермента или одного или нескольких полипептидных производных этого фермента, таких как описанные выше.
На этом основании изобретение относится к любой рекомбинантной нуклеотидной последовательности, такой как описанная выше, в рамках трансформации растений с целью получения рекомбинантной желудочной липазы собаки, в которой нуклеотидная последовательность, кодирующая желудочную липазу собаки и представленная на фиг.1 или 3, заменена нуклеотидной последовательностью, кодирующей желудочную липазу человека и представленной на фиг.4.
Предметом изобретения являются, в особенности, следующие рекомбинантные нуклеотидные последовательности:
- последовательность (обозначаемая как pSP-PSLGH-LGH), содержащая в направлении 5’→3’ промотор pSP бактерии Agribacterium tumefaciens, последовательность, которая кодирует сигнальный пептид желудочной липазы человека, за которой непосредственно следует представленная на фиг.4 нуклеотидная последовательность, затем - терминатор polyA S35 вируса CaMV,
- последовательность (обозначаемая как pSP-PSLPH-LGH), содержащая в направлении 5’→3’ промотор pSP бактерии Agribacterium tumefaciens, последовательность, которая кодирует сигнальный пептид желудочной липазы человека, за которой непосредственно следует представленная на фиг.4 нуклеотидная последовательность, затем - терминатор polyA S35 вируса CaMV,
- последовательность (обозначаемая как pSP-PSLGL-LGH), содержащая в направлении 5’→3’ промотор pSP бактерии Agribacterium tumefaciens, последовательность, которая кодирует часть сигнального пептида LGL (такой, как описанная выше), за которой непосредственно следует представленная на фиг.4 нуклеотидная последовательность, затем - терминатор polyA S35 вируса CaMV.
Изобретение относится также к векторам и клеткам-хозяевам, трансформированным указанными векторами, такими, как описанные выше, и содержащими вышеуказанные рекомбинантные нуклеотидные последовательности, кодирующие желудочную липазу человека и/или ее полипептидные производные.
Предметом настоящего изобретения является также любой способ получения рекомбинантной желудочной липазы человека в виде активного фермента и/или одного, или нескольких ее полипептидных производных, получаемых, особенно, посредством добавления и/или супрессии, и/или замены одной или нескольких аминокислот, причем это или эти полипептидные производные обладают липазной активностью, отличающийся тем, что он включает:
- трансформацию растительных клеток для интеграции в геном этих клеток одной или нескольких рекомбинантных нуклеотидных последовательностей согласно изобретению,
- при необходимости, получение трансформированных растений из указанных выше трансформированных клеток,
- выделение рекомбинантной липазы человека и/или одного, или нескольких вышеуказанных полипептидных производных, продуцированных в указанных выше трансформированных клетках или растениях, особенно путем экстракции с последующей, при необходимости, очисткой.
Предметом изобретения является, особенно, любой способ получения рекомбинантной желудочной липазы человека путем осуществления способа, такого, как описанный выше, в рамках получения рекомбинантной желудочной липазы собаки и/или ее полипептидных производных с помощью вышеуказанной рекомбинантной последовательности, включающей представленную на фиг.4 последовательность.
Из полипептидов, являющихся производными рекомбинантной желудочной липазы человека, которые можно получать в рамках осуществления способа согласно изобретению, можно указать:
- полипептид, ограниченный аминокислотами, расположенными в позициях 74 и 398 фиг.5, называемый также полипептидом (Δ54LGH),
- полипептид, ограниченный аминокислотами, расположенными в позициях 24 и 398 фиг.5, называемый также полипептидом (Δ4LGH),
Изобретение относится, в особенности, к способу получения, такому как описанный выше, рекомбинантной желудочной липазы человека и/или полипептида (Δ54LGH), и/или полипептида (Δ4LGH), отличающемуся тем, что он включает:
- трансформацию клеток эксплантатов из листьев растения за счет сочетания этих последних со штаммом Agrobacterium tumefaciens, трансформированным посредством плазмиды, такой как описанная выше, содержащей указанную выше рекомбинантную нуклеотидную последовательность pSP-PSLGH-LGH и/или pSP-PSLPH-LGH, и/или pSP-PSLGL-LGH, в соответствующей культуральной среде;
- селекцию трансформированных эксплантатов при использовании среды, содержащей канамицин,
- получение трансформированных растений из трансформированных эксплантатов, указанных выше, путем их культивирования в соответствующих средах,
- экстрагирование рекомбинантной желудочной липазы человека и/или полипептида (Δ54LGH), и/или полипептида (Δ4LGH), особенно посредством гомогенизации листьев и/или зерен, и/или плодов упомянутых трансформированных растений в соответствующем буфере, центрифугирования и рекуперации надосадочной жидкости, представляющей собой растительный, обладающий ферментативной активностью экстракт,
- при необходимости, очистку рекомбинантной желудочной липазы человека и/или полипептида (Δ54LGH), и/или полипептида (Δ4LGH), исходя из полученного во время предыдущей стадии экстракта, особенно, путем хроматографии надосадочной жидкости, в результате чего получают рекомбинантную желудочную липазу человека и/или полипептид (Δ54LGH), и/или полипептид (Δ4LGH), по существу в чистом виде.
Изобретение относится также ко всему растению или его части, как листья и/или плоды, и/или семена, содержащим одну или несколько рекомбинантных нуклеотидных последовательностей, таких как описанные выше, согласно изобретению, стабильно интегрированные в их геном.
Предметом настоящего изобретения является любой растительный экстракт с ферментативной активностью, в особенности с описываемой ниже липазной активностью, получаемый путем осуществления одного из описанных выше способов, согласно изобретению содержащий в качестве активных ферментов один или несколько рекомбинантных полипептидов согласно изобретению, таких как рекомбинантная желудочная липаза человека и/или полипептид (Δ54LGH), и/или полипептид (Δ4LGH).
Предметом изобретения являются, особенно, экстракты из листьев и/или семян растений, таких как получаемые путем трансформации клеток эксплантатов из этих растений с помощью последовательности pSP-PSLGH-LGH или последовательности pSP-PSLPH-LGH, или последовательности pSP-PSLGL-LGH одним из описанных выше способов, и содержащие рекомбинантную желудочную липазу человека и/или полипептид (Δ54LGH), и/или полипептид (Δ4LGH), в частности:
- экстракт из листьев или семян табака, такого как, получаемый путем трансформации клеток эксплантатов из табачных листьев, с помощью последовательности pSP-PSLGH-LGH или последовательности pSP-PSLPH-LGH, или последовательности pSP-PSLGL-LGH, согласно вышеописанному способу, и содержащий полипептид (Δ54LGH) в сочетании с полипептидом (Δ4LGH), причем массовый процент смеси из этих двух полипептидов по отношению к общей массе присутствующих в данном экстракте протеинов составляет от около 0,1 до около 20 мас.%, а ферментативная активность указанного экстракта достигает от около 100 до около 300 ед./г сырой массы;
- экстракт из листьев табака, такого как получаемый путем трансформации клеток эксплантатов из табачных листьев с помощью последовательности pSP-PSLGL-LGH и содержащий полипептид (Δ4LGH), причем массовый процент этого полипептида по отношению к общей массе присутствующих в данном экстракте протеинов составляет от около 0,1 до около 20 мас.%, а ферментативная активность указанного экстракта достигает от около 100 до около 300 ед./г сырой массы.
Предметом настоящего изобретения является также любая ферментативно активная рекомбинантная желудочная липаза человека, аминокислотной последовательностью которой является таковая, представленная на фиг.5, или ее полипептидные производные. Получаемые, в особенности, посредством добавления и/или супрессии, и/или замены одной, или нескольких аминокислот, в частности полипептиды (Δ54LGH) и (Δ4LGH), причем эти полипептидные производные характеризуются липазной активностью, такие как получаемые преимущественно, в чистом виде одним из описанных выше способов согласно изобретению, причем эти способы включают стадию очистки рекомбинантных полипептидов согласно изобретению, в частности путем хроматографии описанных выше ферментативных экстрактов.
Как уже указывалось выше применительно к рекомбинантной желудочной липазе собаки предметом изобретения также являются:
- поли- или моноклональные антитела, направленные против рекомбинантной желудочной липазы человека или ее полипептидных производных согласно изобретению и их применение, как описано выше;
- пищевые продукты или пищевые композиции, или фармацевтические композиции, или ферментативные препараты, предназначенные для промышленного применения, на основе растений или их частей, особенно листьев, и/или плодов, и/или семян, и/или растительных клеток, или растительных экстрактов, с ферментативной активностью, таких как описанные выше, или еще рекомбинантной желудочной липазы человека, или ее полипептидных производных согласно изобретению,
- любой способ ферментативной биоконверсии или биокатализа или получения биотоплива, как описанные выше, осуществляемые при использовании рекомбинантной желудочной липазы человека или ее полипептидных производных согласно изобретению или растений, или частей растений, в частности листьев и/или плодов, и/или семян, и/или растительных экстрактов с ферментативной активностью, таких как описанные выше.
Далее изобретение поясняется путем нижеследующего подробного описания получения рекомбинантных нуклеотидных последовательностей, таких как описанные выше, а также трансформированных растений, продуцирующих рекомбинантные полипептиды согласно изобретению, и способа получения биотоплива.
I. КОНСТРУКЦИЯ ХИМЕРНЫХ ГЕНОВ, КОДИРУЮЩИХ РЕКОМБИНАНТНЫЙ ПРОТЕИН ЖЕЛУДОЧНОЙ ЛИПАЗЫ СОБАКИ И ОБЕСПЕЧИВАЮЩИХ ЭКСПРЕССИЮ В ЛИСТЬЯХ И СЕМЕНАХ ПАСЛЕНОВЫХ
(I-A) Конструкция химерных генов, кодирующих рекомбинантную желудочную липазу собаки и обеспечивающих экспрессию в табаке.
Для экспрессии в листьях и семенах табака гена, кодирующего желудочную липазу собаки, требуются следующие регулирующие последовательности:
1. Двойной конститутивный промотор 35S (pd35S) вируса мозаики цветной капусты CaMV.
Он соответствует удвоению последовательностей, активирующих транскрипцию и расположенных выше элемента ТАТА природного промотора 35S (Кау и др., 1987 г.).
2. Концевая последовательность транскрипции, терминатор poly 35S, который соответствует некодирующему участку 3’ последовательности вируса с двухцепочечной кольцевой ДНК мозаики цветной капусты, продуцирующей транскрипт S35 (Frank и др., 1980 г.).
Конструкции различных плазмид при использовании приемов, связанных с рекомбинантной ДНК (Sambrook и др., 1989 г.), образуются из рВIOС4. Данная бинарная плазмида происходит от pGA492 (An, 1986 г.), которая содержит между левым и правым краями, происходящие от плазмиды pTiT37 Agrobacterium tumefaciens в ее переносимой ДНК, следующие последовательности:
конститутивный промотор гена поз, кодирующего нопалинсинтазу (Depicker и др., 1982 г.); кодирующая последовательность гена nptII, кодирующего неомицинфосфотрансферазу II (Berg и Berg, 1983 г.), полученная в результате делеции участка первых 8 кодонов, в числе которых инициирующий кодон метионин ATG, и слияния с последовательностью из 14 первых кодонов кодирующей последовательности гена nos (Depicker и др., 1982 г.); кодирующая последовательность гена nos, лишенная участка из 14 первых кодонов; терминатор nos (Depicker и др., 1982 г.); участок с множественными сайтами клонирования (называемый также “полилинкер”) (HindIII-Xbal-SacI-HpaI-KpnI-ClaI-BgiII), предшествующий гену cat, кодирующему хлорамфениколацетилтрансферазу (Close и Rodriguez, 1982 г.), а также концевые последовательности гена 6 плазмиды pTiA6 Agrobacterium tumefaciens (Liu и др., 1993 г.). Для почти полного удаления кодирующей последовательности гена cat плазмиду pGA492 вдвойне переваривают с помощью SacI (сайт рестрикции полилинкера) и с помощью ScaI (сайт рестрикции, присутствующий в последовательности гена cat), после чего подвергают воздействию фермента Т4 ДНК полимеразы (New England Biolabs) в соответствии с рекомендациями изготовителя. Лигирование модифицированной плазмиды (20 нг) производят в 10 мкл реакционной среды, содержавшей 1 мкл буферного раствора Т4 ДНК лигазы × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигазы (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которые предварительно делают компетентными, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, селекционированных при использовании среды, содержащей 12 мкг/мл тетрациклина, экстрагируют методом щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания. Затем сайт рестрикции HindIII плазмидной ДНК удержанного клона модифицируют в сайте рестрикции EcoRI с помощью фосфорилированного адаптера HindIII-EcoRI (Stratagene Cloning Systems). Для проведения такой модификации 500 нг плазмидной ДНК удержанного клона переваривают с помощью HindIII, дефосфорилируют с помощью фермента щелочной фосфатазы телячьего кишечника (Boenringer Mannheim), в соответствии с рекомендациями изготовителя, и соосаждают в присутствии 1500 нг ДНК адаптера HindIII-EcoRI, 1/10 объема 3М раствора ацетата натрия, рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 мин. После центрифугирования с ускорением 1200 g в течение 30 мин выпавшую в осадок ДНК промывают 70%-ным этанолом, сушат. Обрабатывают с помощью 8 мкл воды, выдерживают при 65°С в течение 10 минут, затем лигируют в присутствии 1 мкл буфера Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. После инактивации Т4 ДНК лигазы при 65°С в течение 10 минут реакционную смесь после лигирования переваривают с помощью EcoRI, очищают посредством электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют, как описано выше. Бактерии Escherichia coli DH5α, которые предварительно делают компетентными, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, селекционированных при использовании среды, содержащей 12 мкг/мл тетрациклина, экстрагируют методом щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания, особенно с помощью HindIII и EcoRI. Результирующую бинарную плазмиду, содержащую не более 9 последних кодонов кодирующей последовательности гена cat и сайт EcoRI, который является единственным, обозначают как pBIOC4.
Кассету экспрессии, образованную промотором pd35S и терминатором poly A35S, выделяют из плазмиды рJIТ163Δ. Плазмида рJТ163Δ происходит от плазмиды рJТ163, которая, в свою очередь, сама образуется из плазмиды РJIT60 (Guerineau и Mullineaux, 1993 г.). Плазмида рjТ163 содержит кодон ATG, расположенный между сайтами HindIII и Sall полилинкера. Для удаления упомянутого кодона ATG и получения плазмиды рJIТ163Δ, плазмидную ДНК рJIТ163 вдвойне переваривают с помощью HindIII и Sall, очищают посредством электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рH 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, подвергают воздействию фермента Кленова (New England Biolabs) в соответствии с рекомендациями изготовителя, удаляют протеин путем экстракции с помощью 1 объема смеси фенол : хлороформ : изоамиловый спирт в соотношении 25:24:1, затем одного объема смеси хлороформ : изоамиловый спирт в соотношении 24:1, осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат и, наконец, лигируют в присутствии 1 мкл буфера Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которые предварительно делают компетентными, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, селекционированных в среде, содержащей 50 мкг/мл ампициллина, экстрагируют методом щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Для выделения кассеты экспрессии, образованной промотором pd35S и терминатором polyA 35S (фрагмент SacI-Xhol), плазмидную ДНК удержанного клона рJТ163Δ переваривают с помощью SacI и XhoI. Фрагмент SacI-XhoI, содержащийся в кассете экспрессии, очищают посредством электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем подвергают воздействию фермента Mung Bean Nuclease (New England Biolabs) в соответствии с рекомендациями изготовителя.
Эту очищенную вставку (200 нг) клонируют в плазмидной ДНК рВIOС4 (20 нг), переваривают с помощью EcoRI, обрабатывают ферментом Mung Bean Nuclease и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Реакцию лигирования проводят в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигазы × 10 (Amersham), 2 мкл 50%-ного полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которые предварительно делают компетентными, трансформируют (Hanahan, 1983 г.) Плазмидную ДНК полученных клонов, селекционированных при использовании среды, содержащей 12 мкг/мл тетрациклина, экстрагируют методом щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как рВIOС21.
Желудочную липазу собаки (LGC) легко синтезируют в виде предшественника. Зрелый протеин желудочной липазы собаки состоит из 379 аминокислот. Комплементарную ДНК желудочной липазы собаки клонируют в сайтах BglII и SalI вектора экспрессии pRU303, получая вектор pDGL5.303, который описан в международной заявке 94/13816. Его используют для конструкции бинарных плазмид рВIOС25, содержащей PS-LGC и рВIOС26, содержащей PPS-LGC, где последовательность, кодирующая зрелую LGC, предшествует таковой, кодирующей сигнальный пептид (PS) или препропептид (PPS, т.е. сигнальный пептид, за которым следуют N-концевые вакуолярные направляющие последовательности соответственно растительного происхождения. Последовательностями PS и PPS, образованными соответственно 23 и 37 аминокислотами, являются таковые запасного протеина клубневидных корней батата: спорамин А (Murakami и др., 1986 г., Matsukoa и Nakamura, 1991 г.).
Для упрощения слияния последовательности зрелой желудочной липазы собаки с таковой сигналов адресации, PS или PPS, плазмиду pDGL5.303 модифицируют посредством введения дополнительного сайта рестрикции HindIII в четвертый и пятый кодоны последовательности зрелой желудочной липазы собаки посредством мутагенеэа, направляемого с помощью полимеразно-цепьевой реакции (ПЦР) с использованием двух олигодезоксинуклеотидов: 5’ caggagatc TTG TTT GGA AAG CTT CAT CCC 3’ (содержащий единственный сайт BglII в плазмиде и дающий дополнительный сайт HindIII) и 5’ CAT ATT ССТ CAG CTG GGT АТС 3’ (содержащий единственный сайт PvuII в плазмиде). Амплификацию путем ПЦР фрагмента BglII-PvuII осуществляют в 100 мкл реакционной среды, содержащей 10 мкл буфера Taq ДНК полимераза × 10 (500 мМ КСl, 100 мМ Tris-HCl, pH 9,0 и 1% Triton × 100), 6 мкл 25 мМ MgCl2, 3 мкл 10 мМ dNTP (dATP, dCTP, dGTP, dTTP), 100 пМ каждого из описанных выше двух олигодезоксинуклеотидов, 5 нг матричной ДНК (вектор экспрессии pRU.303, включающий комплементарную ДНК желудочной липазы собаки), 2,5 ед. Taq ДНК полимеразы (Промега) и 2 капли вазелинового масла. ДНК денатурируют при 94°С в течение 5 минут, подвергают 30 циклам, каждый из которых включает: 1 минута денатурации при 94°С; 1 минута гибридизации при 50°С и 1 минута элонгации при 72°С, затем элонгацию при 72°С продолжают в течение 5 минут. Эту реакцию ПЦР проводят в аппарате “DNA Thermal Cycler” фирмы “Perkin Elmer Cetus”.
Масло удаляют посредством экстракции хлороформом. Затем содержащиеся в реакционной среде фрагменты ДНК осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат и переваривают с помощью двух ферментов рестрикции BglII и PvuII. Происходящие из ПЦР переваренные фрагменты ДНК очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют с плазмидной ДНК вектора pDGL.303, вдвойне переваривают с помощью BglII и PvuII, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют, осаждают с помощью спирта, сушат и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигирование осуществляют со 100 нг описанного выше дефосфорилированного вектора и 50 нг переваренных ферментов ДНК, происходящих от амплификации с помощью ПЦР и описанных выше в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4-ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, предварительно сделанные компетентными, трансформируют (Hanahan, 1983 г.).
Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Плазмидную ДНК некоторых удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). При введении этого сайта рестрикции HindIII генетический код желудочной липазы собаки не изменяется. В самом деле, последовательность природной желудочной липазы собаки ААА ТТА (Lys-Leu) превращается в AAG СТТ (Lys-Leu). Полученную в результате плазмиду обозначают как рВIOС22, причем она включает последовательность протеина зрелой желудочной липазы собаки, которая соответствует:
LEU РНЕ GLY LYS LEU----THR ASP ASN LYS АМВ
agate TTG TTT GGA AAG СТТ---АСА GAT AAT AAG TAG TTCTAGA----
---- ----

LEU: первый кодон зрелой желудочной липазы собаки; АМВ: стоп-кодон.
А. КОНСТРУКЦИЯ БИНАРНОЙ ПЛАЗМИДЫ рВIOС25, СОДЕРЖАЩЕЙ PS-LGC
Плазмиду рВIOС22 переваривают полностью с помощью BglII и, частично, с помощью HindIII с целью удаления последовательности, кодирующей полипептид Leu-Phe-Gly-Lys (4 первые аминокислоты) протеина зрелой желудочной липазы собаки. Эту последовательность заменяют таковой, кодирующей сигнальный пептид PS из 23 аминокислот (ATG ААА GCC ТТС АСА СТС GCT СТС ТТС ТТА GCT СТТ ТСС СТС TAT CTC CTG CCC AAT CCA GCC CAT ТСС), осуществляют слияние с последовательностью из 4 первых кодонов последовательности, кодирующей протеин зрелой желудочной липазы собаки (“PS-4 первых кодонов зрелой желудочной липазы собаки”). Последовательность “PS-4 первых кодонов зрелой желудочной липазы собаки” амплифицируют с помощью ПЦР, исходя из плазмиды рМАТ103 (Matsuoka и Nakamura, 1991 г.) с помощью следующих двух олигодезоксинуклеотидов: 5’ caggagatctgATG AAA GCC TTC АСА CTC GC 3’ и 5’ G ATG AAG CTT TCC AAA CAA GGA ATG GGC TGG ATT GGG CAG G 3’, следуя протоколу амплификации ПЦР, как описано выше, в разделе 1. После двойного ферментативного переваривания с помощью BglII и HindIII фрагменты ДНК, полученные после амплификации с помощью ПЦР, очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют с плазмидной ДНК рВIOС22, которую вдвойне переваривают с помощью BglII и HindIII, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и дефосфорилируют с помощью фермента щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя.
Лигируют со 100 нг описанного выше дефосфорилированного вектора и 50 нг переваренных фрагментов ДНК, полученных после амплификации с помощью ПЦР и описанных выше, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4-ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют методом щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Плазмидную ДНК некоторых удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Последовательности PS и зрелой желудочной липазы собаки клонируют, сохраняя открытыми их рамки считывания. Расщепляемой последовательностью, расположенной между последовательностями PS и зрелой желудочной липазы собаки, является Ser-Leu.
Полученную в результате этого плазмиду обозначают как рВIOС23. Фрагмент BglII-Xbal, включающий последовательность PS-LGC выделяют из рВIOС23 путем двойного ферментативного переваривания с помощью BglII и Xbal, очистки путем электрофореза на 0,8%-ном геле агарозы, электроэлюации (Sambrook и др., 1989 г.), осаждения спиртом, высушивания. После этого этот фрагмент обрабатывают ферментом Кленова в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК рВIOС21, переваривают в сайте HindIII, обрабатывают ферментом Кленова и дефосфорилируют с помощью фермента щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих PS-LGC, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученный клон обозначают как рВIOС25. Нуклеотидную последовательность фрагмента, кодирующего рекомбинантный протеин PS-LGC, анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Плазмидную ДНК бинарного вектора рВIOС25 вводят путем прямой трансформации в штамм LBA4404 Agrobacterium tumefaciens no методу Holsters и др. (1978 г.). Пригодность удержанного клона контролируют ферментативным перевариванием плазмидной ДНК.
Б. КОНСТРУКЦИЯ БИНАРНОЙ ПЛАЗМИДЫ рВIOС26, СОДЕРЖАЩЕЙ PPS-LGC
Плазмиду рВIOС22 переваривают полностью с помощью BgIII и, частично, с помощью HindiIII с целью удаления последовательности, кодирующей полипептид Leu-Phe-Gly-Lys протеина зрелой желудочной липазы собаки. Эту последовательность заменяют таковой, кодирующей сигнальный пептид PPS из 37 аминокислот (ATG AAA GCC TTC АСА СТС GCT СТС TTC ТТА GCT СТТ ТСС СТС ТАТ СТС CTG ССС ААТ ССА GCC CAT ТСС AGG TTC ААТ ССС АТС CGC СТС ССС АСС АСА САС GAA ССС GCC), подвергают слиянию с последовательностью из 4 первых кодонов протеина зрелой желудочной липазы собаки (“PPS-4 первых кодонов зрелой желудочной липазы собаки”). Последовательность “PPS-4 первых кодонов зрелой желудочной липазы собаки” амплифицируют путем ПЦР, исходя из плазмиды рМАТ103 (Matsuoka и Nakamura, 1991 г.) с помощью следующих двух олигодезоксинуклеотидов: 5’ caggagatctgATG AAA GCC TTC АСА СТС GC 3’ и 5’ G ATG AAG CTT TCC AAA CAA GGC GGG TTC GTG TGT GGT TG 3’, следуя протоколу амплификации путем ПЦР, как описано выше, в разделе 1.
После двойного ферментативного переваривания с помощью BglII и HindIII, фрагменты ДНК, полученные после амплификации с помощью ПЦР, очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют с плазмидной ДНК рВIOС22, вдвойне переваривают с помощью BglII и HindIII, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют со 100 нг описанного выше дефосфорилированного вектора и 50 нг описанных выше переваренных фрагментов ДНК, происходящих от амплификации путем ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед.фермента Т4-ДНК-лигаза (Amersham) при 14° С в течение 16 часов. Бактерии Escherichia coli DH5α, которым придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции.
Плазмидную ДНК некоторых удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Последовательности PPS и зрелой LGC клонируют, сохраняя открытыми их рамки считывания. Расщепляемой последовательностью между двумя последовательностями является Ala-Leu.
Полученную в результате этого плазмиду обозначают как рВIOС24. Фрагмент BglII-Xbal, включающий последовательность PPS-LGC, выделяют из рВIOС24 двойным ферментативным перевариванием с помощью BglII и Xbal, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают этанолом и сушат. Затем этот фрагмент обрабатывают ферментом Кленова в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК рВ10С21, переваривают в сайте HindIII, обрабатывают ферментом Кленова и дефосфорилируют с помощью фермента щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих PPS-LGC, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют ферментативным перевариванием с помощью ферментов рестрикции. Полученный клон обозначают как рВIOС26. Нуклеотидную последовательность фрагмента, кодирующего рекомбинантный протеин PPS-LGC, анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Плазмидную ДНК бинарного вектора рВIOС26 вводят прямой трансформацией в штамм LBA4404 Agrobacterium tumefaciens по методу Holsters и др. (1978 г.). Пригодность полученного клона контролируют путем ферментативного переваривания введенной плазмидной ДНК.
В. КОНСТРУКЦИЯ БИНАРНОЙ ПЛАЗМИДЫ рВIOС41, СОДЕРЖАЩЕЙ PSLGL-LGC.
Желудочную липазу кролика синтезируют в виде предшественника, включающего сигнальный пептид из 22 аминокислот, расположенный на NH2-конце и предшествующий полипептидной последовательности зрелой липазы; клон PJO101, содержащий полную кДНК, кодирующую желудочную липазу кролика, описан в европейской заявке на патент №92403055.4, поданной 12.11.92 исследовательским институтом “Institut de Recherche Jouveinal” и озаглавленной “Нуклеиновые кислоты, кодирующие желудочную липазу кролика и полипептидные производные, их применение для продуцирования этих полипептидов и фармацевтические композиции на их основе”.
Выстраивание полипептидных последовательностей желудочной липазы собаки и предшественника желудочной липазы кролика показывает, что последовательность LFGK присутствует в обоих протеинах. В полипептидной последовательности липазы кролика, найденной в природном очищенном протеине (Moreau и др., 1988 г.), первые три остатка L, F, G отсутствуют и входят в состав сигнального пептида с 22 аминокислотами желудочной липазы кролика (LGL). Поэтому сигнальный пептид желудочной липазы кролика, лишенный указанных трех общих аминокислот, слился со зрелой протеиновой последовательностью желудочной липазы собаки. Ее полипептидная последовательность состоит из 19 следующих аминокислот: MWVLFMVAALLSALGTTHG.
Плазмиду рВIOС22, следовательно, переваривают полностью с помощью BglII и, частично, с помощью HindIII с целью удаления последовательности, кодирующей полипептид Leu-Phe-Gly-Lys (4 первые аминокислоты) протеина зрелой желудочной липазы собаки. Эту последовательность заменяют таковой, кодирующей сигнальный пептид PSLGL желудочной липазы кролика из 19 аминокислот (ATG TGG GTG CTT TTC ATG GTG GCA GCT TTG СТА ТСТ GCA CTT GGA ACT АСА CAT GGT), подвергают слиянию с последовательностью из 4 первых кодонов протеина зрелой желудочной липазы собаки (“PSLGL-4 первых кодонов зрелой желудочной липазы собаки”). Последовательность “PSLGL-4 первых кодонов зрелой желудочной липазы собаки” амплифицируют посредством ПЦР, исходя из плазмиды PJO101, с помощью следующих двух олигодезоксинуклеотидов: 5’ aggagatctcaacaATG TGG GTG CTT TTC ATG GTG 3’ и 5’ G ATG AAG CTT TCC AAA CAA ACC ATG TGT AGT TCC AAG TG 3’, следуя протоколу амплификации ПЦР, который описан выше, в разделе 1. После двойного ферментативного переваривания с помощью BglII и HindIII, фрагменты ДНК, полученные после амплификации с помощью ПЦР, очищают электрофорезом на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют с плазмидной ДНК, входящей в состав рВIOС22, вдвойне переваривают с помощью BglII и HindIII, очищают электрофорезом на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют со 100 нг описанного выше дефосфорилированного вектора и 50 нг описанных выше переваренных фрагментов ДНК, происходящих от амплификации с помощью ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Плазмидную ДНК некоторых удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования Т7™, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Последовательности PSLGL и зрелой желудочной липазы собаки клонируют, сохраняя открытыми их рамки считывания (т.е. таким образом, что они образуют одну открытую рамку считывания). Расщепляемой последовательностью, расположенной между двумя последовательностями PSLGL и зрелой LGC, является Gly-Leu.
Полученную в результате плазмиду обозначают как рВIOС40. Фрагмент BglII-Xbal, несущий последовательность PSLGL-LGC, выделяют из рВIOС40 двойным ферментативным перевариванием с помощью BglII и Xbal, очисткой путем электрофореза на 0,8%-ном геле агарозы, электроэлюацией (Sambrook и др., 1989 г.), осаждением спиртом, высушиванием. После этого этот фрагмент ДНК обрабатывают ферментом Кленова в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК рВIOС21, переваривают в сайте HindIII, обрабатывают ферментом Кленова и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих PSLGL-LGC, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученный клон обозначают как рВIOС41. Нуклеотидную последовательность фрагментов, кодирующую рекомбинантный протеин PSLGL-LGC, анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др./ 1977 г.). Плазмидную ДНК бинарного вектора рВIOС41 вводят путем прямой трансформации в штамм LBA4404 Agrobacterium tumefaciens no методу Holsters и др. (1978 г.). Пригодность полученного клона контролируют путем ферментативного переваривания введенной плазмидной ДНК.
1-Б. Конструкция химерных генов, кодирующих рекомбинантную желудочную липазу собаки и обеспечивающих экспрессию в томате.
Использованные конструкции являются такими же, что и конструкции, указанные для генетической трансформации табака, а именно плазмиды рВIOС25, рВIOС26 и рВIOС41.
II. КОНСТРУКЦИЯ ХИМЕРНЫХ ГЕНОВ, КОДИРУЮЩИХ РЕКОМБИНАНТНЫЙ ПРОТЕИН ЖЕЛУДОЧНОЙ ЛИПАЗЫ СОБАКИ И ОБЕСПЕЧИВАЮЩИХ ЭКСПРЕССИЮ В СЕМЕНАХ РАПСА
а) Конструкция бинарной плазмиды рВIOС28, содержащей промотор pCRU.
Экспрессия желудочной липазы собаки (LGC) в семенах рапса вызывает необходимость вставки кДНК, кодирующей LGC, между следующими регулирующими последовательностями:
1. промотор pCRU, соответствующий некодирующему участку 5’ гена запасного протеина семян, круциферин А редьки (Depigny-This и др., 1992 г.) и способствующий специфической экспрессии в семенах;
2. Концевая последовательность транскрипции, терминатор polyA 35 S, соответствующий некодирующему участку 3’ последовательности вируса с двухцепочечной циклической ДНК мозаики цветной капусты, продуцирующей транскриптор S35 (Franck и др., 1980 г.).
Для получения подобной рВIOС21 бинарной плазмиды, у которой, однако промотор pd35S заменен на промотор pCRU, фрагмент “EcoRI, обработанный ферментом Кленова и BamHI”, содержащий промотор pCRU, выделяют из плазмиды рВI221-CRURSP, происходящей от рВI221 (выпускается в продажу фирмой “Clontech”) путем замены промотора S35 промотором pCRU.
Фрагмент “EcoRI, обработанный ферментом Кленова и BamHI”, содержащий промотор pCRU, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и лигируют с плазмидной ДНК рJIТ163 (описано в разделе 1), переваривают с помощью KpnI, обрабатывают посредством Т4 ДНК полимеразы (New England Biolabs) в соответствии с рекомендациями изготовителя, затем переваривают с помощью ВаmHI, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и дефосфорилируют посредством фермента щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК “EcoRI, обработанный ферментом Кленова и BamHI” в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигазы × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как PBIOC27.
Кассету экспрессии, состоящую из промотора pCRU и терминатора polyA S35, выделяют из рВIOС27 путем переваривания полностью с помощью XhoI, с последующим частичным перевариванием EcoRI. Ее очищают электрофорезом на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат, обрабатывают ферментом Кленова (New England Biolabs) в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК рВIOС24 в сайте EcoRI, обработанном ферментом Кленова, и дефосфорилируют посредством фермента щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК XhoI-EcoRI в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как рВIOС28.
б) Конструкция бинарной плазмиды рВIOС29, содержащей PPS-LGC
Выделение фрагмента BglII-XbaI, содержащего последовательность PPS-LGC, из рВIOС24 было уже описано в разделе 1-А-б. Этот фрагмент лигируют с плазмидной ДНК рВIOС28 в сайте EcoRI, обработанном ферментом Кленова, и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК BglII-Xhol, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.).
Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как рВIOС29. Нуклеотидную последовательность рекомбинантного протеина PPS-LGC анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Плазмидную ДНК бинарного вектора рВIOС29 вводят прямой трансформацией в штамм LBA4404 Agrobacterium tumefaciens по методу Holsters и др. (1978 г.). Пригодность полученного клона контролируют путем ферментативного переваривания введенной плазмидной ДНК.
в) Конструкция бинарных плазмид рВIOС90 и рВIOС91, содержащих промотор pGEA1D.
Для экспрессии в семенах рапса животного гена, кодирующего желудочную липазу собаки, необходимы следующие регулирующие последовательности.
1. Промотор pGEA1, соответствующий некодирующему участку 5’ гена запасного протеина семян, GEA1 Arabidopsis thaliana (Gaubier и др., 1993 г.) и обеспечивающий специфическую экспрессию в семенах;
2. Концевая последовательность транскрипции, терминатор роlyA 35S, соответствующий некодирующему участку 3’ последовательности вируса с двухцепочечной циклической ДНК мозаики цветной капусты, продуцирующей транскрипт S35 (Franck и др., 1980 г.).
Для получения подобной рВIOС21 бинарной плазмиды рВIOС90, у которой, однако, промотор pd35S заменен на промотор pGEA1D, фрагмент HindIII-BamHI, обработанный по Кленову и содержащий промотор pGEA1, выделяют из плазмиды pGUS2-pGEA1. Клон pGUS-2-pGEA1, происходящий от рВI221 в результате замены промотора p35S промотором pGEA1, содержит в рамке считывания 2 ATG: ATG гена GEA1 (Еm2) и ATG гена gus. ATG гена GEA1 удаляют. Фрагмент ДНК, находящийся между сайтом SalI и последовательностями выше ATG гена GEA1 клона pGUS-2-pGEAl, амплифицируют по способу ПЦР с помощью двух олигонуклеотидов: 5’ CAAACGTGTACAATAGCCC 3’ и 5’ CCCGGGGATCCTTTTTTG 3’. Подбирают температуру гибридизации. Амплифицированный путем ПЦР фрагмент переваривают с помощью SalI и BamHI, очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют с плазмидной ДНК, входящей в состав pGUS-2-GEAl, вдвойне переваривают с помощью SalI и BamHI, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sarobrook и др., 1989 г.), осаждают спиртом и сушат. Лигируют со 100 нг вектора и 50 нг описанных выше переваренных фрагментов ДНК, происходящих от амплификации с помощью ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Некоторые из удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Полученный клон обозначают как pGUS-2-pGEAlD.
Фрагмент HindIII-BamHI, содержащий промотор pGEAlD, выделенный из pGUS-2-pGEAlD и обработанный ферментом Кленова в соответствии с рекомендациями изготовителя (Biolabs), очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и лигируют с плазмидной ДНК рВIOС21 в сайгах Kpnl и HindIII, обработанных ферментом Т4 ДНК полимераза (Biolabs) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг дефосфорилированного рВIOС21 и 200 нг описанных выше фрагментов ДНК XhoI-EcoRI, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-го раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как рВIOС90.
Для получения бинарной плазмиды рВIOС91 кассету экспрессии “pGEA1D-tNOS”, выделенную из pBSII-pGEA1D, вводят в бинарную плазмиду pSCV1.2, которую, в свою очередь, получают путем клонирования фрагмента HindIII, содержащего кассету экспрессии “p35S-nptII-tNOS”, описанную Fromm и др. (1986 г.), в сайте HindIII pSCV1, созданном Edwards G.A. в 1990 г., при использовании обычных способов клонирования.
Плазмиду pBSII-pGEA1D получают в два этапа:
- во-первых, фрагмент SacI-EcoRI, несущий tNOS (терминатор гена нопалинсинтазы), бактерии Agrobacterium tumefaciens, обработанный фрагментом Т4 ДНК полимераза (Biolabs) в соответствии с рекомендациями изготовителя и очищенный, клонируют в сайте EcoRV pBSIISK+ (выпускается в продажу фирмой Stratagene), дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) согласно рекомендациям изготовителя. Лигируют с 20 нг дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих tNOS, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придают компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Некоторые из удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.).
Полученную плазмиду обозначают как pBSII-tNOS; - во-вторых, фрагмент, несущий pGEA1D, вдвойне переваренный с помощью HindIII, обработанный ферментом Кленова и BamHI и очищенный, клонируют в сайтах “Xbal, обработанный ферментом Кленова и BamHI” плазмиды pBSII-tNOS. Лигируют со 100 нг вектора и 50 нг описанных выше фрагментов ДНК в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как pBSII-pGEA1D.
Затем кассету экспрессии “pGEA1D-tNOS”, которая содержит фрагмент XbaI-HindIII, обработанный ферментом Кленова, клонируют в сайте SmaI pSCV1.2, дефосфорилированном ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигируют с 20 нг дефосфорилированного вектора pSCV1.2 и 200 нг фрагментов, несущих кассету экспрессии “pGEA1D-tNOS”, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как pBIOC91.
г) Конструкция бинарной плазмиды рВIOС92, содержащей промотор pGEA6D.
Для экспрессии в семенах рапса животного гена, кодирующего желудочную липазу собаки, необходимы следующие регулирующие последовательности:
1. Промотор pGEA6, соответствующий некодирующему участку 5’ гена запасного протеина семян, GEA6 Arabidopsis thaliana (Gaubier и др., 1993 г.) и обеспечивающий специфическую экспрессию в семенах;
2. Концевая последовательность транскрипции, терминатор poly A 35S, соответствующий некодирующему участку 3’ последовательности вируса с двухцепочечной циклической ДНК мозаики цветной капусты, продуцирующей транскрипт S35 (Franck и др., 1980 г.).
Для получения подобной рВIOС21 бинарной плазмиды рВIOС92, у которой, однако, промотор pd35S заменен на промотор pGEA6D, фрагмент EcoRI-BamHI, обработанный ферментом Кленова, содержащий промотор pGEA6, выделяют из плазмиды pGUS2-pGEA6. Клон pGUS-2-pGEA6, происходящий от pUC18, содержит в рамке считывания 2 ATG: ATG гена GEA6 (Еm6) и ATG гена gus. ATG гена GEA6 разрушают. Фрагмент ДНК, находящийся между сайтом АсcI и последовательностями выше ATG гена GEA6 клона pGUS-2-pGEA6, амплифицируют с помощью ПЦР с помощью двух олигонуклеотидов: 5’ AAGTACGGCCACTACCACG 3’ и 5’ CCCGGGGATCCTGGCTC 3’. Температуру гибридизации подбирают.
Амплифицированный с помощью ПЦР фрагмент переваривают с помощью АсcI и BamHI, очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат, затем лигируют с плазмидной ДНК, входящей в состав pGUS-2-GEA6, вдвойне переваренной с помощью АсcI и BamHI, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом и сушат. Лигируют со 100 нг описанного выше вектора и 50 нг описанных выше переваренных фрагментов ДНК, происходящих от амплификации с помощью ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amlrsham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Некоторые из удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Полученный клон обозначают как pGUS-2-pGEA6D.
Фрагмент EcoRI-BamHI, содержащий промотор pGEA6D, выделенный из pGUS-2-pGEA6D и обработанный ферментом Кленова в соответствии с рекомендациями изготовителя (Biolabs), очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, сушат и лигируют с сайтом Xhol, обработанным ферментом Кленова, плазмидной ДНК, модифицированной рВIOС21. Модифицированную плазмиду рВIOС21 получают двойным перевариванием с помощью HindIII, обработанного ферментом Кленова и Kpnl pBIOC21 для удаления фрагмента, несущего промотор pd35S, с заменой его фрагментом KpnI-EcoRV, несущим полилинкер, образованный сайгами KpnI-Xhol-SalI-ClaI-HindIII-BamHI-SmaI-EcoRI-EcoRV, относящимися к pBSIISK+.
Лигируют с 20 нг модифицированной дефосфорилированной pBIOC21 и 200 нг описанных выше фрагментов ДНК EcoRI-BamHI в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Предварительно подготовленные бактерии, Escherichia coli DH5α, которым предварительно придают компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как рВIOС92.
д) Конструкция бинарных плазмид рВIOС93, рВIOС94, рВIOС95, рВIOС96 и рВIOС97, содержащих PSLGL-LGC.
Плазмида рВIOС40 описана выше. Эта плазмида содержит фрагмент BglII-XbaI, несущий последовательность PSLGL-LGC.
Этот фрагмент выделяют двойным ферментативным перевариванием с помощью BglII и XbaI, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют, осаждают спиртом, высушивают, обрабатывают ферментом Кленова и лигируют с рВIOС28 (описана выше), переваренной с помощью EcoRI, обработанный ферментом Кленова и дефосфорилированной; с рВIOС90, переваренной с помощью EcoRI, обработанной ферментом Кленова и дефосфорилированной; с рВIOС91, переваренной с помощью Smal и дефосфорилированной; с рВIOС92, переваренной с помощью HindIII, обработанной ферментом Кленова и дефосфорилированной, с целью получения, соответственно рВIOС93, рВIOС94, рВIOС95 и рВIOС96.
Плазмиду рВIOС97 получают в результате клонирования фрагмента KpnI-EcoRV, несущего кассету экспрессии “pGEA6D-PSLGL-LGC-t35S”, обрабатывают ферментом Т4 ДНК полимераза, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют, осаждают спиртом, высушивают и лигируют с pSCV1.2, переваренной с помощью Smal и дефосфорилированной. Кассету экспрессии “pGEA6D-PSLGL-LGC-t35S” получают из pBIOC92.
III. КОНСТРУКЦИЯ ХИМЕРНЫХ ГЕНОВ, КОДИРУЮЩИХ РЕКОМБИНАНТНЫЙ ПРОТЕИН ЖЕЛУДОЧНОЙ ЛИПАЗЫ ЧЕЛОВЕКА И ОБЕСПЕЧИВАЩИХ КОНСТИТУТИВНУЮ ЭКСПРЕССИЮ, НАПРИМЕР, В ЛИСТЬЯХ И СЕМЕНАХ ТАБАКА
а) Конструкция бинарной плазмиды рВIOС82, содержащей химерный промотор СУПЕРПРОМОТОР pSP.
Для экспрессии гена, кодирующего желудочную липазу человека (LGH), в табачных листьях необходимы следующие регулирующие последовательности:
1. Химерный промотор (сверхпромотор; pSP; заявка PCT/US94/12946). Его образует тройной повтор транскрипционного активирующего элемента промотора гена октопинсинтазы Agrobacterium tumefaciens, транскрипционного активирующего элемента промотора гена маннопинсинтазы и промотора маннопинсинтазы бактерии Agrobacterium tumefaciens;
2. Концевая последовательность транскрипции, терминатор polyA 35S, соответствующий некодирующему участку 3’ последовательности вируса с двухцепочечной циклической ДНК мозаики цветной капусты, продуцирующей транскрипт S35 (Franck и др., 1980 г.).
Для получения подобной рВIOС21 бинарной плазмиды рВIOС92, в случае которой, однако, промотор pd35S заменен на промотор pSP, фрагмент pvuII-SalI подвергнут воздействию фермента Кленова, содержащего промотор pSP, выделяют из плазмиды pBISN1 (заявка PCT/US 94/12946), очищают путем электрофореза на 1%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом, высушивают и лигируют с плазмидной ДНК pBIOC81, подвергнутой двойному перевариванию с помощью Kpnl и EcoRI, воздействию Т4 ДНК полимеразы и дефосфорилированной ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Плазмида pBIOC81 соответствует рВIOС21, сайт которой Xbal удален. Для достижения этого плазмиду рВIOС21 переваривают с помощью Xbal, затем подвергают воздействию фермента Кленова и лигируют с Т4 ДНК лигазой.
Лигируют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше, несущих pSP фрагментов ДНК в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как pBIOC82.
Желудочную липазу человека (LGH) легко синтезируют в виде предшественника, описанного в публикации Bodmer и др., 1987 г. Зрелый протеин желудочной липазы человека состоит из 379 аминокислот. Его сигнальный пептид (PSLGH) включает 19 аминокислот. Сайтом расщепления между PSLGH и LGH является Gly-Leu.
Последовательность, кодирующую предшественника желудочной липазы человека, используют для конструкции бинарных плазмид: рВIOС85, содержащей PSLGH-LGH; рВIOС87, содержащей PSLPH-LGH и рВIOС89, содержащей PSLGL-LGH, где последовательность, кодирующая желудочную липазу человека, предшествует последовательностям, кодирующим, соответственно, его природный сигнальный пептид PSLGH, сигнальный пептид панкреатической липазы человека (PSLPH; Giller и др., 1992 г.) и сигнальный пептид желудочной липазы кролика (PSLGL; выше уже описано; европейский патент №924030554).
Последовательность, кодирующую предшественника желудочной липазы человека, выделяют двойным перевариванием с помощью PstI и Dral, очищают путем электрофореза на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом и сушат. Затем ее клонируют в сайтах PstI и SpeI (подвергают воздействию фермента Т4 ДНК полимераза (Biolabs) в соответствии с рекомендациями изготовителя) плазмиды pBSIISK+, выпускаемой в продажу фирмой Stratagene. Лигируют с 100 нг вектора и 50 нг описанных выше фрагментов ДНК, несущей последовательность, кодирующую предшественника желудочной липазы человека, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × (Amrsham), и 2,5 ед. фермента Т4 ДНК лигаза (Amarsham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученную плазмиду обозначают как рВIOС83.
Последовательность, кодирующую зрелую липазу человека, модифицируют введением сайта BamHI, до этого отсутствующего, в девятый и десятый кодоны посредством направленного с помощью ПЦР мутагенеза, используя 2 олигодезоксинуклеотида: 5’ aaactgcaggctcgag TTG. ТТТ GGA ААА ТТА CAT CCT GGA ТСС ССТ GAA GTG ACT ATG 3’ (содержащий единственные сайты PstI, XhoI и BamHI) и 5’ ААТ GGT GGT GCC CTG GGA ATG GCC ААС АТА GTG TAG CTG С 3’ (содержащий один сайт MscI в плазмиде pBIOC83).
ПЦР-амплификацию фрагмента PstI-MscI осуществляют в 100 мкл реакционной среды, содержащей 10 мкл буферного раствора Taq ДНК полимеразы × 10 (500 мМ Трис-HCl, рН 9,0, и 1% Тритона × 100), 6 мкл 25 мМ MgCl2, 3 мкл 10 мМ dNTR (dATR, dCTP, dGTP, dTTP), 100 нМ каждого из двух описанных выше олигодезоксинуклеотидов, 5 нг матричной ДНК (вектор pBIOC83), 2,5 ед. Taq ДНК полимеразы (Promega) и 2 капли вазелинового масла. ДНК денатурируют при 94°С в течение 5 мин, подвергают 30 циклам, каждый из которых включает: 1 минута денатурации при 94°С; 1 минута гибридизации при 65°С и 1 минута элонгации при 72°С, затем элонгацию при 72°С проводят в течение 5 минут. Эту полимеразно-цепьевую реакцию осуществляют в аппарате “DNA Thermal Cycler” фирмы PERKIN ELMER CETUS. Масло удаляют экстракцией с помощью хлороформа. Затем фрагменты ДНК осаждают из реакционной среды в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат и переваривают с помощью двух фрагментов рестрикции PstI и Mscl.
Переваренные фрагменты ДНК, полученные после амплификации с помощью ПЦР, очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат и лигируют с плазмидной ДНК плазмиды рВIOС83, подвергнутой двойному перевариванию с помощью PstI и MscI, очистке путем электрофореза на 0,8%-ном геле агарозы, электроэлюации, осаждению спиртом и сушке. Лигируют со 100 нг вектора и 50 нг описанных выше переваренных фрагментов ДНК, происходящих от амплификации с помощью ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Anersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придают компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Некоторые из удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Введение сайта рестрикции BamHI не изменяет изменения генетического кода желудочной липазы человека. В самом деле, природная последовательность желудочной липазы человека GGA AGC (Gly-Ser) превращается в GGA TCC (Gly-Ser). Полученную плазмиду обозначают как рВIOС84.
б) Конструкция бинарной плазмиды рВIOС85, содержащей PSLGH-LGH
Фрагмент PstI-XbaI, несущий последовательность PSLGH-LGH, выделяют путем двойного ферментативного переваривания с помощью PstI-XbaI из рВIOС83, очищают электрофорезом на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом и сушат. Затем указанный фрагмент ДНК обрабатывают ферментом Т4 ДНК полимераза (Biolabs) в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК плазмиды рВIOС82, переваренной в сайте XbaI, обработанной ферментом Кленова (Biolabs) и дефосфорилированной посредством фермента щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя.
Лигирование осуществляют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше, содержащих PSLGH-LGH фрагментов ДНК в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придают компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Полученный клон обозначают как рВIOС52. Нуклеотидную последовательность фрагмента, кодирующего рекомбинантный протеин PSLGH-LGH, анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Последовательностью расщепления между последовательностями PSLGH и зрелой LGH является Gly-Leu. Плазмидную ДНК бинарного вектора рВIO85 вводят прямой трансформацией в штамм LBA4404 бактерии. Agrobacterium tumefaciens no методу Holsters и др. (1978 г.). Пригодность удержанного клона контролируют ферментативным перевариванием введенной плазмидной ДНК.
в) Конструкция бинарной плазмиды рВIOС86, содержащей PSLGH-LGH
Плазмиду рВIOС84 подвергают двойному перевариванию с помощью PstI и BamI с целью удаления последовательности, кодирующей сигнальный пептид PSLGH и 8 первых аминокислот зрелого протеина LGH (Leu-Phe-Gly-Lys-Leu-His-Pro-Gly). Эту последовательность заменяют таковой, кодирующей сигнальный пептид PSLGH из 16 аминокислот (ATG CTG ССА СТТ TGG ACT CTT ТСА CTG CTG CTG GGA GCA GTA GCA GGA) и осуществляют слияние с последовательностью, кодирующей 8 первых кодонов зрелого протеина LGH (“PSLPH-8 первых кодонов зрелой желудочной липазы человека”). Последовательность “PSLPH-8 первых кодонов зрелой желудочной липазы человека” амплифицируют с помощью ПЦР, исходя из матрицы 5’ aaactgcaggctcgagaacaATG CTG ССА СТТ TGG ACT СТТ ТСА CTG CTG CTG GGA GCA GTA GCA GGA TTG TTT GGA AAA TTA CAT CCT GGA tcc CCT G 3’ с помощью двух олигодезоксинуклеотидов: 5’ aaactgcaggctcgagaacaATG С 3’ и 5’ С AGGSgga TCC AGG ATG TAA TTT TCC 3’, следуя протоколу амплификации с помощью ПЦР, как описано выше (см. выше раздел I). Температуру гибридизации подбирают.
После двойного ферментативного переваривания с помощью PstI и BamHI, фрагменты ДНК, полученные путем амплификации с помощью ПЦР, очищают путем электрофореза на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 минут, центрифугируют при ускорении 12000 g в течение 30 минут, промывают 70%-ным этанолом, сушат и лигируют с плазмидной ДНК плазмиды рВIOС84, вдвойне переваренной с помощью PstI и BamHI, очищенной электрофорезом на 0,8%-ном геле агарозы, подвергнутой электроэлюации (Sambrook и др., 1989 г.), осажденной спиртом и высушенной. Лигируют со 100 нг вектора и 50 нг описанных выше, переваренных фрагментов ДНК, происходящих от амплификации с помощью ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которых предварительно делают компетентными, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Некоторые из удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Последовательности PSLGL и зрелой желудочной липазы человека клонируют, сохраняя открытыми их рамки считывания (т.е. таким образом, что они образуют одну открытую рамку считывания). Последовательностью расщепления между последовательностями PSLGL и зрелой LGH является Gly-Leu. Полученную в результате плазмиду обозначают как рВIOС86.
Из плазмиды рВIOС86 выделяют фрагмент PstI-XbaI, несущий последовательность PSLPH-LGH, двойным ферментативным перевариванием с помощью PstI и XbaI, очищают электрофорезом на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом и высушивают. Затем этот фрагмент ДНК обрабатывают ферментом Т4 ДНК полимераза (Biolabs) в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК плазмиды рВIOС82, переваренной в сайте XbaI, обработанной ферментом Кленова (Biolabs) и дефосфорилированной ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигирование осуществляют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих PSLGH-LGH, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которых предварительно делают компетентными, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют ферментативным перевариванием под действием ферментов рестрикции. Полученный клон обозначают как рВIOС87. Нуклеотидную последовательность фрагмента, кодирующего рекомбинантный протеин PSLPH-LGH, анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Phamacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Плазмидную ДНК бинарного вектора рВIOС87 вводят прямой трансформацией в штамм LBA4404 бактерии Agrobacterium tumefaciens по методу Holsters и др. (1978 г.). Пригодность удержанного клона контролируют ферментативным перевариванием введенной плазмидной ДНК.
г) Конструкция бинарной плазмиды рВIOС89, содержащей PSLGL-LGH
Плазмиду рВIOС84 подвергают двойному перевариванию с помощью PstI и BamI с целью удаления последовательности, кодирующей сигнальный пептид PSLGH и 8 первых аминокислот зрелого протеина желудочной липазы человека (Leu-Phe-Gly- Lys-Leu-His-Pro-Gly). Эту последовательность заменяют последовательностью, кодирующей сигнальный пептид PSLGL, состоящий из 19 аминокислот (ATG ТGG GTG СТТ ТТС ATG GTG GCA GCT TTG СТА ТСТ GCA СТТ GGA ACT АСА CAT GGT), и подвергают слиянию с последовательностью, кодирующей 8 первых кодонов протеина зрелой желудочной липазы человека (“PSLGL-8 первых кодонов зрелой желудочной липазы человека”). Последовательность “PSLGL-8 первых кодонов зрелой желудочной липазы человека” амплифицируют посредством ПЦР, исходя из матрицы 5’ aaactgcaggctcgagaacaATG TGG GTG CTT TTC ATG GTG GCA GCT TTG СТА TCT GCA CTT GGA ACT АСА CAT GGT TTG TTT GGA AAA TTA CAT CCT GGA tcc CCT G 3’ с помощью двух олигодезоксинуклеотидов: 5’ aaactgcaggctcgagaacaATG TGG 3’ и 5’ С AGG gga TCC AGG ATG TAA TTT TCC 3’, следуя протоколу амплификации с помощью ПЦР, как описано ранее (см. выше, раздел I). Подбирают температуру гибридизации.
После двойного ферментативного переваривания с помощью PstI и BamHI, фрагменты ДНК, полученные после амплификации с помощью ПЦР, очищают электрофорезом на 2%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают в присутствии 1/10 объема 3 М раствора ацетата натрия с рН 4,8 и 2,5 объема абсолютного этанола при -80°С в течение 30 мин, центрифугируют при ускорении 12000 g в течение 30 мин, промывают 70%-ным этанолом, сушат и лигируют с плазмидной ДНК плазмиды рВIOС84, вдвойне переваренной с помощью PstI и BamHI, очищенной электрофорезом на 0, 8%-ном геле агарозы, подвергнутой электроэлюации (Sambrook и др., 1989 г.), осажденной спиртом и высушенной. Лигируют со 100 нг вектора и 50 нг описанных выше, переваренных фрагментов ДНК, происходящих от амплификации с помощью ПЦР, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которых предварительно делают компетентными, трансформируют (Hanahan, 1983 г.).
Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания с помощью ферментов рестрикции. Некоторые из удержанных клонов анализируют путем секвенирования с помощью набора для секвенирования Т7TM, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Последовательности PSLGL и зрелой желудочной липазы человека клонируют, сохраняя открытыми их рамки считывания (т.е. таким образом, что они образуют одну открытую рамку считывания). Последовательностью расщепления между последовательностями PSLGL и зрелой LGH является Gly-Leu. Полученную в результате плазмиду обозначают как рВIOС88.
Из плазмиды рВIOС88 выделяют фрагмент PstI-XbaI, несущий последовательность PSLGL-LGH, двойным ферментативным перевариванием с помощью PstI и XbaI, очищают электрофорезом на 0,8%-ном геле агарозы, электроэлюируют (Sambrook и др., 1989 г.), осаждают спиртом и высушивают. Затем этот фрагмент ДНК обрабатывают ферментом Т4 ДНК полимераза (Biolabs) в соответствии с рекомендациями изготовителя и лигируют с плазмидной ДНК плазмиды рВIOС82, переваренной в сайте XbaI, обработанной ферментом Кленова (Biolabs) и дефосфорилированной ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигирование осуществляют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих PSLGL-LGH, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4 ДНК лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4 ДНК лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которых предварительно делают компетентными, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 12 мкг/мл тетрациклина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют ферментативным перевариванием с помощью ферментов рестрикции. Полученный клон обозначают как рВ10С89. Нуклеиновую последовательность фрагмента, кодирующего рекомбинантный протеин PSLGL-LGH, анализируют путем секвенирования с помощью набора для секвенирования Т7™, выпускаемого в продажу фирмой Pharmacia, по методу с использованием дидезоксинуклеотидов (Sanger и др., 1977 г.). Плазмидную ДНК бинарного вектора рВIOС89 вводят прямой трансформацией в штамм LBA4404 бактерии Agrobacterium tumefaciens по методу Holsters и др. (1978 г.). Пригодность полученного клона контролируют ферментативным перевариванием введенной плазмидной ДНК.
IV. КОНСТРУКЦИЯ ХИМЕРНЫХ ГЕНОВ, КОДИРУЮЩИХ РЕКОМБИНАНТНЫЙ ПРОТЕИН ЖЕЛУДОЧНОЙ ЛИПАЗЫ СОБАКИ И ОБЕСПЕЧИВАЮЩИХ ЭКСПРЕССИЮ В СЕМЕНАХ КУКУРУЗЫ
а) Конструкция плазмид рВIOС98 и рВIOС99, содержащих PSLGL-LGC и обеспечивающих структурную экспрессию в семенах кукурузы.
Для конститутивной экспрессии в семенах кукурузы животного гена, кодирующего желудочную липазу собаки (LGC), требуются следующие регулирующие последовательности:
1. один из двух промоторов, обеспечивающих конститутивную экспрессию:
- актиновый промотор риса, следующий за актиновым интроном (pAR-IAR), содержащийся в плазмиде pAct1-F4, описанной McElroy и др. (1991 г.);
- двойной конститутивный промотор 35S(pd35S) вируса CaMV (вирус мозаики цветной капусты). Он соответствует удвоению последовательностей, активирующих транскрипцию и расположенных выше элемента ТАТА природного промотора 35S (Кау и др., 1987 г.).
2. один из двух терминаторов:
- концевая последовательность транскрипции, терминатор polyA 35S, соответствующий некодирующему участку 3’ последовательности вируса с двухцепочечной циклической ДНК мозаики цветной капусты, продуцирующий транскриптор 35S (Franck и др., 1980 г.);
- концевая последовательность транскрипции, терминатор polyA NOS, соответствующий некодирующему участку 3’ гена нопалинсинтазы плазмиды Ti бактерии Agrobacterium tumefaciens штамма с нопалином (Depicker и др., 1982 г.).
Плазмиду pBIOC98, в которой последовательность, кодирующая PSLGL-LGC, находится под контролем pAR-IAR, получают клонированием фрагмента BglII-XbaI, несущего последовательность, кодирующую PSLGL-LGC в сайтах “NcoI и SalI” pBSII-pAR-IAR-tNOS.
Из плазмиды рВIOС40 (описана выше) выделяют фрагмент BglI-XbaI, несущий кодирующую PSLGL-LGC последовательность, двойным ферментативным перевариванием под действием BglII и Xbal, очищают электрофорезом на 0,8%-ном геле агарозы, электроэлюируют, осаждают спиртом, сушат и затем обрабатывают ферментом Кленова. Плазмиду pBSII-pAR-IAR-tNOS подвергают двойному перевариванию под действием SalI и NcoI, очищают, ферментом Mung Bean Nuclease (Biolabs) и дефосфорилируют ферментом щелочной фосфатазы кишечника теленка (Boehringer Mannheim) в соответствии с рекомендациями изготовителя. Лигирование осуществляют с 20 нг описанного выше дефосфорилированного вектора и 200 нг описанных выше фрагментов ДНК, содержащих кодирующую PSLGL-LGC последовательность, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4-ДНК-лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4-ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют ферментативным перевариванием под действием ферментов рестрикции. Полученный клон обозначают как рВIOС98.
Плазмиду pBSII-pAR-IAR-tNOS получают клонированием в сайтах “Есо01091, обработанный ферментом Кленова и Kpnl” pBSII-tNOS фрагмента SnaBI-KpnI, несущего последовательность, соответствующую “pAR-IAR-началу последовательности, кодирующей ген gus”, выделенную из плазмиды pActl-F4. Лигирование осуществляют со 100 нг вектора и 50 нг переваренных фрагментов ДНК, описанных выше, в 10 мкл реакционной среды в присутствии 1 мкл буферного раствора Т4-ДНК-лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания под действием ферментов рестрикции.
Плазмиду pBSII-tNOS получают клонированием в дефосфорилированном сайте EcoRV pBSIISK+, выпускаемой в продажу фирмой Stratagene, фрагмента SacI-EcoRI, несущего последовательность tNOS, выделенного из рВI121, выпускаемой в продажу фирмой Clontech, в результате двойного ферментативного переваривания под действием Sad и EcoRV, очищают электрофорезом на 2%-ном геле агарозы и обрабатывают ферментом Т4-ДНК-полимераза. Лигирование осуществляют с 20 нг дефосфорилированного вектора и 200 нг фрагментов ДНК, содержащей последовательность tNOS, описанных выше, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4-ДНК-лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4-ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют ферментативным перевариванием под действием ферментов рестрикции.
Плазмиду рВIOС99, в которой кодирующая PSLGL-LGC последовательность находится под контролем pd35S, получают путем клонирования, в сайтах “КnpI и BamHI” плазмиды pBSII-t35S, фрагмента Knpl и BamHI, несущего последовательность, соответствующую “pd35S-PSLGL-LGC”, выделенному из описанной выше плазмиды рВIOС41. Лигирование осуществляют со 100 нг вектора и 50 нг переваренных фрагментов ДНК, описанных выше, в 10 мкл реакционной среды в присутствии 1 мл буферного раствора Т4-ДНК-лигаза × 10 (Amersham) и 2,5 ед. фермента Т4 ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания под действием ферментов рестрикции.
Плазмиду pBSII-t35S получают клонированием в дефосфорилированном обработанном ферментом Кленова сайте SpeI плазмиды pBSIISK+, выпускаемой в продажу фирмой Stratagene, фрагмента SmaI-EcoRV, несущего последовательность t35S, выделенного из рJIT163 (описан выше) в результате двойного ферментативного переваривания под действием SmaI и EcoRV, очищенного электрофорезом на 2%-ном геле агарозы. Лигирование осуществляют с 20 нг дефосфорилированного вектора и 200 нг фрагментов ДНК, содержащей последовательность t35S, описанных выше, в 20 мкл реакционной среды в присутствии 2 мкл буферного раствора Т4-ДНК-лигаза × 10 (Amersham), 2 мкл 50%-ного раствора полиэтиленгликоля 8000 и 5 ед. фермента Т4-ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют ферментативным перевариванием под действием ферментов рестрикции.
б) Конструкция плазмид PBIOC100 и pBIOC101, содержащих, соответственно, PSLGL-LGC и PSLGL-LGC-KDEL и обеспечивающих экспрессию в эндосперме зерен кукурузы.
Для экспрессии в эндосперме зерен кукурузы животного гена, кодирующего желудочную липазу собаки (LGC), требуются следующие регулирующие последовательности:
1. Промотор гена γ-зеина кукурузы (рγ-зеин), содержащийся в плазмиде рγ63, описанной Reina и др., 1990 г. Плазмиду рγ63 получают клонированием рγ-зеина в сайтах HindIII и XbaI плазмиды pUC18, содержащей, между сайтами HindIII и XbaI, кассету экспрессии “p35S-gus-tNOS” pBI221, выпускаемую в продажу фирмой Clontech. Он обеспечивает экспрессию в эндосперме кукурузных зерен.
2. Концевая последовательность транскрипции, терминатор polyA NOS, соответствующий некодирующему участку 3’ гена нопалинсинтазы плазмиды Ti бактерии Agrobacterium tumefaciens штамма, содержащего нопалин (Depicker и др., 1982 г.).
Плазмиду pBIOC100, в которой кодирующая PSLGL-LGC последовательность находится под контролем рγ-зеина, получают путем клонирования, в сайтах “SacI, обработанный ферментом Т4-ДНК-полимераза и BamHI” плазмиды рγ63, фрагмента “XbaI, обработанный ферментом Кленова и BgiII”, выделенного из рВIOС40 (описана выше).
Лигирование осуществляют со 100 нг вектора и 50 нг переваренных фрагментов ДНК, описанных выше, в 10 мкл реакционной среды в присутствии 1 мл буферного раствора Т4-ДНК-лигаза × 10 (Amersham) и 2,5 ел. фермента Т4 ДНК-лигаза (Amersham) при 14°С в течение 16 часов. Бактерии, Escherichia coli DH5α, которым предварительно придана компетентность, трансформируют (Hanahan, 1983 г.). Плазмидную ДНК полученных клонов, которые селекционированы в среде, содержащей 50 мкг/мл ампициллина, экстрагируют по методу щелочного лизиса (Birnboim и Doly, 1979 г.) и анализируют путем ферментативного переваривания под действием ферментов рестрикции. Полученный клон обозначают как pBIOC100.
Плазмиду pBIOC101 получают путем замены фрагмента Ncol-AflII плазмиды pBIOC100 фрагментом Ncol-AflII, несущим последовательность, кодирующую тетрапептид KDEL (обеспечивающий адресацию в эндоплазматическую сеть), находящуюся перед стоп-кодоном, получаемым путем ПЦР-амплификации согласно описанным выше способам. Двумя олигодезоксинуклеотидами, используемыми в этой реакции, являются: 5’ ААТ САС TTG GAC ТТТ АТС TGG Gcc atg Gat gcc 3’ (один сайт Ncol) и 5’ ААТ ctt aag AAA CTT TAT TGC CAA ATG ТТТ GAA CGA TCG GGG AAA TTC GAC GCG TCT AGA ACT ATA GCT CAT CCT TAT TAT CTG TTC CCA TCA TGG 3’ (последовательность, кодирующая KDEL и один сайт AflII). Температура гибридизации составляет 70°С. Клонирование проводится как описано выше.
V. ПРИМЕР ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАПСОВЫХ РАСТЕНИЙ
Семена ярового рапса (Brassica napus cv WESTAR или линий Limagrain) дезинфицируют в течение 10 минут в 15%-ном растворе Domestos. После 4-кратной промывки стерильной водой семена проращивают, из расчета по 20 семян на горшок диаметром 7 см и высотой 10 см, в минеральной среде Murashige и Skoog (Sigma M 5519) с содержанием 30 г/л сахарозы, отвержденной гелем агара в количестве 5 г/л. Эти горшки помещают в камеру для культивирования с температурой 26°С и с чередованием освещенности и темноты 16 ч/8 ч и при освещенности порядка 80 мкЕ·м-2c-1.
По истечении 5 суток прорастания стерильно отбирают семядоли, срезая каждый черешок примерно на 1 мм выше семядольного узла.
Параллельно, в колбе Эрленмейера емкостью 50 мл в течение 36 ч при 28°С в 10 мл бактериальной среды 2YT (Sambrook и др., 1989 г.), дополненной антибиотиками, пригодными для селекции используемого штамма, получают предкультуру бактерии Agrobacterium tumefaciens штамма LBA4404, содержащей плазмиду рВIOС29 (или рВIOС25), а именно плазмиду pGAZE, в которую встроена последовательность, кодирующая желудочную липазу собаки, слитая с последовательностью, кодирующей сигнал адресации PPS (или PS) под контролем промотора pCRu (или pd35S).
Такую предкультуру используют для обсеменения 1% новой бактериальной культуры, получаемой в аналогичных условиях. По истечении 14 часов культуру центрифугируют в течение 15 мин при ускорении 3000 g и бактерии обрабатывают эквивалентным объемом жидкой среды проращивания. Эту суспензию распределяют. по чашкам Петри диаметром 5 см из расчета по 5 мл на чашку.
Отрезанный конец черешка окунают на несколько секунд в раствор таким образом полученных агробактерий, затем черешок погружают на глубину в несколько миллиметров в регенерационную среду. Эта среда имеет такой же основной состав, что и среда прорастания, однако дополнительно содержит 4 мг/л бензиламинопурина (ВАР), который является фитогормоном, благоприятствующим новообразованию почек. Культивируют по десять эксплантатов (семядоля с черешком) на чашку Петри диаметром 9 см (Грейнер, номер по каталогу 664102).
После совместного культивирования в течение двух дней в тех же условиях, что и условия для прорастания эксплантаты пересаживают на фитопланшеты (Сигма, номер по каталогу Р 1552), содержащие такую же, как и предыдущая, среду, дополненную селективным агентом: 45 мг/л сульфата канамицина (Сигма, номер по каталогу К 4000) и бактериостатическим агентом: смесь из 1/6 (по массе) калиевой соли клавулиновой кислоты и 5/6 натриевой соли амоксициллина (аугментин для инъекций), из расчета 600 мг/л.
Далее, два раза, с интервалом в 3 недели проводят пикировку эксплантатов, стерильно, на новую среду в тех же условиях.
Зеленые почки, появившиеся в конце второй и третьей пикировки, отделяют от эксплантата и индивидуально культивируют в прозрачных горшках диаметром 5 см и высотой 10 см, содержащим среду, аналогичную предыдущей, но не содержащую ВАР. По истечении 3-х недель культивирования стебель трансформированной почки отрезают, а почку помещают в горшок со свежей средой. Спустя три-четыре недели корни развиваются в достаточной степени, что позволяет акклиматизировать росток в фитотроне. Почки, которые не позеленели или не укоренились, удаляют. Эти ростки тогда пересаживают в чашки со стороной размером 7 см, заполненные насыщенным водой гумусом (норма NF U44551: 40% коричневого торфа, 30% просеянного верескового перегноя и 30% песка). После двух недель акклиматизации в фитотроне (температура: 21°С, чередование освещенности и темноты: 16 ч/8 ч, относительная влажность: 84%) ростки пересаживают в горшки диаметром 12 см, заполненные тем же гумусом, обогащенным удобрением замедленного действия (Osmocote, из расчета 4 г/л перегноя), затем переносят в оранжерею (класса S2) с температурой 18°С и с двухкратным орошением водой ежедневно в течение 2 минут.
После появления цветов их снабжают мешочками (Crispac, стандарт SM 570y 300 мм·70 мм) с целью предупреждения перекрестного опыления.
После созревания стручков их собирают, высушивают и лущат. Полученные семена используют для количественного определения биохимической активности. Селекцию трансгенного потомства проводят путем проращивания на среде, содержащей сульфат канамицина, из расчета 100-150 мг/л (в зависимости от генотипов). Условия проращивания аналогичны вышеописанным условиям за исключением того, что прорастание происходит в пробирках, в каждой из которых находится только одно семя. И только ростки, развившие вторичные корни, первые три недели акклиматизируют в фитотроне перед переносом в оранжерею.
VI. ПРИМЕР ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ПАСЛЕНОВЫХ
а) Получение трансгенных растений табака
Табачные растения, используемые в экспериментах по трансформации (Nicotiana tabacum var. Xanthi NC и PBD6) культивируют ин витро в основной питательной среде [Murashige и Skoog (1962 г.)] с добавками витаминов [Gamborg и др. (1968 г.); Сигма, номер по каталогу МO404], сахарозы в количестве 20 г/л и агара (Мерк) в количестве 8 г/л. Значение рН среды доводят до 5,8 с помощью раствора гидроксида калия перед автоклавированием при температуре 120°С в течение 20 минут. Пикировку табачных растений осуществляют за счет черенка междоузлий каждые 30 суток на этой среде для размножения MS20.
Все культивирования ин витро осуществляют в климатической камере при следующем режиме:
- освещенность: 30 мкЕ·м-2.с-1, продолжительность освещения: 16 ч;
- температурный режим: 26°С днем и 24°С ночью.
Используемый способ трансформации основан на способе Horsch и др. (1985 г.).
Предкультивирование бактерии Agrobacterium tumefaciens штамма LBA4404, содержащей плазмиды рВIOС29 или рВIOС26, или рВIOС25, осуществляют в течение 48 ч при 28°С при перемешивании в среде LB (Sambrook и др., 1989 г.) с добавками адекватных антибиотиков (рифампицин и тетрациклин). Предкультуру затем разбавляют в 50 раз в той же среде и культивируют в тех же условиях. По истечении ночи культуру центрифугируют (10 мин, 3000 g), бактерии обрабатывают эквивалентным объемом жидкой среды MS30 (30 г/л сахарозы) и эту суспензию разбавляют в 10 раз.
Эксплантаты размером около 1 см2 вырезают из листьев описанных выше ростков. Затем их вводят в контакт с бактериальной суспензией в течение 1 ч, после этого быстро высушивают на фильтровальной бумаге и помещают на среду для совместного культивирования (MS30, твердая).
Через два дня эксплантаты переносят в чашки Петри на среду для регенерации MS30, содержащую селективный агент, канамицин (200 мг/л), бактериостатический агент, аугментин (400 мг/л) и гормоны, необходимые для индукции почек (ВАР, 1 мг/л и ANA, 0,1 мг/л). Пересадку эксплантатов проводят на ту же среду после 2-х недель культивирования. После 2-х дополнительных недель почки пересаживают в чашки Петри на среду для развития, состоящую из среды MS20 с добавкой в нее канамицина и аугментина. Через 15 дней пересаживают половину почек. Укоренение продолжается около 20 дней, после чего ростки можно клонировать черенком междоузлии или высаживать в оранжерею.
б) Получение трансгенных растений томата.
Семена томата cv.UC82B стерилизуют с помощью 10%-ного Domestos в течение 15 мин и трижды промывают стерильной водой. Последнюю промывку проводят в течение 10 минут при встряхивании.
Стерилизованные таким образом семена проращивают на среде MSSV/2 (основная питательная среда Murashige и Skoog, 1962 г., Сигма, номер по каталогу М6899)/2 с добавкой витаминов Nitsch (Thomas и Pratt, 1981 г.), сахарозы в количестве 30 г/л, агара (Merck) в количестве 8 г/л, рН 5,9, в течение 7 или 8 суток в климатической камере (освещенность: 30 мкЕ·м-2c-1, продолжительность освещения и темноты: 16 ч/8 ч, 26°С).
Используемый способ трансформации основан на способе Fillatti и др. (1987 г.).
Предкультивирование бактерии Agrobacterium tumefaciens, штамм LBA4404, содержащей плазмиды рВIOС25 или рВIOС26, осуществляют в течение 24 ч при 28°С при встряхивании в среде LB, дополненной адекватными антибиотиками (рифампицин и тетрациклин). Предкультуру затем разбавляют в 50 раз в той же среде и культивируют в тех же условиях в течение ночи. Измеряют оптическую плотность при 600 нм, центрифугируют агробактерии (10 мин, 3000 g) и обрабатывают их в жидкой среде KCMS (описана в публикации Fillatti и др., 1987 г.), с таким расчетом, чтобы получить оптическую плотность при 600 нм = 0,8.
В некоторые стадии способа согласно протоколу Fillatti и др. (1987 г.) внесены технические усовершенствования.
Предкультивирование эксплантатов и совместное культивирование осуществляют по способу, описанному Fillatti и др. (1987 г.), за исключением того, что среду KCMS дополняют ацетосирингоном (200 мМ).
Промывочная среда 2Z отличается добавкой в нее 500 мг/л цефотаксима вместо карбенициллина. Применяемая среда выращивания состоит из основной питательной среды Murashige и Skoog (Сигма, MS6899) с добавкой витаминов Nitsch, 20 г/л сахарозы, 50 мг/л канамицина, 200 мг/л аугментина, 1 мг/л ANA (антинуклеарное антитело) и 0,5 мг/л зеатина.
VII. ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ КУКУРУЗЫ
а) Получение и применение каллуса кукурузы в качестве мишени для генетической трансформации.
Для генетической трансформации кукурузы, каким бы ни был при этом применяемый метод (электропорация, агробактерии, микроволокна, пушка для обстрела частицами), как правило, требуется использование недифференцированных клеток с быстрым делением, сохраняющих способность к регенерации целых растений. Такой тип клеток образует эмбриогенный легко крошащийся каллус кукурузы (так называемый тип II).
Такие каллусы получают из незрелых зародышей генотипа Hl II или (А188 × В73) методом и на средах, которые описаны Armstrong (справочник Maize; (1994 г.) изд. M.Freeling, V.Walbot; стр.665-671). Полученные таким образом каллусы размножают и сохраняют путем последовательных пересадок через каждые 15 дней на начальной среде.
Затем регенерируют ростки из указанных каллусов, изменяя гормональное и осмотическое равновесие клеток методом, описанным Vain и др. (Plant Cell Tissue and Organ Culture (1989, 18:143-151). Эти растения затем акклиматизируют в оранжерее, где они могут скрещиваться или самоопыляться.
б) Применение пушки для бомбардировки частицами с целью генетической трансформации кукурузы
В предыдущем разделе было описано получение и регенерация линий клеток, необходимых для трансформации; здесь описывается метод генетической трансформации, обеспечивающий устойчивое встраивание видоизмененных генов в геном растения. Данный метод базируется на использовании пушки для бомбардировки частицами, идентичной с пушкой, описанной J.Finer (Plant Cell Report (1992) 11, 323-328); клетками-мишенями выступают фрагменты каллусов, описанные в разделе 1. Эти фрагменты с площадью поверхности от 10 до 20 мм2 за 4 часа до их бомбардировки помещают, в количестве 16 фрагментов на чашку, в центр чашки Петри, в которой содержалась культуральная среда, идентичная исходной среде, с добавкой 0,2 М маннита + 0,2 М сорбита. Плазмиды, несущие вводимые гены, очищают на колонне Qiagen® с соблюдением указаний изготовителя. Затем их осаждают на вольфрамовых частицах (М10), следуя методике, описанной Klein (Nature (1987) 327: 70-73). С таким покрытием частицы с помощью пушки и согласно методике, описанной J.Finer (Plant Cell Report (1992) 11: 323-328), выстреливают в клетки-мишени.
Подвергнутые таким образом бомбардировке чашки с каллусами затем запечатывают с помощью Scellofrais®, после чего культивируют в темноте при 27°С. Первую пересадку проводят через 24 часа, затем через каждые две недели в течение 3-х месяцев на среду, идентичную исходной, с добавкой селективного агента, природа и концентрация которого могут меняться в зависимости от используемого гена (см. раздел 3). Используемыми селективными агентами являются, как правило, активные соединения некоторых гербицидов (Basta®, Round up®) или некоторые антибиотики (гигромицин, канамицин...).
Спустя 3 месяца, а иногда и позже, получают каллусы, рост которых не тормозится агентом селекции, обычно и чаще всего образованные клетками, происходящими от деления клетки, в генотип которой интегрировано одна или несколько копий гена селекции. Частота получения таких каллусов составляет приблизительно 0,8 каллуса на подвергнутую бомбардировке чашку.
Эти каллусы идентифицируют, индивидуализируют, амплифицируют, затем культивируют с таким расчетом, чтобы регенерировать ростки (см. раздел “а”). Для избежания любой интерференции с нетрансформированными клетками все указанные операции проводятся на культуральных средах, содержащих селективный агент.
Регенерированные таким образом растения акклиматизируют и культивируют затем в оранжереи, где они могут скрещиваться или самоопыляться.
VIII. АНАЛИЗ ЭКСПРЕССИИ ЖЕЛУДОЧНОЙ ЛИПАЗЫ СОБАКИ В ТРАНСГЕННЫХ ТАБАЧНЫХ РАСТЕНИЯХ
а) Протокол
Протоколом экстрагирования липазы из табачных листьев, взятых от оранжерейных растений, является следующий: 1 г листьев (сырая масса) гомогенизируют в жидком азоте, затем при 4°С в 5 мл буфера Трис-HCl, 25 мМ, рН 7,5, с добавкой 1 мМ ЭДТУ и 10 мМ меркаптоэтанола (буфер А) или буфера глицин-НСl, 25 мМ, рН 3, с добавкой 1 мМ ЭДТУ, 10 мМ β -меркаптоэтанола, 0,2% Тритона Х-100 и 250 мМ NaCl (буфер Б).
Все количество гомогената подвергают немедленному центрифугированию при 4°С в течение 15 мин при ускорении 10000 g.
Для семян табака экстрагирование проводят в буфере Б из расчета 0,1 г семян на 4 мл буфера.
Липазную активность определяют с помощью рН-SТАТ титрометическим методом Gargouri и др. (1986 г.), при котором используемым субстратом является трибутирин. Эмульсию трибутирина (4 мл на 30 мл эмульсии) получают в приборе для встряхивания и перемешивания в присутствии желчных солей (1,04 г/л), бычьего альбумина (0,1 г/л) и NaCl (9 г/л). Анализ заключается в нейтрализации бутановой кислоты, выделяющейся под действием липазы, раствором гидроксида натрия с заданным значением рН 5,5 при 37°С. Одна липазная единица соответствует количеству фермента, которое провоцирует выделение одного микромоля жирных кислот в минуту при 37°С и при оптимальных значениях рН (5,5).
Природная (очищенная) желудочная липаза собаки характеризуется удельной активностью, равной 570 единицам на мг протеина.
Липазную активность можно определять при использовании всего гомогената, осадка после центрифугирования или надосадочной жидкости после центрифугирования.
При использовании надосадочной жидкости после центрифугирования (буфер А) количественный анализ всех растворимых протеинов выполняют по методу Bradford (1976 г.).
Сэндвич-иммуноферментный анализ (Carriиre и др., 1993 г.) проводят также при использовании надосадочной жидкости после центрифугирования и при применении двух популяций моноклональных антител против природной желудочной липазы собаки. Первая популяция включает антитела, реагирующие с желудочной липазой человека и подвергнутые аффинной очистке, исходя из полной антисыворотки, на желудочной липазе человека, привитой к колонке Affigel 10 (Aoubala и др., 1993 г.). Эти антитела используют для покрытия лунок планшетов для иммуноферментного анализа (ELISA) при концентрации 1 мкг/мл. Вторая популяция включает антитела, которым не распознают желудочную липазу человека. Их очищают затем на колонке с сефарозой, связывают с протеином А, а затем - с биотином. Фиксирование антител определяют по смещению конъюгата стрептавидин/пероксидаза, ферментативную активность которых обнаруживают с помощью субстрата на основе о-фенилендиамина. Полученные результаты имеют качественное значение и их отмечают символами + и -.
Эффективность экстракции может быть увеличена за счет добавки в буфер для экстракции детергента типа CHAPS (3-(3-холамидопропил)диметиламмоний-1-пропансульфонат) (СИГМА). В этом случае действительно выход экстракции из надосадочной жидкости увеличивается приблизительно до 100% (см.таблицу 1).

Результаты, которые получены на 98 растениях ТО генотипа Xanthi (стадия 15-20 листьев) представлены в таблице 2.
Количественные анализы проводят на гомогенатах листьев или семян перед центрифугированием. Для каждой конструкции измеренные активности значительно изменяются в зависимости от трансформантов. Приблизительно 20% растений не обладают никакой активностью или обладают слишком слабой активностью для того, чтобы ее можно было обнаружить. Средние и максимальные активности приведены в таблице 2.
Общие количества протеинов сходны для 3-х конструкций со средними значениями 7 и 8 мг/г сырой массы листьев и 34, 31 и 38 мг/г сырой массы в семенах.
Средняя липазная активность в трансформированных с помощью конструкций рВIOС25 листьях составляет 34 ед./г сырой массы, т.е. 0,8% экспрессии от общего количества протеинов. В семенах средняя активность составляет 36 ед./г сырой массы, т.е. 0,2%. Достигнутая максимальная активность одного из трансформантов составляет 146 ед./г сырой массы (листья; 2,5% экспрессии) и 148 ед./г сырой массы (семена; 0,7% экспрессии). Ферментативные активности, полученные на трансформированных с помощью конструкции рВIOС25 растениях, подобны. Средняя активность в листьях составляет 34 ед./г сырой массы (0,8% экспрессии), а максимальная активность - 134 ед./г сырой массы (3% от общего количества протеинов). В семенах средняя активность достигает 42 ед./г сырой массы (0,3%), максимальная активность - 159 ед./г сырой массы (1%).
Для трансформированных с помощью конструкции рВIOС29 растений, в листьях (специфический промотор семян) не обнаруживают никакой активности. В семенах средняя активность составляет 12 ед./г сырой массы (0,1% экспрессии), а максимальная активность - 137 ед./г сырой массы (0,7%).
Экспрессия в листьях и зернах одного и того же случая трансформации, как правило, хорошо коррелирует.
Результаты иммуноферментных анализов также согласуются с результатами количественных анализов по определению ферментативной активности, т.е. растение с липазной активностью дает положительный результат в иммуноферментном анализе.
Полученные затем результаты в случае тех же самых растений показывают, что липазная активность может изменяться в процессе развития растения. В самом деле, растение, экспрессия которого по отношению к общему количеству протеинов, составляет 3% на стадии 12-15 листьев, показывает экспрессию 6% при последующем количественном анализе (более взрослое растение, с цветами).

в) Экспрессия с помощью сигнального пептида желудочной липазы кролика (LGL); количественные анализы липазной активности в табачных листьях.
Результатами, полученными на 44 растениях ТО генотипов Xanthi и pBD6, (стадия 15-20 листьев) являются следующие:
Все количественные анализы проводят на гомогенатах листьев перед цинтрифугированием. Проанализированные активности характеризуются большим разбросом в зависимости от трансформантов. Около 20% растений не обладают никакой активностью или имеют слишком незначительную активность для того, чтобы ее можно было обнаружить. Средняя липазная активность в трансформированных с помощью конструкции рВIOС41 составляет 38 ед./г сырой массы для генотипа Xanthi и 48 ед./г сырой массы для генотипа PBD6. Максимальные активности составляют, соответственно, 152 и 226 ед./г сырой массы.
IX. АНАЛИЗ ЭКСПРЕССИИ ЖЕЛУДОЧНОЙ ЛИПАЗЫ СОБАКИ В ТРАНСГЕННЫХ ТОМАТНЫХ РАСТЕНИЯХ
а) Методика.
Методика экстракции липазы из листьев и плодов томата подобна таковой, описанной для табачных листьев, за исключением того, что 1 г свежего материала обрабатывают в 4 мл буфера В. Липазную активность определяют подобно тому, как описано для листьев табака.
б) Количественный анализ плодов томатов. Проанализированы плоды первых тридцати трансформантов.
Липазная активность, определенная в плодах, разная в зависимости от плодов в случае одного и того же трансформанта. Она составляет в среднем 5 ед./г сырой массы для спелых плодов и 35 ед./г сырой массы для зеленых плодов, при этом независимо от испытываемого конструкта (рВIOС25 или рВIOС26).
Необходимо отметить, что в процессе созревания плода активность снижается. Так, например, для данного первого трансформанта липазная активность составляет 132 ед./г сырой массы для зеленого плода диаметром 10 мм; 44 ед./г сырой массы для красно-зеленого плода диаметром 33 мм и 36 ед./г сырой массы для красного плода диаметром 45 мм.
X. ИММУНОЛОГИЧЕСКИЙ АНАЛИЗ ТИПА “ВЕСТЕРН-БЛОТИРОВАНИЕ”
а) Желудочная липаза LGC собаки, экспрессируемая в листьях и семенах трансгенных табака и рапса.
а.1) Экспрессия с помощью растительных сигнальных пептидов; иммунологический анализ листьев и семян табака и рапса, трансформированных с помощью рВIOС25, рВIOС26 и рВIOС29.
Иммунологический анализ типа “вестерн-блотирования” (Renart и Sandoval, 1984 г.) желудочной липазы собаки проводят на протеинах листьев и семян табака и рапса, экстрагированных с помощью буферов А и В. Для проведения этого анализа прежде всего экстрагированные протеины (30 мг всех протеинов в пробе) разделяют на полиакриламидном геле, денатурирующем на 12,5%, согласно способу Laemmli U.K. (1970 г.), затем переносят их на нитроцеллюлозную мембрану. Поликлональное антитело против липазы собаки, полученное в случае морской свинки, используют в качестве зонда, и обнаружение осуществляют с помощью антитела против IgG морской свинки, маркированного щелочной фосфатазой.
Контрольным протеином является природная желудочная липаза собаки (LC, Фиг.6), которая перемещается в форме одной полосы с кажущейся молекулярной массой около 50 кДа. Миграция желудочной липазы собаки несколько задерживается в присутствии экстракта из нетрансформированных табачных листьев (фиг.6, LC+T).
В протеиновых экстрактах из нетрансформированных листьев и семян табака и рапса никакой полосы не обнаруживают. Продуцированная в табачных листьях липаза обнаруживается в виде двух полос. Наиболее значительная в количественном отношении полоса имеет кажущуюся молекулярную массу около 37 кДа и соответствует упомянутому выше полипептиду (Δ54). Меньшая полоса имеет кажущуюся молекулярную массу около 49 кДа и соответствует указанному выше полипептиду (Δ4) (фиг.6, F). В протеиновых экстрактах из семян прослеживается только одна полоса с меньшей молекулярной массой (фиг.6, GT и GC).
а.2) Экспрессия с помощью сигнального пептида желудочной липазы кролика (LGL); иммунологический анализ в листьях и семенах табака, трансформированных с помощью рВIOС41.
Вестерн-блотирование (Renart и Sandoval, 1984 г.) осуществляют на протеинах табачных листьев и семян, экстрагированных буфером В. Экстрагированные протеины прежде всего разделяют на денатурирующем полиакриламидном геле, (SDS-PAGE) в соответствии с методом Laemmli (1970 г.), затем переносят на нитроцеллюлозную мембрану. Поликлональное антитело против липазы собаки, полученное от морской свинки, используют в качестве зонда и обнаружение осуществляют с помощью антитела против IgG морской свинки, маркированного щелочной фосфатазой.
Вестерн-блотирование табачных листьев показано на фиг.7. Контрольным протеином является желудочная липаза собаки, мигрирующая в виде единственной полосы с кажущейся молекулярной массой около 50 кДа.
В протеиновых экстрактах из нетрансформированных листьев табака (Т) никакой полосы не обнаруживают. Продуцированная в табачных листьях липаза находится в виде большой полосы с кажущейся молекулярной массой около 49 кДа и соответствует упомянутому выше полипептиду (Δ4).
В трансформированных с помощью конструкции рВIOС41 семенах табака рекомбинантная липаза обнаруживается в той же форме, что и в листьях.
б) Желудочная липаза собаки в экстракте протеинов из трансформированных листьев табака: дегликозилирование.
Методика экстракции протеинов для дегликозилирования следующая: 0,5 г листьев (сырая масса) гомогенизируют в жидком азоте, затем при 4°С в 1 мл денатурирующего буферного раствора (100 мМ фосфатный буфер, рН 7,5, с добавкой 1% β-меркаптоэтанола, 25 мМ ЭДТУ и 1% додецилсульфата натрия (SDS).
Гомогенат подвергают центрифугированию при 4°С в течение 15 мин при ускорении 10000 g. Надосадочную жидкость инкубируют в течение 5 мин при 100°С с целью денатурации протеинов, затем центрифугируют в течение 2 мин при 1000 g. Надосадочную жидкость затем разбавляют в 10 раз буфером для дегликозилирования (100 мМ фосфатный буфер, рН 7,5, с добавкой 1% β-меркаптоэтанола, 25 мМ ЭДТУ и 1% SDS и 1% октилгликозида). Фермент (N-гликозидаза F, PNGase, Boehringer) добавляют из расчета 1 ед на 100 мкл надосадочной жидкости. Для каждой пробы осуществляют контроль без фермента. Дегликозилирование контрольного протеина (желудочная липаза собаки или кролика) осуществляют при тех же условиях. Различные протеиновые пробы инкубируют при комнатной температуре в течение 8 часов. После этого протеины разделяют путем электрофореза на полиакриламидном геле и переносят на микроцеллюлозную мембрану, как описано в предыдущем разделе.
Согласно результатам “вестрен-блотирования” желудочная липаза, используемая в качестве контроля, имеет кажущуюся молекулярную массу около 50 кДа. После дегликозилирования ее кажущаяся молекулярная масса составляет только около 43 кДа.
Продуцированная в табачных листьях липаза после инкубации без PNGase при описанных выше условиях проявляется в форме трех полос с кажущимися молекулярными массами 49 (полипептид Δ4), 37 (полипептид Δ54) и 28 кДа.
Полоса с молекулярной массой 28 кДа является без сомнения результатом протеолиза, прошедшего при инкубации в течение 8 часов при комнатной температуре. После дегликозилирования молекулярные массы трех полос уменьшаются приблизительно на 1-2 кДа, что свидетельствует о гликозилировании протеинов, продуцированных в табачных листьях.
в) Желудочная липаза собаки, экспрессированная в трансгенных листьях и плодах томата.
Иммунологический анализ типа “вестерн-блотирования” желудочной липазы собаки проводят на протеинах листьев и плодов томата, экстрагированных с помощью буферного раствора В. Для проведения экспериментов экстрагированные протеины (15 мкг и 6 мкг всех растворимых протеинов, соответственно, в случае листьев и плодов томата) разделяют на денатурирующем полиакриламидном геле, как описано в разделе Х.а.
Контрольным протеином является природная желудочная липаза (след 4 на фиг.8), мигрирующая в виде единственной полосы с кажущейся молекулярной массой около 50 кДа.
В протеиновых экстрактах из нетрансформированных листьев и плодов томата никакой полосы не обнаруживают.
Продуцированная в листьях и плодах томата липаза проявляется в виде двух полос, какую бы конструкцию (рВIOС25 или рВIOС26) при этом не применяли. Наиболее значительная в количественном отношении полоса имеет кажущуюся молекулярную массу около 37 кДа и соответствует упомянутому выше полипептиду (Δ54). Меньшая полоса имеет кажущуюся молекулярную массу около 49 кДа и соответствует указанному выше полипептиду (Δ4) (фиг.8).
XI. ОЧИСТКА ЖЕЛУДОЧНОЙ ЛИПАЗЫ СОБАКИ ИЗ РАСТЕНИЙ (Табл.3)
а) Очистка желудочной липазы собаки из табачных листьев. Активность желудочной липазы собаки, продуцированной в табачных листьях, определяют титриметрическим способом, при этом с помощью РН-стата (Mettler-Toledo-DL25) величину рН фиксируют при 5,5, температуру при 37°С, используя трибутирин в качестве субстрата: 1 мл трибутирина эмульгируют в 29 мл водного 0,15 М раствора NaCl в аппарате для встряхивания и перемешивания. Анализ заключается в нейтрализации бутановой кислоты, выделяющейся под действием липазы, путем добавления 0,02 н. раствора гидроксида натрия, при этом поддерживают интенсивное механическое встряхивание эмульсии. Одна липазная единица соответствует 1 мкмоль жирной кислоты, выделяющейся при данных величинах рН и температуры.
После первой стадии хроматографирования, при отборе пробы в количестве 0,5 мл определяют липазную активность в эмульсии, состоящей из 1 мл трибутирина в 29 мл 0,15 М раствора NaCl, 2 мМ тауродезоксихолята натрия и 1,5 мкМ бычьего альбумина, согласно анализу, описанному Gargouri и др., (1986 г.).
1 г Лиофилизованных листьев гомогенизируют при 4°С в 30 мл 20 мМ глицинового буферного раствора, рН 2,5 и слабо встряхивают в течение 15 минут. Во время мацерации значение рН поддерживают равным. 2,5 добавкой 1 н. соляной кислоты. Продукт мацерации центрифугируют при ускорении 15000 д в течение 5 минут. Значение рН надосадочной жидкости доводят до 4 добавкой 1 н. раствора NaOH. После фильтрации через MIRACLOTH (Calbiochem) все количество надосадочной жидкости вносят в колонку с катионообменной смолой (смола:

Удержанные в колонке протеины элюируют по следующей методике:
- линейный градиент буферного раствора 20 мМ ацетата натрия, рН 4,0, с 20-210 мМ NaCl за 30 мин для элюирования первой совокупности протеиновых пиков, не характеризующихся липазной активностью; тест проводят на пробах по 1 мл,
- плато при 210 мМ NaCl в течение 20 минут,
- линейный градиент буферного раствора 20 мМ ацетата натрия, рН 4,0, с 210 мМ-500 мМ NaCl за 30 минут при элюировании второй совокупности пиков. Липазную активность, измеренную на пробах по 0,5 мл, элюируют во время второго градиента при ионной силе 300-400 мМ.
Активные фракции собирают и концентрируют с помощью концентратора OMEGACELL с ограничением молекулярной массы 30 кДа (Filtron Technology Corporation).
Проводят диализ концентрата в течение 12 часов против 10 мМ буферного раствора Tris-HCl, рН 8, затем вносят его в колонку с анионообменной смолой (MonoQ HR5/5 диаметром 0,5 см и высотой 5 см; Pharmacia), уравновешенной 10 мМ буферным раствором Tris-HCl, рН 8. Липазную активность определяют на пробе 0,5 мл. Расход поддерживают равным 1 мл в минуту при давлении 2,0 МПа. После элюирования не удержанной фракции и промывки колонки с помощью 10 мл 10 мМ буферного раствора Tris-HCl, рН 8, применяют линейный градиент с ионной силой 0-400 мМ NaCl за 60 минут. Липазную активность элюируют при ионной силе 100-200 мМ.
Активные фракции собирают и концентрируют посредством концентратора OMEGACELL до предела молекулярной массы 30 кДа. Концентрат образует очищенная желудочная липаза собаки, экстрагированная из листьев табака.
Концентрацию протеинов определяют методом Bradfor d. M. (1976 г.) в концентрированных надосадочных жидкостях и методом Lowry O.H. (1951 г.) в растворах после первой ионообменной хроматографии.
На разных стадиях очистки проводят анализы электрофорезом на денатурирующем полиакриламидном геле (SDS-PAGE 12,5%) методом Laemmli U.K. (1970 г.). Протеины, таким образом разделенные на полиакриламидном геле, обнаруживают, во-первых, окрашиванием с помощью кумасси-синего и, во-вторых, переносят на нитроцеллюлозную мембрану методом трансфекции электрошоком в полусухом состоянии (Transblot SD, BIORAD) в буферном растворе 20 мМ Tris-основание, 150 мМ глицин и 20% этанол, при 2,3 мА/см2 мембраны. Перенесенную на нитроцеллюлозную мембрану рекомбинантную желудочную липазу собаки выявляют посредством иммунологического анализа по следующей методике:
- маркировка протеина-мишени поликлональным антителом против желудочной липазы собаки, полученным от морской свинки и разбавленным в 5000 раз в забуференным фосфатом физиологическом растворе (ЗФР), содержащем добавку обезжиренного порошкового молока в количестве 5% и Твин 20 в количестве 0,1%, в течение 1 ч при комнатной температуре,
- промывка мембраны последовательно в трех последовательных ваннах из буфера ЗФР, содержащего добавку 1% обезжиренного порошкового молока и 0,1% Твина 20, в течение 10 минут в каждой ванне,
- маркировка с помощью антитела против пероксидазы (Сигма) морской свинки, разбавленного в 2000 раз в ЗФР, дополнительно содержащем +1% обезжиренного порошкового молока и 0,1% Твина, в течение 1 часа при комнатной температуре;
- промывка мембраны последовательно в трех последовательных ваннах из буфера ЗФР, содержащего добавку 1% обезжиренного порошкового молока и 0,1% Твина 20, в течение 10 минут в каждой ванне,
- проявление путем воздействия пероксидазы на 4-хлоро-1-нафтол (Сигма) в присутствии H2O2 голубой, устойчивой во времени окраски.
Продуцированная в листьях липаза проявляется в виде двух полос с молекулярной массой около 49 кДа (полипептид Δ4) и 37 кДа (полипептид Δ54).
б) Вариант очистки желудочной липазы собаки из табачных листьев.
Активность желудочной липазы собаки, продуцированной в табачных листьях, определяют титриметрическими способами, описанными Gargouri и др. (1986 г.) с помощью рН-стата (Mettler-Toledo-DL25).
Определение триглицеридов с короткими цепочками проводят при использовании трибутирина в качестве субстрата: 1 мл трибутирина эмульгируют в 29 мл водного раствора 0,15 М NaCl, 15 мкМ сыворотки бычьего альбумина (BSA) и 2 мМ тауродезоксихолята натрия (NaTDC).
Значение рН составляет 5,0, температура равна 37°С.
Анализ заключается в нейтрализации бутановой кислоты, выделяющийся под действием липазы, путем добавления 0,02 н. раствора гидроксида натрия, причем осуществляют интенсивное механическое встряхивание для сохранения эмульсии.
Количественный анализ триглицеридов с длинными цепочками проводят при использовании в качестве субстрата водной эмульсии с 30% очищенного соевого масла, 1,2% очищенных фосфолипидов яйца, 1,67% безводного глицерина (30% IntralipidTM-PHARMACIA АВ, Стокгольм, Швеция). 10 мл Указанной суспензии эмульгируют в 20 мл водного раствора, содержащего 0,15 М NaCl, 30 мкМ сыворотки бычьего альбумина (BSA) и 3,5 мМ CaCl2. Значение рН составляет 4,0, температура равна 37°С.
Анализ заключается в нейтрализации жирных кислот, выделяющихся под действием липазы, путем добавления 0,02 М раствора гидроксида натрия по скачку значения рН с 4 до 9, причем осуществляют интенсивное механическое встряхивание для сохранения эмульсии.
Одна липазная единица соответствует 1 микромоли жирной кислоты, выделяющейся в 1 минуту при указанных значениях рН и температуры для каждого из субстратов.
Два грамма лиофилизованных листьев гомогенизируют при 4°С в 60 мл 0,2 М раствора NaCl, pH 3 и слабо встряхивают в течение 15 минут при 4°С. Во время этой мацерации значение рН поддерживают равным 3 добавкой 1 н. НСl. Продукт мацерации (гомогенат) центрифугируют при 10000 g в течение 10 минут. После фильтрации через MIRACLOTH (Calbiochem) и фильтр MILLIPORE (0,45 мкм) все количество надосадочной жидкости инжектируют в колонку с катионообменной смолой (RESSOURCE S 6 мл - PHARMACIA - 16 мл (внутренний диаметр) × 30 мм), уравновешенную буферным раствором 20 мМ ацетата натрия, 0,2 М NaCl, рН 3, с расходом 8 мл/мин (240 см·ч-1).
После прохождения неудерживаемой фракции колонку промывают уравновешивающим буферным раствором в количестве, превышающем в 30 раз ее объем. Удержанные в колонке протеины элюируют при линейной градиенте буферного раствора 20 мМ ацетата натрия, рН 3, с 0,2-0,5М NaCl в 7-кратных количествах по отношению к объему колонки. Собирают фракции по 4 мл.
Активная липаза, определенная в пробах по 0,5 мл, элюируется при ионной силе 0,35 М NaCl.
Активные фракции объединяют и концентрируют посредством концентратора OMEGACELL (Filtron Technology Corporation) с молекулярной массой 30 кДа.
Концентрацию протеинов определяют методом Lowry O.H. (1951 г.).
На фигурах 9 и 10 представлен пример полиакриламидного геля и результат переноса этого геля на нитроцеллюлозную мембрану, а также обнаружение антитела против желудочной липазы собаки. Обнаружение проводят воздействием пероксидазы на Люминол (Luminol) в присутствии активатора (ECL western Blotting - AMERSHAM LIFE SCIENCE) и отпечатывания на фотопленке.
Присутствие гликановых остатков в протеине определяют по следующей методике:
- иммобилизация протеина на нитроцеллюлозной мембране,
- обработка периодатом,
- специфическая реакция со стрептавидином, связанным со щелочной фосфатазой,
- реакция окрашивания щелочной фосфатазы (GLYCOTRACK-OXFORD GLYLOSYSTEM).
Пример мембраны для обнаружения гликановых остатков представлен на фиг.11.
Чистота фракций достигается посредством высокоэффективной жидкостной хроматографии.
хроматограф Chromatographe WATERS 625 LC,
детектор с диодами WATERS 991,
колонка VYDAC С4,

в) Очистка желудочной липазы собаки из семян рапса
Активность рекомбинантной желудочной липазы собаки, продуцированной в семенах рапса, определяют таким же способом, что и в случае экстракции из листьев.
10 граммов семян рапса измельчают в жидком азоте. Полученную муку обезжиривают гексаном в ходе первой мацерации при 4°С при слабом встряхивании в течение 12 часов. Надосадочную жидкость декантируют и удаляют гексан. Муку промывают с помощью 100 мл гексана при слабом встряхивании в течение 1/2 часа при 4°С при каждой промывке. Гексан удаляют путем декантации. Муку сушат в ротационном испарителе (HEIDOLPH 94200). Обезжиренная мука хранится при -20°С.
Экстрагирование желудочной липазы собаки проводят из обезжиренной муки мацерацией при 4°С в водном 0,2 М растворе NaCl, рН 3 (1Н НСl) в течение 30 минут из расчета 2 мл водного раствора на 0,1 г муки. Продукт мацерации центрифугируют при 10000 g в течение 10 мин при 4°С.
Осадок удаляют, надосадочная жидкость представляет собой экстракт из семян.
Экстракт из семян подвергают диализу против буферного раствора 10 мМ ацетата натрия, рН 4, 140 мМ NaCl, 3 мМ КСl, после чего вводят в колонку для иммуноаффинной хроматографии, содержащую поликлональные антитела против желудочной липазы собаки, полученные от морской свинки, связанные со смолой (гидразид Avidgel-BIOPROBE INTERNATIONAL, Inc.).
Контактирование между смолой и экстрактом из семян продолжается 30 мин при 4°С при слабом встряхивании. Затем смолу промывают буферным раствором 10 мМ ацетата натрия, рН 4, 150 мМ NaCl, 3 мМ КСl, в количестве, равном 10 объемам колонки. Желудочную липазу собаки элюируют буферным раствором 0,2 М глицина, рН 2,8, 150 мМ NaCl, в количестве, равном 5 объемам колонки. Собранные фракции образуют объем, равный 1 объему колонки, и содержат 1/20 часть по объему буферного 1 М раствора Tris, pH 9. Анализ электрофорезом на полиакриламидном геле в денатурирующей среде (см.фиг.12) показывает на наличие протеина с молекулярной массой около 37 кДа.
XII. СИНТЕЗ ЭФИРОВ ЖИРНЫХ КИСЛОТ
Опыты осуществляют с использованием нетрансформированных семян рапса, причем липазу используют:
- либо в виде иммобилизованного (липозим (NOVO)) или свободного (желудочная липаза кролика (JO 4002)) ферментативного препарата,
- либо в виде трансформированных с помощью гена желудочной липазы собаки (табак Т14-44, 0,85% экспрессии) семян табака.
Реакции по этерификации проводят при 37°С в течение 16 часов в герметично закрытых колбах, помещенных на стол-планшет для встряхивания (250 об/мин). В качестве органического растворителя применяют гексан, в котором растворимы жирные кислоты. Метанол добавляют в стехиометрическом соотношении к теоретически рассчитанному количеству триацилглицерина, содержащегося в семенах рапса.
Преобладающим компонентом жирных кислот рапса является олеиновая кислота, поэтому в качестве стандарта выбирают метиловый эфир олеиновой кислоты. Контроль за синтезом осуществляют с помощью тонкослойной хроматографии (ТСХ). Растворителем для миграции служит смесь из гексана, диэтилового эфира и воды (70:10:1). Проявление пластинок осуществляется при нагревании после пульверизации (5%-ной) серной кислоты в этаноле.
Во время первого опыта к 0,2 г рапсового масла (0,22 миллимоль) добавляют 27 мкл метанола (0,66 миллимоль) и 0,02 г липозима: на одном уровне со стандарным метиловым эфиром олеиновой кислоты не появляется никакого пятна (фиг.13, колонка 2).
Во втором опыте рапсовое масло заменяют 0,5 г измельченных сухих семян рапса и добавляют 1 мл гексана: в этом случае происходит синтез сложного метилового эфира (фиг.13, колонка 5).
При последующих опытах, используют те же условия, но со следующими изменениями: количество липозима снижают до 0,006 г и липозим заменяют желудочной липазой кролика (0,007 г JO 4002). В этом случае синтез метилового эфира олеиновой кислоты протекает в присутствии липозима, но не в присутствии JO 4002 (фиг.14, колонка 2).
Наконец, в последних опытах, липазу используют в виде трансформированных семян табака (1 г семян табака). Появляется характерное пятно сложного метилового эфира (фиг.15, колонка 3).
В заключение следует отметить, что описанные выше результаты свидетельствуют о том, что при сочетании экстрактов из семян рапса, спирта и рекомбинантной желудочной липазы собаки, продуцированной трансгенными табачными растениями, достигают реакции этерификации, приводящей к синтезу сложного метилового эфира, который можно использовать в качестве биотоплива.
Подписи к фигурам
Фиг.1: нуклеотидная последовательность кДНК, кодирующая желудочную липазу собаки;
Фиг.2: аминокислотная последовательность желудочной липазы собаки;
Фиг.3: нуклеотидная последовательность, происходящая от кДНК, кодирующей желудочную липазу собаки, и кодирующая представленную на фиг.2 желудочную липазу собаки;
Фиг.4: нуклеотидная последовательность кДНК, кодирующей желудочную липазу человека, и аминокислотная последовательность желудочной липазы человека;
Фиг.5: аминокислотная последовательность желудочной липазы человека;
Фиг.6: иммунологический анализ рекомбинантных полипептидов, продуцированных листьями и семенами табака Xanthi, и семян рапса, трансформированных с помощью конструкции РвIOС26, рВIOС25 и pBIOC29; E - величина молекулярной массы; LG - желудочная липаза собаки; F - табачные листья и GT - семена табака, трансформированные с помощью конструкции pBIOC25; GC - семена рапса, трансформированные с помощью конструкции pBIOC29; Т - нетрансформированные табачные листья;
Фиг.7: иммунологический анализ рекомбинантных полипептидов, продуцированных листьями табака, трансформированными с помощью конструкций pBIOC25 и рВIOС41;
Е - величина молекулярной массы; LC - желудочная липаза собаки; 1 и 3 - листья табака, трансформированные с помощью конструкции pBIOC41; 2 - листья табака, трансформированные с помощью конструкции рВIOС25; Т - нетрансформированные табачные листья;
Фиг.8: Иммунологический анализ рекомбинантных полипептидов, продуцированных листьями и плодами томата, трансформированными с помощью конструкций рВIOС25 и рВIOС26:
Т1 - нетрансформированный плод томата;
1 и 3 - трансформированные плоды томата;
2 - трансформированный лист томата;
Е - величина молекулярной массы;
LC - желудочная липаза собаки;
Т2 - нетрансформированный лист томата.
Фиг.9: Анализ путем электрофореза на полиакриламидном геле в денатурирующей среде (SDS-PAGE):
1. экстракт из семян рапса,
2. рекомбинантная желудочная липаза собаки, продуцированная табачными листьями,
3. природная желудочная липаза собаки,
4. величина молекулярной массы.
Фиг.10: Иммуноблокирование предыдущего анализа после переноса на нитроцеллюлозную мембрану:
1. природная желудочная липаза собаки,
2. рекомбинантная желудочная липаза собаки, продуцированная табачными листьями,
3. экстракт из семян рапса.
Фиг.11: Обнаружение присутствия гликановых остатков из полиакриламидного геля после переноса на нитроцеллюлозную мембрану:
1. экстракт из семян рапса,
2. рекомбинантная желудочная липаза собаки, продуцированная табачными листьями,
3. природная желудочная липаза собаки
Фиг.12: электрофорез в полиакриламидном геле с додецилсульфатом натрия в отношении иммуноочистки r-DGL, продуцированной семенами рапса
1. природная желудочная липаза собаки,
2. рекомбинантная желудочная липаза собаки
3-6. неудержанные фракции, элюированные из колонки иммуноочистки.
Фиг.13: Проявление пластинки ТСХ; 1 - рапсовое масло, без фермента; 2 - рапсовое масло + липозим; 3 - метиловый эфир олеиновой кислоты; 4 - семена рапса, без фермента; 5 - семена рапса + липозим.
Фиг.14: Проявление пластинки ТСХ; 1 и 4 - семена рапса без наличия фермента; 2 - семена рапса + JO4002; 3 - метиловый эфир олеиновой кислоты; 5 - семена рапса + липозим.
Фиг.15: Проявление пластинки ТСХ; 1 - моноолеин, диолеин, триолеин; 2 - метиловый эфир олеиновой кислоты; 3 - трансформированные семена рапса + семена табака.
Реферат
Изобретение относится к генетической инженерии растений. Трансформация растительных клеток ДНК, кодирующей предуоденальные липазы собаки или человека, позволяет получать эти ферменты или их производные с помощью растений. Экстракты из растений, сами ферменты и их полипептидные производные могут быть применены для получения пищевых продуктов и медикаментов. 12 с. и 12 з.п.ф-лы, 15 ил., 3 табл.

Комментарии