Способ усиления эффекта дисперсных полезных агентов - RU2404740C2
Код документа: RU2404740C2
Чертежи




























Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
В данной заявке утверждается приоритет в соответствии с разделом 35 кодекса законов США §119 по предварительной заявке № 60/718035, внесенной в реестр 16 сентября, 2005.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к применению дисперсных полезных агентов и способам продления связывания этих полезных агентов с поверхностью тела. Конкретнее, данное изобретение обеспечивает частицы полезных агентов с полимерным покрытием в композиции, включающей в себя пептиды, имеющие сродство к данному полимерному покрытию, для продления связывания данного полезного агента с поверхностями тела.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Кондиционеры и красители для волос и кожи представляют собой широкоизвестные и общеупотребительные средства личной гигиены. Основной проблемой современных кондиционеров и неокислительных красителей является то, что у них отсутствует требуемая продолжительность длительных эффектов. Окислительные краски для волос обеспечивают стойкое окрашивание, но содержащиеся в них окисляющие агенты приводят к повреждению волоса. Для повышения стойкости композиций по уходу за волосами и кожей были разработаны полезные агенты, основанные на пептиде, например кондиционеры для волос и красители для волос (Huang et al., рассматриваемые совместно и общедоступные Публикации патентной заявки США № 2005/0050656 и Публикации патентной заявки США № 2005/0226839). Данные полезные агенты, основанные на пептидах, получены посредством соединения специфической последовательности пептида, который имеет высокую аффинность связывания с волосами или кожей, с полезным агентом, например кондиционирующим или красящим агентом. Данная пептидная часть связывается с волосами или кожей, тем самым прочно прикрепляя полезный агент. Эти основанные на пептидах полезные агенты обеспечивают улучшенную устойчивость, но требуют соединения связующего пептида с данным полезным агентом. Солнцезащитные кремы на пептидной основе, включающие в себя пептид, связывающийся с кожей, соединенный с неорганическим солнцезащитным фильтром, описаны Buseman-Williams et al. в рассматриваемой совместно и общедоступной публикации Патентной заявки США № 2005/0249682.
Пептиды с высокой аффинностью связывания с волосами или кожей были установлены с использованием технологий фагового дисплея (Huang et al., supra; Estell et al., WO 0179479; Murray et al., Публикация Патентной Заявки США № 2002/0098524; Janssen et al., Публикация Патентной Заявки США № 2003/0152976; и Janssen et al., WO 04048399). Кроме того, сообщалось о разработанных опытным путем пептидах, связывающихся с кожей и волосами, которые основаны на положительно заряженных аминокислотах (Rothe et al., WO 2004/000257).
Cornwell et al. (Патент США № 6551361) описали способ уменьшения утраты цвета волос, обработанных окислительной краской для волос, включающий в себя воздействие на волосы, либо до, либо после обработки волос данной окислительной краской для волос, органическим аминосоединением, например основными аминокислотами, мочевиной, гуанидином и их солями или смесями. Тем не менее, в этом раскрытии не описывается применение пептидов, связывающих полимер, или конъюгатов, включающих в себя пептиды, связывающие полимер, соединенные с пептидами, связывающимися с волосами или кожей, для увеличения устойчивости дисперсных полезных агентов с полимерным покрытием, на поверхностях тела.
Пептиды, имеющие аффинность связывания с полимерными и пластмассовыми поверхностями, были установлены с использованием фагового дисплея. Например, Adey et al., (Gene 156: 27-31 (1995)) описали пептиды, которые связываются с полистирольными и поливинилхлоридными поверхностями. Кроме того, сообщалось о пептидах, которые связываются с полиуританом (Murray et al., Публикация Патентной Заявки США № 2002/0098524), полиэтилентерефталатом (O'Brien et al., рассматриваемая совместно и общедоступная Публикация Патентной Заявки США № 2005/0054752), и полистиролом, полиуританом, поликарбанатом и нейлоном (Grinstaff et al., Публикация Патентной Заявки США № 2003/0185870). Тем не менее, применение таких пептидов для усиления связывания дисперсных полезных агентов с поверхностями тела не было описано.
Следовательно, проблема, которую надо решить, состоит в обеспечении альтернативных способов усиления устойчивости дисперсных полезных агентов для волос и кожи, которые просты и удобны в осуществлении.
Податели заявки обратили внимание на сформулированную проблему, обнаружив, что пептиды, имеющие сродство к полимерному покрытию дисперсного полезного агента, можно использовать для увеличения стойкости данного дисперсного полезного агента на поверхностях тела. Этот подход позволяет использовать пептид одного типа, связывающийся с полимером, для применения со многими типами дисперсных полезных агентов с полимерным покрытием, тем самым, устраняя потребность в различных пептидах, связывающихся с частицами, для каждого типа частиц.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Раскрыт способ увеличения продолжительности связывания дисперсного полезного агента с поверхностью тела. Дисперсные полезные агенты с полимерным покрытием наносят на поверхность тела в присутствии пептида, связывающегося с полимером. Данный способ чрезвычайно пригоден для нанесения красителей, дисперсных кондиционеров и неорганических солнцезащитных средств на поверхности тела, например волосы или кожу. Пептиды, связывающиеся с полимером, могут быть модифицированы или применяться в виде химеры, включающей в себя пептиды, имеющие сродство к поверхностям тела, например волосам и коже. Полезные агенты с полимерным покрытием в присутствии пептидов, связывающихся с полимером, могут применяться в целом ряде композиций средств личной гигиены, таких как краска для волос и шампуни.
В соответствии с одним вариантом осуществления данное изобретение обеспечивает способ нанесения дисперсного полезного агента на поверхности тела, включающий в себя:
а) обеспечение дисперсного полезного агента с полимерным покрытием;
b) обеспечение композиции, включающей в себя пептид, имеющий сродство к данному полимеру, и
c) нанесение данного имеющего покрытие дисперсного полезного агента (a) с данной композицией (b) на поверхность дела на время, достаточное для связывания данного имеющего покрытие полезного агента с данной поверхностью тела.
В другом варианте осуществления данное изобретение обеспечивает композицию средства личной гигиены, включающую в себя:
a) дисперсный полезный агент с полимерным покрытием; и
b) композицию, включающую в себя пептид, имеющий сродство к данному полимеру.
В другом варианте осуществления данное изобретение обеспечивает двублочный конъюгат на пептидной основе, который имеет общую структуру [(BSBP)m - (PBP)n]x, где
a) BSBP представляет собой пептид, связывающийся с поверхностью тела;
b) PBP представляет собой пептид, связывающийся с полимером; и
c) m, n, и x независимо друг от друга изменяются от 1 до приблизительно 10.
В очередном варианте осуществления данное изобретение обеспечивает трехблочный конъюгат на пептидной основе, который имеет общую структуру [[(BSBP)m-Sq]x-[(PBP)n-Sr]z]y, где
a) BSBP представляет собой пептид, связывающийся с поверхностью тела;
b) PBP представляет собой пептид, связывающийся с полимером;
c) S представляет собой молекулярный спейсер; и
d) m, n, x и z независимо друг от друга изменяются от 1 приблизительно до 10, y изменяется от 1 приблизительно до 5, и где q и r каждый независимо равен 0 или 1, при условии, что r и q не могут быть равны 0.
КРАТКОЕ ОПИСАНИЕ ФИГУР И ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Различные варианты осуществления данного изобретения могут быть более полно поняты из следующего подробного описания, фигуры и сопровождающих описаний последовательностей, которые являются частью данной заявки.
Чертеж представляет собой карту плазмидного вектора pKSIC4-HC77623, описанного в Примере 18.
Следующие последовательности соответствуют 37 C.F.R. 1.821-1.825 («Требования, предъявляемые к патентным заявкам, содержащим описания нуклеотидных последовательностей и/или аминокислотных последовательностей - правила для последовательностей») и соответствуют стандарту ST.25 (1998) Всемирной организации интеллектуальной собственности (ВОИС) и условиям, которые необходимы для регистрации последовательностей EPO и PCT (правила 5.2 и 49.5(a-бис)), и Раздел 208 и Приложение C Административной Инструкции). Символы и формат, использованные для характеристик нуклеотидной и аминокислотной последовательности, подчиняются правилам, изложенным в 37 C.F.R. §1.822.
Список последовательностей предоставлен здесь на компакт-диске. Содержимое данного компакт-диска, включающее в себя список последовательностей, включено здесь посредством ссылки в соответствии с 37 CFR 1.52(e). Данные компакт-диски предоставлены в трех экземплярах, идентичных друг другу. Данные диски помечены «Копия 1 - Список последовательностей», «Копия 2 - Список последовательностей», и CRF. Данные диски содержат в себе следующий файл: CL3145 Conv Seq List.ST25, имеющий следующий размер: 34000 байтов и который был создан 31 августа 2006.
SEQ ID №№ 1-14 представляют собой аминокислотные последовательности пептидов, связывающихся с полиметилметакрилатом.
SEQ ID №№ 15-21 представляют собой аминокислотные последовательности пептидов, связывающихся с полипропиленом.
SEQ ID №№ 22-30 представляют собой аминокислотные последовательности пептидов, связывающихся с политетрафторэтиленом.
SEQ ID №№ 31-36 представляют собой аминокислотные последовательности пептидов, связывающихся с нейлоном.
SEQ ID №№ 37-43 представляют собой аминокислотные последовательности пептидов, связывающихся с полиэтиленом.
SEQ ID №№ 44-46 представляют собой аминокислотные последовательности пептидов, связывающихся с полистиролом.
SEQ ID №№ 47-52 и 73-81 представляют собой аминокислотные последовательности пептидов, связывающихся с волосами.
SEQ ID №№ 53-57 и 82-93 представляют собой аминокислотные последовательности пептидов, связывающихся с кожей.
SEQ ID №№ 58-62 представляют собой аминокислотные последовательности созданных опытным путем пептидов, связывающихся с волосами и кожей.
SEQ ID №№ 63-65 и 94-97 представляют собой аминокислотные последовательности пептидных спейсеров.
SEQ ID № 66 представляет собой аминокислотную последовательность области расщепления для Каспазы 3.
SEQ ID №№ 67-70 представляют собой аминокислотные последовательности множественных копий конъюгатов «пептид, связывающийся с волосами//пептид, связывающийся с полимером».
SEQ ID № 71 представляет собой нуклеотидную последовательность, используемую для получения множественных копий трехблочного, основанного на пептидах, конъюгата «пептид, связывающийся с волосами//пептид, связывающийся с полимером», представленного как последовательность SEQ ID № 70.
SEQ ID № 72 представляет собой нуклеотидную последовательность плазмиды pKSIC4-HCC77623, которая описана в Примере 18.
SEQ ID №№ 98-112 представляют собой аминокислотные последовательности устойчивых к смыванию шампунем пептидов, связывающихся с полиметилметакрилатом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способу увеличения стойкости дисперсных полезных агентов, который включает в себя применение дисперсного полезного агента с полимерным покрытием в сочетании с композицией, включающей пептид, имеющий сродство к данному полимеру. Данное изобретение является полезным вследствие того, что данный способ можно применять для окрашивания или кондиционирования волос и кожи, обеспечивая увеличенную прочность по сравнению с традиционными способами.
Следующие определения используются здесь и должны быть упомянуты для объяснения пунктов формулы изобретения и данного описания.
Используемый здесь термин «изобретение» или «настоящее изобретение» является неограничивающим термином и не предназначен для обозначения какого-либо одного варианта осуществления данного изобретения, но охватывает все возможные варианты осуществления, как описано в данной спецификации и пунктах формулы изобретения.
«PBP» означает пептид, связывающийся с полимером.
«BSBP» означает пептид, связывающийся с поверхностью тела.
«HBP» означает пептид, связывающийся с волосами.
«SBP» означает пептид, связывающийся с кожей.
«BA» означает полезный агент.
Термин «пептид» относится к двум или более аминокислотам, соединенным друг с другом посредством пептидных связей или модифицированных пептидных связей.
Термин «пептид, связывающийся с волосами» означает пептидную последовательность, которая связывается с высокой аффинностью с волосами. Пептиды, связывающиеся с волосами, по данному изобретению имеют длину приблизительно от 7 аминокислот приблизительно до 50 аминокислот, более предпочтительно, приблизительно от 7 аминокислот приблизительно до 25 аминокислот, наиболее предпочтительно приблизительно от 7 приблизительно до 20 аминокислот.
Термин «пептид, связывающийся с кожей» означает пептидную последовательность, которая связывается с высокой аффинностью с кожей. Пептиды, связывающиеся с кожей, по данному изобретению имеют длину приблизительно от 7 аминокислот приблизительно до 50 аминокислот, более предпочтительно, приблизительно от 7 аминокислот приблизительно до 25 аминокислот, наиболее предпочтительно приблизительно от 7 приблизительно до 20 аминокислот.
Термин «пептид, связывающийся с полимером» означает пептидную последовательность, которая связывается с высокой аффинностью с полимером. Пептиды, связывающиеся с полимером, по данному изобретению имеют длину приблизительно от 7 аминокислот приблизительно до 50 аминокислот, более предпочтительно, приблизительно от 7 аминокислот приблизительно до 25 аминокислот, наиболее предпочтительно приблизительно от 7 приблизительно до 20 аминокислот.
Термин «дисперсный полезный агент» является общим термином, который относится к дисперсной субстанции, которая при нанесении на поверхность тела обеспечивает косметическое или профилактическое действие. Дисперсные полезные агенты обычно включают в себя красители, дисперсные кондиционеры, неорганические кремы против загара и тому подобное наряду с другими дисперсными субстанциями, обычно используемыми в индустрии средств личной гигиены.
Термин «поверхность тела» означает любую поверхность тела человека, которая может служить субстратом для нанесения дисперсного полезного агента. Типичные поверхности тела включают в себя, но не ограничиваются ими, волосы, кожу, ногти, зубы, десны и роговичные ткани.
Используемый здесь термин «волосы» относится к волосам, бровям и ресницам человека.
Используемый здесь термин «кожа» относится к коже человека, или заместителям кожи человека, таким как свиная кожа, Vitro-Skin® и EpiDerm™. Кожа, как это слово используется здесь в качестве поверхности тела, обычно включает в себя слой эпителиальных клеток и может дополнительно содержать в себе слой эндотелиальных клеток.
Используемые здесь термины «связанные» или «соединенные» означают любую химическую ассоциацию и включают в себя и ковалентные, и нековалентные взаимодействия.
Термин «конъюгат, основанный на пептидах» относится к композиции, образованной в результате соединения пептида, связывающегося с поверхностью тела, и пептида, связывающегося с полимером, либо напрямую, либо через молекулярный спейсер.
Термин «строгость», применяемый при отборе данных пептидов, связывающихся с полимером, по данному изобретению, относится к данной концентрации данного элюирующего агента, применяемого для элюирования пептидов из данного полимера. Более высокие концентрации данного элюирующего агента обеспечивают более строгие условия.
Термины «аффинность связывания» или «аффинность» относятся к силе взаимодействия связывающегося пептида с его соответствующим субстратом. Данная аффинность связывания определена здесь в единицах значения MB50, установленных в анализе связывания, основанном на ИФА.
Термин «наночастицы» определяется здесь как частицы со средним диаметром между 1 и 500 нм. Предпочтительно, данный средний диаметр частиц составляет между приблизительно 1 и 200 нм. Используемые здесь «размер частицы» и «диаметр частицы» имеют одно и то же значение. Наночастицы включают в себя, но не ограничиваются ими, металлические, полупроводниковые, полимерные, или другие органические или неорганические частицы, и органические и неорганические красители.
Термин «аминокислота» относится к элементарной химической структурной единице белка или полипептида. Следующие аббревиатуры используются здесь для обозначения определенных аминокислот:
«Ген» относится к фрагменту нуклеиновой кислоты, который экспрессирует определенный белок, включающему в себя регуляторные последовательности, предшествующие данной кодирующей последовательности (5'-кодирующие последовательности) и следующие за ней (3'-кодирующие последовательности). «Нативный ген» означает ген, который встречается в природе, с его собственными регуляторными последовательностями. «Химерный ген» означает любой ген, который не является нативным геном, включающий в себя регуляторные и кодирующие последовательности, которые вместе не встречаются в природе. Соответственно, химерный ген может включать в себя регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, происходящие из одного и того же источника, но расположенные в порядке, отличном от того, который обнаружен в природе. «Чужеродный» ген означает ген, который обычно не обнаруживается в организме-хозяине, но который встроен в данный организм-хозяин посредством переноса гена. Чужеродные гены могут включать в себя нативные гены, встроенные в ненативные организмы, или химерные гены.
«Синтетические гены» могут быть собраны из олигонуклеотидных структурных единиц, которые химически синтезированы с использованием способов, известных специалисту в данной области. Эти структурные единицы лигируются и отжигаются для образования сегментов гена, которые затем собираются ферментативным способом для конструкции полного гена. «Химически синтезирована», по отношению к последовательности ДНК, означает, что данные составляющие нуклеотиды собраны in vitro. Химический синтез ДНК вручную может быть осуществлен с использованием общеизвестных процедур, или автоматизированный химический синтез может быть выполнен с использованием одного из множества серийно выпускаемых приборов. Соответственно, данные гены могут быть сконструированы для оптимальной экспрессии гена на основе оптимизации нуклеотидной последовательности для отражения сдвига кодонов данной клетки-хозяина. Квалифицированный специалист оценивает возможность результативной экспрессии гена, если используемый кодон смещен по отношению к кодонам, предпочитаемым клеткой-хозяином. Установление предпочтительных кодонов может быть основано на изучении генов, полученных из клетки-хозяина, где доступна информация о последовательности.
Термин «фаговый дисплей» относится к выявлению функциональных чужеродных пептидов или небольших белков на поверхности бактериофага или фагмидных частиц. Созданный методами генетической инженерии фаг может быть использован для представления пептидов в качестве сегментов их нативных поверхностных белков. Пептидные библиотеки могут быть порождены популяциями фага с различными последовательностями генов.
«ПЦР» или «полимеразная цепная реакция» представляет собой технологию, используемую для амплификации специфических участков ДНК (патенты США №№ 4683195 и 4800159).
Использованные здесь стандартные технологии рекомбинантных ДНК и молекулярного клонирования хорошо известны из уровня техники, и они описаны у Sambrook, J., Fritsch, E.F. and Maniatis, T., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1989) (в дальнейшем «Maniatis»); и у Silhavy, T. J., Bennan, M. L. and Enquist, L. W., Experiments with Gene Fusions, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1984); и у Ausubel, F.M. et al., Current Protocols in Molecular Biology, издательство Greene Publishing Assoc. and Wiley-Interscience (1987).
Данное изобретение обеспечивает способ увеличения прочности дисперсных полезных агентов, например, красителей, дисперсных кондиционеров и неорганических солнцезащитных средств, на поверхностях тела, таких как волосы и кожа, включающий в себя нанесение на данную поверхность тела дисперсного полезного агента с полимерным покрытием в сочетании с композицией, включающей в себя пептид, имеющий сродство к данному полимерному покрытию. Данные пептиды, имеющие сродство к данному полимерному покрытию, также называемые здесь «пептиды, связывающиеся с полимером», можно идентифицировать с помощью комбинаторных способов, как, например, фаговый дисплей. Кроме того, данная композиция, включающая в себя пептид, имеющий сродство к данному полимерному покрытию, может дополнительно включать в себя пептид, связывающийся с поверхностью тела, например, пептид, связывающийся с волосами или кожей, либо как свободный пептид, либо в виде конъюгата, включающего в себя данный пептид, связывающийся с полимером, соединенный с пептидом, связывающимся с поверхностью тела. В данном способе по данному изобретению данная композиция, включающая в себя пептид, имеющий сродство к данному полимерному покрытию, может применяться одновременно с применением данного дисперсного полезного агента с полимерным покрытием, до применения данного полезного агента или после применения данного полезного агента для прочного сцепления данного полезного агента с данной поверхностью тела.
Дисперсные полезные агенты
Данный способ по данному изобретению можно применять в сочетании с большим разнообразием дисперсных полезных агентов, известных в области средств личной гигиены. Примеры дисперсных полезных агентов включают в себя, но не ограничиваются ими, красители, дисперсные кондиционирующие агенты и неорганические солнцезащитные средства.
Используемый здесь термин «красители» означает нерастворимые красители. Большое разнообразие органических и неорганических красителей отдельно или в комбинации можно использовать в настоящем изобретении. Красители для окрашивания волос и кожи хорошо известны из уровня техники (смотри, например, Green et al. (WO 0107009), включено здесь посредством ссылки, CFTA International Color Handbook, 2nded., Micelle Press, England (1992) и Cosmetic Handbook, US Food and Drug Administration, FDA/IAS Booklet (1992)), и они доступны в промышленных масштабах из различных источников (например, Bayer, Pittsburgh, PA; Ciba-Geigy, Tarrytown, NY; ICI, Bridgewater, NJ; Sandoz, Vienna, Austria; BASF, Mount Olive, NJ; и Hoechst, Frankfurt, Germany). Примеры красителей включают в себя, но не ограничиваются ими, D&C красный № 36, D&C красный № 30, D&C оранжевый № 17, зеленый 3 лак, Ext. желтый 7 лак, оранжевый 4 лак, и красный 28 лак; кальциевые лаки D&C красный №№ 7, 11, 31 и 34, бариевый лак D&C красный № 12, стронциевый лак D&C красный № 13, алюминиевые лаки FD&C желтый № 5, FD&C желтый № 6, FD&C № 40, D&C красный №№ 21, 22, 27, и 28, FD&C синий № 1, D&C оранжевый № 5, D&C желтый № 10, циркониевый лак D&C красный № 33; Cromophthal® желтый 131AK (Ciba Specialty Chemicals), Sunfast® фуксин 122 (Sun Chemical) и Sunfast® синий 15:3 (Sun Chemical), оксиды железа, карбонат кальция, гидроксид алюминия, сульфат кальция, каолин, железистый гексациано-железо-кислый аммоний, карбонат магния, кармин, сульфат бария, слюду, оксихлорид висмута, стерат цинка, фиолетовый марганец, оксид хрома, диоксид титана, черный диоксид титана, наночастицы диоксида титана, оксид цинка, оксид бария, синий ультрамарин, лимоннокислый висмут, и белые минералы, такие как гидроксиапатит и циркон (силикат циркония), и частицы углеродной сажи.
Пигменты, по определению, являются в основном нерастворимыми веществами и, вследствие этого, используются в дисперсной форме. Пигмент может быть диспергирован с использованием диспергирующего агента, или можно использовать самодиспергирующийся краситель. В случае использования диспергирующего агента для диспергирования данного красителя данным диспергирующим агентом может быть любой пригодный диспергирующий агент, известный в уровне техники, в том числе, но не ограничиваясь этим, смешанные или структурированные органические полимерные диспергирующие агенты, как описано ниже; белковые диспергирующие агенты, такие как те, которые описаны у Brueckmann et al. (патент США № 5124438); и диспергирующие агенты на основе пептидов, как те, которые описаны у O'Brien et al. (рассматриваемая совместно и общедоступная публикация патентной заявки США № 2005/0054752). Предпочтительные смешанные органические полимерные диспергирующие агенты включают в себя акриловый полимер и стирол-акриловые полимеры. Самыми предпочтительными являются структурированные диспергирующие агенты, которые включают в себя AB, BAB и ABC блок-сополимеры, полимеры с разветвленной структурой и графт-полимеры. Предпочтительно данные органические полимеры включают в себя мономерные единицы, выбранные из группы, включающей в себя акрилат, метакрилат, бутилметакрилат, 2-этилгексил метакрилат, бензилметакрилат, феноксиэтил метакрилат, этокситриэтиленгликоль метакрилат, полиэтиленгликоль метакрилат, полиэтиленгликоль акрилат, акриловую кислоту, метакриловую кислоту, метакриламид, акриламид, диметиламиноэтил метакрилат, гидроксиэтил акрилат, и гидроксиэтил метакрилат, такие, как описаны у Nigan (публикация патентной заявки США № 2004/0232377). Некоторые эффективные структурированные полимерные диспергирующие агенты раскрыты в патенте США № 5085698, EP-A-0556649 и патенте США № 5231131 (описания которых включены здесь посредством ссылки). Кроме того, красители могут быть диспергированы с помощью поверхностно-активного агента, включающего в себя лигносульфоновые кислоты и полипептид, как описано у Cioca et al. в патенте США № 4494994, который включен здесь посредством ссылки.
Данные органические полимеры на данном красителе могут при желании быть сшиты посредством ковалентных или ионных связей, как правило, после того, как они были нанесены на данный краситель. Образование поперечных связей повышает стойкость и устойчивость к воздействию окружающей среды данного полимерного покрытия.
При желании поверхность данного красителя может быть подготовлена перед покрытием органическим полимером. Обычные поверхностные обработки включают в себя, но не ограничиваются этим, акрилсилан, силоксан, метикон и диметикон. Обработка поверхности увеличивает диапазон полимеров, которые имеют сродство к поверхности данного красителя.
Самодиспергирующийся краситель представляет собой краситель, чья поверхность была изменена с помощью химически прикрепленных обеспечивающих дисперсность групп, для обеспечения стабильной дисперсии без отдельного диспергирующего агента. Для дисперсии в среде водного носителя модификация поверхности предусматривает добавление гидрофильных групп и наиболее характерно ионизируемых гидрофильных групп. Данный самодиспергирующийся краситель может быть получен с помощью наращивания функциональной группы или молекулы, содержащей в себе функциональную группу, на поверхность данного красителя посредством физической обработки (например, вакуумно-плазменная обработка) или посредством химической обработки (например, окисление озоном, гипохлористой кислотой и тому подобное). Гидрофильные функциональные группы одного типа или множества типов могут быть связаны с одной частицей красителя. Самодиспергирующиеся красители описаны, например, в патенте США № 5571311, патенте США № 5609671, патенте США № 5968243, патенте США № 5928419, патенте США № 6323257, патенте США № 5554739, патенте США № 5672198, патенте США № 5698016, патенте США № 5718746, патенте США № 5749950, патенте США № 5803959, патенте США № 5837045, патенте США № 5846307, патенте США № 5895522, патенте США № 5922118, патенте США № 6123759, патенте США № 6221142, патенте США № 6221143, патенте США № 6281267, патенте США № 6329446, патенте США № 6332919, патенте США № 6375317, патенте США № 6287374, патенте США № 6398858, патенте США № 6402825, патенте США № 6468342, патенте США № 6503311, патенте США № 6506245, и патенте США № 6852156. Раскрытия данного предшествующего ссылочного материала включены здесь посредством ссылки.
Металлические и полупроводниковые наночастицы также можно использовать в качестве агентов для окрашивания волос вследствие их сильного испускания света (Vic et al., публикация патентной заявки № 2004/0010864). Данные металлические наночастицы включают в себя, но не ограничиваются ими, частицы золота, серебра, платины, палладия, иридия, родия, осмия, железа, меди, кобальта и сплавы, состоящие из этих металлов. «Сплав» здесь определен как гомогенная смесь двух или более металлов. «Полупроводниковые частицы» включают в себя, но не ограничиваются ими, частицы селенида кадмия, сульфида кадмия, сульфида серебра, сульфида кадмия, оксида цинка, сульфида цинка, селенида цинка, сульфида свинца, арсенида галлия, кремния, оксида олова, оксида железа и фосфида индия. Данные наночастицы стабилизированы и сделаны водорастворимыми посредством использования подходящего органического покрытия или монослоя. Используемые здесь наночастицы, защищенные монослоем, являются одним из типов стабилизированной наночастицы. Способы получения стабилизированных, водорастворимых металлических и полупроводниковых наночастиц известны из уровня техники, и подходящие примеры описаны у Huang et al. в рассматриваемой совместно и общедоступной публикации патентной заявки США № 2004/0115345, которая включена здесь посредством ссылки. Цвет данных наночастиц зависит от размера данных частиц. Таким образом, контролируя размер данных наночастиц, можно получить различные цвета.
Данный дисперсный полезный агент может также быть наночастицами, например органическими наночастицами; неорганическими наночастицами, например наночастицами кремния; полимерными наночастицами; металлическими и полупроводниковыми наночастицами, которые выполняют функцию агентов, кондиционирующих волосы, в частности агентов, способствующих выпрямлению волос, усилению волос, и агентов, придающих волосам объем.
Данный дисперсный полезный агент может также быть неорганическим УФ солнцезащитным средством, которое поглощает, отражает или рассеивает ультрафиолетовый свет при длине волны от 290 до 400 нанометров. Неорганические УФ солнцезащитные вещества обычно представляют собой неорганические красители и оксиды металлов, в том числе, но не ограничиваясь этим, диоксид титана (например, SunSmart, имеющийся в наличии у Cognis Co.), оксид цинка и оксид железа. Предпочтительным солнцезащитным фильтром являются наночастицы диоксида титана. Пригодные наночастицы диоксида титана описаны в патентах США №№ 5451390; 5672330; и 5762914. Диоксид титана P25 представляет собой пример пригодного коммерческого продукта, имеющегося в наличии у Degussa (Parsippany, NJ). Другие коммерческие поставщики наночастиц диоксида титана включают в себя Kemira (Helsinki, Finland), Sachtleben (Duisburg, Germany) и Tayca (Osaka, Japan).
Наночастицы диоксида титана обычно имеют средний размер диаметра частицы менее чем 100 нанометров (нм), что определено с помощью динамического рассеяния света, которое измеряет распределение частиц по размерам частиц в жидкой суспензии. Данные частицы представляют собой обычно конгломераты, которые могут варьировать приблизительно от 3 нм приблизительно до 6000 нм. Для получения таких частиц можно использовать любой технологический процесс, известный в уровне техники. Данный технологический процесс может включать в себя окисление в паровой фазе галогенидов титана или переосаждение раствора из растворимых титановых комплексов при условии, что получены наночастицы диоксида титана.
Предпочтительным процессом для получения наночастиц диоксида титана является нагнетание кислорода и галогенида титана, предпочтительно тетрахлорида титана, в высокотемпературную реакционную зону, обычно в диапазоне от 400 до 2000°С. В условиях высокой температуры, представленных в данной реакционной зоне, формируются наночастицы диоксида титана, имеющие высокую удельную поверхность и ограниченное распределение частиц по размерам. Источником энергии в данном реакторе может быть любой источник нагревания, например плазменная горелка.
Дисперсные полезные агенты с полимерным покрытием
Для применения в данном изобретении данный дисперсный полезный агент покрыт полимерным покрытием, так что пептиды, имеющие сродство к данному полимеру, установленному с помощью комбинаторных методов, как описано ниже, будут связываться с данным полимерным покрытием. Данное полимерное покрытие может быть образовано из множества различных органических и биологических полимеров, в том числе, но не ограничиваясь этим, из полиакрилата, полиметакрилатов, полиметилметакрилатов, поликарбонатов, полистирола, полипропилена, полиэтилентерефталата, полиуретанов, полипептидов, лигнина, полисахаридов, полиамидов, полиимидов, полиарамидов, и сополимеров (например, блок-сополимеры и графт-сополимеры), включающих в себя, по меньшей мере, один мономер метакрилатов, акрилатов или стирола.
Этот краситель, диспергированный с помощью полимерного диспергирующего агента, как описано выше, используемый в качестве дисперсного полезного агента, данный полимерный диспергирующий агент, может выполнять функцию данного полимерного покрытия. Можно использовать любой из описанных выше полимерных диспергирующих агентов. Например, красители, диспергированые с помощью диспергирующего агента, содержащего в себе полиакрилат, можно использовать в сочетании с пептидом, связывающимся с полиакрилатом. Альтернативно, данный диспергированный краситель может быть покрыт другим полимером, как описано ниже.
Для красителей и самодиспергирующихся красителей и других дисперсных полезных агентов, которые обычно не используются с полимерным диспергирующим агентом, данные частицы могут быть покрыты данным полимером с использованием известных в уровне техники способов нанесения покрытия на частицы. В основном, способы, используемые для нанесения покрытия на частицы, представляют собой способы на основе растворов, которые основаны на нанесении раствора полимерного покрытия на поверхность частицы, с последующим удалением данного сольвента. Например, данный дисперсный полезный агент может быть покрыт полимером посредством простого смешивания данных частиц с раствором, содержащим в себе данный полимер, в течение времени, достаточного для покрытия данных частиц, а затем данный сольвент удаляют. Кроме того, данные дисперсные полезные агенты могут быть покрыты полимером с помощью технологий нанесения покрытия распылением, как те, которые описаны у Guignon et al. (Drying Technol. 20: 419-447 (2002)). Покрытия также могут быть нанесены с помощью устройства для нанесения покрытий Wurster (смотри, например, Cardozo et al., публикация патентной заявки США № 2006/0019860). Данные дисперсные полезные агенты по данному изобретению также могут быть покрыты полимером с использованием метода эмульгирования-испарения растворителя, как описано у Rosca et al. (J. Control Release 99: 271-280 (2004)). Кроме того, дисперсные полезные агенты могут быть покрыты полимером посредством метода инжекторного смесителя и аппарата, описанного Schurr (патент США № 4430001 и WO 97/007879). В данном способе инжекторного смесителя небольшие уровни вспомогательных веществ тщательно смешиваются с порошками, одновременно распыляя данную покрывающую жидкость и диспергируя данные частицы в газовом инжекторе. Данный способ обеспечивает преимущество использования малого количества воды и очень короткое время контакта, что делает возможным наносить покрытие на материалы, чувствительные к температуре, при высоких температурах.
Определение пептидов, связывающихся с полимером
Пептиды, имеющие сродство к полимеру, также называемые здесь пептидами, связывающимися с полимером (PBP), представляют собой пептидные последовательности, которые прочно связываются с поверхностью полимера. Данные пептиды, связывающиеся с полимером, по данному изобретению имеют длину приблизительно от 7 аминокислот, приблизительно до 50 аминокислот, более предпочтительно, приблизительно от 7 аминокислот, приблизительно до 25 аминокислот, наиболее предпочтительно, приблизительно от 7 приблизительно до 20 аминокислот. Подходящие пептиды, связывающиеся с полимером, могут быть выбраны с использованием способов, которые хорошо известны из уровня техники.
Данные пептиды, связывающиеся с полимером, могут быть созданы беспорядочно и затем отобраны по отношению к специфическому полимерному субстрату, исходя из их аффинности связывания с представляющим интерес субстратом, как описано у O'Brien et al. (рассматриваемая совместно и общедоступная публикация патентной заявки США № 2005/0054752), Adey et al., (Gene 156: 27-31, (1995)), Murray et al. (публикация патентной заявки № 2002/0098524) и Grinstaff et al. (публикация патентной заявки № 2003/0185870), все включены здесь посредством ссылки. Создание смешанных библиотек пептидов хорошо известно и может быть достигнуто посредством ряда технологических приемов, в том числе с помощью бактериального дисплея (Kemp, D.J.; Proc. Natl. Acad. Sci.USA 78(7): 4520-4524 (1981), и Helfman et al., Proc. Natl. Acad. Sci. USA 80(1): 31-35, (1983)), дрожжевого дисплея (Chien et al., Proc Natl Acad Sci USA 88(21): 9578-82 (1991)), комбинаторного твердофазного синтеза пептидов (патент США № 5449754, патент США № 5480971, патент США № 5585275, патент США № 5639603) и технологии фагового дисплея (патент США № 5223409, патент США № 5403484, патент США № 5571698, патент США № 5837500). Технологические приемы для создания таких библиотек биологических пептидов хорошо известны из уровня техники. Иллюстративные способы описаны у Dani, M., J. of Receptor & Signal Transduction Res., 21(4): 447-468 (2001), Sidhu et al., Methods in Enzymology 328: 333-363 (2000), Kay et al., Combinatorial Chemistry & High Throughput Screening, Vol. 8: 545-551 (2005), и Phage Display of Peptides and Proteins, A Laboratory Manual, Brian K. Kay, Jill Winter, and John McCafferty, eds.; Academic Press, NY, 1996. Кроме того, библиотеки фагового дисплея доступны на коммерческой основе у таких компаний, как New England BioLabs (Beverly, MA).
Предпочтительным способом для создания смешанных пептидов является фаговый дисплей. Фаговый дисплей представляет собой технологию отбора in vitro, в которой пептид или белок генетически сплавлен с белком оболочки бактериофага, что приводит к выражению слитого пептида на поверхности данного вириона бактериофага, в то время как ДНК, кодирующая данный сплав, находится внутри данного вириона. Это физическое сцепление между выявляемым пептидом и ДНК, кодирующей его, позволяет проводить скрининг очень большого числа вариантов пептидов, каждый из которых связан с соответствующей последовательностью ДНК, посредством простой процедуры отбора in vitro, называемой «биопэннинг». В его самой простой форме, биопэннинг проводится посредством инкубирования пула вариантов, выражающих фаг, с представляющей интерес мишенью, которая иммобилизирована на планшете или бусах, отмывают несвязавшийся фаг и элюируют специфически связавшийся фаг, разрушая связывающие взаимодействия между данным фагом и данной мишенью. Элюированный фаг затем амплифицируют in vivo и повторяют данный процесс, что приводит к постадийному увеличению фагового пула, что способствует прочному связыванию последовательностей. После 3 или более циклов селекция/амплификация определяют характеристики отдельных клонов посредством секвенирования ДНК.
В частности, данные пептиды, связывающиеся с полимером, могут быть отобраны посредством следующего метода. Создают подходящую библиотеку фаговых пептидов с использованием способов, описанных выше, или данную библиотеку приобретают у коммерческого поставщика. После создания библиотеки фаговых пептидов данную библиотеку затем вводят в контакт с соответствующим количеством данного полимерного субстрата. Данную библиотеку фаговых пептидов растворяют в подходящем растворе для проведения контакта с данным субстратом. Данный тестируемый субстрат может быть суспендирован в данном растворе или может быть иммобилизован на планшете или бусине. Предпочтительным раствором является забуференный водный физиологический раствор, содержащий в себе сурфактант. Подходящим раствором является физиологический раствор, забуференный Трис (TBS) с 5% Tween® 20. Данный раствор может быть дополнительно перемешан любым способом для увеличения скорости переноса массы данных пептидов к данному полимерному субстрату, что, таким образом, укорачивает время, необходимое для достижения максимального связывания.
При контакте целый ряд случайно созданных фаговых пептидов будет связываться с данным полимерным субстратом для образования комплекса фаг-пептид-полимер. Несвязанные фаговые пептиды можно удалить посредством отмывки. После того, как все несвязанные вещества удалены, фаговые пептиды, имеющие разные степени аффинности связывания с данным полимерным субстратом, могут быть фракционированы посредством избирательных отмывок в буферах, имеющих переменную строгость. Повышение строгости данного используемого буфера увеличивает необходимую силу связи между данным фаговым пептидом и полимерным субстратом в данном комплексе фаг-пептид-субстрат.
Целый ряд веществ можно использовать для изменения строгости данного буферного раствора при отборе пептида, включая без ограничения кислый рН (1,5-3,0); основный рН (10-12,5); высокие концентрации солей, таких как MgCl2 (3-5 M) и LiCl (5-10 M); водный раствор этиленгликоля (25-50%); диоксан (5-20%); тиоционат (1-5 M); гуанидин (2-5 M); мочевина (2-8 M); и различные концентрации других поверхностно-активных веществ, таких как SDS (додецилсульфат натрия), DOC (дезоксихолат натрия), Нонидет P-40, Тритон X-100, Tween® 20, где Tween® 20 предпочтителен. Эти вещества могут быть приготовлены в буферных растворах, включая без ограничения Трис-HCl, физиологический раствор, забуференный Трис, Трис-борат, Трис-уксусная кислота, триэтиламин, фосфатный буфер и глицин HCl, среди которых предпочтительным является физиологический раствор, забуференный Трис.
Будет принято во внимание, что фаговые пептиды, имеющие повышенную аффинность связывания с данным полимерным субстратом, могут быть элюированы посредством повторения процесса отбора с использованием буферов с повышенной строгостью. Данные фаговые пептиды могут быть идентифицированы, и их последовательность может быть определена любым способом, который известен из уровня техники.
В одном варианте осуществления для создания пептидов, связывающихся с полимером, по данному изобретению можно использовать следующий способ. Библиотеку комбинаторно созданных фаговых пептидов вводят в контакт с представляющим интерес полимерным субстратом, для формирования комплексов фаг-пептид-субстрат. Данный комплекс фаг-пептид-субстрат отделяют от пептидов, не вошедших в комплекс, и несвязанного субстрата, и данную связь фаг-пептид из комплексов фаг-пептид-субстрат элюируют из данного комплекса, предпочтительно посредством кислотной обработки. Затем данные элюированные фаговые пептиды определяют и устанавливают их последовательность. Для установления пептидных последовательностей, которые связываются с одним полимерным субстратом, но не связываются с другим, можно добавить этап субтрактивного пэннинга. В частности, сначала данную библиотеку комбинаторно созданных фаговых пептидов вводят в контакт с не-мишенью, для удаления фаговых пептидов, которые с ней связываются. Затем несвязавшиеся фаговые пептиды вводят в контакт с искомым полимерным субстратом и продолжают вышеуказанные процессы. Альтернативно, данную библиотеку комбинаторно созданных фаговых пептидов можно вводить в контакт с не-мишенью и искомым полимерным субстратом одновременно. Затем данные комплексы фаг-пептид-субстрат отделяют от комплексов фаг-пептид-не-мишень и продолжают вышеописанный метод для искомых комплексов фаг-субстрат.
Альтернативно, для изолирования пептидов с более высокой аффинностью к полимерным субстратам можно использовать модифицированный метод отбора фагового дисплея. В данном модифицированном способе данные комплексы фаг-пептид-субстрат сформированы, как описаны выше. Затем эти комплексы обрабатывают буфером для элюции. Можно использовать любой из описанных выше буферов для элюции. Предпочтительно, данный буфер для элюции представляет собой кислый раствор. Затем оставшиеся, устойчивые к элюции комплексы фаг-пептид-субстрат используют для прямой инфекции/трансфекции бактериальной клетки-хозяина, например, E.coli ER2738. Данные инфицированные клетки-хозяева выращивают в соответствующей среде для выращивания, например среде LB (Luria-Bertani), и эту культуру распределяют по агару, содержащему подходящую среду для выращивания, например, среду LB с IPTG (изопропил β-D-тиогалактопиранозид) и S-Gal™. После выращивания отбирают бляшки для выделения ДНК и секвенирования для определения пептидных последовательностей с высокой аффинностью к представляющему интерес субстрату. Альтернативно, ПЦР можно использовать для определения устойчивых к элюции фаговых пептидов из описанного выше модифицированного метода отбора фагового дисплея, посредством прямого проведения ПЦР с комплексами фаг-пептид-субстрат с использованием соответствующих праймеров, как описано у Janssen et al. в публикации патентной заявки США № 2003/0152976, которая включена здесь посредством ссылки.
Кроме того, пептиды, связывающиеся с полимером, устойчивые к вымыванию с помощью шампуня, могут быть отобраны с использованием модификации метода биопэннинга для отбора пептидов, связывающихся с волосами, устойчивых к вымыванию с помощью шампуня, который описан у O'Brien et al. (рассматриваемая совместно и общедоступная публикация патентной заявки США № 2006/0073111, которая включена здесь посредством ссылки). Схожим образом, пептиды, связывающиеся с полимером, устойчивые к воздействию кондиционера для волос, можно идентифицировать с использованием модификации способа отбора пептидов, связывающихся с волосами, устойчивых к воздействию кондиционера для волос, который описан у Wang et al. (рассматривая совместно и общедоступная патентная заявка США № 11/359163). Данные пептиды, связывающиеся с полимером, устойчивые к вымыванию с помощью шампуня и устойчивые к воздействию кондиционера для волос, являются чрезвычайно эффективными для обработки волос, поскольку они способны противостоять обработке шампунем или кондиционером для волос соответственно. В этих способах для выявления пептидов, связывающихся с полимером, устойчивых к воздействию шампуня или кондиционера для волос, исходная библиотека фаговых пептидов разведена в представляющем интерес матричном растворе (а именно раствор шампуня или раствор кондиционера для волос) для обеспечения контакта с данным полимерным субстратом. Альтернативно, данный комплекс фаг-пептид-субстрат, после его формирования в результате взаимодействия данного полимерного субстрата с данной библиотекой фаговых пептидов, как описано выше, вводят в контакт с представляющим интерес матричным раствором. Данное контактирование данного комплекса фаг-пептид-субстрат с представляющим интерес матричным раствором можно повторить один или несколько раз. Затем данный метод биопэннинга проводят, как описано выше. Данный матричный раствор шампуня или матричный раствор кондиционера для волос может быть концентрированным коммерческим продуктом или его разведением. Подробное описание отбора пептидов, связывающихся с полиметилметакрилатом, устойчивых к вымыванию шампунем, дается в Примере 21.
Соответствующие примеры пептидов, связывающихся с полимером, выявленных с использованием способов, описанных выше, включают в себя без ограничения, пептиды, связывающиеся с полиметилметакрилатом, данные как SEQ ID №№ 1-14, пептиды, связывающиеся с полиметилметакрилатом, устойчивые к вымыванию шампунем, данные как SEQ ID №№ 98-112, пептиды, связывающиеся с полипропиленом, данные как SEQ ID №№ 15-21, пептиды, связывающиеся с политетратфторэтиленом, данные как SEQ ID №№ 22-30, пептиды, связывающиеся с нейлоном, данные как SEQ ID №№ 31-36, пептиды, связывающиеся с полиэтиленом, данные как SEQ ID №№ 37-43, и пептиды, связывающиеся с полистиролом, данные как SEQ ID №№ 44-46. Кроме того, можно использовать пептиды, связывающиеся с пептидом, известные из уровня техники, например пептиды, связывающиеся с полистиролом и поливинилхлоридом, раскрытые у Adey et al. (Gene 156: 27-31, (1995)), пептиды, связывающиеся с полиуретаном, раскрытые у Murray et al. (публикация патентной заявки США № 2002/0098524), пептиды, связывающиеся с полиэтилентерефталатом, раскрытые у O'Brien et al. (рассматриваемая совместно и общедоступная публикация патентной заявки США № 2005/0054752), и пептиды, связывающиеся с полистиролом, полиуретаном, поликарбонатом и нейлоном, раскрытые у Grinstaff et al., (публикация патентной заявки США № 2003/0185870). Может быть желательно соединить вместе два или более пептидов, связывающихся с полимером, либо непосредственно, либо через спейсер, для усиления взаимодействия данного пептида с данным полимерным субстратом. Способы получения составных пептидных композиций и соответствующие спейсеры описаны ниже.
Производство пептидов, связывающихся с полимером
Полипептиды, связывающиеся с полимером, по настоящему изобретению можно получить с использованием стандартных способов синтеза пептидов, которые хорошо известны из уровня техники (смотри, например, Stewart et al., Solid Phase Peptide Synthesis, Pierce Chemical Co., Rockford, IL, 1984; Bodanszky, Principles of PeptideSynthesis, Springer-Verlag, New York, 1984; and Pennington et al., Peptide Synthesis Protocols, Humana Press, Totowa, NJ, 1994). Кроме того, многие компании предлагают собственные услуги по пептидному синтезу.
Альтернативно, пептиды, связывающиеся с полимером, по настоящему изобретению могут быть изготовлены с использованием технологий рекомбинантных ДНК и технологий молекулярного клонирования. Гены, кодирующие данные пептиды, связывающиеся с полимером, могут вырабатываться в гетерологичных клетках-хозяевах, в частности в клетках микробного организма-хозяина, как описано у Huang et al. (публикация патентной заявки США № 2005/0050656) и O'Brien et al., supra. Данные пептиды, в случае получения их посредством технологий рекомбинантных ДНК и молекулярного клонирования, могут дополнительно включать в себя остаток пролина (Р) на N-конце и при желании остаток аспарагиновой кислоты (D) на С-конце. Эти дополнительные остатки появляются в результате использования участков расщепления DP для отделения необходимой пептидной последовательности от пептидных меток, использованных для активирования формирования включения, и между тандемными повторами данных пептидных последовательностей (смотри Пример 18).
Пептиды, связывающиеся с поверхностью тела
Данные пептиды, связывающиеся с полимером, можно использовать в комбинации с пептидами, связывающимися с поверхностью тела, в том числе, но не ограничиваясь этим, с пептидами, связывающимися с волосами или кожей. Пептиды, связывающиеся с поверхностью тела (BSBP), как определено здесь, представляют собой пептидные последовательности, которые связываются с высокой аффинностью с поверхностью тела. Пептиды, связывающиеся с поверхностью тела, могут быть синтезированы с использованием комбинаторных способов, как описано выше и как описано у Huang et al. (рассматриваемые совместно и общедоступные публикация патентной заявки США № No.2005/0050656, и публикация патентной заявки США № 2005/0226839), Estell et al. (WO 0179479); Murray et al. (публикация патентной заявки США № 2002/0098524); Janssen et al. (публикация патентной заявки США № 2003/0152976); и Janssen et al. (WO 04048399). Кроме того, пептиды, связывающиеся с волосами, устойчивые к вымыванию шампунем, могут быть отобраны с использованием модифицированного способа биопэннинга, как описано у O'Brien et al. в рассматриваемой совместно и общедоступной публикации патентной заявки США № 2006/0073111. Аналогично, пептиды, связывающиеся с волосами, устойчивые к воздействию кондиционера для волос и пептиды, связывающиеся с кожей, устойчивые к воздействию композиций для ухода за кожей, могут быть идентифицированы с использованием способов, описанных у Wang et al. (рассматриваемая совместно и общедоступная патентная заявка США № 11/359163) и Wang et al. (рассматриваемая совместно и общедоступная патентная заявка США № 11/359162) соответственно. В этих способах либо данную исходную библиотеку фаговых пептидов растворяют в представляющем интерес матричном растворе (а именно матричный раствор шампуня, матричный раствор кондиционера для волос, или матричный раствор композиции для ухода за кожей) для проведения контакта с данным субстратом, либо данный комплекс фаг-пептид-субстрат после его образования в результате взаимодействия данного субстрата с библиотекой фаговых пептидов, как описано выше, вводят в контакт с представляющим интерес матричным раствором. Затем проводят способ биопэннинга, как описано выше. Данные матричный раствор шампуня, матричный раствор кондиционера для волос или матричный раствор композиции для ухода за кожей могут представлять собой концентрированный коммерческий продукт или их разведения. Примеры подходящих комбинаторно синтезированных пептидов, связывающихся с поверхностью тела, включают в себя, но не ограничиваются ими, последовательности, связывающиеся с волосами, данные как SEQ ID №№ 47-52, и 73-81, и последовательности, связывающиеся с кожей, данные как SEQ ID №№ 53-57, и 82-93 (смотри Таблицу A). Эти пептиды, связывающиеся с поверхностью тела, могут быть получены с использованием методов, описанных выше.
Альтернативно, пептидные последовательности, связывающиеся с волосами и кожей, могут быть получены опытным путем посредством конструирования пептидов, которые включают в себя положительно заряженные аминокислоты, которые могут связываться с волосами и кожей в результате электростатического взаимодействия, как описано у Rothe et al. (WO 2004/000257). Данные пептиды, связывающиеся с волосами и кожей, полученные опытным путем, имеют длину приблизительно от 7 аминокислот приблизительно до 50 аминокислот, и включают в себя, по меньшей мере, около 40 мольных % положительно заряженных аминокислот, таких как лизин, аргинин и гистидин. Пептидные последовательности, включающие в себя трипептидные мотивы, такие как HRK, RHK, HKR, RKH, KRH, KHR, HKX, KRX, RKX, HRX, KHX и RHX, являются наиболее предпочтительными, где X может быть любой природной аминокислотой, но наиболее предпочтительно, выбранной из аминокислот с нейтральными боковыми цепями, таких как, глицин, аланин, пролин, лейцин, изолейцин, валин и фенилаланин. Кроме того, следует понимать, что данные пептидные последовательности должны соответствовать другим функциональным потребностям при использование в конечном итоге, в том числе требованиям растворимости, вязкости и совместимости с другими компонентами в разработанном продукте, и, следовательно, будут изменяться в зависимости от потребности применения. Иногда в данном пептиде может содержаться до 60 мольных % аминокислот, не включающих в себя гистидин, лизин или аргинин. Подходящие пептиды, связывающиеся с волосами и кожей, полученные опытным путем, включают в себя, но не ограничиваются этим, пептидные последовательности, данные как SEQ ID №№ 58-62 (смотри Таблицу A).
Данные пептиды, связывающиеся с поверхностью тела, можно использовать в сочетании с пептидами, связывающимися с полимером, по данному изобретению для усиления эффектов дисперсных полезных агентов различными способами. Данный пептид, связывающийся с поверхностью тела, можно добавить в композицию, включающую в себя данный пептид, имеющий сродство к данному полимеру, как описано ниже. Альтернативно, можно использовать конъюгат, включающий в себя пептид, связывающийся с поверхностью тела, соединенный с пептидом, связывающимся с полимером. Взаимодействие данного сцепления может быть ковалентной связью или нековалентной связью, например водородной связью, электростатическим взаимодействием, гидрофобным взаимодействием или Ван-дер-ваальсовым взаимодействием. В случае нековалентного взаимодействия данный конъюгат на основе пептидов может быть получен в результате смешивания пептида, связывающегося с поверхностью тела, с пептидом, связывающимся с полимером, и при желании со спейсером, что обеспечивает достаточное время для того, чтобы данное взаимодействие произошло. Несвязавшиеся вещества могут быть отделены от полученного конъюгата на основе пептидов с использованием способов, известных в уровне техники, например с использованием методов хроматографии.
Данные конъюгаты на основе пептидов также могут быть получены посредством ковалентного присоединения специфического пептида, связывающегося с поверхностью тела, например пептида, связывающегося с волосами или кожей, к пептиду, связывающемуся с полимером, либо непосредственно, либо через молекулярный спейсер, как описано у Huang et al. в публикации патентной заявки США № 2005/0050656. Можно использовать любую подходящую известную химию сопряжения пептидов или белков для образования данных конъюгатов на основе пептидов по данному изобретению. Химия сопряжения хорошо известна из уровня техники (смотри, например, Hermanson, Bioconjugate Techniques, Academic Press, New York (1996)). Пригодные сшивающие агенты включают в себя, но не ограничиваются этим, карбодиимидные сшивающие агенты, хлорангидриды, изоцианаты, эпоксиды, малеимиды и другие функциональные связующие реагенты, которые являются реакционно-способными относительно терминальных групп амина и/или карбоксильных групп, и сульфгидрильных групп данных пептидов. Кроме того, может быть необходимым защищать реактивные группы амина и карбоксильные группы в данном пептиде для создания желаемой структуры для данного конъюгата на основе пептидов. Применения защитных групп для аминокислот, таких как t-бутилоксикарбонил (t-Boc), хорошо известны из уровня техники (смотри, например, Stewart et al., supra; Bodanszky, supra; и Pennington et al., supra).
Также может быть целесообразно соединить пептид, связывающийся с данной поверхностью тела, с пептидом, связывающимся с данным полимером, через молекулярный спейсер. Данный спейсер служит для разделения данных пептидных последовательностей для гарантии того, что они не препятствуют связыванию данных пептидов с данной поверхностью тела или данным полезным агентом с полимерным покрытием. Данный молекулярный спейсер может быть любой из множества молекул, таких как алкиловые цепи, фенильные соединения, этиленгликоль, амиды, сложные эфиры и тому подобное. Предпочтительными спейсерами являются гидрофильные и имеют длину цепи от 1 до приблизительно 100 атомов, более предпочтительно от 2 до приблизительно 30 атомов. Примеры предпочтительных спейсеров включают в себя, но не ограничиваются этим, этаноламин, этиленгликоль, полиэтилен с длиной цепи 6 атомов углерода, полиэтиленгликоль с 3-6 повторяющимися единицами, феноксиэтанол, пропаноламид, бутиленгликоль, бутиленгликольамид, пропилфенильные цепи и этил, пропил, гексил, стерил, цетил и пальмитоил алкильные цепи. Данный молекулярный спейсер может быть ковалентно прикреплен к данным пептидам с использованием любой из химий сцепления, описанных выше. Для облегчения встраивания данного спейсера можно использовать бифункциональный сшивающий агент, который содержит в себе спейсер и реакционно-способные группы на обоих концах для связывания с данными пептидами. Подходящие сшивающие агенты хорошо известны из уровня техники и включают в себя, но не ограничиваются этим, диамины, такие как 1,6-диаминогексан; диальдегиды, такие как глутаральдегид; сложные эфиры бис N-гидроксисукцинимида, такие как этиленгликоль-бис(сложный эфир янтарная кислота N-гидроксисукцинимид), дисукцинимидил глутарат, дисукцинимидил суберат, и этиленгликоль-бис(сукцинимидилсукцинат); диизоцианаты, такие как гексаметилендиизоцианат; бис-оксираны, такие как 1,4 бутандиил диглицидил эфир; дикарбоновые кислоты, такие как сукцинилдисалицилат; и тому подобное. Гетеробифункциональные сшивающие агенты, которые содержат в себе различные реакционно-способные группы на каждом конце, также можно использовать.
Кроме того, данным молекулярным спейсером может быть пептид, содержащий в себе любую аминокислоту и их сочетания. Предпочтительные пептидные спейсеры состоят из аминокислот: пролин, лизин, глицин, аланин и серин и их сочетаний. Данный пептидный спейсер может иметь длину от 1 до приблизительно 50 аминокислот, предпочтительно от 1 до приблизительно 20 аминокислот. Примеры пептидных спейсеров включают в себя, но не ограничиваются этим, последовательности SEQ ID №№ 63-65 и 94-97. Кроме того, данный пептидный спейсер может включать в себя сайт расщепления специфическим ферментом, например сайт для протеазы Каспаза 3, данный как SEQ ID № 66, который делает возможным ферментативное удаление данного дисперсного полезного агента с поверхности тела. Эти пептидные спейсеры могут быть сцеплены с последовательностями данных связывающих пептидов посредством любого способа, известного в уровне техники. Например, цельный конъюгат, основанный на пептидах, может быть получен с использованием стандартных методов пептидного синтеза, описанных выше. Кроме того, данные связующие пептиды и блоки пептидных спейсеров могут быть объединены, используя карбодиимидные сшивающие агенты (смотри, например, Hermanson, Bioconjugate Techniques, Academic Press, New York (1996)), хлориды двухосновных кислот, диизоцианаты и другие дифункциональные сшивающие реагенты, которые вступают в реакцию с терминальными группами амина и/или карбоновой кислоты в данных пептидах. Альтернативно, цельный конъюгат на основе пептидов может быть получен с использованием технологий рекомбинантных ДНК и молекулярного клонирования, описанных выше. Данным спейсером также может быть комбинация пептидного спейсера и молекулы органического спейсера, которая может быть получена с использование способов, описанных выше.
Также может быть желательно иметь многократные копии данного пептида, связывающегося с поверхностью тела, и пептида, связывающегося с полимером, соединенных вместе, для усиления взаимодействия между данным конъюгатом на основе пептидов, и полезного агента с полимерным покрытием и данной поверхностью тела, как описано у Huang et al. (публикация патентной заявки № 2005/0050656). Можно использовать либо многократные копии одного и того же пептида, связывающегося с поверхностью тела, и пептида, связывающегося с полимером, либо комбинацию различных пептидов, связывающихся с поверхностью тела и пептидов, связывающихся с полимером. Данная мультикопия конъюгатов, основанных на пептидах, может содержать в себе различные спейсеры, как описано выше. Примеры мультикопий конъюгатов «пептид, связывающийся с поверхностью тела//пептид, связывающийся с полимером» включают в себя, но не ограничиваются этим, мультикопии конъюгатов «пептид, связывающийся с волосами//пептид, связывающийся с полимером», данные как SEQ ID №№ 67-70.
В одном варианте осуществления данного изобретения данный конъюгат на основе пептидов представляет собой двублочную композицию, включающую в себя пептид, связывающийся с поверхностью тела (BSBP), и пептид, связывающийся с полимером (РВР), имеющую общую структуру [(BSBP)m-(PBP)n]x, где n и m независимо друг от друга варьируют от 1 до приблизительно 10, предпочтительно, от 1 до приблизительно 5, и х может быть от 1 до приблизительно 10. В другом варианте осуществления, данный конъюгат, основанный на пептидах, включает в себя молекулярный спейсер (S), отделяющий данный пептид, связывающийся с поверхностью тела, от данного пептида, связывающегося с полимером, как описано выше. Также можно использовать многократные копии данного пептида, связывающегося с поверхностью тела, и данного пептида, связывающегося с полимером, и многократные копии данного пептида, связывающегося с поверхностью тела, и данного пептида, связывающегося с полимером, могут быть отделены сами от себя и друг от друга посредством молекулярных спейсеров. В этом варианте осуществления данный конъюгат на основе пептидов представляет собой трехблочную композицию, включающую в себя пептид, связывающийся с поверхностью тела, спейсер и пептид, связывающийся с полимером, имеющую общую структуру [[(BSBP)m-Sq]x-[(PBP)n-Sr]z]y, где m, n, x и z независимо друг от друга варьируют от 1 приблизительно до 10, y находится в диапазоне от 1 приблизительно до 5, и где q и r каждый независимо равен 0 или 1 при условии, что оба r и q не могут быть равны 0.
В другом варианте осуществления пептид, связывающийся с поверхностью тела, представляет собой пептид, связывающийся с волосами, и данный конъюгат на основе пептидов, представляет собой двублочную композицию, включающую в себя данный пептид, связывающийся с волосами (НВР), и пептид, связывающийся с полимером (РВР), имеющую общую структуру [(HBP)m-(PBP)n]x, где n и m независимо друг от друга варьируют от 1 до приблизительно 10, предпочтительно от 1 до приблизительно 5, и x может быть от 1 до приблизительно 10.
В другом варианте осуществления пептид, связывающийся с поверхностью тела, представляет собой пептид, связывающийся с волосами, и данный конъюгат на основе пептидов, представляет собой трехблочную композицию, включающую в себя данный пептид, связывающийся с волосами (НВР), спейсер (S) и пептид, связывающийся с полимером (РВР), имеющую общую структуру [[(HBP)m-Sq]x-[(PBP)n-Sr]z]y, где m, n, x и z независимо друг от друга варьируют от 1 приблизительно до 10, y варьирует от 1 приблизительно до 5, и где q и r каждый независимо друг от друга может быть 0 или 1, при условии, что оба r и q не могут быть равны 0.
В другом варианте осуществления пептид, связывающийся с поверхностью тела, представляет собой пептид, связывающийся с кожей, и данный конъюгат на основе пептидов, представляет собой двублочную композицию, включающую в себя данный пептид, связывающийся с кожей (SBP), и пептид, связывающийся с полимером (РВР), имеющую общую структуру [(SBP)m-(PBP)n]x, где n и m независимо друг от друга варьируют от 1 до приблизительно 10, предпочтительно, от 1 до приблизительно 5, и х может быть от 1 до приблизительно 10.
В другом варианте осуществления пептид, связывающийся с поверхностью тела, представляет собой пептид, связывающийся с кожей, и данный конъюгат на основе пептидов представляет собой трехблочную композицию, включающую в себя данный пептид, связывающийся с кожей (SBP), спейсер (S) и пептид, связывающийся с полимером (РВР), имеющую общую структуру [[(SBP)m-Sq]x-[(PBP)n-Sr]z]y, где m, n, x и z независимо друг от друга варьируют от 1 приблизительно до 10, y варьирует от 1 приблизительно до 5, и где q и r каждый независимо друг от друга может быть 0 или 1 при условии, что оба r и q не могут быть равны 0.
Следует понимать, что используемые здесь BSBP, HBP, SBP и PBP являются общими обозначениями и не предназначены для отнесения к единственному пептиду, связывающемуся с поверхностью тела, пептида, связывающегося с волосами, пептиду, связывающемуся с кожей, или пептидной последовательности, связывающейся с полимером, соответственно. Там, где m, n, x или z, как они используются выше, составляют более 1, изобретение обладает всем необходимым для обеспечения состояния, когда группа различных последовательностей пептидов, связывающихся с поверхностью тела (например, пептиды, связывающиеся с волосами или кожей), и различных последовательностей пептидов, связывающихся с полимером, могут составлять часть данной композиции. Кроме того, «S» также является общим понятием и не предназначено для обозначения единственного спейсера. Причем q, x, r, или z, как используется выше, составляют более 1, известно в пределах объема данного изобретения для обеспечения состояния, когда некоторое количество различных спейсеров могут составлять часть данной композиции. Кроме того, необходимо понимать, что эти структуры не обязательно представляют ковалентные связи между данными пептидами и данным необязательным молекулярным спейсером. Как описано выше, данное взаимодействие связывания между данными пептидами и данным необязательным молекулярным спейсером может быть либо ковалентным, либо нековалентным.
Композиции, включающие в себя пептид, связывающийся с полимером
Данный пептид, имеющий сродство к полимеру, может быть нанесен на поверхность тела в составе различных композиций, например водном растворе или композиции для личной гигиены. Например, пептид, связывающийся с полимером, может быть нанесен на волосы в составе водного раствора, включающего в себя данный пептид, связывающийся с полимером. Альтернативно, данный пептид, связывающийся с полимером, может быть нанесен на волосы в составе композиции для ухода за волосами (описано ниже). В любом случае, данный пептид, связывающийся с полимером, используется в данной композиции в концентрации от приблизительно 0,01% до приблизительно 10%, предпочтительно, приблизительно от 0,01% до приблизительно 5% по массе, относительно общей массы данной композиции. Подходящие пептиды, связывающиеся с полимером, описаны выше. Кроме того, в данной композиции можно использовать смесь различных пептидов, связывающихся с полимером. Данные пептиды в данной смеси должны быть выбраны таким образом, чтобы не было взаимодействия между данными пептидами, которое уменьшает данный благоприятный эффект. Пригодные смеси пептидов, связывающихся с полимером, могут быть определены специалистом в уровне техники в результате проведения рутинных экспериментов. Если в данной композиции используется смесь пептидов, связывающихся с полимером, полная концентрация данных пептидов, связывающихся с полимером, составляет приблизительно от 0,01% до приблизительно 10% по массе, относительно общей массы данной композиции.
В другом варианте осуществления пептид, связывающийся с волосами, может быть добавлен к данной композиции, включающей в себя пептид, связывающийся с полимером. Концентрация данного пептида, связывающегося с волосами, в данной композиции составляет приблизительно от 0,01% приблизительно до 10%, предпочтительно приблизительно от 0,01% приблизительно до 5%, относительно общей мессы данной композиции. Кроме того, можно использовать смесь различных пептидов, связывающихся с волосами. Если используется смесь пептидов, связывающихся с волосами, полная концентрация данных пептидов, связывающихся с волосами, в данной композиции составляет приблизительно от 0,01% приблизительно до 10%, предпочтительно приблизительно от 0,01% приблизительно до 5%, относительно общей массы данной композиции.
В другом варианте осуществления, данный пептид, связывающийся с полимером, используется в виде конъюгата на основе пептидов, где данный пептид, связывающийся с полимером, соединен с пептидом, связывающимся с волосами, как описано выше.
Композиции для ухода за волосами определены здесь как композиции для обработки волос, включающие в себя, но не ограничивающиеся этим, шампуни, кондиционеры, ополаскиватели, лосьоны, аэрозоли, гели, муссы и краски для волос. Данная композиция для ухода за волосами может содержать в себе коммерчески доступную среду для композиций для ухода за волосами, примеры которых описаны, например, у Philippe et al. в патенте США № 6280747, и у Omura et al. в патенте США № 6139851 и Cannell et al. в патенте США № 6013250, каждый из которых включен здесь посредством ссылки. Например, эти композиции для ухода за волосами могут быть водными, спиртовыми и водно-спиртовыми растворами, данный спирт предпочтительно является этанолом или изопропанолом в пропорции приблизительно от 1 приблизительно до 75% по массе относительно общей массы для водно-спиртовых растворов. Кроме того, данные композиции для ухода за волосами могут содержать в себе одну или несколько традиционных косметических или дерматологических добавок или адъювантов, в том числе, но не ограничиваясь этим, антиоксиданты, консерванты, наполнители, поверхностно-активные вещества, УФА и/или УФБ солнцезащитные фильтры, отдушки, загустители, увлажняющие компоненты, и анионные, неионные или амфотерные полимеры, и окрашивающие вещества или пигменты.
Аналогично, пептид, связывающийся с полимером, может быть нанесен на кожу в составе водного раствора, включающего в себя пептид, связывающийся с полимером. Альтернативно, пептид, связывающийся с полимером, может быть нанесен на кожу в составе композиции для ухода за кожей (описано ниже). В любом случае, данный пептид, связывающийся с кожей, применяется в этой композиции в концентрации приблизительно от 0,01% приблизительно до 10%, предпочтительно, приблизительно от 0,01% приблизительно до 5% по массе, относительно общей массы данной композиции. Подходящие пептиды, связывающиеся с полимером, описаны выше. Кроме того, в данной композиции можно использовать смесь различных пептидов, связывающихся с полимером. Пептиды в данной композиции должны быть выбраны таким образом, чтобы не было взаимодействия между данными пептидами, которые могут уменьшать данный благоприятный эффект. Пригодные смеси пептидов, связывающихся с полимером, могут быть определены специалистом в уровне техники в результате проведения рутинных экспериментов. Если в данной композиции используется смесь пептидов, связывающихся с полимером, полная концентрация данных пептидов, связывающихся с полимером, составляет приблизительно от 0,01% приблизительно до 10% по массе, относительно общей массы данной композиции.
В другом варианте осуществления пептид, связывающийся с кожей, может быть добавлен в данную композицию, включающую в себя пептид, связывающийся с полимером. Концентрация данного пептида, связывающегося с кожей, в данной композиции составляет приблизительно от 0,01% приблизительно до 10%, предпочтительно приблизительно от 0,01% приблизительно до 5%, относительно общей массы данной композиции. Кроме того, в данной композиции можно использовать смесь различных пептидов, связывающихся с кожей. Если используется смесь пептидов, связывающихся с кожей, полная концентрация данных пептидов, связывающихся с кожей, в данной композиции составляет приблизительно от 0,01% приблизительно до 10%, предпочтительно, приблизительно от 0,01% приблизительно до 5%, относительно общей массы данной композиции.
В другом варианте осуществления пептид, связывающийся с полимером, используется в виде конъюгата на основе пептидов, где данный пептид, связывающийся с полимером, соединен с пептидом, связывающимся с кожей, как описано выше.
Композиции для ухода за кожей определены здесь как композиции для обработки кожи, включающие в себя, но не ограничивающиеся этим, средства для ухода за кожей, средства для очищения кожи, средства макияжа, солнцезащитные средства и средства от морщин. Данная композиция для ухода за кожей может включать в себя косметически пригодные среды для композиций для ухода за кожей, примеры которых описаны, например у Philippe et al. supra. Например, данной косметически пригодной средой может быть безводная композиция, включающая в себя жировое вещество в пропорции, в большинстве случаев, приблизительно от 10 приблизительно до 90% по массе относительно общей массы данной композиции, где данная жировая фаза включает в себя, по меньшей мере, одно жидкое, твердое или полутвердое жировое вещество. Данное жировое вещество включает в себя, но без ограничения, масла, воски, камеди и так называемые пастообразные жировые вещества. Альтернативно, данная композиция может быть в форме стабильной дисперсии, например, водно-жировой эмульсии или эмульсии типа «масло в воде». Кроме того, данные композиции могут содержать в себе одну или несколько традиционных косметических или дерматологических добавок или адъювантов, включающих в себя, но не ограниченно, антиоксиданты, консерванты, наполнители, поверхностно-активные вещества, УФА и/или УФБ солнцезащитные фильтры, отдушки, загустители, увлажняющие компоненты, и анионные, неионные или амфотерные полимеры, и окрашивающие вещества или пигменты.
Способы нанесения дисперсного полезного агента на поверхность тела
Пептиды, связывающиеся с полимером, можно использовать для увеличения стойкости общепринятых дисперсных полезных агентов, например красящих веществ, дисперсных кондиционеров, и неорганических солнцезащитных средств на поверхностях тела, в соответствии со способом по данному изобретению. Для использования в данном изобретении, данный дисперсный полезный агент покрыт полимером, как описано выше. В большинстве случаев, данный дисперсный полезный агент с полимерным покрытием наносится на поверхность тела либо перед, после или одновременно с композицией, включающей в себя пептид, имеющий сродство к данному полимеру, на время, достаточное для связывания данного покрытого полезного агента с данным полимерным покрытием на данном дисперсном полезном агенте. Различные способы нанесения дисперсного полезного агента на волосы или кожу описаны более подробно ниже.
В одном варианте осуществления, дисперсный полезный агент с полимерным покрытием наносится на волосы. Данный полезный агент с полимерным покрытием можно наносить на волосы в составе любого подходящего раствора, например водного раствора или в составе традиционной композиции для ухода за волосами, например, красящих композиций. Эти композиции для ухода за волосами хорошо известны из уровня техники и подходящие композиции описаны выше. Данный дисперсный полезный агент с полимерным покрытием оставляют на волосах на время, достаточное для связывания данного дисперсного полезного агента с волосами, обычно между приблизительно 5 секундами и приблизительно 60 минутами. При желании, волосы можно ополоснуть для удаления дисперсного полезного агента, который не связался с волосами. Затем композицию, включающую в себя пептид, имеющий сродство к данному полимерному покрытию, наносят на волосы на время, достаточное для связывания данного пептида, связывающегося с полимером, с данным полимерным покрытием, предпочтительно между приблизительно 5 секундами и приблизительно 60 минутами. Данную композицию, включающую в себя пептид, связывающийся с полимером, можно смыть с волос или оставить на волосах.
В другом варианте осуществления, композицию, включающую в себя пептид, имеющий сродство к данному полимерному покрытию, наносят на волосы на время, достаточное для связывания данного пептида, связывающегося с полимером, с волосами, предпочтительно между приблизительно 5 секундами и приблизительно 60 минутами. Несвязавшуюся композицию, включающую в себя данный пептид, связывающийся с полимером, можно смыть с волос или оставить на волосах. Затем дисперсный полезный агент с полимерным покрытием наносят на волосы на время, достаточное для связывания данного дисперсного полезного агента с пептидом, связывающимся с полимером, обычно, между приблизительно 5 секундами и приблизительно 60 минутами. При желании, волосы можно ополоснуть для удаления данного дисперсного полезного агента, который не связался с данным пептидом, связывающимся с полимером.
В другом варианте осуществления дисперсный полезный агент с полимерным покрытием и композиция, включающая в себя пептид, имеющий сродство к данному полимеру, наносятся на волосы одновременно на время, достаточное для связывания данного дисперсного полезного агента с волосами и связывания данного пептида, связывающегося с полимером, с данным полимерным покрытием на данном дисперсном полезном агенте, обычно между приблизительно 5 секундами приблизительно до 60 минут. При желании, волосы можно ополоснуть для удаления с волос несвязавшегося дисперсного полезного агента и композиции, включающей в себя пептид, связывающийся с полимером.
В другом варианте осуществления, дисперсный полезный агент с полимерным покрытием обеспечен как часть композиции, включающей в себя пептид, имеющий сродство к данному полимеру. В этом варианте осуществления композицию, включающую в себя данный дисперсный полезный агент и данный пептид, связывающийся с полимером, наносят на волосы на время, достаточное для связывания данного дисперсного полезного агента с волосами и связывания данного пептида, связывающегося с полимером, с данным полимерным покрытием на данном дисперсном полезном агенте, обычно между приблизительно 5 секундами и приблизительно 60 минутами. Данную композицию, включающую в себя данный дисперсный полезный агент и данный пептид, связывающийся с полимером, можно смыть с волос или оставить на волосах.
В другом варианте осуществления, дисперсный полезный агент с полимерным покрытием наносят на кожу. Данный полезный агент с полимерным покрытием может быть нанесен на кожу в составе любого подходящего раствора, например водного раствора или традиционной композиции для ухода за кожей, например окрашивающего вещества для кожи, кондиционера для кожи, солнцезащитного средства, или тому подобного, которая хорошо известна из уровня техники. Данный дисперсный полезный агент с полимерным покрытием оставляют на коже на время, достаточное для связывания с кожей, обычно между приблизительно 5 секундами и приблизительно 60 минутами. При желании, кожу можно ополоснуть для удаления данного дисперсного полезного агента, который не связался с кожей. Затем композицию, включающую в себя пептид, имеющий сродство к данному полимерному покрытию на данном дисперсном полезном агенте, наносят на кожу на время, достаточное для связывания данного пептида, связывающегося с полимером, с данным полимерным покрытием, предпочтительно между приблизительно 5 секундами и приблизительно 60 минутами. Данную композицию, включающую в себя данный пептид, связывающийся с полимером, можно смыть с кожи, или оставить на коже.
В другом варианте осуществления, композицию, включающую в себя пептид, имеющий сродство к данному полимерному покрытию, наносят на кожу на время, достаточное для того, чтобы данный пептид, связывающийся с полимером, связался с кожей, предпочтительно между приблизительно 5 секундами и приблизительно 60 минутами. Данную композицию, включающую в себя данный пептид, связывающийся с полимером, можно смыть с кожи или оставить на коже. Затем данный дисперсный полезный агент с полимерным покрытием наносят на кожу на время, достаточное для того, чтобы данный дисперсный полезный агент связался с данным пептидом, связывающимся с полимером, обычно между приблизительно 5 секундами и приблизительно 60 минутами. При желании кожу можно сполоснуть для удаления данного дисперсного полезного агента, который не связался с данным пептидом, связывающимся с полимером.
В другом варианте осуществления, дисперсный полезный агент с полимерным покрытием и композицию, включающую в себя пептид, имеющий сродство к данному полимеру, наносят на кожу одновременно на время, достаточное для того, чтобы данный дисперсный полезный агент связался с кожей и данный пептид, связывающийся с полимером, связался с данным полимерным покрытием на данном дисперсном полезном агенте, обычно между приблизительно 5 секундами и приблизительно 60 минутами. При желании, кожу можно ополоснуть для удаления с кожи несвязавшегося дисперсного полезного агента и данной композиции, включающей в себя пептид, связывающийся с полимером.
В другом варианте осуществления, дисперсный полезный агент с полимерным покрытием обеспечен как часть композиции, включающей в себя пептид, имеющий сродство к данному полимеру. В этом варианте осуществления, данную композицию, включающую в себя данный дисперсный полезный агент и данный пептид, связывающийся с полимером, наносят на кожу на время, достаточное для того, чтобы данный дисперсный полезный агент связался с кожей и данный пептид, связывающийся с полимером, связался с данным полимерным покрытием на данном дисперсном полезном агенте, обычно между приблизительно 5 секундами и приблизительно 60 минутами. Данную композицию, включающую в себя данный дисперсный полезный агент и данный пептид, связывающийся с полимером, можно смыть с кожи или оставить на коже.
В любом из способов, описанных выше, композиция, включающая в себя пептид, имеющий сродство к данному полимеру, может быть при желании повторно нанесена на поверхность тела после нанесения композиции, включающей в себя дисперсный полезный агент с полимерным покрытием и композиции, включающей в себя пептид, имеющий сродство к данному полимеру, с целью дополнительного увеличения стойкости данного полезного агента.
Кроме того, в любом из способов, описанных выше, композиция, включающая в себя полимерный герметик, может быть при желании нанесена на поверхность тела после нанесения композиции, включающей в себя дисперсный полезный агент с полимерным покрытием, и композиции, включающей в себя пептид, имеющий сродство к данному полимеру, с целью дополнительного увеличения стойкости данного полезного агента. Данная композиция, включающая в себя данный полимерный герметик, может быть водным раствором или композицией для ухода за волосами или кожей, включающей в себя данный полимерный герметик. Обычно, данный полимерный герметик представлен в данной композиции в концентрации приблизительно от 0,25% приблизительно до 10% по массе исходя из общей массы данной композиции. Полимерные герметики хорошо известны в области средств личной гигиены и включают в себя, но не ограничиваются этим, поли(аллиламин), акрилаты, акрилатные сополимеры, метакрилаты, метакрилатные сополимеры, полиуретаны, карбомеры, метиконы, амодиметиконы, полипептиды, полиэтиленгликоль, пчелиный воск, силоксаны и тому подобное. Выбор полимерного герметика зависит от используемого данного определенного дисперсного полезного агента и данного пептида, связывающегося с полимером. Оптимальный полимерный герметик может быть без труда определен специалистом в данной области в ходе проведения рутинных экспериментов.
Композиции личной гигиены
Данное изобретение также обеспечивает композиции личной гигиены, включающие в себя дисперсный полезный агент с полимерным покрытием и композицию, включающую в себя пептид, имеющий сродство к данному полимеру. Данная композиция личной гигиены может быть любой композицией, которая наносится на поверхность тела для обеспечения косметического или профилактического эффекта, например композиции для ухода за волосами и кожей, описанные выше.
ПРИМЕРЫ
Настоящее изобретение дополнительно охарактеризовано в следующих Примерах. Следует понимать, что эти Примеры, несмотря на то, что отражают предпочтительные варианты осуществления данного изобретения, приведены только в качестве иллюстрации. Из вышеприведенного обсуждения и этих Примеров специалист в уровне техники может установить необходимые характеристики данного изобретения и, без отклонения от его сущности и диапазона, может осуществить различные изменения и модификации данного изобретения для адаптирования его для различных применений и условий.
Значения используемых сокращений следующие: «мин» означает минута(ы), «сек» означает секунда(ы), «ч» означает час(ы), «мкл» означает микролитр(ы), «мл» означает миллилитр(ы), «л» означает литр(ы), «нм» означает нанометр(ы), «мм» миллиметр(ы), «см» означает сантиметр(ы), «мкм» означает микрометр(ы), «мМ» означает миллимолярный, «M» означает молярный, «ммоль» означает миллимоль(и), «мкмоль» микромоль(и), «г» означает грамм(ы), «мкг» означает микрограмм(ы), «мг» означает миллиграмм(ы), «g» означает гравитационную постоянную, «об/мин» означает число оборотов в минуту, «pfu» означает бляшкообразующую единицу, «BSA» означает альбумин бычьей сыворотки, «ИФА» означает твердофазный иммуноферментный анализ, «IPTG» означает изопропил β-D-тиогалактопиранозид, «A» означает поглощение, «А450» означает поглощение, измеренное при длине волны 450 нм, «TBS» означает физиологический раствор, забуференный Трис, «TBST-X» означает физиологический раствор, забуференный Трис, содержащий в себе Твин®20, где «Х» представляет собой весовой процент Твин®20, «Xgal» означает 5-бром-4-хлор-3-индолил-бета-D-галактопиранозид, «SEM» означает стандартную погрешность среднего, «об. %» означает объемный процент, «атм» означает атмосферу(ы), «кПа» означает килопаскаль(и), «SLPM» означает стандартный литр в минуту, «psi» означает число фунтов на квадратный дюйм, «RCF» означает относительное центробежное поле.
ОБЩИЕ МЕТОДЫ
Стандартные технологии рекомбинантных ДНК и молекулярного клонирования, используемые в данных Примерах, хорошо известны из уровня техники и описаны у Sambrook, J., Fritsch, E.F. and Maniatis, T., Molecular Cloning: A LaboratoryManual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989, у T.J. Silhavy, M.L. Bennan, and L.W. Enquist, Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1984, и у Ausubel, F.M. et at., Current Protocols in Molecular Biology, Greene Publishing Assoc, and Wiley-Interscience, N.Y., 1987. Материалы и методы, пригодные для поддержания и роста бактериальных культур также хорошо известны из уровня техники. Технологии, подходящие для использования в следующих Примерах, можно найти в Manual of Methods forGeneral Bacteriology, Phillipp Gerhardt, R.G.E. Murray, Ralph N. Costilow, Eugene W. Nester, Willis A. Wood, Noel R. Krieg and G. Briggs Phillips, eds., American Society for Microbiology, Washington, DC, 1994, или у Thomas D. Brock в Biotechnology: A Textbook of Industrial Microbiology, Second Edition, Sinauer Associates, Inc., Sunderland, MA, 1989.
Все реагенты, рестрикционные ферменты и материалы, использованные для роста и поддержания бактериальных клеток, были получены от компаний Aldrich Chemicals (Milwaukee, WI), BD Diagnostic Systems (Sparks, MD), Life Technologies (Rockville, MD), или Sigma Chemical Company (St. Louis, MO), если не указано особо.
Библиотеки пептидных фаговых дисплеев
Шесть библиотек пептидных фаговых дисплеев использовали в следующих Примерах. Три пептидные библиотеки, Ph.D.™-12 Phage Display Peptide Library Kit (линейная пептидная библиотека 12-мер), Ph.D.™-7 Phage Display Library Kit (линейная пептидная библиотека 7- мер), и Ph.D.™-C7C Phage Display Library Kit (ограниченная пептидная библиотека 7-мер), были приобретены у компании New England BioLabs (Beverly, MA). Эти наборы основаны на комбинаторной библиотеке случайного пептида 7 или 12-мер, слитого с минорным белком оболочки (pIII) фага M13. Данные случайные пептидные последовательности во всех трех библиотеках экспрессировались на N-конце данного минорного белка оболочки pIII, что приводит к валентности 5 копий данного воспроизводимого пептида на каждый вирион. В обеих данных библиотеках Ph.D.-7 и Ph.D.-12 первый остаток сплава пептид-pIII занимает первое случайное положение, тогда как первому случайному положению в библиотеке Ph.D.-C7C предшествует Ala-Cys. Все данные библиотеки включают в себя короткие линкерные последовательности из четырех аминокислот между данным воспроизводимым пептидом и pIII. Данный случайный сегмент библиотеки Ph.D.-C7C фланкирован парой остатков цистеина, которые окисляются во время объединения фага с дисульфидным соединением, что приводит к представлению воспроизводимого пептида цели в виде петлевых фрагментов. Все три библиотеки состоят приблизительно из 3×109 последовательностей. В объеме 10 мкл содержится около 55 копий каждой пептидной последовательности.
Три другие библиотеки пептидных фаговых дисплеев, одна, содержащая в себе случайную линейную пептидную последовательность 15-мер, другая, содержащая в себе случайную линейную пептидную последовательность 20-мер, и третья, содержащая в себе дисульфидную ограниченную случайную пептидную последовательность 14-мер с остатком цистеина в положениях 3 и 11, были получены с использованием способа, описанного у Kay et al. (Combinatorial Chemistry & High Throughput Screening, Vol. 8, 545-551 (2005)). Этот способ представляет собой модификацию способа, сообщенного Sidhu et al. (Methods in Enzymology 328:333-363 (2000)), в котором штамм E.coli CJ236 (dut- ung-) использован для выработки одноцепочечной фагемидной ДНК, содержащей в себе уридин (U-оцДНК). Эту ДНК использовали в качестве матрицы для синтеза второй цепи олигонуклеотида не только в качестве праймера второй цепи, но также для встраивания кодирующих случайных аминокислот. После завершения синтеза второй цепи, данную двухцепочечную ДНК (дцДНК) трансформировали в штамм дикого типа. Любая U-оцДНК распадалась в данной клетке-хозяине, таким образом, оставляя только данную рекомбинантную цепь для выработки фаговых частиц. Этот способ можно использовать для создания пептидных слияний или мутаций белков оболочки М13. В данном способе Kay et al. используется амбер-стоп кодон в начале гена III. Олигонуклеотиды, включающие в себя случайные участки последовательности ДНК, отжигали с однонитевым фаговым геномом таким образом, чтобы данный случайный участок совпадал с данным стоп-кодоном. Данная одноцепочечная ДНК (оцДНК) была ферментативно преобразована в ковалентно-замкнутую, циклическую дцДНК и затем электропорирована в несупрессорный штамм E.coli. Данная вновь синтезированная цепь ДНК (минус-цепь) служит матрицей для образования данной плюс-цепи в данной клетке-хозяине, которая использовалась для транскрипции/трансляции вирусных генов и упакована внутри данной вирусной частицы.
ПРИМЕР 1
Отбор пептидов, связывающихся с полиметилметакрилатом (PMMA), с помощью биопэннинга
Целью данного Примера являлась идентификация фаговых пептидов, которые связываются с полиметилметакрилатом (PMMA), с использованием модифицированного метода биопэннинга фагового дисплея.
Данные наборы Ph.D.™-12 Phage Display Peptide Library Kit и Ph.D.™-7 Phage Display Library Kit использовали в этом Примере. Каждый начальный цикл экспериментов проводили с использованием оригинальной библиотеки, предоставляемой фирмой-изготовителем, во избежание возникновения любой систематической ошибки в данных результатах.
Биопэнниг относительно поверхности PMMA
Данные используемые материалы PMMA были 1/8 дюйма (32 мм) толщиной, 1/2 дюйма (12,7 мм) диаметром диски Lucite® метилметакрилат полимерной пластины (полученные от E.I. du Pont de Nemours and Co., Wilmington, DE) и устройство для дотблоттинга (полученный от Schleicher & Schuell, Keene, NH). Использовали следующие протоколы для биопэннинга относительно данного диска PMMA. Данный диск PMMA помещали в пробирку, заполненную 5 мл 90% изопропанола на 30 мин при комнатной температуре, и затем отмывали деионизированной водой 5 раз в течение 10 мин каждый раз. Затем, в данную пробирку добавляли 5 мл блокирующего буфера, содержащего 1 мг/мл BSA в TBST, включающего в себя 0,5% Твин®20 (TBST-0,5%), и инкубировали в течение 1 ч при 4°C.
Данный диск отмывали 5 раз с помощью TBST-0,5% и затем в каждую ячейку добавляли 2 мл TBST-0,5%, содержащего 1 мг/мл BSA. Затем, 10 мкл данной оригинальной фаговой библиотеки (2×1011 pfu), либо 12-мер, либо 7-мер библиотеки, добавляли к данному диску и инкубировали в течение 15 мин при комнатной температуре. Данный диск отмывали 10 раз с помощью TBST-0,5%. Затем данный диск переносили в чистую пробирку, в данную пробирку добавляли 2 мл буфера для неспецифической элюции, содержащего в себе 1 мг/мл BSA в 0,2 М глицин-HCl, рН 2,2, и инкубировали в течение 10 мин. Данный диск отмывали еще три раза с помощью буфера для элюции и затем отмывали три раза с помощью TBST-0,5%. Диск, который еще имел прикрепленные кислотоустойчивые фаговые пептиды, использовали для прямого инфицирования данных клеток-хозяев E.coli ER 2738 (New England BioLabs, Beverly, MA), для амплификации фага. Данный диск инкубировали с культурой E.coli ER2738, выращиваемой в течение ночи, разбавленной 1:100 средой LB (Luria-Bertani), при 37°C в течение 4,5 ч. Спустя это время, данную клеточную культуру центрифугировали в течение 30 с и верхние 80% супернатанта переносили в свежую пробирку, добавляли 1/6 объема PEG/NaCl (20% полиэтиленгликоль-800, приобретенный у фирмы Sigma Chemical Co. St. Louis, MO, 2,5 M хлорид натрия) и оставляли в течение ночи при 4°С для обеспечения выпадения данного фага в осадок. Данный осадок собирали посредством центрифугирования при 10000 g при 4°С, и полученный осадок в пробирке ресуспендировали в 1 мл TBS. Затем, данный исходный раствор фага, амплифицированный в первом цикле, титровали в соответствии с методом, описанным далее. Для следующего цикла биопэннига, использовали более чем 2×1011 pfu фагового исходного раствора из первой порции. Процесс биопэннига повторяли от 3 до 4 циклов, в зависимости от данных экспериментов.
После стадий отмывки с помощью кислоты в конечном цикле данный диск РММА использовали для прямого инфицирования 500 мкл бактериальных клеток-хозяев, находящихся в середине логарифмического роста, E. coli ER2738, которые затем выращивали в среде LB в течение 20 мин, и затем смешивали с 3 мл агарозного покрытия (среда LB с 5 мМ MgCl2, и 0,7% агароза) при 45°С. Эту смесь распределяли на плашке со средой LB/S-Gal™ (среда LB с 15 г/л агара, 0,05 г/л IPTG, и 0,04 г/л S-Gal™) и инкубировали в течение ночи при 37°С. Подсчитывали бляшки черного цвета для вычисления титра фага. Одиночные черные бляшки были случайным образом отобраны для выделения ДНК и проведения секвенирования. Данные аминокислотные последовательности этих высокоаффинных, связывающих РММА фаговых пептидов, представлены в Таблице 1.
ПРИМЕР 2
Определение характеристик клонов фагового пептида, связывающегося с РММА, посредством ИФА
Твердофазный иммуноферментный анализ (ИФА) использовали для оценки аффинности связывания с РММА данных отобранных клонов фаговых пептидов, определенных в Примере 1, вместе с фаговым клоном кожа-1 TPFHSPENAPGS (данный как SEQ ID № 53), который служит в качестве контроля.
В качестве данной РММА-поверхности использовали пустой 96-луночный аппарат Minifold I Dot-Blot System фирмы Schleicher & Schuell, Inc. (Keene, NH). Для каждого исследуемого клона данную лунку инкубировали в течение 1 ч при комнатной температуре с 200 мкл блокирующего буфера, включающего в себя 2% обезжиренное сухое молоко в TBS. Данный блокирующий буфер удаляли посредством переворачивания данных систем и промоканием их досуха с помощью бумажных салфеток. Данные лунки промывали 6 раз с помощью промывочного буфера, включающего в себя TBST-0,5%. Данные лунки заполняли 200 мкл TBST-0,5%, включающего в себя 1 мг/мл BSA и затем в каждую лунку добавляли 10 мкл (более 1012 копий) очищенного исходного раствора фага. Данные образцы инкубировали при 37°С в течение 15 мин с неинтенсивным встряхиванием. Удаляли данный несвязавшийся фаг, промывая данные лунки 10-20 раз с помощью TBST-0,5%. Затем в каждую лунку добавляли 100 мкл конъюгата пероксидаза хрена/антитело против М13 (Amersham USA, Piscataway, NJ), разведенного в соотношении 1:500 в данном блокирующем буфере, и инкубировали в течение 1 ч при комнатной температуре. Данный раствор конъюгата удаляли, и данные лунки отмывали 6 раз с помощью TBST-0,05%. Субстрат TMB (200 мкл), приобретенный у фирмы Pierce Biotechnology (Rockford, IL), добавляли в каждую лунку и дожидались развития цвета от 5 до 30 мин, обычно в течение 10 мин, при комнатной температуре. Затем в каждую лунку добавляли стоп-раствор (200 мкл 2 М H2SO4) и данный раствор переносили в 96-луночный планшет и измеряли А450 с помощью спектрофотометра для микропланшета (Molecular Devices, Sunnyvale, CA). Полученные значения поглощения, подтвержденные как среднее значение, по меньшей мере, трех параллельных измерений, и данная стандартная погрешность среднего (SEM) представлены в Таблице 2.
Данные результаты показывают, что все протестированные фаговые пептиды, связывающиеся с РММА, имели значительно более высокую аффинность связывания с РММА, чем данный контрольный пептид кожа-1.
ПРИМЕР 3
Определение данной аффинности связывания с РММА пептидов, связывающихся с РММА
Целью данного Примера являлось определение аффинности пептидов, связывающихся с РММА, к РММА-поверхностям, измеренной как значения MB50, с помощью анализа ИФА.
Данный пептид А09, связывающийся с РММА, был синтезирован в компании Synpep Inc. (Dublin, CA). Данный пептид был биотинилирован посредством добавления остатка биотинилированного лизина на С-конце связывающей аминокислотной последовательности с целью определения, и амидированный цистеин был добавлен к С-концу данной последовательности. Данная аминокислотная последовательность данного протестированного пептида дана как SEQ ID № 13.
Измерение MB50 пептида А09, связывающегося с РММА
Измерения MB50 данного биотинилированного пептида А09 (SEQ ID № 13), связывающегося с РММА, были проведены с помощью 96-луночного аппарата, описанного в Примере 2. Данные 96 лунок были блокированы с помощью блокирующего буфера (SuperBlock™from Pierce Chemical Co., Rockford, IL) при комнатной температуре в течение 1 ч, с последующими шестью отмывками с помощью TBST-0,5%, по 2 мин каждая, при комнатной температуре. В каждую лунку добавляли биотинилированный, связанный пептид в различных концентрациях, инкубировали в течение 15 мин при 37°С, и отмывали шесть раз с помощью TBST-0,5%, по две минуты каждый раз, при комнатной температуре. Затем конъюгат стрептавидин-пероксидаза хрена (HRP) (Pierce Chemical Co., Rockford, IL) добавляли в каждую лунку (1,0 мкг на лунку) и инкубировали в течение 1 ч при комнатной температуре. После данного инкубирования, данные лунки отмывали шесть раз с помощью TBST-0,5%, по 2 мин каждый раз, при комнатной температуре. В результате, развитие цвета и измерение поглощения были осуществлены, как описано в Примере 2.
Данные результаты отражены на графике как А450 против концентрации пептида, с использованием программы GraphPad Prism 4.0 (GraphPad Software, Inc., San Diego, CA). Данные значения MB50 были вычислены по графику Скэтчарда и представлены в Таблице 3.
Измерение MB50 тетрамера пептида А09, связывающегося с РММА
Для измерения МВ50 данного тетармера пептида А09, данная поверхность РММА и все условия связывания были такими же, как описано выше. Данный комплекс тетрамерного пептида А09 был получен в результате смешивания стрептавидина-HRP и биотинилированного пептида А09 (SEQ ID NO:13) в молярном отношении 1:4. После всех этапов блокирования и отмывок комплекс стрептавидин/(А09)4 в различных концентрациях добавляли в каждую лунку, инкубировали в течение 15 мин при 37°С и отмывали шесть раз с помощью TBST-0,5%, по 2 мин каждый раз, при комнатной температуре. Затем осуществлялись развитие цвета и измерения поглощения, как описано в Примере 2. Данные результаты отражены на графике как А450 против концентрации пептидного комплекса, с использованием программы GraphPad Prism 4.0 (GraphPad Software, Inc., San Diego, CA). Данные значения MB50 были вычислены по графику Скэтчарда и представлены в Таблице 3.
Данные результаты демонстрируют, что данная аффинность связывания пептида, связывающегося с РММА, А09, и данного комплекса стрептавидин/тетрамер А09, к РММА была высокой. Использование множественных копий данного связывающегося пептида в данном комплексе тетрамера А09 повышает данную аффинность связывания более чем в 10 раз.
ПРИМЕР 4
Окрашивание волос с помощью красителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с пептидом, связывающимся с РММА
Целью данного Примера было продемонстрировать окрашивание волос с использованием сажевого наполнителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с пептидом, связывающимся с РММА.
Получение сажевой дисперсии
Сажевая дисперсия была получена в результате предварительного смешивания следующих ингредиентов: (i) 210,4 весовых частей (в.ч.) деионизированной воды, (ii) 80,3 в.ч. 41,5 вес.% (сухое вещество) анионного полимерного диспергирующего агента, и (iii) 9,24 в.ч. диметилэтаноламина. Данный анионный полимерный диспергирующий агент представлял собой графт-сополимер 66.3/-g-4.2/29.5 POEA(феноксиэтилакрилат)/-g-ETEGMA(этокситриэтиленгликольметакрилат)/MAA (метакриловая кислота), полученный в соответствии с «Preparation of Dispersant 1» в публикации патентной заявки № 20030128246 (параграфы с 0122 по 0125 включительно), которая включена здесь посредством ссылки, с пропорциями мономеров, скорректированными для получения 66,3/4,2/29,5 процентных отношений по массе, вместо 61,6/5,8/32,6 процентных отношений по массе, указанных в данной публикации. К этому понемногу добавляли 100 в.ч. черного пигмента (Nipex 180IQ, Degussa). После того, как данный пигмент был присоединен, 100 в.ч. деионизированной воды вводили в смесь для образования смеси для перетира, которую пропускали через среду для измельчения. Затем добавляли деионизированную воду (55,4 в.ч.) для разбавления до предела прочности. Эту черную дисперсию (276 г) затем смешивали с 200 г глицерола, 120 г этиленгликоля, 1,6 г Proxel (Arch Chemicals, Inc., Cheshire, CT), 143,6 г деионизированной воды и 2,5 г Surfynol® 485 (Air Products, Allentown, PA), для формирования основы черного красителя. Значение pH данной окрашивающей композиции довели до 7,0, как необходимо, посредством добавления 10% фосфорной кислоты или 10% раствора гидроксида натрия. Исходные растворы углеродной сажи были приготовлены посредством разбавления этой окрашивающей пасты водой для достижения углеродной нагрузки от 1% до 2% по массе, для использования в исследованиях стабильности на волосах.
Данный пептид А09, связывающийся с РММА, имеющий амидированный цистеин на С-конце, представленный как SEQ ID № 14, был приобретен у фирмы SynPep (Dublin, CA). Этот пептид (100 мг) добавляли к 10 г 1% сажевой дисперсии, и данный раствор перемешивали в течение нескольких часов при комнатной температуре.
Окрашивание волос
Образец волос натурального белого цвета (2,60 г), полученный от International Hair Importers and Products (Bellerose, NY), помещали в пробирку размером 3 мм × 100 мм, и добавляли 7-8 мл данной сажевой дисперсии, содержащей в себе данный пептид, связывающийся с РММА. Данную смесь перемешивали с использованием магнитного перемешивающего устройства в течение 30 мин для обеспечения хорошего контакта данной дисперсии пигмента с волосами. Образец волос удаляли из данной пробирки и высушивали на воздухе в течение 30 мин.
Стойкость данной краски для волос тестировали посредством мытья этих волос деионизированной водой. Данный образец волос массировали вручную во время мытья с помощью воды. После ополаскивания водой данный образец волос сохранил большую часть данной черной краски для волос.
ПРИМЕР 5 (сравнительный метод)
Окрашивание волос с помощью красителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в отсутствие пептида, связывающегося с РММА
Целью данного Примера была оценка стойкости данной краски для волос, полученной с помощью данного сажевого наполнителя, в отсутствие данного пептида, связывающегося с РММА, и сравнить ее со стабильностью, полученной в Примере 4.
Данную сажевую дисперсию получали, как описано в Примере 4, но не добавляли данный пептид, связывающийся с РММА. Окрашивание волос и ополаскивание с помощью воды было осуществлено, как описано в Примере 4, используя 10 г данной сажевой дисперсии и 2,30 г образца волос.
После ополаскивания с помощью воды сохранились только следы черного цвета. При сравнении с результатом, полученным в Примере 4, этот результат подтвердил улучшенную стойкость, полученную при использовании сажевого наполнителя в сочетании с пептидом, связывающимся с РММА.
ПРИМЕР 6 (сравнительный метод)
Окрашивание волос с помощью красителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с силоксановым герметиком
Целью данного Примера была оценка стойкости данной краски для волос, полученной с помощью данного сажевого наполнителя в сочетании с традиционным силоксановым герметиком, и сравнить ее со стабильностью, полученной в Примере 4.
Данную сажевую дисперсию получали, как описано в Примере 4, но не добавляли данный пептид, связывающийся с РММА. Один грамм декаметилциклопентасилоксана (Aldrich. Milwaukee, WI; Product № 44,427-8; CAS № 541-02-6) добавили к 9 г данной сажевой дисперсии. Окрашивание волос и ополаскивание с помощью воды было осуществлено, как описано в Примере 4, используя эту сажевую дисперсию и 2,30 г образца волос.
После ополаскивания с помощью воды весь черный краситель был смыт. При сравнении с результатом, полученным в Примере 4, этот результат подтвердил улучшенную стойкость, полученную при использовании сажевого наполнителя в сочетании с пептидом, связывающимся с РММА, по сравнению с данным красителем, использованным с традиционным силоксановым герметиком.
ПРИМЕР 7
Окрашивание волос с помощью красителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с пептидом, связывающимся с РММА, и поли(аллиламиновым) герметиком
Целью данного Примера было продемонстрировать увеличенную стойкость цвета волос, полученного в результате использования поли(аллиламина) в качестве полимерного герметика в сочетании с данным сажевым наполнителем и пептидом, связывающимся с РММА.
Данная сажевая дисперсия была получена, как описано в Примере 4, и использовалась в сочетании с пептидом, связывающимся с РММА. Окрашивание волос было осуществлено, как описано в Примере 4, с использованием 2,66 г образца волос. После того, как образец волос был окрашен и высушен в течение 30 мин, данный образец волос помещали в 4 вес.% раствор поли(аллиламина) (приготовленного посредством разбавления водой 20 вес.% водного раствора поли(аллиламина), приобретенного у компании Aldrich; Product № 479177; CAS № 30551-89-4). Данный образец волос был незамедлительно вымыт, как описано в Примере 4, и затем обработан шампунем (Pantene Pro-V Sheer Volume, Proctor & Gamble, Cincinnati, OH). Данная обработка шампунем предполагала нанесение на волосы капли данного шампуня, распределение данного шампуня равномерно по волосам, и интенсивный массаж волос в течение 30 сек. Затем, данный образец волос промывали с помощью деионизированной воды для удаления данного шампуня.
После мытья с помощью воды и данной обработки шампунем на образце волос сохранилось приблизительно 50% данного черного цвета. Данный результат, что данный цвет выдержал энергичную обработку шампунем, свидетельствует о том, что использование поли(аллиламина) в качестве герметика в сочетании с сажевым наполнителем и пептидом, связывающимся с РММА, обеспечивает усиленную стойкость по сравнению с таковой, полученной при использовании только данного сажевого наполнителя и данного пептида, связывающегося с РММА.
ПРИМЕРЫ 8-12
Окрашивание волос с помощью красителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с пептидом, связывающимся с РММА
Целью этих Примеров являлась демонстрация повышенной стойкости цвета волос, полученного с помощью сажевого наполнителя, диспергированного с помощью диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с пептидом, связывающимся с РММА, и сравнение ее со стойкостью цвета волос, полученной в результате использования только данного сажевого наполнителя. Кроме того, было продемонстрировано дополнительное усиление стойкости, обеспеченное применением поли(аллиламинового) герметика. Данную прочность окраски количественно определяли, используя спектрофотометрическую методику измерения.
Данная сажевая дисперсия была приготовлена, как описано в Примере 4. Окрашивание волос было осуществлено, как описано в Примере 4, с и без использования пептида, связывающегося с РММА (SEQ ID № 14). Данный эффект поли(аллиламинового) герметика был протестирован, как описано в Примере 7. Интенсивность окрашивания после ополаскивания водой (осуществлено, как описано в Примере 4) и после обработки шампунем (осуществлено, как описано в Примере 7) оценивали с использованием сферического спектрофотометра X-Rite® SP78™ (X-Rite, Inc., Grandville, MI), помещая данный окрашенный образец волос внутрь фотодетектора и определяя параметры L*, a* и b*, отражающие данную фотометрическую реакцию. Первичное базовое значение L* было определено для неокрашенных волос и все измерения представляли собой среднее значение трех отдельных определений. Значения дельта Е были вычислены, используя нижеприведенное уравнение 1:
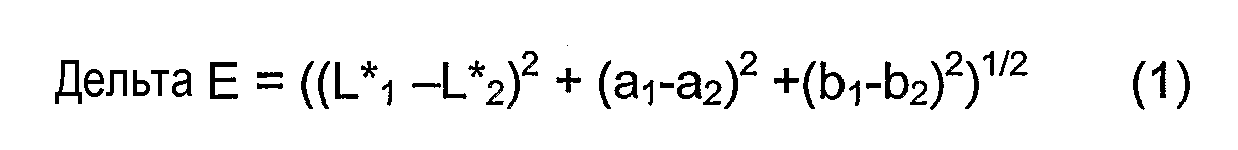
где L* = переменная светлоты, и a* и b* являются координатами цветности цветового пространства CIELAB, как определено Международной Комиссией по Освещению (CIE) (Minolta, Precise Color Communication - Color Control From Feeling to Instrumentation, Minolta Camera Co., 1996). Большие значения дельта Е свидетельствуют о лучшей прочности окраски. Данные результаты суммированы в Таблице 4.
Данные результаты демонстрируют, что использование данного пептида, связывающегося с РММА, в сочетании с данным сажевым наполнителем, покрытым метакрилатом, приводит к значительному усилению прочности цвета волос и после мытья водой (Пример 8), и после обработки шампунем (Пример 10), по сравнению с использованием только углеродной сажи (сравнительные методы Примеров 9 и 12). Кроме того, данное использование данного поли(аллиламинового) герметика обеспечивает дополнительное усиление прочности окраски после данной обработки шампунем (Пример 11).
ПРИМЕР 13
Отбор пептидов, связывающихся с полипропиленом, с помощью биопэннига
Целью данного Примера было определение фаговых пептидов, которые связываются с полипропиленом (РР), используя модифицированный метод биопэннинга фагового дисплея.
Данные пептиды, связывающиеся с полипропиленом, были идентифицированы с помощью метода биопэннинга, описанного в Примере 1. Данным пропиленовым субстратом, использованным в данном методе биопэннинга, был пропиленовый сетчатый материал, в частности, Hernia Repair/Reconstructive Surgery Prosthetics Patch (приобретенный у Davol Inc., Cranston, RI, дочерняя фирма компании C.R. Bard Inc.). Данную полипропиленовую сетку разрезали на 1 см квадраты и перед процессом биопэннинга предварительно обработали 90% изопропанолом в течение 30 мин при комнатной температуре, с последующей отмывкой деионизированной водой 5 раз по 10 мин каждый раз. Все четыре цикла биопэннинга были осуществлены и данные аминокислотные последовательности данных фаговых пептидов, связывающихся с полипропиленом с высокой аффинностью, представлены в Таблице 5.
ПРИМЕР 14
Отбор пептидов, связывающихся с политетрафторэтиленом, с помощью биопэннинга
Целью данного Примера было определение фаговых пептидов, которые связываются с политетрафторэтиленом (PTFE), используя модифицированный метод биопэннинга фагового дисплея.
Данные пептиды, связывающиеся с политетрафторэтиленом, были определены с помощью метода биопэннинга, описанного в Примере 1. Данный политетрафторэтиленовый субстрат, использованный в данном методе, представлял собой пленочный материал ePTFE (приобретен у Davol Inc., Cranston, RI, дочерняя компания фирмы C.R. Bard Inc.). Данную политетрафторэтиленовую пленку разрезали на 1 см квадраты и, перед процессом биопэннинга, предварительно обработали 90% изопропанолом в течение 30 мин при комнатной температуре, с последующей отмывкой деионизированной водой 5 раз по 10 мин каждый раз. Все четыре цикла биопэннинга были осуществлены и данные аминокислотные последовательности данных фаговых пептидов, связывающихся с PTFE с высокой аффинностью, представлены в Таблице 6.
ПРИМЕР 15
Отбор пептидов, связывающихся с нейлоном 6,6, с помощью биопэннинга
Целью данного Примера было определение фаговых пептидов, которые связываются с нейлоном 6,6, с помощью модифицированного метода биопэннинга фагового дисплея.
Данные пептиды, связывающиеся с нейлоном 6,6, были идентифицированы с помощью метода биопэннинга, описанного в Примере 1. Бусины из нейлона 6,6, использованные в качестве субстрата в данном методе биопэннинга, были свободны от вспомогательных веществ и были получены с использованием стандартных процессов полимеризации нейлона, которые хорошо известны из уровня техники (смотри Kohan, M.I., Nylon Plastics Handbook, Hansen/Gardner Publications, Inc. [1995] pages 17-20 & 34-45). Данные нейлоновые бусины перед процессом биопэннинга предварительно обработали 90% изопропанолом в течение 30 мин при комнатной температуре, с последующей отмывкой деионизированной водой 5 раз по 10 мин каждый раз. Все четыре цикла биопэннинга были осуществлены и данные аминокислотные последовательности данных фаговых пептидов, связывающихся с нейлоном 6,6, с высокой аффинностью, представлены в Таблице 7.
ПРИМЕР 16
Отбор пептидов, связывающихся с полиэтиленом, с помощью биопэннинга
Целью данного Примера было определение фаговых пептидов, которые связываются с полиэтиленом (PE), используя модифицированный метод биопэннинга фагового дисплея.
Данные пептиды, связывающиеся с полиэтиленом, были определены с помощью метода биопэннинга, описанного в Примере 1. В качестве субстрата в данном методе биопэннинга использовали пленку полиэтилена сверхвысокой молекулярной массы. Аналогичную пленку можно приобрести в компании Davol, Inc, (Cranston, RI). Данную пленку PE разрезали на 1 см квадраты и данные квадраты перед процессом биопэннинга предварительно обработали 90% изопропанолом в течение 30 мин при комнатной температуре, с последующей отмывкой деионизированной водой 5 раз по 10 мин каждый раз. Все четыре цикла биопэннинга были осуществлены и данные аминокислотные последовательности данных фаговых пептидов, связывающихся с РЕ, с высокой аффинностью, представлены в Таблице 8.
ПРИМЕР 17
Отбор пептидов, связывающихся с полистиролом, с помощью биопэннинга
Целью данного Примера было определение фаговых пептидов, которые связываются с полистиролом (PS), используя модифицированный метод биопэннинга фагового дисплея.
Данные пептиды, связывающиеся с полистиролом, были определены с помощью метода биопэннинга, описанного в Примере 1. Данные пептиды, связывающиеся с полистиролом (PS), были обнаружены в ходе экспериментов биопэннинга на 96-луночных полистироловых планшетах, покрытых растворимым коллагеном типа I (Corning Inc., Acton, MA). Данные 96-луночные планшеты были покрыты растворимым коллагеном типа I, 100 нг/мл (Sigma-Aldrich, St Louis, MO). Все четыре цикла биопэннинга были осуществлены. Были идентифицированы три чрезвычайно улучшенных фаговых пептида, для которых впоследствии было подтверждено связывание с данными лунками PS, не покрытых коллагеном типа I. Данные аминокислотные последовательности данных фаговых пептидов, связывающихся с высокой аффинностью с PS, представлены в Таблице 9.
ПРИМЕР 18
Биологическое производство трехблочного конъюгата на основе пептидов
Целью данного Примера было создание трехблочного конъюгата, основанного на пептидах, с использованием технологий рекомбинантных ДНК и молекулярного клонирования. Данный трехблочный конъюгат на основе пептидов состоял из многочисленных блоков пептида, связывающегося с волосами, пептидного спейсера и пептида, связывающегося с РММА. Данные пептиды были экспрессированы в E.coli в виде внутриклеточных включений. Дополнительные аминокислотные последовательности (а именно пептидные метки) были сплавлены с данным трехблочным конъюгатом на основе пептидов для того, чтобы активировать образование внутриклеточных включений. Кислото-лабильные последовательности Asp-Pro (DP) были встроены между данной пептидной меткой и последовательностью данного трехблочного конъюгата на основе пептидов для облегчения изолирования данного трехблочного пептида от данной пептидной метки.
Конструкция продуцирующих штаммов
Последовательности данного трехблочного конъюгата на основе пептидов представлены в Таблице 10. Последовательности ДНК были сконструированы для кодирования этой пептидной последовательности с использованием подходящих кодонов для E.coli во избежание повторов последовательности и вторичной структуры мРНК. Данная ДНК-последовательность гена была сконструирована с помощью DNA 2.0, Inc. (Menlo Park, CA) с использованием собственного программного обеспечения, описанного у Gustafsson et al. (Trends in Biotechnol. 22(7): 346-355 (2004)). За данной последовательностью, кодирующей данную аминокислотную последовательность, следовали два терминирующих кодона и участок распознавания для эндонуклеазы AscI. Данная аминокислотная последовательность GS на N-конце была закодирована сайтом распознавания для эндонуклеазы BamHI (GGA/TCC). Данная последовательность ДНК представлена как SEQ ID № 71.
Данные гены были собраны из синтетических олигонуклеотидов и клонированы внутрь стандартного плазмидного вектора для клонирования посредством DNA 2.0, Inc. Данные последовательности были проверены с помощью секвенирования ДНК посредством DNA 2.0, Inc.
Данный синтетический ген был вырезан из данного вектора для клонирования с помощью эндонуклеаз рестрикции BamHI и AscI и лигирован внутрь экспрессирующего вектора, используя стандартные методы рекомбинантных ДНК. Данный вектор pKSIC4-HC77623 происходит из коммерчески доступного вектора pDEST17 (Invitrogen, Carlsbad, CA). Он включает в себя последовательности, полученные из коммерчески доступного вектора pET31b (Novagen, Madison, WI), который кодирует фрагмент фермента кетостероид изомераза (KSI). Данный фрагмент KSI был включен в качестве участника слияния для активирования разделения данных пептидов на нерастворимые внутриклеточные включения в E.coli. Данная последовательность из pET31b, кодирующая KSI, была модифицирована с использованием стандартных методов мутагенеза (QuickChange II, Stratagene, La JoIIa, CA) для включения трех дополнительных кодонов Cys, в дополнение к одному кодону Cys, который обнаружен в последовательности KSI дикого типа. Данная плазмида pKSIC4-HC77623, представленная как SEQ ID № 72 и указанная на Фигуре 1, была сконструирована с использованием стандартных методик рекомбинантных ДНК, которые хорошо известны специалисту в уровне техники.
Данная последовательность ДНК, кодирующая данный трехблочный конъюгат на основе пептидов (Таблица 1), была встроена внутрь pKSIC4-HC77623 посредством замещения последовательностей в данном векторе между участками для BamHI и AscI. Плазмидная ДНК, включающая в себя последовательность, кодирующую данный пептид и векторную ДНК, была расщеплена с помощью эндонуклеаз рестрикции BamHI и AscI, затем данную последовательность, кодирующую данный пептид, и векторную ДНК смешивали и лигировали посредством ДНК-лигазы фага Т4 с использованием стандартных методов клонирования ДНК, которые хорошо известны специалисту в уровне техники. Данную исправленную конструкцию, в которой данная последовательность, кодирующая данный трехблочный конъюгат на основе пептидов, была встроена внутрь pKSIC4-HC77623, была установлена посредством рестрикционного анализа и подтвержденная посредством секвенирования ДНК, используя стандартные методы.
В этой конструкции, данная последовательность, кодирующая данный пептидный конъюгат, использовалась вместо той, которая кодируется HC77623. Данная последовательность была функционально связана с промотором гена 10 бактериофага Т7 и экспрессировалась в виде слитого белка, сплавленного с данным вариантом KSI, участником слияния.
Для исследования экспрессии данного конъюгата на основе пептидов данную экспрессирующую плазмиду трансформировали внутрь штамма E.coli BL21-AI (Invitrogen, catalog № C6070-03). Для выработки данного рекомбинантного слитого белка на 50 мл питательной среды LB-ампициллин (10 г/л бактотриптона, 5 г/л бактодрожжевого экстракта, 10 г/л NaCl, 100 мг/л ампициллина, рН 7,0) высевали данную трансформированную бактерию и данную культуру встряхивали при 37°С до тех пор, пока OD600 не достигнет 0,6. Данную экспрессию стимулировали посредством добавления 0,5 мл 20 вес.% L-арабинозы в данную культуру и продолжили встряхивание в течение еще 4 ч. Анализ данного клеточного белка посредством электрофореза в полиакриламидном геле демонстрировал продукцию данных слитых пептидов.
Культивирование
Данный рекомбинантный штамм E.coli, описанный выше, выращивали в ферментере объемом 6 л, выращивание изначально проводили в фоновом режиме, а затем в режиме постоянной подпитки. Данная композиция данной бродильной среды представлена в Таблице 11. Значение pH данной бродильной среды составляло 6,7. Данную бродильную среду стерилизовали посредством автоклавирования, после чего были добавлены следующие стерилизованные компоненты: тиамина гидрохлорид (4,5 мг/л), глюкоза (22,1 г/л), следовые элементы, смотри Таблицу 12 (10 мл/л), ампициллин (100 мг/л), и посевная культура (инокулят) (125 мл). Значение pH доводили, при необходимости, с использованием гидрооксида аммония (20 об %) или фосфорной кислоты (20 об %). Данные добавленные компоненты были стерилизованы либо посредством автоклавирования, либо посредством фильтрования.
Условия проведения данного культивирования объединены в Таблице 13. Исходная концентрация глюкозы составляла 22,1 г/л. Когда начальный остаток глюкозы истощался, досрочная, экспоненциальная подкормка глюкозой была инициирована, начиная стадию постоянной подпитки данного культивирования. Данная глюкозная подпитка (смотри Таблицы 14 и 15) включала в себя 500 г/л глюкозы и дополнена 5 г/л дрожжевого экстракта. Данные компоненты данной питательной среды были стерилизованы либо посредством автоклавирования, либо посредством фильтрования. Цель состояла в том, чтобы обеспечить удельную скорость роста 0,01 ч-1, исходя из коэффициента выработки (биомасса по отношению к глюкозе) 0,25 г/г, и поддержать уровни уксусной кислоты в данном ферментационном чане на очень низких значениях (а именно менее чем 0,2 г/л). Данную глюкозную подпитку продолжали до окончания данного процесса. Индукция была инициирована посредством добавления болюса 2 г/л L-арабинозы в данный подобранный момент времени (а именно 15 ч прошедшего времени культивирования). Болюс для доставки 5 г дрожжевого экстракта на литр ферментационной питательной среды был добавлен в данный ферментационный чан в следующие моменты времени: за 1 ч до индукции, во время индукции и через 1 ч после индукции. Данный процесс культивирования был остановлен через 1,97 ч прошедшего времени культивирования и через 4,97 ч после данного момента индукции.
Выделение и очистка пептида
После завершения данного процесса культивирования, данную перебродившую среду полностью пропускали три раза через гомогенизатор APV модель 2000 Gaulin при 12000 фунтов на кв.дюйм (82700 кПа). Данную среду перед проведением каждого гомогенизирования охлаждали до температуры менее 5°С. Данную гомогенизированную среду незамедлительно обрабатывали на многоуровневой дисковой центрифуге Westfalia WhisperFuge™ (Westfalia Separator Inc., Northvale, NJ) при 700 мл/мин и 12000 RCF для разделения внутриклеточных телец от суспендированного клеточного дебриса и растворенных примесей. Данную восстановленную пастообразную массу повторно суспендировали в концентрации 15 г/л (сухое вещество) в воде и значение рН доводили до значения между 8,0 и 10,0, используя буфер Na2CO3/NaOH. Данное значение рН было выбрано для облегчения отделения клеточного дебриса от данных внутриклеточных включений без растворения белков данных внутриклеточных включений. Данную суспензию пропускали через гомогенизатор APV 2000 Gaulin при 12000 фунтов на кв.дюйм (82700 кПа) один раз для обеспечения тщательного смешивания. Данную гомогенизированную суспензию с высоким значением рН незамедлительно подвергали обработке на многоуровневой дисковой центрифуге Westfalia WhisperFuge™ при 700 мл/мин и 12000 RCF для отделения данных отмытых внутриклеточных включений от супендированного клеточного дебриса и растворенных примесей. Данную восстановленную пастообразную массу ресуспендировали в концентрации 15 г/л (сухое вещество) в чистой воде. Данную суспензию пропускали через гомогенизатор APV 2000 Gaulin при 12000 фунтов на кв.дюйм (82700 кПа) один раз для обеспечения тщательной отмывки. Данную гомогенизированную суспензию незамедлительно подвергали обработке на многоуровневой дисковой центрифуге Westfalia WhisperFuge™ при 700 мл/мин и 12000 RCF для отделения данных отмытых внутриклеточных включений от остаточного супендированного клеточного дебриса и NaOH.
Данную восстановленную пастообразную массу ресуспендировали в чистой воде в концентрации 25 г/л (сухое вещество) и значение рН данной смеси доводили до 2,2 с использованием HCl. Данную подкисленную суспензию нагревали до 70°С в течение 5-14 ч для полного расщепления сайта DP, отделяющего данный слитый пептид от полученного пептида без повреждения пептида-мишени. Значение рН полученной жидкой массы доводили до 5,1 (обратить внимание: значение рН, используемое здесь, может изменяться в зависимости от растворимости от данного восстановленного пептида) с использованием NaOH, и затем охлаждали до 5°С и выдерживали в течение 12 ч. Данную смесь центрифугировали при 9000 RCF в течение 30 мин и данный супернатант декантировали. Данный супернатант затем фильтровали через 0,45 мкм мембрану. Для некоторых пептидов с низкой растворимостью может потребоваться многократная отмывка данного осадка для повышения восстановления пептида.
Данный отфильтрованный продукт собирали и концентрировали посредством выпаривания под вакуумом до коэффициента 2:1 перед лиофилизацией. Спектрофотометрическое определение при 220 и 278 нм использовали для контроля и отслеживания элюции данного пептидного продукта.
ПРИМЕРЫ 19 и 20
Окрашивание волос с помощью красителя, диспергированного с помощью полимерного диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с трехблочным конъюгатом на основе пептидов
Целью этих Примеров являлась демонстрация усиленной стойкости цвета волос, полученного с помощью сажевого наполнителя, диспергированного с помощью диспергирующего агента, содержащего в себе метакриловую кислоту, в сочетании с трехблочным конъюгатом на основе пептидов, и сравнение ее со стойкостью цвета волос, полученной в результате использования только данного сажевого наполнителя. Данный пептидный конъюгат содержал в себе многократные последовательности пептида, связывающегося с волосами, спейсера и пептида, связывающегося с РММА.
Данная сажевая дисперсия была получена, как описано в Примере 4. Использовали трехблочный конъюгат на основе пептидов, описанный в Примере 18 и приведенный здесь как SEQ ID № 70. Данный пептидный конъюгат (20 мг) добавляли к 1 мл деионизированной воды и данную смесь диспергировали с помощью ультразвука в течение 1 мин на льду. Данный диспергированный пептидный конъюгат добавляли в 20 мл сцинтилляционный флакон, в котором содержалось 40 мг сажевой дисперсии, и добавляли 3 мл деионизированной воды для обеспечения конечного объема приблизительно 4 мл. Полученную сажевую дисперсию обрабатывали ультразвуком в течение 3 мин на льду.
Окраска волос
Образец натуральных белых волос (приблизительно 1,00 г), полученный от International Hair Importers and Products (Bellerose, NY), помещали в 20 мл сцинтилляционный флакон и добавляли 8 мл данной сажевой дисперсии, включающей в себя данный пептидный конъюгат. Данную смесь взбалтывали, используя инкубатор с шейкером, при комнатной температуре в течение 30 мин при 100 об/мин, для обеспечения хорошего контакта данного диспергированного пигмента с данными волосами. Данный образец волос удаляли из данного флакона и споласкивали с помощью деионизированной воды. После данного ополаскивания водой данный образец волос сохранял большую часть данной черной краски.
Этапы, описанные выше, повторяли с использованием сажевой дисперсии, в которой не содержался данный пептидный конъюгат. После споласкивания водой, интенсивность окраски обоих образцов волос была измерена, как описано в Примерах 8-12. Данные результаты представлены в Таблице 16.
Данные результаты, представленные в Таблице 16, демонстрируют, что данное использование данного пептидного конъюгата, включающего в себя множественные последовательности пептида, связывающегося с волосами, спейсера и пептида, связывающегося с РММА, в сочетании с сажевым наполнителем, покрытым метакрилатом, приводит к значительному усилению удержания данной краски для волос после смывания водой (Пример 19), по сравнению с использованием только углеродной сажи (Сравнительный пример 20).
ПРИМЕР 21
Отбор пептидов, связывающихся с полиметилметакрилатом (РММА), устойчивого к воздействию шампуня, с использованием биопэннинга
Целью данного Примера было определение фаговых пептидов, которые связываются с полиметилметакрилатом (РММА) и являются устойчивыми к мытью шампунем, с использованием модифицированного метода биопэннинга фагового дисплея. После контактирования РММА-субстрата с фаговой библиотекой, полученные комплексы фаговый пептид-РММА были вымыты с использованием разбавленного шампуня.
Данный РММА-материал, использованный в данных экспериментах по биопэннингу, представлял собой полимерную смолу, Plexiglas VS 100 (бусины диаметром около 3 мм), приобретенные у компании Altuglas International, Arkema Inc., Philadelphia, PA. Следующий протокол использовали для биопэннинга в отношении данных бусин РММА. Три комплекта по три бусины РММА распределяли по трем пробиркам, в каждую наливали по 1 мл блокирующего буфера, включающего в себя 1 мг/мл BSA в TBST, содержащий 0,5% Твин® (TBST-0,5%), и инкубировали в течение 1 ч при 4°С. Данные бусины отмывали 5 раз с помощью TBST-0,5% и затем в каждую пробирку добавляли 1 мл TBST-0,5%, содержащий в себе 1 мг/мл BSA. Затем, 10 мкл одной из трех общих фаговых библиотек (4×1011 pfu в каждой пробирке) добавляли в эти три пробирки (а именно одна объединенная библиотека на пробирку, содержащую в себе три РММА-бусины), и данные бусины инкубировали в течение 15 мин при 37°С. Данные три объединенные фаговые библиотеки состояли из смеси 1:1 следующих фаговых пептидных библиотек (которые описаны в разделе Общие Методы): линейная библиотека 12-мер (Ph.D.™-12 Phage Display Peptide Library) и линейная библиотека 7-мер (Ph.D.™-7 Phage Display Library), линейная библиотека 15-мер и линейная библиотека 20-мер, и ограниченная библиотека 7-мер (Ph.D.™-C7C Phage Display Library) и ограниченная библиотека 14-мер. Данные бусины отмывали 10 раз с помощью TBST-0,5%. Данные бусины затем переносили в чистые пробирки, в каждую пробирку добавляли 1 мл буфера для неспецифической элюции, включающего в себя 1 мг/мл BSA в 0,2 M глицин-HCl, pH 2,2, и данные пробирки инкубировали в течение 10 мин. После данного инкубирования в каждую пробирку добавляли 150 мкл буфера для нейтрализации, включающего в себя 1 М основание Трис, pH 9,1. Данный элюат из данных бусин из каждой пробирки использовали для инфицирования данных клеток-хозяев E.coli ER 2738 (New England BioLabs, Beverly, MA), для фаговых амплификаций. Данный элюат инкубировали с культурой E.coli ER2738, выращиваемой в течение ночи, разведенной 1:100 в среде LB, при 37°С в течение 4,5 ч. После этого времени, данную клеточную культуру центрифугировали в течение 30 с, и верхние 80% данного супернатанта переносили в свежую пробирку, добавляли 1/6 объема PEG/NaCl (20% полиэтиленгликоль-800, полученный от компании Sigma Chemical Co. St.Louis, MO, 2,5 М хлорид натрия), и оставляли данный фаг осаждаться в течение ночи при 4°С. Данный преципитат собирали посредством центрифугирования при 10000 х g при 4°С, и полученный осадок ресуспендировали в 1 мл TBS. Это являлось первой порцией амплифицированного матричного раствора.
Данную амплифицированную первую порцию фагового исходного раствора затем титровали в соответствии с данным способом, описанным ниже. Для второго цикла биопэннинга использовали более чем 2×1011 pfu фагового исходного раствора из первой порции. Данный процесс биопэннинга повторяли, как описано для первого цикла. Начиная с третьего цикла, добавили этапы мытья шампунем после этапа связывания фага (то есть формирование комплекса фаговый пептид - РММА). В частности, раствор шампуня, состоящий из смеси укрепляющего шампуня Neutrogena® Replenishing и буфера TBS в соотношении 1:1, использовали для мытья данных бусин 6 раз с 1-2 секундами интенсивного перемешивания, с последующими 6 отмывками с помощью TBST-0,5%. Затем, данные бусины переносили в чистые пробирки, и оставшиеся этапы были идентичными таковым в предшествующем цикле. Четвертый или пятый цикл пэннинга осуществляли таким же образом, как описано для данного третьего цикла.
После данной стадии элюирования в конечном цикле биопэннинга, небольшую порцию (1-2 мкл) данного элюата из каждой пробирки использовали для инфицирования 200 мкл бактериальных клеток-хозяев в середине логарифмического роста, E.coli ER2738, которые затем выращивали в среде LB в течение 20 мин и затем смешивали с 3 мл агарозного покрытия (среда LB с 5 мМ MgCl2, и 0,7% агарозой) при 45°С. Данную смесь распределяли по плашке, содержащей среду LB/IPNG/S-Gal™ (среда LB с агаром 15 г/л, IPTG 0,05 г/л и S-Gal™ г/л) и инкубировали в течение ночи при 37°С. Подсчитывали количество бляшек черного цвета для вычисления титра данного фага. Одиночные бляшки черного цвета отбирали случайным образом для выделения ДНК и проведения секвенирования. Данные аминокислотные последовательности этих фаговых пептидов, связывающихся с РММА, устойчивых к воздействию шампуня, представлены в Таблице 17.
ПРИМЕР 22
Количественное определение характеристик связывающей аффинности фаговых клонов, связывающихся с РММА, устойчивых к воздействию шампуня
Целью данного Примера было количественное определение данной связывающей аффинности фаговых клонов посредством титрования. Фаговые клоны, представляющие специфические пептиды, использовали для сравнения данных характеристик связывания различных пептидных последовательностей. Для количественного определения связывания фага использовали анализ, основанный на титровании. В этом анализе оценивают выход pfu, оставшихся на поверхности одной бусины РММА (среднее значение для трех отдельных бусин). Выход для всех трех фаговых клонов составлял 1012 pfu/бусина/пробирка. Следует подчеркнуть, что в этом анализе оценивают связывание данной фаговой частицы, экспрессирующей пептид, а не связывание изолированного пептида.
Использовали по одной бусине Plexiglas VS 100 на пробирку, и каждую пробирку наполняли блокирующим буфером, включающим в себя 1 мг/мл BSA в TBST-0,5%, и инкубировали в течение 1 ч при 4°С. Каждую бусину отмывали 5 раз с помощью TBST-0,5%. Данные пробирки затем заполняли 1 мл TBST-0,5%, включающим в себе 1 мг/мл BSA, и затем в каждую пробирку добавляли очищенные фаговые клоны (1012 pfu). Данные образцы бусин инкубировали в течение 15 мин при 37°С, и затем отмывали 6 раз с помощью раствора шампуня, как описано в Примере 21, с последующими 6 отмывками с помощью TBST-0,5%. Каждую бусину переносили в чистую пробирку и добавляли 100 мкл буфера для неспецифической элюции, включающего в себя 1 мг/мл BSA в 0,2 М глицин-HCl при рН 2,2. Данные образцы инкубировали в течение 10 мин и затем в каждую пробирку добавляли 15 мкл нейтрализующего буфера (1 М Трис-HCl, рН 9,2). Данные элюированные фаги из каждой пробирки переносили в новую пробирку для титрования и проведения секвенирования.
Для титрования данных связанных фагов, данный элюированный фаг разводили в буфере SM для получения 10-кратных серийных разведений от 101 до 108. Аликвоты по 10 мкл каждого разведения инкубировали с 200 мкл E.coli ER2738 в середине логарифмического роста (New England BioLabs) и выращивали в среде LB в течение 20 мин, а затем смешивали с 3 мл агарозного покрытия (среда LB с 5 мМ MgCl2, и 0,7% агарозой) при 45°C. Эту смесь распределяли по плашке, содержащей среду LB/IPTG/Xgal (среда LB с агаром 15 г/л, IPTG 0,05 г/л, и Xgal 0,04 г/л) и инкубировали в течение ночи при 37°C. Подсчитывали количество бляшек голубого цвета для вычисления титров фага, которые представлены в Таблице 18, как среднее трех определений, проведенных с тремя различными бусинами.
Данные результаты в Таблице 18 показывают, что данные фаговые клоны связываются с РММА с различными степенями аффинности. Последовательности SEQ ID №№ 101 и 109 имели наивысшие титры.
Реферат
Изобретения относится к косметической промышленности. Способ нанесения дисперсного полезного агента на волосы. Композиция для личной гигиены. Двублочный конъюгат на основе пептидов для применения в композиции. Трехблочный конъюгат на основе пептидов для применения в композиции. Пептид, связывающийся с полиметилметакрилатом, для применения в композиции. Вышеописанные композиции увеличивают продолжительность связывания дисперсного полезного агента с поверхностью тела. 5 н. и 37 з.п. ф-лы, 1 ил., 19 табл.
Формула
a) обеспечение дисперсного полезного агента с полимерным покрытием, где полимер выбран из группы, состоящей из полиакрилатов, полиметакрилатов, поликарбонатов, полистирола, полипропилена, полиэтилентерефталата, полиуретанов, полипептидов, лигнина, полисахаридов, полиамидов, полиимидов, полиарамидов и сополимеров, включающих в себя, по меньшей мере, один мономер метакрилатов, акрилатов или стирола;
b) обеспечение композиции, включающей в себя пептид, имеющий сродство к данному полимеру, где пептид выбран из группы, состоящей из SEQ ID №№: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111 и 112; и
c) нанесение имеющего покрытие дисперсного полезного агента из (а) с композицией из (b) на волосы на время, достаточное для связывания данного имеющего покрытие полезного агента с данными волосами.
d) нанесение на данные волосы композиции, включающей в себя полимерный герметик.
а) дисперсный полезный агент с полимерным покрытием, где полимер выбран из группы, состоящей из полиакрилатов, полиметакрилатов, поликарбонатов, полистирола, полипропилена, полиэтилентерефталата, полиуретанов, полипептидов, лигнина, полисахаридов, полиамидов, полиимидов, полиарамидов и сополимеров, включающих в себя, по меньшей мере, один мономер метакрилатов, акрилатов или стирола, и
b) композицию, включающую в себя пептид, имеющий сродство к данному полимеру, где пептид выбран из группы, состоящей из SEQ ID №№: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111 и 112.
a) BSBP представляет собой пептид, связывающийся с волосами;
b) PBP представляет собой пептид, связывающийся с полимером; и
c) m, n и x независимо друг от друга варьируются от 1 до приблизительно 10.
a) BSBP представляет собой пептид, связывающийся с волосами;
b) PBP представляет собой пептид, связывающийся с полимером;
c) S представляет собой пептидный молекулярный спейсер; и
d) m, n, х и z независимо друг от друга варьируются от 1 до 1 приблизительно 10, y - от 1 приблизительно до 5, и где q и r каждый независимо друг от друга равен 0 или 1, при условии, что r и q не могут быть равными 0.


Комментарии