Композиции контролируемого высвобождения жирных кислот для применения при реконструкции и коррекции фигуры - RU2684611C2
Код документа: RU2684611C2
Чертежи

Описание
Настоящее изобретение относится к композициям, содержащим физиологически приемлемые метаболические липиды и физиологически приемлемые, предпочтительно биодеградируемые соединения с контролируемым высвобождением (англ. controlled release, CR), в которых липиды не содержат клеток, а CR-соединения высвобождают метаболические липиды с временной задержкой в физиологических условиях. Кроме того, настоящее изобретение относится к применению такой композиции для получения косметической или терапевтической композиции, предпочтительно для развития или восстановления жировой ткани. Кроме того, изобретение относится к способу терапевтической или косметической обработки млекопитающего, который включает введение композиции по настоящему изобретению, и предпочтительно инъецирование композиции при извлечении инъекционной иглы до тех пор, пока представляющая интерес область ткани не будет обработана.
Предшествующий уровень техники
Жировая ткань сохраняет энергию, обеспечивает изоляцию и определяет внешние структурные особенности, например, лица, молочных желез, ягодиц или любых других определяющих форму частей тела млекопитающих. Наряду с косметическими требованиями также существуют терапевтические применения для проектирования и реконструкции жировых тканей, например, реконструкции молочной железы после мастэктомии, индуцированной ВИЧ липидной дистрофии и реконструкции лица после травмы.
Традиционные способы лечения дефектов жировой ткани и косметического увеличения ткани используют материал заполнения, который заменяет или добавляет объем целевой части тела. Материалы заполнения классифицируют на аутологичные наполнители и неаутологичные наполнители.
Аутологичный перенос жира, т.е. хирургическая изоляция жировых клеток в одной части организма и повторная инъекция в другую часть организма, практикуется с конца 19-го века. Преимущество переноса аутологичных жировых клеток на лице заключается в его стабильной природе, и инъекция на основе аутологичного жира приводит к более мягкому и румяному внешнему виду омоложенного лица. С другой стороны, основным недостатком является непредсказуемость результатов главным образом благодаря различной выживаемости клеток из жировой ткани после инъекции. Например, из числа жировых клеток, инъецированных в области жировой ткани (например, в области лица или молочных желез), умирает 30-70%, в основном из-за отсутствия питательных веществ и кислорода в преангиогенном состоянии. Еще одной проблемой является выживание жировых клеток в ходе выделения. Эта проблема была улучшена за счет ряда способов, таких как применение аспирирующих игл и специализированная обработка выделенных жировых клеток. Еще одним недостатком этого способа является то, что он требует хирургического вмешательства и достаточного количества материала аутологичных жировых клеток, которое не доступно для многих людей.
Более современный способ проектирования жировой ткани заключается в инъекции стволовых клеток жировой ткани (англ. adipose derived stem cells, ADSC), вызывающих пролиферацию новых адипоцитов. Тем не менее, этот способ предполагает длительную, сложную и дорогую процедуру, включающую липосакцию, выделение ADSC из жировых клеток с помощью специализированного ультрацентрифугирования, необязательно с обработкой выделенных ADSC дифференцирующими факторами, и повторную инъекцию дифференцированных клеток в искомую ткань-мишень.
Для решения проблемы выживания жировых клеток были предложены различные неклеточные материалы-наполнители. До появления гиалуроновой кислоты в 2003 году наиболее широко используемым наполнителем на рынке являлся коллаген. Коллаген индуцирует слабые иммуногенные реакции, поскольку его источником являются коровы, и технология его использования прекратила свое существование из-за растущей обеспокоенности риском заражения губчатой энцефалопатий крупного рогатого скота (BSE). Гиалуроновая кислота (ГК) используется в виде нерецептурного наполнителя жировой ткани в течение многих лет, несмотря на то, что она была одобрена FDA гораздо позже, в 2003 году. Она стала доминирующим наполнителем на рынке. Современная коммерческая ГК имеет большое количество перекрестных сшивок соединениями на основе дивинилсульфона для увеличения периода полураспада, и является рекомбинантной, а не получаемой из животного источника, для снижения иммунитета. Принципиальным недостатком ГК является ее ограниченная продолжительность существования после инъекции. Большинство наполнителей на основе ГК выдерживает только от 3 до 12 месяцев. Как и в случае имплантатов на кремниевой основе, применение ГК для увеличения молочной железы может помешать обнаружению рака маммографией. Другими потенциальными проблемами, связанными с ГК, являются более высокая частота и риск развития гранулемы, образование узелков и масталгии, ощутимости импланта, капсульного сокращения, поверхностных инфекций и развития абсцесса.
Было известно, что местное и системное введение эстрогенов также увеличивает размер молочной железы у женщин посредством генерации жировой ткани при индукции рецептора эстрадиола. Спиронолактон, как известно, вызывает развитие груди и феминизацию из-за его антиандрогенных свойств.
Другой подход генерации жировой ткани de novo заключается в долговременной локальной доставке инсулина и инсулиноподобного фактора-1 (IGF-1) и основного фактора роста фибробластов (bFGF) с помощью микросфер PLGA/PEG и был протестирован in vivo на крысиной модели (Yuksel et al., Plastic & Reconstructive surgery, vol. 105(5), April 2000, 1712-1720), в которой и инсулин- и IGF-1-содержащие микросферы вводили непосредственно в глубокую мышечную фасцию брюшной стенки у крыс для того, чтобы оценить их потенциал при образовании жировой ткани de novo адипогенной дифференцировкой из пула неадипоцитов. Функция микросфер в качестве соединений с контролируемым высвобождением (CR), заключается в обеспечении долгосрочной локальной доставки белков, индуцирующих de novo образование жировой ткани в месте введения.
Таким образом, методы предшествующего уровня техники для лечения дефектов жировой ткани и для косметического наращивания жировой ткани требуют либо аутологичного переноса жировых клеток или стволовых клеток жировой ткани (ADSC), местного введения неклеточных и недолговечных наполнителей, либо, в ином случае, местного введения факторов дифференцировки адипоцитов и факторов роста.
Цель настоящего изобретения заключается в обеспечении композиции для лечения дефектов жировой ткани и для косметического наращивания жировой ткани, которая является технически простой при получении и введении, требует минимального хирургического вмешательства, является безопасной и экономически эффективной.
В первом аспекте проблема, лежащая в основе настоящего изобретения, решается путем обеспечения композиции, включающей (i) физиологически приемлемые, метаболические липиды, и (ii), физиологически приемлемые, предпочтительно биодеградируемые соединения контролируемого высвобождения (CR), где метаболические липиды не содержат клеток, а CR-соединения высвобождают метаболические липиды с временной задержкой в физиологических условиях.
Термин «контролируемое высвобождение» (CR), при использовании в данном документе, относится к технологии получения активных соединений для контроля доступности активных соединений, например, для спланированного по времени высвобождения, такого как непрерывное (пролонгированное) высвобождение, пульсовое высвобождение, замедленное высвобождение, и т.п., и их комбинаций. Типичными CR-применениями являются удобрения, косметические и фармацевтические средства. CR-соединения для применения в настоящем изобретении, представляют собой соединения, составленные вместе с указанными липидами и необязательно другими физиологически активными соединения, которые задерживают высвобождение указанных липидов и активных соединений по сравнению сравнении с отсутствием CR-соединений при введении в физиологическую среду, предпочтительно часть ткани организма человека, такую как лицо, молочные железы, ягодицы и т.п.
CR-соединения и метаболические липиды для применения в настоящем изобретении, должны быть физиологически приемлемыми, то есть по существу, не должны быть токсичными для обрабатываемой ткани. Кроме того, предпочтительно CR-соединения согласно изобретению, по существу, являются биоразлагаемыми, то есть будут удаляться и предпочтительно метаболизироваться из участка введения с течением времени.
CR-соединения высвобождают метаболические липиды и необязательно другие активные соединения с временной задержкой в физиологических условиях. Физиологические условия, как уже упоминалось в данном документе в контексте настоящего изобретения, являются in vivo условиями на участке введения в ткань, например, условиями жировой ткани.
Профиль высвобождения CR-соединений для метаболических липидов и, возможно, других биологически активных веществ, не ограничен и зависит от состава композиции, а также ткани-мишени, способа и частоты введения. Как правило, за первоначальным «взрывным» высвобождением следует устойчивое высвобождение, которые инициируют рост адипоцитов и/или пролиферацию при поддержке физиологически эффективного уровня метаболизма липидов и необязательных искомых активных соединений.
В предпочтительном воплощении CR-соединения высвобождают метаболические липиды и необязательно другие активные соединения с временной задержкой от 7 дней до 12 месяцев, предпочтительно от 30 до 90 дней, более предпочтительно от 50 до 70 дней, наиболее предпочтительно в течение около 60 дней.
Метаболические липиды для применения в композиции по изобретению, не содержат клеток, что означает, что они не являются частью живых или мертвых клеток, и что они по существу не содержат клеточных компонентов, таких как мембраны, ядра, нуклеиновые кислоты и т.п. Не содержащие клеток метаболические липиды обладают преимуществом, которое заключается в том, что они являются менее иммуногенными, фармакологически безопасными и более доступными для поглощения клетками, такими как клетки в ткани-мишени.
Липофильность относится к способности химического соединения растворяться в жирах, маслах, липидах и неполярных растворителях, таких как гексан или толуол. Метаболические липиды, используемые в данном документе, определяются, как любые соединения, которые являются липофильными и которые могут поступать в организм, хранится и метаболизироваться для производства клеточной энергии, например, АТФ, клетками, предпочтительно клетками в жировой ткани, более предпочтительно адипоцитами.
Композиция по настоящему изобретению может быть локально введена, например, путем инъекции, предпочтительно множественным и равномерно распределенными инъекциями, в ткань для лечения дефектов жировой ткани и для косметического увеличения жировой ткани.
Освобожденные метаболические липиды оказывают ряд преимущественных эффектов на обрабатываемую ткань. В отличие от выделенных клеток, например, тучных клеток и ADSC, метаболические липиды являются менее иммуногенными, они не содержат вредных компонентов, таких как коровий коллаген (BSE), и они могут поступать в клетки-мишени напрямую и быстро. Прямой и предпочтительный эффект композиции по изобретению на жировые клетки и другие клетки в ткани-мишени заключается в том, что эти клетки непрерывно «усиленно подкармливаются», что приводит к увеличению объема.
В целях дальнейшего содействия росту ткани-мишени, композиция по настоящему изобретению может содержать другие активные соединения, предпочтительно соединения-эффекторы роста жировых клеток, которые увеличивают размер и количество жировых клеток, то есть стимулируют рост жировых клеток и липогенез, т.е. дифференцировку преадипоцитов в адипоциты и рост объема адипоцитов.
В более предпочтительном воплощении композиция по настоящему изобретению содержит, по меньшей мере, один вид эффектор роста жировых клеток, предпочтительно эффектор роста жировых клеток, выбранный из группы, состоящей из
а. инсулина, белков 1-7, связывающих инсулиноподобный фактор роста (IGFBP 1-7), инсулиноподобного фактора роста 1 (IGF-1) и инсулиноподобного фактора роста 2 (IGF-2), предпочтительно инсулина, инсулиноподобного фактора роста 1 (IGF-1) и инсулиноподобного фактора роста 2 (IFG-2), более предпочтительно инсулина и инсулиноподобного фактора роста 1 (IGF-1), наиболее предпочтительно, человеческого инсулина;
b. факторов роста фибробластов (FGF), предпочтительно FGF-1, FGF-2, FGF-10 и FGF-21, более предпочтительно FGF-1 и FGF-2, наиболее предпочтительно FGF-1;
c. глюкокортикоидов, предпочтительно выбранных из группы, состоящей из кортизола, кортизона, преднизона, преднизолона, триамцинолона, метилпреднизолона, дексаметазона и бетаметазона, предпочтительно дексаметазона и бетаметазона;
d. активаторов циклического аденозинмонофосфата (цАМФ), предпочтительно выбираемых из группы, состоящий из аминофиллина, пентоксифиллина, теофиллина, изобутил-метилксантина (IBMX), форсколина и дегидроабиетиновой кислоты (DAA), предпочтительно аминофиллина, пентоксифилина и теофиллина;
е. агонистов γ-2-рецептора, активирующего пролиферацию пероксисом (PPARy2), предпочтительно соединений класса тиазолидиндионов, более предпочтительно, выбранного из группы, включающей пиоглитазон, троглитазон, розиглитазон и индометацин, предпочтительно троглитазон и розиглитазон;
f. морфогенетических белков кости (BMPs), предпочтительно ВМР-2, ВМР-4, ВМР-7 и ВМР-9, предпочтительно ВМР-2 и ВМР-4.
Некоторые ткани-мишени включают железистую ткань или расположены рядом с железистой тканью, в частности, в женских молочных железах. Предпочтительно, чтобы железистая ткань рядом или окружающая ткани-мишени росла вместе с жировой тканью так, чтобы результат в целом являлся более равномерным, естественным и эстетически приятным.
В более предпочтительном воплощении композиция по изобретению специально разработана для роста целевой ткани молочной железы, дополнительно включающей, по меньшей мере, один эффектор роста железистой ткани, предпочтительно эффектор роста железистой ткани молочной железы, более предпочтительно фактор роста железистой ткани, выбранный из группы, состоящей из
а. эстрадиола и производных эстрадиола, предпочтительно выбранных из группы, состоящей из эстрадиола бензоата, эстрадиола полугидрата, эстрадиола ацетата, эстрадиола ципионаат, эстрадиола валерата, этинилэстрадиола и 17β-эстрадиола, более предпочтительно эстрадиола и эстрадиола ципионата, наиболее предпочтительно, 17β-эстрадиола;
b. эпидермального фактора роста (EGF), фактор роста сосудистого эндотелия (VEGF)-A, фактор роста сосудистого эндотелия (VEGF)-C, трансформирующего фактора роста-α (TGF-α), эпирегулина (EPR), эпигена, бетацеллюлина (BTC), всех изоформ нейрегулина-1 (Nrg1), херегулина (HRG), фактора роста, индуцирующего активность рецепторов для ацетилхолина (ARIA), глиального фактора роста (GGF)), нейрегулина-2 (NRG2), нейрегулина-3 (NRG3), нейрегулина-4 (NRG4), гепарин-связывающего EGF-подобного фактора роста (HB-EGF) и амфирегулина (АР), предпочтительно эпидермального фактора роста (EGF), трансформирующего фактора роста-α (TGF-α), нейрегулина-4 (NRG4), гепарин-связывающего EGF-подобного фактора роста (HB-EGF) и амфирегулина (АР), более предпочтительно человеческого эпидермального фактора роста (EGF);
с. антиандрогенов, предпочтительно выбранных из группы, состоящей из бикалутамида, нилутамида, спиронолактона и флутамида, более предпочтительно, спиронолактона и флутамида.
В еще одном предпочтительном воплощении метаболические липиды, используемые в изобретении, включают жирные кислоты, предпочтительно жирные кислоты, выбранные из группы, состоящей из бутановой кислоты и жирных кислот с более длинной цепью, более предпочтительно выбранных из группы, состоящей из пентановой кислоты, гексановой кислоты, гептановой кислоты, каприловой кислоты, нонановой кислоты, декановой кислоты, ундекановой кислоты, додекановой кислоты, тридекановой кислоты, тетрадекановой кислоты, пентадекановой кислоты, гексадекановой кислоты, гептадекановой кислоты, стеариновой кислоты, нонадекановой кислоты, эйкозановой кислоты, генэйкозановой кислоты, докозановой кислоты, трикозановой кислоты, пентакозановой кислоты, гексакозановой кислоты, гептакозановой кислоты, октакозановой кислоты, нонакозановой кислоты, триаконтановой кислоты, гентриаконтановой кислоты, дотриаконтановой кислоты, тритриаконтановой кислоты, тетратриаконтановой кислоты, пентатриаконтановой кислоты, гексатриаконтановой кислоты, миристолеиновой кислоты, пальмитолеиновой кислоты, олеиновой кислоты, элаидиновой кислоты, вакценовой кислоты, линолевой кислоты, линоэлаидиновой кислоты, линоленовой кислоты, предпочтительно α-линоленовой кислоты, арахидоновой кислоты, эйкозапентаеновой кислоты, эруковой кислоты, докозагексаеновой кислоты, стеаридоновой кислоты, докозапентаеновой кислоты, эйкозатетраеновой кислоты и докозагексаеновой кислоты, более предпочтительно жирных кислот, выбранных из группы, состоящей из октадекановой кислоты, додекановой кислоты, гексадекановой кислота и олеиновой кислоты, наиболее предпочтительно гексадекановой кислоты, октадекановой кислоты и олеиновой кислоты.
В еще одном предпочтительном воплощении физиологически приемлемые, предпочтительно биоразлагаемые CR-соединения для применения в настоящем изобретении, выбраны из группы, состоящей из поли(молочной кислоты-со-гликолевой кислоты) (PLGA), полимолочной кислоты (PLA), поликапролактона (PCL), полоксамеров, полиэтиленгликоля (PEG) -PLGA сополимеров, комбинации PEG и PLGA, комбинации PLA и PEG, предпочтительно PLA-PEG-PLA, комбинаций PLGA и полоксамеров, декстрана, альгинатов и полиметакрилата, предпочтительно PLA, PLGA и комбинаций PEG-PLGA, более предпочтительно PLGA и PLA, наиболее предпочтительно PLGA.
Далее описаны наиболее предпочтительные, но не ограничивающие воплощения композиций по изобретению.
В наиболее предпочтительном воплощении настоящее изобретение предлагает композицию, предпочтительно без эффекторов роста жировых клеток или эффекторов роста железистых клеток, включающий биоразлагаемые микросферы поли(молочной кислоты-со-гликолевой кислоты) (PLGA), гексадекановую кислоту и/или олеиновую кислоту и, возможно, витамин С и/или Е, предпочтительно содержащую
(i) PLGA с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты около 1:1,
(ii) гексадекановую кислоту и/или олеиновую кислоту, предпочтительно, связанную с альбумином и
(iii) витамин С и/или E.
В другом наиболее предпочтительном воплощении настоящее изобретение предлагает композицию, по меньшей мере, с одним видом эффекторов роста жировых клеток, включающим биоразлагаемые микросферы поли(молочной-со-гликолевой кислоты) (PLGA), гексадекановую кислоту и/или олеиновую кислоту, инсулин, FGF-1, розиглитазон, бетаметазон и необязательно витамин С и/или Е, предпочтительно содержащую
(i) PLGA с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты, около 1:1,
(ii) олеиновую кислоту и/или гексадекановую кислоту, предпочтительно, связанных с альбумином,
(iii), рекомбинантный человеческий инсулин, FGF-1, розиглитазон, бетаметазон и витамин С и/или Е.
В другом наиболее предпочтительном воплощении настоящее изобретение предлагает композицию, предпочтительно для лечения рака молочной железы, по крайней мере с одним эффектором роста жировых клеток и, по меньшей мере, одним фактором роста железистых клеток, включающий биоразлагаемые микросферы поли(молочной-со-гликолевой кислоты) (PLGA), гексадекановую кислоту и/или олеиновую кислоту, инсулин, FGF-1, розиглитазон, бетаметазон, EGF-1, спиронолактон, эстрадиол и, возможно, витамин С и/или Е, предпочтительно содержащую
(i) PLGA с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты, около 1:1,
(ii) гексадекановую и/или олеиновую кислоту, предпочтительно, связанную с альбумином,
(iii), рекомбинантный человеческий инсулин, FGF-1, розиглитазон, бетаметазон, EGF-1, спиронолактон, эстрадиол и витамин С и/или Е.
В другом наиболее предпочтительном воплощении настоящее изобретение предлагает композицию, предпочтительно для лечения лица, по меньшей мере, с одним эффектором роста жировых клеток и, по меньшей мере, одним эстрогенным фактором роста, включающую биоразлагаемые микросферы поли(молочной-со-гликолевой кислоты) (PLGA), гексадекановую кислоту и/или олеиновую кислоту, инсулин, FGF-1, розиглитазон, бетаметазон, эстрадиол и, необязательно, витамин С и/или Е, предпочтительно содержащую
(i) PGLA с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты около 1:1,
(ii) олеиновую кислоту и/или гексадекановую кислоту, предпочтительно, связанные с альбумином,
(iii), рекомбинантный человеческий инсулин, FGF-1, розиглитазон, бетаметазон, эстрадиол и витамин С и/или Е.
Композиции по настоящему изобретению предназначены для применения в терапевтических или косметических процедурах, и необязательно могут содержать другие физиологически приемлемые наполнители и разбавители.
Таким образом, и в еще одном аспекте, настоящее изобретение относится к применению композиции по настоящему изобретению для получения косметической или терапевтической композиции, предпочтительно для развития жировой ткани или восстановления жировой ткани.
В предпочтительном воплощении композиция по настоящему изобретению предназначена для применения при развитии жировой ткани, предпочтительно, для увеличения объема жировой ткани, более предпочтительно, для тканей лица, ягодиц и/или груди.
В более предпочтительном воплощении композиция по настоящему изобретению предназначена для применения при терапевтической или косметической обработке состояния, выбранного из группы, состоящей из
(i) медицинских показаний, выбранных из группы, состоящей из дефектов тела, предпочтительно посттравматических рубцов, реконструкции груди и западения мягких тканей; врожденных дефектов, предпочтительно воронкообразной деформации грудной клетки, асимметрии молочных желез (например, синдрома Поланда), гемисиндромов (например, синдром врожденного липоматоза, синдром Ромберга); дефектов около протезов, реконтурирования дефекта бедренной кости после лучевой терапии, липодистрофии при ВИЧ, умеренной небно-глоточный недостаточности; а также
(ii) немедицинских показаний, выбранных из группы, состоящей из косметического увеличения жировой ткани, предпочтительно увеличения жировой ткани молочной железы, ягодиц, лица, половых органов, рук и ног, и ятрогенных дефектов, предпочтительно перипротезных нарушений, дефектов липосакции, и дефектов имплантатов.
В наиболее предпочтительном воплощении композиция по настоящему изобретению предназначена для применения при терапевтической или косметической обработке по медицинским показаниям для реконструкции молочных желез после мастэктомии или для увеличения молочных желез или ягодиц.
В другом наиболее предпочтительном воплощении композиция по настоящему изобретению предназначена для применения при терапевтической или косметической обработке состояния, выбранного из группы, состоящей из (i) медицинских показаний, выбранных из группы, состоящей из восстановления лица после травмы и дефектов, предпочтительно после угревой сыпи, ВИЧ-индуцированной липодистрофии, рубцов; и (ii) немедицинских показаний, выбранных из группы, состоящей из косметического увеличения лица, предпочтительно, щек, бровей, лба, глабеллы, губ, морщин марионетки, носогубных складок, носа, периокулярных морщин и дефекта впавшего века.
Еще один аспект настоящего изобретения относится к способу терапевтической или косметической обработки млекопитающего, предпочтительно человека, более предпочтительно косметической или терапевтической обработки одного из указанных выше косметических и терапевтических состояний, включающий стадии
(i) получения композиции по изобретению,
(ii) необязательно введение анестезии локально в ткань, подлежащую обработке,
(iii) введение композиции и предпочтительно инъекции композиции с одновременным извлечением инъекционной иглы,
(iv) при необходимости повторение стадии (iii), до полной обработки ткани.
В дальнейшем изобретение будет дополнительно проиллюстрировано с помощью конкретных воплощений, ни одно из которых не следует толковать как ограничивающее объем прилагаемой формулы изобретения.
Чертежи
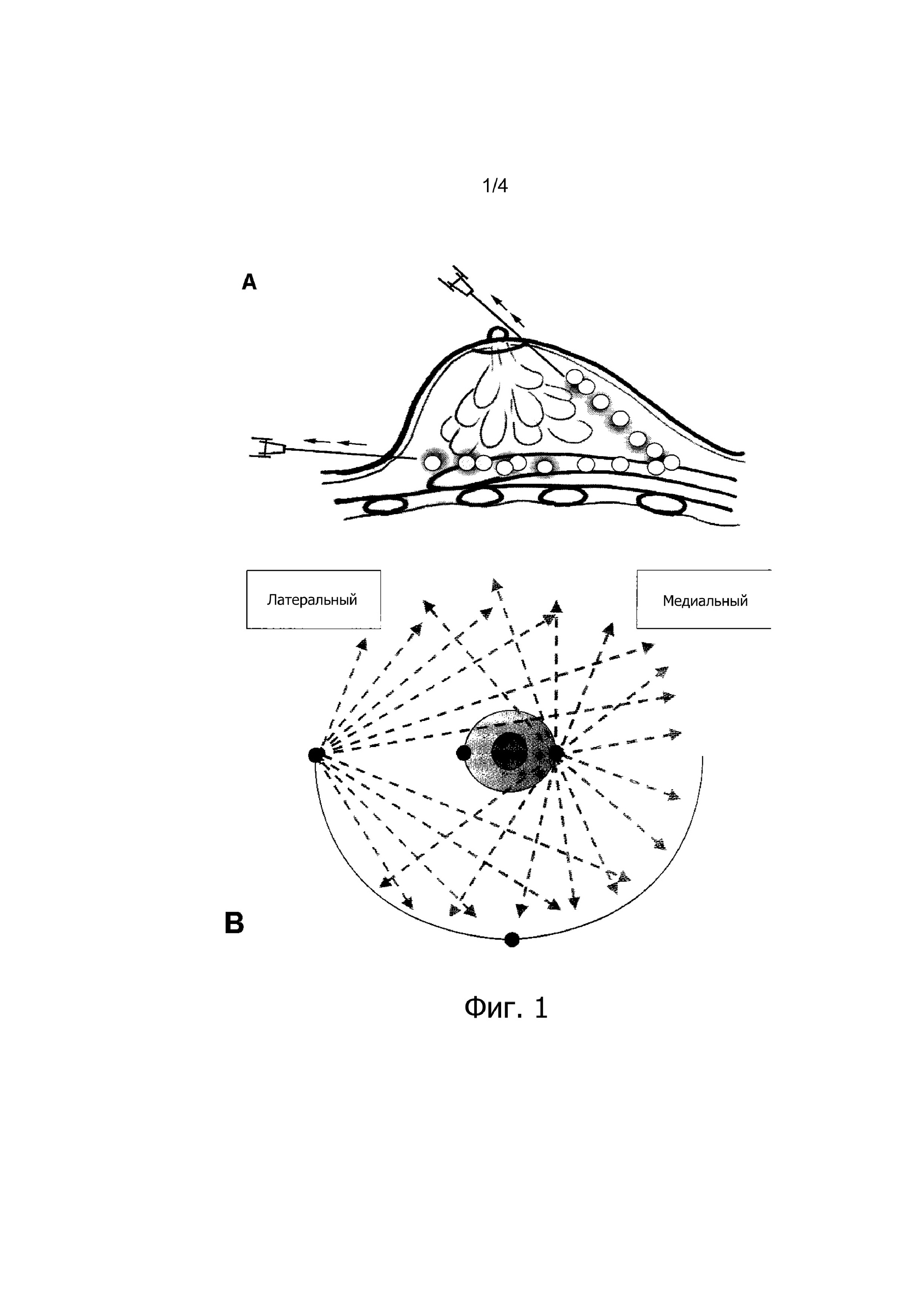
Фиг. 1 (А) представляет собой схематический чертеж вида сбоку вставки канюли с тупым наконечником в молочную железу, демонстрирующий, как небольшие аликвоты жидкой композиции по настоящему изобретению выпускаются при непрерывном выведении иглы.
Фиг. 1 (В) представляет собой схематическое изображение вида сверху молочной железы, в которую вставлена игла либо из одной, либо из двух точек на краю ареолы или из одной из двух точек в складки под молочной железой в различных направлениях и плоскостях для достижения диффузного и равномерного распределения.
Фиг. 2 демонстрирует график, иллюстрирующий концентрацию триглицеридов, поглощенных клетками 3T3-L1 (P9) при инкубации вместе с рядом различных композиций жирных кислот-CR-соединений в соответствии с изобретением, где CR-соединения контролируют высвобождение жирных кислот, включенных в композицию. Звездочка представляет статистическую значимость относительно контроля. Подробная процедура соответствует примеру 11.
Композиции, обозначенные как олеиновая кислота-PLGA (50:50), олеиновая кислота-PLGA (65:35), олеиновая кислота-PLA (PLA: мол. масса = 50000), гептадекановая кислота-PLGA (50:50), гексадекановая кислота-PLGA (50:50), декановая кислота-PLGA (50:50) и докозановая кислота-PLGA (50:50) получали в соответствии с примером 4.
Контроль состоял из пустых микросфер, полученных по примеру 5.
Фиг. 3 демонстрирует график, иллюстрирующий концентрацию триглицеридов в клетках 3T3-L1 (P9), где недифференцированные клетки 3T3-L1 обрабатывали PLGA-инсулином + PLGA-Дексаметазоном + PLGA-олеиновой кислотой по сравнению с клетками, обработанными клеточной культуральной среды + пустые микросферы PLGA (контроль). После двух дней введения этого каждую из групп обрабатывали средой, которая инкапсулировала инсулин и олеиновую кислоту. Подробная процедура описана в примере 12.
Композицию, обозначенную как микросферы, получали в соответствии с примерами 4, 6 и 8.
Композицию, обозначенную как контроль, получали в соответствии с примером 5.
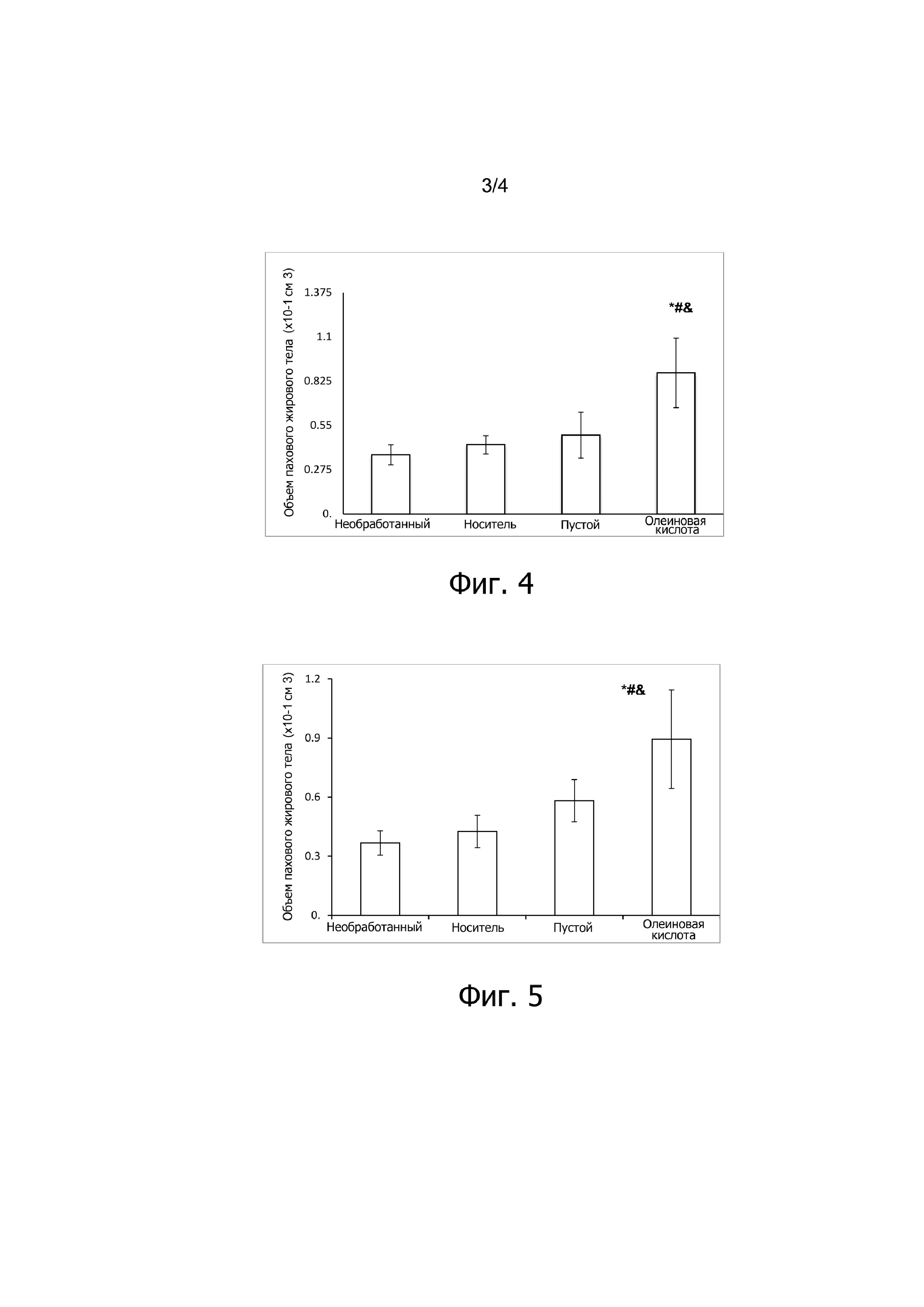
Фиг. 4 демонстрирует график, выделяющий объем пахового жирового тела голых мышей Balb-с без обработки (не подвергнутые воздействию, контроль), с инъецированным CMC-носителем (контроль), с пустыми микросферами в соответствии с примером 5, инъецированные (пустой, контроль), и с микросферами, включающими олеиновую кислоту в соответствии с примером 4, и носитель вводили (олеиновая кислота) в паховое жировое тело через 15 дней после обработки.
* # $ представляют статистическую значимость по сравнению с контролем.
Фиг. 5 демонстрирует график, выделяющий объем пахового жирового тела голых мышей r Balb-с без обработки (не подвергнутые воздействию, контроль), с инъецированным CMC-носителем (контроль), с инъецированными пустыми микросферами в соответствии с примером 5 (пустой, контроль), и с микросферами, включающими олеиновую кислоту в соответствии с примером 4, и инъецированным носителем (олеиновая кислота) в паховое жировое тело через 30 дней после обработки. * # $ представляет статистическую значимость по сравнению с контролем.
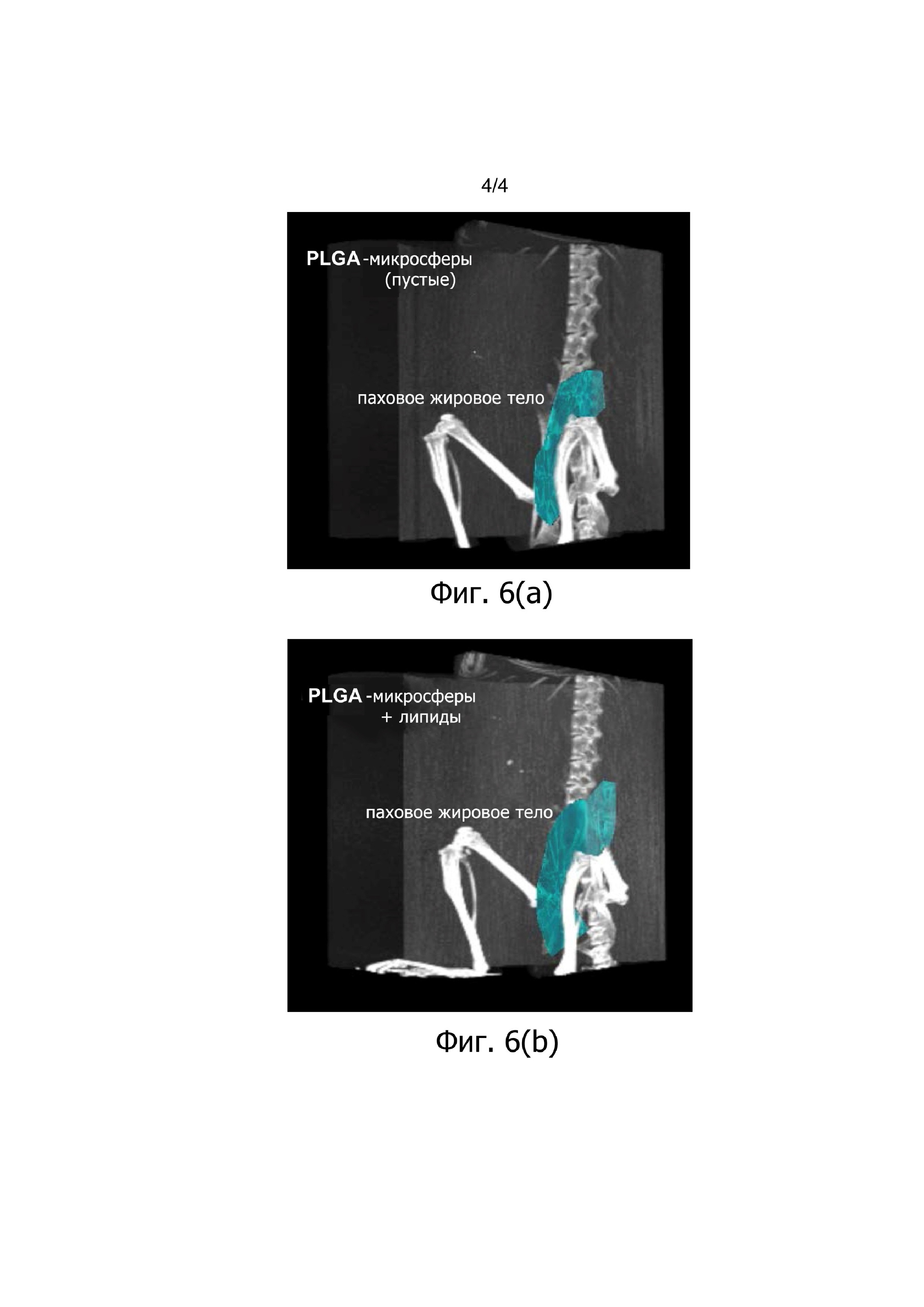
Фиг. 6 (А) и (В) демонстрируют КТ-сканы пахового жирового тела обработанных PLGA-микросферами в соответствии с примером 13, через 15 дней после обработки с PLGA-микросферами без (A) и с (В) олеиновой кислотой.
Пример 1. Композиции по изобретению
Диапазоны, приведенные для каждого компонента представленных ниже композиций, относятся к количествам и единицам активности каждого соединения в композиции для обработки одной области ткани у пациента, и следует понимать, что количество и единицы активности будут зависеть от пациента, конкретный целевой ткани, площадь и объема поверхности ткани, состояния, подлежащего лечению, получаемого эффекта и т.д.
Композиция A
(i) 100-200 г биоразлагаемых PLGA-микросфер с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты, около 1:1;
(ii) 100-500 г олеиновой кислоты и/или гексадекановой кислоты, связанных с альбумином и
(iii) 2-20 мг витамина С и/или Е.
Композиция А особенно подходит для временного увеличения жировой ткани, потому что в ней отсутствуют эффекторы роста жировых клеток и через некоторое время результаты увеличения проходят, например, через недели- месяцы, перекормленные и объемно-увеличенные клетки по всей вероятности используют или поставляют метаболические липиды другим клеткам. Влияние витамина Е заключается в том, что он служит в качестве консерванта и антиоксиданта в особенности для компонентов в составе на липидной основе.
Композиция В
(i) 100-200 г биоразлагаемых PLGA-микросфер с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты, около 1:1;
(ii) 100-500 г олеиновой кислоты и/или гексадекановой кислоты, связанных с альбумином;
(iii) 50-100 МЕ рекомбинантного инсулина человека;
(iv) 200-400 мкг FGF-1;
(v) 2-10 мг росиглитазона;
(vi) 1000-2000 мкг бетаметазона и
(VII) 2-20 мг витамина С и/или Е.
Композиция В особенно подходит для постоянного увеличения жировой ткани, так как включает факторы роста жировых клеток (iii)-(vi), которые стимулируют липогенез, то есть клеточную дифференцировку преадипоцитов в адипоциты и пролиферацию адипоцитов.
Композиция С
(i) 100-200 г биоразлагаемых PLGA-микросфер с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты, около 1:1;
(ii) 100-500 г олеиновой кислоты и/или гексадекановой кислоты, связанных с альбумином;
(iii) 50-100 МЕ рекомбинантного инсулина человека;
(iv) 200-400 мкг FGF-1;
(v) 2-10 мг росиглитазона;
(vi) 1000-2000 мкг бетаметазона;
(VII), 200-400 мкг EGF-1;
(VIII) 50-200 мг спиронолактона;
(IX), 2-4 мг 17y-эстрадиола и
(Х) 2-20 мг витамина С и/или E.
Композиция С особенно подходит для наращивания жировой ткани в молочной железе, поскольку включает факторы роста жировых клеток (iii)-(vi), которые стимулируют липогенез и, кроме того, эффекторы роста железистых клеток (VII) и (IX), которые способствует росту молочных желез.
Композиция D
(i) 100-200 г биоразлагаемых PLGA-микросфер с молекулярной массой 21000 дальтон и соотношением молочной кислоты и гликолевой кислоты, около 1:1;
(ii) 100-500 г олеиновой кислоты и/или гексадекановой кислоты, связанных с альбумином;
(iii) 1-2 МЕ рекомбинантного человеческого инсулина;
(iv) 4-8 мкг FGF-1;
(v) 40-200 мг росиглитазона;
(vi) 20-140 мкг бетаметазона;
(VII) 0-4 мг 17y-эстрадиола (0 мг для мужчин, 0-1 мг для женщин в пременопаузе, 2-4 мг для женщин после менопаузы)
(VIII) 2-20 мг витамина С и/или Е.
Композиция D особенно подходит для увеличения жировой ткани лица, так как она включает факторы роста жировых клеток (iii)-(vi), которые стимулируют липогенез и, кроме того, эстрадиол, который взаимодействует с рецептором эстрогена в резидентных кожных фибробластах и стимулирует образование коллагена.
Пример 2. Способ по настоящему изобретению
Ниже описаны два способа практического осуществления настоящего изобретения.
Способ А
(i) получение композиции по изобретению, в частности, одной из композиций А-D,
(ii) применение местной анестезии в области ткани-мишени, в частности, лица, молочной железы или ягодицы,
(iii), осуществление 1 мм надрезов на целевой области через регулярные интервалы для скрещенных и наложенных плоскостей распределения,
(iv) осуществление множественных и равномерно распределенных инъекций составом в шприце, снабженном губчатым наконечником иглы 15-30 калибра или острой V-образной канюлей, при выведении, тем самым производя вертикальные депозиты вдоль канала инъекции,
(v) повторение стадии (iv) до полного покрытия всей целевой области.
Способ В
(i) получение композиции по изобретению, в частности, одной из композиций А-D,
(ii) применение местной или регионарной анестезии, включающей блокаду нерва в области ткани-мишени, в частности лица, молочной железы или ягодиц,
(iii) введение иглы 15-30 калибра с тупым концом шприца, содержащего композицию на соответствующую глубине ткани в начальной точке инъекции,
(iv) доставка композиции по мере вытаскивания иглы в медленном и непрерывном режиме до тех пор, пока игла не будет полностью удалена из кожи или, в ином случае, направление иглы непрерывно изменяется в радиальном направлении, и новые линии инъецируют без вытаскивания, пока вся целевая область не будет покрыта,
(v) введение серии нитей во вторичную точку, перпендикулярно первичной точке инъекции для обеспечения более широкого охвата больших целевых областей,
(vi) стадии (ii)-(v) могут быть повторены в нескольких целевых областях, в частности в лицевых целевых областях.
Пример 3. Техника инъекций по изобретению
Предпочтительный метод инъекции для введения композиций по настоящему изобретению подобен аутологичным методам переноса жира, которые используются хирургами и описаны со ссылкой на фиг. 1 (А) и 1 (В).
Основные принципы, лежащие в основе вышеуказанного метода введения фиг. 1 (А) и (В), заключаются в равномерном распределении композиции по изобретению по всей ткани-мишени для того, чтобы обеспечить множественные и равномерно распределенные депозиты метаболических липидов, контролирующих высвобождение с помощью включенных в композицию CR-соединений для обеспечения равномерной диффузии метаболических липидов и необязательно эффекторных соединений по всей целевой области. Предпочтительные биоразлагаемые микросферы сходны по форме и размеру с жировыми клетками.
Предпочтительные объемы инъекции могут варьировать от 0,1 мл до 500 мл, так как они зависят от места инъекции, пациента и выбора хирурга. Во время инъекционной сессии небольшие объемы высвобождаются через регулярные промежутки времени для того, чтобы позволить осуществить 3-D формование и для предотвращения образования кист. Участки-мишени инъекций также предпочтительно массируют для того, чтобы обеспечить равномерное распределение и предотвратить образованию кист.
Пример 4. Синтез микросфер с PLGA-жирными кислотами
1. Поли(молочную-со-гликолевую кислоту) 50:50 (30000-60000) или поли(молочную-со-гликолевую кислоту) 65:35 (40000-75000) или поли(молочную-со-гликолевую кислоту) 85:15 (50000-75000) получали из Sigma Aldrich. 200 мг полимера взвешивали на весах и растворяли в дихлорметане ВЭЖХ-категории. Эту смесь перемешивали при 500 об./мин.
2. После полного растворения полимера добавляли 100 мкл представляющей интерес жирной кислоты (декановой кислоты, гептадекановой кислоты, гексадекановой кислоты, олеиновой кислоты, докозановой кислоты) к раствору в дихлорметане при вращении.
3. A 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в 200 мл химический стакан и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
4. Скорость гомогенизации установили на уровне 6000 об./мин., и по мере гомогенизации раствора добавляли к раствору PVA покапельно раствор дихлорметана со смесью.
5. Эту смесь подвергали гомогенизации в течение 5 мин.
6. Гомогенизированный раствор добавляли к 300 мл 0,5% PVA при перемешивании со скоростью 700 об./мин.
7. Растворителю давали испариться в течение 4 ч, что приводило к образованию микросфер и их отвердению.
8. Раствор PVA, содержащего микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
9. Перед первой промывкой собирали надосадочную жидкость для анализа.
10. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
11. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
12. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
13. Собранную надосадочную жидкость использовали для измерения общего количества инкапсулированных жирных кислот. Эффективность инкапсулирования составляла 10-90%.
14. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией мышам или введением в клеточную культуру.
Пример 5. Синтез PLGA-микросфер (пустых)
1. Поли(молочную-со-гликолевую кислоту) 50:50 (30000-60000) или поли (молочную-со-гликолевую кислоту) 65:35 (40000-75000) или поли (молочную-со-гликолевую кислоту) 85:15 (50000-75000) получали из Sigma Aldrich. 200 мг полимера взвешивали на весах и растворяли в дихлорметане для ВЭЖХ. Эту смесь перемешивали при 500 об./мин.
2. 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в химический стакан емкостью 200 мл и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
3. Скорость гомогенизации установили на уровне 6000 об./мин., и по мере гомогенизации раствора, добавляли к раствору PVA покапельно раствор дихлорметана со смесью.
4. Эту смесь подвергали гомогенизации в течение 5 мин.
5. Гомогенизированный раствор добавляли к 300 мл 0,5% поливинилового спирта при перемешивании со скоростью 700 об./мин.
6. Растворитель выпаривали в течение 4 ч, что приводило к образованию микросфер и их отвердению.
7. Раствор PVA, содержащий микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
8. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
9. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
10. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
11. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией в организм мышей.
Пример 6. Синтез микросфер PLGA-Дексаметазон
1. Поли(молочную-со-гликолевую кислоту) 50:50 (30000-60000) или поли(молочную-со-гликолевую кислоту) 65:35 (40000-75000) или поли (молочную-со-гликолевую кислоту) 85:15 (50000-75000) получали из Sigma Aldrich. 200 мг полимера взвешивали на весах и растворяли в дихлорметане ВЭЖХ-категории. Эту смесь перемешивали при 500 об./мин.
2. После полного растворения полимера добавляли 100 мг дексаметазона (Sigma Aldrich) и полностью растворяли.
3. 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в химический стакан емкостью 200 мл и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
4. Скорость гомогенизации установили на уровне 6000 об./мин., и по мере гомогенизации раствора, добавляли к раствору PVA покапельно раствор дихлорметана со смесью.
5. Эту смесь подвергали гомогенизации в течение 5 мин.
6. Гомогенизированный раствор добавляли к 300 мл 0,5% PVA при перемешивании со скоростью 700 об./мин.
7. Растворитель выпаривали в течение 4 ч, что приводило к образованию микросфер и их отвердению.
8. Раствор PVA, содержащий микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
9. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
10. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
11. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
12. Образец микросфер деградировали разбавленным щелочным раствором, надосадочную жидкость анализировали с помощью УФ-прозрачной пластины при 241 нм и сравнивали со стандартной кривой, построенной соответствующим образом. Эффективность инкапсулирования составляла около 2-10%.
13. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией в организм мышей.
Пример 7. Синтез микросфер с PLA-жирными кислотами
1. Поли (L-лактид) (PLA), среднее значение Mn 50000 получали из Sigma Aldrich. 200 мг полимера взвешивали на весах и растворяли в дихлорметане ВЭЖХ-категории. Эту смесь перемешивали при 500 об./мин.
2. После полного растворения полимера добавляли 100 мкл представляющей интерес жирной кислоты (декановой кислоты, гептадекановой кислоты, гексадекановой кислоты, олеиновой кислоты, докозановой кислоты) к раствору в дихлорметане при вращении.
3. 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в химический стакан емкостью 200 мл и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
4. Скорость гомогенизации установили на уровне 6000 об./мин., раствор дихлорметана со смесью добавляли в раствор PVA покапельно для образования эмульсии WOW.
5. Эту смесь подвергали гомогенизации в течение 5 мин.
6. Гомогенизированный раствор добавляли к 300 мл 0,5% поливинилового спирта при перемешивании со скоростью 700 об./мин.
7. Растворитель выпаривали в течение 4 ч, что приводило к образованию микросфер и их отвердению.
8. Раствор PVA, содержащий микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
9. Перед первой промывкой собирали надосадочную жидкость для анализа.
10. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
11. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
12. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
13. Собранную надосадочную жидкость использовали для определения общего количества инкапсулированных жирных кислот. Эффективность инкапсулирования составляла 10-90%, в среднем около 45%.
14. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией мышам или введением в клеточную культуру.
Пример 8. Синтез PLGA-микросфер, инкапсулирующих инсулин
1. Поли(молочную-со-гликолевую кислоту) 50:50 (30000-60000) или поли(молочную-со-гликолевую кислоту) 65:35 (40000-75000) или поли (молочную-со-гликолевую кислоту) 85:15 (50000-75000) получали из Sigma Aldrich.
2. 200 мг полимера взвешивали на весах и растворяли в дихлорметане ВЭЖХ-категории. Эту смесь перемешивали при 500 об./мин.
3. Рекомбинантный человеческий инсулин (Sigma Aldrich) растворяли в 0,1 М растворе HCl с рН 2.
4. После полного растворения полимера, раствор вводили в устройство Ultra Turrax IKA T25 (устройство IKA Ultra Turrax T25 digital, оснащенное диспергирующим элементом S25N-10G). Эквивалентный раствор инсулина до 50 мг добавляли по каплям с получением эмульсии вода в масле (WO).
5. 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в химический стакан емкостью 200 мл и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
6. Скорость гомогенизации установили на уровне 6000 об./мин., и по мере гомогенизации раствора, добавляли к раствору PVA покапельно раствор дихлорметана со смесью.
7. Эту смесь подвергали гомогенизации в течение 5 мин.
8. Гомогенизированный раствор добавляли к 300 мл 0,5% PVA при перемешивании со скоростью 700 об./мин.
9. Растворитель выпаривали в течение 4 ч, что приводило к образованию микросфер и их отвердению.
10. Раствор PVA, содержащего микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
11. Перед первой промывкой собирали надосадочную жидкость для анализа.
12. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
13. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
14. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
15. Часть микросфер деградировали с использованием разбавленной щелочи в течение ночи, и надосадочную жидкость использовали для определения количества инкапсулированного инсулина с использованием анализа ВСА (тест с бицинхониновой кислотой).
16. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией мышам или введением в клеточную культуру.
Пример 9. Синтез микросфер PEG-PLGA-жирные кислоты
1. Поли (этиленгликоль) метиловый эфир-блок-поли(лактид-со-гликолид), PEG со средней Mn 5000, PLGA Mn 55000 получили из Sigma Aldrich. 200 мг полимера взвешивали на весах и растворяли в дихлорметане ВЭЖХ-категории. .Эту смесь перемешивали при 500 об./мин.
2. После полного растворения полимера 100 мкл представляющей интерес жирной кислоты (декановой кислоты, гептадекановой кислоты, гексадекановой кислоты, олеиновой кислоты, докозановой кислоты) добавляли к раствору в дихлорметане при вращении.
3. A 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в химический стакан емкостью 200 мл и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
4. Скорость гомогенизации установили на уровне 6000 об./мин., и в процессе гомогенизации раствора, покапельно добавляли в раствор PVA раствор дихлорметана со смесью.
5. Эту смесь подвергали гомогенизации в течение 5 мин.
6. Гомогенизированный раствор добавляли к 300 мл 0,5% PVA при перемешивании со скоростью 700 об./мин.
7. Растворитель выпаривали в течение 4 ч, что приводило к образованию микросфер и их отвердению.
8. Раствор PVA, содержащего микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
9. Перед первой промывкой собирали надосадочную жидкость для анализа.
10. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
11. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
12. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
13. Собранную надосадочную жидкость использовали для определения общего количества инкапсулированных жирных кислот. Эффективность инкапсулирования составляла 10-90%.
14. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma-Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией мышам или введением в клеточную культуру.
Пример 10. Синтез микросфер PEG-PLGA-PEG жирные кислоты
1. Поли(лактид-со-гликолид)-блок-поли(этиленгликоль)-блок-поли(лактид-со-гликолид), среднее значение Mn (1100-1000-1100) получали из Sigma Aldrich, 200 мг полимера взвешивали на весах и растворяли в дихлорметане ВЭЖХ-категории. Эту смесь перемешивали при 500 об./мин.
2. После полного растворения полимера добавляли 100 мкл представляющей интерес жирной кислоты (декановой кислоты, гептадекановой кислоты, гексадекановой кислоты, олеиновой кислоты, докозановой кислоты) к раствору в дихлорметане при вращении.
3. 95 мл 4% раствора поливинилового спирта (PVA), (MW 89000-98000, гидролизованного на 99+%), вводили в химический стакан емкостью 200 мл и гомогенизировали с помощью устройства IKA Ultra Turrax T25 digital, оснащенного диспергирующим элементом S25N-10G.
4. Скорость гомогенизации установили на уровне 6000 об./мин., и по мере гомогенизации раствора, добавляли к раствору PVA покапельно раствор дихлорметана со смесью.
5. Эту смесь подвергали гомогенизации в течение 5 мин.
6. Гомогенизированный раствор добавляли к 300 мл 0,5% PVA при перемешивании со скоростью 700 об./мин.
7. Растворитель выпаривали в течение 4 ч, что приводило к образованию микросфер и их отвердению.
8. Раствор PVA, содержащего микросферы, центрифугировали при 8000 об./мин., и промывали 3 раза подряд бидистиллированной водой.
9. Перед первой промывкой собирали надосадочную жидкость для анализа.
10. Микросферы в осадке ресуспендировали в 3 мл бидистиллированной воды.
11. Эти ресуспендированные микросферы подвергали сублимационной сушке в течение 12 ч.
12. Микроскопию или/и счетчик Coulter использовали для определения размера микросфер, который составлял 10-50 микрон.
13. Собранную надосадочную жидкость использовали для получения общего количества инкапсулированных жирных кислот. Эффективность инкапсулирования составляла 10-90%.
14. Порошок микросфер ресуспендировали в 2% растворе карбоксиметилцеллюлозы (Mw 90000, Sigma-Aldrich) и энергично встряхивали. Раствор встряхивали перед инъекцией мышам или введением в клеточную культуру.
Пример 11. In vitro поглощение различных композиций CR-соединений/жирных кислот
3T3-L1 является клеточной линией, полученной из (мышиных) клеток 3Т3, обычно используемой в биологических исследованиях на жировой ткани. Эта клеточная линия, как правило, используется в качестве предсказуемой клеточной модели для исследования жировых клеток. Клетки 3T3-L1 (P9) (ATCC, Германия) высевали в количестве 25000 клеток на лунку в 96-луночный планшет. Этим клеткам давали достичь конфлюэнтности в течение 2-х дней. Среду меняли с DMEM (10% сыворотки + стрептомицин (100 Ед.) + пенициллин (0,1 мг/мл)) (Все получены из Gibco, Швейцария) на среду DMEM (10% сыворотки + инсулин + дексаметазон стрептомицин (100 Ед.) + пенициллин (0,1 мг/мл)). Через два дня эту среду заменяли на DMEM (10% сыворотки + Инсулин стрептомицин (100 Ед.) + пенициллин (0,1 мг/мл) + X). Здесь Х представляет собой или олеиновую кислоту, гептадекановую кислоту, гексадекановую кислоту, декановую кислоту и докозановую кислоту в соответствии с примером 4. Композицию олеиновой кислоты -PLA получали в соответствии с примером 7. Жирные кислоты добавляли в каждую лунку в концентрации 20 мкМ. В случае контроля добавляли пустые микросферы в такой же примерной концентрации полимера (5 мг/лунку), пример 5. Во всех случаях, диапазон размеров микросфер поддерживали на уровне выше 10 микрон. Среду меняли каждые три дня с новым добавлением соответствующих микросфер. Клетки лизировали с помощью 1% Тритона Х-100, и измеряли уровни триглицеридов с помощью теста. Статистические данные проводили с использованием одностороннего дисперсионного анализа и апостериорного критерия Тьюки.
Полученные результаты, представленные на фиг. 2, показывают, что композиции в соответствии с настоящим изобретением, то есть композиции, содержащие метаболические жирные кислоты различного типа, а также CR-соединения различных типов, с помощью CR-соединений, контролирующих высвобождение жирных кислот, приводят к значительному увеличению триглицеридов в жировых модельных клетках, обеспечивая тем самым контролируемое поглощение и включение жирных кислот из CR-композиций в клеточные триглицериды. Это увеличение уровня триглециридов не зависит от состава и типа CR-соединения, а также от типа, длины углеродной цепи и степени насыщения физиологически релевантных жирных кислот.
Пример 12. In vitro влияние CR-контролируемых инсулина и дексаметазона на концентрацию триглицеридов
Клетки 3T3-L1 (P9) высевали в количестве 25000 клеток на лунку в 96-луночный планшет. Клеткам давали достичь конфлуэнтности в течение 2-х дней. Среду меняли с DMEM (10% сыворотки) на DMEM (10% сыворотки + инсулин + дексаметазон + олеиновая кислота + стрептомицин (100 Ед.) + пенициллин (0,1 мг/мл)). Инсулин, дексаметазон и олеиновую кислоту инкапсулировали в PLGA-микросферы из 50:50 композиции в соответствии с примерами 4, 6 и 8. Через два дня эту среду заменяли на DMEM (10% сыворотки + инсулин + олеиновая кислота + стрептомицин (100 Ед.) + пенициллин (0,1 мг/мл)), как олеиновая кислота, так и инсулин находились в отдельных микросферах согласно примерам 4 и 8. В случае контроля пустые микросферы добавляли в той же концентрации полимера (5 мг/лунку). Во всех случаях диапазон размеров микросфер поддерживали на уровне выше 10 мкм. Среду меняли каждые три дня с новым дополнением микросфер, либо с олеиновой кислотой и инсулином во всех случаях. Клетки подвергали лизису с помощью Тритона Х-100 на 8-й день, и измеряли уровни триглицеридов с помощью теста. Статистические данные были выполнены с использованием одностороннего дисперсионного анализа и апостериорного критерия Тьюки.
Этот эксперимент показал, что наши микросферы, содержащие дексаметазон и инсулин отдельно вместе с микросферами с олеиновой кислотой, индуцируют дифференцировку клеток 3T3-L1 и последующее накопление триглицеридов, при этом контроль дифференцировался незначительно, и таким образом, имеет место отсутствие накопления триглицеридов. Этот эксперимент демонстрирует, что наша комбинация CR-соединений вместе с инсулином и дексаметазоном в отдельных микрочастицах может индуцировать дифференцировку недифференцированных жировых клеток и последующее увеличение их объема.
Пример 13. Тесты на животных in vivo
Лиофилизированные микросферы, которые были изготовлены в соответствии с примером 4 (приблизительно 25 мг полимера/на мышь и 22,5 мг олеиновой кислоты/на мышь ресуспендировали в 50-200 cP, 2% раствор в воде 90 кДа карбоксиметилцеллюлозы натрия со степенью полимеризации 400 и степенью замены 0,65-0,9 (обозначаемой с этого момента как СМС) в течение ночи и энергично встряхивали перед применением. Эффективность инкапсуляции олеиновой кислоты составляла примерно 45% (45 мг олеиновой кислоты на 100 мг композиции олеиновой кислоты-микросфер). Полимер поли молочной кислоты - гликолевой кислоты использовали в соотношении 50:50 (30000-60000) с выходом микросфер диаметром 10-50 микрон. Для экспериментов использовали 2-х месячных голых мышей Balb-с, каждая группа имела 5 мышей, полученных из лаборатории Charles Rivers, Италия. Мышей акклиматизированы в виварии в течение 30 дней для того, чтобы избежать побочных эффектов из-за стресса. Использовали стерильную олеиновую кислоту категории клеточных культур.
Объем левой пахового жирового тела определяли с помощью КТ через 15 и 30 дней после инъекции. 50 мг соответствующей композиции микросфер впрыскивали в каждую паховое жировое тело с CMC в качестве носителя, что соответствует общему объему 100 мкл на жировое тело. Для инъекций использовали иглу 22G. Мышей анестезировали 3% изофлураном. Доступ к паховому жировому телу получали через брюшную поверхность. Микросферы инъецировали при медленном извлечении иглы, так чтобы иметь равномерное распределение содержимого инъекции в жировом теле.
Микросферы, загруженные олеиновой кислотой, явно увеличивали объем пахового жирового тела через 15 дней после инъекции в голых мышах, согласно оценке с помощью КТ. Этот эксперимент на животных ясно демонстрирует, что композиции CR-соединений/метаболических липидов по изобретению, приводят к контролируемому и длительному усвоению метаболических липидов для значимого и гомогенного увеличения ткани жировых клеток в непосредственной близости от этих композиций.
Реферат
Настоящее изобретение относится к применению композиций для увеличения жировой ткани и может быть применено в косметологии. Предложено применение композиции, включающей липиды, выбранные из бутановой, пентановой, гексановой, гептановой, каприловой, нонановой, декановой, ундекановой, додекановой, тридекановой, тетрадекановой, пентадекановой, гексадекановой, гептадекановой, октадекановой, нонадекановой, эйкозановой, генэйкозановой, докозановой, трикозановой, пентакозановой, гексакозановой, гептакозановой, октакозановой, нонакозановой, триаконтановой, гентриаконтановой, дотриаконтановой, тритриаконтановой, тетратриаконтановой, пентатриаконтановой, гексатриаконтановой, миристолеиновой, пальмитолеиновой, олеиновой, элаидиновой, вакценовой, линоэлаидиновой, линоленовой кислот, арахидоновой, эйкозапентаеновой, эруковой, докозагексаеновой, стеаридоновой, докозапентаеновой, эйкозатетраеновая и докозагексаеновой кислот, и соединения контролируемого высвобождения, выбранные из поли(молочной-со-гликолевой кислоты) (PLGA), полимолочной кислоты (PLA), полиэтиленгликоль (PEG)-PLGA сополимеров, комбинации PEG и PLGA, комбинации PLA и PEG, PLA-PEG-PLA, которые высвобождают указанные липиды с временной задержкой в физиологических условиях, для косметического увеличения жировой ткани и для изготовления лекарственного средства для увеличения жировой ткани. Предложены новые применения, эффективные для увеличения жировой ткани в областях косметологии и терапии, где это необходимо. 2 н. и 25 з.п. ф-лы, 6 ил., 13 пр.

Комментарии