Штамм молочнокислой бактерии для лечения воспаления при воспалительном заболевании кишечника, компонент, эффективный для лечения язвы, способ лечения воспаления при воспалительном заболевании кишечника, продукт (варианты) и композиция (варианты) - RU2378370C2
Код документа: RU2378370C2
Чертежи


Описание
Предшествующий уровень техники
Область, к которой относится изобретение
Настоящее изобретение относится к применению способа скрининга непатогенных противовоспалительных бактериальных штаммов и их продуктов; а также к способам применения таких штаммов для лечения и профилактики нежелательных воспалительных процессов, вызываемых некоторыми бактериями или другими индуцирующими воспаление агентами.
Описание уровня техники
Моноциты покидают костный мозг и через периферические кровеносные сосуды транспортируются в слизистую/серозную оболочку желудочно-кишечного тракта. Эти предполагаемые макрофаги играют ключевую роль во взаимодействии и передаче сигналов, необходимых для регуляции иммунной системы желудочно-кишечного тракта (ЖКТ).
В желудочно-кишечном тракте наблюдается постоянный уровень иммунного ответа, заключающегося в продуцировании макрофагов в эпителии слизистой в ответ на проникновение бактерий в полость тонкой кишки и их адгезии к слизистой тонкой кишки. В нормальном состоянии вырабатывание такого ответа приводит к ограничению продуцирования цитокиновых сигналов и к подавлению нежелательного воспалительного ответа. Однако, при попадании патогена или токсина на указанные клетки, они формируют первую линию защиты и реагируют посредством продуцирования возрастающего количества провоспалительных цитокинов, которые обеспечивают передачу воспалительного ответа до тех пор, пока воспаление не начнет спадать. Генерирование цитокинов, релевантных с точки зрения взаимодействия с бактериями-комменсалами (безопасными бактериями), а также с бактериями, участвующими в продуцировании полного воспалительного ответа на патогены, предотвращается либо самими молочнокислыми бактериями (включая поверхностные антигены), либо веществами, продуцируемыми этими молочнокислыми бактериями, и совершенно очевидно, что комменсальная флора интенсивно взаимодействует с макрофагами слизистой и поддерживает равновесную реакцию в кишечной флоре и тем самым обеспечивает оптимальные условия для сохранения здоровья (Rook GA, Adams V, Hunt J, Palmer R, Martinelli R, Brunet LR. Mycobacteria and other environmental organisms as immunomodulators for immunoregulatory disorders. Springer Semin Immunopathol 2004; 25:237-255).
Известно, что различные патогены могут вызывать воспаление, например, в желудочно-кишечном тракте. Такое воспаление, например, в желудке и в желудочно-кишечном тракте, опосредуется внеклеточными сигнальными белками, известными как цитокины, которые продуцируются макрофагами и дендритными клетками в эпителии в ответ на антигенные возбудители, такие как возбудители, продуцируемые патогеном. После контакта эпителия с антигеном патогена или продуцируемого им эндотоксина, такого как ЛПС, антиген-представляющие клетки (включая дендритные клетки), присутствующие в эпителии, передают сигнал “необученным” макрофагам, которые затем вырабатывают так называемый Th1-ответ, при котором указанными макрофагами продуцируются про-воспалительные цитокины, включая TNF-α, IL-1, IL-6 и IL-12. Эти цитокины, в свою очередь, стимулируют природные клетки-киллеры, Т-клетки и другие клетки, продуцирующие интерферон-γ (IFNγ), который является главным медиатором воспаления. IFNγ способствует усилению воспалительного ответа и стимулирует вышеописанные реакции, которые приводят к цитотоксичности. “Необученные” макрофаги могут также вырабатывать антигенный ответ Th2-типа. Этот ответ ингибируется IFNγ. Клетки Th2-типа продуцируют противовоспалительные цитокины, такие как IL-4, IL-5, IL-9 и IL-10.
Известно, что IL-10 ингибирует продуцирование IFNγ и, таким образом, подавляет иммунный ответ. Равновесие между клетками Th1- и Th2-типа и продуцируемыми ими соответствующими цитокинами определяет уровень воспалительного ответа на данный антиген. Клетки Th2-типа могут также стимулировать продуцирование иммуноглобулинов посредством иммунной системы. Противовоспалительная активность, продуцируемая в желудочно-кишечном тракте, в котором наблюдается снижение уровня TNFα, коррелирует с увеличением уровня эпителиальных клеток (целостности выстилки стенок кишки), а следовательно, и с ослаблением негативных эффектов, вызываемых желудочно-кишечными патогенами и токсинами.
Результаты ряда научных исследований показали, что ДНК может оказывать противовоспалительное действие на эпителиальные клетки тонкой кишки, либо она может стимулировать иммунную систему (Madsen et al. and Rachmilewitz et al, respectively, presentations at Digestive Disease Week, May 19-22, 2002, The Moscone Center, San Francisco).
Воспаление возникает при различных заболеваниях у млекопитающих и поражает как внешние органы, например, кожу, глаза и т.п., так и внутренние органы, такие как, например, различные слизистые оболочки в полости рта, желудочно-кишечном тракте, во влагалище и т.п., а также мышцы, суставы костей и ткани головного мозга. В желудочно-кишечном тракте возникает несколько заболеваний, ассоциированных с воспалением, например, гастрит, язва и воспалительное заболевание кишечника (ВЗК). ВЗК представляет собой хроническое расстройство, которое вызывает воспаление и набухание стенок пищеварительного тракта или тонкой кишки. При воспалении и набухании пищеварительного тракта при ВЗК возникают поражения ткани (язвы) и кровотечения. Это поражение, в свою очередь, может вызывать абдоминальные боли, водянистый стул, кровавый понос, усталость, пониженный аппетит, потерю веса или повышение температуры. Таким образом, воспаление при ВЗК приводит к повреждению ткани, такому как язвы, и к обострению заболевания у пациента.
Двумя наиболее распространенными формами ВЗК являются язвенный колит (ЯК) и болезнь Крона (БК). Болезнь Крона представляет собой хроническое состояние, характеризующееся рецидивирующими воспалительными поражениями стенок всего кишечника от слизистой до серозной оболочки, и может поражать многие участки тонкой кишки. Такое заболевание ассоциируется с дисбалансом микрофлоры кишечника и усилением воспалительной реакции с компонентами нормальной флоры кишечника; причем такая воспалительная реакция плохо поддается лечению современными лекарственными средствами, и одним из способов лечения является терапия с использованием анти-TNFα антитела, разработанная в целях снижения уровней TNFα в слизистой желудочно-кишечного тракта. Таким образом, пациенты с данным заболеванием представляют собой идеальную группу для исследования и, фактически, являются наиболее подходящей группой для применения иммуномодулирующих молочнокислых бактерий, способствующих ослаблению воспаления.
У мышей спонтанно развивается хронический колит, который не наблюдается у стерильных животных. Мышиный колит имеет сходство с человеческой болезнью Крона, то есть с тяжелым хроническим воспалительным заболеванием желудочно-кишечного тракта. Болезнь Крона обычно возникает в тонком кишечнике, но может наблюдаться и в любом другом участке желудочно-кишечного тракта. Для развития этих состояний необходимо присутствие кишечных бактерий, и такими состояниями являются Th1-опосредуемые IL-12-зависимые формы колита.
Из-за сходства причин и симптомов мышиные модели колита и мышиные модели других заболеваний часто используются для прямого исследования компонентов воспалительного ответа, а поскольку у человека наблюдаются те же самые механизмы продуцирования ответа, то такие модели часто применяются для разработки способов лечения желудочно-кишечных заболеваний у человека. Однако, в этой связи, все же возникают некоторые сомнения насчет уместности применения моделей животных для разработки способов лечения человека, а поэтому необходимо разработать альтернативные способы исследования человеческих механизмов и подтверждения результатов исследования, полученных с использованием других моделей, а именно моделей, более близких к человеческим системам. Целью настоящего изобретения является разработка способа, основанного на использовании человеческих клеток, для отбора молочнокислых бактерий, обладающих противовоспалительными свойствами, и последующего применения выбранных молочнокислых бактерий для профилактики и лечения различных воспалительных заболеваний.
Бактерия Lactobacillus reuteri представляет собой одну из природных обитателей желудочно-кишечного тракта животных и обычно присутствуют в тонком кишечнике здоровых животных, а иногда также и в желудке человека, несмотря на его низкий рН. Известно, что эта бактерия обладает антибактериальной активностью. См., например, патенты США № 5439678, 5458875, 5534253, 5837238 и 5849289. Если клетки L. reuteri растут в анаэробных условиях в присутствии глицерина, то они продуцируют противомикробное вещество, известное как рейтерин (β-гидроксипропиональдегид). Также известно, что некоторые штаммы молочнокислых бактерий, включая L. reuteri, обладают противовоспалительными свойствами, как описано в заявках на патент США 20040208863 и 20040067573. Другие иммуномодулирующие свойства также ассоциируются с различными другими молочнокислыми бактериями.
Клинические испытания, проводимые с участием человека, и исследования на животных показали, что Lactobacillus может предотвращать или снижать степень воспаления при хроническом колите. Была высказана гипотеза, что молочнокислые бактерии обладают способностью ингибировать провоспалительные цитокиновые ответы, индуцированные кишечными бактериями. J. Pefla с сотрудниками (2003) были проведены исследования для того, чтобы определить, снижают ли молочнокислые бактерии уровень продуцирования фактора некроза опухоли альфа (TNF-α) мышиными макрофагами. Было показано, что продуцирование TNF-α мышиными макрофагами, инкубированными с Lactobacillus rhamnosus GG и их липосахаридами, значительно снижалось по сравнению с контролем.
Той же самой группой исследователей были проведены исследования для того, чтобы определить, являются ли Lactobacillus spp. эффективными для ослабления Helicobacter-индуцированного воспаления in vivo. Для этого были проведены эксперименты по совместной инокуляции бактериями L. reuteri и L. paracasei мышей с моделью колита, вызываемого H. hepaticus. У самок мышей, которым вводили H. hepaticus и Lactobacillus spp., по сравнению с животными, которым вводили только H. hepaticus, наблюдалось значительное снижение уровней поражения. Было показано, что пробиотическое действие Lactobacillus spp. в этой модели не зависит от бактерии H. hepaticus, а зависит от посттранскрипционной регуляции экспрессии TNF-α. Эти данные позволяют предположить, что существует новый механизм, посредством которого Lactobacillus spp. может ингибировать Helicobacter-индуцируемое продуцирование провоспалительных цитокинов в макрофагах.
В патентной заявке WO 2004/031368 A1 описаны штаммы Lactobacillus, которые были отобраны по их способности снижать уровень воспаления желудочно-кишечного тракта, ассоциированного с инфекцией H. pylori у млекопитающих, с помощью анализа на TNF-α-активность мышиных макрофагов.
В патентной заявке US 20040057943 A1 описан способ отбора новых пробиотических штаммов L. coryniformis, L. salivarius, L. acidofilus, L. gasseri и L. fermentum, обладающих способностью выживать в грудном молоке и в амниотической жидкости.
S. Menard с сотрудниками (2003) провели исследования, чтобы определить, секретируют ли молочнокислые бактерии метаболиты, которые сохраняют противовоспалительные свойства после их транспорта в тонкий кишечник. Для того, чтобы определить, связывается ли ЛПС с ЛПС-связывающимся белком (ЛСБ) перед тем, как ЛПС-ЛСБ сможет распознать рецептор CD14, был проведен анализ на связывание ЛПС с про-моноцитами ТНР-1 в присутствии кондиционированной бактериями среды (КС). Уровень связывания измеряли с помощью проточной цитометрии. Было показано, что среда, кондиционированная бактериями Bifidobacterium и Streptococcus thermofilus, полностью ингибирует LDB-зависимое связывание ЛПС с клетками THP-1 путем высвобождения метаболитов, обладающих анти-TNF-α эффектом и способных пересекать барьер тонкого кишечника.
Хотя известно, что способности некоторых молочнокислых бактерий снижать воспаление, включая воспаление желудочно-кишечного тракта, являются различными, однако до сих пор не было известно, что эти различия могут быть более успешно предсказаны с использованием модели, созданной на основе человеческих клеток, и что такая модель является предпочтительной для отбора указанных штаммов по их потенциальному действию у человека.
Поэтому целью настоящего изобретения является получение штаммов молочнокислых бактерий, которые были отобраны с использованием человеческих клеточных линий по их способности снижать уровень воспаления, такого как воспаление, ассоциированное с ВЗК. Другой целью настоящего изобретения является получение продуктов, содержащих указанные штаммы, включая агенты, предназначенные для лечения или профилактики воспаления, ассоциированного, например, с ВЗК, а также кондиционированные среды, в которых могут быть культивированы указанные штаммы и их белоксодержащие экстракты, в целях их введения человеку и другим млекопитающим. Таким образом, настоящее изобретение предназначено для лечения воспаления при ВЗК, которое приводит к поражению ткани, такому как язва, и к обострению указанного заболевания у пациента.
Другие цели и преимущества настоящего изобретения будут более очевидны из описания изобретения и прилагаемой формулы изобретения.
Описание сущности изобретения
Настоящее изобретение относится к новым штаммам молочнокислых бактерий, отобранных по их способности снижать степень воспаления, такого как воспаление, ассоциированное с заболеванием тонкого кишечника; к способу отбора таких штаммов; и к продуктам, содержащим указанные штаммы.
Краткое описание графического материала
На фиг.1 представлена гистограмма, иллюстрирующая влияние Lactobacillus-кондиционированной среды на продуцирование TNF-α ЛПС-активированными моноцитами. Три штамма и контроль инкубировали в течение 24 часов.
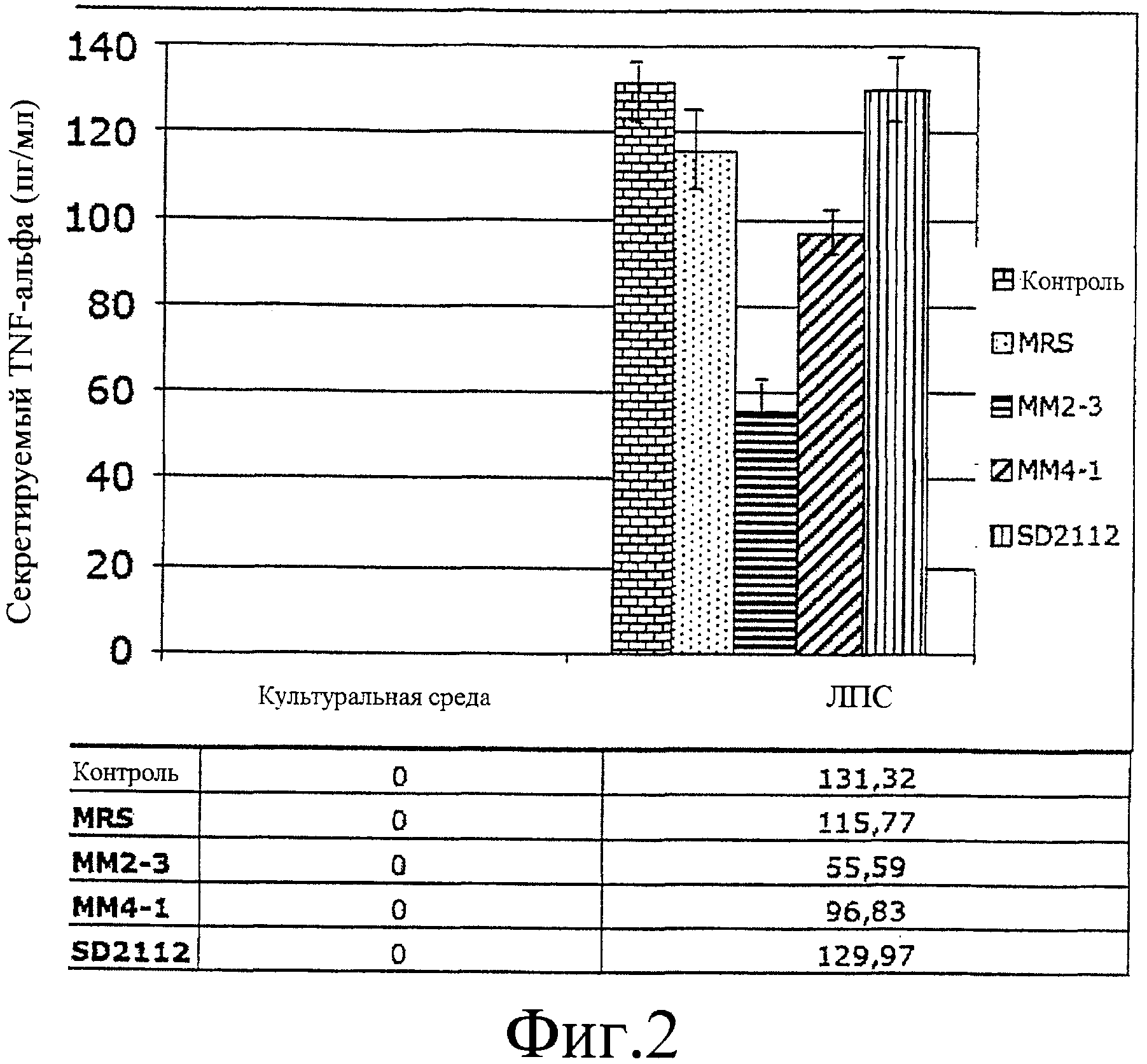
На фиг.2 представлена гистограмма, иллюстрирующая влияние Lactobacillus-кондиционированной среды на продуцирование TNF-α ЛПС-активированными моноцитами. Три штамма и контроль инкубировали в течение 9 часов.
На фиг.3 представлена гистограмма, иллюстрирующая влияние Lactobacillus-кондиционированной среды на ингибирование продуцирования TNF-α ЛПС-активированными первичными моноцитами. Были использованы первичные моноциты, взятые у пациентов с БК в фазе ремиссии (БК-рем) и с активной формой БК (БК-акт). Эти штаммы и контроль инкубировали в течение 24 часов.
На фиг.4 представлена гистограмма, иллюстрирующая влияние Lactobacillus-кондиционированной среды на продуцирование TNF-α ЛПС-активированными первичными моноцитами. Были использованы первичные моноциты, взятые у пациентов с активной формой БК. Указанные штаммы и контроль инкубировали в течение 24 часов.
Подробное описание настоящего изобретения и предпочтительных вариантов его осуществления
В настоящем изобретении описаны штаммы молочнокислых бактерий, которые были отобраны по их способности снижать уровень воспаления, такого как воспаление, ассоциированное с ВЗК. Такими штаммами являются штаммы ММ4-1А, АТСС РТА-6475 Lactobacillus reuteri. Продукты, такие как пищевые продукты, питательные добавки и препараты, а также фармацевтические средства или медицинские устройства, содержащие целые клетки или компоненты, происходящие от указанных штаммов, могут быть изготовлены методом, известным специалистам, и, как известно, они обычно включают носитель, подходящий для приема вовнутрь, и штамм Lactobacillus или происходящий от него компонент. При получении вышеуказанных препаратов могут быть также использованы уже известные штаммы, которые, как было установлено, обладают хорошей способностью снижать уровень TNFα, а именно такие штаммы, как GG L. rhamnosus АТСС 53103, ММ2-3 L. Reuteri, АТСС РТА-4659 и т.п.
Для определения факторов, снижающих или повышающих уровень воспаления, применяются системы-модели, в которых используются соответствующие цитокины. В настоящем изобретении применяется анализ, проводимый с использованием человеческих клеток.
Клетки ТНР-1 представляют собой человеческую моноцитарную клеточную линию, выделенную у пациента с лейкозом и хранящуюся в Американской коллекции типовых культур. Эти клетки были выделены у человека, что делает их особенно ценными для проведения исследований по взаимодействию человеческой иммунной системы желудочно-кишечного тракта с человеческими бактериями-комменсалами.
В настоящем изобретении приводятся данные, указывающие на эффективное ингибирование продуцирования TNFα конкретными штаммами L. reuteri ATCC PTA 4659 и L. reuteri ATCC PTA 6475 и на то, что такое ингибирование опосредуется веществом, высвобождаемым в культуральную среду этими двумя конкретными штаммами на поздней логарифмической/стационарной фазе роста. В противоположность этому, два других штамма L. reuteri не только неспособны ингибировать воспалительный ответ клеток на токсин E.coli, но также сами индуцируют такой воспалительный ответ. Неожиданно было обнаружено, что эти штаммы L. reuteri ATCC PTA 4659 и L. reuteri ATCC PTA 6475 обладают потенциальными противовоспалительными свойствами, которые ранее не были предсказаны.
Для подтверждения потенциальной клинической ценности этих данных были проведены дополнительные исследования на клетках, выделенных из крови пациентов с воспалительным заболеванием кишечника, а в частности с болезнью Крона (БК).
Для исследования взаимодействий молочнокислых бактерий и иммунных клеток слизистой авторами настоящего изобретения в качестве модели были выбраны дифференцированные макрофаги, поскольку считается, что они являются лучшей моделью, чем недифференцированные моноциты. Такие дифференцированные макрофаги, вероятно, имеют большее сходство с клеточной популяцией макрофагов in vivo в желудочно-кишечном тракте, отвечающих на присутствие молочнокислых бактерий и вызывающих регуляторные или воспалительные изменения в природной иммунной системе хозяина. Так, например, продуцирование про-воспалительного интерлейкина-8 клетками ТНР-1 в ответ на присутствие эндотоксинов заметно повышается после индуцирования дифференцировки этих клеток (Baqui et al., 1999), а после осуществления такой дифференцировки также значительно повышается уровень продуцирования TNF-α этими клетками (Klegeris et al., 1997).
Отличительные признаки настоящего изобретения будут более очевидны из описания нижеследующих примеров, которые не должны рассматриваться как ограничение объема изобретения.
Пример 1. Отбор противовоспалительных штаммов
Клетки ТНР-1 инкубировали вместе с контрольной средой или с кондиционированной средой (L-CM), полученной после культивирования отобранных штаммов L. reuteri, L. reuteri ATCC PTA 4659, L. reuteri ATCC PTA 6475, L. reuteri ATCC 55730 и L. reuteri CF48-3A. Кондиционированные среды (L-CM) представляют собой бесклеточные супернатанты, полученные после 9-часового или 24-часового культивирования каждой из культур L. reuteri. Клетки THP-1 стимулировали либо контрольной средой, либо липосахаридами (ЛПС), происходящими от E.coli (которые вызывают продуцирование TNF-α в виде обычного воспалительного ответа), путем инкубирования в течение 3,5 часов, после чего эти клетки удаляли и супернатанты анализировали на уровни TNF-α с помощью ELISA.
Материалы
Моноцитарная клеточная линия лейкоза ТНР-1 (ATCC, cat.№ TIB202);
Среда RPMI 1640 (Gibco-Invitrogen);
Фетальная бычья сыворотка (Gibco-Invitrogen);
Раствор пенициллина-стрептомицина (Sigma);
Липополисахарид E.coli серотипа О127: В8 (Sigma, cat.№ L3137);
Набор для проведения ELISA человеческих TNF-альфа/TNF-SFII DuoSet (R&D Systems, cat.№ DY210).
Метод
Использовали моноцитарную клеточную линию ТНР-1. Затем в соответствующие лунки добавляли 5% (об/об) среды MRS и 5% (об/об) Lactobacillus-кондиционированной среды. Lactobacillus-кондиционированная среда представляет собой супернатант, полученный в результате 24-часового культивирования бактерий Lactobacillus spp. в среде MRS. Затем рН кондиционированной среды корректировали путем скоростной вакуумной сушки и осадок ресуспендировали в равном объеме культуральной среды. Хотя для минимизации испарения жидкости была встроена увлажняющая камера, однако после инкубирования в течение 48 часов объем клеточной суспензии в 24-луночных планшетах снижался примерно до 475 мкл.
В соответствующие лунки добавляли 100 нг/мл липополисахарида E.coli серотипа О127:В8. Затем смесь инкубировали при 37°С в камере с повышенной влажностью при 5% СО2. После инкубирования в течение 3,5 часа культуры собирали в 1,5-миллилитровые центрифужные пробирки. Затем проводили центрифугирование при 1500 об/мин в течение 5 минут при 4°С. После этого собирали супернатанты.
Затем проводили анализ на экспрессию цитокинов с помощью ELISA (набора для количественной оценки человеческих TNF-альфа/ TNF-SFII DuoSet).
В качестве культуральной среды использовали 10% FBS, 2% раствор пенициллина-стрептомицина в среде RPMI.
Результаты примера 1
Инкубирование клеток THP-I с 24-часовой средой L-CM, полученной от штаммов L. reuteri ATCC PTA 4659 и L. reuteri ATCC PTA 6475, в отсутствии ЛПС, не приводило к продуцированию TNFα в среде для инкубирования (фиг.1). Неожиданно было обнаружено, что cреда L-CМ, полученная от штаммов L. reuteri ATCC 55730 и L. reuteri CF48-3A, стимулировала продуцирование TNFα клетками ТНР-1 на уровнях, аналогичных уровням, наблюдаемым при использовании только одного ЛПС. Таким образом, штаммы L. reuteri отличаются друг от друга по своей способности стимулировать продуцирование провоспалительных TNFα покоящимися моноцитами ТНР-1.
Добавление ЛПС в клетки ТНР-1 в отсутствие L-CM приводило к продуцированию 138 пг/мл TNFα в процессе инкубирования в течение 3,5 часов. Этот результат является ожидаемым воспалительным ответом клеток ТНР-1 на токсин. Добавление культуральной среды (MRS), которую использовали в качестве контроля в случае добавления L-CM, приводило к продуцированию 132 пг/мл TNFα, и, таким образом, было обнаружено, что MRS не влияет на ЛПС-стимулируемый ответ. Добавление 24-часовой среды L-CM от штамма L. reuteri ATCC PTA 4659 или штамма L. reuteri ATCC PTA 6475 приводило к резкому снижению уровней ЛПС-стимулируемых TNF-α вплоть до 14 и 10 пг/мл соответственно. Это означает, что такое ингибирование продуцирования ЛПС-стимулированного TNF-α составляет 89% и 92% соответственно. В противоположность этому, в присутствии 24-часовой среды L-CM от штамма L. reuteri ATCC 55730 и штамма L. reuteri CF48-3A, ЛПС все еще обладал способностью значительно повышать уровень продуцирования TNF-α, в отличие от уровней, наблюдаемых в отсутствии ЛПС. Несмотря на присутствие среды L-CM, полученной от штамма L. reuteri ATCC 55730 и от штамма L. reuteri CF48-3A, уровень продуцирования ЛПС-стимулированного TNFα повышался на 50% и 38% соответственно.
Аналогичные эксперименты, проведенные с использованием 9-часовой среды L-CM от штамма L. reuteri ATCC PTA 4659 или штамма L. reuteri ATCC PTA 6475, показали, что их действие, направленное на ингибирование продуцирования ЛПС-стимулированного TNF-α, значительно снижалось (на 52% и 16% соответственно; фиг.2), но все еще оставалось в пределах нормы. Таким образом, более длительное инкубирование штаммов L. reuteri с последующим сбором L-CM в поздней логарифмической/стационарной фазе роста давало лучший эффект в отношении ингибирования продуцирования TNF-α.
Пример 2: Препараты для негативного отбора на моноциты
Набор для выделения моноцитов II (Miltenyi Biotec, Inc. 12740 Earhart Avenue, Auburn, CA 95602 (800) 367-6227; http://www.miltenyibiotec.com/index.php?, порядковый номер 130-091-153) представляет собой систему непрямого магнитного мечения для выделения интактных моноцитов из мононуклеарных клеток человеческой периферической крови (МКПК). Немоноцитарные клетки, т.е. Т-клетки, В-клетки, NK-клетки, дендритные клетки и базофилы, подвергали непрямому магнитному мечению с использованием смеси конъюгированных с биотином антибиотиков против CD3, CD7, CD16, CD19, CD56, CD123 и гликофорина A, а также микросфер, покрытых антителом против биотина. Между двумя стадиями мечения не требовалось проведения стадий промывки. Уровень подвергнутых магнитному мечению клеток, не являющихся моноцитами, снижали путем их удерживания на колонке MACS® в магнитном поле сепаратора MACS, а немеченные моноциты проходили через эту колонку. Выделение относительно более высокого уровня немеченных моноцитов достигалось путем снижения уровня клеток, подвергнутых магнитному мечению. Уровень такого обогащения может быть проанализирован или подтвержден с помощью проточной цитометрии.
Данные о наборах: набор для выделения моноцитов II (порядковый номер 130-091-153). Состав набора: FcR-блокирующий реагент (1 ml); смесь конъюгированных с биотином антител (1 мл); микросферы, покрытые антителом против биотина (2 мл); материалы и оборудование, не поставляемые с набором: 15-миллилитровые центрифужные пробирки Corning; центрифуга, снабженная холодильником; пипетки и наконечники для пипеток; набор пипеток для взятия сыворотки и наконечники для этих пипеток; таймер; колонка Miltenyi Biotec MACS® MS; магнит Miltenyi Biotec MACS®; подставка для колонки Miltenyi Biotec MACS®; гемоцитометр Hausser Scientific Bright-Line; рабочий буфер (РБ): стерильный 1Х забуференный фосфатом физиологический раствор (PBS, pH 7,4, Gibco, номер по каталогу 10010023) + 0,5% альбумин бычьей сыворотки (BSA, Panvera, номер по каталогу P2489) + 2 мМ этилендиаминтетрауксусная кислота (EDTA, Gibco, номер по каталогу 15553-035).
Метод (набор для выделения моноцитов II)
Клеточную плотность определяли путем подсчета клеток на гемоцитометре. Затем клеточную суспензию переносили в 15-миллилитровую коническую пробирку Corning. Клетки осаждали при скорости 300 об/мин в течение 10 минут при 4°С. Супернатант удаляли с использованием 10-миллилитровой пипетки для взятия сыворотки. Клеточный осадок ресуспендировали в 30 мкл РБ на 107 всех клеток. Затем добавляли 10 мкл FcR-блокирующего реагента на 107 всех клеток. После этого добавляли 10 мкл смеси конъюгированных с биотином антител на 107 всех клеток. Содержимое лунок перемешивали и инкубировали в течение 10 минут при 4-8°С. Затем добавляли 30 мкл РБ на 107 всех клеток. После этого добавляли 20 мкл микросфер, покрытых антителом против биотина, на 107 всех клеток. Содержимое лунок перемешивали и инкубировали еще 15 минут при 4-8°С. Клетки промывали путем добавления 10-20 Х объема РБ для мечения. Затем клетки центрифугировали при 300 об/мин в течение 10 минут при 4°С. Супернатант удаляли с использованием 2-миллилитровой пипетки для взятия сыворотки. Клеточный осадок ресуспендировали в 500 мкл РБ на 108 клеток. Колонку MACS MS помещали на магнит.
Колонку промывали 500 мкл РБ. Клеточную суспензию загружали на колонку. Затем ее сливали в пробирку для сбора образцов (~4 мин/мл). Колонку промывали 3·500 мкл РБ и жидкость сливали в ту же самую пробирку-сборник.
Захваченные клетки элюировали в другую пробирку-сборник путем подсоединения колонки к другой пробирке, а затем в колонку пипеткой вводили 1 мл РБ, и клетки интенсивно промывали путем подачи положительного давления поршнем, которым была снабжена колонка. Скорость потока составляла 2 секунды/дюйм.
Процедуры, описанные в данном протоколе, следует проводить быстро и, при этом, следует использовать только холодные растворы. При обработке на льду время инкубирования для микросфер MACS должно быть увеличено. Инкубирование проводят в холодильнике при 4-8°С. Буферы или среды не должны содержать Ca2+ или Mg+. BSA может быть заменен другими белками, такими как желатин, альбумин человеческой сыворотки или фетальная телячья сыворотка. Тип используемого антикоагулянта не имеет важного значения для данного протокола. Более высокие температуры и более длительные периоды инкубирования могут приводить к неспецифическому мечению клеток.
Пример 3. Биоанализ на первичные моноциты
Первичные человеческие моноциты выделяли из крови пациентов с болезнью Крона (БК) в фазе активного воспаления (БК-акт) или в фазе ремиссии (БК-рем), при которой интенсивность симптомов воспаления снижается. У пациентов с БК брали кровь и выделяли мононуклеарные клетки периферической крови. Обогащение периферической крови моноцитами проводили методом, описанным в примере 2. Суспензии этих клеток оставляли на 48 часов при 37°С в камере с повышенной влажностью и с 5% CO2 для дифференцировки клеток. После этой процедуры клетки превращались в макрофаги. Затем к моноцитам периферической крови или к дифференцированным макрофагам добавляли культуральную среду (контроль) или L-СМ, и клетки стимулировали либо контрольной средой, либо ЛПС E.coli, а затем инкубировали в течение 3,5 часов. После этого проводили анализ на уровень продуцирования TNFα в супернатантах, полученных после такого инкубирования. Были использованы следующие материалы: первичные моноциты периферической крови; среда RPMI 1640 (Gibco-Invitrogen); фетальная бычья сыворотка (Gibco-Invitrogen); раствор пенициллина-стрептомицина (Sigma); липополисахарид E.coli серотипа O127:B8 (Sigma, номер по каталогу L3137); транс-ретиноевая кислота (CalBioChem, номер по каталогу 554720); набор для проведения ELISA человеческих TNF-альфа/TNF-SFII DuoSet (R&D Systems, номер по каталогу DY210).
Моноциты периферической крови выделяли, как описано в протоколах, а именно в протоколе выделения мононуклеарных клеток периферической крови (как описано в примере 2) и в протоколе негативного отбора на моноциты (как описано в примере 2). Среду для суспендирования клеток (PBS) заменяли средой для культивирования клеток (10% FBS, 2% раствор пенициллина-стрептомицина в RPMI 1640).
Клетки разводили до 1,0·105 клеток/мл. В каждую лунку 24-луночного микротитрационного планшета добавляли 500 мкл клеточной суспензии. Затем клетки помещали на 48 часов при 37°С в камеру с повышенной влажностью с 5% CO2 для дифференцировки клеток. После этого начинали биоанализ. В соответствующие лунки добавляли 5% (об/об) среды MRS и 5% (об/об) Lactobacillus-кондиционированной среды. Lactobacillus-кондиционированная среда представляет собой супернатант, полученный от 24-часовой культуры Lactobacillus sp. в среде MRS. Затем рН кондиционированной среды корректировали путем скоростной вакуумной сушки, и осадок ресуспендировали в равном объеме культуральной среды. Хотя для минимизации испарения жидкости была встроена увлажняющая камера, однако, после инкубирования в течение 48 часов, объем клеточной суспензии в 24-луночных планшетах снижался примерно до 475-485 мкл. В соответствующие лунки добавляли 100 нг/мл липополисахарида E.coli серотипа О127:В8. Затем смесь инкубировали при 37°С в камере с повышенной влажностью и с 5% СО2. После инкубирования в течение 3,5 часов, культуры собирали в 1,5-миллилитровые центрифужные пробирки. Затем проводили центрифугирование при 1500 об/мин в течение 5 минут при 4°С. После этого собирали супернатанты. Затем проводили анализ на экспрессию цитокинов с помощью ELISA (набора для количественной оценки человеческих TNF-альфа/TNF-SFII DuoSet).
Результаты примера 3
В первичных моноцитах, выделенных у пациентов с БК в стадии ремиссии, ЛПС вызывали ожидаемое увеличение уровня TNFα, и такое увеличение может быть ингибировано на 43% в присутствии среды L-CM от L. reuteri ATCC PTA 6475. В первичных моноцитах, выделенных у пациентов с активной формой БК, уровень продуцирования ЛПС-стимулированного TNFα был несколько выше и ингибировался на том же уровне в присутствии L-CM от L. reuteri ATCC PTA 6475 (фиг.3).
По сравнению с контролем (среда) уровень продуцирования TNFα в ответ на действие ЛПС в дифференцированных макрофагах, происходящих от первичных моноцитов, выделенных у пациентов с активной формой БК, значительно ингибировался, а именно на 50% в присутствии L-CM от L. reuteri ATCC PTA 4659 и на 60% в присутствии L-CM от L. reuteri ATCC PTA 6475 (фиг.4). Данные, полученные для клеток THP-1, подтвердили, что среды L-CM, полученные от штаммов L. reuteri ATCC 55730 и L. reuteri CF48-3A, были неспособны ингибировать продуцирование TNFα, и наоборот, способствовали увеличению уровня продуцирования TNFα на 22% и на 30% соответственно по сравнению с соответствующим контролем (фиг.4).
Эти данные неожиданно показали, что различные штаммы от L. reuteri оказывают различное действие на продуцирование TNFα моноцитами и дифференцированными макрофагами, и что штаммы L. reuteri ATCC PTA 4659 и L. reuteri ATCC PTA 6475 являются особенно подходящими для их использования в целях лечения заболеваний желудочно-кишечного тракта у человека, страдающего воспалительным заболеванием кишечника.
Пример 4. Использование кондиционированной среды
В соответствии с методом, описанным в примере 1, кондиционированной средой, выбранной для осуществления этого эксперимента, была среда, полученная от одного штамма, эффективно снижающего уровень TNFα, а именно от L. reuteri ATCC PTA-4659. Эта среда была получена в большом количестве путем культивирования штамма в среде de Man, Rogosa, Sharpe (MRS) (Difco, Sparks, MD). Ночные культуры молочнокислых бактерий разводили до OD600= 1,0 (оптической плотности, соответствующей примерно 109 клеток/мл), а затем разводили 1:10 и культивировали еще 24 часа. Кондиционированную среду, не содержащую бактериальных клеток, собирали путем центрифугирования при 8500 об/мин в течение 10 минут при 4°С. Кондиционированную среду отделяли от клеточного осадка, а затем фильтровали через фильтрующее устройство с размером пор 0,22 мкм (Millipore, Bedford, Mass.). После этого кондиционированную среду лиофилизовали и составляли композицию, из которой затем, стандартными методами, изготавливали таблетки. Эти таблетки использовали в качестве лекарственных средств для эффективного лечения язвы у человека, вызываемой ВЗК.
Пример 5. Использование выбранных противовоспалительных штаммов Lactobacillus reuter
В соответствии с методом, описанным в примере 1, кондиционированной средой, выбранной для осуществления этого эксперимента, была среда, полученная от одного штамма, эффективно снижающего уровень TNFα, а именно L. reuteri ATCC PTA-4659. После этого штамм L. reuteri лиофилизовали и составляли композицию, из которой затем, стандартными методами, изготавливали капсулы. Эти капсулы использовали в качестве лекарственных средств для эффективного снижения уровня воспаления слизистой у пациентов с ВЗК.
Пример 6. Характеристика белка, продуцируемого эффективными штаммами Lactobacillus
Различные эффективные Lactobacillus-кондиционированные среды, включая среды, кондиционированные штаммами L. reuteri ATCC PTA 4659 и L. reuteri ATCC PTA-6475, обрабатывали различными денатурирующими соединениями для определения природы предполагаемых иммуномодулинов, происходящих от указанных бактерий. Так, например, кондиционированные среды подвергали нескольким циклам замораживания-оттаивания, термообработки, гидролиза ДНК-расщепляющими ферментами, протеазами и инактивированными протеазами. Таким образом, предполагаемый иммуномодулин был идентифицирован как один или несколько природных белков или пептидов. Для определения размера предполагаемого белка иммуномодулина кондиционированную среду фракционировали путем фильтрации, и полученные фильтраты тестировали на их эффективность. Таким образом, было обнаружено, что размер активного компонента кондиционированной среды, полученной от эффективных штаммов Lactobacillus, составлял приблизительно 5 кДа или менее.
Хотя настоящее изобретение описано на конкретных вариантах его осуществления, однако очевидно, что в него могут быть внесены различные изменения, модификации и варианты, и все такие изменения, модификации и варианты не выходят за рамки существа и объема настоящего изобретения.
Пример 7. Получение ферментированного молока.
Ферментированное молоко может быть получено с использованием следующих стадий.
Вариант а):
- стандартизация жира и твердого составляющего молока;
- гомогенизация молока, обезжиренного молока и лиофилизированного штамма (108 кое/г) - приблизительно 0,1 г на 1 кг молока, для достижения оптимальных физических свойств продукта;
- нагревание с последующей стадией гомогенизации;
- охлаждение,
- упаковка и хранение.
Вариант б):
- штамм выращивают и лиофилизируют, используя стандартные для пищевой промышленности способы, подходящие для выращивания Lactobacillus;
- культуру вносят в предварительно ферментированное молоко, используя стандартные йогуртные культуры, например йогуртные культуры с концентрацией 107 кое/г;
- гомогенизирование, упаковка и хранение.
Вариант в):
- смешивание масла триглицеридовых жирных кислот средней цепи и подсолнечного масла с диоксидом кремния в смесителе Больцмана;
- гомогенизирование;
- вакуумная сушка смеси при давлении 10 мбар;
- добавление порошка L. Reuteri, (предпочтительно лиофилизированного), количество зависит от конечного продукта, однако для примера количество составляет 0,2 кг культуры с 1011 кое/г;
- смешивание;
- перенос суспензии в стеклянный сосуд и обработка азотом;
- наполнение бутылок.
Пример 8. Получение фармацевтических продуктов.
Вариант а):
Пробиотические культуры подходят для введения в дозе 108 кое/г в каплях на основе коммерчески доступного масла из триглицеридов со средней длиной цепи или масла подсолнечника (согласно способу в примере 7).
Вариант б):
Лиофилизированный бактериальный порошок можно помещать в стандартные капсулы из желатина или целлюлозы. Стадии производства зависят от требуемого продукта и особенностей технологии используемой в каждом случае.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению штаммов молочнокислых бактерий, и может быть использовано в медицине. Получают штамм молочнокислой бактерии Lactobacillus reuteri АТСС РТА-6475. Полученный штамм или кондиционированную среду после его культивирования используют для лечения воспаления при воспалительном заболевании кишечника. Изобретение позволяет получить эффективное средство для лечения воспалительных заболеваний кишечника. 7 н.п. ф-лы, 4 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ улучшения здоровья животных

Комментарии