Устройство для лечения дерматологических состояний - RU2388504C2
Код документа: RU2388504C2
Чертежи




Описание
Область техники
Это изобретение относится к ультразвуковым устройствам для доставки, способам и композициям для местного применения для воздействия на кожу, в частности для лечения косметических состояний кожи и улучшения внешнего вида поврежденной солнцем и/или стареющей кожи; изобретение дополнительно относится к применению такого устройства и композиций в способах лечения кожи, которые могут включать в себя применение ультразвука.
Предпосылки создания изобретения
Кожа представляет собой потенциальный путь доставки фармацевтических или косметически активных средств в организм. Однако считается, что кожа не всегда является эффективным путем доставки вследствие низкой проницаемости рогового слоя и эпидермиса в целом. Традиционно местное применение фармацевтических терапевтических средств было нацелено на локальные дерматологические области. Позже методы чрескожной доставки применялись для системных целей, тем более, что этот путь минует печеночный барьер, где может происходить разрушение активных веществ.
Ультразвук может применяться для доставки молекул внутрь кожи. Когда ультразвук применяется в этом контексте, он называется "сонофорез". Ультразвук, применяемый на коже, имеет два главных эффекта. Сначала в результате быстро осциллирующего поля давления возникает кавитация, вызывающая образование и сжатие пузырьков, которые механически создают каналы в роговом слое. Второй эффект представлен прямым нагреванием вещества, через которое проходят ультразвуковые волны, вследствие затухания акустической энергии за счет отражения, поглощения и рассеяния. В коже это происходит более чем в четыре раза интенсивнее по сравнению с другими тканями вследствие ее гетерогенности. Известно, что нагревание приводит к разрыву системы липидного бислоя в роговом слое, также способствуя повышенной проницаемости эпидермиса. Некоторые факторы могут влиять на нагревающую способность ультразвука, включая:
(i) применение ультразвука в непрерывном вместо пульсового режима,
(ii) удлинение времени экспозиции,
(iii) фокусировка ультразвука вместо несфокусированного применения,
(iv) избежание применения гелей на водной основе, которые используются для снижения степени отражения,
(v) применение ультразвука с более высокой плотностью выделения энергии,
(vi) применение ультразвука к тканям, непосредственно прилежащим к кости.
Было показано, что с применением ультразвука диффузия низкомолекулярных молекул через изолированный эпидермис повышается в 2-5000 раз in vitro и до 1700 раз в теоретических исследованиях. Даже лекарственные препараты с большим размером молекул, такие как инсулин и гепарин, эффективно доставлялись, когда ультразвук применялся в течение 15 минут с частотой 20 кГц. В одном исследовании in vitro было обнаружено, что молекулы поли-L-лизина вплоть до 51 кДа могли бы доставляться при помощи ультразвука с частотой 20 кГц и интенсивностью в диапазоне от 2 до 50 Вт/см2. В качестве объяснения этого повышения проницаемости некоторые исследования сообщали скорее об увеличении количества пор, чем об увеличении диаметров отдельных пор (28±12Ǻ). Однако термин "сономакропорация" был предназначен для определенного ультразвука, который действительно вызывает в большей степени образование пор.
Проницаемость кожи повышается посредством разрыва межклеточных липидов путем нагревания и/или механического воздействия и путем повышения пористости. Сообщалось о повышении температуры от 6°С (1 МГц, 0,25 Вт/см2) до 50°С (20 кГц, 10-30 Вт/см2), но было показано, что подъемы уже на 11°С (1 МГц, 2 Вт/см2) вызывают повреждение кожи. Непрерывный режим воздействия ультразвука при интенсивности от 1 Вт/см2 через 10 минут повышает температуру тканей на глубину 3 см до 40°С. Для меньших молекул, таких как маннит, улучшение проникновения через кожу происходит, когда ультразвук применяется в качестве предварительного воздействия или одновременно с применением молекулы; тогда как для больших молекул, таких как инсулин, повышение проницаемости было зафиксировано только в течение применения ультразвука.
Ультразвук может применяться для улучшения чрескожной доставки лекарств. WO 99/34857 сообщает о чрескожной доставке различных активных веществ с применением плотности энерговыделения меньшей, чем 20 Вт/см2, предпочтительно менее 10 Вт/см2; применяемой частотой меньшей, чем 2,5 МГц, предпочтительно меньшей, чем 2 МГц, предпочтительно меньшей, чем 1 МГц, наиболее предпочтительно 20-100 кГц; экспериментальные данные in vivo при исследованиях на крысах были получены с применением частоты 20 кГц и плотности энерговыделения 1 или 1,5, или 7 Вт/см2.
US 4767402 описывает чрескожную доставку лекарств с применением ультразвука при плотности энерговыделения 0-3 Вт/см2, предпочтительно 0,5-1,5 МГц, и рекомендует, что по мере того, как плотность энерговыделения уменьшается, частоту также следует снизить. В примере приведена плотность энерговыделения 1-2 Вт/см2при частоте 870 кГц.
Косметологические воздействия, которые имеют своей целью улучшение качества кожи, также затрудняются барьерной функцией эпидермиса и в особенности наружного рогового слоя. Эпидермис обеспечивает значительный механический и химический барьер для переноса раствора вследствие бислоя из липидов и ороговевших клеток. Также эпидермис и дерма имеют значительную ферментативную активность, которая обеспечивает биохимическую защиту для нейтрализации применяемых ксенобиотиков и которая сравнима с биохимической защитой печени в пересчете активность на единицу объема. Дополнительно известно, что молекулярная масса активных веществ является важной для определения их свойства диффундировать через кожу. Известно, что диффузия веществ с молекулярной массой приблизительно 500 Да и выше является неэффективной. Способы и устройство, использующие ультразвук, были описаны для применения в косметологии и в медицинских воздействиях. US 6113559 раскрывает способ и устройство для уменьшения морщин посредством применения сфокусированного ультразвукового пучка (плотность энерговыделения ультразвука 100-500 Вт/см2, частота 1-500 МГц) на участке кожи таким образом, чтобы энергия, доставленная в дермальный слой, была достаточной для нагревания тканей с целью стимуляции или раздражения дермального слоя, вызывающих изменения в дермальном слое, которые приводят к изменениям гладкости эпидермального слоя.
Ультразвуковая терапия для лечения целлюлита хорошо известна, и применение энергии ультразвуковой волны было признано в целом эффективным для разрушения подкожной жировой ткани. В качестве примера ЕР 0695559 относится к многофункциональному оборудованию для лечения целлюлита, которое может включать источники ультразвуковых колебаний для применения, например, на бедрах человека. Однако пригодные плотности энерговыделения и частоты не рассматриваются. GB 2303552 раскрывает ультразвуковое устройство, пригодное для неинвазивного уменьшения целлюлита. Ультразвуковые устройства применяют для ультразвукового воздействия на целлюлит при заранее определенной частоте приблизительно 3,3 МГц и обычной плотности энерговыделения 2,8 Вт/см2, причем 50% энергии поглощается на глубине от 1,27 см до 2,54 см ниже поверхности тела.
US 6030374 раскрывает способ улучшения транспорта активного вещества через кожу посредством экспозиции кожи ультразвуком и применения активного вещества на коже путем инъекции. Активный агент может применяться для уменьшения проявлений целлюлита. Для низкочастотного ультразвука применяется частота ультразвуковых колебаний от 25 кГц до 3 МГц при плотности энерговыделения 0,5-2,0 Вт/см2; для ультразвука с более высокой частотой применяют частоту от 3 МГц до 16 МГц при плотности энерговыделения 0,2-1,0 Вт/см2.
US 5665053 относится к кожному массажеру, имеющему генераторы ультразвука, которые избирательно контролируются оператором. Раскрытый очень низкочастотный длинноволновый ультразвук, от 10 до 40 кГц, лежит в диапазоне, обычно определяемом как разрушающий ультразвук, который может повреждать клетку, и, следовательно, не пригоден для повсеместного применения по причине безопасности, за исключением применения при очень низких уровнях энергии.
US 5507790 раскрывает устройство для фокусирования энергии ультразвука таким образом, чтобы температура участка в слое подкожной жировой ткани пациента повышалась до уровня от 40,0 до 41,5°С, для повышения скорости местных реакций липолиза жировой ткани. Устройство включает ультразвуковой преобразователь, который поставляет энергию ультразвука нераскрытой частоты и при нераскрытой плотности энерговыделения на фокусирующий элемент.
WO 99/56829 раскрывает ультразвуковые повязки и повязки с системой излучателей ультразвука, которые считаются пригодными для ускорения заживления ран посредством расположения ультразвуковых повязок и повязок с системой излучателей ультразвука близко к ране и генерации ультразвуковых импульсов.
WO 99/48621 описывает гибкие пьезоэлектрические излучающие ультразвук элементы с большой площадью, и системы таких излучающих элементов имеют достаточную гибкость для повторения контуров анатомических образований человека, например бедра, позвоночника.
Чтобы являться эффективным, лечение косметических состояний кожи, таких как старение кожи и повреждения в результате действия солнца, должно обеспечивать доставку активных веществ на глубину, по меньшей мере, верхнего (сосочкового) слоя дермы и, следовательно, должно использовать механизм для преодоления этого эффективного физического и биохимического барьера, даже когда он поврежден с возрастом.
Повреждение кожи человека вследствие естественного и "истинного" старения характеризуется множеством симптомов. Такие симптомы включают истончение и эпидермиса, и дермы, уплощение их соединения, медленное заживление ран, плохую терморегуляцию и сниженную иммунную функцию вследствие ухудшения ассоциированных механических свойств, таких как сопротивление разрыву, эластичность и барьерная функция. Внешний вид также ухудшается, приводя к шероховатому, морщинистому и сухому виду кожи наряду с неравномерной пигментацией. В большинстве случаев старение кожи не имеет большого медицинского значения, за исключением таких случаев, как замедленное заживление ран, которое делает возможным инфекцию и дисфункцию.
Заметное повреждение кожи с возрастом является следствием сочетания некоторых изменений, которые происходят более или менее одновременно. Это повреждение может ускоряться особенностями образа жизни, такими как курение и загар. Заметные видимые изменения включают: обвисание кожи, неровную структуру кожи, депигментацию, тусклый цвет лица и общую потерю сияния. Появление морщин или образование складок является, вероятно, симптомом, наиболее часто связанным со старением кожи и, как известно, вызывается изменением типа и распределения белков межклеточного вещества и протеогликанов. Аналогично функции кожи, которые с возрастом ослабевают, включают: замену клеток, иммунное распознавание, чувствительное восприятие, ответ на повреждение, сосудистую реактивность, выработку витамина Д, барьерную функцию, терморегуляцию, выработку кожного сала, химическое очищение, потообразование и механическую защиту. Также могут наблюдаться изменения рН (от 4,5 до 5).
Старение кожи характеризуется снижением толщины эпидермиса и пролиферацией вместе с уплощением структуры сети папиллярных линий. Наблюдаемое утончение может быть связано с повышенным апоптозом в базальном и шиповатом слоях, наряду с замедленной клеточной пролиферацией в базальном слое. Увядающая кожа истончается, становится менее эластичной и обладает сниженной барьерной функцией. Эти изменения связаны с пониженным содержанием клеточного компонента в дерме с ригидными, неэластичными белками межклеточного вещества и уменьшенным количеством капиллярных петель. Вышележащий эпидермис вследствие этого страдает, поскольку дермо-эпидермальное соединение (DEJ) уплощается, приводя к уменьшенной площади поверхности контакта, в то время как меньше капиллярных петель находится по близости к DEJ. Обмен питательных веществ и метаболитов между двумя слоями снижается и связь, необходимая для поддержания интеграции слоев в ответ на изменения условий внешней среды, ослабляется.
Кожа не только подвержена внутренним или хронологическим процессам старения, но также и связанным с воздействием окружающей среды или внешним процессам. Например, известно, что факторы, такие как питание, загрязнение окружающей среды и курение, влияют на скорость старения кожи. Однако один фактор выделяется из остальных как наиболее сильный "геронтоген": солнечный свет. Полагают, что приблизительно 80% старения кожи лица обусловлено пребыванием на солнца.
Воздействию подвергаются коллаген, эластин и другие внутри- и внеклеточные белки кожи, что приводит к солнечному эластолизу, нарастанию локализованной эластической ткани в виде фиброзных тяжей через дерму.
Ультрафиолетовый компонент солнечного света также связывался с уменьшением клеточной популяции эпидермиса (кератиноцитов) и дермы (фибробластов). Предполагали, что это обусловлено усилением программируемой клеточной смерти или апоптоза. Как известно, эпидермис и дерма становятся все более ацеллюлярными с возрастом, что подтверждает эту гипотезу. Несмотря на то, что эпидермис обуславливает сухой и морщинистый внешний вид кожи, степень гладкости поверхности определяет дерма. Уменьшение и/или перераспределение белков межклеточного вещества и активно связывающих воду протеогликанов в большой степени обуславливают появление морщин и степень гладкость поверхности в целом. Аналогично этому рубцевание кожи обусловливается анормальным содержанием, структурой и распределением белка, вследствие образования после травмы грануляционной ткани, что опять же является проблемой скорее на уровне дермы, чем эпидермиса.
Типичные симптомы фотостарения включают огрубление кожи, образование морщин, неравномерную пигментацию, телангиэктазии, шероховатость и множество доброкачественных, предраковых и злокачественных новообразований. Фотостарение является доминирующим у людей европеоидной расы со светлой кожей, которые подвергались инсоляции, и встречается наиболее выраженно на лице, шее и внешних поверхностях верхних конечностей. Эластоз, узнаваемый как грубая гусиная кожа, заметная на шее и верхней половине грудной клетки, обусловлен узловой агрегацией поврежденных эластиновых волокон в дерме. Пролиферация значительно утолщенных и переплетенных эластиновых волокон наблюдалась в папиллярном и ретикулярном слоях дермы кожи, подвергшейся действию инсоляции. Даже в умеренно поврежденной солнцем коже было обнаружено 5-20-кратное увеличение диаметра эластиновых волокон, с незначительными изменениями в структуре фибрилл и повреждением нормального расположения, приводящее к поврежденному и "изъеденному молью" внешнему виду кожи.
В целом световое повреждение проявляется прогрессирующим повреждением фибробластов дермы с количественными и качественными изменениями поддерживающего внеклеточного вещества. Солнечная энергия проходит через кожу и поглощается, возникает градиент повреждения, причем наиболее выраженное повреждение наблюдается во внешнем сосочковом слое дермы, с уменьшением к более глубокому ретикулярному слою дермы.
Истинное (хронологическое) старение характеризуется атрофией кожи с потерей эластичности и сниженной метаболической активностью. В частности, роговой слой остается неизмененным, но эпидермис в целом утончается с уплощением дермально-эпидермального соединения, приводя к повышенной слабости кожи. Толщина и васкуляризация дермы снижаются; это сопровождается уменьшением количества и биосинтетической активности фибробластов дермы. Это последнее изменение проявляется замедленным заживлением ран. Старение также обладает эффектом снижения ответа кератиноцитов и фибробластов на действие факторов роста.
На молекулярном и ультраструктурном уровне имеются изменения эластичности и другие изменения белков межклеточного вещества. Что касается эластичности, наблюдается снижение внеклеточного белка фибриллина, который является основным компонентом тяжей микрофибрилл, которые связывают дермально-эпидермальное соединение с сосочковым слоем дермы. Эти тяжи, часто называемые окситалановыми волокнами, по существу, обеспечивают эластическое соединение между эпидермисом и дермой. Показано, что присутствующие в дермально-эпидермальном соединении волокна, рассматриваемые ранее как синтезируемые только фибробластами, синтезируются кератиноцитами. Было обнаружено, что концентрация фибриллина в состаренной инсоляцией коже снижена, и оказалась пригодной к использованию в качестве биомаркера фотостарения, которое, как известно, связано с образованием мимических морщин. Концентрация фибриллина также снижена в коже, которая подвергалась растяжению, и демонстрирует растяжки (jtriae distensae).
In vivo белки пострансляционно модифицируются неферментативной реакцией (реакция Майяра) между белками (и внутри-, и внеклеточными) и сахарами. Эта реакция известна как реакция гликирования или гликолизилирования, и, общепризнано, играет важную роль в обмене белков, перестройке тканей, диабете и старении. В коже этот процесс обостряется под действием ультрафиолета, причем дермальное гликозилирование часто значительно повышается после 35 лет. Гликозилирование белков происходит, когда восстанавливающие сахара, такие как глюкоза и фруктоза или реакционно-способные промежуточные продукты их метаболизма, такие как глиоксаль, реагируют с аминогруппами белков с длительным периодом полужизни, таких как коллаген (t1/2=15 лет в коже человека) и эластин в дерме. В результате этого процесса накапливаются цитотоксические конечные продукты избыточного гликозилирования (AGE).
Усиление гликозилирования наблюдалось в коже, предварительно облученной ультрафиолетом. Было показано, что хорошо известный биомаркер гликозилирования белка, карбоксиметиллизин (CML), присутствует, главным образом, в зонах вызванного инсоляцией эластоза в дерме и, как правило, в более высоких концентрациях в состаренной инсоляцией коже, что наводит на мысль о том, что индуцированное ультрафиолетом окисление может ускорять образование AGEs в состаренной инсоляцией коже.
Накопление AGE имеет несколько эффектов. Белки, модифицированные конечными продуктами избыточного гликозилирования, являются эндогенными активаторами фотоокислительного повреждения клеток в коже человека посредством индуцированного ультрафиолетом типа А образования активных форм кислорода (ROS), способствующих фотостарению и фотоканцерогенезу. Образование ROS также связывалось с ранними и поздними стадиями образования AGE, с прямой зависимостью между скоростью образования ROS, которое, в свою очередь, повышает экспрессию металлопротеиназы межклеточного вещества, с последующим снижением в нормально перевариваемом здоровом межклеточном веществе. Также имеется перекрестное связывание внеклеточных белков, которое вызывает ухудшение структурных механических свойств белка и снижает их восприимчивость к действию нормальных ферментов организма, таких как металлопротеиназы межклеточного вещества (ММР), которые в нормальных условиях обеспечивают постоянный здоровый белковый обмен. Перекрестно-связывающиеся AGE включают такие формы, как пентозидин. Неперекрестно-связывающиеся AGE включают такие формы, как CML. Гликозилирование также снижает гидрофильность белков, делая их более термостабильными и снижая вероятность их термической денатурации.
Организм обладает множеством физиологических механизмов, которые защищают его от вредных белковых модификаций, включая ферменты, переваривающие белки. Своевременный протеолиз удаляет поврежденные белки до того, как они подвергнуться окислительному повреждению и перекрестному связыванию. Следовательно, быстрый эффективный протеолиз является, по существу, механизмом, защищающим от старения. Уже упоминалось, что белки, такие как коллаген и эластин, которые были посттранскрипционно модифицированы посредством вызванного ультрафиолетом гликозилирования, являются более устойчивыми к перевариванию эндогенными ферментами (например, металлопротеиназами). Это, наряду с повышением экспрессии таких ферментов, дополнительно уменьшает соотношение между здоровыми перевариваемыми белками межклеточного вещества и модифицированными вредными белками.
Не только обмен нативных белков под действием эндогенных ферментов, таких как коллагеназа и эластаза, но есть также другие системы как внутри-, так и внеклеточные, которые имеют дело со стареющими и/или денатурированными/подвергнутыми стрессу белками. Один такой механизм использует молекулярные шапероны. Старение связано со сниженной способностью поддерживать гомеостаз во всех физиологических системах, и это может быть следствием, по меньшей мере, отчасти, параллельного и прогрессирующего снижения способности вырабатывать белки теплового шока. Ослабленный ответ белка теплового шока может внести вклад в повышение чувствительности к изменениям условий внешней среды у пожилых индивидуумов.
Белки теплового шока (HSP), также известные как стрессовые белки, действуют, как считается, в качестве молекулярных шаперонов посредством содействия синтезу, транспорту, укладке и деградации белка. Они представляют собой группу белков, которые присутствуют во всех клетках, во всех формах жизни. Они стимулируются, когда клетка подвергается стрессовым внешним воздействиям, нагреванию, холоду или кислородному голоданию. HSP также присутствуют в клетках при идеальных нормальных условиях и связывались с модулированием ответов сокращения и расслабления в гладкой мышце сосудов; они играют важную роль в укладке и функционировании белков, даже при отсутствии стресса.
Образование конечных продуктов избыточного гликозилирования вызывает развертывающее цепь протеинов необратимое перекрестное связывание и другие химические изменения. Известно, что HSP способствуют свертыванию/поддержанию конформации и также быстрой деградации необратимо поврежденных белков. Известно, что маленькие белки теплового шока, такие как α-кристаллин, защищают белки хрусталика глаза от изменений, вызванных гликозилированием. Известно, что маленькие белки теплового шока (sHSP) имеют общую "кристаллиновую" сердцевину, которая, по-видимому, отвечает за каталитическую активность этих шаперонов. Полагают, что большее понимание действия α-кристаллина/sHSP шаперона будет иметь значение для разработки лекарственных препаратов для лечения и предотвращения катаракты.
Семейство белков теплового шока включает 8 кДа убиквитин (известный в связи с убиквитин-протеасомным путем деградации белка), 32 кДа гемоксигеназа-1 (связанная с окислительным стрессом, вызванным ультрафиолетом типа А) и HSP-47, известный коллагеновый шаперон. HSP-27 был обнаружен в коже человека и предположительно играет защитную роль в воспалительных заболеваниях вследствие его связей с интерлейкином-1 и фактором некроза опухолей-α. Это, вместе с пониманием, что экспрессия HSP-27 тесно связана с дифференцировкой эпидермальных кератиноцитов, дает основание предполагать, что белки теплового шока, такие как HSP-27, играют роль в защите кожи и, возможно, в воспалительном цикле солнечного ожога. Известно, что, в отличие от других клеток и систем органов, эпидермальные кератиноциты экспрессируют HSP72 конститутивно, т.е. без предшествующего действия стресса. Показано, что белок теплового шока HSP47 является важным как молекулярный шаперон для синтеза проколлагена в фибробластах человека. Синтез HSP47 снижен в старой и состаренной солнцем коже.
Экспрессия HSP вслед за экспозицией ультрафиолетом связывалась с повышенной устойчивостью к клеточной смерти, индуцируемой ультрафиолетом. Нетоксичные индукторы HSP могут защищать от немедленных и долговременных эффектов экспозиции ультрафиолетом. Исследования показали, что предшествующая экспозиция клеток красным и инфракрасным (IR) светом защищает их от последующей экспозиции ультрафиолетом. Аналогично предварительная обработка клеток IR также защищает клетки от последующего летального (51°С) внешнего теплового стресса.
Хорошо известный защитный эффект HSP от стресса, вызванного действием факторов внешней среды, не является неизменным в течение жизни. HSP-ответ на стресс ослабевает с возрастом, возможно, на уровне транскрипции. Было обнаружено, что повторяющийся слабый тепловой шок (RMHS) фибробластов кожи человека снижает скорость связанных с возрастом изменений. Одно исследование было связано с возрастным снижением способности фибробластов человека уменьшать накопление гликозилированных белков с параллельным снижением способности экспрессировать HSP70, в то время как фибробласты человека, подвергшиеся RMHS, демонстрировали повышенную экспрессию HSP70 и сниженное накопление гликозилированных белков. Благоприятные эффекты RMHS были отнесены к повышенной протеосомальной активности, повышенной способности разлагать Н2О2, пониженному накоплению липофусцина и улучшенной устойчивости к ультрафиолетовому излучению.
Было показано, что подъемы температуры на 3-5°С выше исходной в мышце вызывают индукцию HSP. Индукция HSP посредством 30-минутного воздействия ультразвука в импульсном режиме при нормальной температуре тела была продемонстрирована в крысиных эмбрионах, показывая, что ответ на тепловой шок является неспецифичным для нагревания, но может происходить в ответ на механический стресс. Аналогичным образом куриные эмбрионы, подвергшиеся действию ультразвука без какого-либо значительного вклада температуры, показали повышенный синтез HSP72, давая возможность предположить, что механический стимул может вызывать стрессовый ответ.Также было сделано заключение, что для получения "полного биологического эффекта, стресс должен быть постоянным в течение приблизительно 10 секунд или более через любой интервал времени в процессе экспозиции". Возможно, кумулятивные эффекты могут стимулировать выработку HSP, что было обнаружено, когда слабый тепловой шок повторялся в течение 3 дней, вызывая значительное повышение уровня HSP в мышцах.
Некоторые вещества обладают эффектом экспрессии HSP. Например, было показано, что салицин снижает необходимый для достижения экспрессии HSP уровень температуры с 42°С до 39°С и уменьшает степень последующего вызванного ультрафиолетом повреждения в культурах фибробластов и кератиноцитов человека. Известные раздражающие вещества, такие как лаурилсульфат натрия (SLS), также вызывают экспрессию HSP. Положительная регуляция HSP27 вследствие обработки SLS фрагментов кожи человека применялась в качестве способа определения клеточного стресса вследствие химического раздражения. В аналогичном исследовании, однако, SLS-индуцированная экспрессия HSP27 в эпидермисе человека угнеталась посредством местного применения витамина С.
Вещество цинк-L-карнозин, известное также под коммерческим названием Polaprezinc, индуцирует, как было показано, экспрессию HSP72 (стресс-индуцированный HSP70) в клетках, защищающих слизистую желудка от стресса в виде химического раздражения. Также в качестве контроля также были протестированы ZnSO4 и карнозин, которые не показали достижения такого же результата. Ранозаживляющее действие цинк-L-карнозина, известного в качестве противоязвенного препарата, было связано с его пролиферативным ответом в неэндотелиальных клетках, таких как фибробласты.
Исследовалось влияние аспирина на экспрессию HSP70 у интактных крыс, подвергшихся тепловому стрессу. Крысам была проведена внутрибрюшинная инъекция или аспирина (100 мг/кг), или только плацебо, за 60 минут до их помещения в температуру 37°С или комнатную температуру на 30 минут. Комбинация аспирина с тепловым воздействием приводило к 3-4-кратному повышению уровня м-РНК HSP70 по сравнению с уровнем, наблюдаемым только при воздействии тепла.
Исследовалось значение HSP-72 и -70 в обеспечении устойчивости к действию аспирина на слизистую оболочку желудка; экспрессия этих HSP повышалась последующим хроническим воздействием аспирина.
Известно, что анальгетики, такие как аспирин, ибупрофен и парацетамол, защищают от катаракты. Это действие было приписано ингибированию индуцированного сахарами перекрестного связывания в маленьких HSP, таких как α-кристаллин. Ферменты, которые защищают против катаракты, подвержены вызываемой гликозилированием инактивации, но было показано, что аспирин от этого защищает.
Аналогично ацетил-L-карнитин был признан сильным средством для защиты шаперона вследствие его способности ацетилировать потенциальные участки гликозилирования маленьких HSP и соответственно защищать их от вызванного гликозилированием повреждения.
Маленькие белки теплового шока (sHSP) и кластерин представляют собой молекулярные шапероны, которые разделяют многие функциональные свойства, несмотря на отсутствие у них значительного сходства последовательностей. Маленькие белки теплового шока представляют собой повсеместно распространенные внутриклеточные белки, тогда как кластерин, как правило, обнаруживается экстрацеллюлярно. Оба шаперона предотвращают аморфную агрегацию и преципитацию белков-мишеней в условиях стресса, таких как повышение температуры, восстановление и окисление. Транскрипция и HSP, и кластерина опосредована транскрипцией фактора HSF-1. Однако было показано, что кластерин является более эффективным, чем некоторые sHSP, такие как α-кристаллин, в предотвращении преципитации из раствора стрессовых белков-мишеней.
Кластерин экспрессируется в виде гетеродимерного белка размером 75-80 кДа, который гликозилируется в значительной степени, так что 30% от его массы составляет углевод. В то время как шаперонная активность маленьких белков теплового шока, таких как α-кристаллин, значительно снижается при более низком рН, активность кластерина при низком рН повышается. Это имеет большое значение для участков повреждения тканей или воспаления, в которых возникает локальный ацидоз (рН<6). Другим сходством, которое имеет кластерин с sHSP, является способность регулировать апоптоз. Избыточная экспрессия кластерина может защищать клетки от множества агентов (например, ФНО-α или ультрафиолетового облучения), которые в противоположном случае вызывают апоптоз. Полагают, что кластерин может взаимодействовать со стрессовыми белками поверхности клетки для ингибирования проведения сигнала к апоптозу или предотвращения нецелесообразных взаимодействий внутриклеточных белков во время стресса.
Множество местных кожных препаратов доступны для лечения заболеваний кожи и для воздействия на косметические состояния кожи, в частности старение кожи и повреждение в результате инсоляции. Во многих случаях эти препараты неэффективны, с минимальным или непродолжительным действием. Существует, таким образом, необходимость в новых препаратах, эффективных в лечении заболеваний кожи. Кроме того, настоящее изобретение рассматривает проблемы достижения эффективной доставки к коже таких новых препаратов.
Раскрытие изобретения
Изобретение предоставляет устройство для применения ультразвука на коже, включающее в себя множество ультразвуковых излучающих элементов (ультразвуковых преобразователей), расположенных в виде системы матрицы на гибком материале в определенной пространственной конфигурации, в которой ультразвуковые излучающие элементы способны к доставке ультразвука с низкой и/или высокой частотой на участок кожи.
В соответствии с этим аспектом изобретения ультразвуковая система может быть включена в маску, повязку или повязки, которые могут применяться на коже для обеспечения ультразвукового воздействия.
Маска или повязка предпочтительно имеет такую форму, чтобы повторять контур по меньшей мере одной части поверхности лица. Таким образом, гибкая система ультразвуковых излучающих элементов может быть сформирована в циркулярную или любую другую простую или составную форму, особенно элементы, оптимизированные для соответствия формам и особенностям тела, особенно частям лица и шеи. Система должна быть достаточно гибкой для изгибания в соответствии с кривизной радиусом 3-4 см, предпочтительно изгибаться для повторения формы поверхности с двумя криволинейными контурами так же, как и с одним криволинейным контуром.
Воздействие ультразвука с использованием устройства в соответствии с изобретением может применяться в качестве предварительного лечения перед применением композиции согласно изобретению или композиция согласно изобретению может применяться на коже, или непосредственно, или при помощи материала, пропитанного композицией, например, подушечки, такой как гелевая подушечка, и затем посредством гибкой системы поставляется ультразвук. Гибкая ультразвуковая система может быть соединена с тонкой (2-3 мм) одноразовой гелевой подушечкой, которая содержит композицию и сочетается с ультразвуковой энергией. Гибкая система может быть удобно зафиксирована, непосредственно или опосредованно (например, посредством подушечки) на коже на время лечения.
Излучающие элементы системы предпочтительно герметизированы, например содержатся в водонепроницаемом гибком материале, способном к электрическому взаимодействию даже когда приклеены/соединены с водными образованиями.
Является предпочтительным, чтобы в устройстве гибкий материал являлся, по меньшей мере приблизительно, акустически подходящим к одному или предпочтительно обоим излучающим элементам для подавления возникновения отражения от материала, который может отклонять или иначе рассеивать ультразвуковые волны. Гибкий материал может содержать полимерный материал, выбранный из термопластиков, термореактивных пластиков, резины или их смесей. Гибкий акустически подходящий материал будет, как правило, образован из полимерного материала и, дополнительно, наполнителя. Полимерный материал должен обладать хорошей совместимостью с компонентами излучающего элемента, биосовместимостью и гибкостью. Пригодные полимерные материалы включают в себя термопластики, такие как полиэтилены повышенной плотности, полиметилметакрилаты, полипропилены, полибутилентерефталаты, поликарбонаты, полиуретаны, такие как СА 118 и СА 128, доступные в Morton Chemicals, и эстанполиэстер и тому подобное; термоактивные пластики, такие как эпоксиды, такие как Spurr эпоксид и Stycast 80, Stycast 1365-65 и тому подобное; и резины, такие как силиконовые резины, такие как дисперсия 236, доступная в Dow Corning и RTV-141, доступный в Rhone-Poulenc, Inc., и тому подобное. При необходимости акустический импеданс полимерных материалов может быть повышен посредством включения одного или более наполнителей. Пригодные наполнители включают титанат-цирконат свинца (PZT), вольфрам, оксид алюминия, кварцевое стекло, карбид вольфрама, титан, порошок стекла и тому подобное, причем порошок стекла является предпочтительным. Размер частиц наполнителя должен находиться в диапазоне от приблизительно 0,1 до приблизительно 50 микрон и предпочтительно от приблизительно 0,5 до приблизительно 5 микрон. Количество применяемого наполнителя будет представлять собой то количество, которое необходимо для обеспечения необходимого акустического импеданса. В нормальных условиях используется от приблизительно 2 до приблизительно 50 об.% наполнителя и предпочтительно от приблизительно 5 до приблизительно 30 об.% наполнителя. Предпочтительный полимерный материал представляет собой силиконовую резину.
Как правило, излучающие элементы будут индивидуально соединены с ультразвуковым генератором так, чтобы ультразвуковые излучающие элементы были способны доставлять низко- и высокочастотный ультразвук одновременно или последовательно.
Устройство в соответствии с изобретением может содержать гибкую систему, имеющую набор высокочастотных излучающих элементов и набор низкочастотных излучающих элементов, соответственно способных к доставке ультразвука с низкой и высокой частотой. Высоко- и низкочастотные излучатели могут чередоваться или иначе располагаться в структуре, например, по существу, в регулярном расположении двух типов излучателей. В других вариантах осуществления изобретения высоко- и низкочастотные элементы могут устанавливаться вместе, например один поверх другого, в частности коаксиально. В этом аспекте излучающие элементы могут представлять собой излучающие элементы с двойной частотой, способные к доставке низко- и высокочастотного ультразвука последовательно или одновременно, по одной и той же оси. Излучатели с двойной частотой могут быть размещены в структуре, например, по существу, правильном расположении излучателей с двойной частотой. Излучатели могут быть расположены циркулярно или иным образом или беспорядочно. Излучающие элементы соответствующим образом содержат излучающие материалы, известные в данной области, например пьезокерамику, ПВДФ и/или пьезоэлектрические материалы, такие как порошки PZT, коммерчески доступные в Morgan Matroc, Inc., керамику, монокристаллический ферроэлектрик Relaxor, цирконат титанат свинца Pb(Zr, Ti)O3, метаниобат свинца Pb (Nb2O6), модифицированный титанат свинца PbTiO3, такой как (Pb, Ca)TiO3 и (Pb, Sm)TiO3, титанат бария BaTiO3, PMN-PT(1-x) Pb(Mg''3Nb2/3)O3-хРbТiО3, PZN-PT/BT(Nb2/3)O3-x(yPbTiO3-(1-y)PbZrO3)Pb(Zn1/3Nb2/3)O3-xPbTiO3-BaTiO3, (1-х)Pb (Zn1/3) и тому подобное.
В устройстве в соответствии с изобретением излучающие элементы могут быть способны к доставке низкочастотной составляющей в импульсном режиме и высокочастотной составляющей в непрерывном режиме или, более предпочтительно, способны к доставке низкочастотной составляющей ультразвука в постоянном режиме и высокочастотной составляющей в импульсном режиме. Импульсный режим может быть управляемым так, чтобы он мог варьироваться для обеспечения изменяющихся импульсных режимов, например, работа в течение 2 мс, перерыв 8 мс (20%-ный рабочий цикл).
В устройстве в соответствии с изобретением удобно, чтобы излучающие элементы были способны к доставке ультразвука с низкой частотой от 20 до 500 кГц, предпочтительно ~50 кГц и/или ультразвука с высокой частотой от 0,5 до 3,5 МГц, предпочтительно от ~1 МГц до 3 МГц. Пространственное среднее плотности энерговыделения энергии низкочастотного ультразвука составляет в подходящем случае от 20 до 500 мВт/см2. Пространственное среднее плотности энерговыделения энергии высокочастотного ультразвука составляет в подходящем случае от 0,5 Вт/см2.
Во втором аспекте изобретение обеспечивает двухчастотный излучающий элемент, включающий в себя высокочастотный излучающий элемент и низкочастотный излучающий элемент, предпочтительно высоко- и низкочастотные излучающие элементы являются установленными коаксиально и могут быть соединены механически и электрически. В предпочтительном варианте осуществления высокочастотный излучающий элемент содержит пьезокерамический материал и низкочастотный излучающий элемент содержит ПВДФ. Высоко- и низкочастотные излучающие элементы могут быть связаны вместе, опционально с разделительным элементом между ними, который может представлять собой металлический разделительный элемент.
Устройство в соответствии с изобретением может включать в себя комплект двухчастотных излучающих элементов, как описано здесь.
Ультразвуковая система может быть запрограммирована для доставки требуемой последовательности высокой и/или низкой ультразвуковых частот, в импульсном или непрерывном режиме, в установленном порядке, таким образом избегая проблем, связанных с чрезмерной или недостаточной экспозицией кожи ультразвуком, которые могут вызывать перегревание кожи. Устройство изобретения управляется таким образом, чтобы низкие и высокие частоты были способны перемещаться так, чтобы ультразвуковое поле двигалось между концами системы в заранее заданном порядке и с заранее заданной скоростью, например 2-3 секунды слева направо через всю ширину (например, 5-10 см) системы, затем 2-3 секунды обратно, например время цикла 4-6 секунд; или в центр системы и затем обратно из центра, особенно, если система имеет округлую форму. Порядок может изменяться в течение одного и того же сеанса лечения, например, слева направо, затем сверху вниз. В идеальном варианте высокие и низкие частоты применяются таким образом, чтобы каждая частота покрывала обрабатываемую площадь так равномерно, насколько это возможно. Гибкая система предпочтительно имеет такую конфигурацию, чтобы ультразвук не действовал на глаза, и чтобы излучатели были помещены и управлялись так, чтобы возможность чрезмерной экспозиции ультразвуком кожи, которая расположена близко от кости (например, глазницы или скуловой кости), была сведена к минимуму. Это может быть достигнуто посредством применения ультразвука в импульсном режиме и, например, посредством доставки ультразвука в заранее определенной фазированной последовательности. Применение маски, повязки или повязок для приложения ультразвука особенно удобно для домашнего применения.
Устройство может содержать блок питания и управления, который имеет соответствующий размер для того, чтобы помещаться в руку. Блок предпочтительно предоставлен в водонепроницаемом корпусе, который можно протирать. Энергия может поставляться батареями, например заряжаемыми батареями, позволяя применять устройство вдали от основного источника энергии. Блок предпочтительно снабжен панелью управления, позволяя потребителю выбирать установки для желаемого воздействия, которые могут включать заранее определенные уровни, позволяющие потребителю выбирать установки для различных целей применения, например для лечения старения, лечения целлюлита или для уменьшения шрамов, причем различные установки основаны на различных установках частоты и амплитуды/энергии. Удобно, если панель управления включает выключатель максимального времени для предотвращения чрезмерной экспозиции, например 10 минут. Может предоставляться функция памяти, например, для записи даты и/или продолжительности лечения.
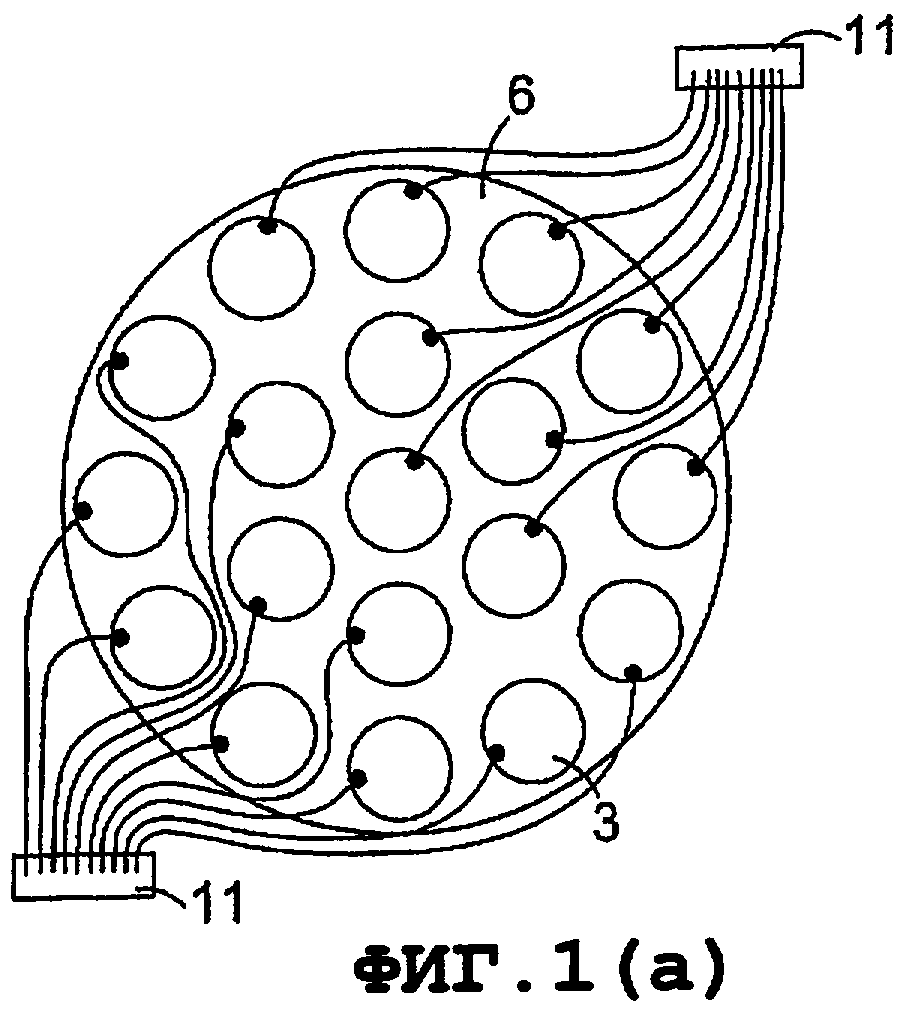
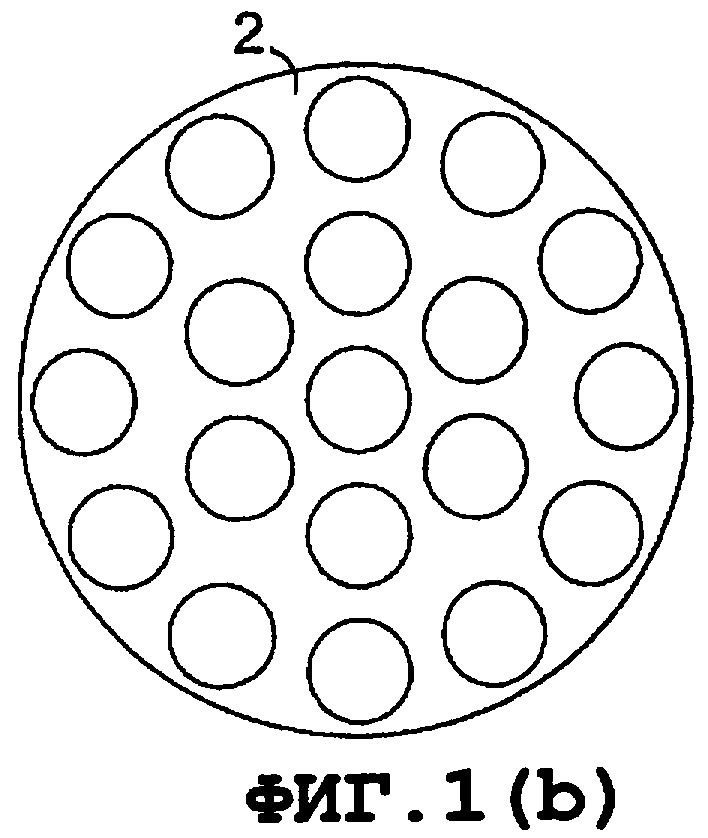
В особенно предпочтительном варианте осуществления изобретение относится к ультразвуковой системе лечения, содержащей множество излучающих элементов (15), организованных в систему (2) и удерживаемых в близости друг от друга при помощи соответствующего материала (4), который в наиболее удобном варианте представляет собой силиконовую резину (фиг.1a, b и с).
Каждый элемент (15) может содержать два компонента, высокочастотный излучающий элемент, например пьезокерамический дисковый элемент (5) и низкочастотный излучающий элемент, например ПВДФ элемент (7), расположенный так, чтобы положительно заряженный электрод каждого элемента являлся механически и электрически соединенным на поверхности раздела (9). Верхняя поверхность (30) PZT элемента (5) и нижняя поверхность (31) ПВДФ элемента (7) соединены вместе посредством электрического контакта (фиг.1(d)). Каждый элемент (1) индивидуально соединен с источником энергии, показанном на фиг.3, посредством пружинных разъемов (8), прикрепленных к расположенным рядом контактам (3) на гибко закрепленной пластинке (6) фиг.1а. Комплект излучателей может затем соединяться с ультразвуковым генератором посредством соединителей (11).
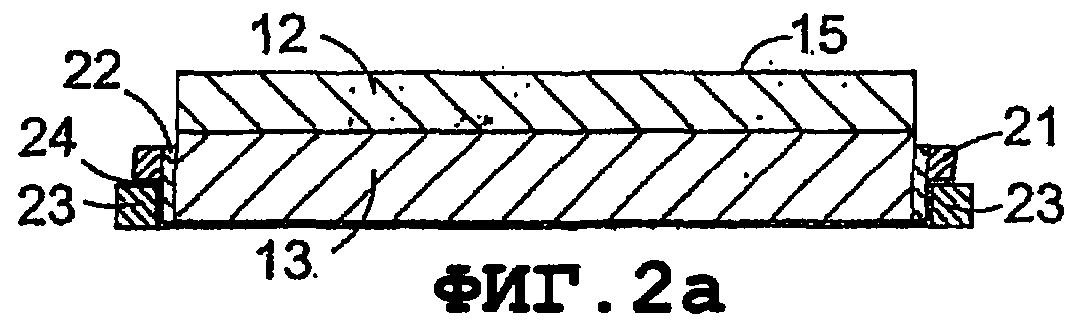
Фиг.2а и 2b показывают конкретный тип излучающего элемента, в котором PZT диск (12) непосредственно присоединен к металлическому элементу (13), который, в свою очередь, является соединенным непосредственным включением в цепь с ПВДФ материалом (24) посредством металлического кольца (23) и изоляционного разделительного кольца (22). Общее НТ соединение (9) достигается посредством проводящего кольца (21). Переменные ведущие частоты 50 кГц и 1 МГц генерируются или посредством индивидуальных контуров в системе фиг.3В или посредством DDS-чипа на фиг.3А. Комбинированный излучатель, таким образом, альтернативно приводится в действие в монорежиме 50 кГц и 1МГц синусоидальных колебаний. Длина и соотношение сигналов активации может управляться процессором или производиться от сенсорного управления, относящегося к измеряемым характеристикам ткани-мишени.
На фиг.2а элемент 13 может быть сформирован в виде фокусирующего устройства посредством придания нижней поверхности изогнутого, фокусирующего профиля, например вогнутого профиля, таким образом, сообщая такие же свойства геометрически деформируемой ПВДФ пленке.
В третьем аспекте настоящее изобретение предоставляет композицию, содержащую один или более агент, предотвращающий гликозилирование, один или более антиоксидант, дерматологически приемлемый наполнитель или наполнители и дополнительно одно или более вещество, способное вызывать экспрессию молекулярного шаперона.
Композиции согласно изобретению являются пригодными для лечения косметических состояний кожи, в частности, действуя на улучшение внешнего вида стареющей кожи, особенно при помощи уменьшения эффектов повреждения в результате инсоляции. Как правило, каждый агент, препятствующий гликозилированию, присутствует в количестве от приблизительно 0,5 до 5%, предпочтительно от приблизительно 1 до 3 мас.% композиции.
В подходящем случае, в некоторых вариантах осуществления композиции по изобретению, агент(ы), препятствующий гликозилированию, также имеет антиоксидантную активность.
Предпочтительные препятствующие гликозилированию агенты для включения в композиции включают один или более гистидинсодержащий дипептид, аланил-L-гистидин (L-карнозин) или их пептидомиметик, N-ацетилцистеин, аминогуанидин, d-пеницилламин, ацетилсалициловую кислоту (аспирин), парацетамол, индометацин и ибупрофен и/или их функциональный гомолог, производную или пролекарство.
Известно, что гистидинсодержащие натуральные дипептиды, такие как L-карнозин (β-аланил-L-гистидин или "карнозин"), эффективны против различных свободных радикалов, производных кислорода, а также липопероксильных радикалов. Карнозин, присутствующий в скелетной мышечной ткани в высоких концентрациях, может замедлять старение и провоцировать омолаживание в культуре фибробластов человека. Механизм, посредством которого такая простая молекула вызывает эти эффекты, не известен, несмотря на то, что карнозин имеет убедительно подтвержденные документальными доказательствами антиоксидантную активность и способность удалять свободные радикалы кислорода. В дополнение к профилактическому действию карнозина он может также непосредственно принимать участие в инактивации/удалении старых белков, возможно посредством прямого реагирования с карбонильными группами белков. Возможные метаболические пути этих карнозинилированных белков включают образование инертного липофусцина, протеолиз посредством системы протеасом и экзоцитоз в результате взаимодействия с рецепторами.
Полагают, что карнозин может метить гликозилированные белки для их удаления. Метаболизм белков зависит от гидратации во время термальной денатурации и известно, что гликозилированные белки имеют более высокую энтальпию денатурации, что, очевидно, делает их менее способными к разложению. "Карнозинилирование" гликозилированных белков, как полагали, может увеличивать доступную для воды поверхность таких белков и, следовательно, способствовать гидратации и развертыванию в течение термической денатурации. Эта теория была подтверждена посредством наблюдения более низкого ΔH и ΔG денатурации для карнозинилированных гликозилированных белков.
Карнозин действует в качестве препятствующего гликозилированию агента, он ингибирует действие карбонила метилглиоксаля (MG) и AGE карбоксиметиллизином (CML). Показано, что карнозин сам по себе быстро гликозилируется множеством сахаров, образуя немутагенные продукты присоединения, и его защитная роль приписана действию предотвращения гликозилирования кристаллина, супероксиддисмутазы (SOD) и каталазы. Было обнаружено, что карнозин показывает лучшие параметры эффективности и токсичности при сравнении с препятствующим гликозилированию агентом аминогуанидином, следовательно, карнозин является предпочтительным агентом, препятствующим гликозилированию.
Карнозин демонстрирует свойства хелировать Мn+ и удалять свободные радикалы, но эти свойства в отдельности не могут адекватно объяснить эффект омоложения стареющих фибробластов. Одно исследование подтвердило его свойства реагировать с карбонильными группами гликозилированных/окисленных белков и других молекул; эта реакция, названная "карнозинилирование", подавляет перекрестное связывание гликоксидизированных белков с нормальными макромолекулами; и карнозинилирование могло бы влиять на метаболический путь гликоксидизированных полипептидов.
Исследования фибробластов эмбрионов крысы показали, что L-карнозин поддерживает сохранение морфологии клеток даже во время трофического повреждения в течение пяти недель. Также L-карнозин значительно снижает образование 8-гидрокси-деоксигуанозина (8-ОН dG) в клетках монокультуры через четыре недели. Таким образом, может быть предположено, что эффект L-карнозина против старения возможно связан с ингибированием им образования внутриклеточного 8-ОН dG во время окислительного стресса. Карнозин также удлиняет время жизни выращенных в культуре фибробластов человека, убивает трансформированные клетки, защищает клетки от альдегидов и фрагментов амилоидного белка и ингибирует in vitro гликозилирование белка и перекрестное связывание ДНК и белков. Фибробласты сохраняют ювенильный вид в присутствии карнозина и возвращаются к старческому фенотипу, когда карнозин удаляют.
В дополнение к антиоксидантной активности против гликозилирования карнозин также имеет противовоспалительное действие. Денатурированный белок в месте воспаления более восприимчив к гликозилированию, следовательно, противовоспалительный эффект может усиливать ингибирование гликозилированию.
Карнозин является водорастворимым, и это дает основание предполагать, что он может представлять эквивалент водной фазы жирорастворимых антиоксидантов, таких как α-токоферол, который действует, защищая клеточные мембраны. Было обнаружено, что карнозин и подобные карнозину соединения (CRC) (имидазол, гистидин, ансерин) и эрготинеин в равной степени эффективны в удалении синглетного кислорода. Было обнаружено, что во время образования гидроксильных радикалов из перекиси водорода в реакции Фентона карнозин является более эффективным, чем тестируемые CRC. Однако следующий порядок по рангу эффективности карнозино-подобных соединений был продемонстрирован во время измерения окисления сывороточных липопротеинов человека: ацетилкарнозин < ацетилансерин < гомокарнозин = офидин < карнозин < ансерин, в котором было показано, что аминокислотные компоненты карнозина, гистидин и аланин, имеют небольшое или не имеют ингибирующего действия на окисление жиров или белков. Естественные уровни содержания карнозина снижаются с возрастом параллельно снижению активности других антиоксидантных систем, таких как система супероксиддисмутазы (SOD). Дополнительно карнозин сам по себе может защищать против пероксильной радикальной фрагментации белка в Cu, Zn-SOD, которые в противном случае инактивируют фермент. Карнозин хорошо известен своей активностью в удалении синглетного кислорода.
Было показано, что карнозин образует димерный комплекс Cu2+, и это может объяснить, почему карнозин снижает образование свободных радикалов, поскольку образование комплексных соединений с металлами будет уменьшать доступные уровни Cu2+ Fe2+, которые будут в противном случае координационно связаны с AGEs в белках (имидазольное кольцо карнозина может быть сравнено с имидазольным кольцом множества различных имидазолсодержащих Х-связей AGE), приводя к образованию in situ гидроксильных и других реакционно-способных продуктов. Карнозин также препятствует железо/аскорбат-индуцированному окислению фосфолипидов.
Карнозин вызывает дозозависимое расслабление мышц сосудов (вазодилатацию), которая не зависит от эндотелия. Интересно, что в том же исследовании было обнаружено, что аминокислоты L-гистидин и аланин, входящие в состав карнозина, не вызывают соответственно эффекта и дозозависимой вазоконстрикции.
Карнозин физиологическим путем гидролизуется на составляющие его аминокислоты: гистидин и β-аланин. Полагают, что β-аланин участвует в стимуляции синтеза коллагена. Гистидин известен своими противовоспалительными свойствами, своей способностью удалять атомарный кислород и препятствовать восстановительным реакциям с участием ионов железа и других металлов.
Было показано, что карнозин повышает скорость заживления ран, когда он применяется в составе комплексной энтеральной формулы, но не сообщалось о его применении в составе местных ранозаживляющих препаратов.
CRC, такие как пролекарство карнозина N-ацетил-L-карнозин (NAC), подвергаются гидролизу, образуя in situ карнозин. Было показано, что NAC лечит окислительный стресс при офтальмологических нарушениях, таких как катаракты и глаукома.
Другие гомологи карнозина включают гомокарнозин и ансерин, которые защищают Cu, Zn-SOD от инактивации и предотвращают освобождение Cu2+. Многие гомологи карнозина образуются ферментом карнозинсинтетазой.
Функциональные гомологи, производные и пролекарства карнозина, которые могут быть включены в композиции в соответствии с изобретением, включают одно или более из следующих веществ: β-аланилгистамина (карцинина), N-ацетил-β-аланилгистамина (N-ацетил карцинина), L-пролилгистамина и/или n-ацетил-L-карнозина.
Декарбоксилирование L-карнозина приводит к образованию производной с повышенной устойчивостью к гидролизующим ферментам. Известны пептидомиметики карнозина (функциональные гомологи), которые обладают свойствами удаления свободных радикалов и дезактивации гидроперекисей липидов, такими же или превосходящими свойства природного пептида карнозина.
Было показано, что два пептидомиметика карнозина (функциональные гомологи), N-ацетил-β-аланилгистамин и L-пролилгистамин являются высокоэффективными ингибиторами перекрестного связывания белков, опосредованного гидроперекисями липидов. Было показано, что in vivo N-ацетил-β-аланилгистамин защищает ферменты кожи от вызванного ультрафиолетом разрушения.
Композиция в соответствии с изобретением содержит один или более антиоксидант(ы), предпочтительно выбранный из группы, содержащей аргинин, аскорбиновую кислоту, пролекарство или производную аскорбиновой кислоты, аскорбилпальмитат, аскорбилфосфат магния, аскорбилфосфат натрия, ансерин, карнозин, опидин, гомокарнозин и/или ацетилансерин. Как правило, каждый антиоксидант присутствует в количестве от приблизительно 0,5 до 5%, предпочтительно от приблизительно 1 до 3 мас.% композиции.
Аргинин представляет собой сильный антиоксидант и очень эффективную протекторную мишень для реакций перекрестного связывания белка типа Майяра. Было показано, что и аргинин, и лизин являются эффективными ингибиторами гликозилирования, но аргинин особенно склонен сам образовывать AGE. Известно, что количество и диаметр капиллярных петель в близи от дермально-эпидермального соединения (DEJ) уменьшается с возрастом. Снабжение питательными веществами и удаление побочных продуктов метаболизма и другие клеточные процессы вследствие этого нарушаются. L-аргинин действует в качестве вазодилататора вследствие ферменто-каталитического образования оксида азота (NO) in situ. Образование оксида азота (NO) из L-аргинина в настоящее время определяется как убиквитарный (повсеместно распространенный) биохимический путь, вовлеченный в регуляцию сердечно-сосудистой, центральной и периферической нервной систем, так же, как и в другие гомеостатические механизмы.
Аскорбиновая кислота (витамин С, AA) представляет собой естественное питательное вещество, имеющее множество физиологических функций. Она с легкостью (хотя и обратимо) подвергается двум последовательным одноэлектронным процессам окисления с образованием аскорбатного радикала, относительно нереакционноспособного свободного радикала, и рассматривается, таким образом, как превосходный восстанавливающий агент. В живых организмах аскорбиновая кислота может защищать ткани клетки от окислительного повреждения свободными радикалами и активными продуктами, производными кислорода. Известно, что АА проявляет сильную защищающую способность в исследованиях белков хрусталика глаза, включающих в себя облучение рентгеновскими лучами.
К сожалению, в некоторых ситуациях аскорбиновая кислота в растворе может подвергаться окислению и образовывать дегидро-L-аскорбиновую кислоту, так же, как и множество других продуктов деградации, которая может приводить к потемнению композиций, содержащих аскорбиновую кислоту. Некоторые факторы могут ускорить деградацию аскорбиновой кислоты, такие как высокая температура хранения, свет, высокий уровень рН и присутствие растворенного кислорода, хотя механизм реакции аскорбиновой кислоты с молекулой кислорода не был до сих пор полностью объяснен. Тем не менее реакция аскорбиновой кислоты с кислородом эффективно катализируется ионами металлов, в особенности ионами меди и железа. Для предотвращения деградации аскорбиновая кислота как компонент композиции может предоставляться отдельно и смешиваться с другими компонентами композиции непосредственно перед применением. Стабильное пролекарство или производная аскорбиновой кислоты могут быть включены в состав композиции в качестве альтернативы или в дополнение к аскорбиновой кислоте.
Аскорбилпальмитат представляет собой жирорастворимое производное витамина С, широко применяемое в продуктах для ухода за кожей. Он является не раздражающим и более стабильным, чем аскорбиновая кислота. Дополнительно аскорбилпальмитат представляет собой жирорастворимый антиоксидант и является, по меньшей мере, таким же эффективным, как витамин Е в защите кожи от перекисного окисления липидов (ведущего типа свободнорадикального повреждения кожи).
Аскорбилпальмитат магния представляет собой водорастворимую производную витамина С. Он является не раздражающим и более стабильным, чем витамин С. Более важно, что аскорбилпальмитат магния оказался таким же эффективным, как витамин С, в повышении синтеза коллагена кожи, но является эффективным в значительно более низких концентрациях. Большинство формул витамина С являются высококислотными и, таким образом, вызывают шелушение, поэтому аскорбилфосфат магния является предпочтительной производной аскорбиновой кислоты для применения в композициях, особенно предназначенных для индивидуумов с чувствительной кожей и для предотвращения эффекта шелушения.
Аскорбилфосфат натрия (Stay-C® 50) представляет собой натриевую соль монофосфатного сложного эфира аскорбиновой кислоты. Он представляет собой провитамин с большей стабильностью в водном растворе, чем аскорбиновая кислота. Фосфатазы в коже действуют на аскорбилфосфат натрия для высвобождения аскорбиновой кислоты.
Композиции в соответствии с изобретением могут содержать одно или более веществ, способных вызывать экспрессию молекулярного шаперона, особенно пригодными являются вещества, способные вызывать экспрессию белка теплового шока, кластерина и/или α-кристаллина. Одно или более веществ, способных вызывать экспрессию молекулярного шаперона, могут представлять собой ацетилсалициловую кислоту, салициловую кислоту, ионы цинка, соль цинка, сульфат цинка и/или цинк-L-карнозин. Как правило, цинксодержащие вещества присутствуют в концентрации от приблизительно 0,1 до 1%, предпочтительно от приблизительно 0,25 до 0,75%, наиболее предпочтительно около 0,5 мас.% композиции. Когда ацетилсалициловая кислота или салициловая кислота присутствуют в композиции, пригодная концентрация составляет от 0,5 до 2,5%, предпочтительно от приблизительно 1 до 1,5 мас.% композиции.
Композиция в соответствии с изобретением может дополнительно содержать одно или более вещество, препятствующее апоптозу, предпочтительно выбранное из группы, содержащей никотинамид, L-карнитин, ацетил-L-карнитин, N-ацетилцистеин и/или L-карнозин. Хотя бы одно вещество, препятствующее апоптозу, обычно присутствует в концентрации от приблизительно 0,5 до 5%, предпочтительно от 1 до 3% композиции.
В четвертом аспекте настоящее изобретение предоставляет композицию, содержащую одно или более веществ, способных вызывать экспрессию молекулярного шаперона и дерматологически приемлемый носитель.
Композиция в соответствии с изобретением может дополнительно содержать один или более ингредиент, выбранный из группы, содержащей один или более витаминов, один или более маленький пептид(ы) и/или одну или более аминокислоту(аминокислоты) или их производные или пролекарства.
Витамины, которые могут быть включены в композиции согласно изобретению, включают соединения витамина В, такие как тиамин (витамин В1), например тиамина пирофосфат, такой как бенфотиамин; пиридоксамин (витамин В6), витамин А и/или Е или их производные или пролекарства.
Было показано, что пиридоксамин (В6) эффективно ингибирует образование AGE и продуктов окисления липидов, и, в частности, блокирует образование метилглиоксал-лизинового димера, образуя сам метилглиоксал-пиридоксаминовый димер. Было показано, что пиридоксамин (В6) и тиамина пирифосфат (В1) являются эффективными post-Amadory ингибиторами образования AGE, причем В6 вызывает измеряемое снижение скорости образования AGE и снижение конечных уровней AGE, a B1 вызывает измеряемое снижение только конечных уровней AGE. Оба соединения показывают лучшую способность ингибировать post-Amadori образование AGE, чем аминогуанидин. Производные тиамина, такие как бенфотиамин (жирорастворимое пролекарство тиамина) были определены в качестве эффективных терапевтических средств для ингибирования внутриклеточного гликозилирования в лечении сосудистых осложнений диабета и, как было показано, ингибируют накопление AGE имидазолонового типа.
Композиция может содержать один или более маленьких пептидов, в оптимальном варианте, в виде дипептидов, трипептидов и/или тетрапептидов и/или одной или более аминокислот, например пролина, лизина, гистидина, аланина или их производных или пролекарств.
Композиция в соответствии с изобретением может дополнительно содержать один или более полисахарид, который может представлять собой протеогликан, такой как глюкозаминогликан.
Один или более применяемый глюкозаминогликан может быть низко- и/или высокомолекулярным гиалуронаном, хондроитин сульфатом, дерматан сульфатом и/или одним или более их производным.
Дополнительно с целью дегликозилировать белки межклеточного вещества и улучшить функцию сосудов дермы, важным эффектом композиции в соответствии с настоящим изобретением является восстановление содержания и распределения протеогликановой составляющей. Протеогликаны (PG) являются важными для обеспечения "мягкого" набухания кожи вследствие гидратации и важны в качестве межклеточных резервуаров для факторов роста и других цитокинов. PG синтезируются фибробластами дермы и имеют тесную зависимость от факторов роста, таких как основной фактор роста фибробластов (b-FGF). N-концевой связывающий домен коллагена подвергается гликозилированию и вследствие этого на количество и положение PG в дерме воздействует накопление AGE. Например, гепарансульфат протеогликаны (HSPG) активируют клеточную пролиферацию посредством взаимодействия с FGF-2.
Показано, что некоторые GAG, особенно гиалуроновая кислота, присутствуют в стареющей коже в сниженном количестве. Даже несмотря на то, что мукополисахариды составляют только 0,1-0,3% сухого веса кожи, любое снижение, как легко понять, может влиять на тургор кожи, поскольку молекулы связывают воду в дерме в объеме, более чем в 1000 раз превышающем объем самой молекулы. Дополнительно известно, что эти вещества в некоторых случаях влияют на миграцию, рост и дифференцировку клеток соединительной ткани.
Гиалуроновая кислота или гиалуронан ("НА") представляет собой полисахарид с длинной цепью, который является главной составляющей окружающих клеток в большинстве тканей животных. НА привлекается и соединяется со специфическими рецепторами на клеточной мембране, которые могут обнаруживаться в повышенном количестве в местах повреждения и заболевания организма со значительным количеством в коже. Это означает, что препараты могут потенциально становиться мишенями и удерживаться на месте, где лекарство необходимо. Характеристики безопасности НА, ее способность переносить лекарство и ее эффективная характеристика направленности делают ее превосходным транспортным средством для местной доставки лекарств. Лекарства могут ковалентно связываться с НА или содержаться в Х-связанных сетях производных НА.
Гиалуронан применялся в течение десятков лет в косметологии, вискохирургии и вискодобавках без иммунологических реакций или любых других побочных эффектов. Он присутствует естественно в высоких концентрациях в соединительной ткани, такой как кожа и хрящ, в стекловидном теле глаза и в синовиальной жидкости. В большинстве случаев он связан с клетками и белками, но некоторые НА присутствуют в интерстициальной жидкости. НА представляет собой полисахарид, состоящий из чередующихся единиц глюкуроновой кислоты и N-ацетилглюкозамина. Присутствующие карбоксильные группы значительно ионизированы при рН кожи (как правило, около от 4,5 до 5,5) и являются, следовательно, в высокой степени гидрофильными. Свойство связывать воду и размер молекулы полимера НА предрасполагает к образованию НА вязкоэластических гелей, которые имеют способность к поддержанию формы поверхности, действуя в качестве резервуара для терапевтических средств. Несмотря на гидрофильные свойства НА, она может проникать в нормальный эпидермис и накапливаться внеклеточно в дерме до удаления при помощи известных путей метаболизма.
В предпочтительных вариантах осуществления композиция в соответствии с изобретением будет содержать низко- и высокомолекулярный гиалуронан и/или одно или более его производных. Низкомолекулярный гиалуронан обычно имеет молекулярную массу менее чем 1×106 дальтон, тогда как высокомолекулярный гиалуронан, как правило, имеет молекулярную массу более 1×106 дальтон.
НА образует вязкоэластичную, гладкую, смазывающую пленку, когда применяется на поверхности кожи, таким образом, НА, примененный наружно, не только оказывает полезное действие на кожу, но также может применяться для повышения вязкости композиции так, чтобы при нанесении на кожу она оставалась в контакте с кожей в гелеподобном слое. Это является особенно благоприятным, когда ультразвук должен применяться на коже, обработанной композицией в соответствии с изобретением. Молекула НА может быть изменена посредством модификации ацетамидной группы, восстанавливающей концевой группы, но наиболее часто гидроксильной и карбоксилатной групп. Гликозидная связь также легко гидролизуется с образованием более коротких цепей или олигосахаридов. Продукты присоединения НА-лекарства были синтезированы для применения с регулируемой доставкой, и продукты присоединения НА-белка в качестве биоматериалов и клеточных субстратов.
НА существует в форме Na-HA при физиологическом рН. У него полностью отсутствует иммуногенность, что делает его идеальным строительным блоком для биоматериалов и систем доставки лекарств. НА обеспечивает регулируемое и замедленное высвобождение лекарств через кожу посредством образования резервуара лекарства вокруг базальной мембраны. Ни NaCMC (при массовой или реологически равной концентрации), ни хондроитина сульфат (при равной массовой концентрации) не демонстрируют эффекты регулируемого высвобождения, наблюдающиеся у гиалуронановых составов во всей толщине кожи, таким образом, НА является особенно предпочтительным глюкозаминогликаном для целей настоящего изобретения. Полагают, что повышение чрезкожной абсорбции при помощи НА происходит частично за счет его способности увлажнять кожу, разрушая таким образом сплошные клеточно-липидные слои. НА превосходит другие GAG в этом отношении вследствие его высокой способности связывать воду.
Было обнаружено, что тетрасахариды НА вызывают эффект предотвращения апоптоза, поскольку они стимулируют экспрессию HSP72 в условиях стресса и подавляют смерть клеток. Высокомолекулярные полисахариды НА являются, как правило, заполняющими промежутки молекулами с ангиангиогенной, противовоспалительной и иммуносупрессивной активностью. Низкомолекулярные фрагменты (6-20 кДа) являются ангиогенными, воспалительными и иммуностимулирующими.
Было показано, что НА деполимеризуется продуктами реакции Майяра (глюкоза-лизин) посредством свободно-радикального механизма. Гидроксильные радикалы деполимеризуют НА и связывались с воспалением при артрите и разрушением синовиальной жидкости. Высоко- (но не низко-) молекулярный НА и производные НА, такие как ВЕНА, действуют в качестве антиоксидантов, удаляющих активные продукты кислорода (ROS), таких как O2· и ОН, которые в противном случае будут ухудшать миграционные и пролиферативные свойства фибробластов дермы, таким образом пролонгируя воспаление и замедляя заживление раны.
Гиалуронаны обладают способностью повышать синтез протеогликанов, стимулировать тканевой ингибитор металлопротеиназы-1, имеют способность стимулировать ремоделирование коллагена, усиливать миграцию клеток, стимулировать заживление раны посредством стимуляции экспрессии трансформирующего фактора роста-β.
Низкомолекулярный НА (~300 кДа) доступен в Sigma, Poole, Dorset (изолированный из жидкой части стекловидного тела быка). Высокомолекулярный НА доступен в ConvaTec, Flintshire, UK (изолированный из пуповины человека).
Коммерчески доступные препараты НА представлены в таблицах 1a, 1b и 1с.
Другие НА включают NIF-NaHA, продаваемые под названием Healon® для медицинского и Hylartil® для ветеринарного применения; Hylan А (вязкоэластическая жидкость) и Hylan В (вязкоэластический гель), разработанные Biomatrix Inc.
Дерматологически приемлемый наполнитель или наполнители, пригодные для применения в композиции в соответствии с изобретением, включают воду, водно-этаноловую смесь (например, до 25%, предпочтительно до 20% этанола в композиции, мас.%), вязкий гель или эмульсию, гель на водной основе, гидрогель, эмульсию на водной основе в виде крема для нанесения, эмульсию по типу масло-в-воде в виде крема для нанесения или желе.
Как правило, композиция, которая должна применяться в комплексе с ультразвуковым лечением (где композиция применяется до, во время ультразвукового лечения или сразу после ультразвукового предварительного лечения), будет иметь вязкие свойства, так что слой композиции может быть распылен на коже и будет оставаться на участке кожи до удаления, например, посредством вытирания композиции при помощи ткани или хлопковой ваты или посредством смывания состава.
Композиция в соответствии с изобретением может содержать образующий пленку ингредиент. Один или более ингредиентов, выбранных из: средства против загара, увлажнителя, пигмента, основы или тонального пигмента, пигмента или композиции для имитации загара, может быть включен в композицию в соответствии с изобретением.
Композиция в соответствии с изобретением имеет предпочтительно рН, близкий к рН кожи, например рН от рН 4 до рН 6 или от рН 4,5 до 5,5.
В пятом аспекте настоящее изобретение предоставляет способ лечения кожи, включающий в себя нанесение на кожу композиции в соответствии с изобретением.
Предпочтительно способ представляет собой способ косметического лечения косметических состояний кожи. Однако изобретение также охватывает лечение заболеваний кожи, в которых способ представляет собой способ медицинского лечения.
Способ лечения кожи может дополнительно включать в себя применение ультразвука непосредственно или опосредованно на зону кожи, на которую была нанесена композиция или в качестве предварительного воздействия на зону кожи, на которую композиция должна быть нанесена.
В предпочтительных способах согласно изобретению применение ультразвука осуществляется при низкой и/или высокой частоте, непосредственно или опосредованно на зону кожи, где была применена композиция или должна быть применена.
Низко- и высокочастотный ультразвук может применяться одновременно, последовательно или отдельно, например последовательно как несколько чередующихся одиночных применений низкой и высокой частоты, или отдельно, где серия применений низкой частоты чередуется с серией применений высокой частоты. Полагают, что низкочастотный ультразвук пригоден для улучшения доставки молекул к коже (процесс называется "сонофорез"). Высокочастотный ультразвук имеет меньший сонофоретический эффект, чем низкочастотный, но он также имеет много других эффектов, благоприятных для кожи, поскольку он стимулирует пролиферацию фибробластов, стимулирует образование коллагена и других компонентов внеклеточного вещества (ЕСМ) (например, фибриллина), стимулирует кровоснабжение, восстанавливает эластичность ЕСМ, который с возрастом становится твердым, стимулирует экспрессию белков теплового шока (HSPs - внутриклеточные молекулярные шапероны) в фибробластах (дерма) и кераноцитах (эпидермис) посредством температурной и механической стимуляции.
В предпочтительном способе низко- и высокочастотный ультразвук применяется одновременно.
В способах согласно изобретению, включающих применение низко- и высокочастотного ультразвука, низкочастотный компонент ультразвука предпочтительно применяется в постоянном режиме, и высокочастотный компонент предпочтительно применяется в пульсовом режиме.
Термин "ультразвук" описывает звуковые частоты от 20 кГц и выше, низкая ультразвуковая частота составляет от 20 до 500 кГц, причем пространственная средняя плотность энерговыделения низкочастотного ультразвука составляет от 20 до 500 мВт/см2; высокая ультразвуковая частота составляет от 500 кГц (0,5 МГц) до 3,5 МГц, причем пространственная средняя плотность энерговыделения высокочастотного ультразвука составляет от 0,5 до 3,5 Вт/см2.
В способах согласно настоящему изобретению, как правило, пучок не фокусируется и является расходящимся. Целевой подъем температуры в коже составляет вплоть до 42 или 43°С, но предпочтительно не выше. Одиночные зоны кожи обрабатываются в течение 5 минут, предпочтительно 10 минут или время между 5 и 12 минутами.
В способах изобретения ультразвук может быть применен с использованием переносного (ручного) аппликатора, опционально приспособленного для нанесения композиции в соответствии с изобретением на кожу. Например, картридж/диспенсер могут быть присоединены к ультразвуковой головке таким образом, чтобы состав высвобождался постепенно, по мере того, как головка двигается по поверхности кожи, картридж может содержать заранее определенное количество состава. Различные картриджи с различными составами могут присоединяться в зависимости от состояния кожи, которое требует лечения, например, различные картриджи могут содержать различные композиции для лечения, направленного против старения, для лечения шрамов, растяжек кожи или целлюлита. Ультразвук применяется посредством легкого массажа ультразвуковым аппликатором кожи круговыми или линейными поглаживающими движениями.
Ультразвук может применяться в качестве предварительного лечения, до применения композиции по изобретению. В качестве альтернативы или дополнительно слой композиции или материала, пропитанного композицией, может наноситься на кожу во время или до применения ультразвука. Когда применяется аппликатор, он двигается параллельно коже таким образом, чтобы не одна зона не подвергалась чрезмерному действию ультразвука, которое может вызывать перегревание. Комбинация ультразвука и механической стимуляции, создаваемой массажным действием, помогает стимулировать кожу, способствуя обновлению и восстановлению.
Ультразвук может применяться посредством погружения области, на которую воздействуют, в ультразвуковую ванну, например, непосредственно путем погружения открытой кожи в композицию по изобретению или посредством покрытия кожи композицией, обертывая часть, на которую воздействуют, и погружения в жидкость, которая может передавать энергию ультразвука.
Как описано выше, устройство для применения ультразвука на коже может включать в себя множество ультразвуковых излучающих элементов, собранных в систему на гибком материале в пространственной конфигурации, в которой ультразвуковые излучающие элементы способны доставлять ультразвук низкой и/или высокой частоты к области кожи.
Лечение кожи с применением этого способа может осуществляться в клинике красоты или медицинской клинике, такой как госпитальная клиника, или в терапевтическом кабинете.
Круговую зону на коже от 2 до 3 см в диаметре следует подвергать действию ультразвука в течение минимум 5 минут, предпочтительно 10 минут или в течение интервала времени от 5 до 12 минут.
Когда лечение кожи проводится в косметологической клинике или в медицинской клинике, такой как больница или кабинет терапевта, пригодное ультразвуковое устройство для применения в способах изобретения представляет собой ультразвуковую систему, помещенную в маску или повязку, как описано в данном описании; или устройство, которое может генерировать выработку ультразвука низких и высоких частот и имеет ручной пульт управления, предназначенный для предоставления комбинаций вырабатываемых частот или энергий, такой как изделие Duo SonTM (Orthosonics, Devon UK). Изделие Duo SonTM может применяться или в соответствии с настоящим описанием (предоставленным в таблице 2), или в соответствии со слегка измененным описанием, обусловленным оптимизацией частоты, потребляемой мощности в ваттах и параметров рабочего цикла для улучшения доставки активных веществ и стимуляции клеток/белков. Такие уточнения сохраняются в руководстве для маркировки о соответствии стандартам ЕС данного изделия.
Эффективность ультразвука (УЗ), или сонофореза, в доставке молекул в кожу зависит от двух аспектов его действия на кожу. Во-первых, кавитация вследствие быстрых осцилляций поля давления, вызывающих образование и коллапс пузырьков, которые механически создают каналы через роговой слой. Второй эффект представляет собой фактическое прямое нагревание материала, через который проходят звуковые волны, вследствие ослабления акустической энергии в связи с отражением, поглощением и рассеиванием. Это происходит в коже до четырех раз эффективнее, чем в других тканях вследствие ее гетерогенности. Известно, что нагревание разрушает систему липидного бислоя в роговом слое, также способствуя повышенной проницаемости эпидермиса.
По существу, проницаемость кожи повышается посредством разрушения межклеточных липидов в результате комбинированного действия нагревания и/или механического стресса и повышения пористости. Сообщалось о подъемах температуры до 50°С (20 кГц, 10-30 Вт/см2), но показано, что подъемы уже на 11°С (1 МГц, 2 Вт/см2) вызывают повреждение кожи. Действие ультразвука в постоянном режиме с интенсивностью 1 Вт/см2 повышает температуру тканей на глубине 3 см до 40°С за 10 минут. Полагают, что ткань должна достигать температуры 40-45°С в течение, по меньшей мере, 5 минут, чтобы быть терапевтически выгодной. Показано, что температура тканей повышается со скоростью 0,86°С/мин, при экспозиции ультразвуком 1 Вт/см2-1 МГц.
Известно, что действие ультразвука приводит к разрушению полимеров и применяется для усиления освобождения включенных в эти полимеры лекарственных препаратов. Когда ультразвук применяется к композиции согласно изобретению, содержащей полимеры, такие как полисахариды, предпочтительно протеогликаны, в частности глюкозаминогликаны, такие как НА, ультразвук будет разрушать (вызывать деполимеризацию) полимер. Это имеет множество эффектов, когда НА присутствует в композиции, ультразвук приводит к образованию полимеров НА с короткой цепью, которые являются способными более легко проникать в кожу. В дополнение к использованию ультразвука для улучшения проницаемости для активных веществ, важно, что эффективное время пребывания таких активных веществ в месте действия максимально. Микроциркуляторное русло дает возможность веществам удаляться из места проникновения для расщепления в печени. Оптимизация времени пребывания является необходимой для обеспечения требуемого эффекта активного вещества. Когда композиция согласно изобретению содержит полимеры, такие как полисахариды или протеогликаны, в частности глюкозаминогликаны, такие как НА, лечение ультразвуком будет способствовать образованию депо полимера (например, НА) в коже, которое может функционировать в качестве резервуара для медленного высвобождения активных веществ, обеспечивая увеличенную продолжительность эффекта.
Ультразвук также стимулирует освобождение активных ингредиентов композиции. Ультразвук будет также действовать в направлении деполимеризации полимерных полисахаридов или протеогликанов, в частности глюкозаминогликанов, таких как НА, которые проникли в кожу. Когда НА и аскорбиновая кислота присутствуют в композиции, деполимеризация НА будет стимулироваться аскорбиновой кислотой, в которой будет реагировать с атмосферным кислородом и стимулировать деполимеризацию.
Композиция согласно изобретению может применяться вместе с ультразвуком, но это не обязательно, композиция по изобретению может также наноситься на кожу без применения ультразвука. В предпочтительном способе лечения кожи первая композиция по изобретению применяется в комплексе с ультразвуком (или с предварительным воздействием ультразвука на кожу, на которую будет нанесена композиция, или с ультразвуковым воздействием на кожу во время или после нанесения композиции на кожу) еженедельно, раз в две недели или раз в месяц. После ультразвуковой обработки кожи может быть применена вторая композиция согласно изобретению, например, ежедневно или каждые 12 часов без необходимости применения ультразвука. Первая и вторая композиции могут быть одинаковыми или могут различаться по составу, но обе будут являться композициями в соответствии с изобретением.
Настоящее изобретение дополнительно предоставляет перевязочный материал, содержащий композицию в соответствии с изобретением, который может быть представлен в виде пластыря, повязки, гелевой повязки или пены.
Также предоставлен набор, содержащий композицию в соответствии с изобретением, и дополнительно устройство, включающее в себя источник ультразвука и/или дополнительно аппликатор для применения ультразвука на коже и/или нанесения композиции на кожу. Набор в соответствии с изобретением пригоден для осуществления способа изобретения, как описано здесь. Набор может дополнительно содержать инструкции по применению набора.
Изобретение предоставляет применение композиции в соответствии с изобретением в лечении косметического состояния кожи. Также предоставлено применение композиции в соответствии с изобретением в производстве косметической композиции для лечения косметического состояния кожи, например, выбранного из группы: шрамы, поврежденная солнцем кожа, стареющая кожа, морщины, неровность кожи, неравномерная пигментация, телангиэктазии, эластоз, целлюлит, кожа, напоминающая апельсиновую корку; сухость кожи, шелушение, акне, растяжки; высыпания, потрескавшаяся кожа, воспаленная кожа; кожа с пятнами, розацея, шрамы от акне, гипертрофические и келоидные шрамы и облысение.
Термин "косметические состояния кожи", применяемый здесь, включает симптомы старения кожи, которые включают, но не ограничены ими, все внешние видимые и осязаемые ощутимые проявления, так же, как и любые макро- и микроэффекты вследствие старения кожи. Такие признаки могут быть вызваны внутренними или внешними факторами, например хронологическим старением и/или повреждением под воздействием окружающей среды (например, солнечный свет, ультрафиолет, курение, озон, загрязнители, стресс и т.д.). Эти симптомы могут являться следствием процессов, которые включают, но не ограничены, развитие структурных неоднородностей, таких как морщины, включая и мелкие поверхностные морщинки, и грубые глубокие морщины, складки кожи, складки, возникающие на лице при наморщивании, мимические складки, морщины, дерматохелиоз, фотоповреждения, преждевременное старение кожи, трещины, бугорки, ямки, крупные поры (например, ассоциированные с придаточными структурами, такими как протоки потовых желез, сальные железы или волосяные фолликулы), кожа в виде "апельсиновой корки", сухость, шероховатость, чешуйчатость и/или другие формы неровности или шероховатости кожи; проблемы излишне жирной кожи, такие как избыточная выработка кожного сала, маслянистость, блеск лица, разрыв базальной мембраны; ненормальное слущивание (или шелушение) или ненормальная дифференцировка эпидермиса (например, ненормальный обмен в коже), такая как шероховатость, чешуйчатость, кератоз, гиперкератинизация; неадекватная влажность кожи (или гидратация), такая как вызванная повреждением кожного барьера, сухостью окружающей среды; потеря эластичности кожи (потеря и/или инактивация функционального эластина кожи), такая как эластоз, провисание (включая отечность в зоне вокруг глаз и челюстей), потеря кожей плотности, потеря натяжения кожи, потеря восстановления кожи после деформации; немеланиновое патологическое окрашивание кожи, такое как круги под глазами, дефекты (например, неровная красная окраска вследствие, например, розацеи), желтоватая окраска кожи (тусклый цвет), патологическое окрашивание, вызванное телангиэктазиями; связанные с меланином гиперпигментированные (или неравномерно пигментированные) участки кожи; гиперпигментация вследствие воспаления, такая как та, что возникает вслед за явлением воспаления (например, раной от акне, вросшим волосом, местом укуса насекомого/паука, царапиной, порезом, раной, ссадиной и тому подобным); атрофия, такая, но не ограниченная ею, как та, что ассоциирована со старением или применением стероидов; другие гистологические или микроскопические изменения компонентов кожи, такие как основное вещество (например, гиалуроновой кислоты, глюкозаминогликанов и т.д.), разрушение коллагена и структурные изменения или аномалии (например, изменения в роговом слое, дерме, эпидермисе, кожной сосудистой системе, как при телангиэктазии); ответные реакции кожи на повреждение, такое как чесотка или зуд; и изменения подстилающих тканей (например, подкожного жира, водно-жировых отложений, мышц, трабекул, септ и тому подобного), особенно расположенных проксимально относительно кожи.
Изобретение также предусматривает применение композиции соответственно изобретению для медицинского лечения или в качестве медикамента. Таким образом, композиция согласно изобретению предназначается для применения как медикамент. Дополнительно предусматривается применение композиции соответственно изобретению в производстве медикамента для лечения состояний кожи, например, выбранного из группы: рубец, солнечный ожог, раны, порезы, кровоподтеки, ожоги, рубцы после ожогов, экзема, дерматит, явления сухости кожи, крапивница, псориаз.
Перечень чертежей
Фиг.1 (а)-(с) показывают расположение излучающих элементов; фиг.1(d) показывает отдельный излучающий элемент с двухчастотной характеристикой.
Фиг.2 (a)-(b) показывают излучающий элемент.
Фиг.3А показывает одиночный DDS чип для генерирования альтернативных высоких и низких частот, в то время как на фиг.3В высокие и низкие частоты генерируются отдельными контурами.
Фиг.4 показывает действие Рецептуры Topical 1 на экспрессию фибриллина вблизи дермально-эпидермального соединения.
Фиг.5 показывает действие Рецептуры Topical 1 на экспрессию ММР-1 в эпидермисе.
Фиг.6 показывает действие Рецептуры Topical 1 на экспрессию RARα в эпидермисе.
Фиг.7 показывает действие Рецептуры Topical 1 на экспрессию HSP72 в эпидермисе.
Фиг.8 показывает действие Рецептуры Topical 1 на экспрессию фибриллина вблизи дермально-эпидермального соединения после лечения ультразвуком.
Фиг.9 показывает действие Рецептуры Topical 1 на экспрессию ММР-1 в эпидермисе после лечения ультразвуком.
Фиг.10 показывает действие Рецептуры Topical 1 на экспрессию HSP72 в эпидермисе после лечения ультразвуком.
Фиг.11 показывает действие Рецептуры Topical 1 на экспрессию кожного кластерина после лечения ультразвуком.
Примеры
Пример 1. Рецептуры Topical 1
Topical 1 представляет собой композицию в соответствии с изобретением, содержащую следующие компоненты:
Пример 2. Тестирование с помощью повязки
Стандартный четырехдневный тест с помощью повязки удлинен до периода в семь дней для исследования эффекта Рецептуры Topical 1 под повязкой или доставленной при помощи ультразвука на индукцию экспрессии фибрина как механизма, при помощи которого могут быть уменьшены клинические признаки фотостарения.
Субъектам с клиническими доказательствами фотостарения кожи предплечья на тыльную поверхность предплечья под повязкой наносят следующие продукты:
(1) 0,025% t-RA, дополненный носителем, содержащим 67,2% этанола, 30% пропиленгликоля и 0,05% бутилгидрокситолуола (консервант), доведенным до 100% деионизированной водой (положительный контроль),
(2) Только плацебо, указанное выше,
(3) Рецептура Topical 1.
Рецептура Topical 1 доставляется с применением и без применения ультразвукового устройства.
В качестве положительного контроля местное нанесение 0,025% полностью транс-RA под повязкой применяется в течение стандартного четырехдневного интервала времени для сведения к минимуму потенциально вредных побочных эффектов.
Фибриллин является главной составляющей эластиновой сети в сосочковом слое дермы и играет важную роль в укреплении эпидермиса на нижерасположенной дерме. Местное применение полностью транс-ретиноевой кислоты (t-RA) в качестве положительного контроля уменьшает клинические проявления фотостарения. Предшествующая работа продемонстрировала, что местное применение t-RA под повязкой в течение четырех дней (четырехдневный тест с помощью повязки) вызывает значительное повышение уровней мРНК и белка фибриллина, предвещающие повышение этих уровней, наблюдаемое после нескольких недель местного применения без повязки, обеспечивающего быстрые и удобные пути оценки действия новых терапевтических вмешательств на коже.
Старение может контролироваться посредством определения других молекул в коже. Предшествующая работа определила изменения экспрессии металлопротеиназы 1 ферментативного матрикса (ММР-1; незаменимой для обновления внеклеточного матрикса)3 и ядерного ретиноидного рецептора ретиноевой кислоты α (RARα; необходимый для модуляции эффектов витамина А и его производных)4. Были исследованы два молекулярных шаперона для определения путей элиминации анормальных белков; они представляли собой белок теплового шока-72 (HSP-72)5 и внеклеточный шаперон, кластерин6.
Исследование представляло собой открытое клиническое исследование; оценка биопсийного материала являлась рандомизированной и слепой. Исследование проводилось на 10 субъектах, в возрасте 40-80 лет, у которых, как считалось, имелись признаки фотостарения на коже предплечья от средней до тяжелой степени.
Используемыми критериями включения являлись:
возраст от 40 до 80 лет; согласие подвергнуться исследованию состаренной в результате инсоляции кожи предплечья; согласие носить тестовые повязки на предплечье вплоть до 4 дней; согласие подвергнуться 3 мм пункционной биопсии из каждой их четырех тестируемых зон (в общем 4 биопсии); отсутствие болезненных состояний, которые могли бы ослаблять оценку тестируемых областей; субъекты не должны принимать лекарственные препараты системного действия; отсутствие местного или системного применения ретиноидов в последние 6 месяцев и 12 месяцев соответственно перед началом исследования; отсутствие местного применения стероидов или других местных препаратов в течение 2 недель; подписанное информированное согласие.
Критериями исключения являлись:
анамнез применения экспериментальных препаратов или экспериментального устройства в течение 30 дней до начала исследования; келоидные рубцы в анамнезе; беременность или грудное вскармливание.
Процедура исследования включает сбор анамнеза и физикальное обследование; клиническая оценка выраженности фотостарения кожи наружной поверхности предплечья по 0-9 балльной шкале (0 = отсутствие повреждения; 9 = максимальное фотоповреждение); получение письменного, заверенного, информированного согласия. Субъекты, согласившиеся с условиями исследования, имеют степень повреждения 6 или выше.
Материалы и способы
Протокол теста повязки
Набирают шесть здоровых, но имеющих признаки фотостарения добровольцев-женщин (возраст в пределах 52-79 лет). На разгибательную поверхность предплечья по-отдельности наносят в стандартных 6 мм лунках Финна следующие вещества: Рецептура Topical 1 (20 мкл/лунку), основа-плацебо (20 мкл/лунку) и 0,025% полностью транс-RA (Retin-A® крем, Janssen-Cilag Ltd., 20 мкл/лунку). Дополнительно в качестве контрольной точки берется исходная биопсия до лечения. Рецептуры применяют на чистую кожу в 1 и 4 дни исследования. Полностью транс-RA применяют на необработанном участке в 4 день. На 8 день лунки Финна удаляют и берут 3 мм пункционные биопсии под местной анестезией 1%-ным раствором лигнокаина из каждого тестируемого участка. Биопсийный материал погружают в ОСТ соединение (Tissue-Tek®, Miles, IN, USA) и быстро замораживают в жидком азоте. Участки биопсии ушивают 1×4/о этилоном и субъектам предписывают вернуться через 7-10 дней для удаления шва.
Ультразвуковой протокол
Набирают 10 здоровых, но имеющих признаки фотостарения добровольцев (мужчины: 2; женщины: 8; возрастной диапазон 40-79 лет). Рецептура Topical 1 наносится на разгибательную поверхность предплечья отдельно и при помощи ультразвукового устройства (изделие Duo SonTM, Orthosonics, Devon UK). Низкая частота (45 кГц, 100 мВт/см2, постоянный режим) и высокая частота (1 МГц, 1 Вт/см2 в среднем в пульсе, 20%-ный рабочий цикл) применяются одновременно десять минут, в течение которых головка для доставки ультразвука двигается по коже. Воздействие происходит в 1, 4 и 7 дни исследования. На 8 день проводится 3 мм пункционная биопсия из каждого обработанного участка, как описано выше.
Получение срезов
Получают замороженные срезы толщиной 10 мкм (криостат OTF, Bright Instruments Ltd.) и помещают на покрытые желатином предметные стекла перед гистологическим исследованием.
Иммуногистохимия
Известно, что количество множества молекул внеклеточного матрикса (ЕСМ), сниженное в состаренной инсоляцией коже, исследуется посредством методов иммуногистохимии для детализации возможных эффектов Рецептуры Topical 1 и способов ее доставки. Первичным маркером результата является распределение богатых фибриллином микрофибрил проксимально от дермально-эпидермального соединения (DEJ). Также определяется количество эпидермальных кератиноцитов, экспрессирующих ММР-1 и RARα. Молекулярные шапероны, HSP72 и кластерин исследуются для определения потенциальных механизмов восстановления.
В каждом исследовании маркер определялся в каждом из трех срезов (например, 3 среза/воздействие/пациент).
Срезы фиксируют оптимальным образом. После гидратации в трис-буферном растворе (TBS; 100 мМ Tris, 150 мМ NaCl) срезы солюбилизируют посредством добавления 0,5% Triton®-X 100 (10 минут). После промывания активность эндогенной пероксидазы ликвидируется посредством инкубации при избытке перекиси водорода в метаноле (30 минут). Срезы блокируют перед применением первичного антитела (инкубация в течение всей ночи при 4°С). Отрицательные контроли параллельно инкубируют или с блокирующим раствором в отдельности, или с контрольной мышиной сывороткой. После инкубации срезы тщательно промывают TBS перед применением соответствующего биотинилированного вторичного антитела. Оно дополнительно конъюгируется с ферментом пероксидазой хрена с применением коммерчески доступного набора, следуя инструкциям производителя (АВС Elite System, vector Laboratory, Peterborough, UK). Антитела локализуют с применением Vector SG® в качестве хромогена (инкубация 10 минут, промывание в TBS, блокирующем эту реакцию). Срезы дополнительно окрашивают с применением красителя Nuclear Fast Red и в конце дегидратируют, проводя через серийные разведения спиртов, просветляют и заключают.
Количественная оценка
Срезы перемешивают для анализа в слепую и изучают под микроскопом Nikon OPTIPHOT (Токио, Япония). Для определения компонентов ЕСМ степень иммуноокрашивания определяется по 5-балльной полуколичественной шкале, где 0 = отсутствие окрашивания и 4 = максимальное окрашивание. Четыре среза (включая контроль) исследуют для каждого пациента и для каждого участка. Степень иммуноокрашивания измеряют для трех полей каждого среза при высоком увеличении и средний результат рассчитывают для каждого участка/тестируемой области.
Для ассоциированного с клетками окрашивания количество положительных эпидермальных кератиноцитов определяют для одного поля при высоком увеличении, и средний показатель рассчитывают для каждого участка/тестируемой области.
Достоверность различий в распределении между тестируемыми участками до и после применения тестируемых веществ в течение изменяющегося периода времени определяют с применением повторяющихся измерений дисперсионного критерия (ANOVA). Для определения, влияют ли способы доставки на результат измерений, данные тестируют с применением парного t-теста Стьюдента. Обе модели тестируют с применением программного обеспечения SPSS+(v11,5, SPSS Inc., IL USA) с уровнем достоверности 95%.
Результаты
Эритема
Все добровольцы были достаточно устойчивы к тесту повязки. Более того, при применении полностью транс-RA проявилась выраженная эритема в месте применения. Эритема не наблюдалась в случае применения Рецептуры Topical 1.
Протокол тестирования повязки
Фибриллин-1 IHC
Применение полностью транс-RA ("золотого" стандарта) вызывает перемещение фибриллина-1 проксимально к DEJ у 3/6 добровольцев. Рецептура Topical 1 приводит к повышенному перемещению фибриллина 1 у 4/6 испытуемых добровольцев, но на более низком уровне, чем это обычно наблюдается при использовании полностью транс-RA (фиг.4).
MMP-1 IHC
Окрашивание MMP-1 наблюдалось и в эпидермисе, и в дерме. В целом, местное применение полностью транс-RA в течение 4-х дней под повязкой снижает экспрессию MMP-1 в эпидермальных кератиноцитах, хотя это не достигает достоверных значений. Применение Рецептуры Topical 1 приводит к такому же уровню снижения (фиг.5).
RARα IHC
Окрашивание RARα наблюдается в первую очередь в эпидермисе. В целом, местное применение полностью транс-RA в течение 4-х дней под повязкой достоверно снижает экспрессию RARα в эпидермальных кератиноцитах. Применение Рецептуры Topical 1 приводит к такому же уровню снижения экспрессии, хотя оно не достигает достоверности в этой совокупности данных.
HSP72
HSP72 обнаруживается, главным образом, в эпидермисе, где наблюдается сильное окрашивание. Воздействие полностью транс-RA значительно повышает экспрессию эпидермального HSP72, как при применении Рецептуры Topical 1 (p=0,005 и 0,012 соответственно; фиг.7).
Протокол ультразвукового воздействия
Фибриллин-1
Рецептура Topical 1 далее наносилась на фотосостаренную кожу разгибательной поверхности предплечья посредством базового нанесения без повязки или посредством ультразвукового устройства. У всех испытуемых (n=10) доставка ультразвуком приводит к достоверно повышенному перемещению фибриллина проксимально к дермально-эпидермальному соединению (фиг.8)
ММР-1
Окрашивание ММР-1 наблюдается и в эпидермисе, и в дерме. Отмечается слабое, недостоверное снижение экспрессии ММР-1 в эпидермальных кератиноцитах вслед за ультразвуковым воздействием (фиг.9)
HSP72
HSP72 показывает легкое, но недостоверное, повышение эпидермальной экспрессии после ультразвукового воздействия (фиг.10).
Кластерин
Кластерин также демонстрирует слабое, но недостоверное, повышение дермальной экспрессии вслед за ультразвуковым воздействием (фиг.11)
Резюме
Нанесение Рецептуры Topical 1 с использованием ультразвукового устройства значительно повысило перемещение фибриллина проксимально к дермально-эпидермальному соединению в поврежденной инсоляцией коже.
Экспрессия HSP72 модулировалась и Рецептурой Topical 1, и полностью транс-RA. Кроме того, ультразвуковая доставка Рецептуры Topical 1 также приводила к повышенной экспрессии HSP72. Возможно, что повышенная экспрессия белка теплового шока может являться благоприятной для кожи, посредством "стимулирования" клеток для борьбы со стрессовыми факторами внешней среды (гормезис - стимулирующий эффект токсических веществ в малых дозах). Следовательно, повышенная экспрессия HSP72 эпидермальными кератиноцитами может вовлекаться в репаративные процессы в клетках после повреждения.
Полученные данные позволяют предположить, что наблюдается снижение экспрессии ММР-1 и RARα в эпидермисе поврежденных инсоляцией клеток вслед за нанесением этой рецептуры, что подтверждает ее пригодность для применения в лечении состаренной кожи.
Дополнительно были проведены последующие неколичественные наблюдения в процессе испытаний эффективности лечения кожи на основе ультразвука. Оказалось, что Рецептура Topical 1, применяемая вместе с ультразвуком, хотя нельзя прямо сравнить из-за состава протокола испытания, приводит к такому же уровню фибриллина, как и ретиноидная рецептура. Рецептура Topical 1 в отдельности и Рецептура Topical 1, используемая с ультразвуком, не вызывала эритему или гиперплазию эпидермиса, в отличие от ретиноидной рецептуры. Степень рубцевания на участках биопсии, предварительно обработанных ультразвуком, была заметно ниже, чем рубцевание на всех других участках.
Источники информации
1. Watson REB, Griffiths СЕМ, Craven N.M., Shuttleworth C.A., Kielty C.M. Fibrillin-rich microfibrils are reduced in photoaged skin: Distribution at the dermo-epidemial junction. J Invest Dermatol, 112: 782-787, 1999.
2. Watson REB, Graven N.M., Kang S., Jones CJP, Kielty C.M., Griffiths СЕМ. А short term screening protocol, using fibritlin-1 as a receptor molecule for photoageing repair agents. J Invest Dermatol, 116: 672-678, 2001.
3. Brennan М., Bhatti H., Nerusu K.С., Bhagavathula N., Kang S., Fisher G.J., Varani J., Voorhees J.J. Matrix metalloproteinase-1 is the major collagenolyfic enzyme responsible for collagen damage in UV-irradiated human skin. Photochem Photobiol, 78: 43-48, 2003.
4. Watson REB, Ratnayaka J.A., Brooke R.C., Yee-Sit-Yu S., Ancian P., Griffiths СЕМ. Retinoic acid receptor alpha expression and cutaneous ageing. Mech Ageing Dev, 125: 465-473, 2004.
5. Jantschitsch С., Trautinger F. Heat shock and UV-B-induced DNA damage and mutagenesis in skin. Photochem Photobiol Sci. 2:899-903, 2003.
6. Debure L., Vayssiere J.L., Rincheval V., Loison F., Le Drean Y., Michel D. Intracelluiar clusterin causes juxtanuctear aggregate formation and mitochondrial alteration. J Cell Sci. 116: 3109-3121, 2003.
Реферат
Изобретение относится к медицинской технике, а именно к устройствам для воздействия на кожу. Устройство включает множество ультразвуковых излучающих элементов, расположенных в виде системы в гибком материале в пространственной конфигурации, при этом ультразвуковые излучающие элементы способны к доставке ультразвука низкой и высокой частоты к области кожи. Устройство входит в состав набора для применения ультразвука на коже, включающего также гелевую подушечку, содержащую композицию и сконфигурированную для размещения между гибкой системой и обрабатываемой областью кожи. Использование изобретения позволяет расширить арсенал средств для лечения дерматологических состояний с использованием ультразвука. 2 н. и 7 з.п. ф-лы, 12 табл., 11 ил.

Комментарии