Способ нейтрон-захватной терапии злокачественных опухолей и устройство для его осуществления - RU2141860C1
Код документа: RU2141860C1
Чертежи








Описание
Изобретение относится к медицине, к лучевой терапии при предварительном введении препаратов в организм, и может быть использовано для нейтрон-захватной терапии злокачественных опухолей с использованием гадолиний- и/или борсодержащих препаратов.
Известен способ лечения злокачественных опухолей, в частности опухолей головного мозга, путем введения в опухоль металлических клипс, что при лучевой терапии снижает экспозиционную дозу излучения на величину дополнительного рассеянного излучения в ≈1,5 раза. Исключая хирургическое вмешательство, используют комплексные соединения радиоактивных изотопов, которые способны накапливаться в опухолевых клетках и уничтожать их действием своего радиоактивного излучения. Однако процесс накопления в опухолевых клеток весьма продолжителен (несколько часов), что сопровождается облучением здоровых тканей организма в процессе миграции препарата по органам и тканям организма.
Известен способ лечения злокачественных опухолей методом нейтрон-захватной терапии. Метод заключается в предварительном накоплении в опухоли соединений со стабильными изотопами10B или157Gd, последующем облучении опухоли потоком тепловых нейтронов. При этом атомы10B поглощают нейтроны с испусканием вторичного излучения α-частиц и низкоэнергетических γ-квантов, которое полностью поглощается клетками опухоли, что приводит их к гибели. Поглощенная опухолью доза излучения пропорциональна произведению потока тепловых нейтронов в сечении их захвата атомами10B. При использовании157Gd в опухоли возникает вторичное γ-излучение, электроны конверсии и Оже-электроны. Сечение захвата тепловых нейтронов157Gd в 66 раз больше сечения захвата10B, что увеличивает число актов взаимодействия в единице объема опухоли. Данное техническое решение, используемое для лечении меланомы, принято за прототип.
Известно устройство для лучевой терапии содержащее ядерный реактор с биологической защитой; радиальные горизонтальные каналы, в которых размещены фильтры из тяжелых металлов: W, Pb, Bi для формирования необходимой мощности потока. Данное устройство позволяет облучать биологические объекты тремя видами излучений: быстрыми нейтронами, тепловыми нейтронами и позитронами. В реакторе установлена сложноорганизованная активная зона, снаружи которой размещены два подвижных кольца-замедлителя, содержащих жидкий состав с различными поглотителями. Устройство содержит 4 радиальных канала, соединяющие активную зону с рабочими камерами, а поворотные кольца замедлителя обеспечивают заданный режим облучения. Однако для нейтрон-захватной терапии подвижные кольца замедлителя не обеспечивают в радиальных каналах необходимое уменьшение плотности потока быстрых нейтронов и γ-лучей.
Наиболее близким техническим решением, принятым за прототип предложенного устройства, является устройство для облучения опухоли, включающее активную зону реактора, горизонтальный канал с графитовым рассеивателем, фильтр, коллиматор переменного сечения, рабочую камеру со столом для размещения биологического объекта внутри биологической защиты. Данное устройство обеспечивает увеличение мощности потока нейтронов с энергиями до 0, 4-0,8 МэВ при снижении доли тепловых нейтронов с энергиями ниже 0,4 МэВ для уменьшения теплового поражения здоровых тканей. Технический уровень водо-водяного реактора в стандартном исполнении обеспечивает следующие характеристики полей излучения: плотность потока тепловых нейтронов - 3•108 тн/см2•с, плотность потока быстрых нейтронов - 1,2• 107 бн/см2•с при мощности дозы фонового γ-излучения 1,2 Р/с. Указанные параметры не обеспечивают эффективности нейтрон-захватной терапии, поскольку плотность потока тепловых нейтронов мала и его использование удлиняет время облучения, что из-за высокой мощности фонового γ-излучения приводит к радиационному поражению биологического объекта.
Единой технической задачей, на которую направлена группа изобретений, является повышение эффективности нейтрон-захватной терапии путем создания высокой концентрации атомов10B и157Gd в ткани опухоли, увеличения плотности потока тепловых нейтронов при снижении (мощности) фонового γ-излучения.
Указанная задача решена тем, что в способе нейтрон-захватной терапии злокачественных опухолей в эксперименте, включающем введение в биологический объект бор- и/или гадолинийсодержащих препаратов, облучение объекта потоком нейтронов и оценку эффективности терапии, согласно изобретению в биологический объект вводят бор- и/или гадолинийсодержащее соединение в пролонгированной лекарственной форме и затем его облучают пучком тепловых нейтронов диаметром 20-150 мм с потоком 5• 108-109 тн/см2с с мощностью дозы фонового γ-излучения в пучке не более 0,14 Р/с, в течение 15-60 мин. В качестве биологического объекта используют мелких лабораторных животных с перевитыми опухолями или фантом головы человека, с плоскими полиэтиленовыми емкостями, заполненными пролонгированными лекарственными формами бор- и/или гадолинийсодержащих соединений, а бор- и/или гадолинийсодержащие соединения в виде пролонгированных лекарственных форм вводят непосредственно в опухоли за 5 мин до облучения потоком нейтронов.
Указанная задача решена также тем, что в устройстве, содержащем ядерный реактор с каналом, соединяющим активную зону и рабочую камеру, с подвижным столиком для размещения биологического объекта и с биологической защитой, а также систему формирования нейтронного пучка с рассеивателем, фильтром, коллиматором переменного сечения, согласно изобретению в нем горизонтальный канал с графитовым рассеивателем размещен по касательной к активной зоне водяного ядерного реактора и на выходе в рабочую камеру закрыт диафрагмой с диаметром отверстия от 20 до 150 мм; система формирования нейтронного пучка состоит из пяти шиберных колец, в трех центральных из которых вставлен конусообразный коллиматор с углом расходимости α = 1-2o, выполненный из полиэтилена высокого давления с плотностью ρ - 0,97 г/см3, при этом в 3-м по ходу пучка шиберном кольце установлен фильтр из поликристаллического висмута с плотностью ρ - 9,75 г/см3, отношение которого l к расстоянию до диафрагмы L равно l/L=1/(30-40); при этом в первом шиберном кольце размещены свинцовая и полиэтиленовая втулки, а биологическая защита рабочей камеры снабжена подвижным, соединенным со столиком блоком, поверхность которого выполнена в виде уступов, сопрягаемых с аналогичными уступами внутренней поверхности рабочей камеры; стационарная биологическая защита рабочей камеры выполнена из стальных каркасов, заполненных послойно свинцом и борированным полиэтиленом с толщиной слоя 5-6 см. При этом на столике установлены параллельно две рамки, на первой, перед диафрагмой, выполнены фиксаторы для крепления биологического объекта или фантома головы, на второй рамке, на закрепленной на ней пластине из оргстекла нанесены юстировочные концентрические окружности для ориентации нейтронного пучка и установке детекторов-дозиметров.
Заявленная группа изобретений соответствует требованию "единство изобретения", поскольку предложенное устройство предназначено для осуществления способа, и оба объекта направлены на решение одной и той же задачи с получением единого полезного результата.
Полезный результат заключается в том, что на стандартном реакторе получен поток тепловых нейтронов с плотностью 5•108-109 тн/см2 •с, что выше, чем в прототипе (в 30 раз), c мощностью дозы фонового γ-излучения в пучке 0,14 Р/с (снижена в 8 раз). В сочетании с предлагаемым устройством применение пролонгированных лекарственных форм бор- и/или гадолинийсодержащих соединений позволяет получить высокий терапевтический эффект нейтрон-захватной терапии злокачественных опухолей (около 80%).
Изготовленная экспериментальная установка смонтирована на базе водо-водяного реактора ИРТ. Проведенные дозиметрические измерения показали полное соответствие параметров установки указанным в изобретении и требованиям действующиx НРБ и ОСП. Установка способна работать с использованием в качестве биологических объектов мелких лабораторных животных или фантома головы. Приготовленные пролонгированные формы бор- и/или гадолинийсодержащих соединений отличаются замедленным всасыванием из места введения и злокачественной опухоли, что обеспечивает поддержание нужных нейтрон-захватной терапии концентраций10B и157Gd во все время облучения. Предлагаемое изобретение как в части устройства, так и в части лекарственных форм используется в экспериментальных исследованиях. Таким образом, предложение заявителя соответствует критерию изобретения "промышленная применимость".
Проведенный авторами поиск по патентным и научно-техническим источникам не выявил аналогов для способа и устройства заявленной группы, характеризуемой признаками, идентичными по своим свойствам и полученному результату в своей совокупности существенным признакам известных технических решений в данной области, что позволяет считать предложение заявителя соответствующим критерию изобретению "изобретательский уровень". Отдельные элементы устройства и материалы для их изготовления известны, однако, их использование для нейтрон-захватной терапии в указанной в изобретении совокупности не известно и практически не применяется. Аналогично не известны пролонгированные лекарственные формы бор- и гадолинийсодержащих соединений.
При сравнении предложения заявителя с прототипами выявлено, что способ отличается характером биологического объекта, лекарственных форм бор- и гадолинийсодержащих соединений и характеристиками потока нейтронов, а устройство отличается геометрическим расположением и устройством канала для формирования потока тепловых нейтронов, экспериментально подобранными материалами и геометрией основных элементов устройства, что позволяет считать предложение заявителя соответствующим критерию изобретения "новизна".
Суть изобретения заключается в том, что для формирования пучка тепловых нейтронов по предлагаемому способу на стандартном водяном реакторе ИРТ мощностью 2,5 МэВ потребовалось создать горизонтальный канал, касательный к активной зоне, отстоящий от ее центра на 395 мм, что позволило уменьшить долю быстрых нейтронов и γ -излучения в пучке. В касательном канале в плоскости A3 установлен графитовый рассеиватель длиной 400 мм, который в зависимости от толщины и материала увеличивает вклад тепловых нейтронов в потоке. При этом количество быстрых нейтронов уменьшается в 20 раз, а γ-излучения - в 50 раз (в случае использования графита толщиной 150-200 мм) (фиг. 1 и 5). Для формирования пучка тепловых нейтронов в касательном канале в трех центральных шиберных кольцах установлен коллиматор из полиэтилена высокого давления. Выбор полиэтилена высокого давления обусловлен наличием в нем максимального числа рассеивающих γ-излучение центров по сравнению с другими марками полиэтилена. Экспериментально установлено, что расходимость коллиматора α = 1,8 - 2,0o, что обеспечивает фокусирование тепловых нейтронов и уменьшение доли быстрых нейтронов и γ-излучения в пучке. Коллиматор представляет собой усеченный конус с диаметром входного отверстия 126 мм и выходного - 60 мм. Полиэтилен высокого давления, с выбранной плотностью ρ - 0,97 г/см3 обеспечивает дополнительный сбор тепловых нейтронов.
Для ослабления выходящего из
канала
потока
γ\-излучения в 3-м шиберном кольце по ходу пучка нейтронов установлен фильтр из
поликристаллического висмута. Из различных материалов - уран, молибден, свинец, висмут - был
выбран
поликристаллический висмут с плотностью ρ - 9,75 г/см3 (фиг. 2), который
незначительно уменьшает количество тепловых нейтронов, но эффективно поглощает γ-излучение.
Выбор
поликристаллического висмута объясняется также тем, что он имеет требуемую кристаллическую
структуру и является доступным материалом. Экспериментально было установлено, что оптимальное
размещение
фильтра определяется следующей формулой:
l/L=1/(30-40),
где l - толщина
фильтра, L - расстояние между фильтром и диафрагмой, 30-40 - экспериментально подобранный
коэффициент.
Зависимость плотности потока тепловых нейтронов и интенсивности фонового γ -излучения и их отношения от положения висмутового фильтра приведены на фиг. 6 и 7.
В первом шиберном кольце, расположенном вблизи диафрагмы, установлены полиэтиленовая и свинцовая втулки, которые определяют окончательную мощность фонового γ-излучения, равную 0, 10-0,14 Р/с.
Таким образом, каждый элемент устройства вносит свой вклад в сохранение потока тепловых нейтронов вблизи биологического объекта и снижает уровень потока быстрых нейтронов и мощность фонового γ-излучения в пучке. При этом значения двух последних соответствуют требованиям действующих НРБ и ОСП.
Величина диаметра диафрагмы, формирующего пучок тепловых нейтронов, устанавливается в диапазоне 10-150 мм, что соответствуют геометрии биологического объекта - лабораторным животным с перевитыми опухолями или фантому головы.
Рабочая камера, в которой размещается столик с биологическим объектом, окружена биологической защитой (фиг. 3 и 4). Защита состоит из стационарного и четырех подвижных, соединенных со столиком блоков. Замковая конфигурация стационарного и подвижных блоков в закрытой рабочей камерой позволяет избежать прямых прострелов нейтронов и γ-излучения. Стационарные блоки выполнены из монолитного железобетона. Подвижные блоки состоят из слоев свинца и нейтроностоп-борированного полиэтилена толщиной 5-6 см.
На столике установлены две параллельные рамки из оргстекла. На рамке, отстоящей от диафрагмы на 6 см, фиксируется биологический объект. Вторая рамка отстоит от первой на 30 см и снабжена сменной пластиной из оргстекла с нанесенными на ней с шагом 1-2 см (в зависимости от размеров биологического объекта) концентрическими окружностями, центр которых совпадает с осью пучка тепловых нейтронов. Окружности предназначены для юстировки пучка и размещения детекторов-дозиметров.
Пример реализации способа.
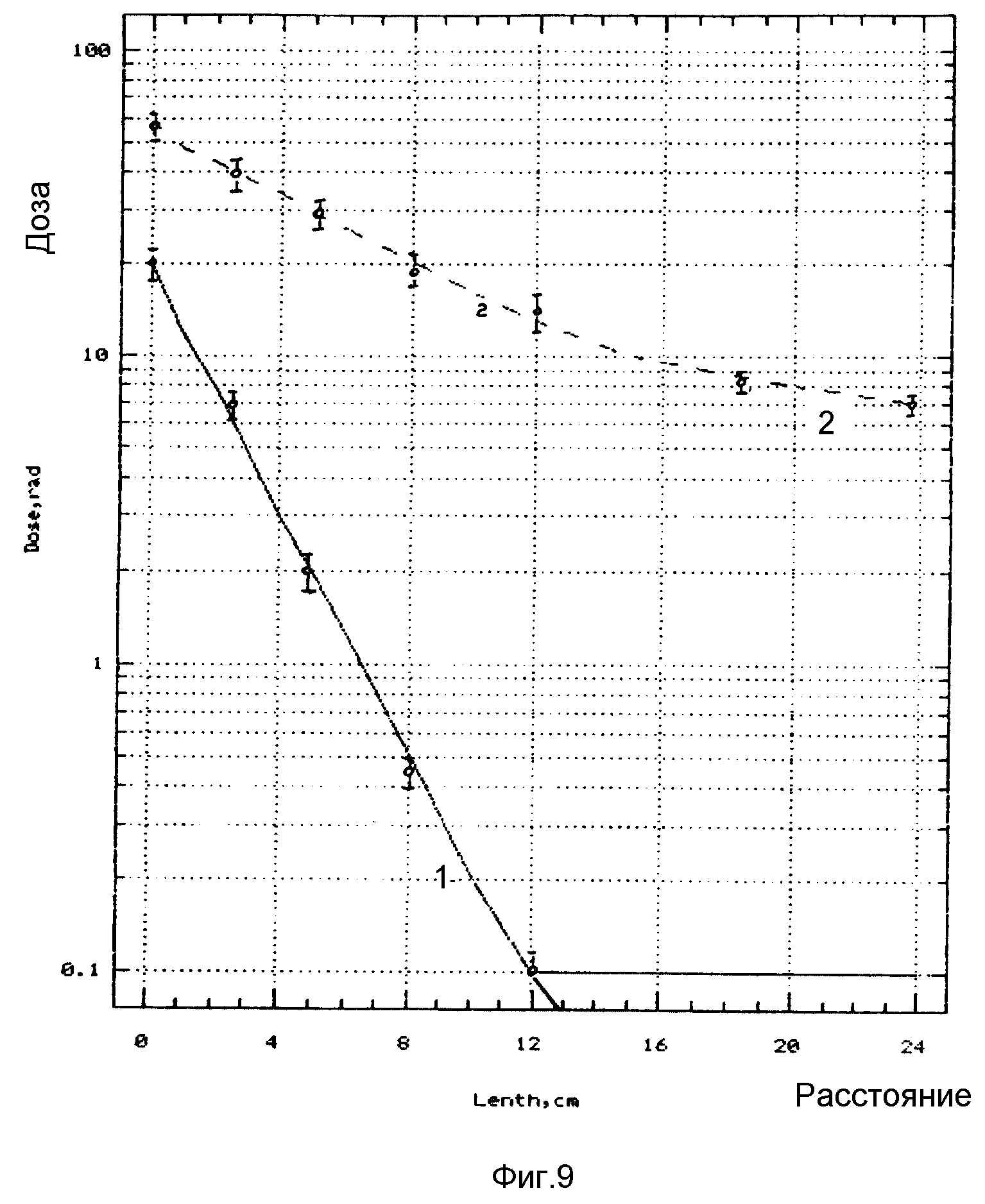
Экспериментальные исследования по нейтрон-захватной терапии были проведены на лабораторных животных - мышах и крысах в количестве 250 шт. и фантоме головы. Фантом головы представляет собой шар из оргстекла с каналами, оборудованными ячейками для вставки полиэтиленовых пакетов с пролонгированными лекарственными формами бор- и гадолинийсодержащих соединений и пластинчатых детекторов излучения (фиг. 4). Приготовленные пролонгированные лекарственные формы бор- и гадолинийсодержащих соединений вводились непосредственно в перевитую опухоль за 5 мин до облучения животных тепловыми нейтронами. Эксперименты проводились на саркомах Йенсена, Уокера и S45. Использование пролонгированных лекарственных форм обеспечивает содержание10B в опухоли на уровне не ниже 35 мкг/г и157Gd - не ниже 180 мкг/г в течение 50-60 мин. Полученные результаты экспериментальной проверки предлагаемого способа и устройства для нейтрон-захватной терапии злокачественных опухолей на лабораторных животных приведены в таблице, а с использованием фантомов - на фиг. 8,9. На фиг. 8а представлено глубинное распределение доз в гомогенном фантоме крысы, где 1 - поток тепловых нейтронов; 2 - доза γ-излучения вдоль оси пучка излучения реактора; 3 - поток тепловых нейтронов (х20); 4 - доза γ -излучения (х10) для нормального сечения на расстоянии 70 мм вправо от оси пучка. На фиг. 8б представлено распределение доз в фантоме крысы с моделью опухоли, содержащей гадолиний, на глубине 0,6 см от поверхности, где 1 - керма нейтронов; 2 - доза γ-излучения. На фиг. 8в - то же, что на фиг. 8б, но для локализации модели опухоли на глубине 1 см от поверхности. На фиг. 9 представлено глубинное распределение доз в гомогенном фантоме головы человека, где 1 - керма нейтронов; 2 - доза γ -излучения.
На животных с другими перевитыми опухолями получены следующие величины выживаемости: 80±4% (саркома Уокера) и 82±5 (саркома S45).
Устройство изображено на фиг. 1-4, где на фиг. 1 представлен общий вид устройства; на фиг. 2 - размещение и устройство канала для формирования пучка тепловых нейтронов; на фиг. 3 - подвижный столик для размещения биологического объекта с блоками защиты; на фиг. 4 - фантом головы.
Устройство (фиг. 1) содержит активную зону 1 с горизонтальным касательным каналом 2, на выходе которого установлена свинцовая диафрагма 3 в рабочей камере 4. Канал проходит через пять шиберных колец 5. Подвижные блоки защиты 6 имеют замковую поверхность в виде уступов со стационарной защитой 7 рабочей камеры. На подвижном столике 8 установлены рамки 9 для фиксации биологического объекта для юстировки и дозиметрии пучка.
В канале (фиг. 2) в плоскости A3 установлен графитовый рассеиватель 10. В центральных шиберных кольцах (II, III, IV) установлен конусообразный коллиматор 11 из полиэтилена высокого давления. В шиберном кольце III размещен висмутовый фильтр 12. В шиберном кольце 1 установлены полиэтиленовая 13 и свинцовые 14 втулки.
На подвижном столике (фиг. 3) расположены рамки 15, на одной из которых фиксируется биологический объект 16, а на другую нанесены юстировочные кольца 17 и установлены детекторы-дозиметры 18.
Работа устройства. Биологический объект и детекторы-дозиметры фиксируются на рамках подвижного столика, после чего столик с защитой задвигается в рабочую камеру. Открываются шиберные кольца, фиксируется время облучения. Облучение прекращается закрыванием шиберных колец, выдвигается столик, снимаются детекторы для спектрометрического анализа и дозиметры для расчета доз и биологический объект (животные) для последующего наблюдения.
Реферат
Изобретение может быть использовано в медицине, а именно в лучевой терапии. Вводят в биологический объект (за 5 мин до облучения) бор- и/или гадолинийсодержащее соединение в пролонгированной лекарственной форме. Облучают его пучком тепловых нейтронов диaметром 20-150 мм с потоком 5•108 - 109 тн/см2 •с с мощностью дозы фонового γ -излучения в пучке не более 0,14 Р/с, в течение 15-60 мин. Устройство содержит горизонтальный канал с графитовым рассеивателем, размещенный по касательной к активной зоне водяного ядерного реактора и на выходе в рабочую камеру закрытый диафрагмой с диаметром отверстия от 10 до 150 мм. Система формирования нейтронного пучка состоит из пяти шиберных колец, в трех центральных из которых вставлен конусообразный коллиматор с углом расходимости α = 1,8 - 2o, выполненный из полиэтилена высокого давления, с плотностью ρ = 0,97 г/см3. В третьем по ходу пучка шиберном кольце установлен фильтр из поликристаллического висмута с плотностью ρ = 9,75 г/см3, отношение которого l к расстоянию до диафрагмы L равно l/L = 1/(30-40). В первом шиберном кольце размещены свинцовая и полиэтиленовая втулки. Биологическая защита рабочей камеры снабжена подвижным, соединенным со столиком блоком, поверхность которого выполнена в виде уступов, сопрягаемых с аналогичными уступами внутренней поверхности рабочей камеры. Стационарная биологическая защита рабочей камеры выполнена из стальных каркасов, заполненных послойно свинцом и борированным полиэтиленом с толщиной слоя 5-6 см. На столике установлены параллельно две рамки, на первой перед диафрагмой выполнены фиксаторы для крепления биологического объекта или фантома головы, на второй рамке, на закрепленной на ней пластине из оргстекла нанесены юстировочные концентрические окружности для ориентации нейтронного пучка и установке детекторов-дозиметров. Способ и устройство позволяют получить высокий терапевтический эффект нейтрон-захватной терапии опухолей. 2 с. и 4 з.п. ф-лы, 1 табл., 9 ил.


Комментарии