Система и способ для контроля персонализированного лечения пациента лучевой терапией и система обеспечения качества - RU2682455C2
Код документа: RU2682455C2
Чертежи









Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 61/876,269, поданной 11 сентября 2013 года и озаглавленной «Patient-Specific Radiotherapy Treatment Verification and Quality Assurance Method», раскрытие которой включено в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Радиационная терапия или лучевая терапия (RT) представляет собой обычную лечебную процедуру для лечения злокачественной опухоли. Цель процесса лучевой терапии состоит в том, чтобы воздействовать на опухоль достаточной дозой излучения с тем, чтобы уничтожать все клетки злокачественной опухоли. Доза облучения часто близка к уровню переносимости нормальных тканей организма. Следовательно, необходимо определять уровни дозы в различных частях облучаемого организма с высокой точностью и воспроизводимостью.
[0003] Недавние успехи в радиологической и биологической визуализации улучшили диагностирование и лечение злокачественной опухоли. Для лучевой терапии эти успехи позволяют точно очерчивать опухоль и радиоустойчивые подобъемы внутри опухоли. Следовательно, часто необходима сложная и неравномерная доставка дозы. Современные способы лучевой терапии, такие как лучевая терапия с модулированной интенсивностью (IMRT), объемно модулированная лучевая терапия (VMAT), стереотаксическая радиохирургия/лучевая терапия (SRS/SRT) и протонная терапия (PT), делают возможной реализацию таких сложных паттернов доз.
[0004] По мере того, как лучевая терапия становится все более настраиваемой для каждого индивидуального пациента, возрастают сложности вспомогательной системы планирования лечения (TPS) и системы доставки дозы. Это, в свою очередь, влечет необходимость улучшения качества способов обеспечения качества (QA), которые используют для контроля эффективности систем и реализации надежного контроля плана перед лечением (PTPV) в клинической практике.
[0005] Следовательно, эти сложные процедуры лучевой терапии требуют сложного планирования лечения, оптимизации поля облучения и контроля доставки запланированной дозы прежде, чем пациента подвергают лучевой терапии. Желательно обладать возможностью измерять эффект запланированного поля лечения с высокой точностью и чувствительностью в трехмерном объеме клинически релевантных размеров.
КРАТКОЕ ИЗЛОЖЕНИЕ
[0006] Контроль лечебной дозы пациента типично выполняют с использованием фантомов для измерения дозы. Фантом имитирует ткань организма и использует дозиметры для того, чтобы измерять дозу излучения перед началом процесса лечения пациента. Однако стандартные фантомы не персонализированы.
[0007] В целом, настоящее раскрытие предусматривает, в соответствии с определенными вариантами осуществления, системы и способы контроля плана персонализированного лечения лучевой терапией и обеспечения качества. Такие способы и системы в целом могут включать прием по меньшей мере одного набора первых медицинских изображений по меньшей мере части пациента; создание трехмерной модели части пациента на основании по меньшей мере одного первого медицинского изображения; установку дозиметра в часть трехмерной модели, причем дозиметр выполнен с возможностью измерять воздействие излучения; облучение по меньшей мере части трехмерной модели, содержащей дозиметр, в соответствии с планом лечения лучевой терапией; и сканирование облучаемой трехмерной модели, содержащей дозиметр, чтобы предоставлять по меньшей мере одно считываемое изображение. Этап сканирования можно осуществлять с помощью устройства медицинской визуализации (например, MRI сканера).
[0008] В одном примерном варианте осуществления настоящее раскрытие направлено на процедуру контроля персонализированного (специфического для пациента) плана лечения, которая повышает точность и эффективность современных способов лучевой терапии. По меньшей мере в одном из вариантов осуществления эта процедура может быть основана на полной пространственной трехмерной дозиметрии с высоким пространственным разрешением (например, ~1×1×1 мм3), которую выполняют с использованием способов полимерной гелевой дозиметрии на основе MRI.
[0009] Один из вариантов осуществления включает изготовление путем технологии трехмерной печати и использование по меньшей мере частично полой модели или фантома, разработанного для того, чтобы дублировать по меньшей мере часть внешней анатомической структуры и внутренней анатомической структуры пациента, по меньшей мере в отношении костных структур, который называют в настоящем документе персонализированным дозиметрическим фантомом или PSDP. PSDP можно конструировать для каждого отдельного пациента, и его можно заполнять полимерным гелем, пока он остается в жидкой форме (например, непосредственно после получения геля). Персонализированное планирование лечения и процедуру облучения можно применять к PSDP (т.е., PSDP можно лечить так, как если бы он являлся настоящим пациентом). Трехмерное измерение дозы с высоким пространственным разрешением затем можно осуществлять посредством магнитно-резонансной визуализации (MRI) облучаемой модели. Эти магнитно-резонансные изображения, которые могут включать экспериментально получаемые данные о дозе, затем можно объединять или сравнивать с CT изображениями планирования настоящего пациента, которые содержат планируемый целевой объем (PTV), органы, подверженные риску, (OAR) и/или вычисленный паттерн дозы. Сравнение между вычисленными (TPS) и экспериментально полученными (полимерный гель) трехмерными данными о дозе затем могут отслеживаться и вносить вклад в завершение персонализированного контроля плана до и/или после лечения.
[0010] Онколог и/или медицинский дозиметрист может быть информирован или предупрежден перед лечением пациента о: (i) фактическом трехмерном паттерне дозы, подлежащем доставке данному пациенту, и его различиях с соответствующим TPS вычисленным паттерном дозы, используя анатомические структуры пациента, а не стандартную геометрию тестовой дозиметрической модели (например, куб или цилиндр, который используют в настоящее время в клинической практике), и (ii) точном геометрическом положении, куда паттерн дозы может или должен быть доставлен, относительно внешних и внутренних анатомических структур пациента. В зависимости от результатов (преимущественно трехмерное сравнение доз и сравнение гистограмм доза-объем (DVH) (экспериментальных и вычисленных) и сравнение соответствующих радиобиологических показателей) можно принимать новые, более подходящие решения для стратегии облучения данного пациента. В то же время можно реализовать непрерывную оптимизацию TPS и эффективности системы доставки (усовершенствовать геометрическую – изоцентрическую точность, усовершенствовать фотонную дозиметрическую точность с малым полем или протонную полевую дозиметрическую точность и, следовательно, TPS эффективность). Настоящее раскрытие также предусматривает ретроспективный контроль плана после лечения с использованием систем и способов по настоящему раскрытию.
[0011] Настоящее раскрытие устраняет проблемы, которые возникают при использовании радиологических способов известного уровня техники, поскольку PSDP могут дублировать внешние контуры и внутренние анатомические структуры пациента в отношении костных структур, делает возможным объединение/совмещение реконструированной модели-копии («модели») и изображений данного пациента и ведет к персонализированному контролю лечения и обеспечению уверенности для пациента.
ОПИСАНИЕ ФИГУР
[0012] Приведенное выше краткое изложение, а также следующее подробное описание изобретения, легче понять при прочтении в сочетании с приложенными рисунками. С целью иллюстрирования изобретения на рисунках представлены различные иллюстративные варианты осуществления. Однако следует понимать, что изобретение не ограничено точными представленными компоновками и средствами.
[0013] На фиг. 1 представлен набор или совокупность медицинских изображений от CT-сканирования реальной головы пациента.
[0014] На фиг. 2A-2C соответственно представлены осевая, сагиттальная и коронарная реконструкции CT-сканирования с фиг. 1.
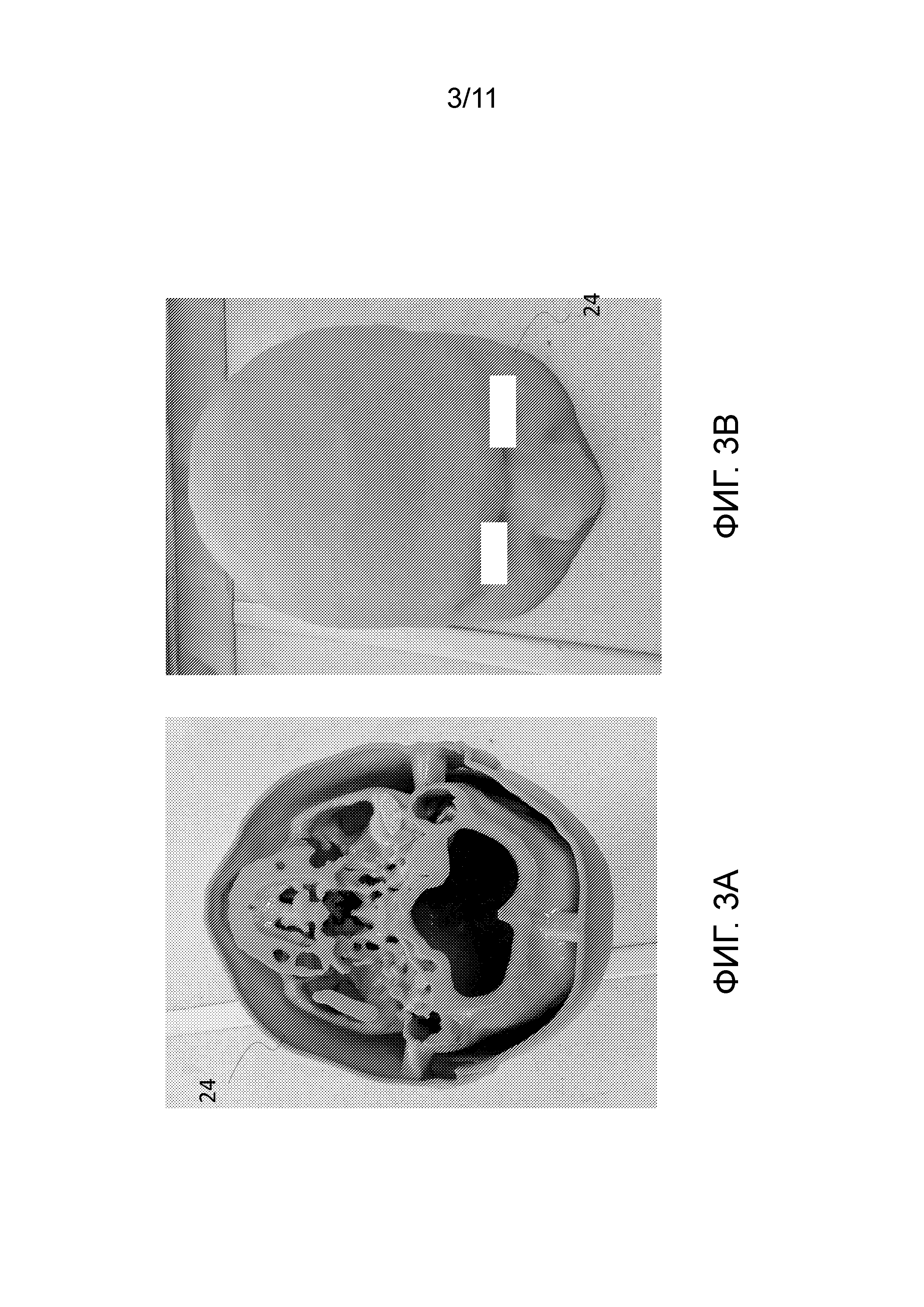
[0015] На фиг. 3A и 3B представлены виды в перспективе сверху PSDP в соответствии с вариантами осуществления по настоящему раскрытию.
[0016] На фиг. 4A и 4B представлены изображения, показывающие PSDP, выполненный с возможностью облучения в соответствии с вариантами осуществления по настоящему раскрытию.
[0017] На фиг. 5 представлен набор или совокупность считываемых изображений (карта времени спин-спиновой релаксации (T2) (осевой срез)) из MRI сканирования облучаемого PSPD в соответствии с вариантами осуществления по настоящему раскрытию.
[0018] На фиг. 6A-6C представлены соответственно осевое, сагиттальное и коронарное изображения PSDP, реконструированные по изображениям, представленным на фиг. 5.
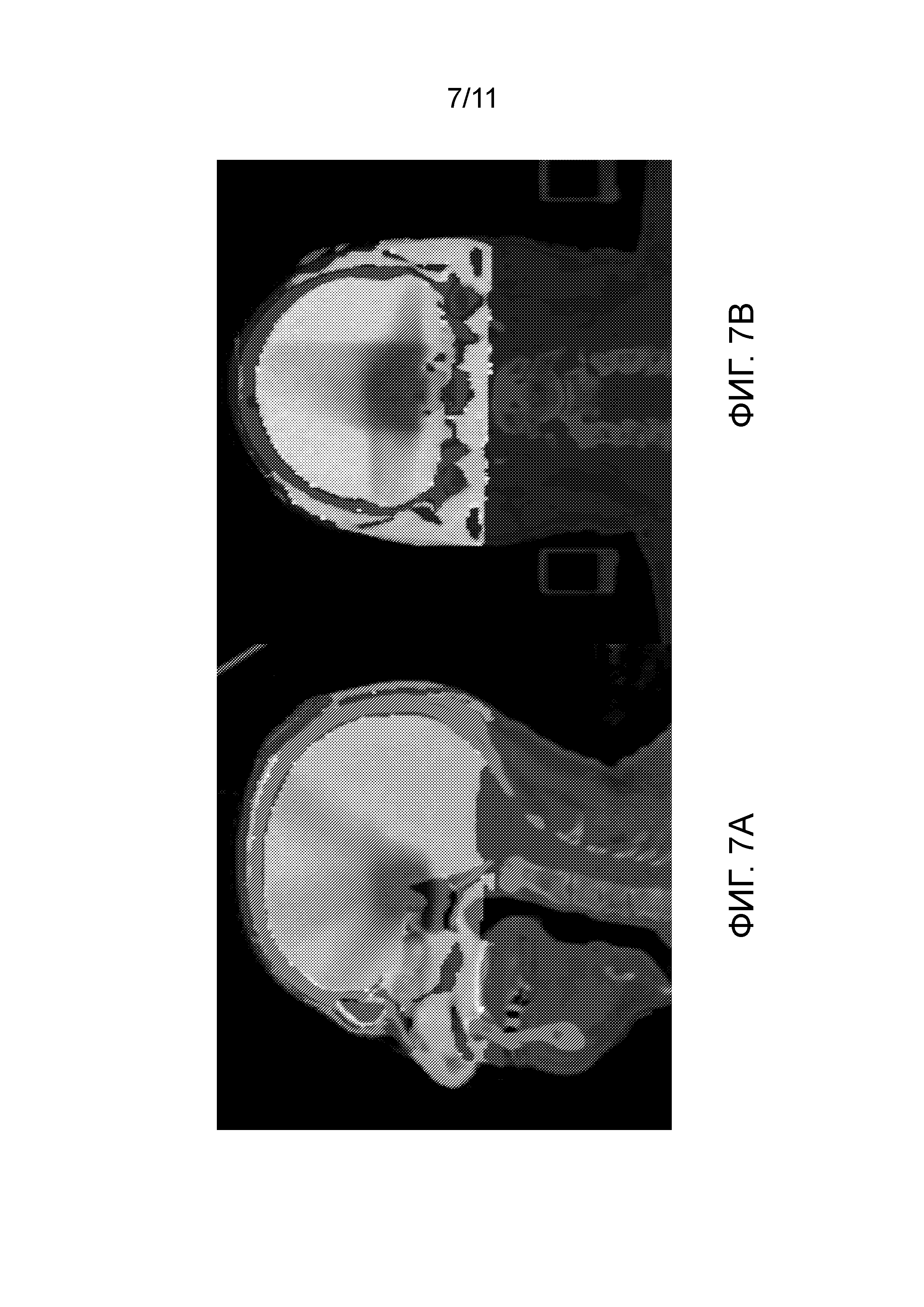
[0019] На фиг. 7A и 7B представлено объединение-совмещение между наборами данных изображений с фиг. 1 и фиг. 5 или фиг. 2A-2C и фиг. 6A-6C. Исходным является CT-сканирование данного пациента, и более яркие изображения (которые содержат темную область высокой дозы) представляют собой MR изображения облучаемого PSDP. Темная область представляет собой область экспериментальной измеренной дозы.
[0020] На фиг. 8A и 8B представлено объединение-совмещение фиг. 7A и 7B с TPS теоретическим вычислением наложенной дозы (окрашенные линии изодоз).
[0021] На фиг. 9 представлено совмещенное-объединенное изображение CT-изображений данного пациента и MRI изображений модели согласно одному из вариантов осуществления по настоящему раскрытию;
[0022] На фиг. 10 представлена схема последовательности операций способа согласно одному из вариантов осуществления по настоящему раскрытию.
[0023] На фиг. 11 представлено схематическое изображение примерного вычислительного устройства, которое можно использовать для осуществления по меньшей мере определенных процессов, описанных в настоящем документе.
ПОДРОБНОЕ ОПИСАНИЕ
[0024] Настоящее раскрытие в целом относится к контролю плана персонализированного лечения лучевой терапией и системам, устройствам и способам обеспечения качества. Определенную терминологию используют в дальнейшем описании только для удобства и не для ограничения. Пока конкретно не указано в настоящем документе, формы единственного числа не ограничены одним элементом, и взамен их следует читать как «по меньшей мере один».
[0025] Система или способ по настоящему раскрытию может включать получение или прием одного или нескольких наборов радиотерапевтических медицинских изображений по меньшей мере части живого пациента (например, краниальной области и/или грудной области). Радиотерапевтические медицинские изображения могут включать одно или несколько рентгеновских компьютерных томографических (CT) изображений, магнитно-резонансных изображений (MRI), позитронно-эмиссионных томографических (PET) изображений и т.п. или какое-либо их сочетание. Такие изображения можно получать в соответствии с системой планирования лечения (TPS) для определения области, подлежащей облучению, а также для определения областей, которые следует защищать от излучения.
[0026] Набор(наборы) радиотерапевтических медицинских изображений можно использовать для того, чтобы создавать трехмерную модель части пациента, которую называют в настоящем документе персонализированным дозиметрическим фантомом или PSDP. Пример PSDP представлен на фиг. 3. PSDP может включать одно или несколько из внутренних костных структур и/или органов, а также контуров внешней поверхности. Другими словами, PSDP воспроизводить или дублировать анатомическую структуру конкретного пациента, такую как голова или шея или грудная клетка, в отношении внешнего контура и костных структур (внутренних и внешних). Таким образом, каждый PSDP может быть уникальным или специально сконструированным для каждого пациента. PSDP можно формировать путем быстрого прототипирования с использованием трехмерного принтера. Трехмерная печать делает возможным получение стабильных объектов почти любой геометрической формы. В определенных вариантах осуществления медицинские изображения обрабатывают с использованием коммерчески доступного программного обеспечения (например, GEOMAGIC) и печатают с использованием коммерчески доступных трехмерных принтеров (например, 3Dsystems-Project 3510 HDPlus). После завершения PSDP может быть по меньшей мере частично полым, и его можно формировать из одного или нескольких материалов, таких как, например, керамический материал, полимерный материал (например, эпоксидная смола, плексиглас) или тому подобное. В определенных вариантах осуществления материал, используемый для того, чтобы формировать по меньшей мере частично или полностью PSDP, разрабатывают так, чтобы он обладал свойствами, схожими с костью в отношении взаимодействия с ионизирующим излучением (например, CT-число больше чем приблизительно 500 или больше чем приблизительно 700 или больше чем или равное приблизительно 1000 HU). PSDP также может иметь в целом сплошную внешнюю периферию и/или может включать одно или несколько разнесенных отверстий в полую внутреннюю часть. Дополнительно, PSDP может содержать компартменты для заменителей различных анатомических признаков, например, таких как головной мозг, кость и желудочки.
[0027] дозиметр вводят по меньшей мере в часть PSDP. Дозиметр может представлять собой какой-либо предмет или устройство, подходящее для введения в PSDP и выполненное с возможностью измерять воздействие излучения; например, дозиметр можно вставлять по меньшей мере частично или полностью в часть PSDP. Подходящие дозиметры включают те, в которых определенные оптические свойства в объеме дозиметра меняются предсказуемо при взаимодействии с ионизирующим излучением. Эти оптические свойства чувствительны к параметрам, таким как степень рассеяния света, поглощательная способность, показатель преломления и их комбинации. Кроме того, подходящие дозиметры включают те, в которых время спин-спиновой релаксации в объеме дозиметра меняется предсказуемо при взаимодействии с ионизирующим излучением. Примеры подходящих дозиметров включают, но не ограничиваясь этим, какое-либо устройство, аппарат или вещество, которое способно измерять воздействие излучения, такое как полимерный гелевый дозиметр, один или несколько одномерных точечных дозиметров, таких как ионизационная камера, диод или тому подобное, один или несколько линейных массивов одномерных точечных дозиметров, один или несколько двухмерных массивов точечных дозиметров или двухмерных дозиметров, таких как радиографическая или радиохромная пленка, один или несколько трехмерных массивов точечных дозиметров, и т.п. В определенных вариантах осуществления дозиметр представляет собой полимерный гелевый дозиметр, выполненный так, чтобы обладать свойствами, схожими с мягкими тканями в отношении взаимодействия с ионизирующим излучением (например, CT-число приблизительно 0 HU или меньше чем приблизительно 400 или меньше чем приблизительно 100 или меньше чем приблизительно 30 или меньше чем приблизительно 0). PSDP можно изготавливать вокруг дозиметра или дозиметр можно вводить в модель после изготовления.
[0028] В определенных вариантах осуществления дозиметр представляет собой полимерный гелевый дозиметр. Полимерный гелевый дозиметр может регистрировать и сохранять пространственную информацию о воздействии дозы в трех измерениях. Полимерный гелевый дозиметр можно формировать из полимера, чувствительного к излучению, в котором при облучении происходит полимеризация в качестве функции поглощенной дозы облучения. Подходящие полимерные гелевые дозиметры включают гидрогели, в которых выбранные мономеры и сшиватели растворяют так, что водные свободные радикалы, образуемые посредством облучения, вызывают полимеризацию мономеров так, что мономеры превращаются в полимеры. Количество полученного полимера может представлять собой функцию поглощенной дозы. Цель гелевой матрицы состоит в том, чтобы удерживать полимерные структуры на месте, сохраняя пространственную информацию о поглощенной дозе. Такие полимерные гели можно получать в виде жидкости и выливать в трехмерную модель части пациента, где происходит их отверждение.
[0029] Полимерные гелевые дозиметры коммерчески доступны или известны в данной области, и доказано, что они подходят для дозиметрических целей, поскольку они демонстрируют линейную реакцию на дозу в широком динамическом диапазоне. Их в настоящее время используют в целях исследования и обеспечения качества путем их облучения с использованием стандартных устройств лучевой терапии (RT) и последующей их транспортировки в MRI устройства и визуализации в них.
[0030] PSDP, содержащий дозиметр, можно облучать в соответствии с планом лечения, разработанным для живого пациента. PSDP моно располагать и облучать, как если бы он представлял собой живого пациента (см., например, фиг. 4). После этого PSDP можно визуализировать для того, чтобы определять распределение дозы облучения внутри PSDP. Например, когда дозиметр представляет собой полимерный гель, PSDP можно сканировать с использованием MRI и превращать в персонализированный дозиметрический фантом (см., например, фиг. 5 и фиг. 6). Такие дозиметрические фантомы также можно превращать в карты дозы облучения с использованием калибровочных данных полимерного геля.
[0031] В определенных вариантах осуществления дозиметрический фантом можно комбинировать (т.е., использовать объединение-совмещение) с медицинскими изображениями пациента (см., например, фиг. 7). Такое объединение-совмещение возможно, поскольку PSDP предоставляет точные персонализированные анатомические данные. Таким образом, медицинскую информацию об изображении с вычислениями трехмерной дозы, генерируемую системой планирования лечения, можно сравнивать с трехмерным распределением дозы, определяемым по персонализированному дозиметрическому фантому. Это сравнение можно осуществлять с использованием TPS или какого-либо другого программного обеспечения медицинской визуализации, которое допускает объединение-совмещение. Такому объединению-совмещению способствует соответствие костных структур и внешних контуров на медицинском изображении и в PSDP. Этот этап обеспечения качества помогает онкологу и/или медицинскому дозиметристу, например, исследовать дозиметрическую и геометрическую точность плана лечения. Это сравнение может демонстрировать трехмерное распределение дозы, вычисляемое посредством TPS, в сравнении с трехмерной дозой, которую фактически доставляли, используя план лечения, и/или пространственной геометрической точностью доставленной дозы. Таким образом, система и способ по настоящему раскрытию демонстрируют, если фактически доставленная доза облучения доставлена в желаемое геометрическое/пространственное положение у живого пациента. Затем можно рассматривать или выполнять коррекции или модификации лечения лучевой терапией на основании системы или способа по настоящему раскрытию.
[0032] Как очевидно из обсуждения в настоящем документе, способ(способы) и/или продукт(продукты) по настоящему раскрытию можно использовать не только для контроля плана перед лечением, но также для контроля плана после лечения, т.е. ретроспективно. Процесс после лечения можно использовать для медицинских записей пациента по мере регистрации того, как доставляют лечение. Согласно известному уровню техники, на сегодняшний день медицинские записи пациента являются только теоретическими. Однако согласно настоящему раскрытию, медицинские записи пациента могут содержать то, что фактически выполнено у конкретного пациента. Способ(способы) и/или продукт(продукты) по настоящему раскрытию можно использовать для предоставления информации о том, как доставляли лечение и какие ткани затронуты.
[0033] Цифровую информацию, которая необходима для доставки лечения (например, TPS и данные Онкологической информационной системы для каждого пациента) хранят в течение длительного периода времени после лечения. Следовательно, то же самое лечение, которое доставляли пациенту, можно воспроизводить с использованием PSDP. Это можно использовать, например, для того, чтобы обосновать, вызвало ли лечение побочный эффект, такой как потеря зрения из-за облучения зрительного нерва. Согласно способам и системам известного уровня техники, это не может быть обосновано (даже если TPS показывает что-то другое, поскольку TPS теоретически вычисляют на основании множества предположений). Система и способ по настоящему раскрытию воспроизводит то, что произошло, используя те же анатомические данные пациента, и ту же цифровую информацию о лечении. Как результат, все лечение можно воспроизводить в любое время.
[0034] Способ(способы) и/или продукт(продукты) по настоящему раскрытию также можно использовать для целей проверки. Проверку RT отделения проводят обычным образом, и для таких целей можно использовать продукт(продукты) и способ(способы) по настоящему раскрытию. Система и способ(способы) по настоящему раскрытию можно использовать для конструирования выбранного PSDP, и можно доставлять лечение в PSDP. Сравнение между экспериментальными и теоретическими (TPS) данными можно использовать при проверке.
[0035] Далее, в деталях обращаясь к чертежам, на которых одинаковые номера обозначают одинаковые элементы, на фиг. 1-11 представлены система и/или способ контролся персонализированного лечения лучевой терапией (RTV) и обеспечения качества (QA) в соответствии с определенными вариантами осуществления по настоящему раскрытию. Как указано выше, систему и способ по настоящему раскрытию можно применять к каждому отдельному пациенту лучевой терапии, чтобы достигать более точного и эффективного лечения лучевой терапией, и можно использовать для всех модальностей лучевой терапии и ионизирующего излучения всех типов, используемых для осуществления лучевой терапии.
[0036] Со ссылкой на фиг. 1-2C, система или способ по настоящему раскрытию могут включать получение или прием одного или нескольких наборов радиотерапевтических медицинских изображений 20 по меньшей мере части пациента. В настоящем раскрытии рассмотрено и показано, что частью пациента является череп или голова. Однако систему или способ, описанные в настоящем документе, можно использовать для более эффективного лечения какой-либо одной или нескольких частей организма пациента, таких как абдоминальная область. Радиотерапевтические медицинские изображения 20 могут включать одно или несколько из рентгеновских компьютерных томографических (CT) изображений (фиг. 1, 2A-2C), магнитно-резонансных изображений (MRI), позитронно-эмиссионных томографических (PET) изображений и т.п.
[0037] Со ссылкой на фиг. 3A и 3B, в одном примерном варианте осуществления одну или несколько CT сканограмм 20 можно посылать на или вводить в трехмерный принтер. Принтер можно выполнять с возможностью печатать или формировать один или несколько PSDP, разработанных для того, чтобы воспроизводить одну или несколько частей пациента, представленного на CT сканограмм (сканограммах) (этап 50, показанный на фиг. 10). Таким образом, каждый PSDP 24 может быть уникальным или специально разработанным для каждого пациента. По завершении, каждый PSDP 24 может быть по меньшей мере частично полым и может воспроизводить или дублировать анатомические структуры конкретного пациента, такие как череп или шея, в отношении внешних контуров и костных структур (внутренних и внешних). PSDP 24 может иметь в целом сплошную внешнюю периферию (фиг. 3B) и/или может включать одно или несколько разнесенных отверстий в по меньшей мере частично полую внутреннюю часть. Модель 24 выполнена с возможностью принимать или включать дозиметр, способный измерять воздействие излучения. Например, полимерный гелевый дозиметр в жидкой форме можно вставлять в PSDP 24, чтобы в целом заполнять внутреннюю полую полость в PSDP 24 (см. этап 52 на фиг. 10).
[0038] В одном примерном варианте осуществления PSDP 24 можно облучать в соответствии с планом лечения лучевой терапией (RTP), созданным системой планирования лечения (TPS) (см. этап 54 на фиг. 10). Как известно специалистам в данной области, RTP типично используют для осуществления облучения лучевой терапии у настоящего живого пациента. По меньшей мере в одном из вариантов осуществления настоящей заявки перед тем, как осуществлять RTP у настоящего живого пациента, можно осуществлять «тестирование» RTP на PSDP 24 для контроля персонализированного лечения лучевой терапией и обеспечения качества. Например, когда PSDP 24 представляет голову пациента, PSDP 24 можно располагать в лечебном помещении и облучать точно так же, как если бы PSDP 24 был данным пациентом (см. фиг. 4A и 4B)
[0039] Со ссылкой на фиг. 5 и 6, в одном примерном варианте осуществления PSDP 24 сканируют с использованием MRI, например, для того, чтобы измерять распределение доставленной дозы в трех измерениях (см. этап 56 на фиг. 10) внутри PSDP 24. Трехмерное MRI сканирование всего облученного объема PSDP 24 может вести к трехмерным T2-параметрическим картам высокого пространственного разрешения или стандартным клиническим T2 взвешенным изображениям. Более темные области считываемых изображений на фиг. 5 и фиг. 6 представляют область высокой дозы. В работе, чем ниже T2-значение, как оценивают с помощью T2 карт, тем выше доза. Используя калибровочные данные полимерного геля [D=f(T2), D: доза], параметрические T2-карты можно преобразовывать в карты фактической дозы облучения.
[0040] На фиг. 7A и 7B показано объединение-совмещение или сравнение между CT-изображениями данного пациента и MRI изображениями PSDP 24 (см. этап 58 на фиг. 10). CT-изображения могут содержать TPS вычисленные распределения дозы, и MRI изображения могут содержать измеренные полимерным гелем распределения дозы. Соответственно, TPS теоретические вычисления дозы (окрашенные линии изодоз) можно накладывать на объединение-совмещение, как показано на фиг. 8 и 9. Это допускает качественное и/или количественное сравнение и оценку всего лечения. Например, когда паттерн дозы выявляет проблему (например, этот паттерн дозы будет затрагивать критический орган), план лечения можно модифицировать.
[0041] Один или несколько описанных выше способов и/или вариантов осуществления можно реализовать с или используя программное обеспечение, например, модули, исполняемые одним или несколькими вычислительными устройствами 210 (см. фиг. 10). Конечно, модули, описанные в настоящем документе, иллюстрируют различные функциональности и не ограничивают структуру или функциональность каких-либо вариантов осуществления. Скорее функциональность различных модулей можно по-разному делить и выполнять с помощью большего или меньшего числа модулей в соответствии с различными проектными соображениями.
[0042] Каждое вычислительное устройство 210 может содержать одно или несколько обрабатывающих устройств 211, разработанных для того, чтобы обрабатывать инструкции, например, машиночитаемые инструкции (т.е., код), хранимые на невременной основе в одном или нескольких запоминающих устройствах 213. Путем обработки инструкций обрабатывающее устройство(устройства) 211 может выполнять одну или несколько из этапов и/или функций, описанных в настоящем документе. Каждое обрабатывающее устройство может быть реальным или виртуальным. В системе множественной обработки множество блоков обработки могут исполнять исполняемые компьютером инструкции, чтобы повышать вычислительную мощность. Запоминающее устройство(устройства) 213 могут относиться к какому-либо типу постоянного запоминающего устройства (например, оптическое запоминающее устройство, магнитное запоминающее устройство, твердотельное запоминающее устройство и т.д. Запоминающее устройство(устройства) 213 может быть съемным или несъемным, и может включать магнитные диски, магнитооптические диски, магнитные ленты или кассеты, CD-ROM, CD-RW, DVD, BD, SSD или какую-либо другую среду, которую можно использовать для хранения информации. Альтернативно, инструкции можно хранить в одном или нескольких удаленных запоминающих устройствах, например, запоминающих устройствах, доступ к которым осуществляют через сеть или интернет.
[0043] Каждое вычислительное устройство 210 дополнительно может иметь память 212, один или несколько контроллеров 216 ввода, один или несколько контроллеров 215 вывода и/или одно или несколько коммуникационных соединений 240. Память 212 может представлять собой энергозависимую память (например, регистры, кэш, RAM и т.д.), энергонезависимую память (например, ROM, EEPROM, флэш-память и т.д.) или некоторое их сочетание. По меньшей мере в одном из вариантов осуществления память 212 может хранить программное обеспечение, которое реализует описанные способы.
[0044] Механизм 214 межсоединения, такой как шина, контроллер или сеть, может функционально соединять компоненты вычислительного устройства 210, в том числе процессор(процессоры) 211, память 212, запоминающее устройство(устройства) 213, контроллер(контроллеры) 216 ввода, контроллер(контроллеры) 215 вывода, коммуникационное соединение(соединения) 240 и какие-либо другие устройства (например, сетевые контроллеры, звуковые контроллеры и т.д.). контроллер(контроллеры) 215 вывода можно функционально соединять (например, через проводное или беспроводное соединение) с одним или несколькими устройствами 220 вывода (например, монитор, телевизор, экран мобильного устройства, чувствительный к прикосновениям дисплей, принтер, громкоговоритель и т.д.) таким образом, что контроллер(контроллеры) 215 вывода может преобразовывать отображение на устройстве отображения 220 (например, в ответ на исполняемые модули). Контроллер(контроллеры) 216 ввода можно функционально соединять (например, через проводное или беспроводное соединение) с устройством 230 ввода (например, мышь, клавиатура, чувствительная к прикосновениям панель, шар прокрутки, чувствительный к прикосновениям дисплей, перо, игровой контроллер, устройство голосового ввода, сканирующее устройство, цифровая камера и т.д.) таким образом, что можно получать ввод от пользователя.
[0045] Коммуникационное соединение(соединения) 240 могут делать возможной связь по коммуникационной среде с другим вычислительным объектом. Коммуникационная среде несет такую информацию, как исполняемые компьютером инструкции, аудио- или видеоинформация или другие данные в модулированном сигнале данных. Модулированный сигнал данных представляет собой сигнал, одна или несколько характеристик которого заданы или изменены таким образом, чтобы кодировать информацию в сигнале. В качестве примера и не ограничения коммуникационные среды включают проводные или беспроводные способы, реализованные с использованием электрического, оптического, радиочастотного, инфракрасного, акустического или другого носителя.
[0046] На фиг. 11 проиллюстрировано вычислительное устройство 210, устройство 220 вывода и устройство 230 ввода в виде отдельных устройств только для легкости идентификации. Однако вычислительное устройство 210, устройство(устройства) 220 отображения и/или устройство(устройства) 230 ввода могут представлять собой отдельные устройства (например, персональный компьютер, соединенный проводами с монитором и мышью), могут быть интегрированы в одном устройстве (например, мобильное устройство с чувствительным к прикосновениям дисплеем, такое как смартфон или планшет) или могут представлять собой какую-либо комбинацию устройств (например, вычислительное устройство, функционально связанное устройством отображения с чувствительным к прикосновениям экраном, множество вычислительных устройств, присоединенных к одному устройству отображения и устройству ввода и т.д.). Вычислительное устройство 210 может представлять собой один или несколько серверов, например, ферма сетевых серверов, кластерное серверное окружение или облачные службы, исполняемые на удаленных вычислительных устройствах.
[0047] Следовательно, настоящее изобретение хорошо адаптировано для достижения указанных целей и преимуществ, а также тех, которые свойственны в этом отношении. Хотя специалисты в данной области могут делать множество изменений, такие изменения входят в сущность данного изобретения, как проиллюстрировано, отчасти, с помощью приложенной формулы изобретения.
Реферат
Группа изобретений относится к медицинской технике, а именно к средствам контроля лечения лучевой терапией. Способ контроля персонализированного лечения пациента лучевой терапией включает прием медицинских изображений одного пациента, создание персонализированной трехмерной модели части одного пациента на основании только указанных медицинских изображений, установку дозиметра в персонализированную трехмерную модель пациента, причем дозиметр выполнен с возможностью измерять воздействие излучения, сканирование персонализированной трехмерной модели пациента, содержащей дозиметр, чтобы предоставлять по меньшей мере одно считываемое изображение, представляющее персонализированную трехмерную модель пациента, облучение по меньшей мере части персонализированной трехмерной модели пациента, которая содержит дозиметр, в соответствии с планом персонализированного лечения пациента лучевой терапией для получения облученной персонализированной трехмерной модели пациента, сканирование облученной персонализированной трехмерной модели пациента, чтобы предоставлять по меньшей мере одно считываемое изображение после облучения, представляющее распределение дозы облучения внутри облученной персонализированной трехмерной модели пациента, при этом по меньшей мере одно считываемое изображение после облучения является трехмерным изображением. Во втором варианте способ контроля включает сканирование облученной персонализированной трехмерной модели пациента, чтобы предоставлять по меньшей мере одно считываемое изображение после облучения, которое представляет распределение дозы облучения внутри облученной персонализированной трехмерной модели пациента, при этом по меньшей мере одно считываемое изображение после облучения является трехмерным изображением. Использование изобретений позволяет измерять эффективность запланированного поля лечений с высокой точностью. 2 н. и 16 з.п. ф-лы, 11 ил.

Комментарии