Изучение дозиметрического воздействия движения на формирование адаптивных границ для конкретного пациента при планировании наружной дистанционной лучевой терапии - RU2603606C2
Код документа: RU2603606C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящий документ в целом относится к наружной дистанционной лучевой терапии (EBRT). Она находит конкретное применение в отношении формирования границ лечения конкретного пациента и будет описана с конкретной ссылкой на это применение. Однако следует понимать, что она также находит применение в других сценариях использования и не обязательно ограничивается вышеупомянутым применением.
УРОВЕНЬ ТЕХНИКИ
При наружной дистанционной лучевой терапии (EBRT) пространственно целевые дозы излучения применяют к опухолям или другим мишеням, содержащим раковую или злокачественную ткань. Рост и быстрое размножение раковых клеток имеют тенденцию быть более восприимчивыми к повреждению излучением по сравнению со здоровыми клетками, так что дозы, назначенные посредством должного планирования, избирательно убивают раковую или злокачественную ткань. Чтобы гарантировать, что опухоли или другие мишени облучаются полностью, планы лучевой терапии (RTP) обычно составляются с границами лечения вокруг опухолей или других мишеней. Стандартный протокол использует универсальные для основного населения границы лечения для всех пациентов. Хотя эти границы лечения разрабатываются так, чтобы гарантировать полное покрытие опухоли или другой мишени, они могут приводить к передозированию органов риска (OAR) или других областей. Поэтому при EBRT обычно стараются соблюсти баланс между необходимостью полного разрушения опухолей или других мишеней и необходимостью сужения границы, чтобы уберечь окружающие органы риска (OAR) или другие области от радиационного поражения.
Одним из преимуществ сужения границ лечения является то, что меньшие границы позволяют увеличивать дозу на опухоли или мишени. Однако серьезным сдерживающим фактором для сужения границ лечения является наличие движения ткани как во время, так и в промежутках между сеансами лечения (или фракциями). Поэтому контроль движения, особенно в отношении опухолей или других мишеней, имеет исключительное значение для обеспечения успешной подачи излучения.
Перед проведением фракции лечения положение пациента на процедурном столе обычно выравнивается, используя лазеры, по знакам на коже и/или на рентгенографическом изображении. В некоторых случаях перед лечением дополнительно используют компьютерную томографию с конусным пучком (CBCT). Все эти способы направлены на корректировку движения, происходящего в промежутках между фракциями. Однако корректировка только движения между фракциями не обеспечивает полной меры достоверности при подаче дозы. Для решения этой проблемы существуют способы слежения за положением опухоли или другой мишени во время лечения (внутрифракционное движение). Эти способы содержат получение флуороскопического изображения имплантированных маркеров опорных точек и электромагнитное (EM) слежение за имплантированными приемопередатчиками с высокой частотой во времени (например, 10 Гц). Имплантированные маркеры опорных точек и/или имплантированные приемопередатчики служат в качестве имитаторов опухоли или другой мишени. Такие способы, как эти, предоставляют информацию не только о местоположении опухоли или другой мишени во время лечения, но также о начальных отклонениях опухоли или другой мишени в начале каждой фракции и/или предыдущих фракций плана лучевой терапии (RTP). Во время лечения информация о местоположении приемопередатчиков или опорных точек может использоваться разными способами, чтобы корректировать стандартный метод лечения, одним из которых является выключение лучевого пучка вручную, если мишень, как считают, вышла за пределы заданных границ.
Хотя вышеупомянутые меры уменьшают неравномерность подачи запланированного распределения дозы, информация об межфракционном и/или внутрифракционном движении, полученная этими способами, обычно не используется для изучения воздействия движения после лечения. В том отношении результирующее воздействие движения для поданной дозы является важным критерием, посредством которого может быть классифицирован успех лечения. Траектории для малого движения (которое не может считаться значительным во время лечения) могут в совокупности приводить к доставленной дозе, существенно отличающейся от запланированного распределения дозы.
Настоящий документ обеспечивает новые и улучшенные способы и системы, которые преодолевают упомянутые выше и другие проблемы.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом обеспечивается система планирования лечения, позволяющая формировать границы лечения для конкретного пациента. Система включает в себя один или более процессоров, запрограммированных для приема плана лучевой терапии (RTP) для облучения мишени в течение одной или более фракций лечения. RTP включает в себя одну или более границ лечения вокруг мишени и запланированное распределение дозы для мишени. Процессоры дополнительно программируются, чтобы принимать данные движения по меньшей мере для одной из фракций лечения по RTP от одного или более имитаторов мишеней. Данные движения по меньшей мере для одной из фракций лечения не должны включать в себя данные движения для всех фракций лечения. Процессоры дополнительно программируются, чтобы вычислять распределение дозы с компенсацией движения для мишени, используя данные движения и запланированное распределение дозы, сравнивать распределение дозы с компенсацией движения с запланированным распределением дозы и корректировать границы лечения, основываясь на дозиметрических разностях между распределением дозы с компенсацией движения и запланированным распределением дозы.
В соответствии с другим вариантом обеспечивается способ формирования границ лечения конкретного пациента. План лучевой терапии (RTP) для облучения мишени принимается в течение одной или более фракций лечения. RTP включает в себя одну или более границ лечения вокруг мишени и запланированное распределение дозы для мишени. Данные движения по меньшей мере для одной из фракций лечения по RTP принимают от одного или более имитаторов мишеней. Нет необходимости, чтобы данные движения по меньшей мере для одной из фракций лечения содержали данные движения для всех фракций лечения. Распределение дозы с компенсацией движения для мишени вычисляется, используя данные движения и запланированное распределение дозы. Распределение дозы с компенсацией движения сравнивают с запланированным распределением дозы. Границы лечения корректируют, основываясь на дозиметрических разностях между распределением дозы с компенсацией движения и запланированным распределением дозы.
Одно из преимуществ заключается в вычислении дозы облучения, фактически доставляемой пациенту.
Другое преимущество заключается в более точной подаче излучения в область мишени.
Другое преимущество заключается в более точном определении дозы облучения, фактически доставленной к мишени и ткани, не относящейся к мишени.
Другое преимущество заключается в улучшении последовательности выполнения операций планирования лечения посредством лучевой терапии, используемых в медицинских учреждениях.
Другое преимущество заключается в снижении необходимости получения изображений в середине лечения.
Другое преимущество заключается в вычислении границ лечения конкретного пациента и повышении дозы для мишени.
Другое преимущество заключается в снижении риска повреждения здоровых тканей.
Другие дополнительные преимущества настоящего изобретения будут очевидны специалистам в данной области техники после прочтения и понимания последующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение может принимать форму различных компонентов и построений компонентов и различных этапов и построений этапов. Чертежи предназначены только для целей иллюстрации предпочтительных вариантов осуществления и не должны рассматриваться как ограничение изобретения.
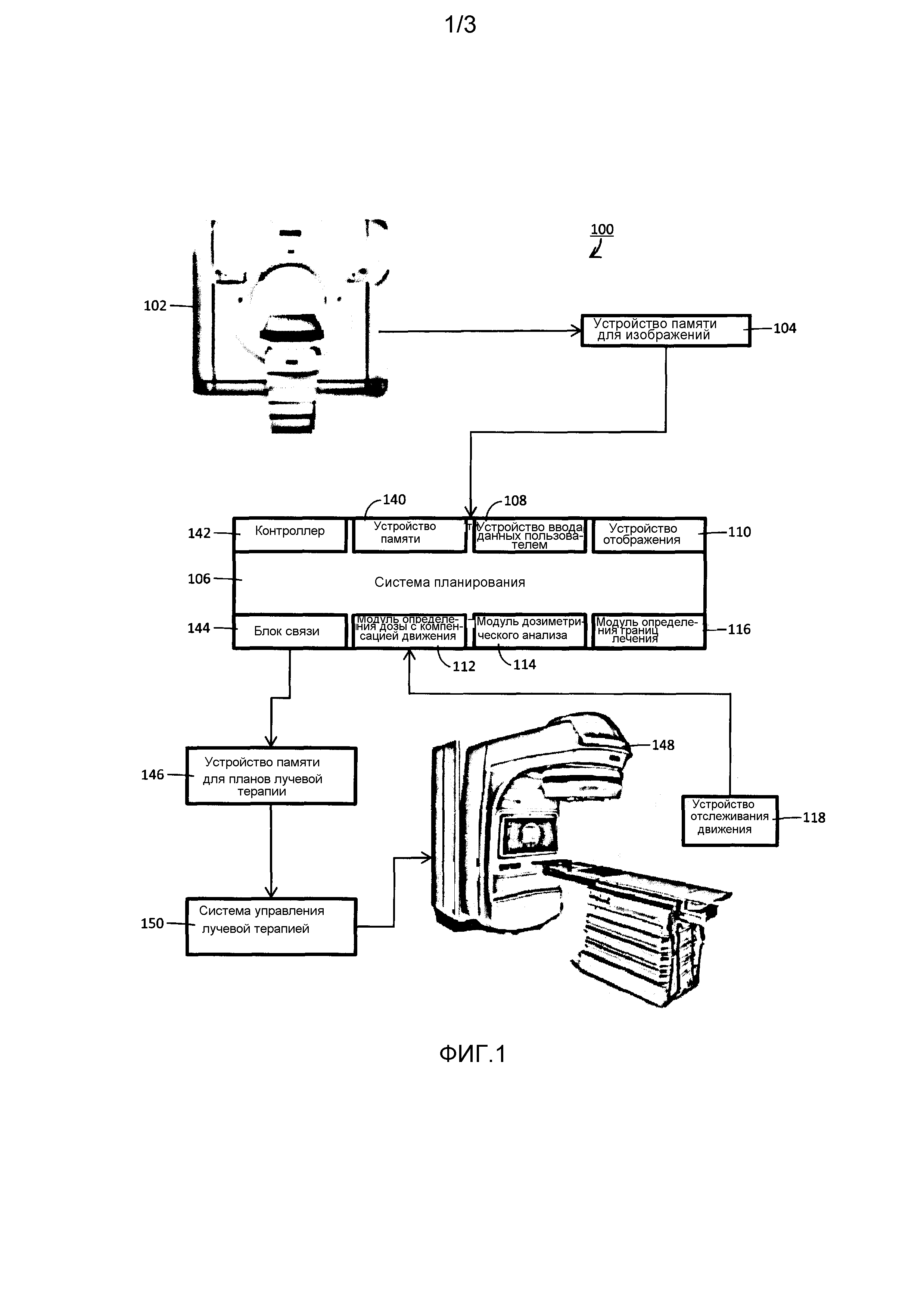
Фиг. 1 - система лучевой терапии, соответствующая аспектам настоящего раскрытия.
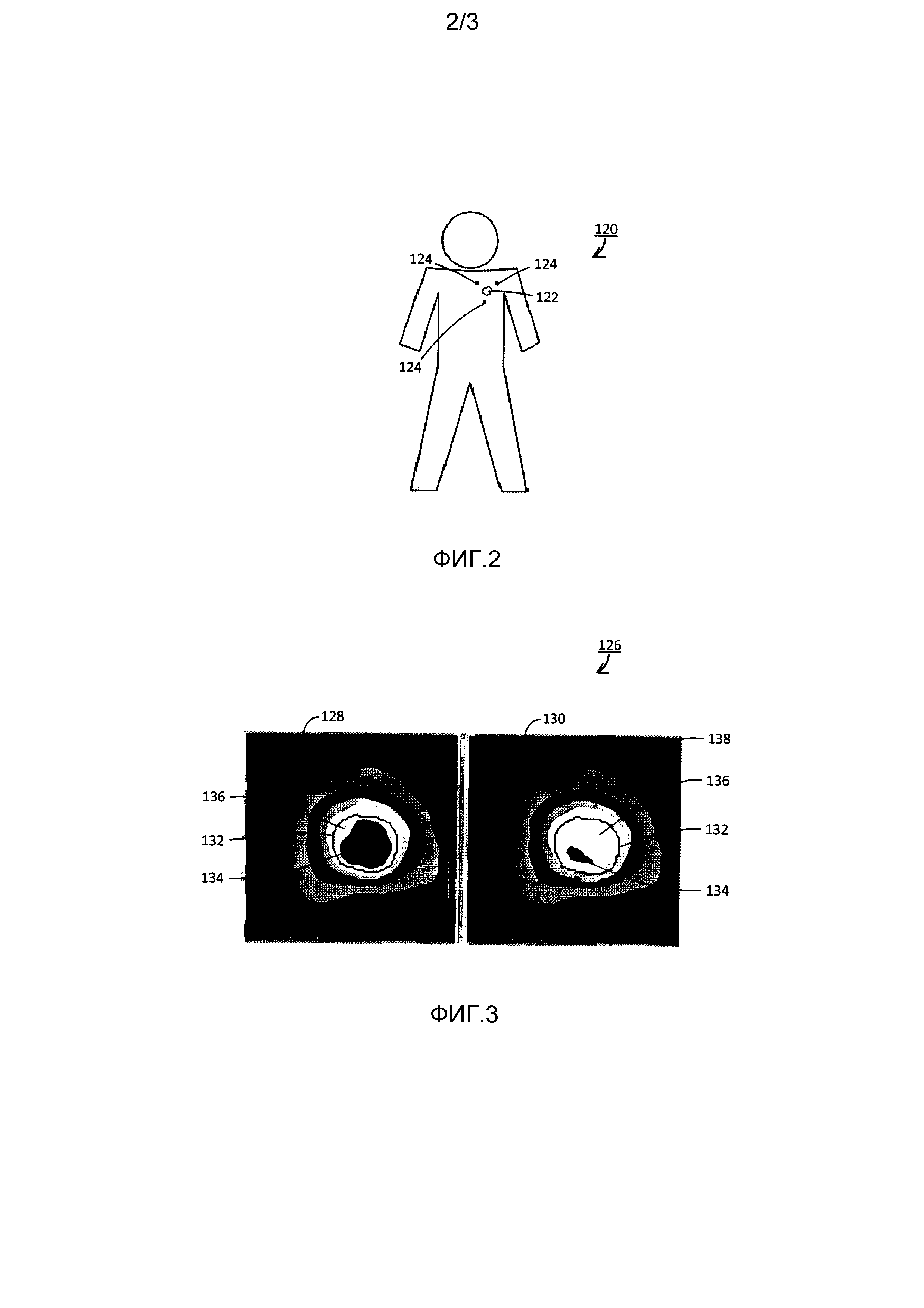
Фиг. 2 - пример пациента, подвергаемого лучевой терапии на опухоли или другой мишени.
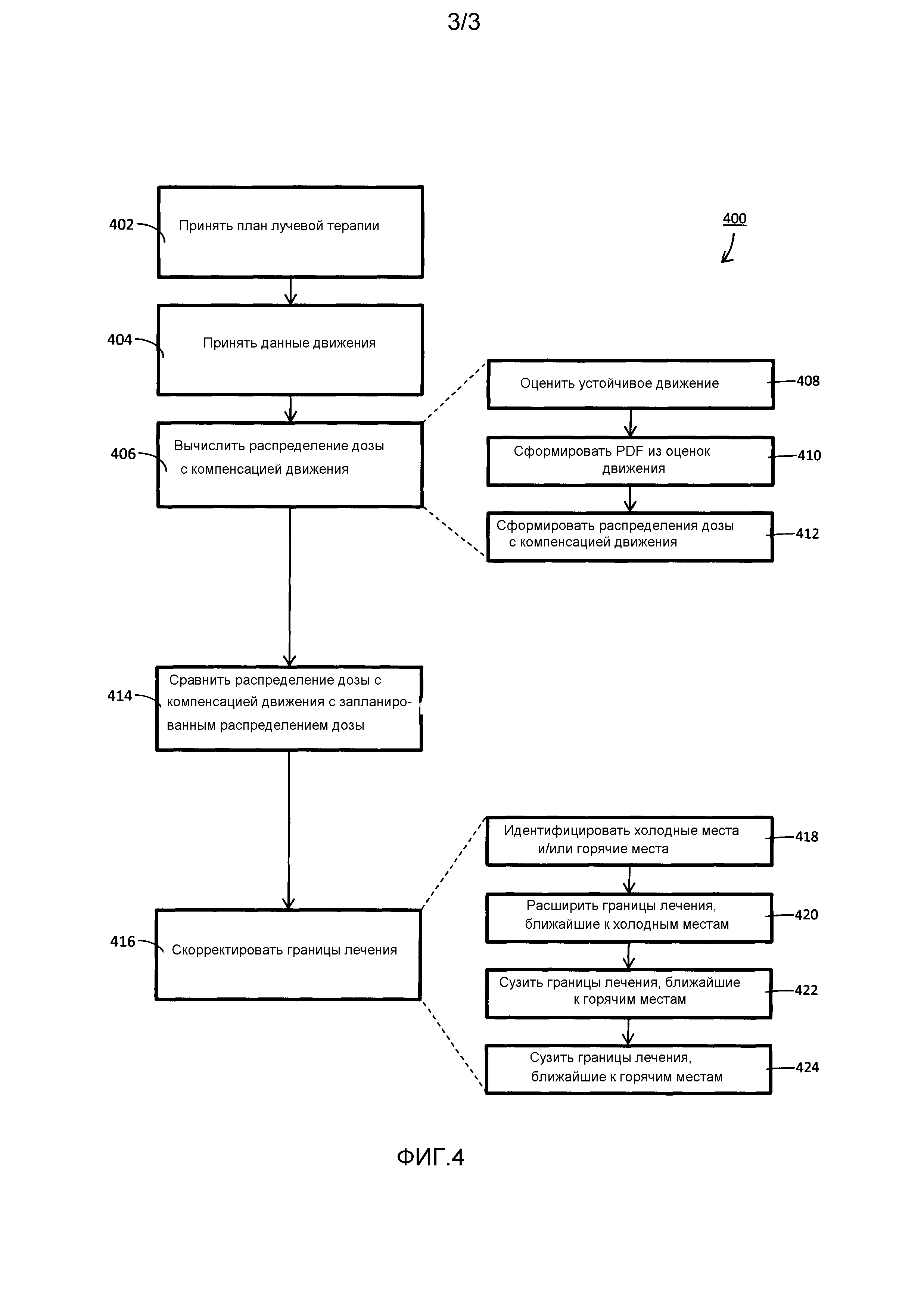
Фиг. 3 - один из вариантов осуществления графического интерфейса пользователя согласно аспектам настоящего раскрытия.
Фиг. 4 - способ формирования границ лечения конкретного пациента согласно аспектам настоящего раскрытия.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Как показано на Фиг. 1, обеспечивается система 100 лучевой терапии для лечения пациентов. Система лучевой терапии используется для предоставления пациенту одного или более типов лучевой терапии, такой как наружная дистанционная лучевая терапия, протонная терапия, абляционная терапия и фокусированная ультразвуковая терапия высокой интенсивности. Система 100 лучевой терапии содержит одно или более средств 102 получения изображений, пригодных для получения изображений, представляющих интересующие объекты (OOI), такие как интересующие области (ROI) и интересующие точки (POI) внутри пациентов. Средства 102 получения изображений соответственно содержат сканер компьютерной томографии (СТ). Однако средства 102 получения изображений могут дополнительно или альтернативно содержать одно или более из следующих устройств: сканер позитронной эмиссионной томографии (PET), магнитно-резонансный (MR) сканер, сканер однофотонной эмиссионной компьютерной томографии (SPECT) и т.п.
Изображения, полученные средствами 102 получения изображений, обычно являются трехмерными изображениями. Однако предполагаются и двумерные изображения. Трехмерные изображения обычно содержат стек двумерных изображений, в дальнейшем именуемых срезами. Дополнительно, изображения, полученные средствами 102 получения изображений, хранятся в устройстве 104 памяти для изображений. Как правило, устройство 104 памяти для изображений является центральной системой хранения документов. Однако предполагается, что устройство 104 памяти для изображений является локальным по отношению к средствам 102 получения изображений или другому компоненту системы 100 лучевой терапии. Поскольку устройство 104 памяти для изображений удалено от средств 102 получения изображений, средства 102 получения изображений должным образом соединяются с ним через сеть связи, такую как локальная сеть (LAN).
Система 106 планирования системы 100 лучевой терапии принимает изображения для планирования для каждого из пациентов и использует изображения для формирования и/или обновления планов лечения с использованием лучевой терапии (RTP) и/или для выполнения анализа после лечения согласно RTP. Изображение для планирования является изображением, используемым для формирования и/или обновления RTP. Как правило, изображения получают от устройства 104 памяти для изображений и/или от средств 102 получения изображений. Однако изображения могут быть получены и от других источников. Дополнительно, изображения для планирования обычно принимаются электронными средствами через сеть связи. Однако предполагаются и другие средства приема изображений для планирования. Соответственно, система 106 планирования предоставляет типичные функциональные возможности планирования лечения, такие как ручные и автоматизированные инструменты сегментации, инструменты слияния изображений, инструменты планирования трехмерной конформной лучевой терапии (CRT), инструменты оптимизации лучевой терапии с инверсно модулированной интенсивностью (IMRT), инструменты вычисления дозы и так далее.
Для формирования RTP для пациента система 106 планирования принимает перед лучевой терапией одно или более изображений для планирования. Изображения для планирования соответственно сосредоточены на одной или более опухолях или других мишенях пациента, которые должны лечиться или наблюдаться. Дополнительно, изображения для планирования соответственно являются трехмерными и содержат множество срезов (или двухмерных изображений).
После приема изображений для планирования идентифицируется контур (или траектория) вокруг каждой из опухолей или других мишеней и одной или более OAR или других областей. Построение контура используется для определения границ между опухолями или другими мишенями и OAR или другими областями и между OAR и другими областями. Построение контура выполняет должным образом онколог или другой клинический врач. Однако предполагаются и автоматические и полуавтоматические подходы. При выполнении клиническим врачом построения или установления контура клинический врач соответственно использует одно или более устройств 108 ввода данных пользователем, чтобы идентифицировать контуры на графическом интерфейсе пользователя, предоставленном посредством устройства 110 отображения. Например, графический интерфейс пользователя может отображать изображение для планирования и позволяет клиническому врачу вычерчивать или маркировать контуры на планируемом изображении, используя устройства 108 ввода данных пользователем. Как правило, одна или более границ лечения автоматически добавляются вокруг нанесенных контурных областей, чтобы учесть внутрифракционное и/или межфракционное движение. Как отмечено выше, эти границы лечения традиционно были границами лечения, основанными на характерных особенностях населения.
В дополнение к идентификации контуров, для оконтуренных областей определяются параметры плана лучевой терапии. Соответственно, клинический врач или онколог определяет параметры плана лучевой терапии через графический интерфейс пользователя. Например, клинический врач определяет параметры плана лучевой терапии, используя устройства 108 ввода данных пользователем. Однако, как и при построении контура, предлагаются автоматизированные подходы. Параметры плана лучевой терапии обычно содержат минимальные или целевые дозы, которые должны подаваться к опухолям или другим мишеням, максимально допустимые дозы для OAR или других областей и т.п.
Параметры плана лучевой терапии вместе с известной информацией о характеристиках затухания или поглощения излучения различными тканями и нанесенных контурах опухолей или других мишеней и нанесенных контурах OAR или других областей используются для формирования RTP. Как обсуждается ниже, RTP определяет траектории, вдоль которых пучок излучения облучает мишени, пространственную проекцию для каждой траектории пучка излучения, интенсивность пучка излучения вдоль каждой траектории, продолжительность облучения мишеней вдоль каждой траектории и т.п. В определенных вариантах осуществления RTP оптимизируется для конкретного типа лучевой терапии, такого как наружная дистанционная лучевая терапия, протонная терапия, абляционная терапия и фокусированная ультразвуковая терапия высокой интенсивности.
Во время каждого сеанса лучевой терапии определяется накопленная доза излучения, доставленного к опухолям или другим мишеням и OAR или другим областям. По мере проведения процедуры терапии опухоли или другие мишени обычно сужаются и OAR или другие области обычно смещаются, потенциально вызывая ошибки в вычислениях накопленной дозы и контурах (или траекториях). RTP и интеграция накопленной дозы облучения, доставленной к опухолям или другим мишеням и OAR или другим областям, принимают, что местоположения и размеры опухолей или других целей и OAR или других областей остаются такими, как на изображениях, на которых основан план RTP. Если эти местоположения и размеры изменяются, в накопленных дозах облучения будут появляться неточности. Поэтому, чтобы сохранять точность, RTP периодически обновляется. Хотя RTP обычно обновляется между фракциями лечения, предполагается, что RTP обновляется во время фракций лечения.
Чтобы обновить RTP для пациента, система 106 планирования обычно принимает одно или более новых изображений для планирования. Например, система 106 планирования принимает изображения для планирования после каждого или заранее заданного количества сеансов лучевой терапии (или фракций). Как сказано выше, изображения для планирования, соответственно, сосредоточены на одной или более опухолях или других мишенях пациента. После приема нового изображения для планирования или после приема заданного количества новых изображений для планирования контуры (или траектории) и/или дозы RTP обычно обновляются, сравнивая новые изображения для планирования с изображениями для планирования, использованными для формирования RTP и/или предыдущих фракций. Дополнительно или альтернативно, в определенных вариантах осуществления границы для лечения в RTP прослеживаются для пациента, используя модуль 112 определения дозы с компенсацией движения, модуль 114 дозиметрического анализа и модуль 116 определения границ лечения системы 106 планирования. Термин "прослеживание" распределения дозы для пациента, как он используется здесь, должен толковаться как форма слежения за границами лечения пациента.
Модуль 112 определения дозы с компенсацией движения вычисляет дозы, фактически доставленные пациенту (здесь далее упоминаемые как распределение дозы с компенсацией движения) во время одной или более фракций RTP, основываясь на данных движения пациента, собранных во время и/или между фракциями. Модуль определения границ лечения принимает RTP, например, от системы 106 планирования. Устройство 118 отслеживания движения формирует данные, индицирующие движение опухолей или других мишеней и/или OAR или других областей, относительно предыдущих фракций и/или RTP. В этом отношении данные движения обычно определяются в системе координат изображений для планирования, использованных для формирования предыдущей фракции и/или RTP.
Данные движения обычно принимаются от одного или более имитаторов опухолей или других мишеней (здесь далее именуемых "имитаторы мишеней"). Например, данные движения принимают от трех имитаторов мишеней, расположенных в различных местах внутри пациента. В некоторых вариантах осуществления имитаторы мишеней являются радиочастотными приемопередатчиками, расположенными в непосредственной близости от мишени. Устройство 118 отслеживания движения в одном из вариантов осуществления содержит радиоприемники в каждом из множества окружающих местоположений, в которых контролируют сигналы от приемопередатчиков на наличие фазовых сдвигов или других индикаторов перемещения и производят триангуляцию местоположения каждого приемопередатчика. На основе пространственных соотношений между приемопередатчиками и мишенью, указанных в самых последних изображениях для планирования, определяется смещение или изменение формы мишеней. В других вариантах осуществления имитаторами мишеней являются маркеры точек отсчета, имплантированные в пациента. В одном из вариантов осуществления устройство 118 отслеживания движения содержит устройство получения изображений, такое как устройство получения проекционных рентгеновских изображений, изображений магнитно-резонансной томографии (MRI), изображений компьютерной томографии и т.п., действующее, например, во флуороскопическом режиме. Смещение опорных точек определяют, анализируя флюороскопические изображения. В некоторых вариантах осуществления имитаторы мишеней не используют. Скорее для приема данных движения используют слежение за движением на основе изображений. В одном из вариантов осуществления устройство 118 отслеживания движения содержит устройство получения изображений, как описано выше, которое облегчает слежение за движением на основе изображений мишеней в реальном времени, например контуров или анатомических структур.
Данные движения могут приниматься непрерывно, по требованию, после возникновения события, такого как событие таймера, и так далее, но обычно их принимают периодически во время лучевой терапии, например, с частотой 10 Гц. Когда данные движения принимают непрерывно, их, соответственно, разбивают на дискретные блоки на основе времени и алгоритма анализа тенденций и такие значения, как минимальное, медианное, максимальное, среднее значение и так далее, применяют к дискретным блокам.
На Фиг. 2 представлен пример пациента 120, подвергающегося лучевой терапии с помощью системы 100 лучевой терапии. Пациент 120 имеет опухоль или другую мишень 122, вблизи которой имплантированы или прикреплены три имитатора 124 мишени, такие как приемопередатчики и маркеры опорных точек. Имитаторы 124 мишеней снабжают модуль 112 определения дозы с компенсацией движения данными о движении в то время, когда пациент 120 подвергается одной или более фракциям лечения.
Возвращаясь к Фиг. 1, данные собираются одновременно с движением или после движения, и модуль 112 определения дозы с компенсацией движения вычисляет распределение дозы с компенсацией движения. В некоторых вариантах осуществления для каждого временного этапа (или выборки) для собранных данных движения вводится оценка устойчивого движения имитаторов мишеней относительно самого последнего изображения для планирования, используемого для формирования RTP для фракции, связанной с этим временным этапом. Например, предположим, что данные движения для трех имитаторов мишеней собираются в течение двух фракций лечения. Оценка движения определяется для тканей мишени и кутикулы относительно самого последнего изображения для планирования, используемого для первой фракции. Оценка движения показывает ряд местоположений, через которые двигалась мишень, и частоту, с которой мишень появлялась в каждом местоположении. Компоненты устойчивого движения содержат поступательное движение и вращения. Также может использоваться неустойчивое движение.
После определения оценок движения определяется траектория суммарного движения для опухоли или другой мишени во время по меньшей мере части фракции. Как правило, однако, траектория суммарного движения определяется для всей фракции. Например, основываясь на оценках движения, для каждой из опухолей или других мишеней создаются одна или более функций плотности вероятности (PDF). PDF или другая модель ухудшения создается, применяя каждую из оценок движения, связанных с опухолью или другой мишенью и фракцией лечения, к опухоли или другой мишени, чтобы получить в результате местоположение с компенсацией движения, например вероятность, что мишень находится в данном местоположении. Движение опухоли или другой мишени накапливается в PDF, чтобы определить траекторию суммарного движения опухоли или другой мишени во время фракции. Чем больше выборок данных движения собрано во время фракции лечения, тем более точной будет PDF. Применение оценки движения к опухоли или другой мишени показывает часть времени во время облучения терапевтическим пучком, когда мишень полностью или частично находилась вне терапевтического пучка и как долго отсутствовали какие участки.
Для каждой из PDF запланированное распределение дозы, соответствующее PDF, свертывается с PDF, чтобы определить распределение дозы с компенсацией движения для фракции(-ий), соответствующей PDF. Запланированное распределение дозы, соответствующее PDF, является распределением дозы, назначенным для опухоли или другой мишени PDF во время фракции(-ий) лечения PDF. Дозы с компенсацией движения для опухоли или другой мишени могут накапливаться до окончания части (или субнабора) фракции, одной фракции или поднабора фракций.
Первоначальное вычисление дозы для плана обычно предполагает, что во время фракции лечения мишень является стационарной. Из-за движения мишень фактически не может принять вычисленную дозу. Например, если движение заставляет мишень полностью находиться вне терапевтического пучка в течение 10% времени, то вычисленная накопленная доза должна быть выше, чем доза, которая была фактически получена, приблизительно на 10%. PDF или другая модель движения, скорее всего, покажут, какие участки мишени находились вне пучка и в течение какого процента времени. Применяя PDF, на статистической основе определяется фактически доставленная доза. Последующие фракции могут затем планироваться, основываясь на фактической дозе, которая была доставлена ранее.
Последующие фракции могут корректироваться различными способами. Например, поперечное сечение терапевтического пучка может быть увеличено в соответствующих направлениях, так чтобы мишень оставалась под действием лечения, по меньшей мере, для предварительно выбранной части времени. С другой стороны, если мишень не покидает терапевтический пучок, то PDF или другая модель движения покажут, если и в каких направлениях может быть уменьшено поперечное сечение пучка. У обычного пациента поперечное сечение терапевтического пучка на 20-30% больше, чем теоретическое поперечное сечение для неподвижной мишени. Если реальный пациент движется меньше, чем среднее значение движения, поперечное сечение может быть уменьшено, например, чтобы иметь только 10-15% при сканировании. Если пациент движется больше, чем среднее значение движения, поперечное сечение может быть соответственно увеличено.
Во время каждой фракции терапевтический пучок облучает пациента вдоль множества траекторий. PDF определяется для каждой траектории и корректировки поперечного сечения пучка могут делаться независимо для каждой траектории. Другая корректировка RTP для фракций может содержать изменение траекторий или изменение количества облучения вдоль каждой траектории.
Модуль 114 дозиметрического анализа качественно или количественно сравнивает распределение дозы с компенсацией движения для опухолей или других мишеней с соответствующими запланированным распределением дозы. Как правило, но не обязательно, распределение дозы с компенсацией движения получают от модуля 112 определения дозы с компенсацией движения. В некоторых вариантах осуществления, если обнаруживаются значительные дозиметрические отклонения от запланированных распределений дозы, выполняют получение изображений, используя средства 102 получения изображений, в качестве реальной проверки для распределений дозы с компенсацией движения.
Чтобы качественно сравнить распределение дозы с компенсацией движения для опухоли или другой мишени с запланированным распределением дозы, распределение дозы с компенсацией движения и запланированное распределение дозы отображаются графически на графическом интерфейсе пользователя, предоставленном онкологу или другому клиническому врачу через устройство 110 отображения. В некоторых вариантах осуществления распределения дозы отображаются смежными друг с другом, как бы бок о бок. В других вариантах осуществления распределения дозы отображаются наложенными друг на друга с переменными прозрачностями. Соответственно, для идентификации интенсивности дозы используется цвет. Например, градиент используется для идентификации относительной интенсивности, когда чем темнее цвет, тем больше интенсивность. Дополнительно поверх могут накладываться контуры (или траектории). Используя устройства 108 ввода данных пользователем, клинический врач может последовательно продвигаться по срезам в любом направлении (например, поперечном, сагиттальном, венечном, наклонном и т.д.) и наблюдать результирующие двумерные распределения дозы для среза. Предполагаются срезы или проекции, поперечные к одной или более траекториям терапевтического пучка. Предпочтительно это может помочь идентифицировать очевидные и/или значительные различия в дозах и их пространственных расположениях. Другими словами, это может помочь идентифицировать "горячие" места и/или "холодные" места. Горячие места являются местами, где принимается излучение, большее, чем ожидаемое, а холодные места являются областями, где принимается излучение, меньшее, чем ожидается. В некоторых вариантах осуществления качественное сравнение дополнительно содержит прием данных сравнения от устройств 108 ввода данных пользователем, причем данные сравнения указывают дозиметрические различия между распределениями дозы, такие как степень подобия распределений дозы, местоположение горячих мест и/или холодных мест и так далее.
На Фиг. 3 представлен один из вариантов осуществления графического интерфейса 126 пользователя. Здесь, запланированное распределение 128 дозы отображается рядом с распределением 130 дозы с компенсацией фактического движения. Распределения 128, 130 дозы пространственно представлены контуром 132 мишени, наложенным на них. Как показано на чертеже, RTP, спланированный для подачи самой высокой дозы 134, по существу, покрывает весь контур 132 мишени. Однако фактически доставляемое распределение 130 дозы показывает, что самая высокая доза 134 была доставлена только в небольшую часть контура 132 мишени. Следующая, более низкая доза 136 была доставлена в большую часть области мишени. Кроме того, еще более низкая доза 138 была доставлена в контур 132 мишени вблизи его нижнего правого края и нижнего края.
Чтобы количественно сравнить распределения доз, предполагают много разных подходов. В некоторых вариантах осуществления вычисляют разность между запланированным распределением дозы и распределением дозы с компенсацией движения. Разность дает информацию, касающуюся наличия холодных мест (или горячих мест) с точки зрения по меньшей мере величины, местоположения или степени. К разности могут быть применены пороги, например, чтобы идентифицировать холодные места и/или горячие места. Дополнительно или альтернативно, в некоторых вариантах осуществления сравнивают одну или более гистограмм объема дозы (DVH), максимальные дозы, средние дозы, минимальные дозы и т.д. для обоих распределений дозы. Дополнительно или альтернативно, в некоторых вариантах осуществления дозиметрическое воздействие движения определяется количественно как весовая комбинация упомянутых выше факторов, с весами, определяемыми онкологом или другим клиническим врачом.
Модуль 116 определения границ лечения формирует границы для конкретного пациента посредством адаптации первоначальных границ лечения согласно RTP. Модуль 116 определения границ лечения принимает RTP, например, от системы 106 планирования. То есть, основываясь на PDF или другом результате измерения движения мишени(-ей), границы или поперечное сечение терапевтического пучка вне теоретического сечения дозы, полученного для неподвижной мишени, расширяются или сужаются. Когда PDF показывает большие объемы движения или траектории движения, в которых мишень проводит значительную часть времени вблизи крайних точек движения, граница и поперечное сечение расширяются относительно номинальной части. Наоборот, если мишень движется очень мало, граница и поперечное сечение могут быть сужены. Кроме того, граница может быть расширена в некоторых направлениях и сужена в других направлениях. Подобное вычисление корректировки границы делается для каждой траектории, вдоль которой терапевтический пучок облучает мишень во время фракции.
Дополнительно, модуль 116 определения границ лечения принимает одну или более доз с компенсацией движения обычно от модуля 112 определения дозы с компенсацией движения. После этого модуль 116 определения границ лечения соответственно использует модуль 114 дозиметрического анализа, чтобы сравнить распределения доз с компенсацией движения с запланированными распределениями доз. Однако предполагается, что модуль 116 определения границ лечения сравнивает распределения доз с запланированными распределениями доз без модуля 114 дозиметрического анализа.
На основе сравнения соответственно изменяются границы лечения по RTP. В случае одного или более холодных мест, которые считаются недопустимыми, границы, ближайшие к холодным местам, могут быть расширены на одном и том же срезе и/или на соседних срезах. В случае одного или более горячих мест, которые считаются недопустимыми, границы, ближайшие к горячим местам, могут быть сужены на одном и том же срезе и/или на соседних срезах. В случае незначительных разностей в дозе границы могут быть повсеместно сужены с определяемым клинически коэффициентом. В некоторых вариантах осуществления определяемый клинически коэффициент выражается как процент. Полагают, что онколог определяет то, что является недопустимым и/или незначительным, используя для этого устройства 108 ввода данных пользователем и, дополнительно, устройство 110 отображения. В некоторых вариантах осуществления изменение существующих границ выполняется автоматически, используя, например, механизм правил. Однако предполагается ручная корректировка существующих границ онкологом или другим клиническим врачом.
Когда границы корректируются вручную, модуль определения границ лечения принимает данные корректировки от устройств 108 ввода данных пользователем. Данные корректировки являются данными, указывающими, какие из границ лечения следует корректировать и насколько можно их корректировать. Например, данные корректировки могут определить необходимость расширения границы лечения, ближайшей к холодному месту. В некоторых вариантах осуществления графический интерфейс пользователя, отображаемый на устройстве 110 отображения, используется для облегчения ручного изменения границ лечения. Например, может использоваться графический интерфейс пользователя, подобный графическому интерфейсу пользователя, применяемому модулем дозиметрического анализа.
Когда границы лечения для конкретного пациента формируются, используя модуль 116 определения границ лечения, границы лечения для конкретного пациента могут использоваться для оставшихся сеансов лечения по RTP. Если новые распределения дозы предлагают уменьшенное покрытие опухолей или других мишеней или увеличенную дозу для OAR или других областей, границы могут быть оценены повторно. В этом отношении границы лечения для конкретного пациента могут формироваться, многократно используя модуль 116 определения границ лечения, пока не будет достигнута граница, приводящая в результате к удовлетворительному распределению дозы. Дополнительно могут быть выполнены дозиметрические проверки, используя, например, одно из средств 102 получения изображений, чтобы подтвердить правильность границ лечения для конкретного пациента.
Чтобы выполнить анализ после лечения по плану RTP, система 106 планирования принимает одно или более изображений после завершения RTP и/или данные движения, как описано выше. Изображения, соответственно, сосредоточены на одной или более опухолях или других мишенях пациента. После приема новых изображений и/или данных движения по меньшей мере один из таких модулей, как модуль 112 определения дозы с компенсацией движения, модуль 114 дозиметрического анализа или модуль 116 определения границ лечения, используется для анализа RTP. Определяются накопленные значения дозы, скорректированной с учетом движения. RTP корректируется в соответствии с новым изображением, накопленной дозой, моделью движения и т.п. Например, модуль 116 определения границ лечения может использоваться для формирования границы лечения для конкретного пациента. В другом примере модуль 114 дозиметрического анализа может использоваться для изучения воздействия движения на RTP.
Система 106 планирования соответственно содержит одно или более устройств 140 памяти и один или более контроллеров 142 на основе процессоров. Устройства 140 памяти хранят исполняемые команды для управления процессором контроллеров 142 на основе процессоров, чтобы выполнять одну или более из упомянутых выше функций системы 106 планирования. Дополнительно, в некоторых вариантах осуществления по меньшей мере один из таких модулей, как модуль 112 определения дозы с компенсацией движения, модуль 114 дозиметрического анализа или модуль 116 определения границ лечения, осуществляется посредством исполняемых команд, хранящихся, например, в устройстве 140 памяти. Контроллеры 142 на основе процессоров выполняют исполняемые команды, хранящиеся в устройствах 140 памяти, чтобы выполнять функции, связанные с системой 106 планирования. Когда система 106 планирования работает, чтобы выполнять по меньшей мере одну из таких операций, как прием изображений из сети связи, хранение RTP по сети связи или прием данных движения из сети связи, система 106 планирования дополнительно содержит один или более блоков 144 связи, облегчающих связь между контроллерами 142 на основе процессоров и сетями связи.
Планы RTP, формируемые и/или обновляемые системой 106 планирования, хранятся в устройстве 146 памяти для планов лучевой терапии. Как правило, устройство 146 памяти для планов лучевой терапии является центральной системой хранения документов. Однако предполагается, что устройство 146 памяти для планов лучевой терапии локально по отношению к системе 106 планирования или другому компоненту системы 100 лучевой терапии. Поскольку устройство 146 памяти для планов лучевой терапии находится на удалении от системы 106 планирования, устройство 146 памяти для планов лучевой терапии соответственно соединяется с ней через сеть связи, такую как локальная сеть (LAN).
В запланированные день и время сеанса лучевой терапии или фракции RTP устройство 148 лучевой терапии используется для подачи терапевтического излучения пациенту. Излучение может содержать рентгеновское излучение, протоны, звуковое излучение и так далее, пригодные для лучевой терапии, такой как наружная дистанционная лучевая терапия, протонная терапия, абляционная терапия и фокусированная ультразвуковая терапия высокой интенсивности. Соответственно, устройством 148 лучевой терапии управляет система 150 управления лучевой терапией согласно плану RTP, хранящемуся в устройстве 146 памяти для планов лучевой терапии. Например, в показанном на чертеже варианте осуществления устройство 148 лучевой терапии содержит линейный ускоритель (LINAC) и система 150 управления лучевой терапией воздействует на многолепестковый коллиматор (MLC) или другое устройство формирования профиля пучка излучения ускорителя LINAC, чтобы модулировать интенсивность и профиль пучка по мере того, как линейный ускоритель перемещается или ступенчато движется вокруг объекта, чтобы доставить распределение дозы облучения объекту, обеспечивая требуемую интегрированную дозу излучения для целевой области, в то же время соответственно ограничивая или устанавливая пределы экспозиции радиоактивного облучения чувствительных критических областей в соответствии с RTP.
Хотя модуль 112 определения дозы с компенсацией движения, модуль 114 дозиметрического анализа и модуль 116 определения границ лечения были описаны вместе, следует понимать, что модули 112, 114, 116 могут использоваться отдельно. Дополнительно, следует понимать, что модули 112, 114, 116 обладают более широкой применяемостью, чем системы лучевой терапии. То есть модули 112, 114, 116 могут использоваться для целей, отличных от лучевой терапии.
На Фиг. 4 представлена блок-схема способа 400, выполняемого одним или более процессорами для формирования границ лечения для конкретного пациента. План лучевой терапии (RTP) для облучения мишени в течение одной или более фракций формируют или принимают на этапе 402. RTP содержит одну или более границ лечения вокруг мишени и запланированное распределение дозы для мишени. В течение по меньшей мере одной из фракций лечения на этапе 404 принимают данные движения, такие как от одного или более имитаторов мишеней. Данные движения содержат профиль движения или распределение, по меньшей мере, мишени в трех измерениях.
Распределение дозы с компенсацией движения для мишени вычисляется на этапе 406, используя данные движения и запланированное распределение дозы. В некоторых вариантах осуществления вычисление на этапе 406 содержит получение на этапе 408 оценки движения имитаторов мишеней относительно изображения для планирования, используемого для формирования выборки фракции лечения. После этого для каждой по меньшей мере одной из фракций лечения используют оценки движения для фракции лечения, чтобы на этапе 410 сформировать функции плотности вероятности (PDF) для мишени. Каждая из PDF представляет траекторию суммарного движения мишени во время соответствующей фракции лечения. Наконец, на этапе 412 из PDF формируют распределение дозы с компенсацией движения. Соответственно, этот этап содержит для каждой из PDF выполнение свертывания запланированного распределения дозы, соответствующего неподвижной мишени, облучаемой терапевтически пучком лучевой терапии, с границей, указанной в RTP, с PDF, чтобы определить дозу с учетом компенсации движения для фракции лечения, то есть дозу, которая была фактически доставлена из-за присутствия движения. Например, компоненты движения в плоскости, ортогональной к каждой траектории терапевтического пучка, могут использоваться для формирования двумерной PDF, которая служит для определения, как движение оказало влияние на доставленную дозу вдоль этой траектории пучка. Распознавание, что движение не оказывает влияние на все траектории пучка, также позволяет более точно вычислять накопленную дозу по всем траекториям или линейным положениям для фракции.
Когда распределение дозы с компенсацией движения вычислено, на этапе 414 оно сравнивается с запланированным распределением дозы. В некоторых вариантах осуществления сравнение является качественным и делается с отображением рядом друг с другом распределения дозы с компенсацией движения и запланированного распределения дозы. В таких вариантах осуществления соответственно принимают от устройств 108 ввода данных пользователем данные сравнения, указывающие дозиметрические разности между распределениями дозы. В других вариантах осуществления сравнение является количественным. В таких вариантах осуществления предполагается, что вычисляется разность между распределением дозы с компенсацией движения и запланированным распределением дозы. Дополнительно или альтернативно, предполагают, что для каждого распределения дозы с компенсацией движения и запланированного распределения дозы вычисляется по меньшей мере один их таких параметров, как гистограмма объема дозы (DVH), максимальная доза, средняя доза или минимальная доза. Дополнительно или альтернативно, предполагают, что дозиметрическое воздействие движения на RTP вычисляется для распределения дозы с компенсацией движения и/или для запланированного распределения дозы посредством весовой комбинации по меньшей мере одного из таких параметров, как максимальная доза, средняя доза или минимальная доза. Учитывая накопленную дозу, фактически доставленную в эту точку, в RTP, RTP повторно вычисляют для остальных фракций, чтобы к концу лечения доставить общую запланированную дозу.
Для повторного вычисления RTP на этапе 416 границы лечения корректируют, основываясь на дозиметрических разностях между распределением дозы с компенсацией движения и запланированным распределением дозы. Соответственно, это содержит выполнение на этапе 418 идентификации холодных мест и/или горячих мест между распределением дозы с компенсацией движения и запланированным распределением дозы. После этого на этапе 420 по меньшей мере одну из границ лечения, ближайшую к холодным местам, расширяют и на этапе 422 по меньшей мере одну из границ лечения, ближайшую к горячим местам, сужают, например, посредством регулировки установок коллиматора вдоль одной или более траекторий терапевтического пучка. Дополнительно, если разность между распределениями дозы незначительна, на этапе 424 сужают по меньшей мере одну из границ лечения.
Устройство памяти, как оно используется здесь, содержит один или более несъемных считываемых компьютером носителей; магнитный диск или другой магнитных носитель данных; оптический диск или другой оптический носитель данных; оперативную память (RAM), постоянное запоминающее устройство (ROM) или другое электронное запоминающее устройство или микросхему или набор оперативно соединенных микросхем; сервер Интернета/Интранета, с которого хранящиеся команды могут быть получены через Интернет/Интранет или локальную сеть, и так далее. Дополнительно, контроллер на основе процессоров, как он используется здесь, содержит один или больше микропроцессоров, микроконтроллер, графический процессор (GPU), специализированную интегральную схему (ASIC), программируемую логическую интегральную схему (FPGA) и т.п.; устройство ввода данных пользователем содержит одно или более из таких устройств, как мышь, клавиатура, сенсорный дисплей, одна или более кнопок, один или более выключателей, один или более переключателей и т.п.; и устройство отображения содержит одно или более из таких устройств, как жидкокристаллический дисплей, светодиодный дисплей, плазменный дисплей, проекционный дисплей, сенсорный дисплей и т.п.
Изобретение было описано со ссылкой на предпочтительные варианты осуществления. Модификации и изменения альтерации могут быть выполнены специалистами в данной области техники после прочтения и понимания предшествующего подробного описания. Предполагается, что изобретение должно пониматься как содержащее все такие модификации и изменения, насколько они попадают в границы приложенной формулы изобретения или ее эквивалентов.
Реферат
Группа изобретений относится к наружной дистанционной лучевой терапии. Система планирования лечения для формирования границ лечения содержит один или более процессоров, запрограммированных, чтобы принимать план лучевой терапии (RTP) для облучения мишени в течение одной или более фракций лечения, причем упомянутый RTP включает в себя одну или более границ лечения вокруг мишени, и запланированное распределение дозы, которая должна быть доставлена мишени, принимать данные движения по меньшей мере для одной из фракций лечения по RTP, причем данные движения принимаются во время и/или между фракциями лечения по RTP, вычислять распределение дозы с компенсацией движения для мишени и сравнивать распределение дозы с компенсацией движения с запланированным распределением дозы. Система лучевой терапии содержит одно или более средств получения изображений, систему планирования, устройство лучевой терапии и устройство отслеживания движения, формирующее для мишени данные движения на основе имитаторов мишеней. Способ формирования границ лечения содержит этапы, на которых принимают план лучевой терапии (RTP) для облучения мишени в течение одной или более фракций лечения, причем RTP включает одну или более границ лечения вокруг мишени и запланированное распределение дозы для мишени, принимают данные движения по меньшей мере для одной из фракций лечения по RTP, вычисляют распределение дозы с компенсацией движения для мишени и сравнивают распределение дозы с компенсацией движения с запланированным распределением дозы. Система лучевой терапии по второму варианту содержит устройство лучевой терапии, устройство отслеживания движения на основе
Формула
один или более процессоров (142), запрограммированных, чтобы:
принимать план лучевой терапии (RTP) для облучения мишени (122) в течение одной или более фракций лечения, причем упомянутый RTP включает в себя одну или более границ лечения вокруг мишени (122) и запланированное распределение дозы, которая должна быть доставлена мишени (122);
принимать данные движения по меньшей мере для одной из фракций лечения по RTP, причем данные движения принимаются во время и/или между фракциями лечения по RTP;
вычислять распределение дозы с компенсацией движения для мишени (122), используя данные движения для корректирования запланированного распределения дозы, основываясь на принятых данных движения;
сравнивать распределение дозы с компенсацией движения с запланированным распределением дозы.
идентификацию холодных мест и/или горячих мест между распределением дозы с компенсацией движения и запланированным распределением дозы;
расширение в ответ на идентификацию холодного места по меньшей мере одной из границ лечения, ближайшей к холодному месту;
сужение в ответ на идентификацию горячего места по меньшей мере одной из границ лечения, ближайшей к горячему месту; и
сужение по меньшей мере одной из границ лечения в ответ на незначительные разности дозы между распределением дозы с компенсацией движения и запланированным распределением дозы.
создание одной или более функций плотности вероятности (PDF) из данных движения, причем каждая из упомянутых PDF представляет траекторию суммарного движения мишени (122) во время фракции лечения.
выполнение свертки запланированных распределений дозы с PDF, чтобы определить одну или более доз с компенсацией движения, указывающую дозу, фактически доставленную к мишени.
устройство (110) отображения;
при этом сравнение включает в себя по меньшей мере одно из следующего:
отображение на устройстве (110) отображения распределения дозы с компенсацией движения рядом с запланированным распределением дозы; и
отображение распределения дозы с компенсацией движения с наложением на запланированное распределение дозы.
вычисление разности между распределением дозы с компенсацией движения и запланированным распределением дозы; и/или
вычисление по меньшей мере одного из следующего: гистограмм объема дозы (DVH), максимальной дозы, средней дозы и минимальной дозы для каждого из распределения дозы с компенсацией движения и запланированного распределения дозы.
одно или более средств (102) получения изображений, которые получают одно или более изображений для планирования;
систему (106) планирования по любому из пп. 1-7, которая формирует из изображений для планирования план лучевой терапии (RTP) для облучения мишени (122) в течение одной или более фракций лечения, причем упомянутый RTP включает в себя одну или более границ лечения вокруг мишени (122) и запланированное распределение дозы для мишени (122), и которая формирует границы лечения для конкретного пациента на основе RTP;
устройство (148) лучевой терапии для осуществления лучевой терапии в соответствии с RTP; и
устройство (118) отслеживания движения, формирующее для мишени (122) данные движения на основе имитаторов (124) мишеней.
принимают (402) план лучевой терапии (RTP) для облучения мишени (122) в течение одной или более фракций лечения, причем упомянутый RTP включает в себя одну или более границ лечения вокруг мишени (122) и запланированное распределение дозы для мишени (12 0);
принимают (404) данные движения по меньшей мере для одной из фракций лечения по RTP, причем данные движения принимаются во время и/или между фракциями лечения по RTP;
вычисляют (406) распределение дозы с компенсацией движения для мишени (122), используя данные движения для корректировки запланированного распределения дозы, основываясь на принятых данных движения; и
сравнивают (414) распределение дозы с компенсацией движения с запланированным распределением дозы.
корректируют (416) границы лечения, основываясь на дозиметрических разностях между распределением дозы с компенсацией движения и запланированным распределением дозы.
идентифицируют (418) холодные места и/или горячие места между распределением дозы с компенсацией движения и запланированным распределением дозы;
расширяют (420) в ответ на идентификацию холодного места по меньшей мере одну из границ лечения, ближайшую к холодному месту;
сужают (422) в ответ на идентификацию горячего места по меньшей мере одну из границ лечения, ближайшую к горячему месту; и
сужают (424) по меньшей мере одну из границ лечения в ответ на незначительные разности дозы между распределением дозы с компенсацией движения и запланированным распределением дозы.
создают (410) одну или более функций плотности вероятности (PDF) из данных движения, причем каждая из упомянутых PDF представляет траекторию суммарного движения мишени (122) во время фракции лечения; и
выполняют свертку запланированных распределений дозы с PDF, чтобы определить одну или более доз с компенсацией движения, указывающую дозу, фактически доставленную к мишени, так что могут накапливаться дозы с компенсацией движения по меньшей мере одной из фракций лечения.
отображают распределение дозы с компенсацией движения рядом с запланированным распределением дозы;
отображают распределение дозы с компенсацией движения с наложением на запланированное распределение дозы;
вычисляют разность между распределением дозы с компенсацией движения и запланированным распределением дозы;
вычисляют по меньшей мере одно из следующего: гистограммы объема дозы (DVH), максимальную дозу, среднюю дозу и минимальную дозу для каждого из распределения дозы с компенсацией движения и запланированного распределения дозы; и
вычисляют дозиметрическое воздействие движения на RTP посредством весовой комбинации по меньшей мере одного из следующего: максимальной дозы, средней дозы и минимальной дозы для распределения дозы с компенсацией движения и/или запланированного распределения дозы.
устройство (148) лучевой терапии для осуществления лучевой терапии в соответствии с RTP;
устройство (118) отслеживания движения, формирующее для мишени (122) данные движения на основе имитаторов (124) мишеней; и
один или более процессоров (142), запрограммированных для выполнения способа (400) по любому из пп. 9-13.

Комментарии