Система лучевой терапии, снабженная программой для вычисления интенсивности луча электронов - RU2655070C2
Код документа: RU2655070C2
Чертежи


Описание
Настоящее изобретение относится к системе лучевой терапии, снабженной программой для вычисления интенсивности луча электронов.
Более конкретно, изобретение относится к системе или устройству вышеуказанного вида, предназначенной, в частности, для моделирования вычисления интенсивности луча электронов, которое может быть применено в интраоперационной лучевой терапии, которая используется в процессе удаления опухолевой ткани, но которая также может использоваться для любой интраоперационной лучевой терапии, в которой необходимо вычисление интенсивности применяемого луча электронов.
Как хорошо известно, в настоящее время после консервативного хирургического вмешательства, то есть после удаления части тела, в которой присутствует опухолевая ткань, это место подвергают обычной внешней лучевой терапии, при которой высокоэнергетические рентгеновские лучи направляют через кожу, чтобы подать дозу рентгеновского облучения на заранее заданную облучаемую зону для стерилизации оставшейся части, в особенности «поддерживающей ткани» опухоли, которая представляет собой конусообразную зону, где опухоль находилась до хирургической резекции, для уменьшения риска локальных рецидивов.
В общем случае при обычной лучевой терапии требуемую суммарную дозу разбивают на несколько частей, в результате чего пациенту необходимо десятки раз приезжать в медицинское учреждение.
Кажется очевидным, что эта процедура является обременительной, приносит значительный дискомфорт пациентам и отрицательно влияет на экономику и организацию работы отделений лучевой терапии.
Кроме того, при таком типе лечебного воздействия, которое производится фотонами, невозможно полностью избежать облучения здоровых тканей и органов, расположенных близко к области местонахождения опухоли, что может представлять угрозу для нормального функционирования этих органов и тканей.
Поэтому была разработана интраоперационная лучевая терапия (Intraoperative Radiotherapy, IORT) как техническая замена и/или дополнение обычной лучевой терапии.
Интраоперационная лучевая терапия состоит, главным образом, в назначении во время хирургического удаления опухолевой ткани разовой большой дозы облучения, поставляемой в поддерживающую ткань опухоли, для стерилизации опухолевых клеток, оставшихся после хирургической резекции.
Главное преимущество интраоперационной лучевой терапии заключается в том, что при использовании лучей электронов с адекватной энергией можно подать лечебную дозу непосредственно в целевой объем во время хирургической операции за разовый курс, что в то же время позволяет сберечь здоровую ткань, которая может быть полностью экранирована или временно исключена из обрабатываемой зоны во время облучения.
В частности, интраоперационная лучевая терапия уже повседневно используется для лечения некоторых поверхностных опухолей (груди, головы, шеи) и глубоких опухолей (простаты, прямой кишки) и приносит значительную пользу Региональной или Национальной службе здравоохранения, поскольку она значительно уменьшает очереди пациентов для доступа в отделения лучевой терапии, так как лечение выполняют однократно во время самой хирургической операции.
Клинический опыт показывает, что биологическая эффективность назначения разовой дозы дает больший эффект, чем та же доза по частям. Согласно оценкам радиобиологов (Strandquist 1994, Окунев 1999) разовая доза при интраоперационной лучевой терапии способна уничтожить приблизительно в 2 или 3 раза больше опухолевых клеток, чем та же доза, примененная при полном курсе лучевой терапии по частям.
Действительно, уменьшение времени между хирургическим удалением опухоли и облучением значительно уменьшает риск возобновления роста опухолевой ткани вследствие наличия остаточных опухолевых клеток, не говоря уже о бесспорных преимуществах для пациента с клинической и логистической точек зрения. Заявка на патент US 2007/195929 А1 раскрывает систему для лучевой терапии согласно ограничительной части п. 1 формулы изобретения.
Этот способ важен в случаях, при которых операция по хирургическому удалению опухолевой ткани не полностью эффективна или же ее проведение затруднено из-за наличия структур или критически важных органов, которые могут быть повреждены или порезаны во время хирургии, или если существует высокий риск микроскопической инфильтрации поддерживающей ткани опухоли.
Кроме того, возможно предотвращение воздействия луча на здоровые органы, которые можно соответственно экранировать или защитить во время хирургической операции.
В настоящее время значение дозы, подаваемой в поддерживающую ткань опухоли, проверяют дозиметрическими измерениями в естественных условиях, размещая детектор в важной эталонной точке в поле облучения или в апертуре поддерживающей ткани опухоли.
Пример известного устройства, ближайшего к изобретению, представлен европейской заявкой на патент ЕР 2269693, которая относится к моделирующей и планирующей системе интраоперационной лучевой терапии и соответствующему способу.
Эта система содержит центральный блок обработки для управления системой и интерфейсом пользователя, множество блоков контроля или экранов для демонстрации изображений и периферийное оборудование, предназначенное для захвата данных, относящихся к действиям, выполняемым пользователем.
Кроме того, система также содержит модуль моделирования деформации для моделирования деформации, возникающей в органах и соседних тканях во время интраоперационной лучевой терапии, при этом моделирование осуществляется посредством алгоритмов для мгновенного вычисления дозы облучения, применяемой во время интраоперационной лучевой терапии, средство для записи всех действий, выполненных пользователем, и средство для генерации дозиметрического отчета.
Эта система, однако, ограничена лишь моделированием и планированием интраоперационной лучевой терапия для оценки дозы облучения, которая необходима во время самого лечения, на основе дозиметрического отчета относительно всей продолжительности лечения.
Однако в используемых в настоящее время системах интраоперационной лучевой терапии все еще имеются значительные ограничения и недостатки.
Первый недостаток относится к недостаточной точности всей распространенной дозы, подаваемой в режиме реального времени в облучаемые области, что сопровождается риском воздействия на клинические исследования, направленные на определение зависимости эффекта от применяемой дозы.
Кроме того, еще не доступны коммерчески инструменты для регулировки испускаемого луча, то есть инструменты, которые позволяют менять форму и размер луча, чтобы подогнать его к обрабатываемой области, к клиническим объектам неправильной формы, как, например, в случае саркомы нижних конечностей.
Также, при современном уровне инструментов, обработка поддерживающей ткани опухоли с размерами больше 10-12 см не возможна.
Другой недостаток связан с невозможностью выявления точного расположения обрабатываемой зоны или «клинической цели» и радиочувствительных структур, которые следует предохранять во время хирургической фазы, поскольку недоступны системы захвата изображения в реальном времени или «отображение онлайн».
Еще одним недостатком является невозможность выявления, отображения и документирования фактического распространения испускаемой дозы к обрабатываемой зоне и к радиочувствительным структурам, поскольку не доступна программа планирования лечения или «система планирования лечения» (Treatment Planning System, TPS), основанная на захвате изображений в хирургической фазе, в более комплексных морфологических ситуациях, в результате чего приходится значительно расширять зоны обработки, например при раке головы и шеи.
Последним недостатком является невозможность персонализировать интраоперационную лучевую терапию непосредственно перед испусканием дозы в зависимости от фактической геометрии анатомической области, значительно измененной после хирургии вследствие удаления опухолевой ткани.
Поэтому в свете вышеизложенного целью настоящего изобретения является создание системы лучевой терапии, снабженной программой вычисления в реальном времени интенсивности луча электронов, который можно подать пациенту в область, подвергнутую хирургическому удалению, контекстуально представляющему собой хирургическое вмешательство, при этом учитывается точное вычисленное значение интенсивности уже поданного луча электронов и структура обрабатываемой области в течение и после хирургического удаления.
Другой целью изобретения является выполнение прогнозирующего вычисления плана интраоперационной лучевой терапии, который позволяет иметь информацию об интенсивности луча электронов, подаваемого в обрабатываемую зону, и информацию относительно здоровых органов для оптимизации лечения.
Еще одной целью изобретения является создание системы планирования лечения (TPS), которая использует значение интенсивности луча электронов, записанное во время первой половины облучения, для точного определения блоков контроля, в которых значение пропорционально поданной дозе.
Поэтому специфической целью настоящего изобретения является система лучевой терапии, снабженная программой для вычисления интенсивности луча электронов, при этом система содержит ускоритель свободных электронов, оборудованный аппликатором, предназначенным для передачи луча электронов с заранее заданной интенсивностью на зону или внутрь пациента, обеспечивая целевую лучевую терапию, устройство захвата изображений, предназначенное для обнаружения указанной зоны, встроенный блок управления, содержащий дисплей для формирования двумерных или трехмерных изображений, и компьютер, при этом указанный компьютер соединен с указанным ускорителем электронов и с указанным устройством захвата изображений, и активный датчик дозы облучения, создаваемой указанным лучом электронов, который может быть установлен между дистальным концом указанного аппликатора и указанной зоной, и который может быть соединен с указанным встроенным блоком управления, отличающаяся тем, что указанный компьютер снабжен программой для вычисления интенсивности указанного луча электронов, посредством которого облучают указанную зону, содержащей следующие шаги:
(i) установку первой интенсивности указанного луча электронов согласно функционированию и геометрическим характеристическим параметрам указанного ускорителя электронов и/или вычисленной методом Монте-Карло, а также согласно по меньшей мере одному заранее заданному изображению указанной зоны, при этом указанную интенсивность создают указанным ускорителем электронов при первом облучении;
(ii) работу указанного ускорителя электронов для испускания первого луча электронов при указанном первом облучении, соответствующего части указанной первой интенсивности, установленной на шаге (i);
(iii) обнаружение реальной интенсивности указанного первого луча электронов во время указанного первого облучения посредством указанного датчика облучения, размещенного в соответствии с указанной зоной;
(iv) захват по меньшей мере одного изображения указанной зоны посредством указанного устройства захвата изображений;
(v) вычисление промежуточной интенсивности указанного луча электронов согласно указанному по меньшей мере одному изображению, захваченному на шаге (iv), и согласно указанной реальной интенсивности указанного первого луча электронов, обнаруженной на шаге (iii); и
(vi) сравнение указанной первой интенсивности, установленной на шаге (i), с указанной промежуточной интенсивностью, вычисленной на шаге (v), для вычисления окончательной интенсивности указанного луча электронов, посредством которого указанная зона может быть облучена при втором облучении после указанного первого облучения.
Кроме того, согласно изобретению вычисление указанной окончательной интенсивности на шаге (vi) выполняют согласно следующему уравнению:
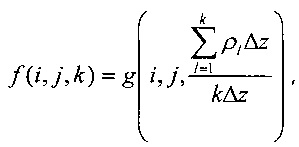
где
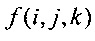
Предпочтительно, чтобы вычисление указанной функции

Согласно изобретению указанная часть, испускаемая при указанном первом облучении на шаге (ii), соответствует приблизительно половине указанной первой интенсивности на шаге (i).
Кроме того, согласно изобретению указанные шаги от (i) до (iv) могут выполняться рекурсивно так, что при каждой новой рекурсии окончательная интенсивность, вычисленная на шаге (iv) из предыдущей рекурсии, совпадает с первой интенсивностью, устанавливаемой на шаге (i) следующей рекурсии.
Предпочтительно, чтобы указанный активный датчик облучения представлял собой активный дозиметр, такой как полевой транзистор с изолированным затвором (MOSFET) или диод или алмазный детектор, и был оборудован рентгеноконтрастным или гипоэхоическим репером, чтобы быть видимым во время шага (iv).
Предпочтительные варианты осуществления настоящего изобретения определены в зависимых пунктах формулы изобретения.
Ниже настоящее изобретение описано с иллюстративной, но не ограничительной целью на примере предпочтительных вариантов его осуществления со ссылками на приложенные чертежи, где:
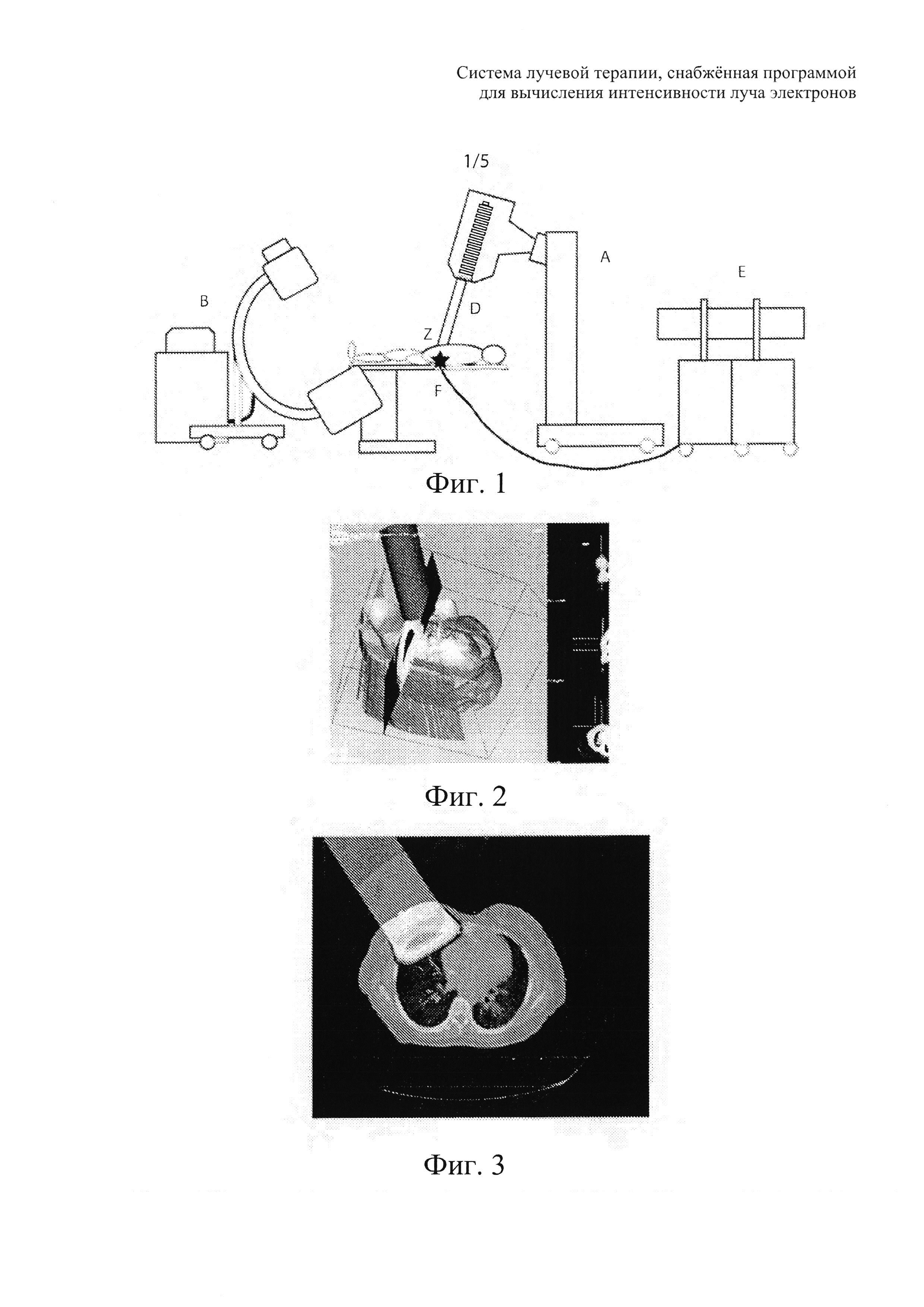
на фиг. 1 показана система, представляющая собой цель изобретения;
на фиг. 2 показана система формирования изображения, предназначенная для описания геометрии области, которая будет подвергнута обработке, и относительное положение аппликатора ускорителя относительно пациента;
на фиг. 3 показано представление обрабатываемой зоны с аппликатором;
на фиг. 4 также показано представление обрабатываемой зоны с аппликатором;
на фиг. 5 показано моделирование трехмерного интраоперационного распространения, вычисленного с использованием статистического способа;
на фиг. 6 показана область, имеющая специфическую форму и обрабатываемая аппликатором;
на фиг. 7 также показана область, имеющая специфическую форму и обрабатываемая аппликатором;
на фиг. 8 также показана область, имеющая специфическую форму и обрабатываемая аппликатором;
на фиг. 9 показан прототип формирователя луча, где на фиг. А показан вид снизу, а на фиг. В показан вид сбоку;
на фиг. 10 схематично показан алгоритм, используемый в настоящем изобретении; и
на фиг. 11 показана блок-схема алгоритма.
На различных чертежах сходные элементы обозначены одинаковыми позициями.
На фиг. 1 система S содержит специализированный ускоритель А свободных электронов, устройство В захвата изображений, которое обеспечивает захват интраоперационных изображений во время хирургической операции, отличающихся от дооперационных, что обеспечивает точную локализацию зоны Z, обрабатываемой аппликатором D для доставки излучения.
Система S также содержит встроенный блок Ε управления, содержащий дисплей для формирования двумерных и трехмерных изображений и компьютер, который снабжен программой планирования лечения или «системой планирования лечения» (TPS), соединенный с дисплеем изображений для обработки изображения, необходимого при вычислении адекватной интенсивности луча электронов, и с ускорителем А для управления конкретными параметрами лучевой терапии и техническими параметрами.
Кроме того, система S также содержит устройство F контроля и проверки, работа которого основана на измерениях в живом организме, выполняемых в режиме реального времени посредством небольших по размеру активных детекторов облучения, таких как диоды или полевой транзистор с изолированным затвором, который соединен со встроенной системой Е.
Программа системы планирования лечения, встроенная в ускоритель А, позволяет захватывать изображения, которые отображаются дисплеем и которые могут использоваться интраоперационно для очерчивания представляющих интерес областей, используемых в качестве направляющих во время хирургического вмешательства.
Система S позволяет выполнять в реальном времени предварительное изучение плана интраоперационной лучевой терапии на основе точного вычисления результата после обработки изображений для вычисления интенсивности луча электронов, который можно отправить в обрабатываемую зону Ζ и в соседние ткани.
Система планирования лечения (TPS) основана на захвате и обработке изображений посредством адекватных машинных кодов для совместной регистрации самих изображений во время дооперационного, интраоперационного и послеоперационного моделирования лечения.
Во время дооперационного моделирования лечения система планирования лечения использует характеристические дозиметрические данные ускорителя А, такие как очаговая доза (Percentage Depth Dose, PDD), и профили для каждого значения энергии и каждого типа аппликатора D.
В моделировании также используется геометрия аппликаторов D и устройства модификации луча, которые являются дополнительными системами и устанавливаются на конце аппликатора D для формирования поля.
В алгоритмах системы планирования лечения используется моделирование Монте-Карло и экспериментальные дозиметрические измерения в реальных условиях.
Кроме того, система планирования лечения также включает вычислительные алгоритмы для изучения взаимодействия между лучами электронов в рамках интраоперационной лучевой терапии и тканями пациента, через которые эти лучи проходят, для вычисления интенсивности луча электронов, испускаемого во время интраоперационной фазы.
Кроме того, программа системы планирования лечения также содержит трехмерные анатомические модели сегментов, которые обеспечивают трехмерную визуализацию органов и электронной интенсивности.
Кроме того, система S обеспечивает обмен данными и информацией между различными устройствами, создавая специализированную уникальную платформу, выполненную с использованием изображений в стандарте DICOM и стандартов, относящихся к ускорителю А.
У системы S имеется функция, которая отличается в зависимости от фазы, в которой она работает, в частности:
при захвате данных в предварительной фазе, «предварительное планирование», захватывают изображения компьютерной томографии (Computed Tomography, СТ) для анатомической секции С, подвергающейся хирургии, с использованием любой обычной системы формирования СТ изображения.
Затем эти изображения используются для реализации и оптимизации плана дооперационного лечения путем вычисления модулем TPS первой интенсивности луча электронов с учетом работы и геометрических характеристических параметров ускорителя А электронов и/или вычисления методом Монте-Карло, для доставки его посредством ускорителя А электронов при первом облучении.
Во время интраоперационной фазы устройство В захвата изображений захватывает в реальном времени трехмерные/объемные изображения области после хирургического вмешательства, которые отправляются в TPS для определения электронной плотности тканей в обрабатываемой зоне Ζ для дифференциации эффективности обработки ткани опухоли и ткани здоровых органов.
Эти данные позволяют вычислить распространение интенсивности луча электронов с учетом формирователей луча, или поверхностей, и/или объемов с неправильной геометрией, и вследствие этого получать, отображать и документировать распространение интенсивности луча электронов, идущего в ткани, во время интраоперационной лучевой терапии.
Устройство F обнаруживает реальную интенсивность первого луча электронов в живых тканях, доставляемого во время интраоперационной лучевой терапии.
Это измерение сравнивают со значением первой интенсивности вычисленного луча электронов и устанавливают перед обработкой, чтобы затем изменить/адаптировать дозу, подаваемую в реальном времени, избегая возможных чрезмерных доз, и вычисляют окончательную интенсивность луча, который будет подан при втором облучении.
Поскольку применение интраоперационной лучевой терапии реализовано в двух последовательных частях, первом облучении и втором облучении, с блокировкой тракта облучения в пределах той же самой хирургической процедуры, измерения, выполненные устройством F в живой ткани во время первого облучения, используются для оптимизации интенсивности луча электронов во время второго облучения.
Во время послеоперационной фазы вычисление дозиметрии TPS поддерживается моделированием Монте-Карло для проверки согласования вычисления дозиметрии TPS в реальных условиях или с использованием изображений и информации, захваченных во время интраоперационной фазы.
Вычисление интенсивности луча электронов сопровождается обращением к базе данных распространения дозы облучения в воде, вычисленной с использованием моделирования Монте-Карло или определенной экспериментально, в различных эталонных геометриях.
Что касается моделирования Монте-Карло, распространение интенсивности луча электронов в воде и величины поля падающего луча выводятся из подробного описания и характеристик используемого в интраоперационной лучевой терапии мобильного линейного ускорителя, как с точки зрения геометрии, так и материалов конструкции.
Если отталкиваться от распространения интенсивности луча электронов в воде, имеется выбор из двух направлений вычисления. Первое это быстрая оценка распространения интенсивности луча электронов, следующая из геометрии выбора облучения, которая достигается путем выбора для каждого коллиматора (определяемого диаметром и углом отсечки) и энергии луча соответствующей матрице интенсивности луча электронов и применением быстрого алгоритма для вычисления эквивалентного радиологического пути, то есть для «отслеживания луча».
Данные, полученные из снимков в рамках компьютерной томографии, используются для определения эквивалентного пути в воде посредством вычисления известных интегралов для конкретных радиусов в однородном пространстве компьютерной томографии:
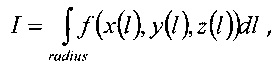
где I - эквивалентный путь, который будет вычислен, a f(x(l), у(l), z(l)) - электронная плотность относительно воды.
Обозначим воксельную функцию как f(i, j, k), где воксел - это объемный пиксель, то есть воксели рассматриваются как объем пересечения наборов параллельных плоскостей, смещенных на одинаковое расстояние, с индексами (i, j, k), длина вокселя равна l(i, j, k), а интеграл I может быть дискретизирован согласно формуле:
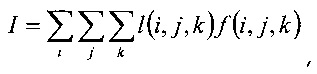
где
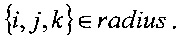
Прямое вычисление согласно этому уравнению требует использования алгоритма, который проходит по всем членам в сумме, число которых соответствует количеству вокселей на равномерной сетке в пространстве компьютерной томографии.
На фиг. 10а пиксели на снимке компьютерной томографии рассматриваются как области, определенные пересечениями ортогональных наборов равномерно распределенных параллельных прямых линий, в частности двух семейств параллельных прямых линий, как показано на фиг. 10b.
Вычисляют пересечения радиуса АВ, который представляет излучение, с равномерно распределенными параллельными прямыми линиями.
Поскольку линии распределены равномерно, необходимо определить только первое пересечение и сгенерировать все другие рекурсивно.
Пересечения радиуса АВ с прямыми линиями представляют собой объединения двух равноотстоящих наборов, один набор - для горизонтальных прямых линий (сплошная линия) и один - для вертикальных (штриховых) прямых линий.
Обратимся, например, к фиг. 10а. Пересечения между радиусом АВ и прямыми линиями включают две группы: первая группа - пересечения с горизонтальными прямыми линиями (треугольники), а вторая группа - пересечения с вертикальными прямыми линиями (круги).
Пересечения радиуса АВ с пикселями идентифицируют путем объединения этих двух групп пересечений.
Идентификация этого набора объединений используется для определения радиологического пути.
Из этой идентификации следует возможность получения регулярного расположения в трехмерном пространстве компьютерной томографии.
Радиус из точки А в точку В может быть представлен согласно известным формулам:

где XA, YA, ZA - координаты точки А, ХВ, YB, ZB - координаты точки В, а Х(α), Y(α), Ζ(α) - координаты точки ткани вдоль пути от А до В.
Параметр α, который определяет часть пути от А до В, равен нулю в точке А и равен единице в точке В.
Пересечения радиуса АВ со сторонами регулярного расположения вокселей в пространстве компьютерной томографии показано на фиг. 10.
На фиг. 11а, если точка А и точка В попадают за пределы регулярного расположения в пространстве компьютерной томографии, то значения параметра, соответствующие точкам пересечения радиуса и границ, задаются как αmin и αmax.
Все пересечения радиуса АВ с одиночными линиями должны иметь значения параметра, которые попадают в диапазон между αmin и αmax.
На фиг. 10b точка А находится в пределах регулярного расположения в пространстве компьютерной томографии и значение αmin равно нулю.
На фиг. 10с, если точка В находится в пределах регулярного расположения, то αmax равно единице.
На фиг. 10d в случае, когда обе точки А и В находятся в пределах регулярного расположения в пространстве компьютерной томографии, αmin равно нулю и αmax равно единице.
Решение для пересечения радиуса с вокселями компьютерной томографии получают сразу, поскольку оно соответствует параметрическим значениям пересечений в диапазоне между αmin и αmax радиуса с каждым ортогональным набором параллельных и равноотстоящих плоскостей.
Для каждой из координатных плоскостей получают набор значений параметра α, и три набора параметрических значений четко объединяют в единый набор: например, комбинируя упорядоченный набор (1, 4, 7); (2, 5, 8), и (3, 6, 9), можно получить полный набор (1, 2, 3, 4, 5, 6, 7, 8, 9). Длина луча, содержащегося в конкретном вокселе, в единицах длины радиуса дается как разность между двумя соседними параметрическими значениями для полного набора.
Для каждой длины пересечения вокселя получают индексы соответствующего вокселя и суммируют произведения длины на плотность по всем пересечениям с получением радиологического пути. Более подробное описание алгоритма дано ниже.
Для регулярного расположения вокселя в пространстве компьютерной томографии (Nx-1, Ny-1, Nz-1) набор ортогональных равноотстоящих параллельных плоскостей может быть описан с использованием следующих известных формул:
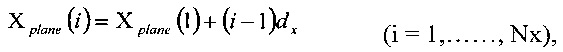
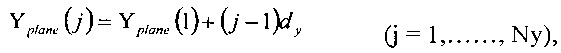
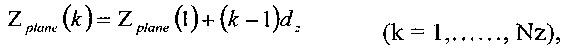
где dx, dy и dz - расстояния между плоскостями х, у, z соответственно.
Значения dx, dy и dz также соответствуют длинам сторон вокселя.
Параметрические значения αmin и αmax получены пересечением радиуса АВ и сторон регулярного расположения в пространстве компьютерной томографии.
Из вышеуказанных уравнений параметрические значения, соответствующие сторонам, получаются следующим образом:
если (ХВ-ХА)≠0, то


и аналогичные выражения имеются для αу(1), αу(Ny), αz(1), αz(Nz).
Если знаменатель (ХВ-ХА) уравнения равен нулю, то луч перпендикулярен оси X и соответствующие значения αх не определены.
То же самое относится к αу и αz.
Если значения αх, αу и αz не определены, то в последующем рассмотрении они просто опущены.
С точки зрения параметрических значений, заданных выше, значения αmin и αmax определяются следующими известными формулами:
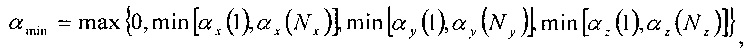
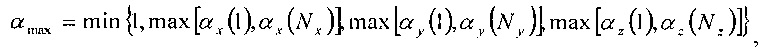
где функции min и mах выбирают из списков соответствующих аргументов минимальное и максимальное значение соответственно.
Если αmax меньше или равно αmin, то радиус не пересекает регулярное расположение в пространстве компьютерной томографии.
Среди всех пересекающихся плоскостей есть только несколько, у которых параметрические значения лежат в диапазоне между αmin и αmax.
Из вышеуказанных уравнений диапазон индексов (imin, imax), (jmin, jmax) и (kmin, kmax), соответствующий этим конкретным плоскостям, дается следующими выражениями:
для (ХВ-ХА)>0


для (ХВ-ХА)<0
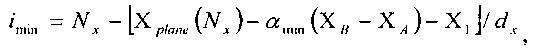

и аналогичными выражениями для jmin, jmax, kmin, и kmax.
Для данного диапазона индексов (imin, imax), (jmin, jmax) и (kmin, kmax), наборы параметрических значений

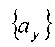

для (ХВ-ХА)>0

для (ХВ-ХА)<0

где

и аналогичные значения для


Каждый из наборов

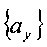

Каждый член в каждом наборе соответствует пересечению радиуса с конкретной плоскостью. Пересечения радиуса с вокселями получают, группируя наборы
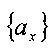


Чтобы включить сюда случай, в котором одна или обе крайние точки радиуса находятся в пределах регулярного пространства в пространстве компьютерной томографии, параметрические значения αmin и αmax добавляют к уникальному параметрическому набору.
Члены αmin и αmax и сгруппированные наборы
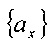



где последний член имеет индекс n, который равен:
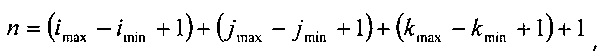
два соседних члена в наборе {α} относятся к пересечениям радиуса с конкретным вокселем.
Для двух пересечений m и m-1, длина l(m) вокселя дается известным выражением:
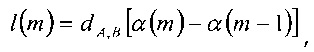
(m=1, …, n)
в котором значение dA,В соответствует расстоянию точки А от точки В,
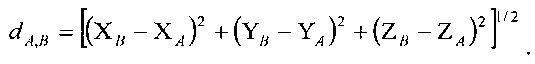
Воксель [i(m), j(m), k(m)], который соответствует пересечениям m и m-1, является тем, который содержит среднюю точку этих двух пересечений.
Индексы [i(m), j(m), k(m)] получены с использованием следующих известных выражений:

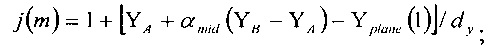

где αmid дается выражением:

Интеграл
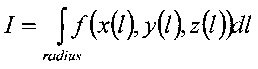

где n дается выражением:
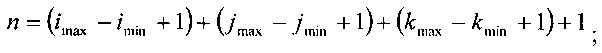
l(m) дается выражением

а индексы

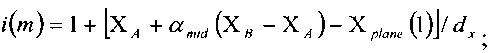


Алгоритм может быть смоделирован по блок-схеме на фиг. 11.
Для типичной задачи относительное количество времени, необходимое для компьютерной обработки каждого шага алгоритма, дается в соответствующих процентах справа от каждого блока, соответствующего рассматриваемому шагу.
Этот алгоритм, применяемый к матрице данных электронных плотностей, полученной из анализа одного или более количества изображений пациента, извлекает в каждой точке эквивалентный радиологический путь в воде и использует его для выборки входных значений для матрицы интенсивности луча электронов.
Затем результат этой операции выборки накладывается «воксел на воксел» на радиологическое изображение пациента, которое представляет собой изучаемое воздействие.
Изображения, полезные для определения моделируемой дозы, получены в фазе изучения/планирование обработки с использованием дохирургического морфологического изображения, при этом во время хирургической операции предыдущее изображение соответственно деформируют и/или записывают совместно с изображением, захваченным во время хирургической операции перед интраоперационной лучевой терапией.
Вычисление также может выполняться непосредственно на трехмерном изображении, полученном в операционной.
Более точное вычисление дозы получают с использованием аналитической формулы, в которой данные Монте-Карло параметризированы, а параметры получены статистическими способами из распространения дозы, полученного моделированием Монте-Карло, или, альтернативно, из данных эксперимента.
С использованием этой параметризации, данные, вычисленные методом Монте-Карло или измеренные, выражают в интегральном аналитическом представлении, применяя аналитическую подгоночную формулу к данным эксперимента или к данным полученным методом Монте-Карло.
Распространение очаговой дозы вдоль центральной оси луча выражается известной формулой:
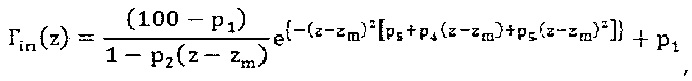
где zm глубина максимума распространения, a p1,…, ps являются подгоночными параметрами.
Кроме того распространение очаговой дозы во внешнюю область к аппликатору дается исходным выражением:
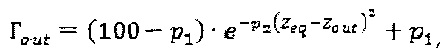
где р1, р2 и zout - подгоночные параметры.
Профиль дозы на остронаправленном луче представлен гауссианом, в котором дисперсия меняется в зависимости от глубины в воде и раскладывается на два компонента

Аналитическое выражение геометрического компонента имеет следующий вид
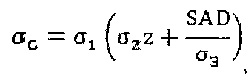

где σ1, …, σ5 - параметры, полученные подгонкой к данным эксперимента или к данным, полученным методом Монте-Карло.
Последнее выражение представляет собой существенную часть изобретения для вычисления дозы.
Из экспериментальных или генерируемых методом Монте-Карло распространений, когда они собраны в виде просмотровых таблиц или трехмерных матриц g(i, j, l), производят повторные выборки для учета неоднородностей, с которыми взаимодействуют электроны на своем пути, согласно схеме, описанной ниже.
Обозначив как
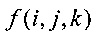
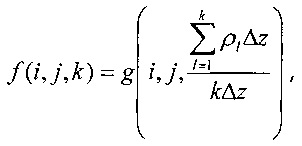
где g(i, j, l) - исходная матрица данных, ρl - электронная плотность относительно воды, Δz - размер вокселя вдоль оси луча, а i и j обозначают стартовую точку пути излучения в указанной зоне (Z).
Информацию о плотности, полученную из изображений перед хирургической операцией пациента, используют для модификации параметров аналитического представления для более достоверного описания влияния на распространение интенсивности луча электронов различных плотностей среды, через которую проходит луч.
Дозиметрическую верификацию в режиме онлайн проводят, размещая дозиметр F в одном или нескольких местах, представляющих интерес, в пределах хирургического разреза, который будет подвергаться обработке.
Активный дозиметр F (такой как полевой транзистор с изолированным затвором (MOSFET), диод или алмазный детектор) изготавливают видимым системой интраоперационного формирования изображения (например посредством рентгеноконтрастного или гипоэхоического репера и т.п.) и считанное значение используют для сравнения с планируемыми данными.
Преимущество настоящего изобретения заключается в возможности вычисления интенсивности луча электронов, который можно направить в обрабатываемую зону для уничтожения остаточных раковых клеток, с учетом вариации морфологии обрабатываемой зоны в результате хирургической операции и излучения, уже полученного облучаемой зоной.
Дополнительное преимущество настоящего изобретения заключается в возможности учета при вычислении дозы модификаторов луча с учетом поглощения излучения в нем самом.
Настоящее изобретение описано для иллюстрации, а не ограничения, согласно предпочтительным вариантам его выполнения, но следует понимать, что специалисты могут внести изменения и/или модификации без отхода от объема изобретения, определенного формулой изобретения.
Реферат
Изобретение относится к медицинской технике а именно к системам для лучевой терапии. Система содержит: ускоритель свободных электронов, оборудованный аппликатором, устройство захвата изображений, встроенный блок управления, содержащий дисплей для формирования двумерных или трехмерных изображений и компьютер, и активный датчик дозы облучения, который может быть установлен между дистальным концом аппликатора и указанной зоной (Z). Компьютер снабжен программой для вычисления интенсивности луча электронов, которая содержит следующие шаги: (i) установку первой интенсивности луча электронов согласно функционированию и геометрическим характеристическим параметрам ускорителя электронов и/или вычисленной методом Монте-Карло, а также согласно по меньшей мере одному заранее заданному изображению зоны (Z), при этом интенсивность создают посредством ускорителя электронов при первом облучении; (ii) работу ускорителя электронов для испускания первого луча электронов при первом облучении, соответствующего части первой интенсивности, установленной на шаге (i); (iii) обнаружение реальной интенсивности первого луча электронов во время первого облучения посредством датчика облучения, размещенного в соответствии с зоной (Z); (iv) захват по меньшей мере одного изображения зоны посредством устройства захвата изображений; (v) вычисление промежуточной интенсивности луча электронов согласно по меньшей мере одному изображению, захваченному на шаге (iv), и согласно реальной интенсивности первого луча электронов, обнаруженной на шаге (iii); (vi) сравнение первой интенсивности, установленной на шаге (i), с промежуточной интенсивностью, вычисленной на шаге (v), для вычисления окончательной интенсивности луча электронов, посредством которой зона (Z) может быть облучена при втором облучении после первого облучения. Вычисление окончательной интенсивности на шаге (vi) выполняют согласно следующему уравнению:,где- матрица, которая представляет окончательную интенсивность, вычисленную на шаге (vi), которая может быть создана при втором облучении, индекс k представляет глубину среды, через которую проходит луч электронов, g(i, j, l) - исходная матрица данных, относящихся к первой интенсивности, установленной на шаге (i), ρ- электронная плотность относительно воды, Δ- размер вокселя по меньшей мере одного изображения, захваченного на шаге (iv), вдоль оси луча электронов, a i и j представляют исходную точку пути облучения на зоне (Z). Изобретение позволяет полностью экранировать или временно исключить из обрабатываемой зоны здоровую ткань. 4 з.п. ф-лы, 11 ил.
Формула
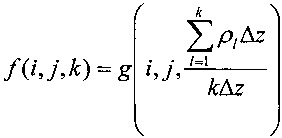
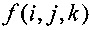


Комментарии