Способ лечения злокачественных опухолей - RU2196623C2
Код документа: RU2196623C2
Чертежи

Описание
Изобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении онкологических заболеваний путем облучения зоны злокачественной опухоли лазерным излучением.
Известен способ фотодинамической терапии опухоли, при котором вводят в область злокачественной опухоли фотосенсибилизатор и перед лазерным облучением этой области дополнительно проводят низкоинтенсивное лазерное воздействие, контролируя при этом интенсивность спектров флюоресценции по коэффициенту отражения в центре и на границе патологического очага (патент РФ 2119363 "Способ фотодинамической терапии опухоли", МПК 6 А 61 N 5/06, опубл. Б.И. 27 от 27.09.98 г.).
Наиболее близким является способ лечения злокачественных опухолей, включающий нагрев зоны злокачественной опухоли, введение в нее фотосенсибилизатора и проведение сеансов фотодинамической терапии и термотерапии (патент США 5814088, НКИ 604/21, опубл. 29.09.1998 г.).
Известно устройство для подачи тепла к месту лечения опухоли, включающее блок питания, источник излучения, зонд со средствами для излучения света, тепла и измерения температуры (патент США 5814088, НКИ 604/21, опубл. 29.09.1998 г.).
Наиболее близким является устройство для лазерной терапии, содержащее последовательно соединенные блок питания, микропроцессорный блок управления, оптический блок с полупроводниковыми лазерными диодами, излучающими в видимой и ИК-областях спектра, волоконно-оптический преобразователь и сменный волоконно-оптический инструмент (патент РФ 2122873, МКП 6 А 61 N 5/06, опубл. 10.12.98, бюлл. 34).
Недостатками известных способов и устройств являются использование лазерного излучения постоянной мощности, узкий диапазон применения различных классов фотосенсибилизаторов, невозможность широкого варьирования режимами работы при проведении фотодинамической терапии и термотерапии, а также их последовательностью, что в целом влияет на эффективность и продолжительность проводимого лечения.
Задачей, на решение которой направлено предлагаемое изобретение, является повышение эффективности лечения злокачественных новообразований и сокращение времени его проведения.
Поставленная задача решается тем, что
в способе лечения злокачественных опухолей,
включающем нагрев зоны злокачественной опухоли, введение в нее фотосенсибилизатора и проведение сеансов фотодинамической терапии и термотерапии, до
введения фотосенсибилизатора или во время его
введения в зону злокачественной опухоли проводят сеанс лазериндукцированной термотерапии, при котором зону злокачественной опухоли прогревают до
температуры 40o-45oС в течение
заданного времени модулированным по заданному закону лазерным излучением со спектром излучения в ближней ИК-области оптического диапазона,
отличного от спектра поглощения фотосенсибилизатора, далее
через заданный интервал времени проводят сочетанные сеансы фотодинамической терапии и лазериндукцированной термотерапии, используя
модулированное по заданному закону лазерное излучение, прячем время и
температуру нагрева биоткани при проведении сеансов контролируют и поддерживают автоматически, при этом лечение повторяют с
интервалом 4-5 дней как минимум два раза, а лазерное излучение формируют по
закону, выраженному формулой
Pmid=Рmах•Q,
где Pmid - средняя мощность;
Рmах
- максимальная мощность;
Q - относительная длительность импульсов,
амплитудно-модулируемая в пределах 0≤Q≤1 на заданном такте управления.
При этом сеанс лазериндукцированной термотерапии проводят как минимум за 30 минут до введения фотосенсибилизатора в зону злокачественной опухоли, или непосредственно перед введением фотосенсибилизатора, или во время введения фотосенсибилизатора, зону злокачественной опухоли нагревают в течение как минимум 30 минут, при этом для нагрева используют модулированное по заданному закону лазерное излучение со спектром в ближней ИК-области оптического диапазона с длиной волны 800÷1064 нм.
Сочетанные сеансы фотодинамической терапии и лазериндуцированной термотерапии проводят через как минимум 6 часов после введения фотосенсибилизатора в область злокачественной опухоли одновременно, либо непрерывно последовательно, либо последовательно с интервалом времени как минимум 24 часа. Причем в качестве фотосенсибилизатора используют химические соединения, имеющие спектр поглощения с максимумами в диапазоне волн 630÷800 нм.
Поставленная задача решается также тем, что устройство для лечения злокачественных опухолей, содержащее блок питания, микропроцессорный блок управления, генератор лазерного излучения на полупроводниковых лазерных диодах, один канал которого генерирует лазерное излучение в видимом диапазоне со спектрами, совпадающими со спектрами поглощения фотосенсибилизаторов, другой - в ближней ИК-области оптического диапазона, волоконно-оптический преобразователь, волоконно-оптический световод, дополнительно снабжено генератором тактовых импульсов, управляемым микропроцессорным блоком, выход которого связан с входами обоих каналов генератора лазерного излучения, а также дополнительно снабжено температурным сенсором, который связан с одним из входов компаратора микропроцессорного блока управления, при этом другой вход компаратора связан с узлом ввода данных. При этом генератор тактовых импульсов выполнен с возможностью отдельного или совместного функционирования каждого из его каналов по заданному в каждом из них закону в режиме широтно-импульсной модуляции. Волоконно-оптический преобразователь дополнительно снабжен как минимум одним оптическим разъемом. Температурный сенсор выполнен в виде контактного или бесконтактного измерителя температуры или их совокупности. Для обеспечения безопасности проведения лечебной процедуры устройство дополнительно снабжено измерителем мощности лазерного излучения и/или измерителем плотности мощности лазерного излучения, а также приспособлением для калибровки температурного сенсора и измерителя мощности и плотности мощности лазерного излучения. Волоконно-оптический световод на дистальном конце дополнительно снабжен сменным диффузором.
Изобретение поясняется чертежами:
фиг.1 - внешний вид устройства, реализующего предложенный способ;
фиг.2 - блок-схема устройства;
фиг.3 - типовая циклограмма
включения лазерных диодов.
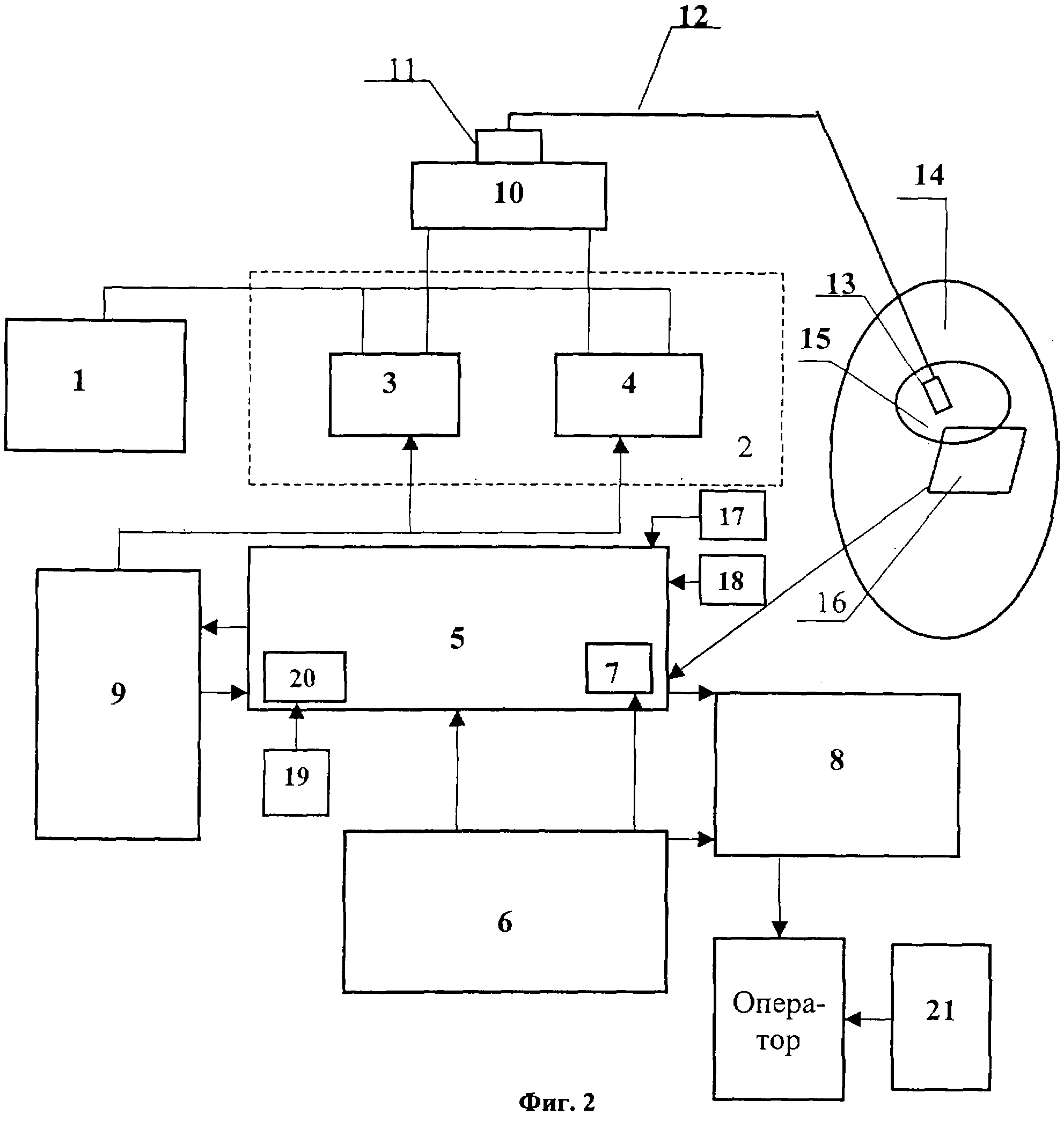
Устройство для лечения злокачественных опухолей содержит блок питания 1, связанный с ним генератор лазерного излучения 2, один канал 3 которого генерирует лазерное излучение в видимом диапазоне, а другой канал 4 - в ближней ИК-области оптического диапазона, микропроцессорный блок управления 5 и связанные с ним узел ввода данных 6, соединенный с входом компаратора 7 микропроцессорного блока управления 5, и устройство индикации 8. Устройство дополнительно снабжено генератором тактовых импульсов 9, управляемым микропроцессорным блоком 5. Выход генератора тактовых импульсов 9 связан с входами каналов 3 и 4 генератора лазерного излучения 2. При этом генератор тактовых импульсов 9 выполнен с возможностью отдельного или совместного функционирования каждого из его каналов по заданному в каждом из них закону в режиме широтно-импульсной модуляции, которая обеспечивается программно-аппаратными средствами устройства. Генерируемое каналами 3 и 4 излучение с помощью волоконно-оптического преобразователя 10, снабженного как минимум одним оптическим разъемом 11, сводится воедино для ввода на вход волоконно-оптического световода 12. Волоконно-оптический световод 12, например кварцевый, имеет диаметр 400÷600 мкм и снабжен сменным диффузором 13. Волоконно-оптический световод 12 со сменным диффузором 13 на дистальном конце обеспечивает подведение излучения в область пораженного участка 14 биоткани к раковой опухоли 15. Волоконно-оптический световод 12 выполнен с возможностью осуществления, в зависимости от локализации опухоли 15, кожного, внутритканевого и внутриполостного нагрева и облучения пораженного участка 14, а наличие соответствующего диффузора 13 на его дистальном конце позволяет проводить облучение пораженного участка наиболее эффективно. Для контроля и поддержания температуры и времени нагрева биоткани устройство снабжено температурным сенсором 16, который связан с одним из входов компаратора 7 микропроцессорного блока управления 5. Температурный сенсор 16 выполнен в виде контактного, или бесконтактного измерителя температуры, или их совокупности. При этом в качестве контактных и бесконтактных измерителей температуры могут быть использованы различные типы датчиков. Например, в качестве контактных - датчики в виде термопары, p-n перехода; бесконтактных - пироэлектрический датчик. Устройство дополнительно снабжено измерителем 17 мощности лазерного излучения и измерителем 18 плотности мощности лазерного излучения. При этом устройство может быть укомплектовано либо измерителем 17 мощности лазерного излучения, либо измерителем 18 плотности мощности лазерного излучения, либо и тем и другим одновременно. Наличие в устройстве измерителей мощности и плотности мощности лазерного излучения позволяет гарантировать при проведении терапевтической процедуры требуемую мощность на выходе диффузора, у которого в процессе эксплуатации деградируют исходные оптические характеристики. И в целом, обеспечивая гарантированную воспроизводимость параметров терапевтических процедур, они значительно повышают безопасность оператора и пациента. Устройство содержит также приспособление 19 для калибровки температурного сенсора и измерителей мощности и плотности мощности лазерного излучения, подключенным к каналу последовательного кода 20 (RS-232) микропроцессорного блока управления 5. Для контроля показаний температурного сенсора устройство снабжено дополнительно автономным узлом контроля температуры 21, который предназначен для контроля температурного сенсора и включает в себя эталонные измерители температуры, например, ртутный или спиртовой.
Устройство работает следующим образом. Блок питания устройства включают. В диалоговом режиме средствами клавиатуры узла ввода данных и устройства индикации устанавливают выбранные параметры излучения: режим работы (сеансы ФДТ, ЛИТТ, ФДТ+ЛИТТ), уровень мощности по каждому каналу, температуру нагрева, циклограмму сеанса (заданием временных констант). Подводят волоконно-оптический световод с диффузором на дистальном конце к области злокачественной опухоли, подают команду "пуск" и проводят лечебный сеанс, автоматически контролируя время и температуру нагрева с помощью температурного сенсора, включенного в систему автоматического управления режимом работы генератора лазерного излучения. При проведении лечебного сеанса оператор имеет возможность контролировать весь процесс с помощью устройства индикации, на котором отображаются такие основные данные, как: заданный уровень мощности по каждому каналу; заданная температура; фактическая температура; временные параметры циклограммы; признаки, характеризующие работу на участках переходного режима (разогрев) и термостабилизации; время, оставшееся до завершения процедуры, и ряд других.
Способ для лечения злокачественных опухолей осуществляется следующим образом.
Область злокачественной опухоли прогревают до температура 40o÷45oС, при этом нагрев осуществляют модулированным по заданному закону лазерным излучением, которое подводят к пораженному участку через волоконно-оптический световод 12, подключенный к генератору лазерного излучения 2. Излучение имеет спектр в ближней ИК-области оптического диапазона с длиной волны 800÷1064 нм, отличного от спектра поглощения фотосенсибилизатора. При этом в зависимости от класса и способа введения фотосенсибилизатора сеанс лазериндуцированной термотерапии проводят либо как минимум за 30 минут до введения фотосенсибилизатора в область пораженного участка, либо непосредственно перед его введением, или во время его введения. Фотосенсибилизатор может быть введен внутривенно, через рот, в виде аппликации, инстиляции в полые органы или интратуморальной инъекции. В качестве фотосенсибилизаторов используют химические соединения, имеющие спектр поглощения с максимумами в диапазоне волн 630-800 нм, например: порфирины (HpD, Фотофрин-II, Фотосан-III, Фотоген, Аласенс-PPIX), фтало- и нафталоцианины (Фотосен), хлорины (Фоскан), бензопорфирины, бактериохлорины (Латрин, Антрин). Сеанс лазериндуцированной терапии проводят в течение 30÷60 минут, при этом наиболее целесообразно использовать лазерное излучение с длинами волн 810, 820, 850, 940, 980, 1064 нм.
Далее через заданный интервал времени, который составляет 6÷72 часа, после введения в пораженный злокачественной опухолью участок биоткани фотосенсибилизатора проводят сочетанные сеансы фотодинамической и лазериндуцированной терапии. При этом для нагрева используют модулированное по заданному закону лазерное излучение.
Экспериментальным путем было установлено, что при
лечении онкологических заболеваний наиболее эффективно фракционированное
излучение, среднюю плотность которого можно менять (модулировать) во времени в зависимости от величины опухоли, класса и
способа введения фотосенсибилизатора. Закон модуляции может быть выражен
следующей формулой
Pmid=Pmах•Q
где Pmid - средняя мощность;
Рmах - максимальная мощность;
Q - относительная
длительность импульсов, амплитудно-модулируемая в пределах 0≤Q≤1 на заданном такте управления.
Относительная длительность импульсов определяется формулой
Q =
τи/τ, где
τи - длительность импульса;
τ - период повторения
импульсов.
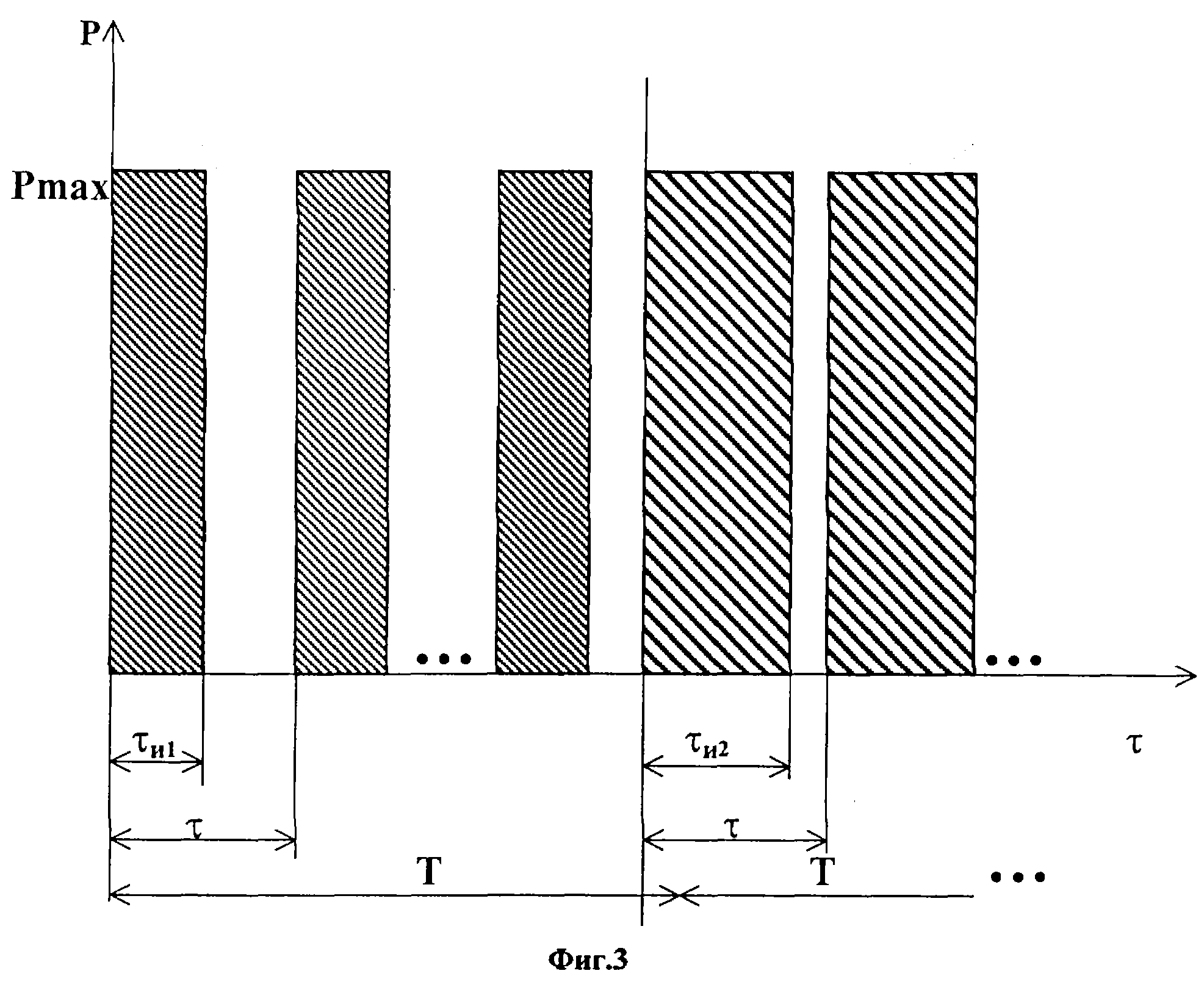
Модуляция длительности импульса производится с заданным тактом управления Т или периодом, на котором длительность импульсов τи не меняется, т.е. относительная длительность импульсов Q остается постоянной.
На
фиг.3 приведена типовая циклограмма включения лазерных диодов, поясняющая закон модуляции интенсивности светоизлучения,
где
Р - мощность;
τ - текущее время;
τи1,τи2 - длительности импульсов на тактах управления Т;
Рmах
- максимальная мощность, соответствующая непрерывному включению лазерных диодов, которой
соответствует Q = 1(τи = τ).
Типовой лечебный сеанс может быть реализован,
например, следующей циклограммой включения лазерных диодов:
- минимальная
длительность импульсов τиmin = 0,5 мс;
- период повторения импульсов τ
=50 мс (величина постоянная на всем участке управления);
- такт управления
Т=1 с;
- дискретность изменения уровня мощности
τиmin/τ = 0,01;
т.е. составляет 1%.
Таким образом, уровень мощности меняется от 0
до Рmах с дискретностью 1%, а частота включения лазерных диодов определяется отношением
f =
1/τ и равна 20 Гц.
Сочетанные сеансы фотодинамической терапии и лазериндуцированной термотерапии проводят одновременно, либо непрерывно последовательно, либо последовательно с интервалом времени как минимум 24 часа.
Время и температуру нагрева биоткани при проведении сеансов постоянно контролируют и поддерживают автоматически путем включения температурного сенсора в систему микропроцессорного блока управления режимом работы генератора лазерного излучения.
Сочетанные сеансы фотодинамической и лазериндуцированной терапии повторяют от 2 до 5 раз с интервалом 4-5 дней в зависимости от класса выбранного фотосенсибилизатора, скорости его выведения из опухоли, остаточного количества фотосенсибилизатора по сравнению с первоначально введенным и эффективностью первого сеанса лечения.
Лечение проводят до выраженной регрессии опухоли, которая может, например, состоять в уменьшении злокачественного новообразования до 50% от его первоначального размера.
Так, например, сочетанные сеансы фотодинамической терапии и лазериндуцированной термотерапии злокачественных опухолей с узловой формой роста (>1 см) или площадью поражения более 6 см2 проводят с интервалом 4÷5 дней и повторяют 3 или 4 раза.
Предложенные способ и устройство для лечения злокачественных опухолей позволяют осуществлять внутритканевый, дистанционный и внутриполостной (эндоскопический) нагрев и облучение пораженного участка. При этом предварительный сеанс лазериндуцированной термотерапии с использованием модулированного лазерного излучения позволяет повысить концентрацию и селективность накопления фотосенсибилизатора в области злокачественной опухоли, а проведение последующих сеансов лазериндуцированной термотерапии в сочетании с фотодинамической терапией усиливает противоопухолевый эффект последней и позволяет повреждать опухоль на большую глубину и в большем объеме. Предложенные способ и устройство дают также возможность изменять последовательность выполнения сеансов фотодинамической терапии и лазериндуцированной термотерапии, менять при этом и закон модулирования лазерного излучения, что позволяет расширить диапазон применяемых при лечении различных классов фотосенсибилизаторов. В целом все это значительно повышает эффективность проводимого лечения злокачественных опухолей и сокращает время лечения.
Клиническая апробация.
Клиническая апробация способа лечения злокачественных опухолей и устройства для его осуществления проводилась в отделении эндоскопических и физических методов диагностики и лечения опухолей Московского научно-исследовательского онкологического института им. П.А. Герцена.
Больной Р. , 74 года, поступил в клинику с диагнозом рецидив базальноклеточного рака кожи правой ушной раковины после криодеструкции. На коже правой ушной раковины в области мочки с переходом на кожу наружного слухового прохода при осмотре определяется опухоль размерами 1,0•1,5 см с экзофитным компонентом до 0,3 см. По данным УЗИ на фоне рубцовых изменений визуализируется опухолевидное образование размерами 1, 0•1,6 см, поражающее все слои дермы до хряща.
За 24 часа до начала лечения больному введено внутривенно капельно препарата "Фотосенс" в дозе 0,5 мг/кг веса тела. С помощью заявляемого устройства для лазерной терапии проведен сеанс сочетанной фотодинамической терапии (ФДТ) и лазеридуцированной термотерапии (ЛИТТ) опухоли правой ушной раковины. Мощность лазера в режиме ФДТ (670 нМ) составила 300 мВт, диметр облучаемого поля 2,0 см. Лазер в режиме ЛИТТ использовался мощностью 1800 мВт, диаметр поля составил 2,0 см. Во время лечения проводился постоянный мониторинг температуры кожи в зоне светового воздействия с использованием дистанционного пирометрического датчика, установленного параллельно гибкому терапевтическому световоду. Температура кожи оставалась постоянной на уровне 42oС. Общее время воздействия 30 минут, общая энергия составила 3240 Дж.
В процессе лечения в зоне воздействия появился выраженный отек, гиперемия, больной отмечал "покалывание". При контрольном осмотре через 24 часа сохраняется отечность правой ушной раковины, в зоне опухоли плотная корка.
В настоящее время на коже правой ушной раковины белесоватый рубец. По данным морфологического и УЗИ исследования элементов опухоли не обнаружено.
По сравнению со стандартным способом лечения процесс разрушения опухоли проходил быстрее, что свидетельствует об эффективности данного способа лечения.
Реферат
Изобретение относится к медицине и может быть использовано при лечении онкологических заболеваний. Производят нагрев зоны злокачественной опухоли. Вводят в нее фотосенсибилизатор. Проводят сеанс фотодинамической терапии и термотерапии. При этом до введения фотосенсибилизатора или во время его введения в зоне злокачественной опухоли проводят сеанс лазериндукцированной термотерапии, при котором зону злокачественной опухоли прогревают до температуры 40-45oС, при этом нагрев осуществляют лазерным излучением со спектром излучения в ближней ИК-области оптического диапазона, отличного от спектра поглощения фотосенсибилизатора. Далее проводят сочетанные сеансы фотодинамической терапии и лазериндукцированной термотерапии. Лечение повторяют с интервалом 4-5 дней как минимум два раза. Способ позволяет повысить эффективность лечения злокачественных новообразований и сократить время его проведения. 9 з.п. ф-лы, 3 ил.

Комментарии