Коацерватные гидрогели на основе гиалуроновой кислоты для применения в дермальных филлерах - RU2750684C2
Код документа: RU2750684C2
Чертежи


Описание
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[001] Настоящее описание по существу относится к пригодным для инъекций дермальным филлерам. Дермальные филлеры представляют собой гидрогелевые композиции, содержащие анионный полисахарид и катионный полисахарид. Более конкретно гидрогель содержит ионный комплекс гиалуроновой кислоты с катионным полисахаридом.
[002] Пригодные для инъекций дермальные филлеры представляют собой гели, которые действуют как увеличители объема кожи или заполняющие пространство агенты, которые заполняют пустоты внутри или под кожей для уменьшения появления морщин или других дефектов кожи. Дермальные филлеры могут также использоваться для формирования конкретных параметров мягких тканей, включая параметры лица, или для замены дермальной ткани. Материалы дермального филлера являются биологически инертными и достигают своей цели исключительно за счет механического давления на смежную ткань. Было показано, что дермальные филлеры сохраняются в организме в течение периода до 18 месяцев. Для достижения желаемых результатов при коррекции глубоких морщин или кожных дефектов, а также для формирования конкретных параметров лица желательно, чтобы эти гели имели достаточную подтягивающую способность, хорошую пластичность и/или пригодность для инъекций.
[003] Гиалуроновая кислота (ГК), также известная как гиалуронан, представляет собой несульфатированный гликозаминогликан, который присутствует во многих тканях по всему организму человека, включая соединительную, эпителиальную и нейрональную ткани. ГК распространена в различных слоях кожи, где она выполняет множество функций, таких как обеспечение хорошей гидратации, участие в организации внеклеточного матрикса, действие в качестве материала-наполнителя и участие в механизмах восстановления ткани. Однако количества ГК и других матриксных полимеров, присутствующих в коже, таких как коллаген и эластин, уменьшается с возрастом. Например, постоянное воздействие ультрафиолетового излучения от солнца или из других источников приводит к тому, что в дермальных клетках уменьшается продукция ГК и повышается скорость ее разложения. Такая потеря материалов приводит к различным состояниям кожи, таким как морщины, образование пустот, потеря влаги и другие нежелательные состояния, которые вносят свой вклад в видимые признаки старения.
[004] Пригодные для инъекций дермальные филлеры успешно применяются для борьбы со старением кожи и для уменьшения других кожных дефектов, таких как шрамы или дефекты контура мягких тканей. Филлеры могут замещать утраченные эндогенные матриксные полимеры или улучшать/облегчать функционирование существующих матриксных полимеров, обеспечивая уход за этими состояниями кожи.
[005] Благодаря превосходной биосовместимости ГК считается идеальным кандидатом для применения в дермальных филлерах. ГК состоит из повторяющихся дисахаридных звеньев, несущих свободные карбоксилатные группы; таким образом, ГК при физиологическом pH представляет собой анионный полисахарид.
[006] Чтобы обеспечить возможность использования в качестве эффективного дермального филлера в течение оптимального срока, ГК, как правило, является химически сшитой, поскольку несшитая ГК имеет короткое время существования in vivo. К химическим способам сшивания относятся реакция Майкла, тиол-еновое связывание, свободнорадикальная полимеризация, химические реакции карбодиимидов (например, 1-этил-3-(3-диметиламинопропил) карбодиимид (EDC)) с использованием ди- или полиамина в качестве поперечносшивающего агента и химические реакции эпоксидов с использованием диглицидилового эфира 1,4-бутандиола (BDDE) в качестве поперечносшивающего агента. К другим часто применяемым химическим поперечносшивающим агентам относятся дивинилсульфон (DVS) и 1,2,7,8-диэпоксиоктан (DEO), а также дополнительные агенты, описанные в настоящем документе. Эти химические способы поперечного сшивания позволяют получить ковалентно связанный каркас ГК.
[007] Одним из ограничений традиционных химически сшитых гидрогелей является то, что для них часто необходимы трудоемкие стадии очистки. Другим ограничением химически сшитых ГК-гидрогелей, полученных с применением традиционных процессов поперечного сшивания, является то, что они по существу непригодны для инъекции с момента их сшивания, и их необходимо дополнительно обработать, чтобы сделать их пригодными для инъекций в виде дермальных филлеров. Например, чтобы сделать сшитые гели ГК пригодными для инъекций через тонкую иглу, их обычно регидратируют до желаемой концентрации, а затем дополнительно обрабатывают либо путем размерной оптимизации гидратированного геля с помощью мелкопористого сита, либо с помощью процесса гомогенизации. В качестве дополнительной технологической стадии иногда добавляют несшитую ГК, чтобы повысить смазывающую способность и пригодность геля для инъекций. Одним из недостатков дополнительной обработки сшитого ГК-гидрогеля является то, что гель обычно теряет свои когезивные свойства в ходе этих дополнительных стадий обработки, что особенно касается гидрогеля с высоким модулем накопления (G'). Таким образом, может нарушаться подтягивающая способность и пластичность материалов при уходе за кожей или мягкими тканями, например, материалы могут не подходить для применения при глубоких морщинах и моделировании ткани.
[008] Другим подходом к преодолению ограничений химически сшитых гидрогелей является инъекция ГК с низкой вязкостью, содержащей сшиваемые химически или при помощи ультрафиолета (УФ) функциональные группы, и формирование гидрогеля in situ. Недостатком этого подхода является то, что предшественники являются реакционноспособными, сложными в получении, обработке и хранении и неудобны в использовании для врачей.
[009] Сохраняется потребность в более совершенных дермальных филлерах для улучшения внешнего вида и ухода за мягкими тканями, включая кожу.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0010] В настоящем изобретении предложена содержащая коацерватный гидрогель композиция дермального филлера, которую можно использовать для обработки мягких тканей субъекта, таких как кожа. Коацерватный гидрогель содержит нековалентный комплекс, основанный на зарядовых взаимодействиях между полисахаридами «анионной ГК», дополнительно описанной в настоящем документе, такой как гиалуроновая кислота, и катионным полисахаридом. Комплексы образуются посредством электростатических и/или ионных взаимодействий между анионами и катионами полисахаридов. Более конкретно взаимодействия происходят между ионами анионных полисахаридов ГК и ионами катионных полисахаридов. В некоторых аспектах взаимодействия возникают за счет ионных взаимодействий между карбоксилатными анионами ГК и катионами катионных полисахаридов. Следовательно, связывающие взаимодействия между полисахаридами коацерватных ГК-гидрогелей по изобретению являются более динамичными, чем фиксированные взаимодействия традиционных сшитых ГК-гидрогелей, соединенных ковалентными связями. Например, анионно-катионные взаимодействия настоящих коацерватных ГК-гидрогелей могут быть нарушены, например, при сдвиге или других условиях, и такие же или другие катионно-анионные взаимодействия могут образовываться между теми же или другими парами анион-катион. Таким образом, коацерватные гидрогели являются «самовосстанавливающимися» и их преимуществом является сохранение когезивности и пластичности без необходимости в многочисленных стадиях гомогенизации или размерной оптимизации перед использованием. Таким образом, коацерватные гидрогели на основе ГК по настоящему изобретению обладают многочисленными преимуществами по сравнению с традиционными химически сшитыми дермальными филлерами на основе ГК. Например, многие из гидрогелей по настоящему изобретению могут быть получены в виде дермальных филлеров без необходимости в применении некоторых из трудоемких стадий химического поперечного сшивания и сложной очистки, которая иногда необходима для удаления остатков химических веществ из химически сшитых гелей, без необходимости в дополнительной обработке путем размерной оптимизации и гомогенизации, которые могут нарушать целостность геля и приводить к образованию гелевых частиц, не пригодных для инъекций, а также без добавления несшитой ГК для улучшения смазывающих свойств и пригодности для инъекций.
[0011] В некоторых аспектах коацерватные гидрогели на основе ГК по изобретению обладают достаточными или улучшенными характеристиками, включая достаточную или улучшенную когезивность, пластичность, подтягивающую способность и/или пригодность для инъекций для желаемого применения в качестве дермального филлера, по сравнению с химически сшитыми гидрогелями на основе ГК.
[0012] В одном аспекте изобретения предложен дермальный филлер, по существу содержащий коацерватный ГК-гидрогель. В некоторых аспектах гидрогель содержит анионную ГК и катионный полисахарид. В некоторых аспектах гидрогель содержит ионный комплекс анионной ГК с катионным полисахаридом.
[0013] В некоторых аспектах гидрогель содержит анионный ГК-полисахарид, который представляет собой саму гиалуроновую кислоту (ГК). В других аспектах анионная ГК представляет собой «модифицированную ГК», т.е. ГК, которая была модифицирована введением одной или более анионных групп, отличных от карбоксилата, и причем анионные группы могут быть одинаковыми или разными, как дополнительно определено в настоящем документе. В некоторых аспектах гидрогель содержит анионную ГК, которая является гомоанионной. В других аспектах гидрогель содержит анионную ГК, которая является гетероанионной. В некоторых аспектах гидрогель содержит анионную ГК, выбранную из несшитой анионной ГК, сшитой анионной ГК и их смеси. В некоторых аспектах гидрогель содержит несшитую ГК, сшитую ГК или их смесь.
[0014] В некоторых аспектах коацерватный гидрогель содержит катионный полисахарид. В некоторых аспектах катионный полисахарид модифицирован введением одной или более дополнительных катионных групп и/или других катионных групп по отношению к своей немодифицированной форме. В некоторых аспектах гидрогель содержит немодифицированный или модифицированный катионный полисахарид, являющийся гомокатионным. В других аспектах гидрогель содержит немодифицированный или модифицированный катионный полисахарид, который является гетерокатионным. В некоторых аспектах катионный полисахарид представляет собой хитозан. В других аспектах катионный полисахарид представляет собой триметилхитозан.
[0015] В других аспектах изобретения предложен катионный полисахарид, который представляет собой «катионную ГК», и способы его получения. В дополнительных аспектах изобретения предложен коацерватный гидрогель, содержащий катионную ГК. В других дополнительных аспектах катионная ГК выбрана из несшитой катионной ГК, сшитой катионной ГК и их смеси.
[0016] В другом аспекте предложены композиции дермального филлера, дополнительно содержащие косметические агенты или другие агенты, такие как витамины, антиоксиданты и/или агенты для осветления кожи.
[0017] В другом аспекте коацерватные ГК-гидрогели по изобретению представлены в физиологически приемлемом носителе. В некоторых аспектах физиологически приемлемый носитель представляет собой фосфатно-солевой буфер или несшитую ГК.
[0018] В другом аспекте коацерватные ГК-гидрогели по изобретению имеют хорошие свойства пластичности. В некоторых аспектах коацерватные ГК-гидрогели имеют модуль накопления (G') от приблизительно 50 Па до приблизительно 5000 Па. В других аспектах коацерватные ГК-гидрогели имеют модуль накопления от приблизительно 500 Па до приблизительно 2000 Па, или от приблизительно 500 Па до приблизительно 1500 Па, или от приблизительно 500 Па до приблизительно 1000 Па. В других аспектах модуль накопления коацерватных ГК-гидрогелей составляет приблизительно 500 Па. В других аспектах модуль накопления коацерватных ГК-гидрогелей составляет приблизительно 1450.
[0019] В другом аспекте коацерватные ГК-гидрогели по изобретению пригодны для инъекций через иглу по меньшей мере 18 калибра, более предпочтительно по меньшей мере 27 калибра или иглу еще большего калибра. В некоторых аспектах дермальные филлеры и композиции на основе коацерватных ГК-гидрогелей пригодны для инъекций через иглу, не требуя оптимизации размеров и/или гомогенизации композиции перед инъекцией.
[0020] В другом аспекте в изобретении предложены общие способы получения дермальных филлеров, содержащих коацерватные ГК-гидрогели. В некоторых вариантах осуществления способ включает в себя образование ионного комплекса между анионной ГК и катионным полисахаридом. В некоторых вариантах осуществления способ включает в себя образование ионного комплекса между самой ГК и катионным полисахаридом. В другом аспекте в изобретении предложены способы получения коацерватных ГК-гидрогелей с различными реологическими профилями, которые могут быть образованы на основе значений pKa анионов и/или катионов каждого из анионного ГК-полисахарида и катионного полисахарида соответственно. В некоторых аспектах способ включает в себя получение коацерватного ГК-гидрогеля в физиологически приемлемом носителе. В некоторых аспектах настоящего изобретения предложен коацерватный ГК-гидрогель, имеющий модуль накопления (G’) в диапазоне от приблизительно 50 Па до приблизительно 5000 Па, например от приблизительно 500 Па до приблизительно 2000 Па, от приблизительно 500 Па до приблизительно 1500 Па или от приблизительно 500 Па до приблизительно 1000 Па, или имеет модуль накопления приблизительно 500 Па или приблизительно 1450 Па. В некоторых аспектах способа предложенный дермальный филлер не требует дополнительной стадии обработки, такой как размерная оптимизация и/или гомогенизация, перед инъекцией через иглу, например через тонкую иглу.
[0021] В еще одном аспекте в настоящем изобретении предложены способы обработки мягкой ткани субъекта, такой как кожа. В некоторых аспектах способ обработки включает в себя увеличение объема кожи или мягких тканей, улучшение качества кожи или мягких тканей или уменьшение дефекта кожи или мягких тканей субъекта. В некоторых аспектах способ включает в себя стадии введения (например, инъекции) дермального филлера по изобретению, в мягкую ткань или кожу субъекта. В некоторых аспектах способ включает в себя стадию введения (например, инъекции) дермального филлера в область дермы или в эпидермальную область субъекта. В некоторых аспектах способ включает в себя стадию введения (например, инъекции) дермального филлера в плоский или более глубокий участок мягкой ткани (например, для целей изменения объема или контура) субъекта. В некоторых аспектах обработка включает в себя придание формы, заполнение, придание объема или пластику мягкой ткани или кожи субъекта. В других аспектах обработка включает в себя улучшение гомеостаза кожи, увеличение толщины кожи, заживление раны или уменьшение шрама у субъекта. В некоторых аспектах дефект кожи представляет собой морщину, шрам или утрату дермальной ткани. В некоторых аспектах обработка является эффективной в течение периода, составляющего по меньшей мере приблизительно 3 месяца.
[0022] Эти и другие аспекты и преимущества настоящего изобретения можно лучше понять и оценить при обращении к приведенным ниже чертежам и подробному описанию.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
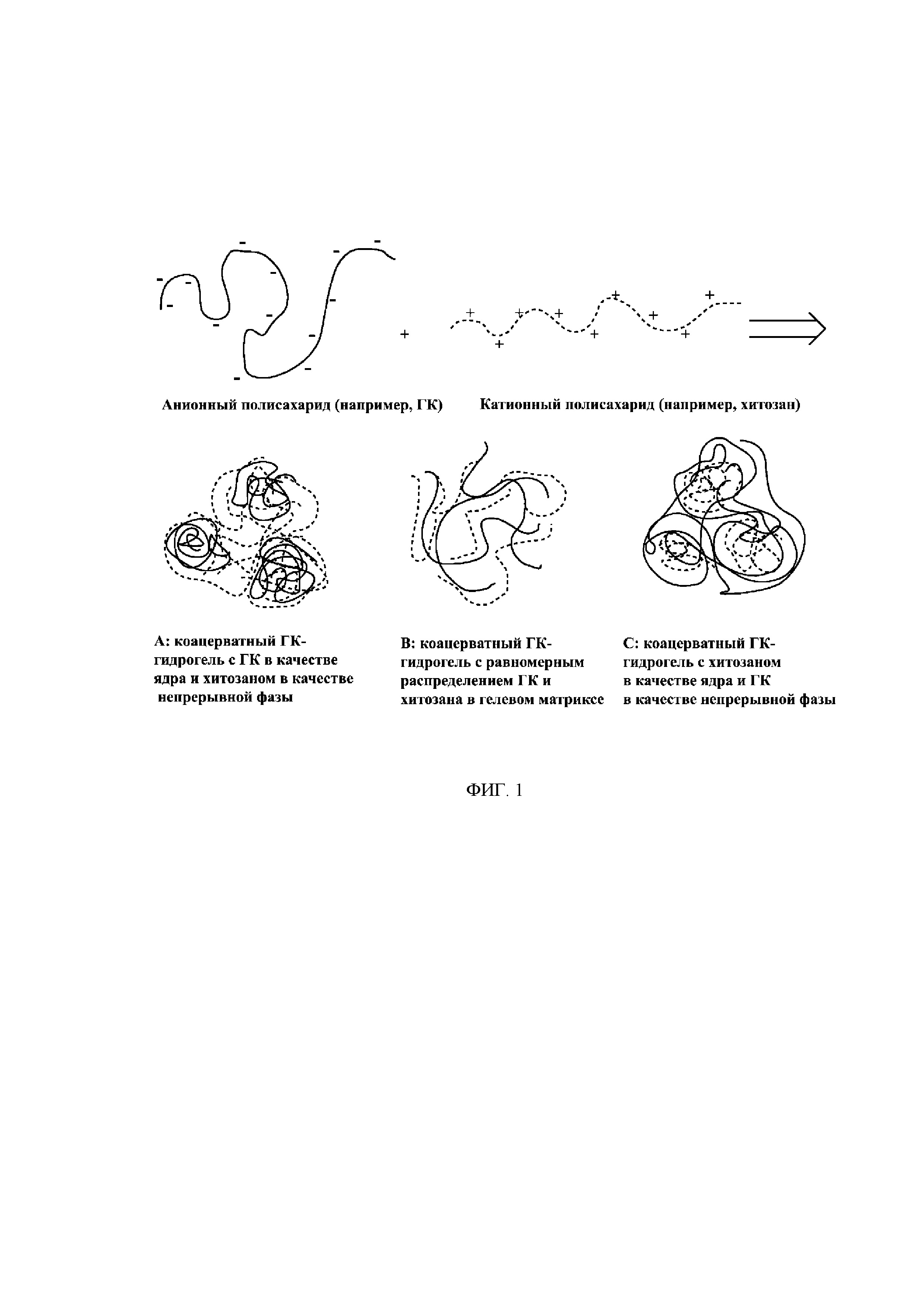
[0023] На Фиг. 1 показана схема коацерватного ГК-гидрогеля, образованного при помощи несшитой ГК и катионного полисахарида, такого как хитозан. A: несшитый анионный полисахарид, такой как ГК, конденсируется, или образует комплекс, или инкапсулируется в сердцевину за счет электростатических взаимодействий с катионными группами катионного полисахарида, такого как хитозан, причем катионный полисахарид служит в качестве непрерывной фазы, инкапсулирующей конденсированную или заключенную в комплекс анионную ГК. Ферментативное разложение анионной ГК ингибируется, поскольку она захватывается в катионную полисахаридную матрицу; например, снижение доступности для гиалуронидазы защищает ГК от разложения гиалуронидазой. B: соотношение зарядов между анионной ГК и катионным полисахаридом (например, хитозаном) близко к зарядному равновесию; ГК и хитозан образуют полиионный комплекс и равномерно распределены по гелевому матриксу. C: катионный полисахарид (например, хитозан) конденсируется, или образует комплекс, или инкапсулируется в сердцевину за счет электростатических взаимодействий с анионными группами анионной ГК, в то время как анионная ГК служит в качестве непрерывной фазы, инкапсулирующей конденсированный или заключенный в комплекс катионный полисахарид (хитозан). На Фиг. 1B и 1C ГК образует комплексы с катионным полисахаридами, уменьшая доступность ГК для гиалуронидазы и защищая ГК от разложения гиалуронидазой.
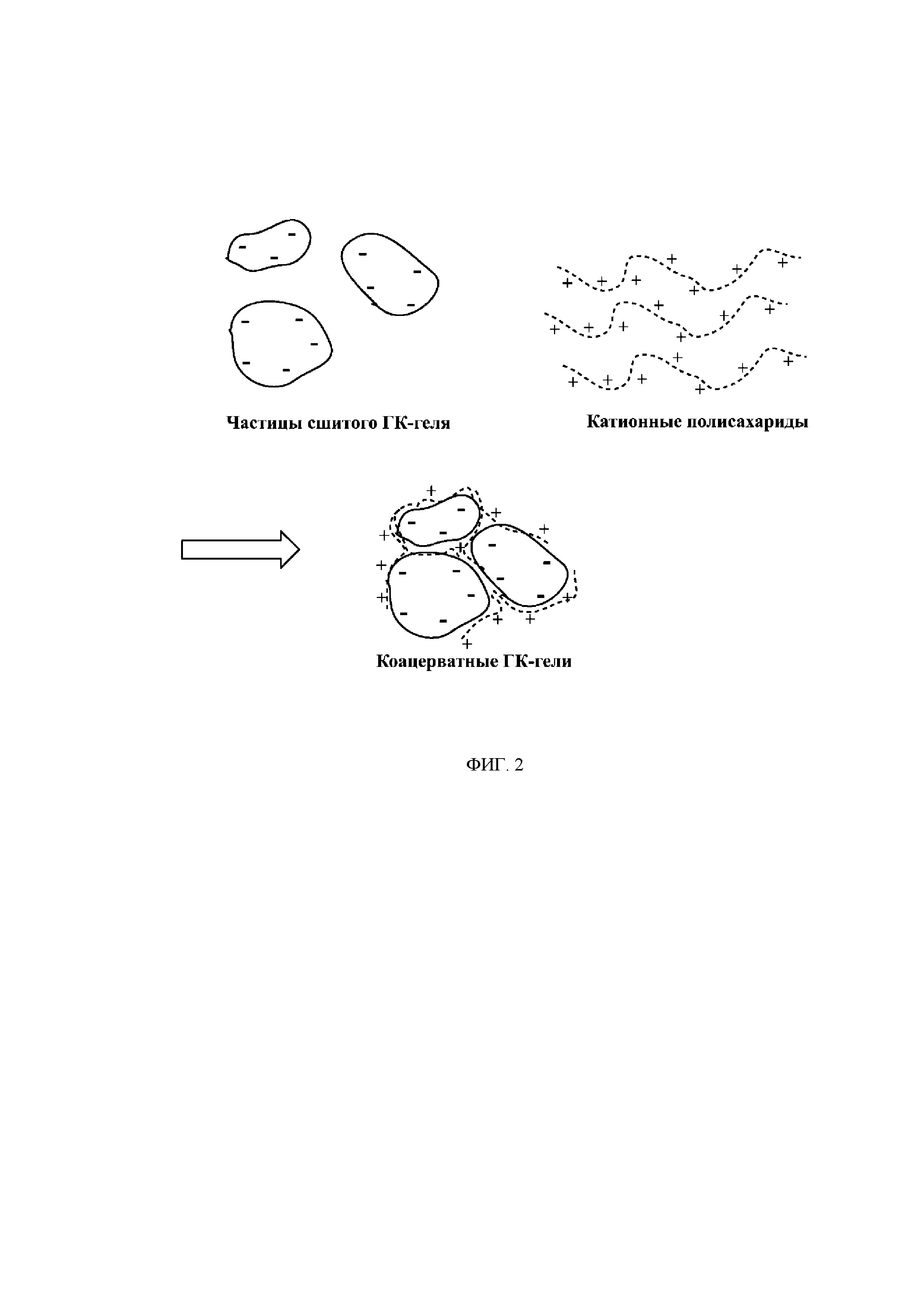
[0024] На Фиг. 2 показана схема коацерватного ГК-гидрогеля, образованного при помощи сшитой ГК и катионного(-ых) полисахарида(-ов). Частицы сшитой ГК заключены в матрикс за счет электростатических взаимодействий с катионными группами катионного полисахарида. Поскольку в данном случае ГК является сшитой, ГК уже обладает определенной устойчивостью к ферментативному разложению, которое может быть дополнительно увеличено за счет встраивания в коацерватный гидрогель. Катионные полисахариды служат для удерживания вместе частиц сшитого ГК-геля. Гель обладает улучшенной когезивностью и пластичностью из-за неспецифического (т.е. динамического или «самовосстанавливающегося») характера ионного связывания.
[0025] На Фиг. 3 показан внешний вид и механические свойства гидрогелей, полученных с использованием сшитой ГК и различных концентраций высокочистого хитозана (HPC); см. пример 4. (A) Гидрогели, полученные в шприцах, обведены пунктирными линиями. По мере увеличения содержания HPC с 0,04 экв. до 0,20 экв. гидрогели становятся более непрозрачными. (B) Модуль накопления (G’) снижался поэтапно по мере увеличения содержания HPC. Модуль накопления представлен для натяжения 1% и частоты 5 Гц.
[0026] На Фиг. 4 показаны результаты испытания на разбухание/диссоциацию геля для гидрогелей из примера 4. Гидрогель (приблизительно 250 мкл) вводили путем инъекции в цилиндрическую форму и центрифугировали для удаления пузырьков. Затем гидрогели переносили в PBS (20 мл) и инкубировали на орбитальном встряхивателе при 37°C и 200 об/мин. В течение первых 24 часов гидрогели достигали равновесного набухания, а затем сохраняли целостность без дальнейшей диссоциации или рассеяния в PBS. В то время как гель без добавления хитозана диссоциировался в буфере PBS в течение двух дней (не показано), все составы, содержащие хитозан, оставались стабильными в течение по меньшей мере 29 дней.
ПОДРОБНОЕ ОПИСАНИЕ
[0027] В настоящем изобретении предложен дермальный филлер, содержащий коацерватный ГК-гидрогель. Гидрогель содержит ионный комплекс анионной ГК с катионным полисахаридом. В некоторых вариантах осуществления анионная ГК представляет собой гиалуроновую кислоту, которая может быть сшитой или несшитой.
[0028] Используемый в настоящем документе «гель» относится к нетекучей полимерной сети, которая разбухает по всему своему объему под воздействием текучей среды.
[0029] Используемый в настоящем документе «гидрогель» относится к нетекучей полимерной сети, которая разбухает по всему своему объему под воздействием водной текучей среды.
[0030] Используемый в настоящем документе «коацерватный гидрогель» относится к гидрогелю, в котором нетекучая полимерная сеть содержит ионный комплекс между анионным полисахаридом и катионным полисахаридом, причем каждый из анионного полисахарида и катионного полисахарида независимо является сшитым или несшитым. Ионный комплекс представляет собой нековалентный комплекс; то есть анионный полисахарид и катионный полисахарид не сшиты друг с другом ковалентными связями.
[0031] Коацерватный гидрогель настоящего изобретения может быть образован путем смешивания водной композиции, содержащей анионный полисахарид, с водной композицией, содержащей катионный полисахарид, с получением таким образом нетекучей полимерной сети, которая расширяется по всему своему объему под воздействием водной текучей среды.
[0032] Используемый в настоящем документе термин «коацерватный ГК-гидрогель» относится к гидрогелю, в котором нетекучая полимерная сеть содержит ионный комплекс анионного ГК-полисахарида с катионным полисахаридом, причем каждый из анионного ГК-полисахарида и катионного полисахарида независимо является сшитым или несшитым. Ионный комплекс представляет собой нековалентный комплекс; то есть анионный ГК-полисахарид и катионный полисахарид не сшиты друг с другом ковалентными связями.
[0033] Коацерватный ГК-гидрогель по изобретению может быть образован путем смешивания водной композиции, содержащей анионный ГК-полисахарид, с водной композицией, содержащей катионный полисахарид, с получением таким образом нетекучей полимерной сети, которая расширяется по всему своему объему под воздействием водной текучей среды. Водная композиция, содержащая анионный ГК-полисахарид, может быть получена из анионного ГК-полисахарида (который может быть сшитым или несшитым) и водной текучей среды, такой как вода, вода с урегулированным уровнем pH (например, кислотная, нейтральная или щелочная вода) или буфер для получения водной композиции, которая может иметь различные формы, включая, без ограничений, раствор, суспензию или гель. Аналогичным образом водная композиция, содержащая катионный полисахарид, может быть получена из катионного полисахарида (который может быть сшитым или несшитым) и водной текучей среды, такой как вода, вода с урегулированным уровнем pH (например, кислотная, нейтральная или щелочная вода) или буфер для получения водной композиции, которая может иметь различные формы, включая, без ограничений, раствор, суспензию или гель.
[0034] Используемый в настоящем документе термин «анионный полисахарид» относится к полисахариду, имеющему полный отрицательный заряд в растворе при физиологическом pH. Следует понимать, что ссылка в настоящем документе на анионный полисахарид не исключает наличия одной или более нейтральных или катионных функциональных групп на анионном полисахариде, то есть анионный полисахарид должен лишь нести общий (полный) отрицательный заряд в растворе при физиологическом pH (или при pH, при котором образуется или используется коацерватный комплекс). В частности анионным полисахаридом называется (a) полисахарид, который не модифицирован и содержит достаточное количество анионных групп, так чтобы общий (полный) заряд полисахарида был отрицательным при физиологическом pH; и (b) полисахарид, который был модифицирован так, чтобы (i) содержать достаточное количество анионных групп, так чтобы после модификации общий (полный) заряд полисахарида был отрицательным при физиологическом pH; (ii) изменить природу одного или более анионов немодифицированного анионного полисахарида при условии, что полный заряд полисахарида останется отрицательным; (iii) изменить (увеличить или уменьшить) количество анионов относительно немодифицированного полисахарида при условии, что полный заряд полисахарида останется отрицательным; и (iv) их комбинации. К не имеющим ограничительного характера примерам анионных полисахаридов относится ГК, которая может быть не модифицирована или может быть модифицирована для включения дополнительных и/или других анионных групп, как описано в настоящем документе. Анионный полисахарид может быть гомоанионным или гетероанионным и может быть сшитым или несшитым.
[0035] Используемый в настоящем документе термин «анионная ГК» включает в себя как «ГК», так и «модифицированную анионную ГК».
[0036] Используемый в настоящем документе термин «ГК» относится к гиалуроновой кислоте (ГК). ГК представляет собой анионный полисахарид, в частности гликозаминогликан. Кроме того, «ГК» относится к гиалуроновой кислоте и любой из ее солей гиалуронатов, включая, без ограничений, гиалуронат натрия, гиалуронат калия, гиалуронат магния, гиалуронат кальция и их комбинации.
[0037] Используемый в настоящем документе термин «модифицированная анионная ГК» относится к ГК, которая была модифицирована с заменой одного или более карбоксилатных анионов одним или более альтернативными анионами, такими как сульфонат и/или фосфонат. Модифицированная анионная ГК может быть гомоанионной или гетероанионной и может быть сшитой или несшитой.
[0038] Используемый в настоящем документе термин «катионный полисахарид» относится к немодифицированному или модифицированному полисахариду, имеющему чистый положительный заряд в растворе при физиологическом pH (или pH, при котором образуется или используется коацерватный комплекс). В частности катионным полисахаридом называется (a) полисахарид, который не модифицирован и содержит достаточное количество катионных групп, чтобы общий (полный) заряд полисахарида был положительным при физиологическом pH; или (b) полисахарид, который был модифицирован так, чтобы (i) содержать достаточное количество катионных групп, так чтобы после модификации общий заряд полисахарида был положительным при физиологическом pH; (ii) изменить природу одного или более катионов немодифицированного катионного полисахарида при условии, что полный заряд полисахарида останется положительным; (iii) изменить (увеличить или уменьшить) количество катионов относительно немодифицированного полисахарида при условии, что полный заряд полисахарида останется положительным; и (iv) их комбинации. Катионный полисахарид может быть гомокатионным или гетерокатионным и может быть сшитым или несшитым. Не имеющие ограничительного характера примеры катионных полисахаридов включают в себя хитозан, триметилхитозан и катионную ГК.
[0039] Используемый в настоящем документе термин «катионная ГК» относится к ГК, которая была модифицирована так, чтобы содержать достаточное количество катионных групп, чтобы общий (полный) заряд полученного полисахарида является положительным при физиологическом pH. Катионная ГК представляет собой катионный полисахарид. Катионная ГК может быть гомокатионной или гетерокатионной и может быть сшитой или несшитой.
[0040] Не имеющие ограничительного характера примеры катионных функциональных групп включают в себя аммоний; гуанидиний; гетероциклил, имеющий один или более протонированных атомов азота в кольце; и гетероарил, имеющий один или более протонированных атомов азота в кольце. Используемый в настоящем документе термин «аммоний» включает в себя первичный аммоний, вторичный аммоний, третичный аммоний и четвертичный аммоний. В частности аммоний имеет следующую структуру:
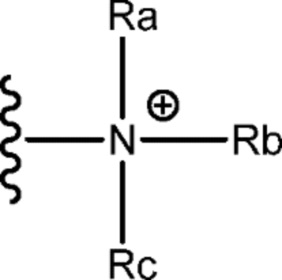
где каждый Ra, Rb и Rc независимо выбран из водорода и незамещенной или замещенной алкильной группы, каждая из которых может быть одинаковой или разной. Например, когда каждый из Ra, Rb и Rc представляет собой водород, катион представляет собой катион первичного аммония; когда каждый из Ra, Rb и Rc представляет собой алкил, катион представляет собой катион четвертичного аммония.
[0041] Используемый в настоящем документе «алкил» означает алифатическую углеводородную группу, которая может быть неразветвленной или разветвленной и может содержать от приблизительно 1 до приблизительно 20 атомов углерода в цепи. Предпочтительные алкильные группы содержат от приблизительно 1 до приблизительно 12 атомов углерода в цепи. Более предпочтительные алкильные группы содержат от приблизительно 1 до приблизительно 6 атомов углерода в цепи. «Разветвленный» означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкильной цепи. «Алкил» может быть незамещенным или необязательно замещенным одним или более заместителями, которые могут быть одинаковыми или разными, причем каждый заместитель независимо выбран из группы, состоящей из галогена, алкила, арила, гетероциклила, гетероарила, циклоалкила, циано, гидрокси, алкокси, алкилтио, амино, оксима (например, =N-OH), -NH(алкила), -NH(циклоалкила), -N(алкил)2, -O-C(O)-алкила, -O-C(O)-арила, -O-C(O)-циклоалкила, -SF5, карбокси, -C(O)O-алкила, -C(O)NH(алкила) и -C(O)N(алкила)2. К не имеющим ограничительного характера примерам подходящих алкильных групп относятся метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
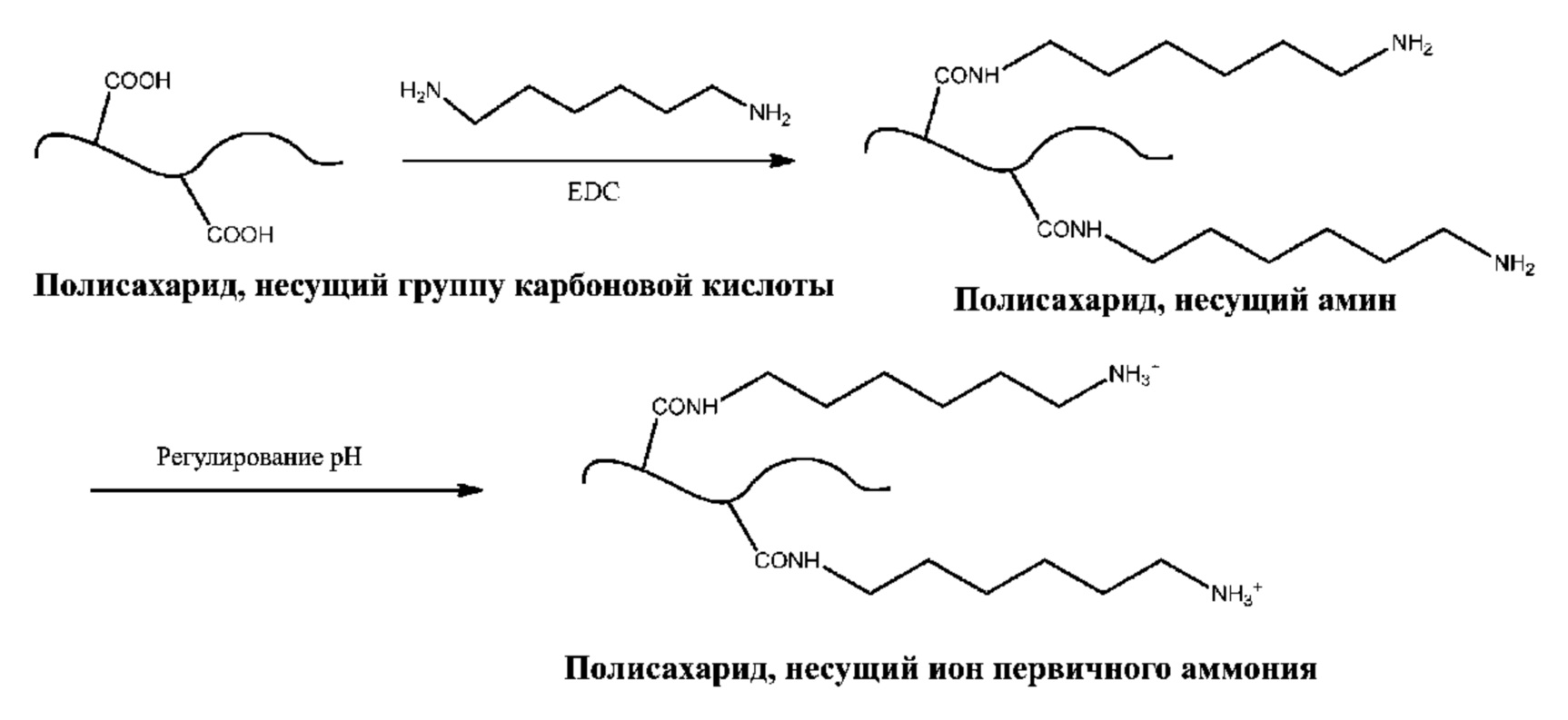
[0042] Используемый в настоящем документе «гетероциклил» означает неароматическую насыщенную моноциклическую или мультициклическую кольцевую систему, содержащую от приблизительно 3 до приблизительно 10 атомов в кольце, предпочтительно от приблизительно 5 до приблизительно 10 атомов в кольце, в которой один или более атомов в кольцевой системе представляют собой элемент, отличный от углерода, например, азот, кислород или серу, по отдельности или в комбинации. В кольцевой системе отсутствуют смежные атомы кислорода и/или серы. Предпочтительные гетероциклилы содержат от приблизительно 5 до приблизительно 6 атомов в кольце. Префикс аза, окса или тиа перед базовым названием гетероцикла означает, что по меньшей мере атом азота, кислорода или серы соответственно присутствует в качества атома в кольце. Любой N в гетероциклическом кольце может существовать в протонированной форме. Любая -NH в гетероциклическом кольце может быть защищена, например, может иметь вид группы -N(Boc), -N(CBz), -N(Tos) и т.п.; такие защиты также считаются частью настоящего изобретения. Гетероциклил может быть необязательно замещен одним или более «заместителями в кольцевой системе», которые могут быть одинаковыми или разными, в соответствии с определениями, приведенными в настоящем документе. Атом азота или серы в гетероциклиле может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. К не имеющим ограничительного характера примерам подходящих моноциклических гетероциклических колец относятся пиперидил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, лактам и т.п. К «гетерциклилу» также относятся гетероциклические кольца, как описано выше, в которых =0 заменяет два доступных атома водорода у одного и того же атома углерода в кольце.
[0043] Используемый в настоящем документе «гетероарил» означает ароматическую моноциклическую или мультициклическую кольцевую систему, содержащую от приблизительно 5 до приблизительно 14 атомов в кольце, предпочтительно от приблизительно 5 до приблизительно 10 атомов в кольце, причем один или более атомов в кольце представляют собой элемент, отличный от углерода, например, азот, кислород или серу, по отдельности или в комбинации. Предпочтительные гетероарилы содержат от приблизительно 5 до приблизительно 6 атомов в кольце. Префикс аза, окса или тиа перед базовым названием гетероцикла означает, что по меньшей мере атом азота, кислорода или серы соответственно присутствует в качества атома в кольце. Любой N в гетероциклическом кольце может существовать в протонированной форме. «Гетероарил» может быть необязательно замещен одним или более «заместителями в кольцевой системе», которые могут быть одинаковыми или разными, в соответствии с определениями, приведенными в настоящем документе. Атом азота гетероарила может быть необязательно окислен до соответствующего N-оксида. К не имеющим ограничительного характера примерам подходящих гетероарилов относятся пиридил, пиразинил, пиримидинил, пиридон (включая N-замещенные пиридоны), изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил, пирролил, пиразолил, триазолил, 1,2,4-тиадиазолил, пиразинил, пиридазинил, хиноксалинил, фталазинил, оксиндолил, имидазо[1,2-a]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидил, пирролопиридил, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, бензотиазолил и т.п. Термин «гетероарил» также относится к частично насыщенным гетероарильным функциональным группам, таким как, например, тетрагидроизохинолил, тетрагидрохинолил и т.п.
[0044] Используемый в настоящем документе «заместитель в кольцевой системе» означает заместитель, присоединенный к ароматической или неароматической кольцевой системе, который, например, заменяет имеющийся водород в кольцевой системе. Заместители в кольцевой системе могут быть одинаковыми или разными и каждый из них независимо выбран из группы, состоящей из алкила, алкенила, алкинила, арила, гетероарила, аралкила, алкиларила, гетероаралкила, гетероарилалкенила, гетероарилалкинила, алкилгетероарила, гидрокси, гидроксиалкила, алкокси, арилокси, аралкокси, ацила, ароила, галогена, нитро, циано, карбокси, алкоксикарбонила, арилоксикарбонила, аралкоксикарбонила, алкилсульфонила, арилсульфонила, гетероарилсульфонила, алкилтио, арилтио, гетероарилтио, аралкилтио, гетероаралкилтио, циклоалкила, гетероциклила, -SF5, -O-C(O)-алкила, -O-C(O)-арила, -O-C(O)-циклоалкила, -C(=N-CN)-NH2, -C(=NH)-NH2, -C(=NH)-NH(алкил), оксима (например, =N-OH), -NY1Y2, -алкил-NY1Y2, -C(O)NY1Y2, -SO2NY1Y2 и -SO2NY1Y2, причем Y1 и Y2 могут быть одинаковыми или разными и независимо выбраны из группы, состоящей из водорода, алкила, арила, циклоалкила и аралкила.
[0045] В некоторых вариантах осуществления катионную функциональную группу катионного полисахарида получают путем включения одной или более аминокислот в полисахарид, например, аргининовая боковая цепь может формировать ион гуанидия; лизиновая или орнитиновая боковая цепь может формировать ион аммония; гистидиновая боковая цепь может формировать ион имидазолия; пролин может формировать ион пирролидиния.
[0046] В других вариантах осуществления катионная функциональная группа обеспечивается одним или более повторяющимися звеньями полисахарида. В некоторых вариантах осуществления катионные группы обеспечиваются D-глюкозамином, причем первичные аминогруппы протонируют с получением ионов первичного аммония.
[0047] В некоторых вариантах осуществления первичные аминогруппы полисахарида алкилируют с получением соответствующих ионов вторичного, третичного и/или четвертичного аммония.
[0048] В некоторых вариантах осуществления катионный полисахарид представляет собой хитозан. Хитозан, также известный как полиглусам, деацетилхитин и поли-(D)-глюкозамин, представляет собой линейный полисахарид, содержащий β-(1-4)-связанный D-глюкозамин (деацетилированное звено) и N-ацетил D-глюкозамин (ацетилированное звено). Хитозан, в том числе промышленно изготавливаемый хитозан, может быть получен путем деацетилирования хитина. В некоторых вариантах осуществления степень деацетилирования (%DD) находится в диапазоне от приблизительно 60 до приблизительно 100%. В некоторых вариантах осуществления аминогруппа хитозана имеет значение pKa приблизительно 6,5, что приводит к протонированию (т.е. образованию ионов аммония) в кислотных или нейтральных растворах, включая физиологический pH, причем плотность заряда зависит от pH и от %DD. В некоторых вариантах осуществления молекулярная масса хитозана составляет от приблизительно 3800 до приблизительно 20 000 дальтон. В других вариантах осуществления катионный полисахарид представляет собой алкиламинохитозан. В одном таком варианте осуществления катионный полисахарид представляет собой кватернизированный хитозан, содержащий четвертичные ионы аммония. В конкретном варианте осуществления катионный полисахарид представляет собой триметилхитозан.
[0049] В некоторых вариантах осуществления катионную группу вводят в полисахарид путем получения производного от аниона полисахарида при помощи группы, несущей катион, в результате чего анион замещается катионом. В некоторых вариантах осуществления полисахарид представляет собой катионный полисахарид, а катион вводят для включения в полисахарид дополнительных катионов, например, для модуляции pKa катионного полисахарида и/или для корректировки реологических свойств коацерватного гидрогеля, содержащего полисахарид. В других вариантах осуществления полисахарид представляет собой анионный полисахарид, а катион вводят для модуляции pKa полисахарида и/или для корректировки реологических свойств гидрогеля, содержащего полисахарид. В некоторых вариантах осуществления полисахарид представляет собой анионный полисахарид, а катионные группы вводят для превращения анионного полисахарида в катионный полисахарид. Например, анионный полисахарид может представлять собой ГК, которую превращают в катионную ГК.
[0050] Способы введения аминных функциональных групп (т.е. источников катионов аммония) в полисахарид, содержащий карбоксильные группы, могут осуществляться путем взаимодействия полисахарида с диамином или полиамином (см. Фиг. 1a и 1b). В некоторых вариантах осуществления полисахарид представляет собой ГК. В одном примере осуществления полисахарид, содержащий одну или более карбоксильных групп, связывают с диамином или полиамином в присутствии связывающего агента с образованием амидной связи. Полисахарид может представлять собой ГК. К не имеющим ограничительного характера примерам аминов, подходящих для введения катионов в полисахарид, несущий группы карбоновой кислоты, относятся аминокислоты, такие как лизин и орнитин, гексаметилендиамин (HMDA), спермин, спермидин и производные или защищенные формы вышеуказанного. Например, амины могут содержать один или более сложных карбоксилатных эфиров и/или N-Boc-групп, таких как метиловый эфир лизина, метиловый эфир Nэпсилон-Boc-лизина, метиловый эфир орнитина и метиловый эфир Nдельта-Boc-орнитина. К не имеющим ограничительного характера примерам соединительных агентов, которые можно применять для формирования пептидных связей между группами карбоновых кислот полисахарида и аминами, относятся карбодиимиды, такие как 1-этил-3-(3-диметиламинопропил) карбодиимид (EDC), 1-этил-3-(3-триметиламинопропил) карбодиимид (ETC), 1-циклогексил-3-(2-морфолиноэтил) карбодиимид (CMC), а также их соли и смеси.
[0051] Если функциональная группа в соединении называется «защищенной», это означает, что группа имеет модифицированную форму, предотвращающую нежелательные побочные реакции в защищенном сайте, когда соединение вводят в реакцию. Подходящие защитные группы будут известны специалистам в данной области, а также при обращении к стандартным справочникам, таким как, например, T. W. Greene et al., Protective Groups in Organic Synthesis (1991), Wiley, New York. Например, аминогруппу можно защитить группой -(Boc), -(CBZ) или -(Tos) и т.п., а затем защиту можно снять с получением соответствующей аминогруппы или соответствующего иона аммония.
[0052] Не имеющий ограничительного характера вариант осуществления предложенного способа показан на схеме 1a, на которой представлено связывание полисахарида, содержащего группы карбоновых кислот, с HMDA в присутствии EDC. В данном варианте осуществления одна из аминогрупп HMDA образует амидную связь, а другая аминогруппа формирует ион аммония.
[0053] Другой не имеющий ограничительного характера вариант осуществления представлен на схеме 1b, где показано соединение полисахарида, содержащего группы карбоновой кислоты, с метиловым эфиром Nэпсилон-Boc-лизина в присутствии EDC, так что альфа-аминогруппа лизина образует амидную связь с группой карбоновой кислоты полисахарида; затем с группы Nэпсилон-Boc снимают защиту с получением иона аммония с использованием способов, по существу известных специалисту в данной области.
[0054] Схема 1a.
[0055] Схема 1b.
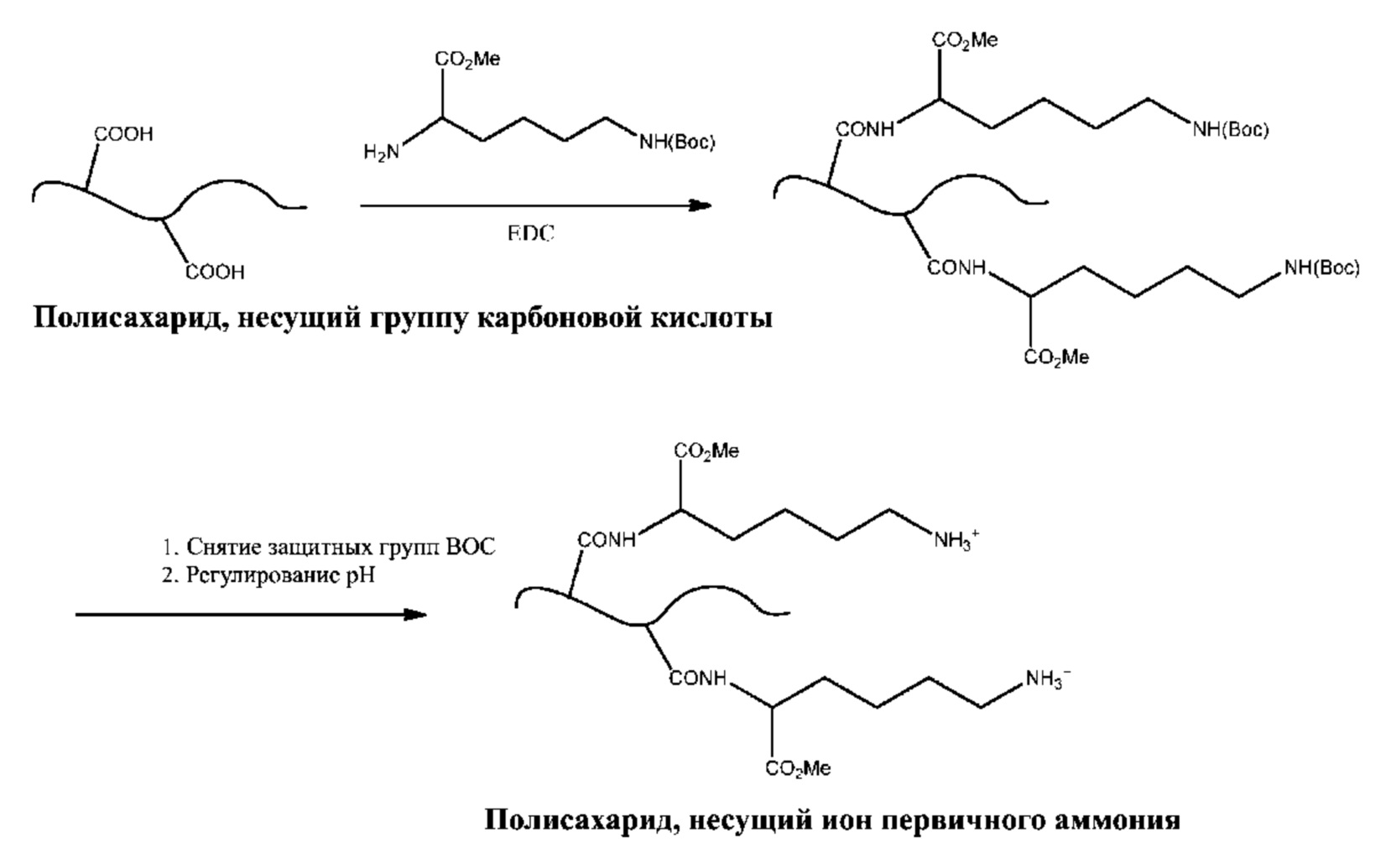
[0056] В некоторых вариантах осуществления из одной или более аминогрупп полисахарида формируют производные с целью введения ионов гуанидиния. Способы превращения ионов первичного аммония в ионы гуанидиния описаны в публикации Hunt, et al. Tunable, High Modulus Hydrogels Driven by Ionic Coacervation, Advanced Materials, 2011, 23, 2327–2331, все содержимое которой полностью включено в настоящий документ путем ссылки. В одном варианте осуществления полисахарид, содержащий одну или более амино/аммониевых групп, можно вводить в реакцию с 1H-пиразол-1-карбоксимидамидом с образованием катиона гуанидиния, как показано на схемах 2a и 2b.
[0057] Схема 2a.

[0058] Схема 2b.
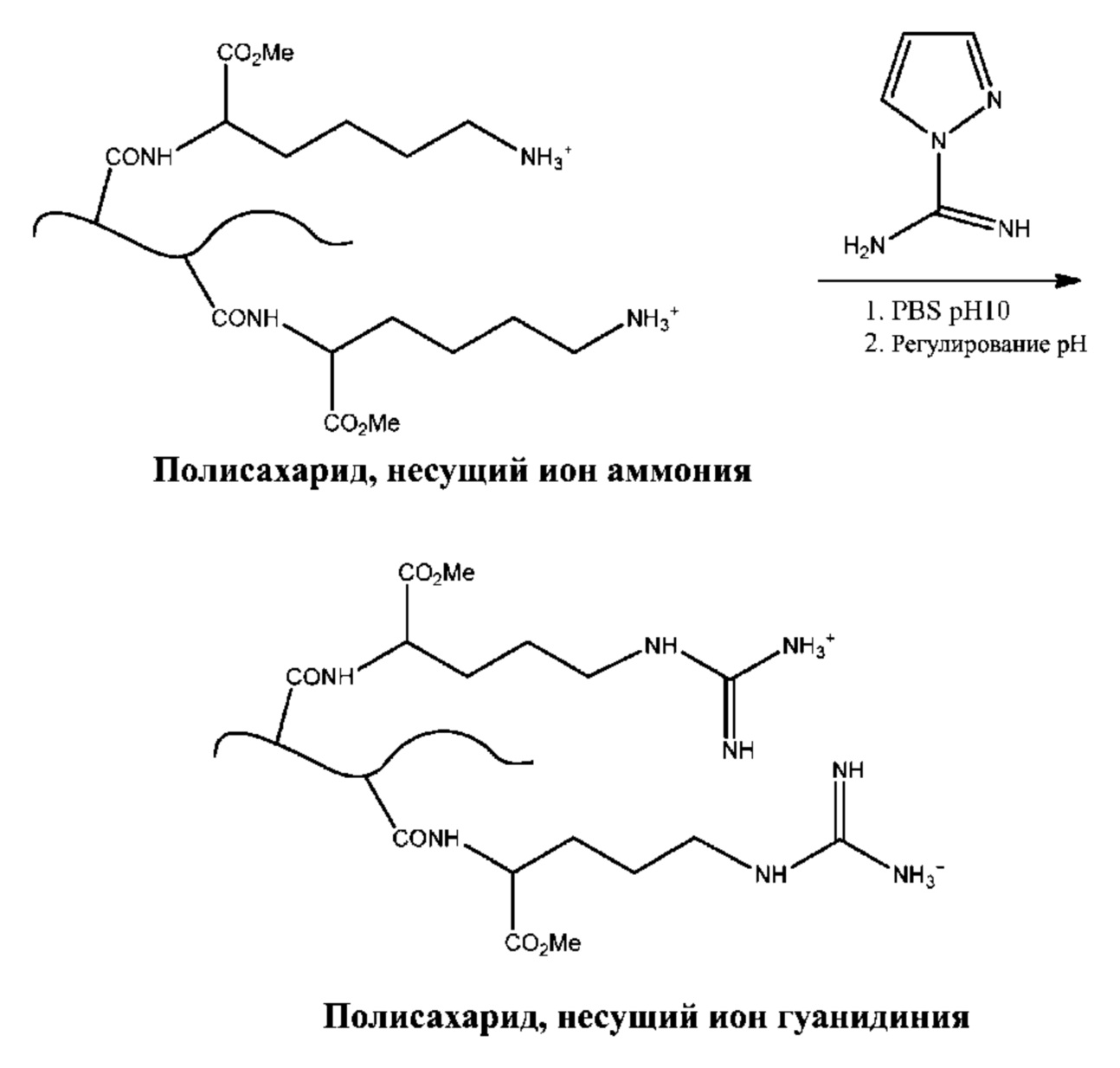
[0059] В некоторых вариантах осуществления все из аминогрупп полисахарида превращаются в ионы гуанидиния. В других вариантах осуществления только некоторые из аминогрупп полисахарида превращаются в группы гуанидиния и полученный полисахарид содержит как ионы первичного аммония, так и ионы гуинидиния.
[0060] В другом варианте осуществления все из аминогрупп полисахарида алкилированы, например, с образованием полисахарида, содержащего вторичный, третичный и/или четвертичный ионы аммония. В других вариантах осуществления только некоторые из аминогрупп полисахарида являются алкилированными и полученный полисахарид содержит первичные и вторичные, третичные и/или четвертичные ионы аммония.
[0061] В другом варианте осуществления некоторые из аминогрупп полисахарида являются алкилированными, а другие аминогруппы превращаются в ионы гуанидиния, таким образом образуя полисахарид, содержащий ионы первичного аммония, ионы вторичного аммония, ионы третичного аммония, ионы четвертичного аммония, ионы гуанидиния или их комбинации.
[0062] В некоторых вариантах осуществления сшитую катионную ГК получают из сшитой ГК. Не имеющие ограничительного характера примеры способов получения сшитой ГК описаны выше. В одном варианте осуществления сшитую ГК модифицируют путем введения катионных групп, например, путем введения ионов аммония (например, см. схемы 1a и 1b), и необязательно посредством алкилирования ионов аммония и/или введения ионов гуанидиния (например, см. схемы 2a и 2b), таким образом формируя сшитую катионную ГК, несущую ионы первичного аммония, вторичного аммония, третичного аммония, четвертичного аммония и/или ионы гуанидиния.
[0063] В некоторых вариантах осуществления в полисахарид вводят анионную группу. В некоторых вариантах осуществления полисахарид представляет собой катионный полисахарид, а анион вводят для включения в полисахарид анионов, например, с целью модуляции pKa катионного полисахарида и/или для корректировки реологических свойств коацерватного гидрогеля, содержащего полисахарид. В других вариантах осуществления полисахарид представляет собой ГК, а анион вводят для модуляции pKa ГК и/или для корректировки реологических свойств гидрогеля, содержащего ГК.
[0064] К не имеющим ограничительного характера примерам анионных функциональных групп относятся карбоксилат, фосфонат и сульфонат. В некоторых вариантах осуществления фосфонатные и/или сульфонатные анионы получают путем взаимодействия одной или более карбоксильных групп полисахарида, такого как ГК, с аминофосфоновой кислотой с образованием полисахарида, содержащего фосфонатные ионы, и/или аминосульфаминовой кислотой с образованием полисахарида, содержащего сульфонатные ионы, соответственно. В некоторых вариантах осуществления анионную функциональную группу получают посредством включения в полисахарид аминокислоты, например, аспарагиновой кислоты или глутаминовой кислоты, которая может обеспечивать карбоксилатный ион.
[0065] Следует понимать, что, хотя pKa конкретной группы может быть ниже 7, конкретная группа (например, имидазол или N-концевая аминогруппа) может выступать в качестве катиона и, следовательно, может использоваться для формирования и/или использования коацерватного геля в условиях pH, при которых группа является протонированной. И наоборот, следует понимать, что, хотя pKa конкретной группы может быть выше 7, конкретная группа может выступать в качестве аниона и может использоваться для формирования и/или использования коацерватного геля в условиях pH, при которых группа является депротонированной.
[0066] В некоторых вариантах осуществления предложены коацерватные ГК-гидрогели с различными реологическими профилями, которые могут формироваться на основе значения(-ий) pKa анионов и/или катионов как анионной ГК, так и катионных полисахаридов соответственно. Например, сила зарядового взаимодействия зависит от природы анионов и/или катионов, что влияет на свойства итогового геля. Таким образом, реологические свойства гидрогелей можно регулировать путем подбора конкретных ионных групп с конкретными pKa и/или путем корректировки относительного количества каждой ионной группы. В некоторых вариантах осуществления для регулировки реологических свойств геля может потребоваться гомоанионный/гомокатионный комплекс, гомоанионный/гетерокатионный комплекс, гетероанионный/гомокатионный комплекс или гетероанионный/гетерокатионный комплекс.
[0067] В одном варианте осуществления дермальный филлер по изобретению содержит гидрогель на основе ГК, причем гидрогель содержит анионную ГК и катионный полисахарид. В некоторых вариантах осуществления анионная ГК является несшитой. В других вариантах осуществления анионная ГК является сшитой. В некоторых вариантах осуществления катионный полисахарид является несшитым. В других вариантах осуществления катионный полисахарид является сшитым.
[0068] В некоторых вариантах осуществления дермальный филлер по изобретению содержит гидрогель на основе ГК, причем гидрогель содержит ГК и катионный полисахарид. В некоторых вариантах осуществления ГК является несшитой. В других вариантах осуществления ГК является сшитой. В некоторых вариантах осуществления катионный полисахарид является несшитым. В других вариантах осуществления катионный полисахарид является сшитым.
[0069] В одном варианте осуществления предложен коацерватный гидрогель, содержащий несшитую анионную ГК. В этом примере несшитую анионную ГК конденсирут (т.е. вводят в комплекс с катионным полисахаридом) и инкапсулируют в сердцевину посредством взаимодействий с катионными группами катионного полисахарида, причем катионный полисахарид служит непрерывной фазой, в которой диспергирована конденсированная несшитая анионная ГК (см. Фиг. 1A).
[0070] В другом варианте осуществления предложен коацерватный гидрогель, содержащий несшитую ГК и несшитый катионный полисахарид, такой как хитозан, в котором соотношение заряда между анионной ГК и катионным хитозаном близко к равновесному заряду, ГК и хитозан образуют полиионный комплекс и равномерно распределены по матриксу геля (см. Фиг. 1B).
[0071] В другом варианте осуществления предложен коацерватный гидрогель, содержащий несшитую ГК и несшитый катионный полисахарид, такой как хитозан, в котором несшитый катионный полисахарид конденсируют (т.е. вводят в комплекс с анионной ГК) и инкапсулируют в сердцевину за счет взаимодействия с анионными группами анионной ГК, причем анионная ГК выступает в качестве непрерывной фазы, в которой диспергирован конденсированный несшитый катионный полисахарид (см. Фиг. 1C).
[0072] В другом варианте осуществления предложен коацерватный гидрогель, содержащий сшитую анионную ГК. В этом примере сшитые анионные ГК-полисахариды находятся в комплексе с катионным полисахаридом и катионный полисахарид служит в качестве непрерывной фазы, в которой диспергированы частицы сшитой анионной ГК (см. Фиг. 2). В некоторых вариантах осуществления катионные полисахариды действуют как связующие «клеи» для удержания или инкапсулирования частиц гидрогеля из сшитой анионной ГК.
[0073] В другом варианте осуществления гидрогели содержат ионные комплексы несшитой анионной ГК со сшитой катионной ГК. ГК служит в качестве непрерывной фазы, в которой диспергированы частицы сшитой катионной ГК. В некоторых вариантах осуществления полисахариды анионной ГК действуют как связующие «клеи» для удержания или инкапсулирования частиц гидрогеля из сшитой катионной ГК.
[0074] В некоторых вариантах осуществления коацерватные гидрогели содержат гомоанионный ГК-полисахарид, в котором все анионы имеют одинаковую природу. Например, гомоанионный полисахарид может представлять собой ГК, причем каждый анион представляет собой карбоксилатный анион.
[0075] В некоторых вариантах осуществления гидрогели содержат модифицированную гетероанионную ГК (т.е. ГК, которая была модифицирована путем введения одного или более анионов вместо карбоксилата), причем анионы имеют разную природу (например, карбоксилат, фосфонат и/или сульфонат), и каждый из них может иметь одинаковые или разные значения pKa. Например, ГК можно ввести в реакцию с аминофосфоновой кислотой в условиях, обеспечивающих получение гомоанионной ГК, содержащей фосфонатные анионы. В другом примере ГК может вступать в реакцию с аминосульфаминовой кислотой в условиях, обеспечивающих получение гомоанионной ГК, содержащей сульфонатные анионы. В другом примере ГК может вступать в реакцию с аминофосфоновой кислотой в условиях, обеспечивающих получение гетероанионной ГК, содержащей как карбоксилатные, так и фосфонатные анионы. В другом примере ГК может вступать в реакцию с аминосульфаминовой кислотой в условиях, обеспечивающих получение гетероанионной ГК, содержащей как карбоксилатные, так и сульфонатные анионы. В другом примере ГК можно вводить в реакцию, одновременно или последовательно, с аминофосфоновой кислотой и аминосульфаминовой кислотой в условиях, обеспечивающих получение гетероанионной ГК, содержащей карбоксилатные, фосфонатные и сульфонатные группы.
[0076] В некоторых вариантах осуществления коацерватные ГК-гидрогели содержат гомокатионный полисахарид, причем все катионы, например, имеют одинаковую природу, при этом каждый катион представляет собой ион первичного аммония. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой хитозан.
[0077] В других вариантах осуществления коацерватные ГК-гидрогели содержат гетерокатионный полисахарид, в котором два или более катионов имеют разную природу (например, первичный аммоний, четвертичный аммоний, гуанидиний и/или имидазолий), причем каждый из которых может иметь одинаковые или разные значения pKa.
[0078] В некоторых вариантах осуществления коацерватные гидрогели содержат гомоанионную ГК и гомокатионный полисахарид. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК, а гомокатионный полисахарид представляет собой хитозан.
[0079] В некоторых вариантах осуществления коацерватные гидрогели содержат гомоанионную ГК и гетерокатионный полисахарид. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК.
[0080] В некоторых вариантах осуществления коацерватные гидрогели содержат гетероанионную ГК и гомокатионный полисахарид. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой катионную ГК. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой хитозан.
[0081] В некоторых вариантах осуществления коацерватные гидрогели содержат гетероанионную ГК и гетерокатионный полисахарид.
[0082] В некоторых вариантах осуществления гидрогели содержат ионный комплекс гомоанионной ГК с гомокатионным полисахаридом. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой катионную ГК. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК, а гомокатионный полисахарид представляет собой катионную ГК или хитозан.
[0083] В некоторых вариантах осуществления гидрогели содержат ионный комплекс гомоанионной ГК с гетерокатионным полисахаридом. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК.
[0084] В некоторых вариантах осуществления гидрогели содержат ионный комплекс гетероанионной ГК с гомокатионным полисахаридом. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой катионную ГК или хитозан.
[0085] В некоторых вариантах осуществления гидрогели содержат ионный комплекс гетероанионной ГК с гетерокатионным полисахаридом.
[0086] Не имеющие ограничительного характера варианты осуществления изобретения включают в себя гидрогели, содержащие ионный комплекс анионного полисахарида с катионным полисахаридом, причем анионный полисахарид выбран из вариантов осуществления анионного полисахарида из таблицы 1 и катионный полисахарид выбран из вариантов осуществления катионных полисахаридов из таблицы 1, без ограничений по возможным комбинациям анионных и катионных полисахаридов.
[0087] Таблица 1.
[0088] В дополнительных вариантах осуществления предложены коацерватные ГК-гидрогели, как описано в таблице 1, причем гидрогель дополнительно содержит косметический агент, витамин, антиоксидант, осветляющий кожу агент или их комбинацию.
[0089] В дополнительных вариантах осуществления коацерватные ГК-гидрогели, как описано в таблице 1 и в предыдущем абзаце, представлены в физиологически приемлемом носителе, таком как, например, фосфатно-солевой буфер (PBS) или несшитая ГК.
[0090] В некоторых вариантах осуществления ГК-гидрогели по изобретению имеют достаточную или улучшенную пластичность, подтягивающую способность и/или характеристики инъекционного введения для предполагаемого применения в качестве дермальных филлеров с улучшениями по сравнению с традиционными химически сшитыми дермальными филлерами на основе ГК.
[0091] В некоторых вариантах осуществления гели имеют модуль накопления (G') в диапазоне от приблизительно 50 Па до приблизительно 5000 Па, например от приблизительно 500 Па до приблизительно 2000 Па, от приблизительно 500 Па до приблизительно 1500 Па или от приблизительно 500 Па до приблизительно 1000 Па, или имеют модуль накопления приблизительно 500 Па или приблизительно 1450 Па. В некоторых аспектах гели с высоким G' могут быть получены путем варьирования концентраций анионной ГК и катионного полисахарида, относительных соотношений анионной ГК и катионного полисахарида и/или путем регулировки анионно-катионных взаимодействий с использованием различных анионов и катионов для образования комплекса; например, пары анион-катион могут иметь сильные анионно-катионные взаимодействия, такие как ионные взаимодействия между сульфонатом и гуанидинием.
[0092] В некоторых вариантах осуществления изобретения коацерватные ГК-гидрогели блокируют доступ гидролитических ферментов, что приводит к лучшей целостности гидрогеля, продолжительности его существования или обоих аспектов в мягкой ткани, такой как кожа. В одном варианте осуществления блокируется доступность для гиалуронидазы. В другом варианте осуществления блокируются ферменты, гидролизующие катионные полисахариды. В другом варианте осуществления блокируются эстеразы.
[0093] В некоторых вариантах осуществления дермальный филлер по изобретению присутствует по меньшей мере приблизительно 3 месяца, по меньшей мере приблизительно 4 месяца, по меньшей мере приблизительно 5 месяцев или по меньшей мере приблизительно 6 месяцев после введения в кожу или другую мягкую ткань. В некоторых вариантах осуществления дермальный филлер по изобретению присутствует в ткани до приблизительно года после введения в кожу или другую мягкую ткань. В других вариантах осуществления дермальные филлеры по изобретению присутствуют в ткани приблизительно до 18 месяцев после введения в кожу или другую мягкую ткань. В конкретных вариантах осуществления дермальный филлер присутствует в ткани в течение от приблизительно 3 месяцев до приблизительно 18 месяцев после введения в кожу или другую мягкую ткань.
[0094] В некоторых вариантах осуществления коацерватные ГК-гидрогели содержат несшитую анионную ГК (такую как несшитая ГК), имеющую молекулярную массу в диапазоне от приблизительно 50 тыс до приблизительно 3 млн дальтон, от приблизительно 100 тыс до приблизительно 3 млн дальтон, или от приблизительно 500 тыс до приблизительно 3 млн дальтон, от приблизительно 50 тыс до приблизительно 2 млн дальтон, от приблизительно 100 тыс до приблизительно 2 млн дальтон или от приблизительно 500 тыс до приблизительно 2 млн дальтон.
[0095] В некоторых вариантах осуществления ГК-компонент в гидрогеле представляет собой сшитый анионный ГК-полисахарид, такой как сшитая ГК. Используемый в настоящем документе термин «сшитый» относится к межмолекулярным связям, соединяющим отдельные молекулы полимера или мономерные цепи с образованием более стабильной структуры, такой как гель. Таким образом, сшитый анионный ГК-полисахарид имеет по меньшей мере одну межмолекулярную связь, соединяющую по меньшей мере одну отдельную полисахаридную молекулу с другой.
[0096] Поперечное сшивание полисахаридов гликозаминогликанов, таких как ГК, как правило, приводит к образованию гидрогеля. Такие гидрогели имеют высокую вязкость, и для их прохождения через тонкую иглу требуются значительные усилия. Полисахариды гликозаминогликаны в целом, включая ГК, могут быть сшиты с использованием диальдегидных и дисульфидных сшивающих агентов, включая, без ограничений, многофункциональные сшивающие агенты на основе ПЭГ, дивинилсульфоны, простые диглицидиловые эфиры и бис-эпоксиды, бискарбодиимид. К не имеющим характера примерам сшивающих ГК агентов относятся многофункциональные сшивающие агенты на основе ПЭГ, такие как простой пентаэритритол-тетраглицидиловый эфир (PETGE), дивинилсульфон (DVS), простой 1,4-бутандиол-диглицидиловый эфир (BDDE), 1,2-бис(2,3-эпоксипропокси)этилен (EGDGE), 1,2,7,8-диэпоксиоктан (DEO), (фениленбис-(этил)-карбодиимид и 1,6 гексаметиленбис(этилкарбодиимид), адипиновый дигидразин (ADH), бис(сульфосукцинимидил)суберат (BS), гексаметилендиамин (HMDA), 1 (2,3 эпоксипропил)-2,3-эпоксициклогексан или их комбинации. Другие полезные сшивающие агенты описаны в публикации Stroumpoulis and Tezel, Tunably Crosslinked Polysaccharide Compositions, опубликованная заявка на патент США US 2011/0077737, которая полностью включена в настоящий документ путем ссылки. Не имеющие ограничительного характера примеры способов сшивки полисахаридов гликозаминогликанов описаны, например, в Piron and Tholin, Polysaccharide Crosslinking, Hydrogel Preparation, Resulting Polysaccharides(s) and Hydrogel(s), uses Thereof, опубликованная заявка на патент США 2003/0148995; Lebreton, Cross-Linking of Low and High Molecular Weight Polysaccharides, Preparation of Injectable Monophase Hydrogels, Polysaccharides and Hydrogels Obtained, опубликованная заявка на патент США 2010/0226988; Lebreton, Viscoelastic Solutions Containing Sodium Hyaluronate and Hydroxypropyl Methyl Cellulose, Preparation and Uses, опубликованная заявка на патент США 2008/0089918; Lebreton, Hyaluronic Acid-Based Gels Including Lidocaine, опубликованная заявка на патент США 2010/0028438; и Polysaccharides and Hydrogels thus Obtained, опубликованная заявка на патент США 2006/0194758; и Di Napoli, Composition and Method for Intradermal Soft Tissue Augmentation, опубликованная заявка на международный патент WO 2004/073759; Njikang et al., Dermal Filler Compositions, опубликованная заявка на патент США 2013/0096081; каждая из которых полностью включена в настоящий документ путем ссылки.
[0097] В некоторых вариантах осуществления сшитые модифицированные анионные ГК-полисахариды получают из сшитой ГК. Не имеющие ограничительного характера примеры способов получения сшитой ГК описаны выше. В одном варианте осуществления сшитая ГК модифицирована путем введения анионных групп в дополнение к карбоксилату или вместо него. Например, сшитую ГК можно ввести в реакцию с аминофосфоновой кислотой с образованием сшитой гомоанионной ГК, содержащей фосфонатные анионы. В другом примере сшитую ГК можно ввести в реакцию с аминосульфаминовой кислотой с получением сшитой гомоанионной ГК, содержащей сульфонатные анионы. В другом примере сшитую ГК можно ввести в реакцию с аминофосфоновой кислотой с получением сшитой гетероанионной ГК, имеющей как карбоксилатные, так и фосфонатные анионы. В другом примере сшитую ГК можно ввести в реакцию с аминосульфаминовой кислотой с получением сшитой гетероанионной ГК, содержащей как карбоксилатные, так и сульфонатные анионы. В другом примере сшитую ГК можно ввести в реакцию одновременно или последовательно с аминофосфоновой кислотой и аминосульфаминовой кислотой с получением сшитой гетероанионной ГК, содержащей карбоксилатные, фосфонатные и сульфонатные группы.
[0098] В соответствии с настоящим описанием обозначение «%» в составе определяется как массовая доля (т.е. мас./мас.) в процентах. Пример: 1% (мас./мас.) означает концентрацию 10 мг/г.
[0099] В одном варианте осуществления гидрогелевая композиция содержит анионный ГК-полисахарид (такой как ГК), который присутствует в количестве, достаточном для обработки мягких тканей или лечения состояния кожи, как описано в настоящем документе. В других аспектах данного варианта осуществления композиция содержит анионную ГК (такую как ГК), которая составляет, например, приблизительно 1% по массе, приблизительно 2% по массе, приблизительно 3% по массе, приблизительно 4% по массе, приблизительно 5% по массе, приблизительно 6% по массе, приблизительно 7% по массе, приблизительно 8% по массе, приблизительно 9% по массе, приблизительно 10% по массе от всей композиции. В других аспектах данного варианта осуществления композиция содержит анионную ГК (такую как ГК), которая составляет, например, не более 1% по массе, не более 2% по массе, не более 3% по массе, не более 4% по массе, не более 5% по массе, не более 6% по массе, не более 7% по массе, не более 8% по массе, не более 9% по массе, не более 10% по массе от всей композиции. В других аспектах данного варианта осуществления композиция содержит анионную ГК (такую как ГК), которая составляет, например, от приблизительно 0,5% до приблизительно 20% по массе, от приблизительно 1% до приблизительно 17% по массе, от приблизительно 3% до приблизительно 15% по массе, от приблизительно 5% по массе до приблизительно 10% по массе, например, приблизительно 11% по массе, приблизительно 15% по массе или приблизительно 17% по массе от всей композиции.
[00100] В аспектах данного варианта осуществления гидрогелевая композиция содержит анионную ГК (такую как ГК), которая присутствует в концентрации, например, приблизительно 2 мг/г, приблизительно 3 мг/г, приблизительно 4 мг/г, приблизительно 5 мг/г, приблизительно 6 мг/г, приблизительно 7 мг/г, приблизительно 8 мг/г, приблизительно 9 мг/г, приблизительно 10 мг/г, приблизительно 11 мг/г, приблизительно 12 мг/г, приблизительно 13 мг/г, приблизительно 13,5 мг/г, приблизительно 14 мг/г, приблизительно 15 мг/г, приблизительно 16 мг/г, приблизительно 17 мг/г, приблизительно 18 мг/г, приблизительно 19 мг/г или приблизительно 20 мг/г. В других аспектах данного варианта осуществления композиция содержит анионную ГК (такую как ГК), которая присутствует в концентрации, например, по меньшей мере 1 мг/г, по меньшей мере 2 мг/г, по меньшей мере 3 мг/г, по меньшей мере 4 мг/г, по меньшей мере 5 мг/г, по меньшей мере 10 мг/г, по меньшей мере 15 мг/г, по меньшей мере 20 мг/г, по меньшей мере 25 мг/г или по меньшей мере 40 мг/г. В других аспектах данного варианта осуществления композиция содержит анионную ГК (такую как ГК), которая присутствует в концентрации, например, не более 1 мг/г, не более 2 мг/г, не более 3 мг/г, не более 4 мг/г, не более 5 мг/г, не более 10 мг/г, не более 15 мг/г, не более 20 мг/г, не более 25 мг/г или не более 40 мг/г. В других аспектах данного варианта осуществления композиция содержит анионную ГК (такую как ГК), которая присутствует в концентрации, например, от приблизительно 7,5 мг/г до приблизительно 19,5 мг/г, от приблизительно 8,5 мг/г до приблизительно 18,5 мг/г, от приблизительно 9,5 мг/г до приблизительно 17,5 мг/г, от приблизительно 10,5 мг/г до приблизительно 16,5 мг/г или от приблизительно 11,5 мг/г до приблизительно 15,5 мг/г или от приблизительно 12,5 мг/г до приблизительно 14,5 мг/г или до приблизительно 40 мг/г.
[00101] В аспектах настоящего описания частично предложена гидрогелевая композиция, содержащая сшитый анионный ГК-полисахарид, имеющий некоторую степень поперечного сшивания. Используемый в настоящем документе термин «степень поперечного сшивания» относится к процентной доле мономерных звеньев анионного ГК-полисахарида, таких как, например, дисахаридные мономерные звенья ГК, которые связаны со сшивающим агентом. Степень поперечного сшивания выражается как массовое процентное соотношение сшивающего агента к анионной ГК. В некоторых вариантах осуществления коацерватные гидрогели по изобретению содержат сшитую анионную ГК со степенью поперечного сшивания от приблизительно 1 мас. % до приблизительно 15 мас. %, от приблизительно 1 мас. % до приблизительно 10 мас. %, от приблизительно 2 мас. % до приблизительно 10 мас. %, от приблизительно 3 мас. % до приблизительно 10 мас. % или от приблизительно 5 мас. % до приблизительно 10 мас. %. В других вариантах осуществления коацерватные гидрогели по изобретению содержат сшитую анионную ГК со степенью поперечного сшивания менее чем приблизительно 10%.
[00102] Аспекты настоящего описания частично предусматривают гидрогелевую композицию, содержащую несшитый анионный ГК-полисахарид. Используемый в настоящем документе термин «несшитый» относится к отсутствию межмолекулярных связей, соединяющих отдельные анионные полисахаридные молекулы или мономерные цепи. Таким образом, несшитый анионный ГК-полисахарид (включая несшитую ГК) не связан ни с каким другим анионным ГК-полисахаридом с помощью ковалентной межмолекулярной связи. В аспектах данного варианта осуществления композиция дермального филлера содержит несшитый анионный ГК-полисахарид, такой как несшитую ГК. В других аспектах дермальный филлер содержит коацерватный ГК-гидрогель, причем коацерватный комплекс содержит несшитый анионный ГК-полисахарид, такой как несшитая ГК.
[00103] Несшитые ГК-полисахариды растворимы в воде и по существу остаются по своей природе текучими. Таким образом, несшитые ГК-полисахариды можно смешивать с коацерватным гидрогелем на основе ГК-полисахарида в качестве смазывающего средства для облегчения процесса экструзии композиции через тонкую иглу.
[00104] В аспектах настоящего изобретения частично предложена гидрогелевая композиция, содержащая низкомолекулярные анионные ГК-полисахариды, высокомолекулярные анионные ГК-полисахариды или как низкомолекулярные, так и высокомолекулярные анионные ГК-полисахариды. Используемый в настоящем документе термин «высокомолекулярная» применительно к «анионной ГК» относится к анионным ГК-полисахаридам (включая ГК) со средней молекулярной массой 1 000 000 Да или выше. Не имеющими ограничительного характера примерами высокомолекулярных анионных ГК-полисахаридов (включая ГК) являются имеющие молекулярную массу приблизительно 1 500 000 Да, приблизительно 2 000 000 Да, приблизительно 2 500 000 Да, приблизительно 3 000 000 Да, приблизительно 3 500 000 Да, приблизительно 4 000 000 Да, приблизительно 4 500 000 Да или приблизительно 5 000 000 Да. Используемый в настоящем документе термин «низкомолекулярная» применительно к «анионной ГК» относится к анионным ГК-полисахаридам (включая ГК) со средней молекулярной массой менее 1 000 000 Да. Не имеющими ограничительного характера примерами низкомолекулярных анионных ГК-полисахаридов (таких как ГК) являются имеющие молекулярную массу приблизительно 100 000 Да, приблизительно 200 000 Да, приблизительно 300 000 Да, приблизительно 400 000 Да, приблизительно 500 000 Да, приблизительно 600 000 Да, приблизительно 700 000 Да, приблизительно 800 000 Да или приблизительно 900 000 Да.
[00105] В одном варианте осуществления композиция дермального филлера содержит несшитые низкомолекулярные анионные ГК-полисахариды или содержит сшитые анионные ГК-полисахариды, полученные из несшитой низкомолекулярной анионной ГК, причем несшитая низкомолекулярная анионная ГК имеет среднюю молекулярную массу, например, приблизительно 100 000 Да, приблизительно 200 000 Да, приблизительно 300 000 Да, приблизительно 400 000 Да, приблизительно 500 000 Да, приблизительно 600 000 Да, приблизительно 700 000 Да, приблизительно 800 000 Да или приблизительно 900 000 Да. В других аспектах настоящего варианта осуществления несшитая низкомолекулярная анионная ГК имеет среднюю молекулярную массу, например, не более 100 000 Да, не более 200 000 Да, не более 300 000 Да, не более 400 000 Да, не более 500 000 Да, не более 600 000 Да, не более 700 000 Да, не более 800 000 Да или не более 900 000 Да или не более 950 000 Да. В других аспектах данного варианта осуществления несшитая низкомолекулярная ГК имеет среднюю молекулярную массу, например, от приблизительно 100 000 Да до приблизительно 500 000 Да, от приблизительно 200 000 Да до приблизительно 500 000 Да, от приблизительно 300 000 Да до приблизительно 500 000 Да, от приблизительно 400 000 Да до приблизительно 500 000 Да, от приблизительно 500 000 Да до приблизительно 950 000 Да, от приблизительно 600 000 Да до приблизительно 950 000 Да, от приблизительно 700 000 Да до приблизительно 950 000 Да, от приблизительно 800 000 Да до приблизительно 950 000 Да, от приблизительно 300 000 Да до приблизительно 600 000 Да, от приблизительно 300 000 Да до приблизительно 700 000 Да, от приблизительно 300 000 Да до приблизительно 800 000 Да, от приблизительно 400 000 Да до приблизительно 700 000 Да.
[00106] В другом варианте осуществления композиция содержит несшитые высокомолекулярные анионные ГК-полисахариды (такие как несшитая ГК) или содержит сшитые анионные ГК-полисахариды, полученные из несшитой высокомолекулярной ГК, причем несшитая высокомолекулярная анионная ГК имеет среднюю молекулярную массу, например, приблизительно 1 000 000 Да, приблизительно 1 500 000 Да, приблизительно 2 000 000 Да, приблизительно 2 500 000 Да, приблизительно 3 000 000 Да, приблизительно 3 500 000 Да, приблизительно 4 000 000 Да, приблизительно 4 500 000 Да или приблизительно 5 000 000 Да. В других аспектах данного варианта осуществления несшитая высокомолекулярная анионная ГК имеет среднюю молекулярную массу, например, по меньшей мере 1 000 000 Да, по меньшей мере 1 500 000 Да, по меньшей мере 2 000 000 Да, по меньшей мере 2 500 000 Да, по меньшей мере 3 000 000 Да, по меньшей мере 3 500 000 Да, по меньшей мере 4 000 000 Да, по меньшей мере 4 500 000 Да или по меньшей мере 5 000 000 Да. В других аспектах данного варианта осуществления несшитая высокомолекулярная анионная ГК имеет среднюю молекулярную массу, например, от приблизительно 1 000 000 Да до приблизительно 5 000 000 Да, от приблизительно 1 500 000 Да до приблизительно 5 000 000 Да, от приблизительно 2 000 000 Да до приблизительно 5 000 000 Да, от приблизительно 2 500 000 Да до приблизительно 5 000 000 Да, от приблизительно 2 000 000 Да до приблизительно 3 000 000 Да, от приблизительно 2 500 000 Да до приблизительно 3 500 000 Да или от приблизительно 2 000 000 Да до приблизительно 4 000 000 Да. В других аспектах несшитая высокомолекулярная анионная ГК имеет среднюю молекулярную массу, например, более чем 2 000 000 Да и менее чем приблизительно 3 000 000 Да, более чем 2 000 000 Да и менее чем приблизительно 3 500 000 Да, более чем 2 000 000 Да и менее чем приблизительно 4 000 000 Да, более чем 2 000 000 Да и менее чем приблизительно 4 500 000 Да, более чем 2 000 000 Да и менее чем приблизительно 5 000 000 Да.
[00107] В другом варианте осуществления дермальный филлер содержит комбинацию как высокомолекулярных анионных ГК-полисахаридов, так и низкомолекулярных анионных ГК-полисахаридов в различных соотношениях; например, соотношение высокомолекулярной анионной ГК и низкомолекулярной анионной ГК может составлять приблизительно 20 : 1, приблизительно 15 : 1, приблизительно 10 : 1, приблизительно 5 : 1, приблизительно 1 : 1, приблизительно 1 : 5, приблизительно 1 : 10, приблизительно 1 : 15 или приблизительно 1 : 20. В некоторых вариантах осуществления высокомолекулярный анионный ГК-полисахарид сшит с низкомолекулярным анионным ГК-полисахаридом в вышеуказанных соотношениях.
[00108] В некоторых вариантах осуществления катионный полисахарид коацерватного гидрогеля присутствует в количестве, достаточном для улучшения состояния кожи, описанного в настоящем документе. В других аспектах настоящего варианта осуществления композиция содержит катионный полисахарид, составляющий, например, приблизительно 1% по массе, приблизительно 2% по массе, приблизительно 3% по массе, приблизительно 4% по массе, приблизительно 5% по массе, приблизительно 6% по массе, приблизительно 7% по массе, приблизительно 8% по массе, приблизительно 9% по массе, приблизительно 10% по массе от всей композиции. В других аспектах данного варианта осуществления композиция содержит катионный полисахарид, который составляет, например, не более 1% по массе, не более 2% по массе, не более 3% по массе, не более 4% по массе, не более 5% по массе, не более 6% по массе, не более 7% по массе, не более 8% по массе, не более 9% по массе, не более 10% по массе от всей композиции. В других аспектах данного варианта осуществления композиция содержит катионный полисахарид, который составляет, например, от приблизительно 0,5% до приблизительно 20% по массе, от приблизительно 1% до приблизительно 17% по массе, от приблизительно 3% до приблизительно 15% по массе, от приблизительно 5% по массе до приблизительно 10% по массе, например, приблизительно 11% по массе, приблизительно 15% по массе или приблизительно 17% по массе от всей композиции.
[00109] В аспектах данного варианта осуществления гидрогелевая композиция содержит катионный полисахарид, который присутствует в концентрации, например, приблизительно 2 мг/г, приблизительно 3 мг/г, приблизительно 4 мг/г, приблизительно 5 мг/г, приблизительно 6 мг/г, приблизительно 7 мг/г, приблизительно 8 мг/г, приблизительно 9 мг/г, приблизительно 10 мг/г, приблизительно 11 мг/г, приблизительно 12 мг/г, приблизительно 13 мг/г, приблизительно 13,5 мг/г, приблизительно 14 мг/г, приблизительно 15 мг/г, приблизительно 16 мг/г, приблизительно 17 мг/г, приблизительно 18 мг/г, приблизительно 19 мг/г или приблизительно 20 мг/г. В других аспектах данного варианта осуществления композиция содержит катионный полисахарид, который присутствует в концентрации, например, по меньшей мере 1 мг/г, по меньшей мере 2 мг/г, по меньшей мере 3 мг/г, по меньшей мере 4 мг/г, по меньшей мере 5 мг/г, по меньшей мере 10 мг/г, по меньшей мере 15 мг/г, по меньшей мере 20 мг/г, по меньшей мере 25 мг/г или по меньшей мере 40 мг/г. В других аспектах данного варианта осуществления композиция содержит катионный полисахарид, который присутствует в концентрации, например, не более 1 мг/г, не более 2 мг/г, не более 3 мг/г, не более 4 мг/г, не более 5 мг/г, не более 10 мг/г, не более 15 мг/г, не более 20 мг/г, не более 25 мг/г или не более 40 мг/г. В других аспектах данного варианта осуществления композиция содержит катионный полисахарид, который присутствует в концентрации, например, от приблизительно 7,5 мг/г до приблизительно 19,5 мг/г, от приблизительно 8,5 мг/г до приблизительно 18,5 мг/г, от приблизительно 9,5 мг/г до приблизительно 17,5 мг/г, от приблизительно 10,5 мг/г до приблизительно 16,5 мг/г или от приблизительно 11,5 мг/г до приблизительно 15,5 мг/г, или от приблизительно 12,5 мг/г до приблизительно 14,5 мг/г или до приблизительно 40 мг/г.
[00110] В аспектах настоящего описания частично предложена гидрогелевая композиция, содержащая сшитый катионный полисахарид, имеющий некоторую степень поперечного сшивания. Используемый в настоящем документе термин «степень поперечного сшивания» относится к процентной доле мономерных звеньев катионного полисахарида, таких как, например, дисахаридные мономерные звенья катионного полисахарида, которые связаны со сшивающим агентом. Степень поперечного сшивания выражается как массовое процентное соотношение сшивающего агента к катионной ГК. В некоторых вариантах осуществления коацерватные гидрогели по изобретению содержат сшитый катионный полисахарид со степенью поперечного сшивания от приблизительно 1 мас. % до приблизительно 15 мас. %, от приблизительно 1 мас. % до приблизительно 10 мас. %, от приблизительно 2 мас. % до приблизительно 10 мас. %, от приблизительно 3 мас. % до приблизительно 10 мас. % или от приблизительно 5 мас. % до приблизительно 10 мас. %. В других вариантах осуществления коацерватные гидрогели по изобретению содержат катионный полисахарид со степенью поперечного сшивания менее чем приблизительно 10%.
[00111] Аспекты настоящего описания частично предусматривают гидрогелевую композицию, содержащую несшитый катионный полисахарид. Используемый в настоящем документе термин «несшитый» относится к отсутствию межмолекулярных связей, соединяющих отдельные катионные полисахаридные молекулы или мономерные цепи. Таким образом, несшитый катионный полисахарид не связан ни с каким другим катионным полисахаридом с помощью ковалентной межмолекулярной связи. В аспектах данного варианта осуществления композиция дермального филлера содержит несшитый катионный полисахарид. В других аспектах дермальный филлер содержит коацерватный ГК-гидрогель, причем коацерватный комплекс содержит несшитый катионный полисахарид.
[00112] В аспектах настоящего изобретения частично предложена гидрогелевая композиция, содержащая низкомолекулярные катионные полисахариды, высокомолекулярные катионные полисахариды или как низкомолекулярные, так и высокомолекулярные катионные полисахариды. Используемый в настоящем документе термин «высокомолекулярные» применительно к «катионным полисахаридам» относится к катионным полисахаридам, имеющим среднюю молекулярную массу 1 000 000 Да или выше. Не имеющими ограничительного характера примерами высокомолекулярных катионных полисахаридов являются имеющие молекулярную массу приблизительно 1 500 000 Да, приблизительно 2 000 000 Да, приблизительно 2 500 000 Да, приблизительно 3 000 000 Да, приблизительно 3 500 000 Да, приблизительно 4 000 000 Да, приблизительно 4 500 000 Да и приблизительно 5 000 000 Да. Используемый в настоящем документе термин «низкомолекулярные» применительно к «катионным полисахаридам» относится к катионным полисахаридам со средней молекулярной массой менее 1 000 000 Да. Не имеющими ограничительного характера примерами низкомолекулярных катионных полисахаридов являются имеющие молекулярную массу приблизительно 100 000 Да, приблизительно 200 000 Да, приблизительно 300 000 Да, приблизительно 400 000 Да, приблизительно 500 000 Да, приблизительно 600 000 Да, приблизительно 700 000 Да, приблизительно 800 000 Да и приблизительно 900 000 Да.
[00113] В одном варианте осуществления композиция дермального филлера содержит несшитые низкомолекулярные катионные полисахариды или сшитые катионные полисахариды, полученные из несшитых низкомолекулярных катионных полисахаридов, причем средняя молекулярная масса несшитого низкомолекулярного катионного полисахарида составляет, например, приблизительно 100 000 Да, приблизительно 200 000 Да, приблизительно 300 000 Да, приблизительно 400 000 Да, 500 000 Да, приблизительно 600 000 Да, приблизительно 700 000 Да, приблизительно 800 000 Да или приблизительно 900 000 Да. В других аспектах настоящего варианта осуществления несшитый низкомолекулярный катионный полисахарид имеет среднюю молекулярную массу, например, не более 100 000 Да, не более 200 000 Да, не более 300 000 Да, не более 400 000 Да, не более 500 000 Да, не более 600 000 Да, не более 700 000 Да, не более 800 000 Да, или не более 900 000 Да, или не более 950 000 Да. В других аспектах данного варианта осуществления несшитый низкомолекулярный катионный полисахарид имеет среднюю молекулярную массу, например, от приблизительно 100 000 Да до приблизительно 500 000 Да, от приблизительно 200 000 Да до приблизительно 500 000 Да, от приблизительно 300 000 Да до приблизительно 500 000 Да, от приблизительно 400 000 Да до приблизительно 500 000 Да, от приблизительно 500 000 Да до приблизительно 950 000 Да, от приблизительно 600 000 Да до приблизительно 950 000 Да, от приблизительно 700 000 Да до приблизительно 950 000 Да, от приблизительно 800 000 Да до приблизительно 950 000 Да, от приблизительно 300 000 Да до приблизительно 600 000 Да, от приблизительно 300 000 Да до приблизительно 700 000 Да, от приблизительно 300 000 Да до приблизительно 800 000 Да или от приблизительно 400 000 Да до приблизительно 700 000 Да.
[00114] В другом варианте осуществления композиция содержит несшитые высокомолекулярные катионные полисахариды или сшитые катионные полисахариды, полученные из несшитых высокомолекулярных катионных полисахаридов, причем средняя молекулярная масса несшитого высокомолекулярного катионного полисахарида составляет, например, приблизительно 1 000 000 Да, приблизительно 1 500 000 Да, приблизительно 2 000 000 Да, приблизительно 2 500 000 Да, 3 000 000 Да, приблизительно 3 500 000 Да, приблизительно 4 000 000 Да, приблизительно 4 500 000 Да или приблизительно 5 000 000 Да. В других аспектах данного варианта осуществления несшитый высокомолекулярный катионный полисахарид имеет среднюю молекулярную массу, например, по меньшей мере 1 000 000 Да, по меньшей мере 1 500 000 Да, по меньшей мере 2 000 000 Да, по меньшей мере 2 500 000 Да, по меньшей мере 3 000 000 Да, по меньшей мере 3 500 000 Да, по меньшей мере 4 000 000 Да, по меньшей мере 4 500 000 Да или по меньшей мере 5 000 000 Да. В других аспектах данного варианта осуществления несшитый высокомолекулярный катионный полисахарид имеет среднюю молекулярную массу, например, от приблизительно 1 000 000 Да до приблизительно 5 000 000 Да, от приблизительно 1 500 000 Да до приблизительно 5 000 000 Да, от приблизительно 2 000 000 Да до приблизительно 5 000 000 Да, от приблизительно 2 500 000 Да до приблизительно 5 000 000 Да, от приблизительно 2 000 000 Да до приблизительно 3 000 000 Да, от приблизительно 2 500 000 Да до приблизительно 3 500 000 Да или от приблизительно 2 000 000 Да до приблизительно 4 000 000 Да. В других аспектах несшитый высокомолекулярный катионный полисахарид имеет среднюю молекулярную массу, например, более чем 2 000 000 Да и менее чем приблизительно 3 000 000 Да, более чем 2 000 000 Да и менее чем приблизительно 3 500 000 Да, более чем 2 000 000 Да и менее чем приблизительно 4 000 000 Да, более чем 2 000 000 Да и менее чем приблизительно 4 500 000 Да, более чем 2 000 000 Да и менее чем приблизительно 5 000 000 Да.
[00115] В другом варианте осуществления дермальный филлер содержит комбинацию как высокомолекулярных катионных полисахаридов, так и низкомолекулярных катионных полисахаридов в различных соотношениях. В аспектах данного варианта осуществления дермальный филлер содержит комбинацию как высокомолекулярных, так и низкомолекулярных катионных полисахаридов в соотношении приблизительно 20 : 1, приблизительно 15 : 1, приблизительно 10 : 1, приблизительно 5 : 1, приблизительно 1 : 1, приблизительно 1 : 5, приблизительно 1 : 10, приблизительно 1 : 15 или приблизительно 1 : 20. В некоторых вариантах осуществления высокомолекулярный катионный полисахарид сшивают с низкомолекулярным катионным полисахаридом в вышеуказанных соотношениях.
[00116] Композиция дермального филлера или коацерватного ГК-гидрогеля, описанная в настоящем документе, может дополнительно содержать другой агент или комбинацию агентов, которые обеспечивают благоприятный эффект при введении композиции индивиду. Такие полезные агенты включают в себя, без ограничений, косметические агенты или другие ингредиенты. Не имеющие ограничительного характера примеры таких благоприятных агентов включают в себя антиоксидант, противозудный агент, антицеллюлитный агент, агент против образования шрамов, противовоспалительный агент, анестезирующий агент, агент против раздражения, отшелушивающий агент, натягивающий агент, агент против акне, агент для осветления кожи, агент для пигментации кожи, агент против пигментации, увлажняющий агент или витамин. В некоторых вариантах осуществления агент добавляется и захватывается в коацерват без модификации агента, и таким образом обеспечивается способ медленного высвобождения и доставки агента. Значительным преимуществом данного подхода является то, что он внедряет полезные агенты, но не сшивает их со сложным ГК-гелевым комплексом, так что компоненты могут захватываться в исходном состоянии с регулируемой скоростью высвобождения, определяемой плотностью, скоростью диффузии, скоростью разложения и/или реологическими свойствами коацерватного ГК-геля. В некоторых вариантах осуществления агент вступает в ионные или электростатические взаимодействия с одним или более полисахаридами коацерватного ГК-гидрогеля. В некоторых вариантах осуществления высвобождение агента контролируется ионными или электростатическими взаимодействиями между агентом и одним или более из коацерватных ГК-полисахаридов. В дополнительном варианте осуществления коацерватный ГК-комплекс рассчитан на более быстрое или на более медленное высвобождение агента; например, количество, природу и/или значения pKa полисахаридов коацерватного ГК-комплекса можно регулировать для более быстрого или более медленного высвобождения агента. Профиль высвобождения может составлять дни, недели, месяцы или даже более продолжительные периоды для достижения желаемых преимуществ.
[00117] В аспектах настоящего описания частично предложена композиция дермального филлера, которая может необязательно содержать анестезирующий агент или его соль. Анестезирующий агент предпочтительно представляет собой местный анестезирующий агент, т. е. анестезирующий агент, который вызывает обратимую местную анестезию и утрату болевой чувствительности, такой как, например, местные аминоамидные анестетики и местные аминоэфирные анестетики. Количество анестезирующего агента, включенного в композицию, описанную в настоящем документе, представляет собой количество, эффективное для уменьшения боли, испытываемой индивидом при введении композиции дермального филлера. Таким образом, количество анестезирующего агента, включенного в состав дермального филлера, описанного в настоящем документе, составляет от приблизительно 0,1% до приблизительно 5% от общей массы композиции. К не имеющим ограничительного характера примерам анестезирующих агентов относятся лидокаин, амбукаин, амоланон, амилокаин, беноксинат, бензокаин, бетоксикаин, бифенамин, бупивакаин, бутакаин, бутамбен, бутаниликаин, бутетамин, бутоксикаин, картикаин, хлоропрокаин, кокаэтилен, кокаин, циклометикаин, дибукаин, диметизоквин, диметокаин, диперодон, дициклонин, экгонидин, экгонин, этилхлорид, этидокаин, бета-эукаин, эупроцин, феналкомин, формокаин, гексилкаин, гидрокситетракаин, изобутила п-аминобензоат, лейцинокаина мезилат, левоксадрол, лидокаин, мепивакаин, меприлкаин, метабутоксикаин, метилхлорид, миртекаин, наепаин, октакаин, ортокаин, оксетазаин, парэтоксикаин, фенакаин, фенол, пиперокаин, пиридокаин, полидоканол, прамоксин, прилокаин, прокаин, пропанокаин, пропаракаин, пропипокаин, пропоксикаин, псевдококаин, пиррокаин, ропивакаин, салициловый спирт, тетракаин, толикаин, тримекаин, золамин, их комбинации и их соли. К не имеющим ограничительного характера примерам местных аминоэфирных анестетиков относятся прокаин, хлорпрокаин, кокаин, циклометикаин, циметокаин (ларокаин), пропоксикаин, прокаин (новокаин), пропаракаин, тетракаин (аметокаин). К не имеющим ограничительного характера примерам местных аминоамидных анестетиков относятся артикаин, бупивакаин, цикохаин (дибукаин), этидокаин, левобупивакаин, лидокаин (лигнокаин), мепивакаин, пиперокаин, прилокаин, ропивакаин и тримекаин. Композиция, описанная в настоящем документе, может содержать один анестезирующий агент или множество анестезирующих агентов. Не имеющим ограничительного характера примером комбинации местных анестетиков является лидокаин/прилокаин (EMLA).
[00118] В других аспектах данного варианта осуществления описанная в настоящем документе композиция дермального филлера содержит анестезирующий агент в количестве, например, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0%, приблизительно 5,0%, приблизительно 6,0%, приблизительно 7,0%, приблизительно 8,0%, приблизительно 9,0% или приблизительно 10% от общей массы композиции. В других аспектах композиция, описанная в настоящем документе, содержит анестезирующий агент в количестве, например, по меньшей мере 0,1%, по меньшей мере 0,2%, по меньшей мере 0,3%, по меньшей мере 0,4%, по меньшей мере 0,5%, по меньшей мере 0,6%, по меньшей мере 0,7%, по меньшей мере 0,8%, по меньшей мере 0,9%, по меньшей мере 1,0%, по меньшей мере 2,0%, по меньшей мере 3,0%, по меньшей мере 4,0%, по меньшей мере 5,0%, по меньшей мере 6,0%, по меньшей мере 7,0%, по меньшей мере 8,0%, по меньшей мере 9,0% или по меньшей мере 10% от общей массы композиции. В других аспектах композиция дермального филлера, описанная в настоящем документе, содержит анестезирующий агент в количестве, например, не более 0,1%, не более 0,2%, не более 0,3%, не более 0,4%, не более 0,5%, не более 0,6%, не более 0,7%, не более 0,8%, не более 0,9%, не более 1,0%, не более 2,0%, не более 3,0%, не более 4,0%, не более 5,0%, не более 6,0%, не более 7,0%, не более 8,0%, не более 9,0%, не более 10% от общей массы композиции. В дополнительных аспектах композиция дермального филлера, описанная в настоящем документе, содержит анестезирующий агент в количестве, например, от приблизительно 0,1% до приблизительно 0,5%, от приблизительно 0,1% до приблизительно 1,0%, от приблизительно 0,1% до приблизительно 2,0%, от приблизительно 0,1% до приблизительно 3,0%, от приблизительно 0,1% до приблизительно 4,0%, от приблизительно 0,1% до приблизительно 5,0%, от приблизительно 0,2% до приблизительно 0,9%, от приблизительно 0,2% до приблизительно 1,0%, от приблизительно 0,2% до приблизительно 2,0%, от приблизительно 0,5% до приблизительно 1,0%, от приблизительно 0,5% до приблизительно 2,0% от общей массы композиции.
[00119] В другом варианте осуществления описанный в настоящем документе дермальный филлер не содержит анестезирующего агента.
[00120] В аспектах настоящего описания частично предложена композиция коацерватного ГК-гидрогеля, которая демонстрирует комплексный модуль, модуль упругости, модуль вязкости и/или тангенс угла потерь tan δ. Композиции, описанные в настоящем документе, являются вязкоупругими в том смысле, что композиция имеет эластичный компонент (подобие твердому веществу, например, сшитые анионные или катионные ГК-полисахариды) и вязкий компонент (подобие жидкому веществу, например, несшитые ГК-полисахариды или фаза-носитель) при приложении к ним усилия (напряжения, деформации). Реологический параметр, описывающий это свойство, представляет собой комплексный модуль (G*), который определяет общую стойкость композиции к деформации. Комплексный модуль представляет собой комплексное число с реальной и мнимой частью: G* = G' + iG". Абсолютное значение G* равно Abs(G*) = Sqrt(G'2 + G"2). Комплексный модуль может быть определен как сумма модуля упругости (G') и модуля вязкости (G"). Falcone, et al., Temporary Polysaccharide Dermal Fillers: A Model for Persistence Based on Physical Properties, Dermatol Surg. 35(8): 1238–1243 (2009), полностью включено в настоящий документ путем ссылки.
[00121] Модуль упругости или модуль эластичности относится к способности гидрогелевого материала противостоять деформации или наоборот — к склонности объекта к обратимой деформации при приложении к нему усилия. Модуль упругости характеризует твердость композиции и он также известен как модуль накопления, поскольку описывает сохранение энергии от движения композиции. Модуль упругости описывает взаимодействие между эластичностью и прочностью (G’ = напряжение / деформация) и, таким образом, обеспечивает количественную меру твердости или мягкости композиции. Модуль упругости объекта определяется как наклон кривой напряжение-деформация в области эластической деформации: λ = напряжение / натяжение, где λ представляет собой модуль упругости в Паскалях; напряжение представляет собой силу, вызывающую деформацию, поделенную на площадь, к которой прилагается усилие; а деформация представляет собой отношение изменения, вызванного напряжением, к исходному состоянию объекта. Хотя это и зависит от скорости приложения силы, более жесткая композиция будет иметь более высокий модуль упругости, и для деформации материала на заданное расстояние, например, для инъекции, потребуется большее усилие. Указание способов измерения напряжений, включая направления, позволяет определить множество типов модулей упругости. Три основных модуля упругости представляют собой модуль упругости при растяжении, модуль упругости при сдвиге и модуль упругости при объемной деформации.
[00122] Модуль вязкости также известен как модуль потерь, поскольку он описывает энергию, которая теряется при вязком рассеянии. Tan δ представляет собой отношение модуля вязкости и модуля упругости tan δ = G" / G'. Falcone, выше, 2009. В случае значений tan δ, представленных в настоящем описании, tan δ получают из динамического модуля с частотой 1 Гц. Более низкое значение tan δ соответствует более жесткой, твердой или более эластичной композиции.
[00123] В другом варианте осуществления композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, демонстрирует модуль упругости, например, приблизительно 25 Па, приблизительно 50 Па, приблизительно 75 Па, приблизительно 100 Па, приблизительно 125 Па, приблизительно 150 Па, приблизительно 175 Па, приблизительно 200 Па, приблизительно 250 Па, приблизительно 300 Па, приблизительно 350 Па, приблизительно 400 Па, приблизительно 450 Па, приблизительно 500 Па, приблизительно 550 Па, приблизительно 600 Па, приблизительно 650 Па, приблизительно 700 Па, приблизительно 750 Па, приблизительно 800 Па, приблизительно 850 Па, приблизительно 900 Па, приблизительно 950 Па, приблизительно 1000 Па, приблизительно 1200 Па, приблизительно 1300 Па, приблизительно 1400 Па, приблизительно 1450 Па, приблизительно 1500 Па, приблизительно 1600 Па, приблизительно 1700 Па, приблизительно 1800 Па, приблизительно 1900 Па, приблизительно 2000 Па, приблизительно 2100 Па, приблизительно 2200 Па, приблизительно 2300 Па, приблизительно 2400 Па, приблизительно 2500 Па, приблизительно 3000 Па, приблизительно 4000 Па, приблизительно 5000 Па, приблизительно 6000 Па, приблизительно 7000 Па, приблизительно 8000 Па, приблизительно 9000 Па или приблизительно 10 000 Па. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует модуль упругости, например, по меньшей мере 25 Па, по меньшей мере 50 Па, по меньшей мере 75 Па, по меньшей мере 100 Па, по меньшей мере 125 Па, по меньшей мере 150 Па, по меньшей мере 175 Па, по меньшей мере 200 Па, по меньшей мере 250 Па, по меньшей мере 300 Па, по меньшей мере 350 Па, по меньшей мере 400 Па, по меньшей мере 450 Па, по меньшей мере 500 Па, по меньшей мере 550 Па, по меньшей мере 600 Па, по меньшей мере 650 Па, по меньшей мере 700 Па, по меньшей мере 750 Па, по меньшей мере 800 Па, по меньшей мере 850 Па, по меньшей мере 900 Па, по меньшей мере 950 Па, по меньшей мере 1000 Па, по меньшей мере 1200 Па, по меньшей мере 1300 Па, по меньшей мере 1400 Па, по меньшей мере 1500 Па, по меньшей мере 1600 Па, по меньшей мере 1700 Па, по меньшей мере 1800 Па, по меньшей мере 1900 Па, по меньшей мере 2000 Па, по меньшей мере 2100 Па, по меньшей мере 2200 Па, по меньшей мере 2300 Па, по меньшей мере 2400 Па или по меньшей мере 2500 Па. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует модуль упругости, например, не более 25 Па, не более 50 Па, не более 75 Па, не более 100 Па, не более 125 Па, не более 150 Па, не более 175 Па, не более 200 Па, не более 250 Па, не более 300 Па, не более 350 Па, не более 400 Па, не более 450 Па, не более 500 Па, не более 550 Па, не более 600 Па, не более 650 Па, не более 700 Па, не более 750 Па, не более 800 Па, не более 850 Па, не более 900 Па, не более 950 Па, не более 1000 Па, не более 1200 Па, не более 1300 Па, не более 1400 Па, не более 1500 Па или не более 1600 Па. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует модуль упругости, например, от приблизительно 25 Па до приблизительно 150 Па, от приблизительно 25 Па до приблизительно 300 Па, от приблизительно 25 Па до приблизительно 500 Па, от приблизительно 25 Па до приблизительно 800 Па, от приблизительно 125 Па до приблизительно 300 Па, от приблизительно 125 Па до приблизительно 500 Па, от приблизительно 125 Па до приблизительно 800 Па, от приблизительно 400 до приблизительно 1,600 Па, от приблизительно 500 Па до приблизительно 1600 Па, от приблизительно 600 Па до приблизительно 1600 Па, от приблизительно 700 Па до приблизительно 1600 Па, от приблизительно 800 Па до приблизительно 1600 Па, от приблизительно 900 Па до приблизительно 1600 Па, от приблизительно 1000 Па до приблизительно 1600 Па, от приблизительно 1100 Па до приблизительно 1600 Па, от приблизительно 1200 Па до приблизительно 1600 Па, от приблизительно 500 Па до приблизительно 2500 Па, от приблизительно 1000 Па до приблизительно 2500 Па, от приблизительно 1500 Па до приблизительно 2500 Па, от приблизительно 2000 Па до приблизительно 2500 Па, от приблизительно 1300 Па до приблизительно 1600 Па, от приблизительно 1400 Па до приблизительно 1700 Па, от приблизительно 1500 Па до приблизительно 1800 Па, от приблизительно 1600 Па до приблизительно 1900 Па, от приблизительно 1700 Па до приблизительно 2000 Па, от приблизительно 1800 Па до приблизительно 2100 Па, от приблизительно 1900 Па до приблизительно 2200 Па, от приблизительно 2000 Па до приблизительно 2300 Па, от приблизительно 2100 Па до приблизительно 2400 Па или от приблизительно 2200 Па до приблизительно 2500 Па. В других аспектах предложена гидрогелевая композиция, демонстрирующая модуль упругости, например, от приблизительно 50 Па до приблизительно 5000 Па, от приблизительно 100 Па до приблизительно 5000 Па, от приблизительно 100 до приблизительно 4000 Па, от приблизительно 100 до приблизительно 3 000 Па, от приблизительно 100 до приблизительно 2000 Па или от приблизительно 100 до приблизительно 1000 Па или приблизительно 500 Па. В других аспектах предложена гидрогелевая композиция, имеющая модуль упругости, например, от приблизительно 20 Па до приблизительно 3000 Па, от приблизительно 20 Па до приблизительно 2000 Па, от приблизительно 20 до приблизительно 1000 Па, от приблизительно 50 до приблизительно 3000 Па, от приблизительно 50 до приблизительно 2000 Па или от приблизительно 50 до приблизительно 1000 Па.
[00124] В дополнительном варианте осуществления гидрогелевая композиция, описанная в настоящем документе, демонстрирует высокий модуль упругости (высокий модуль накопления (G')), например, по меньшей мере приблизительно 500 Па.
[00125] В другом варианте осуществления композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, демонстрирует модуль вязкости. В аспектах настоящего варианта осуществления гидрогелевая композиция демонстрирует модуль вязкости, например, приблизительно 10 Па, приблизительно 20 Па, приблизительно 30 Па, приблизительно 40 Па, приблизительно 50 Па, приблизительно 60 Па, приблизительно 70 Па, приблизительно 80 Па, приблизительно 90 Па, приблизительно 100 Па, приблизительно 150 Па, приблизительно 200 Па, приблизительно 250 Па, приблизительно 300 Па, приблизительно 350 Па, приблизительно 400 Па, приблизительно 450 Па, приблизительно 500 Па, приблизительно 550 Па, приблизительно 600 Па, приблизительно 650 Па или приблизительно 700 Па. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует модуль вязкости, например, не более 10 Па, не более 20 Па, не более 30 Па, не более 40 Па, не более 50 Па, не более 60 Па, не более 70 Па, не более 80 Па, не более 90 Па, не более 100 Па, не более 150 Па, не более 200 Па, не более 250 Па, не более 300 Па, не более 350 Па, не более 400 Па, не более 450 Па, не более 500 Па, не более 550 Па, не более 600 Па, не более 650 Па или не более 700 Па. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует модуль вязкости, например, от приблизительно 10 Па до приблизительно 30 Па, от приблизительно 10 Па до приблизительно 50 Па, от приблизительно 10 Па до приблизительно 100 Па, от приблизительно 10 Па до приблизительно 150 Па, от приблизительно 70 Па до приблизительно 100 Па, от приблизительно 50 Па до приблизительно 350 Па, от приблизительно 150 Па до приблизительно 450 Па, от приблизительно 250 Па до приблизительно 550 Па, от приблизительно 350 Па до приблизительно 700 Па, от приблизительно 50 Па до приблизительно 150 Па, от приблизительно 100 Па до приблизительно 200 Па, от приблизительно 150 Па до приблизительно 250 Па, от приблизительно 200 Па до приблизительно 300 Па, от приблизительно 250 Па до приблизительно 350 Па, от приблизительно 300 Па до приблизительно 400 Па, от приблизительно 350 Па до приблизительно 450 Па, от приблизительно 400 Па до приблизительно 500 Па, от приблизительно 450 Па до приблизительно 550 Па, от приблизительно 500 Па до приблизительно 600 Па, от приблизительно 550 Па до приблизительно 650 Па, от приблизительно 600 Па до приблизительно 700 Па.
[00126] В другом варианте осуществления композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, демонстрирует tan δ. В дополнительном варианте осуществления гидрогелевая композиция демонстрирует tan δ, например, приблизительно 0,1, приблизительно 0,2, приблизительно 0,3, приблизительно 0,4, приблизительно 0,5, приблизительно 0,6, приблизительно 0,7, приблизительно 0,8, приблизительно 0,9, приблизительно 1,0, приблизительно 1,1, приблизительно 1,2, приблизительно 1,3, приблизительно 1,4, приблизительно 1,5, приблизительно 1,6, приблизительно 1,7, приблизительно 1,8, приблизительно 1,9, приблизительно 2,0, приблизительно 2,1, приблизительно 2,2, приблизительно 2,3, приблизительно 2,4 или приблизительно 2,5. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует tan δ, например, не более чем 0,1, не более чем 0,2, не более чем 0,3, не более чем 0,4, не более чем 0,5, не более чем 0,6, не более чем 0,7, не более чем 0,8, не более чем 0,9, не более чем 1,0, не более чем 1,1, не более чем 1,2, не более чем 1,3, не более чем 1,4, не более чем 1,5, не более чем 1,6, не более чем 1,7, не более чем 1,8, не более чем 1,9, не более чем 2,0, не более чем 2,1, не более чем 2,2, не более чем 2,3, не более чем 2,4 или не более чем 2,5. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует tan δ, например, от приблизительно 0,1 до приблизительно 0,3, от приблизительно 0,3 до приблизительно 0,5, от приблизительно 0,5 до приблизительно 0,8, от приблизительно 1,1 до приблизительно 1,4, от приблизительно 1,4 до приблизительно 1,7, от приблизительно 0,3 до приблизительно 0,6, от приблизительно 0,1 до приблизительно 0,5, от приблизительно 0,5 до приблизительно 0,9, от приблизительно 0,1 до приблизительно 0,6, от приблизительно 0,1 до приблизительно 1,0, от приблизительно 0,5 до приблизительно 1,5, от приблизительно 1,0 до приблизительно 2,0 или от приблизительно 1,5 до приблизительно 2,5.
[00127] Композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, может быть дополнительно обработана путем распыления гидрогеля в виде частиц и необязательно смешана с несущей фазой, такой как фармацевтически приемлемый носитель, такой как, например, вода, солевой раствор (включая PBS), глицерин и/или несшитая ГК, с образованием пригодного для инъекций или местного нанесения вещества, такого как раствор, масло, лосьон, гель, мазь, крем, суспензия, бальзам или паста. Таким образом, описанные композиции коацерватных ГК-гидрогелей могут быть однофазными или многофазными композициями. Коацерватный ГК-гидрогель может быть размолот до размера частиц от приблизительно 10 мкм до приблизительно 1000 мкм в диаметре, например, от приблизительно 15 мкм до приблизительно 30 мкм, от приблизительно 50 мкм до приблизительно 75 мкм, от приблизительно 100 мкм до приблизительно 150 мкм, от приблизительно 200 мкм до приблизительно 300 мкм, от приблизительно 450 мкм до приблизительно 550 мкм, от приблизительно 600 мкм до приблизительно 700 мкм, от приблизительно 750 мкм до приблизительно 850 мкм или от приблизительно 900 мкм до приблизительно 1000 мкм. Частицы могут быть подвергнуты дополнительной обработке путем гомогенизации или размерной оптимизации на мелкопористом сите.
[00128] В аспектах настоящего описания частично предложена композиция, описанная в настоящем документе, которая является пригодной для инъекций. Используемый в настоящем документе термин «пригодный для инъекций» относится к материалу, обладающему свойствами, необходимыми для введения композиции в кожу индивида или другую мягкую ткань с применением инъекционного устройства с иглой, например, тонкой иглой. Используемый в настоящем документе термин «тонкая игла» относится к игле 27 калибра или более (при этом более высокий калибр означает меньший наружный диаметр). Пригодность для инъекций композиции, описанной в настоящем документе, может быть достигнута путем размерной оптимизации гидрогелевых частиц, как описано выше. В некоторых вариантах осуществления пригодность композиции для инъекций может быть достигнута без дополнительной обработки гидрогеля путем гомогенизации или размерной оптимизации через мелкопористое сито.
[00129] В аспекте данного варианта осуществления описанную в настоящем документе композицию коацерватного ГК-гидрогеля можно вводить через тонкую иглу. В других аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию можно вводить через иглу, например, 18 калибра, 19 калибра, 20 калибра, 21 калибра, 22 калибра, 23 калибра, 24 калибра, 25 калибра, 26 калибра, 27 калибра, 28 калибра, 29 калибра, 30 калибра, 31 калибра или 32 калибра. В других аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию можно вводить через иглу, например, по меньшей мере 21 калибра, по меньшей мере 25 калибра, по меньшей мере 27 калибра, по меньшей мере 30 калибра или по меньшей мере 32 калибра. В других аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию можно вводить через иглу, например, от 18 калибра до 35 калибра, от 18 калибра до 25 калибра, от 21 калибра до 35 калибра, от 21 калибра до 34 калибра, от 21 калибра до 33 калибра, от 21 калибра до 32 калибра, от 21 калибра до 27 калибра или от 27 калибра до 32 калибра.
[00130] В аспектах данного варианта осуществления композицию коацерватного ГК-гидрогеля, описанную в настоящем документе, можно вводить путем инъекции с усилием экструзии приблизительно 60 Н, приблизительно 55 Н, приблизительно 50 Н, приблизительно 45 Н, приблизительно 40 Н, приблизительно 35 Н, приблизительно 30 Н, приблизительно 25 Н, приблизительно 20 Н или приблизительно 15 Н при скоростях 100 мм/мин. В других аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию можно вводить путем инъекции через иглу 27 калибра с усилием экструзии приблизительно 60 Н или менее, приблизительно 55 Н или менее, приблизительно 50 Н или менее, приблизительно 45 Н или менее, приблизительно 40 Н или менее, приблизительно 35 Н или менее, приблизительно 30 Н или менее, приблизительно 25 Н или менее, приблизительно 20 Н или менее, приблизительно 15 Н или менее, приблизительно 10 Н или менее или приблизительно 5 Н или менее. В других дополнительных аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию можно вводить путем инъекции через иглу 30 калибра с усилием экструзии приблизительно 60 Н или менее, приблизительно 55 Н или менее, приблизительно 50 Н или менее, приблизительно 45 Н или менее, приблизительно 40 Н или менее, приблизительно 35 Н или менее, приблизительно 30 Н или менее, приблизительно 25 Н или менее, приблизительно 20 Н или менее, приблизительно 15 Н или менее, приблизительно 10 Н или менее или приблизительно 5 Н или менее. В других дополнительных аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию можно вводить путем инъекции через иглу 32 калибра с усилием экструзии приблизительно 60 Н или менее, приблизительно 55 Н или менее, приблизительно 50 Н или менее, приблизительно 45 Н или менее, приблизительно 40 Н или менее, приблизительно 35 Н или менее, приблизительно 30 Н или менее, приблизительно 25 Н или менее, приблизительно 20 Н или менее, приблизительно 15 Н или менее, приблизительно 10 Н или менее или приблизительно 5 Н или менее.
[00131] В аспектах настоящего изобретения частично предусмотрена гидрогелевая композиция, описанная в настоящем документе, которая демонстрирует когезивность. Когезивность, также называемая силой сцепления, силой когезии или сжимающей силой, является физической характеристикой материала, обусловленной межмолекулярным притяжением между сходными молекулами внутри материала, которое служит для объединения молекул. Когезивность выражается в единицах грамм-силы (gmf). На когезивность влияет, среди прочих факторов, соотношение молекулярных масс исходного свободного ГК-полисахарида, степень поперечного сшивания ГК-полисахаридов, количество остаточных свободных ГК-полисахаридов после поперечного сшивания и рН гидрогелевой композиции. Композиция должна быть достаточно когезивной, чтобы оставаться локализованной в месте введения. Кроме того, в определенных сферах применения достаточная когезивность композиции важна для сохранения ее формы и, следовательно, функциональности в случае циклического изменения механической нагрузки. Таким образом, в одном варианте осуществления композиция коацерватной ГК-гидрогеля, описанная в настоящем документе, обладает когезивностью, равной когезивности воды. В еще одном варианте осуществления гидрогелевая композиция, описанная в настоящем документе, демонстрирует достаточную когезивность, чтобы оставаться локализованной в месте введения. В еще одном варианте осуществления гидрогелевая композиция, описанная в настоящем документе, демонстрирует достаточную когезивность для сохранения своей формы. В дополнительном варианте осуществления гидрогелевая композиция, описанная в настоящем документе, демонстрирует достаточную когезивность для сохранения своей формы и функциональности.
[00132] В аспектах настоящего описания частично предусмотрена композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, которая демонстрирует физиологически приемлемую осмолярность. Используемый в настоящем документе термин «осмолярность» относится к концентрации осмотически активных растворенных веществ в растворе. Используемый в настоящем документе термин «физиологически приемлемая осмолярность» относится к осмолярности, которая соответствует или которая характерна для нормального функционирования живого организма. Таким образом, введение гидрогелевой композиции, описанной в настоящем документе, демонстрирует осмолярность, которая по существу не оказывает длительного или постоянного вредного эффекта при введении млекопитающему. Осмолярность выражается в осмолях осмотически активного растворенного вещества на литр растворителя (осмоль/л или Осм/л). Осмолярность отличается от молярности, так как она указывает число молей осмотически активных частиц растворенного вещества, а не молей растворенного вещества. Различие возникает из-за того, что некоторые соединения могут диссоциировать в растворе, а другие не могут. Осмолярность раствора можно рассчитать по следующему уравнению: Осмоль/л = Σ ϕi ηi Ci, где ϕ представляет собой осмотический коэффициент, который учитывает степень неидеальности раствора; η представляет собой число частиц (например, ионов), на которые диссоциирует молекула; а C представляет собой молярную концентрацию растворенного вещества; и i представляет собой коэффициент, отражающий природу конкретного растворенного вещества. Осмолярность гидрогелевой композиции, описанной в настоящем документе, может быть измерена с помощью стандартного способа измерений в растворах.
[00133] В одном варианте осуществления композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, демонстрирует физиологически приемлемую осмолярность. В аспектах данного варианта осуществления гидрогелевая композиция демонстрирует осмолярность, например, приблизительно 100 мОсм/л, приблизительно 150 мОсм/л, приблизительно 200 мОсм/л, приблизительно 250 мОсм/л, приблизительно 300 мОсм/л, приблизительно 350 мОсм/л, приблизительно 400 мОсм/л, приблизительно 450 мОсм/л или приблизительно 500 мОсм/л. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует осмолярность, например, по меньшей мере 100 мОсм/л, по меньшей мере 150 мОсм/л, по меньшей мере 200 мОсм/л, по меньшей мере 250 мОсм/л, по меньшей мере 300 мОсм/л, по меньшей мере 350 мОсм/л, по меньшей мере 400 мОсм/л, по меньшей мере 450 мОсм/л или по меньшей мере 500 мОсм/л. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует осмолярность, например, не более 100 мОсм/л, не более 150 мОсм/л, не более 200 мОсм/л, не более 250 мОсм/л, не более 300 мОсм/л, не более 350 мОсм/л, не более 400 мОсм/л, не более 450 мОсм/л или не более 500 мОсм/л. В других аспектах данного варианта осуществления гидрогелевая композиция демонстрирует осмолярность, например, от приблизительно 100 мОсм/л до приблизительно 500 мОсм/л, от приблизительно 200 мОсм/л до приблизительно 500 мОсм/л, от приблизительно 200 мОсм/л до приблизительно 400 мОсм/л, от приблизительно 300 мОсм/л до приблизительно 400 мОсм/л, от приблизительно 270 мОсм/л до приблизительно 390 мОсм/л, от приблизительно 225 мОсм/л до приблизительно 350 мОсм/л, от приблизительно 250 мОсм/л до приблизительно 325 мОсм/л, от приблизительно 275 мОсм/л до приблизительно 300 мОсм/л или от приблизительно 285 мОсм/л до приблизительно 290 мОсм/л.
[00134] В аспектах настоящего изобретения частично предусмотрена композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, которая демонстрирует существенную стабильность. Используемый в настоящем документе термин «стабильность» или «стабильный» применительно к гидрогелевой композиции, описанной в настоящем документе, относится к композиции, которая не подвержена распаду, разложению или разрушению в любой значительной или существенной степени во время хранения перед введением индивиду. Используемый в настоящем документе термин «существенная термостабильность», «по существу термостабильная», «стабильная при автоклавировании» или «стабильная при паровой стерилизации» относится к гидрогелевой композиции, описанной в настоящем документе, которая является по существу стабильной при воздействии термообработки, как описано в настоящем документе.
[00135] Стабильность гидрогелевой композиции, описанной в настоящем документе (включая гидрогелевые композиции, дополнительно содержащие любой агент или добавку, описанную в настоящем документе), может быть определена путем воздействия на гидрогелевую композицию термообработки, такой как, например, паровая стерилизация при нормальном давлении или под давлением (например, автоклавирование). Предпочтительно термическую обработку выполняют при температуре по меньшей мере приблизительно 100°C в течение от приблизительно одной минуты до приблизительно 10 минут. Оценивают существенную стабильность гидрогелевой композиции, описанной в настоящем документе, 1) путем определения изменения силы экструзии (AF) гидрогелевой композиции, описанной в настоящем документе, после стерилизации, причем изменение силы экструзии менее 2 Н указывает на по существу стабильную гидрогелевую композицию по результатам измерения величины (сила экструзии гидрогелевой композиции с указанными агентами и/или добавками) минус (сила экструзии гидрогелевой композиции без введенных агентов и/или добавок); и/или 2) путем определения изменения реологических свойств гидрогелевой композиции, описанной в настоящем документе, после стерилизации, причем изменение tan δ при 1 Гц менее 0,1 указывает на по существу стабильную гидрогелевую композицию по результатам измерения значения (tan δ при 1 Гц для состава геля с агентами и/или добавками) минус (tan δ при 1 Гц состава геля без агентов и/или добавок). Таким образом, по существу стабильная гидрогелевая композиция, описанная в настоящем документе, сохраняет одну или более из следующих характеристик после стерилизации: гомогенность, силу экструзии, когезивность, концентрацию анионной ГК, концентрацию катионного полисахарида, концентрацию агента или добавки, осмолярность, pH или другие реологические характеристики, желательные для гидрогеля, наблюдавшиеся перед термической обработкой.
[00136] В одном варианте осуществления коацерватный ГК-гидрогель, описанный в настоящем документе, обрабатывают с применением термической обработки, которая сохраняет желаемые свойства гидрогеля, описанные в настоящем документе. В аспектах данного варианта осуществления коацерватный ГК-гидрогель, описанный в настоящем документе, обрабатывают с использованием термообработки, например, приблизительно 100°C, приблизительно 105°C, приблизительно 110°C, приблизительно 115°C, приблизительно 120°C, приблизительно 125°C или приблизительно 130°C. В других аспектах данного варианта осуществления коацерватный ГК-гидрогель, описанный в настоящем документе, обрабатывают с использованием термообработки, например, по меньшей мере 100°C, по меньшей мере 105°C, по меньшей мере 110°C, по меньшей мере 115°C, по меньшей мере 120°C, по меньшей мере 125°C или по меньшей мере 130°C. В других аспектах этого варианта осуществления коацерватный ГК-гидрогель, описанный в настоящем документе, обрабатывают с использованием термообработки, например, от приблизительно 100°C до приблизительно 120°C, от приблизительно 100°C до приблизительно 125°C, от приблизительно 100°C до приблизительно 130°C, от приблизительно 100°C до приблизительно 135°C, от приблизительно 110°C до приблизительно 120°C, от приблизительно 110°C до приблизительно 125°C, от приблизительно 110°C до приблизительно 130°C, от приблизительно 110°C до приблизительно 135°C, от приблизительно 120°C до приблизительно 125°C, от приблизительно 120°C до приблизительно 130°C, от приблизительно 120°C до приблизительно 135°C, от приблизительно 125°C до приблизительно 130°C или от приблизительно 125°C до приблизительно 135°C.
[00137] Долгосрочную стабильность гидрогелевой композиции, описанной в настоящем документе, можно определить путем воздействия на коацерватный ГК-гидрогель термической обработкой, такой как, например, хранение при приблизительно 45°C в течение приблизительно 60 дней. Долгосрочная стабильность коацерватного ГК-гидрогеля, описанного в настоящем документе, может оцениваться 1) путем оценки прозрачности и цвета гидрогелевой композиции после термообработки при 45°C, причем прозрачная и бесцветная гидрогелевая композиция является показателем по существу стабильной гидрогелевой композиции; 2) путем определения изменения силы экструзии (AF) коацерватного ГК-гидрогеля, описанного в настоящем документе, после термической обработки при 45°C, причем изменение силы экструзии менее 2 Н указывает на по существу стабильную композицию коацерватного ГК-гидрогеля по результатам измерения величины (сила экструзии гидрогелевой композиции перед термообработкой при 45°C) минус (сила экструзии гидрогелевой композиции после термообработки при 45°C); и/или 3) путем определения изменения реологических свойств коацерватного ГК-гидрогеля, описанного в настоящем документе, после стерилизации, причем изменение tan δ при 1 Гц менее 0,1 указывает на по существу стабильную композицию коацерватного ГК-гидрогеля, измеренную с помощью величины (tan δ при 1 Гц состава геля до термообработки при 45°C) минус (tan δ при 1 Гц состава геля после термообработки при 45°C). Таким образом, долговременную стабильность композиции коацерватного ГК-гидрогеля, описанной в настоящем документе, оценивают путем регистрации одной или более из следующих характеристик после термообработки при 45°C: чистота (прозрачность и светопроницаемость), гомогенность и когезивность.
[00138] В аспектах настоящего варианта осуществления композиция коацерватного ГК-гидрогеля является по существу стабильной при комнатной температуре в течение, например, приблизительно 3 месяцев, приблизительно 6 месяцев, приблизительно 9 месяцев, приблизительно 12 месяцев, приблизительно 15 месяцев, приблизительно 18 месяцев, приблизительно 21 месяца, приблизительно 24 месяцев, приблизительно 27 месяцев, приблизительно 30 месяцев, приблизительно 33 месяцев или приблизительно 36 месяцев. В других аспектах данного варианта осуществления композиция коацерватного ГК-гидрогеля является по существу стабильной при комнатной температуре в течение, например, по меньшей мере 3 месяцев, по меньшей мере 6 месяцев, по меньшей мере 9 месяцев, по меньшей мере 12 месяцев, по меньшей мере 15 месяцев, по меньшей мере 18 месяцев, по меньшей мере 21 месяца, по меньшей мере 24 месяца, по меньшей мере 27 месяцев, по меньшей мере 30 месяцев, по меньшей мере 33 месяцев или по меньшей мере 36 месяцев. В других аспектах данного варианта осуществления композиция коацерватного ГК-гидрогеля является по существу стабильной при комнатной температуре, например, от приблизительно 3 месяцев до приблизительно 12 месяцев, от приблизительно 3 месяцев до приблизительно 18 месяцев, от приблизительно 3 месяцев до приблизительно 24 месяцев, от приблизительно 3 месяцев до приблизительно 30 месяцев, от приблизительно 3 месяцев до приблизительно 36 месяцев, от приблизительно 6 месяцев до приблизительно 12 месяцев, от приблизительно 6 месяцев до приблизительно 18 месяцев, от приблизительно 6 месяцев до приблизительно 24 месяцев, от приблизительно 6 месяцев до приблизительно 30 месяцев, от приблизительно 6 месяцев до приблизительно 36 месяцев, от приблизительно 9 месяцев до приблизительно 12 месяцев, от приблизительно 9 месяцев до приблизительно 18 месяцев, от приблизительно 9 месяцев до приблизительно 24 месяцев, от приблизительно 9 месяцев до приблизительно 30 месяцев, от приблизительно 9 месяцев до приблизительно 36 месяцев, от приблизительно 12 месяцев до приблизительно 18 месяцев, от приблизительно 12 месяцев до приблизительно 24 месяцев, от приблизительно 12 месяцев до приблизительно 30 месяцев, от приблизительно 12 месяцев до приблизительно 36 месяцев, от приблизительно 18 месяцев до приблизительно 24 месяцев, от приблизительно 18 месяцев до приблизительно 30 месяцев или от приблизительно 18 месяцев до приблизительно 36 месяцев.
[00139] В аспектах настоящего описания частично предусмотрена композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, которая представляет собой фармацевтически приемлемую композицию. Используемый в настоящем документе термин «фармацевтически приемлемый» означает любой молекулярный объект или композицию, которые не вызывают неблагоприятной, аллергической или другой побочной или нежелательной реакции при введении индивиду. Фармацевтически приемлемая композиция коацерватного ГК-гидрогеля пригодна для применения в медицинских и ветеринарных целях. Фармацевтически приемлемую композицию коацерватного ГК-гидрогеля можно вводить индивиду отдельно или в комбинации с другими дополнительными активными ингредиентами, агентами, лекарственными средствами или гормонами. Используемые в настоящем документе термины «фармацевтически приемлемый» и «физиологически приемлемый» могут использоваться взаимозаменяемо.
[00140] В аспектах настоящего описания частично предусмотрена композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, которая содержит фармакологически приемлемый эксципиент. Используемый в настоящем документе термин «фармакологически приемлемый эксципиент» является синонимом термину «фармакологический эксципиент» или «эксципиент» и относится к любому эксципиенту, который по существу не оказывает длительного или постоянного негативного воздействия при введении млекопитающему и охватывает такие соединения, как, например, стабилизатор, наполняющий агент, криопротектор, лиопротектор, добавка, несущая среда, носитель, разбавитель или вспомогательный компонент. Эксципиент, как правило, смешивают с активным ингредиентом или позволяют ему разбавить или включить в себя активный ингредиент, и он может представлять собой твердый, полутвердый или жидкий агент. Кроме того, предполагается, что фармацевтическая композиция, описанная в настоящем документе, может включать в себя один или более фармацевтически приемлемых эксципиентов, облегчающих превращение активного ингредиента в фармацевтически приемлемые композиции. Если любой фармакологически приемлемый эксципиент совместим с активным ингредиентом, можно предполагать возможность его использования в фармацевтически приемлемых композициях. Не имеющие ограничительного характера примеры фармакологически приемлемых эксципиентов (включая носители) можно найти, например, в Pharmaceutical Dosage Forms and Drug Delivery Systems (Howard C. Ansel et al., eds., Lippincott Williams & Wilkins Publishers, 7th ed. 1999); Remington: The Science and Practice of Pharmacy (Alfonso R. Gennaro ed., Lippincott, Williams & Wilkins, 20th ed. 2000); Goodman & Gilman's The Pharmacological Basis of Therapeutics (Joel G. Hardman et al., eds., McGraw-Hill Professional, 10th ed. 2001); и Handbook of Pharmaceutical Excipients (Raymond C. Rowe et al., APhA Publications, 4th edition 2003), каждая из которых полностью включена в настоящий документ путем ссылки.
[00141] Используемые в настоящем документе термины «носитель» и «приемлемый носитель» могут использоваться взаимозаменяемо и относятся к носителю, который можно комбинировать с представленным в настоящем документе гидрогелем для получения желаемой композиции. Специалистам в данной области будет понятно, что существует ряд хорошо известных носителей для получения конкретных косметических композиций. Физически и/или фармацевтически приемлемые носители включают в себя, без ограничений, физиологические растворы, такие как фосфатно-солевой буфер (PBS), глицерин и несшитая ГК.
[00142] Дополнительно предусмотрено, что композиция коацерватного ГК-гидрогеля, описанная в настоящем документе, может необязательно включать в себя, без ограничений, другие фармацевтически приемлемые компоненты, включая, без ограничений, буферы, носители, консерванты, регуляторы тоничности, соли, антиоксиданты, агенты, регулирующие осмоляльность, эмульгирующие агенты, смачивающие агенты и т.п.
[00143] Фармацевтически приемлемый буфер представляет собой буферный раствор, который можно использовать для получения гидрогелевой композиции, описанной в настоящем документе, при условии, что полученный препарат является фармацевтически приемлемым. Не имеющие ограничительного характера примеры фармацевтически приемлемых буферов включают в себя ацетатные буферы, боратные буферы, цитратные буферы, нейтральные солевые буферы, фосфатные буферы и фосфатно-солевые буферы. Не имеющие ограничительного характера примеры концентраций физиологически приемлемых буферов находятся в диапазоне от приблизительно 0,1 мМ до приблизительно 900 мМ. Значение pH фармацевтически приемлемых буферов можно регулировать при условии, что полученный препарат является фармацевтически приемлемым. Следует понимать, что для регулировки pH фармацевтической композиции при необходимости можно использовать кислоты или основания. Не имеющие ограничительного характера примеры физиологически приемлемого pH находятся в диапазоне от приблизительно pH 5,0 до приблизительно pH 8,5. Например, pH гидрогелевой композиции, описанной в настоящем документе, может составлять от приблизительно 5,0 до приблизительно 8,0, или от приблизительно 6,5 до приблизительно 7,5, от приблизительно 7,0 до приблизительно 7,4 или от приблизительно 7,1 до приблизительно 7,3.
[00144] К фармацевтически приемлемым консервантам относятся, без ограничений, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол. К фармацевтически приемлемым консервантам относятся, без ограничений, хлорид бензалкония, хлорбутанол, тимеросал, ацетат фенилртути, нитрат фенилртути, стабилизированная оксихлорная композиция, такая как, например, DTPA или DTPA-бисамид, кальций DTPA и CaNaDTPA-бисамид.
[00145] Фармацевтически приемлемые регуляторы тоничности, используемые в составе коацерватной композиции ГК-гидрогеля, описанной в настоящем документе, включают в себя, без ограничений, соли, такие как, например, хлорид натрия и хлорид калия; и глицерин. Композиция может быть предусмотрена в виде соли и может быть образована множеством кислот, включая, без ограничений, соляную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли, как правило, более растворимы в водных или других протонных растворителях, чем соответствующие формы свободных оснований. Следует понимать, что эти и другие вещества, известные в области фармакологии, могут быть включены в фармацевтическую композицию, описанную в настоящем документе. Другие не имеющие ограничительного характера примеры фармацевтически приемлемых компонентов описаны, например, в публикациях Ansel, выше (1999); Gennaro, выше (2000); Hardman, выше (2001); и Rowe, выше (2003), содержание каждой из которых полностью включено в настоящий документ путем ссылки.
[00146] В изобретении дополнительно предложены общие способы получения коацерватных ГК-гидрогелей. В некоторых вариантах осуществления способы включают в себя образование комплекса, содержащего ионные связывающие взаимодействия между ионами анионной ГК и ионами катионных полисахаридов.
[00147] В изобретении также предложены способы получения коацерватных ГК-гидрогелей с различными реологическими профилями, которые могут быть образованы на основе количества, природы и/или значения(-ий) pKa анионов и/или катионов каждого из анионной ГК и катионных полисахаридов соответственно.
[00148] В некоторых вариантах осуществления гидрогели образуются за счет ионных взаимодействий между несшитыми анионными ГК и катионными полисахаридами, причем анионная ГК имеет анионы, включая, без ограничений, карбоксилат, сульфонат и/или фосфонат; катионные полисахариды имеют катионы, включая, без ограничений, первичный аммоний, четвертичный аммоний и/или гуанидиний.
[00149] В других вариантах осуществления гидрогели образуются за счет ионных взаимодействий между сшитыми анионными ГК и катионными полисахаридами, причем анионная ГК имеет анионы, включая, без ограничений, карбоксилат, сульфонат и/или фосфонат; катионные полисахариды имеют катионы, включая, без ограничений, первичный аммоний, четвертичный аммоний и/или гуанидиний. В некоторых вариантах осуществления катионный полисахарид служит в качестве когезивного агента для улучшения когезивности сшитого анионного ГК-геля.
[00150] В некоторых вариантах осуществления гидрогели получают, образуя ионный комплекс гомоанионной ГК с гомокатионным полисахаридом. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой катионную ГК. В некоторых вариантах осуществления гомокатионный полисахарид представляет собой хитозан. В дополнительных вариантах осуществления гомокатионный полисахарид представляет собой триметилхитозан.
[00151] В некоторых вариантах осуществления гидрогели получают, образуя ионный комплекс гомоанионной ГК с гетерокатионным полисахаридом. В некоторых вариантах осуществления гомоанионная ГК представляет собой ГК.
[00152] В некоторых вариантах осуществления гидрогели получают, образуя ионный комплекс гетероанионной ГК с гомокатионным полисахаридом. В некоторых вариантах осуществления ГК представляет собой катионную ГК. В других вариантах осуществления гомокатионный полисахарид представляет собой хитозан. В дополнительных вариантах осуществления гомокатионный полисахарид представляет собой триметилхитозан.
[00153] В некоторых вариантах осуществления гидрогели получают, образуя ионный комплекс гетероанионной ГК с гетерокатионным полисахаридом.
[00154] Не имеющие ограничительного характера варианты осуществления способа формирования гидрогелей по изобретению включают в себя образование ионного комплекса анионного полисахарида с катионным полисахаридом, причем анионный полисахарид выбран из вариантов осуществления анионного полисахарида из таблицы 1 и катионный полисахарид выбран из вариантов осуществления катионных полисахаридов из таблицы 1, без ограничений по комбинациям анионных и катионных полисахаридов.
[00155] В одном варианте осуществления предложен способ получения гидрогеля, содержащего несшитые ГК и несшитые катионные ГК, причем способ включает в себя раздельную гидратацию каждого полисахарида, например, путем растворения каждого в фосфатно-солевом буфере; с последующим смешиванием гидратированной ГК с гидратированной катионной ГК с переменным зарядным соотношением, например, от приблизительно 1 : 20 до приблизительно 20 : 1, до получения коацерватного геля. Необязательно для удаления избыточной воды применяют центрифугирование.
[00156] В другом варианте осуществления предложен способ получения гидрогеля, содержащего сшитую ГК и несшитый катионный полисахарид, такой как несшитая катионная ГК, содержащая катионные группы гуанидиния, причем способ включает в себя смешивание сшитой ГК с 1 мас. % несшитой катионной ГК, содержащей катионные группы гуанидиния в буфере (например, буфер PBS с pH 7,5) от приблизительно 1 : 10 до приблизительно 50 : 1 до получения коацерватного геля.
[00157] В другом варианте осуществления предложен способ получения гидрогеля, содержащего сшитую ГК и хитозан, причем способ включает в себя получение гидратированной сшитой ГК (например, ГК-геля, такого как JUP), получение высокочистого хитозана (HPC), растворение HPC в кислом водном растворе, необязательную паровую стерилизацию HPC в кислом водном растворе, разбавление полученного раствора водой (например, до получения концентрации HPC в диапазоне от 0,4 мг/мл до 1,9 мг/мл) и смешивание разбавленного раствора HPC с гидратированной сшитой ГК с получением коацерватного гидрогеля, содержащего сшитую ГК и хитозан.
[00158] В других аспектах гидрогель настоящего изобретения получают объединением от приблизительно 0,01 до приблизительно 1 молярного эквивалента катионного полисахарида с приблизительно 1 молярным эквивалентом анионного полисахарида. В дополнительных аспектах катионный полисахарид в количестве от приблизительно 0,02 до приблизительно 0,5 молярных эквивалентов объединяют с 1 молярным эквивалентом анионного полисахарида. В других дополнительных аспектах катионный полисахарид в количестве от приблизительно 0,04 до приблизительно 0,2 молярных эквивалентов объединяют с приблизительно 1 молярным эквивалентом анионного полисахарида. Предпочтительно анионный полисахарид представляет собой ГК. Более предпочтительно анионный полисахарид представляет собой сшитую ГК, а катионный полисахарид представляет собой хитозан.
[00159] В аспектах настоящего описания частично предусмотрен способ улучшения состояния мягких тканей индивида путем введения композиции дермального филлера, описанной в настоящем документе.
[00160] Используемый в настоящем документе термин «мягкие ткани» относится к тканям, которые окружают, поддерживают или соединяют другие структуры или органы тела. Не имеющие ограничительного характера примеры мягких тканей включают в себя соединительные ткани, такие как кожа, волокнистые ткани, жир, фасции, сухожилия, связки и синовиальные мембраны. К мягким тканям также могут относиться несоединительные ткани, такие как нервы, мышцы и кровеносные сосуды.
[00161] Используемый в настоящем документе термин «обработка/уход» относится к увеличению объема мягкой ткани, улучшению качества мягких тканей или уменьшению дефекта мягких тканей; или к сокращению или устранению у индивида косметического симптома состояния мягкой ткани, характеризующегося изъяном и/или дефектом мягкой ткани; или к задержке или предотвращению возникновения у индивида косметического симптома состояния, характеризующегося изъяном и/или дефектом мягкой ткани. Например, термин «обработка/уход» может означать уменьшение симптома состояния, характеризующегося дефектом мягких тканей, например по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70% или по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%. Эффективность композиции дермального филлера, описанной в настоящем документе, при улучшении состояния, характеризующегося качеством и/или дефектом мягкой ткани, может быть определена путем наблюдения за одним или более косметическими и/или физиологическими показателями, связанными с состоянием. Эффективность увеличения объема мягкой ткани, или улучшения качества мягкой ткани, и/или устранения дефектов также может быть видна по сниженной потребности в параллельной терапии. Специалистам в данной области будут известны соответствующие симптомы или индикаторы, связанные с конкретным дефектом мягких тканей, и им будет известно, как определить, подходит ли пациенту уход с применением композиции, описанной в настоящем документе.
[00162] В определенных аспектах способ включает в себя введение дермального филлера по изобретению, содержащего коацерватный ГК-гидрогель, в мягкую ткань или кожу субъекта на глубину не более чем приблизительно 1 мм. В некоторых вариантах осуществления композицию вводят поверхностно, то есть с глубиной не более чем приблизительно 0,8 мм, не более чем приблизительно 0,6 мм или не более чем приблизительно 0,4 мм.
[00163] В другом аспекте в настоящем изобретении предложены способы улучшения эстетического внешнего вида субъекта, в том числе лица субъекта. Настоящие способы по существу включают в себя стадии введения дермального филлера, содержащего коацерватный ГК-гидрогель, в мягкую ткань или кожу субъекта, например, в лицо субъекта. В определенных аспектах способ по существу включает в себя введение дермального филлера по изобретению, содержащего коацерватный ГК-гидрогель, в область кожи, например, в область дермы субъекта, например, в лицо субъекта, на глубину не более чем приблизительно 1 мм. В некоторых вариантах осуществления композицию вводят поверхностно, то есть с глубиной не более чем приблизительно 0,8 мм, не более чем приблизительно 0,6 мм или не более чем приблизительно 0,4 мм.
[00164] Гидрогелевую композицию вводят индивиду. Индивид, также называемый в настоящем документе субъектом или пациентом, как правило, представляет собой человека любого возраста, пола или расы. Как правило, любому субъекту, которому не противопоказана традиционная процедура ухода за мягкими тканями, подходит описанный в настоящем документе способ. Хотя индивид, имеющий признаки старения кожи, представляет собой взрослого, индивиды, испытывающие преждевременное старение или другие состояния кожи, подходящие для улучшения (например, шрам), также могут получать гидрогелевую композицию, описанную в настоящем документе. Кроме того, описанные в настоящем документе гидрогелевые композиции и способы могут применяться к индивидам, желающим небольшого/умеренного увеличения, изменения формы или изменения контура части или области тела, которое может не быть технически возможным или эстетически приемлемым при использовании существующей технологии имплантации мягких тканей. Предварительная оценка, как правило, включает в себя обычный сбор анамнеза и физическое обследование, а также получение информированного согласия, охватывающего все соответствующие риски и преимущества процедуры.
[00165] Гидрогелевую композицию и способы, описанные в настоящем документе, можно использовать при уходе за мягкими тканями. К состоянию мягких тканей относится, без ограничений, изъян и/или дефект мягкой ткани. Не имеющие ограничительного характера примеры состояния мягкой ткани включают в себя изъяны и/или дефекты лица, такие как, например, увеличение объема лица, пластика лица, мезотерапия, синдром Парри—Ромберга, глубокая красная волчанка, пересадка кожи, шрамы, впалые щеки, тонкие губы, изъяны или дефекты носа, ретроорбитальные изъяны или дефекты, лицевые складки, линии и/или морщины, например, межбровная складка, носогубная складка, околоротовая складка, и/или морщины марионетки, и/или другие деформации или изъяны контуров лица; изъян и/или дефект шеи; изъян и/или дефект кожи; другие изъяны и/или дефекты мягких тканей, такие как, например, увеличение или пластика верхней части руки, нижней части руки, кисти, плеча, спины, торса, включая живот, ягодицы, верхнюю часть ноги, нижнюю часть ноги, включая голени, ступни, включая подошвенную жировую подушку, глаз, гениталии или другую часть тела, регион или область. Используемый в настоящем документе термин «мезотерапия» относится к нехирургической технике косметического ухода за кожей, связанной с внутриэпидермальной, внутридермальной и/или подкожной инъекцией агента, вводимого в виде небольших множественных капель в эпидермис, дермо-эпидермальную границу и/или дерму.
[00166] Количество гидрогелевой композиции, используемой с любым из описанных в настоящем документе способов, как правило, определяют на основании желаемого изменения и/или улучшения, уменьшения и/или устранения симптома состояния мягкой ткани, эффекта, требуемого индивидом или врачом, а также в зависимости от подлежащей обработке части тела или области. Эффективность введения композиции может проявляться в одном или более из следующих показателей: измененная и/или улучшенная форма мягкой ткани, измененный и/или улучшенный размер мягких тканей, измененный и/или улучшенный контур мягкой ткани, измененная и/или улучшенная функция ткани, повышение удовлетворенности пациента и/или качества жизни, а также уменьшение использования имплантируемого чужеродного материала.
[00167] В другом примере эффективность композиций и способов ухода за мягкой тканью лица может проявляться в одном или более из следующих показателей: увеличение размера, формы и/или контура элемента лица, например, увеличение размера, формы и/или контура области губ, щеки или глаз; изменение размера, формы и/или контура элемента лица, например, изменение размера, формы и/или контура области губ, щеки или глаз; уменьшение или устранение морщины, складки или линии на коже; резистентность к появлению морщины, складки или линии на коже; восстановление содержания влаги в коже; повышение эластичность кожи; снижение или устранение шероховатости кожи; повышение и/или улучшение натяжения кожи; уменьшение или устранение линий или отметок от растяжек; увеличение и/или улучшение тона, блеска, яркости и/или сияния кожи; увеличение и/или улучшение цвета кожи, уменьшение или устранение бледности кожи; повышение удовлетворенности пациента и/или качества жизни.
[00168] В аспектах данного варианта осуществления количество вводимой гидрогелевой композиции составляет, например, приблизительно 0,01 г, приблизительно 0,05 г, приблизительно 0,1 г, приблизительно 0,5 г, приблизительно 1 г, приблизительно 5 г, приблизительно 10 г, приблизительно 20 г, приблизительно 30 г, приблизительно 40 г, приблизительно 50 г, приблизительно 60 г, приблизительно 70 г, приблизительно 80 г, приблизительно 90 г, приблизительно 100 г, приблизительно 150 г или приблизительно 200 г. В аспектах данного варианта осуществления количество вводимой гидрогелевой композиции составляет, например, от приблизительно 0,01 г до приблизительно 0,1 г, от приблизительно 0,1 г до приблизительно 1 г, от приблизительно 1 г до приблизительно 10 г, от приблизительно 10 г до приблизительно 100 г или от приблизительно 50 г до приблизительно 200 г. В других аспектах данного варианта осуществления количество вводимой гидрогелевой композиции составляет, например, приблизительно 0,01 мл, приблизительно 0,05 мл, приблизительно 0,1 мл, приблизительно 0,5 мл, приблизительно 1 мл, приблизительно 5 мл, приблизительно 10 мл, приблизительно 15 мл, приблизительно 20 мл, приблизительно 30 мл, приблизительно 40 мл, приблизительно 50 мл, приблизительно 60 мл, приблизительно 70 г, приблизительно 80 мл, приблизительно 90 мл, приблизительно 100 мл, приблизительно 150 мл или приблизительно 200 мл. В других аспектах данного варианта осуществления количество вводимой гидрогелевой композиции составляет, например, от приблизительно 0,01 мл до приблизительно 0,1 мл, от приблизительно 0,1 мл до приблизительно 1 мл, от приблизительно 1 мл до приблизительно 10 мл, от приблизительно 1 мл до приблизительно 20 мл, от приблизительно 10 мл до приблизительно 100 мл или от приблизительно 50 мл до приблизительно 200 мл.
[00169] Продолжительность обработки, как правило, определяется в зависимости от эффекта, желательного для индивида и/или врача, а также от подлежащей обработке части тела или области. В аспектах данного варианта осуществления введением гидрогелевой композиции, описанной в настоящем документе, можно обрабатывать мягкие ткани в течение, например, приблизительно 6 месяцев, приблизительно 7 месяцев, приблизительно 8 месяцев, приблизительно 9 месяцев, приблизительно 10 месяцев, приблизительно 11 месяцев, приблизительно 12 месяцев, приблизительно 13 месяцев, приблизительно 14 месяцев, приблизительно 15 месяцев, приблизительно 18 месяцев или приблизительно 24 месяцев. В других аспектах данного варианта осуществления введением гидрогелевой композиции, описанной в настоящем документе, можно обрабатывать мягкие ткани в течение, например, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев, по меньшей мере 12 месяцев, по меньшей мере 13 месяцев, по меньшей мере 14 месяцев, по меньшей мере 15 месяцев, по меньшей мере 18 месяцев или по меньшей мере 24 месяцев. В других аспектах данного варианта осуществления введением гидрогелевой композиции, описанной в настоящем документе, можно обрабатывать мягкие ткани в течение, например, от приблизительно 6 месяцев до приблизительно 12 месяцев, от приблизительно 6 месяцев до приблизительно 15 месяцев, от приблизительно 6 месяцев до приблизительно 18 месяцев, от приблизительно 6 месяцев до приблизительно 21 месяцев, от приблизительно 6 месяцев до приблизительно 24 месяцев, от приблизительно 9 месяцев до приблизительно 12 месяцев, от приблизительно 9 месяцев до приблизительно 15 месяцев, от приблизительно 9 месяцев до приблизительно 18 месяцев, от приблизительно 9 месяцев до приблизительно 21 месяцев, от приблизительно 6 месяцев до приблизительно 24 месяцев, от приблизительно 12 месяцев до приблизительно 15 месяцев, от приблизительно 12 месяцев до приблизительно 18 месяцев, от приблизительно 12 месяцев до приблизительно 21 месяцев, от приблизительно 12 месяцев до приблизительно 24 месяцев, от приблизительно 15 месяцев до приблизительно 18 месяцев, от приблизительно 15 месяцев до приблизительно 21 месяцев, от приблизительно 15 месяцев до приблизительно 24 месяцев, от приблизительно 18 месяцев до приблизительно 21 месяцев, от приблизительно 18 месяцев до приблизительно 24 месяцев или от приблизительно 21 месяцев до приблизительно 24 месяцев.
[00170] В аспектах настоящего описания частично предусмотрено введение гидрогелевой композиции, описанной в настоящем документе. Используемый в настоящем документе термин «введение» означает любой механизм доставки, который обеспечивает для индивида описанную в настоящем документе композицию, которая потенциально дает положительный результат. Фактический механизм доставки, используемый для введения композиции индивиду, может быть определен обычным специалистом в данной области с учетом, без ограничений, таких факторов, как тип состояния, локализация состояния, причина состояния, тяжесть состояния, желаемая величина полезного эффекта, желаемая продолжительность полезного эффекта, конкретная используемая композиция, скорость биоразложения конкретной используемой композиции, характер других агентов, входящих в конкретную используемую композицию, конкретный способ введения, конкретные характеристики, анамнез и факторы риска для индивида, например, возраст, вес, общее состояние здоровья и т.п., а также любая их комбинация. В одном аспекте данного варианта осуществления композицию, описанную в настоящем документе, вводят в мягкую ткань индивида или в кожу путем инъекции.
[00171] Способ введения гидрогелевой композиции конкретному пациенту, как правило, определяется на основании косметического эффекта, желательного для индивида и/или врача, а также подлежащей обработке части тела или области. Композицию, описанную в настоящем документе, можно вводить любыми средствами, известными обычным специалистам в данной области, включая, без ограничений, шприц с иглой, пистолет (например, гидропневматический компрессионный пистолет) или непосредственную хирургическую имплантацию. Гидрогелевую композицию, описанную в настоящем документе, можно вводить в мягкую ткань или кожу, например, в область дермы, в гиподермальную область или в еще более глубокую область. Например, гидрогелевая композиция, описанная в настоящем документе, может быть введена с использованием игл или канюль диаметром от приблизительно 0,26 мм до приблизительно 0,4 мм и длиной в диапазоне от приблизительно 4 мм до приблизительно 14 мм. Альтернативно иглы или канюли могут иметь калибр от 21 до 32 и длину от приблизительно 4 мм до приблизительно 70 мм. В настоящем документе описаны и другие приемлемые калибры игл. Предпочтительно игла представляет собой одноразовую иглу. Игла может быть совмещена со шприцем, катетером и/или пистолетом. Канюли могут иметь разный размер и включать в себя жесткие или гибкие варианты.
[00172] Кроме того, композицию, описанную в настоящем документе, можно вводить за один раз или за несколько раз. В конечном счете используемые сроки должны соответствовать стандартам качества обслуживания. Например, композицию дермального филлера, описанную в настоящем документе, можно вводить один раз или в течение нескольких сеансов, причем сеансы разнесены на несколько дней или недель. Например, индивиду можно вводить композицию дермального филлера, описанную в настоящем документе, каждые 1, 2, 3, 4, 5, 6 или 7 дней или каждые 1, 2, 3 или 4 недели. Введение композиции дермального филлера, описанной в настоящем документе, индивиду можно осуществлять ежемесячно или раз в два месяца или вводить каждые 3, 6, 9 или 12 месяцев.
[00173] Аспекты настоящего описания отчасти относятся к коже. Кожа состоит из трех основных слоев: эпидермиса, который обеспечивает изоляцию от воды и служит барьером от инфекций; дермы, которая служит местом размещения придатков кожи; и гиподермы (подкожного жирового слоя). Эпидермис не содержит кровеносных сосудов и питается за счет диффузии из дермы. Основным типом клеток, образующих эпидермис, являются кератиноциты, меланоциты, клетки Лангерганса и клетки Меркеля. Кожа включает в себя «область дермы».
[00174] Аспекты настоящего описания отчасти относятся к области дермы. Используемый в настоящем документе термин «область дермы» относится к области кожи, включающей эпидермально-дермальную границу и дерму. Граница эпидермиса обеспечивает эпидермально-дермальную адгезию, механическую поддержку эпидермиса и барьер для обмена клетками и некоторыми крупными молекулами через область контакта. Дерма включает в себя поверхностную дерму (папиллярную область) и глубокую дерму (ретикулярную область).
[00175] Дерма представляет собой слой кожи под эпидермисом, который состоит из соединительной ткани, защищающий организм от стресса и напряжений. Дерма прочно соединена с эпидермисом при помощи базальной мембраны. Кроме того, в ней находятся множество механорецепторов/нервных окончаний, которые обеспечивают тактильное восприятие и восприятие тепла. Она содержит волосяные фолликулы, потовые железы, сальные железы, апокриновые железы, лимфатические сосуды и кровеносные сосуды. Кровеносные сосуды дермы обеспечивают питание и удаление отходов из своих собственных клеток, а также из базального слоя эпидермиса. Дерма структурно разделена на две области: поверхностную область, смежную с эпидермисом, называемую папиллярной областью, и глубокую более толстую область, известную как ретикулярная область.
[00176] Папиллярная область состоит из рыхлой ареолярной соединительной ткани. Она получила свое название за пальцевидные выступы, называемые папиллами, которые проходят в направлении эпидермиса. Папилла образует в дерме «бугристую» поверхность, которая смыкается с эпидермисом, упрочняя соединение между этими двумя слоями кожи. Ретикулярная область находится глубоко в папиллярной области и, как правило, имеет гораздо большую толщину. Она состоит из плотной нерегулярной соединительной ткани и получила свое название от плотной концентрации коллагеновых, эластичных и ретикулярных (сетчатых) волокон, которые переплетены по всему ее объему. Эти белковые волокна придают дерме свойства прочности, растяжимости и эластичности. Также внутри ретикулярной области находятся корни волос, сальные железы, потовые железы, рецепторы, ногти и кровеносные сосуды. Краска при татуировке находится в дерме. Растяжки после беременности также находятся в дерме.
[00177] Гиподерма лежит ниже дермы. Ее назначением является прикрепление области дермы кожи к нижележащим костям и мышцам, а также обеспечение ее кровеносными сосудами и нервами. Она состоит из рыхлой соединительной ткани и эластина. Основными типами клеток являются фибробласты, макрофаги и адипоциты (гиподерма содержит 50% жира в организме). Жир служит в качестве подкладки и изоляции для тела.
[00178] В аспекте данного варианта осуществления гидрогелевую композицию, описанную в настоящем документе, вводят в кожу индивида путем инъекции в область дермы или гиподермальную область. В аспектах данного варианта осуществления описанную в настоящем документе гидрогелевую композицию вводят в область дермы индивида путем инъекции, например, в область эпидермально-дермального контакта, папиллярную область, ретикулярную область или любую их комбинацию.
[00179] Другие аспекты настоящего описания частично описывают способ ухода за кожей, включающий в себя стадию введения нуждающемуся в этом индивиду гидрогелевой композиции, описанной в настоящем документе, причем введение композиции улучшает состояние кожи, таким образом осуществляя уход за кожей. В аспекте данного варианта осуществления способ ухода за кожей представляет собой способ устранения обезвоживания кожи, включающий в себя стадию введения индивиду, страдающему от обезвоживания кожи, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции приводит к регидратации кожи и, таким образом, к устранению обезвоживания кожи. В другом аспекте этого варианта осуществления способ устранения недостаточной эластичности кожи включает в себя стадию введения индивиду, страдающему от недостаточности эластичности кожи, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции повышает эластичность кожи, таким образом устраняя недостаточную эластичность кожи. В еще одном аспекте данного варианта осуществления способ борьбы с огрублением кожи включает в себя стадию введения индивиду, страдающему от огрубления кожи, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции снижает огрубление кожи и таким образом борется с огрублением кожи. В другом аспекте данного варианта осуществления способ борьбы с недостаточным натяжением кожи включает в себя стадию введения индивиду, страдающему от недостаточности натяжения кожи, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции повышает натяжение кожи, таким образом осуществляя борьбу с недостаточным натяжением кожи.
[00180] В дополнительном аспекте данного варианта осуществления способ борьбы растяжками включает в себя стадию введения индивиду, страдающему от линий или отметок растяжек кожи, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции уменьшает или устраняет растяжки на коже, таким образом осуществляя борьбу с растяжками кожи. В другом аспекте данного варианта осуществления способ устранения бледности кожи включает себя стадию введения индивиду, страдающему от бледности кожи, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции снижает бледность кожи, таким образом устраняя бледность кожи. В другом аспекте данного варианта осуществления способ устранения морщин включает в себя стадию введения индивиду, страдающему от морщин, гидрогелевой композиции, описанной в настоящем документе, причем введение композиции уменьшает или удаляет морщины, таким образом осуществляя устранение морщин кожи. В еще одном аспекте данного варианта осуществления способ устранения морщин включает в себя стадию введения индивиду гидрогелевой композиции, описанной в настоящем документе, причем введение композиции делает кожу устойчивой к морщинам, таким образом осуществляя устранение морщин кожи. В настоящем изобретении также предложены способы устранения состояния, причем способ включает в себя введение коацерватного ГК-гидрогеля по изобретению. В одном варианте осуществления предложен способ уменьшения появления морщин. В другом варианте осуществления предложен способ пластики элементов мягких тканей, включая элементы мягких тканей лица. В другом варианте осуществления предложен способ приложения механического давления к ткани, смежной с гидрогелем. В других вариантах осуществления предложен способ обеспечения способности к подтягиванию тканей, смежных с введенным гидрогелем.
[00181] В настоящем изобретении также предложены варианты использования коацерватных ГК-гидрогелей. Не имеющие ограничительного характера варианты использования коацерватных ГК-гидрогелей по изобретению включают в себя их использование в качестве средств увеличения объема кожи или заполняющих агентов, которые заполняют пустоты внутри кожи или под кожей для уменьшения появления морщин или для пластики элементов мягких тканей, таких как свойства мягких тканей лица. В некоторых вариантах осуществления коацерватные ГК-гидрогели по изобретению используются для приложения механического давления к ткани, смежной с гидрогелем. В других вариантах осуществления коацерватные ГК-гидрогели по изобретению обеспечивают способность к подтягиванию тканей, смежных с введенным гидрогелем. В других вариантах осуществления коацерватные ГК-гидрогели используются для доставки косметических или других агентов в ткань субъекта. Не имеющими ограничительного характера примерами агентов, доставляемых с коацерватным ГК-гидрогелем, являются антиоксидант, противозудный агент, антицеллюлитный агент, агент против образования шрамов, противовоспалительный агент, анестезирующий агент, агент против раздражения, отшелушивающий агент, натягивающий агент, агент против акне, агент для осветления кожи, агент для пигментации кожи, агент против пигментации, увлажняющий агент и/или витамин.
[00182] Ниже описаны дополнительные не имеющие ограничительного характера варианты осуществления настоящего изобретения.
[00183] 1. В варианте осуществления 1 предложен дермальный филлер, содержащий гидрогель, причем гидрогель содержит:
(a) анионный полисахарид гиалуроновой кислоты (ГК) и
(b) катионный полисахарид.
[00184] 2. В варианте осуществления 2 предложен дермальный филлер по варианту осуществления 1, в котором гидрогель представляет собой коацерватный гидрогель.
[00185] 3. В варианте осуществления 3 предложен дермальный филлер по варианту осуществления 1 или 2, в котором гидрогель содержит нековалентный ионный комплекс анионного полисахарида с катионным полисахаридом.
[00186] 4. В варианте осуществления 4 предложен дермальный филлер как в вариантах осуществления 1, 2 или 3, где анионный ГК-полисахарид выбран из несшитой анионной ГК, сшитой анионной ГК и их смеси.
[00187] 5. В варианте осуществления 5 предложен дермальный филлер как в вариантах осуществления 1, 2, 3 или 4, причем анионный ГК-полисахарид выбран из несшитой ГК, сшитой ГК и их смеси.
[00188] 6. В варианте осуществления 6 предложен дермальный филлер как в варианте осуществления 5, в котором катионный полисахарид выбран из несшитого катионного полисахарида, сшитого катионного полисахарида и их смеси; предпочтительно катионный полисахарид является несшитым.
[00189] 7. В варианте осуществления 7 предложен дермальный филлер как в любом одном из вариантов осуществления 1–6, в котором катионный полисахарид выбран из катионной ГК, несшитого хитозана и несшитого триметилхитозана.
[00190] 8. В варианте осуществления 8 предложен дермальный филлер как в любом одном из вариантов осуществления 1–7, в котором катионный полисахарид представляет собой несшитый хитозан.
[00191] 9. В варианте осуществления 9 предложен дермальный филлер как в любом одном из вариантов осуществления 1–8, в котором анионный полисахарид представляет собой сшитую гиалуроновую кислоту.
[00192] 10. В варианте осуществления 10 предложен дермальный филлер по варианту осуществления 1, в котором анионная ГК представляет собой сшитую гиалуроновую кислоту, а катионный полисахарид представляет собой несшитый хитозан.
[00193] 11. В варианте осуществления 11 предложен дермальный филлер как в любом одном из вариантов осуществления 1–10, в котором анионный ГК-полисахарид и катионный полисахарид присутствуют в молярном соотношении от приблизительно 1 до 1000, от приблизительно 1 до 100, от приблизительно 1 до 10, от приблизительно 1 до 9, от приблизительно 1 до 8, от приблизительно 1 до 7, от приблизительно 1 до 6, от приблизительно 1 до 5, от приблизительно 1 до 4, от приблизительно 1 до 3, от приблизительно 1 до 2, от приблизительно 1 до 1, от приблизительно 1 до 0,04, от приблизительно 1 до 0,1, от приблизительно 1 до 0,01 или от приблизительно 1 до 0,001; предпочтительно, чтобы дермальный филлер содержал от приблизительно 1 молярного эквивалента анионного полисахарида до приблизительно 0,04 и до приблизительно 0,20 молярных эквивалентов катионного полисахарида.
[00194] 12. В варианте осуществления 12 предложен дермальный филлер как в любом одном из вариантов осуществления 1–11, дополнительно содержащий косметический агент.
[00195] 13. В варианте осуществления 13 предложен дермальный филлер как в любом одном из вариантов осуществления 1–11, дополнительно содержащий агент, выбранный из антиоксиданта, противозудного агента, антицеллюлитного агента, агента против образования шрамов, анестезирующего агента, отшелушивающего агента, натягивающего агента, агента против акне, агента для осветления кожи, агента для пигментации кожи, агента против пигментации, увлажняющего агента, витамина и любой комбинации одного или более из вышеуказанного.
[00196] 14. В варианте осуществления 14 предложен дермальный филлер как в варианте осуществления 12 или 13, причем агент высвобождается в мягкую ткань в месте введения и/или вокруг него в течение по меньшей мере приблизительно 3 недель после введения дермального филлера в мягкую ткань.
[00197] 15. В варианте осуществления 15 предложен дермальный филлер как в любом одном из вариантов осуществления 1–14, дополнительно содержащий физиологически приемлемый носитель.
[00198] 16. В варианте осуществления 16 предложен дермальный филлер как в варианте осуществления 15, в котором носитель представляет собой фосфатно-солевой буфер или несшитую ГК.
[00199] 17. В варианте осуществления 17 предложен дермальный филлер как в любом одном из вариантов осуществления 1–16, в котором гидрогель имеет модуль накопления (G') от приблизительно 50 Па до приблизительно 5000 Па, от приблизительно 50 Па до приблизительно 3000 Па, от приблизительно 50 Па до приблизительно 1000 Па, от приблизительно 50 до приблизительно 500 Па, от приблизительно 50 до приблизительно 400 Па, от приблизительно 50 до приблизительно 300 Па или от приблизительно 100 до приблизительно 300 Па; предпочтительно от приблизительно 30 Па до приблизительно 500 Па.
[00200] 18. В варианте осуществления 18 предложен дермальный филлер как в любом одном из вариантов осуществления 1–17, который вводят путем инъекции через иглу, причем калибр иглы составляет по меньшей мере 18, по меньшей мере 21, по меньшей мере 23, по меньшей мере 25, по меньшей мере 27 или по меньшей мере 30; предпочтительно по меньшей мере 27.
[00201] 19. В варианте осуществления 19 предложен дермальный филлер как в любом одном из вариантов осуществления 1–18, имеющий G’ по меньшей мере приблизительно 500 Па, причем дермальный филлер пригоден для инъекций через иглу без размерной оптимизации или гомогенизации дермального филлера перед инъекцией; причем игла имеет калибр по меньшей мере 27.
[00202] 20. В варианте осуществления 20 предложен дермальный филлер как в любом одном из вариантов осуществления 1–3, содержащий от приблизительно 1 молярного эквивалента анионного полисахарида до приблизительно 0,01 и до приблизительно 1 молярного эквивалента катионного полисахарида (например, приблизительно 1 : 0,01, 1 : 0,02, 1 : 0,04, 1 : 0,06, 1 : 0,08, 1 : 0,10, 1 : 0,15, 1 : 0,20, 1 : 0,40, 1 : 0,60, 1 : 0,80 или 1 : 1 эквивалента анионного и катионного полисахаридов или любое соотношение в этом диапазоне).
[00203] 21. В варианте осуществления 21 предложен дермальный филлер как в любом одном из вариантов осуществления 1–3, содержащий от приблизительно 1 молярного эквивалента анионного полисахарида до приблизительно 0,02 и до приблизительно 0,5 молярного эквивалента катионного полисахарида.
[00204] 22. В варианте осуществления 22 предложен дермальный филлер как в любом одном из вариантов осуществления 1–3, содержащий от приблизительно 1 молярного эквивалента анионного полисахарида до приблизительно 0,04 и до приблизительно 0,2 молярного эквивалента катионного полисахарида (например, приблизительно 1 : 0,04, приблизительно 1 : 0,06, приблизительно 1 : 0,08, приблизительно 1 : 0,1, приблизительно 1 : 0,15, приблизительно 1 : 0,20 или любое соотношение в этом диапазоне).
[00205] 23. В варианте осуществления 23 предложен дермальный филлер как в варианте осуществления 20, 21 или 22, причем анионный полисахарид представляет собой сшитую гиалуроновую кислоту, а катионный полисахарид представляет собой несшитый хитозан.
[00206] 24. В варианте осуществления 24 предложен способ обработки мягкой ткани (такой как кожа) субъекта, причем способ включает в себя инъекцию дермального филлера в соответствии с любым одним из вариантов осуществления 1–23 в мягкую ткань субъекта.
[00207] 25. В варианте осуществления 25 предложен способ по варианту осуществления 24, причем мягкая ткань представляет собой кожу, при этом способ включает в себя инъекцию дермального филлера в соответствии с любым одним из вариантов осуществления 1–23 в область дермы кожи субъекта.
[00208] 26. В варианте осуществления 26 предложен способ как в варианте осуществления 24 или 25, в котором обработка включает в себя увеличение объема мягкой ткани, повышение качества мягкой ткани или уменьшение дефекта мягкой ткани субъекта.
[00209] 27. В варианте осуществления 27 предложен способ как в любом одном из вариантов осуществления 24–26, причем обработка включает в себя формирование, заполнение, увеличение объема или пластику мягких тканей у субъекта.
[00210] 28. В варианте осуществления 28 предложен способ как в любом одном из вариантов осуществления 24–27, причем обработка включает в себя улучшение гомеостаза дермы, увеличение толщины кожи, заживление раны или уменьшение шрама у субъекта.
[00211] 29. В варианте осуществления 29 предложен способ как в варианте осуществления 26, в котором дефект представляет собой морщину, шрам или утрату дермальной ткани.
[00212] 30. В варианте осуществления 30 предложен способ как в любом одном из вариантов осуществления 24–29, причем дермальный филлер сохраняется в мягкой ткани (такой как кожа) субъекта в течение по меньшей мере приблизительно: 3 месяцев, 4 месяцев, 5 месяцев или 6 месяцев после инъекции филлера в мягкую ткань субъекта.
[00213] 31. В варианте осуществления 31 предложен способ как в любом одном из вариантов осуществления 24–29, причем дермальный филлер сохраняется в области дермы субъекта в течение по меньшей мере приблизительно: 3 месяцев, 4 месяцев, 5 месяцев или 6 месяцев после инъекции филлера в область дермы субъекта.
[00214] 32. В варианте осуществления 32 предложен способ как в любом одном из вариантов осуществления 24–31, причем обработка является эффективной в течение периода, составляющего по меньшей мере приблизительно 3 месяца.
[00215] 33. В варианте осуществления 33 предложен способ по любому из вариантов осуществления 24–32, причем мягкая ткань представляет собой кожу.
[00216] 1a. В варианте осуществления 1a представлен дермальный филлер, содержащий гидрогель гиалуроновой кислоты (ГК), причем гидрогель содержит:
(a) анионный ГК-полисахарид и
(b) катионный полисахарид;
при этом гидрогель содержит нековалентный ионный комплекс анионного ГК-полисахарида с катионным полисахаридом, и при этом каждый из анионного ГК-полисахарида и катионного полисахарида независимо является сшитым или несшитым.
[00217] 2a. В варианте осуществления 2a предложен дермальный филлер как в варианте осуществления 1a, в котором анионный ГК-полисахарид представляет собой гиалуроновую кислоту.
[00218] 3a. В варианте осуществления 3a предложен дермальный филлер как в варианте осуществления 1а, в котором анионный ГК-полисахарид выбран из несшитой анионной ГК, сшитой анионной ГК и их смеси.
[00219] 4a. В варианте осуществления 4a предложен дермальный филлер как в варианте осуществления 2a, причем анионный ГК-полисахарид выбран из несшитой ГК, сшитой ГК и их смеси.
[00220] 6a. В варианте осуществления 6a предложен дермальный филлер как в варианте осуществления 5a, в котором катионный полисахарид выбран из несшитого катионного полисахарида, сшитого катионного полисахарида и их смеси; предпочтительно катионный полисахарид является несшитым.
[00221] 7a. В варианте осуществления 7a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–4a, в котором катионный полисахарид выбран из катионной ГК, несшитого хитозана и несшитого триметилхитозана.
[00222] 8a. В варианте осуществления 8a предложен дермальный филлер как в варианте осуществления 7a, в котором катионный полисахарид выбран из хитозана и триметилхитозана, каждый из которых является несшитым.
[00223] 9a. В варианте осуществления 9a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–4a, в котором катионный полисахарид представляет собой несшитый хитозан.
[00224] 10a. В варианте осуществления 10a предложен дермальный филлер по варианту осуществления 1a, в котором анионная ГК представляет собой сшитую гиалуроновую кислоту, а катионный полисахарид представляет собой несшитый хитозан.
[00225] 11a. В варианте осуществления 11a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–10a, причем анионный ГК-полисахарид и катионный полисахарид присутствуют в молярном соотношении от приблизительно 1 до 1000, от приблизительно 1 до 100, от приблизительно 1 до 10, от приблизительно 1 до 9, от приблизительно 1 до 8, от приблизительно 1 до 7, от приблизительно 1 до 6, от приблизительно 1 до 5, от приблизительно 1 до 4, от приблизительно 1 до 3, от приблизительно 1 до 2, от приблизительно 1 до 1, от приблизительно 1 до 0,1, от приблизительно 1 до 0,01 или от приблизительно 1 до 0,001; предпочтительно, чтобы дермальный филлер содержал от приблизительно 1 молярного эквивалента анионного полисахарида до приблизительно 0,04 и до приблизительно 0,20 молярных эквивалентов катионного полисахарида.
[00226] 12a. В варианте осуществления 12a предложен дермальный филлер как в одном из вариантов осуществления 1a–11a, дополнительно содержащий косметический агент.
[00227] 13a. В варианте осуществления 13a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–11a, дополнительно содержащий агент, выбранный из антиоксиданта, противозудного агента, антицеллюлитного агента, агента против образования шрамов, анестезирующего агента, отшелушивающего агента, натягивающего агента, агента против акне, агента для осветления кожи, агента для пигментации кожи, агента против пигментации, увлажняющего агента, витамина и любой комбинации одного или более из вышеуказанного.
[00228] 14a. В варианте осуществления 14a предложен дермальный филлер как в варианте осуществления 12a или 13a, причем агент высвобождается в мягкую ткань в месте введения или вокруг него в течение по меньшей мере приблизительно 3 недель после введения дермального филлера в мягкую ткань.
[00229] 15a. В варианте осуществления 15a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–14a, дополнительно содержащий физиологически приемлемый носитель.
[00230] 16a. В варианте осуществления 16a предложен дермальный филлер как в варианте осуществления 15a, в котором носитель представляет собой фосфатно-солевой буфер или несшитую ГК.
[00231] 17a. В варианте осуществления 17a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–16a, в котором ГК-гидрогель имеет модуль накопления (G’) от приблизительно 50 Па до приблизительно 5000 Па, от приблизительно 50 Па до приблизительно 3000 Па, от приблизительно 50 Па до приблизительно 1000 Па, от приблизительно 50 до приблизительно 500 Па, от приблизительно 50 до приблизительно 400 Па, от приблизительно 50 до приблизительно 300 Па или от приблизительно 100 до приблизительно 300 Па; предпочтительно от приблизительно 30 Па до приблизительно 500 Па.
[00232] 18a. В варианте осуществления 18a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–17a, который вводят путем инъекции через иглу, причем калибр иглы составляет по меньшей мере 18, по меньшей мере 21, по меньшей мере 23, по меньшей мере 25, по меньшей мере 27 или по меньшей мере 30; предпочтительно по меньшей мере 27.
[00233] 19a. В варианте осуществления 19a предложен дермальный филлер как в любом одном из вариантов осуществления 1a–18a, имеющий G’ по меньшей мере приблизительно 500 Па, причем дермальный филлер пригоден для инъекций через иглу без размерной оптимизации или гомогенизации дермального филлера перед инъекцией; причем игла имеет калибр по меньшей мере 27.
[00234] 20a. В варианте осуществления 20a предложен способ обработки мягкой ткани (такой как кожа) субъекта, причем способ включает в себя инъекцию дермального филлера в соответствии с любым одним из вариантов осуществления 1a–19a в мягкую ткань субъекта.
[00235] 21a. В варианте осуществления 21a предложен способ по варианту осуществления 20a, причем мягкая ткань представляет собой кожу, при этом способ включает в себя инъекцию дермального филлера в соответствии с любым одним из вариантов осуществления 1a–19a в область дермы субъекта.
[00236] 22a. В варианте осуществления 22a предложен способ как в варианте осуществления 20a или 21a, в котором обработка включает в себя увеличение объема мягкой ткани, повышение качества мягкой ткани или уменьшение дефекта мягкой ткани субъекта.
[00237] 23a. В варианте осуществления 23a предложен способ как в любом одном из вариантов осуществления 20a–22a, причем обработка включает в себя формирование, заполнение, увеличение объема или пластику мягких тканей субъекта.
[00238] 24a. В варианте осуществления 24a предложен способ как в любом одном из вариантов осуществления 20a–22a, причем обработка включает в себя улучшение гомеостаза дермы, увеличение толщины кожи, заживление раны или уменьшение шрама у субъекта.
[00239] 25a. В варианте осуществления 25a предложен способ как в варианте осуществления 22a, в котором дефект представляет собой морщину, шрам или утрату дермальной ткани.
[00240] 26a. В варианте осуществления 26a предложен способ как в любом одном из вариантов осуществления 20a–25a, причем дермальный филлер сохраняется в мягкой ткани (такой как кожа) субъекта в течение по меньшей мере приблизительно: 3 месяцев, 4 месяцев, 5 месяцев или 6 месяцев после инъекции филлера в мягкую ткань субъекта.
[00241] 27a. В варианте осуществления 27a предложен способ как в любом одном из вариантов осуществления 21a–25a, причем дермальный филлер сохраняется в области дермы субъекта в течение по меньшей мере приблизительно: 3 месяцев, 4 месяцев, 5 месяцев или 6 месяцев после инъекции филлера в область дермы субъекта.
[00242] 28a. В варианте осуществления 28a предложен способ как в любом одном из вариантов осуществления 20a–27a, причем обработка является эффективной в течение периода, составляющего по меньшей мере приблизительно 3 месяца.
[00243] 29a. В варианте осуществления 29a предложен способ по любому из вариантов осуществления 20a–28a, причем мягкая ткань представляет собой кожу.
[00244] В варианте осуществления (I) предложен дермальный филлер по любому из вариантов осуществления 1–23, причем указанный гидрогель содержит полимерный компонент, состоящий из анионного ГК-полисахарида (a) и катионного полисахарида (b).
[00245] В варианте осуществления (Ia) предложен дермальный филлер по варианту осуществления (I), в котором полимерный компонент состоит из сшитой гиалуроновой кислоты и несшитого катионного полисахарида.
[00246] В варианте осуществления (Ib) предложен дермальный филлер по варианту осуществления (Ia), в котором несшитый катионный полисахарид представляет собой хитозан.
[00247] В варианте осуществления (II) предложен дермальный филлер по любому из вариантов осуществления 1a–19a, причем указанный гидрогель содержит полимерный компонент, состоящий из анионного ГК-полисахарида (a) и катионного полисахарида (b).
[00248] В варианте осуществления (IIa) предложен дермальный филлер по варианту осуществления (II), в котором полимерный компонент состоит из сшитой гиалуроновой кислоты и несшитого катионного полисахарида.
[00249] В варианте осуществления (IIb) предложен дермальный филлер по варианту осуществления (IIa), в котором несшитый катионный полисахарид представляет собой хитозан.
ПРИМЕРЫ
Пример 1. Материалы для получения настоящих гидрогелей, пригодных для использования в качестве дермальных филлеров
[00250] A. Несшитая ГК. Несшитая ГК с молекулярной массой от приблизительно 50 тыс до приблизительно 3 млн дальтон была приобретена в компании HTL Biotechnology (Франция).
[00251] B. Сшитая ГК. К источникам сшитой ГК относятся доступные в продаже ГК-гидрогели, такие как дермальный филлер под маркой Juvederm® (Allergan, Inc.), например, дермальный филлер Juvederm® Ultra Plus или дермальный филлер Juvederm® Voluma. Также для исследовательских целей может использоваться сшитая ГК, имеющая модуль накопления (G’) от приблизительно 500 до приблизительно 1000 Па. Способы получения сшитой ГК описаны в публикациях Lebreton (US 2010/0226988, US 2008/0089918, US 2010/0028438 и US 2006/0194758; выше) и Njikang et al. (US 2013/0096081; выше).
[00252] C. Катионная ГК. Катионную ГК можно получить в соответствии с процедурами, описанными в настоящем документе, например, как показано ниже.
[00253] Схема 3. Введение катионов аммония в ГК. ГК связывают с HMDA в присутствии EDC с получением катионной ГК, содержащей ионы первичного аммония.
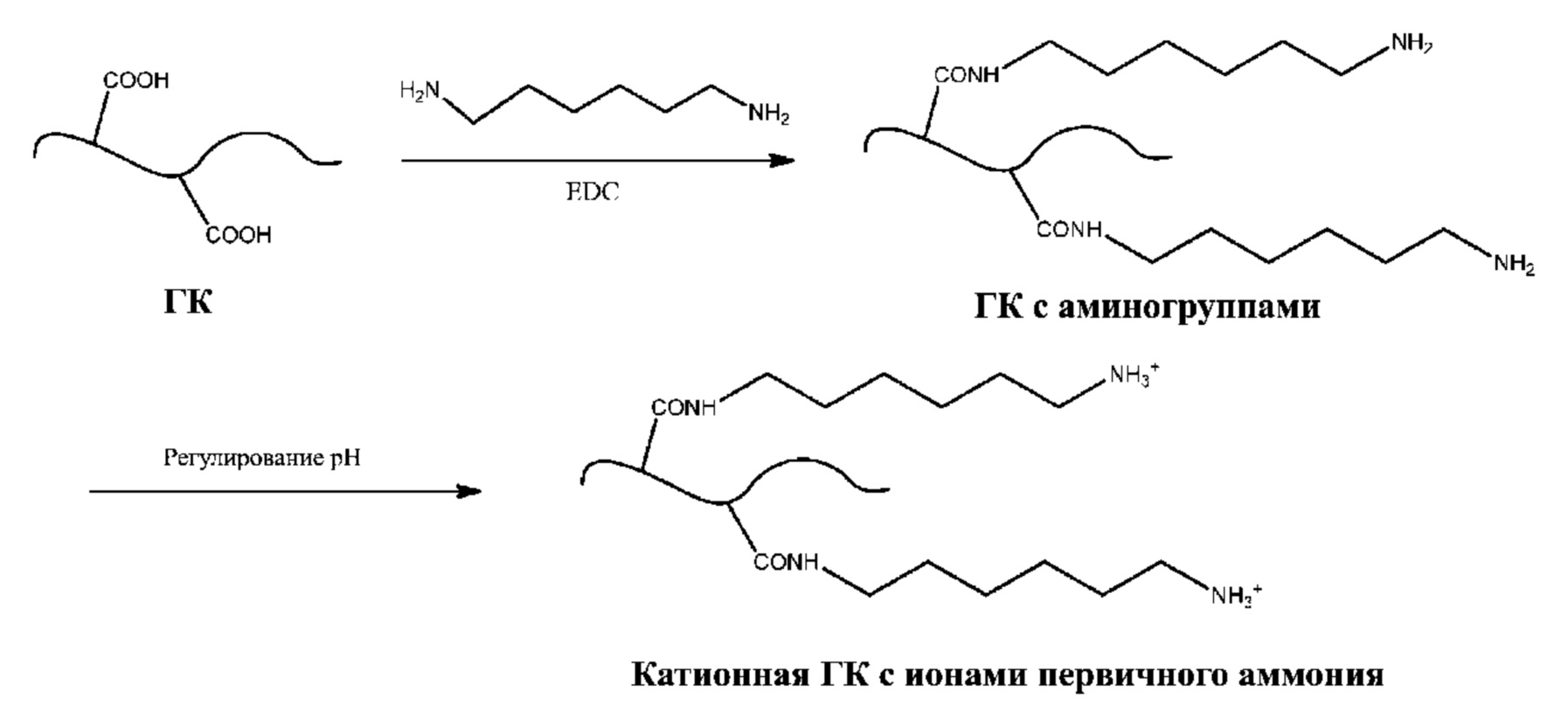
[00254] Схема 4. Введение катионов аммония в ГК. ГК связывают с метиловым эфиром Nэпсилон-BOC-лизина в присутствии EDC с последующим удалением защитной группы BOC с получением катионной ГК, содержащей ионы первичного аммония.
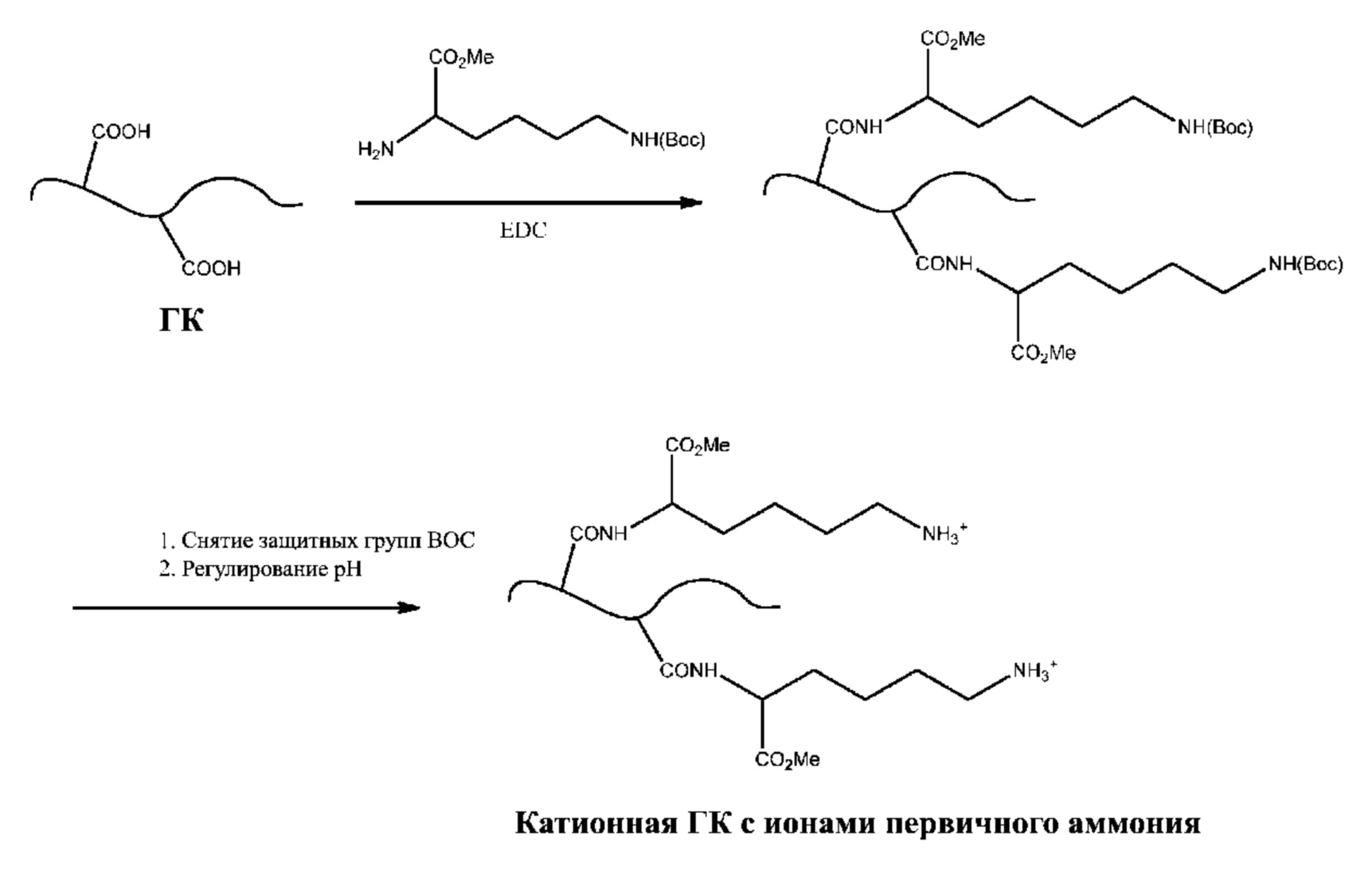
[00255] Схема 5. Введение катионов гуанидиния в ГК. Катионная ГК, полученная по схеме 3, взаимодействует с 1H-пиразол-1-карбоксамидином с получением катионной ГК, имеющей ионы гуанидиния.
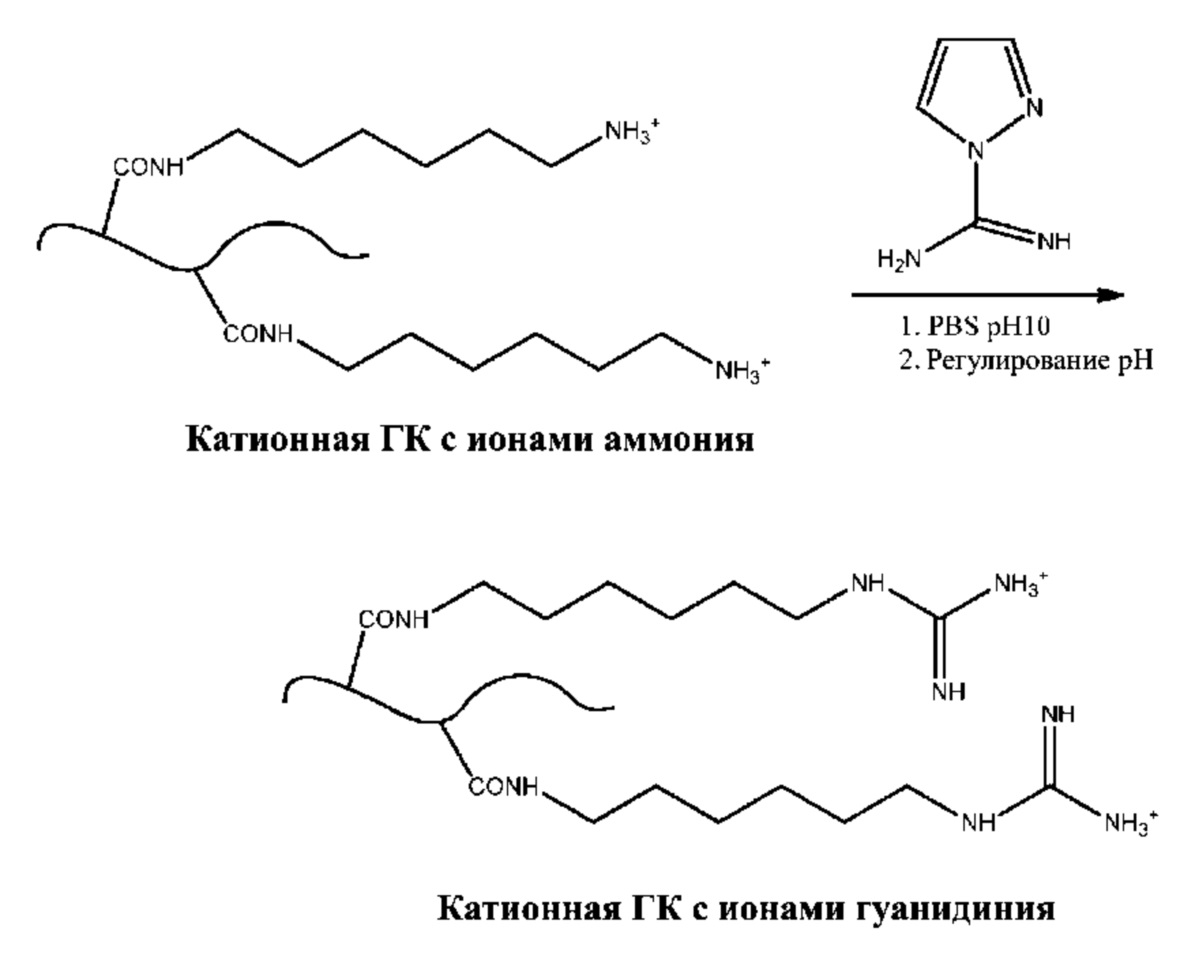
[00256] Схема 6. Введение катионов гуанидиния в ГК. Катионная ГК, полученная по схеме 4, взаимодействует с 1H-пиразол-1-карбоксамидином с получением катионной ГК, имеющей ионы гуанидиния.
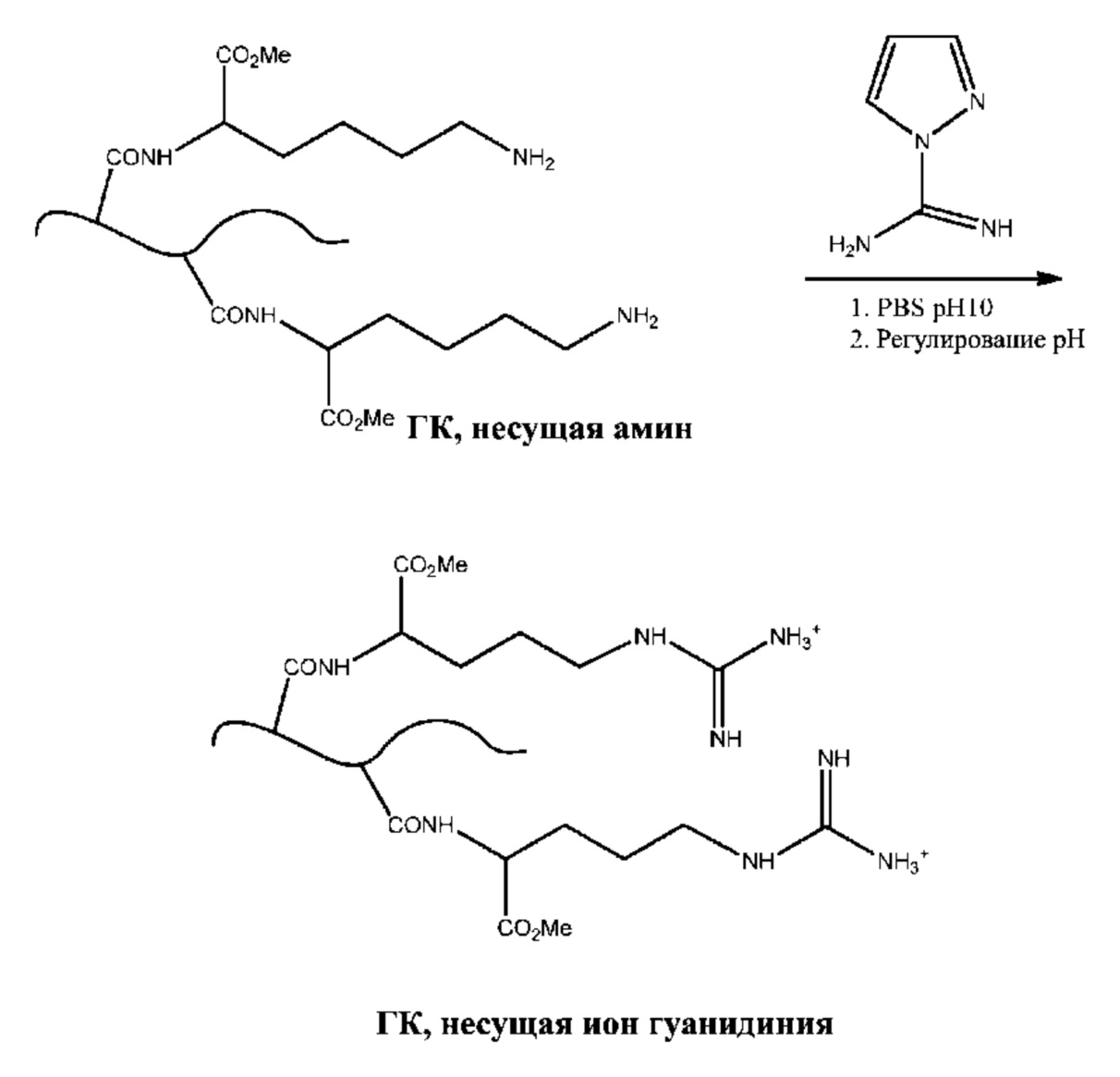
[00257] (i) Несшитая катионная ГК, содержащая ионы первичного аммония. Вкратце, в шприце объемом 15 мл приблизительно 50 мг несшитой ГК (MW: 300~800 тыс дальтон) и 14,4 мг гексаметилендиамина (HMDA) растворяют в буфере MES с pH 5,0. Затем в отдельный шприц объемом 15 мл, содержащий 5 мл буфера MES с pH 5,0, добавляют 23,9 мг 1-этил-3-[3-диметиламинопропил] карбодиимида гидрохлорида (EDC) и 14,3 мг N-гидроксисукцинимида (NHS). Два шприца соединяют друг с другом через соединитель и перемешивают 20 раз за счет многократного введения/выдвигания поршней шприцев. Полученную смесь переносят во флакон и оставляют на 6 часов, а затем подвергают дальнейшей очистке диализом относительно PBS с использованием диализной пробирки с отсечкой молекулярной массы 20 000 дальтон. Полученный раствор лиофилизируют с получением сухого порошка. Полученная несшитая ГК (ГК-HMDA) будет иметь функциональные группы первичного амина, т.е. несшитая ГК-HMDA содержит первичные аммониевые группы при физиологическом pH.
[00258] (ii) Несшитая катионная ГК, содержащая ионы гуанидиния. Несшитую ГК-HMDA (полученную так, как описано выше) вводят в реакцию с 1H-пиразол-1-карбоксамидина гидрохлоридом в буфере PBS с pH 10. Вкратце, 10 мг несшитой ГК-HMDA растворяют в 5 мл буфера PBS с pH 10, после чего добавляют 20 мг 1H-пиразол-1-карбоксамидина гидрохлорида. Реакционную смесь оставляют на приблизительно 5 часов. Полученный раствор диализуют относительно буфера PBS с pH 7 с использованием диализной пробирки с отсечкой молекулярной массы 20 000 дальтон. Полученный раствор лиофилизируют с получением сухого порошка. Полученная несшитая катионная ГК будет нести гуанидиниевые группы.
[00259] (iii) Сшитая ГК, содержащая ионы первичного аммония. Приблизительно 50 мг сшитой ГК (полученной так, как указано в примере 1B) и 14,4 мг HMDA растворяют в буфере MES с pH 5,0. Затем в отдельный шприц объемом 15 мл, содержащий 5 мл буфера MES с pH 5,0, добавляют 23,9 мг EDC и 14,3 мг NHS. Два шприца соединяют друг с другом через соединитель и перемешивают 20 раз за счет многократного введения/выдвигания поршней шприцев. Полученную смесь переносят во флакон и оставляют на приблизительно 6 часов, а затем подвергают дальнейшей очистке диализом с использованием диализной пробирки с отсечкой молекулярной массы 20 000 дальтон. Полученный раствор лиофилизируют с получением сухого порошка. Полученная сшитая ГК (ГК-HMDA) будет иметь функциональные группы первичного амина, т.е. сшитая ГК-HMDA будет содержать первичные аммониевые группы при физиологическом pH.
[00260] (iv) Сшитая ГК, содержащая ионы гуанидиния. Сшитую ГК-HMDA (полученную так, как описано выше) вводят в реакцию с 1H-пиразол-1-карбоксамидина гидрохлоридом в буфере PBS с pH 10. Вкратце, 10 мг сшитой ГК-HMDA растворяют в 5 мл буфера PBS с pH 10, после чего добавляют 20 мг 1H-пиразол-1-карбоксамидина гидрохлорида. Реакционную смесь оставляют на приблизительно 5 часов. Полученный раствор диализуют относительно буфера PBS с pH 7. Полученный раствор лиофилизируют с получением сухого порошка. Полученная сшитая катионная ГК будет нести гуанидиниевые группы.
[00261] D. Модифицированная анионная ГК.
[00262] (i) Несшитые ГК, модифицированные функциональными группами фосфоновой кислоты. Материал будет получен путем взаимодействия несшитой ГК с аминофосфоновой кислотой с использованием химического агента EDC. Вкратце, в шприце объемом 15 мл приблизительно 50 мг несшитой ГК (MW: 300~800 дальтон) и 27,8 мг аминометилфосфоновой кислоты растворяют в буфере MES с pH 5,0. Затем в отдельный шприц объемом 15 мл, содержащий 5 мл буфера MES с pH 5,0, добавляют 23,9 мг EDC и 14,3 мг NHS. Два шприца соединяют друг с другом через соединитель и перемешивают приблизительно 20 раз за счет многократного введения/выдвигания поршней шприцев. Полученную смесь переносят во флакон и оставляют на приблизительно 6 часов, а затем подвергают дальнейшей очистке диализом с использованием диализной пробирки с отсечкой молекулярной массы 20 000 дальтон. Полученный раствор лиофилизируют до сухого порошка с получением несшитой анионной ГК, содержащей фосфонатные группы.
[00263] (ii) Несшитые ГК, модифицированные функциональными группами сульфоновой кислоты. Материал будет получен с использованием процедуры, аналогичной описанной в примере 1D(i), с использованием аминосульфаминовой кислоты вместо аминофосфоновой кислоты для функционализации ГК, с получением несшитой анионной ГК, содержащей сульфонатные группы.
[00264] (iii) Несшитые ГК, модифицированные функциональными группами фосфоновой кислоты. Сшитую ГК (полученную так, как указано в примере B) модифицируют с помощью функциональных групп фосфоновой кислоты в условиях, по существу таких, как описано в примере 1D(i), с получением сшитой ГК, содержащей группы фосфоновой кислоты. Альтернативно несшитые ГК, модифицированные группами фосфоновой кислоты, как описано в примере D(i), сшивают с использованием процедур поперечного сшивания ГК, как описано в публикациях Lebreton (US 2010/0226988, US 2008/0089918, US 2010/0028438 и US 2006/0194758; выше) и Njikang et al. (выше), с получением сшитой ГК, содержащей группы фосфоновой кислоты.
[00265] (iv) Сшитая ГК, модифицированная функциональными группами сульфоновой кислоты. Сшитую ГК (полученную так, как указано в примере 1B) модифицируют с помощью функциональных групп сульфоновой кислоты в условиях, по существу таких, как описано в примере 1D(ii), с получением сшитой ГК, содержащей группы сульфоновой кислоты. Альтернативно несшитые ГК, модифицированные группами сульфоновой кислоты, как описано в примере D(i), сшивают с использованием процедур поперечного сшивания ГК, как описано в публикациях Lebreton (US 2010/0226988, US 2008/0089918, US 2010/0028438 и US 2006/0194758; выше) и Njikang et al. (выше), с получением сшитой ГК, содержащей группы сульфоновой кислоты.
[00266] E. Хитозаны.
[00267] (i) Высокочистый хитозан (HPC) с Mw 60 000–120 000 приобретали в компании Sigma Aldrich. HPC с молекулярной массой от приблизительно 10 000 Да до приблизительно 1 000 000 Да получают из коммерческих источников.
[00268] (ii) Триметилхитозан может быть получен из коммерческих источников или может быть получен известными способами алкилирования хитозана (такими как HPC).
Пример 2. Получение гидрогеля с использованием несшитой ГК и катионной ГК
[00269] В шприце объемом 10 мл приблизительно 25 мг несшитой ГК с молекулярной массой от приблизительно 1 миллиона до приблизительно 3 миллионов дальтон гидратируют, используя 5 мл 1 x PBS. Несшитую катионную ГК (пример 1C) отдельно растворяют в 1 x PBS в концентрации приблизительно 1 мас. %. Гидратированную ГК смешивают с несшитой катионной ГК при изменяющемся соотношении зарядов (-COOH/гуанидиний) от 1 : 20 до 20 : 1 до получения коацерватного геля. Для удаления избыточной воды можно использовать дополнительное центрифугирование.
Пример 3. Получение гидрогеля с использованием сшитой ГК с высоким G' и катионной ГК
[00270] В шприцах емкостью 10 мл приблизительно 2 мл сшитой ГК с модулем накопления (G’) от приблизительно 500 Па до приблизительно 1000 Па смешивают с 1 мас. % несшитой катионной ГК, содержащей катионные группы гуанидиния (получена так, как описано в примере 1C(ii)) в буфере PBS с pH 7,5 при изменяющемся соотношении зарядов (-COOH/гуанидиний) от 1 : 10 до 50 : 1 до получения коацерватного геля.
Пример 4. Получение гидрогеля с использованием Juvederm® Ultra Plus и хитозана
[00271] Приготовление раствора хитозана. Высокочистый хитозан (HPC; см. пример 1E; Mw 85 кДа, степень ацетилирования 24,4 моль %) растворяли в кислой воде (4,904 мл воды milliQ с 96 микролитрами концентрированной HCI) до конечной концентрации 38,76 мг/мл, после чего раствор стерилизовали паром (128°C, 5 мин). Далее полученный раствор HPC разбавляли до различных концентраций в диапазоне от 0,4 мг/мл до 1,9 мг/мл с использованием воды milliQ и разбавленные растворы использовали для приготовления различных составов гидрогеля.
[00272] Получение гидрогеля. Juvederm® Ultra Plus (JUP; 1 куб. см) смешивали с 50 микролитрами каждого разбавленного водного раствора HPC (от 0,4 мг/мл до 1,9 мг/мл) с получением гелевых смесей с эквивалентным соотношением HPC и JUP в диапазоне от 0,04 : 1 до 0,2 : 1. Гели подвергали испытаниям для определения реологических параметров и испытаниям на набухание/диссоциацию.
[00273] Механические свойства гидрогелевых составов. После смешивания наблюдали изменения в физическом внешнем виде и величинах модулей гидрогелей (Фиг. 3). При постепенном увеличении концентрации HPC материал гидрогеля становился все более непрозрачным.
[00274] Определение реологических свойств геля. Для измерения реологических свойств гелей использовали колебательный реометр с плоскопараллельным зазором (Anton Paar, Physica MCR 302). Диаметр использованной пластины составлял 25 мм. Зазор между пластинами устанавливали на уровне 1 мм. Для каждого измерения сначала запускали частотный цикл при постоянной деформации, а затем цикл деформаций при фиксированной частоте. Величину G’ (модуль накопления) гидрогелей получали из кривой цикла деформаций при 1% деформации с частотой деформации 5 Гц. Модуль накопления (G') снижался поэтапно с увеличением концентрации HPC (Фиг. 3B). В исследуемом диапазоне модуль при самой высокой концентрации хитозана снижался приблизительно на 9,5%.
[00275] Испытание гелей на набухание/диссоциацию. Каждый гидрогель (приблизительно 250 мкл) вводили в цилиндрическую форму и центрифугировали для удаления пузырьков. Затем гидрогели переносили в PBS (20 мл) и инкубировали на орбитальном встряхивателе при 37°C и 200 об/мин. В течение первых 24 часов гидрогели достигали равновесного набухания, а затем сохраняли целостность без дальнейшей диссоциации или рассеяния в PBS. Тогда как гель без добавления хитозана диссоциировал и рассеивался в буфере PBS в течение двух дней (данные не показаны), все составы, содержащие хитозан, оставались стабильными в течение по меньшей мере 29 дней (Фиг. 4).
Пример 5. Испытание когезивности гелей при разбавлении
[00276] Гидрогели, изготовленные в примере 4, замачивали в избытке раствора PBS. Смесь подвергли встряхиванию со скоростью 200 об/мин. Сохранение целостности геля определяли с помощью визуального наблюдения.
Пример 6. Испытание пластичности гелей
[00277] Гидрогели, изготовленные в примерах выше, оценивали на способность к подтягиванию и на пластичность.
[00278] Для количественного анализа способности геля к подтягиванию выполняют испытание на линейное сжатие для оценки подтягивающей способности с использованием колебательного реометра с плоскопараллельным зазором (Anton Paar, MCR302). В этом испытании между пластинами помещают филлер с известной массой и верхнюю пластину опускают с постоянной скоростью, измеряя вертикальную силу (противоположную деформации); более высокое значение вертикальной силы представляет более высокую устойчивость к деформации.
[00279] Пластичность геля оценивают путем измерения предрасположенности введенного филлера к деформации при воздействии определенного внешнего усилия. Применяемое усилие, 319 грамм, было выбрано для имитации силы большого пальца выполняющего инъекцию человека при манипуляциях с филлером. Пластичность филлера измеряют в течение девяти дней на модели крыс линии Спрэг-Доули с использованием устройства трехмерной визуализации Canfield 3D Imaging.
[00280] Было определено, что гели обладают хорошей подтягивающей способностью и пластичностью.
[00281] В качестве заключения, следует понимать, что, хотя аспекты настоящего описания были изложены со ссылкой на различные варианты осуществления, специалисту в данной области будет понятно, что конкретные описанные примеры приведены только для иллюстрации принципов объекта изобретения, представленных в настоящем документе. Таким образом, следует понимать, что описанный объект изобретения никоим образом не ограничен конкретной методологией, протоколом и/или реагентом и т.д., описанными в настоящем документе. Таким образом, специалисты в данной области могут создавать многочисленные и разнообразные модификации, или изменения, или альтернативные конфигурации описанного объекта изобретения, которые могут быть выполнены в соответствии с идеями, представленными в настоящем документе, без отступления от сущности настоящего описания. Возможно внесение изменений в детали без отклонения от сущности изобретения, определенной в прилагаемых пунктах формулы изобретения. Наконец, в настоящем документе терминология служит только для цели описания конкретных вариантов осуществления и не должна рассматриваться как ограничивающая объем настоящего изобретения, который определяется исключительно пунктами формулы изобретения. Кроме того, предполагается, что все вещества, указанные в приведенном выше описании или показанные на сопроводительных чертежах, следует интерпретировать только как иллюстративные, а не как ограничивающие изобретение. Соответственно, настоящее изобретение не ограничено строго показанными фигурами и описанием.
[00282] В настоящем документе описаны определенные варианты осуществления данного изобретения, включая лучший способ реализации изобретения, известный авторам изобретения. Разумеется, после прочтения приведенного выше описания специалистам в данной области будут понятны отклонения от этих описанных вариантов осуществления. Автор изобретения предполагает, что специалисты будут использовать такие вариации в зависимости от обстоятельств, и предполагают, что изобретение будет реализовано на практике иным образом, чем описано в настоящем документе. Соответственно, данное изобретение включает в себя все модификации и эквиваленты объекта изобретения, изложенного в прилагаемой формуле изобретения, в соответствии с действующим законодательством. Более того, изобретение охватывает любую комбинацию описанных выше элементов во всех возможных вариантах, если в настоящем документе не указано иное или если это явно не противоречит контексту.
[00283] Группировки альтернативных элементов или вариантов осуществления изобретения, описанных в настоящем документе, не следует рассматривать как ограничения. Каждый элемент группы может быть именован и заявлен индивидуально или в любой комбинации с другими элементами группы или другими элементами, описанными в настоящем документе. Предполагается, что один или более элементов группы могут быть включены в группу или удалены из группы по причинам удобства и/или патентоспособности. После осуществления любого такого включения или удаления описание рассматривается как содержащее модифицированную группу, таким образом выполняя письменное описание всех групп Маркуша, используемых в прилагаемой формуле изобретения.
[00284] Если не указано иное, все числа, выражающие количества ингредиентов, характеристик, таких как молекулярная масса, условий реакции и т.п., используемые в описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином «приблизительно». Используемый в настоящем документе термин «приблизительно» означает, что элемент, параметр или термин, имеющий такую квалификацию, охватывает диапазон плюс или минус десять процентов выше и ниже значения указанного элемента, параметра или термина. Соответственно, если не указано противоположное, числовые параметры, указанные в описании и прилагаемой формуле изобретения, являются приближенными значениями, которые могут варьировать в зависимости от желательных свойств, которые требуется получить посредством настоящего изобретения. В самом крайнем случае, но не в качестве попытки ограничить применение теории эквивалентов к объему формулы изобретения, каждый числовой параметр должен по меньшей мере рассматриваться с учетом числа представленных значащих цифр и с использованием стандартных методик округления. Хотя числовые диапазоны и параметры, устанавливающие широкий объем объекта изобретения, являются приблизительными, числовые значения, указанные в конкретных примерах, представлены настолько точно, насколько это возможно. Однако любое числовое значение по своей природе содержит определенные ошибки, неизбежно вытекающие из стандартного отклонения, обнаруживаемого при соответствующих тестовых измерениях.
[00285] Формы единственного числа и им подобные рассматриваемые объекты в контексте описания изобретения (в особенности в контексте последующей формулы изобретения) необходимо рассматривать как охватывающие как единственное, так и множественное число, если в настоящем документе не указано иное или если это явно не противоречит контексту. Перечисление диапазонов значений в настоящем документе используется исключительно в качестве сокращенного способа ссылки индивидуально на каждое отдельное значение, находящееся в пределах указанного диапазона. Если в настоящем документе не указано иное, каждое индивидуальное значение включено в описание так, как если бы оно было индивидуально указано в настоящем документе. Все описанные в настоящем документе способы могут выполняться в любом приемлемом порядке, если в настоящем документе не указано иное или если это явно не противоречит контексту. Использование любых и всех примеров или фраз для указания примера (например, «такой как») предназначено только для лучшего разъяснения изобретения и не накладывает ограничения на объем изобретения, если не заявлено иное. Ни одну формулировку в описании не следует рассматривать как формулировку, называющую любой незаявленный элемент существенным для практической реализации изобретения.
[00286] Конкретные варианты осуществления, описанные в настоящем документе, могут быть дополнительно ограничены в формуле изобретения с использованием выражений «состоящий из» или «состоящий по существу из». При использовании в формуле изобретения независимо от того, входит ли термин в исходную заявку или добавляется в соответствии с поправкой, термин «состоящий из» исключает любой элемент, стадию или ингредиент, не указанный в формуле изобретения. Переходный термин «состоящий по существу из» ограничивают объем пункта формулы указанными материалами или стадиями и тем, что не оказывает существенного влияния на основные и новые характеристики. Варианты осуществления изобретения, заявленные таким образом, по существу или явным образом описаны и использованы в настоящем документе.
[00287] Все патенты, патентные публикации и другие публикации, на которые даны ссылки и которые указаны в настоящем описании, индивидуально и явным образом полностью включены в настоящий документ путем ссылки в целях описания и раскрытия, например, композиций и методологий, описанных в таких публикациях, которые могут применяться в связи с настоящим изобретением. Эти публикации приведены исключительно для их изложения на момент до даты подачи настоящей заявки. Ничто в этом отношении не должно толковаться как признание того, что авторы изобретения не имеют права относить такое описание к более ранней дате в силу предшествующего изобретения или по любой другой причине. Все заявления о дате или представление в отношении содержания этих документов основаны на информации, имеющейся у заявителей, и не представляют собой какого-либо признания корректности дат или содержания этих документов.
Реферат
Группа изобретений относится к области косметической промышленности, а именно к дермальному филлеру, обладающему способностью к подтягиванию кожи, содержащему гидрогель, причем гидрогель содержит: (a) анионную гиалуроновую кислоту (ГК); и (b) водорастворимый катионный полисахарид, имеющий чистый положительный заряд в растворе при физиологическом pH, где гидрогель представляет собой коацерватный гидрогель и также относится к способу улучшения подтягивающей способности кожи субъекта, включающему в себя инъекцию дермального филлера в кожу субъекта. Группа изобретений обеспечивает разработку дермального филлера, который обладает способностью к подтягиванию кожи. 2 н. и 19 з.п. ф-лы, 4 ил., 6 пр.

Комментарии