Составы кожного наполнителя, включая антиоксиданты - RU2624239C2
Код документа: RU2624239C2
Чертежи





Описание
ОБЛАСТЬ ТЕХНИКИ
Эта заявка заявляет приоритет и эффект заявки на предварительный патент США под №61/493309, зарегистрированной 3 июня 2011 года, полное раскрытие которой включено в данную работу посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Изобретение в общих чертах связано с составами кожного наполнителя, а более конкретно - с впрыскиваемыми составами кожного наполнителя, включая антиоксиданты.
Старение кожи - это прогрессирующее явление, которое возникает со временем и может ускоряться под воздействием таких факторов образа жизни, как употребление алкоголя, курение и пребывание на солнце. Старение кожи лица может характеризоваться ее атрофией, провисанием и жировым утолщением. Атрофия соответствует значительному сокращению толщины кожной ткани. Провисание тканей подкожной основы приводит к появлению избыточности кожного покрова и птозу, последствия которого проявляются в виде обвислых щек и припущенных век. Утолщение демонстрируется как чрезмерный вес лицевых мышц в виде вздутия нижней части лица и шеи. Эти изменения обычно ассоциируются с сухостью, потерей эластичности и загрубелостью кожной ткани.
Гиалуронан, также известный под названием гиалуроновая кислота (НА), представляет собой несульфированный гликозаминогликан, который распространен во всем человеческом теле - в соединительных связках, эпителии и в нервных тканях. Гиалуронан широко распространен в различных слоях кожи, где он выполняет многочисленные функции, например, такие как обеспечение надежной гидратации, оказание помощи в организации внеклеточного матрикса, воздействие в качестве материала наполнителя и участие в механизмах восстановления тканей. Однако с возрастом количество гиалуронана, коллагена, эластина и других матричных полимеров, присутствующих в коже, снижается. К примеру, повторное воздействие ультрафиолетового излучения, например, от солнца, приводит к тому, что кожные клетки снижают свою выработку гиалуронана, а также увеличивают скорость его распада. Такая потеря гиалуронана приводит к различным состояниям кожи, таким как, например, изъяны дефекты, заболевания и/или нарушения кожного покрова и тому подобному. Например, существует сильная корреляция между содержанием воды в коже и уровнями содержания гиалуронана в кожной ткани. По мере старения кожи количество и качество гиалуронана в коже снижается. Эти изменения приводят к высыханию и морщинистости кожи.
Кожные наполнители полезны для очистки мягких тканей и в других терапиях кожи, потому что могут заменить потерянные эндогенные матричные полимеры или усилить/посодействовать функции существующих матричных полимеров с целью лечения таких болезненных состояний кожи. В прошлом такие составы использовались в косметическом уходе для наполнения морщин, сглаживания линий, складок, шрамов и для увеличений кожных тканей, таких как, например, придание пухлости тонким губам или наполнение запавших глаз или впалых щек. Единым общим для всех матричным полимером, используемым в составах кожного наполнителя, является гиалуронан. В связи с тем, что гиалуронан является естественным для человеческого тела, он обычно хорошо переносится, и лечение с его помощью широкого разнообразия болезных состояний кожи характеризуется низким риском.
Первоначально составы включали гиалуронан, полученный из природных полимеров, существовавших в несшитом состоянии. Несмотря на демонстрирование биологической совместимости и сродство с молекулами воды, природный гиалуронан характеризуется слабыми биомеханическими свойствами при его использовании в качестве кожного наполнителя. Основная причина заключается в том, что по причине несшитого состояния этого полимера, он характеризуется высокой растворяемостью и, будучи таким, быстро очищается при введении в участок кожи. Эта, проводимая в организме, чистка достигается, главным образом, быстрым разложением полимеров, в основном, за счет ферментативного расщепления посредством гиалуронидазы и химического разложения посредством свободных радикалов. Таким образом, все еще находясь в коммерческом использовании, составы, включающие несшитые полимеры на основе гиалуронана, обладают тенденцией к разложению в течение нескольких дней после введения инъекции и, таким образом, требуют довольно частой повторной инъекции для поддержания своего эффекта по улучшению кожи.
Для минимизации действия этих двух направлений разложения полимеров гиалуронана в организме матричные полимеры «сшиваются» друг с другом с целью формирования стабилизированного гидрогеля. По причине того, что гидрогели, включающие поперечно сшитые матричные полимеры, являются более твердой субстанцией, кожные наполнители, включающие такие гидрогели, остаются в месте имплантации дольше. Кроме того, эти гидрогели более подходят в качестве кожных наполнителей по причине того, что их более твердое состояние улучшает механические свойства наполнителя, позволяя ему лучше подтягивать и заполнять участок кожи. Полимеры на основе гиалуронана, как правило «сшиваются» с помощью агента по образованию поперечных связей для формирования ковалентных связей между полимерами на основе гиалуронана. Такие поперечно сшитые полимеры образуют сеть менее растворимых в воде гидрогелей, которые проявляют более высокую стойкость к разложению и, таким образом, требуют менее частых повторных инъекций, чем составы на основе несшитого гиалуронана.
Витамин С, также известный как аскорбиновая кислота AsA, хорошо известен как антиоксидант, который снижает и тем самым нейтрализует такие активные частицы кислорода как перекись водорода, снижая, таким образом, окислительную нагрузку для получения различных положительных клинических эффектов, включая лечение сердечнососудистых заболеваний, гипертонии, хронических воспалительных процессов, диабета и тяжелых ожогов. Например, помимо других положительных эффектов витамин С действует как противовоспалительное средство и способствует коллагенозу и ангиогенезу. Как известно, витамин С способствует коллагенозу и/или ангиогенезу за счет функционирования в качестве кофермента в ферментативных реакциях, направленных на содействие образованию коллагена, развитие и поддержание кровеносных сосудов и хрящей. Как известно, витамин С тормозит биологические функции тирозиназы для предотвращения образования меланина или осветления пигментации меланина. По этим причинам имеется интерес к разработке составов кожного наполнителя, включающих витамин С.
Витамин С, как правило, неустойчив с момента воздействия на него воздуха, света и тепла. На определенных уровнях он также полагается цитотоксичным. Когда витамин С механически смешивается с гелем на основе гиалуроновой кислоты и впрыскивается под кожу, он полностью высвобождается из смеси менее чем за неделю.
Было бы желательно обеспечить создание впрыскиваемого состава на основе гиалуроновой кислоты, включающего витамин С или другой витамин с устойчивой скоростью высвобождения, то есть с такой скоростью высвобождения, которая держится неделями или даже месяцами, а не всего несколько дней. Однако, оказывается, трудно разработать устойчивые и эффективные продукты кожного наполнителя с устойчивой скоростью высвобождения, в состав которых включены витамины. Настоящее изобретение обеспечивает создание улучшенных составов кожного наполнителя на основе гиалуроновой кислоты, включая сопряженные витамины, например, производные витаминов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает создание новаторских кожных наполнителей, полезных для ухода за кожей. А более конкретно, то настоящее изобретение обеспечивает создание эффективных и долговременных составов кожного наполнителя терапевтического действия, в состав которых, как правило, включен биологически совместимый полимер, например, гиалуроновая кислота, и витамин, например, витамин С, например, производная витамина С.
В одном варианте изобретения полимер является гликаном, например, гиалуроновой кислотой. Гиалуроновая кислота включает поперечно сшитый компонент. Витамин может включать витамин С, например, производную витамина С. Более конкретно витамин С - это, по меньшей мере, один из следующих витаминов - 2-глюкозида L-аскорбиновой кислоты (AA2G), аскорбил 3-аминопропил фосфата (витаген) и аскорбил фосфат натрия (АА2Р).
В общих чертах витамины определяются как любая группа органических соединений, которые важны для нормального роста и питания и требуются в малых количествах в рационе, потому что они не могут быть синтезированы в человеческом организме.
В одном варианте изобретения витамин является производной витамина и ковалентно сопряжен с полимером за счет соответствующей химической реакции, например, этерификации с образованием простых эфиров, амидизации и этерификации с образованием сложных эфиров.
Уровень сопряжения составляет, самое большее, примерно 5 молекулярных процентов, самое большее, примерно 10 молекулярных процентов, самое большее, примерно 15 молекулярных процентов, самое большее, примерно 20 молекулярных процентов, самое большее, примерно 25 молекулярных процентов, самое большее, примерно 30 молекулярных процентов или, самое большее, примерно 40 молекулярных процентов.
В другом варианте изобретения представлены способы создания составов впрыскиваемых кожных наполнителей, включая поперечно сшитую гиалуроновую кислоту и сопряженный витамин С так, как представлено выше
В еще другом варианте изобретения представлены способы лечения дефектов кожи, включая введение под кожу состава в соответствие с изобретением.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 представлена структура 2-глюкозида L-аскорбиновой кислоты (AA2G).
На Фигуре 2 представлена структура аскорбил 3-аминопропил фосфата (витагена).
На Фигуре 3 представлена структура аскорбил фосфата натрия (АА2Р).
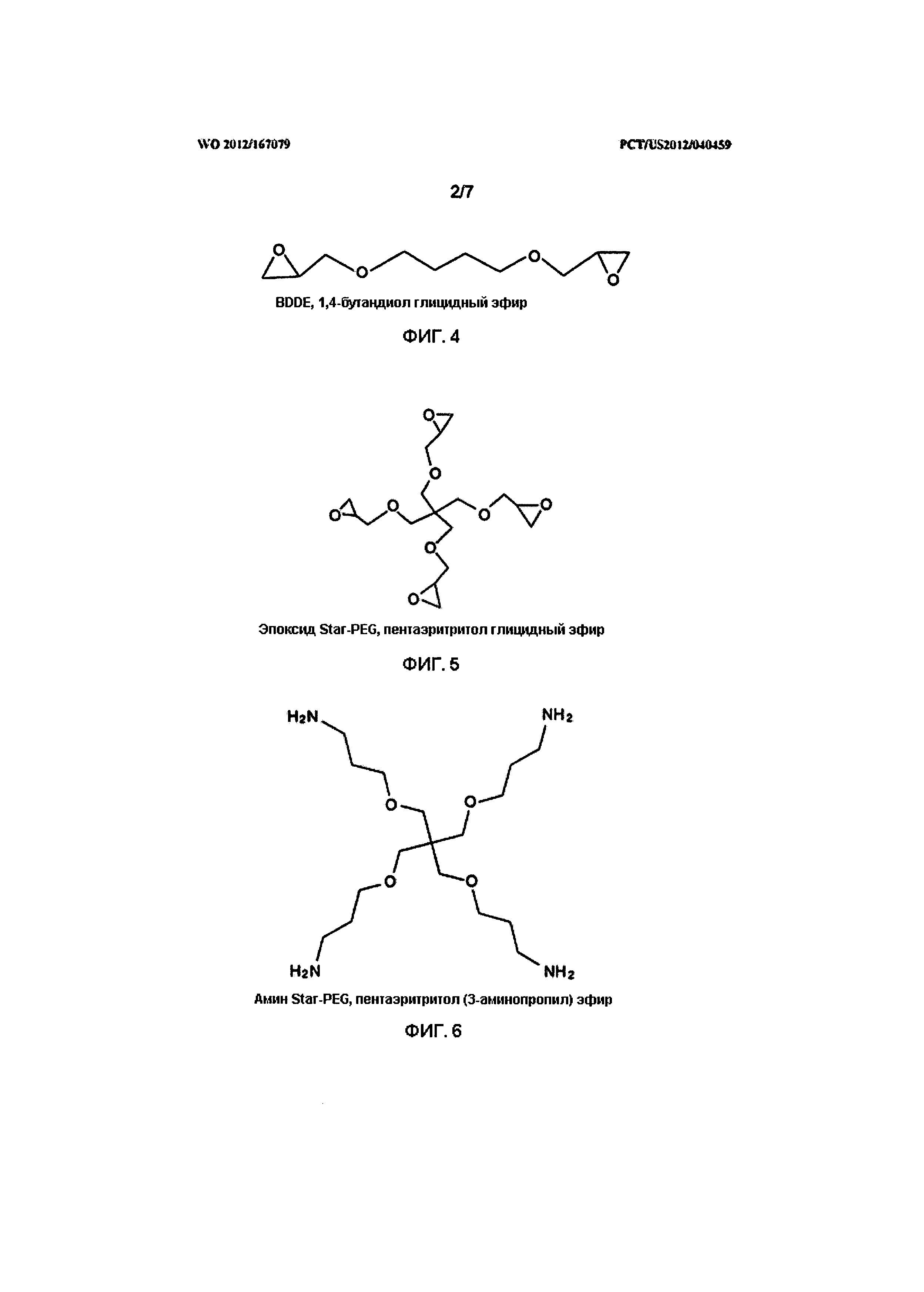
На Фигуре 4 представлена структура 1,4-бутандиол диглицидилового эфира (BDDE).
На Фигуре 5 представлена структура пентаэритритол глицидилового эфира (эпоксид Star-PEG).
На Фигуре 6 представлена структура пентаэритритол (3-аминопропил) эфира (амин Star-PEG).
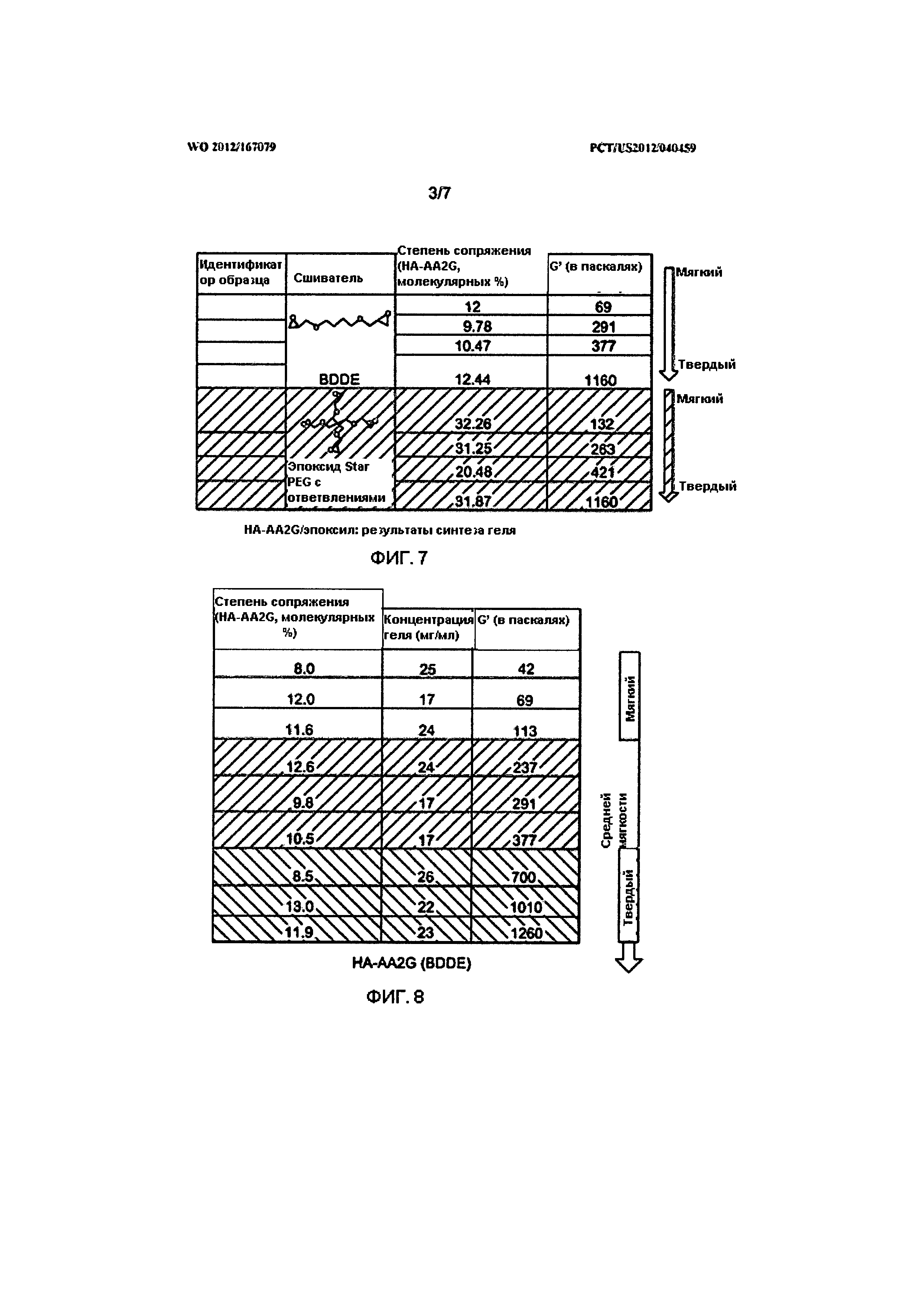
На Фигуре 7 представлена Таблица, в которой показан уровень сопряжения и значения G', используемые для различных составов кожного наполнителя согласно изобретению.
На Фигуре 8 представлена Таблица, в которой показаны уровни сопряжения, концентрация гиалуроновой кислоты и значения G' для составов кожного наполнителя на основе HA-AA2G (BDDE) согласно изобретению.
На Фигуре 9 представлена Таблица, в которой показано действие концентрации а-глюкозидазы на процесс высвобождения AsA из раствора AA2G-PBS.
На Фигуре 10 показано отображение профиля отщепления свободного AsA от сопряженных кожных наполнителей согласно изобретению (устойчивое высвобождение) (превращение AA2G в молекулярные проценты относительно времени прохождения химической реакции).
На Фигурах 11А и 11В показаны дополнительные данные о таком высвобождении для различных кожных наполнителей согласно изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте изобретения обеспечивается создание составов кожного наполнителя, составов, как правило, включающих биологически совместимый полимер, например гликан, такой как гиалуроновая кислота, загущенная сшитым полимером, и производную витамина С, ковалентно сопряженную с полимером. Состав обеспечивает устойчивое восстановление витамина С для неоколлагеноза кожи, а также другие полезные свойства терапевтического или косметического действия. При впрыскивании, например, под кожу, состав вступает в реакцию с эндогенными ферментами тела, и через некоторое время биологически активный витамин С генерируется в организме, с помощью ферментативных расщеплений. По мере высвобождения витамина С из состава на протяжении временного периода, длящегося недели или месяцы, сопутствующие его использованию полезные действия становятся доступными всему организму.
Полимер может быть выбран из группы полимеров, состоящей из протеинов, пептидов и полипептидов, полилизина, коллагенов, проколлагенов, эластинов и ламининов.
Полимер может быть выбран из группы полимеров, состоящей из синтетических полимеров, в состав которых входят гидроксильная, аминовая и карбоксильная функциональные группы, - поливиниловый спирт, полиэтилен гликоль, поливинил амин, полиаллиламин, деацилированнный полиакриломид, полиакриловая и полиметакриловая кислота. Полимер может быть выбран из группы полимеров, состоящей из дентритных или разветвленных полимеров, включая дентритные полиолы и дентритные полиамины. Полимер может быть выбран из группы полимеров, состоящей из полимеров с твердой поверхностью, в состав которых входят гидроксильная, аминовая и карбоксильная функциональные группы.
Гликаны могут быть выбраны из группы гликанов, включая крахмал и его производные; декстран и его производные, целлюлозу и ее производные; хитин, хитозан, альгинат и его производные.
В примере осуществления изобретения полимером является гликозамигликан. Представленный здесь состав гидрогеля далее может состоять из одного или нескольких различных полимеров на основе гликозаминогликана. В контексте данной работы термин "гликозаминогликан" является синонимом "GAG" и "мукополисахарид" и касается длинных неразветвленных гликанов, состоящих из повторяющихся звеньев дисахаридов. Повторяющееся звено состоит из гексозы (шестиуглеродного сахара) или аскорбиновой кислоты, связанной с гексозамином (шестиуглеродный азотосодержащий сахар), и применимых в фармацевтике солей из вышеперечисленных полимеров. Представители семейства GAG изменяются по типу звеньев гексозамина, гексозы или аскорбиновой кислоты, которые входят в их состав, таких как, например, глюкуроновая кислота, идуроновая кислота, галактоза, галактозамин, глюкозамин), и также могут изменяться по конфигурации гликозидной связи. Использование любого полимера на основе гликозаминогликана является полезным в составах представленных здесь гидрогелей, с той лишь оговоркой, что полимер на основе гликозаминогликана улучшает состояние кожи. Неограничивающие примеры гликозаменигликанов охватывают хондроитинсульфат, дерматансульфат, кератансульфат и галуронан. Неограничивающие примеры применимых солей гликозаминогликанов охватывают соли натрия, соли калия, соли магния, соли кальция и их комбинации. Гликозаминогликан и полученные на его основе полимеры полезны в составах гидрогелей и в способах, представленных в данной работе, описаны, например, у Пирона (Piron) и Толина (Tholin) в публикации патента США №2003/0148995 под названием "Образования поперечных связей гликанов, приготовления гидрогелей, полученный в результате гликан (гликаны) и гидрогель (гидрогели) и их использование», в работе Лебретона (Lebreton) «Образование поперечных связей в гликанах с низким и высоким молекулярным весом в приготовлении впрыскиваемых мономерных гидрогелей», у Лебретона (Lebreton) в публикации патента США №2008/0089918 под названием «Вязкоупругие растворы, включающие гиалуронат натрия и гидроксипропил метил целлюлозу, приготовление и использование»; у Лебретона (Lebreton) в публикациях патента США №2010/0028438 под названием «Гели на основе гиалуроновой кислоты, включающие лидокаин» и №2006/0194758 под названием «Полученные таким образом гликаны и гидрогели» и у Di Napoli в публикации международного патента №WO 2004/073759 под названием «Состав и способ для внутрикожного увеличения мягких тканей», каждый из которых сим включен в данную работу во всей своей полноте посредством ссылки. GAG, применение которых полезно в составах гидрогелей и в представленных здесь способах, доступны в продаже, это такие гликозаминогликаны, как, например, кожные наполнители на основе гиалуронана JUVEDERM®, JUVEDERM® 30, JUVEDERM® Ultra, JUVEDERM® Ultra Plus, JUVEDERM® Ultra XC и JUVEDERM® Ultra Plus XC (компания Allergan Inc, г. Ирвин (Irvine), штат Калифорния). Вышеуказанные гликозаминогликаны перечислены в Таблице 1.


Варианты настоящего изобретения частично обеспечивают создание состава гидрогеля, включающего полимер хондроитинсульфат. В контексте данной работы термин "полимер хондроитинсульфат" ссылается на неразветвленный сульфатированный полимер переменной длины, в состав которого входят дисахариды двух чередующихся гликанов D-глюкуроновой кислоты (GIcA) и N-ацетил-D-галактозамина (GalNAc) и применяемых в фармацевтике солей этих гликанов. Полимер хондроитинсульфат может также включать кислотные остатки D-глюкуроновой кислоты, которые эпимеризированы в L-идуроновую кислоту (IdoA), в результате чего на дисахарид, образованный на выходе, ссылаются как на дерматансульфат. Полимер хондроитинсульфат может иметь цепь, состоящую из более 100 отдельных Сахаров, каждый из которых может быть сульфатирован в непостоянные положения и в переменных количествах. Полимеры хондроитинсульфата являются важным структурным компонентом хряща и обеспечивают значительную часть его сопротивляемости сжатию. Использование любого полимера хондроитинсульфата полезно в представленных здесь составах с той оговоркой, что полимер хондроитинсульфат улучшает состояние кожи. Неограничивающие примеры применимых в фармацевтике солей хондроитинсульфата охватывают соли хондроитинсульфата, включая хондроитинсульфат натрия, хондроитинсульфат калия, хондроитинсульфат магния, хондроитинсульфат кальция и комбинации этих солей.
Варианты настоящего изобретения частично обеспечивают создание состава гидрогеля, включающего полимер кератансульфат. В контексте данной работы термин "полимер кератансульфат" ссылается на полимер переменной длины, охватывающий ферменты дисахаридов, которые сами β включают -D-галактозу и N-ацетил-О-галактозамин (GalNAc) и применяемые в фармацевтике соли этих гликанов. Дисахариды с провторяющейся зоной кератансульфата могут быть фукозилированы, а N-сиаловая кислота образует концевую структуру цепей. Использование любого полимера кератансульфата полезно в составах, представленных здесь с той оговоркой, что полимер кератансульфат улучшает состояние кожи. Неограничивающие примеры применимых в фармацевтике солей кератансульфата охватывают соли кератансульфата, включая кератансульфат натрия, кератансульфат калия, кератансульфат магния, кератансульфат кальция и комбинации этих солей.
Варианты настоящего изобретения частично обеспечивают создание состава гидрогеля, включающего полимер гиалуронан. В контексте данной работы термин "полимер гиалуроновой кислоты" является синонимом терминов "полимер НА", "полимер гиалуроновой кислоты" и "полимер гиалуронат" и касается анионного несульфатированного полимера гликозаминогликана, охватывающему ферменты дисахаридов, которые сами включают D-глюкуроновую кислоту и мономеры D-N-ацетиоглюкозамина, которые сцеплены с друг другом с помощью чередующихся β-1, 4 и β-1,3 гликозидных связей, и также касается фармацевтически приемлемых солей этих гликанов. Полимеры гиалуронана могут быть очищены от источников загрязнения животного и неживотного происхождения. Размер полимеров гиалуронана может изменяться в диапазоне примерно от 5000 дальтонов и примерно до 20000000 дальтонов. Использование любого полимера гиалуронана полезно в представленных здесь составах с той оговоркой, что полимер гиалуронан улучшает состояние кожи. Неограничивающие примеры применимых в фармацевтике солей гиалуронана охватывают гиалуронан натрия, гиалуронан калия, гиалуронан магния, гиалуронан кальция и комбинации этих солей.
Варианты настоящего изобретения частично обеспечивают создание состава гидрогеля, включающего поперечно-связанный полимер гликозаминогликан. В контексте данной работы термин "поперечно-связанный" ссылается на межмолекулярные связи, соединяющие отдельные молекулы полимеров или цепи мономеров в более устойчивые структуры наподобие геля. Как таковой поперечно-связанный полимер гликозаминогликан обладает, по меньшей мере, одной межмолекулярной связью, соединяющей, по меньшей мере, одну отдельную молекулу полимера с другой молекулой. Образование поперечных связей в полимерах гликозаминогликана, как правило, приводит к образованию гидрогеля. Такие гидрогели обладают высокой вязкостью и требуют значительных усилий для выдавливания через тонкую иглу. Полимеры гликозаминогликана, представленные в данной работе, могут быть поперечно связаны с помощью сшивающих» агентов на основе диальдегидов и дисульфидов, включая без ограничения многофункциональные сшивающие агенты на основе этиленгликоля, дивинил сульфоны, диглицидные эфиры, биоксиды и бикарбодиимид. Неограничивающие примеры сшивающих агентов на основе гиалуронана включают многофункциональные сшивающие агенты на основе этиленгликоля подобные пентаэритритол тетраглицидил эфиру (PETGE), дивинил сульфону (DVS), 1,4-бутандиол диглицидиловому эфиру (BDDE), 1,2-би(2,3-эпоксипропокси)этилену (EGDGE), 1,2,7,8-дипоксиоктану (DEO), (фенилен-би-этил)-карбодиимиду и 1,6 гексаметилен-би(этилкарбоиимиду), адипин дигидрозиду (ADH), би-(сульфосукцинимидил)суберату (BS), гексиаметилэнедиамину (HMDA), 1-(2,3-эпоксипропил)-2,3-эпоксициклогексану или комбинациям этих агентов. Другие полезные сшивающие агенты представлены в патентной заявке США №12/910,466, зарегистрированной 22 октября 2010 года, под названием «Составы регулировано поперечно-связанных гликанов», авторы: Стромпулис (Stroumpoulis) и Тезел (Tezel), которая посредством ссылки включена во всей своей полноте в эту работу. Неограничивающие примеры способов образования поперечных связей в полимерах гликозаминогликана, например, в полимерах гликозаминогликана, полезных в составах и способах, представленных в этой работе, описаны, например, у Пирона (Piron) и Толина (Tholin) в публикации патента США №2003/0148995 под названием "Образования поперечных связей гликанов, приготовления гидрогелей, полученный в результате гликан (гликаны) и гидрогель (гидрогели) и их использование»; в работе Лебретона (Lebreton) «Образование поперечных связей в гликанах с низким и высоким молекулярным весом при приготовлении впрыскиваемых мономерных гидрогелей», у Лебретона (Lebreton) в публикации патента США №2008/0089918 под названием «Вязкоупругие растворы, включающие гиалуронат натрия и гидроксипропил метил целлюлозу, приготовление и использование»; у Лебретона (Lebreton) в публикациях патента США №2010/0028438 под названием «Гели на основе гиалуроновой кислоты, включающие лидокаин» и №2006/0194758 под названием «Полученные таким образом гликаны и гидрогели» и у Ди Наполи (Di Napoli) в публикации международного патента №WO 2004/073759 под названием «Состав и способ для внутрикожного увеличения мягких тканей», каждый из которых сим включен в данную работу во всей своей полноте посредством ссылки.
Согласно данному изобретению, "%" в формуле определяется как процент веса в весе (или w/w). В качестве примера: 1% (w/w) означает концентрацию 10 мг/г.
В осуществлении изобретения состав гидрогеля включает поперечно сшитый полимер гликозаминогликан, где поперечно сшитый полимер гликозаминогликан находится в количестве, достаточном для улучшения состояния кожи так, как представлено в данной работе. В варианте этого осуществления изобретения состав включает поперечно сшитый полимер хондроитинсульфат, поперечно сшитый полимер дерматансульфат, поперечно сшитый полимер кератансульфат, поперечно сшитый полимер гепаран, поперечно сшитый полимер гепарансульфат или поперечно сшитый полимер гиалуронан. В другом варианте этого осуществления изобретения состав включает поперечно сшитый гликозаминогликан, где поперечно сшитый гликозаминогликан представляет, например, примерно 1% от веса, примерно 2% от веса, примерно 3% от веса, примерно 4% от веса, примерно 5% от веса, примерно 6% от веса, примерно 7% от веса, примерно 8% от веса или примерно 9% от веса либо примерно 10% от веса всего гликозаминогликана, содержащегося в составе. В еще других вариантах осуществления данного изобретения состав включает поперечно сшитый гликозаминогликан, где поперечно сшитый гликозаминогликан представляет, например, самое большее, 1% от веса, самое большее, 2% от веса, самое большее, 3% от веса, самое большее, 4% от веса, самое большее, 5% от веса, самое большее, 6% от веса, самое большее, 7% от веса, самое большее, 8% от веса или самое большее, 9% от веса либо самое большее, 10% от веса всего гликозаминогликана, содержащегося в составе. И во все еще других вариантах осуществления данного изобретения состав включает поперечно сшитый гликозаминогликан, где поперечно сшитый гликозаминогликан представляет, например, примерно от 0% и примерно до 20% от веса, примерно от 1% и примерно до 17% от веса, примерно от 3% и примерно до 15% от веса или примерно от 5% и примерно до 10% от веса, например, примерно 11% от веса, примерно 15% от веса или примерно 17% от веса всего гликозаминогликана, содержащегося в составе.
В вариантах осуществления данного изобретения состав гидрогеля включает поперечно-сшитый гликозаминогликан, где поперечно-сшитый гликозаминогликан представлен в концентрации, например, примерно 2 мг/г, примерно 3 мг/г, примерно 4 мг/г, примерно 5 мг/г, примерно 6 мг/г, примерно 7 мг/г, примерно 8 мг/г, примерно 9 мг/г, примерно 10 мг/г, примерно 11 мг/г, примерно 12 мг/г, примерно 13 мг/г, примерно 13,5 мг/г, примерно 14 мг/г, примерно 15 мг/г, примерно 16 мг/г, примерно 17 мг/г, примерно 18 мг/г, примерно 19 мг/г или примерно 20 мг/г.В других вариантах осуществления данного изобретения состав включает поперечно-сшитый гликозаминогликан, где поперечно-сшитый гликозаминогликан представлен в концентрации, например, по меньшей мере, 1 мг/г, по меньшей мере, 2 мг/г, по меньшей мере, 3 мг/г, по меньшей мере, 4 мг/г, по меньшей мере, 5 мг/г, по меньшей мере, 10 мг/г, по меньшей мере, 15 мг/г, по меньшей мере, 20 мг/г, или, по меньшей мере, 25 мг/г либо примерно 40 мг/г. В еще других вариантах осуществления данного изобретения состав включает поперечно сшитый гликозаминогликан, где поперечно сшитый гликозаминогликан представлен в концентрации, например, самое большее, 1 мг/г, самое большее, 2 мг/г, самое большее, 3 мг/г, самое большее, 4 мг/г, самое большее, 5 мг/г, самое большее, 10 мг/г, самое большее, 15 мг/г, самое большее, 20 мг/г, самое большее, 25 мг/г или, самое большее, 40 мг/г.И во все еще других вариантах осуществления данного изобретения состав включает поперечно сшитый гликозаминогликан, где поперечно сшитый гликозаминогликан представлен в концентрации, например, примерно от 7,5 мг/г и примерно до 19,5 мг/г, примерно от 8,5 мг/г и примерно до 18,5 мг/г, примерно от 9,5 мг/г и примерно до 17,5 мг/г, примерно от 10,5 мг/г и примерно до 16,5 мг/г, примерно от 11,5 мг/г и примерно до 15,5 мг/г, или примерно от 12,5 мг/г и примерно до 14,5 мг/г и, самое большее, примерно до 40 мг/г.
Варианты данного изобретения обеспечивают создание состава гидрогеля, включающего полимеры гиалуронана с низким молекулярным весом, полимеры гиалуронана с высоким молекулярным весом или полимеры гиалуронана как с низким, так и с высоким молекулярным весом. В контексте данной работы термин "высокий молекулярный вес" при ссылке на "гиалуронан" касается полимеров гиалуронана со средним молекулярным весом 1000000 дальтонов или более. Неограничивающие примеры полимеров гиалуронана с высоким молекулярным весом включают полимеры гиалуронана, молекулярный вес которых составляет примерно 1500000 дальтонов, примерно 2000000 дальтонов, примерно 2500000 дальтонов, примерно 3000000 дальтонов, примерно 3500000 дальтонов, примерно 4000000 дальтонов, примерно 4500000 дальтонов и примерно 5000000 дальтонов. В контексте данной работы термин "низкий молекулярный вес" при ссылке на "гиалуронан" касается полимеров гиалуронана со средним молекулярным весом менее 1000000 дальтонов. Неограничивающие примеры полимеров гиалуронана с низким молекулярным весом включают полимеры гиалуронана, молекулярный вес которых составляет примерно 200000 дальтонов, примерно 300000 дальтонов, примерно 400000 дальтонов, примерно 500000 дальтонов, примерно 600000 дальтонов, примерно 700000 дальтонов, примерно 800000 дальтонов и примерно 900000 дальтонов.
В осуществлении изобретения состав включает поперечно сшитые полимеры гиалуронана с низким молекулярным весом. В вариантах этого осуществления изобретения состав включает поперечно сшитые полимеры гиалуронана со средним молекулярным весом, например, примерно 100000 дальтонов, примерно 200000 дальтонов, примерно 300000 дальтонов, примерно 400000 дальтонов, примерно 500000 дальтонов, примерно 600000 дальтонов, примерно 700000 дальтонов, примерно 800000 дальтонов или примерно 900000 дальтонов. В еще других вариантах осуществления данного изобретения состав включает поперечно сшитые полимеры гиалуронана со средним молекулярным весом, например., самое большее, 100000 дальтонов, самое большее, 200000 дальтонов, самое большее, 300000 дальтонов, самое большее, 400000 дальтонов, самое большее, 500000 дальтонов, самое большее, 600000 дальтонов, самое большее, 700000 дальтонов, самое большее, 800000 дальтонов, самое большее, 900000 дальтонов или, самое большее, 950000 дальтонов. И во все еще других вариантах осуществления данного изобретения состав включает поперечно сшитые полимеры гиалуронана со средним молекулярным весом, например, примерно от 100000 дальтонов и примерно до 500000 дальтонов, примерно от 200000 дальтонов и примерно до 500000 дальтонов, примерно от 300000 дальтонов и примерно до 500000 дальтонов, примерно от 400000 дальтонов и примерно до 500000 дальтонов, примерно от 500000 дальтонов и примерно до 950000 дальтонов, примерно от 600000 дальтонов и примерно до 950000 дальтонов, примерно от 700000 дальтонов и примерно до 950000 дальтонов, примерно от 800000 дальтонов и примерно до 950000 дальтонов, примерно от 300000 дальтонов и примерно до 600000 дальтонов, примерно от 300000 дальтонов и примерно до 700000 дальтонов, примерно от 300000 дальтонов и примерно до 800000 дальтонов или примерно от 400000 дальтонов и примерно до 700000 дальтонов.
В другом варианте осуществления изобретения состав включает поперечно сшитые полимеры гиалуронана с высоким молекулярным весом. В вариантах осуществления данного изобретения, состав включает поперечно сшитые полимеры гиалуронана со средним молекулярным весом, например, примерно 1000000 дальтонов, примерно 1500000 дальтонов, примерно 2000000 дальтонов, примерно 2500000 дальтонов, примерно 3000000 дальтонов, примерно 3500000 дальтонов, примерно 4000000 дальтонов, примерно 4500000 дальтонов или примерно 5000000 дальтонов. В еще других вариантах осуществления данного изобретения состав включает поперечно сшитые полимеры гиалуронана со средним молекулярным весом, например., по меньшей мере, 1000000 дальтонов, по меньшей мере, 1500000 дальтонов, по меньшей мере, 2000000 дальтонов, по меньшей мере, 2500000 дальтонов, по меньшей мере, 3000000 дальтонов, по меньшей мере, 3500000 дальтонов, по меньшей мере, 4000000 дальтонов, по меньшей мере, 4500000 дальтонов или, по меньшей мере, 5000000 дальтонов. И во все еще других вариантах осуществления данного изобретения состав включает поперечно сшитые полимеры гиалуронана со средним молекулярным весом, например, примерно от 1000000 дальтонов и примерно до 5000000 дальтонов, примерно от 1500000 дальтонов и примерно до 5000000 дальтонов, примерно от 2000000 дальтонов и примерно до 5000000 дальтонов, примерно от 2500000 дальтонов и примерно до 5000000 дальтонов, примерно от 2000000 дальтонов и примерно до 3000000 дальтонов, примерно от 2500000 дальтонов и примерно до 3500000 дальтонов или примерно от 2000000 дальтонов и примерно до 4000000 дальтонов.
В еще другом варианте осуществления изобретения состав включает поперечно сшитые полимеры гиалуронана, где поперечно сшитые полимеры гиалуронана включают комбинацию как полимеров гиалуронана с высоким молекулярным весом, так и полимеров гиалуронана с низким молекулярным весом, представленных в различных соотношениях. В вариантах осуществления данного изобретения состав включает поперечно сшитые полимеры гиалуронана, где поперечно сшитые полимеры гиалуронана включают комбинацию как полимеров гиалуронана с высоким молекулярным весом, так и полимеров гиалуронана с низким молекулярным весом, в соотношении примерно 20:1, примерно 15:1, примерно 10:1, примерно 5:1, примерно 1:1, примерно 1:5, примерно 1:10, примерно 1:15 или примерно 1:20.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, который включает поперечно сшитый полимер гликозаминогликана, обладающий степенью образования поперечных связей. В контексте данной работы термин "степень образования поперечных связей" касается процентного отношения мономерных звеньев полимера гликозаминогликана, таких как, например, мономерные звенья дисахарида в гиалуронане, которые связаны со сшивающим агентом. Степень образования поперечных связей представлена как соотношение веса сшивающего агента и гликозаминогликана, выраженное в процентах.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, который включает несшитый полимер гликозаминогликана. В контексте данной работы термин "несшитый" указывает на отсутствие межмолекулярных связей, соединяющих отдельные молекулы полимера гликозамингликана или мономерные цепи. Как таковой, несшитый полимер гликозаминогликана не соединен с каким-либо другим полимером гликозаминогликана посредством межмолекулярной связи. В вариантах осуществления данного изобретения состав включает несшитый полимер хондроитинсульфата, несшитый полимер дерматансульфата, несшитый полимер кератансульфата, несшитый полимер гепарана, несшитый полимер гепарансульфата или несшитый полимер гиалуронана. Несшитые полимеры гликозаминогликана растворимы в воде и, как правило, по своей природе остаются текучими. Как таковые, несшитые полимеры гликозаминогликана часто входят в состав гидрогеля на основе гликозаминогликана в качестве смазочного вещества для облегчения процесса экструзии состава через тонкую иглу.
В осуществлении изобретения состав включает несшитый полимер гликозаминогликана, где несшитый полимер гликозаминогликана представлен в количестве, достаточном для улучшения состояния кожи, как представлено в данной работе. В вариантах осуществления данного изобретения состав включает несшитый полимер гликозаминогликана, где несшитый полимер гликозаминогликана присутствует в концентрации, например, примерно 2 мг/г, примерно 3 мг/г, примерно 4 мг/г, примерно 5 мг/г, примерно 6 мг/г, примерно 7 мг/г, примерно 8 мг/г, примерно 9 мг/г, примерно 10 мг/г, примерно 11 мг/г, примерно 12 мг/г, примерно 13 мг/г, примерно 13.5 мг/г, примерно 14 мг/г, примерно 15 мг/г, примерно 16 мг/г, примерно 17 мг/г, примерно 18 мг/г, примерно 19 мг/г, примерно 20 мг/г, примерно 40 мг/г или примерно 60 мг/г.В других вариантах осуществления данного изобретения состав включает несшитый полимер гликозаминогликана, где несшитый полимер гликозаминогликана присутствует в концентрации, например, по меньшей мере, 1 мг/г, по меньшей мере, 2 мг/г, по меньшей мере, 3 мг/г, по меньшей мере, 4 мг/г, по меньшей мере, 5 мг/г, по меньшей мере, 10 мг/г, по меньшей мере, 15 мг/г, по меньшей мере, 20 мг/г, по меньшей мере, 25 мг/г, по меньшей мере, 35 мг/г или, по меньшей мере, 40 мг/г. В еще других вариантах осуществления данного изобретения, состав включает несшитый полимер гликозаминогликана, где несшитый полимер гликозаминогликана присутствует в концентрации, например, самое большее, 1 мг/г, самое большее, 2 мг/г, самое большее, 3 мг/г, самое большее, 4 мг/г, самое большее, 5 мг/г, самое большее, 10 мг/г, самое большее, 15 мг/г, самое большее, 20 мг/г или, самое большее, 25 мг/г. И во все еще других вариантах осуществления данного изобретения состав включает несшитый полимер гликозаминогликана, где несшитый полимер гликозаминогликана присутствует в концентрации, например, примерно от 1 мг/г и примерно до 60 мг/г, примерно от 10 мг/г и примерно до 40 мг/г, примерно от 7,5 мг/г и примерно до 19,5 мг/г, примерно от 8,5 мг/г и примерно до 18,5 мг/г, примерно от 9,5 мг/г и примерно до 17,5 мг/г, примерно от 10,5 мг/г и примерно до 16,5 мг/г, примерно от 11,5 мг/г и примерно до 15,5 мг/г или примерно от 12,5 мг/г и примерно до 14,5 мг/г.
В осуществлении изобретения состав включает несшитые полимеры гиалуронана с низким молекулярным весом. В вариантах осуществления данного изобретения состав включает несшитый полимер гиалуронан со средним молекулярным весом, например, примерно 100000 дальтонов, примерно 2000000 дальтонов, примерно 3000000 дальтонов, примерно 4000000 дальтонов, примерно 5000000 дальтонов, примерно 6000000 дальтонов, примерно 7000000 дальтонов, примерно 8000000 дальтонов или примерно 900000 дальтонов. В еще других вариантах осуществления данного изобретения состав включает несшитые полимеры гиалуронана со средним молекулярным весом, например, самое большее, 100000 дальтонов, самое большее, 2000000 дальтонов, самое большее, 300000 дальтонов, самое большее, 4000000 дальтонов, самое большее, 500000 дальтонов, самое большее, 6000000 дальтонов, самое большее, 7000000 дальтонов, самое большее, 8000000 дальтонов, самое большее, 900000 дальтонов или, самое большее, 950000. И во все еще других вариантах осуществления данного изобретения состав включает несшитые полимеры гиалуронана со средним молекулярным весом, например, примерно от 100000 дальтонов и примерно до 5000000 дальтонов, примерно от 2000000 дальтонов и примерно до 5000000 дальтонов, примерно от 3000000 дальтонов и примерно до 5000000 дальтонов, примерно от 4000000 дальтонов и примерно до 5000000 дальтонов, примерно от 5000000 дальтонов и примерно до 9500000 дальтонов, примерно от 6000000 дальтонов и примерно до 9500000 дальтонов, примерно от 7000000 дальтонов и примерно до 9500000 дальтонов, примерно от 8000000 дальтонов и примерно до 9500000 дальтонов, примерно от 3000000 дальтонов и примерно до 6000000 дальтонов, примерно от 3000000 дальтонов и примерно до 7000000 дальтонов, примерно от 3000000 дальтонов и примерно до 8000000 дальтонов или примерно от 4000000 дальтонов и примерно до 7000000 дальтонов.
В другом варианте осуществления изобретения состав включает несшитые полимеры гиалуронана с высоким молекулярным весом. В вариантах осуществления данного изобретения состав включает несшитый гиалуронан со средним молекулярным весом, например, примерно 1000000 дальтонов, примерно 1500000 дальтонов, примерно 2000000 дальтонов, примерно 2500000 дальтонов, примерно 3000000 дальтонов, примерно 3 5000000 дальтонов, примерно 4000000 дальтонов, примерно 4500000 дальтонов или примерно 5000000 дальтонов. В других вариантах осуществления данного изобретения состав включает несшитые полимеры гиалуронана со средним молекулярным весом, например, по меньшей мере, 1000000 дальтонов, по меньшей мере, 1500000 дальтонов, по меньшей мере, 2000000 дальтонов, по меньшей мере, 2 5000000 дальтонов, по меньшей мере, 3000000 дальтонов, по меньшей мере, 3 5000000 дальтонов, по меньшей мере, 4000000 дальтонов, по меньшей мере, 4500000 дальтонов или, по меньшей мере, 5000000 дальтонов. В еще других вариантах осуществления данного изобретения состав включает несшитые полимеры гиалуронана со средним молекулярным весом, например, примерно от 1000000 дальтонов и примерно до 5000000 дальтонов, примерно от 1 5000000 дальтонов и примерно до 5000000 дальтонов, примерно от 2000000 дальтонов и примерно до 5000000 дальтонов, примерно от 2 5000000 дальтонов и примерно до 5000000 дальтонов, примерно от 2000000 дальтонов и примерно до 3000000 дальтонов, примерно от 2 5000000 дальтонов и примерно до 3 5000000 дальтонов или примерно от 2000000 дальтонов и примерно до 4000000 дальтонов. И во все еще других вариантах состав включает несшитые полимеры гиалуронана со средним молекулярным весом, например, выше чем 2000000 дальтонов и ниже чем примерно 3000000 дальтонов, выше чем 2000000 дальтонов и ниже чем примерно 3500000 дальтонов, выше чем 2000000 дальтонов и ниже чем примерно 4000000 дальтонов, выше чем 2000000 дальтонов и ниже чем примерно 4500000 дальтонов, выше чем 2000000 дальтонов и ниже чем примерно 5000000 дальтонов.
В другом варианте осуществления изобретения состав включает несшитые полимеры гиалуронана, где несшитый гиалуронан включает как полимеры гиалуронана с высоким молекулярным весом, так и полимеры гиалуронана с низким молекулярным весом в различных соотношениях. В вариантах осуществления данного изобретения состав включает несшитые полимеры гиалуронана, где несшитые полимеры гиалуронана включает комбинацию как полимеров гиалуронана с высоким молекулярным весом, так и полимеров гиалуронана с низким молекулярным весом в соотношении примерно 20:1, примерно 15:1, примерно 10:1, примерно 5:1, примерно 1:1, примерно 1:5 примерно 1:10, примерно 1:15 или примерно 1:20.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, включающего в значительной степени несшитый полимер гликозаминогликана. В контексте данной работы термин "в значительной степени несшитый" касается наличия несшитых полимеров гликозаминогликана в представленном здесь составе на уровне, по меньшей мере, 90% от веса состава, при этом оставшиеся, самое большее, 10% от веса состава состоят из других компонентов, включая поперечно сшитые полимеры гликозаминогликана. В вариантах осуществления данного изобретения состав включает в значительной степени несшитый полимер хондроитинсульфата, в значительной степени несшитый полимер дерматансульфата, в значительной степени несшитый полимер кератансульфата, в значительной степени несшитый полимер гепарана, в значительной степени несшитый полимер гепарансульфата или в значительной степени несшитый полимер гиаулорана. В других вариантах осуществления данного изобретения состав включает несшитый гликозаминогликан, где несшитый гликозаминогликан представляет, например, примерно 90% или более веса, примерно 91% или более веса, примерно 92% или более веса, примерно 93% или более веса, примерно 94% или более веса, примерно 95% или более веса, примерно 96% или более веса, примерно 97% или более веса, примерно 98% или более веса либо примерно 99% или более веса либо примерно 100% веса всего гликозаминогликана, присутствующего в составе. В еще других вариантах осуществления данного изобретения состав включает несшитый гликозаминогликан, где несшитый гликозаминогликан представляет, например, примерно от 90% и примерно до 100% веса, примерно от 93% и примерно до 100% веса, примерно от 95% и примерно до 100% веса или примерно от 97% и примерно до 100% веса всего гликозаминогликана, присутствующего в составе.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, который по существу свободен от поперечно сшитого полимера гликозаминогликана. В контексте данной работы термин "существенно свободный" (или «состоящий, главным образом, из») касается состава, где могут быть обнаружены лишь малые количества поперечно сшитых матричных полимеров. В варианте осуществления данного изобретения состав включает хондроитинсульфат, существенно свободный от поперечно сшитого полимера хондроитинсульфата, дерматансульфат, существенное свободный от поперечно сшитого полимера дерматансульфата, кератансульфат, существенное свободный от поперечно сшитого полимера кератансульфата, гепаран, существенное свободный от поперечно сшитого полимера гепарана, гепарансульфат, существенное свободный от поперечно сшитого полимера гепарансульфата или гиалуронансульфат, существенное свободный от поперечно сшитого полимера гиалуронана.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, который полностью свободен от поперечно сшитого полимера гликозаминогликана. В контексте данной работы термин "полностью свободен" касается состава, в котором в пределах диапазона обнаружения прибора или в пределах используемого процесса нельзя обнаружить поперечно сшитые полимеры гликозаминогликана, или же их присутствие не может быть подтверждено. В варианте осуществления данного изобретения состав включает хондроитинсульфат, полностью свободный от поперечно сшитого полимера хондроитинсульфата, дерматансульфат, полностью свободный от поперечно сшитого полимера дерматансульфата, кератансульфат, полностью свободный от поперечно сшитого полимера кератансульфата, гепаран, полностью свободный от поперечно сшитого полимера гепарана, гепарансульфат, полностью свободный от поперечно сшитого полимера гепарансульфата или гиалуронансульфат, полностью свободный от поперечно сшитого полимера гиалуронана.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, который включает соотношение поперечно сшитого полимера гликозаминогликана и несшитого полимера гликозаминогликана. Это соотношение поперечно сшитого и несшитого полимера гликозаминогликана также известно как соотношение «гель/жидкость». Любое соотношение «гель/жидкость» полезно при создании представленных в данной работе составов с той оговоркой, что такое соотношение приводит к созданию представленного здесь состава, который улучшает состояние кожи так, как представлено в этой работе. Неограничивающие примеры соотношений «гель/жидкость» в составах настоящего изобретения включают следующие значения: 100:0, 98:2, 90:10, 75:25, 70:30, 60:40, 50:50, 40:60, 30:70, 25:75, 10:90; 2:98 и 0:100.
В вариантах осуществления данного изобретения состав включает поперечно сшитый полимер гликозаминогликан и несшитый полимер гликозаминогликан, где соотношение «гель/жидкость» составляет, например, примерно 0:100, примерно 1:99, примерно 2:98, примерно 3:97, примерно 4:96, примерно 5:95, примерно 6:94, примерно 7:93, примерно 8:92, примерно 9:91 или примерно 10:90. В других вариантах осуществления данного изобретения состав включает поперечно сшитый полимер гликозаминогликан и несшитый полимер гликозаминогликан, где соотношение «гель/жидкость» составляет, например, самое большее, 1:99, самое большее, 2:98, самое большее, 3:97, самое большее, 4:96, самое большее, 5:95, самое большее, 6:94, самое большее, 7:93, самое большее, 8:92, самое большее, 9:91 или, самое большее, 10:90. В еще других вариантах осуществления данного изобретения состав включает поперечно сшитый полимер гликозаминогликан и несшитый полимер гликозаминогликан, где соотношение «гель/жидкость» составляет, например, примерно от 0:100 и примерно до 3:97, примерно от 0:100 и примерно до 5:95 или примерно от 0:100 и примерно до 10:90.
В других вариантах осуществления данного изобретения состав включает поперечно сшитый полимер гликозаминогликан и несшитый полимер гликозаминогликан, где соотношение «гель/жидкость» составляет, например, примерно 15:85, примерно 20:80, примерно 25:75, примерно 30:70, примерно 35:65, примерно 40:60, примерно 45:55, примерно 50:50, примерно 55:45, примерно 60:40, примерно 65:35, примерно 70:30, примерно 75:25, примерно 80:20, примерно 85:15, примерно 90:10, примерно 95:5, примерно 98:2, or примерно 100:0. В еще других вариантах осуществления данного изобретения состав включает поперечно сшитый полимер гликозаминогликан и несшитый полимер гликозаминогликан, где соотношение «гель/жидкость» составляет, например, самое большее, 15:85, самое большее, 20:80, самое большее, 25:75, самое большее, 30:70, самое большее, 35:65, самое большее, 40:60, самое большее, 45:55, самое большее, 50:50, самое большее, 55:45, самое большее, 60:40, самое большее, 65:35, самое большее, 70:30, самое большее, 75:25, самое большее, 80:20, самое большее, 85:15, самое большее, 90:10, самое большее, 95:5, самое большее, 98:2 или, самое большее, 100:0. И во все еще других вариантах осуществления данного изобретения, состав включает поперечно сшитый полимер гликозаминогликан и несшитый полимер гликозаминогликан, где соотношение «гель/жидкость» составляет, например, примерно от 10:90 и примерно до 70:30, примерно от 15:85 и примерно до 70:30, примерно от 10:90 и примерно до 55:45, примерно от 80:20 и примерно до 95:5, примерно от 90:10 и примерно до 100:0, примерно от 75:25 и примерно до 100:0 или примерно от 60:40 и примерно до 100:0.
Представленный здесь состав гидрогеля может далее включать другой агент или комбинацию агентов, которые обеспечивают положительный эффект при введении состава пациенту. Такие полезные агенты включают без ограничения антиоксидант, противозудный агент, антицеллюлитный агент, агент для рубцевания шрамов, противовоспалительный агент, обезболивающий агент, агент-антираздражитель, сосудосужающее средство, сосудорасширяющее средство, кровоостанавливающий агент наподобие гемостатического агента или антифибринолитического агента, агент против шелушения, агент против растяжек кожи, противоугревой агент, пигментационный агент, антипигментационный агент или увлажняющий агент. Варианты настоящего изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который по выбору может включать обезболивающий агент. Предпочтительно, чтобы обезболивающий агент был агентом для местной анестезии, например, для двусторонней местной анестезии и для потери болевого возбуждения нервных волокон, таким как, например, местный анестетик на основе аминоамида и местный анестетик на основе аминоэфира. Количество обезболивающего агента в составе, представленном в этой работе, - это то его количество, которое эффективно ослабляет боль, испытуемую пациентом при введении состава с помощью укола. Как таковое, количество обезболивающего агента в составе, представленном в данного изобретения, находится между примерно 0,1% и примерно 5% веса всего состава. Неограничивающими примерами обезболивающих агентов являются лидокаин, амбукаин, амоланон, амилокаин, беноксинат, бензокаин, бетоксикаин, бифеламин, бупивакаин, бутакаин, бутамбен, бутаниликаин, бутетамин, бутоксикаин, картикаин, хлорпрокаин, кокаэтилен, кокаин, циклометикаин, дибукаин, диметисокаин, диметокаин, диперодон, дициклонин, экгонидин, экгонин, этил хлорид, этидокаин, бета-эйкаин, эупроцин, феналкомин, формокаин, гексилкаин, гидрокситетракаин, изобутил р-аминобензоат, лейцинкаин мезилат, левоксадрол, лидокаин, мепивакаин, меприлкаин, метабутоксикаин, метил хлорид, миртекаин, наэпаин, октакаин, ортокаин, оксетазаин, паретоксикаин, фенакаин, фенол, пиперокаин, пиридокаин, полидоканол, прамоксин, прилокаин, новокаин, пропанокаин, пропаракаин, пропипокаин, пропоксикаин, псевдококаин, пиррокаин, ропивакаин, салициловый спирт, тетракаин, толикаин, тримекаин, золамин, комбинации вышеперечисленных агентов и соли вышеперечисленных агентов. Неограничивающими примерами локальных анестетиков на основе аминоэфира являются новокаин, хлорпрокаин, кокаин, циклометикаин, циметокаин (ларокаин), пропоксикаин, прокаин (новокаин), пропаракаин, тетракаин (аметокаин). Неограничивающими примерами локальных анестетиков на основе амидоамина являются артикаин, бупивакаин, хинокаин (дибукаин), этидокаин, левобупивакаин, лидокаин (лигнокаин), мепивакаин, пиперокаин, прилокаин, ропивакаин и тримевакаин. Представленный здесь состав может включать единственный обезболивающий агент или множество обезболивающих агентов. Неограничивающим примером местного комбинированного анестетика является лидокаин/прилокаин (EMLA).
Таким образом, в осуществлении изобретения представленный здесь состав включает обезболивающий агент и его соли. В варианте осуществления данного изобретения, представленный здесь состав включает местный анестетик на основе аминоамида и его соли или местный анестетик на основе аминоэфира и его соли. В других вариантах осуществления данного изобретения, представленный здесь состав включает новокаин, хлорпрокаин, кокаин, циклометикаин, циметокаин, проксикаин, новокаин, пропаракаин, тетракаин или их соли либо любую комбинацию из вышеперечисленных агентов. В еще других вариантах осуществления данного изобретения представленный здесь состав включает артикаин, бупивакаин, хинокаин, этидокаин, левобупивакаин, лидокаин, мепивакаин, пиперокаин, прилокаин, ропивакаин и тримекаин или их соли либо любую комбинацию из вышеперечисленных агентов. И во все еще других вариантах осуществления данного изобретения представленный здесь состав включает комбинацию лидокаина и прилокаина.
В других вариантах осуществления данного изобретения представленный здесь состав включает обезболивающий агент в количестве, например, примерно 0,1%, примерно 0,2%, примерно 0,3%, примерно 0,4%, примерно 0,5%, примерно 0,6%, примерно 0,7%, примерно 0,8% примерно 0,9%, примерно 1,0%, примерно 2,0%, примерно 3,0%, примерно 4,0%, примерно 5,0%, примерно 6,0%, примерно 7,0%, примерно 8,0%, примерно 9,0% или примерно 10% веса всего состава. В еще других вариантах представленный здесь состав включает обезболивающий агент в количестве, например, по меньшей мере, 0,1%, по меньшей мере, 0,2%, по меньшей мере, 0,3%, по меньшей мере, 0,4%, по меньшей мере, 0,5%, по меньшей мере, 0,6%, по меньшей мере, 0,7%, по меньшей мере, 0,8%, по меньшей мере, 0,9%, по меньшей мере, 1,0%, по меньшей мере, 2,0%, по меньшей мере, 3,0%, по меньшей мере, 4,0%, по меньшей мере, 5,0%, по меньшей мере, 6,0%, по меньшей мере, 7,0%, по меньшей мере, 8,0%, по меньшей мере, 9,0% или, по меньшей мере, 10% веса всего состава. И во все еще других вариантах представленный здесь состав включает обезболивающий агент в количестве, например,, самое большее, 0,1%, самое большее, 0,2%, самое большее, 0,3%, самое большее, 0,4%, самое большее, 0,5%, самое большее, 0,6%, самое большее, 0,7%, самое большее, 0,8%, самое большее, 0,9%, самое большее, 1,0%, самое большее, 2,0%, самое большее, 3,0%, самое большее, 4,0%, самое большее, 5,0%, самое большее, 6,0%, самое большее, 7,0%, самое большее, 8,0%, самое большее, 9,0% или, самое большее, 10% веса всего состава. В дальнейших вариантах представленный здесь состав включает обезболивающий агент в количестве, например, примерно от 0,1% и примерно до 0,5%, примерно от 0,1% и примерно до 1,0%, примерно от 0,1% и примерно до 2,0%, примерно от 0,1% и примерно до 3,0%, примерно от 0,1% и примерно до 4,0%, примерно от 0,1% и примерно до 5,0%, примерно от 0,2% и примерно до 0,9%, примерно от 0,2% и примерно до 1,0%, примерно от 0,2% и примерно до 2,0%, примерно от 0,5% и примерно до 1,0%, или примерно от 0,5% и примерно до 2,0% веса всего состава
В другом варианте осуществления изобретения представленный здесь состав не включает обезболивающий агент.
В одном варианте настоящего изобретения обеспечивается впрыскиваемый кожный наполнитель, который содержит полимер, например, полимер гликозаминогликана, например, полимер на основе гиалуроновой кислоты, например, гиалуроновую кислоту, по меньшей мере, часть которой является поперечно сшитой, и полезный агент, ковалентно сопряженный с полимером.
Полезный агент, ковалентно сопряженный с полимером, может включать витамин, антиоксидант, фактор роста, пептид иди любой другой полезный агент, который может быть химически сопряжен с полимером, например, для увеличения периода продолжительного высвобождения агента в организм
Полезный агент может содержать витамин. В некоторых осуществлениях изобретения витамином является, по меньшей мере, один из витаминов С, ретиноид и витамин Е.
В особенно выгодном осуществлении изобретения полезным агентом, ковалентно сопряженным с полимером, является витамин С или производная витамина С.Количество витамина С в составе - это такое его количество, которое эффективно обеспечит, по меньшей мере, одно желательное терапевтическое или косметическое полезное действие после своего высвобождения в организм, например, но, не ограничиваясь, неоколллагенозом, противоспалительным действием, повышением жизнеспособности клеток, антиоксидантным действием, ангиогенезом, непроницаемостью и другими полезными действиями. Количество витамина С в представленном здесь составе составляет примерно от 0,04% и примерно до 5,0% веса всего состава, например, примерно от 0,1% и примерно до 4,0% веса всего состава, например, примерно от 0,2% и примерно до 2,0% веса всего состава. В одном осуществлении изобретения количество витамина С в представленном здесь составе составляет примерно от 0,3% и примерно до 1,2% веса всего состава.
Применимым витамином С или производными витамина С, которые ковалентно сопряжены с полимером в составах изобретения, являются аскорбиновая кислота, L-аскорбиновая кислота, 2-сульфат L-аскорбиновой кислоты (AA-2S) и 2-фосфат (АА-2Р) L-аскорбиновой кислоты, 2-О-глюкозид L-аскорбиновой кислоты (AA-2G), 6-O-ацил-2-O-альфа-D-глюкопираносил-L-аскорбиновые кислоты (6-Ацил-АА-2G), (аскорбил 3-аминопропил фосфат, аскорбил пальмитат), а также производные и комбинации вышеперечисленного. Представленный здесь состав может включать отдельный агент витамина С или множество агентов витамина С.
В другом варианте изобретения полезным агентом, химически сопряженным с полимером, является ретиноид. К применимым ретиноидам относятся ретинол (-гидроксильная группа, -ОН), третиноин (группа ретиноевой кислоты-карбоновой кислоты -СООН) и адапален (карбоксильная группа -СООН).
В другом варианте изобретения полезным агентом, химически сопряженным с полимером, является витамин Е, например, (g-токоферол, d-токоферол).
В другом варианте изобретения полезным агентом, химически сопряженным с полимером, является антиоксидант, например, альфа-липоевая кислота (ALA,-COOH), диметиламинэтанол (DMAE, -ОН), каталаза (-ОН).
В другом варианте изобретения полезным агентом, химически сопряженным с полимером, является а фактор роста (с аминовыми группами), например, фактор роста эпидермы (EGF с аминовыми группами), трансформирующий фактор роста (TGF с аминовыми группами).
В другом варианте изобретения полезным агентом, химически сопряженным с полимером, является пептид (с аминовыми группами), например, микроколлаген пентапептиды, кератин или эластин.
В другом варианте настоящего изобретения обеспечивается впрыскиваемый кожный наполнитель, который включает полимер гликозаминогликан, по меньшей мере, часть которого поперечно сшита, и агент-антиоксидант в количестве, эффективном для снижения или предотвращения расщепления представленного здесь состава, такого как, например, ферментативное расщепление и/или химическое разложение состава. Как таковое, количество агента-антиоксиданта, включенное в представленный здесь состав, составляет примерно от 0,1% и примерно до 10% веса всего состава. Неограничивающие примеры агентов-антиоксидантов включают полиол, флавонид, фитоалексин, агент аскорбиновой кислоты, токоферол, липоевую кислоту, мелатонин, каротиноид, аналог или производную вышеперечисленных антиоксидантов и любую комбинацию из вышеперечисленных антиоксидантов. Представленный здесь состав может включать отдельный агент-антиоксидант или множество агентов-антиоксидантов - ретинол, кофермент, идебенон, аллопуринол, глютатион, селенит натрия.
Варианты данного изобретения частично обеспечивают создание состава гидрогеля, включающего полимер и витамин С, ковалентно сопряженный с полимером. К неограничивающим примерам витамина С относятся аскорбиновая кислота и соли натрия, калия и кальция аскорбиновой кислоты, жирорастворимые сложные эфиры аскорбиновой кислоты с длинноцепочечными жирными кислотами (аскорбил пальмитат или аскорбил стеарат), фосфат аскорбила магния (MAP), фосфат аскорбила натрия (SAP) и 2-глюкозид аскорбиновой кислоты (AA2G™), фосфат аскорбила натрия (АА2Р), сульфат двунатриевого аскорбила и аскорбил 3-аминопропил фосфат (витаген).
Аскорбиновая кислота может быть представлена в составе в количестве, например, примерно 0,01%, примерно 0,1%, примерно 0,2%, примерно 0,3%, примерно 0,4%, примерно 0,5%, примерно 0,6%, примерно 0,7%, примерно 0,8% примерно 0,9%, примерно 1,0%, примерно 2,0%, примерно 3,0%, примерно 4,0%, примерно 5,0%, примерно 6,0%, примерно 7,0%, примерно 8,0%, примерно 9,0% или примерно 10% веса всего состава. В еще других вариантах представленный здесь состав включает аскорбиновую кислоту в количестве, например, по меньшей мере, 0,1%, по меньшей мере, 0,2%, по меньшей мере, 0,3%, по меньшей мере, 0,4%, по меньшей мере, 0,5%, по меньшей мере, 0,6%, по меньшей мере, 0,7%, по меньшей мере, 0,8%, по меньшей мере, 0,9%, по меньшей мере, 1,0%, по меньшей мере, 2,0%, по меньшей мере, 3,0%, по меньшей мере, 4,0%, по меньшей мере, 5,0%, по меньшей мере, 6,0%, по меньшей мере, 7,0%, по меньшей мере, 8,0%, по меньшей мере, 9,0% или, по меньшей мере, 10% веса всего состава. И во все еще других вариантах, представленный здесь состав включает аскорбиновую кислоту в количестве, например, самое большее, 0,1%, самое большее, 0,2%, самое большее, 0,3%, самое большее, 0,4%, самое большее, 0,5%, самое большее, 0,6%, самое большее, 0,7%, самое большее, 0,8%, самое большее, 0,9%, самое большее, 1,0%, самое большее, 2,0%, самое большее 3,0%, самое большее, 4,0%, самое большее, 5,0%, самое большее, 6,0%, самое большее, 7,0%, самое большее, 8,0%, самое большее, 9,0% или, самое большее, 10% веса всего состава. В дальнейших вариантах представленный здесь состав включает аскорбиновую кислоту в количестве, например, примерно от 0,1% и примерно до 0,5%, примерно от 0,1% и примерно до 1,0%, примерно от 0,1% и примерно до 2,0%, примерно от 0,1% и примерно до 3,0%, примерно от 0,1% и примерно до 4,0%, примерно от 0,1% и примерно до 5,0%, примерно от 0,2% и примерно до 0,9%, примерно от 0,2% и примерно до 1,0%, примерно от 0,2% и примерно до 2,0%, примерно от 0,5% и примерно до 1,0% или примерно от 0,5% и примерно до 2,0% веса всего состава.
В одном осуществлении настоящего изобретения обеспечивается состав гидрогеля, включающий поперечно сшитый полимер на основе гиалуроновой кислоты и витамин С, химически сопряженный с полимером со степенью сопряжения, самое большее, примерно 3 молекулярных процента, самое большее, примерно 5 молекулярных процентов, самое большее, примерно 10 молекулярных процентов, самое большее, примерно 15 молекулярных процентов, самое большее, примерно 20 молекулярных процентов, самое большее, примерно 25 молекулярных процентов, самое большее, примерно 30 молекулярных процентов или, самое большее, примерно 40 молекулярных процентов.
В одном осуществлении изобретения обеспечивается кожный наполнитель, где гилауроновая кислота сшивается с эпоксидом Star-PEG или амидом Star PEG. В осуществлении данного изобретения степень сопряжения может находиться между примерно 20 молекулярными процентами и примерно 32 молекулярными процентами.
В другом варианте осуществления изобретения обеспечивается кожный наполнитель, где гилауроновая кислота сшивается с BDDE (бутандиол диглицидиловым эфиром). В осуществления данного изобретения, степень сопряжения может находиться между примерно 3 молекулярными процентами и примерно 15 молекулярными процентами, например, между примерно 10 молекулярными процентами и примерно 13 молекулярными процентами.
В некоторых осуществлениях изобретения кожные наполнители обладают устойчивой биологической доступностью. Например, обеспечиваются кожные наполнители, которые при введении под кожу пациента, действуют на высвобождение аскорбиновой кислоты или другого витамина в человеческий организм в течение, по меньшей мере, примерно 1 месяца и, самое большее, на протяжении 20 месяцев или больше.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который демонстрирует суммарный модуль, модуль упругости, модуль вязкости и/или показатель tan δ. Составы, как здесь показано, являются вязкоупругими тем, что состав обладает эластичным компонентом (твердым, таким как, например, поперечно сшитые полимеры гликозаминогликана) и вязким компонентом (жидкообразным, таким как, например, несшитые полимеры гликозаминогликана или фаза носителя) в случае приложения усилия (нагрузка, деформация). Реологическим признаком, который описывает это свойство, является суммарный модуль (G*), который определяет полное сопротивление состава деформации. Суммарный модуль - это комплексное число с действительной и мнимой частью: G*=G'+iG''. Абсолютная величина G* - это Abs(G*)=Sqrt(G'2+G''2). Суммарный модуль можно определить как сумму модуля упругости (G') и модуля вязкости (G''). Обратитесь к работам Фальконе и другие (Falcone, et al.) ({Временные кожные наполнители на основе гликанов: модель устойчивости, основанная на физических свойствах», журнал «Дерматологическая хирургия» (Dermatol Surg.) 35(8): 1238-1243 (2009); Тезеля (Tezel), см. выше, 2008; Каблика (Kablik), см. выше, 2009; Бизли (Beasley), см. выше, 2009; каждая из них сим полностью включена в эту работу посредством ссылки.
Упругий модуль или модуль упругости касается способности материала гидрогеля противостоять деформации или, наоборот, тенденции объектов к непостоянной деформации, когда к ним прикладывается сила. Модуль упругости характеризует твердость состава и также известен как модуль накопления по той причине, что он описывает накопление энергии вследствие перемещения состава. Модуль упругости описывает взаимодействие между упругостью и силой (G' = нагрузка/деформация) и, как таковой, обеспечивает качественное измерение твердости или мягкости состава. Модуль упругости объекта определяется как наклон его кривой нагрузки/деформации в области упругой деформации; λ = нагрузка/деформация, где λ - модуль упругости в паскалях; нагрузка - это сила, вызывающая деформацию, разделенная на площадь приложения силы; а деформация = это отношение изменения, вызванного нагрузкой, и первоначального состояния объекта. Хотя и являясь зависимым от скорости приложения силы, более жесткий состав будет характеризоваться более высоким значением модуля упругости, и для деформации материала на заданное расстояние, такое как, например, глубина инъекции, потребуется более значительное усилие. Указание того, как следует измерять нагрузки, включая направления их приложения, позволит определить многие типы модулей упругости. К трем основным модулям упругости относятся модуль упругости растяжения, модуль сдвига и модуль всестороннего сжатия.
Модуль вязкости также известен как модуль потерь, так как он описывает энергию, которая теряется при вязкой диссипации. Tan δ - это отношение модуля вязкости и модуля упругости, tan δ = G''/G' (Фальконе (Falcone), см. выше, 2009). Значения tan δ, представленные в данного изобретения, определяются по динамическому модулю на частоте 1 Гц. Низкое значение tan δ соответствует более жесткому, твердому или более упругому составу.
В другом варианте осуществления изобретения представленный здесь состав геля демонстрирует модуль упругости. В вариантах осуществления данного изобретения, представленный здесь состав геля демонстрирует модуль упругости, например, в размере примерно 25 паскалей, примерно 50 паскалей, примерно 75 паскалей, примерно 100 паскалей, примерно 125 паскалей, примерно 150 паскалей, примерно 175 паскалей, примерно 200 паскалей, примерно 250 паскалей, примерно 300 паскалей, примерно 350 паскалей, примерно 400 паскалей, примерно 450 паскалей, примерно 500 паскалей, примерно 550 паскалей, примерно 600 паскалей, примерно 650 паскалей, примерно 700 паскалей, примерно 750 паскалей, примерно 800 паскалей, примерно 850 паскалей, примерно 900 паскалей, примерно 950 паскалей, примерно 1000 паскалей, примерно 1 200 паскалей, примерно 1 300 паскалей, примерно 1400 паскалей, примерно 1500 паскалей, примерно 1600 паскалей, примерно 1700 паскалей, примерно 1800 паскалей, примерно 1900 паскалей, примерно 2000 паскалей, примерно 2100 паскалей, примерно 2200 паскалей, примерно 2300 паскалей, примерно 2400 паскалей, или примерно 2500 паскалей. В другом варианте состав демонстрирует модуль упругости в размере, например, по меньшей мере, 25 паскалей, по меньшей мере, 50 паскалей, по меньшей мере, 75 паскалей, по меньшей мере, 100 паскалей, по меньшей мере, 125 паскалей, по меньшей мере, 150 паскалей, по меньшей мере, 175 паскалей, по меньшей мере, 200 паскалей, по меньшей мере, 250 паскалей, по меньшей мере, 300 паскалей, по меньшей мере, 350 паскалей, по меньшей мере, 400 паскалей, по меньшей мере, 450 паскалей, по меньшей мере, 500 паскалей, по меньшей мере, 550 паскалей, по меньшей мере, 600 паскалей, по меньшей мере, 650 паскалей, по меньшей мере, 700 паскалей, по меньшей мере, 750 паскалей, по меньшей мере, 800 паскалей, по меньшей мере, 850 паскалей, по меньшей мере, 900 паскалей, по меньшей мере, 950 паскалей, по меньшей мере, 1000 паскалей, по меньшей мере, 1200 паскалей, по меньшей мере, 1300 паскалей, по меньшей мере, 1400 паскалей, по меньшей мере, 1500 паскалей, по меньшей мере, 1600 паскалей, по меньшей мере, 1700 паскалей, по меньшей мере, 1800 паскалей, по меньшей мере, 1900 паскалей, по меньшей мере, 2000 паскалей, по меньшей мере, 2100 паскалей, по меньшей мере, 2200 паскалей, по меньшей мере, 2300 паскалей, по меньшей мере, 2400 паскалей или, по меньшей мере, 2500 паскалей. В еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует модуль упругости в размере, например, самое большее, 25 паскалей, самое большее, 50 паскалей, самое большее, 75 паскалей, самое большее, 100 паскалей, самое большее, 125 паскалей, самое большее, 150 паскалей, самое большее, 175 паскалей, самое большее, 200 паскалей, самое большее, 250 паскалей, самое большее, 300 паскалей, самое большее, 350 паскалей, самое большее, 400 паскалей, самое большее, 450 паскалей, самое большее, 500 паскалей, самое большее, 550 паскалей, самое большее, 600 паскалей, самое большее, 650 паскалей, самое большее, 700 паскалей, самое большее, 750 паскалей, самое большее, 800 паскалей, самое большее, 850 паскалей, самое большее, 900 паскалей, самое большее, 950 паскалей, самое большее, 1000 паскалей, самое большее, 1200 паскалей, самое большее, 1300 паскалей, самое большее, 1400 паскалей, самое большее, 1500 паскалей или, самое большее, 1 600 паскалей. И во все еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует модуль упругости в размере, например, примерно от 25 паскалей и примерно до 150 паскалей, примерно от 25 паскалей и примерно до 300 паскалей, примерно от 25 паскалей и примерно до 500 паскалей, примерно от 25 паскалей и примерно до 800 паскалей, примерно от 125 паскалей и примерно до 300 паскалей, примерно от 125 паскалей и примерно до 500 паскалей, примерно от 125 паскалей и примерно до 800 паскалей, примерно от 500 паскалей и примерно до 1600 паскалей, примерно от 600 паскалей и примерно до 1600 паскалей, примерно от 700 паскалей и примерно до 1600 паскалей, примерно от 800 паскалей и примерно до 1600 паскалей, примерно от 900 паскалей и примерно до 1600 паскалей, примерно от 1000 паскалей и примерно до 1600 паскалей, примерно от 1100 паскалей и примерно до 1600 паскалей, примерно от 1 200 паскалей и примерно до 1 600 паскалей, примерно от 500 паскалей и примерно до 2500 паскалей, примерно от 1000 паскалей и примерно до 2 500 паскалей, примерно от 1500 паскалей и примерно до 2 500 паскалей, примерно от 2000 паскалей и примерно до 2500 паскалей, примерно от 1300 паскалей и примерно до 1600 паскалей, примерно от 1400 паскалей и примерно до 1700 паскалей, примерно от 1500 паскалей и примерно до 1800 паскалей, примерно от 1600 паскалей и примерно до 1900 паскалей, примерно от 1700 паскалей и примерно до 2000 паскалей, примерно от 1800 паскалей и примерно до 2100 паскалей, примерно от 1900 паскалей и примерно до 2200 паскалей, примерно от 2000 паскалей и примерно до 2300 паскалей, примерно от 2 100 паскалей и примерно до 2400 паскалей или примерно от 2200 паскалей и примерно до 2500 паскалей.
В другом варианте осуществления изобретения представленный в данной работе состав гидрогеля демонстрирует модуль вязкости. В вариантах осуществления данного изобретения состав гидрогеля демонстрирует модуль вязкости, например, примерно 10 паскалей, примерно 20 паскалей, примерно 30 паскалей, примерно 40 паскалей, примерно 50 паскалей, примерно 60 паскалей, примерно 70 паскалей, примерно 80 паскалей, примерно 90 паскалей, примерно 100 паскалей, примерно 150 паскалей, примерно 200 паскалей, примерно 250 паскалей, примерно 300 паскалей, примерно 350 паскалей, примерно 400 паскалей, примерно 450 паскалей, примерно 500 паскалей, примерно 550 паскалей, примерно 600 паскалей, примерно 650 паскалей или примерно 700 паскалей. В других вариантах осуществления данного изобретения состав гидрогеля демонстрирует модуль вязкости, например, самое большее, 10 паскалей, самое большее, 20 паскалей, самое большее, 30 паскалей, самое большее, 40 паскалей, самое большее, 50 паскалей, самое большее, 60 паскалей, самое большее, 70 паскалей, самое большее, 80 паскалей, самое большее, 90 паскалей, самое большее, 100 паскалей, самое большее, 150 паскалей, самое большее, 200 паскалей, самое большее, 250 паскалей, самое большее, 300 паскалей, самое большее, 350 паскалей, самое большее, 400 паскалей, самое большее, 450 паскалей, самое большее, 500 паскалей, самое большее, 550 паскалей, самое большее, 600 паскалей, самое большее, 650 паскалей или, самое большее, 700 паскалей.. В еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует модуль вязкости, например, примерно от 10 паскалей и примерно до 30 паскалей, примерно от 10 паскалей и примерно до 50 паскалей, примерно от 10 паскалей и примерно до 100 паскалей, примерно от 10 паскалей и примерно до 150 паскалей, примерно от 70 паскалей и примерно до 100 паскалей, примерно от 50 паскалей и примерно до 350 паскалей, примерно от 150 паскалей и примерно до 450 паскалей, примерно от 250 паскалей и примерно до 550 паскалей, примерно от 350 паскалей и примерно до 700 паскалей, примерно от 50 паскалей и примерно до 150 паскалей, примерно от 100 паскалей и примерно до 200 паскалей, примерно от 150 паскалей и примерно до 250 паскалей, примерно от 200 паскалей и примерно до 300 паскалей, примерно от 250 паскалей и примерно до 350 паскалей, примерно от 300 паскалей и примерно до 400 паскалей, примерно от 350 паскалей и примерно до 450 паскалей, примерно от 400 паскалей и примерно до 500 паскалей, примерно от 450 паскалей и примерно до 550 паскалей, примерно от 500 паскалей и примерно до 600 паскалей, примерно от 550 паскалей и примерно до 650 паскалей либо примерно от 600 паскалей и примерно до 700 паскалей.
В другом варианте осуществления изобретения представленный здесь состав гидрогеля демонстрирует значения tan δ. В вариантах осуществления данного изобретения представленный здесь состав гидрогеля демонстрирует значения tan δ, например, примерно 0,1, примерно 0,2, примерно 0,3, примерно 0,4, примерно 0,5, примерно 0,6, примерно 0,7, примерно 0,8, примерно 0,9, примерно 1,0, примерно 1,1, примерно 1,2, примерно 1,3, примерно 1,4, примерно 1,5, примерно 1,6, примерно 1,7, примерно 1,8, примерно 1,9, примерно 2,0, примерно 2,1, примерно 2,2, примерно 2,3, примерно 2,4 или примерно 2,5. В других вариантах осуществления данного изобретения представленный здесь состав гидрогеля демонстрирует значения tan δ, например, самое большее, 0,1, самое большее, 0,2, самое большее, 0,3, самое большее, 0,4, самое большее, 0,5, самое большее, 0,6, самое большее, 0,7, самое большее, 0,8, самое большее, 0,9, самое большее, 1,0, самое большее, 1,1, самое большее, 1,2, самое большее, 1,3, самое большее, 1,4, самое большее, 1,5, самое большее, 1,6, самое большее, 1,7, самое большее, 1,8, самое большее, 1,9, самое большее, 2,0, самое большее, 2,1, самое большее, 2,2, самое большее, 2,3, самое большее, 2,4 или, самое большее, 2,5. В еще других вариантах осуществления данного изобретения представленный здесь состав гидрогеля демонстрирует значения tan δ, например, примерно от 0,1 и примерно до 0,3, примерно от 0,3 и примерно до 0,5, примерно от 0,5 и примерно до 0,8, примерно от 1,1 и примерно до 1,4, примерно от 1,4 и примерно до 1,7, примерно от 0,3 и примерно до 0,6, примерно от 0,1 и примерно до 0,5, примерно от 0,5 и примерно до 0,9, примерно от 0,1 и примерно до 0,6, примерно от 0,1 и примерно до 1,0, примерно от 0,5 и примерно до 1,5, примерно от 1,0 и примерно до 2,0 либо примерно от 1,5 и примерно до 2,5.
Варианты данного изобретения частично обеспечивают создание представленного здесь прозрачного и/или просвечиваемого состава гидрогеля. Прозрачность (также называемая химической прозрачностью или способностью пропускать свет) является физическим свойством, которое позволяет свету проходить через материал, тогда как просвечиваемость (также называемая просвечиванием или химической просвечиваемостью) позволяет свету проходить через материал только с рассеиванием. Противоположным этому свойством является непрозрачность. Через прозрачные материалы все четко видно, тогда как в просвечиваемых материалах такая четкость отсутствует. Представленные здесь гидрогели на основе шелкового фиброина могут или не могут демонстрировать физические свойства, такие как прозрачность и просвечиваемость. Например, в определенных случаях поверхностного наполнения до определенного уровня выгодно использовать непрозрачный гидрогель. В других случаях такой разработки линзы или "влаги" для заполнения глаза наличие просвечиваемого гидрогеля должно быть преимуществом. Эти свойства можно было бы изменить посредством воздействия на структурное распределение материала гидрогеля. К факторам, используемым для управления оптическими свойствами гидрогеля, относятся без ограничения концентрация полимера, кристалличность геля и гомогенность гидрогеля.
Когда свет наталкивается на материал, он может взаимодействовать с ним несколькими разными способами. Эти взаимодействия зависят от природы света (его длина волны, частота, энергия и т.д.) и природы материала. Световые волны взаимодействуют с объектом за счет некоторой комбинации отражения и коэффициента пропускания с преломлением. Как таковой, оптически прозрачный материал позволяет большей части падающего на него света проходить с одновременным отражением незначительной его части. Материалы, которые не позволяют проходить свету, называются оптически непрозрачными или просто непрозрачными.
В осуществлении изобретения представленный здесь состав гидрогеля оптически прозрачен. В вариантах осуществления данного изобретения состав гидрогеля пропускает, например, примерно 75% света, примерно 80% света, примерно 85% света, примерно 90% света, примерно 95% света или примерно 100% света. В других вариантах осуществления данного изобретения состав гидрогеля пропускает, например, по меньшей мере, 75% света, по меньшей мере, 80% света, по меньшей мере, 85% света, по меньшей мере, 90% света или, по меньшей мере, 95% света. В еще других вариантах осуществления данного изобретения состав гидрогеля пропускает, например, примерно от 75% и примерно до 100% света, примерно от 80% и примерно до 100% света, примерно от 85% и примерно до 100% света, примерно от 90% и примерно до 100% света или примерно от 95% и примерно до 100% света.
В другом варианте осуществления изобретения представленный здесь состав гидрогеля оптически непрозрачен. В вариантах осуществления данного изобретения состав гидрогеля пропускает, например, примерно 5% света, примерно 10% света, примерно 15% света, примерно 20% света, примерно 25% света, примерно 30% света, примерно 35% света, примерно 40% света, примерно 45% света, примерно 50% света, примерно 55% света, примерно 60% света, примерно 65% света или примерно 70% света. В других вариантах осуществления данного изобретения состав гидрогеля пропускает, например, самое большее, 5% света, самое большее, 10% света, самое большее, 15% света, самое большее, 20% света, самое большее, 25% света, самое большее, 30% света, самое большее, 35% света, самое большее, 40% света, самое большее, 45% света, самое большее, 50% света, самое большее, 55% света, самое большее, 60% света, самое большее, 65% света, самое большее, 70% света или, самое большее, 75% света. В других вариантах осуществления данного изобретения состав гидрогеля пропускает, например, примерно от 5% и примерно до 15%, примерно от 5% и примерно до 20%, примерно от 5% и примерно до 25%, примерно от 5% и примерно до 30%, примерно от 5% и примерно до 35%, примерно от 5% и примерно до 40%, примерно от 5% и примерно до 45%, примерно от 5% и примерно до 50%, примерно от 5% и примерно до 55%, примерно от 5% и примерно до 60%, примерно от 5% и примерно до 65%, примерно от 5% и примерно до 70%, примерно от 5% и примерно до 75%, примерно от 15% и примерно до 20%, примерно от 15% и примерно до 25%, примерно от 15% и примерно до 30%, примерно от 15% и примерно до 35%, примерно от 15% и примерно до 40%, примерно от 15% и примерно до 45%, примерно от 15% и примерно до 50%, примерно от 15% и примерно до 55%, примерно от 15% и примерно до 60%, примерно от 15% и примерно до 65%, примерно от 15% и примерно до 70%, примерно от 15% и примерно до 75%, примерно от 25% и примерно до 35%, примерно от 25% и примерно до 40%, примерно от 25% и примерно до 45%, примерно от 25% и примерно до 50%, примерно от 25% и примерно до 55%, примерно от 25% и примерно до 60%, примерно от 25% и примерно до 65%, примерно от 25% и примерно до 70% или примерно от 25% и примерно до 75% света.
В осуществлении изобретения представленный здесь состав гидрогеля является оптически просвечивающимся. В вариантах осуществления данного изобретения состав гидрогеля передает с рассеиванием, например, примерно 75% света, примерно 80% света, примерно 85% света, примерно 90% света, примерно 95% света либо примерно 100% света. В других вариантах осуществления данного изобретения состав гидрогеля передает с рассеиванием, например, по меньшей мере, 75% света, по меньшей мере, 80% света, по меньшей мере, 85% света, по меньшей мере, 90% света или, по меньшей мере, 95% света. В еще других вариантах осуществления данного изобретения состав гидрогеля передает с рассеиванием, например, примерно от 75% и примерно до 100% света, примерно от 80% и примерно до 100% света, примерно от 85% и примерно до 100% света, примерно от 90% и примерно до 100% света или примерно от 95% и примерно до 100% света.
Представленный здесь состав гидрогеля может в дальнейшем обрабатываться растиранием гидрогеля на частицы и по желанию смешиваться с подвижной фазой, такой как, например, вода или соляной раствор для получения впрыскиваемой или используемой местно субстанции наподобие раствора, масла, лосьона, геля, мази, крема, кашицы, притирания или пасты. Как таковые, представленные здесь составы гидрогеля могут быть монофазными или многофазными. Гидрогель может быть перемолот на частицы размером примерно от 10 мкм и примерно до 1000 мкм в диаметре, таким как примерно от 15 мкм и примерно до 30 мкм, примерно от 50 мкм и примерно до 75 мкм, примерно от 100 мкм и примерно до 150 мкм, примерно от 200 мкм и примерно до 300 мкм, примерно от 450 мкм и примерно до 550 мкм, примерно от 600 мкм и примерно до 700 мкм, примерно от 750 мкм и примерно до 850 мкм или примерно от 900 мкм и примерно до 1000 мкм.
Варианты данного изобретения частично обеспечивают впрыскиваемость представленного здесь состава. В контексте данной работы термин "впрыскиваемый" касается материала со свойствами, необходимыми для введения состава в участок кожи пациента с помощью инъекционного приспособления с тонкой иглой. В контексте данной работы термин "тонкая игла" касается иглы 27 размера или меньше. Впрыскивание представленного здесь состава может быть выполнено посредством классификации частиц гидрогеля по размеру так, как обсуждалось ранее.
В варианте осуществления данного изобретения представленный здесь состав гидрогеля является впрыскиваемым через тонкую иглу. В других вариантах осуществления данного изобретения представленный здесь состав гидрогеля впрыскивается через иглу, например, примерно 27 размера, примерно 30 размера или примерно 32 размера. В еще других вариантах осуществления данного изобретения представленный здесь состав гидрогеля впрыскивается через иглу, например, 22 размера или менее, 27 размера или менее, 30 размера или менее либо 32 размера или менее. И во все еще других вариантах осуществления данного изобретения представленный здесь состав гидрогеля впрыскивается через иглу, например, примерно от 22 размера и примерно до 35 размера, от 22 размера и примерно до 34 размера, от 22 размера и примерно до 33 размера, от 22 размера и примерно до 32 размера, примерно от 22 размера и примерно до 27 размера, или примерно от 27 размера и примерно до 32 размера.
В вариантах осуществления данного изобретения представленный здесь состав гидрогеля может впрыскиваться с силой выдавливания примерно 60 ньютонов, примерно 55 ньютонов, примерно 50 ньютонов, примерно 45 ньютонов, примерно 40 ньютонов, примерно 35 ньютонов, примерно 30 ньютонов, примерно 25 ньютонов, примерно 20 ньютонов или примерно 15 ньютонов со скоростью 100 мм/минута. В других вариантах осуществления данного изобретения представленный здесь состав гидрогеля может впрыскиваться через иглу 27 размера с силой выдавливания примерно 60 ньютонов или менее, примерно 55 ньютонов или менее, примерно 50 ньютонов или менее, примерно 45 ньютонов или менее, примерно 40 ньютонов или менее, примерно 35 ньютонов или менее, примерно 30 ньютонов или менее, примерно 25 ньютонов или менее, примерно 20 ньютонов или менее, примерно 15 ньютонов или менее, примерно 10 ньютонов или менее, либо примерно 5 ньютонов или менее. В еще других вариантах осуществления данного изобретения представленный здесь состав гидрогеля может впрыскиваться через иглу 30 размера с силой выдавливания примерно 60 ньютонов или менее, примерно 55 ньютонов или менее, примерно 50 ньютонов или менее, примерно 45 ньютонов или менее, примерно 40 ньютонов или менее, примерно 35 ньютонов или менее, примерно 30 ньютонов или менее, примерно 25 ньютонов или менее, примерно 20 ньютонов или менее, примерно 15 ньютонов или менее, примерно 10 ньютонов или менее либо примерно 5 ньютонов или менее. И во все еще других вариантах осуществления данного изобретения представленный здесь состав гидрогеля может впрыскиваться через иглу 32 размера с силой выдавливания примерно 60 ньютонов или менее, примерно 55 ньютонов или менее, примерно 50 ньютонов или менее, примерно 45 ньютонов или менее, примерно 40 ньютонов или менее, примерно 35 ньютонов или менее, примерно 30 ньютонов или менее, примерно 25 ньютонов или менее, примерно 20 ньютонов или менее, примерно 15 ньютонов или менее, примерно 10 ньютонов или менее либо примерно 5 ньютонов или менее.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который демонстрирует сцепление. Сцепление, также называемое когезией, сцепливающим притягиванием, силой сцепления или сжимающей силой, является физическим свойством материала, вызванным межмолекулярным притяжением между подобными молекулами материала, которое действует с целью объединения молекул. Сцепление выражается в единицах грамм-силы (г-с). На способность к сцеплению среди других факторов оказывает влияние коэффициент молекулярного веса первоначально свободного полимера гликозаминогликана, степень сшиваемости полимеров гликозаминогликана, количество свободных полимеров гликозаминогликана, оставшиеся после сшивания и pH состава гидрогеля. Состав должен быть достаточно связывающим для того, чтобы оставаться локализованным в месте инъекции. Дополнительно к этому в определенных приложениях важным является наличие достаточной способности к сцеплению для того, чтобы состав сохранял свою форму и, таким образом, функциональность в случае циклической механической нагрузки. Как таковой, в одном осуществлении изобретения представленный здесь состав гидрогеля демонстрирует сцепление наравне с водой. В еще другом варианте осуществления изобретения представленный здесь состав гидрогеля демонстрирует достаточное сцепление для того, чтобы оставаться локализованным в месте инъекции. И во все еще другом осуществление изобретения представленный здесь состав гидрогеля демонстрирует достаточное сцепление, чтобы оставаться в своей форме. В дальнейшем осуществлении изобретения представленный здесь состав гидрогеля демонстрирует достаточное сцепление, чтобы оставаться в своей форме и функциональности.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который демонстрирует физиологически приемлемую осмотическую концентрацию раствора. В контексте данной работы термин "осмотическая концентрация раствора" касается концентрации осмотически активных растворенных веществ в растворе. В контексте данной работы термин "физиологически приемлемая осмотическая концентрация раствора" касается осмотической концентрации раствора в соответствие или характерно нормальному функционированию живого организма. Как таковая, инъекция состава гидрогеля так, как представлено в этой работе, демонстрирует осмотическую концентрацию раствора, которая в значительной степени не оказывает долговременного или перманентного воздействия после введения в организм млекопитающего. Осмотическая концентрация раствора выражается в осмолах осмотически активного растворенного вещества на литр растворителя (осмол/литр или Осм/л). Осмотическая концентрация раствора отлична от молярности, потому что она измеряет моли частиц осмотически активного растворенного вещества, а не моли растворенного вещества. Отличие возникает по причине того, что некоторые соединения могут распадаться в растворе, тогда как другие этого не делают. Осмотическую концентрацию раствора можно вычислить посредством следующего выражения: , где ϕ - это осмотический коэффициент, который учитывает степень неидеальности раствора; η - количество частиц (например, ионов), на которые распадаются молекулы; С - молярная концентрация растворенного вещества, a i - индекс, представляющий идентичность конкретного растворенного вещества. Осмотическая концентрация раствора представленного здесь состава гидрогеля может быть измерена с помощью традиционного метода измерений растворов.
В осуществлении изобретения представленный здесь состав гидрогеля демонстрирует физиологически приемлемую осмотическую концентрацию раствора. В вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, примерно 100 мОсм/л, примерно 150 мОсм/л, примерно 200 мОсм/л, примерно 250 мОсм/л, примерно 300 мОсм/л, примерно 350 мОсм/л, примерно 400 мОсм/л, примерно 450 мОсм/л либо примерно 500 мОсм/л. В других вариантах осуществления данного изобретения представленный здесь состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, по меньшей мере, 100 мОсм/л, по меньшей мере, 150 мОсм/л, по меньшей мере, 200 мОсм/л, по меньшей мере, 250 мОсм/л, по меньшей мере, 300 мОсм/л, по меньшей мере, 350 мОсм/л, по меньшей мере, 400 мОсм/л, по меньшей мере, 450 мОсм/л или, по меньшей мере, 500 мОсм/л. В еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, самое большее, 100 мОсм/л, самое большее, 150 мОсм/л, самое большее, 200 мОсм/л, самое большее, 250 мОсм/л, само большее, 300 мОсм/л, самое большее, 350 мОсм/л, самое большее, 400 мОсм/л, самое большее, 450 мОсм/л или, самое большее, 500 мОсм/л. И во все еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, примерно от 100 мОсм/л и примерно до 500 мОсм/л, примерно от 200 мОсм/л и примерно до 500 мОсм/л, примерно от 200 мОсм/л и примерно до 400 мОсм/л, примерно от 300 мОсм/л и примерно до 400 мОсм/л, примерно от 270 мОсм/л и примерно до 390 мОсм/л, примерно от 225 мОсм/л и примерно до 350 мОсм/л, примерно от 250 мОсм/л и примерно до 325 мОсм/л, примерно от 275 мОсм/л и примерно до 300 мОсм/л либо примерно от 285 мОсм/л и примерно до 290 мОсм/л.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который демонстрирует физиологически приемлемую осмотическую концентрацию раствора. В контексте данной работы термин "осмотическая концентрация раствора" касается концентрации осмотически активных растворенных веществ на килограмм растворителя в организме. В контексте данной работы термин "физиологически приемлемая осмотическая концентрация раствора" касается осмотической концентрации раствора в соответствии с нормальным функционированием живого организма или иой концентрации, которая является показательной в этом отношении. Как таковая, инъекция представленного здесь состава гидрогеля демонстрирует физиологически приемлемую осмотическую концентрацию раствора, которая, в сущности, не оказывает длительного или перманентного пагубного влияния при введении всем млекопитающим. Осмотическая концентрация раствора выражается в осмолях осмотически активного растворенного вещества на килограмм растворителя (осмоль/ег или осм/кг) и равняется сумме моляльностей всех растворенных веществ, представленных в растворе. Осмотическую концентрацию раствора можно измерить с помощью осмометра. Наиболее повсеместно используемым прибором современных лабораторий является осмометр для измерения пониженной точки замерзания. Эти приборы измеряют изменение точки замерзания, которая наблюдается в растворе при увеличении осмотической концентрации раствора (осмометр для измерения пониженной точки замерзания.) или изменение давления пара, которое наблюдается в растворе по мере увеличения осмотической концентрации раствора (паронаполненный осмометр).
В осуществлении изобретения представленный здесь состав демонстрирует физиологически приемлемую осмотическую концентрацию раствора. В вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, примерно 100 мОсм/кг, примерно 150 мОсм/кг, примерно 200 мОсм/кг, примерно 250 мОсм/кг, примерно 300 мОсм/кг, примерно 350 мОсм/кг, примерно 400 мОсм/кг, примерно 450 мОсм/кг либо примерно 500 мОсм/кг. В других вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, по меньшей мере, 100 мОсм/кг, по меньшей мере, 150 мОсм/кг, по меньшей мере, 200 мОсм/кг, по меньшей мере, 250 мОсм/кг, по меньшей мере, 300 мОсм/кг, по меньшей мере, 350 мОсм/кг, по меньшей мере, 400 мОсм/кг, по меньшей мере, 450 мОсм/кг или, по меньшей мере, 500 мОсм/кг.В еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, самое большее, 100 мОсм/кг, самое большее, 150 мОсм/кг, самое большее, 200 мОсм/кг, самое большее, 250 мОсм/кг, самое большее, 300 мОсм/кг, самое большее, 350 мОсм/кг, самое большее, 400 мОсм/кг, самое большее, 450 мОсм/кг или, самое большее, 500 мОсм/кг. И во все еще других вариантах осуществления данного изобретения состав гидрогеля демонстрирует осмотическую концентрацию раствора, например, примерно от 100 мОсм/кг и примерно до 500 мОсм/кг, примерно от 200 мОсм/кг и примерно до 500 мОсм/кг, примерно от 200 мОсм/кг и примерно до 400 мОсм/кг, примерно от 300 мОсм/кг и примерно до 400 мОсм/кг, примерно от 270 мОсм/кг и примерно до 390 мОсм/кг, примерно от 225 мОсм/кг и примерно до 350 мОсм/кг, примерно от 250 мОсм/кг и примерно до 325 мОсм/кг, примерно от 275 мОсм/кг и примерно до 300 мОсм/кг либо примерно от 285 мОсм/кг и примерно до 290 мОсм/кг.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который демонстрирует значительную устойчивость. В контексте данной работы термин "устойчивость" или "устойчивый", когда речь заходит о представленном здесь составе гидрогеля, касается состава, который не подвержен ухудшению, разложению или разрушению до любой значительной или значимой степени в процессе хранения перед использованием его в качестве инъекции пациенту. В контексте данной работы термин "значительная теплостойкость", "в значительной степени теплостойкий", "устойчивый к обработке в автоклаве" или "устойчивый к стерилизации паром" касается представленного здесь состава гидрогеля, который в значительной степени устойчив при паровой обработке, как представлено в настоящей работе.
Устойчивость представленного здесь состава гидрогеля может определяться в том случае, если подвергнуть состав гидрогеля тепловой обработке, такой как, например, стерилизация паром при нормальном давлении или под давлением (например, стерилизация в автоклаве). Предпочтительно, чтобы тепловая обработка проводилась при температуре, по меньшей мере, примерно 100°С в течение периода примерно от одной минуты и примерно до 10 минут. Представленная здесь значительная устойчивость состава гидрогеля может быть оценена 1) посредством определения изменения силы экструзии (AF) после стерилизации представленного здесь состава гидрогеля, где изменение силы экструзии до менее 2 ньютонов свидетельствует о значительной устойчивости состава гидрогеля, определенной в результате измерения (силы экструзии для состава гидрогеля вместе с указанными добавками) минус (сила экструзии для состава гидрогеля без внесения добавок); и/или 2) посредством определения изменения реологических свойств после стерилизации представленного здесь состава гидрогеля, где изменение tan δ при 1 Гц ниже, чем 0,1, указывает на значительную устойчивость состава гидрогеля в результате измерения (tan δ при 1 Гц рецептуры геля с добавками) минус (tan δ при 1 Hz рецептуры геля без добавок). Как таковой, представленный здесь и в значительной степени устойчивый состав гидрогеля сохраняет одну или несколько из следующих характеристик после стерилизации: однородность, силу экструзии, сцепление, концентрацию гиалуронана, концентрацию агента (агентов), осмотическую концентрацию раствора, pH или другие реологические характеристики, желательные для гидрогеля до тепловой обработки.
В осуществлении изобретения состав гидрогеля, включающий полимер гликозаминогликан и, по меньшей мере, один представленный здесь агент подвергается тепловой обработке, которая сохраняет представленные здесь желательные свойства гидрогеля. В вариантах осуществления данного изобретения, состав гидрогеля, включающий полимер гликозаминогликан и, по меньшей мере, один представленный здесь агент, подвергается тепловой обработке, например, при температуре примерно 100°C, примерно 105°C, примерно 110°C, примерно 115°C, примерно 120°C, примерно 125°C либо примерно 130°C. В других вариантах осуществления данного изобретения состав гидрогеля, включающий полимер гликозаминогликан и, по меньшей мере, один представленный здесь агент, подвергается тепловой обработке при температуре, например, по меньшей мере, 100°C, по меньшей мере, 105°C, по меньшей мере, 110°C, по меньшей мере, 115°C, по меньшей мере, 120°C, по меньшей мере, 125°C или, по меньшей мере, 130°C. В еще других вариантах осуществления данного изобретения состав гидрогеля, включающий полимер гликозаминогликан и, по меньшей мере, один представленный здесь агент подвергается тепловой обработке при температуре, например, примерно от 100°C и примерно до 120°C, примерно от 100°C и примерно до 125°C, примерно от 100°C и примерно до 130°C, примерно от 100°C и примерно до 135°C, примерно от 110°C и примерно до 120°C, примерно от 110°C и примерно до 125°C, примерно от 110°C и примерно до 130°C, примерно от 110°C и примерно до 135°C, примерно от 120°C и примерно до 125°C, примерно от 120°C и примерно до 130°C, примерно от 120°C и примерно до 135°C, примерно от 125°C и примерно до 130°C либо примерно от 125°C и примерно до 135°C.
Долгосрочная устойчивость представленного здесь состава гидрогеля может быть определена в результате тепловой обработки состава гидрогеля, такой как, например, хранение при температуре окружающей среды примерно 45°C в течение примерно 60 дней. Долгосрочная устойчивость представленного здесь состава гидрогеля может быть определена 1) оценкой степени прозрачности и цвета состава гидрогеля после тепловой обработки при температуре 45°C в сравнении с чистым и бесцветным составом гидрогеля, что свидетельствует в значительной степени об устойчивости составе гидрогеля; 2) определением изменения силы экструзии (AF) представленного здесь состава гидрогеля после тепловой обработки при температуре 45°C, где изменение силы экструзии до менее 2 ньютонов свидетельствует о значительной устойчивости состава гидрогеля, определенной в результате измерения (силы экструзии состава гидрогеля вместе с указанными добавками до тепловой обработки при температуре 45°C) минус (сила экструзии состава гидрогеля вместе с указанными добавками после тепловой обработки при температуре 45°C); и/или 3) посредством определения изменения реологических свойств после стерилизации представленного здесь состава гидрогеля, где изменение tan δ при 1 Гц ниже, чем 0,1, указывает на значительную устойчивость состава гидрогеля в результате измерения (tan δ при 1 Гц рецептуры геля с конкретными добавками до тепловой обработки при температуре 45°C) минус (tan δ при 1 Гц рецептуры геля с конкретными добавками после тепловой обработки при температуре 45°C). Как таковая, долговременная устойчивость представленного здесь состава гидрогеля оценивается сохранением одной или нескольких следующих характеристик после тепловой обработке при температуре 45°C: внешний вид (прозрачность и просвечиваемость), однородность и способность к сцеплению.
В вариантах осуществления данного изобретения состав гидрогеля в значительной степени устойчив при комнатной температуре на протяжении, например, примерно 3 месяцев, примерно 6 месяцев, примерно 9 месяцев, примерно 12 месяцев, примерно 15 месяцев, примерно 18 месяцев, примерно 21 месяцев, примерно 24 месяцев, примерно 27 месяцев, примерно 30 месяцев, примерно 33 месяцев либо примерно 36 месяцев. В других вариантах осуществления данного изобретения состав гидрогеля в значительной степени устойчив при комнатной температуре на протяжении, например, по меньшей мере, 3 месяцев, по меньшей мере, 6 месяцев, по меньшей мере, 9 месяцев, по меньшей мере, 12 месяцев, по меньшей мере, 15 месяцев, по меньшей мере, 18 месяцев, по меньшей мере, 21 месяцев, по меньшей мере, 24 месяцев, по меньшей мере, 27 месяцев, по меньшей мере, 30 месяцев, по меньшей мере, 33 месяцев или, по меньшей мере, 36 месяцев. В других вариантах этого осуществления изобретения состав гидрогеля в значительной степени устойчив при комнатной температуре на протяжении, например, примерно от 3 месяцев и примерно до 12 месяцев, примерно от 3 месяцев и примерно до 18 месяцев, примерно от 3 месяцев и примерно до 24 месяцев, примерно от 3 месяцев и примерно до 30 месяцев, примерно от 3 месяцев и примерно до 36 месяцев, примерно от 6 месяцев и примерно до 12 месяцев, примерно от 6 месяцев и примерно до 18 месяцев, примерно от 6 месяцев и примерно до 24 месяцев, примерно от 6 месяцев и примерно до 30 месяцев, примерно от 6 месяцев и примерно до 36 месяцев, примерно от 9 месяцев и примерно до 12 месяцев, примерно от 9 месяцев и примерно до 18 месяцев, примерно от 9 месяцев и примерно до 24 месяцев, примерно от 9 месяцев и примерно до 30 месяцев, примерно от 9 месяцев и примерно до 36 месяцев, примерно от 12 месяцев и примерно до 18 месяцев, примерно от 12 месяцев и примерно до 24 месяцев, примерно от 12 месяцев и примерно до 30 месяцев, примерно от 12 месяцев и примерно до 36 месяцев, примерно от 18 месяцев и примерно до 24 месяцев, примерно от 18 месяцев и примерно до 30 месяцев либо примерно от 18 месяцев и примерно до 36 месяцев.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, который является фармацевтически приемлемым составом. В данном контексте, термин "фармацевтически приемлемый" означает любую молекулярную сущность или состав, который не приводит к проявлению неблагоприятной, аллергической или другой некорректной либо нежелательной реакции после введения его в организм пациента. Фармацевтически приемлемый состав гидрогеля полезен в лечебных и ветеринарных целях. Фармацевтически приемлемый состав гидрогеля может быть введен пациенту в чистом виде или в виде комбинации с другими дополнительными активными ингредиентами, агентами, лекарственными средствами или гормонами.
Варианты данного изобретения частично обеспечивают создание представленного здесь состава гидрогеля, включающего фармакологически приемлемый наполнитель. В контексте данной работы термин "фармакологически приемлемый наполнитель" является синонимом термина "фармакологический наполнитель" или "наполнитель" и касается любого наполнителя, который не оказывает значительно долговременного или перманентного пагубного воздействия при введении в организм млекопитающего и охватывает такие соединения как, например, стабилизирующий агент, объемообразующий агент, криопротектор, лиопротектор, добавку, связующий агент, несущая среда, разбавитель или вспомогательные добавки. Как правило, наполнитель смешивается с активным ингредиентом или допускает разбавление либо включение активного ингредиента и может быть твердым, наполовину твердым или жидким агентом. Также предполагается, что фармацевтический состав в контексте данного изобретения может включать один или несколько фармацевтически приемлемых наполнителей, которые способствуют переработке активного ингредиента в фармацевтически приемлемые составы. В той степени, в какой любой фармацевтически приемлемый наполнитель несовместим с активным ингредиентом, рассматривается его использование в фармацевтически приемлемых составах. Неограничивающие примеры фармакологически приемлемых наполнителей можно обнаружить, например, в следующих изданиях - «Лекарственные Формы и Системы Доставки Лекарственного Препарата к Участку Действия» (редактора Говард С. Анзель и другие (Howard С. Ansel et al.), издательство Lippincott Williams & Wilkins Publishers, 7-е издание. 1999); «Ремингтон: Наука и Практика Аптечной Деятельности» (Remington: The Science and Practice of Pharmacy) (под редакцией Альфонсо P. Геннаро (Alfonso R. Gennaro ed.), издательство Lippincott, Williams & Wilkins, 20-е издание. 2000); «Фармакологические Основы Терапии Гудмена и Джильмана» (Goodman & Gilman's The Pharmacological Basis of Therapeutics) (редактора Джое ль Хардман и другие (Joel G. Hardman et al.) издательство McGraw-Hill Professional, 10-е издание, 2001); и «Справочник по Фармацевтическим Наполнителям» (Handbook of Pharmaceutical Excipients) (Раймонд С. Роу и другие (Raymond С. Rowe et al.), издательство APhA Publications, 4-е издание, 2003), каждое из которых настоящим включено во всей полноте посредством ссылки.
Далее предполагается, что представленный здесь состав гидрогеля может по выбору включать без ограничения другие фармацевтически приемлемые компоненты, включая без ограничения замедлители, антисептики, регуляторы мышечного напряжения, соли, антиоксиданты, агенты регулирования осмотической концентрации раствора, эмульгирующие агенты, увлажнители, подсластители или вкусовые агенты и тому подобное.
Фармацевтически приемлемым замедлителем является такой замедлитель, который можно использовать для представленного здесь состава гидрогеля при условии, что полученный в результате препарат фармацевтически приемлем. Неограничивающие примеры фармацевтически приемлемых замедлителей включают буферы на основе ацетата, буферы на основе бората, буферы на основе цитрата, нейтральные буферные солевые растворы, буферы на основе фосфата, фосфатно-солевые буферные растворы. Любая концентрация фармацевтически приемлемого буфера может быть полезной при разработке рецептуры представленного здесь фармацевтического состава с той лишь оговоркой, что терапевтически эффективное количество активного ингредиента восстанавливается с помощью этой эффективной концентрации замедлителя. Неограничивающие примеры концентраций физиологически приемлемых буферов наблюдаются в диапазоне примерно от 0,1 мМ и примерно до 900 мМ. Показатель pH фармацевтически приемлемых замедлителей может быть отрегулирован при условии, что полученный в результате раствор окажется физиологически приемлемым. Понятно, что для требуемой регулировки показателя pH фармацевтического раствора могут использоваться кислоты и основания. Любой буферный уровень pH может оказаться полезным при разработке рецептуры фармацевтического состава с той лишь оговоркой, что терапевтически эффективное количество активного ингредиента в виде матричного полимера восстанавливается с помощью этого эффективного уровня показателя pH. Неограничивающие примеры физиологически приемлемого показателя pH наблюдаются в диапазоне примерно от pH, равного 5,0, и примерно до pH, равного 8,5. Например, показатель pH представленного здесь состава гидрогеля может составить примерно от 5,0 и примерно до 8,0, или примерно от 6,5 и примерно до 7,5, примерно от 7,0 и примерно до 7,4 либо примерно от 7,1 и примерно до 7,3.
Фармацевтически приемлемые антисептики включают без ограничения метабисульфат натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол. Фармацевтически приемлемые антисептики включают без ограничения бензалконий хлорид, хлорбутанол, тимеросал, фенилртутный ацетат, фенилртутный нитрат, стабилизированный окси-хлор-состав, такой как, например, PURITE® (компания Allergan, Inc., г. Ирвин (Irvine), штат Калифорния) и хелатирующие агенты, такие как, например, ацеллюлярная АКДС-вакцина (DTPA) или DTPA-бисамид, DTPA кальция и CaNaDTPA-бисамид.
Фармацевтически приемлемые регуляторы мышечного напряжения, полезные в представленном здесь составе гидрогеля, включают без ограничения такие соли как, например, хлорид натрия, хлорид калия и глицерин. Состав может быть предоставлен в виде соли и образован в комбинации со многими кислотами, включая, но, не ограничиваясь, хлористоводородной, серной, уксусной, молочной, винной, оксиянтарной, янтарной и прочими кислотами. Соли характеризуются большей растворимостью в водном или в других протонных растворах, чем соответствующие формы с нейтральным основанием Понятно, что эти и другие вещества, известные в области фармакологии, можно включить в представленный здесь фармацевтический состав. Другие неограничивающие примеры фармакологически приемлемых компонентов можно обнаружить, например, в работах Анзеля (Ansel), см. выше, (1999); Геннаро (Gennaro), см. выше, (2000); Хардмана (Hardman), см. выше, (2001); и Роу (Rowe), см. выше, (2003), каждая из которых настоящим включена сюда во всей своей полноте посредством ссылки.
Варианты данного изобретения частично обеспечивают способ обработки мягкой ткани пациента при инъекции представленного здесь состава гидрогеля. В контексте данной работы термин "обработка" касается снижения воздействия или устранения у пациента косметического или клинического симптома состояния мягкой ткани, который характеризуется появлением изъяна, недостатка, дефекта, заболевания и/или нарушения мягкой ткани; либо задержки или предотвращения проявления у пациента косметического или клинического симптома такого состояния мягкой ткани, которое характеризуется появлением изъяна, недостатка, дефекта, заболевания и/или нарушения мягкой ткани на уровне, например, по меньшей мере, 20%, по меньшей мере, 30%, по меньшей мере, 40%, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90% или, по меньшей мере, 100%. Эффективность представленного здесь состава гидрогеля при обработке состояния, которое характеризуется дефектом, болезнью и/или нарушением мягкой ткани, может быть определена наблюдением за одним или несколькими косметическими и клиническими симптомами и/или физиологическими симптомами, связанными с состоянием мягкой ткани. На устранение дефекта, заболевания и/или нарушением состояния мягкой ткани также может указывать сниженная потребность в сопутствующей терапии. Специалисты в предметной области должны знать соответствующие симптомы и признаки, связанные с конкретным дефектом, болезнью и/или нарушением мягкой ткани, и способы их определения, если пациент является кандидатом на проведение лечения представленным здесь соединением или составом.
Состав гидрогеля вводится индивидууму. Индивидуум - это обычно лицо любого возраста, пола или расы. Обычно любой индивидуум, который является кандидатом на проведение общепринятой процедуры лечения состояния мягкой ткани, -кандидат также и на опробывание представленного здесь способа. Хотя индивидуумом, который ощущает признаки старения кожи, является взрослый, индивидуумы, которые испытывают преждевременное старение кожи или их кожа находится в состоянии, подходящем для лечебной обработки (например, шрам), также могут проходить лечение представленным здесь составом гидрогеля. Кроме того, представленные здесь составы гидрогеля и способы могут использоваться применительно к пациентам, желающим получить малое/среднее увеличение, изменение формы или контуров той части или участка тела, которые технически могут не быть реализованы или окажутся неприемлемыми с эстетической точки зрения при использовании существующей технологии имплантации в мягкие ткани. Предоперационная оценка помимо получения согласия пациента на инъекцию после детального его информирования, в котором раскрываются все уместные риски и достоинства этой процедуры, чаще всего включает составление стандартной истории болезни и физическое обследование.
Представленный здесь состав гидрогеля и способы полезны для лечения мягких тканей в болезненном состоянии. Болезненное состояние мягких тканей включает без ограничения изъян, дефект, заболевание и/или другое нарушение мягких тканей. Неограничивающие примеры болезненного состояния мягких тканей включают изъян, дефект, заболевание и/или другое нарушение целостности бюста, такие как те, что, например, требуют увеличения бюста, воссоздания бюста, мастопексии, микромастии, грудной гипоплазии, устранения синдрома Поланда и дефектов, возникших в результате установки имплантатов, наподобие капсулярной контрактуры и/или разрыва; изъян, дефект, заболевание и/или другое нарушение лицевых тканей, такое как, например, увеличение лицевых тканей, воссоздание лицевых тканей, мизотерапия, лечение синдрома Пари-Ромберга, глубокой эриматозной волчанки, кожные накладки, шрамы, запавшие щеки, тонкие губы, изъяны или дефекты носа, ретроорбитальные изъяны и дефекты, кожная складка на лице, линии и/или морщины наподобие межбровной морщины, носогубной морщины, околоротовой морщины и/или вертикальные морщины, идущие от уголков губ к подбородку, и/или другие контурные деформации либо изъяны лица; изъян, дефект, заболевание и/или другое нарушение кожи шеи; изъян, дефект, заболевание и/или другое нарушение кожи; другие изъяны, дефекты, заболевания и прочие нарушения мягких тканей лица, такие как, например, увеличение или воссоздание плеча, предплечья, руки, плечевого выступа, спины, туловища, включая живот, ягодицы, верхнюю часть ноги, нижнюю часть ноги, включая икры, ступню, включая скопление подошвенной жировой ткани, глаз, гениталии или любую часть, участок либо область тела или заболевание либо нарушение, пагубно действующее на эти части, участки или области тела; недержание мочи, недержание кала и прочие формы недержания; и гастроезофигиальная рефлюксная болезнь (ГЭРБ). В данном контексте термин "мезотерапия" касается способа косметической обработки без хирургического вмешательства кожи, включая внутриэпидермальную, внутридермальную и/или подкожную инъекцию агента, вводимого в эпидермис, дермоэпидермальное соединение и/или в дерму малыми многочисленными капельками.
Количество состава гидрогеля, используемого при любом из способов в данном контексте, как правило, должно определяться, основываясь на требуемом изменении и/или улучшении, снижении и/или устранении требуемого симптома состояния мягкой ткани, клиническом и/или косметическом действии, желательном для пациента и/или врача, а также для проходящей лечение части или области тела. Эффективность введения состава может проявить себя в результате одной или нескольких следующих клинических и/или косметических мер в виде: измененной и/или улучшенной формы мягкой ткани, измененного и/или улучшенного размера мягкой ткани, измененного и/или улучшенного контура мягкой ткани, измененной и/или улучшенной функции мягкой ткани, обеспечения внутреннего врастания мягкой ткани и/или нового отложения коллагена, устойчивого проживления трасплантата из состава, роста удовлетворенности и качества жизни пациента, а также сниженного использования имплантируемого зарубежного материала.
Например, после проведения процедур увеличения размера бюста в результате обращения к одной или к нескольким следующим клиническим и/или косметическим мерам можно говорить об эффективности составов и способов, проявившейся в виде: увеличенного размера бюста, измеренной формы бюста, измененного контура бюста, устойчивого проживления трасплантата, снижения риска капсулярной контрактуры, сниженной скорости образования липонекротической кисты, роста удовлетворенности и качества жизни пациента, а также в виде сниженного использования имплантируемого материала, предназначенного для исправления формы бюста.
В другом примере эффективность составов и способов для лечения мягкой лицевой ткани может проявиться в результате обращения к одной или к нескольким следующим клиническим и/или косметическим мерам в виде увеличенного размера, формы и/или контура компонента лица наподобие увеличенного размера, формы и/или контура губы, щеки или участка глаза; в виде измененного размера, формы и/или контура компонента лица наподобие измененного размера, формы и/или контура губы, щеки или участка глаза; уменьшения или устранения морщины, кожной складки или линии; появления сопротивляемости образованию морщин, кожной складки или линии; регидратации кожи; возросшей эластичности кожи; снижения или устранения шероховатости кожи; роста и/или улучшения натянутости кожи; уменьшения или устранения линий либо пятен от растяжек кожи; увеличения и/или улучшения тонуса, блеска, яркости и/или сияния кожи; увеличения и/или улучшения цвета кожи, снижения или устранения бледности кожи; устойчивого проживления состава; снижения побочных эффектов; роста удовлетворенности и качества жизни пациента.
В еще другом примере, связанном с процедурами по устранению недержания мочи, после обращения к одной или нескольким следующим клиническим мерам можно говорить об эффективности составов и способов для поддержания работы сфинктера, проявившейся в виде: уменьшенного количества случаев недержания мочи, устойчивого проживления состава, роста удовлетворенности и качества жизни пациента и сниженного применения имплантируемого наполнителя зарубежного производства.
В вариантах осуществления данного изобретения количество введенного состава гидрогеля составляет, например, примерно 0,01 г, примерно 0,05 г, примерно 0,1 г, примерно 0,5 г, примерно 1 г, примерно 5 г, примерно 10 г, примерно 20 г, примерно 30 г, примерно 40 г, примерно 50 г, примерно 60 г, примерно 70 г, примерно 80 г, примерно 90 г, примерно 100 г, примерно 150 г либо примерно 200 г. В других вариантах осуществления данного изобретения количество введенного состава гидрогеля составляет, например, примерно от 0,01 г и примерно до 0,1 г, примерно от 0,1 g и примерно до 1 г, примерно от 1 g и примерно до 10 г, примерно от 10 g и примерно до 100 г либо примерно от 50 g и примерно до 200 г.В еще других вариантах осуществления данного изобретения количество введенного состава гидрогеля составляет, например, примерно 0,01 мл, примерно 0,05 мл, примерно 0,1 мл, примерно 0,5 мл, примерно 1 мл, примерно 5 мл, примерно 10 мл, примерно 20 мл, примерно 30 мл, примерно 40 мл, примерно 50 мл, примерно 60 мл, примерно 70 г, примерно 80 мл, примерно 90 мл, примерно 100 мл, примерно 150 мл либо примерно 200 мл. В других вариантах осуществления данного изобретения, количество введенного состава гидрогеля составляет, например, примерно от 0,01 мл и примерно до 0,1 мл, примерно от 0,1 мл и примерно до 1 мл, примерно от 1 мл и примерно до 10 мл, примерно от 10 мл и примерно до 100 мл либо примерно от 50 мл и примерно до 200 мл.
Продолжительность лечения, как правило, будет определяться с учетом косметического и/или клинического эффекта, желательного для индивидуума и/или для врача и части либо участка тела, подвергнутого лечению. В вариантах осуществления данного инъекция представленного здесь состава гидрогеля может оказывать лечебное действие на состояние мягкой ткани на протяжении периода длительностью, например, примерно 6 месяцев, примерно 7 месяцев, примерно 8 месяцев, примерно 9 месяцев, примерно 10 месяцев, примерно 11 месяцев, примерно 12 месяцев, примерно 13 месяцев, примерно 14 месяцев, примерно 15 месяцев, примерно 18 месяцев либо примерно 24 месяцев. В других вариантах этого осуществления изобретения инъекция представленного здесь состава гидрогеля может оказывать лечебное действие на состояние мягкой ткани на протяжении, например, по меньшей мере, 6 месяцев, по меньшей мере, 7 месяцев, по меньшей мере, 8 месяцев, по меньшей мере, 9 месяцев, по меньшей мере, 10 месяцев, по меньшей мере, 11 месяцев, по меньшей мере, 12 месяцев, по меньшей мере, 13 месяцев, по меньшей мере, 14 месяцев, по меньшей мере, 15 месяцев, по меньшей мере, 18 месяцев или, по меньшей мере, 24 месяцев. В еще некоторых вариантах осуществления данного изобретения инъекция представленного здесь состава гидрогеля может оказывать лечебное действие на состояние мягкой ткани на протяжении периода длительностью, например, примерно от 6 месяцев и примерно до 12 месяцев, примерно от 6 месяцев и примерно до 15 месяцев, примерно от 6 месяцев и примерно до 18 месяцев, примерно от 6 месяцев и примерно до 21 месяца, примерно от 6 месяцев и примерно до 24 месяцев, примерно от 9 месяцев и примерно до 12 месяцев, примерно от 9 месяцев и примерно до 15 месяцев, примерно от 9 месяцев и примерно до 18 месяцев, примерно от 9 месяцев и примерно до 21 месяца, примерно от 6 месяцев и примерно до 24 месяцев, примерно от 12 месяцев и примерно до 15 месяцев, примерно от 12 месяцев и примерно до 18 месяцев, примерно от 12 месяцев и примерно до 21 месяцев, примерно от 12 месяцев и примерно до 24 месяцев, примерно от 15 месяцев и примерно до 18 месяцев, примерно от 15 месяцев и примерно до 21 месяцев, примерно от 15 месяцев и примерно до 24 месяцев, примерно от 18 месяцев и примерно до 21 месяца, примерно от 18 месяцев и примерно до 24 месяцев либо примерно от 21 месяца и примерно до 24 месяцев.
Варианты данного изобретения частично обеспечивают инъекцию представленного здесь состава гидрогеля. В контексте данной работы термин "инъекция" означает любой механизм доставки, который обеспечивает инъекцию представленного здесь состава гидрогеля индивидууму, которая потенциально приведет к получению клинически, терапевтически или экспериментально благоприятного результата. Фактический механизм доставки, используемый для инъекции состава индивидууму, может быть определен лицом обычной квалификации в предметной области за счет принятия во внимание факторов, включая без ограничения тип состояния кожи, место нарушения состояния кожи, причину нарушения состояния кожи, степень серьезности нарушения состояния кожи, уровень желательного облегчения, продолжительность желательного облегчения, конкретный используемый состав, скорость выделения конкретного используемого состава, фармакодинамику конкретного используемого состава, характер других соединений, включенных в конкретный используемый состав, конкретный путь поступления гидрогеля в организм, конкретные характеристики, предисторию применения и факторы риска для индивидуума, такие как, например, возраст, вес, общее состояние здоровья и тому подобное или любую комбинацию вышеуказанных факторов. В варианте осуществления данного изобретения представленный здесь состав вводится в участок кожи индивидуума с помощью инъекции.
Путь поступления в организм состава гидрогеля индивидуальному пациенту, как правило, должен определяться, основываясь на косметическом и/или клиническом действии, которое желательно для индивидуума и/или врача и части или участка тела, которые подлежат лечению. Представленный здесь состав может быть введен любыми средствами, известными лицам обычной квалификации в предметной области, включая без ограничения шприц с иголкой, инъекционный пистолет (например, инъекционный пистолет гидропневматического сжатия), катетер, применяемый местно или в процессе имплантации, выполняемой посредством прямого хирургического вмешательства. Представленный здесь состав гидрогеля может быть введен в участок кожи, такой как, например, кожный участок или подкожный участок. Например, представленный здесь состав гидрогеля может быть введен, используя иглы в диаметре от примерно 0,26 мм и примерно до 0,4 мм и длиной, изменяющей в диапазоне примерно от 4 мм и примерно до 14 мм. С другой стороны иглы должны быть от 21 до 32 размера и иметь длину примерно от 4 мм и примерно до 70 мм. Предпочтительно, чтобы игла была иглой одноразового пользования. Игла может комбинироваться со шприцом, катетером и/или инъекционным пистолетом.
Кроме того, представленный здесь состав гидрогеля может быть введен один или более чем множество раз. В конечном счете, используемый выбор времени должен следовать стандартам соблюдения качества. Например, представленный здесь состав гидрогеля может быть введен в течение одного или несколько лечебных сеансов, при этом интервал между такими сеансами составляет несколько дней или недель. Например, индивидууму может быть введен представленный здесь состав гидрогеля через 1, 2, 3, 4, 5, 6 или 7 дней либо через каждые 1, 2, 3 или 4 недели. Введение индивидууму представленного здесь состава гидрогеля может выполняться помесячно или через два месяца либо каждые 3, 6, 9 или 12 месяцев.
При проведении процедуры замены мягких тканей бюста путь поступления состава в организм может включать вспомогательный, периареоларный и/или нижегрудной путь поступления. В качестве альтернативы или дополнения состав можно подать по подмышечному, эндоскопическому и расположенному над грудной мышцей пути поступления в организм. При проведении процедуры замены лицевых мягких тканей путь поступления в организм может быть фронтальным, височным, скуловым, периокулярным, мандибулярным, периоральным и подбородочным. В процедурах по лечению недержания мочи путь поступления в организм может быть трансуретральным или околомочеточниковым. В качестве альтернативы или дополнения состав можно подать через антеградном путь поступления. Обсуждаемые здесь пути поступления в организм не исключают применения многочисленных вариантов путей поступления, необходимых для достижения желательного клинического действия.
Варианты данного изобретения частично обеспечивают доступ к участку кожи. В контексте данной работы термин "участок кожи" касается участка кожи, охватывающего место стыка эпидермиса и дермы, включая поверхностный слой дермы (папиллярный участок) и глубокий слой дермы (ретикулярный участок). Кожа состоит из трех первичных слоев: эпидермиса, который обеспечивает гидроизоляцию и служит в качестве барьера против инфекции; дермиса, который служит в качестве места расположения придатков кожи; и гиподермиса (подкожного жирового слоя). Эпидермис не содержит кровеносных сосудов и питается за счет диффузии из дермиса. Основной тип ячеек, которые образуют эпидермис, - это кератиноциты, меланоциты, клетки Лангерганса и осязательные клетки Меркеля.
Дермис - это слой кожи, расположенный ниже эпидермиса, который состоит из соединительной ткани и ослабляет нагрузку и напряжение, воздействующие на тело. Дермис плотно соединен с эпидермисом базальной мембраной. Он также служит укрытием для окончаний механорецепторов/нервов, которые обеспечивают осязание и восприятие тепла. Он содержит волосяные мешочки, потовые железы, сальные железы, апокринные железы, лимфатические и кровеносные сосуды. Кровеносные сосуды дермы обеспечивают питание и устранение выделений из ее собственных клеток, а также из базального слоя эпидермиса. Дермис структурно подразделяется на две области: поверхностную область, расположенную рядом с эпидермисом и называемую папиллярным участком, и глубоко расположенную область, которая больше по толщине и известна как ретикулярный участок.
Папиллярный участок состоит из незакрепленной ареолярной соединительной ткани. Она так названа по имени пальцеподобных проекций, называемых папиллами, которые простираются в направлении эпидермиса. Папиллы обеспечивают дермис "бугристой" поверхностью, которая смыкается с эпидермисом, упрочняя соединение между двумя слоями кожи. Ретикулярный участок лежит глубоко в пределах папиллярного участка и обычно намного толще. Он состоит из плотной неровной соединительной ткани и назван по имени плотной концентрации проходящих через него коллагеновых, эластичных и ретикулярных волокон. Эти протеиновые волокна предают дермису его свойства прочности, растяжимости и эластичности. В пределах ретикулярного участка также располагаются корни волос, сальные железы, потовые железы, рецепторы, ногти и кровеносные сосуды. В дерме удерживаются чернила нанесенных татуировок. Следы растяжек после беременности также располагаются в дерме.
Эпидермис находится под дермисом. Его назначение состоит в прикреплении кожного участка кожи к нижележащей кости и мышце, а также в обеспечении его кровеносными сосудами и нервами. Он состоит из незакрепленной соединительной ткани и эластина. Основными типами клеток являются фибробласты, макрофаги и адипоциты (гиподермис содержит 50% жира тела). Жир служит в качестве прокладки и изоляции для тела.
В варианте осуществления данного изобретения представленный здесь состав гидрогеля вводится в участок кожи индивидуума с помощью инъекции в дермальный участок или в гиподермальный участок. В вариантах осуществления данного изобретения представленный здесь состав гидрогеля вводится в участок кожи индивидуума с помощью инъекции, например, в место соединения эпидермиса и дермы, папиллярную область, ретикулярную область или в место любой комбинации из вышеперечисленных мест.
Другие варианты данного изобретения частично представляют способ лечения болезненного состояния кожи, который состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от болезненного состояния кожи, где введение состава гидрогеля улучшает состояние кожи, тем самым излечивая ее болезненное состояние. В варианте осуществления данного изобретения состояние кожи - это способ лечения обезвоживания кожи, который состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от обезвоживания кожи, где введение состава регидратирует кожу, тем самым излечивая ее обезвоживание. В другом варианте осуществления данного изобретения метод лечения недостатка эластичности кожи состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от недостатка эластичности кожи, где введение состава повышает эластичность кожи, тем самым излечивая недостаток ее эластичности. В еще другом варианте осуществления данного изобретения способ лечения шероховатости кожи состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от шероховатости кожи, где введение состава снижает шероховатость кожи, тем самым излечивая ее шероховатость. И во все еще другом варианте осуществления данного изобретения способ лечения недостатка натянутости кожи состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от недостатка натянутости кожи, где введение состава делает кожу более натянутой, тем самым излечивая недостаток ее натянутости.
В дальнейшем варианте осуществления данного изобретения способ лечения линии или отметки растяжки кожи состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от линии или отметки растяжки кожи, где введение состава уменьшает или устраняет линию или отметку растяжки кожи, тем самым излечивая линию или отметку растяжки кожи. В другом варианте осуществления данного изобретения способ лечения бледности кожи состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от бледности кожи, где введение состава усиливает тонус или сияние кожи, тем самым излечивая бледность кожи. В другом варианте осуществления данного изобретения способ лечения кожных морщин состоит из этапа введения представленного здесь состава гидрогеля индивидууму, страдающему от кожных морщин, где введение состава снижает количество или устраняет кожные морщины, тем самым излечивая кожные морщины. В еще другом варианте осуществления данного изобретения способ лечения кожных морщин состоит из этапа введения представленного здесь состава гидрогеля индивидууму там, где введение состава делает кожу стойкой к появлению кожных морщин, тем самым излечивая кожные морщины.
Сопряженные гели на основе витамина С/гиалуроновой кислоты (11А) в соответствие с определенными осуществлениями изобретения характеризуются явными преимуществами по сравнению с составом, полученным в результате физического смешивания витамина С с гиалуроновой кислотой, с точки зрения кривой высвобождения. Сопряженные НА-гели достаточно устойчивы в простых лабораторных условиях высвобождения (без участия ферментов). Предполагается, что сопряженные гели на основе витамина С характеризуются устойчивым высвобождением с помощью ферментов. В случае сопряженных гелей AA2G, полученных с помощью этерификации, высвобождение активного витамина С инициируется посредством а-глюкозидазы и/или гиалуронидазы. В переводе на сопряженный витаген (Vitagen) или на гели АА2Р, полученные с помощью амидизации, высвобождение активного витамина С инициируется фосфатазой. В случае сопряженных гелей AA2G высвобождение активного витамина С инициируется гидролизом и глюкозидазой.
В некоторых осуществлениях изобретения кожные наполнители обладают устойчивой биологической доступностью. Например, созданы кожные наполнители, которые при введении в кожу пациента (например, внутрикожно или подкожно пациенту для исправления дефектов мягких тканей пор лица) высвобождают аскорбиновую кислоту (или другой витамин) в тело пациента на протяжении, по меньшей мере, примерно 1 месяца и примерно на протяжении периода до 20 месяцев или более.
Например, для прогнозирования действенности устойчивого витамина С с целью ее координирования с продолжительностью действенности наполнителя проводится оценка степени сопряжения. Эта оценка основана на рецептуре сопряжения AA2G с гиалуроновой кислотой посредством этерификации. Рецептура является устойчивой при физиологических условиях, однако начинает высвобождать а-глюкозидазу аскорбиновой кислоты (AsA), которая присоединяется к клеточной мембране. Высвобождение AsA происходит на участке сопряжения наполнителя и клетки в результате того, что а-глюкозидаза присоединяется к клеточной мембране. Дальнейшее высвобождение AsA из HA-AA2G должно сопровождаться распадом гилауроновой кислоты для того, чтобы сделать AA2G доступной фибробластам. Таким образом, высвобождение AsA зависит от степени сопряжения AA2G и продолжительности действия гилауроновой кислоты. Гель со степенью сопряжения примерно 5 молекулярных процентов мог бы высвободить активный витамин С в течение периода, составляющего, по меньшей мере, до 1 месяца, например 3-5 месяцев; гель со степенью сопряжения 10 молекулярных процентов мог бы высвободить активный витамин С в течение периода, составляющего 6-8 месяцев; гель со степенью сопряжения 15 молекулярных процентов мог бы высвободить активный витамин С в течение периода, составляющего до 10 месяцев; а со степенью сопряжения 30 молекулярных процентов - в течение периода до полутора лет.
В осуществлении изобретения обеспечено создание кожного наполнителя, включающего гиалуроновую кислоту, сшитую с эпоксидом Star-PEG, и производную витамина С (например одну из следующих производных - AA2G (2-глюкозид аскорбиновой кислоты), витаген (3-аминопропил-L-аскорбил фосфат) и SAP (фосфат аскорбила натрия), сопряженную с гиалуроновой кислотой при степени сопряжения, которая находится между примерно 5 молекулярными процентами и примерно 40 молекулярными процентами.
Способы создания этого кожного наполнителя включают реакцию между глицидиловым эфиром пентаэритрита (эпоксид Star-PEG) и 2-глюкозидом аскорбиновой кислоты (AA2G) при весовом отношении, температуре реакции и времени реакции, которые подходят для получения состава, содержащего соединение AA2G, блокированное эпоксидами с 4 ответвлениями (эпоксиды с 4 ответвлениями AA2G), непрореагировавшими эпоксидами с 4 ответвлениями и свободной AA2G. Соединение AA2G, блокированное эпоксидами с 4 ответвлениями (эпоксиды с 4 ответвлениями AA2G), сопрягается с гиалуроновой кислотой посредством эпоксидной группы. Непрореагировавшие эпоксиды с 4 ответвлениями служат в качестве сшивателя для поперечного сшивания гиалуроной кислоты и в качестве агента сопряжения для дальнейшего сопряжения AA2G.
В другом варианте осуществления изобретения обеспечивается создание кожного наполнителя, включающего гилауроновую кислоту, сшитую с помощью BDDE и содержащую производную витамина С (например, одну из следующих производных-AA2G (2-глюкозид аскорбиновой кислоты), витаген (3-аминопропил-L-аскорбил фосфат) и SAP (фосфат аскорбила натрия), сопряженную с гиалуроновой кислотой при степени сопряжения, которая находится между примерно 3 молекулярными процентами и 15 молекулярными процентами.
Способы создания этого кожного наполнителя включают реакцию BDDE с 2-глюкозидом аскорбиновой кислоты (AA2G) при весовом отношении, температуре реакции и времени реакции, которые подходят для получения состава, содержащего соединение AA2G, блокированное посредством BDDE (AA2G-BDDE), непрореагировавшего BDDE и свободной AA2G. Блокированное посредством BDDE соединение AA2G (AA2G-BDDE) сопрягается с гиалуроновой кислотой с помощью эпоксидной группы. Непрореагировавшие BDDE служат в качестве сшивателя для поперечного сшивания гиалуроной кислоты и в качестве агента сопряжения для дальнейшего сопряжения AA2G.
На Фигуре 9 представлена Таблица, показывающая действие концентрации а-глюкозидазы на высвобождение AsA из раствора AA2G-PBS. Превращение AA2G в AsA зависит от концентрации α-глюкозидазы. Превращение AA2G в AsA завершается почти через 15 минут, когда концентрация α-глюкозидазы составляет 6,3 единицы на 1 грамм геля. Когда концентрация α-глюкозидазы составляет 4,7 единицы на 1 грамм, полное превращение AA2G в AsA заняло 30 минут. Дальнейшее снижение концентрации а-глюкозидазы привело к медленному превращению AA2G в AsA.
На Фигуре 10 представлено отображение профиля высвобождения свободной AsA из сопряженных кожных наполнителей согласно изобретению (устойчивое высвобождение) (превращение AA2G в молекулярных процентах относительно времени продолжительности реакции). Соединение AA2G, пребывая в смеси AA2G/Juvederm, AA2G полностью превращалась в AsA за 40 минут. Конъъюгаты соединения HA-AA2G показали зависимость превращения AA2G в AsA.
На Фигурах 11А и 11В показаны дополнительные данные по высвобождению для различных кожных наполнителей согласно изобретению. Более конкретно, превращение AA2G из гелей HA-AA2G в AsA зависит от концентрации α-глюкозидазы. Высокая концентрация а-глюкозидазы привела к быстрому превращению AA2G в AsA. При данной концентрации а-глюкозидазы различные рецептуры проявили разные профили превращения AA2G в AsA.
Примеры
Пример 1: Сопряжение AA2G со сшитыми гелями НА с помощью BDDE. используемого в качестве сшивателя
400,6 мг гиалуроновой кислоты с низким молекулярным весом было гидратировано в 1 802 мг 1%-ного по весу NaOH, находящегося в шприце, в течение 30 минут. 800,7 мг соединения AA2G было помещено в пробирку, затем добавлено 713,7 мг BDDE и 1 416,8 мг 10%-ного NaOH. Вышеуказанному раствору (pH>12) была предоставлена возможность вступить в реакцию длительностью 20 минут в водяной бане температурой 50°C перед добавлением гидратированной гиалуроной кислоты. После добавления смесь перемешивалась 20 раз переливанием назад и вперед между 2 шприцами. Пастообразная смесь была помещена в пробирку на 2,5 часа в водяной бане температурой 50°C. 223,5 мг HCl на 12 молей было добавлено к 90,5 г фосфатно-солевого буферного раствора (PBS), pH=7,4. Спустя 2,5 часа был получен гель HA-AA2G. Гель был разрезан на кусочки, после чего к нему был добавлен раствор HCl-PBS. Гель был оставлен на ночь для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками 60 мкм и перемешивался 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 15000 MWCO RC и диализирован в PBS, буферном растворе, pH которого равен 7.4. Диализ длился на протяжении 185 часов и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C.
Пример 2: Определение сопряжений AA2G
Как было описано в примере 1, вес геля был правильно зафиксирован до и после диализа. Было сделано предположение о том, что концентрация геля составила примерно 1 г/мл после диализа. Диализ был приостановлен в тот момент, когда более чем 8 часов спустя в 1 литр е PBS не оказалось существенного количества AA2G. Соединение AA2G было измерено с использованием спектрофотометра, работающего в ультрафиолетовой/видимой области спектра (Nanodrop 2000С производства компании ThermoScientific) на длине волны 260 нм. Калибровочна кривая AA2G была определена с помощью различной концентрации AA2G в 2%-ной гиалуроновой кислоте (А@260 нм = 1,4838 [АА20(ммоль)]).
Вес гиалуроновой кислоты после диализа: начальный вес гиалуроновой кислоты × (реальный вес перед диализом / теоретический вес).
Значение AA2G в ммолях после диализа: после диализа установите поглощение на волну 260 нм в уравнении (A@260nm=1,4838[AA2G (ммоль)]).
Сопряжение @ AA2G: (ммоль для АА20/ммоль гиалуроновой кислоты) ×100%.
Степень сопряжения AA2G в геле составляет 14,7 молекулярных процентов, как описано в Примере 1.
Пример 3: Определение реологических свойств геля
Осциллирующий реометр, оборудованный плоскопараллельным зазором (Anton Paar, Physica MCR 301), был использован для определения свойств геля, полученных в Примере 1. Диаметр использованной пластины составил 25 мм. Зазор между пластинами был установлен в 1 мм. При проведении каждого измерения вначале была проведена перестройка частоты при постоянной деформации до обращения к перестройке деформации при фиксированной частоте. Параметр G' (модуль накопления) был получен с помощью кривой перестройки деформации через 1%. Его значение для геля составляет 1450 Паскалей.
Пример 4: Сопряжение AA2G с поперечно сшитыми гелями на основе гиалуроновой кислоты с использованием BDDE в качестве сшивателя при подстраиваемом сопряжении и регулируемых реологических свойствах геля
Процедура была подобна той, которая описана в Примере 1. Степень сопряжения изменяется посредством подстройки сшивателя на отношение молей гиалуроновой кислоты и AA2G. Свойства геля были измерены так, как описано в Примере 3. Подробности следующие: 400,8 мг гиалуроновой кислоты с низким молекулярным весом гидратировались в 1 752,1 мг 1%-ного NaOH, находящегося в шприце, на протяжении примерно 30 минут.800,3 мг AA2G было помещено в пробирку, после чего туда было влито 354,1 мг BDDE и 1 402,0 мг 10%-ного NaOH. Вышеуказанному раствору (pH>12) была предоставлена возможность примерно на 2 0 минут вступить в реакцию в водяной бане температурой 50°C перед добавлением гидратированной гиалуроновой кислоты. После добавления смесь перемешивалась 20 раз переливанием вперед-назад между 2 шприцами. Пастообразная смесь была помещена в пробирку на 2,5 часа в водяной бане температурой 50°C. 140,9 мг HCl на 12 молей было добавлено к 9,0053 г фосфатно-солевого буферного раствора (PBS), pH=7,4. Спустя 2,5 часа был получен гель HA-AA2G. Гель был разрезан на кусочки, после чего к нему был добавлен раствор HCl-PBS. Гель был оставлен на ночь для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками примерно 60 мкм и перемешивался 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 15000 MWCO RC и диализирован в PBS, буферном растворе, pH=7.4. Диализ длился на протяжении 164,5 часов и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C. Степень сопряжения составляет 13%. Модуль накопления геля (G') равняется 803 паскалям.
Пример 5: Сопряжение AA2G с поперечно сшитыми гелями на основе гиалуроновой кислоты с использованием BDDE в качестве сшивателя, при этом степень сопряжения составляет 5,3%, а G' - 300 паскалей
400,3 мг гиалуроновой кислоты с низким молекулярным весом гидратировались в 3 002,0 мг 1%-ного NaOH в шприце на протяжении примерно 30 минут. 800,5 мг AA2G было помещено в пробирку, после чего туда было влито 264,3 мг BDDE и 1 100,0 мг 10%-ного NaOH. Вышеуказанному раствору (pH>12) была предоставлена возможность примерно на 20 минут вступить в реакцию в водяной бане температурой 50°C перед добавлением гидратированной гиалуроновой кислоты. После добавления смесь перемешивалась 20 раз переливанием вперед-назад между 2 шприцами. Пастообразная смесь была помещена в пробирку на 2,5 часа в водяной бане температурой 50°C. 104,2 мг HCl на 12 молей было добавлено к 8,5128 г фосфатно-солевого буферного раствора (PBS), pH=7,4. Спустя 2,5 часа был получен гель HA-AA2G, и к нему был добавлен раствор HC1-PBS. Гель был оставлен на вечер пятницы, субботу и воскресенье (примерно на 55 часов) для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками примерно 60 мкм и перемешивался примерно 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 15000 MWCO RC и диализирован в PBS, буферном растворе с pH=7.4. Диализ длился примерно 114 часа и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C. Степень сопряжения и реологические свойства геля измеряются при выполнении процедуры так, как описано в Примере 2 и 3. Степень сопряжения составляет 5,3%. Модуль накопления геля (G') равняется 300 паскалям.
Пример 6: Сопряжение AA2G с поперечно сшитыми гелями на основе гиалуроновой кислоты с использованием эпоксида STAR-PEG в качестве сшивателя, при этом степень сопряжения составляет 29,4%, а G' - 235 паскалей
200,4 мг гиалуроновой кислоты с низким молекулярным весом гидратировались в 2000 мг 1%-ного NaOH в шприце на протяжении примерно 30 минут.400 мг AA2G было помещено в пробирку, после чего туда было влито 312,7 мг эпоксида star-PEG и 1 026,5 мг 10%-ного NaOH. Вышеуказанному раствору была предоставлена возможность примерно на 20 минут вступить в реакцию в водяной бане температурой 50°C перед добавлением гидратированной гиалуроновой кислоты. После добавления смесь перемешивалась примерно 20 раз переливанием вперед-назад между 2 шприцами. Пастообразная смесь была помещена в пробирку на 2,5 часа в водяной бане температурой 50°C. 187,4 мг HCl на 12 молей было добавлено к 3,034 г фосфатно-солевого буферного раствора (PBS), pH=7,4. Спустя 2,5 часа был получен гель HA-AA2G, и к нему был добавлен раствор HCl-PBS. Гель был оставлен на вечер пятницы, субботу и воскресенье (примерно на 68 часов) для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками примерно 60 мкм и перемешивался примерно 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 15000 MWCO RC и диализирован в PBS, буферном растворе с pH=7.4. Диализ длился примерно 95 часов и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C. Степень сопряжения и реологические свойства геля измеряются при выполнении процедуры так, как описано в Примере 2 и 3. Степень сопряжения составляет 29,4%. Модуль накопления геля равняется примерно 235 паскалям.
Пример 7: Сопряжение AA2G с поперечно сшитыми гелями на основе гиалуроновой кислоты с использованием эпоксида STAR-PEG в качестве сшивателя, при этом степень сопряжения составляет 27,8%. а С - 363 паскаля
200,3 мг гиалуроновой кислоты с низким молекулярным весом гидратировались в 2000 мг 1%-ного NaOH в шприце на протяжении примерно 30 минут.400,2 мг AA2G было помещено в пробирку, после чего туда было влито 313,4 мг эпоксида star-PEG и 1022,6 мг 10%-ного NaOH. Вышеуказанный раствор был добавлен к гидратированной гиалуроновой кислоте. После добавления смесь перемешивалась примерно 20 раз переливанием вперед-назад между 2 шприцами. Пастообразная смесь была помещена в пробирку на 2,5 часа в водяной бане температурой 50°C. 196,5 мг HCl на 12 молей было добавлено к 3,016 г фосфатно-солевого буферного раствора (PBS), pH=7,4. Спустя 2,5 часа был получен гель HA-AA2G, и к нему был добавлен раствор HCl-PBS. Гель был оставлен на ночь (примерно на 24 часа) для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками примерно 60 мкм и перемешивался примерно 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 15000 MWCO RC и диализирован в PBS, буферном растворе с pH=7.4. Диализ длился примерно 98,5 часов и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C. Степень сопряжения и реологические свойства геля измеряются при выполнении процедуры так, как описано в Примере 2 и 3. Степень сопряжения составляет 27,8%. Модуль накопления геля равняется примерно 363 паскалям.
Пример 8: Сопряжение AA2G с поперечно сшитыми гелями на основе гиалуроновой кислоты с высоким молекулярным весом с использованием BDDE в качестве сшивателя, при этом степень сопряжения составляет 9,8 молекулярных %. a G' - 238 паскалей 400,3 мг гиалуроновой кислоты с высоким молекулярным весом гидратировались в 2 501,3 мг 4%-ного NaOH в шприце на протяжении примерно 30 минут.1 200 мг AA2G было помещено в пробирку, после чего туда было влито 304,7 мг BDDE и 1 178,6 мг 16%-ного NaOH. Вышеуказанному раствору (pH>12) была дана возможность вступить в реакцию в водяной бане температурой 50°C примерно на 20 минут с последующим переносом в шприц объемом 20 см3 до добавления к гидратированной гиалуроновой кислоте. После добавления смесь перемешивалась примерно 20 раз переливанием вперед-назад между 2 шприцами. Пастообразная смесь была помещена в пробирку объемом 20 см3 примерно на 2,5 часа в водяной бане температурой 50°C. После-2.5 часов был образован гель XA-AA2G. Далее 226,6 мг HCl на 12 молей было добавлено к 8492.2 мг 10Х PBS, pH=7,4, для получения раствора HCl-PBS, после чего раствор HCl-PBS был добавлен для нейтрализации и разбухания геля. Гель был оставлен более чем на 48 часов для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками примерно 60 мкм и перемешивался примерно 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 20000 MWCO СЕ и диализирован в PBS, буферном растворе с pH=7.4. Диализ длился примерно 114 часов и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C. Степень сопряжения и реологические свойства геля измеряются при выполнении процедуры так, как описано в Примере 2 и 3. Степень сопряжения составляет 5,3%. Модуль накопления геля равняется примерно 300 паскалям.
Пример 9: Сопряжение витагена с поперечно сшитыми гелями на основе гиалуроновой кислоты с низким молекулярным весом с помощью BDDE в качестве сшивателя, при этом степень сопряжения составляет 15 молекулярных %, a G' - 365 паскалей 398,2 мг гиалуроновой кислоты с низким молекулярным весом гидратировались в 1 753,24 мг 1%-ного NaOH в шприце на протяжении примерно 40 минут. Соединение BDDE (311,7 мг) было добавлено к раздутой гиалуроновой кислоте, после чего ее разбуханию позволили длиться еще 80 минут. Разбухшая смесь гиалуроновой кислоты/BDDE предварительно вступила в реакцию на 20 минут при температуре 50°C.
801,9 мг витагена было отдельно растворено в 1 459,7 мг 10%-ного NaOH и смешано с гиалуроновой кислотой, которая предварительно вступила в реакцию с BDDE. Реакция смеси продолжалась еще 2,5 часа при температуре 50°C. Примерно через 2,5 часа был получен гель на основе гиалуроновой кислоты/витагена. После этого 195 мг HCl на 12 молей было добавлено к 9 004,0 мг 10Х PBS, pH=7,4, для получения раствора HCl-PBS, после чего раствор HCl-PBS был добавлен для нейтрализации и разбухания геля. Гель был оставлен более чем на 48 часов для нейтрализации и разбухания в орбитальном шейкере. Гель был пропущен через сито с ячейками примерно 60 мкм и перемешивался примерно 20 раз посредством переливания назад-вперед между 2 шприцами. Гель был помещен в диализный мешок 20000 MWCO СЕ и диализирован в PBS, буферном растворе с pH=7.4. Диализ длился примерно 120 часов и сопровождался частой сменой буферного раствора PBS. После диализа гель был помещен в шприц и хранился в холодильнике при температуре 4°C. Реологические свойства геля измерялись при выполнении процедуры так, как описано в Примере 3. Степень сопряжения вычислена и составила 15%. Модуль накопления геля равняется примерно 365 паскалям.
Пример 10: Сопряжение витагена с линейной гиалуроновой кислотой с помощью амидизации
200.3 мг гиалуроновой кислоты с высоким молекулярным весом гидратировались в 10 мл воды в шприце емкостью 60 см3. 500 мг витагена было растворено в 0,5 мл воды, после чего раствор был нейтрализирован до pH=4,8. 197,7 мг дихлорэтана (EDC) и 149 мг NHS были раздельно растворены в 6 мл воды. Вышеуказанные растворы (растворы и растворы EDC/NHS) были добавлены в другой шприц емкостью 60 см3, содержащий 23,5 мл воды. Содержимое двух шприцов было перемешано 20 раз переливанием вперед-назад между двумя шприцами. Смеси хранились в одном шприце и в течение 4 часов размачивались в водяной бане при температуре 37°C. В конечном счете, растворы были диализировались в буферном растворе PBS (pH=7,4) до тех пор, пока присутствие витагена перестало быть ощутимым. Степень сопряжения была определена аналогичным способом так, как описано в Примере 3. Степень сопряжения составляет примерно 10 молекулярных процентов.
Пример 11: Сопряжения АА2Р с поперечно сшитыми гелями на основе гиалуроновой кислоты
200.4 мг гиалуроновой кислоты с низким молекулярным весом гидратируется в 1000 мг буферного раствора MES 5,2, находящегося в шприце на протяжении примерно 30 минут.292 мг АА2Р помещены в колбу, куда затем было добавлено, 300 мг амина star-PEG. Вышеуказанному раствору дана возможность участвовать в химической реакции при комнатной температуре в течение ночи. Гель гидратирован с помощью буферного раствора и диализирован с участием буферного раствора PBS для удаления непрореагировавшего АА2Р. В конечном итоге были определены характеристики геля так, как описано в Примерах 2 и 3 для определения степени сопряжения и реологических свойств геля. Степень сопряжения составляет примерно 20 молекулярных процентов. Модуль накопления (G') составляет примерно 500 паскалей.
Пример 12: Рецептура получения кожного наполнителя на основе HA/BDDE с использованием AA2G
К любому из гелей, описанных в вышеуказанных примерах после диализа можно добавить надлежащее количество геля свободной гиалуроновой кислоты для улучшения модифицированного сцепления геля и/или легкости впрыскивания. Например, волокна свободной гиалуроновой кислоты разбухают в буферном растворе фосфата для получения однородного вязкоупругого геля (гель «свободной» гиалуроновой кислоты). До этапа проведения диализа этот несшитый гель добавляется к сшитому гелю на основе HA/BDDE, полученному в Примере 1 (например, для получения состава примерно от 1% и примерно до 5% свободной гиалуроновой кислоты в весовом отношении). Затем полученным таким путем гелем заполняются готовые к наполнению стерильные шприцы, которые затем стерилизуются в автоклаве при значениях температуры и давления, достаточных для стерилизации в течение, по меньшей мере, примерно 1 минуты. После обработки в автоклаве конечный продукт HA-AA2G пакуется и распределяется между врачами для использования в качестве кожного наполнителя.
Пример 13: Рецептура кожного наполнителя HA-AA2G, включая лидокаин
Выполняется процедура из Примера 12, однако после этапа диализа и перед добавлением геля свободной гиалуроновой кислоты в смесь вводится лидокаин хлоргидрат (лидокаин соляной кислоты). (Лидокаин соляной кислоты) в виде порошка в первую очередь может быть сделан растворимым в инъекционной воде и отфильтрован через фильтр с размером ячеек 0,2 мкм. Разведенный раствор NaOH добавляется к связывающему гелю HA-AA2G для получения слегка базового pH (например, pH, значение которого составляет примерно 7,5-8). Затем к слегка базовому гелю добавляется раствор лидокаина соляной кислоты с тем, чтобы достичь окончательной желательной концентрации, например, концентрации в примерно 0,3% (весовое отношение). Полученный в результате pH смеси HA-AA2G и лидокаина тогда составляет примерно 7, а концентрация гиалуроновой кислоты - примерно 24 мг/мл. Механическое перемешивание выполняется для получения соответствующей гомогенности в стандартном химическом реакторе, оборудованном соответствующим смесительным механизмом.
Пример 14: Сопряжение добавок, содержащих карбоксильную функциональную группу, с гидрогелями на основе гиалуроновой кислоты
Такие добавки как ретиноевая кислота (АКА, третиноин), адапален и альфа-липоевая кислота содержат карбоксильную функциональную группу (-СООН). Эти добавки сопрягаются с гидрогелями гиалуроновой кислоты путем этерификации с использованием химического состава EDC. Пример сопряжений в соответствии с осуществлением изобретения описан следующим образом:
200 мг гиалуроновой кислоты с высоким молекулярным весом гидратируется в 10 мл буферного раствора морфолиноэтансульфоновой кислоты (pH=4,8) в шприце емкостью 60 см3. В другом шприце 200 мг ретиноевой кислоты растворяется в 5 мл смеси воды и ацетона (отношение объемов воды и ацетона - 1:3). Содержимое двух вышеуказанных шприцев перемешивается через соединитель шприцев примерно 20 раз. Затем 197,7 мг EDC и 149 мг NHS растворяются отдельно в 6 мл воды в отдельном шприце. Шприц, содержащий EDC и NHS, подсоединяется к шприцу, содержащему гиалуроновую и ретиноевую кислоты для того, чтобы позволить реагирующим веществам смешиваться, по меньшей мере, 20 раз путем их переливания вперед-назад между 2 шприцами. Смеси хранятся в одном шприце и вымачиваются в водяной бане при температуре 37°C на протяжении 4 часов. Гели диализируются изопропанолом для устранения несопряженной ретиноевой кислоты и затем диализируются буферным раствором PBS в стерильных условиях. Гели пакуются в стерилизованные шприцы и хранятся при температуре 4°C.
Пример 15: Сопряжения добавок, содержащих гидроксильную функциональную группу, с гидрогелями на основе гиалуроновой кислоты
Такие добавки как ретиноевая кислота (AKA, третиноин), каталаза, диметиламинэтанол и g-токоферол содержат карбоксильную функциональную группу (-ОН). Эти добавки сопрягаются с гидрогелями гиалуроновой кислоты путем эстерификации с использованием химического состава EDC. Типовой пример сопряжений описан следующим образом:
200 мг гиалуроновой кислоты с высоким молекулярным весом гидратируется в 10 мл буферного раствора 2-(N)-морфолино)-этансульфоновой кислоты (pH=4,8) в шприце емкостью 60 см3. В другом шприце 200 мг ретиноевой кислоты растворяется в 5 мл смеси воды и ацетона (отношение объемов воды и ацетона - 1:3). Содержимое двух вышеуказанных шприцев перемешивается через соединитель шприцев примерно 20 раз. Затем 197,7 мг EDC и 149 мг NHS растворяются отдельно в 6 мл воды в отдельном шприце. Шприц, содержащий EDC и NHS, подсоединяется к шприцу, содержащему гиалуроновую и ретиноевую кислоту для того, чтобы позволить реагирующим веществам смешиваться, по меньшей мере, 20 раз путем их переливания вперед-назад между 2 шприцами. Смеси хранятся в одном шприце и вымачиваются в водяной бане при температуре 37°C на протяжении 4 часов. Гели диализируются изопропанолом для устранения несопряженной ретиноевой кислоты и затем диализируются буферным раствором PBS в стерильных условиях. Гели пакуются в стерилизованные шприцы и хранятся при температуре 4°C.
Пример 16: Сопряжения добавок, содержащих гидроксильную функциональную группу, с гидрогелями на основе гиалуроновой кислоты путем последующих модификаций
Это 2-этапный процесс. Этап 1: гидрогели на основе гиалуроновой кислоты, например, Juvederm или рестилан обрабатываются с использованием EDC/NHS для активации карбоксильной группы гиалуроновой кислоты. Этап 2: активированные гидрогели гиалуроновой кислоты обрабатываются с помощью добавок, содержащих гидроксильные группы. Добавками, содержащими гидроксильные группы, являются ретинол, каталаза, диметиламинэтанол и гидроксильная функциональная группа (-ОН) g-токоферола. Типичные примеры сопряжения добавок с поперечно сшитыми гелями на основе гиалуроновой кислоты имеют следующий вид:
2 мг геля Juvederm смешивается с 200 мг EDC и 150 мг NHS при комнатной температуре. Затем 200 мг ретинола добавляется к 3 мл смеси воды и ацетона. Вышеуказанная смесь вступает в 4-часовую реакцию при температуре 37°C. Гели диализируются изопропанолом для удаления несопряженного ретинола и затем диализируются буферным раствором PBS в стерильных условиях. Гели пакуются в стерилизованные шприцы и хранятся при температуре 4°C.
Пример 17: Сопряжение факторов роста, пептидов или эластина с гидрогелями на основе гиалуроновой кислоты
Такие добавки как фактор роста эпидермиса (EGF), трансформирующий фактор роста (TGF) и пептиды содержат функциональные аминовые группы, которые могут сопрягаться с гиалуроновой кислотой для создания полезных кожных наполнителей. Эти добавки сопрягаются с гиалуроновой кислотой путем химической реакции амидизации. Типичный пример сопряжения описан следующим образом:
200.3 мг гиалуроновой кислоты с высоким молекулярным весом гидратируется в 10 мл буферного водного раствора морфолиноэтансульфоновой кислоты (MES) (pH=5,4). 20 мг EGF добавляется в 100 мг раствора MES. К вышеуказанной смеси добавляется 197,7 мг EDC и 149 мг. Полученной в результате реакционной смеси дается возможность вступить в реакции на 4 часа при температуре 37°С.После завершения реакции гель далее диализируется изопропанолом и затем буферным раствором PBS в стерильных условиях. Гели пакуются в стерилизованные шприцы и хранятся при температуре 4°C.
И в завершение следует понять, что хотя варианты настоящего изобретения описаны, ссылаясь на разные осуществления изобретения, специалист из предметной области легко поймет, что представленные здесь конкретные примеры носят только иллюстративный характер в отношении принципов представленного здесь предмета изобретения. Следовательно, необходимо понять, что представленная здесь тема никоим образом не ограничена конкретной методологией, протоколом и/или реагентом и т.д., описанными в данной работе. Как таковые специалисты в предметной области могли бы осуществить многочисленные и разные модификации или изменения либо реализовать альтернативные конфигурации представленного здесь предмета и могут это сделать в соответствие с представленными здесь теориями без отклонения от сущности и объема данного изобретения. Изменения в деталях могут быть сделаны без отклонения от сущности и объема настоящего изобретения, которые определены в прилагаемой патентной формуле. И, наконец, использованная здесь терминология предназначена для описания только конкретных осуществлений изобретения и не ставит перед собой цель ограничить объем настоящего изобретения, который определяется патентной формулой. Кроме того, подразумевается, что весь материал, содержащийся в вышеприведенном описании или показанный в сопроводительных чертежах, должен интерпретироваться только как иллюстративный материал неограничивающего характера. Соответственно настоящее изобретение не ограничено в точности тем, что показано и описано.
Определенные осуществления данного изобретения описаны в этой работе, включая и наилучший режим для реализации изобретения, известный изобретателям. Конечно, изменения в отношении этих описанных осуществлений изобретения станут очевидными для специалистов стандартной квалификации в предметной области после прочтения вышеизложенного описания. Изобретатель ожидает от квалифицированных специалистов внесения надлежащих изменений, и изобретатели хотят, чтобы их изобретение на практике использовалось по-иному, чем конкретно описано в данной работе. Соответственно это изобретение включает все модификации и эквиваленты предмета, заявленного в прилагаемой к этому патентной формуле так, как позволено применяемой правовой нормой. Помимо этого любая комбинация вышеописанных элементов во всех возможных вариациях охвачена изобретением, если иное не указано в данной работе или иное ясно не противоречит контексту.
Группы представленных здесь альтернативных элементов или осуществлений изобретения не следует интерпретировать как ограничения. Каждый член группы может быть упомянут или заявлен отдельно либо в любой комбинации с другими членами группы или с другими обнаруженными здесь элементами. Ожидается, что один или несколько членов группы могут быть включены или исключены из группы по причинам удобства и/или патентноспособности. Когда происходит такое включение или исключение, считается, что изобретение содержит группу, которая модифицирована таким образом за счет соблюдения письменного описания всех групп Маркуша, использованных в прилагаемой патентной формуле.
Если не указано иное, все цифры, выражающие количества ингредиентов, такие свойства, как молекулярный вес, условия химической реакции и так далее, использованные в изобретении и в патентной формуле, должны восприниматься как видоизмененные во всех примерах в результате использования термина "примерно." В контексте данной работы термин "примерно" означает, что элемент, параметр или срок, определенный таким образом, охватывает диапазон плюс или минус десять процентов выше и ниже значения изложенного элемента, параметра или срока. Соответственно, если не указано противоположное, числовые параметры, изложенные в изобретении и в прилагаемой патентной формуле, являются приблизительными соответствиями, которые могут изменяться в зависимости от желательных свойств, для поиска получения которых предназначено настоящее изобретение. По самой меньшей мере и не в качестве попытки ограничить применение теории эквивалентов к объему патентной формулы, каждый числовой параметр, по меньшей мере, следует интерпретировать в свете количества отчетных значащих цифр, применяя обычные способы округления. Несмотря на то, что числовые диапазоны и параметры, которые излагают широкий спектр изобретения, являются приблизительными соответствиями, численные значения, изложенные в конкретных примерах, по сообщениям, насколько это возможно, точны. Однако любое численное значение по своей сущности содержит определенные ошибки, обязательно происходящие в результате среднеквадратичного отклонения, найденного в соответствующих им проверочных измерениях.
Термины и аналогичные ссылки в единственном числе, использованные в контексте описания изобретения (особенно в контексте следующей патентной формулы), должны интерпретироваться как те, что охватывают как единственное, так и множественное число, если в данной работе не указано иное или есть явное противоречие с контекстом. Изложение представленных здесь диапазонов значений предназначено только в случае использования способа стенографии при индивидуальной ссылке на каждое отдельное значение в пределах диапазона. Если в этой работе не указано иное, каждое отдельное значение включается в изобретение так, как будто оно индивидуально излагалось в данной работе. Представленные здесь способы можно реализовать в любом удобном порядке, если в этой работе не указано иное, или в других отношениях есть явное противоречие с контекстом. Применение любого или всех примеров либо показательного языка (например, "такой как"), использованного в данной работе, предназначено только для лучшей иллюстративности изобретения и не предлагает ограничить объем изобретения, сформулированного иным образом.. Никакой язык, использованный в изобретении, не должен интерпретироваться как указание на существование любого незаявленного элемента, неотъемлемого для практического применения изобретения.
Представленные здесь конкретные осуществления изобретения могут далее ограничиваться в патентной формуле путем использования выражений «состоящий из» или «состоящий, по существу, из» в языке изложения. При использовании в патентной формуле поправки в качестве записи или добавления переходной термин «состоящий из» исключает любой элемент, этап, или ингредиент, не указанный в патентной формуле. Переходной термин «состоящий, по существу, из» ограничивает объем заявки заданными материалами или этапами и всем тем, что не оказывает отрицательного материального воздействия на основную и новую характеристику (характеристики). Таким образом, осуществления заявленного изобретения описаны и сделаны возможными по сути или в прямой форме.
Все патенты, публикации патентов и другие публикации, упомянутые и идентифицированные в данного изобретения, индивидуально и специально включены в данную работу во всей своей полноте путем ссылки с целью описания и представления, например, составов и методологий, описанных в таких публикациях, которые можно было бы использовать в связи с настоящим изобретением. Эти публикации предоставляются исключительно для их изложения до даты регистрации настоящей заявки. Ничего в этом отношении не следует истолковывать как допущение того, что изобретатели не имеют права предшествовать такому представлению в силу предшествующего изобретения или по любой другой причине. Все заявления касательно даты и представления содержания этих документов основаны на информации, доступной заявителям, и не создают какое-либо допущение касательно правильности дат или содержания этих документов.
Реферат
Изобретение относится к области косметологии, а именно к впрыскиваемому кожному наполнителю, состоящему из гиалуроновой кислоты, ковалентно конъюгированной с производной витамина С, выбираемой из аскорбил 3-аминопропил фосфата (витагена), 2-глюкозида L-аскорбиновой кислоты (AA2G) или аскорбил фосфата натрия (АА2Р), при этом степень конъюгирования составляет примерно 3-40 молекулярных процентов. В частном случае гиалуроновая кислота может быть дополнительно поперечно сшита глицидиловым эфиром пентаэритрита (эпоксидом Star-PEG), 3-аминопропиловым эфиром пентаэритрита (амином Star-PEG) или 1,4-бутандиол диглицидиловым эфиром (BDDE). Изобретение также относится к способу изготовления кожного наполнителя и к лечению состояния кожи, выбираемого из обезвоживания кожи, недостатка эластичности или натянутости кожи, шероховатости кожи, бледности кожи, линии или отметки растяжки кожи и кожных морщин, путем введения такого кожного наполнителя. Группа изобретений обеспечивает создание улучшенных составов кожного наполнителя с устойчивой скоростью высвобождения витамина С. 3 н. и 6 з.п. ф-лы, 11 ил., 2 табл., 17 пр.

Комментарии