Способ лечения с введением лекарственных препаратов и генов посредством электропорации - RU2168337C2
Код документа: RU2168337C2
Чертежи







Описание
Настоящее изобретение относится к лечению заболеваний людей и других млекопитающих, в частности, к улучшенному способу и устройству по применению регулируемых электрических полей для введения in vivo генов и фармацевтических соединений в живые клетки пациента путем электропорации.
В 1970-х годах было открыто, что электрические поля можно применять для создания пор в клетках, не вызывая у последних перманентных повреждений. Это открытие позволило осуществлять внедрение больших молекул в цитоплазму клетки. Известно, что гены и другие молекулы, такие как фармацевтические соединения, могут быть введены в живые клетки способом, известным как электропорация. Гены или другие молекулы перемешивают с живыми клетками в буферной среде и короткими импульсами прикладывают сильные электрические поля. Клеточные мембраны временно становятся пористыми, так что гены или молекулы проникают в клетки. Там они могут изменять геном клетки.
Электропорация недавно была предложена в качестве одного подхода для лечения определенных заболеваний, таких как рак. Например, при лечении определенных типов рака методом химиотерапии необходимо, применяя довольно высокие дозы препарата, чтобы убить раковые клетки, не убивать при этом неприемлемо большое количество нормальных клеток. Этой цели можно достигнуть, если химиотерапевтический препарат может быть введен непосредственно внутрь раковых клеток. Некоторые из самых лучших противоопухолевых препаратов, например, блеомицин, в нормальных условиях не могут проникать через мембраны определенных раковых клеток. Однако электропорация позволяет вводить блеомицин в такие клетки.
Лечение рака - одно из терапевтических применений электропорации. Результаты проведенных экспериментов на лабораторных млекопитающих приведены в работах: Okino, М., E. Kensuke, 1990. The Effects of a Single High Voltage Electrical Stimulation with an Anticancer Drug on in vivo Growing Malignant Tumors. Jap. Journal of Surgery. 20: 197-204. Mir, LM., Orlowski, J. Belehradek Jr., and C. Paotetti. 1991. Electrochemotherapy Potentiation of Antitumor Effect of Bleomycin by Local Electric Pulses. Eur. J.Cancer. 27: 68-72. Клинические исследования были проведены и изложены в работе: Mir, L.M., М. Belehradek, С. Domenge, S. Orlowski, В. Poddevin, et al. 1991. Electrochemotherapy, a Novel Antitumor Treatment: First Clinical Trial. C.R. Acad. Sci. Paris. 313: 613-618.
Такое лечение выполняют путем инфузии противоопухолевого вещества непосредственно в опухоль и наложения электрического поля на опухоль, расположенную между двух электродов. Сила поля должна быть тщательно откорректирована, таким образом, чтобы электропорация клеток опухоли проходила при минимальном повреждении или вообще без повреждения нормальных или здоровых клеток. В нормальных условиях это можно осуществить на наружных опухолях, накладывая электроды на противоположные стороны опухоли так, что между электродами создается электрическое поле. Расстояние между электродами можно измерить, а напряжение, подаваемое затем на электроды, должно быть рассчитано по формуле E=V/d (E=сила электрического поля, В/см: V=напряжение, B; d=расстояние, см). Установка электродов для лечения внутренних опухолей, а также измерение расстояния между электродами - задача трудная. В патенте US 5439440 описан аппарат для in vivo электропорации, где электродные иглы введены в тело. В патенте US 5273525 описан шприц для введения молекул и макромолекул путем электропорации, у которого иглы для инъекции выполняют еще и функцию электродов. Это позволяет размещать электроды непосредственно под поверхностью внутри или рядом с опухолями так, что электрические поля можно генерировать в ткани, предполагаемой для электропорации опухолевых клеток.
В документе WO-A 94/22526 описано устройство, включающее совокупность игольчатых электродов для введения в ткань, предназначенную для лечения и устанавливающую объем лечения. Иглы образуют пары, и переключатель последовательно направляет импульс от генератора в различные пары игл.
Исследования также показали, что путем электропорации в клетки млекопитающих можно вводить нуклеотидные последовательности большого размера (до 630 т. н. п.) (Eanault, et al., Gene (Amsterdam), 144(2):205. 1994; Nucleic Acids Research, 15(3): 1311. 1987; Knutson, et al, Anal. Biochem., 164:44. 1987; Gibson, et al., EMBO J., 6(8):2457, 1987; Dower, et al., Genetic Engineering, 12: 275, 1990; Mozo, et al., Plant Molecular Biology, 16:917, 1991), таким образом, например, обеспечивая эффективный способ генной терапии.
Соответственно, задачей данного изобретения является создание улучшенного устройства, которое можно удобно и эффективно располагать для генерации заранее заданных электрических полей в заранее отобранной ткани.
Задачей данного изобретения также является создание улучшенного устройства, в котором имеются эффективные и удобные средства для расстановки электродов в ткани для введения терапевтических соединений в ткань и приложения к ткани электрических полей.
В соответствии с основным аспектом данного изобретения электродный аппарат для применения электропорации на участке тела больного представляет собой поддерживающий элемент, совокупность рядов противопоставленных пар игольчатых электродов, расположенных с возможностью регулирования на поддерживающем элементе и предназначенных для введения в ткань на выбранных участках и расстояниях друг от друга, а также средства, включающие генератор сигнала и переключатель, для приложения электрического сигнала на выбранные пары электродов для создания электрического поля заданной силы.
Другой аспект данного изобретения включает иглы, предназначенные для инъекции лечебных препаратов в ткань, а также в качестве электродов для генерирования электрических полей на участках клеток ткани.
Еще в одном аспекте изобретения предусмотрен терапевтический способ с применением аппарата с рядом игл для лечения клеток, особенно опухолевых.
Цель, преимущества и особенности данного изобретения можно будет легче понять из следующего
подробного описания в сочетании с чертежами, на которых:
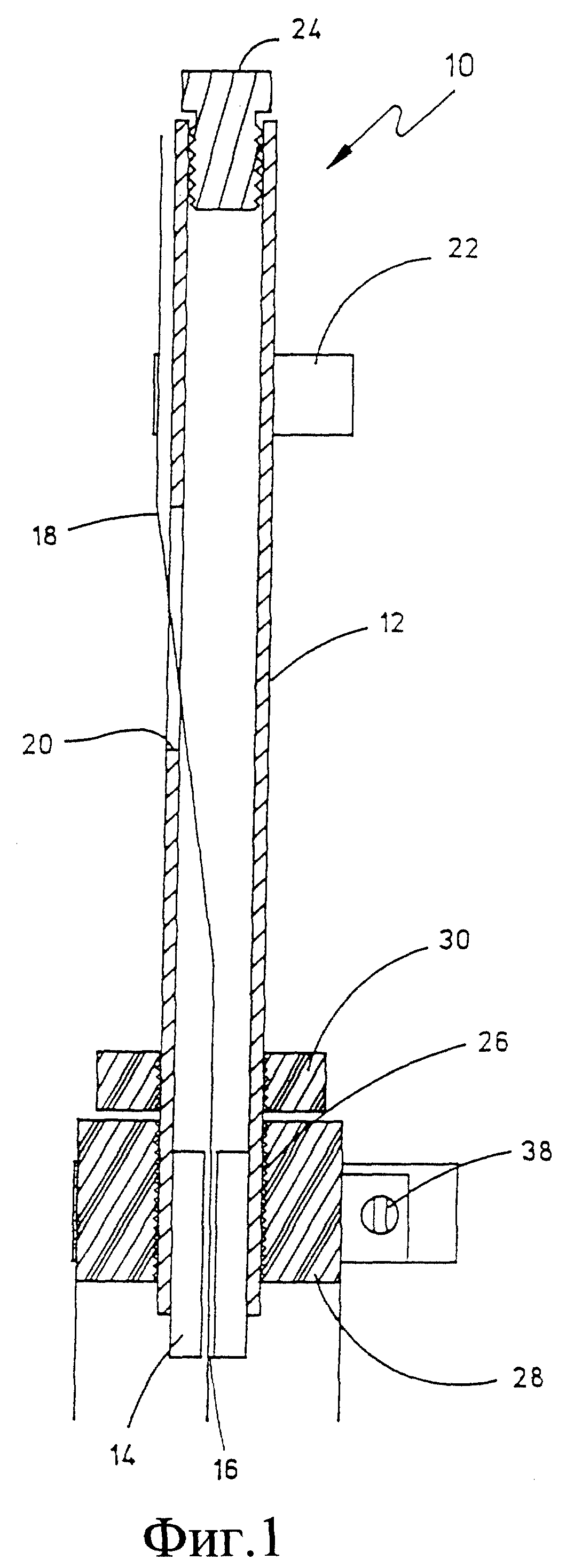
Фиг. 1 - вид сбоку в вертикальном разрезе узла иглы в соответствии с предпочтительным вариантом выполнения изобретения.
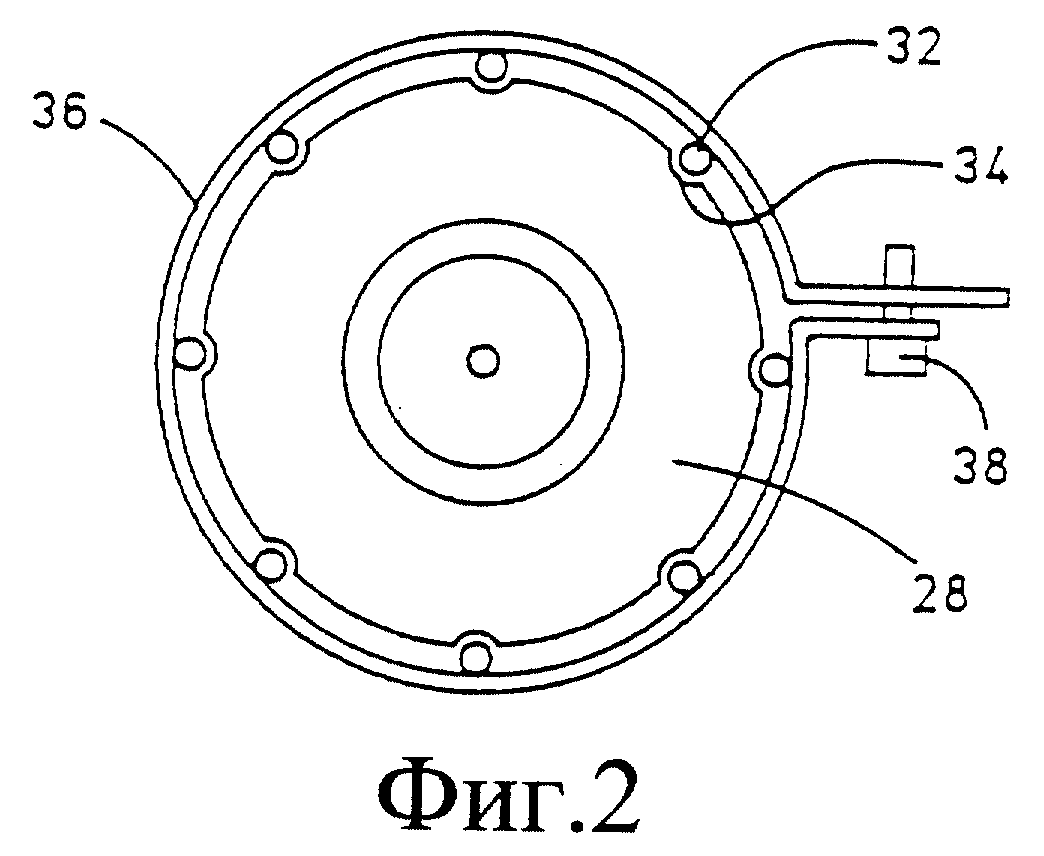
Фиг. 2 - вид снизу варианта выполнения изобретения фиг. 1.
Фиг. 3 - чертеж устройства, где в перспективе показан другой вариант выполнения изобретения.
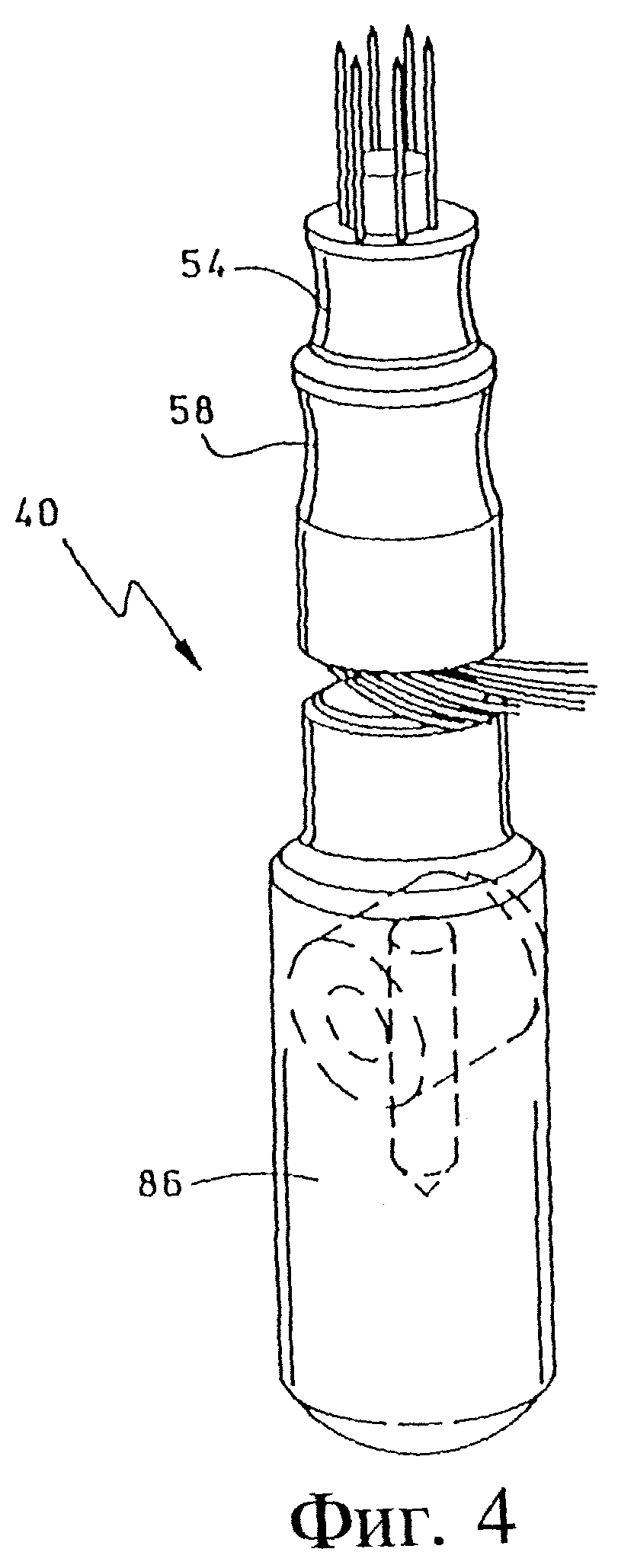
Фиг. 4 - вид в перспективе варианта выполнения изобретения, показанного на фиг. 3, в собранном виде.
Фиг. 5 - вид в перспективе селекторного переключателя для электродного узла, показанного на фиг. 4.
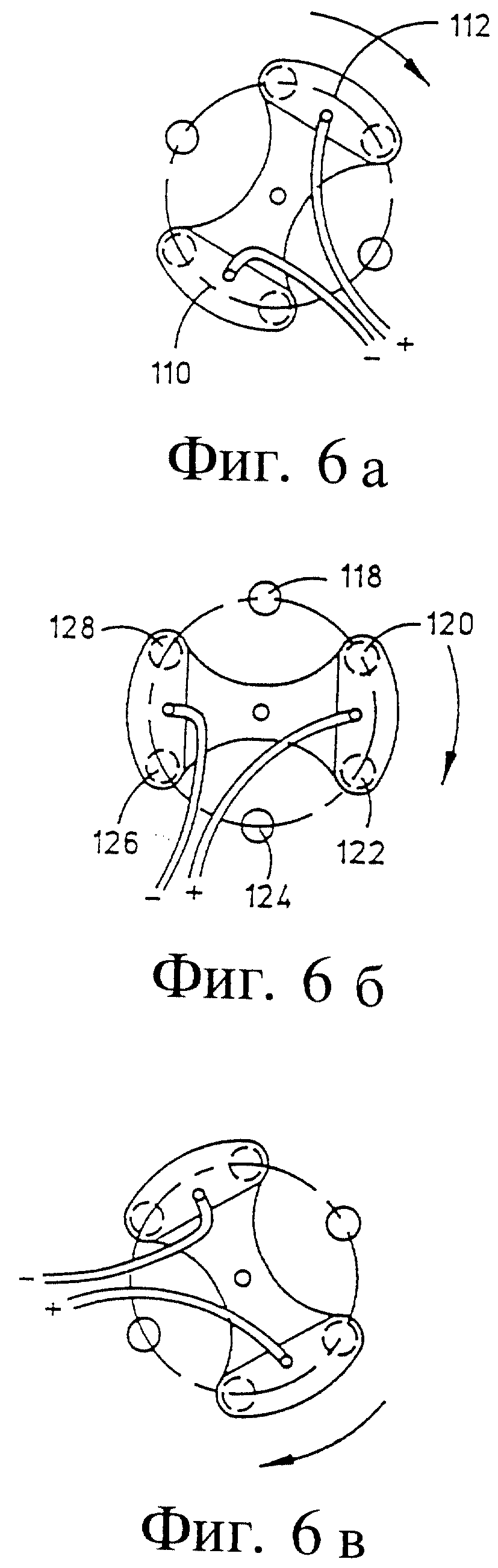
Фиг. 6а-6в - схематический вид выбранных контактных положений для переключателя на фиг. 5.
Фиг. 7 - вид в перспективе следующего варианта выполнения изобретения.
Фиг. 8 - вид в перспективе еще одного варианта выполнения изобретения.
Фиг. 9а-9г - вид сверху, иллюстрирующий предпочтительную форму электродов и последовательность применения.
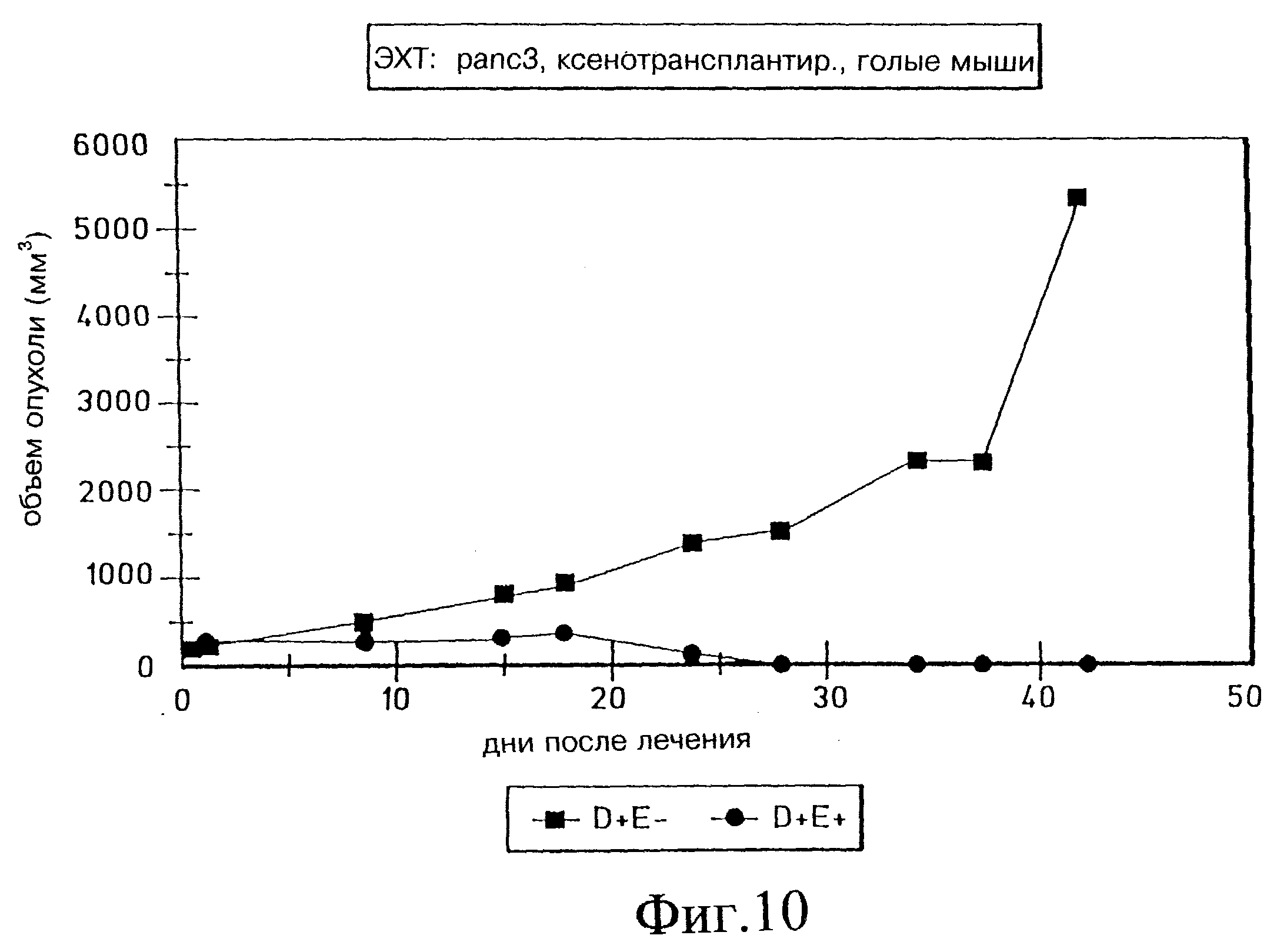
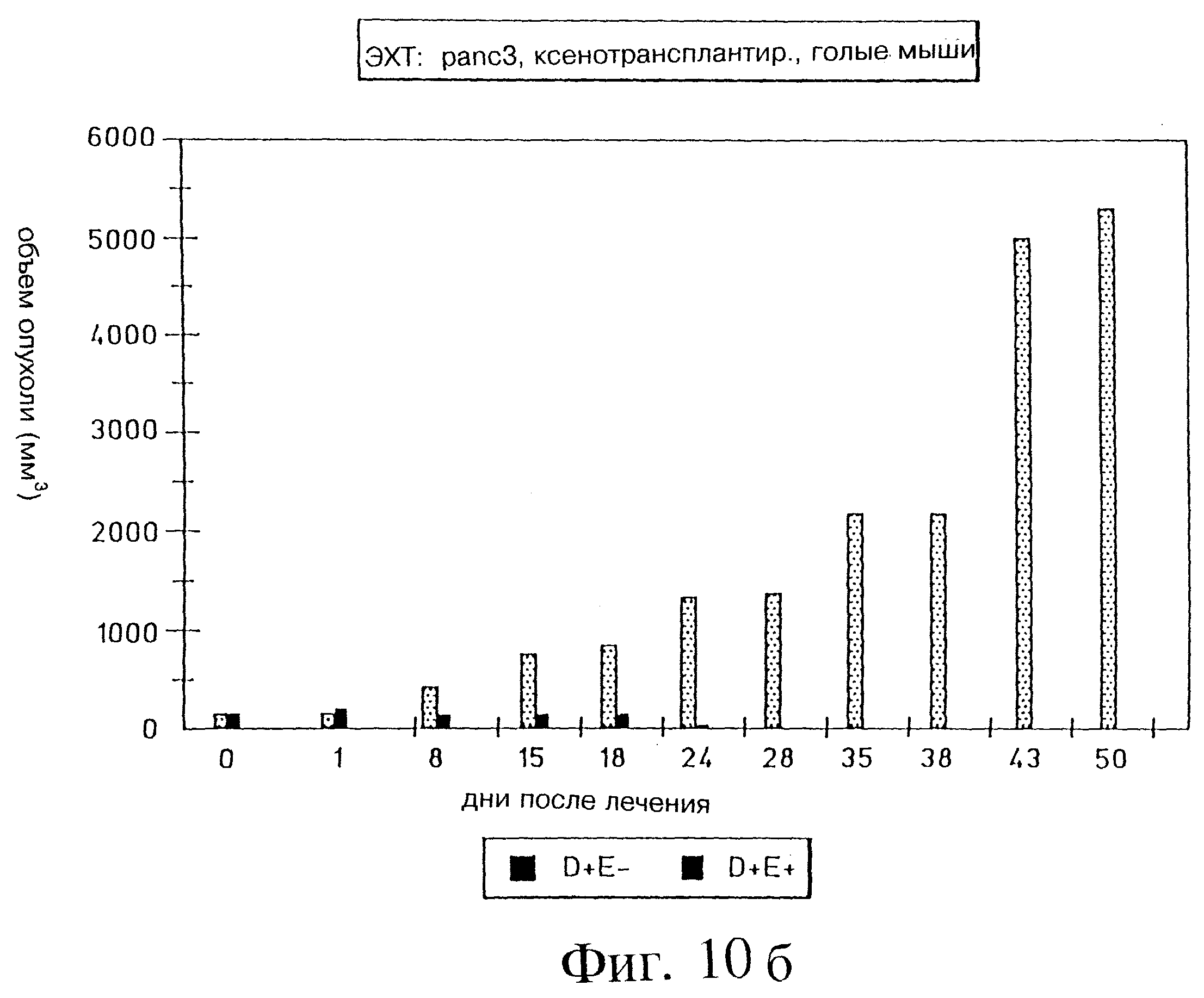
Фиг. 10а и 10б демонстрируют объем опухоли через 43 дня электрохимиотерапии с блеомицином на Panc-3 ксенотрансплантированных голых мышах, (D= препарат; E=электропорация).
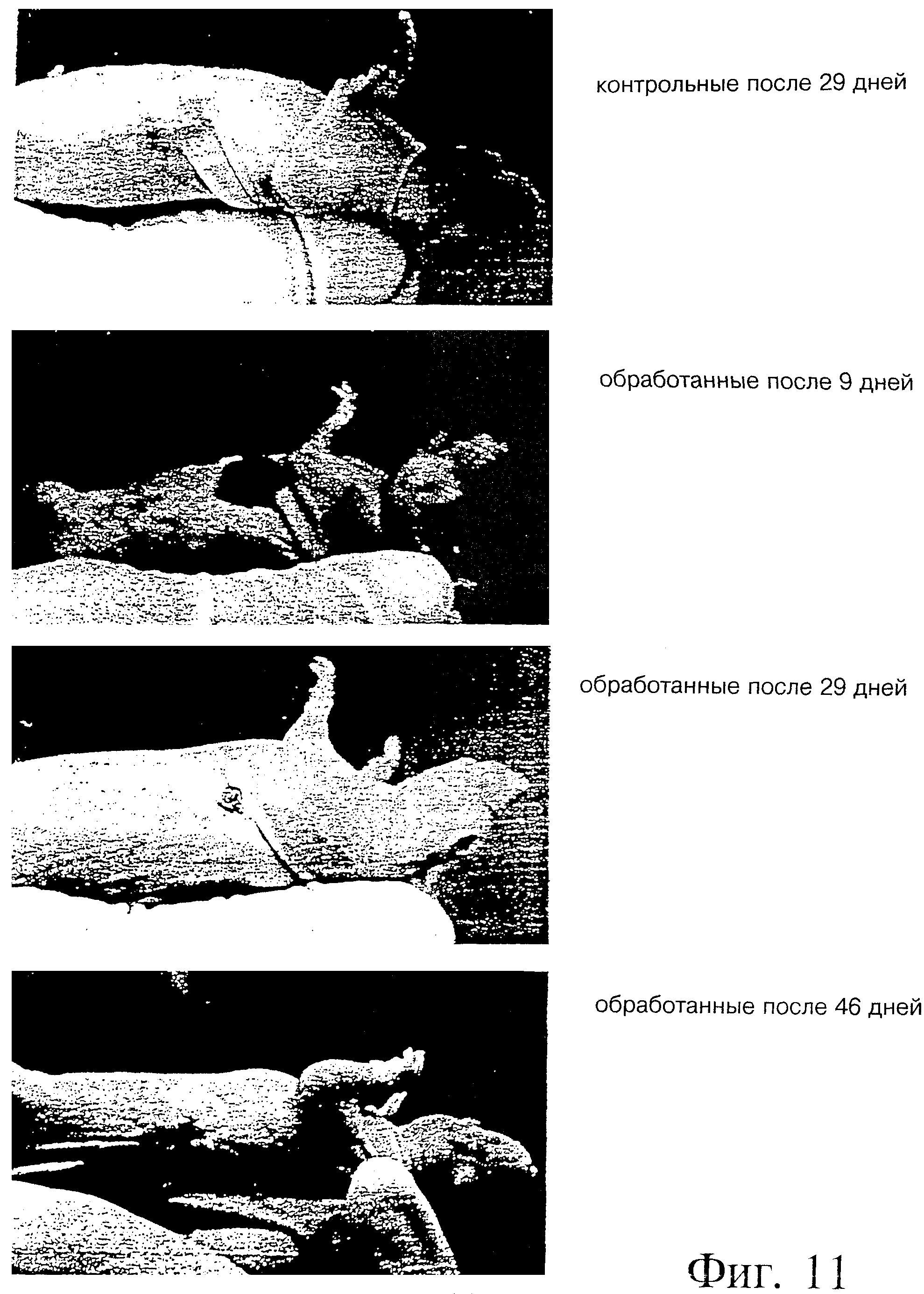
Фиг. 11 - иллюстрация опухолевого роста клеток Panc-3 после электрохимиотерапии блеомицином у голых мышей.
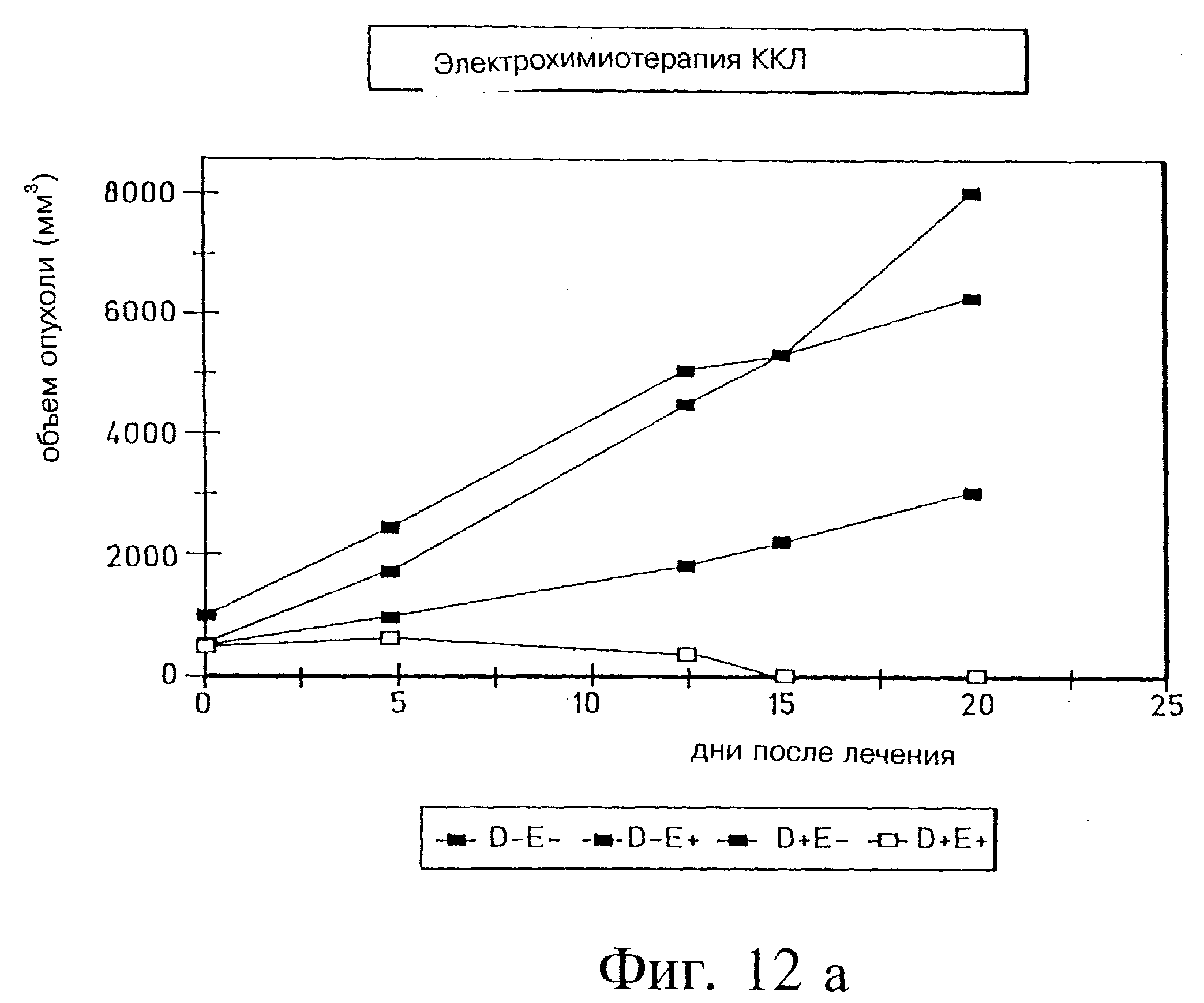
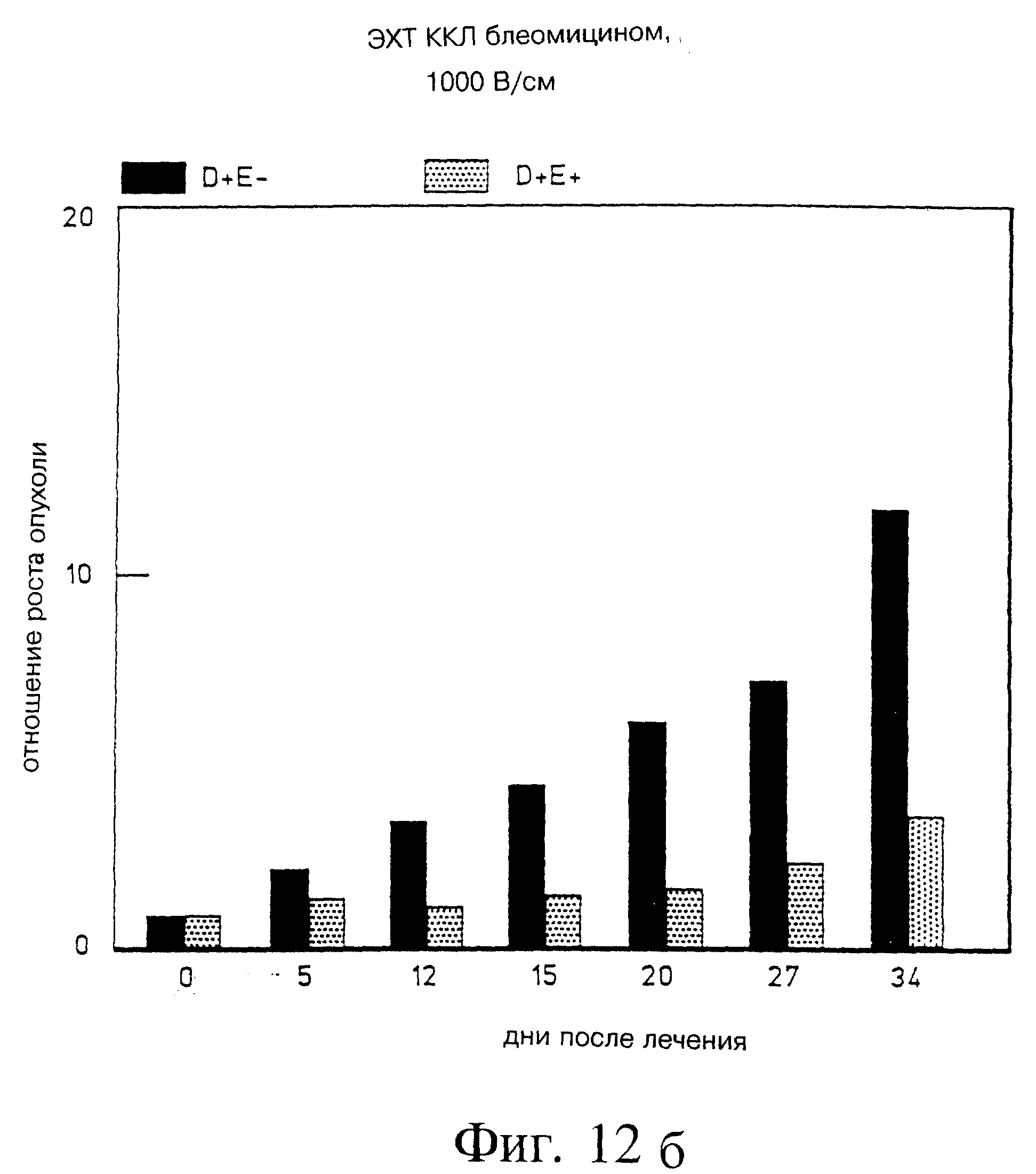
Фиг. 12а и 12б демонстрируют объем опухоли после 20 и 34 дней электрохимиотерапии блеомицином соответственно в крупноклеточной карциноме легких (ККЛ) ксенотрансплантированных голых мышей, (D=препарат; E=электропорация).
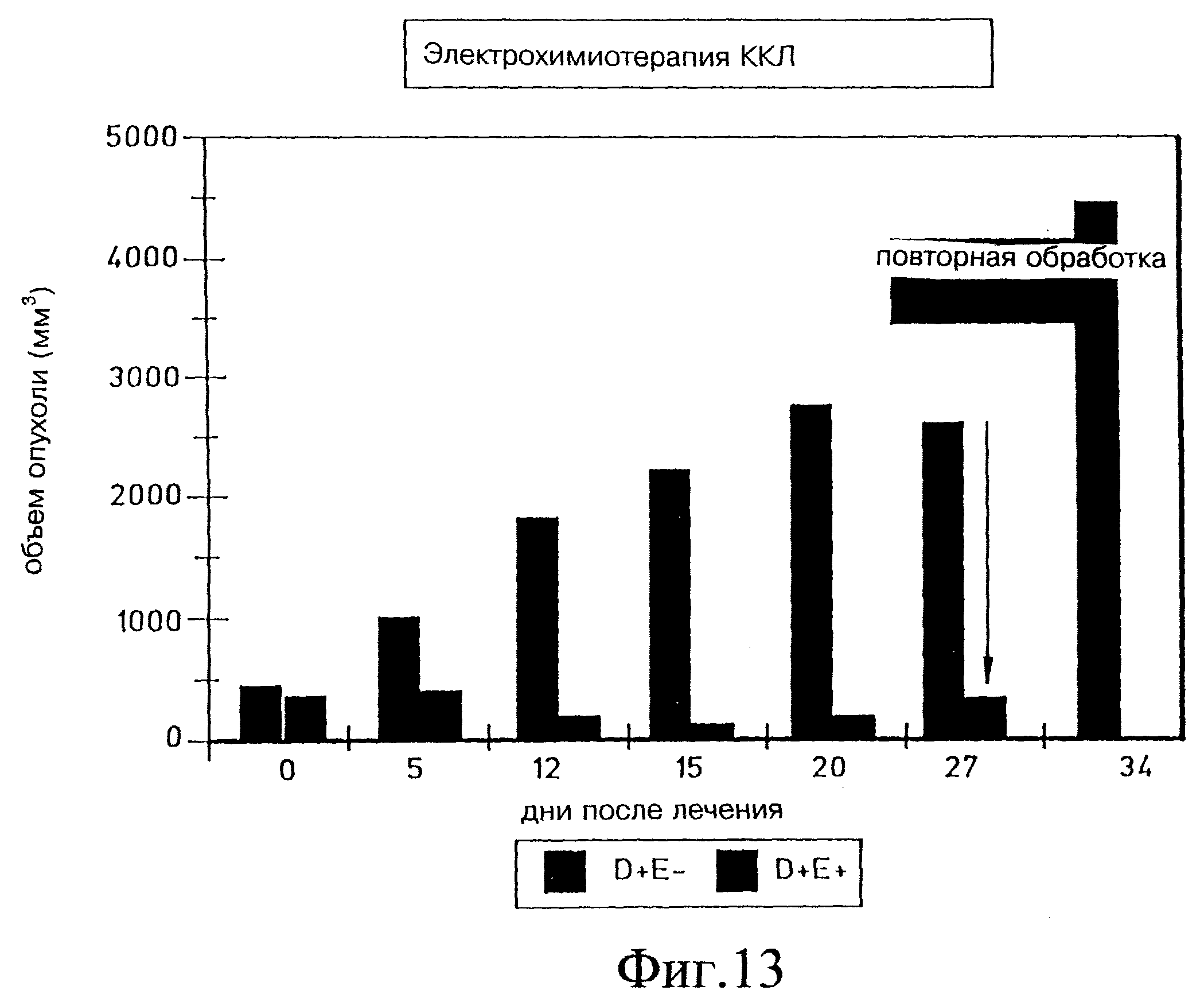
Фиг. 13 демонстрирует объем опухоли через 34 дня электрохимиотерапии блеомицином в крупноклеточной карциноме легких (ККЛ) ксенотрансплантированных голых мышей. Стрелкой указано повторное лечение одной мыши на 27 день. (D=препарат; E=электропорация).
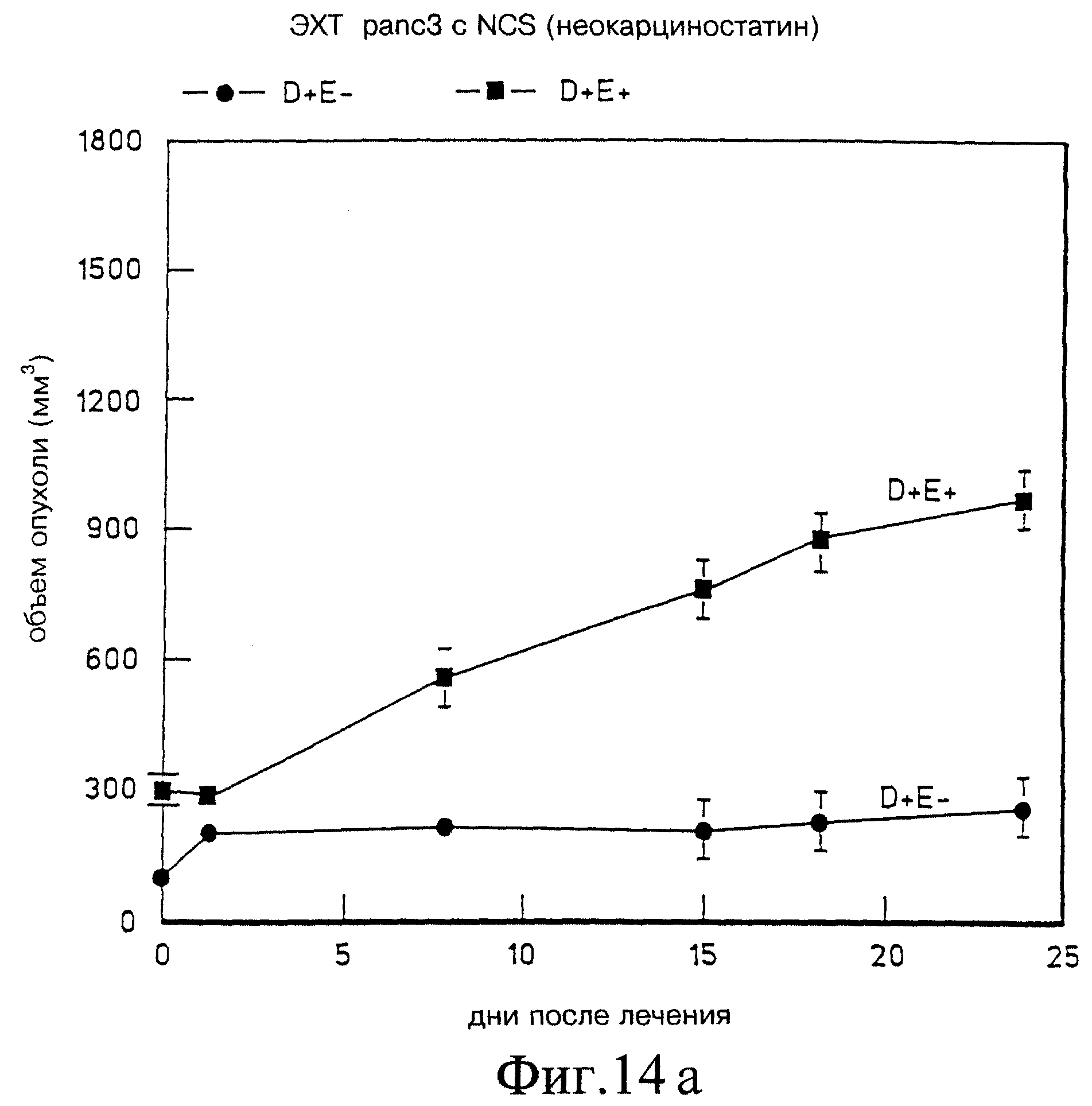
Фиг. 14а и 14б демонстрируют доимпульсную дозировку неокарциностатином в Panc-3 и ККЛ соответственно, на модели голой мыши.
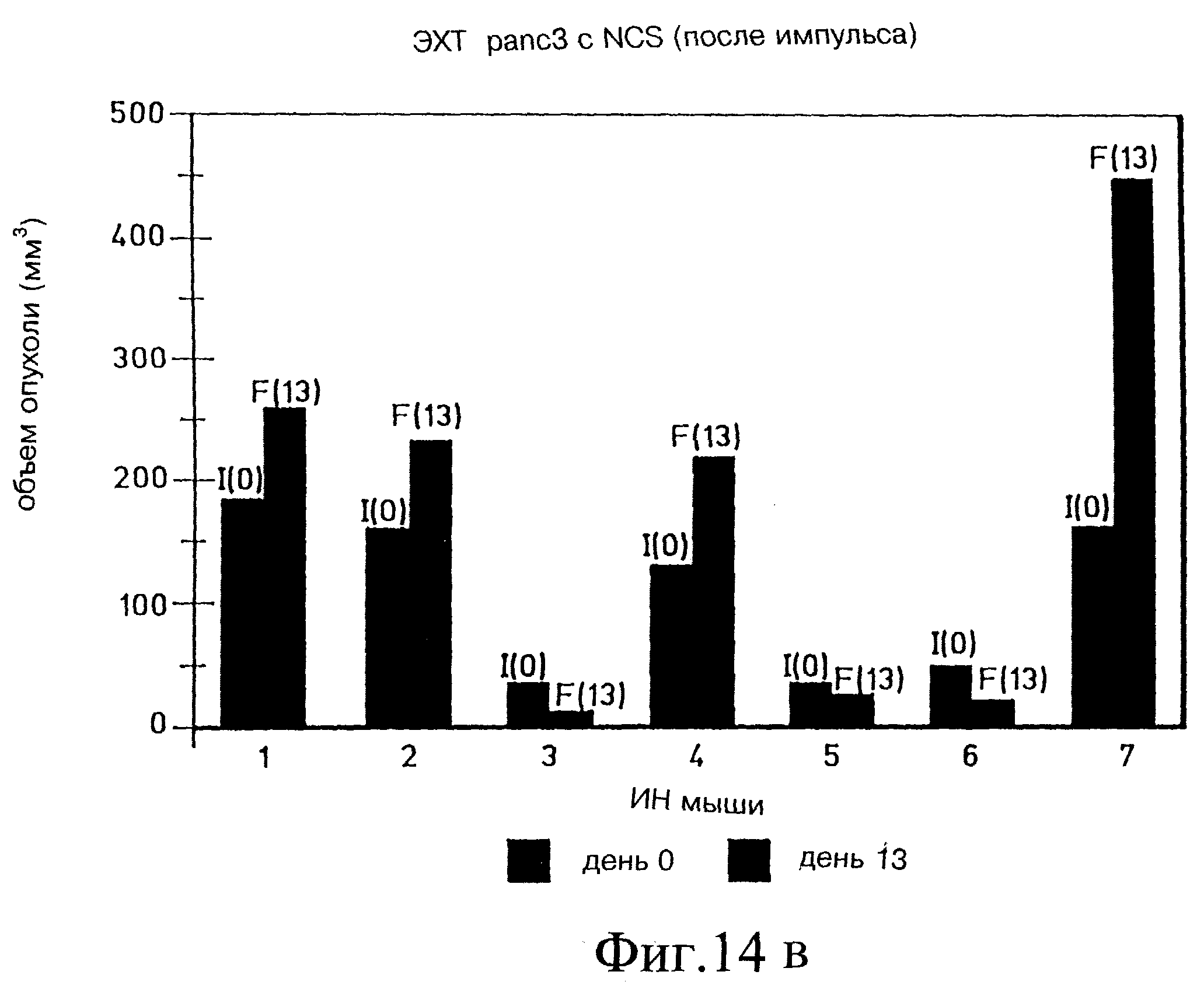
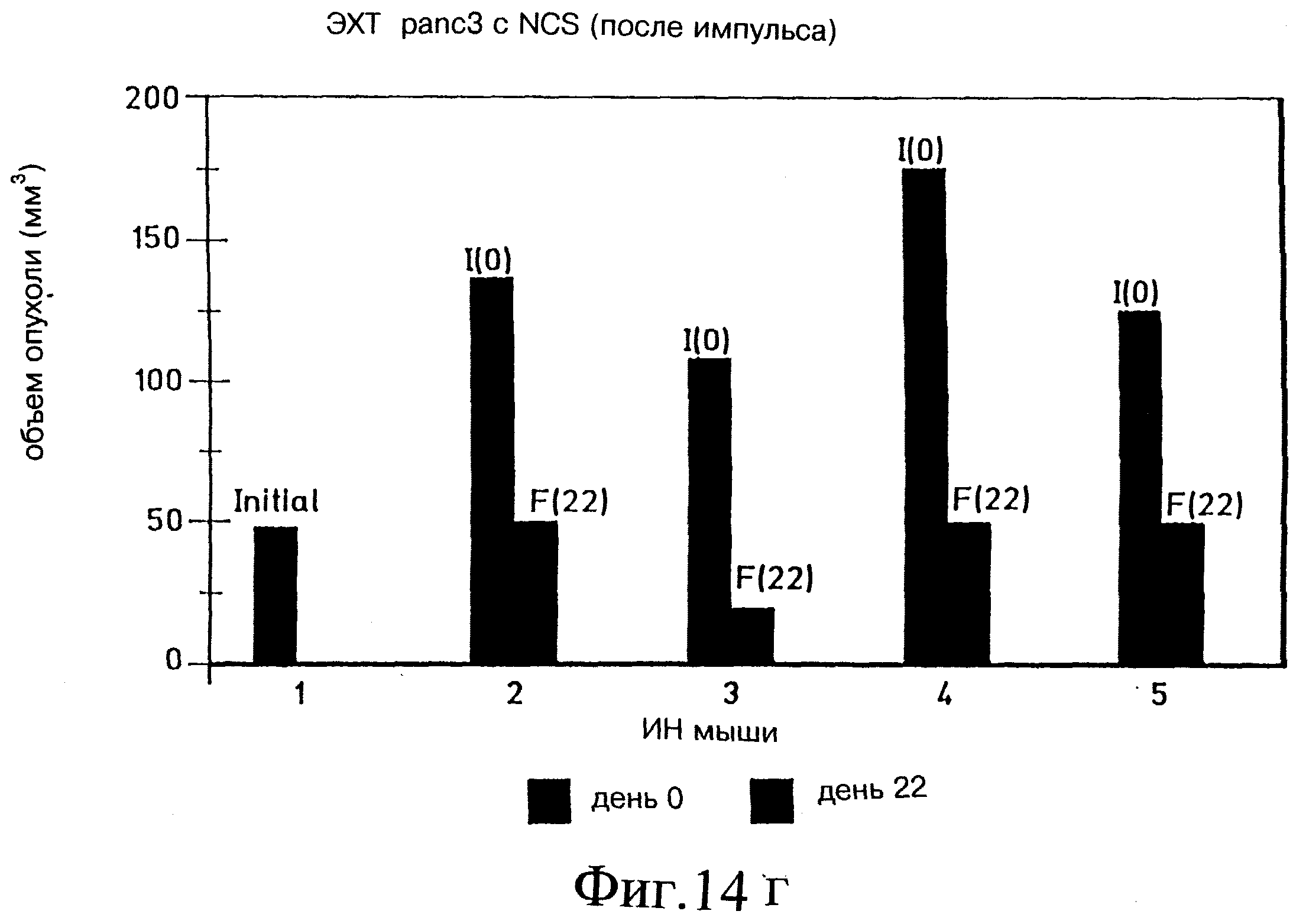
Фиг. 14в и 14г демонстрируют постимпульсную дозировку неокарциностатином в Panc-3 на модели голой мыши.
Применяемый здесь термин "молекулы" включает фармацевтические агенты, гены, антитела и другие белки. Одно терапевтические применение электропорации у человека состоит в инфузии противоопухолевого лекарства и электропорации его в опухоль, применяя импульсы электрического напряжения между электродами, расположенными на противоположных сторонах опухоли - электрохимиотерапия (ЭХТ). Настоящее изобретение главным образом предназначено для осуществления ЭХТ, такой как описано у Okino, Mir и др., проведенной на неповерхностных опухолях, таких как опухоли внутри тела. Однако она может быть использована и для других терапевтических применений.
На фиг. 1 показан узел иглы, для ясности обозначенный в целом номером 10. Узел иглы представляет собой удлиненную трубку 12, предпочтительно по форме представляющую собой полую ось из нержавеющей стали. Держатель центральной иглы 14 закреплен на нижнем конце оси 12 с центральным отверстием 16 для приема и направления центральной иглы 18. Ось 12 имеет щель 20, через которую тянется игольчатый электрод 18 изнутри оси 12 наружу, где его закрепляют зажимом 22 на наружной поверхности трубки 12.
Верхний конец электрода 18 может быть прикреплен к винту 24 для присоединения к электрической цепи. Нижний конец трубчатого держателя 12 имеет крепеж 26 для удержания втулки 28, несущей несколько игл, а также фиксирующую втулку 30 для фиксации и удержания на месте втулки 28.
Несколько игл 32 фиксируют во впадинах 34, расположенных на равном расстоянии по периметру на внешней поверхности втулки 28. Таким образом получают кольцеобразный блок игл, расположенных через одинаковые промежутки, на демонстрационном образце изобретения - восемь игл. Иглы удерживают на месте с помощью опоясывающего зажима 36 с концевыми ушками, закрепленными вместе винтом или гайкой и болтом 38, который также служит для электрического подключения игл. С помощью опоясывающего зажима 36 подключают напрямую и удерживают иглы на месте.
Данный электродный узел предназначен для приложения электрической энергии на живую ткань, когда в нее введены иглы. Центральная игла 18 играет роль одного электрода, например, анода или катода, а другая игла или кольцевой набор игл 32 функционирует как противоположный электрод. Когда зажимы установлены и закреплены, все эти иглы находятся в фиксированных положениях. Одна или более игл могут быть полыми или трубчатыми по форме для введения молекул генов, лекарств или других веществ в ткань.
В одном варианте проведения операции центральная игла должна быть установлена нужным образом для достижения требуемого проникновения в ткань. Этого достигают путем ослабления давления зажима 22 центральной иглы и смещением центральной иглы 18 наружу или внутрь, как видно на фиг. 1, так что она вытягивается из держателя центральной иглы 14 на необходимое расстояние проникновения. Затем иглу прижимают зажимом. После этого кольцевые иглы 32 укрепляют таким образом, чтобы достичь требуемого проникновения в ткань. Это можно осуществить путем ослабления давления опоясывающего зажима 36 и смещения игл 32 в необходимое положение. Небольшие смещения можно также выполнять, перемещая втулку 28 в направлениях к концу оси 12 и обратно. Терапевтическое вещество можно вводить в ткань через одну или более таких игл или отдельно.
После того, как проникновение всех игл отрегулировано, ось 12 крепко захватывают, и иглы вводят в ткань на необходимую глубину. Затем к электродному узлу подключают соответствующий импульсный генератор и на электроды подают необходимое напряжение. Перед подачей тока в ткань вводят соответствующее количество терапевтического веществ, такого как гены или молекулы подходящего для лечения химического или фармацевтического препарата.
Модификация этого электродного узла может включать сплошной непроникающий электрод (не показан) вместо центральной иглы. Непроникающий центральный электрод может быть проводником любой подходящей формы, такой как кнопка или пластинка, прикрепленная на конце оси 12 для контакта с поверхностной тканью. Набор кольцевых игл может быть установлен для проникновения в ткань на нужную глубину, когда центральный электрод остается на тканевой поверхности. Электрическая энергия может идти от проникающих игл через ткань к центральному электроду на поверхности. Эти модификации могут применяться при лечении околоповерхностных опухолей, где кольцевой набор электродов установлен таким образом, чтобы окружить опухоль. Центральный электрод устанавливают так, чтобы электроэнергия шла через опухоль на центральный электрод.
Другие преимущества этого электродного узла заключаются в том, что все иглы 18 и 32 могут быть независимо установлены так, чтобы достичь требуемого проникновения. Втулка для игл 28 может быть также установлена на таком расстоянии от конца оси 12, чтобы можно было непосредственно наблюдать введение центральной и кольцевых игл. Кроме того, втулка 28 может иметь любой размер и конфигурацию для того, чтобы окружить область ткани, предназначенную для лечения. На иглы можно также подавать энергию попарно, как описано на фиг. 3-6.
Как указано на фиг. 3 и 4, вариант выполнения узла с кольцевым расположением игольчатых электродов представлен на чертеже под номером 40. Этот игольчатый узел представляет собой кольцевой блок игл 42-52, закрепленных на равном расстоянии на втулке 54, установленной на удлиненной цилиндрической оси 56. Втулка 54 предпочтительно выбрана с таким диаметром, чтобы установить иглы вокруг опухоли или другой ткани, предназначенной для лечения. Одна или несколько игл могут быть полыми для возможности введения молекул терапевтического вещества, как будет описано более подробно ниже.
Узел гнезда электрического разъема представляет собой корпус 58, имеющий центральный выход, или отверстие 60 для входа оси 56 и кольцеобразного узла гнезд 62-72 для установки концов игл 42-52. Гнезда 62-72 электрически присоединяют иглы к подводящим проводам 74-84, которые соединены с распределяющим переключателем, как будет описано ниже.
Гнездо электрического разъема 58 крепится на ось 56, причем концы игл входят в электрогнезда 62-72 для соединения с подводящими проводами 74-84. Ось 56, несущая втулку 54 с набором игл, крепится вместе с гнездовым узлом 58 в держателе 86, приспособленном для захвата рукой. Держатель 86 имеет удлиненную цилиндрическую форму, приспособленную для удерживания рукой при манипуляции. Держатель 86 имеет переднее гнездо с выдающейся вперед трубчатой осью 88, имеющей отверстие 90, в которое входит ось 56, в то время как ось 88 входит в отверстие (не указано), расположенное на разъеме 58. Ось 56 входит в отверстие 90 и имеет кольцевую выемку, или впадину 92, при помощи которой ось закрепляется удерживающим фиксатором, представляющим собой поперечную пробку 94 в отверстии 96, смещенную к одной стороне и имеющую отверстие 98, в которое входит кольцевая выемка 92, где она и крепится в держателе. Пружина 102, укрепленная в отверстии 96, смещает пробку 94 в запирающее положение. Ось 56 можно освободить для удаления путем надавливания на конец 100 пробки 94.
Держатель в собранном виде, как показано на фиг. 4, можно удерживать в руке, погружая иглы в выбранную область ткани. Иглы 42-52 предпочтительно расположены так, чтобы окружить выбранную для лечения ткань. Одна или более игл 42-52, как отмечено ранее, могут быть полыми для возможности введения необходимого терапевтического вещества. Электродные проводники 74-84 подсоединяют затем в предпочтительном порядке к узлу поворотного переключателя, показанному на фиг. 5, который дает возможность выбора противоположных пар игл для активации, или приложения электрического потенциала.
Узел переключателя, обозначенный номером 104, включает стационарный корпус 106, который в приведенном варианте обычно имеет цилиндрическую форму и который закреплен на роторе 108 с разделенными контактами 110 и 112, соединенными парой проводников 114 и 116 с импульсным силовым генератором 115. Роторные контакты 110 и 112 расположены на корпусе 106 так, чтобы быть в связи с кольцевыми контактами 118, 120, 122, 124, 126 и 128, с которыми соединены проводники 74-84.
Как указано на фиг. 6а, б и в, ротор 108 имеет внутреннюю часть с контактами 110 и 112, каждый из которых соединяет мостиком два контакта 118-128, к которым присоединены проводники 74-84 для соединения с источником тока. Внутренние контакты 110 и 112 вращаются с ротором 108 и могут быть выборочно установлены для токопроводящего контакта с парами внутренних контактов 118-128 так, чтобы активировать противоположные пары игольчатых электродов. Это дает возможность оператору выборочно размещать электроды, окружающие выбранную ткань, и выборочно создавать направление электрического поля, требуемое для оптимального лечения. Ротор 108 позволяет выборочно генерировать поле около и внутри ткани по всем направлениям.
На фиг. 7 представлен другой вариант выполнения ряда параллельно размещенных регулируемых электродов, генерирующих электрическое поле, как описано в основной заявке. Набор электродов, обозначенный номером 130, включает в себя пару разделенных в пространстве рядов 132 и 134 проводящих игольчатых электродов 136 и 138, закрепленных на диэлектрической стойке или опорном элементе 140. Блок игл 132 удерживается в фиксированном зажиме 142, который позволяет устанавливать иглы 136 по глубине относительно элемента 140.
Иглы 138 установлены на подвижном зажиме 146, который установлен с возможностью регулировки на опорном элементе 140 при помощи прижимного винта 148. Иглы (136 и 138) каждая снабжены фиксатором проникновения 144. Зажимной винт-регулятор расстояния промежутка 148 фиксирует зажим 146 в выбранной позиции на опорном элементе 140. Датчик расстояния промежутка 150 определяет расстояние между блоками игл 132 и 134 и генерирует сигнал, который поступает на импульсный генератор через проводящий кабель 152. Генератор импульсов присоединен к игольчатым электродам посредством кабелей 154 и 156.
На фиг. 8 приведены детали держателя игл, или шаблона, для различных вариантов установки разделенных в пространстве параллельных блоков игл. Этот вариант выполнения включает основной держатель 158, имеющий набор смежно расположенных параллельных выемок 160, в которые могут быть установлены выбранные иглы 162 и 164 в выбранном пространственном отношении. Этот держатель может служить для установки пары игольчатых электродов 162 и 164 с противоположными зарядами, как показано на чертеже. Они могут быть выборочно расположены в выбранном пространственном отношении для размещения на противоположных сторонах выбранной ткани. Иглы фиксируются в выемках при помощи зажима, или пластины, 159. Кроме того, держатель можно применять в комбинации с дополнительным держателем для обеспечения работы нескольких рядов на противоположных сторонах избранной ткани. Иглы можно подключить через проводники 166 и 168 к подходящему импульсному генератору. В каждом ряду могут быть размещены по крайней мере два электрода или по крайней мере пять электродов.
На фиг. 9а-9г представлен дополнительный аспект изобретения. В соответствии с пояснением, сочетание электродов может принимать форму отдельных игл 170 и 172, которые могут быть первыми введены непосредственно в выбранную область ткани или рядом с ней, например, как показано, в противоположные стороны опухоли 174. После этого иглы могут быть соединены со шприцем или другим источником молекул и применены для введения избранного молекулярного раствора в тканевую область. Иглы могут быть неэлектропроводными, и пару электродов 176 и 178, как показано на фиг. 9б, селективно вводят в ткани через отверстие, или просвет соответствующих игл, как показано, а затем иглу удаляют, как показано на фиг. 9в. Каждый из электродов 176 и 178 снабжен удлиненным изолированным проводником 180 и 182 с токопроводящими кончиками.
Пара проводников 188 и 190 от подходящего электрогенератора может быть затем присоединена к концам проводников электродов при помощи микрозажимов 192 и 194, как показано на фиг. 9г, затем через электроды подают электрический потенциал. Он генерирует в ткани поле и электропорирует клетки избранной ткани, такой как опухолевая или подобная ей. Эта электропорация дает возможность избранным молекулам входить в клетки ткани и более эффективно убивать или изменять клетки необходимым образом. Эта форма иглы и электрода может быть применена в любом или во всех вышеописанных устройствах.
Эти узлы с игольчатыми электродами, как описано выше, позволяют in vivo располагать электроды внутри или вблизи подповерхностных опухолей или других тканей. В то время как в данной заявке основное внимание уделено электрохимиотерапии, варианты выполнения изобретения могут быть применены в других видах лечения, таких, как генная терапия определенных органов тела.
Природа генерируемого электрического поля определяется природой ткани, размером выбранного участка ткани и его расположением. Желательно, чтобы поле было как можно более однородным и имело точную амплитуду. Чрезмерная сила поля приводит к лизису клеток, тогда как низкая сила поля приводит к понижению эффективности. Электроды можно устанавливать и управлять ими многими способами, включая те из них, что описаны в основной заявке, но не ограничиваясь ими. Электроды можно легко накладывать вручную и при помощи пинцета в случае внутреннего наложения.
Форма волны электрического сигнала, подаваемого импульсным генератором, может быть экспоненциально затухающим импульсом, прямоугольным импульсом, униполярной осциллирующей импульсной серией волн или биполярной осциллирующей импульсной серией волн. Сила электрического поля может быть от 0,2 кВ/см до 20 кВ/см. Длительность импульса может быть от 10 мкс до 100 мс. Количество импульсов может быть от одного до ста. Конечно, форма волны, сила электрического поля и длительность импульса также зависят от типа клеток и типа молекул, предназначенных для ввода в клетки путем электропорации.
Различные параметры, включая силы электрического поля, необходимые для электропорации любой известной клетки, можно почерпнуть из научных статей, касающихся предмета, а также из базы данных, поддерживаемой компанией Genetronics Inc., San Diego, California, владельцем данной заявки. Электрические поля, необходимые для клеточной электропорации in vivo, например, ЭХТ, схожи по амплитуде с полями, необходимыми для клеток in vitro. Они находятся в диапазоне от 100 В/см до нескольких кВ/см. Это подтверждено изобретателями в их собственных экспериментах и в экспериментах других ученых, опубликованных в научной литературе. О первом in vivo применении импульсных электрических полей в области химиотерапии для лечения опухолей было доложено в Японии Окино в 1987 году.
Импульсные генераторы для выполнения описанных здесь процедур стали и продолжают оставаться доступными на рынке в течение ряда лет. Одним из них является генератор сигналов ELECTRO CELL MANIPULATOR, модель ECM 600, поставляемый компанией GENETRONICS, INC., San Diego, California, U.S.A. Генератор сигналов ECM 600 генерирует импульс от полной разрядки конденсатора, в результате чего получается экспоненциально затухающая форма волны. Электрический сигнал, генерируемый этим генератором сигналов, характеризуется быстрым повышением во времени и экспоненциальным хвостом. В генераторе сигналов длину импульса электропорации устанавливают путем выбора одного из десяти хронометрирующих резисторов, обозначенных R1-R10. Они активны как в режиме высокого напряжения (РВН) (емкость устанавливают равной пятидесяти микрофарадам), так и в режиме низкого напряжения (РНН) (диапазон емкости от 25 до 3,175 микрофарад).
Генератор сигналов ЕСМ 600 имеет контрольную кнопку, которая позволяет корректировать амплитуду заряда установленного напряжения, поданного на внутренние конденсаторы, в интервале от 50 до 500 В при РНН и от 0,05 до 2,5 кВ при РВН. Амплитуда электрического сигнала высвечивается на дисплее, вмонтированном в генератор сигналов ЕСМ 600. Кроме того, данное устройство имеет ряд кнопочных выключателей для контроля над длительностью импульса в режиме РНН при одновременном использовании резисторов, включенных параллельно выходу, и набора из семи переключаемых аддитивных конденсаторов.
Генератор сигналов ЕСМ 600 также содержит кнопку единичного автоматического заряда и импульса. Эту кнопку можно использовать как для включения зарядки внутренних конденсаторов до установленного напряжения, так и для подачи импульса к внешним электродам в автоматическом цикле, для которого требуется менее 5 секунд. Затем можно воспользоваться кнопкой ручного управления для многократного включения заранее заданного электрического поля.
Предпочтительно в предложенном терапевтическом способе использовать систему электропорации с прямоугольным импульсом. Например, можно использовать прибор ElectroSquarePorator (T820), также поставляемый компанией GENETRONICS, INC.
Системы подачи прямоугольных импульсов при электропорации подают регулируемые электрические импульсы, которые быстро возрастают до установленного напряжения, остаются на заданном уровне в течение заданного времени (длительность импульса) и затем быстро снижаются до нуля. Этот тип систем дает большую трансформационную эффективность при электропорации растительного протопласта и линий клеток млекопитающих, чем система экспоненциального затухания.
Прибор ElectroSquarePorator (T820) является первой коммерчески доступной системой электропорации с прямоугольной формой импульсов, позволяющей генерировать до 3000 В. Длительность импульса может быть установлена от 5 мкс до 99 мс. Прямоугольные электропорационные импульсы обладают более щадящим действием на клетки, что приводит к большей жизнеспособности клеток.
Прибор ElectroSquarePorator (T820) активен как в режиме высокого напряжения (РВН) (100-3000 В), так и в режиме низкого напряжения (РНН) (50-500 В). Длительность импульса при РНН составляет примерно 0,3-99 мс, а при РВН - 5-99 мкс. В приборе T820 имеется возможность получения многократных импульсов, примерно от 1 до 99 импульсов.
Мир и др. применяли прямоугольные импульсы в электрохемотерапии, которая позволяет осуществлять введение хемотерапевтических агентов в раковые опухоли. Мышей инъецировали низкой дозой блеомицина. Затем раковые опухоли подвергали электропорации, в результате чего происходило уменьшение или полное исчезновение опухолей (Mir, L.M., Eur. J.Cancer., 27(1):68.1991).
Сондерс сравнивал прямоугольные и экспоненциально затухающие импульсы при электропорации растительного протопласта. Электропорация прямоугольными импульсами имела более высокую трансформационную эффективность, чем электропорация экспоненциально затухающими импульсами. Он также сообщил, что оптимизация параметров электропорации намного легче при применении прямоугольных импульсов, поскольку достаточная трансформационная эффективность может быть получена в более широком диапазоне напряжений (Saunders, Guide to Electroporation and Electrofusion, pp. 227-247, 1991).
Терапевтический способ по изобретению включает электротерапию, также называемую здесь электропорационной терапией, с использованием устройства по изобретению для доставки макромолекул к клетке или ткани. Как описано ранее, термин "макромолекула" или "молекула", используемый здесь, относится к лекарствам (например, химиотерапевтическим агентам), нуклеиновым кислотам (например, полинуклеотидам), пептидам и полипептидам, включая антитела. Термин "полинуклеотиды" включает ДНК, кДНК или РНК последовательности.
Лекарства, предполагаемые для применения в способе по изобретению, представляют собой типичные химиотерапевтические агенты, имеющие противоопухолевый или цитотоксический эффект. Такие лекарства или агенты включают блеомицин, неокарциностатин, сурамин и цисплатин. Другие химиотерапевтические агенты известны специалистам в данной области (см., например, The Merck Index). Химический состав агента диктует наиболее подходящее время для введения лекарства в зависимости от применения электрического импульса. Например, вне связи с конкретной теорией, полагают, что лекарство, имеющее низкую изоэлектрическую точку (например, неокарциностатин, изоэлектрическая точка = 3,78), было бы, наверное, более эффективно, если вводить его после электропорации для того, чтобы избежать электростатического взаимодействия сильно заряженного лекарства внутри поля. Кроме того, такие лекарства, как блеомицин, которые имеют сильно отрицательный log P (где P - коэффициент разделения между октанолом и водой) и большой размер (М=1400), а также гидрофильны, прочно связываясь вследствие этого с липидной мембраной, очень медленно диффундируют в опухолевую клетку, и их обычно вводят до или фактически одновременно с электрическим импульсом. Электропорация облегчает вход блеомицина или других схожих лекарств в опухолевую клетку путем создания пор в клеточной мембране.
Может быть желательно модулировать экспрессию гена в клетке путем введения молекулы предложенным в изобретении способом. Термин "модулировать" предполагает подавление экспрессии гена, если он сверхэкспрессируется, или увеличение экспрессии, если он недостаточно экспрессируется. Когда нарушение клеточной пролиферации связано с экспрессией гена, может быть применена последовательность нуклеиновой кислоты, которая влияет на экспрессию гена на уровне трансляции. При этом способе используют, например, антисмысловую нуклеиновую кислоту, рибозимы или триплексные агенты, которые блокируют транскрипцию или трансляцию специфичной мРНК, либо маскируя эту мРНК антисмысловой нуклеиновой кислотой или триплексным агентом, либо разрезая ее рибозимом.
Антисмысловые нуклеиновые кислоты - это ДНК или РНК молекулы, которые комплементарны по крайней мере части специфичной молекулы мРНК (Weintraub, Scientific American, 262:40, 1990). В клетке антисмысловые нуклеиновые кислоты гибридизуются с соответствующей мРНК, образуя двухцепочечную молекулу. Антисмысловые нуклеиновые кислоты влияют на трансляцию мРНК, поскольку клетка не будет транслировать мРНК, которая оказывается двухцепочечной. Предпочтительны антисмысловые олигомеры около 15 нуклеотидов, поскольку их легко синтезировать и они менее вероятно будут представлять проблемы по сравнению с большими молекулами при вводе в клетку-мишень. Применение антисмысловых способов для подавления трансляции генов in vitro хорошо известно (Marcus-Sakura, Anal. Biochem., 172:289, 1988).
Применение олигонуклеотида для остановки транскрипции известно как триплексная стратегия, поскольку олигомер наматывается вокруг двойной спирали ДНК, образуя трехцепочечную спираль. Таким образом, триплексные соединения должны быть созданы, чтобы узнавать уникальный сайт на выбранном гене (Maher, et al. Antisense Res. and Dev., 1(31:227, 1991, С., Anticancer Drug Design, 6161:569, 1991).
Рибозимы - это молекулы РНК, обладающие способностью специфично расщеплять другую одноцепочечную РНК способом, аналогичным для рестрикционных эндонуклеаз ДНК. Модифицируя нуклеотидные последовательности, которые кодируют эти РНК, можно создавать молекулы, которые узнают специфичные нуклеотидные последовательности на молекуле РНК и расщепляют ее (Cech, J.Amer. Med. Assn., 260:3030, 1988). Основное преимущество этого способа в том, что поскольку они являются сиквенс-специфичными, то инактивируются только мРНК с особенными последовательностями.
Существует два основных типа рибозимов, а именно тип тетрахимены (tetrahymena) (Hasselhoff, Nature, 334:585. 1994) и тип "головки молотка". Рибозимы типа tetrahymena узнают последовательности длиной 4 основания, тогда как рибозимы типа "головки молотка" узнают последовательности оснований длиной 11-18 оснований. Чем длиннее последовательность узнавания, тем больше вероятность того, что последовательность встретится только лишь на участке мРНК молекулы-мишени. Соответственно, рибозимы типа "головки молотка" предпочтительнее рибозимов типа tetrahymena для инактивации участка специфичной мРНК, и последовательности узнавания из 18 оснований предпочтительнее более коротких последовательностей узнавания.
Данное изобретение также обеспечивает генную терапию для лечения клеточных пролиферативных и иммунологических расстройств, обусловленных специфичным геном или его отсутствием. Такая терапия будет достигать своего терапевтического эффекта при введении специфичного смыслового или антисмыслового полинуклеотида в клетку с таким расстройством. Доставка полинуклеотидов может быть достигнута с применением рекомбинантного вектора экспрессии, такого как химерный вирус, или полинуклеотид может быть доставлен в виде, например, "голой" ДНК.
Различные вирусные векторы, которые могут быть применены для генной терапии, как здесь сообщается, включают аденовирус, вирус герпеса, вирус коровьей оспы или, предпочтительно, РНК вирус, такой как ретровирус. Предпочтительно, ретровирусный вектор - это производное мышиных или птичьих ретровирусов. Примеры ретровирусных векторов, в которые может быть вставлен единичный чужеродный ген, включают, но не ограничиваются следующими: вирус лейкемии мышей Молонея (MoMuLV), вирус саркомы мышей Харвея (HaMuSV), вирус опухоли молочных желез мышей (MuMTV) и вирус саркомы Рауса (RSV). Для человека может быть применен вирус лейкемии гиббонов (GaLV). Ряд других ретровирусных векторов может инкорпорировать несколько генов. Все эти векторы могут переносить или инкорпорировать ген селективного маркера, чтобы трансдуцированные клетки могли быть идентифицированы и произведены.
Терапевтические пептиды или полипептиды также могут быть включены в терапевтический способ по изобретению. Например, иммуномодуляторные агенты и другие модификаторы биологического ответа могут быть введены при инкорпорации, осуществляемой клеткой. Термин "модификаторы биологического ответа" обозначает вещества, которые включаются в модификацию иммунного ответа. Примеры модификаторов иммунного ответа включают такие соединения как лимфокины. Лимфокины включают фактор некроза опухоли, интерлейкины 1, 2 и 3, лимфотоксин, фактор активации макрофагов, фактор торможения миграции, колониестимулирующий фактор, α-, β-, γ-интерферон и их подтипы.
Также включены полинуклеотиды, которые кодируют метаболические ферменты и белки, включая антиангиогенезисные соединения, например, Фактор VIII или Фактор IX.
Макромолекулы по изобретению также включают молекулы антител. Термин "антитело" применяется для обозначения интактных молекул, а также их фрагментов, таких как Fab или F(ab')2.
Применение лекарства, полинуклеотида или полипептида в способе по изобретению, может быть, например, парентеральное путем инъекции, быстрой инфузии, носоглоточной абсорбции, дермальной абсорбции или перорально. В случае опухоли, например, хемотерапевтический или другой агент может быть введен локально, системно или непосредственно инъецирован в опухоль. Когда лекарство, например, вводится прямо в опухоль, целесообразно вводить лекарство "веерным" способом. Термин "веерный" относится к введению лекарства с изменением направления иглы во время введения лекарства или к множественному введению во многих направлениях, подобно открытому ручному вееру, а не в виде болюса, чтобы обеспечить большее распределение лекарства по опухоли. По сравнению с объемом, который обычно используют в практике, желательно увеличить объем раствора, содержащего лекарство, когда лекарство вводят (например, инъецируют) в опухоль, чтобы обеспечить адекватное распределение лекарства по опухоли. Например, как описано здесь в примерах, специалист обычно вводит 50 мкл раствора, содержащего лекарство, однако результаты сильно улучшаются при увеличении объема до 150 мкл. Предпочтительно инъекцию следует проводить очень медленно и лучше по периферии, чем по центру опухоли, где внутреннее давление очень высоко.
Предпочтительно молекулы применяют "фактически одновременно" с электропорационным лечением. Термин "фактически одновременно" значит, что молекулярное и электропорационное лечение применяют обоснованно близко друг к другу во времени. Введение молекулярного или терапевтического агента может проводиться с любыми интервалами в зависимости от таких факторов, например, как природа опухоли, состояние пациента, размер и химические характеристики молекул и период полураспада молекул.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Носители для окклюзионных повязок могут применяться для увеличения проницаемости кожи и увеличения абсорбции антигена. Формы жидкой дозировки для перорального применения могут в общем представлять собой липосомный раствор, содержащий жидкую форму дозировки. Подходящие формы для суспендирования липосом включают эмульсии, суспензии, растворы, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в практике, такие как очищенная вода. Кроме инертных разбавителей, такие композиции могут также включать адъюванты, увлажняющие агенты, эмульгирующие и суспендирующие агенты. Кроме того, вазоконстрикторные агенты могут применяться для сохранения терапевтического агента, локализованного перед импульсацией.
Любая клетка может быть обработана способом по изобретению. Пояснительные примеры, приведенные здесь, демонстрируют применение способа по изобретению для лечения опухолевых клеток, например, поджелудочной железы и легкого. Другие расстройства клеточной пролиферации поддаются лечению путем электропорации по изобретению. Термин "расстройства клеточной пролиферации" обозначает как злокачественные, так и незлокачественные клеточные популяции, которые часто имеют видимые отличия от окружающей ткани как морфологически, так и генотипически. Злокачественные клетки (т.е., опухоль или рак) развиваются как результат многостадийного процесса. Способ по изобретению применим в лечении раковых и других заболеваний различных систем органов, особенно, например, клеток поджелудочной железы и легкого, а также клеток сердца, почек, мышц, груди, ободочной кишки, простаты, тимуса, семенника и яичника. Предпочтительным объектом для лечения является человек.
Следующие примеры предназначены для иллюстрации, но они не ограничивают изобретение. Поскольку процедуры являются типичными, специалистами могут быть альтернативно применены другие известные процедуры.
Примеры
Следующие примеры иллюстрируют применение электрохимиотерапии (ЭХТ)
низкодифференциированной опухоли поджелудочной железы человека (Panc-3), ксенотрансплантированной подкожно на левый бок голой мыши. Одна лечебная процедура включала инъекцию блеомицина (0,5 ед. в 0,15
мл физиологического раствора) в опухоль, применяя "веер", как здесь описано, после которой через 10 минут следовало применение 6 прямоугольных электрических импульсов с использованием патентуемого
блока игольчатых электродов, расположенных по периметру окружности диаметром 1 см. Блоки игл, имеющие различные диаметры (например, 0,5 см, 0,75 см и 1,5 см), также можно использовать для
приспосабливания под опухоли различных размеров. Фиксаторы различной высоты могут быть вставлены в центр блока электродов для проникновения игл в опухоль на разную глубину. Встроенный механизм
позволял переключать электроды для максимального перекрытия опухоли импульсным полем. Электрические параметры были следующие: 1300 В/см и 6x99 мкс импульсов, разделенных интервалами в 1 с.
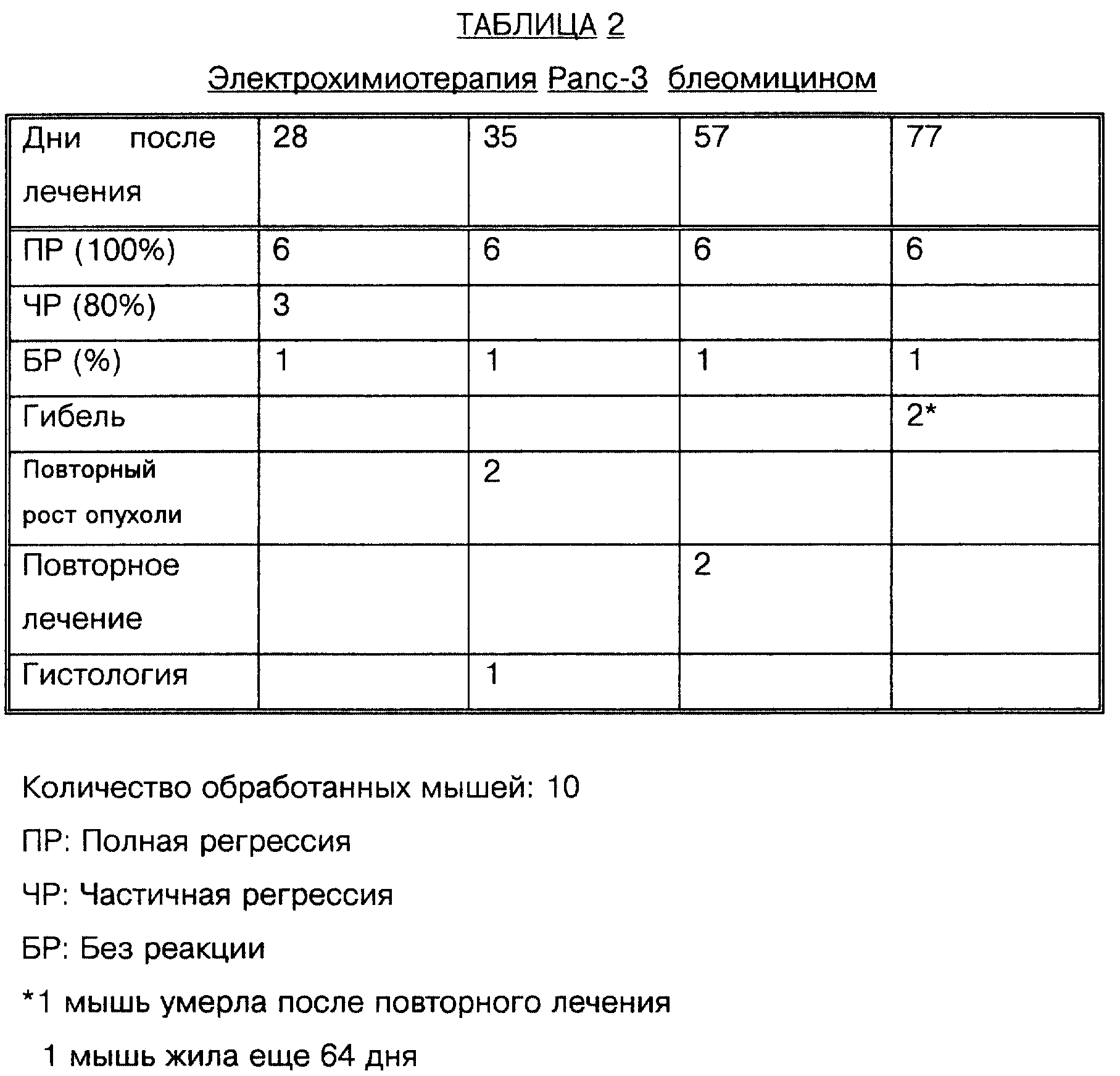
Результаты показали тяжелый некроз и эдему в области лечения почти у всех мышей. В то время как у мышей группы, подвергнутой лечению (D+E+; D= лекарство, E= электрическое поле), наблюдали значительное уменьшение объема опухоли (после незначительного начального возрастания вследствие эдемы), в контрольной группе (D+E-) объем опухоли заметно увеличивался. Почти полную регрессию опухоли наблюдали у 90% мышей, подвергнутых лечению ЭХТ через 28 дней. Реакции не наблюдали у 10% мышей. Полная регрессия без прощупываемой опухоли наблюдалась в 60% случаев через 77 дней после начала лечения. Однако у 20% мышей наблюдался вторичный рост опухоли через 35 дней после лечения, но в гораздо более медленном темпе по сравнению с контролем. Это наблюдение связали с неполной обработкой большой первичной опухоли, где глубина иглы была ниже, чем Z-размер опухоли. Гистологический анализ опухолевых образцов показал тени некротических опухолевых клеток в D+E+ группе по сравнению с живыми и некротическими клетками в D+E-группе. Предварительные опыты с опухолью крупноклеточной карциномы легких человека, ксенотрансплантированной голым мышам, также показали очень обнадеживающие результаты лечения с применением ЭХТ и блеомицина.
Пример 1:
Опухолевая клеточная линия Panc-3, низкодифференцированная линия клеток аденокарциномы поджелудочной железы была
предоставлена AntiCancer, Inc., San Diego. Для ЭХТ экспериментов брали ткань у имеющихся мышей, в которых поддерживали опухолевую линию, разрезали на очень маленькие кусочки диаметром 1 мм каждый и
8-10 кусочков хирургически ксенотрансплантировали в подкожный разрез, сделанный на левом боку голых мышей, и затем закрывали 6,0 хирургическим швом. После того, как размер средней опухоли достигал
около 5 мм, мыши с прощупываемыми опухолями были случайным образом разделены на 10 мышей контрольной группы (D+E-; D=лекарство, E=электрическое поле) и 10 мышей для ЭХТ лечения, то есть для инъекции
блеомицина, за которой следовали импульсы (D+E+) от ВТХ генератора прямоугольных импульсов T820. Измеряли размер опухоли и рассчитывали объем опухоли по формуле:
(II/6)•a•
b•c,
где a, b и c - соответственно, длина, ширина и толщина опухоли. 0,5 единиц Блеомицина (Sigma Chemicals) растворяли в 0,15 мл 0,9% NaCl и инъецировали внутрь опухоли каждой мыши
"веерным" методом как контрольной (D+E-), так и подвергнутой лечению (D+E+) группы. Через 10 минут после инъекции каждую мышь из D+E+ группы подвергали импульсам от ВТХ T820 электропоратора
прямоугольных импульсов с использованием блока игольчатых электродов, как описано в настоящем изобретении. Были использованы следующие электрические параметры: сила поля 1300 В/см, 6 импульсов по 99
мкс каждый с интервалом в 1 с.
Мышей наблюдали каждый день, и отмечали каждый смертельный случай и любые признаки патологического состояния. Через равные интервалы измеряли размеры опухоли и наблюдали регрессию/прогрессию опухолевого роста. Другая группа голых мышей с ксенотрансплантатом линии крупноклеточной карциномы легких также была подвергнута обработке схожим способом, как в случае Panc-3 опухолей.
На фиг. 10а и 10б показан анализ объема опухоли, определенного за период 43 дня после ЭХТ с использованием блеомицина для Panc-3 опухолей. Наблюдалось очень сильное различие между подвергнутыми и не подвергнутыми лечению мышами по показателю объема опухоли. После примерно 24 дней лечения существенно заметной опухоли не наблюдали. Результаты фиг. 10 также приведены ниже в таблице 1. Иллюстрация очевидной регрессии опухоли показана на фиг. 11.
Эксперимент с Panc-3 был повторен с применением опухолевой клеточной линии крупноклеточной карциномы легких (ККЛ), 177 (AntiCancer, San Diego, CA). Результаты были схожими с найденными для блеомицина и Panc-3, как показано на фиг. 12а и 12б. В одном эксперименте наблюдался рецидив опухоли, которая была повторно обработана на 27 день (фиг. 13), и через 7 дней опухоли не обнаружили.
Модели Panc-3 и ККЛ были использованы с лекарством неокарциностатином (НКС), следуя тем же процедурам, что обозначены выше. Как показано на фиг. 14а и 14б, предимпульсное введение НКС способом, схожим для опытов с блеомицином, вообще не было эффективно для уменьшения объема опухоли. Полагают, что из-за низкой изоэлектрической точки НКС электростатическое взаимодействие препятствовало входу лекарства в опухолевую клетку. Поэтому эксперимент был повторен с подачей импульса в начале и пост-импульсным инъецированием НКС.
Фиг. 14в показывает начальный объем опухоли (I) по сравнением с конечным объемом опухоли (F) на 13 день после лечения 7 мышей (мыши 1-7). У нескольких мышей (1, 2, 4 и 7) наблюдали увеличение объема опухоли, но это, вероятно, связано с эдемой. Однако, как показано на фиг. 14г, когда отдельную группу из 5 мышей проверяли на 23 день, то все мыши показали заметное уменьшение объема опухоли.
Сравнение фиг. 14а и б с 14в и г показало, что лечение НКС с пост-импульсом было более эффективно, чем предимпульсное введение НКС.
Выводы
Настоящие примеры показывают возможность эффективного лечения низкодифференцированной опухоли поджелудочной железы (Panc-3) и крупноклеточной опухоли легких (ККЛ),
подкожно ксенотрансплантированных голым мышам, по электрохимиотерапевтическому протоколу с применением блеомицина или НКС и игольчатых электродов. Другие аналогичные химиотерапевтические агенты также
могут быть эффективны с применением способа по изобретению.
Результаты показали, что полная регрессия Panc-3 опухоли достигнута у 60% в обработанной группе без видимой прощупываемой опухоли даже через 77 дней после однократной обработки. Частичную регрессию (80% уменьшение объема опухоли) наблюдали в 30% случаев, и только в 10% не было реакции (табл.2).
Гистологическое изучение ясно показало сильный некроз в районе опухоли для группы, подвергавшейся ЭХТ, в то время как в контрольной группе некроза не было. Внутриопухолевая инъекция лекарства большим объемом блеомицина в сочетании с "веерным" способом для максимально равномерного распределения лекарства по объему опухоли, оказалась очень эффективной по сравнению с обычным способом инъекции лекарства до подачи импульса.
Хотя настоящее изобретение описано на основе предпочтительного варианта выполнения, нужно понимать, что возможны различные модификации без отхода от основной идеи изобретения. Соответственно, данное изобретение ограничено лишь приведенными пунктами формулы изобретения.
Реферат
Изобретения относятся к лечению заболеваний людей и других млекопитающих, в частности к способам и устройствам по применению регулируемых электрических полей для введения in vivo генов и фармацевтических соединений в живые клетки пациента путем электропорации. Техническим результатом является повышение эффективности лечения и удобство в эксплуатации используемых для лечения средств. Изобретение использует устройство для наложения электрических полей на выбранный участок живого тела, включающее опорные средства, блок электродов, установленных на опорных средствах, по меньшей мере часть электродов выполнена в форме игл для проникновения в ткань, и электрический импульсный генератор, выполненный с возможностью подачи электрических импульсных сигналов высокой амплитуды на электроды для электропорации клеток, находящихся между ними, причем блок электродов состоит из противоположных пар электродов, установленных на опорных средствах на расстоянии друг от друга, а генератор имеет средства для избирательной подачи на электроды сигналов, параметры которых пропорциональны расстоянию между электродами, при этом средства переключения выполнены с возможностью подачи сигналов на противоположные пары электродов. Способ электропорации для введения молекул в клетки с использованием импульсного генератора высокоамплитудных электрических сигналов и блока нескольких электродов, выполненных в форме игл для проникновения в ткань, включает введение молекулярного раствора в ткань, установку электродов с возможностью размещения между ними выбранной ткани, введение их в ткань и подключение электродов к генератору, параметры сигналов которого выбирают пропорционально расстоянию между электродами, причем подключают к генератору противоположные пары электродов. 2 с. и 24 з.п. ф-лы, 2 табл., 24 ил.
Формула
Документы, цитированные в отчёте о поиске
Система для клинического применения электропорации с обратной связью, управляющей напряжением

Комментарии