Устройство и способ для электростимуляции - RU2438732C2
Код документа: RU2438732C2
Чертежи
Описание
Изобретение относится к устройству и способу для электростимуляции.
В нейрофизиологии известен H-рефлекс или рефлекс Гофмана, который хотя и представляет собой рефлекс, очень сходный с моносинаптическим рефлексом, сопровождающим механическое вытяжение мышцы, может быть вызван также электростимуляцией, производимой на уровне афферентной иннервации. В недалеком прошлом проведены широкие исследования H-рефлекса человека, так как его свойства позволяют получать полезную информацию для определения спинномозговой возбудимости человека как в физиологическом, так и патологическом состояниях. В частности, модуляцию H-рефлекса изучали после тяжелых клинических проявлений гетерогенной группы патологий, содержащих мышечную спастичность, дистонию и фибромиалгию. При некоторых патологиях усиление спинномозгового возбуждения на уровне единственного метамера или нескольких метамеров считается патофизиологическим общим знаменателем, который активизируется разнообразными центральными и периферическими воздействиями, и спинномозговое возбуждение человека можно исследовать in vivo путем точной оценки H-рефлекса как в плане латентности, так и в плане амплитуды рефлекса по отношению к дозированной стимуляции. H-рефлекс можно определить как простейший из спинномозговых рефлексов и можно вызывать электростимуляцией афферентных волокон типа la, содержащихся в окончаниях мышечных веретен. За упомянутой стимуляцией следует распространение вызванного разряда по афферентным путям в спинной мозг, создание синхронизированного возбуждающего постсинаптического потенциала, который достаточен для разряда двигательных нейронов соответствующей группы, с распространением рефлекторного разряда вдоль аксонов двигательных альфа-нейронов в мышцу. Возбудимость спинномозговых двигательных нейронов зависит непосредственно от нисходящего пути центральной нервной системы под системным воздействием, которое обычно находится на эндокринном уровне и переносится циркулирующими нейротрансмиттерами выроста периферической рефлекторной дуги. Измерение минимальной латентности H-волны, в сочетании с амплитудой, длительностью и пороговой величиной последней, обеспечивает информацию на уровне проводимости рефлекторной дуги. С другой стороны, амплитуда H-рефлекса позволяет непосредственно измерять количество двигательных альфа-нейронов, которые активировались синхронно, при модуляции разнообразными афферентациями. Слабое произвольное сокращение усиливает H-рефлекс, усиливает разряд группы двигательных нейронов, но изменяет латентность рефлекса. В непатологических условиях H-рефлекс можно записывать с камбаловидной мышцы при стимуляции большеберцового нерва и с лучевого сгибателя запястья при стимуляции срединного нерва низкочастотным стимулом.
Если рефлекторную реакцию воспроизвести невозможно, то это можно приписать афферентному нарушению или низкой возбудимости центральной нервной системы. Низкая возбудимость центральной нервной системы необязательно является признаком конкретной патологии, так как тест во время слабого мышечного сокращения может выявить интактный рефлекторный путь с нормальной латентностью. В литературе сообщается о различных попытках снижения гипервозбудимости двигательного нейрона посредством чрескожной электростимуляции (TENS), но не существует согласованного мнения относительно влияния последней на рефлекс Гофмана.
Спинномозговая возбудимость регулируется многими воздействиями, которые можно кратко классифицировать как вышеупомянутые спинномозговые, системные (обусловленные гормонами и циркулирующими нейротрансмиттерами), проприоспинальные (через интраспинальные соединительные пути) или периферические рефлекторные воздействия.
Периферические рефлекторные воздействия, в свою очередь, содержат комбинацию рефлекторных дуг, которые являются как моносинаптическими, так и олиго- или мультисинаптическими и объединяются на определенном уровне спинальной иннервации (метамерном). Периферические афферентации приходят из центрального отростка клеток спинальных ганглиев. Периферический отросток соединяется с разнотипными рецепторами: мышечными веретенами, сухожильными рецепторами, суставными рецепторами и кожными рецепторами различных типов. В частности, афферентации мышечных веретен (волокон la) являются афферентациями, которые определяют самые непосредственные связи с группой двигательных альфа-нейронов, взаимодействующих в процессе так называемого «моносинаптического рефлекса Шеррингтона». Хотя модель рефлекса Шеррингтона по-прежнему является объектом обсуждения, можно утверждать, что, когда мышца вытягивается, первичные чувствительные волокна, т.е. афферентные нейроны группы la мышечных веретен, реагируют как на скорость, так и на степень вытяжения и передают информацию на спинальном уровне. С другой стороны, вторичные чувствительные волокна, т.е. афферентные нейроны группы II, определяют и передают в центральную нервную систему (CNS) только такую информацию, которая относится к степени вытяжения. Данная информация передается моносинаптически в двигательный альфа-нейрон, который активизирует экстрафузальные волокна, чтобы ослабить вытягивание, и передается полисинаптически, посредством промежуточного нейрона, в другой двигательный альфа-нейрон, который тормозит сокращение, в мышце-антагонисте. Кроме того, в то же самое время CNS может влиять на афферентации мышечных веретен во время движения через двигательные гамма-нейроны двух типов, известных под названием статических и динамических двигательных нейронов. Таким образом, мышечное веретено можно определить как самый важный проприорецептор, выполняющий фундаментальную функцию в движении и регуляции рефлекторной активности. Комбинированный сигнал, приходящий из множества мышечных веретен каждой мышцы, снабжает CNS информацией и, тем самым, производит точную настройку и, следовательно, выполняет что-то вроде сервоуправления. В то же самое время мышечные веретена непрерывно управляются гамма-нейронами, которыми CNS управляет отдельно от двигательных альфа-нейронов при управлении всеми мышечными функциями. Интрафузальные волокна обычно возбуждаются стимуляцией ниже экстрафузального двигательного порога: как только двигательный порог превышается, мышечное сокращение активизирует сухожильные рецепторы, которые вызывают эффект мышечных веретен.
В публикации WO 02/09809 предложено устройство для лечения мышечных, сухожильных и сосудистых патологий, посредством которого к пациенту подводят стимуляцию, при этом упомянутая стимуляция содержит последовательность электрических импульсов, имеющих длительность в пределах от 10 до 40 микросекунд и интенсивность, которая допускает регулирование в зависимости от импеданса и проводимости ткани и находится в пределах от 100 до 170 микроампер.
В публикации WO 2004/084988 предложено устройство для электростимуляции, с помощью которого, в зависимости от типа производимой электростимуляции и принятых параметров конфигурации, можно осуществлять индуцируемую биоактивную нейромодуляцию, которая подходит для создания вазоактивных феноменов в микрокругах и макрокругах кровообращения. Данные феномены, в свою очередь, переносятся медиаторными феноменами, связанными с непосредственной стимуляцией гладкой мышцы, и, по существу, катехоламинэргическими феноменами, путем стимуляции постсинаптических рецепторов. Вышеупомянутое устройство способно формировать специальные стимулирующие последовательности, которые вызывают воспроизводимые и постоянные нейрофизиологические реакции. В частности, в публикации WO 2004/084988 описана активизирующая последовательность для активизации микрокруга кровообращения (ATMC) и релаксационная последовательность для релаксации мышечного волокна (DCTR), которые могут стимулировать различные функциональные группы, включая поперечно-полосатую мышцу, гладкую мышцу и периферический смешанный нерв. Вышеописанные стимулирующие последовательности включают три основных параметра: длительность стимуляции, частота стимуляции и временные интервалы, в течение которых следуют комбинации длительностей/частот стимуляции. Общая рабочая модель стимулирующих последовательностей отражает цифроаналоговое преобразование, которое происходит при передаче нервного импульса.
Нейронная электростимуляция посредством модуляции частоты и амплитуды или FREMSTM (Система частотной ритмической электрической модуляцииTM), описанная в вышеупомянутых публикациях WO 2004/084988 и WO 2004/067087, (включенных в настоящую заявку для ссылки), отличается применением чрескожных электрических токов, которые формируются с помощью последовательных электрических импульсов, имеющих переменную частоту и длительность. Частота может изменяться от 0,1 до 999 Гц, длительность стимуляции находится в пределах от 0,1 до 40 мкс, и напряжение, которое постоянно выдерживается выше порога восприятия, находится в пределах от 0,1 до 300 В (предпочтительно 150 В). Путем подходящего сочетания вышеупомянутых изменений частоты и длительности получают конкретную последовательность, именуемую DCTR, оказывающую релаксационное действие и содержащую ряд подфаз, называемых A, B и C. В подфазе A частота и длительность являются постоянными, в подфазе B частота является постоянной и длительность является регулируемой, в подфазе С частота является регулируемой и длительность является постоянной.
Экспериментальные исследования позволили оценить воздействия FREMS и оценить способность данной системы вызывать составные потенциалы действия мышцы (cMAP), которые достижимы в мышце, приводящей большой палец стопы, путем стимуляции заднего большеберцового нерва, а также изменение амплитуды вышеупомянутого H-рефлекса при использовании последнего в качестве обуславливающего стимула. Как описано в публикации WO 2004/084988, вышеупомянутые экспериментальные исследования показали также, что максимальная амплитуда cMAP, которая достижима (0,60 ± 0,02 мВ), приблизительно в 15 раз меньше, чем максимальные амплитуды cMAP, получаемые с известными устройствами, которые подводят ток TENS, т.е. амплитуды порядка 9 ± 0,6 мВ, со стимулами, имеющими длительность обычно в пределах 200-1000 мкс. Кроме того, замечено, что максимальное значение амплитуды cMAP получают при отношении длительности к частоте, равном 0,13 (40 мкс/29 Гц).
Последовательность дополнительного типа, обозначенная ATCM и соответственно разработанная для получения вазоактивного эффекта, оказывает превалирующее воздействие на моторику микрокруга кровообращения, т.е. гладкие сфинктеры артериол и венул подкожной ткани. Последовательность ATCM допускает деление на три подпоследовательности, называемые S1, S2, S3. Подпоследовательности S1 и S3 различаются по фазе повышения частоты, при неодинаковых временных режимах. Подпоследовательность S2 составлена, главным образом, для создания возможности изменения длительности отдельных раздражителей в постепенно расширяющемся частотном диапазоне таким образом, чтобы ослаблять биореакцию, пока последняя не стабилизируется. В частности, подпоследовательность S1, оказывающая релаксационное воздействие и, следовательно, оказывающая воздействие, которое очень близко напоминает воздействие последовательности DCTR, содержит фазы, в которых после первой адаптационной фазы, проводимой на частоте 1 Гц, постепенно повышают частоту при постоянной амплитуде и, тем самым, постепенно снижают биореакцию. Затем частоту повышают намного быстрее, пока она не достигает заданного значения 19 Гц. После этого выполняют подпоследовательность S2, которая, в свою очередь, допускает разделение на четыре фазы, обозначаемые S2-A, S2-B, S2-C и S2-D. В подпоследовательности S2 после фазы (S2-A), проводимой при постоянной частоте и с быстрым повышением амплитуды до момента 1 времени, частоту постепенно повышают, и, следовательно, биореакция быстро снижается до момента 2 времени (S2-B). С этого момента амплитуда устанавливается в исходное значение, с которого снова повышается при постоянной частоте до момента 3 времени (S2-C). Затем частота снова постепенно повышается, причем амплитуду выдерживают постоянной, и, следовательно, биореакция постепенно снижается до момента 3 времени 3 (S2-D). Таким образом, биореакцию регулируют лишенным непрерывности способом с формированием точек резкого изменения наклона, т.е. точек 1, 2 и 3. Как изложено в публикации WO 2004/084988, практически получают систему, вызывающую последовательность расширений сосудов и сужений сосудов, с последовательными усилениями и ослаблениями кровотока в микрокруге, окружающем зону стимуляции. Упомянутые расширения сосудов и сужения сосудов создают эффект «насоса», который, несомненно, формируется нейромодуляцией симпатической нейровисцеральной системы, которая влияет на вазоэффект через гладкую мышцу капиллярных сосудов и артериол. Таким образом, можно показать, что данная последовательность, которая отличается чередующимися изменениями реобазы, производит, по этой причине, вазоактивное действие, состоящее из последовательных фаз расширения сосудов и фаз сужения сосудов. Это, несомненно, производит дренирующее действие и, прежде всего, придает микрокругу упругость и модулирует последнюю относительно основной несущей волны, которая определяет ее среднее изменение.
Задачей изобретения является усовершенствование известного устройства для электростимуляции.
Другой задачей является создание устройства для электростимуляции, которое позволяет лечить мышечную гипервозбудимость пациента спинномозгового и/или церебрального происхождения.
Дополнительной целью является создание устройства и способа для электростимуляции, которые позволяют лечить мышечную гипервозбудимость пациента спинномозгового и/или церебрального происхождения.
В соответствии с первым аспектом изобретения предлагается устройство для электростимуляции, содержащее генерирующее средство для генерации электрических импульсов, организованных в последовательности, имеющих предварительно установленные значения типичных параметров, при этом упомянутые типичные параметры включают амплитуду, длительность и частоту упомянутых импульсов, множество каналов стимуляции, чтобы подавать упомянутые последовательности независимо в зоны тела организма, регулирующее средство, пригодное для регулирования, по меньшей мере, одного из упомянутых типичных параметров таким образом, чтобы, по существу, препятствовать привыканию упомянутого организма к упомянутым электрическим импульсам.
В соответствии со вторым аспектом изобретения предлагается способ электростимуляции организма, содержащий следующие этапы:
- формируют последовательность электрических импульсов, оказывающих релаксационное действие, и дополнительную последовательность электрических импульсов, оказывающих вазоактивное действие;
- подают упомянутую последовательность в зоны тела упомянутого организма и дополнительно подают упомянутую дополнительную последовательность в дополнительные зоны тела упомянутого организма, при этом упомянутые зоны тела и упомянутые дополнительные зоны тела содержат мышцу-агонист и мышцу-антагонист нервно-мышечного отдела, содержащегося в упомянутом организме.
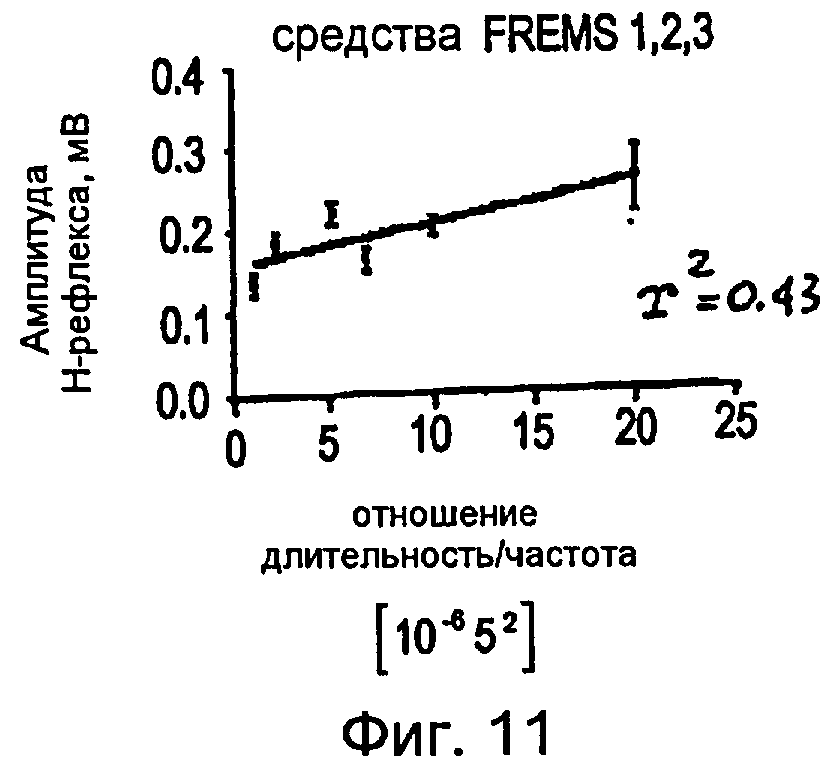
Основой для представленных аспектов изобретения служит новый нейрофизиологический эффект, который был обнаружен во время недавних экспериментальных исследований, проведенных с вышеупомянутой FREMS. Фактически, данные исследования показали, что амплитуда H-рефлекса, снимаемого с ипсилатеральной камбаловидной мышцы с применением или без обработки FREMS, подаваемой в короткую мышцу, приводящую большой палец стопы, значительно уменьшается (на величину, равную 50%) во время стимуляции FREMS. Изменение амплитуды H-рефлекса во многом зависит от изменений отношения длительности импульса к частоте стимуляции (w/f), в частности, во время подфазы C (r2 = 0,43; p<0,001). Данный результат предполагает, что FREMS действительно позволяет модулировать амплитуду H-рефлекса, весьма вероятно, посредством активного вовлечения мышечных веретен.
Данные результаты обеспечили возможность создания нового устройства для электростимуляции, посредством которого можно выполнять новый способ электростимуляции для лечения спинномозговой гипервозбудимости, которая является вторичной к повреждению головного или спинного мозга и является причиной спастичности пациента. Новое устройство для электростимуляции позволяет подавать вышеупомянутую FREMS, с использованием разных последовательностей одновременно в два антагонистических нервно-мышечных участка двигательного сегмента, которые связаны с одним и тем же метамером и взаимосвязаны через контур (цепь) афферентный нейрон/промежуточный нейрон/двигательный альфа-нейрон. Таким образом, возможно создание синергического эффекта, который препятствует гипертоническому сокращению, которое обычно обусловлено дисфункцией центрального двигательного нейрона и потому характерно для спастических феноменов, которые являются вторичными к повреждению головного или спинного мозга центральной нервной системы. Настоящее изобретение можно лучше понять и реализовать после изучения прилагаемых чертежей, которые иллюстрируют примерный, но не ограничивающий вариант осуществления изобретения, и на которых:
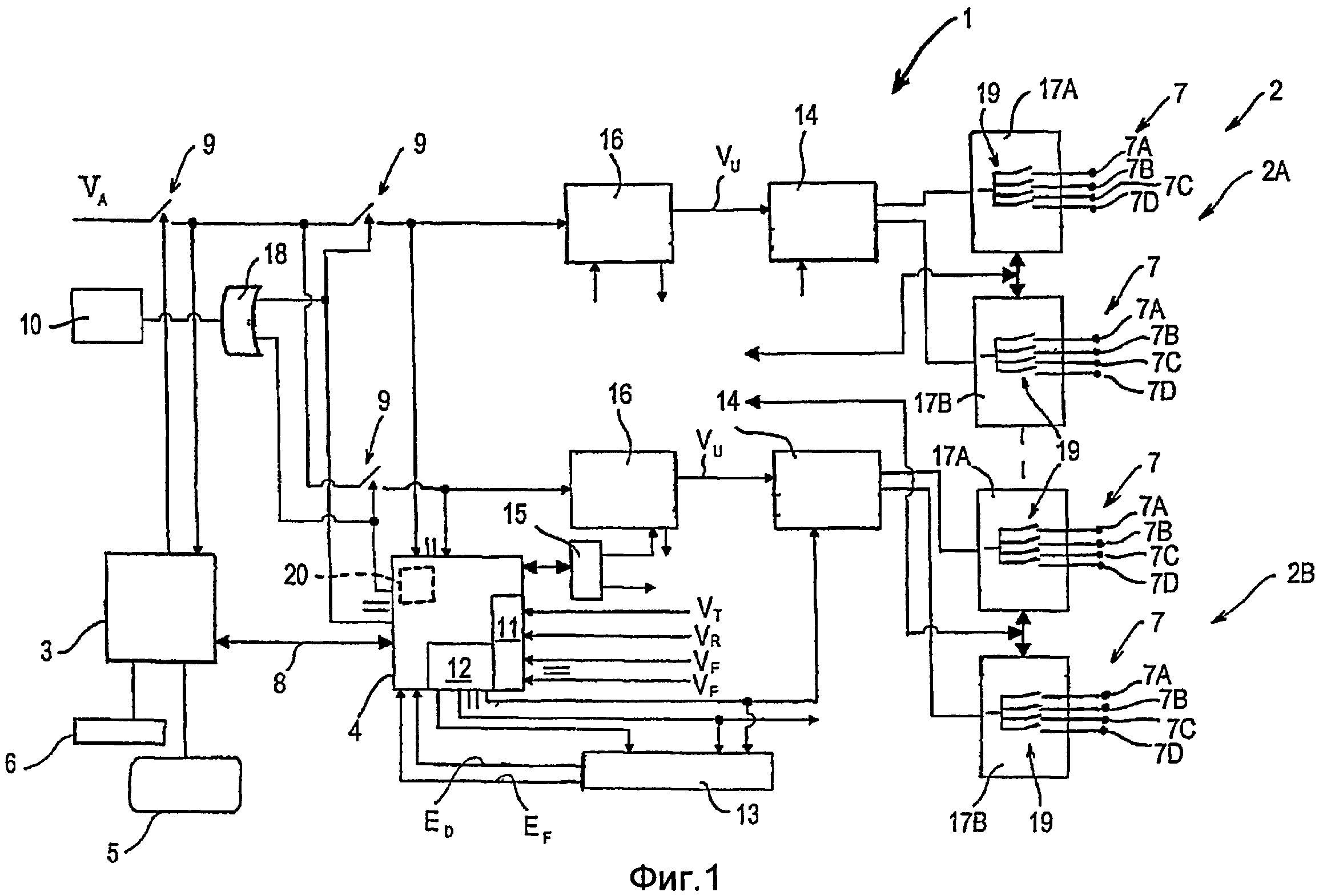
Фигура 1 - блок-схема, иллюстрирующая устройство для электростимуляции, содержащее множество независимых каналов стимуляции;
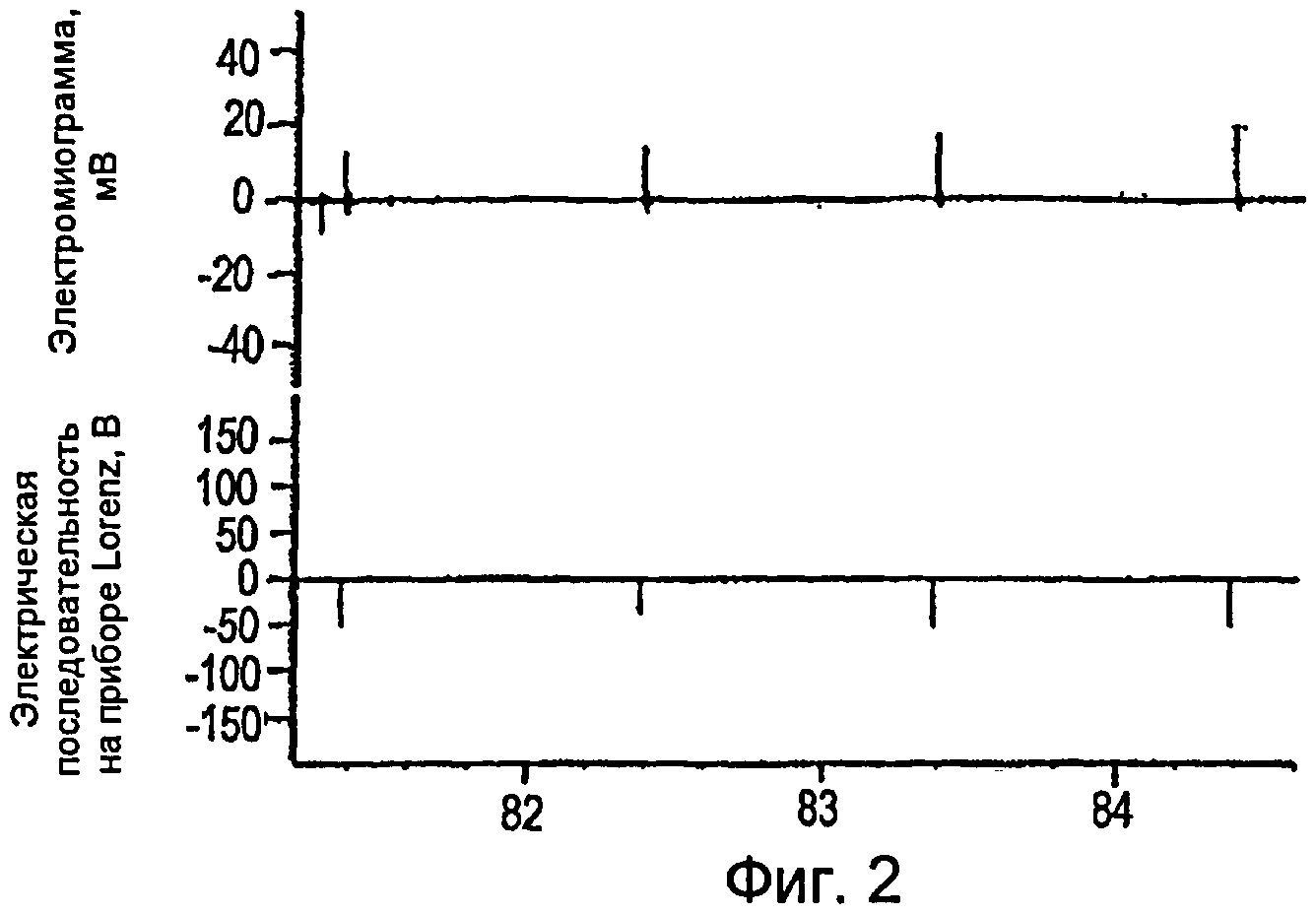
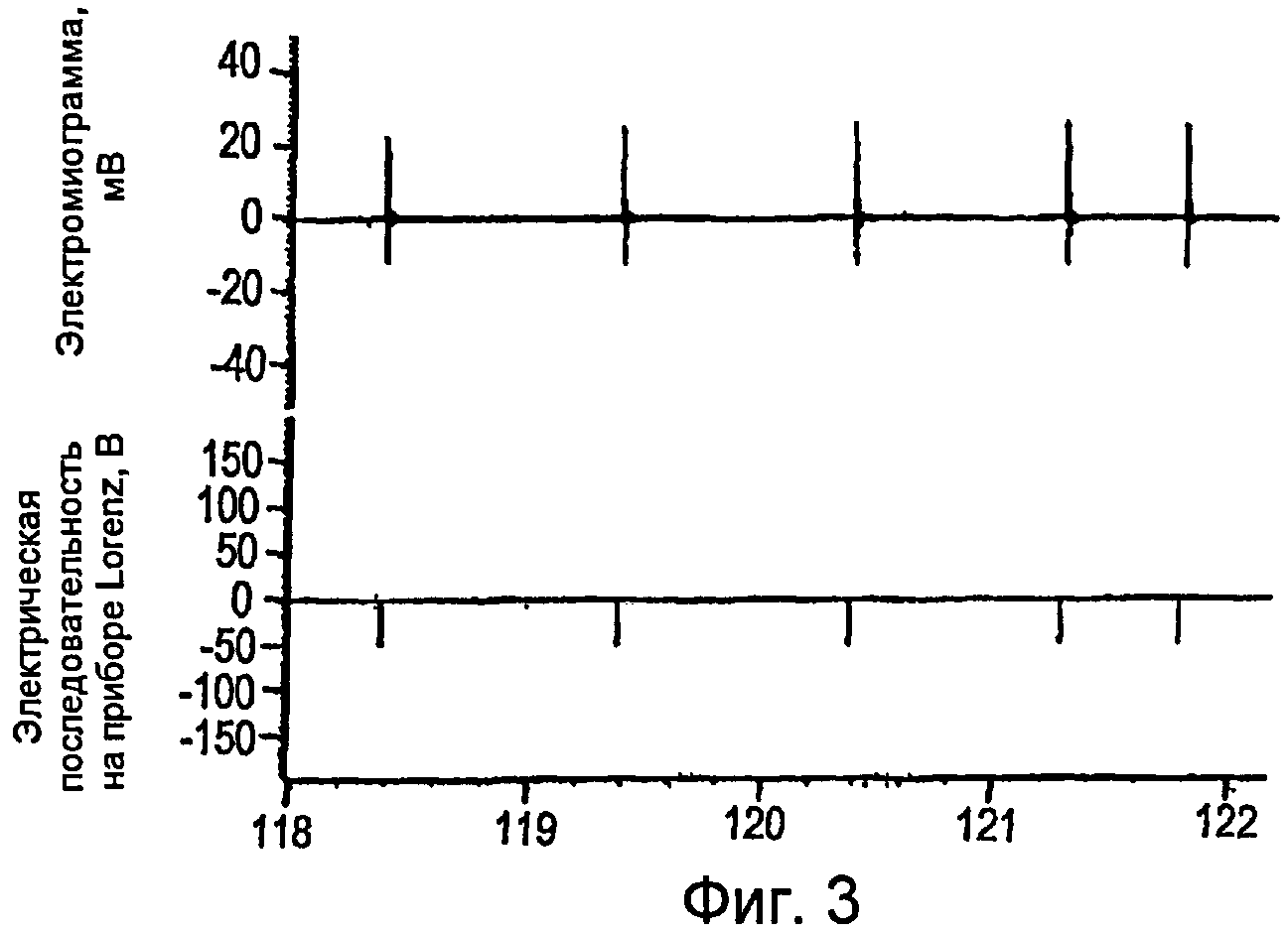
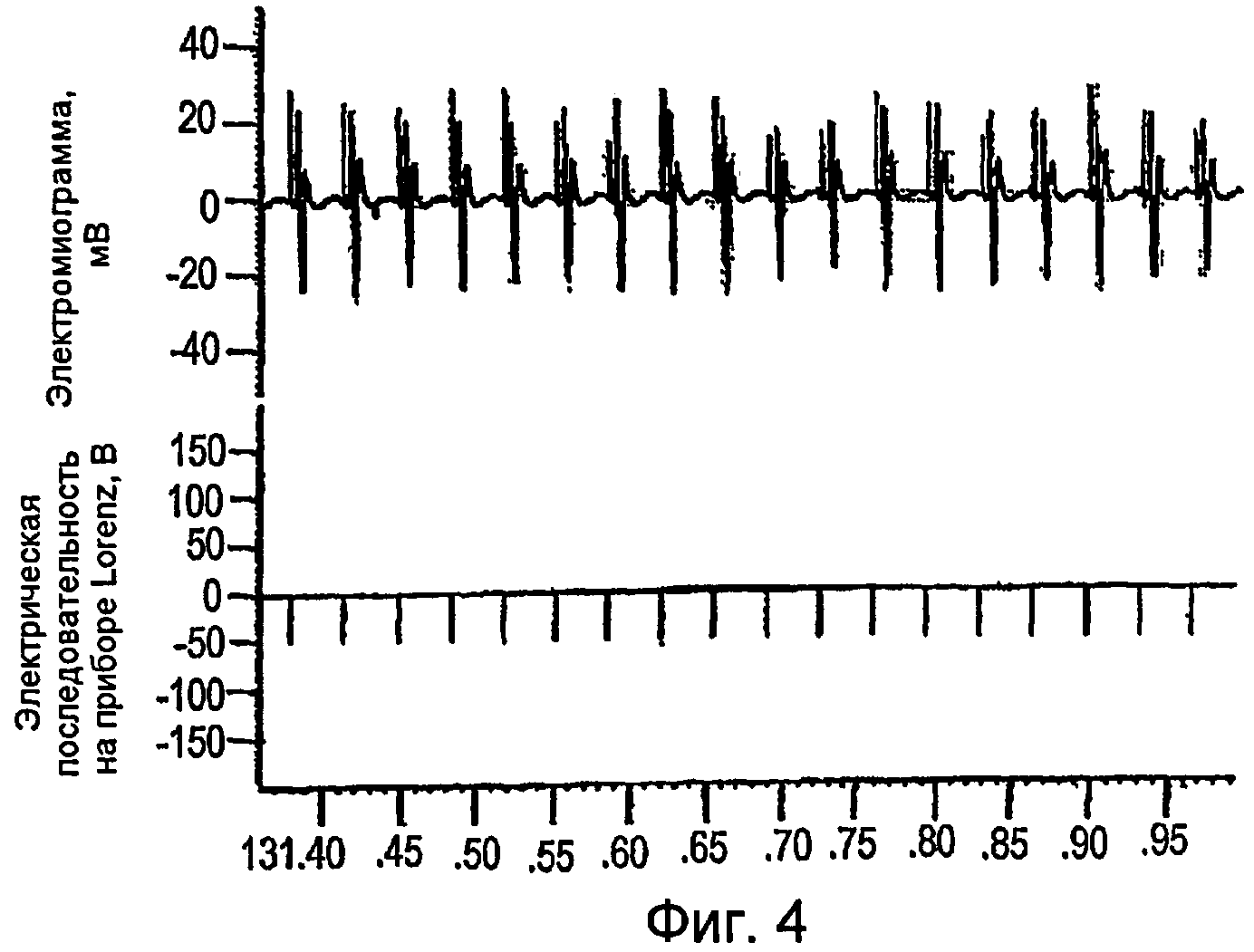
Фигуры 2-4 - электромиограммы, иллюстрирующие создание cMAP в мышце, отводящей большой палец стопы, получаемого путем стимуляции заднего большеберцового нерва последовательностями DCTR;
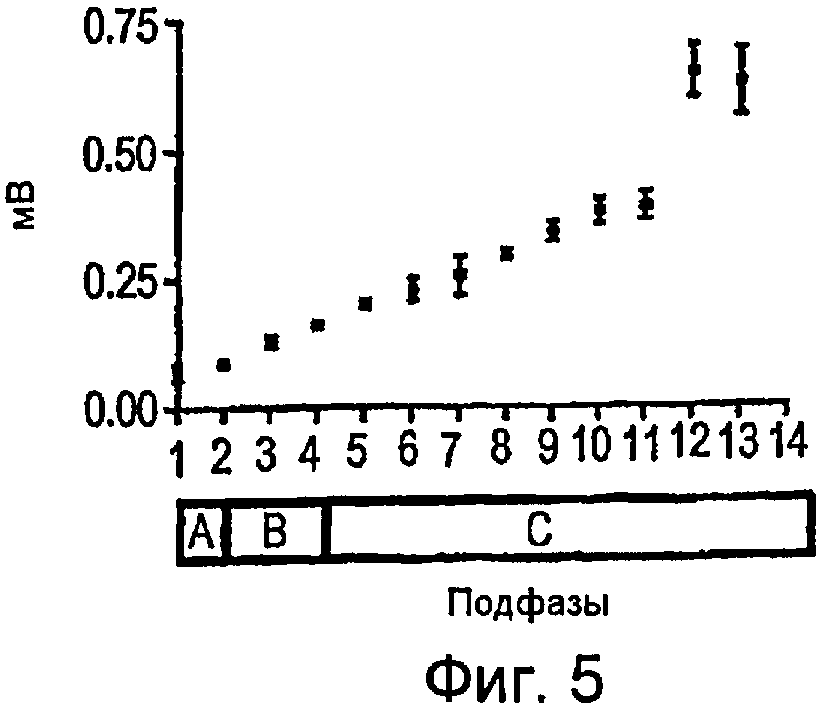
Фигура 5 - график зависимости разности потенциалов от времени в прямоугольной системе координат, где показано изменение значения cMAP в течение подфаз A, B и C последовательности DCTR;
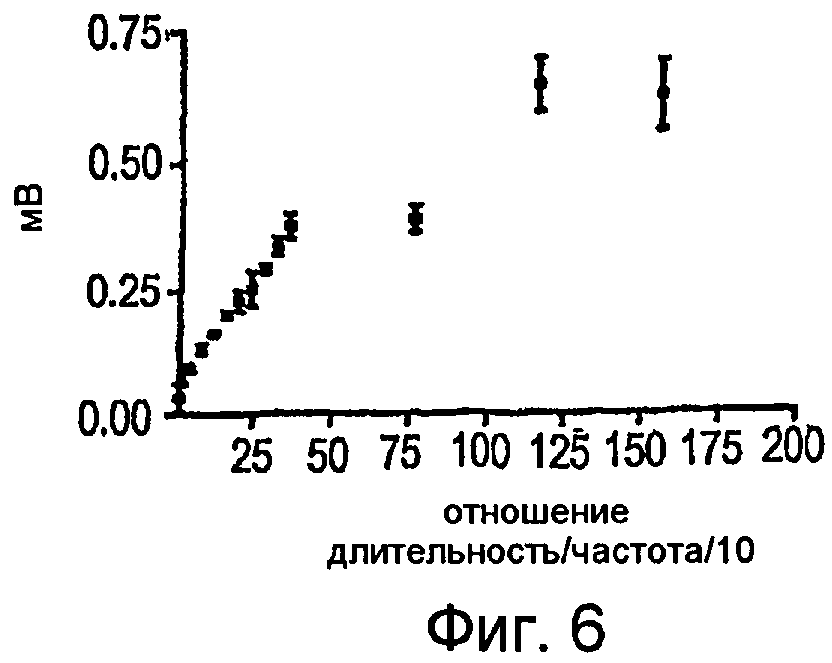
Фигура 6 - график зависимости разности потенциалов от отношения длительности импульсов и частоты импульсов в прямоугольной системе координат, где показано изменение значения cMAP во время подачи последовательности DCTR:
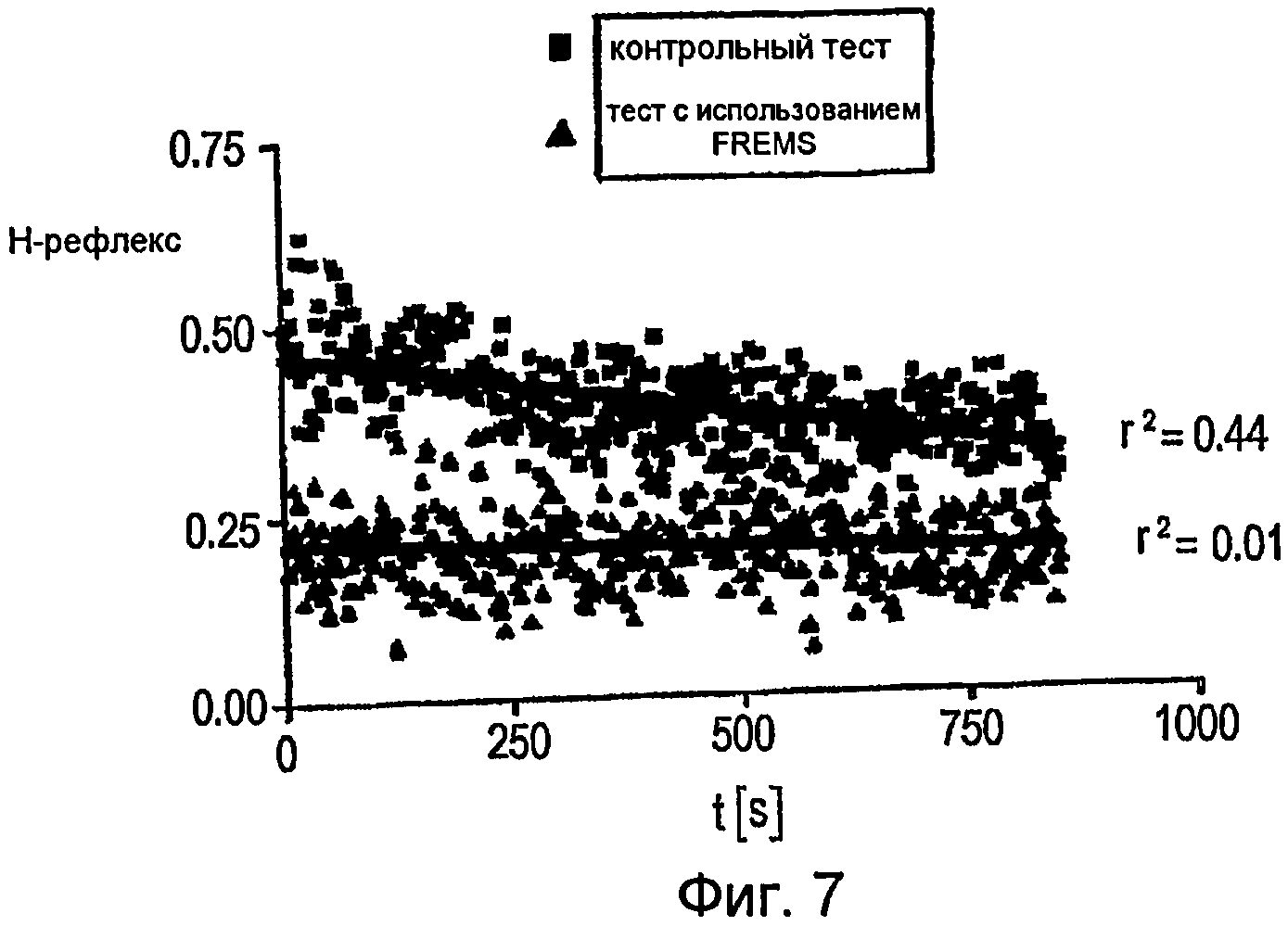
Фигура 7 - график, показывающий амплитуду H-рефлекса в присутствии или в отсутствие стимуляции FREMS;
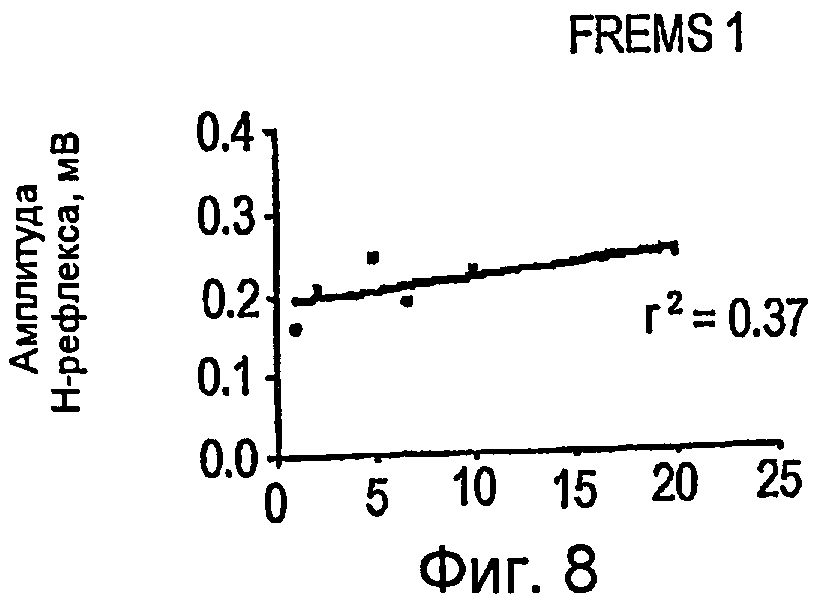
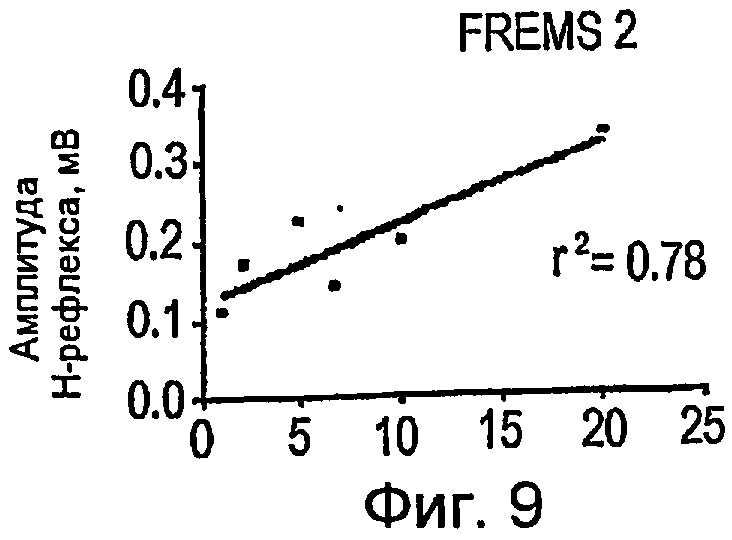
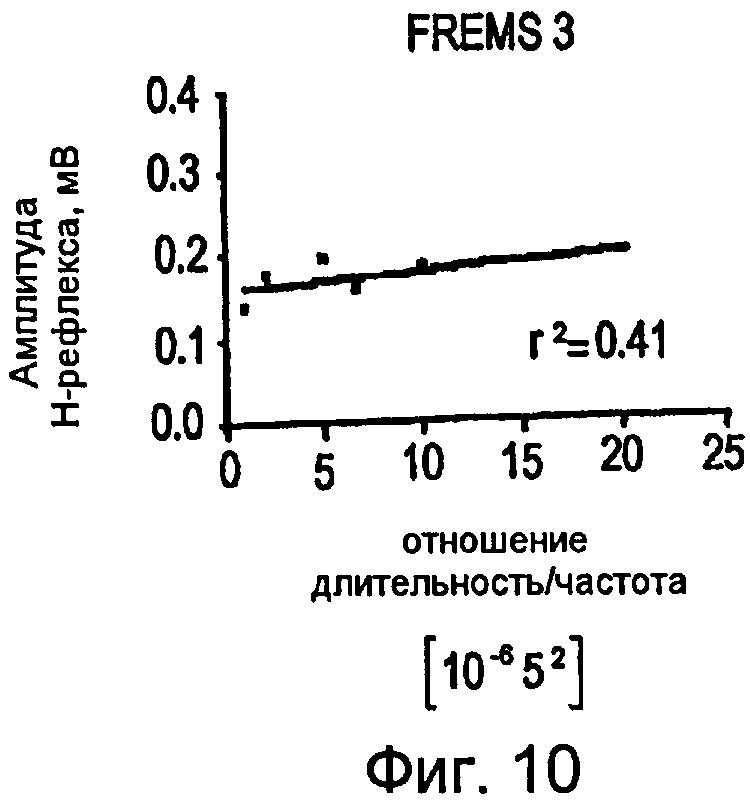
Фигуры 8-10 - графики в прямоугольной системе координат, иллюстрирующие изменение амплитуды H-рефлекса в зависимости от изменения отношения длительности импульсов и частоты импульсов, во время трех сеансов стимуляции FREMS;
Фигура 11 - график в прямоугольной системе координат, иллюстрирующий средние изменения амплитуды H-рефлекса в зависимости от изменений отношения длительности импульсов и частоты импульсов, при измерении во время трех стимуляций FREMS, показанных на фигурах 8-10.
На фигуре 1 схематично показан набор схем, содержащихся в устройстве 1 для электростимуляции, которое может формировать и подавать вышеупомянутые (релаксационные) последовательности DCTR и (вазоактивные) последовательности ATMC, входящие в стимуляцию FREMS, посредством множества независимых каналов 2 стимуляции, каждый из которых сформирован множеством пар чрескожных электродов 7.
В варианте осуществления устройства 1, показанного на фигуре 1, обеспечены четыре канала 2 стимуляции, из которых только два показаны (для наглядности) и обозначены позициями 2A, 2B.
В варианте осуществления, который не показан, обеспечено устройство 1, имеющее количество каналов 2 стимуляции, которое больше четырех.
В другом варианте осуществления, который не показан, обеспечено устройство 1, имеющее количество каналов 2 стимуляции, которое меньше четырех.
Устройство 1 содержит первый блок 3 управления и второй блок 4 управления, которые взаимодействуют между собой и выполнены в виде микропроцессоров известного типа. Первый блок 3 управления управляет дисплейным устройством, например жидкокристаллическим дисплеем 5, и буквенно-цифровой клавиатурой 6. Путем манипуляций клавишами последней пользователь устройства 1 может управлять работой последнего и устанавливать параметры, которые отображаются на дисплее 5, для электростимуляций, которыми требуется воздействовать на пациента.
В варианте осуществления, который не показан, обеспечено устройство дистанционного управления, с помощью которого пациент, подсоединенный к устройству 1, может управлять работой последнего без взаимодействия с клавиатурой 6. Данный вариант осуществления особенно полезен ввиду того, что он позволяет пациенту управлять устройством 1 благодаря выполнению функции чувствительного элемента обратной связи, связанного с, по меньшей мере, одним рабочим параметром устройства 1. Первый блок 3 управления управляет предохранительным выключателем 9, который, в свою очередь, управляет входным питающим напряжением VA. В нормальном рабочем режиме выключатель 9 замкнут, и тогда в регулятор 16 напряжения (функцию которого описана ниже), который содержится в каждом канале 2 стимуляции, подается питание. В аварийном режиме, например в случае неисправности устройства, первый блок 1 управления размыкает выключатель 9 и, тем самым, прекращает подачу питания в регулятор 16 напряжения. К второму блоку 4 управления дополнительно подсоединено устройство подсветки, например LED (светодиод) 10, известного типа. Когда пациент подсоединен к устройству 1 с помощью электродов 7 и устройство 1, питаемое напряжением VA, осуществляет электростимуляцию пациента, LED 10 высвечивается и, тем самым, указывает, что пациент подвергается воздействию электрического тока.
Первый блок 3 управления подсоединен через последовательный связный интерфейс 8 связи известного типа ко второму блоку 4 управления, который управляет формированием электрических импульсов посредством регулировки их основных параметров, т.е. амплитуды, длительности и частоты, и содержит аналого-цифровой преобразователь (ADC) 11 и встроенный блок (ITU) 12 синхронизации. Во втором блоке 4 управления может содержаться средство 20 поддержки (которое показано пунктирными линиями), в котором записаны данные, которые необходимы для работы устройства 1, например данные, относящиеся к последовательностям стимуляции, которые могут быть сформированы устройством 1. Средство 20 поддержки допускает считывание средством обработки данных (которое не показано) известного типа, содержащимся в устройстве 1 или расположенным снаружи устройства 1 и сопряженным с последним. Средство обработки данных, в случае его присутствия в устройстве 1, может, например, находиться во втором блоке 4 управления.
В варианте осуществления, который не показан, средство 20 поддержки содержится в первом блоке 3 управления.
Аналого-цифровой преобразователь 11 получает сигнал обратной связи (в форме напряжения), относящийся к амплитуде импульсов, и вмешивается в работу путем осуществления регулировки и/или формирования предупредительного сигнала, если амплитуда импульсов, сформированных устройством 1, отличается от амплитуды импульсов, установленной пользователем. В частности, аналого-цифровой преобразователь 11 получает опорное напряжение VT, стабилизирующее работу аналого-цифрового преобразователя 11, дополнительное опорное напряжение VR, которое обеспечивает возможность контроля правильности работы аналого-цифрового преобразователя 11, и для каждого из каналов 2 стимуляции напряжение VF обратной связи.
Встроенный блок синхронизации 12 определяет длительность и частоту импульса посредством взаимодействия с устройством 13 регулирования синхронизации. Последнее регулирует длительность и частоту формируемого импульса и, если один или другой из данных параметров неточен, формирует и передает сигнал ED ошибки длительности и/или сигнал EF ошибки частоты, которые могут приостановить второй 4 блок управления.
Аналогично тому, что описано в связи с первым блоком 3 управления, второй блок 4 управления также управляет предохранительными выключателями 9, которые обеспечены в количестве, равном количеству каналов 2 стимуляции, содержащихся в устройстве 1. Предохранительные переключатели 9, управляемые первым блоком 3 управления и вторым блоком 4 управления, взаимодействуют между собой и с LED 10 через логический порт 18 типа «ИЛИ».
Электрические сигналы, задающие частоту и длительность импульса, формируются встроенным блоком 12 синхронизации и передаются непосредственно в генератор 14 выходных импульсов. Число генераторов 14 выходных импульсов, обеспеченных в устройстве 1, равно числу каналов 2 стимуляции. Длительность импульса задается и регулируется цифроаналоговым преобразователем (DAC) 15, сопряженным со вторым блоком 4 управления. Цифроаналоговый преобразователь 15 формирует множество электрических сигналов, задающих амплитуду импульсов для каждого отдельного канала 2, и каждый сигнал передается в регулятор 16 напряжения. Устройство 1 содержит несколько регуляторов 16 напряжения, число которых равно числу каналов 2 стимуляции. Выходное напряжение VU, значение которого находится в пределах от 0 до 300 В, формируется каждым регулятором 16 напряжения и передается в соответствующий генератор 14 выходных импульсов. Каждый генератор 14 выходных импульсов формирует импульс, обладающий заданными частотой и длительностью, и передает данный импульс в пару выходных селекторов 17A, 17B, к которым подсоединены электроды 7. Число обеспеченных пар выходных селекторов 17A, 17B равно числу генераторов 14 выходных импульсов, содержащихся в устройстве 1. Каждый выходной селектор 17A, 17B содержит множество переключателей 19, число которых равно числу электродов 7, подсоединенных к селектору, при этом при посредстве упомянутых переключателей сформированный импульс может попеременно передаваться в соответствующий электрод 7 или выключаться. В каждой паре выходных селекторов 17A, 17B электроды 7 функционально связаны так, чтобы формировать четыре пары, при этом электроды каждой пары обозначены соответственно позициями 7A, 7B, 7C и 7D. Электроды 7 каждой пары подсоединены к соответствующему выходному селектору 17A или 17B.
В варианте осуществления, который не показан, обеспечены выходные селекторы 17A, 17B, содержащие больше четырех пар электродов 7.
В другом варианте осуществления, который не показан, обеспечены выходные селекторы 17A, 17B, содержащие меньше четырех пар электродов 7.
Когда применяют устройство 1, то можно путем манипулирования переключателями 19 выбирать электроды 7, в которые следует передавать импульс, сформированный генераторами 14 выходных импульсов. Таким образом, можно независимо использовать как пары электродов 7A-7D, содержащиеся в, по меньшей мере, двух каналах 2 стимуляции, так и пары электродов 7A-7D, содержащиеся в одном канале 2 стимуляции.
Поскольку второй блок 4 управления способен при посредстве цифроаналогового преобразователя 15 и встроенного блока 12 синхронизации регулировать амплитуду, длительность и частоту импульсов, формируемых в каналах 2 стимуляции, независимо для каждого канала 2, то устройство 1 является таким, чтобы обладать возможностью заданным образом увеличивать число выходных импульсов и задавать между ними интервалы.
Кроме того, встроенный блок 12 синхронизации позволяет заданным образом увеличивать длительность выходного импульса. В частности, можно добиться процентного увеличения длительности импульса электростимуляции, которая проводится в ходе множества фаз, при этом после завершения упомянутых фаз длительность импульса остается постоянной. Процентное увеличение длительности импульса, длительность импульса и число фаз взаимно связано следующей формулой:
Ti(Nf)=T0×(1+I%)Nf
где:
Nf - число фаз;
Ti(Nf) - длительность импульса стимуляции в зависимости от числа фаз;
T0 - длительность исходного импульса стимуляции;
I% - процентное увеличение длительности импульса.
В варианте осуществления устройства 1, показанном на фигуре 1, достигаемое процентное увеличение I% равно 20%, 25%, 33%, 50%, и значения, отражающие Nf (т.е. число фаз), находятся в пределах от 0 до 9.
Встроенный блок 12 синхронизации дополнительно позволяет псевдослучайно изменять продолжительность периода времени, который проходит между двумя последовательными фазами. Таким образом, можно формировать последовательности стимуляции, в которых длительность импульсов изменяется пропорционально процентному увеличению случайным образом. Это позволяет предотвратить феномены биологической аккомодации, т.е. предотвратить привыкание стимулируемых тканей пациента к импульсам и, вследствие этого, снижение их чувствительности к импульсам.
В варианте осуществления устройства 1, показанном на фигуре 1, обеспечиваются, по меньшей мере, четыре периода времени, которые могут формироваться по правилу случайных чисел.
Чтобы предотвратить вышеупомянутые феномены биологической аккомодации, устройство 1 может в процессе работы изменять частоту и амплитуду импульсов. Частота, как упоминалось выше, регулируется встроенным блоком 12 синхронизации, тогда как амплитуда регулируется цифроаналоговым преобразователем 15.
Как изложено выше, предложен вариант осуществления устройства 1, оборудованного устройством дистанционного управления, при использовании которого пациент может выполнять функцию чувствительного элемента обратной связи по отношению к работе устройства 1. Фактически, пациенту можно дать соответствующие инструкции по изменению амплитуды во время лечения электростимуляцией путем воздействия на цифроаналоговый преобразователь 15 посредством устройства дистанционного управления, чтобы предотвратить вышеупомянутые феномены биологической аккомодации. Например, пациенту можно дать инструкции по изменению амплитуды импульса, когда импульс достигает максимального (субъективно) уровня допустимости. В качестве альтернативы, пациенту можно дать инструкции по изменению амплитуды импульса, когда импульс достигает порога чувствительности.
Во время применения устройство 1 подсоединяют к пациенту, пораженному спастическими феноменами, и используют, по меньшей мере, два раздельных канала 2 стимуляции, например вышеупомянутые каналы 2A и 2B, электроды 7 которых прикладывают, соответственно, к участку тела около конкретного эфферентного нерва гипертонической мышцы (мышцы-агонисте) и на дополнительном участке тела, содержащем соответствующую мышцу-антагонист. Затем гипертоническую мышцу стимулируют релаксационной последовательностью DCTR в то время, как мышцу-антагонист стимулируют вазоактивной последовательностью ATMC. Последняя последовательность допускает непосредственное мышечное стимулирование, а также взаимодействие с симпатическими афферентными нервами и афферентными нервами нейровегетативной системы, чтобы замыкать цепь, содержащую двигательный нейрон, промежуточный нейрон и афферентный нейрон. Вышеупомянутая сдвоенная, одновременная и дифференцированная стимуляция препятствует сокращению гипертонической мышцы-агониста и ритмически возбуждает двигательный нейрон, который синергически взаимодействует с гипотонической мышцей-антагонистом и, тем самым, вызывает взаимное угнетение через канал промежуточного нейрона. Вышеупомянутый эффект угнетения сокращения гипертонической мышцы получают стимуляцией последней последовательностью, которая подходит для вызова угнетения фазы H-рефлекса.
При необходимости путем использования подходящего числа каналов 2 стимуляции и поэтому подходящего числа пар электродов 7 можно одновременно стимулировать, по меньшей мере, три зоны тела пациента, в частности зоны 4, 8 или 16 тела. Импульсы, подаваемые в различные зоны тела, могут быть одинаковой частоты или нет и могут подаваться одновременно или с разнесением во времени, т.е. последовательно.
Если устройство 1 применяют для электростимуляции множества зон тела пациента, то во время лечения можно выбрать некоторое число зон тела и ограничиваться стимуляцией упомянутых зон. Упомянутый подход обеспечивают воздействием на второй блок 4 управления таким образом, чтобы исключить, в течение предварительно установленного периода времени, все каналы 2 стимуляции, кроме тех, которые относятся к зонам тела, которые желательно стимулировать.
Все параметры, относящиеся к рабочим режимам устройства 1, включая вышеупомянутый режим стимуляции «предпочтительных зон», могут быть записаны в вышеупомянутом средстве 20 поддержки, что допускает, тем самым, программирование работы устройства 1.
Далее представлены экспериментальные результаты, которые привели к созданию вышеописанного устройства 1 для электростимуляции и в дальнейшем получили подтверждение в клинических экспериментах.
Чтобы подтвердить возможность применения стимуляции FREMS в ходе лечения мышечной гипервозбудимости спинномозгового и/или церебрального происхождения, применяли последовательности электрических импульсов вышеупомянутого типа DCTR, которые формировали устройством LorenzTM для электростимуляции. В данных последовательностях DCTR последовательные изменения длительностей (в пределах от 10 до 40 мкс) и изменения частоты (в пределах от 1 до 39 Гц) могут вызывать составные потенциалы действия (cMAP), при подаче вдоль двигательного нерва мышцы, аналогично тому, что происходит при вовлечении произвольно сокращающихся мышц посредством временного сложения. В частности, планировалось оценить возможность влияния на двигательную спинномозговую активность посредством разного регулирования активизации мышечных веретен различных типов. С этой целью оценивалось изменение амплитуды H-рефлекса, который получали его возбуждением между камбаловидной мышцей и мышцей, приводящей большой палец ноги, каждая из которых частично иннервирована на уровне первого крестцового позвонка (S1).
Как показано на фигурах 4-6, cMAP можно получать в мышце, приводящей большой палец ноги, стимулированием заднего большеберцового нерва последовательностями DCTR. Максимальная величина cMAP, измеренная в виде полной амплитуды сигнала или RMS (его среднеквадратического значения) (0,60 мВ ± 0,02), была приблизительно 15 раз меньше, чем амплитуда cMAP, получаемая электрическими стимуляторами TENS известного типа, которые используют стимулы, имеющие длительность 200-1000 мкс, и создают cMAP, величина которого равна приблизительно 9-10 мВ. Максимальную величину среднеквадратической амплитуды cMAP можно определить при отношении длительности к частоте (w/f), равном 0,13, значению, которое соответствует частоте импульсов 29 Гц и длительности стимула, равной 40 мкс. При дополнительном повышении частоты стимуляции до 39 Гц отношение длительности к частоте (w/f) снижается до 0,10 и величина среднеквадратической амплитуды cMAP немного уменьшается. Поскольку невозможно показать какую-нибудь корреляцию между абсолютной величиной отношения длительности к частоте (w/f) и среднеквадратической амплитудой cMAP, то можно предположить, что повышение cMAP связано с ходом последовательности DCTR и ненапрямую с абсолютной величиной отношения длительности к частоте (w/f).
На фигуре 7 показана амплитуда H-рефлекса в присутствии или в отсутствие стимуляции FREMS. В отсутствие последней H-рефлекс постепенно снижается с заметной линейной корреляцией (r2 = 0,44). В присутствии стимуляции FREMS амплитуда H-рефлекса снижается немедленно и остается на низком уровне, но без какой-либо корреляции (r2 = 0,01). Это демонстрирует возможность получения модуляции H-рефлекса при изменениях частоты (f) импульсов и длительности (w) импульсов, выраженных отношением длительности к частоте (w/f). Результаты показывают, что упомянутая стимуляция по описанной схеме вызывает непосредственную и воспроизводимую модуляцию возбудимости вовлеченных спинномозговых двигательных нейронов. Последовательность DCTR позволяет вовлекать cMAP таким образом, который аналогичен вовлечению нервно-мышечных соединений посредством последовательности постепенно возрастающих пиков. Полученный cMAP меньше, чем cMAP, который можно получить в традиционных нейрофизиологических режимах с импульсами длительностью > 100 мс. Что касается вышеупомянутого вовлечения cMAP посредством стимуляции FREMS, то следует также подчеркнуть наличие линейной тенденции в ходе повышения cMAP, которая связана с тенденцией постепенного увеличения длительности и частоты последовательности DCTR. Фактически, изменение отношения длительности к частоте (w/f) лучше описывает вклад обоих параметров переменных в интенсивность стимула, чем изменение только частоты (f) и длительности (w). Кроме того, можно определить, что корреляция между отношением длительности к частоте (w/f) и амплитудой H-рефлекса не носит линейного характера. Следовательно, можно утверждать, что амплитуда cMAP определяется не только интенсивностью стимула, но что большое значение имеет также временная последовательность стимуляции. Путем наложения чрескожных электродов устройства LorenzTM непосредственно на мышцу, приводящую большой палец стопы, при стимуляции вблизи мышцы, заведомо не идентичной стимуляции двигательного нерва, было показано, что данный режим стимуляции, который ниже двигательного порога, но последовательно упорядочен, может воздействовать на возбудимость спинномозговых двигательных нейронов.
Как показано на фигурах 8-11, во время подфазы C всех выбранных циклов FREMS стимуляции можно обнаружить сильную линейную корреляцию между амплитудой H-рефлекса и отношением длительности к частоте (w/f) (r2=0,43; P<0,001). Как ранее упоминалось, одной из наиболее важных систем для регулирования спинномозговой возбудимости является рефлекторный путь, который начинается от мышечных веретен и влияет на возбудимость группы двигательных альфа-нейронов посредством тормозных промежуточных нейронов. Предполагается, что электрическое вовлечение мышечной активности, при низкой интенсивности стимуляции, может быть более эффективным в процессе активизации мышечных веретен, чем всей поперечно-полосатой мышцы вслед за низким порогом активизации мышечных веретен. В отсутствие стимуляции FREMS амплитуда H-рефлекса демонстрирует самопроизвольное и постепенное ослабление, обусловленное обычным механизмом аккомодации. С другой стороны, во время стимуляции FREMS амплитуда H-рефлекса имеет тенденцию к сильному ослаблению в постоянной манере. Фазу B последовательности DCTR, фактически, отличают по увеличению длительности импульсов постоянной частоты; такой режим является режимом «тонической» и пропорциональной активизации, к которой мышечные веретена ядерной сумки проявляют наибольшую чувствительность. Можно предположить, что тенденция H-рефлекса во время подфазы B последовательности DCTR выражает преобладающее вовлечение веретен ядерной сумки. Во время подфазы C, с другой стороны, происходят быстрые и воспроизводимые колебания амплитуды H-рефлекса, линейно коррелированные с быстрым ростом частоты импульсов последовательности DCTR. Мышечные веретена с ядерной цепочкой предпочтительно активизируются высокочастотными и значительно изменяющимися стимулами. На основании предыдущих замечаний можно предположить, что фаза C последовательности DCTR, предпочтительно, является активной в отношении мышечных веретен с ядерной цепочкой. В конечной стадии фазы C амплитуда H-рефлекса снова демонстрирует повышение, хотя частота стимуляции достигает максимальной величины. Данный эффект является следствием стимуляции рецепторов Ib вследствие вытяжения сухожилий во время сокращения мышцы. Другое фундаментальное физиологическое следствие описанного анализа состоит в том, что эффект вызывает значительную устойчивость ослабления средней величины H-рефлекса даже после окончания стимуляции DCTR. Данная устойчивость подавления амплитуды рефлекса отражает адаптационное повышение активности спинномозговых ингибиторных систем, что ранее никогда не упоминалось в литературе.
Поскольку вышеизложенное выявило возможность создания новых методов терапии некоторых двигательных нарушений, которые отличаются аномальной возбудимостью двигательных нейронов, то вышеупомянутые гипотезы проверили проведением клинического эксперимента. Последний проводили на помещенных в стационар пациентах, страдающих патологиями центрального двигательного нейрона, например гемиплегией, параплегией, квадриплегией или спастическим тетрапарезом. Данные патологии бывали последствием ишемических феноменов, центральных геморрагических (нарушения мозгового кровообращения или травмы головы) феноменов или поражений спинного мозга.
Лечебный протокол состоял из одновременной стимуляции гипертонической мышцы последовательностями DCTR и мышцы-антагониста последовательностями ATMC. К лечению принимали должным образом предупрежденных пациентов, обладающих приемлемым ощущением пространства и времени и склонных к подходящему или активному сотрудничеству, не страдающих постоянным сокращением суставов и мышечно-сухожильными ретракциями 2-4 степеней по модифицированной шкале Ренкина (mRS). С другой стороны, исключались пациенты, имеющие измененное состояние сознания, пациенты, которые были не очень или совсем не склонны к сотрудничеству, пользователи кардиостимуляторов или имплантированных дефибрилляторов и пациенты, страдающие такими патологиями, которые не допускают применение электротерапии. Пациентов оценивали клинически на момент привлечения, в конце лечения и через 15, 30 и 45 суток после окончания терапии. Для функциональных оценок использовали специальные клинические шкалы: шкалу Ашворта, индекс A.D.L. (активности повседневной жизни по Бартелу), шкалу Ренкина, шкалу частоты спазмов, индекс Motricity, FIM (степень функциональной независимости). Приведенные клинические шкалы позволяют оценивать степень тонуса и мышечную спастичность пациента и дают последнему возможность выполнять двигательные функции в конечностях, независимо ходить и независимо осуществлять действия повседневной жизни (ADL). Для оценки боли применили шкалу VAS 0-100. Пациенты ежедневно проходили сеанс лечения на протяжении 15 последовательных сеансов. При первой оценке все пациенты имели спастическую гипертонию степени 2 по шкале Ашворта в мышцах нижних конечностей. В конце первого цикла терапии обнаружено ослабление гипертонии до средней оценки степени 1 по шкале Ашворта. Указанные результаты свидетельствуют о клинической эффективности вышеописанных способа и устройства для электростимуляции.
Реферат
Изобретение относится к медицине, а именно - к физиотерапии и неврологии. Устройство содержит генерирующее средство для генерации электрических импульсов, организованных в последовательности, имеющие предварительно установленные значения параметров. Параметры импульсов включают амплитуду, длительность и частоту. Последовательности подают независимо по каналам стимуляции в зоны тела организма. Устройство содержит также регулирующее средство, по меньшей мере, одного из упомянутых параметров для препятствия привыканию организма к электрическим импульсам, содержащее средство синхронизации и встроенный блок синхронизации для формирования процентного увеличения (I%) длительности импульсов, выдаваемых в переменном числе фаз. Процентное увеличение связано с числом фаз (Nf), длительностью Т0 исходного импульса стимуляции и длительностью Тi(Nf) импульса стимуляции формулой: Тi(Nf)=Т0×(1+I%)Nf. Способ электростимуляции осуществляют посредством устройства, при этом последовательность электрических импульсов оказывает релаксационное действие, дополнительно формируют дополнительную последовательность электрических импульсов, оказывающих вазоактивное действие. Сформированную последовательность подают в зоны тела организма, а дополнительную последовательность - в дополнительные зоны. Зоны тела и дополнительные зоны тела содержат мышцу-агониста и мышцу-антагониста нервно-мышечного отдела. По меньшей мере, один из параметров импульсов регулируют и формируют процентное увеличение (I%) длительности импульсов в соответствии с приведенной выше формулой. Средство поддержки, считываемое средством обработки данных, со
Формула
Ti(Nf)=T0·(1+I%)Nf.
- формируют последовательность электрических импульсов, оказывающих релаксационное действие, и дополнительно формируют дополнительную последовательность электрических импульсов, оказывающих вазоактивное действие;
- подают упомянутую последовательность в зоны тела упомянутого организма и дополнительно подают упомянутую дополнительную последовательность в дополнительные зоны тела упомянутого организма, при этом упомянутые зоны тела и упомянутые дополнительные зоны тела содержат мышцу-агониста и мышцу-антагониста нервно-мышечного отдела, содержащегося в упомянутом организме, отличающийся тем, что
- регулируют, по меньшей мере, один из параметров упомянутых импульсов, при этом упомянутые параметры включают амплитуду, длительность и частоту;
- формируют процентное увеличение (I%) упомянутой длительности упомянутых импульсов, при этом упомянутые импульсы выдаются в переменном числе фаз, и упомянутое процентное увеличение (I%) связано с числом фаз (Nf), длительностью Т0 исходного импульса стимуляции и длительностью Ti(Nf) импульса стимуляции, выраженной функцией от упомянутого числа фаз (Nf), в соответствии со следующей формулой Ti(Nf)=T0·(1+I%)Nf.
42 Способ по п.41, в котором этап упомянутого регулирования содержит регулирование упомянутой длительности упомянутых импульсов средством (12) синхронизации, содержащимся в упомянутом регулирующем средстве (12, 15).

Комментарии