Новые биополимеры, полученные облучением в твердой фазе в атмосфере ненасыщенных газов - RU2280038C2
Код документа: RU2280038C2
Чертежи
Описание
Область изобретения
Настоящее изобретение относится к новым продуктам; к способам их получения из сухих биологических полимеров (биополимеров) с использованием ионизирующего излучения в твердом (не жидком) состоянии в присутствии ненасыщенного газа в условиях специфических реакций, и к использованию этих продуктов.
Предпосылки изобретения
Специалистам в рассматриваемой области известно, что некоторые типы полимерных материалов подвергают облучению с целью решения ряда различных задач, хотя, насколько известно авторам, специалистам неизвестна обработка таких биополимеров излучением высоких энергий в присутствии опосредствующего газа, например ацетилена, с целью модификации биополимера таким образом, чтобы улучшить его свойства в одном или более из аспектов. Представляют интерес следующие патенты США: 3215634 (Walker); 4024073 (Shimizu); 4716224 (Sakurai); 4746514 (Warne); 4987222 (De Ambrosi); 5376692 (Park) и опубликованная иностранная заявка WO 96/03147 (Fidia,S.p.A), но они не являются значимо релевантными. Например, нигде в этих работах не сообщается об облучении полимерных материалов в твердом состоянии, включая Warne ('514), который действительно использует этиленсодержащие ненасыщенные соединения, но не в газообразном состоянии.
Sakurai ('224) раскрывает сшивку гиалуроновой кислоты с полифункциональными эпоксисоединениями в определенных условиях, но ни в одном из вариантов не упоминается использование ионизирующего излучения/ненасыщенных(алкеновых или алкиновых) газов.
Walker ('634) и Shimizu ('073) также раскрывают использование различных химических сшивающих агентов для получения продуктов - сшитых полисахаридов.
De Ambrosi ('222) раскрывает контролируемое получение низкомолекулярных глюкозаминогликанов в результате деполимеризации высокомолекулярных глюкозаминогликанов под действием гамма-излучения.
Предложение Warne ('514) направлено на обратную задачу. Warne раскрывает получение сшитых гидрогелей, обрабатывая полисахарид, со степенью высокомолекулярности, не более чем пентасахарид, ионизирующим излучением в присутствии этилен-ненасыщенных соединений (но не газов), содержащих, по крайней мере, одну гидрофильную группу.
Park ('692) раскрывает белки, например альбумин, которые функционализированы таким образом, что если альбумин связан с совместимым с кровью субстратом, и после радиационной обработки, свободные радикалы, образующиеся как на белке, так и на субстрате, химически связываются друг с другом. В этой ссылке нет указаний или предположений относительно сшивки полимеров под действием ионизирующего излучения в присутствии ненасыщенного газа, который образует часть сшивки.
Fidia (PCT заявка № WO 96/03147) раскрывает синтез химических гелей из полиэлектролитных полисахаридов, включая HA- и НА-бензиловые сложные эфиры, под действием гамма-излучения, которому предшествует функционализация для введения в их структуру олефиновых связей. Единственным раскрытым функционализирующим агентом является глицидилакрилат. Следует упомянуть другие иностранные патенты, которые имеют меньшее отношение к изобретению: EP 000038426; JP 360143991; JP 363301234; JP 401118529; DE 004123889; DE 004124338 и JP 406073102.
Не патентная литература, относящаяся к объекту настоящего изобретения, в частности, к некоторым исследованиям, проведенным на некоторых исходных материалах, использованных в настоящем изобретении, и к воздействию ионизирующего излучения на незаряженные полисахариды (такие как крахмал и целлюлоза) и на полиэлектролитные полисахариды (такие как гиалуроновая кислота и ее сшитое производное гилан, альгинаты, гепарин и т.д.) для того, чтобы вызвать разложение с разрывом основной цепи, приводящим к снижению молекулярного веса и вязкости, представлена здесь:

Описание изобретения
В настоящем изобретении предложена чрезвычайно широкая категория новых биополимеров, обладающих существенно улучшенными характеристиками по сравнению с исходными биополимерами. Молекулярные веса этих материалов можно увеличить регулируемым образом с тем, чтобы получить новые физические и химические свойства (например, эмульгирование и связывание с водой). Водные растворы новых продуктов можно получить буквально любой нужной вязкости и/или вязкоэластичности. Биополимеры можно превратить в новые гидрофильные гели (гидрогели) заданного конкретного размера и обладающие конкретными микромеханическими свойствами. Такие изменения можно осуществить без введения новых химических заместителей, и, следовательно, новые материалы сохраняют присущую им биосовместимость исходного или родительского биополимера. В способе получения новых биосополимеров можно использовать один или более из различных биополимеров.
В том смысле, как здесь использованы термины биополимер и биологический полимер, их следует понимать как полимер, полученный из биологического источника, в том числе и растения, включая микроорганизмы, или животное.
Рассматриваемые в настоящем изобретении биополимеры включают незамещенные биополимеры, охватывая всю область полисахаридов, полученных из растений и животных, независимо от того, заряжены они или не заряжены, а также белки, непосредственно полученные из источников коллагеновой ткани животных, такие как коллаген, желатин, и человеческие и животные продукты, такие как казеин, комбинации одного или более из таких полисахаридов с одним или более из белков растительного происхождения - такие как арабиногалактановые белки, биологические ткани и материалы, полученные из них, используемые для пересадки тканей и трансплантации, либо конечные продукты, либо частичные, и которые получены или сформированы из одного или более из таких биополимеров или их комбинаций с другими вышеуказанными материалами. Биополимеры, которые предстоит обработать для получения новых материалов в соответствии со способом настоящего изобретения, нет необходимости модифицировать каким либо образом до обработки, например, вводя какие-либо функционализирующие группы, которые могут быть необходимы в других процессах для активации биополимера, или для того, чтобы сделать его более реакционноспособным.
Иллюстративные примеры биополимеров, рассматриваемых в настоящем изобретении, включают:
Растительные экссудаты акаций, таких как Acacia Senegal и Acacia Seyal, содержащие арабиногалактановые белки во всех растениях; декстран и родственные бактериальные полисахариды; химически модифицированные полисахариды, такие как карбоксиметилцеллюлоза; гелеобразующие полисахариды либо бактериального происхождения (ксантан), либо растительного происхождения (каррагенан), либо фруктового происхождения (пектин); полисахариды и белки соединительных тканей животных и их комбинации, такие как гиалуронан, протеогликаны и химически модифицированные полисахариды животного происхождения, такие как хилан; и интерактивные комбинации этих материалов, которые могут быть ассоциированы, связаны и могут быть сращенными в специфических комбинациях.
При осуществлении способа настоящего изобретения для получения новых материалов из исходных биополимеров, предпочтительно, чтобы в исходном виде биополимер был в твердом состоянии, т.е. сухим, в атмосфере, включающей опосредствующий агент, предпочтительно низкомолекулярный ненасыщенный алкеновый или алкиновый газ, такой как этилен, пропилен или ацетилен, предпочтительно ацетилен. Перед введением опосредствующего газа в зону реакции эту зону необходимо очистить от любой содержащей активный кислород атмосферы. Любой опосредствующий газ удаляют после завершения процесса, и поэтому полученный в результате новый материал не содержит какого-либо опосредствующего газа.
Биополимерная система (или обработанный или частично обработанный, полученный из нее продукт) из которого была удалена активная атмосфера, насыщают затем опосредствующим газом при атмосферном давлении, и экспонируют источником ионизирующего излучения, который может быть либо изотопом, таким как60Со (γ-лучи), либо излучением высокой энергии (250 КэВ до 10 МэВ) от ускорителя электронов, либо рентгеновскими лучами, создаваемыми ускорителем, либо любым другим подходящим устройством.
Минимальная поглощаемая доза излучения может меняться от 1 кГр до 50 кГр, в зависимости от строения биополимера, от необходимости получения разветвленного или длинноцепочечного продукта, от необходимости повышение молекулярного веса для создания легко растворимого в воде продукта или получения либо геля, либо мембранного продукта. Как правило, сильно разветвленные полисахаридные структуры могут привести к достижению 4х-кратного увеличения молекулярного веса при дозах вплоть до 10 кГр и гелей при дозах вплоть до 50 кГр, тогда как аналогичных изменений в неразветвленных структурах удается достичь при столь низких дозах, как 1-3 кГр. Белкам необходимо вплоть до 25 кГр для достижения аналогичного результата. Смеси и комбинированные адгезивные системы требуют тщательного выбора доз в зависимости от состава систем.
После стадии облучения в присутствии газообразного опосредствующего агента и для удаления всех активных агентов, образовавшихся в процессе облучения, полученную биополимерную систему или новый материал подвергают термообработке (отжигу) в отсутствие кислорода при повышенных температурах в интервале от 40 до 120°C в зависимости от термостабильности биополимерной системы, которую необходимо модифицировать. Такую стадию отжига в идеале можно осуществить в присутствии ненасыщенной газообразной атмосферы или, в другом варианте, в присутствии инертного газа, такого как азот или гелий, или в вакуумном термостате. Первое может привести к увеличению количества образования нового продукта, а последнее обеспечивает подходящий механизм окончания процесса.
После стадии отжига все оставшиеся газообразные опосредствующие агенты удаляют из модифицированной биополимерной системы путем аэрации системы, и при необходимости используют для обработки полимера вакуумный процесс. Это зависит от удерживающей способности материала в отношении газа, что зависит от пористости твердой системы.
Новые биополимеры, полученные в результате вышеописанной обработки, характеризуются изменением следующих параметров, при сравнении исходного материала с новыми биополимерами:
а) молекулярный вес может увеличиться в 4-5 раз;
b) обычно параллельно с увеличением молекулярного веса происходит повышение связывания воды;
с) используя пониженные концентрации биополимеров, удается получить эмульсию с размерами капель порядка 1 мкм;
d) интервал изменений вязкости и вязкоэластичности достигает 1000-кратного; и
е) наблюдается образование гидрогелей с размерами частиц 150-2000 мкм.
Молекулярный вес исходного биополимера можно увеличить контролируемым образом с тем, чтобы получить новое поколение продуктов с улучшенными свойствами без утраты основных функциональностей исходного биополимера. Увеличенные параметры молекул обеспечивают большее связывание с водой, улучшают физические свойства, такие как образование более мелких частиц эмульсии, новые связывающие способности и функции в отношении других полимеров, независимо от того, являются они заряженными или нет, и лучшее качество при изготовлении лекарств и небольшое выделение ионов.
Можно получить растворимые продукты с повышенной или пониженной вязкостью и/или вязкоэластичностью. Таким образом, можно получить новые пищевые, лекарственные и промышленные продукты.
Особенно важным для настоящего изобретения является тот факт, что в структуру биополимера в результате процесса изобретения не вносится никаких заметных или идентифицируемых химических изменений. Поэтому любой новый продукт, полученный в соответствии с настоящим изобретением, можно использовать на практике фактически тем же способом, что и исходный биополимер.
Гидрофильные гели (гидрогели) можно получить с определенным размером частиц и конкретными микромеханическими свойствами. Полученные продукты обладают такой же биосовместимостью, что и исходные биополимеры.
Широкий круг новых продуктов можно получить, изменяя параметры процесса, и эти параметры составляют неотъемлемую часть сути и целей настоящего изобретения и включены в объем представленной формулы изобретения. Способ не приводит к получению одного нового продукта, или даже ряда новых продуктов для конкретного типа биополимера, но скорее он предлагает возможность получения семейства новых продуктов, каждый из которых можно приспособить для конкретных применений.
Краткое описание фигур
Фигуры включают ФИГ.1-24, всего 43 ФИГ. на 27 листах. Каждая из этих перечисленных и описанных далее ФИГ. представляет графики, и они относятся к одному или более из примеров, представленных далее в разделе примеры.
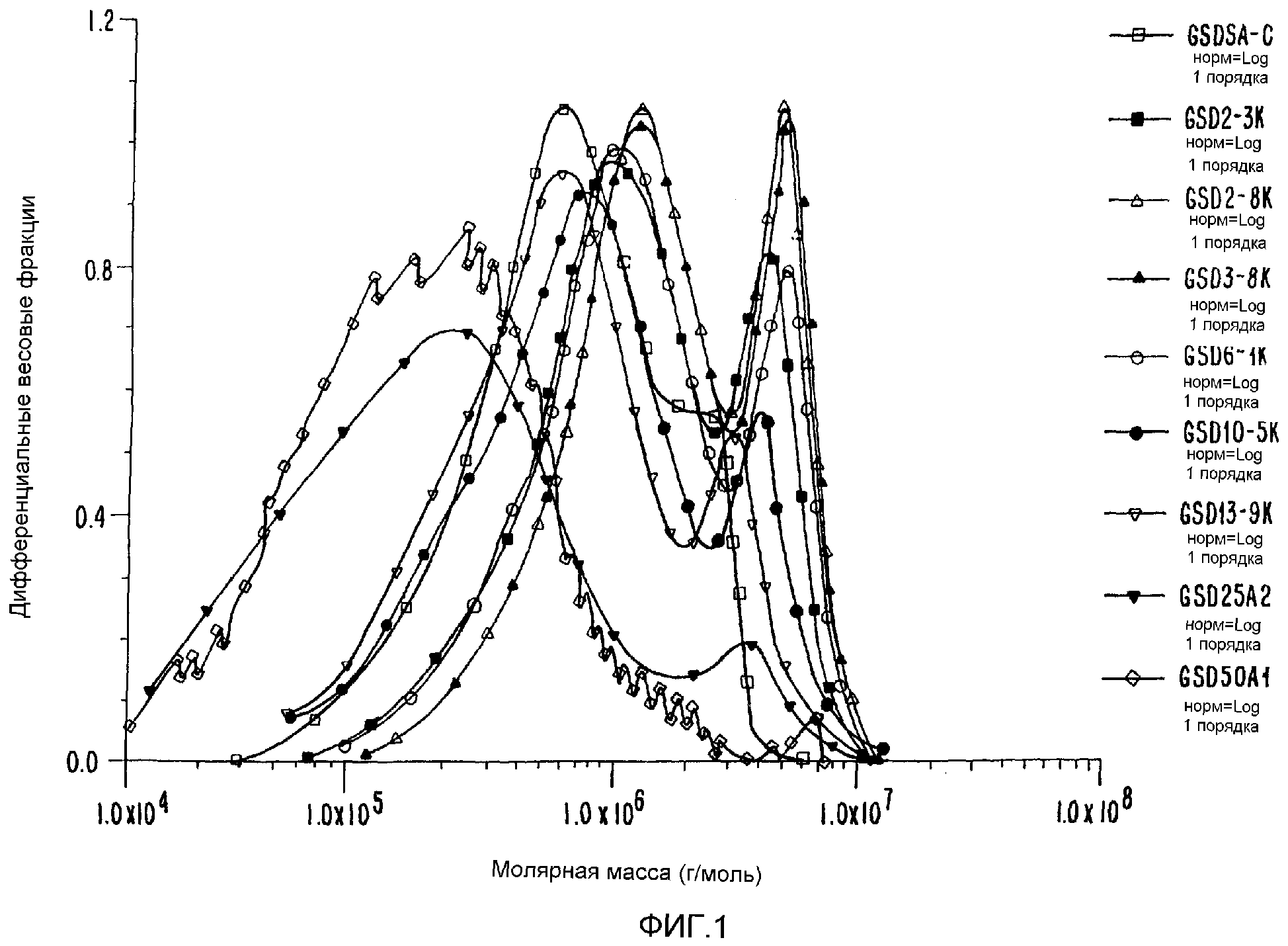
ФИГ.1. Дифференциальное молярномассовое распределение контрольных и облученных образцов Acacia Senegal (высушены распылением).
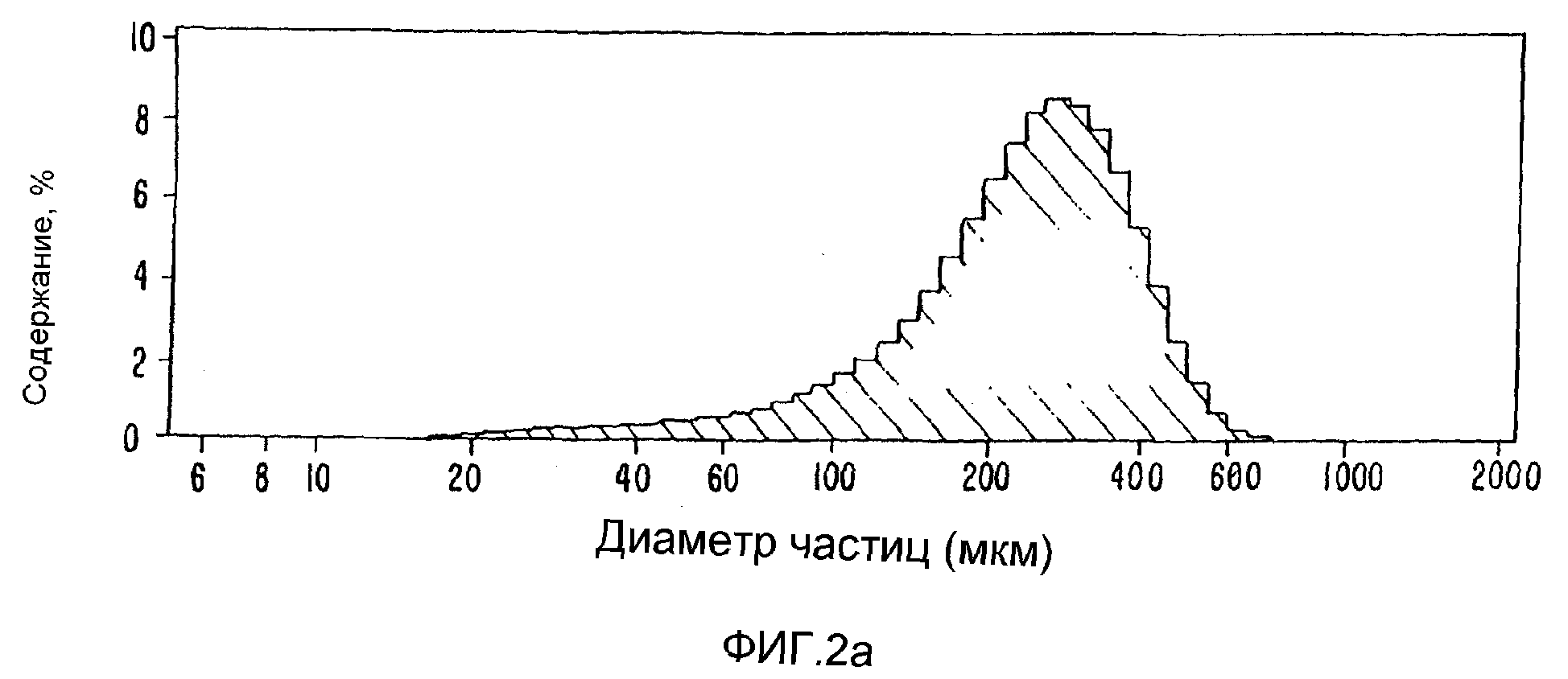
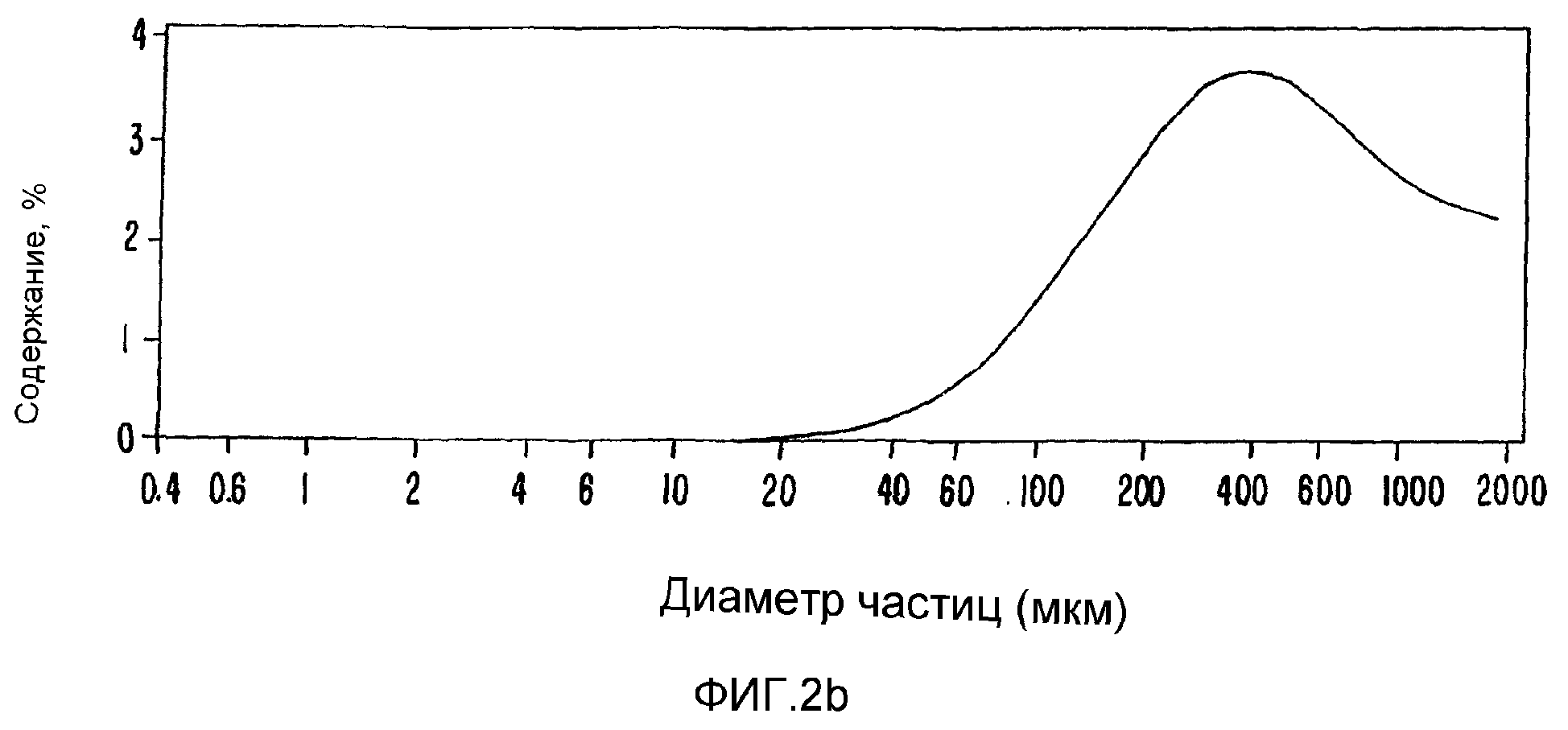
ФИГ.2. Увеличение образования гидрогелей при различных условиях обработки.
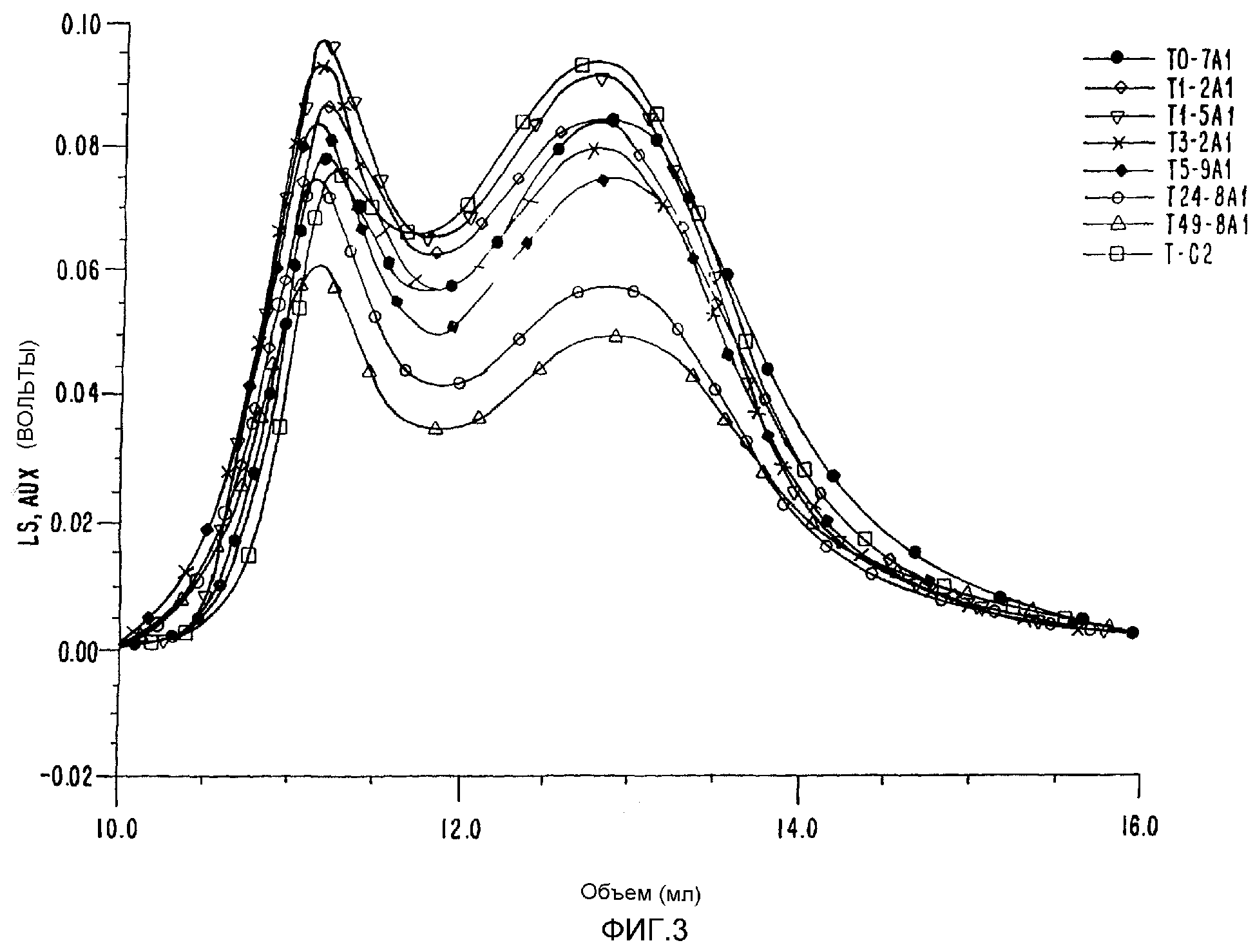
ФИГ.3. Сравнение содержания белка в Acacia Seyal после радиационной обработки; контроль по поглощению УФ-излучения на длине волны 214 нм.
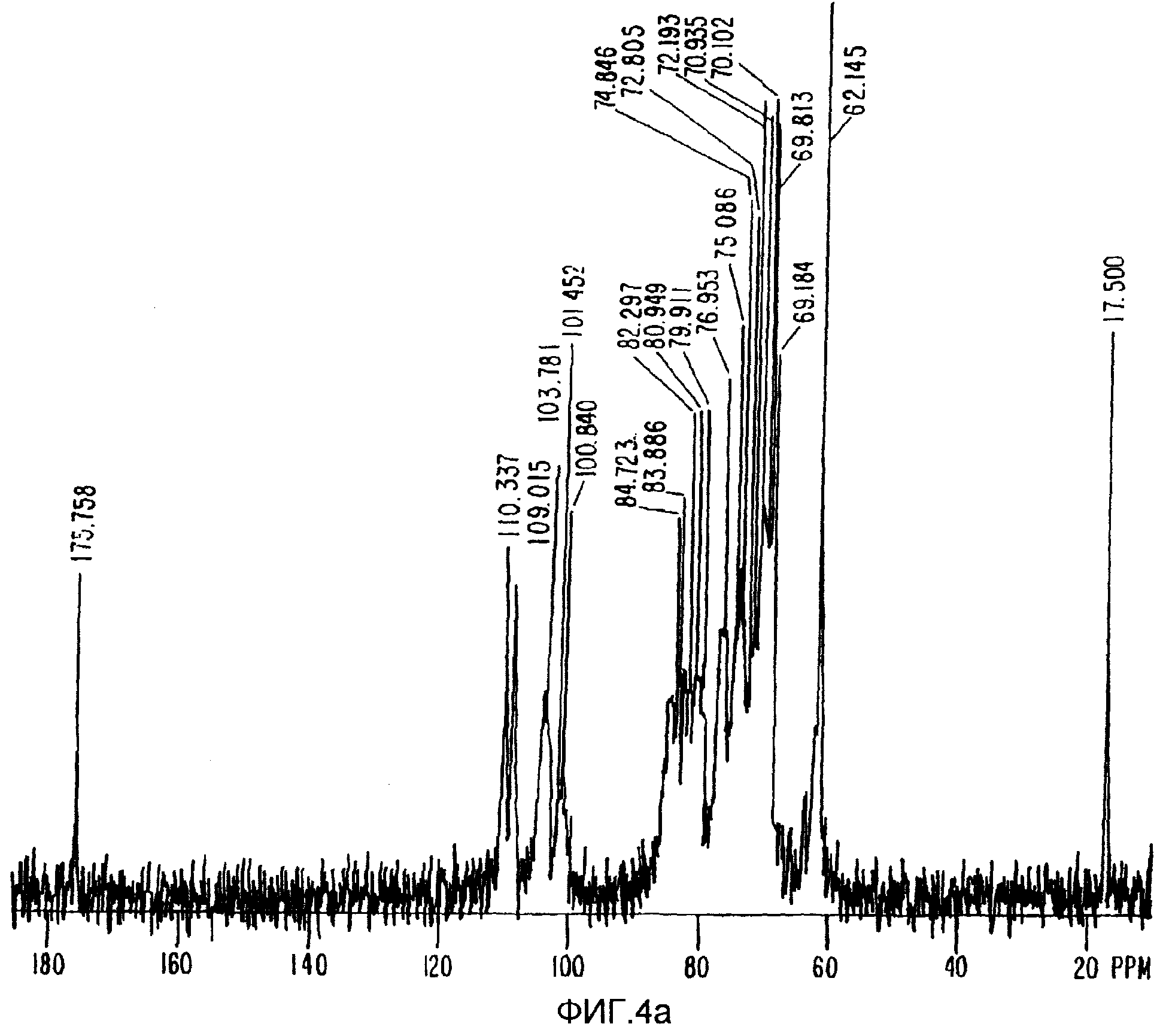
ФИГ.4а. Спектр13С-ЯМР Acacia Senegal (без облучения).
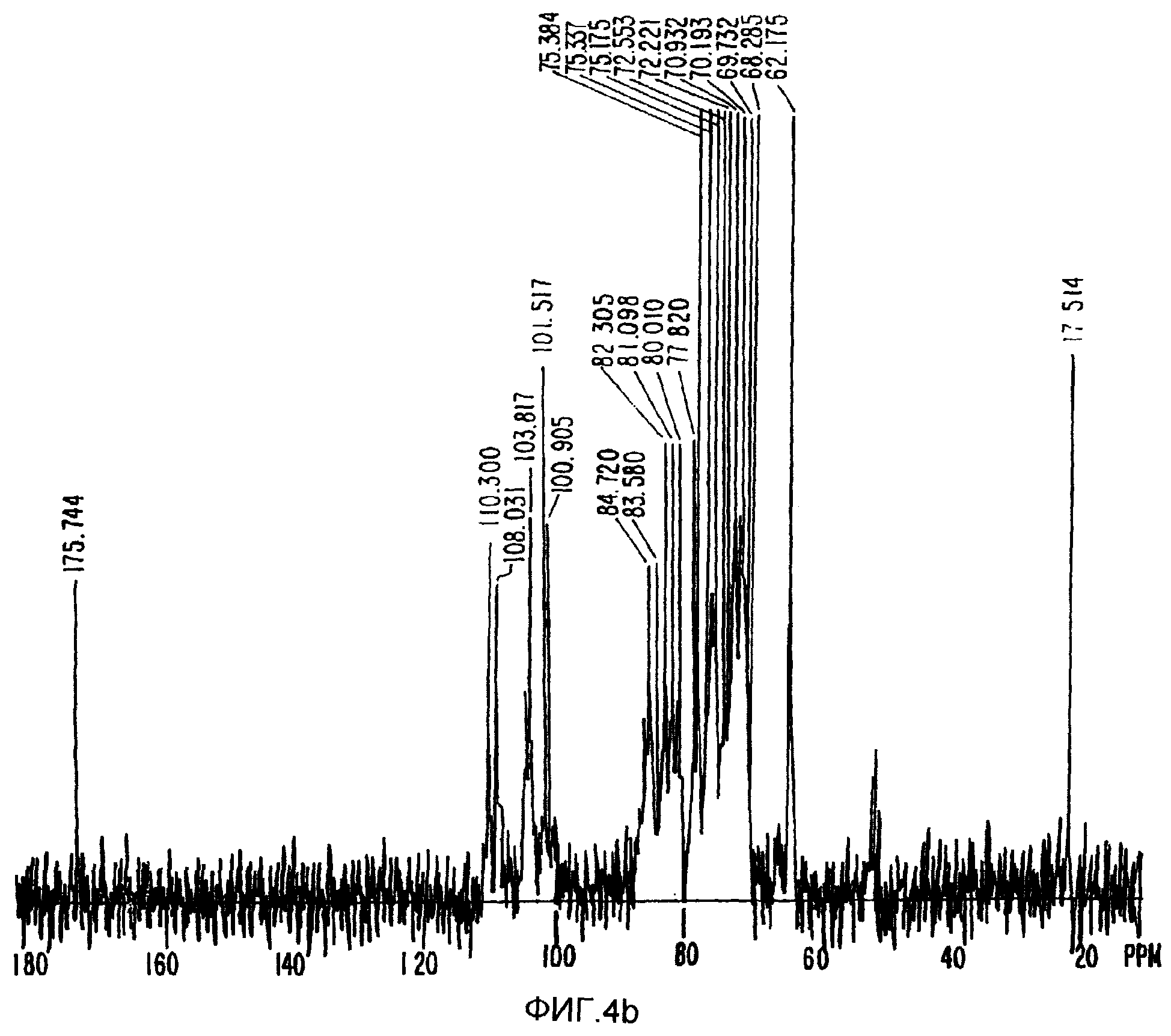
ФИГ.4b. Спектр13С-ЯМР Acacia Senegal (облучение 6,1 кГр).
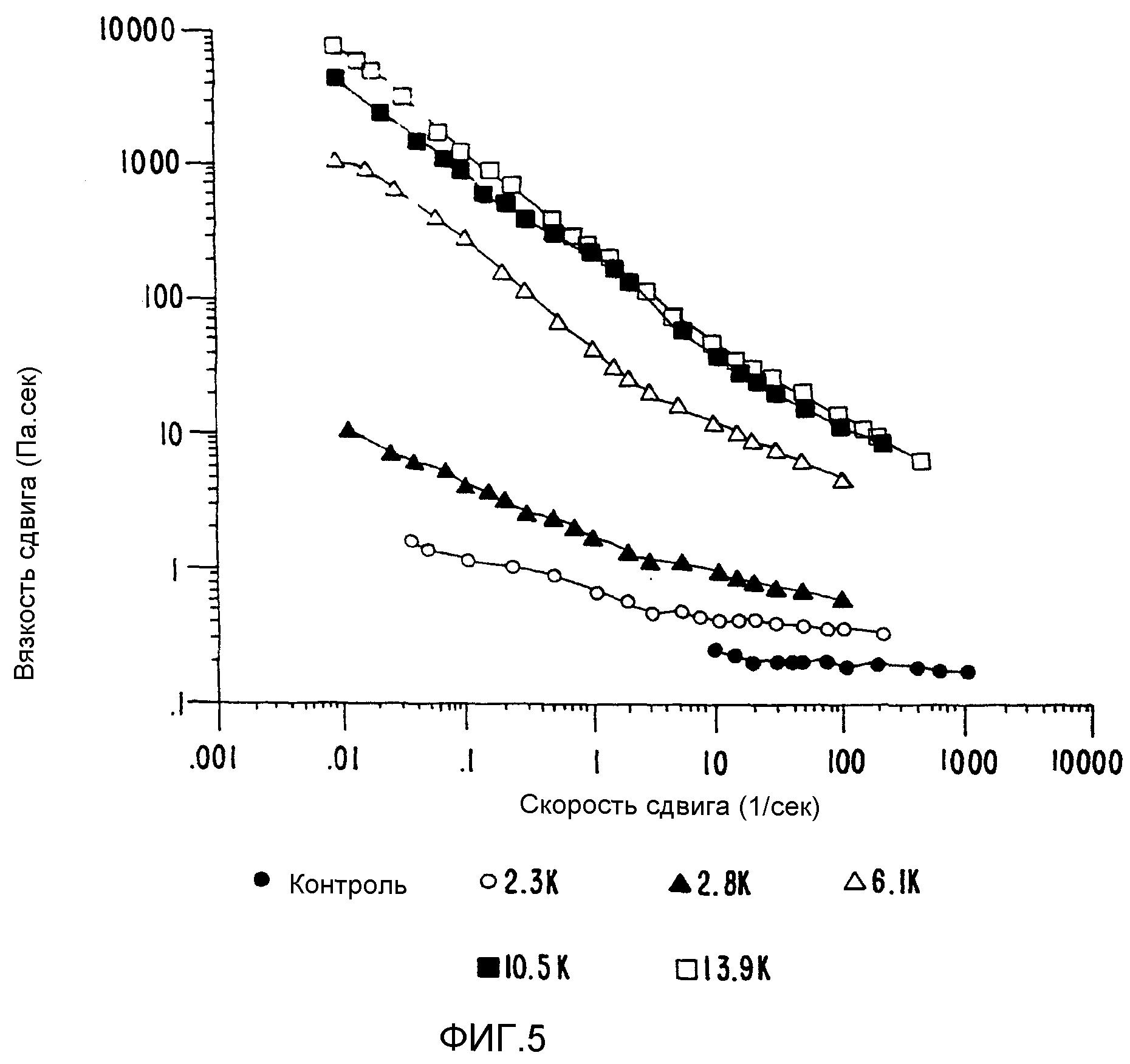
ФИГ.5. Кривая вязкости сдвига как функция скорости сдвига для 33,3% (вес/вес) контроля и облученного образца Acacia Senegal (высушен распылением). (•) контроль; (о) 2,3 кГр; (▲) 2,8 кГр; (Δ) 6,1 кГр; (■) 10,5 кГр;
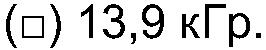
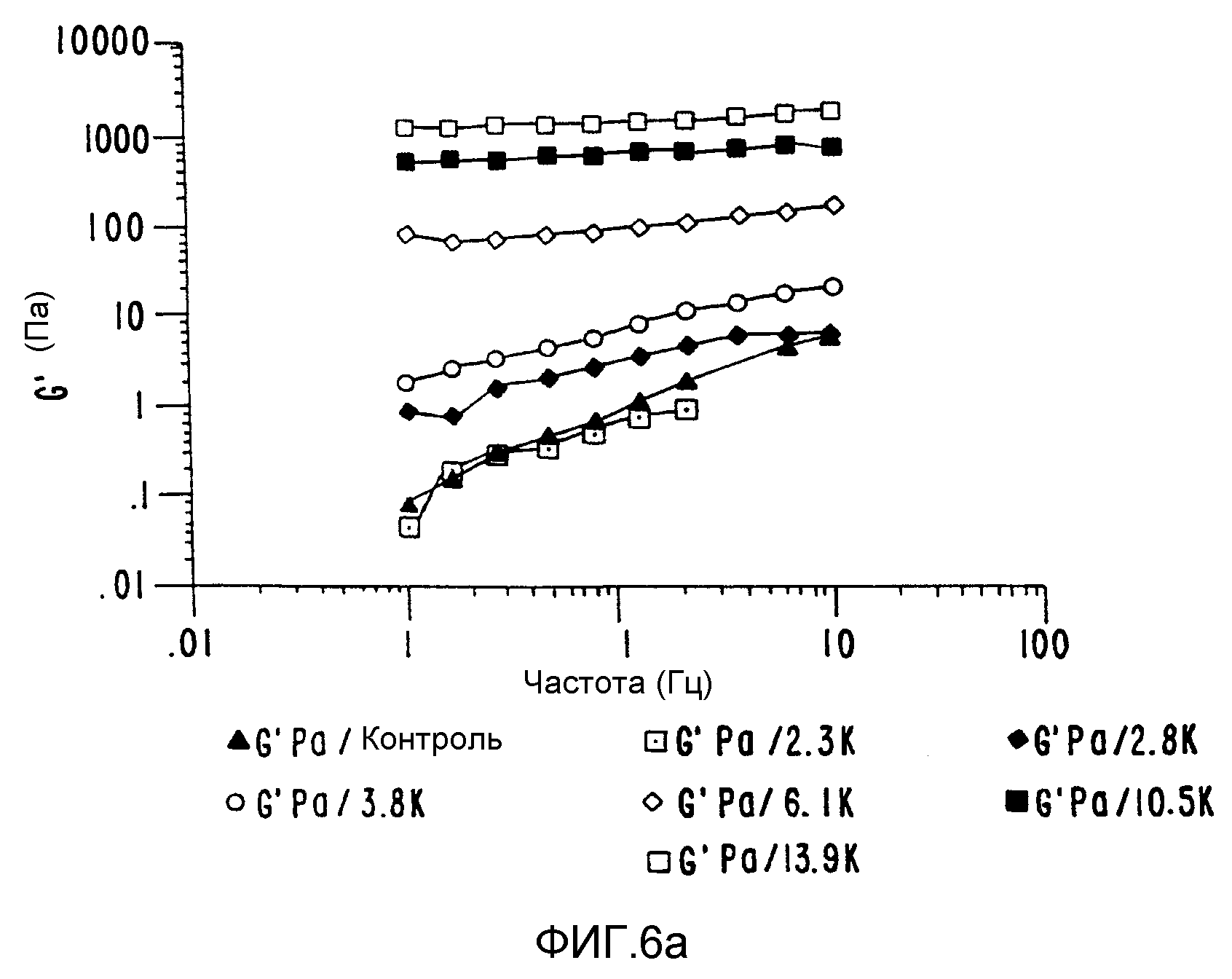
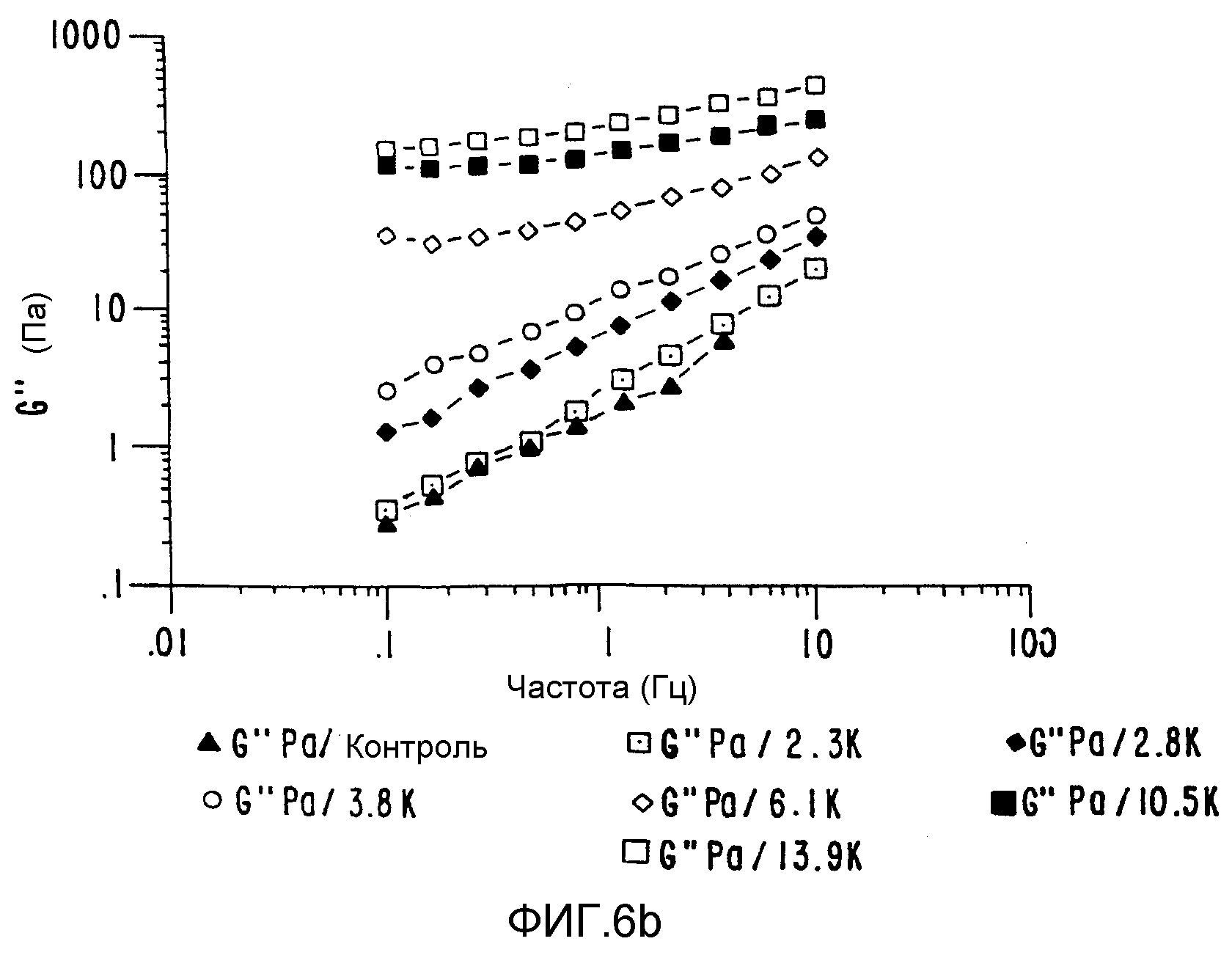
ФИГ.6. График (а) модуля сохранения и (b) модуля потерь как функция частоты для 33,3% (вес/вес) контроля и облученного образца Acacia Senegal (высушен распылением). (▲) контроль
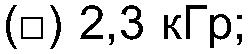
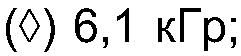

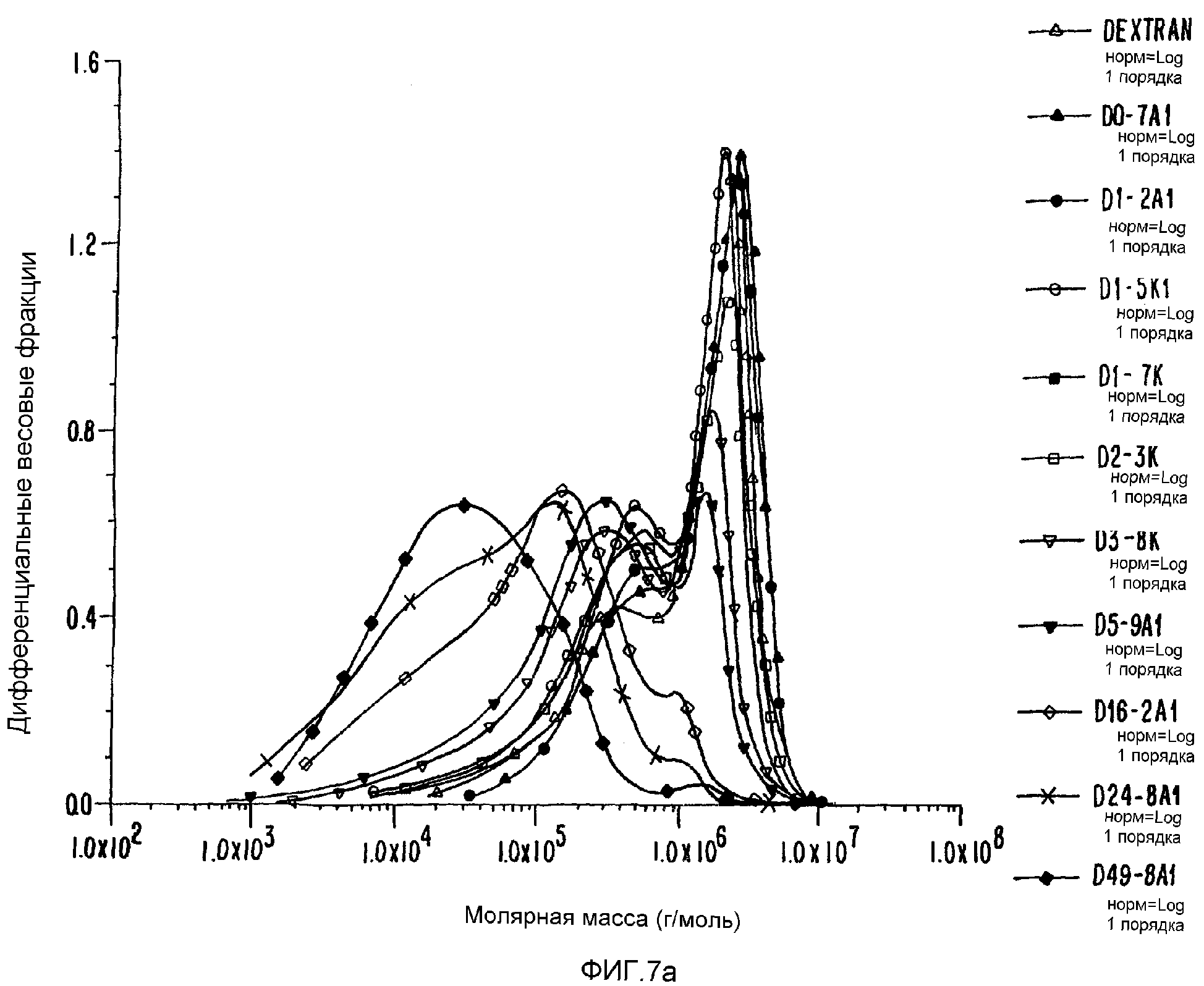
ФИГ.7а. Дифференциальное молярномассовое распределение контрольных и облученных образцов декстрана.
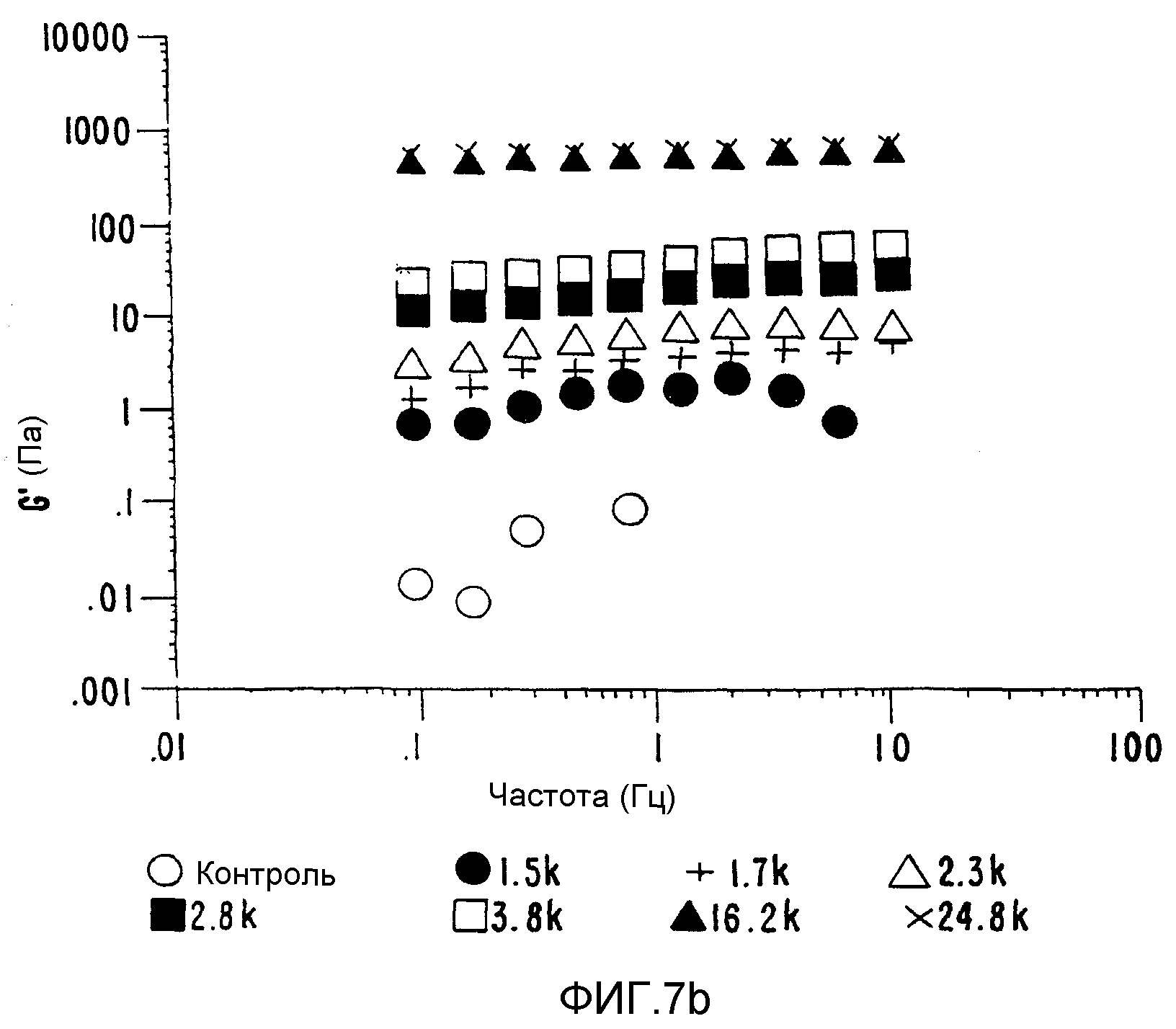
ФИГ.7b. Кривые модулей сохранения (G') как функция частоты для 6,25% (вес/объем) декстрана.
(о) контроль, (•) 1,5 кГр, (+) 1,7 кГр; (Δ) 2,3 кГр; (■) 2,8 кГр;
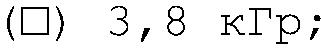
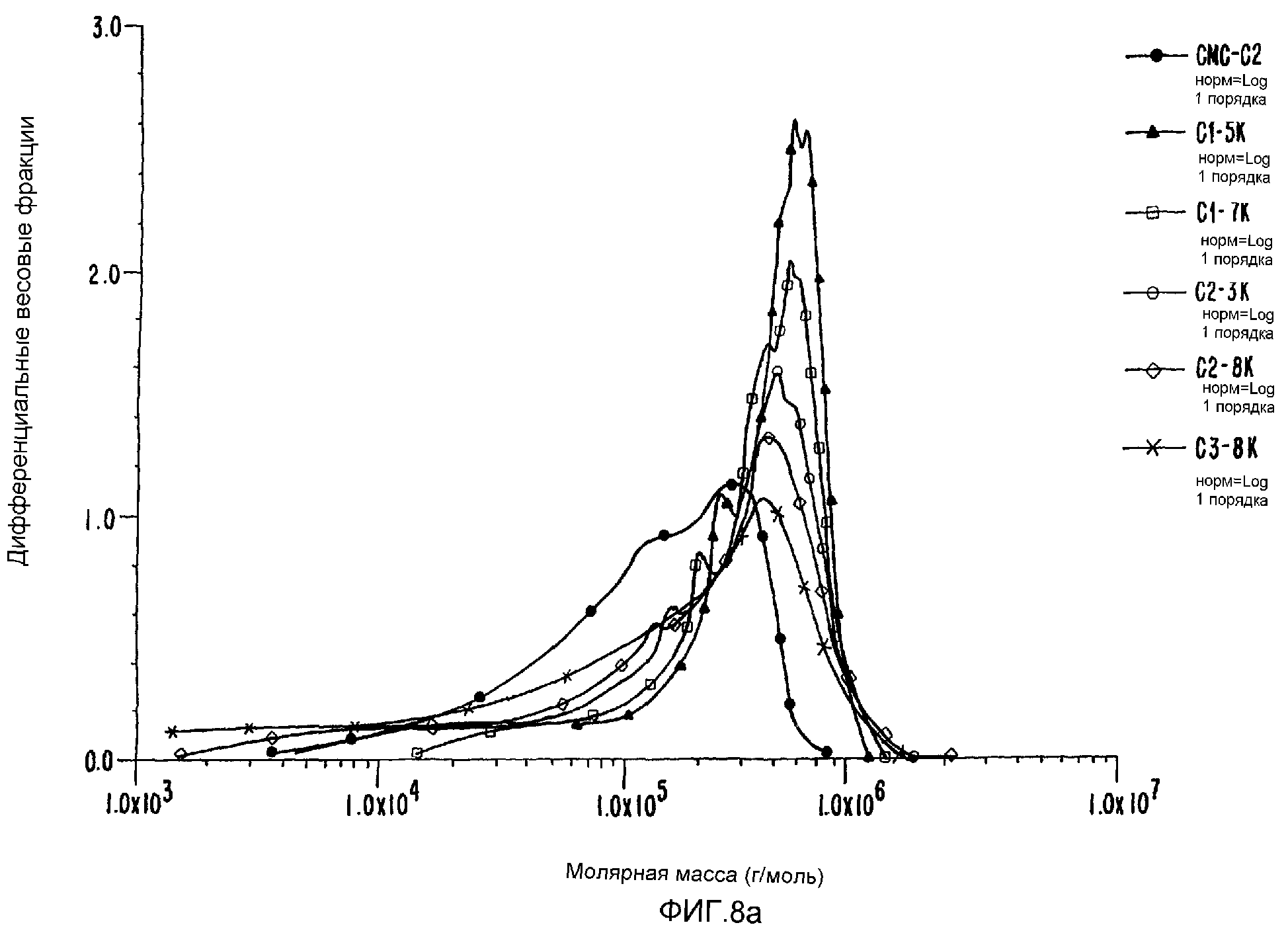
ФИГ.8а. Дифференциальное молярномассовое распределение контрольного и облученных образцов СМС.
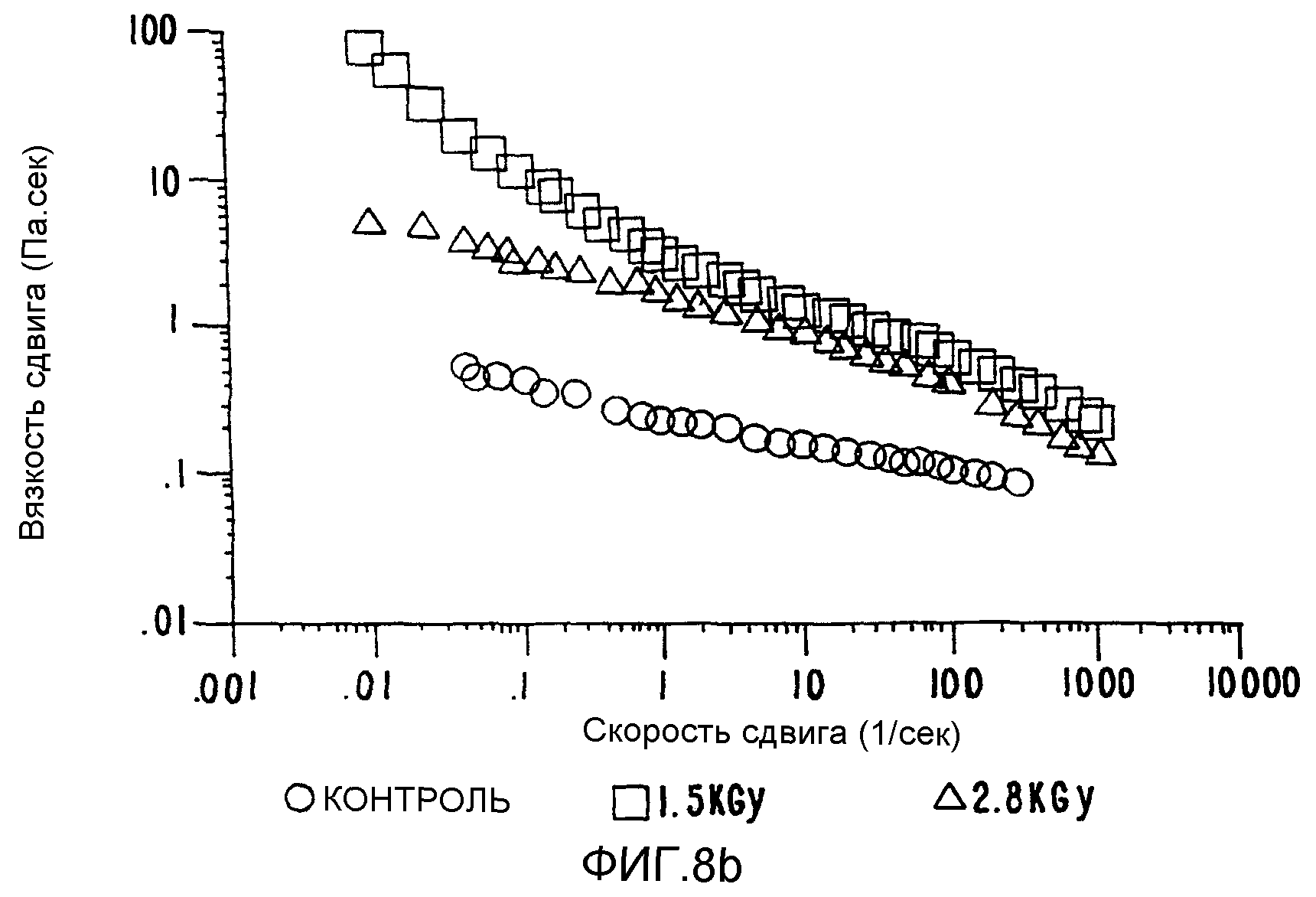
ФИГ.8b. Кривая вязкости сдвига как функция скорости сдвига для 2% в Н2О контрольного и облученного образцов СМС. (о) контроль; (Δ) 1,5 кГр;
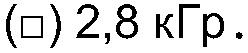
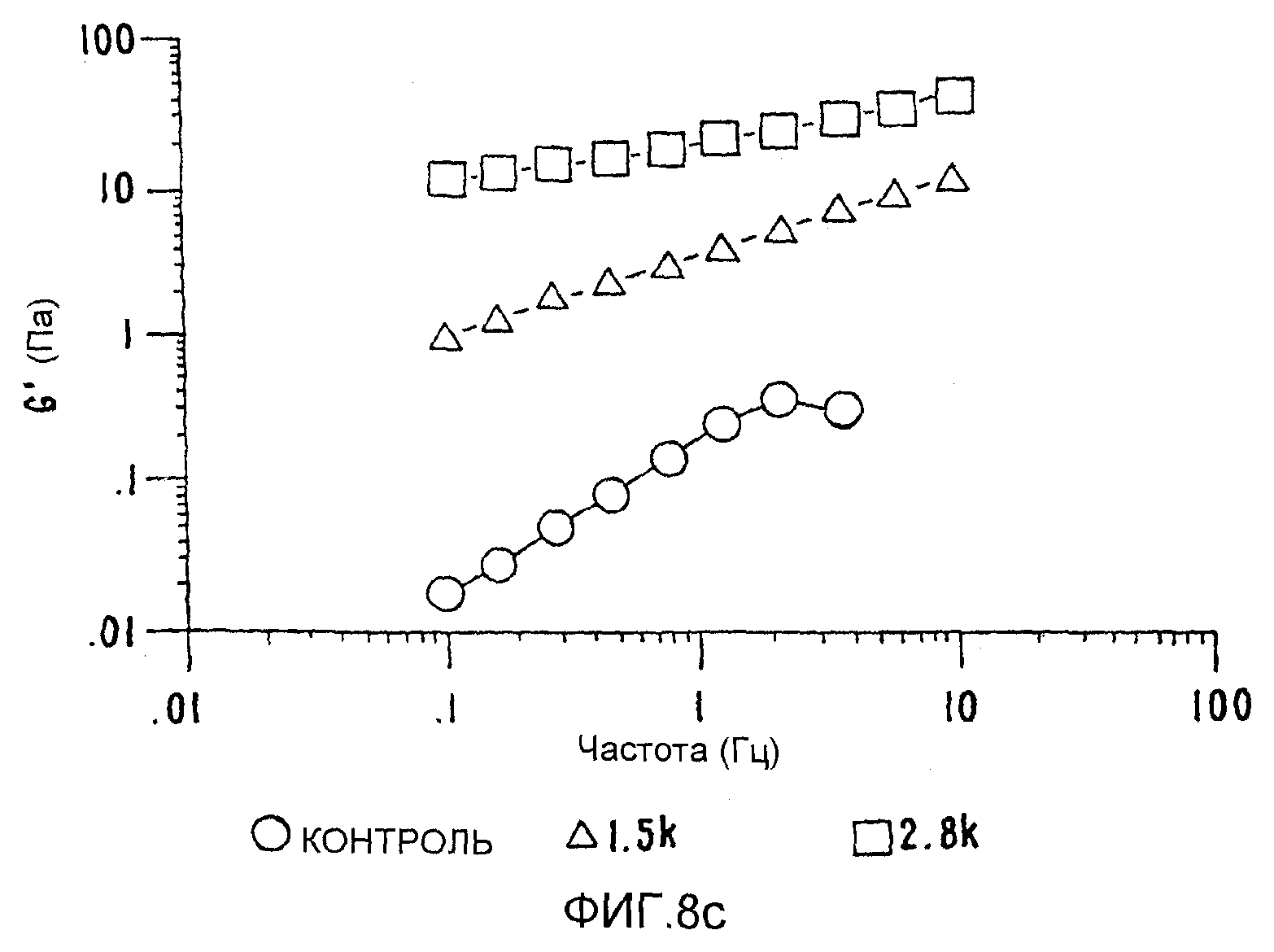
ФИГ.8 с. Кривые модулей сохранения (G') как функция частоты для 2% в Н2О контрольного и облученных образцов СМС. (о) контроль; (Δ) 1,5 кГр;
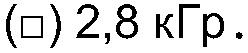
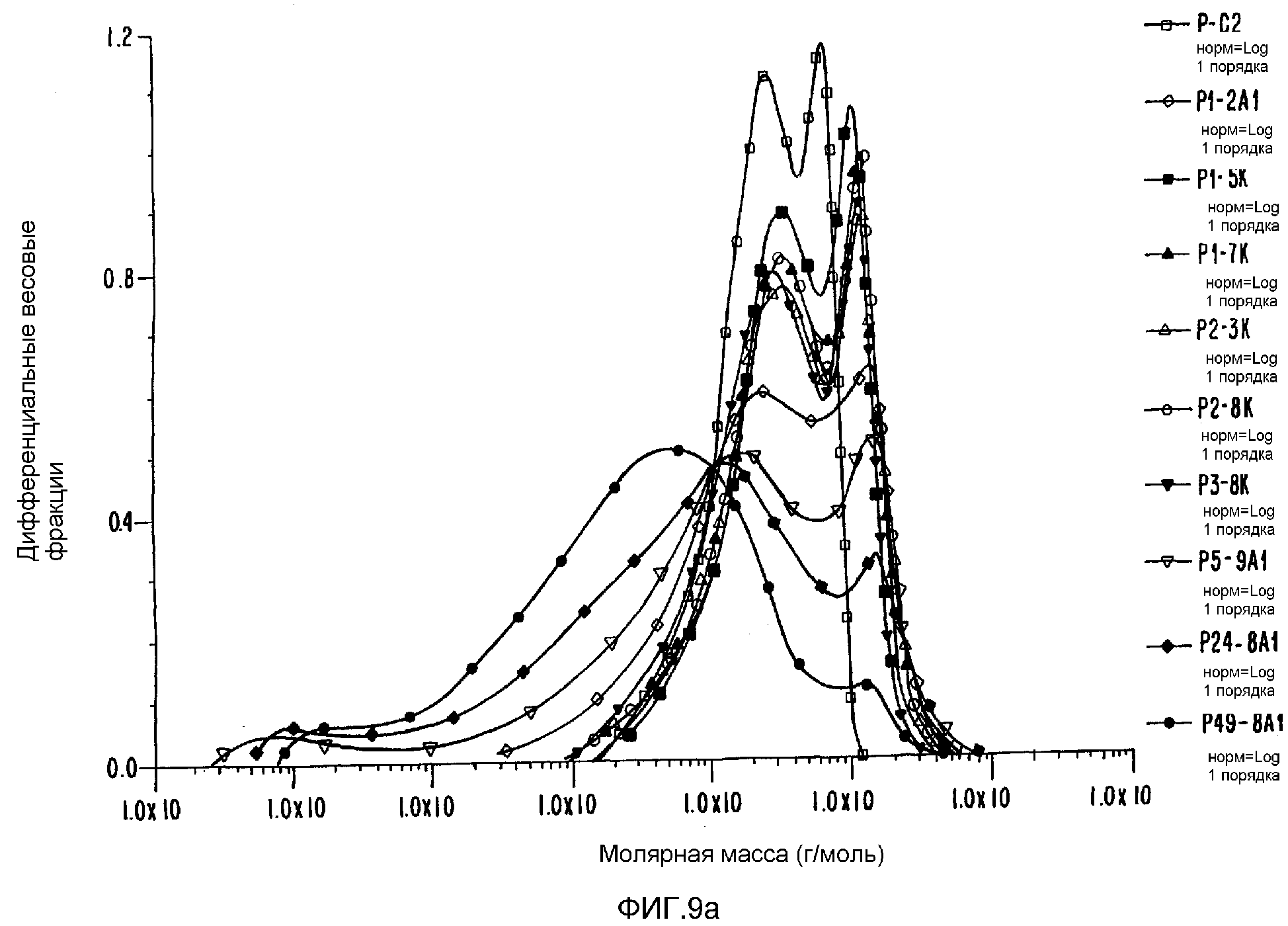
ФИГ.9а. Дифференциальное молярномассовое распределение контрольных и облученных образцов пуллулана.
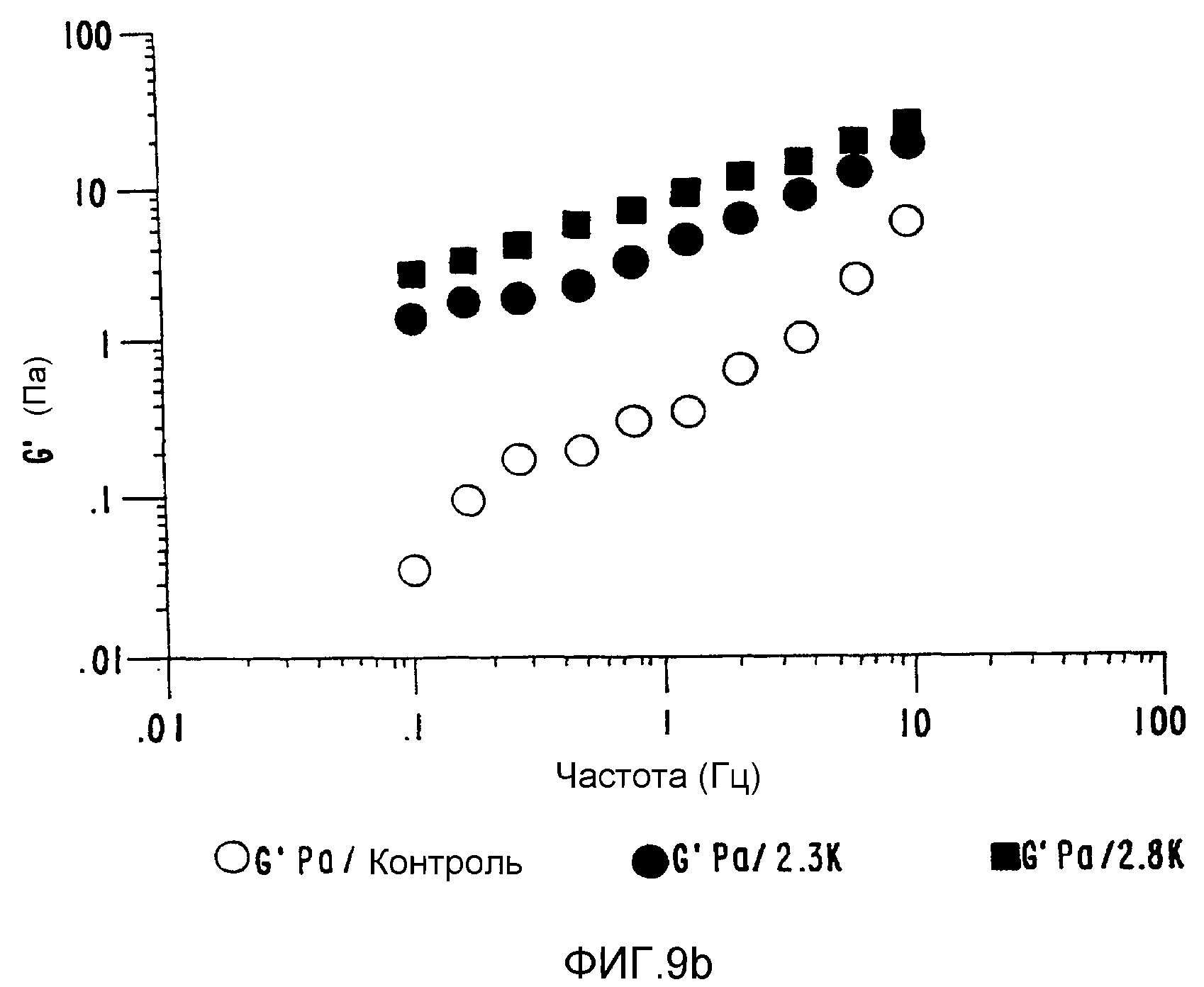
ФИГ.9b. Кривая модуля сохранения (G') как функция частоты для контрольного и облученного 20% пуллулана. (○) контроль; (•) 2,3 кГр, (■) 2,8 кГр.
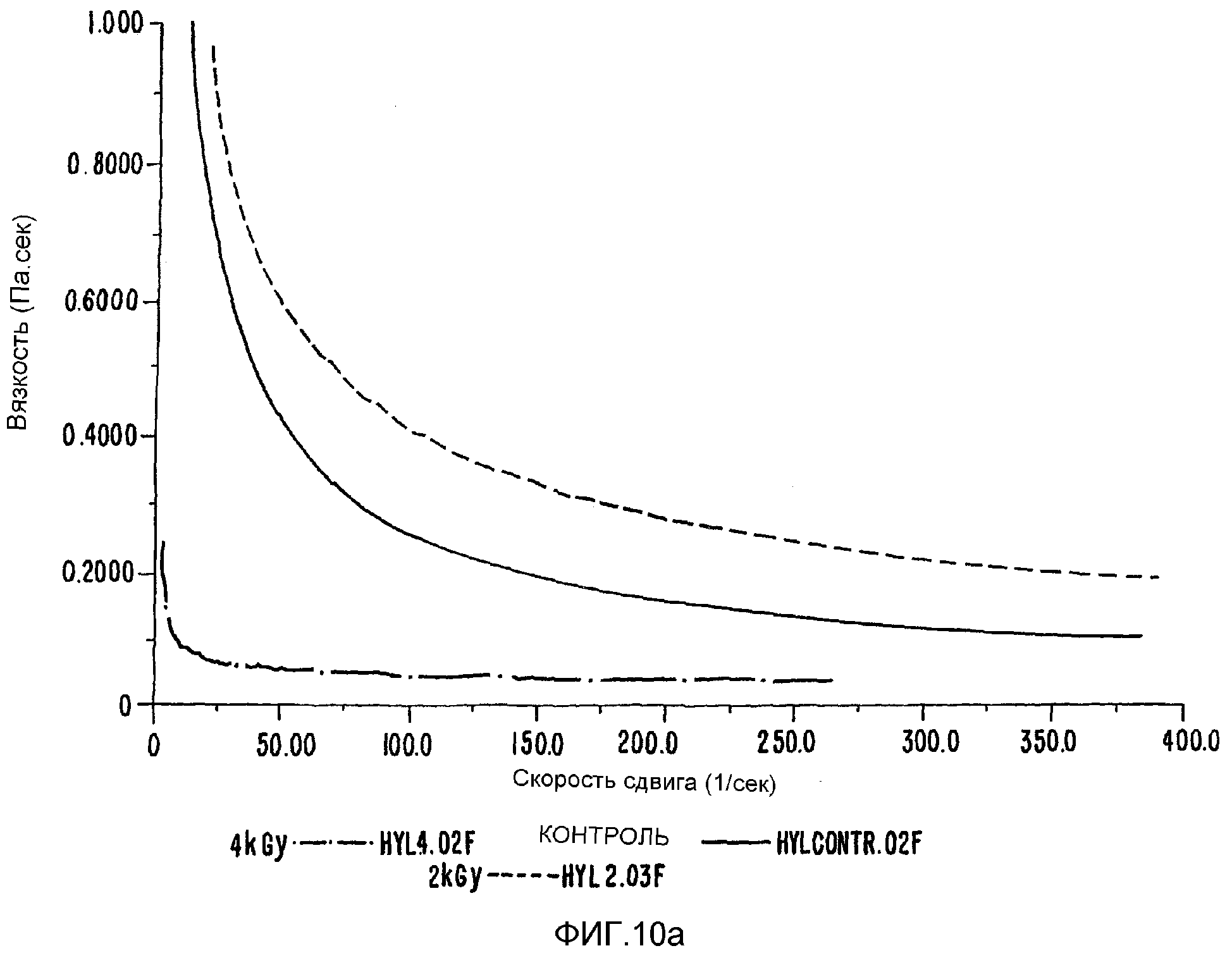
ФИГ.10а. Кривая сдвига вязкости как функция скорости сдвига для образца 0,5% в Н2О облученного гиалуронана по сравнению с контрольным образцом.
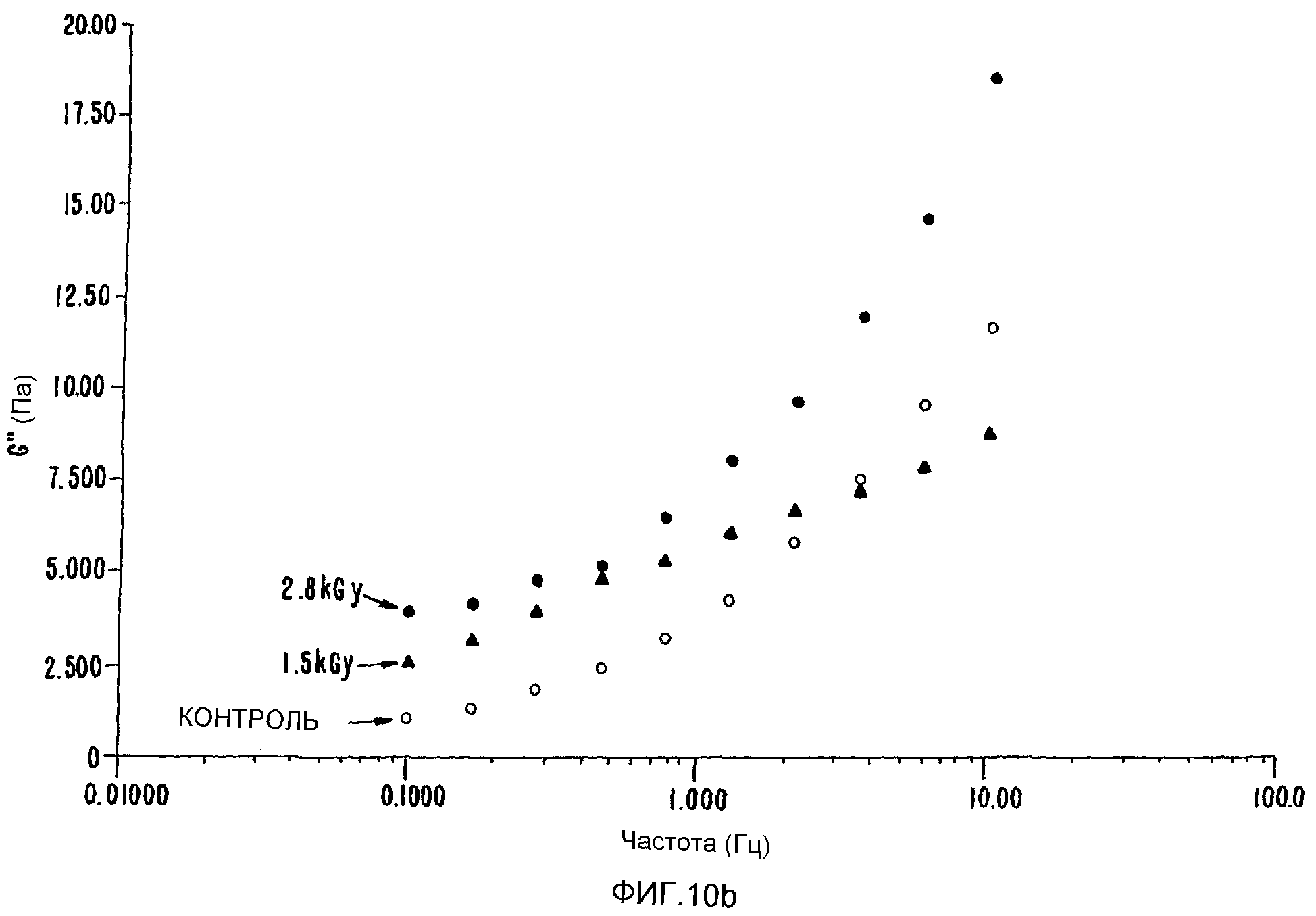
ФИГ.10b. Кривая модуля потерь (G") как функция частоты для образца 0,4% в Н2О облученного гиалуронана по сравнению с контрольным образцом.
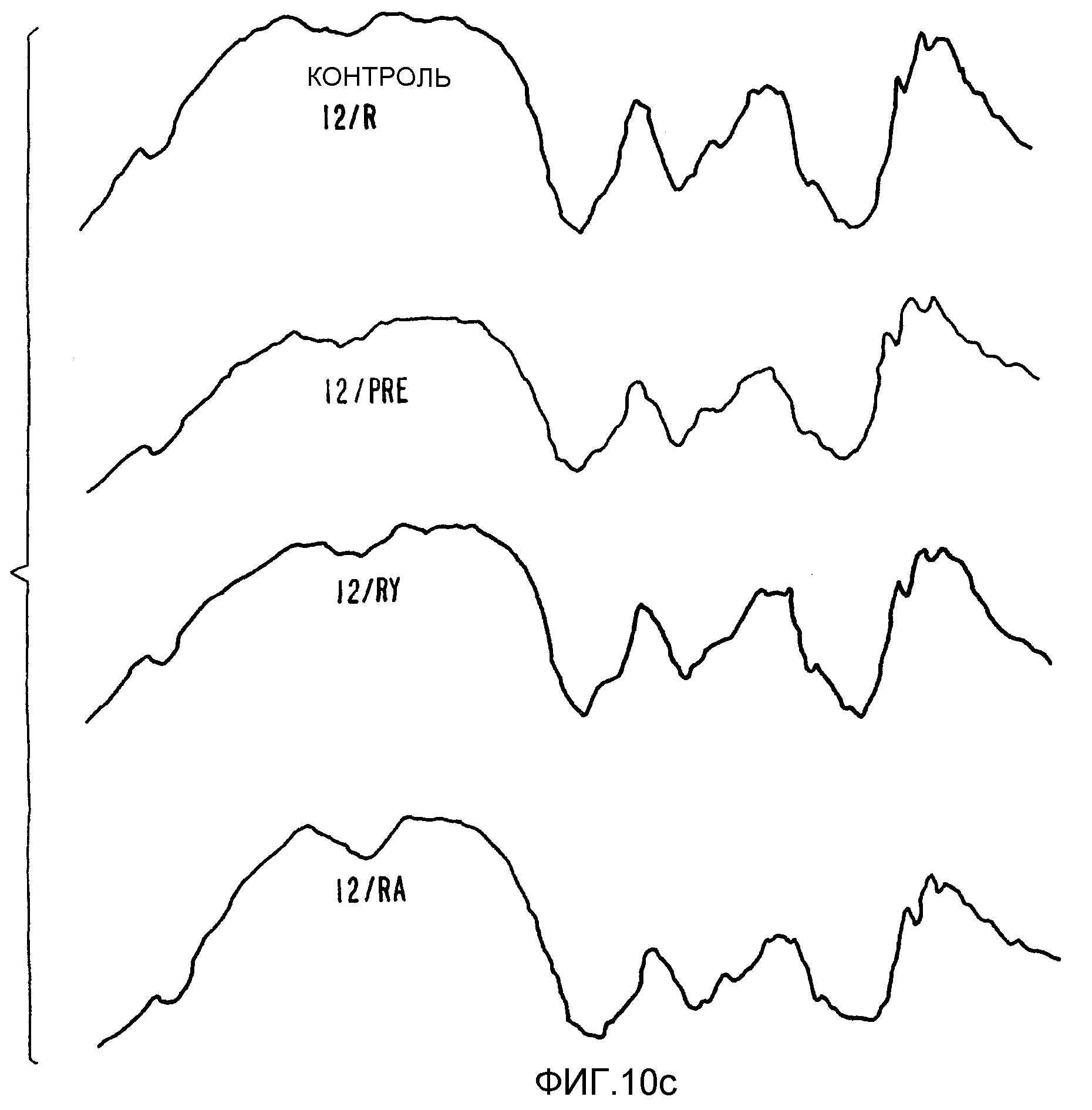
ФИГ.10с. Инфракрасный спектр волокон облученного гилана.
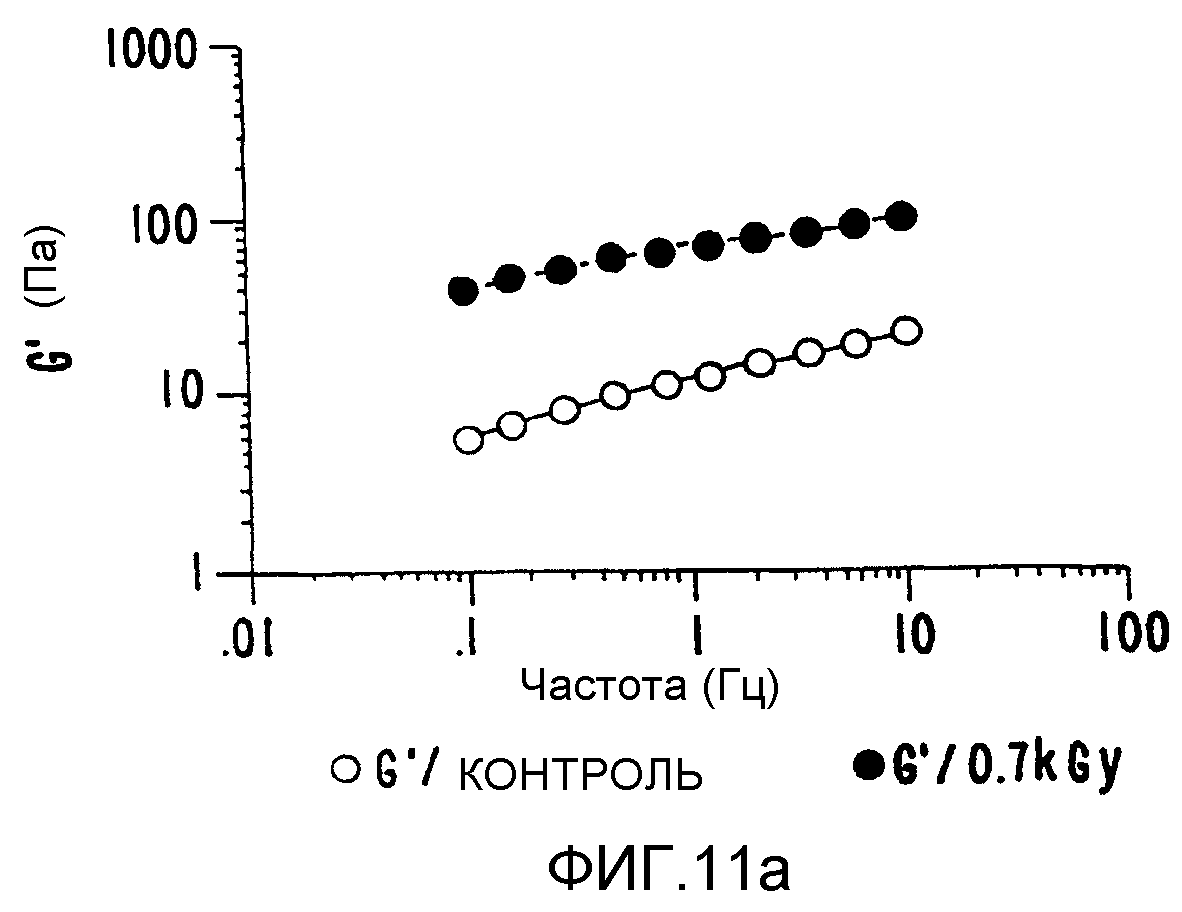
ФИГ.11а. Кривая модуля сохранения (G') как функция частоты для 1% в Н2О образцов контрольного и облученного ксантана. Раствор нагревают в течение 20 минут при 85°C, и измерения проводят при 25°C. (о) контроль; (•)0,7 кГр.
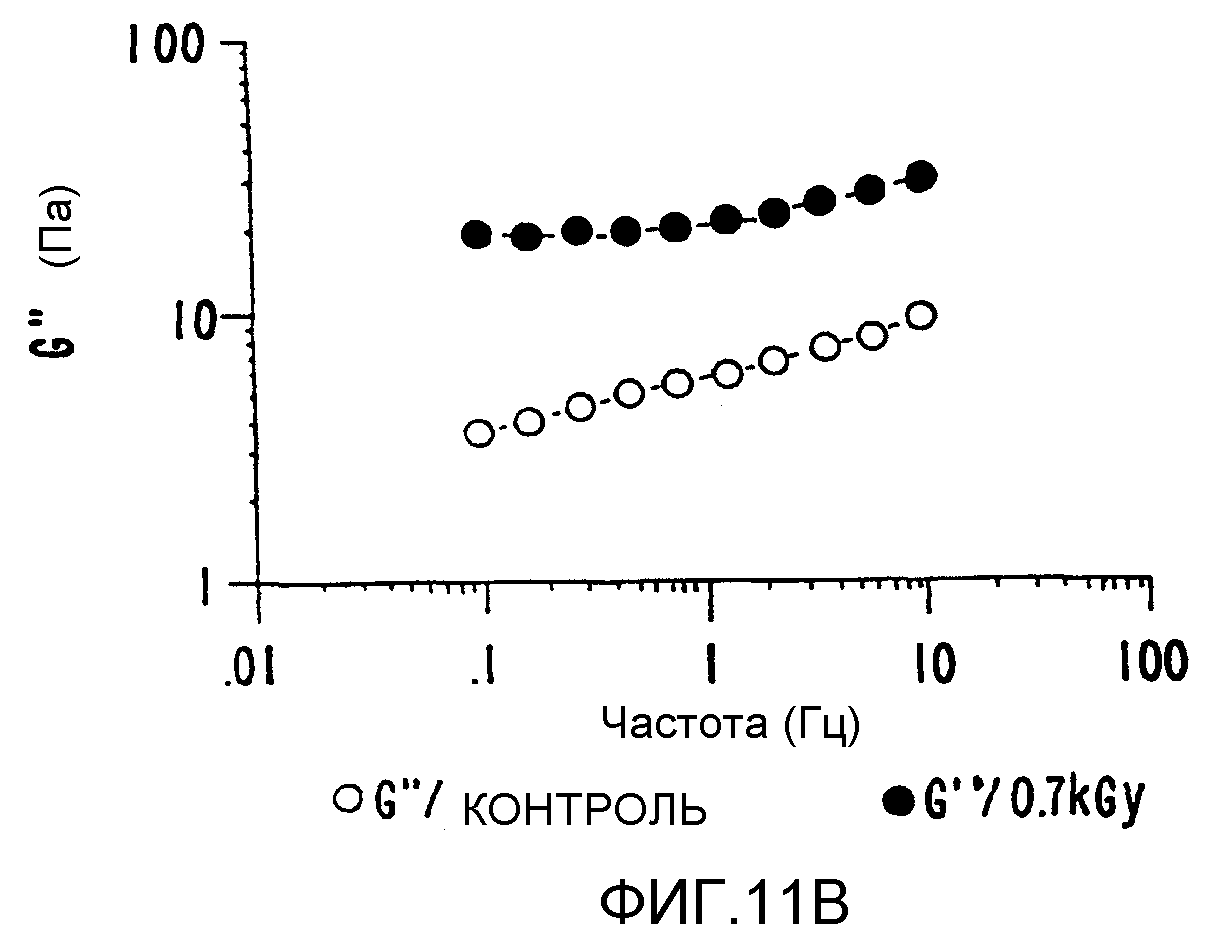
ФИГ.11b. Кривая модуля потерь (G") как функция частоты для 1% в Н2О образцов контрольного и облученного ксантана. Раствор нагревают в течение 20 минут при 85°C и измерения проводят при 25°C. (о) контроль; (•)0,7 кГр.
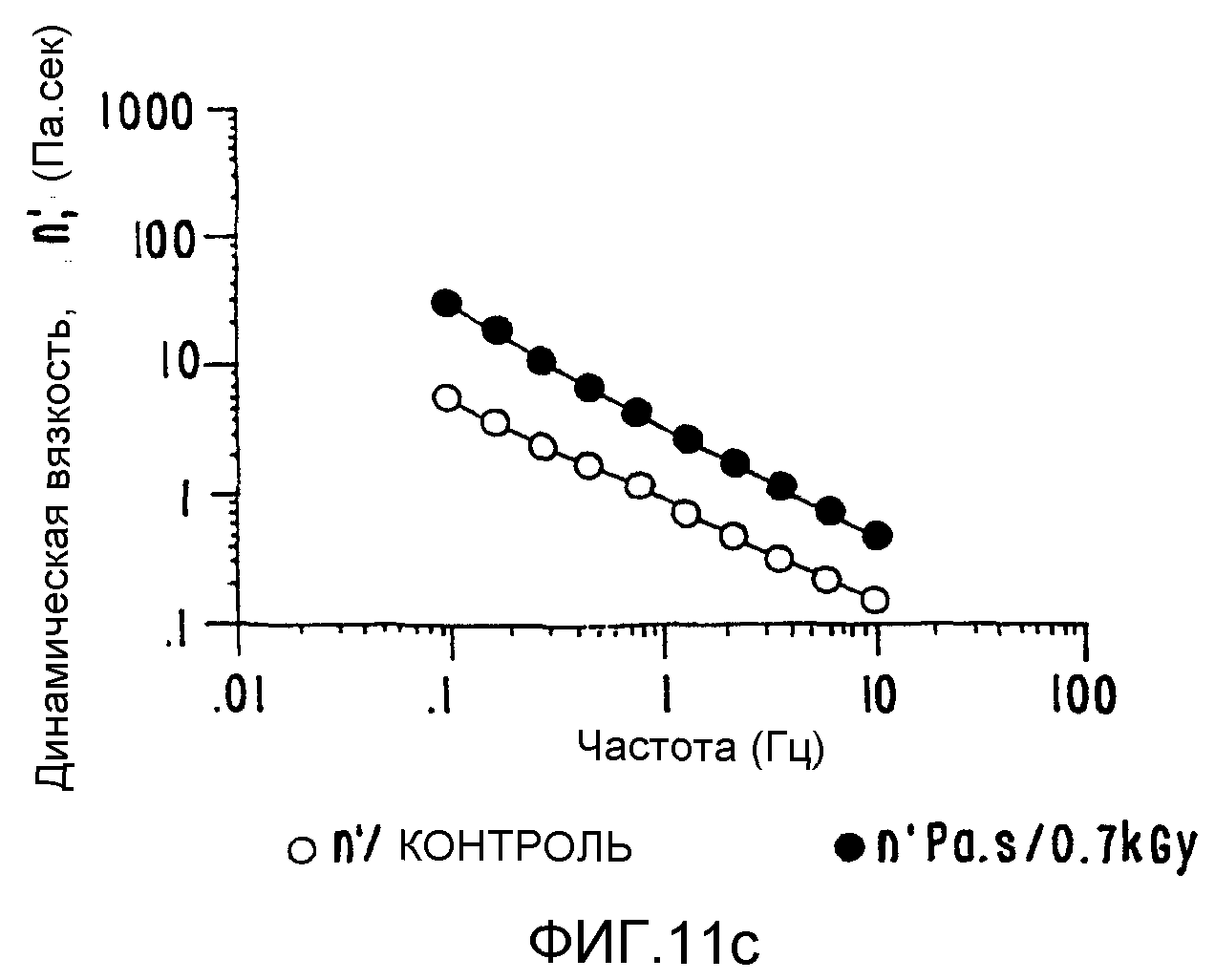
ФИГ.11с. Кривая динамической вязкости (η') как функция частоты для 1% в Н2О образцов контрольного и облученного ксантана. Раствор нагревают в течение 20 минут при 85°C и измерения проводят при 25°C. (о) контроль; (•)0,7 кГр.
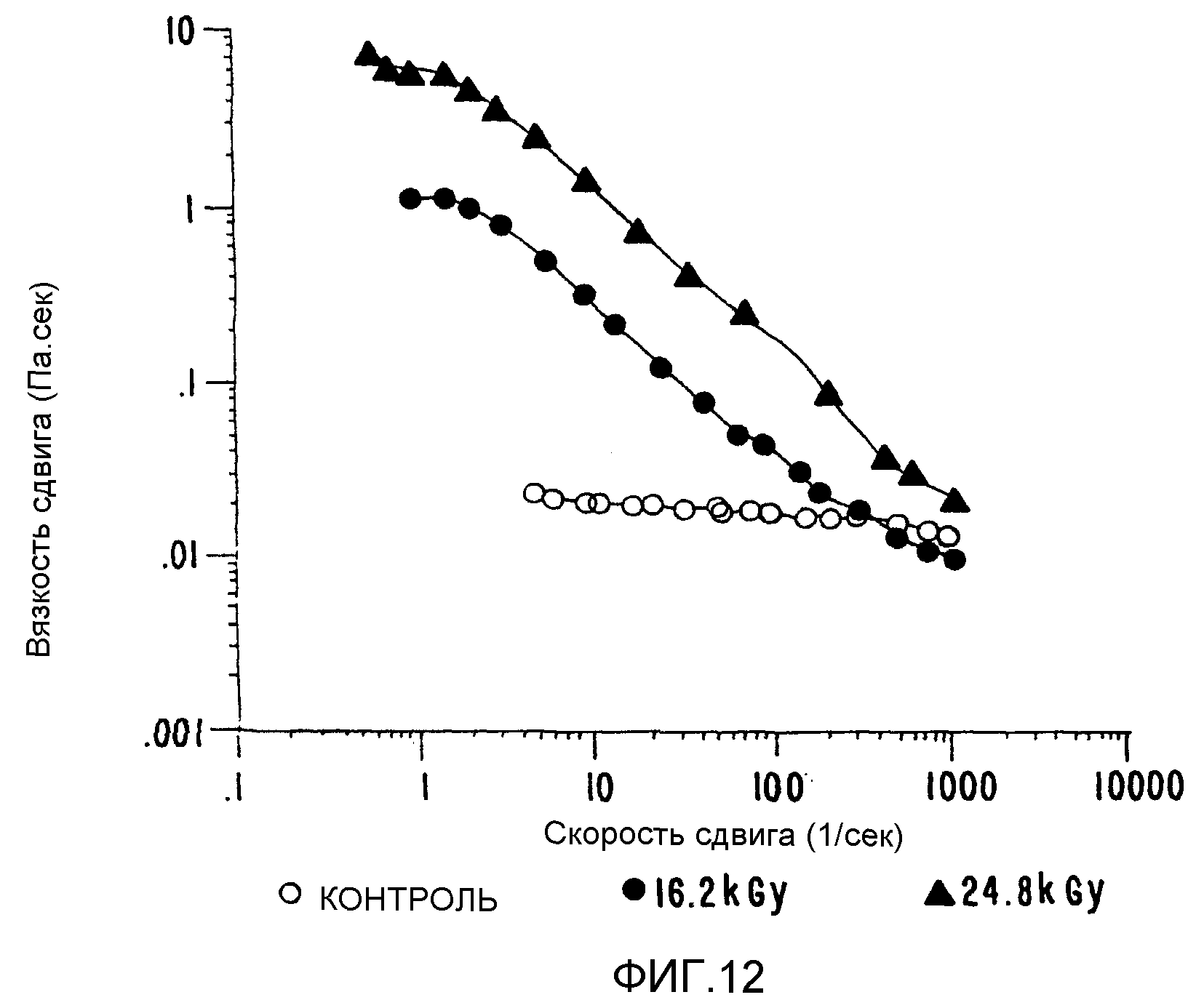
ФИГ.12. Кривая вязкости сдвига как функция скорости сдвига для 1% в Н2О образцов контрольного и облученного каппа-каррагенана. Раствор нагревают в течение 20 минут при 85°C и измерения проводят при 25°C. (о) контроль; (• )16,2 кГр;(▲) 24,8 кГр.
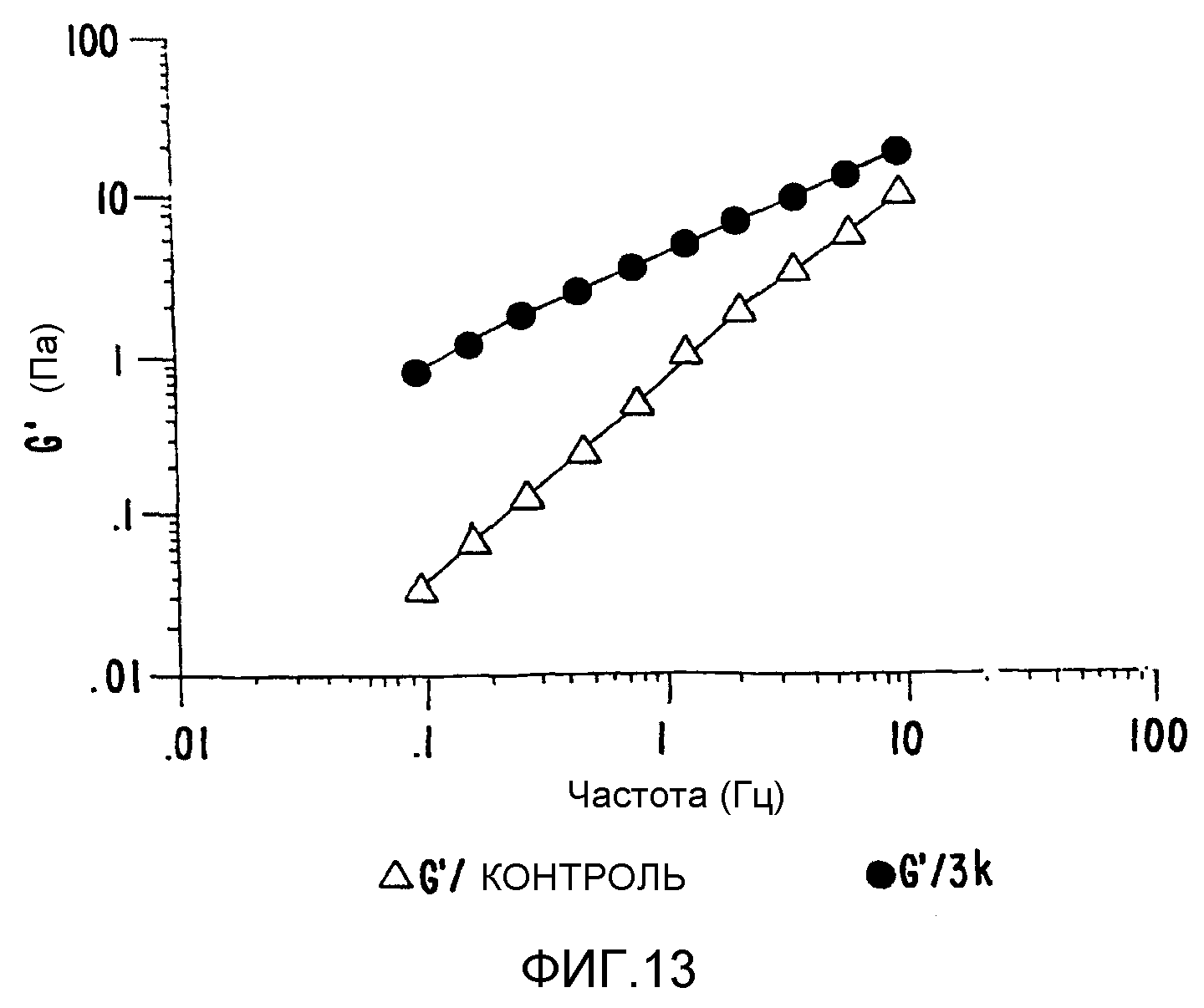
ФИГ.13. Кривая модуля сохранения (G') как функция частоты для 3,6% (вес/объем) в Н2О образцов контрольного и облученного апельсинового пектина.

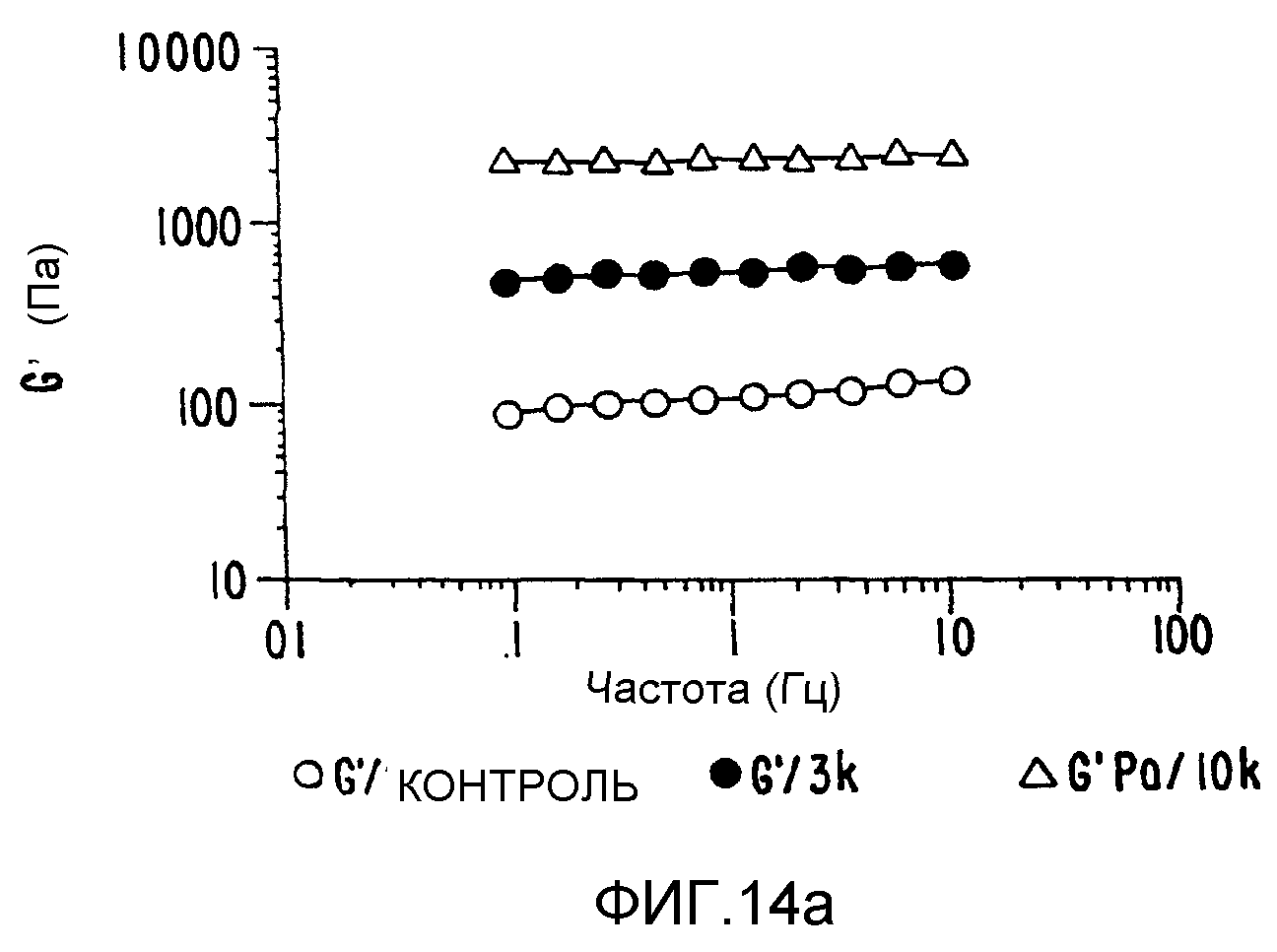
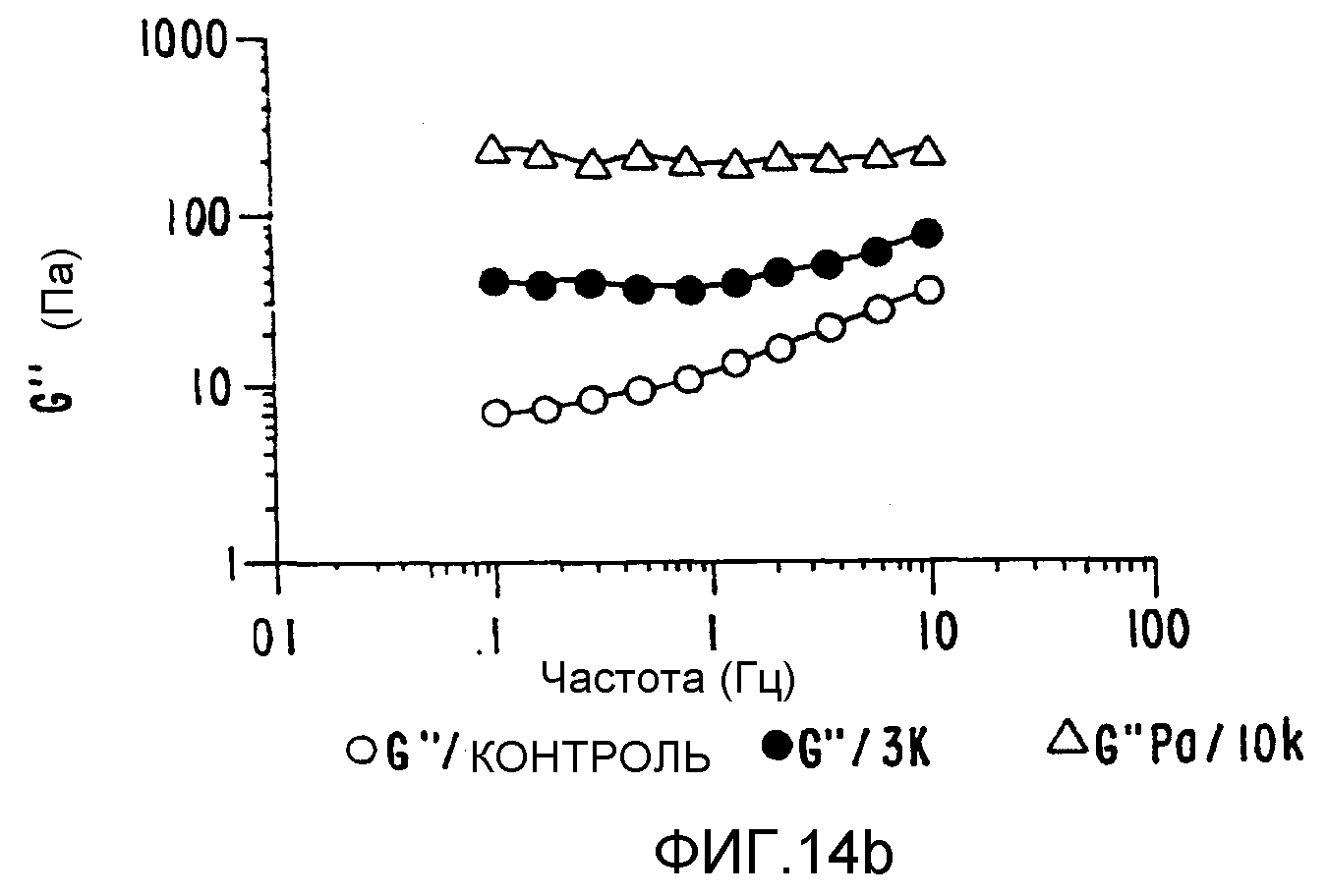
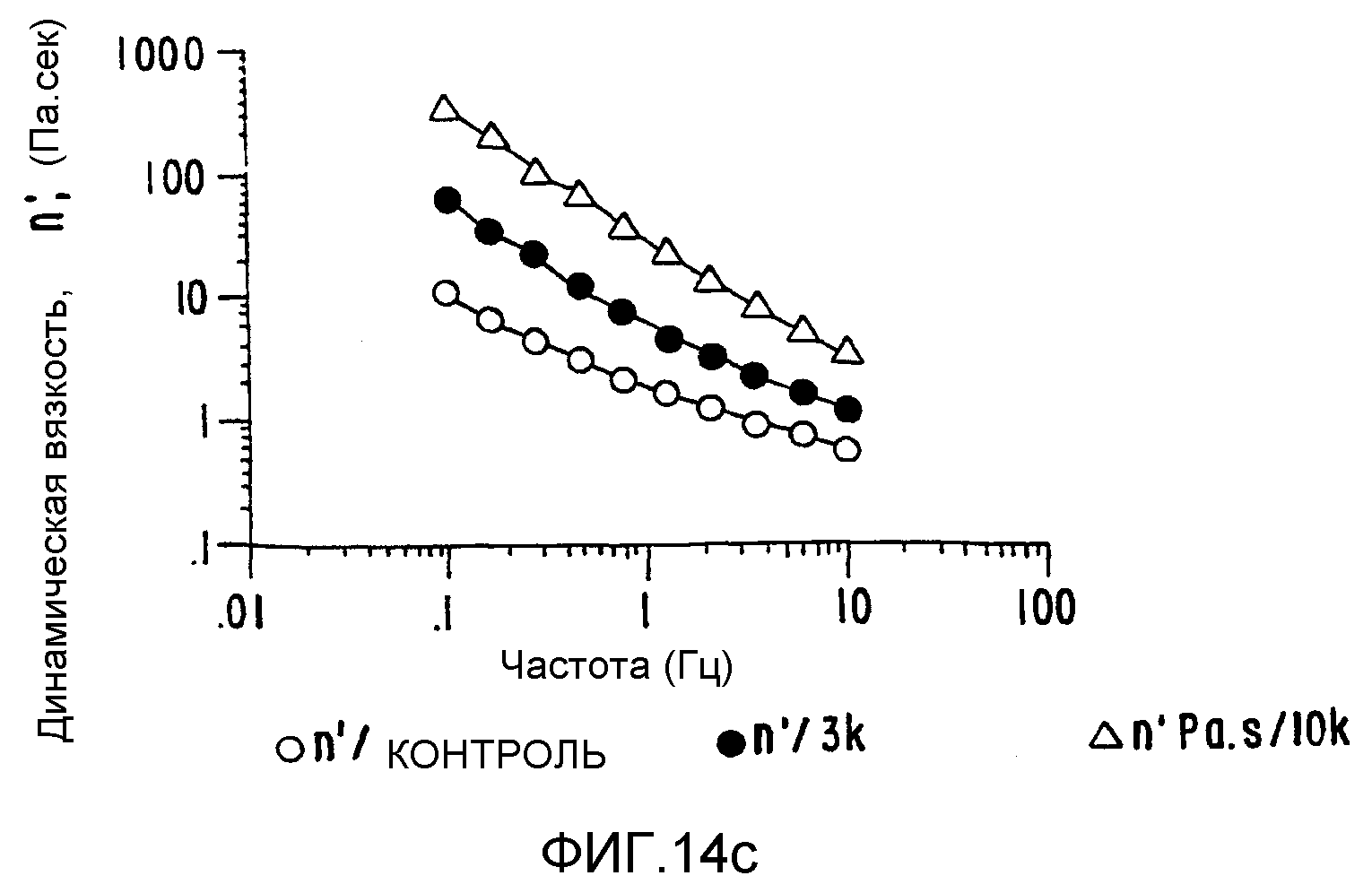
ФИГ.14. Кривые (а) модуля сохранения (G'), (b) модуля потерь (G") и (с) динамической вязкости как функции частоты для 10% (вес/объем) в Н2О образцов контрольного и облученного желатина. Образцы нагревают в течение 15 минут при 50°C и измерения проводят на охлажденных образцах при 25°C. (о) контроль; (•) 3 кГр;
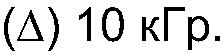
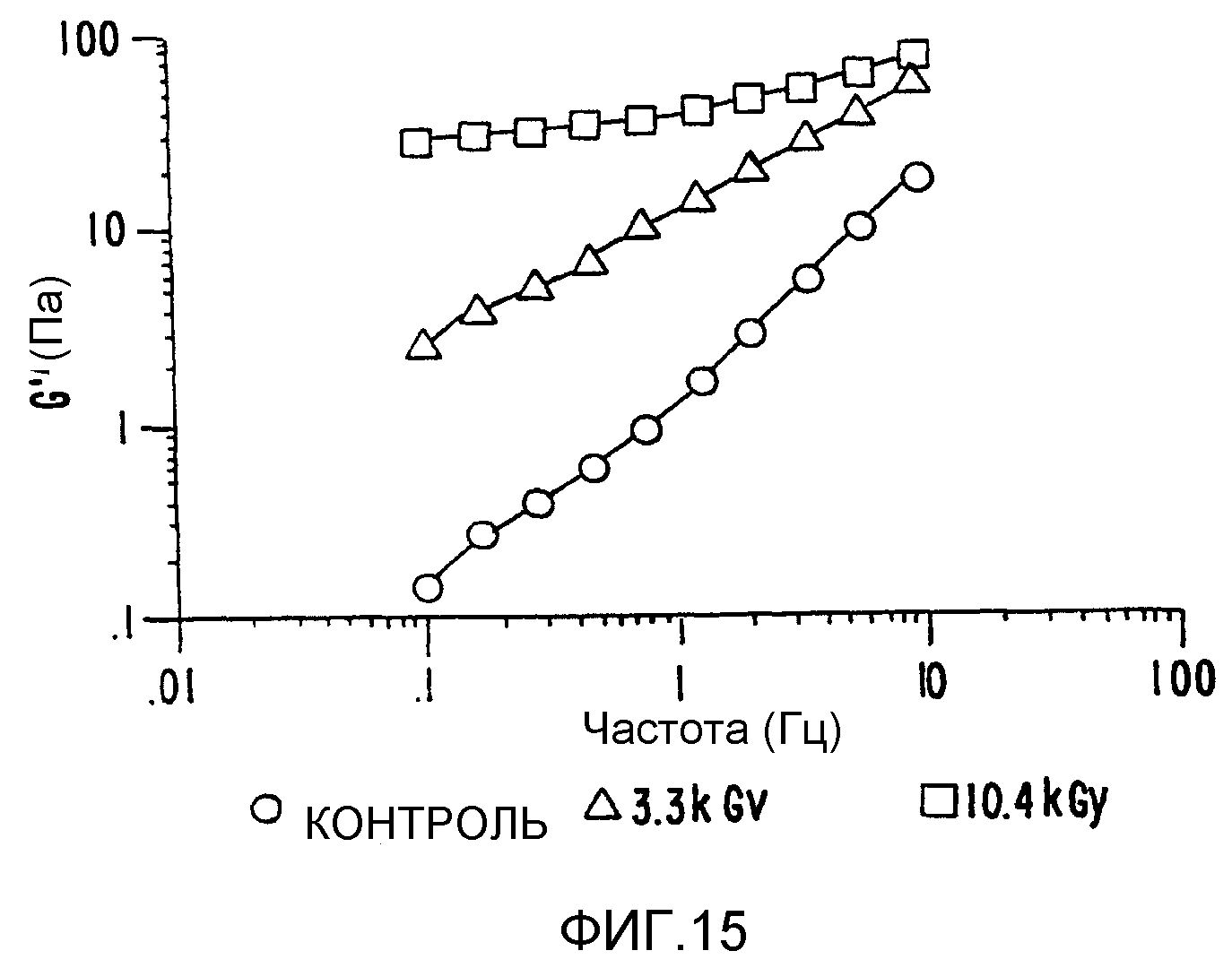
ФИГ.15. Кривая модуля сохранения (G') как функция частоты для 4% (вес/объем) в Н2О образцов контрольного и облученной смеси 90% апельсинового пектина +10% СМС. (о) контроль,(•) 3,3 кГр, (▲) 10,4 кГр.
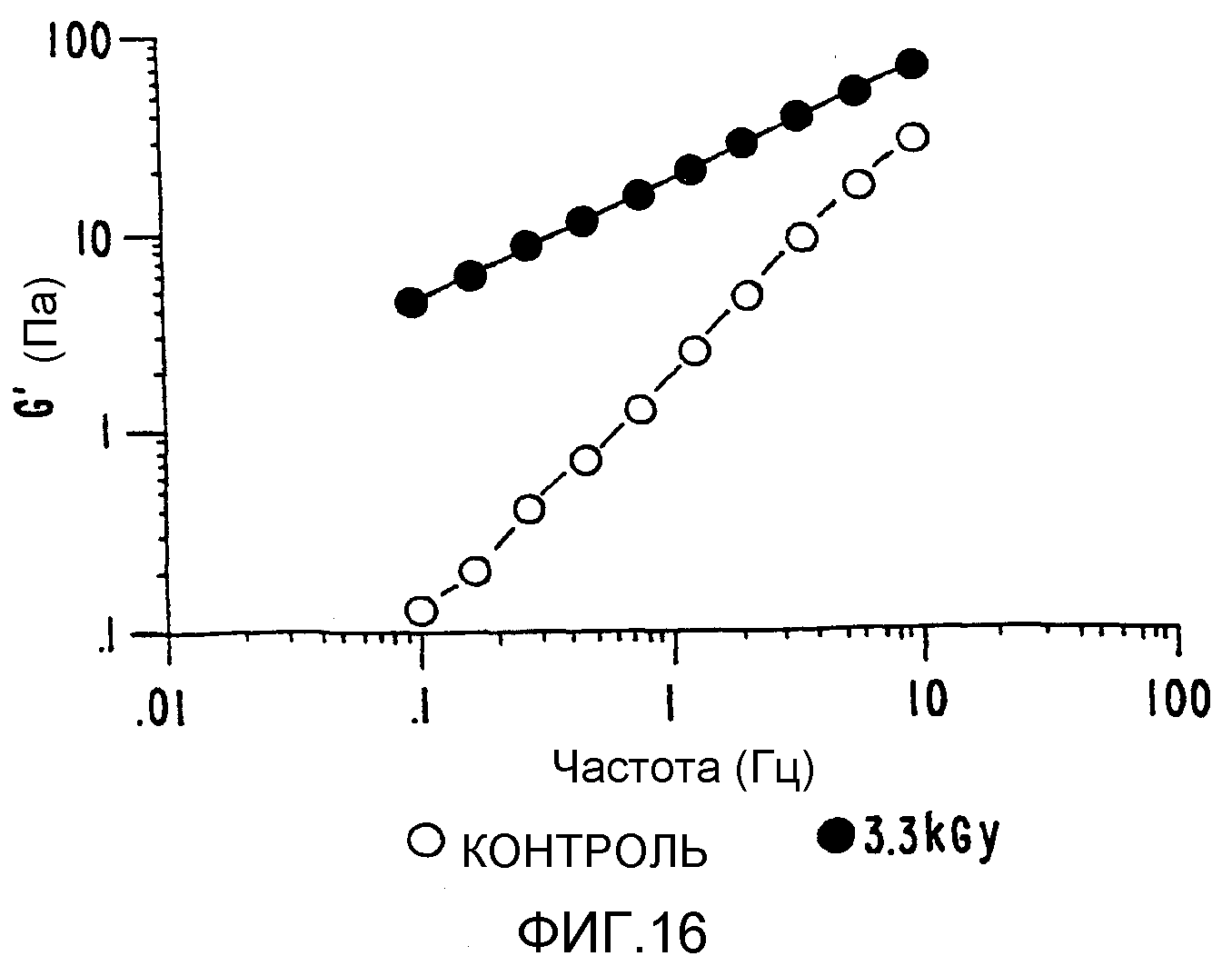
ФИГ.16. Кривая модуля сохранения (G') как функция частоты для 4% (вес/объем) в Н2О образцов контрольной и облученной смеси 90% апельсинового пектина +10% декстрана. (о) контроль,(•) 3,3 кГр, (▲) 10,4 кГр.
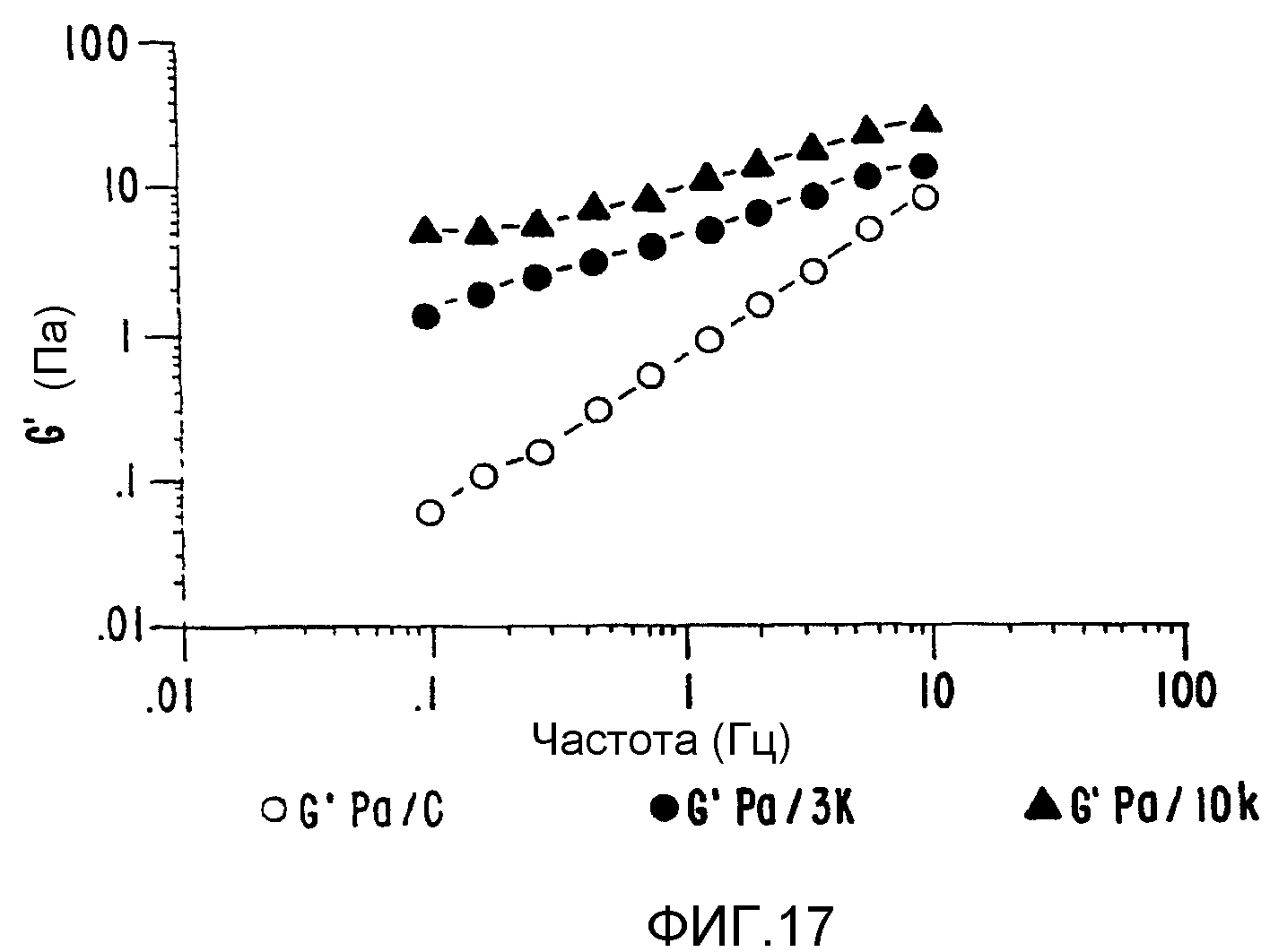
ФИГ.17. Кривая модуля сохранения (G') как функция частоты для 4% (вес/объем) в Н2О образцов контрольной и облученной смеси 50% декстрана +50% СМС. (о) контроль,(•) 3,3 кГр,(▲) 10,4 кГр.
ФИГ.18. Кривая динамической вязкости как функция частоты для 4% (вес/объем) в Н2О образцов контрольной и облученной смеси 90% поливинилпирролидона (PVP) +10% декстрана. (о) контроль,
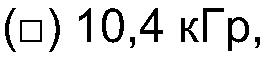
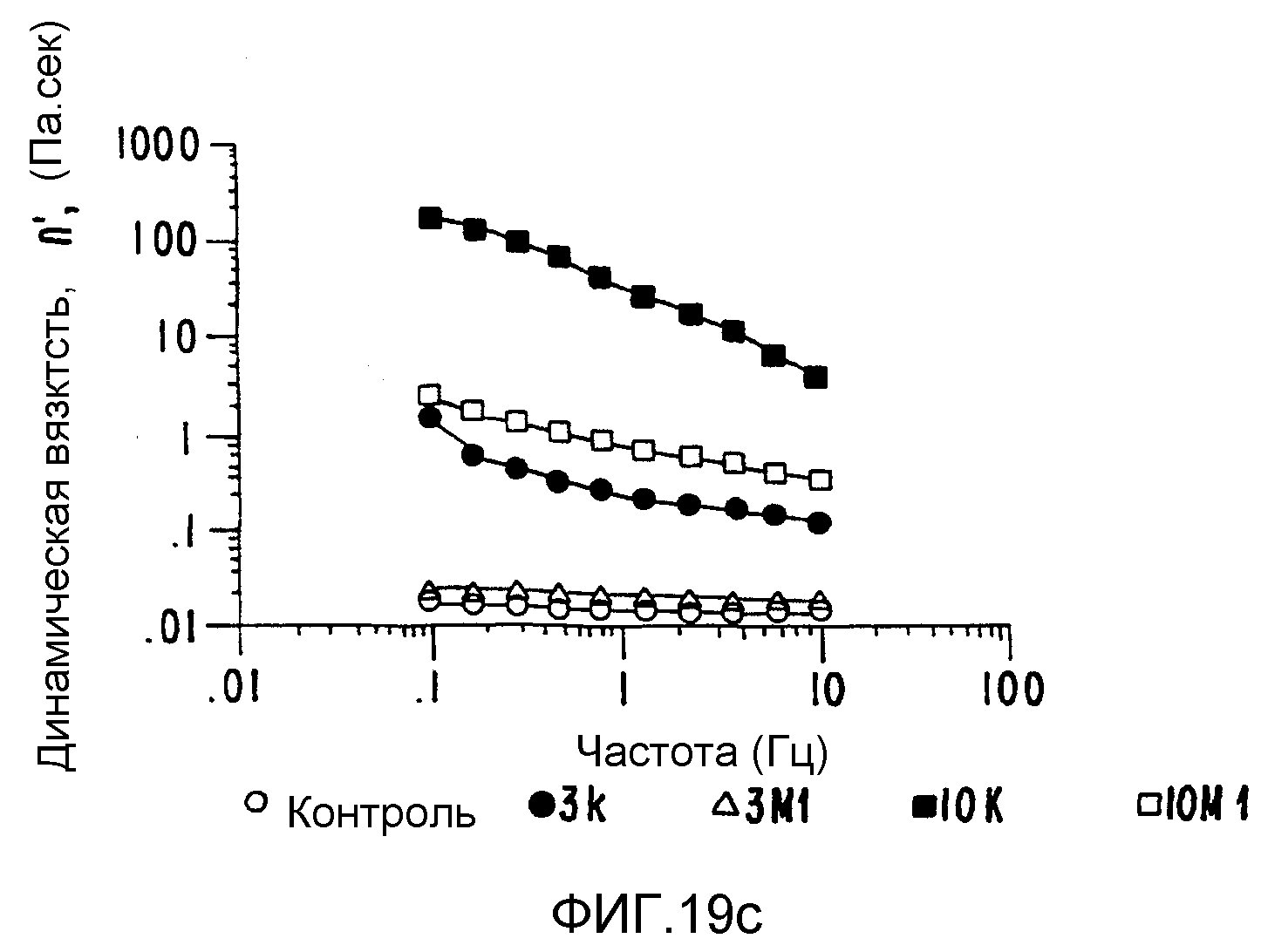
ФИГ.19. Кривые (а) модуля сохранения (G'), (b) модуля потерь (G") и (с) динамической вязкости (η') как функции частоты для 4% (вес/объем) в Н2О образцов контрольной и облученной смеси 50% поливинилпирролидона (PVP) +50% арабиногалактанового белка (гуммиарабик).

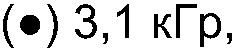
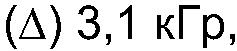
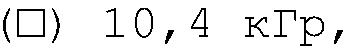
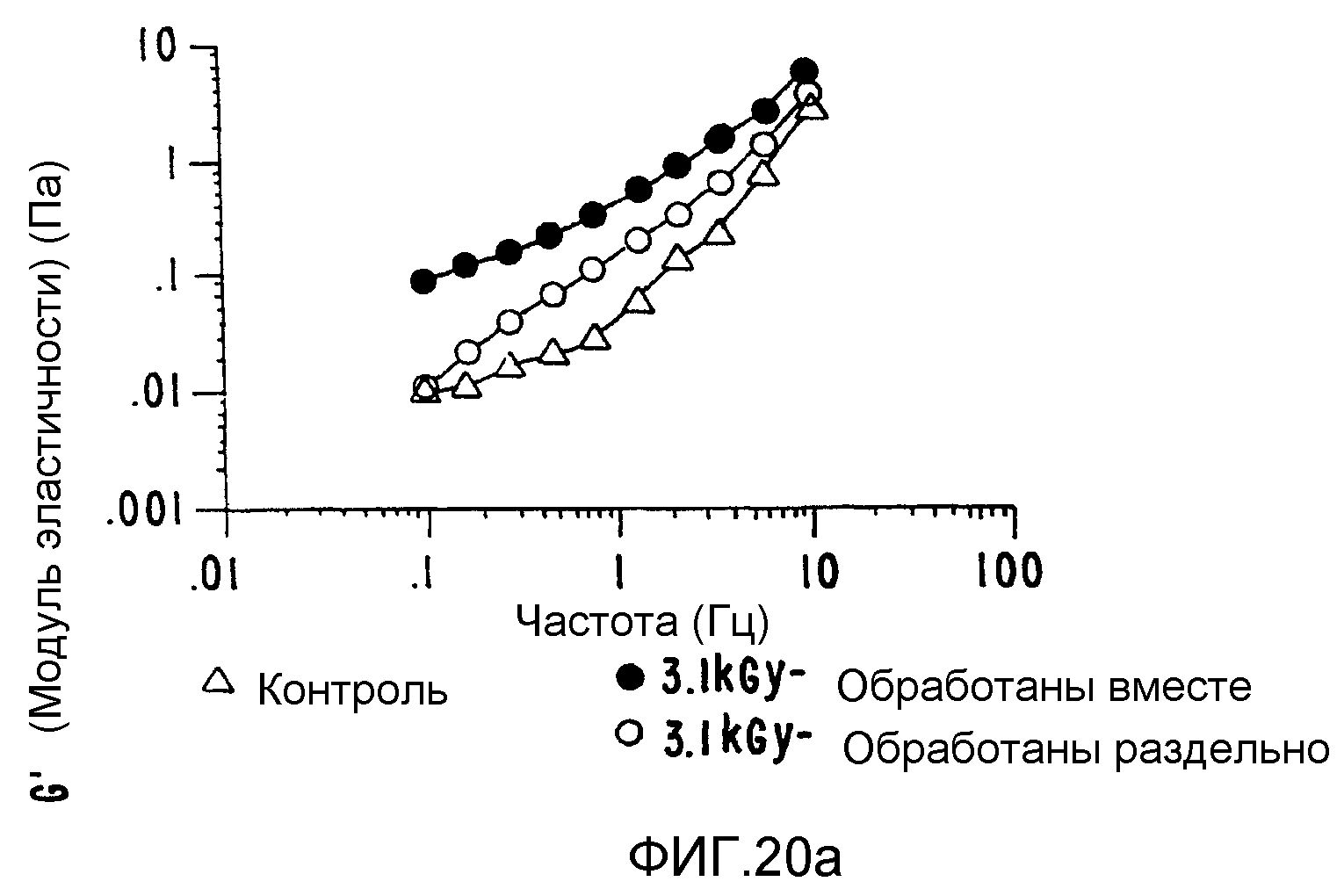
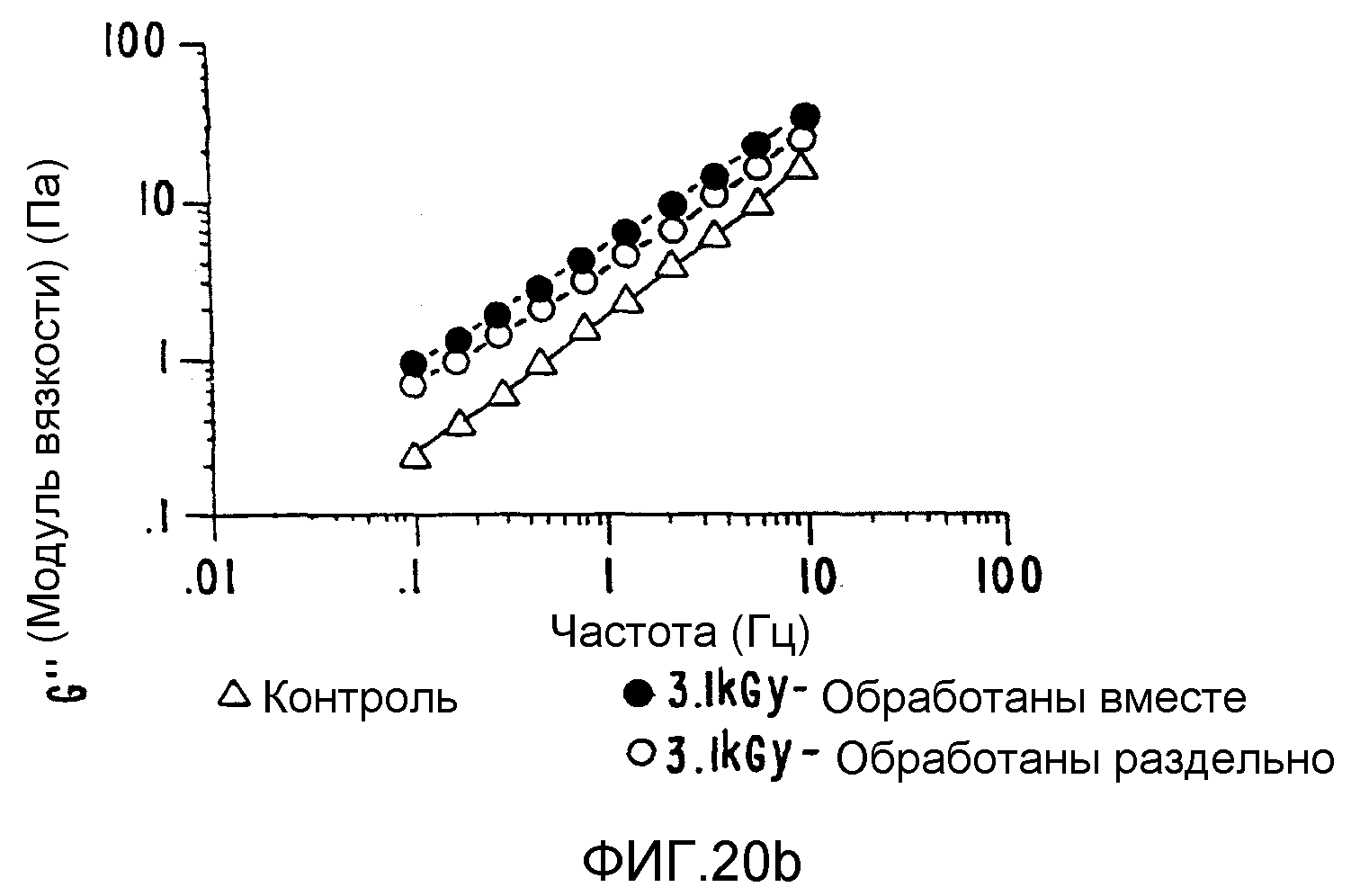
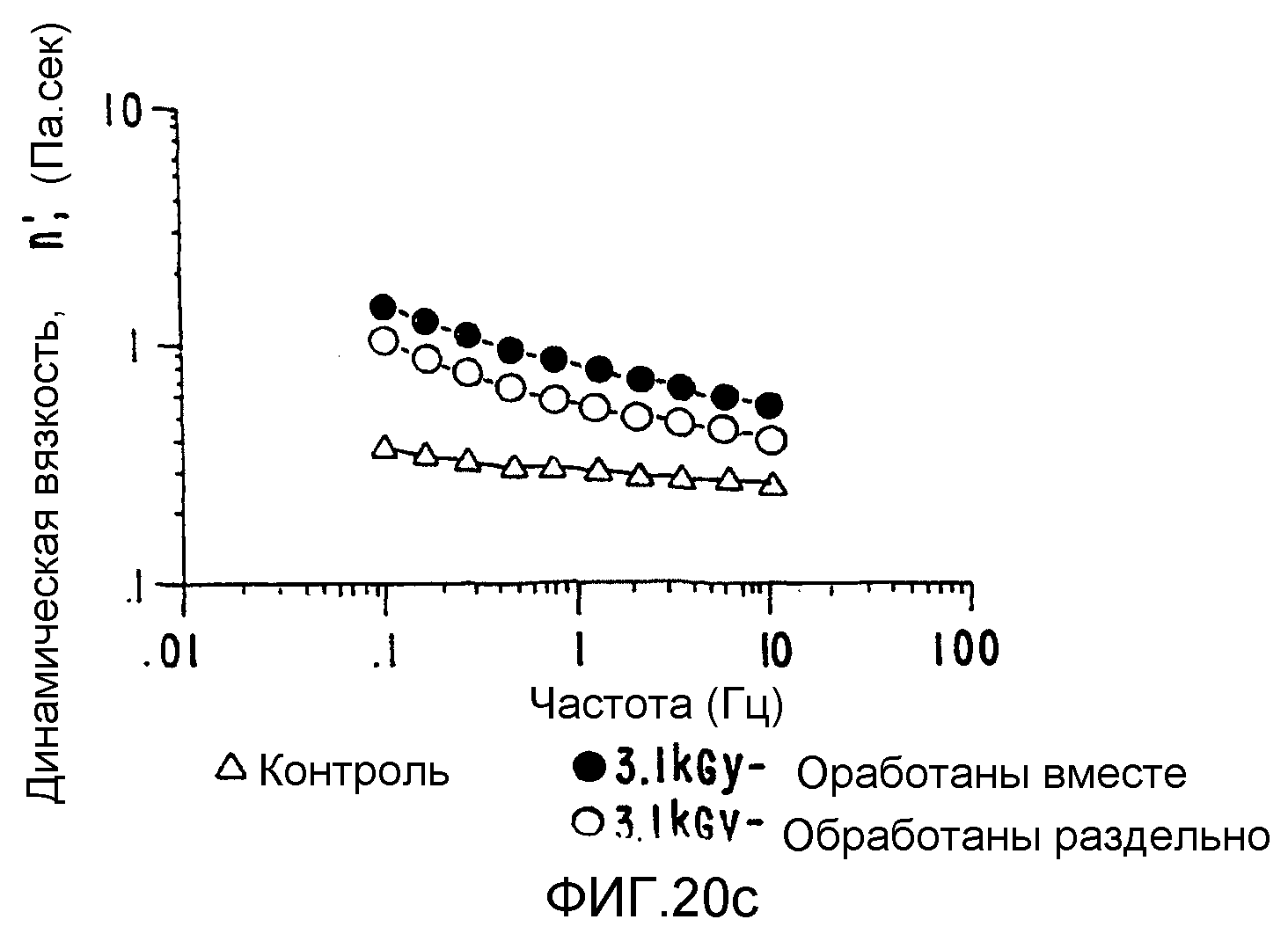
ФИГ.20. Кривые (а) модуля сохранения (G'), (b) модуля потерь (G") и (с) динамической вязкости (η')как функции частоты для 25% (вес/объем) в Н2О образцов контрольной и облученной смеси 10% карбоксиметилцеллюлозы (СМС) +90% поливинилпирролидона арабиногалактанового белка (гуммиарабик). (○) контроль,
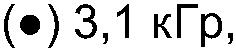
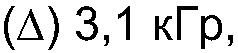
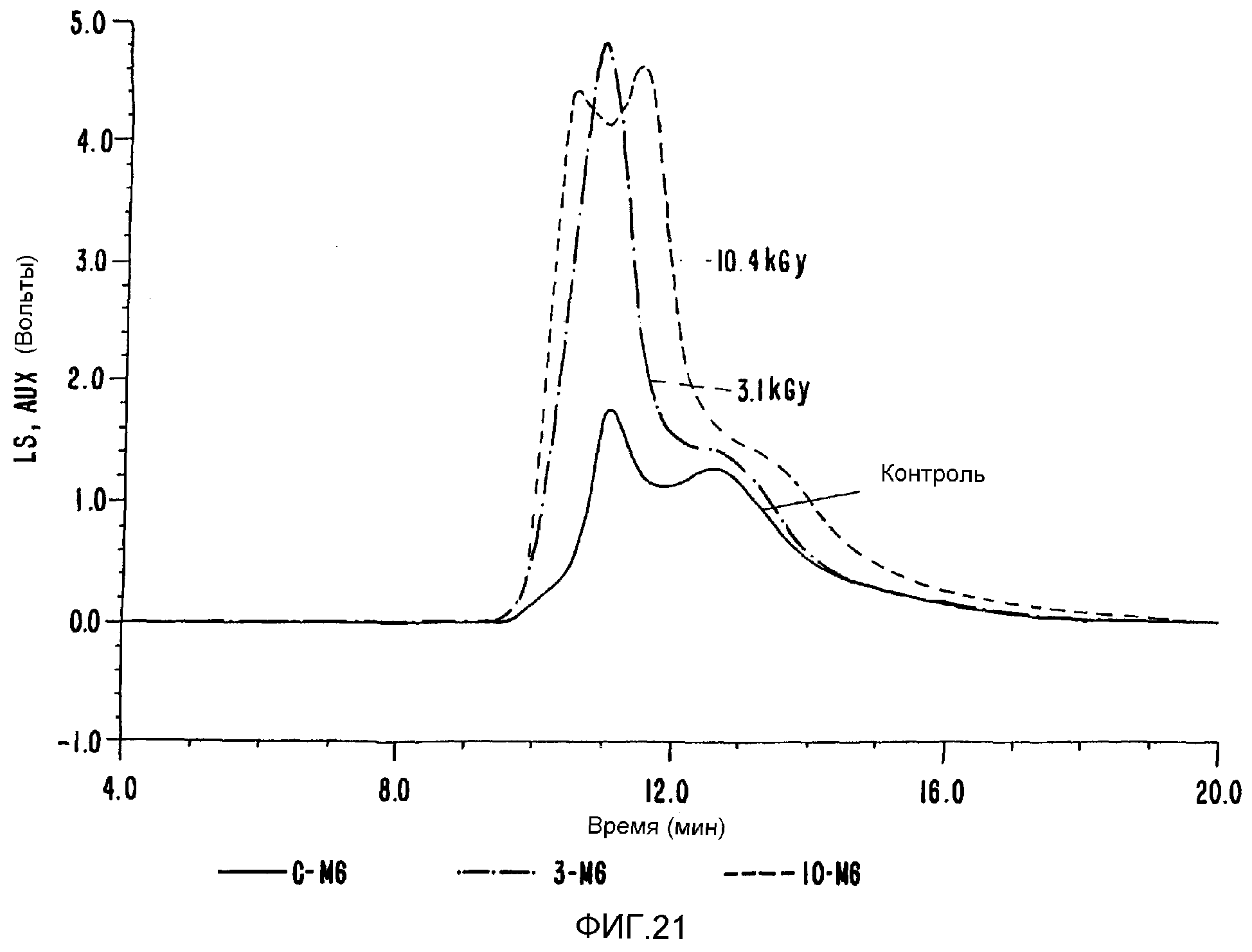
ФИГ.21. GPC-хроматограммы образцов контрольной и облученной смеси, содержащей 10% карбоксиметилцеллюлозы (СМС) +90% арабиногалактанового белка (гуммиарабик).
С-М6 контроль 3-М6 3,1 кГр 10-М6 10,4 кГр
ФИГ.22. Кривые (а) модуля сохранения (G'), (b) модуля потерь (G") и (с) динамической вязкости (η) как функции частоты для 4% (вес/объем) в Н2О образцов контрольной и облученной смеси 90% оранжевого пектина +10% декстрана.

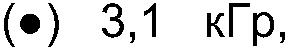
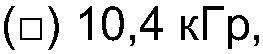
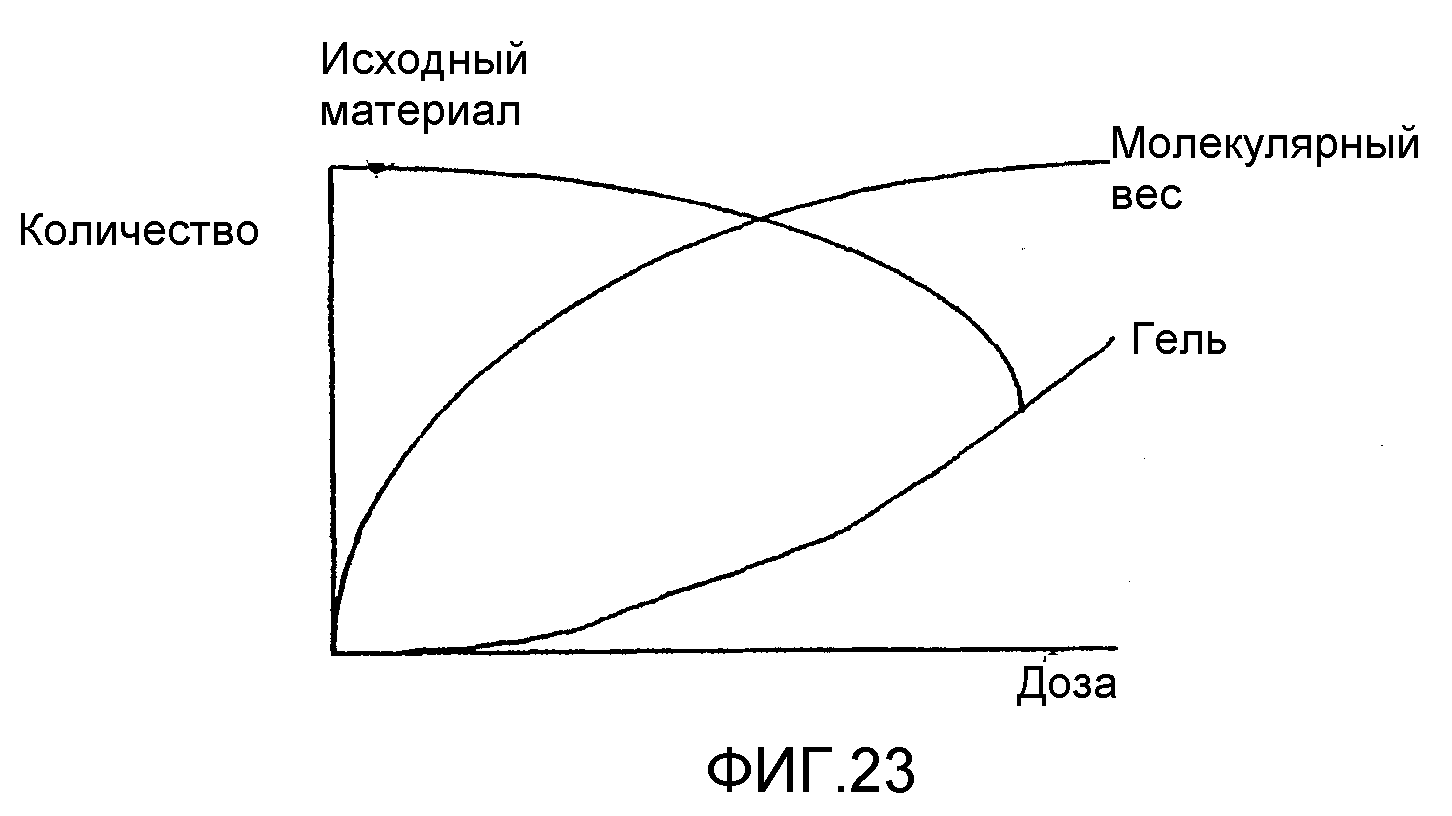
ФИГ.23. Схема превращения высокомолекулярной смолы акации в гидрогель под действием радиации.
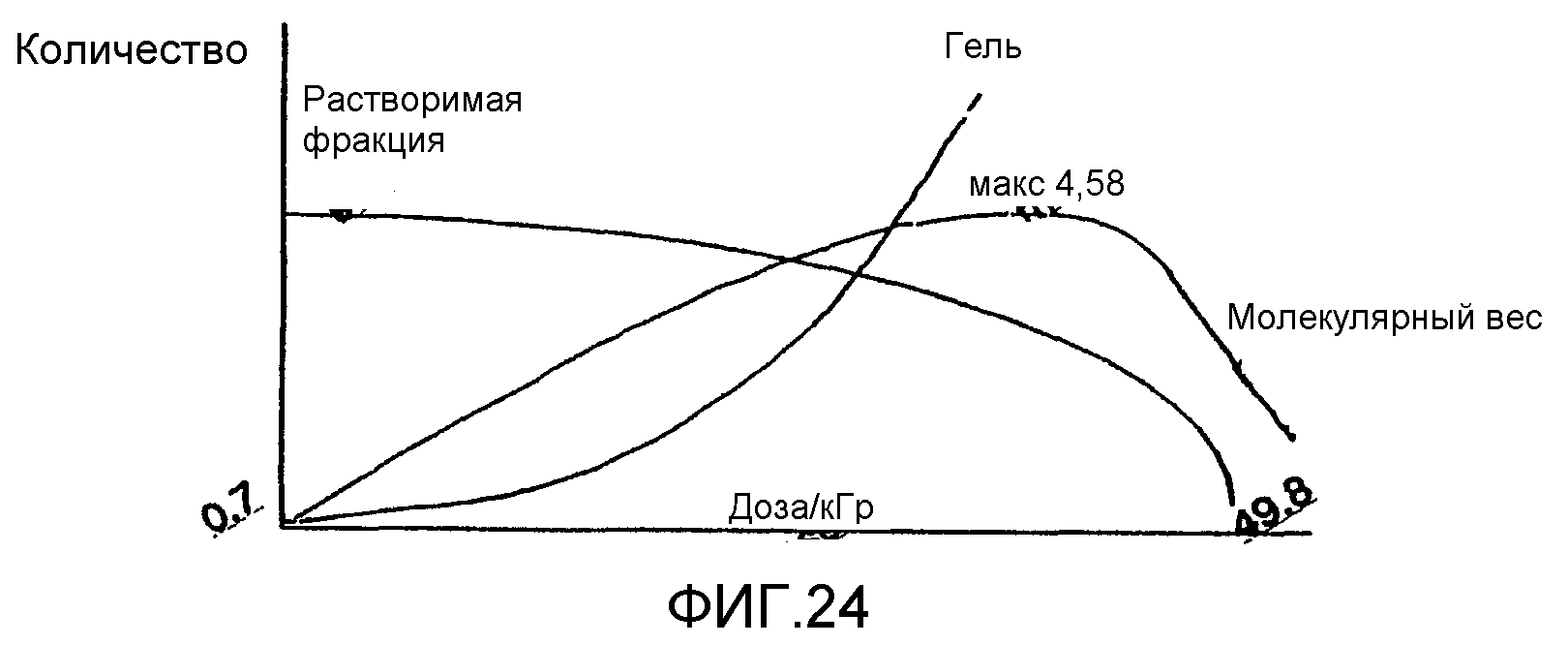
Фиг.24. Схема превращения декстрана в гидрогель под действием радиации.
Предпочтительный вариант осуществления изобретения
Далее настоящее изобретение будет раскрыто более подробно в следующих примерах, которые ни коим образом не ограничивают его объем, но просто его иллюстрируют.
Пример 1
Арабиногалактановые белки
Авторами были предварительно исследованы строение, свойства и функциональности смолистых экссудатов Acacia Senegal и Acacia Seyal, и эти виды включены в объем примеров и настоящего изобретения. Они также включены в описание материала, известного в продаже под названием гуммиарабик коммерческий (Gum Arabic of Commerce).
Эти материалы широко используются в промышленности в качестве адгезивов, стабилизаторов, эмульгаторов, сохраняющих вкус агентов, материалов, предотвращающих кристаллизацию сахара (в кондитерской промышленности), стабилизаторов типографских красок и т.д. Этот материал представляет собой глобулярный сшитый полисахарид, состоящий из арабинозы, галактозы, рамнозы и уроновой кислоты, соединенных вместе в полисахаридные фрагменты с молекулярным весом (МВ) примерно 400000, причем все глобулярные полисахаридные фрагменты соединены вместе как шарики на струне с белковой цепочкой. Белок составляет около 3%. Арабиногалактановые белки не являются дискретными молекулярными образованиями, так как по данным гидрофобности или фракционирования с исключением по размерам можно выделить два основных компонента с МВ примерно 1· 106 и 4-5·105.
Характеристика свойств, связанных с новыми полученными продуктами
Контролируемое увеличение молекулярного веса
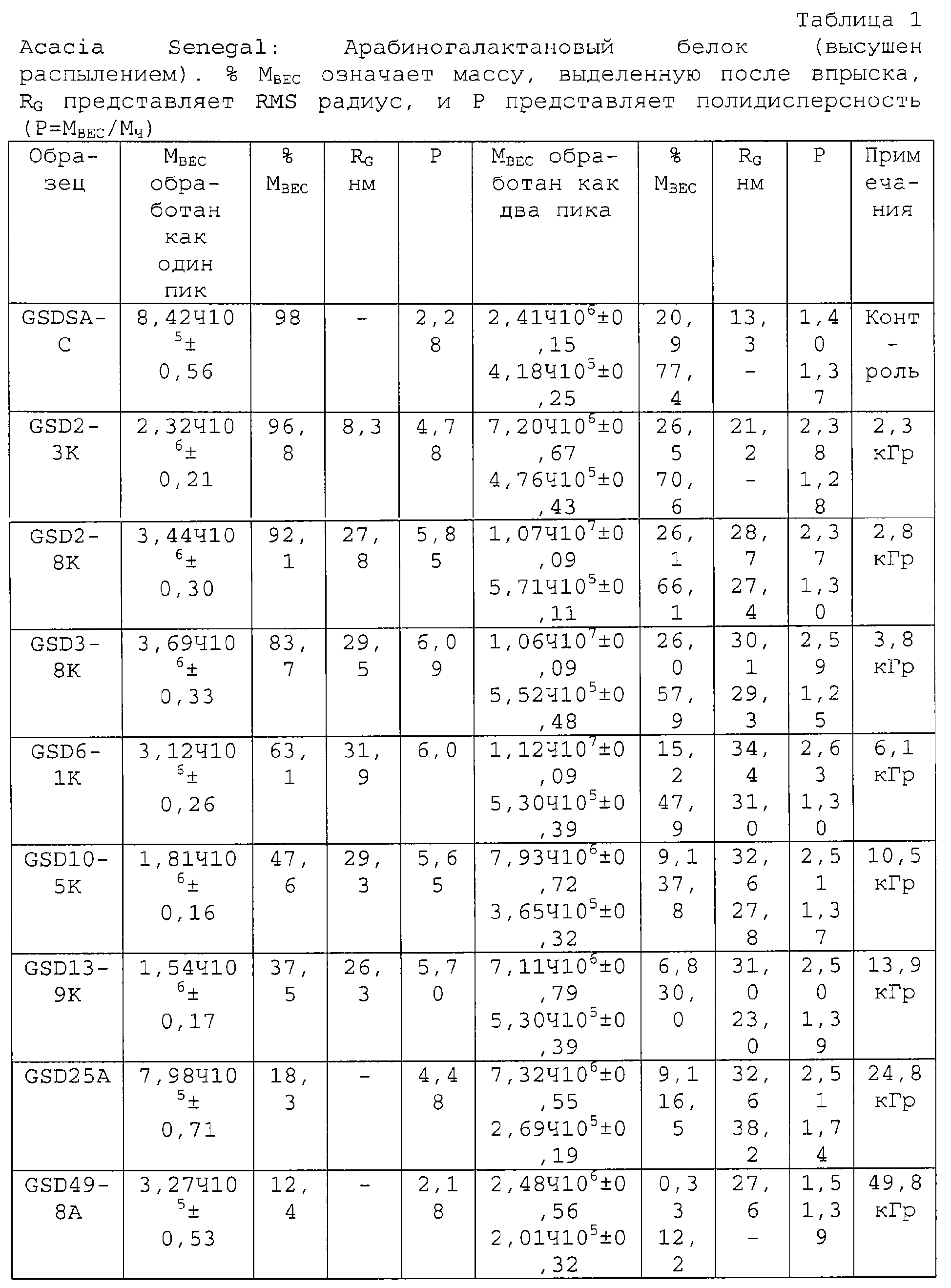
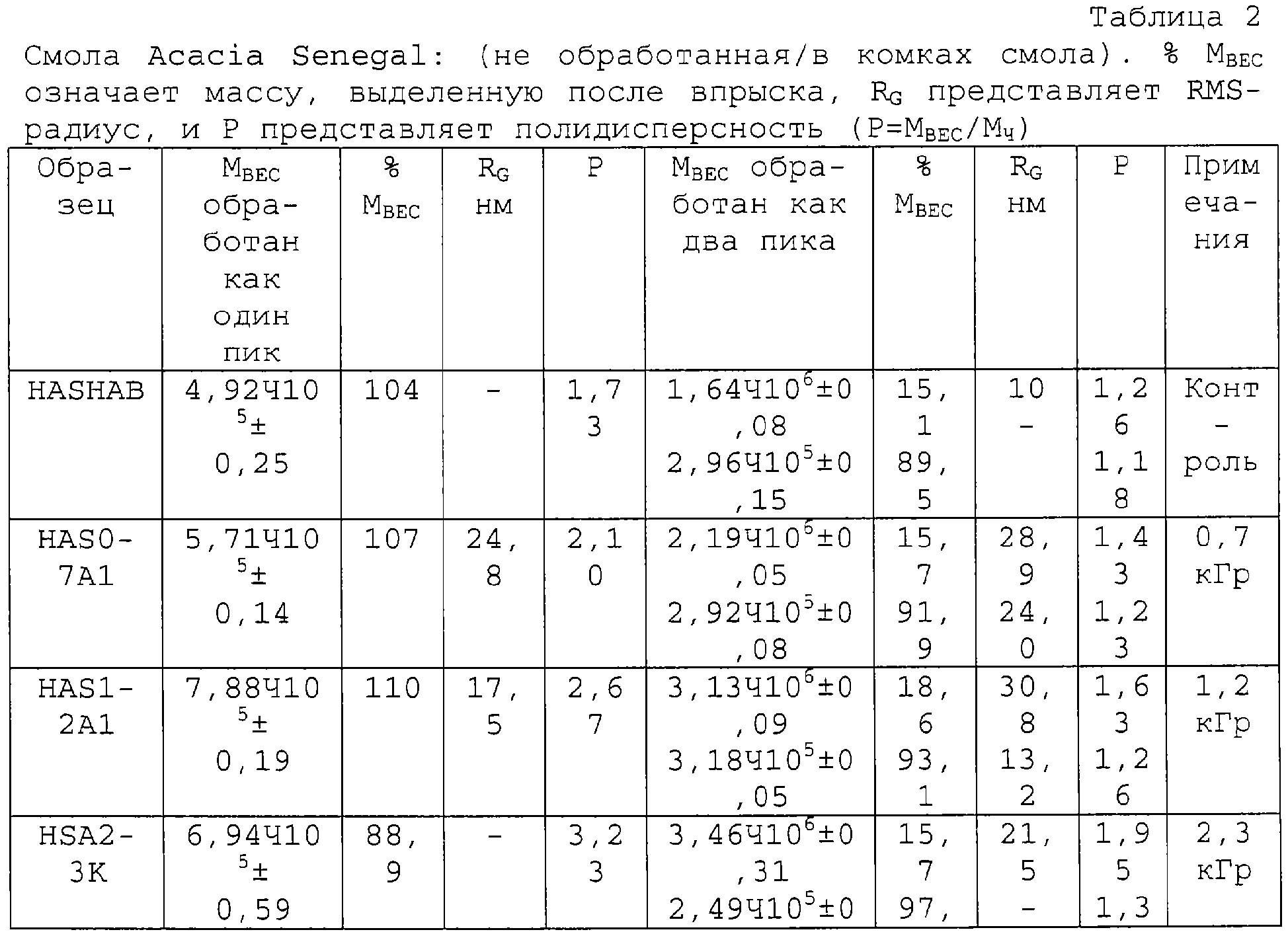
Способ настоящего изобретения позволяет осуществлять контролируемое увеличение молекулярного веса арабиногалактанов. Вначале исходный материал фракционируют, используя колонку для гельпроникающей хроматографии (GPC), соединенную с широкоугольным детектором рассеянного света лазера (MALLS), детектором концентраций (показатель преломления - RI) и детектором УФ-поглощения на длине волны 214 нм. Такая система позволяет определить молекулярно весовое распределение подлежащей измерению смолы, используя широкоугольное рассеяние света лазера, и, таким образом, используя эти три детектора, можно следить за любыми изменениями во всей структуре. Типичные изменения молекулярно-весового распределения представлены на ФИГ.1, а количественные результаты приведены в таблице 1 для представительной высушенной распылением смолы Acacia Senegal. Для того чтобы проиллюстрировать тот факт, что процесс сушки распылением не оказывает никакого влияния на общность наблюдаемых изменений, авторы провели точно такой же эксперимент, используя необработанную (в комках) смолу Acacia Senegal, и полученные результаты приведены в таблице 2, которые непосредственно оцениваются по 4 показателям. Наблюдается соответствующее увеличение среднеквадратического (RMS) радиуса для обработанной смолы.
2. Превращение в форму гидрогеля (различных размеров)
Путем создания контролируемой дозы радиации высокомолекулярную смолу акации можно превратить в гидрогель в соответствии со следующей схемой, представленной на фиг.23.
В таблицах 1 и 2 проиллюстрировано также, как можно последовательно превратить любое количество или долю растворимого арабиногалактанового белка в гидрогель. Более того, в соответствии с необходимостью можно изменять размеры частиц гидрогеля. Распределение частиц по отсечке демонстрирует, например, изменение от среднего примерно 160 мкм в сторону увеличения в системах отверждаемых гидрогелей до 2000 мкм и выше (ФИГ.2). Кривая для МВ затем постепенно повышается, причем значение для белка достигает даже 100·106, а связывание на этой стадии достигает такой степени, что частицы геля становятся хорошо видны. Эти частицы столь велики, что уже не могут попасть во фракционную колонку и представляют материал с наивысшим значение МВ, что объясняет выход на плато растворимой смолы после значения 6,1 кГр.
Увеличение доли высокомолекулярного эмульгирующего компонента
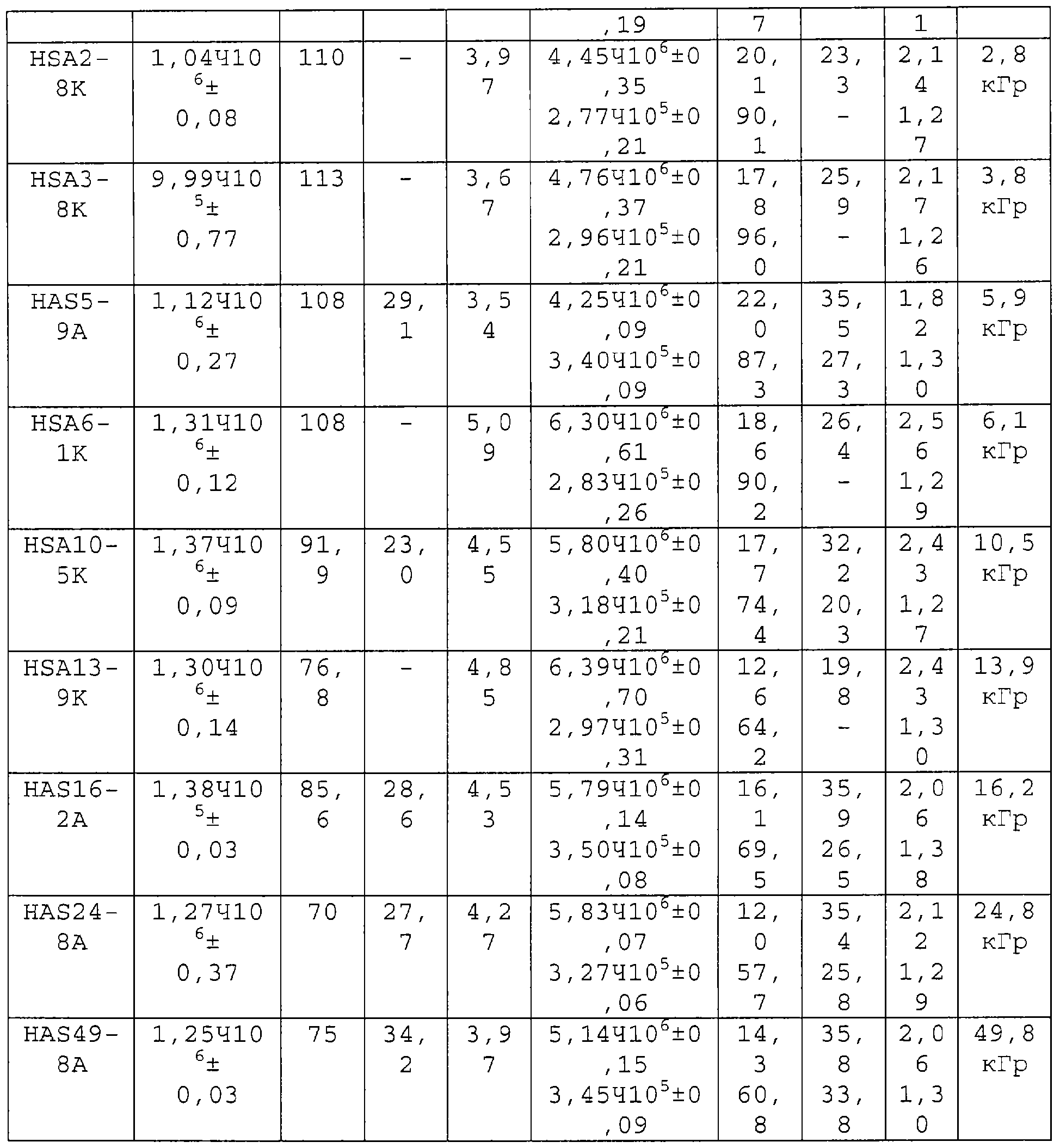
Высокомолекулярный арабиногалактановый белок (AGP), компонент смолы акации, отвечает за эффективность эмульгирования в эмульсиях типа масло-в-воде. Более высокое его содержание в Acacia Senegal по сравнению с Acacia Seyal делает эту смолу более ценной и, соответственно, более дорогостоящей. AGP покрывает капельки масла и предотвращает их повторную ассоциацию. Поэтому такие эмульсии оказываются стабильными в течение месяцев и даже лет. Увеличение количества этого компонента добавило бы ценности смоле. Авторы смогли продемонстрировать, что, используя способ радиационной обработки для Acacia Seyal, можно повысить долю высокомолекулярного компонента (AGP). Это повышение отражено в молекулярновесовом распределении и в RMS-радиусе; и таким образом получают новый материал, свойства которого приближаются к свойствам A.Senegal (таблица 3).
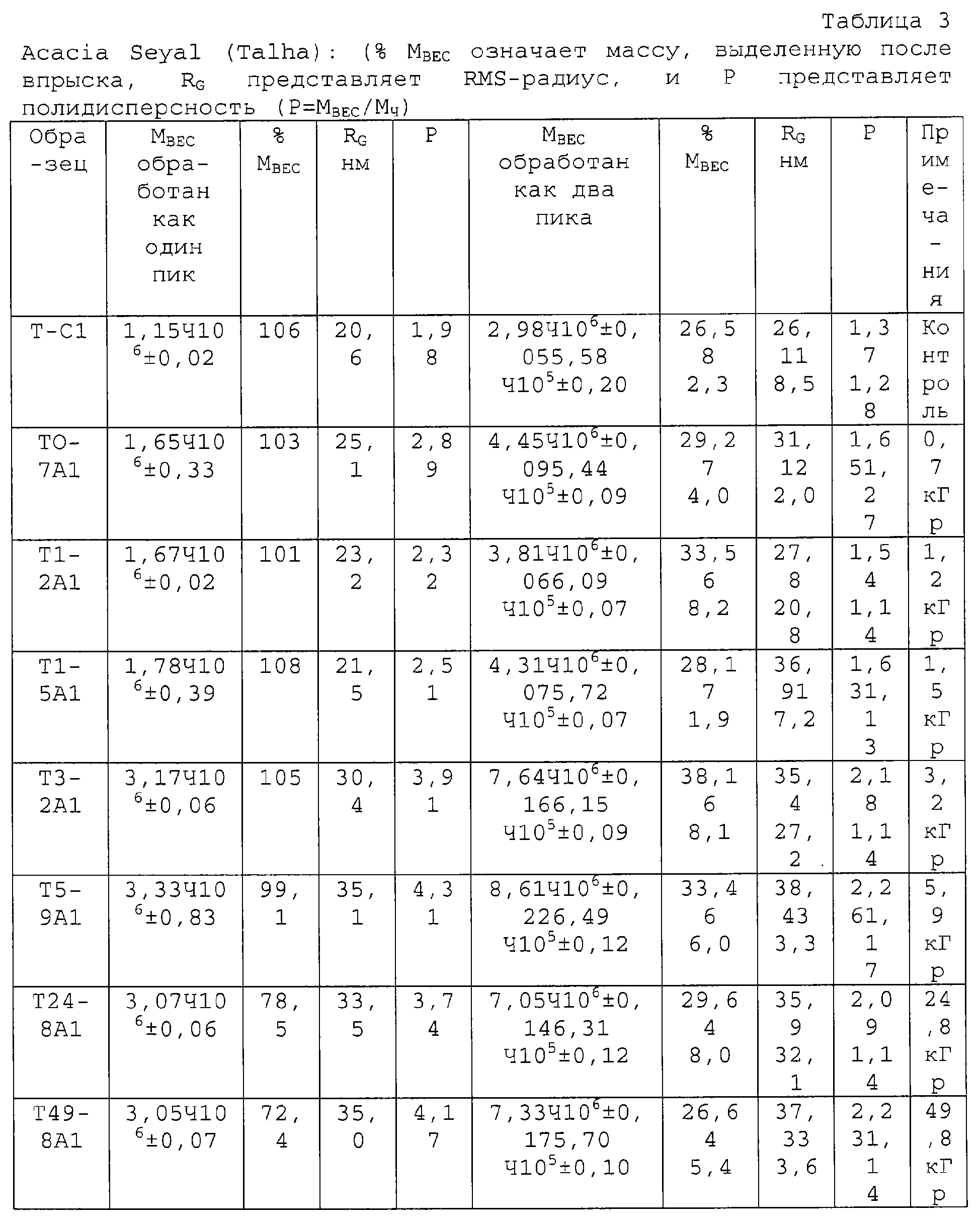
Таблица 3 иллюстрирует то, как молекулярный вес высокомолекулярного компонента можно повысить с 3 до 8 миллионов, при этом его количество увеличивается с 26% до 38%. Используя хроматографию гидрофобных взаимодействий (HIC), были выделены отдельные компоненты. Полученные результаты подтверждают увеличение доли AGP компонента, что отражено повышенным количеством белка по данным регистрации УФ-поглощения на длине волны 214 нм, что представлено на ФИГ.3.
Улучшенные характеристики эмульгирования
Оценивают модифицированные образцы смолы акации. Результаты оценки эффективности эмульгирования показали:
Когда Acacia Senegal превращена в новый продукт с более высоким значением молекулярного веса, доказано, что этот продукт является лучшим эмульгатором, нежели исходный, не обработанный контрольный образец.
Когда Acacia Seyal, более слабый эмульгатор по сравнению с Acacia Senegal, обрабатывают для увеличения ее молекулярного веса и для достижения того же количества высокомолекулярного компонента, что и в Acacia Senegal, ее характеристики оказываются столь же хорошими. Действительно, Acacia Seyal была превращена, по крайней мере, в отношении ее характеристик как эмульгатора, в более ценную Acacia Senegal.
Отсутствие введения новых химических групп
Используемые дозы радиации относительно низки по сравнению с теми, которые были бы необходимы для того, чтобы вызывать значительные химические изменения, если тот же материал облучают в отсутствие опосредствующего газа. Химический анализ показывает, что осуществление способа настоящего изобретения не приводит к значительным структурным изменениями, что и представлено в таблице 4.
Для точной оценки того, для которой из смол (обработанной или не обработанной) были обнаружены максимальные изменения молекулярного веса, проводилось сравнения13С-ЯМР спектров ядерного магнитного резонанса. Между обработанной и не обработанной смолой не было обнаружено никакой разницы (ФИГ.4а и 4b). То есть в результате обработки не было введено никаких новых химических групп.
Регулируемое увеличение вязкости и вязкоэластичности
Изменения вязкости сдвига по мере изменения скорости сдвига отражают наблюдаемые изменения молекулярных весов. Вначале смола представляет собой компактную глобулярную систему, которая не оказывает заметного влияния на сдвиг. На этой стадии полисахарид ведет себя как набор маленьких компактных шариков, не уменьшая сдвига. По мере увеличения дозы радиации, используемой при обработке, образуется переплетенная сеть, которая типична для более длинных переплетенных молекул, когда можно наблюдать уменьшение сдвига (ФИГ.5). Наблюдается, по крайней мере, 1000-кратное увеличение вязкости при нулевом сдвиге после дозы 13 кГр.
Измерения колебаний также подтверждают вышеуказанные наблюдения (ФИГ.6а и 6b). Кривые зависимости модуля сохранения (G'-ФИГ.6а) и модуля потерь (G"-ФИГ.6b) построены как функции частоты. И снова, построение динамичной сети отражено в изменении от реакции разбавленного раствора (то есть G">G') до концентрированного раствора (G'>G") при смещении частоты перехода в сторону более низких частот при возрастании МВ), и наконец, до поведения плотного геля, когда G' и G" не зависят от частоты. Кривая динамической вязкости аналогична кривой сдвиговой вязкости, которые представлены на ФИГ.5, причем уменьшение сдвига проявляется как результат образования сетчатой структуры, способной создать затруднения, при увеличении дозы. Таким образом, вязкость можно увеличить как это нужно, и при необходимости систему можно превратить в гидрогель, который представляет собой высокоэластичное состояние.
Улучшенное взаимодействие с водой (Улучшенные характеристики связывания с водой)
В результате увеличения размеров молекул можно регулировать свойства связывания с водой арабиноглактанового белка. Это продемонстрировано с использованием импульсной спектрометрии ядерного магнитного резонанса.
Времена спин-спиновой релаксации (Т2) для водных растворов обработанных и не обработанных Acacia Senegal и Acacia Seyal представлены в таблице 5. Измерения проводили, используя 25 МГц импульсный ЯМР при 30°C. Был выбран полностью растворимый образец Acacia Seyal, для которого очевиден только один тип Т2. Так как Т2 объема воды меняется с 2 до 4 сек, а значения, полученные для образцов Acacia Seyal, составляли 1 сек или меньше, очевидно, что движения молекул воды ограничены смолой акации. Другими словами, образцы акации связывают воду. Исследования авторов с использованием дифференциальной сканирующей калориметрии ранее продемонстрировали эффективность связывания воды смолой акации. См. "Hydration characteristics of the gum exudate from Acacia Senegal, G.O. Phillips, et al, Food Hydrocolloids, Vol 10 (1), 1996, pp 11-19.
Как видно из таблицы 5, величина Т2 уменьшается по мере увеличения молекулярного веса. Это показывает, что количество связанной воды возрастает с увеличением молекулярного веса.
Высушенные распылением образцы Acacia Senegal демонстрируют два типа значений Т2, так как выбранные образцы смолы содержат гелевую компоненту. Однако тот же характер изменения наблюдается для увеличения связывания воды с увеличением молекулярного веса для компонента свободной воды. Обратное справедливо для гелевого компонента. С повышением молекулярного веса структура гидрогеля становится более рыхлой, и степень иммобилизации воды уменьшается с молекулярным весом.
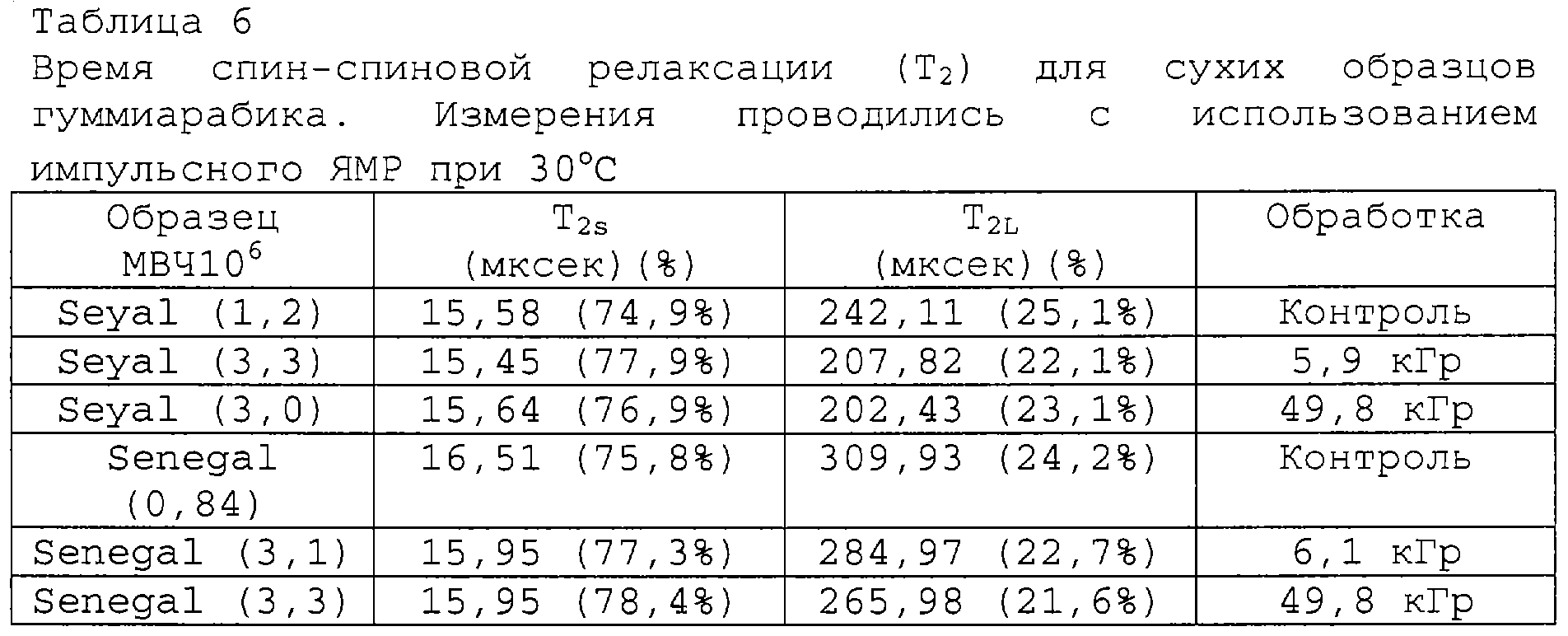
Измеряли также величины Т2сухих образцов, результаты представлены в таблице 6. Оба типа образцов демонстрируют два типа Т2. Т2S относится ко времени релаксации протонов ОН групп в смоле, а Т2L представляет время релаксации абсорбированной воды. И снова наблюдается эффект уменьшения времени релаксации за счет молекулярного веса, что совпадает с наблюдениями для водных растворов, и результатами, полученными на "сухих" образцах.
Пример 2
Природные (незамещенные) и химически модифицированные полисахариды
Аналогичного типа модификации можно осуществить для широчайшего круга доступных полисахаридов. Здесь будут раскрыты полисахариды, типичные для различных групп. Результаты будут суммированы, но тип уже раскрытой информации доступен и составляет часть формулы изобретения.
Описанный здесь процесс модификации можно осуществить для широчайшего круга доступных полисахаридных систем. Нет возможности проиллюстрировать его для каждого отдельного полисахарида и для тех, которые были химически модифицированы. Тем не менее, авторы выбрали представительные образцы из различных групп и семейств, чтобы показать, что одинаковые изменения можно осуществить для широкого круга таких материалов, и что поведение их универсально. В этом разделе авторы предлагают иллюстративные примеры, соответствующие объему продуктов, заявленных в представленной далее формуле изобретения.
ДЕКСТРАН - бактериальный полисахарид с разветвленной цепью
Как известно, основной скелет декстрана состоит из (1-6) связанных звеньев D-глюкозы с боковыми цепями, присоединенными к 0-3 звеньям основной цепи. Степень разветвленности была определена и составляет 5%. Существуют также некоторые указания на присутствие небольшой доли α-D(1-3) разветвлений. Однако многие аспекты тонкой структуры необходимо еще определить. Декстран используют как заменитель плазмы крови, и для этой цели необходимо, чтобы он имел различные молекулярные веса. Декстраны также используют в качестве стандартов при определении молекулярного веса. По этой причине было бы желательно иметь метод, который позволил бы точно подгонять молекулярный вес к конкретным значениям.
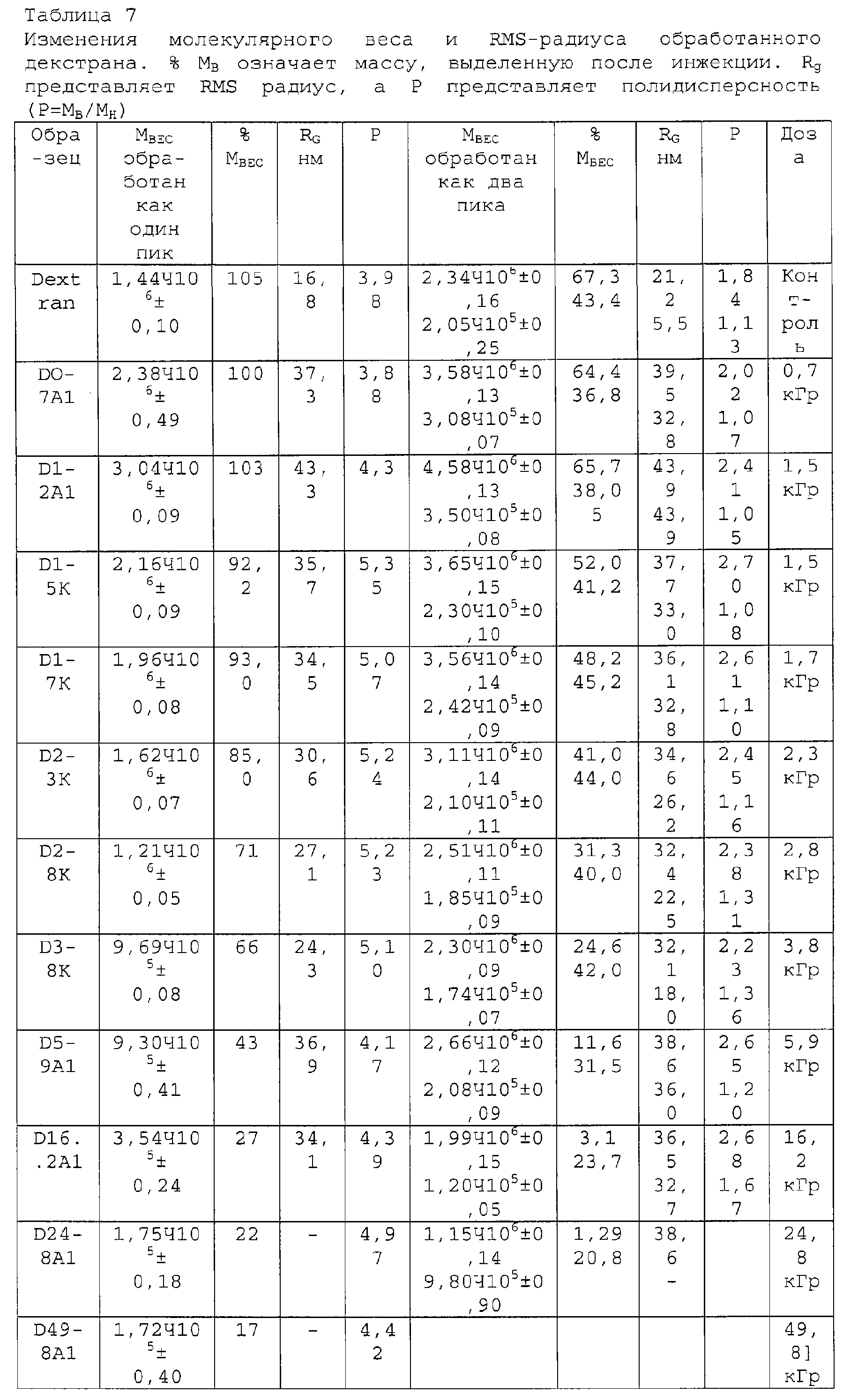
Для примера был выбран декстран с высоким средним молекулярным весом МВ (1,44·106), причем на его хроматограмме присутствуют два пика. Определяют средневесовой молекулярный вес для каждого из пиков, и найдено, что они составляют 2,34· 106 и 2,05·105. После облучения дозой 1,2 кГр происходит увеличение МВ средней компоненты (3,04·106), и компоненты с самым высоким значением МВ (4, 58·106). Молярномассовое распределение иллюстрирует общее увеличение в распределении МВ (ФИГ.7а). Гель начинает образовываться после дозы 1,2 кГр, о чем свидетельствует уменьшение выделяемой массы (таблица 7). И снова, образование геля возрастает с увеличением дозы облучения. С увеличением дозы уровни МВ выравниваются, а затем уменьшаются, так как гель образуется за счет сшивок высокомолекулярного растворимого полисахарида. После дозы 49,8 кГр, примерно 83% исходного материала уже не проходит через фильтр 1 мкм, и его используют для получения геля, который можно наблюдать визуально. Значение среднеквадратического радиуса (RMS) подтверждает увеличение МВ дисперсной полисахаридной системы, увеличиваясь с начального значения 26,8 нм до примерно 43 нм при наивысшем достигнутом МВ. Аналогичным образом возрастает полидисперсность (Р), демонстрируя уширение молекулярно-весового распределения у более высокомолекулярного конца хроматограммы (с 4 до 5). Подробности количественных изменений представлены в таблице 7.
С точки зрения реологии изменения вязкости обработанного декстрана очень значительны. Вначале кривая сдвиговой вязкости демонстрирует ньютонианский характер, который изменяется в сторону уменьшения сдвига при увеличении дозы облучения. Следует отметить, что даже хотя полный МВ при 24,8 кГр уменьшается, вязкость сохраняется, что указывает на то, что гелеподобный характер системы создается до образования геля. Измерения колебательных характеристик подтверждают вышеприведенные наблюдения, где возрастание G' и G" как функция дозы облучения представлено на ФИГ.7b, где четко прослеживаются изменения реакции от разбавленного раствора до концентрированного раствора и, наконец, до гелеподобной реакции.
Представленные далее изменения схематически иллюстрируют превращение растворимого материала в гель. Тщательно выбирая дозу и МВ, можно сконструировать нужную систему.
На Фиг.24 представлены частицы геля с распределением от 20 до 600 мкм.
Карбоксиметилцеллюлоза (СМС): химически модифицированный полисахарид.
Когда целлюлозу вымачивают в растворе гидроксида натрия и щелочную целлюлозу этерифицируют монохлорацетатом натрия, получают натрийкарбоксиметилцеллюлозу:
RЦЕЛ(OH)3+ClCH2COONa+NaOH=RЦЕЛ(OH)2(OCH2COONa)+NaCl+H2O
Так как на каждом D-глюкозопиранозильном фрагменте присутствуют три реакционноспособные гидроксильные группы, существует возможность ввести три натрийкарбоксиметильные группы на фрагмент. Такой продукт был бы весьма желателен, так как степень его замещения (DS) равна 3. Наличествующая в продаже СМС обычно имеет среднее значение DS менее чем 1,5. Прошедший обработку продукт был получен из целлюлозы с сохраненной у нее β-1-4 связью и имеет линейную структуру, и был выбран как структура, отличающаяся от раскрытых ранее глобулярных и сшитых полисахаридов.
Полученные результаты представлены в таблице 8. Очевидно, что снова изменения структуры можно обеспечить, используя радиационную обработку, даже для этой линейной структуры, которая естественно должна была бы скорее быть подвержена разрывам цепи под действием радиации. Исходная величина среднего МВ 1,55·105 при дозе 1,5 кГр возрастает в три раза до 4,44·105.Более того, характеристика полидисперсности улучшается с 2 до 2,8. Это хорошо видно на примере кривой дифференциального молярномассового распределения (ФИГ.8а) и соответственного увеличения Rg с 36 до 52 (см таблицу 8).
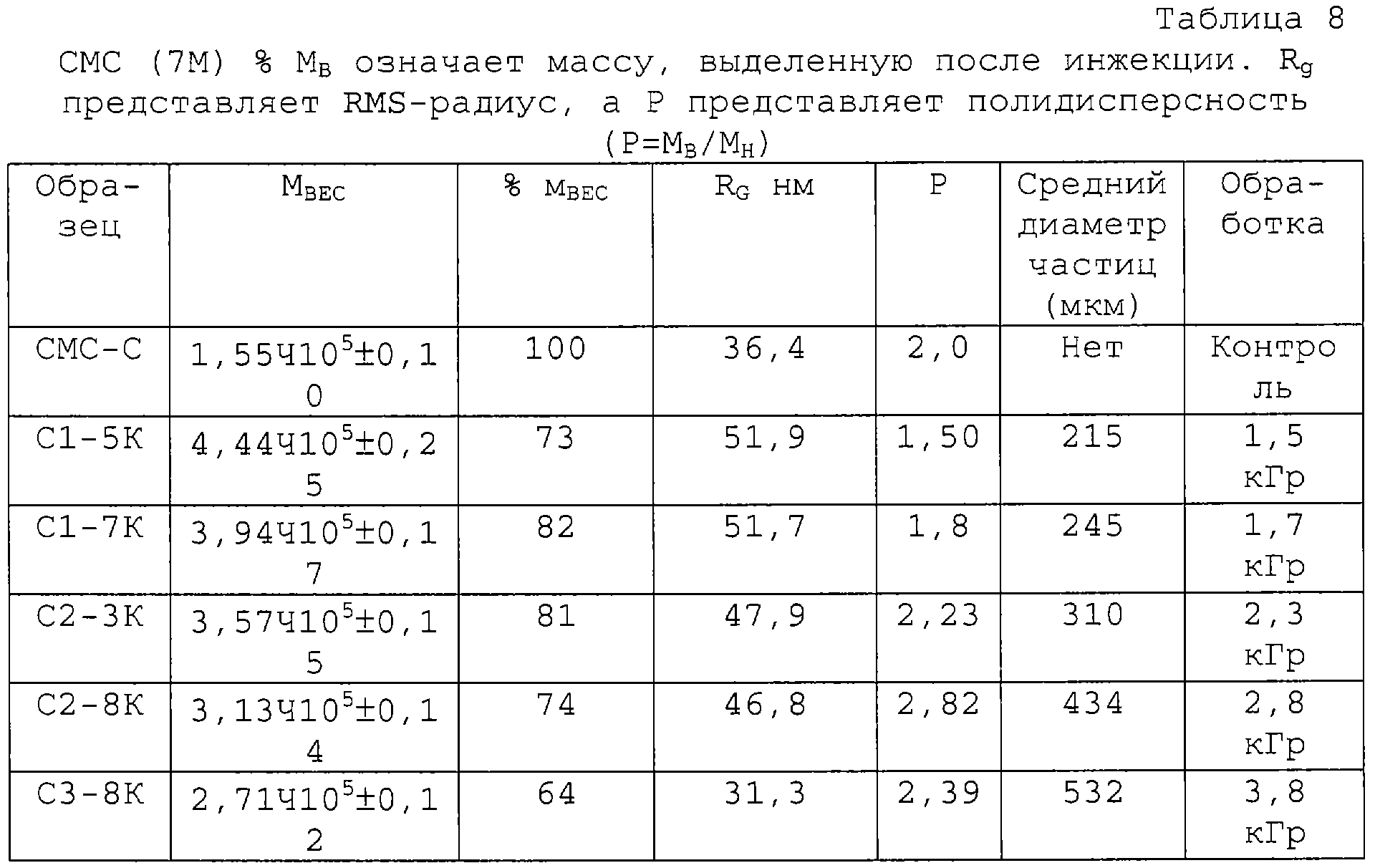
Изменения вязкости (ФИГ.8b) отражают изменения МВ, теперь с ожидавшимся уменьшением сдвига, связанным с более высоким молекулярным весом продукта. Гель образуется при более высоких дозах радиации и становится видимым в растворе. Гелеобразование в СМС растворе можно регулировать, чтобы получать стабильные по консистенции гели, начиная от мягких, перетекающих, до очень твердых. Результаты измерений колебательных характеристик представлены на ФИГ.8 с и 8d для G' и G", соответственно. При частоте 0,1 Гц наблюдается 10-кратное увеличение G' и G". Способ позволяет регулировать увеличение молекулярного веса и образование геля, которые возрастают линейно при увеличении дозы радиации, как представлено в таблице 8.
Образцы модифицированной СМС оценивают по их эффективности при применении в выпечке. Оценка оказалась весьма положительной, как видно из отчета на основании результатов, полученных на приборе Farinogragh для трех модифицированных образцов:
Следующие разъяснения помогут интерпретировать эти параметры: Стандартная СМС соответствует 7 MF, что является исходным материалом.
Термин размягчение теста означает изменение консистенции в процессе перемешивания. Чем лучше тесто сохраняет консистенцию, тем лучше; и соответственно, целью является высокая стабильность теста (измеряемая в минутах) и малое размягчение теста (измеряемое в единицах BRABENDER (произвольные единицы)).
Стабильность теста определяется количеством минут, на протяжении которых тесто сохраняет одну и ту же консистенцию, а размягчение теста определяют как изменение консистенции после фиксированного количества минут (обычно 12 минут).
Абсорбция воды представляет собой количество воды, которое необходимо добавить, чтобы обеспечить нужную консистенцию; т.е. если мука обладает высокой степенью абсорбции воды, она потребует больше воды для достижения этой фиксированной консистенции, нежели мука с низкой степенью абсорбции воды. Добавление гидроколлоидов может повысить абсорбцию воды, но часто это приводит к меньшей стабильности теста и к большему размягчению теста - что вполне логично, так как тесто содержит больше воды.
Выводы: как видно из таблицы 9, представленные образцы демонстрируют хорошие свойства абсорбции воды, превосходную стабильность теста и устойчивость в отношении размягчения теста. Это означает, что очень стабильное тесто с превосходными характеристиками перемешивания и хорошей абсорбцией воды можно получить, используя модифицированные в соответствии с настоящим изобретением образцы CMC-С1, С2 и С3.
Пуллулан: полисахарид грибкового происхождения
Пуллулан представляет собой глюкан, который внеклеточно вырабатывается грибками рода Aureobasidium. У этого глюкана линейная структура, состоящая из повторяющихся звеньев мальтотриозы, соединенных между собой α-D-(1-6)связями. В результате гидролиза пуллулана под действием пулланазы получается около 6,6% мальтотетраозы, что указывает на то, что пуллулан содержит некоторое количество мальтотетраозных звеньев.
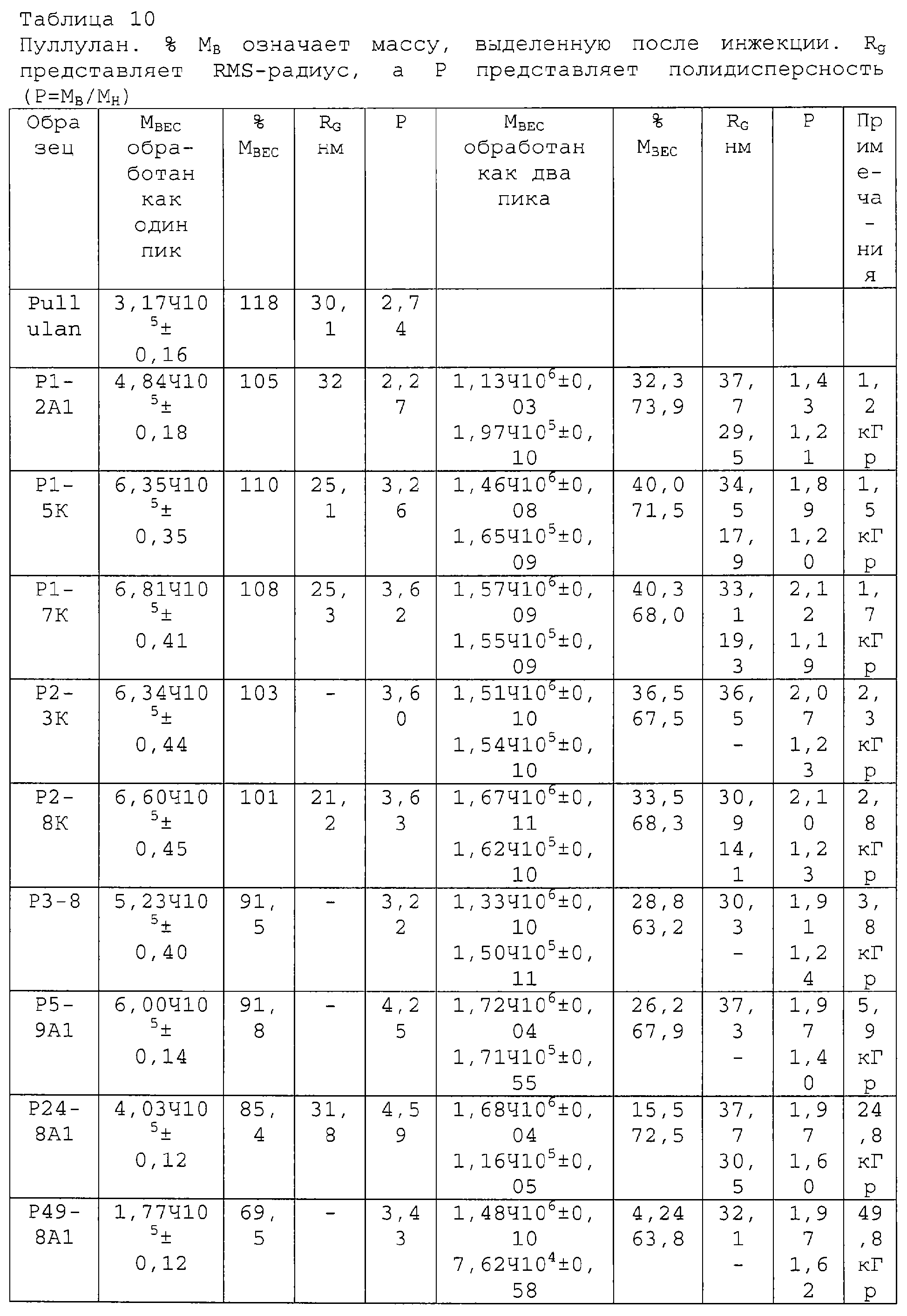
Пуллулан был выбран для экспериментов, так как он занимает промежуточное положение между СМС с линейной цепью и сшитым декстраном и сильно разветвленными глобулярными арабиногалактановыми белками. При радиационной обработке средний МВ удваивается с 3,17×105 до 6,81×105, и сохраняется на этом уровне до 2,8 кГр; и, кроме того, наблюдается превращение исходного материала с образованием геля после 3,8 кГр. После дозы 49,8 кГр оказывается, что около 30% исходного материала превратилось в частицы геля (таблица 10).
Очевидно, что для достижения оптимальных результатов необходимо определять дозы и условия облучения для каждой системы. Начальное молекулярно-весовое распределение демонстрирует два пика, причем один, с центром молекулярных масс, соответствующим 2,3×105, сдвигается до 3,5×105. Второй высокомолекулярный пик, соответствующий вначале 6×105, сдвигается после обработки до 1, 3×106. Молекулярно-весовое распределение уширяется (ФИГ.9а), и наблюдается уменьшение исходных дифференциальных весовых фракций, так как происходит образование более высокомолекулярного материала. Измерения G' (ФИГ.9b) свидетельствуют об улучшении реологических характеристик таким образом, который ожидается для высокомолекулярных материалов. Увеличение динамической вязкости после обработки хорошо коррелирует с вышеприведенной ФИГ.
Гиалуронан и гилановое семейство сшитых производных
Вначале гиалуронан (HA) подвергают радиационной обработке, используя энергию вплоть до 3,8 кГр. Наблюдается возрастание МВ с последующим образованием геля в системе гиалуронана. На ФИГ.10 представлены кривые сдвиговых вязкостей для гиалуронана, обработанного различными дозами радиации. Характеристики эластичности и текучести линейных полимерных молекул связаны с длиной молекул, гибкостью молекулярных цепей и с взаимодействиями сегментов полимерных молекул с другими сегментами тех же самых, или других полимерных молекул. На ФИГ.10а можно видеть, что при дозе 2,0 кГр образуются молекулы с большой молекулярной массой, что приводит к увеличению сдвиговой вязкости HA системы, хотя очевидно, что присутствует некоторое количество частиц геля. Однако, после увеличения дозы облучения до 4,0 кГр, частицы геля высокомолекулярного гидрогеля увеличиваются в размерах, и это можно осуществлять регулируемым образом. В результате наблюдается уменьшение сдвиговой вязкости. Изменения эластичности и вязкости в ответ на небольшую колебательную деформацию далее подтверждают вышеуказанные наблюдения, которые демонстрируют увеличение G' на ФИГ.10b.
Гилан представляет собой сшитое производное линейного гиалуронана, и можно достичь увеличения характеристической вязкости. Использованные дозы находились в том же интервале значений (0,828 до 4,435 кГр).
В результате обработки не было введено значительного количества новых химических групп, о чем свидетельствует тот факт, что спектры инфракрасного поглощения были идентичны для контрольного образца и для образца гилана, после облучения дозами 0,5, 1,0 и 2,0 кГр (ФИГ.10с). Не наблюдалось различий и в спектрах поглощения ультрафиолетового излучения для контрольного образца и образцов облученного гилана. То есть, в результате радиационной обработки в основную структуру не было внесено никаких изменений. Если обрабатывают гилан с исходным высоким молекулярным весом (6×106), гидрогель образуется даже после дозы 1,0 кГр. Объем и диаметр частиц геля представлены в таблице 12. Спектр размеров частиц показывает, что после дозы 2,0 кГр 75% частиц геля оказываются больше 335 мкм и 50% оказываются больше 673 мкм. Размеры гелевых частиц, и их образующееся количество можно регулировать, меняя условия облучения.
Гелеобразующие полисахариды: ксантан, пектин и каррагенан
Модификации, уже продемонстрированные для других групп полисахаридов, можно также применить в отношении широчайшего круга коммерческих полисахаридов, включая геллан, велан, гуаровую смолу, смолу бобов локусты, альгин, крахмал, гепарин, хитин и хитозан. Так как другими целями авторов являются модификация и улучшение характеристик гелеобразования, для иллюстрации универсальности процесса были выбраны хорошо известные полисахаридные желирующие продукты.
Ксантан
Химическая структура ксантана включает (1-4) связанный β-D-глюкановый (целлюлозный) скелет, замещенный в положении 3 на чередующиеся глюкозные остатки с заряженной трисахаридной боковой цепью. Дисперсии таких бактериальных полисахаридов демонстрируют слабое гелеподобное поведение. При сдвиге такая структура разрушается. При низких скоростях сдвига вязкость велика и образцы демонстрируют обратимое, уменьшающее сдвиг поведение. Невосприимчивость к рН, температуре и ионной силе можно обеспечить за счет соответствующего выбора экспериментальных условий. Обычно гелеобразование ксантана вызывают, добавляя двухвалентные и трехвалентные неорганические ионы, такие как боратные ионы. В описываемом здесь способе для достижения гелеобразования нет необходимости добавлять такие химические добавки, и процесс можно осуществить для "чистого" ксантана регулируемым образом. Отсутствие чужеродных добавок в системе, естественно, значительно увеличивает круг возможных применений с использованием одного только ксантана. На ФИГ.11а, b и с продемонстрировано, как модуль хранения, модуль потерь и динамической вязкости можно улучшить более чем в 10-100 раз, не добавляя никаких неорганических ионов. При необходимости можно варьировать соотношение геля и вязкого компонента.
Каррагенан и альгинаты
Альгинаты и каррагенаны являются основными полисахаридными компонентами некоторых видов морских коричневых и красных водорослей. Оба являются линейными полимерами, но совершенно различными по первичной структуре. Каррагенаны основаны на дисахаридной повторяющейся последовательности чередующихся 1,3-связанных-β-D-галактоз и 1,4-связанных α-D-галактоз, с меняющейся степенью и характером сульфирования. Альгинат представляет собой 1,4-связанный блок-сополимер β-D-маннуроната и α-L-гулуроната. Причем остатки сгруппированы в длинные гомополимерные последовательности обоих типов и в гетерополимерные последовательности, где распределение этих двух сахаров может меняться от почти хаотического до почти чередующегося. Из альгината с кальцием (или более крупными катионами группы II) получают термостабильные гели; каррагенановые гели плавятся при нагревании и восстанавливаются при охлаждении. Однако, несмотря на эти кажущиеся различия, существуют также поразительные параллели в том, каким образом эти два семейства полисахаридов образуют гелевые сетки.
Оба эти гелеобразующие полисахарида можно модифицировать описанным выше способом для того, чтобы улучшить функции гелеобразования и сделать их регулируемыми. На ФИГ.12 представлен пример кривой сдвиговой вязкости каппа-каррагенана. Таким образом, можно получить новое семейство этих материалов. Каррагенан получают из природных морских водорослей. Поэтому молекулярные параметры полностью определяются природными процессами. Из водорослей из некоторых стран можно получить каррагенан и альгинат только с относительно низким молекулярным весом. Раскрытый здесь способ настоящего изобретения позволяет преодолеть такие проблемы, характерные для природных полисахаридных продуктов.
Пектины
С химической точки зрения пектин представляет собой полиуронид с линейной цепью из нескольких сотен молекул α-D-галактуроновой кислоты, связанных между собой 1,4-гликозидными связями, которые все диэкваториальны благодаря С1 конформации. В тщательно экстрагированных пектинах из большинства растений 70-80% галактуроновой кислоты метил-этерифицировано. Пектины не являются чистыми полиуронидами: внутри галактуронановой цепи существуют 1,2-связанные молекулы α-L-рамнозы, которые прерывают ее конформационную регулярность "узелками". В тщательно экстрагированных пектинах из множества фруктов и овощей существуют от 1 до 4 молекул рамнозы и от 10 до 15 молекул арабинозы и галактозы на 100 молекул галактуроната. Молекулы L-арабинозы и D-галактозы ковалентно связаны с молекулами рамнозы как усложняющие боковые цепи. Пектины с высоким содержанием метоксигрупп образуют гели только в присутствии сахаров или других совместно растворенных агентов, и это при достаточно низких значениях рН, так что кислотные группы в полимере не являются полностью ионизированными. Эти факторы влияют как на прочность геля, так и на температуру фиксации. В системе с сахарозой при содержании около 65% растворимой твердой части пектины с высоким содержанием метоксигрупп образуют гель при рН вплоть до 3,4 (быстро фиксируемый пектин) или 3,2 (медленно фиксируемый пектин). При уменьшении рН прочность геля и температура фиксации будет возрастать вплоть до точки, при которой температура фиксации достигает температуры, при которой гель осаждается. Ниже этого значения рН пектин имеет тенденцию к образованию пре-геля. Поэтому важен контроль за функцией гелеобразования. Авторы использовали апельсиновый пектин, чтобы продемонстрировать тот факт, что молекулярный вес и гелеобразование можно регулировать, о чем свидетельствует увеличение G', что представлено на ФИГ.13. Таким образом можно получить полностью новый круг пектиновых материалов, что значительно расширяет их применимость.
Пример 3
Белковые системы
Желатин был выбран для демонстрации применимости способа настоящего изобретения к белкам соединительных тканей так же, как и к углеводородным системам. Эта серия материалов не существует в природе, и они были получены из родственного коллагена способом, в котором разрушают вторичную и более высокие структуры различными степенями гидролиза полипептидного скелета. Основными источниками служат кожа или кости животных. Этот белок отличается высоким содержанием глицина, пролина и гидроксипролина и имеет структуру, которая включает триплеты глицин-пролин-гидроксипролин. Такая структура тройной спирали позволяет белку образовывать гели при нагревании и охлаждении в воде. При температурах выше 35-40°C желатины в растворах ведут себя как хаотические спирали, которые могут принимать неопределенное число мгновенных конфигураций. При охлаждении раствора образуются агрегаты, и при концентрации выше 1% (в зависимости от качества желатина и значения рН) образуется прозрачный гель. В отличие от большинства белковых и полисахаридных гелей желатиновые гели термообратимы, так как при нагревании гель растворяется. Используя описанный выше способ обработки в твердом состоянии, можно увеличить молекулярный вес регулируемым образом для получения круга продуктов с варьируемым молекулярным весом и характеристиками растворения/-гелеобразования (ФИГ.14а, b и с).
Для демонстрации общности этого явления для других белков то же самое поведение было установлено для казеина в форме его натриевой соли.
Пример 4
Интерактивные смеси
Основной технологией, связанной с гидроколлоидами, является создание синергичных смесей, которые обладают реологическими свойствами, отличающимися от поведения смеси, когда просто добавляют каждый из компонентов, и обычно это более высокая вязкость, нежели вязкость суммы этих частей.
Способ настоящего изобретения делает возможным значительное увеличение такого синергизма, и обеспечивает улучшение характеристик вязкости и вязкоэластичности по сравнению с отдельно приготовленными смесями растворов на несколько порядков. Совместно обработанные по способу настоящего изобретения в твердом состоянии смеси достигают более тесного взаимодействия вновь образуемых высокомолекулярных форм индивидуальных компонентов. Реологические характеристики нельзя воспроизвести, просто приготовив выбранные смеси исходных материалов.
Конкретными примерами этих смесей являются:
Системы карбоксиметилцеллюлоза-пектин (ФИГ.15).
Системы пектин-декстран (ФИГ.16).
Система карбоксиметилцеллюлоза-декстран (ФИГ.17).
Динамическую вязкость, модули потерь и хранения обработанных смесей этих систем можно улучшить регулируемым образом, и представить эти смеси для использования в форме обычных и экономически выгодных смесей.
Пример 5
Адгезия и связывание
Если смеси полисахаридов или полисахаридов и белков приготавливают в плотном интерактивном состоянии, можно достичь связывания компонентов. Реологические характеристики получаемых продуктов можно регулировать таким образом, чтобы вязкоэластичность была больше или меньше, чем вязкоэластичность соответствующих смесей компонентов, которые были подвергнуты идентичной обработке, но по отдельности. При этом возможно образование нового продукта, в который включены два компонента. Возможно также осуществить взаимодействие и аналогичным образом совместно обработать смешанные системы природных полисахаридов и водорастворимых синтетических продуктов.
В качестве иллюстративных примеров достижения указанных эффектов авторы приводят следующие смеси, полученные в плотном интерактивном состоянии:
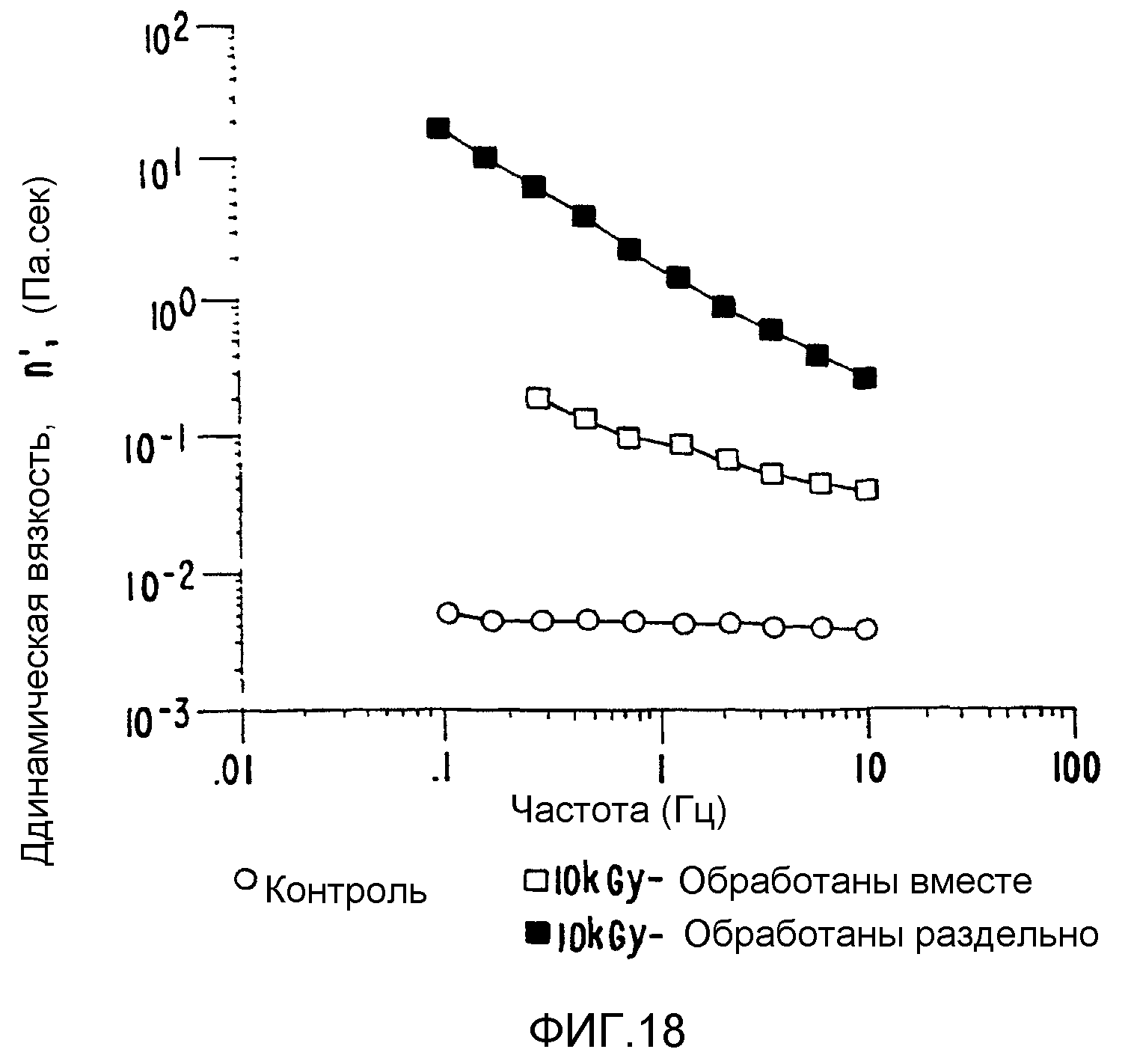
(а) в качестве композита с более низким значением вязкоэластичности можно получить композит поливинилпирролидон-декстран (ФИГ.18).
Плотная интерактивная смесь демонстрирует пониженную динамическую вязкость (после 10 кГр), по сравнению с вязкостью обработанных отдельно компонентов. Интерактивные смеси полиэтиленоксид-арабиногалактановый белок были использованы для демонстрации такого же поведения с использованием других типов структурных компонентов;
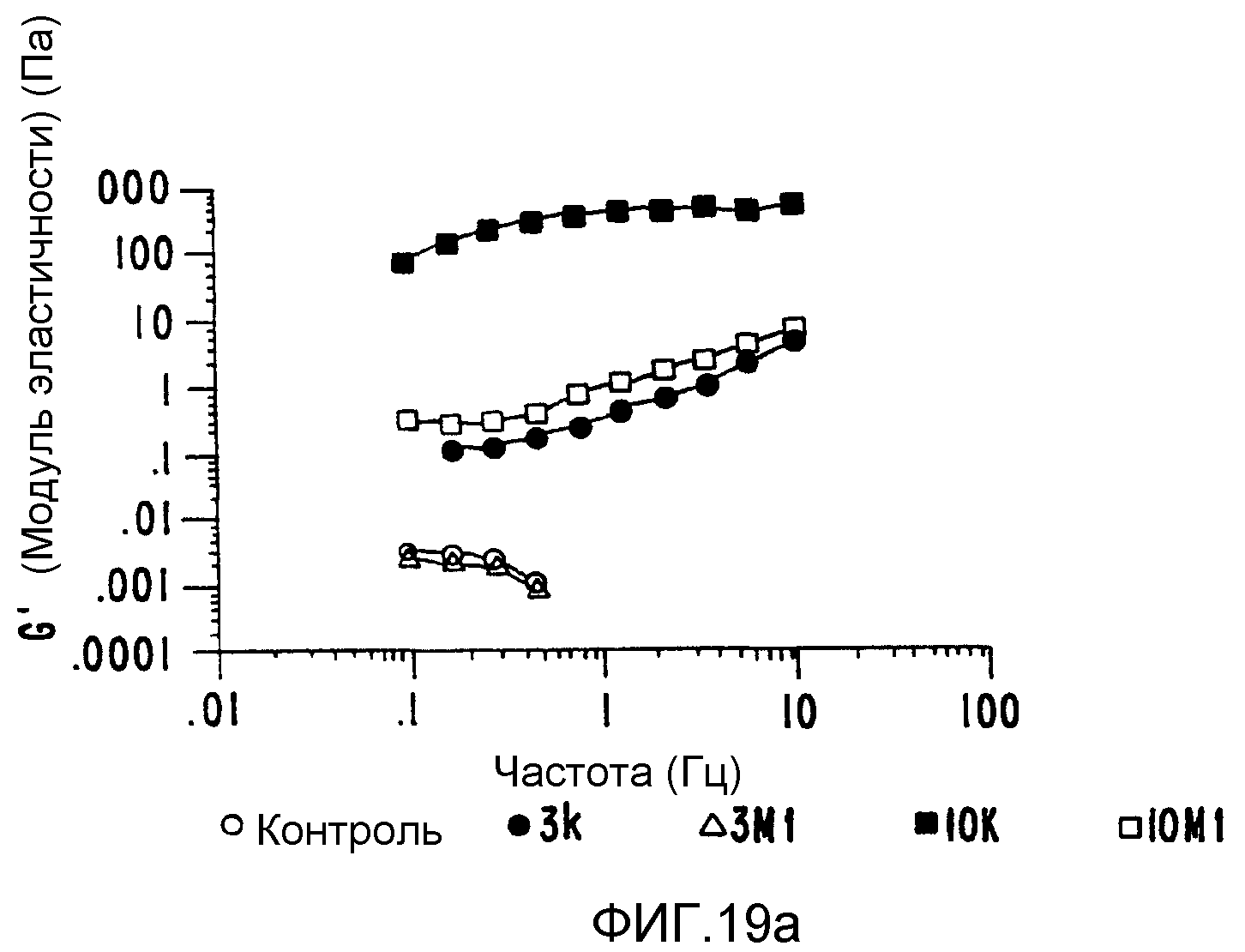
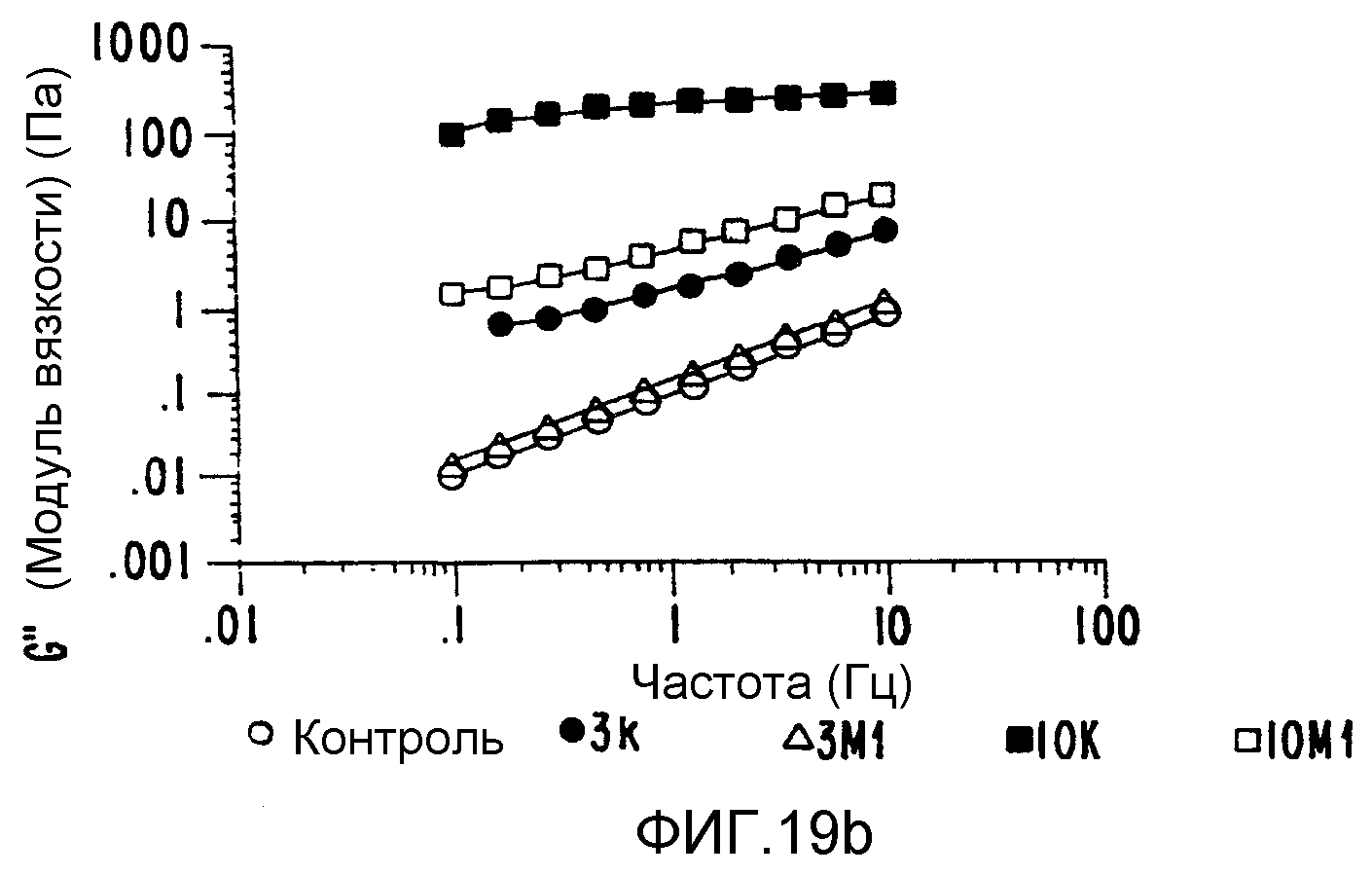
(b) в качестве композита с более высокой вязкоэластичностью можно получить композит поливинилпирролидон-арабиногалактановый белок.
Плотная интерактивная смесь после обработки обладает вязкоэластичностью на несколько порядков величины большей, нежели эквивалентная смесь компонентов, обработанных отдельно, причем она сама на несколько порядков больше, нежели не обработанные контрольные смеси (ФИГ.19);
(с) если нужно получить высокое значение вязкоэластичности, используя только полисахариды, можно использовать смеси карбоксиметилцеллюлоза-арабиногалактановый белок.
Были повторены сообщавшиеся ранее улучшенные реологические характеристики для выбранных плотно интерактивных смесей (ФИГ.20), и новый продукт можно получить таким, что соотношения отдельных компонентов в композите можно варьировать. ФИГ.(21) иллюстрирует такое поведение на примере поведения характеристик гель-проницаемости/молекулярно весового распределения;
(d) высокое или низкое значение вязкоэластичности можно получить в зависимости от выбранных условий.
Декстран-пектин
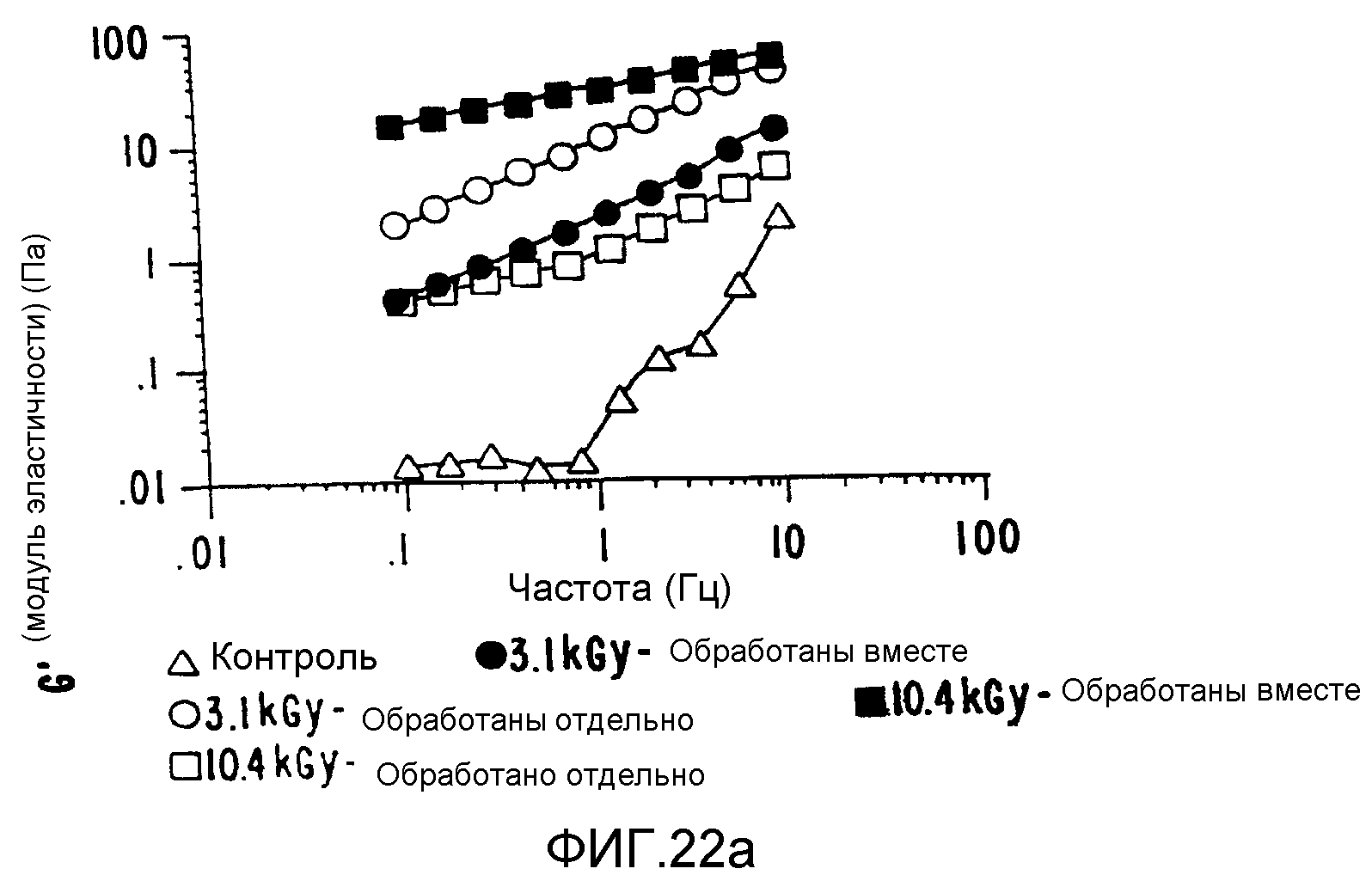
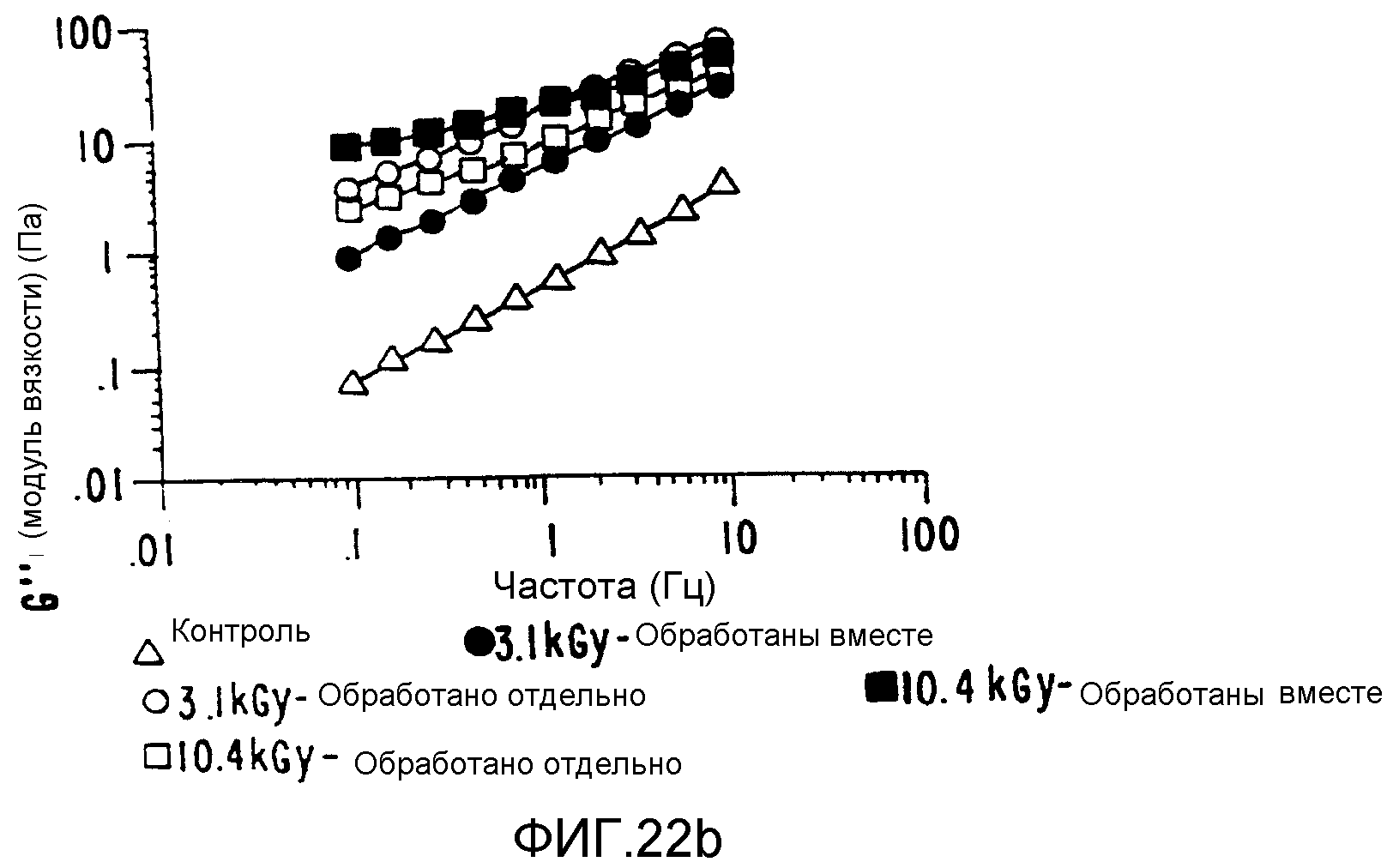
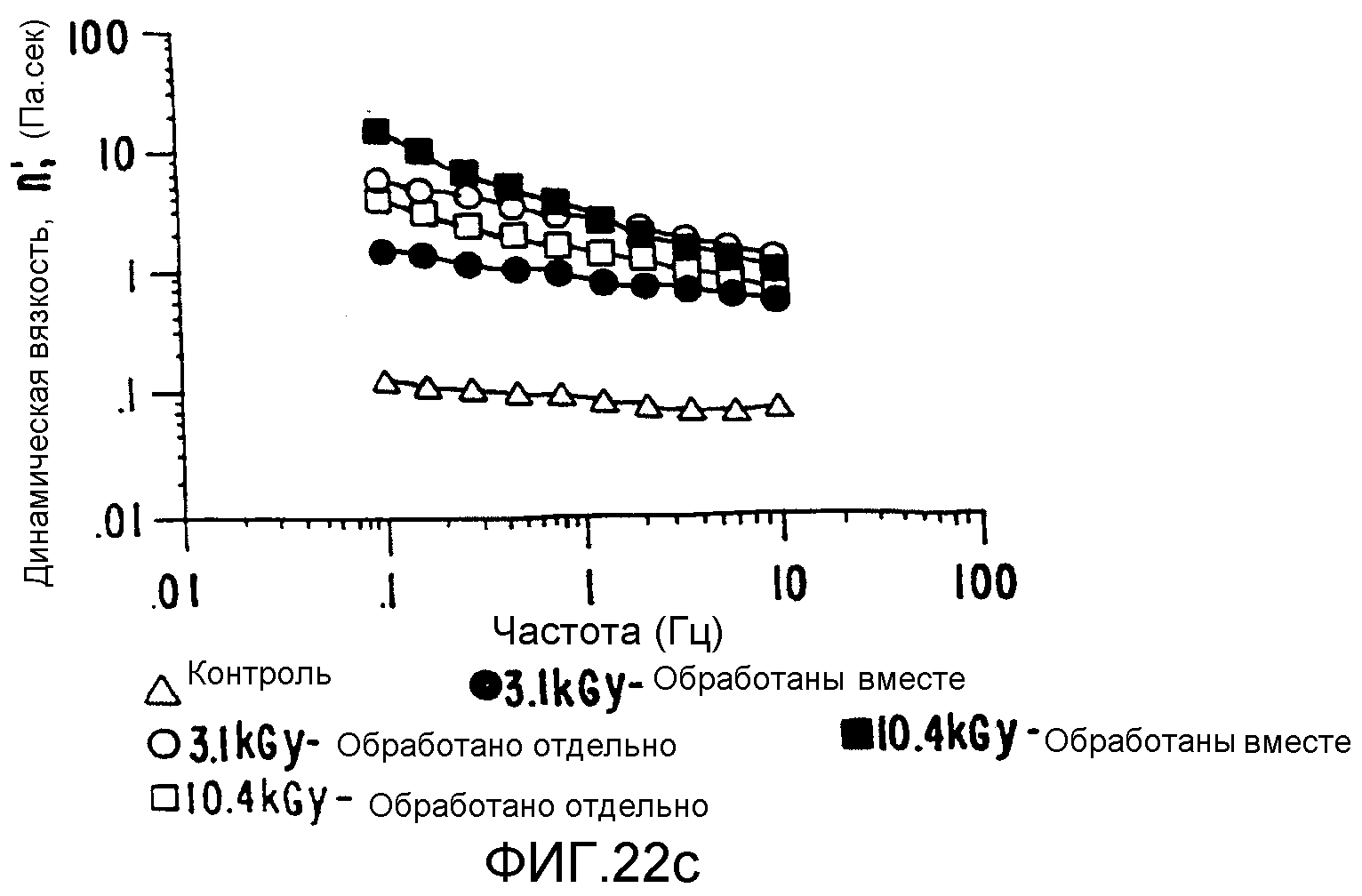
В зависимости от условий обработки конечное плотное интерактивное состояние можно использовать для получения композита либо с низким, либо с высоким значением вязкоэластичности по сравнению с вязкоэластичностью смеси тех же индивидуально обработанных компонентов (ФИГ.22), вязкость которой сама по себе на порядки величин выше вязкости необработанных контрольных смесей.
Полученные таким образом продукты можно получить в формах, которые прилипают к целлюлозным поверхностям, обеспечивая повышенную биосовместимость, сохраняя при этом полную биоразлагаемость. Если они получены на поверхности таких систем, адгезия оказывается более высокой, и при этом имеются некоторые указания на частичное образование тесного связывания.
Применение
Используя плотные интерактивные смеси, обработанные раскрытым выше способом, можно получить целый круг новых композитов. Полученные таким образом продукты отличаются своим поведением от синергичных смесей, раскрытых в примере 4. Эти новые композитные матрицы могут обладать более высокими или более низкими значениями вязкоэластичности, нежели смеси, обработанные обычными способами. Так, можно создать новый круг продуктов либо в виде гелей, вязких растворов, либо в виде мембран. Их можно создавать для конкретных применений в виде медицинских мембран и фармацевтических эксципиентов, систем для доставки лекарств и в качестве носителей для доставки макромолекул, подающих сигнал затягивающим раны клеткам, таких как гиалуронан и альгинат.
Пример 6
Улучшение биологических функций деминерализованной кости (DMB) при построении новых костных образований
Предпосылки
Человеческая кость, когда ее обрабатывают способом для дифференцированного удаления минерала кости для получения "деминерализованной кости" (DMB), обладает способностью активно индуцировать рост новой кости при трансплантировании ее человеку (J.N.Kearney and R J.Lomez, Advances in Tissue Banking, 1997, 1, 43-71). Такие материалы имеют широкое применение в стоматологии и челюстно-лицевой хирургии, так как остеоиндуктивная способность таких аллогенных костей позволяет осуществлять трансформацию примитивных клеток предшественников мезенхимы в хондробласты или остеобласты (C.J.Yim, Advances in Tissue Banking, 1999, 3, 87-111). Способ настоящего изобретения позволяет трансформировать DMB в материал со значительно улучшенной остеоиндуктивной активностью, что ускоряет образование и улучшает качество вновь образующейся кости.
Материалы и методы
1. Экспериментальные животные
Для исследования в этом эксперименте использовали девяносто здоровых самцов белых крыс (250-300 г). Животных разделили на три группы: негативный контроль, контроль (с использованием DMB) и экспериментальная группа (с использованием новой обработанной кости - NPB). Крыс содержали (по 5 крыс в каждой клетке) в стандартном окружении помещения для экспериментальных животных в School of Dentistry, Dankook University, Republic of Korea. Во время периодов эксперимента их кормили твердой пищей. После двухнедельного адаптационного периода начали эксперименты на животных.
2. Получение DMB и NPB
Здоровых самцов крыс умерщвляют, переламывая шейные позвонки, с целью получения бедренных и больших берцовых костей. После получения костей их подвергают глубокой заморозке при -70°C в течение 24 часов и после этого тонко измельчают в мельнице для костей. Затем кости обрабатывают следующим образом: частицы перемешивают в дистиллированной воде, что повторяют 6 раз каждые 30 минут, деминерализуют в 0,5 н. хлористоводородной кислоте в течение 5 часов, затем 4 раза промывают стерильной водой в течение 2 часов, на 1 час погружают в абсолютный этанол при комнатной температуре (25°C), еще раз промывают дистиллированной водой в течение 3 часов, погружают в диэтиловый эфир на 30 минут и сушат в вакууме в течение ночи.
После этих процедур частицы DMB разделяют по размерам, используя соответствующие сита. В описываемом исследовании используют только частицы DMB размером 350-600 мкм. DMB подвергают описанной выше опосредствованной газом радиационной обработке, после чего их обозначают как "новая обработанная кость" (NPB). После тройной упаковки все образцы DMB и NPB стерилизуют, используя γ-излучение 1,5 МРад.
3. Методики (хирургические процедуры)
1) Анестезия.
Животным вводят с помощью инъекций до операции окситетрациклин и затем анестезируют кетамингидрохлоридом (внутримышечно, 10 мг/кг) и ксилазингидрохлоридом (0,15 мл/кг).
2) Операция:
Обычным образом, после того как черепные лоскуты отгибают, создают костные дефекты вокруг середины черепа, используя низкоскоростную зубоврачебную дрель с буром для трепанации диаметром 6 мм. Во время создания этим буром дефектов подают охлаждающую воду (стерилизованный солевой раствор), что предотвращает перегрев операционного участка. Затем три группы животных подвергают следующей процедуре:
2.1. Негативная контрольная группа: раны закрывают без каких-либо трансплантированных материалов.
2.2. Контрольная группа: им трансплантируют чистый DMB (15 мг/каждой).
2.3. Экспериментальная группа: им трансплантируют NPB (15 мг/каждой).
Для всех групп дефекты закрывают, используя 4-0 Vicryl, нанося слой за слоем. Все вышеуказанные процедуры осуществляют в асептических условиях.
3) Умерщвление животных.
После хирургической операции пять животных из каждой группы умерщвляют через 1, 2 и 3 недели, соответственно, и их дефектные участки (в черепе) удаляют с полной толщиной лоскута, включая надкостницу. Черепные срезы фиксируют в 10% нейтрализованном формалине.
4. Получение образца.
После фиксации черепной кости в 10% нейтрализованном формалине костные дефекты декальцифицируют в течение 3 дней, используя 5% азотную кислоту. Обычным образом осуществляют дегидратацию и очистку, после чего образцы черепа заключают в парафин. Парафиновые срезы окрашивают и исследуют под микроскопом на предмет образования кости.
5. Гистологический анализ подтверждает наблюдающееся образование кости.
6. Измерение прочности внутрикостного соединения.
Полной толщины черепную кость, включая дефектный участок, получают из животных для каждого из временных интервалов и тестируют на прочность внутрикостного соединения.
Образцы костей фиксируют в держателе прибора Universal Testing Machine. Скорость сжатия тестового устройства составляла 5 мм/мин. Пуансон тестирующего устройства был круглым (диаметр 1 мм).
Результаты (прочность кости в мПа)
Выводы
Обработанная деминерализованная кость (NPB) была более эффективной, нежели контрольная, в отношении создания новой кости в процессе залечивания кости, и после трех недель эта кость была более чем в 3 раза более прочной, нежели контрольная. Это значительное достижение в ускорении роста кости, и оно должно иметь широкое применение в стоматологии и челюстно-лицевой хирургии, где обычно используют деминерализованную кость. Потенциальные применения включают также использование в ортопедии, и предлагается новый подход к заживлению трансплантированных костей после травмы или в результате заболевания. Модификации мягких соединительных тканей можно также осуществить аналогичным образом, чтобы придать им новые и улучшенные функциональные характеристики.
Репрезентативное использование нового продукта в представительных категориях
1. Арабиногалактановые белки
Эмульгирование в системах масло-в-воде для применения в напитках, маслах, эмульсиях, лосьонах, для косметических, медицинских и фармацевтических целей.
Новые адгезивы для бумаги и родственных целлюлозных изделий.
Высокомолекулярные волокна для улучшения бактериальной ферментации в толстой кишке для регулирования холестерина и для диабетиков.
Гели, которые можно использовать в качестве замены желатина, в микрокапсулах, фотографических пленках, и как микробиологическую среду и в культуре тканей.
Гели акации для эксципиентов, для контролируемого выделения фармацевтических/лекарственных активных агентов.
Мембраны для доставки активных агентов для залечивания ран с характеристиками большего связывания воды.
2. Полисахариды
Стандарты для гель-проникающего и гель-электрофореза в стандартном интервале молекулярных весов.
Новый круг заменителей плазмы крови.
Системы растворимых и не растворимых полисахаридов для иммобилизации белков, ферментов, клеток млекопитающих, кофакторов и лекарств.
Новые гели, мембраны и пленки для применений в медицине.
Новое поколение полисахаридных волокон для таких применений, как пищевые добавки и ингредиенты. Возможность регулирования молекулярного веса в значительной степени расширяет применимость во всем разнообразии пищевых продуктов, таких как загустители, желирующие агенты, стабилизаторы, вкусовые псевдопластификаторы и ингредиенты инкапсуляторов.
Новые карбоксиметилцеллюлозные ингредиенты для хлебопекарной промышленности, которые обеспечивают более высокую стабильность теста и прекрасную устойчивость к размягчению теста.
Новое поколение материалов для загущения водных систем, поверхностно активные агенты, суспендирующие твердые частицы в водной среде, замедлители роста кристаллов, агенты, абсорбирующие воду из атмосферы и из пленок, и в качестве добавок в пластики и упаковочные материалы.
Круг мембран для хроматографии с варьирующимся зарядом, с хиральными и лигандными интерактивными характеристиками.
Новый круг текучих гелей, улучшающих характеристики желатина.
Промышленные применения в качестве полисахаридов, образующих хелаты с металлами для широкого применения, начиная с обработки сточных вод, до точного выделения металлов и металл-хелатной хроматографии.
3. Системы белок-полисахарид
Применение продуктов из новых материалов в качестве повязок для ран, адгезивных тампонов для хирургического применения, гемостатических агентов, интрадермального прилива крови, систем доставки лекарств с контролируемым выделением для наружного и перорального введения.
Все существующие применения биосовместимых гидрогелей можно расширить, используя материалы, модифицированные способом настоящего изобретения, и открытие новых адгезивов для таких применений как покрытия для связанного с медициной полимерного оборудования, сосудистых трансплантатов и для контактных линз, искусственных роговиц, для наращивания мягких тканей и т.д.
4.Модификация тканей
Ткани человеческого и животного происхождения, такие как кости, кожа, сухожилия, хрящи, можно получить со значительно улучшенными физическими и биологическими характеристиками после обработки по способу настоящего изобретения, если использовать их для пересадки или в качестве трансплантатов. После обработки по способу настоящего изобретения можно получить деминерализованную кость с улучшенными (вплоть до четырехкратных) способностями заживления кости. Такие кости имеют широкое применение в ортопедии, стоматологии и челюстно-лицевой хирургии для промотирования роста новых костей после разрушения кости в результате травмы или заболевания.
Реферат
Изобретение относится к новым продуктам на основе биополимеров. Способ модификации встречающегося в природе биосовместимого биополимера, который характеризуется отсутствием каких-либо функциональных групп, включает обработку указанного биополимера в твердом или сухом состоянии источником ионизирующего излучения в присутствии опосредствующего газа. Опосредующий газ представляет собой незамещенный алкеновый или алкиновый газ, которым является этилен, пропилен или ацетилен, и отжиг полученного продукта в отсутствие кислорода при температуре от около 40 до 120°С, с последующим удалением всего оставшегося опосредствующего газа. Модифицированный биополимер получен вышеуказанным способом. Модифицированный, встречающийся в природе биосовместимый биополимер, полученный вышеуказанным способом, выбран из группы, состоящей из полисахаридов растительного или животного происхождения, белка, полученного из соединительной ткани животного, белка, полученного из других тканей животного, комбинации, по крайней мере, одного из указанных полисахаридов и, по крайней мере, одного другого белка растительного происхождения, или деминерализованной кости ("DMB"). Способ модификации ткани животного происхождения включает обработку образца указанной ткани или ее компонента в твердом или сухом состоянии источником ионизирующего излучения в присутствии опосредствующего газа и отжиг полученного продукта в отсутствие кислорода при температуре от около 40 до 120°С, с последующим удалением всего оставшегося опосредствующего газа. Изобретение позволяет получить биополимеры, обладающие хорошей биосовместимостью, при этом в исходный биополимер не вводят ни новых, ни дополнительных функциональных групп. 4 н. и 31 з.п. ф-лы, 12 табл., 43 ил.

Комментарии