Способ лечения расстройств пищевого поведения посредством нейростимулирующей системы (варианты) - RU2486930C2
Код документа: RU2486930C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение, в общем случае, относится к способам и устройствам для стимуляции определенных областей мозга для терапии расстройств пищевого поведения путем модуляции электрической активности нервной ткани в выбранной области мозга.
Уровень техники
Если пищевое поведение человека изменяется до такого состояния, что психическое здоровье личности затрагивается губительным образом, такого рода расстройство называется расстройством пищевого поведения. Наиболее известными типами расстройств пищевого поведения являются нейрогенная булимия и нейрогенная анорексия. Нейрогенная булимия является расстройством пищевого поведения, при котором личность испытывает повторяющиеся эпизоды непреодолимой тяги к пище, часто, в результате которых кинорексия чередуется с недопустимым компенсационным поведением для предотвращения наращивания веса. Недопустимое компенсационное поведение обычно бывает выражено в виде самостоятельно выраженной рвоты, голодания, избыточных физических упражнений, а также использование слабительных и мочегонных средств. Люди, страдающие от булимии, обычно впадают в кинорексию и недопустимое компенсационное поведение два раза в неделю в течение трех и более месяцев. По статистике, 17% женщин школьного возраста впадают в булимическое поведение, хотя их вес, обычно, нормален или незначительно избыточен. Нейрогенная анорексия отличается добровольным голоданием, которое может сопровождаться физическими нагрузками. Страдающий анорексией человек поддерживает свой вес ниже минимального нормального уровня, соответствующего возрасту и росту. Кинорексия, без компенсационного очищающего поведения, также является видом расстройства пищевого поведения, отличающимся потреблением больших количеств пищи, тайным поеданием неподходящей пищи, и прибавкой в весе.
Расстройства пищевого поведения имеют как физические, так и психологические составляющие, и, следует отметить, что расстройства пищевого поведения не относятся к еде, но еда является тем инструментом, которым злоупотребляют люди с расстройствами пищевого поведения. Следствием расстройства пищевого поведения могут быть тяжелые медицинские осложнения. Расстройство пищевого поведения может быть незначительным у одного человека, и тяжелым или даже угрожающим жизни, у другого. Обычно, пораженная болезнью личность пытается скрыть его или ее необычное поведение от других и может отказываться от диагностики расстройства пищевого поведения или избегать лечения.
Поступление пищи, в человеческом организме, управляется комплексным взаимодействием внутренних и внешних раздражителей. Известно, что блуждающий нерв играет роль в промежуточной передаче афферентной информации от желудка к центрам насыщения мозга. Патент США №5188104 (Cyberonics, Inc.) и патент США №5263480 (Cyberonics, Inc.) раскрывают способы лечения расстройств пищевого поведения, в том числе, булимии, включая определение количества пищи, потребленной пациентом в заранее заданный период времени, и, если потребление превышает заранее заданный уровень, за данный период, приложение стимулирующего сигнала к блуждающему нерву пациента. Параметры выходного сигнала генератора стимула в нейростимуляторе программируется с обеспечением стимуляции вагусной активности так, чтобы сформировать ощущение полного желудка пациента при распознавании избыточного потребления пищи. (То есть определение превышения заранее заданного уровня за выбранный интервал времени путем интегрирования числа проглатываний пищи в течение интервала).
Патент США №5540734 (Cyberonics, Inc.) показывает, что уход, управление или предупреждение некоторых медицинских, психиатрических или неврологических расстройств может быть выполнено путем приложения модулирующих электрических сигналов к тригеминальному и/или языкоглоточному нерву пациента. Поддающиеся лечению расстройства могут быть расстройствами пищевого поведения, в том числе, нейрогенная анорексия, булимия и навязчивое переедание.
Патент США №5782798 (Medtronic, Inc.) отмечает, что нейронный контур мозга, который управляет едой и насыщением, содержит нейроны в латеральном гипоталамусе (питание) и переднем срединном гипоталамусе (насыщение). Некоторые раскрытые технологии используют лекарственную и электрическую стимуляцию для терапии расстройства пищевого поведения с использованием имплантируемого генератора сигналов с электродами и имплантируемого насоса с катетером. Катетер имплантируется в мозг хирургическим путем для введения лекарственных препаратов, а электрод имплантируется в мозг для организации электрической стимуляции. Области стимуляции в мозге включают в себя латеральный гипоталамус, паравентрикулярный нуклеус и передний срединный гипоталамус.
Опубликованная заявка №2005/0027284 на выдачу патента США (Advanced Neuroмодуляцию Системеs, Inc.) предлагает облегчение или изменение настроения и/или тревожных расстройств путем стимуляции подмозолистых полей мозга, таких как субгенуальная поясная часть головного мозга, область извилины подмозолистого поля, вентральная/медиальная предлобная область коры головного мозга, вентральное/медиальное белое вещество мозга, область Бродманна 24, область Бродманна 25, и/или область Бродманна 10.
Таким образом, необходимы новые пути ухода за пациентами, страдающими от тяжелых или угрожающих жизни расстройств пищевого поведения, которые не могут быть подвергнуты успешной традиционной терапии.
Раскрытие изобретения.
В настоящем изобретении предполагается, что выборочная глубокая стимуляция мозга эффективна для терапии булимии и других расстройств пищевого поведения, в частности, когда определенные области или отделы мозга стимулируются избирательно. Области мозга, выбранные для воздействия, связаны с симптомами булимии и других расстройств пищевого поведения. Более точно, предпочтительные варианты способа содержат прямую или косвенную стимуляцию островковой доли большого мозга, подмозолистого поля, поясной части головного мозга, зрительного бугра, предлобной области коры головного мозга, стволовой части мозга, мозжечка и трактов белого вещества мозга, ведущих к указанным областям мозга.
Соответственно, некоторые варианты реализации настоящего изобретения, обеспечивают способ глубокой стимуляции мозга (ГСМ) для терапии страданий пациента от серьезного расстройства пищевого поведения. Способ включает в себя приложение первого терапевтического стимулирующего сигнала к первому стимулятору, соединенному с заранее заданной зоной стимуляции, содержащей объем нервной ткани в области мозга человека, выбранной из совокупности, состоящей из островковой доли большого мозга, подмозолистого поля, поясной части головного мозга, зрительного бугра, предлобной области коры головного мозга, стволовой части мозга, мозжечка и трактов белого вещества мозга, ведущих к указанным областям, причем первый стимулирующий сигнал вызывает модуляцию неврональной активности нервной ткани, а модуляция неврональной активности облегчает симптом расстройства пищевого поведения. В отдельных вариантах реализации, первый стимулятор содержит электрод, а первый терапевтический стимулирующий сигнал содержит первый заранее заданный электрический сигнал, кроме того, способ содержит подключение электрода к выбранной области мозга человека; и приложение первого заранее заданного электрического сигнала к электроду таким образом, что неврональная активность нервной ткани изменяется, и такое изменение неврональной активности облегчает симптом расстройства пищевого поведения.
В некоторых из вышеупомянутых вариантов реализации, первый терапевтический стимулирующий сигнал содержит импульсный стимулирующий компонент и постоянный стимулирующий компонент, причем каждый из компонентов содержит набор электрических параметров (ток, ширина импульса, частота), времена нахождения во включенном и отключенном состояниях и продолжительность стимуляции. В некоторых вариантах реализации, импульсный стимулирующий компонент имеет более высокий уровень интенсивности стимуляции и более короткую длительность, чем постоянный стимулирующий компонент. Более высокий уровень интенсивности стимуляции имеет большие, по значению, электрические параметры, времена нахождения во включенном и отключенном состояниях и продолжительность. В некоторых вариантах реализации импульсный стимулирующий компонент имеет продолжительность от одного до шести месяцев.
В некоторых из указанных выше вариантов реализации, способ также включает в себя стимуляцию черепно-мозгового нерва. В некоторых вариантах реализации, настоящий способ включает в себя (а) соединение первого стимулятора с областью мозга человека, выбранной из группы, в которую входят: островковая доля большого мозга, подмозолистое поле, поясная часть головного мозга, зрительный бугор, предлобная область коры головного мозга, стволовая часть мозга, мозжечок и тракты белого вещества мозга, ведущие к указанным областям; (а) соединение второго стимулятора с черепно-мозговым нервом человека; (б) приложение первого заранее заданного стимулирующего сигнала к первому стимулятору; и (в) приложение второго заранее заданного стимулирующего сигнала ко второму стимулятору, причем приложение первого и второго сигналов вызывает модуляцию неврональной активности нервной ткани с облегчением расстройства пищевого поведения. В некоторых из указанных вариантов реализации, второй терапевтический стимулирующий сигнал содержит второй импульсный стимулирующий компонент и второй постоянный стимулирующий компонент. В некоторых вариантах реализации второй импульсный стимулирующий компонент имеет более высокий уровень интенсивности стимуляции и более короткую длительность, чем второй постоянный стимулирующий компонент.
В отдельных вариантах реализации описанного выше способа, расстройство пищевого поведения является булимией, приложение первого терапевтического стимулирующего сигнала, расширенного, в некоторых частных случаях, вторым терапевтическим стимулирующим сигналом, облегчает у человека кинорексию и/или очищающее поведение. В некоторых вариантах реализации, приложение сигнала (сигналов) вызывает у человека чувство насыщения. В некоторых вариантах реализации, выбранная область мозга содержит, по крайней мере, часть островковой доли большого мозга или тракт белого вещества мозга, ведущий к островковой доле большого мозга. В некоторых вариантах реализации, выбранная область выбрана из группы, состоящей из левой и правой передней и задней островковых долей большого мозга и ограды головного мозга. В некоторых вариантах реализации, выбранная область содержит подмозолистое поле или тракт белого вещества мозга, ведущий подмозолистое поле. В некоторых вариантах реализации, выбранная область мозга содержит, по крайней мере, часть области Бродманна внутри поясной части головного мозга, выбранную из группы, состоящей из области Бродманна 24 и области Бродманна 25, или выбранная область содержит тракт белого вещества мозга, ведущий в указанную область Бродманна. В некоторых вариантах реализации, выбранная область мозга включает в себя, по крайней мере, часть области Бродманна внутри предлобной коры головного мозга или тракт белого вещества мозга, ведущий в указанную область Бродманна. В частном случае, выбранная область может включать в себя орбитально-переднюю кору головного мозга и/или, по крайней мере, часть любых из областей Бродманна 8-11. В других вариантах реализации, выбранная область мозга содержит зрительный бугор, ствол мозга, мозжечок или средний мозг, или, по крайней мере, одно ядро внутри указанных областей или тракт белого вещества мозга тракт, ведущий в ядро. В некоторых вариантах реализации, выбранная область содержит мостовое или сердцевидное ядро, такое как голубое пятно, ядро одиночного пути (nucleus tractus solitarius), ядро шва или парабрахиальное ядро. В некоторых вариантах реализации выбранная область содержит аномальное пучковое (парафасцикулярное) ядро.
В соответствии с некоторыми вариантами реализации раскрытого выше способа настоящего изобретения, используется химическая стимуляция выбранной области мозга. В некоторых вариантах реализации, первый стимулятор содержит аппарат дозировки реагента, содержащий катетера, соединенный с насосом, а первый терапевтический стимулирующий сигнал содержит заранее заданный сигнал подачи. Указанный способ содержит подключение катетера к выбранной области мозга человека и приложение первого заранее заданного сигнала подачи к аппарату дозировки реагента так, что реагент освобождается катетером и контактирует с нервной тканью, причем неврональная активность нервной ткани изменяется и такое изменение неврональной активности облегчает симптом расстройства пищевого поведения.
Стимуляцию черепно-мозгового нерва совместно с глубоким зондированием мозга используется в соответствии с другими вариантами реализации настоящего изобретения для терапии лица, страдающего от расстройства пищевого поведения. В частном случае, иллюстративный способ терапии включает в себя (а) выполнение блока управления, содержащего генератор сигнала и процессор, соединенные с первым электродом и вторым электродом; (б) подключение первого электрода к черепно-мозговому нерву человека; (в) подключение второго электрода к области мозга человека выбранной из группы, в которую входят: островковая доля большого мозга, подмозолистое поле, поясная часть головного мозга, зрительный бугор, предлобная область коры головного мозга, стволовая часть мозга, мозжечок и тракты белого вещества мозга, ведущие к вышеупомянутой зоне; (г) приложение заранее заданного электрического сигнала первому электроду; (д) зондирование электрической активности в выбранной области мозга вторым электродом; (е) сравнение результатов измеренной электрической активности с заранее заданным электрическим состоянием выбранной области; и (ж) определение, по результатам указанного сравнения, вызывает ли приложение заранее заданного электрического сигнала к первому электроду модуляцию электрической активности области мозга, при которой такая модуляция электрической активности соответствует облегчению симптома расстройства пищевого поведения. В отдельных вариантах реализации, черепно-мозговой нерв выбирается из группы, в которую входят: блуждающий нерв, подъязычный, тригеминальный и дополнительный нервы.
Также, в соответствии с некоторыми вариантами реализации настоящего изобретения, предложен способ ухода за лицом, страдающим от расстройства пищевого поведения путем глубокой стимуляции мозга и зондирования черепно-мозгового нерва. Указанный способ содержит (а) выполнение блока управления, содержащего генератор сигнала и процессор, соединенные с первым электродом и вторым электродом; (б) подключение первого электрода к черепно-мозговому нерву человека; (в) подключение второго электрода к области мозга человека выбранной из группы, в которую входят: островковая доля большого мозга, подмозолистое поле, поясная часть головного мозга, зрительный бугор, предлобная область коры головного мозга, стволовая часть мозга, мозжечок и тракты белого вещества мозга, ведущие к указанным областям; (г) приложение заранее заданного электрического сигнала ко второму электроду для модуляции неврональной активности выбранной области мозга; (д) зондирование электрической активности в черепно-мозговом нерве первым электродом; (е) сравнение результирующей измеренной электрической активности с заранее заданным электрическим состоянием нерва; и (ж) определение, по результатам указанного сравнения, вызывает ли приложение заранее заданного электрического сигнала ко второму электроду, модуляцию электрической активности черепно-мозгового нерва.
В соответствии с некоторыми вариантами реализации изобретения, предложен способ терапии расстройства пищевого поведения, такого как булимия. Способ содержит операции: хирургической имплантации электрода электрической стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединяется с выбранным подмозолистым полем или трактом белого вещества мозга, ведущим в подмозолистое поле; подключение проксимального вывода электрода к генератору сигнала и формирование электрического сигнала генератором сигнала, где сигнал электрически стимулирует выбранную область в результате чего осуществляется терапия булимии или других расстройств пищевого поведения. В некоторых вариантах реализации, способ, кроме того, содержит хирургическую имплантацию катетера, имеющего проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы лекарственного препарата, причем после имплантации разгрузочная часть катетера соединена с выбранным подмозолистым полем или трактом белого вещества мозга, ведущим к подмозолистому полю; и управлении насосом для выделения лекарственного препарата через разгрузочную часть катетера в выбранное подмозолистое поле, или тракт белого вещества мозга, в результате чего осуществляется терапия расстройства пищевого поведения.
В соответствии еще одним вариантом реализации настоящего изобретения, способ терапии расстройства пищевого поведения содержит хирургическую имплантацию электрода электрической стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединена с областью Бродманна 25; подключение проксимального вывода электрода к генератору сигнала и формирование электрического сигнала генератором сигнала, причем указанный сигнал электрически стимулирует область Бродманна 25, в результате чего осуществляется терапия расстройства пищевого поведения. В отдельных вариантах реализации, электрическая стимуляция области Бродманна 25 дает в результате модуляцию неврональной активности в области Бродманна 25. В отдельных вариантах реализации, электрическая стимуляция области Бродманна 25 дает в результате модуляцию неврональной активности в области Бродманна 9. В отдельных вариантах реализации, электрическая стимуляция области Бродманна 25 дает в результате модуляцию неврональной активности в области Бродманна 24.
В отдельных вариантах реализации, раскрытый выше способ, кроме того, содержит операции: хирургической имплантации катетера, имеющего проксимальный вывод, соединенный с насосом, и разгрузочную часть для введения дозы лекарственного препарата, причем после имплантации, разгрузочная часть катетера соединена с областью Бродманна 25; и управление насосом для выделения лекарственного препарата через разгрузочную часть катетера в область Бродманна 25, в результате чего осуществляется терапия расстройства пищевого поведения. В отдельных вариантах реализации, лекарственного препарата выбран из группы, в которую входят: агонисты и антагонисты, подавляющие нейромедиаторы, агонисты и антагонисты возбудителей нейромедиаторов, реактивы, повышающие уровень подавления нейромедиаторов, реактивы, снижающие уровень возбуждения нейромедиаторов, и реактивы местной анестезии.
Также, в соответствии с некоторыми вариантами реализации настоящего изобретения, предложен способ терапии расстройства пищевого поведения, содержащий операции: хирургической имплантации электрода электрической стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединена с выбранной области субгенуальной поясной части головного мозга или тракт белого вещества мозга, ведущий в область субгенуальной поясной части головного мозга; подключение проксимального вывода электрода к генератору сигнала и формирование электрического сигнала генератором сигнала, причем указанный сигнал электрически стимулирует выбранную область субгенуальной поясной части головного мозга, в результате чего осуществляется терапия расстройства.
В соответствии с некоторыми вариантами реализации настоящего изобретения, также предложен способ терапии расстройства пищевого поведения, содержащий операции: хирургической имплантации электрода электрической стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации, стимулирующая часть соединена либо с черепно-мозговыми нервами, либо с подмозолистым полем, или с трактом белого вещества мозга - трактом, ведущим к подмозолистому полю; хирургической имплантации катетера, имеющего проксимальный вывод, соединенный с насосом, и разгрузочную часть для введения дозы лекарственного препарата, причем после имплантации разгрузочная часть катетера соединена с выбранным подмозолистым полем или трактом белого вещества мозга; и подключение проксимального вывода электрода к генератору сигнала; формирование электрического сигнала генератором сигнала, в котором указанный сигнал электрически стимулирует выбранное подмозолистое поле; и управление насосом для выделения лекарственного препарата через разгрузочную часть катетера в выбранное подмозолистое поле или тракт белого вещества мозга, в результате чего осуществляется терапия расстройства пищевого поведения.
В соответствии с другими вариантами реализации настоящего изобретения, предложен способ терапии расстройства пищевого поведения, содержащий операции: хирургической имплантации электрода электрической стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединена с областью Бродманна 25 или трактом белого вещества мозга, ведущим к указанной области; хирургической имплантации катетера, имеющего проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы лекарственного препарата, причем после имплантации, разгрузочная часть катетера сообщается с выбранной областью Бродманна 25, или трактом белого вещества мозга, ведущим к указанной области; подключение проксимального вывода электрода к генератору сигнала; формирование электрический сигнал с использованием генератора сигнала, в котором указанный сигнал электрически стимулирует область Бродманна 25; а также, управление насосом с обеспечением выделения лекарственного препарата через разгрузочную часть катетера в область Бродманна 25 или выбранный тракт белого вещества мозга, ведущий в указанную область, в результате чего осуществляется терапия расстройства.
В отдельных вариантах реализации любого из описанных выше способов, может быть использован зонд, а зондирование осуществляется эпидурально, субдурально, или на коже черепа.
В отдельных вариантах реализации описанного выше процесса, электрические параметры устанавливаются с обеспечением двусторонней стимуляции блуждающих нервов, синхронно или асинхронно, в порядке выборочной модуляции (например, подавления, возбуждения или блокировки) выбранных областей мозга для обеспечения терапевтического эффекта. Например, устройство настраивается для обеспечения распределения во времени пакетов импульсов электрической двухсторонней стимуляции для ослабления невральной активности в выбранных областях мозга. Параметры могут быть установлены таким образом, что осуществляется благотворная выборочная модуляция парасимпатических центростремительных ветвей черепно-мозговых нервов для модуляции вкусовых проводящих путей нервной системы, обонятельных, вызывающих воспаление или противовоспалительный проводящих путей нервной системы, дыхательных проводящих путей нервной системы, кардиотонических проводящих путей нервной системы, барорецепторных проводящих путей нервной системы, соматосенсорных проводящих путей нервной системы и проводящих путей насыщения нервной системы. Сходным образом, стимуляция черепно-мозгового нерва может возбуждать нейротрансмиттеры проводящих путей нервной системы такие, как норадренергические, серотонинергические, дофаминергические и холинергические проводящие пути нервной системы.
В отдельных вариантах реализации описанного выше способа, имплантированный электрод стимуляции и/или зондирования и/или совокупность электродов контактирует или находится вблизи к одному из черепно-мозговых нервов и/или объему нервной ткани в мозге человека. Черепно-мозговой нерв является, предпочтительно, тригеминальным, подъязычным, блуждающий нервом и/или дополнительным нервом. Нерв может контактировать в любой точке его длины или одной из ветвей нерва. Один или более черепно-мозговых нервов могут быть стимулированы/модулированы, и это может проводиться двусторонним образом, то есть для левого и правого блуждающих нервов.
В раскрытом выше способе используется система, которая содержит внутреннее или внешнее устройство или система для измерения, зондирования, записи, контроля психологической активности, психологических событий, психологических пороговых величин, состояния тела или мозга. Указанная особенность, предпочтительно, реализуется с использованием зондирования электрической активности (биоэлектрических потенциалов) в нерве или нервной ткани внутри или снаружи мозга.
Некоторые варианты реализации описанного выше способа используют устройство, оборудование или систему, которые могут изменять параметры воздействия на основе адаптивного обучения, причем устройство распознает неврональную активность после стимуляции и автоматически настраивает блок управления для осуществления попытки обеспечения оптимальной терапии. Блок управления может также распознавать результат неблагоприятной стимуляции и настраивать стимуляцию с обеспечением предотвращения неблагоприятной реакции пациента.
В соответствии с еще одним вариантом реализации настоящего изобретения, предложена система для модуляции нервной ткани живого человека, которая содержит первый электрод для электрического, подключения к нервной ткани; второй электрод - для электрического подключения к черепно-мозговому нерву пациента; источник электричества; генератор сигнала, соединенный с источником электричества и первым и вторым электродами; и модуль программируемой электроники, соединенный с генератором сигнала, причем система, выполненная с возможностью приложения первого терапевтического электрического сигнала к нервной ткани первым электродом, и приложения второго терапевтического электрического сигнала - к ткани черепа вторым электродом, причем первый и второй электрические сигналы вызывают модуляцию неврональной активности нервной ткани. В некоторых вариантах реализации, первый сигнал содержит первую кратковременную компоненту электрического сигнала и первую длительную компоненту электрического сигнала. В некоторых вариантах реализации второй сигнал содержит вторую кратковременную компоненту электрического сигнала и вторую длительную компоненту электрического сигнала.
В отдельных вариантах реализации настоящего изобретения, предложена система для модуляция нервной ткани живого человека, содержащая: первый электрод для электрического подключения к нервной ткани; второй электрод для электрического подключения к черепно-мозговому нерву пациента; источник электричества; генератор сигнала, соединенный с источником электричества и первым и вторым электродами; и модуль программируемой электроники, соединенный с генератором сигнала, причем система выполнена с возможностью приложения первого терапевтического электрического сигнала к нервная ткани первым электродом, и приложения второго терапевтического электрического сигнала к ткани черепа вторым электродом, а первый и второй электрические сигналы выбраны таким образом, что вызывают модуляцию неврональной активности нервной ткани.
В отдельных вариантах реализации настоящего изобретения, предложена система для модуляция неврональной активности в объеме нервной ткани мозга живого человека, содержащая: (а) первый электрод для электрического подключения к выбранной области нервной ткани мозга; (б) второй электрод для электрического подключения к черепно-мозговому нерву пациента; источник электричества; (в) блок управления, содержащий генератор сигнала, соединенный с источником электричества и первым и вторым электродами; и (г) модуль программируемой электроники, соединенный с блоком управления, причем блок управления выполнен с возможностью приложения терапевтического электрического сигнала к черепно-мозговому нерву вторым электродом, и распознавания электрической активности нервной ткани мозга первым электродом, модуль программируемой электроники выполнен содержащим компаратор для сравнения измеренной электрической активности в ткани мозга с заранее заданным электрическим состоянием ткани мозга. В отдельных вариантах реализации, второй электрический сигнал выбирается с обеспечением модуляцию неврональной активности нервной ткани мозга. Эти и другие варианты реализации, отличительные признаки и преимущества, станут очевидными после раскрытия в приведенном ниже описании с приложенными чертежами.
Краткое описание чертежей.
Фиг.1 является упрощенной иллюстрацией конфигурации расположения электрода и нейростимулятора для терапии расстройства пищевого поведения в соответствии с вариантом реализации настоящего изобретения.
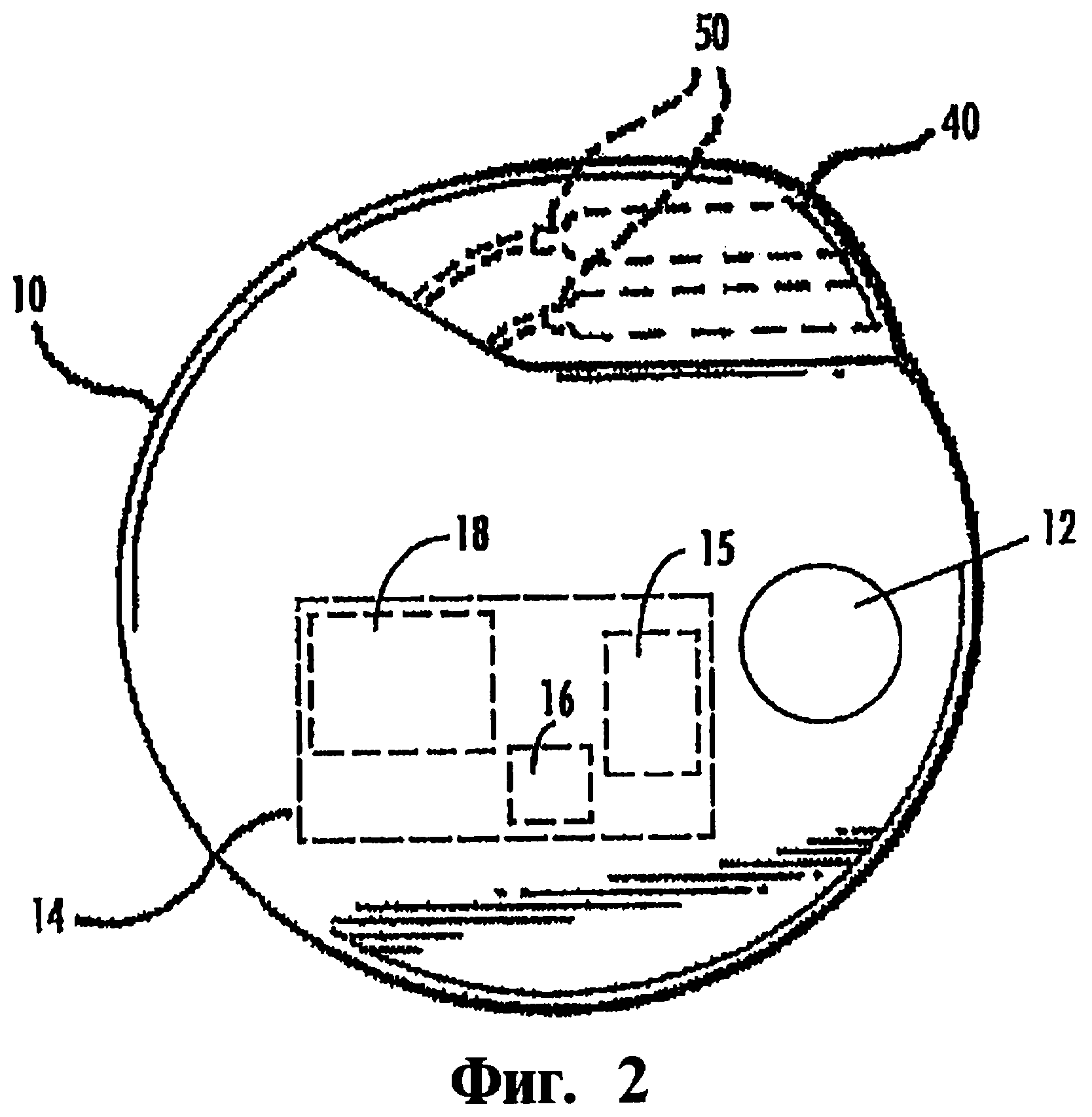
Фиг.2 является фрагментарной иллюстрацией блока управления, содержащего батарею и модуль программируемой электроники (представленный как блок-схема), для использования в терапии расстройства пищевого поведения в соответствии с вариантом реализации настоящего изобретения.
Фиг.3 является схематической блок-схемой устройства химической стимуляции, в соответствии с вариантом реализации настоящего изобретения.
Фиг.4-5 являются упрощенными иллюстративными примерами размещения блоков стимулятора в выбранных областях мозга пациента для терапии расстройства пищевого поведения, в соответствии с некоторыми вариантами реализации настоящего изобретения. Фиг.4 является сагиттальным видом в разрезе мозга, представляющим иллюстративную островковую долю большого мозга в качестве зоны стимуляции мозга, Фиг.5 является венечным видом в разрезе мозга, представляющим в иллюстративных целях предлобную кору головного мозга, поясную часть головного мозга, зрительный бугор и стволовая часть мозга используемые в качестве блоков терапии.
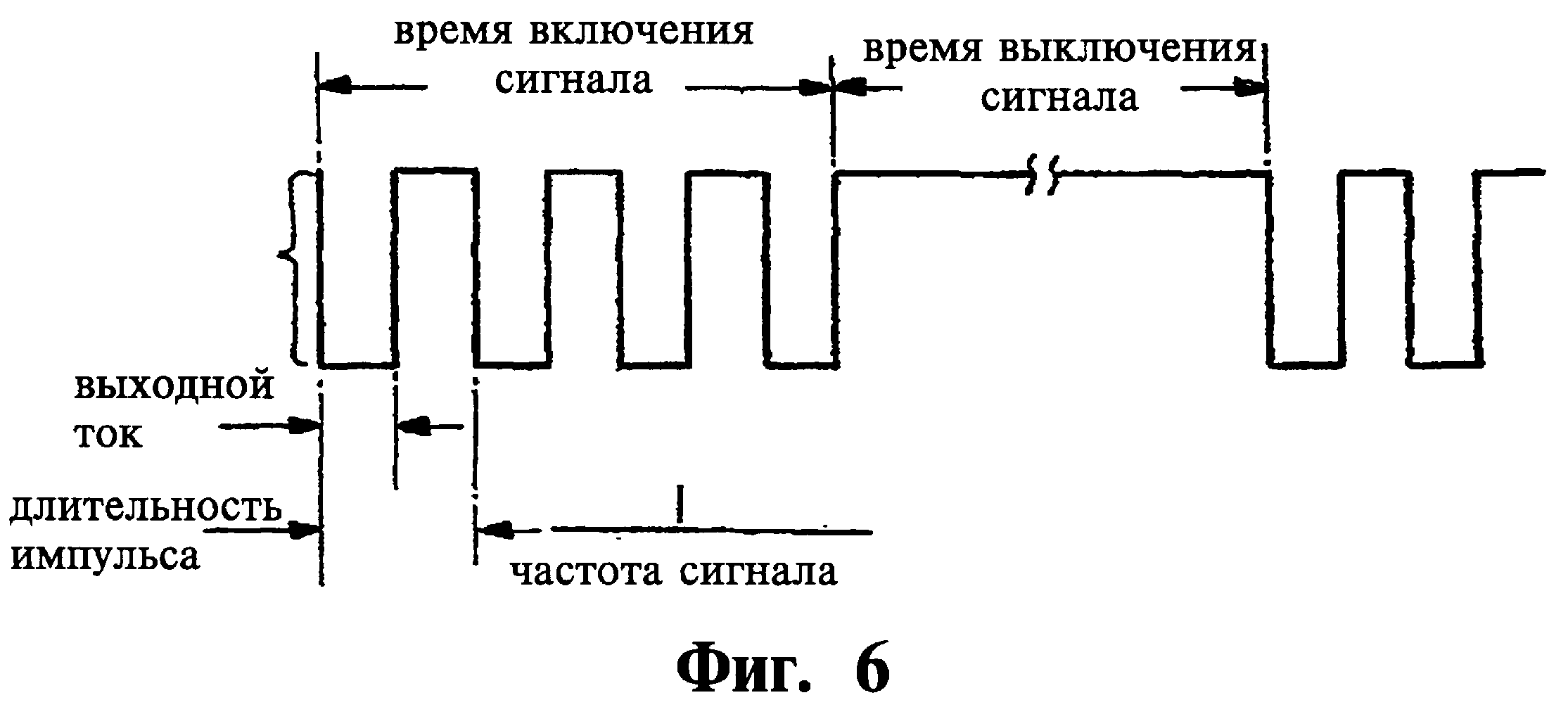
Фиг.6 является иллюстрацией формы волны электрического выходного сигнала генератора сигнала, изображенного на Фиг.1, использованной для пояснения существенных параметров сигнала, сформированного генератором сигнала для приложения к нерву, в соответствии с вариантом реализации настоящего изобретения.
Осуществление изобретения
Определения.
"Расстройство пищевого поведения" относится к любому из группы синдромов, включая, но не ограничиваясь, нейрогенную анорексию, нейрогенную булимию и переедание. Они отличаются значительными расстройствами в пищевом поведении и сильным чувством заботы о параметрах веса или размера тела.
В настоящем описании, термины "стимуляция" и "стимулятор", в общем случае, относятся к подаче сигнала, возбудителя или импульса к нервной ткани для воздействия на неврональную активность нервной ткани (например, объем нервной ткани мозга или нерва). Эффект воздействия такой стимуляции на неврональную активность обозначен термином "модуляция"; однако, для простоты изложения, термины "стимуляция" и "модуляция", а также их варианты, иногда используются в описании взаимозаменяемо. Эффект подачи сигнала к нервной ткани может быть возбуждающим или подавляющим и может делать возможными кратковременные и/или длительные изменения в неврональной активности. Например, эффект "стимуляции" или "модуляции" нервной ткани может включать в себя один или более следующих эффектов: (а) изменения в нервную ткань с обеспечением возбуждения биоэлектрического потенциала (двунаправленного или однонаправленного), (б) подавление проводимости биоэлектрических потенциалов (сформированными эндогенно или под действием внешних факторов) или блокирование проводимости биоэлектрических потенциалов (гиперполяризационных или блокирующих конфликтные состояния), (в) воздействие на изменения в поглощении или освобождении нейротрансмиттера/нейромодулятора, рецепторов, вентильных ионных каналов или синапсов, причем указанное воздействие может иметь возбуждающее, подавляющее или блокирующее свойства и (г) изменения в нейроадаптации или нейрогенезисе ткани мозга.
Термин "глубокая стимуляция мозга" (ГСМ) относится к прямому или косвенному приложению возбудителя к области в мозге. Такая стимуляция может быть электрической с использованием реагента (например, лекарства или лекарственного препарата) или магнитной, и может быть приложена непосредственно или опосредованно к нервной ткани мозга. Сходным образом, глубокое зондирование мозга относится к распознаванию электрического или химического сигнала внутри мозга.
Для облегчения ссылок "стимуляция черепно-мозгового нерва" иногда обозначается в настоящем описании как "СЧМН".
Термины "соединять", "соединяется", "соединен" и "подключение" обозначает как опосредованное, так и прямое электрическое соединение.
"Заранее заданный электрический сигнал" относится к электрическому импульсу или последовательности электрических импульсов, имеющих определенные параметры, такие как ток импульса, ширина импульса, частота, время действия и время паузы.
"Насыщение" относится к чувству достаточности поступления пищи, не связанному с неприятными ощущениями отсутствию желания продолжать есть или пить, а также ощущению заполненного желудка.
"Химическая стимуляция" и "химический реактив" относится к реагенту, наркотическому или лекарственному препарату или реактиву, обеспечивающему возможность стимуляции неврональной активности нерва или нервной ткани, подвергшейся воздействию такого реактива. Примерами таких реактивов являются агонисты, подавляющие нейромедиаторы, антагонисты возбудителей нейротрансмиттеров, реактивы, повышающие уровень подавления нейротрансмиттеров, реактивы, снижающие уровень возбуждения нейротрансмиттеров, и реактивы местной анестезии.
Настоящим изобретением предполагается, что нейронные цепи мозга, связанные с насыщением и с симптомами булимии и других расстройств пищевого поведения, содержат нейроны определенных областей мозга, которые не были ранее связаны с причинным анализом или облегчением расстройства пищевого поведения. Указанные области включают в себя островковую долю большого мозга, подмозолистое поле, поясную часть головного мозга, зрительный бугор, предлобную область коры головного мозга, стволовую часть мозга, мозжечок и тракты белого вещества мозга, ведущие к указанным областям или в область Бродманна, или в ядро внутри указанной области. Предполагается, что указанные области содержат узлы в нейронных цепях, которые имеют отношение к проявлению расстройств пищевого поведения, и могут быть модулированы для возбуждения наличия, отсутствия или изменения степени расстройства пищевого поведения у человека. Также предполагается, что зондирование неврональной активности может быть использовано в сочетании с модуляцией одной или более таких областей мозга для адаптации или изменения параметров стимуляции системы нейростимуляции система и для оптимизации режима лечебной терапии для лечения расстройства пищевого поведения пациента.
Система для терапии расстройств пищевого поведения с использованием глубокой стимуляции мозга (ГСМ)
На Фиг.1 нейростимуляционная система 1 показана выполненной с возможностью терапии булимии или другого расстройства пищевого поведения пациента 34 (показан фантомной линией) путем модуляция электрической активности выбранных областей мозга, связанных с симптомами расстройства. Система 1, в общем случае, содержит, по крайней мере, одно имплантируемое стимулирующее устройство (стимулятор) 36, предпочтительно электрод, соединенное с устройством управления (блоком управления) 10, выполненным на основе микропроцессора для формирования стимулирующих сигналов.
Стимулятор. Для простоты использования блок приложения стимулирующего или возбуждающего воздействия, в некоторых случаях назван просто "электрод." Тем не менее, следует понимать, что стимуляция нерва или нервной ткани может быть реализована с использованием электрического, магнитного или химического/лекарственного (с использованием реагентов или лекарственных препаратов) возбуждения, или для стимуляции может быть использована комбинация любых или всех средств, указанных выше. Электрод выполнен с возможностью расположения в непосредственном контакте с объемом нейронной ткани мозга, в отношении которой, в зависимости от необходимости, осуществляется стимуляция и/или измерения. В другом варианте выполнения выбран, по крайней мере, один электрод, пригодный для размещения вблизи к выбранной нервной ткани. Для режима электрической стимуляции блок управления 10 соединен с каждым из электродов 36 с использованием расположенного снаружи черепа электрода(ов) 37, выполненного с возможностью приложения электрического сигнала к выбранной области с использованием блока формирования электрического сигнала 15 блока управления 10 (Фиг.2). Электрод(ы) 37, 39 присоединены к блоку управления соединителями 50, расположенными на головном устройстве 40. Электрод/сборка электродов такого типа выпускаются известными производителями. В другом варианте выполнения электрод(ы) 37 не используются, а, по крайней мере, один имплантированный электрод содержит индукционный приемник, а блок управления 10 выполнен с возможностью дистанционной модуляции выбранной нервной ткан, с использованием телеметрической информации, переданной через внешний передатчик. Пригодные для этих целей электроды такого типа, также выпускаются известными производителями.
Зонд. Система может содержать, по крайней мере, один имплантируемый зондирующий электрод (зонд) 38. Зонд выполнен с возможностью измерения эндогенной невральной активности или активности, вызванной модуляцией и посредством блока управления 10 соединен с устройством управления 10 через электрод(ы) 39. Соответственно, система может быть выполнена с возможностью приложения стимулирующего сигнала в ответ на предварительно заданное инициирующее сигнал событие или в зависимости от измеренной психологической активности, или в зависимости от внешнего сигнала, или от визуализированных параметров мозга или от сигнала, сформированного вручную врачом или пациентом, как подробно показано ниже. Пригодные для целей изобретения электроды зондирования и других устройства зондирования, предназначенные для зондирования психологических параметров, выпускаются известными производителями.
Блок управления. Точные параметры раздражителей, сформированные блоком управления, могут быть запрограммированы. Система 1 содержит внутреннюю или внешнюю систему, выполненную с возможностью измерения, зондирования, записи и контроля психологической активности, психологических событий, психологических пороговых величин, а также состояния тела или мозга. Кроме того, система может быть выполнена с возможностью изменения параметров воздействия с использованием адаптивного обучения, причем устройство распознает активность или психологические изменения после стимуляции и автоматически настраивает блок управления для осуществления попытки обеспечения оптимальной терапии. В этом случае, блок управления может также распознавать результат неблагоприятной стимуляции и настраивать стимуляцию для обеспечения предотвращения неблагоприятной реакции пациента.
Как показано на Фиг.1, в изобретении используется система внешнего программирования 150, обычная для имплантируемых электрических медицинских устройств. Система внешнего программирования 150 является, предпочтительно, выполненной с возможностью беспроводного (например, радиочастотного) соединения с блоком управления 10 и содержит компьютер 160 и блок чтения-записи 170, имеющий радиочастотные передатчик и приемник. Компьютер 160 может включать в себя портативный компьютер, управляемый поставщиком услуг по охране здоровья. Блок чтения-записи 170 выполнен с возможностью обмена информацией с приемником и передатчиком блока управления 10 и может быть использован для приема данных или передачи данных к блоку управления 10.
В другом варианте выполнения имплантируемое устройство управления 10 содержит модуль программируемой электроники 14, содержащий генератор 15 сигнала, блок контроля (индикатор) 16 для передачи соответствующих сигналов от и к имплантированному электроду и зонду, или электродам и зондам, и блок процессора (процессор) 18 для записи, измерения, зондирования или контроля психологических данных и их сравнения с хранящимися в памяти значениями, базовыми значениями, расчетными или ожидаемыми значениями, и осуществляет вычисление наилучших параметров воздействия (как это схематически показано на Фиг.6). Источник энергии 12 также входит в состав блока управления 10. Программируемый процессор выполнен с возможностью настройки и передачи параметров возбуждения к блоку стимуляции для лечения расстройства. Параметры управления могут храниться в цифровом виде для последующей обработки или диагностирования. В обобщенном виде имплантируемый блок управления/генератор импульсов для использования в система и способе, согласно настоящему изобретению, раскрыт, например, в патенте США №5154172, заявленном тем же заявителем, что и настоящая заявка (устройство также относится к устройству нейрокибернетического протеза (Neurocybernetic Prosthesis или NCP, "NCP" является товарным знаком Cyberonics, Inc. Хьюстон, Техас, США).
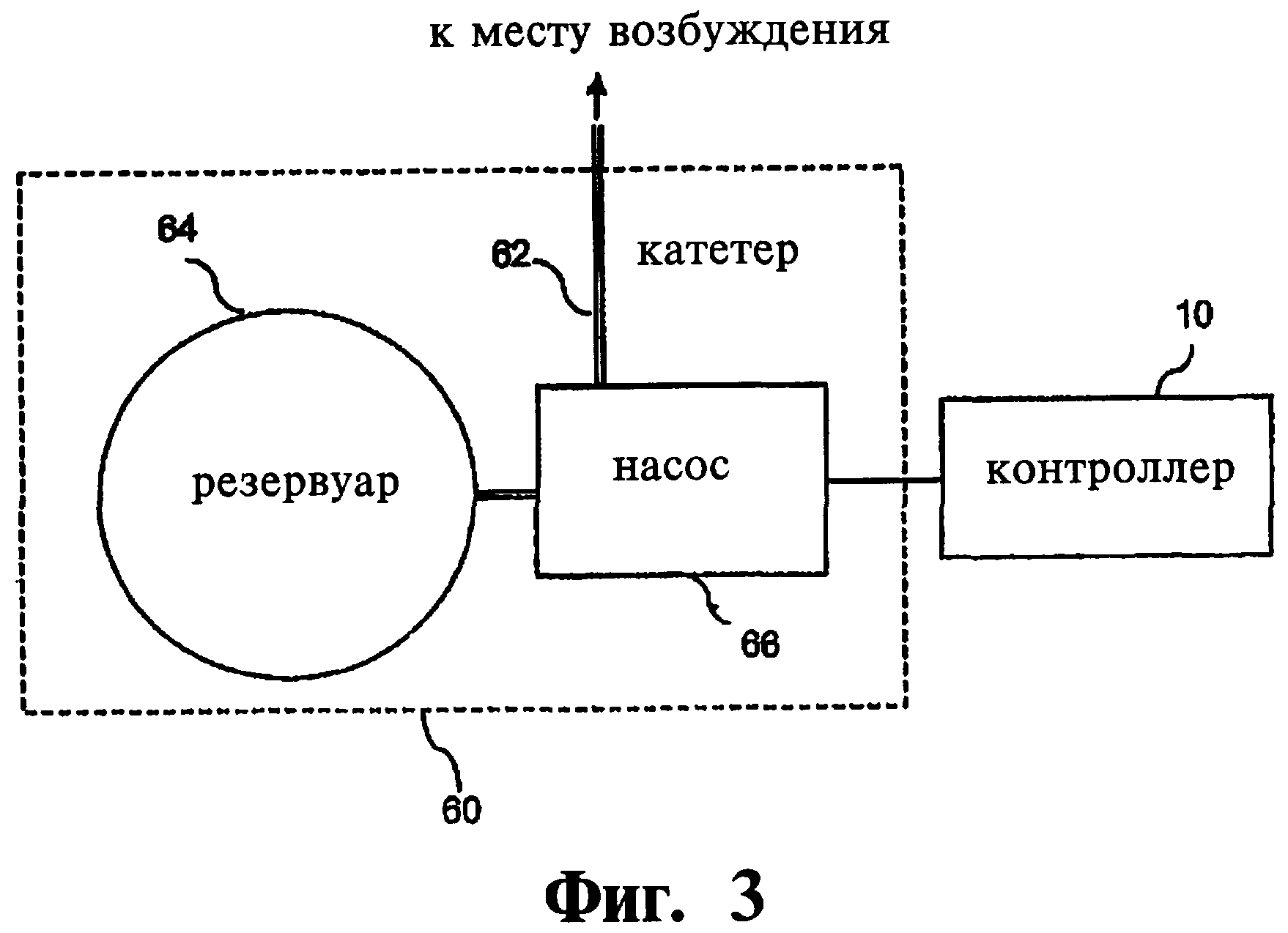
Электрическая, химическая, магнитная стимуляция. Хотя предпочтительным является использование, по крайней мере, одного электрода, в качестве устройство приложения возбуждения (стимулятора) для подачи сигнала электрической стимуляции к выбранной нервной ткани, предполагается также, что нейростимуляторные системы могут, вместо этого или в дополнение, содержать средства для ввода реагентов или лекарственных препаратов для приложения лечебного возбудителя выбранной нервной ткани, эффективного для модуляции активности нервной ткани, облегчающей расстройство пищевого поведения. Устройство введения возбуждающего реагента 60 может включать в себя катетер 62, заполненный реагентом резервуар 64 и насос 66, при этом устройство может быть имплантируемо целиком или состоять из имплантируемых (катетера) и внешних (насос) компонентов, либо в системе может использоваться другое приемлемое устройство введения реагента (Фиг.3). Насос соединен с блок управления 10. Примерами типов реагентов или лекарственных средств, которые могут быть использованы для благотворной модуляции, являются: агонисты или антагонисты, подавляющие нейромедиаторы, агонисты и антагонисты возбудителей нейромедиаторов, реактивы, повышающие уровень подавления нейротрансмиттеров, реактивы, снижающие уровень возбуждения нейротрансмиттеров, и реактивы местной анестезии. Сигналы управления могут подаваться к или от: электрода на нерве, электрода или зонда в мозге, от устройства введения реагента, и/или зонда, или от внутреннего или внешнего блока контроля с использованием телеметрических и/или дистанционных сигналов, передаваемых через проводящие электроды, выполненные в программируемой цепи.
В другой конфигурации системы нейростимуляции стимулятор не используется, а система выполнена с возможностью бесконтактного приложения магнитного возбуждения к выбранному нерву или нервной ткани от внешнего источника через расположенный снаружи черепа магнитный стимулятор (не показан), что известно в указанной области техники. Соответственно, следует учесть, что модуляция нервной ткани модуляцию может быть возбуждена с использованием электрического, магнитного воздействия или химического реагента/лекарственного препарата.
В другой конфигурации системы нейростимуляции используются заменяющие электроды, разработанные для дурального или субдурального размещения в прилегающих областях мозга таких как, орбитально-передняя область коры головного области, вместо использования электрода для глубокой имплантации мозг. Дуральный или субдуральный электроды могут быть использованы для приложения электрической стимуляции или для зондирования электрической активности, или как для приложения электрической стимуляции, так и для зондирования электрической активности.
В еще одной конфигурации системы, также показанной на Фиг.1, система нейростимуляции содержит, по крайней мере, один стимулятор и/или зонд для подключения непосредственно или опосредованно к, по крайней мере, одному черепно-мозговому нерву, в предпочтительном случае, тригеминальному, подъязычному, блуждающему нерву и дополнительному нерву. В другом варианте выполнения в системе могут быть использованы электроды, выполненные с возможностью размещения на или вблизи левого и/или правого блуждающего нерва(нервов) в области рядом с диафрагмой (например, наддиафрагменной или поддиафрагменной). Указанные электроды могут быть электродами стимуляции и/или электродами зондирования.
Программируемое управление. Устройство управления выполнено с возможностью передачи сигналов управления от внутреннего или внешнего блока контроля к электроду(ам) и/или зонду(ам). Система выполнена с возможностью передачи стимулирующих воздействий, которые могут быть перемежающимися, периодическими, случайными, в виде парных импульсов кодированными или сформированными на основе шаблона. Например, частота электрической стимуляции может быть от 0,1 до 2500 Гц, ширина импульса 1-2000 мкс, амплитуда тока от 0,1 мА до 10 мА. Стимуляция также может быть реализована с использованием как катода (электрода отрицательной полярности), так и электрода положительной полярности.
Система нейростимуляции 1 является, предпочтительно, выполненной с возможностью передачи к выбранной нервной ткани стимулирующих электрических сигналов, которые могут быть перемежающимися, периодическими, случайными, в виде парных импульсов кодированными или сформированными на основе шаблона. Частота электрической стимуляции может быть от 0,1 до 2500 Гц, ширина импульса 1-2000 мкс, амплитуда тока от 0,1 мА до 10 мА. Стимуляция также может быть реализована с использованием как катода (электрода отрицательной полярности), так и электрода положительной полярности.
Ручное возбуждение/вывод из активного состояния. Конструктивно система может быть выполнена различным образом для реализации ключа ручного возбуждения или вывода из активного состояния, связанного с блоком управления 10. Сходные устройства для ручного и автоматического возбуждения имплантируемых медицинских устройств известно, например, из описания патента США №5304206 (Cyberonics, Inc.). Например, ручное возбуждение или вывод из активного состояния генератора сигнала может быть достигнуто при использовании устройств таких, как акселерометр или пьезоэлемент, установленный на внутренней поверхности корпуса блока управления для распознавания легких ударов пациента по месту размещения имплантированного блока управления в теле пациента. Такое выполнение позволяет пациенту ограниченно, но доступным образом осуществлять управление действием устройства, если врач сочтет это приемлемым.
Способ терапии расстройства пищевого поведения
Фиг.1 показывает предпочтительное размещение имплантированного блока управления 10 в черепе пациента в полости, сформированной хирургом, проводящим имплантацию, непосредственно под кожным покровом, примерно тем же способом, как имплантируется кардиостимулятор. Иллюстративный пример режима терапии, позволяющего пациенту преодолеть серьезное расстройство пищевого поведения (например, повторяющиеся случаи кинорексии и освобождения кишечника), в общем случае, содержит использование раскрытой выше системы нейростимуляции, и выполнение ей с возможностью и программирования или программирование системы для модуляции неврональная активность заранее заданной области нервной ткани.
По крайней мере, один стимулятор 36 (например, электрод, катетер) имплантирован хирургическим путем в мозг пациента, нуждающегося в терапии серьезного расстройства пищевого поведения. При использовании соответствующей хирургической техники, известной из уровня техники, в черепе пациента формируется небольшое отверстие, и стимулятор устанавливается в или вблизи области мозга, содержащей "ядро" нейронных цепей, находящихся в связи с симптомами расстройства пищевого поведения пациента. Например, выбранная область может быть связана с чувством насыщения пациента. Иллюстративным местом установки стимулятора является позиция в островковой доле большого мозга, как показано на Фиг.4. Левая и правая передняя и задняя островковые доли большого мозга и ограда головного мозга являются предпочтительными местами модуляции. Другими преимущественными местами имплантации стимуляторов являются: подмозолистое поле, поясная часть головного мозга, зрительный бугор, предлобная кора головного мозга, мозжечок, средний мозг и ствол мозга, и ядра или области Бродманна внутри указанных областей, а также тракты белого вещества мозга, ведущие к или от любой из указанных областей (Фиг.5). Области Бродманна 24, 25 и 32, или части любой из указанных областей, являются преимущественными областями стимуляции. Аномальное пучковое ядро является другой предпочтительной позицией. Области Бродманна 8, 9, 10 и 11 и орбитально-передняя часть коры головного мозга, или часть одной или нескольких из указанных областей, также являются преимущественными областями воздействия. Мостовое и сердцевидный регионы также пригодны в качестве областей имплантации. Там где графические материалы и описание сосредоточены на полушарии мозга, следует учитывать, что в этих случаях также подразумевается стимуляция и/или зондирование такого рода структур как для одной, так и для двух сторон мозга. Стимуляция и/или зондирование может быть реализована по отношению к блокам в одном или двух полушариях и может производиться одновременно или в разное время, а также может включать в себя одинаковые или различные раздражители. Представляющая интерес область мозга, в качестве мест для стимуляции и/или зондирования, содержит, но не ограничивается следующими областями: центрально-медианный пучковый комплекс, гиппокамп, переднее срединное таламическое ядро Вима, аномальный пучковый комплекс, другие части зрительного бугра, вся зона зрительного бугра, субталамическое ядро (STN), хвостатое ядро, скорлупа, другие базальные компоненты нервных узлов, поясная часть головного мозга, другие подкорковые ядра, ядро locus ceruleus, пендуколомостовое ядро ретикулярной формации, красное ядро, черная субстанция, другие стволовые структуры мозга, мозжечок, внутренняя капсула, внешняя капсула, корково-спинномозговой пирамидный путь, пирамидный тракт, ansa lenticularis, каемчатый контур или Papez, нижне-передняя ганглиозно-таламокортикальная система, тракты белого вещества мозга, моторная кора головного мозга, премоторная кора головного мозга, соматосенсорная кора головного мозга, другие области, критические чувствительные области, околообонятельное поле Брока, область Верники, желудочковая область, паравентрикулярная область, другие структуры центральной нервной системы, другие структуры периферической нервной системы, кора головного мозга, лимбическая система и ретикулярная система, префронтальная кора головного мозга, орбитально-передняя кора головного мозга, передняя оконечность внутренней капсулы, прилегающее ядро, вентральный стриатум, вентральный паллидум переднего ядра зрительного бугра, дорсомедиальное ядро зрительного бугра, интраламинарные таламические ядра, поясная часть коры головного мозга, мозжечковая миндалина, гиппокамп, сосцевидные тела, латеральный гипоталамус, голубое пятно, ядро шва, парабрахиальное ядро, ядро одиночного тракта, хвостовая вентролатеральная медулла и передняя вентролатеральная медулла, паравентрикулярное ядро гипоталамуса, аномальное пучковое ядро, ядро основания (stria terminalis), предлобная кора головного мозга, надоптическое ядро и циркумвентикулярные органы переднего мозга, вентральная покрышка, черная субстанция, компактная зона черной субстанции (pars compacta) и сетчатка.
В режиме электрической стимуляции имплантированный электрод соединен с генератором сигнала блока управления 10. Как схематически показано на Фиг.3, для режима стимуляции с использованием реагента/лекарственного препарата, катетер соединяется с выбранной тканью и устройством (насосом) подачи реагента/лекарственного препарата, который соединен с блоком управления 10. Электроды 37, 39, в предпочтительном случае, проходят под кожей черепа к имплантированному блоку управления 10, однако они также могут располагаться снаружи, по отношению к имплантированному или внешнему блоку управления. Катетер может быть сходным образом проложен к имплантированному или расположенному снаружи насосу. Катетер, при необходимости, может быть выполнен содержащим, по крайней мере, один электрод.
Система может иметь возможность зондирования, которыми можно управлять для распознавания электрической или химической активности в выбранной области мозга или объеме нервной ткани, обеспечивающую обратную связь с блоком управления, таким образом, что стимулирующий сигнал (например, один или более параметров таких, как ток импульса, ширина импульса, частота и время наличия или время отсутствия сигнала) автоматически настраивается с обеспечением терапии расстройства пищевого поведения. Предпочтительными областями мозга для зондирования являются островковая доля большого мозга, подмозолистое поле, поясная часть головного мозга, зрительный бугор, гипоталамус, предлобная кора головного мозга, мозжечок, средний мозг и ствол мозга, ядра внутри указанных областей и тракты белого вещества мозга, ведущие от указанных областей. Электрод стимуляции также может быть использован в качестве электрода зондирования. В предпочтительном случае, зондирование области мозга может осуществляться эпидурально, субдурально или коже черепа пациента. В другом варианте выполнения, по крайней мере, один электрод зондирования 26, или другое устройство зондирования, располагается в контакте с или поблизости от одного из черепно-мозговых нервов 27. Зонд соединяется с блоком управления 10 через электрод 22 (Фиг.1). Выбранным черепно-мозговым нервом, в предпочтительном случае, является тригеминальный, подъязычный, блуждающий нерв и/или дополнительные нервы. Подключение к нерву может осуществляться в любой точке на протяжении нерва или одной из ветвей нерва.
После успешного заживления результатов хирургической имплантации врач выбирает подходящие стимулирующие сигналы путем запуска системы нейростимуляции 1 для формирования электрических раздражителей в форме электрических импульсов в соответствии с запрограммированным режимом для глубокой стимуляции мозга выбранной области мозга пациента. В процессе процедуры имплантации электрода врач проверяет уровень тока импульсного сигнала для того, чтобы удостовериться, что амплитуда тока настраивается, по крайней мере, меньшей, чем критическая для пациента амплитуда, при которой могут возникнуть неблагоприятные эффекты. Обычно, уровень стимуляции программируется так, чтобы пациент не испытывал значительных неприятных ощущений, относящихся к терапии ГСМ, хотя различия в настройках параметров устройства могут изменяться от пациента к пациенту. В любом случае, максимальная амплитуда тока должна быть соответствующим образом настроена до эффекта улучшения (например, облегчение позывов к перееданию), в допустимых границах безопасности. Пороговые значения неблагоприятных эффектов и/или благоприятных эффектов могут значительно изменяться с течением времени в течение нескольких дней после имплантации, таким образом, уровни, в предпочтительном случае повторно проверяются в первые несколько дней после имплантации для определения необходимости настроек для установки эффективного режима. Режим ГСМ, в предпочтительном случае, использует перемежающиеся последовательности, где период, в котором формируются повторяющиеся последовательности импульсов для стимуляции выбранной нервной ткани в мозге, чередуется с периодом, в течение которого импульсы не формируются. Рабочий цикл включенного и отключенного состояний указанных различных периодов стимуляции, а также отсутствие стимуляции, в предпочтительном случае имеет отношение, в котором время отсутствия активности, примерно, в 1,8 раза больше периода активности. Также, в предпочтительном случае, ширина каждого набора импульсов устанавливается со значением, которое не больше 500 мкс, а частота повторения импульсов программируется в диапазоне около 130 Гц. Раскрытые выше электрические и временные параметры сигнала стимуляции, используемого для ГСМ, по большей части иллюстративные и не содержат ограничений сущности настоящего изобретения.
В качестве помощи в настройке программирования системы и оптимизации параметров сигнала стимуляции для терапевтического режима конкретного пациента может быть использована программа стимуляции черепно-мозгового нерва с выборочным глубоким зондированием мозга. Такой способ содержит размещение электрода в контакте или вблизи с одним из черепно-мозговых нервов (в предпочтительном случае левый блуждающий нерв в шее пациента), и контактирование электрода зондирования с выбранной областью мозга пациента, такой как: островковая доля большого мозга, подмозолистое поле, поясная часть головного мозга, зрительный бугор, гипоталамус, предлобная область коры головного мозга, стволовая часть мозга, мозжечок и тракты белого вещества мозга, ведущие от указанных выше областей. Оба электрода соединяются с блоком управления/возбуждения блока генератора или процессора, как это было показано выше. Заранее заданный электрический сигнал прикладывается к электроду черепно-мозгового нерва - электрод, что вызывает стимуляцию или подавление (модуляцию) электрической активности нервной ткани, которая принимает электрическое возбуждение от указанного черепно-мозгового нерва. Иллюстративная идеализированная форма сигнала электрического выхода генератора сигнала, пригодная для пояснения существенных параметров сигнала, сформированного генератором сигнала для приложения к нерву, показана на Фиг.6. Программирование и настройка блока управления/процессора выполняется с обеспечением распределения во времени пакетов импульсов электрической стимуляции нерва, что вызывает стимуляцию выборочных парасимпатических центростремительных ветвей черепно-мозговых нервов, причем один или более: вкусовых проводящих путей нервной системы, обонятельных, вызывающих воспаление или противовоспалительный проводящих путей нервной системы, дыхательных проводящих путей нервной системы, кардиотонических проводящих путей нервной системы, барорецепторных проводящих путей нервной системы, соматосенсорных проводящих путей нервной системы и проводящих путей насыщения нервной системы активируются благотворной модуляцией, в результате чего формируется ослабление невральной активности в различных областях мозга. Сходным образом, стимуляция черепно-мозгового нерва может возбуждать нейротрансмиттеры проводящих путей нервной системы такие, как норадренергические, серотонинергические, дофаминергические и холинергический проводящих пути нервной системы.
Ответная модуляция или изменение электрической активности нейронной ткани, в области мозга пациента, с использованием имплантированного контактного электрода измеряется и передается на блок управления 10. В другом варианте выполнения программирование системы и оптимизация параметров сигнала стимуляции, для терапевтического режима пациента, содержит выполнение программы выборочной ГСМ с выборочным глубоким зондированием мозга. В частном случае, имплантируемый зонд соединен с подмозолистым полем, а система затем функционирует с распознаванием электрической или химической активности в подмозолистом поле и выполняется с обратной связью к блоку управления для оптимальной настройки стимулирующей терапии расстройства пищевого поведения пациента. Стимулирующие и измеренные данные анализируются в процессоре для определения любых изменений в электрической активности выбранной области мозга, вызванных приложением конкретного электрического сигнала. Таким образом, параметры сигнала настраиваются под наблюдением врача, и вызывают ответное ослабление невральной активности в выбранной области мозга. Такая модуляция электрической активности выбранной области мозга связывается процессором с определенным или ожидаемым облегчением симптома расстройства пищевого поведения пациента.
Пищевое поведение пациента должно стабилизироваться, приблизительно, на уровне, существовавшем до операции, до того, как действительно начнет осуществляться режим ГСМ. Терапия, приложенная в форме длительной перемежающейся электрической стимуляции в течение каждого двадцатичетырехчасового периода может быть предварительно исследована с результатом, заключающимся в отсутствии несоответствующего пищевого/очищающего поведения пациента. Но после периода в несколько дней, такого режима ГСМ, возникнет различимая потеря интереса к кинорексии/перееданию/освобождению кишечника. Типичным проявляющимся результатом может быть тот, что использование времени приема пищи стремится к увеличению до существенного длительного периода, чем тот, что был выявлен для предоперационного поведения пациента, с меньшими объемами пищи, потребляемыми при однократном приеме пищи и увеличенными временными интервалами между раздельными приемами пищи. Не предполагается, что ГСМ терапия неблагоприятно возбуждает нормальное поведение пациента, в других аспектах его жизни. Ожидается, что полное прекращение режима ГСМ даст, в результате, относительно быстрый возврат к предшествующему булимическому поведению, прекращающемуся после возобновления режима ГСМ. Предполагается, что ГСМ стимуляция определенных областей мозга лиц, страдающих от серьезного расстройства пищевого поведения, может использоваться в качестве вспомогательного средства для более эффективного лечения и изменения модели пищевого поведения лиц, страдающих от булимии и других расстройств пищевого поведения.
Выборочная стимуляция области подмозолистого поля. В иллюстративном режиме терапии, заранее заданный стимулирующий сигнал (например, электрический сигнал) прикладывается к подмозолистому полю мозга человека, и такая стимуляция подмозолистого поля формирует модуляцию неврональной активности в субгенуальной области поясной части головного мозга. Приложение другого заранее заданного стимулирующего сигнала стимуляции выбранного подмозолистого поля дает, в результате, модуляцию неврональной активности в области, выбранной из группы, в которую входят: область Бродманна 32, область Бродманна 25, область Бродманна 24, область Бродманна 10 и область Бродманна 9, как показано на Фиг.5. В результате такой нейрональной модуляции выбранного подмозолистого поля частота позывов субъектов к перееданию очищению пищевода, минимизируется. В частном случае, стимулирующая часть (электрод) соединяется с областью Бродманна 25, и электрический сигнал стимулирует область Бродманна 25, в результате чего модулируется неврональная активность в области Бродманна 25, посредством чего пациент испытывает чувство насыщения и/или побуждение к перееданию или очищению минимизируется. Другой режим терапии включает приложение заранее заданного электрического сигнала к области Бродманна 25 которое дает, в результате, модуляцию неврональной активности в области Бродманна 9. В другом режиме, заранее заданный электрический сигнал прикладывается к области Бродманна 32 и области Бродманна 25, в результате чего осуществляется модуляция неврональной активности в области Бродманна 24.
В режиме химической/лекарственной стимуляции врач хирургическим путем имплантирует катетер, имеющий проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы реагента или лекарственного средства так, что после имплантации разгрузочная часть катетера соединена с подмозолистым полем. Приложению заранее заданного стимулирующего сигнала включает приведение в действие насоса для выделения реагента/лекарственного препарата через разгрузочную часть катетера в подмозолистое поле, в результате чего осуществляется терапия расстройства пищевого поведения. Выбранная нервная ткань и возбуждаемая (модулируемая) нервная ткань могут быть различными или одинаковыми, в зависимости от выбранного для стимулирующего сигнала реагента/лекарственного препарата, что аналогично раскрытому выше режиму электрической стимуляции. Для частного случая, порядок действий может содержать хирургическую имплантацию катетера, имеющего проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы лекарственного препарата, причем после имплантации разгрузочная часть катетера s соединена с областью Бродманна 25 мозга пациента. Заранее заданный стимулирующий сигнала прикладывается путем приведения в действие насоса для выделения лекарственного препарата через разгрузочную часть катетера в область Бродманна 25, в результате чего осуществляется модуляция невральной активности в данной части мозга для улучшения симптомов расстройства пищевого поведения. Некоторые приемлемые типы реагентов и/или лекарственных препаратов могут быть выбраны из агонистов, подавляющих нейромедиаторы, антагонистов возбудителей нейротрансмиттеров, препаратов, повышающих уровень подавления нейротрансмиттеров, препаратов, снижающих уровень возбуждения нейротрансмиттеров, и препаратов местного обезболивания.
Выборочная стимуляция области островковой доли большого мозга. Как показано на Фиг.4, другой предпочтительный режим терапии включает хирургическую имплантации в мозг пациента, страдающего от серьезного расстройства пищевого поведения, электрода стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединена с частью островковой доли большого мозга. Проксимальный вывод электрода соединен с генератором сигнала, который формирует заранее заданный электрический стимулирующий сигнала так, что сигнал электрически стимулирует выбранную область островковой доли большого мозга, в результате чего осуществляется модуляция неврональной активности возбуждаемой ткани с облегчением расстройства пищевого поведения.
Выборочная стимуляция субгенуальной поясной области. Как показано на Фиг.5, другой предпочтительный режим терапии включает хирургическую имплантацию электрода электрической стимуляции, имеющего проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединена с областью субгенуальной поясной части головного мозга. Проксимальный вывод электрода соединен с генератором сигнала, который формирует заранее заданный сигнал электрической стимуляции, причем указанный сигнал электрически стимулирует область субгенуальной поясной части головного мозга для модуляции неврональной активности возбуждаемой ткани, которая, в свою очередь, облегчает расстройство пищевого поведения.
Выборочная двухуровневая стимуляция - электрическая/химическая ГСМ. Другой режим терапии включает режимы как электрической, так и химической стимуляции. Врач хирургическим путем имплантирует электрода электрической стимуляции, имеющий проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть соединена с подмозолистым полем мозга человека. Также, врач хирургическим путем имплантирует катетера, имеющий проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы реагента или лекарственного препарата так, что после имплантации разгрузочная часть катетера соединена с выбранным подмозолистым полем. Проксимальный вывод электрода соединен с генератором сигнала, а заранее заданный электрический сигнал формируется генератором сигнала так, что стимулируется выбранное подмозолистое поле. Кроме того, осуществляется управление насосом так, что реагент или лекарственный препарат выделяется через разгрузочную часть катетера в подмозолистое поле так, что подмозолистое поле дополнительно стимулируется реагентом или лекарственным препаратом для облегчения расстройства пищевого поведения.
Иллюстративная процедура, в которой ГСМ и стимуляция черепно-мозгового нерва используются совместно, содержит подключение первого электрода к выбранной области мозга пациента, для которой известно или ожидается, что она связана с симптомами расстройства пищевого поведения (например, область поясной части головного мозга или область островковой доли большого мозга). Второй электрод соединен черепно-мозговым нервом пациента. Заранее заданный терапевтический электрический сигнал прикладывается к первому электроду для стимуляции нервной ткани, а второй заранее заданный терапевтический электрический сигнал прикладывается к второму электроду. В результате двойного приложения первого и второго сигналов, достигается благоприятная модуляция неврональной активности выбранной области нервной ткани, которая облегчает булимию или другое расстройство пищевого поведения.
Другой двухуровневый режим стимуляции включает хирургическую имплантацию стимулирующего электрода с прямым или опосредованным соединением с областью Бродманна 25. Катетера, имеющий проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы лекарственного препарата, хирургическим путем имплантируется так, что разгрузочная часть катетера также соединяется с областью Бродманна 25. Заранее заданный электрический сигнал прикладывается к электроду таким образом, что стимулируется область Бродманна 25. Кроме того, осуществляется управление насосом таким образом, что осуществляется выделение лекарственного препарата через разгрузочную часть катетера в область Бродманна 25 так, что дополнительно стимулируется область Бродманна 25 с усилением облегчения расстройства. Электрическая и химическая стимуляция могут быть приложены одновременно или поочередно, по назначению врача.
Выборочная ГСМ с обратной связью по результатам зондирования. Когда в настоящем изобретении используются возможности зондирования, имплантируемый или внешний процессор дополнительно настраивается для измерения, зондирования, записи и контроля психологической активности, психологических событий, психологических пороговых величин, состояния тела или мозга. Такое выполнение осуществляется, в частном случае, путем зондирования электрической активности нерва (биоэлектрических потенциалов), внутри или снаружи мозга, сердца, желудочно-кишечного тракта, поджелудочной железы или других органов, соединенных с блуждающим нервом. Процессор и блок управления выполнены таким образом, что параметры воздействия могут изменяться или настраиваться в зависимости от адаптивного обучения, где система распознает активность или психологические изменения после стимуляции и автоматически настраивает блок управления для осуществления попытки обеспечения оптимальной терапии. Блок управления/процессор может также определять результат неблагоприятной стимуляции и настраивать стимуляцию с обеспечением предотвращения неблагоприятной реакции пациента.
Иллюстративная адаптивная система стимуляции мозга содержит, по крайней мере, один биологический зонд (или датчик), соединенный с пациентом для зондирования текущего состояния, по крайней мере, первой области мозга или нескольких первых областей мозга. По крайней мере, один контур стимуляции соединен с первой областью мозга или несколькими первыми областями мозга пациента с использованием первого электрода для обеспечения стимуляции в соответствии с набором параметров стимуляции. Система также содержит компаратор, соединенный с зондами для приема данных. Относящихся к текущему состоянию и сравнивает набор данных, относящихся к текущему состоянию с данными, относящимися к эталонному состоянию, где сравнение приводит к положительному результату или отрицательному результату, а положительный результат является эффектом улучшения и/или отсутствием недопустимых неблагоприятных эффектов. По крайней мере, одна цепь управления соединена с указанным, по крайней мере, одним контуром стимуляции, выполненным с возможностью настройки в соответствии с результатом сравнения текущего и эталонного состояний, для управления набором параметров стимуляции.
Стимуляция черепно-мозгового нерва с выборочным глубоким зондированием мозга. В вариантах указанного выше способа двухуровневой стимуляции способ, стимуляция черепно-мозгового нерва (СЧМН) используется вместо или в дополнение к глубокой стимуляции мозга (ГСМ). В таком варианте способа один из черепно-мозговых нервов электрически стимулируется вместо электрической стимуляции подмозолистого поля. Система из, по крайней мере, одного стимулирующего электрода или стимулирующего реагента/лекарственного препарата расположена в контакте с или вблизи одного из черепно-мозговых нервов. Выбранный черепно-мозговой нерв является, предпочтительно, тригеминальным, подъязычным, блуждающим нервом или дополнительным нервом. Контакт с нервом может быть осуществлен в любой точке вдоль нерва или с любой из ветвей нерва. В частном случае, показанном на Фиг.1, электрод 26 является, предпочтительно, электродом биполярной стимуляции, в предпочтительном случае спирального типа, как показано в патенте США №4573481 (Bullara). Электродный узел хирургическим путем имплантируется к блуждающему нерву 27 в шее пациента. В другом примере врач хирургическим путем может имплантировать пару стимулирующих электродов к левому и правому блуждающим нервам, а параметры стимулирующего сигнала устанавливаются с обеспечением двусторонней стимуляции двух блуждающих нервов в синхронном или асинхронном порядке для выборочного подавления, возбуждения, или блокировки выбранных областей мозга для облегчения симптомов булимии. Блок управления/процессор настраивается для обеспечения распределения во времени пакетов импульсов электрической двухсторонней стимуляции для ослабления невральной активности в выбранной области мозга для достижения требуемого результата. Параметры сигнала могут настраиваться для стимуляции выбранных парасимпатических центростремительных ветвей черепно-мозговых нервов, где благотворной модуляции подвергаются один или более следующих проводящих путей нервной системы: вкусовые проводящие пути нервной системы, обонятельные, воспалительные или противовоспалительные проводящие пути нервной системы, дыхательные проводящие пути нервной системы, кардиотонические проводящие пути нервной системы, барорецепторные проводящие пути нервной системы, соматосенсорные проводящие пути нервной системы и проводящие пути насыщения нервной системы. Сходным образом, стимуляция черепно-мозгового нерва может возбуждать нейротрансмиттеры проводящих путей нервной системы такие, как норадренергические, серотонинергические, дофаминергические и холинергические проводящие пути нервной системы.
Конфигурация стимуляции черепно-мозгового нерва особенно полезна для оптимизации параметров сигнала стимуляции, как это было показано выше. Например, электрод 26 соединен с черепно-мозговым нервом (например, блуждающим нервом, подъязычным, тригеминальным или дополнительным нервом) человека и соединяется с блоком управления 10 через электрод 22. Другой электрод 38, электрод зондирования или "зонд", соединен с выбранной областью мозга пациента таким, как часть или ядро внутри: островковой доли большого мозга, подмозолистого поля, поясной частью головного мозга, зрительного бугра, гипоталамуса, предлобной области коры головного мозга, стволовой части мозга, мозжечка или трактом белого вещества мозга, ведущим к указанным областям. В зависимости от расположения выбранной позиции в мозге, наиболее щадящий субдуральный электрод может быть использован вместо глубинного электрода. Электрод 38 также соединен с блоком управления /генератором возбуждения/ блоком процессора. Заранее заданный электрический сигнал прикладывается к электроду черепно-мозгового нерва, вызывая стимуляцию или подавление (модуляцию) электрической активности нервной ткани, которая принимает электрическое возбуждение от данного черепно-мозгового нерва. Ответная модуляция или изменение в электрической активности нейронной ткани измеряется имплантированным электродом и передается к блоку управления/процессору 10. Данные анализируются в процессоре для определения, вызывает ли приложение частного электрического сигнала изменение в электрической активности выбранной области мозга. Такая модуляция электрической активности выбранной области также связывается процессором с субъективными и объективными данными, отражающими облегчение симптома расстройства пищевого поведения.
Комбинирование ГСМ и СЧМН. Иллюстративная процедура, в которой вместе используются глубокая стимуляция мозга (ГСМ) и стимуляция черепно-мозгового нерва (СЧМН), содержит операцию подключения первого электрода к черепно-мозговому нерву пациента. Фиг.1 показывает электрод, соединенный в шее пациента, с левым блуждающим нервом. В другой конфигурации размещение одного или более электродов осуществляется вблизи диафрагмы на левом или правом блуждающих нервах, выше или ниже диафрагмы, как это раскрыто в известных источниках информации. Второй электрод соединен с выбранной областью мозга пациента, для которой ожидается или известно, что она связана с симптомами расстройства пищевого поведения (например, подмозолистое поле). Заранее заданный терапевтический электрический сигнал прикладывается к первому электроду, для стимуляции черепно-мозгового нерва, а второй заранее заданный терапевтический электрический сигнал прикладывается ко второму электроду для стимуляции нервной ткани. В результате двойного приложения первого и второго сигналов, достигается благоприятная модуляция неврональной активности выбранной области нервной ткани, которая облегчает булимию или другое расстройство пищевого поведения. Параметры стимуляции могут быть установлены таким образом, что осуществляется двусторонняя стимуляция двух блуждающих нервов, синхронно или асинхронно, с выборочной модуляцией (например, подавление, возбуждение, блокировка) выборочных областей мозга для обеспечения требуемого облегчения симптомов расстройства пищевого поведения. Блок управления может быть настроен с обеспечением распределения во времени пакетов импульсов двухсторонней электрической стимуляции, вызывающей ослабление невральной активности в выборочных областях мозга.
Комбинированная ГСМ/СЧМН - Двухуровневая Электрическая/Химическая стимуляция.
Другой иллюстративный пример комбинированной ГСМ/СЧМН терапии содержит хирургически имплантированный электрод и электродный узел, имеющий проксимальный вывод и стимулирующую часть, причем после имплантации стимулирующая часть (то есть электрод) соединен либо с черепно-мозговым нервом, либо с подмозолистым полем. Также, врач хирургическим путем имплантирует катетера, имеющий проксимальный вывод, соединенный с насосом и разгрузочную часть для введения дозы химического реактива. После имплантации разгрузочная часть катетера соединена с выбранным подмозолистым полем. Врач соединяет проксимальный вывод электрода с генератором сигнала. Соответствующий электрический сигнал формируется с использованием генератора сигнала и подается через электрод и электродный узел, в результате чего формируется сигнал, обеспечивающий электрическую стимуляцию подмозолистого поля. Совместно с электрической стимуляцией, управляемый насос обеспечивает выделение химического реактива через разгрузочную часть катетера в выбранное подмозолистое поле, в результате чего осуществляется терапия расстройства пищевого поведения.
Сходным образом, врач может хирургическим путем имплантировать электрод/электродный узел так, что после имплантации стимулирующая часть соединяется соединенные с областью Бродманна 25. Таким же образом, разгрузочная часть катетера также располагается, сообщаясь с областью Бродманна 25. Электрический сигнал электрически стимулирует область Бродманна 25, в то время, как насос разгружает химический реактив в область Бродманна 25, для обеспечения комбинированной, двухуровневой лечебной терапии расстройства пищевого поведения.
Управляемое возбуждение/вывод из активного состояния. В предпочтительном случае, требуемая стимуляция и результирующая модуляция могут управляться с использованием зондирования заранее заданного события или условия или, с использованием сформированного вручную возбуждения от внешнего устройства, или от врачом или пациентом. В раскрытом выше описании переключатель для ручного формирования сигнала возбуждения включен в состав имплантируемого блока управления, и если врач установит, что для клиента желательно иметь возможность ограниченного управления устройством, программирование процессора выполняется с обеспечением возможности генерации заранее заданного стимулирующего сигнала генератором сигнала, при распознавании блоком управления соответствующего ввода сигнала, осуществленного пациентом вручную.
Магнитная стимуляция. В качестве альтернативы хирургической имплантации ГСМ стимулятора, области мозга такие, как орбитально-передняя кора головного мозга, может быть стимулирована с использованием внешней черепной магнитной стимуляции. Таким образом, возбудитель может быть электрическим, химическим/лекарственным, или магнитным, или комбинацией указанных возбудителей.
Авторы предполагают, что раскрытые выше способы будут полезны врачам для разработки правильной лечебной терапии для пациентов, которые страдают от серьезных неуправляемых приступов кинорексии/очищающего поведения. Булимия рассмотрена в качестве иллюстрации, также и для других расстройств пищевого поведения, на которые может благоприятным образом повлиять сходная терапия глубокой стимуляции мозга.
Без дальнейших объяснений очевидно, что лицо, сведущее в области техники, с приведенным здесь описанием, сможет использовать настоящее изобретение с максимальной широтой. Указанные выше варианты реализации приведены в схемных подробностях, в иллюстративных целях, а не в качестве законченного описания, ограничивающего объем изобретения. Поскольку в настоящем описании показаны и раскрыты предпочтительные варианты реализации изобретения, изменения, внесенные в указанные варианты, могут быть сделаны лицом, сведущим в уровне техники, с сохранением сущности и основных положений изобретения. Должно быть понятно, что для частных различных случаев режимов стимуляции, зондирования и активации, программные и тому подобные особенности, раскрытые в настоящем описании, могут быть перегруппированы и использованы в различных комбинациях, приведенных в настоящем описании, исключительно в иллюстративных целях. Таким образом, сущности изобретения соответствуют многие вариации и изменения реализации, возможно раскрытые в настоящем описании. Соответственно, объем защиты не ограничивается приведенным в настоящем описании набором признаков, и может определяться только приведенной ниже формулой изобретения, которая должна трактоваться с использованием всех эквивалентов объектов изобретения, указанных в формуле изобретения. Раскрытие всех патентов, заявок на выдачу патентов и опубликованных источников информации, процитированных в настоящем описании, использованы в настоящем описании также, как возможные варианты реализации признаков изобретения, расширяя иллюстративные, процедурные и дополнительные или другие детали из набора признаков настоящего изобретения.
Реферат
Изобретение относится к области медицины, а именно к способам нейростимуляции для терапии расстройств пищевого поведения. Способ включает прямую или косвенную стимуляцию областей мозга, которую выбирают из группы: островковая доля большого мозга, подмозолистое поле, поясная часть головного мозга, зрительный бугор, предлобная область коры головного мозга, стволовая часть мозга, мозжечок и тракты белого вещества мозга. Также используют стимуляцию областей мозга совместно со стимуляцией черепно-мозгового нерва. Режим стимуляции программируют с обеспечением физической оптимизации параметров сигнала стимуляции для улучшения, по крайней мере, одного из симптомов таких, как, например, симптом булимии или другого расстройства пищевого поведения. Способ расширяет арсенал средств для лечения расстройств пищевого поведения. 4 н. и 26 з.п. ф-лы, 6 ил.
Формула
используют блок управления, который снабжают генератором сигнала и указанным компаратором, посредством которого формируют электрический сигнал, которым стимулируют, по крайней мере, первую область мозга или группу первых областей мозга в соответствии с первым набором параметров стимуляции, после этого посредством указанного компаратора сравнивают указанные данные измерений с указанными данными, относящимися к эталонному состоянию, и формируют результаты сравнения, затем определяют на основании указанных результатов сравнения, являются ли необходимыми изменения параметров стимуляции, и в случае определения, что указанные изменения необходимы, определяют, какие изменения необходимы в указанных параметрах стимуляции, при этом указанный блок управления выполняют с возможностью изменения указанного первого набора параметров стимуляции и повторяющегося определения изменений параметров стимуляции до тех пор, пока не отпадет необходимость в последующих изменениях, где необходимость изменений отсутствует, если стимуляция в соответствии с измененным набором параметров стимуляции облегчает симптом указанного расстройства пищевого поведения.

Комментарии