Производные альдегида полиэтиленгликоля - RU2288212C2
Код документа: RU2288212C2
Описание
Изобретение относится к альдегидам полиэтиленгликоля, к способам получения и применения таких производных, таким, как пэгилирование полипептидов и других биомолекул.
Полиэтиленгликоль (ПЭГ) представляет собой прямой или разветвленный нейтральный полиэфир с различной молекулярной массой формулы НО-(СН2-СН2-O)n-Н, где n означает количество повторяющихся в ПЭГ этиленоксидных звеньев.
ПЭГ и производные ПЭГ применяются для модификации разнообразных биомолекул. При связывании с такими молекулами ПЭГ повышает их растворимость и молекулярную массу и не придает им нежелательные свойства. Преимущество конъюгатов ПЭГ с биомолекулами заключается в том, что они характеризуются повышенным удерживанием и замедленным метаболизмом в организме.
Для такого применения получено множество производных ПЭГ. Такие производные ПЭГ описаны, например, в патентах US 5252714, US 5672662, US 5959265, US 5990237 и US 6340742.
Для получения производных ПЭГ используются два общих подхода: (1) модификация концевой гидроксильной группы и/или (2) взаимодействие ПЭГ в контролируемых условиях с бифункциональными соединениями таким образом, что одна функциональная группа взаимодействует с полимером ПЭГ, а вторая сохраняет активность (остается свободной). В большинстве случаев получение требумого производного ПЭГ проводят в несколько стадий. Требуемые производные ПЭГ часто образуются с низким выходом и для их выделения необходимо использовать сложные методы очистки. Кроме того, производные ПЭГ могут неспецифически связывать исследуемые биомолекулы, т.е. с одной биомолекулой может связываться нескольких молекул полимера и/или ПЭГ может связаться с активным центром. Многократное связывание усложняет очистку ПЭГ-производных. Многократное связывание и/или связывание ПЭГ с активным центром может также привести к снижению активности биомолекулы.
Следовательно, необходимо получить производные ПЭГ, обладающие улучшенными свойствами и пригодные для конъюгирования с множеством других молекул, включая полипептиды и другие биомолекулы, содержащие α-аминогруппу. Существует необходимость в получении производных ПЭГ, которые можно получать с высоким выходом и чистотой и которые можно вводить в реакции конъюгирования с целью получения биомолекул, обладающих ценными свойствами.
Ниже более подробно описаны эти и другие объекты настоящего изобретения.
Соединения по изобретению представляют собой альдегиды полиэтиленгликоля общей формулы (I)
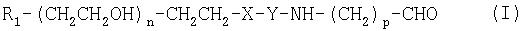
где R1 означает блокирующую группу, Х означает О или NH, Y выбирают из группы, включающей
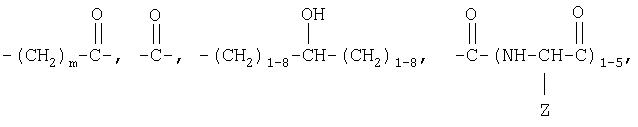
где Z означает боковую цепь аминокислоты, m равно 1-17, n равно 10-10000, а р равно 1-3.
Настоящее изобретение относится также к соединению формулы (II):

где R1, m, n и р имеют значения, указанные выше.
Другим предпочтительным вариантом настоящего изобретения является бифункциональный альдегид полиэтиленгликоля формулы (VIII):
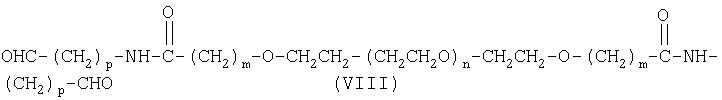
где m, n и р имеют значения, указанные выше.
Настоящее изобретение относится также к промежуточным соединениям формулы (IX):
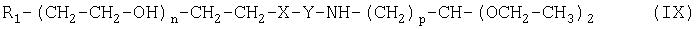
где R1, X, Y, Z, m, n и р имеют значения, указанные выше.
Кроме того, настоящее изобретение относится к промежуточным соединениям формулы (X):

где R1 m, n и р имеют значения, указанные выше.
Изобретение также относится к промежуточным соединениям формулы (XI):

где каждый m, n и р имеют одинаковые или разные значения, указанные выше.
Кроме того, настоящее изобретение относится к способу получения альдегида полиэтиленгликоля, включающему гидролиз соединения формулы (IX):

с образованием альдегида полиэтиленгликоля формулы (I):

где R1, X, Y, Z, m, n и р имеют значения, указанные выше.
Если настоящее изобретение относится к "методу получения", то это означает, что оно относится и к "способу получения".
Настоящее изобретение также относится к способу получения альдегида полиэтиленгликоля, включающему гидролиз соединения формулы (X):
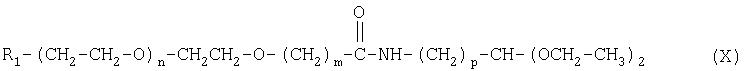
с образованием альдегида полиэтиленгликоля формулы (II):
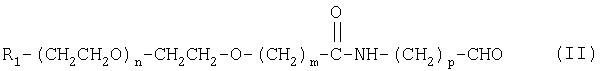
где R1, m, n и р имеют значения, указанные выше.
Настоящее изобретение также относится к способу получения альдегида полиэтиленгликоля, включающему гидролиз соединения формулы (XVII):

с образованием альдегида полиэтиленгликоля формулы (VIII)

где m, n и р имеют значения, указанные выше.
Настоящее изобретение относится к множеству соединений и промежуточных продуктов, а также к способам, которые можно использовать для получения ПЭГилирования полипептидов и других биомолекул. Настоящее изобретение относится к новой структуре альдегидов полиэтиленгликоля.
Соединения по изобретению представляют собой альдегидные производные полиэтиленгликоля общей формулы (I):

где R1 означает блокирующую группу, Х означает О или NH, Y выбирают из группы, включающей
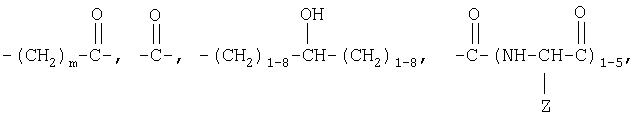
где Z означает боковую цепь аминокислоты, m равно 1-17, n равно 10-10000, а р равно 1-3.
Термин «блокирующая группа», используемый в описании заявки, означает любую пригодную химическую группу, которая предпочтительно обычно является нереакционноспособной или может вступать в реакцию с другими соединениями. Концевая альдегидная группа в указанной формуле легко образует ковалентную связь с другими группами, например с α-аминогруппой полипептида. Группу R1 используют с целью обеспечить или блокировать бифункциональные свойства полимера, например ковалентное связывание с другой молекулой активного соединения.
Если блокирующая группа в общем случае не взаимодействует с другими группами, то R1 является инертным остатком. Если R1 относительно инертна, то полученный альдегид полиэтиленгликоля является монофункциональным и, следовательно, образует ковалентную связь только с одной молекулой активного соединения. Пригодные нереакционноспособные группы R1 включают водород, гидроксил, (низш.)алкил, (низш.)алкокси, (низш.)циклоалкил, (низш.)алкенил, (низш.)циклоалкенил, арил и гетероарил.
Термин «(низш.)алкил», используемый в тексте заявки, означает замещенную или незамещенную алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 7, предпочтительно от 1 до 4 атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, н-гексил, н-гептил и т.п.
Термин «(низш.)алкокси», используемый в тексте заявки, означает (низш.)алкильную группу, указанную выше, которая присоединена через атом кислорода; примеры (низш.)алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентокси и т.п.
Термин "(низш.)циклоалкил" означает замещенную или незамещенную циклоалкильную группу, содержащую от 3 до 7, предпочтительно от 4 до 6 атомов углерода, т.е. циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин «(низш.)алкенил», используемый в тексте заявки, означает замещенную или незамещенную алкенильную группу с прямой или разветвленной цепью, содержащую от 2 до 7, предпочтительно от 2 до 5 атомов углерода, например этенил, бутенил, пентенил, гексенил и т.п.
Термин "(низш.)циклоалкенил" означает замещенную или незамещенную циклоалкенильную группу, содержащую от 4 до 7 атомов углерода, например циклобутенил, циклопентенил, циклогексенил и т.п.
Термин «арил» означает фенильную или нафтильную группу, незамещенную или необязательно моно- или полизамещенную группу, выбранной из ряда галоген, (низш.)алкил, (низш.)алкокси, трифторметил, гидроксил, карбоксил, сложный эфир карбоновой кислоты, нитро, амино или фенил, прежде всего галоген, (низш.)алкил, (низш.)алкокси, трифторметил, гидроксил, нитро, амино и фенил.
Термин «гетероарил» означает 5- или 6-членную гетероароматическую группу, содержащую 1 или более гетероатомов, выбранных из N, S и О.
Предпочтительная обычно нереакционноспособная блокирующая группа R1 включает метокси, гидроксил или бензилокси. Более предпочтительной блокирующей группой R1 является метоксигруппа. Если R1 означает метокси, то альдегиды и родственные соединения иногда обозначаются как "мПЭГ" соединения, где "м" означает метокси.
Если блокирующая группа R1 способна взаимодействовать с другими соединениями, то R1 представляет собой функциональную группу, способную взаимодействовать с другой функциональной группой, такой как аминогруппа и/или сульфгидрильная группа пептида и/или белка. В этом случае R1 может означать функциональную группу, которая способна легко взаимодействовать с электрофильными или нуклеофильными группами других молекул, в отличие от таких групп, которые способны вступать в реакцию в присутствии сильного катализатора или в неприемлемых жестких условиях. Если R1 является относительно реакционноспособной группой, то альдегид полиэтиленгликоля представляет собой бифункциональное соединение и, следовательно, может ковалентно связываться с двумя молекулами.
Примеры в основном пригодных реакционноспособных блокирующих групп R1 включают галоген, эпоксид, имид малеиновой кислоты, орто-пиридилдисульфид, тозилат, изоцианат, гидразингидрат, цианургалогенид, N-сукцинимидилокси, сульфо-N-сукцинимидилокси, 1-бензотриазолилокси, 1-имидазолилокси, пара-нитрофенилокси и
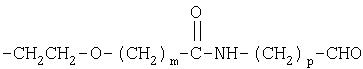
Термин "галоген" означает фтор, хлор, бром или иод.
Предпочтительной реакционноспособной блокирующей группой R1 является группа
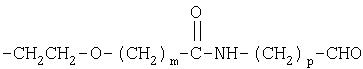
В соединениях по настоящему изобретению Х означает О или NH, предпочтительно Х означает О. Кроме того, Y выбирают из группы, включающей

где Z означает боковую цепь аминокислоты.
В настоящем изобретении m равно от 1 до 17. В предпочтительном варианте m равно 1-14. Более предпочтительно m равно 1-7, и еще более предпочтительно m равно 1-4, наиболее предпочтительно m равно 1.
Если Y означает группу общей формулы

то группа Y связана с аминокислотой пептидной связью. Соответственно, в наиболее простом случае, когда в качестве аминокислоты используется глицин, группа имеет формулу
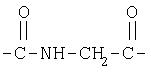
При использовании аланина Z означает СН3, при использовании серина Z означает СН2ОН.
Очевидно, что при использовании других аминокислот (см. схему ниже) и при использовании нескольких аминокислот, образуются более сложные структуры. Предпочтительно используют одну аминокислоту.

В настоящем изобретении n составляет от 10 до 10000. В предпочтительном варианте настоящего изобретения n составляет от 20 до 5000, предпочтительно n равно 50-2500, еще более предпочтительно 75-1000, более предпочтительно n равно 100-750.
В настоящем изобретении р равно 1-3, предпочтительно р равно 3.
В предпочтительных вариантах изобретения р равно 3, R1 означает метокси, m равно 1, а n равно 100-750; или р равно 2, R1 означает метокси, m равно 1, а n равно 100-750; или р равно 1, R1 означает метокси, m равно 1, а n равно 100-750.
Настоящее изобретение включает, без ограничения перечисленным, соединения формулы (I), которые означают соединения формул (II-VI):
(A)
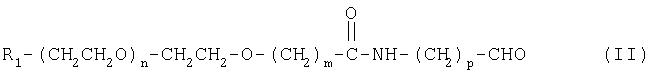
(Б)

(В)

(Г)

(Д)

Предпочтительно блокирующая группа R1 является относительно нереакционноспособной, и предпочтительно означает метокси, гидроксил и бензилокси.
Предпочтительные соединения по настоящему изобретению включены в группу А, указанную выше. Соответственно, настоящее изобретение включает соединение формулы (II)
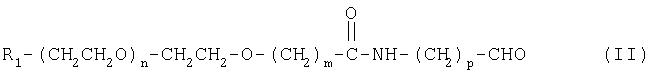
где R1, m, n и р имеют значения, указанные выше.
В предпочтительном варианте изобретения R1 означает метокси, m равно 1, а n равно от 100 до 750. Более предпочтительно р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Другим предпочтительным вариантом настоящего изобретения является бифункциональный альдегид полиэтиленгликоля формулы (VIII)

где m, n и р имеют значения, указанные выше.
В предпочтительном варианте R1 означает метокси, m равно 1, а n равно от 100 до 750. Более предпочтительно р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Настоящее изобретение также относится к множеству промежуточных соединений, из которых можно получить альдегиды полиэтиленгликоля по изобретению, описанные выше. Указанные промежуточные соединения включают соединения формулы (IX):
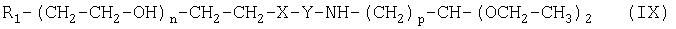
где R1 X, Y, Z, m, n и р имеют значения, указанные выше.
В предпочтительном варианте р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1означает метокси, m равно 1, а n равно от 100 до 750.
Кроме того, настоящее изобретение относится к промежуточным соединениям формулы (X):

где R1, m, n и р имеют значения, указанные выше.
В предпочтительном варианте р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Кроме того, в изобретении предлагаются промежуточные соединения формулы (XI):

где каждый m, n и р являются идентичными или различными и имеют значения,
указанные выше.
В предпочтительном варианте р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Соединения по настоящему изобретению можно получать любым пригодным способом с использованием известных реагентов и методов. Однако в настоящем изобретении предлагается специальный способ получения альдегида полиэтиленгликоля, включающий гидролиз соединения формулы (IX):

с образованием альдегида полиэтиленгликоля (I)
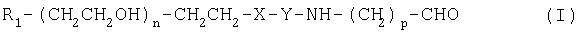
где R1, X, Y, Z, m, n и р имеют значения, указанные выше. Предпочтительно гидролиз проводят при катализе кислотой. Пригодные каталитические кислоты включают трифторуксусную кислоту, соляную кислоту, фосфорную кислоту, серную кислоту и азотную кислоту, предпочтительной кислотой является трифторуксусная кислота.
В предпочтительных вариантах р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Соединения альдегида полиэтиленгликоля формулы (II) можно также получить любым пригодным способом. Например, альдегиды полиэтиленгликоля формулы (II) можно получить следующими способами: во-первых, полиэтиленгликоль высушивают, во-вторых, полиэтиленгликоль вводят в реакцию с галоген-производным уксусной кислоты. После гидролиза полученной реакционной смеси получают ПЭГ-карбоновую кислоту. В другом варианте ПЭГ-карбоновую кислоту можно также получить прямым окислением ПЭГ после стадии высушивания. Затем ПЭГ-карбоновую кислоту обрабатывают аминопроизводным диэтилацеталя с образованием ПЭГ-ацетальамина, который вводят в реакцию с галогенированной карбоновой кислотой с образованием альдегида полиэтиленгликоля указанной формулы. Альдегид полиэтиленгликоля выделяют и очищают.
Альдегид полиэтиленгликоля выделяют и очищают любым пригодным способом. Например, альдегид полиэтиленгликоля можно экстрагировать дихлорметаном. Органический слой сушат над сульфатом натрия, фильтруют, концентрируют и осаждают продукт добавлением этилового эфира. Продукт, ПЭГ-альдегид, отделяют фильтрованием и высушивают в вакууме.
Таким образом, в настоящем изобретении предлагается способ получения альдегида полиэтиленгликоля, включающий гидролиз соединения формулы (X):
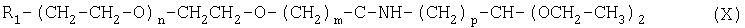
с образованием альдегида полиэтиленгликоля формулы (II):
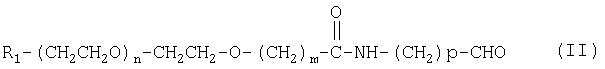
где R1, m, n и р имеют значения, указанные выше.
Соединение формулы (X) можно получить при взаимодействии соединения формулы (XII):

Другим методом получения ПЭГ-кислоты или ПЭГ-карбоновой кислоты является прямое окисление. В этом случае можно использовать окислители, такие как CrO3 или K2Cr2O7 /H2SO4, HNO3 в присутствии ванадата аммония, или реагент Джона (CrO3 и H2SO4).
Соединение формулы (XII) можно получить гидролизом соединения формулы (XIV):
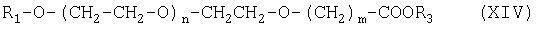
где R3 означает разветвленный или неразветвленный С1-С4алкил.
Соединение формулы (XIV) можно получить при взаимодействии соединения формулы (XV):
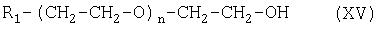
с соединением формулы (XVI):
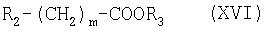
где R2 означает галоген. Предпочтительно R2 означает бром или хлор. Пригодные соединения формулы (XVI) включают трет-бутиловый эфир бромуксусной кислоты, метиловый эфир бромуксусной кислоты, этиловый эфир бромуксусной кислоты, трет-бутиловый эфир хлоруксусной кислоты, метиловый эфир хлоруксусной кислоты и этиловый эфир хлоруксусной кислоты. Другие реагенты, которые можно использовать на этой стадии, т.е. на стадии замещения в формуле (XVI), включают, например, трет-бутиловый эфир бромуксусной кислоты, метиловый эфир бромуксусной кислоты, этиловый эфир бромуксусной кислоты, трет-бутиловый эфир хлоруксусной кислоты, метиловый эфир хлоруксусной кислоты или этиловый эфир хлоруксусной кислоты в присутствии трет-бутоксида калия, гидрида щелочного металла, такого как гидрид натрия или нафталид калия. Предпочтительно соединение формулы (XVI) означает трет-бутиловый эфир бромуксусной кислоты.
В предпочтительном варианте р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Соединения формул (III)-(VI) (или соединения Б-Д, соответственно) можно также получить любыми пригодными способами. Например, соединения формул (III)-(VI) (или соединений Б-Д) можно получить по следующим схемам.
Как указано выше в случае альдегидов полиэтиленгликоля, бифункциональные альдегиды полиэтиленгликоля можно получить любыми пригодными способами. В настоящем изобретении предлагается метод получения альдегида полиэтиленгликоля, включающий гидролиз соединения формулы (XVII):

с образованием альдегида полиэтиленгликоля формулы (VIII)
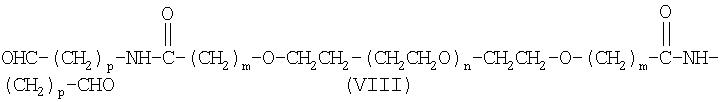
где m, n и р имеют значения, указанные выше.
Соединение формулы (VI) можно получить при взаимодействии соединения формулы (XVIII):
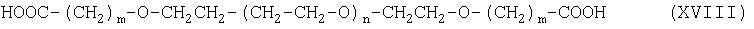
с соединением формулы (XIX):
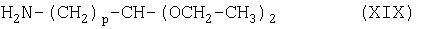
Соединение формулы (XVIII) можно получить гидролизом соединения формулы (XX):

где R3 означает разветвленный или неразветвленный С1-С4алкил.
Соединение формулы (XX) можно получить при взаимодействии соединения формулы (XXI):

с соединением формулы (XVI):

где R2 означает галоген.
Композиции альдегида полиэтиленгликоля по настоящему изобрению, указанные выше, можно использовать для получения множества молекул, включая биомолекулы, с использованием любых пригодных методов.
ПЭГ-альдегиды соединений по настоящему изобретению представляют собой специфичные реагенты для пэгилирования пептидов и других биомолекул по N-концевым аминокислотным остаткам. ПЭГ-альдегиды соединений по настоящему изобретению образуют конъюгат с N-концевой α -аминогруппой биомолекулы или белка с образованием стабильной связи в виде вторичного амина между ПЭГ и биомолекулой или белком.
Биомолекулы, пэгилированные ПЭГ-альдегидами по настоящему изобретению, имеют воспроизводимый состав в отношении числа и точек присоединения ПЭГ, что позволяет существенно упростить процесс выделения. Такое специфичное пэгилирование позволяет получить конъюгат, в котором участок присоединения ПЭГ удален от центра связывания биомолекулы или пептида с клеточными рецепторами, и, следовательно, пэгилированные биомолекулы, белки или пептиды полностью или почти полностью сохраняют биологическую активность. ПЭГ-альдегиды по настоящему изобретению могут взаимодействовать с любыми биомолекулами, содержащими α-аминогруппу.
В зависимости от выбранного альдегида полиэтиленгликоль может ковалентно связываться с биомолекулой одной концевой группой (монофункциональный альдегид полиэтиленгликоля) или двумя концевыми группами (бифункциональный альдегид полиэтиленгликоля).
Как указано выше, альдегиды полиэтиленгликоля по настоящему изобретению можно использовать для пэгилирования по N-концевым аминогруппам. При этом в пэгилированных полипептидах образуется специфичная N-концевая связь, что исключает образование поперечных связей или образование нескольких производных одного и того же полипептида. Для получения такой специфичной ковалентной связи можно использовать любые пригодные реакции. В общем случае реакцию проводят в слабокислотной среде, позволяющей активировать концевую α-аминокислоту пэгилируемого пептида. Обычно рН реакционной смеси составляет приблизительно от 5,5 до приблизительно 7,4, предпочтительно приблизительно 6,5.
Следовательно, в изобретении предлагается способ присоединения полиэтиленгликоля к полипептиду, включающий:
взаимодействие по меньшей мере одного полипептида формулы (XXII)

с альдегидом полиэтиленгликоля формулы (I):

где R1 X, Y, Z, m, n и р имеют значения, указанные выше, с образованием соединения формулы (XXIII)

где молекула альдегида полиэтиленгликоля связывается с N-концевой аминогруппой полипептида.
В предпочтительных вариантах р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Соединения формулы (XXII) могут означать любой полипептид, включая интерферон-альфа, интерферон-бета, консенсус-интерферон, эритропоэтин (ЕРО), гранулоцит- колонийстимулирующий фактор (GCSF), гранулоцит/макрофаг-колонийстимулирующий фактор (GM-CSF), интерлейкины (включая IL-2, IL-10 и IL-12) и колонийстимулирующий фактор.
Соединения формулы (XXII) могут также представлять собой иммуноглобулины, такие как IgG, IgE, IgM, IgA, IgD, и их подгруппы и фрагменты. Термин "антитело" или "фрагменты антитела" означает поликлональные или моноклональные антитела, целый иммуноглобулин или антитело или любой функциональный фрагмент молекулы иммуноглобулина, который связывается с антигеном-мишенью. Примеры таких фрагментов антител включают Fv (вариабельный фрагмент), одноцепочечный Fv, комплементарные участки (CDR), VL (вариабельная область легкой цепи), VH (вариабельная область тяжелой цепи). Fab (участок связывания антигена), F(ab)2', и любая их комбинация или любая другая функциональная группа иммуноглобулина, способная связываться с антигеном-мишенью.
Как указано выше, пэгилированное соединение можно получить любым требуемым способом. Условия реакции, например величину рН, выбирают таким образом, чтобы обеспечить создание благоприятных условий для специфичного связывания ПЭГ с α-аминогруппами.
В общем случае полипептиды можно пэгилировать соединениями полиэтиленгликоля по изобретению при смешивании соединения формулы (XXII) и реагента на основе ПЭГ в молярном соотношении от 1:1 до 1:100. Затем реакционную смесь выдерживают в боратном, фосфатном или трис-содержащем буферном растворе при рН от 5,5 до 9,0 и при комнатной температуре или при 4°С в течение приблизительно 5-24 ч. При этом молярное соотношение реагента на основе ПЭГ и пептида/белка составляет от 1:1 до 100:1, концентрация пептида/белка составляет обычно от 1 до 10 мг/мл, а концентрация буферного раствора обычно составляет от 10 до 500 мМ.
Пэгилированное соединение выделяют любым известным способом. Например, полученную реакционную смесь разбавляют уравновешивающим буферным раствором (20 мМ трис, рН 7,5), а затем смесь наносят на колонку с Q-сефарозой. После нанесения смеси на QA колонку ее промывают уравновешивающим буферным раствором, продукт элюируют 75 М NaCl, 200 мМ NaCl, 1 М NaCl и колонку регенерируют промыванием 1 М АсОН, содержащей 1 М NaCl, а затем 0,5 М NaOH. N-Монопэгилированный продукт можно отделить от других побочных продуктов методом обращенно-фазовой ЖХВР. Затем каждый выделенный продукт характеризуют методом MALDI-TOF (матричная лазерная десорбционная ионизация на времяпролетном масс-спектрометре).
В предпочтительном варианте способа пэгилирования по изобретению полипептид формулы (XXII)

вводят в реакцию с альдегидом полиэтиленгликоля формулы (II)

где R1, m, n и р имеют значения, указанные выше,
с образованием соединения формулы (XXIV):

где молекула альдегида полиэтиленгликоля связывается с N-концевой аминогруппой полипептида.
В предпочтительных вариантах р равно 3, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 2, R1 означает метокси, m равно 1, а n равно от 100 до 750; или р равно 1, R1 означает метокси, m равно 1, а n равно от 100 до 750.
Дополнительная информация по применению соединений по настоящему изобретению содержится в одновременно зарегистрированных заявках US "Pegylated T20 Polypeptide" №60/398195, зарегистрированной 24 июля 2002 г., "Pegylated T 1249 Polypeptide," №60/398190, зарегистрированной 24 июля 2002 г., и №60/439213, зарегистрированной 10 января 2003 г., включенных в описание в полном объеме в качестве ссылки.
Кроме того, предлагается способ присоединения молекулы полиэтиленгликоля к полипептиду, включающий взаимодействие полипептида формулы (XXII)

с молекулой альдегида полиэтиленгликоля формулы (VIII):
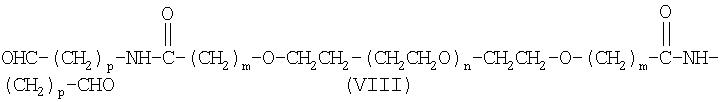
где каждый m, n и р являются одинаковыми или различными и имеют значения, указанные выше,
с образованием соединения формулы (XXV):
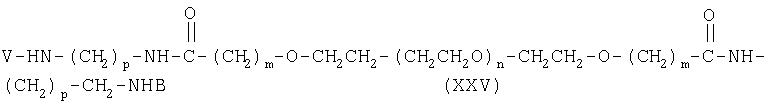
где молекула альдегида полиэтиленгликоля связывается с N-концевой аминогруппой полипептида.
В предпочтительных вариантах р равно 3, m равно 1, а n равно от 100 до 750; или р равно 2, m равно 1, а n равно от 100 до 750; или р равно 1, m равно 1, а n равно от 100 до 750.
Пэгилированные полипептиды используют любым требуемым способом. Однако предпочтительно их используют для получения фармацевтических композиций в смеси с фармацевтически приемлемым эксципиентом. Такие фармацевтические композиции могут выпускаться в форме стандартной дозы. Такие композиции могут иметь форму инъекционных растворов или суспензий, чрескожных систем доставки или любую другую требуемую форму.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
Получение соединений ПЭГ-альдегида
5 г ПЭГ (с молекулярной массой от 1000 до 60000 Да) в 50-100 мл толуола сушили азеотропной перегонкой при кипячении с обратным холодильником в течение 1-3 ч, а затем удаляли 20-30 мл толуола. Полученный раствор охлаждали до комнатой температуры, а затем к раствору ПЭГ добавляли трет-бутоксид калия (молярный избыток от 1 до 10) в 20-50 мл абсолютного трет-бутанола и 20-50 мл толуола. Затем полученную смесь перемешивали в атмосфере аргона при комнатной температуре в течение 2 ч.
К реакционной смеси с использованием шприца добавляли трет-бутиловый эфир бромуксусной кислоты (молярный избыток от 1 до 10) и смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. В зависимости от требуемого значения "m" в формуле (XVI) трет-бутиловый эфир бромуксусной кислоты можно заменить на другую галогенированную кислоту, например, на пропионовую кислоту, масляную кислоту и т.п.
Затем реакционную смесь концентрировали упариванием на роторном испарителе и продукт осаждали добавлением диэтилового эфира. Осадок, трет-бутиловый эфир ПЭГ-карбоновой кислоты, отделяли фильтрованием и высушивали в вакууме.
Затем трет-бутиловый эфир ПЭГ-карбоновой кислоты (4 г) растворяли в 50-100 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 1-6 н. соляную кислоту до рН 2,5-3,0 и экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, ПЭГ-карбоновую кислоту, отделяли фильтрованием и высушивали в вакууме.
Затем ПЭГ-карбоновую кислоту (3 г) растворяли в безводном дихлорметане (20-30 мл) и добавляли диэтилацеталь 4-аминобутиральдегида (молярный избыток 1-5), 1-гидроксибензотриазол (молярный избыток 1-5) и дициклогексилкарбодиимид (молярный избыток 1-5). В зависимости от требуемого значения "р" в формуле (XIII) диэтилацеталь 4-аминобутиральдегида можно заменить на диэтилацетали других аминоальдегидов, например на диэтилацеталь 3-аминопропиональдегида или диэтилацеталь 2-аминоацетальальдегида.
Полученную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. Реакционную смесь фильтровали, концентрировали и продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1). Продукт, ПЭГ-ацеталь, высушивали в вакууме в течение ночи.
Затем продукт, ПЭГ-ацеталь, растворяли в 10-200 мл 1-90% CF3СООН и раствор перемешивали при комнатной температуре в течение ночи. К раствору добавляли 1 н. раствор NaOH до рН 6,0, добавляли хлорид натрия (10 мас.%), а затем добавляли 1 н. раствор NaOH до рН 7,0 и смесь экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, ПЭГ-альдегид, отделяли фильтрованием и высушивали в вакууме.
Пример 2
Получение мПЭГ10K-бутанальдегида
Ниже приводится общая схема получения мПЭГ10K -бутанальдегида по изобретению.
Схема получения мПЭГ10K-бутанальдегида
Схема реакции получения мПЭГ10K-бутанальдегида

КарбоксиметилПЭГ (мПЭГ) с молекулярной массой 10000 Да (30,0 г, 3 ммоля) в 300 мл толуола сушили азеотропной перегонкой при кипячении с обратным холодильником в течение 2 ч, а затем удаляли 100 мл толуола. Полученный раствор охлаждали до комнатой температуры, а затем к раствору ПЭГ (1) добавляли трет-бутоксид калия (0,68 г, 6 ммолей) в 20 мл абсолютного трет-бутанола и 20 мл толуола и полученную смесь перемешивали в атмосфере аргона при комнатной температуре в течение 2 ч.
К реакционной смеси с использованием шприца добавляли трет-бутиловый эфир бромуксусной кислоты (1,00 мл, 6,75 ммоля) и смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали на роторном испарителе и продукт осаждали добавлением диэтилового эфира. Осажденный продукт отделяли фильтрованием и высушивали в вакууме (выход 28 г).
1Н-ЯМР (ДМСО-d6): 1,40 (t, 9H, -СН3), 3,21 (s, -ОСН3), 3,50 (s, -O-CH2CH2-O-), 3,96 (s, 2H, -O-CH2-COO-).
Затем трет-бутилкарбоксиметиловый эфир мПЭГ10K (20 г) растворяли в 200 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи (2). К смеси добавляли 6 н. соляную кислоту до рН 2,5 и экстрагировали дихлорметаном (порциями 50 мл, 40 мл и 30 мл). Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ10K-карбоксиметиловую кислоту, отделяли фильтрованием, и высушивали в вакууме (выход 18 г).
1Н-ЯМР (ДМСО-d6): 3,21 (s, -ОСН3), 3,5 (s, -О-CH2СН2-О-), 3,99 (s, 2H, -О-СН2-СООН).
мПЭГ10k-карбоксиметиловую кислоту (3 г, 0,3 ммоля) растворяли в безводном дихлорметане (20 мл), а затем добавляли диэтилацеталь 4-аминобутиральдегида (50 мг, 0,3 ммоля), 1-гидроксибензотриазол (40 мг, 0,3 ммоля) и дициклогексилкарбодиимид (80 мг, 0,39 ммоля) (3) и реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. Затем реакционную смесь фильтровали, концентрировали и продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1). Продукт, мПЭГ10k-бутанацеталь, высушивали в вакууме в течение ночи (выход 2,7 г)
1Н-ЯМР (ДМСО-d6): 1, 07-1,12 (t, 6H, (-O-СН2-СН3)2), 1,46 (m, 4H, -NHCH2СН2СН2-СН-), 3,08-3,11 (q, 2H, -NHCH2CH2CH2-CH-), 3,21 (s, -ОСН3), 3,5 (s, -O-CH2CH2-O-), 3,85 (s, 2H, -O-CH2-CO-NH-), 4,44 (t, 1Н, -NHCH2CH2CH2-CH-), 7,67 (-NH-).
Наконец, мПЭГ10k-бутанацеталь (5 г, 0,5 ммоля) растворяли в 50 мл 10% CF3СООН и раствор перемешивали при комнатной температуре в течение ночи (4). Затем к смеси добавляли 1 н. раствор NaOH до рН 6,0, хлорид натрия (10 мас.%), 1 н. раствор NaOH до рН 7,0 и смесь экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ10k-бутанальдегид (5), отделяли фильтрованием и высушивали в вакууме (выход 4,1 г, 82%).
1Н-ЯМР (ДМСО-d6): 3,21 (s, -ОСН3), 3,5 (s, -O-CH2CH2-O), 3,85 (s, 2H, -O-CH2-CO-NH-), 7,67 (-NH-), 9,66 (-CHO-).
Пример 3
Получение мПЭГ10k-ацетальальдегида
Исходное соединение, мПЭГ10k-диэтилацеталь, получали по методике, описанной в примере 1. Исходное соединение (1 г, мол. масса 10000) растворяли в 10 мл 80% трифторуксусной кислоты (фирма Aldrich, >99%) и реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. К реакционной смеси добавляли по каплям 1 н. раствор NaOH до рН 6,0, затем NaCl (10 мас.%) и 0,1 н. раствор NaOH до рН 6,95±0,05. Раствор экстрагировали хлористым метиленом, органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ10k-ацетальальдегид, отделяли фильтрованием и высушивали в вакууме. Выход 0,85 г (85%).
Пример 4
Получение мПЭГ10k-пропиональдегида
Исходное соединение, мПЭГ10k с-пропионацеталь, получали по методике, описанной в примере 1. Исходное соединение (2 г, мол. масса 10000) растворяли в 20 мл 80% трифторуксусной кислоты (фирма Aldrich, >99%) и реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. К реакционной смеси добавляли по каплям 1 н. раствор NaOH до рН 6,0, затем NaCl (10 мас.%) и 1 н. раствор NaOH до рН 6,95±0,05. Раствор экстрагировали хлористым метиленом, органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ10k -пропиональдегид, отделяли фильтрованием и высушивали в вакууме. Выход 1,8 г (90%).
Пример 5
Получение мПЭГ20k-дибутанальдегида
Исходное соединение, диэтилацеталь ПЭГ20k-дибутиральдегида, получали по методике, описанной в примере 1. Исходное соединение (3,1 г, мол. масса 20000) растворяли в 20 мл 80% трифторуксусной кислоты (фирма Aldrich, >99%) и реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. К реакционной смеси добавляли по каплям 1 н. раствор NaOH до рН 6,0, затем NaCl (10 мас.%) и 0,1 н. раствор NaOH до рН 6,95±0,05. Раствор экстрагировали хлористым метиленом, органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ20k-дибутанальдегид, отделяли фильтрованием и высушивали в вакууме. Выход 2,5 г (81%).
Пример 6
Получение мПЭГ20k-бутанальдегида
Исходное соединение, диэтилацеталь мПЭГ20k-бутиральдегида, получали по методике, описанной в примере 1. Исходное соединение (3,0 г, мол. масса 20000) растворяли в 30 мл 80% трифторуксусной кислоты (фирма Aldrich, >99%) и реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. К реакционной смеси добавляли по каплям 1 н. раствор NaOH до рН 6,0, затем NaCl (10 мас.%) и 1 н. раствор NaOH до рН 6,95±0,05. Раствор экстрагировали хлористым метиленом, органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ20k-бутанальдегид, отделяли фильтрованием и высушивали в вакууме. Выход 2,5 г (83,3%).
Пример 7
Получение мПЭГ20k-бутанальдегида
Исходное соединение, диэтилацеталь мПЭГ20k-бутиральдегида, получали по методике, описанной в примере 1. Исходное соединение (14,7 г, мол. масса 20000) растворяли в 200 мл 10% трифторуксусной кислоты (фирма Aldrich, >99%) и реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. К реакционной смеси добавляли по каплям 1 н. раствор NaOH до рН 6,0, затем NaCl (10 мас.%) и 0,1 н. раствор NaOH до рН 6,95±0,05. Раствор экстрагировали хлористым метиленом, органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, мПЭГ20k -бутанальдегид, отделяли фильтрованием и высушивали в вакууме. Выход 13,1 г (89%).
Реферат
Изобретение относится к соединениям альдегида полиэтиленгликоля (ПЭГ-альдегиды), к способам получения указанных соединений альдегида полиэтиленгликоля, а также к промежуточным соединениям, которые используются при получении соединений ПЭГ-альдегидов. Способ получения ПЭГ-альдегидов включает гидролиз указанных промежуточных продуктов. Указанные альдегиды полиэтиленгликолей представляют собой специфические реагенты для пэгилирования пептидов и других биомолекул по N-концевым аминокислотным остаткам, т.е. ПЭГ-альдегиды образуют конъюгат с N-концевой α-аминогруппой биомолекулы или белка с образованием стабильной связи в виде вторичного амина между ПЭГ и биомолекулой или белком. При этом в пэгилированных полипептидах образуется специфичная N-концевая связь, что исключает образование поперечных связей или образование нескольких производных одного и того же полипептида. В зависимости от выбранного альдегида ПЭГ может ковалентно связываться с биомолекулой одной концевой группой (монофункциональный ПЭГ-альдегид) или двумя концевыми группами (бифункциональный ПЭГ-альдегид). Преимущество конъюгатов ПЭГ с биомолекулами заключается в том, что они характеризуются повышенным удерживанием и замедленным метаболизмом в организме. 9 н. и 8 з.п. ф-лы.
Формула






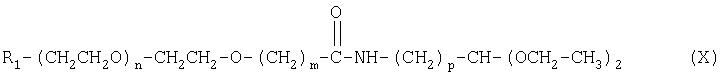

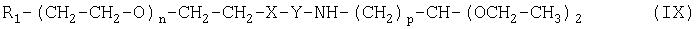
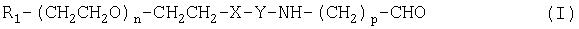


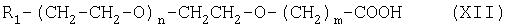
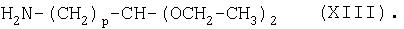
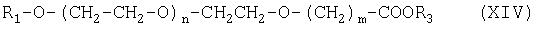



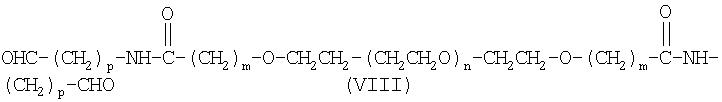
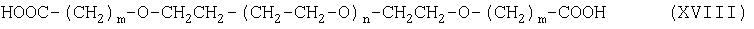
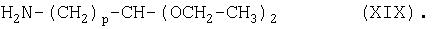

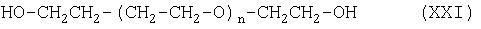
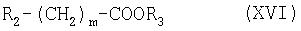
Документы, цитированные в отчёте о поиске
Полиэтиленгликолевое производное полипептидов нейротрофического фактора и способ их получения

Комментарии