Вакцина против внутриутробного заболевания - RU2672589C2
Код документа: RU2672589C2
Чертежи







Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США №61/731,333, поданной 29 ноября 2012 года, содержание которой включено в данную заявку посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ
[2] Настоящее изобретение в целом относится к охране здоровья жвачных животных и, более конкретно, к композициям и способам, позволяющим ослабить воздействие бактериальных инфекций, связанных с внутриутробным заболеванием.
УРОВЕНЬ ТЕХНИКИ
[3] Послеродовые внутриутробные заболевания молочных коров вызывают
расстройство здоровья животных и могут привести к их раннему удалению из стада или к ослаблению репродуктивной функции животных. Послеродовой метрит характеризуется аномально увеличенной маткой и наличием зловонных водянистых красно-бурых маточных выделений на фоне признаков системного заболевания (уменьшение надоев молока, вялость или другие признаки токсемии) и температурой >39.5°С в течение 21 дня после отела, тогда как эндометритом называется воспаление матки в отсутствие системного заболевания, появляющееся позже, чем через 21 день после отела. В Северной Америке метрит поражает от 10% до 20% коров, тогда как частота заболеваемости эндометритом составляет около 28% и колеблется в пределах от 5.3% до 52.6%. Послеродовой метрит обычно лечится антибиотиками, такими как пенициллин или цефалоспорины третьего поколения. Однако во всем мире сдерживание устойчивости к антибиотикам считается приоритетной задачей охраны здоровья, и поэтому растет озабоченность относительно возможного влияния интенсивного потребления антибиотиков, включая цефалоспорины последнего поколения, животными, предназначенными для употребления в пищу. Сообщалось, что каждый случай метрита обходится примерно в 329-386 долларов США, что связано с лечением антибиотиками и негативным воздействием метрита на способность к воспроизводству (репродуктивную способность), на надои молока и выживаемость. Следовательно, продолжает существовать нереализованная потребность в композициях и методах для применения с целью профилактики внутриутробных заболеваний. Настоящее изобретение удовлетворяет эту потребность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[4] Согласно одному аспекту настоящего изобретения включается способ профилактики послеродового метрита у жвачных животных. Как правило, этот способ включает подкожное введение ветеринарной композиции жвачному млекопитающему животному. Ветеринарная композиция может содержать цельные клетки, выбранные из клеток Escherichia coli (Е. coli), Trueperella pyogenes (Т. pyogenes), Fusobacterium necrophorum (F. necrophorum) и их комбинации; и/или (2) белки, выбранные из лейкотоксина (LKT) F. necrophorum, фимбриального адгезина (FimH) типа 1 Е. coli (FimH), пиолизина (PLO) Т. Pyogenes, и все комбинации цельных клеток и белков. Согласно некоторым вариантам ветеринарная композиция содержит цельные клетки Ε coli, Т. pyogenes и F. necrophorum. Согласно некоторым вариантам ветеринарная композиция содержит белки FimH, PLO и LKT. Согласно некоторым вариантам ветеринарная композиция содержит цельные клетки Ε coli, Т. pyogenes и F. necrophorum и белки FimH, PLO и LKT.
[5] Предполагалось, что этот способ будет применим для любого жвачного млекопитающего. Согласно некоторым вариантам жвачное животное является животным рода Bos, таким как бык, корова или буйвол, а согласно некоторым вариантам жвачное животное является молочной коровой.
[6] В соответствии с одним способом молочная корова является членом группы молочных коров, и способ включает подкожное введение ветеринарной композиции другим молочным коровам в группе с тем, чтобы уменьшить частоту (коэффициент) заболеваемости послеродовым метритом в группе.
[7] Согласно другому аспекту изобретение включает повышение репродуктивной функции у жвачного животного. Способ повышения репродуктивной функции жвачного животного включает подкожное введение жвачному животному ветеринарной композиции по данному изобретению с тем, чтобы повысить репродуктивную функцию жвачного животного.
[8] В другом аспекте изобретение включает ветеринарную композицию, содержащую цельные клетки, выбранные из цельных клеток Е. coli, Т. pyogenes, F. necrophorum и их комбинаций; белки, выбранные из F. necrophorum LKT, Ε. coli FimH, PLO и их комбинаций; и любую комбинацию указанных цельных клеток и белков.
[9] В соответствии с другим аспектом настоящего изобретения включается изделие. Это изделие содержит упаковку и по меньшей мере один герметичный контейнер. Контейнер включает ветеринарную композицию, содержащую цельные клетки, выбранные из цельных клеток Е. coli, Т. pyogenes, F. necrophorum и их комбинаций; белки, выбранные из F. necrophorum LKT, Ε. coli FimH, PLO и их комбинаций; и любую комбинацию указанных цельных клеток и белков. Упаковка содержит также печатный материал, в котором указано, что данная ветеринарная композиция предназначена для подкожного введения жвачному животному с целью профилактики послеродового метрита и/или для повышения репродуктивной функции этого жвачного животного.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[10] На Фигуре 1 приводится пример распространенности видоспецифических факторов вирулентности бактерий, lktA (Fusobacterium necrophorum), fimH {Escherichia coli) и fimA и plo (Arcanobacterium pyogenes) на 3 различных стадиях лактации. *V.F.≥1=
Присутствует по меньшей мере один фактор вирулентности.
[11] На Фигуре 2 дается пример того, как fimH, обнаруженный на 1-3 день лактации (DIM), влияет на способность к воспроизводству. Сплошная черная линия относится к fimH-негативным коровам, а прерывистая линия относится к fimH-позитивным коровам. У fimH-позитивных коров вероятность подтвержденной беременности в 2.1 меньше, чем fimH-негативных коров (Р<0.001).
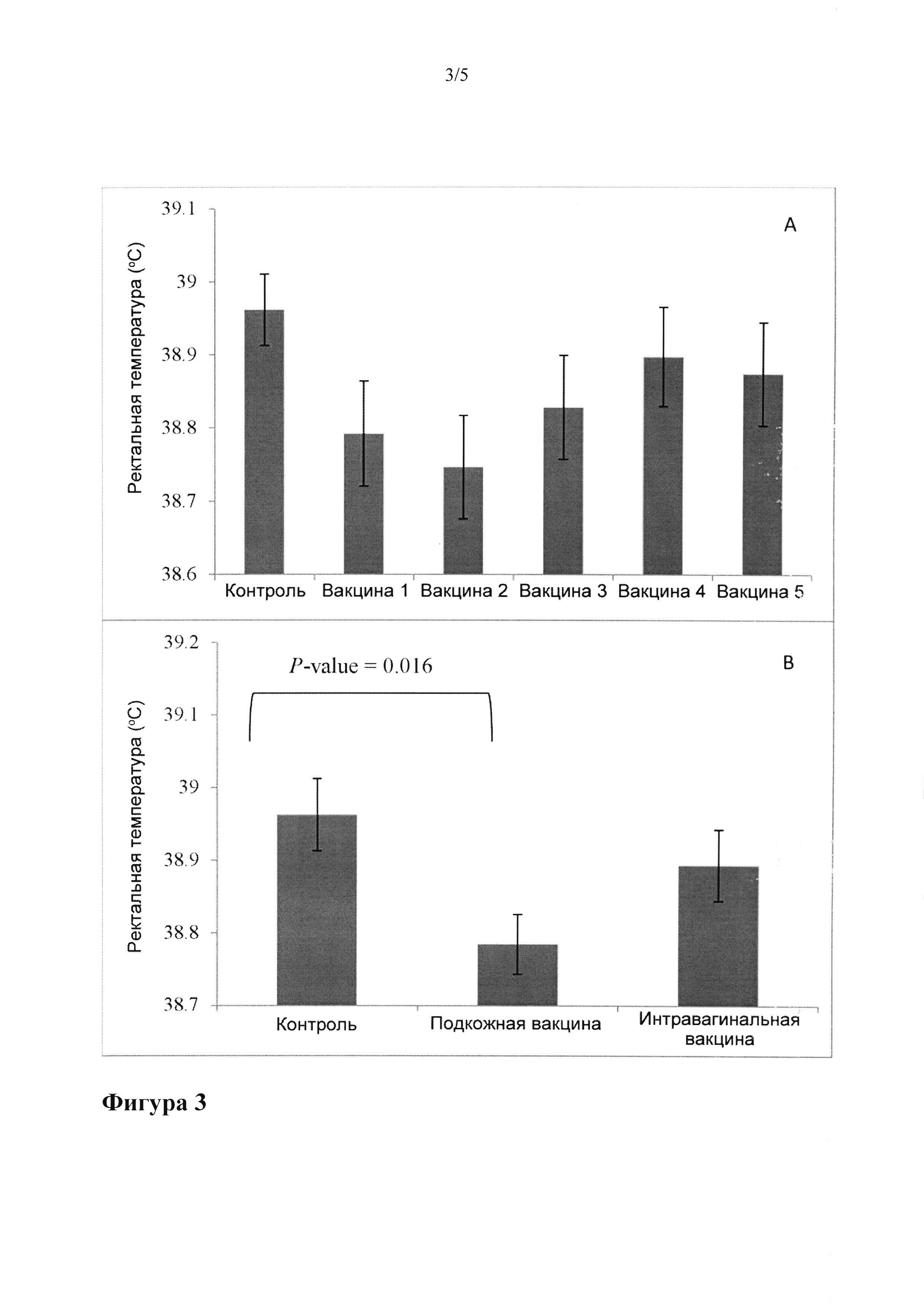
[12] На Фигуре 3 приведен пример влияния вакцинации на ректальную температуру на 6±1 DIM. Вакцины оценивались по отдельности (А, величина Ρ=0.14) и в группе (В, величина Ρ=0.018). Стандартные ошибки среднего представлены в виде "усов".
[13] На Фигуре 4 приведен пример влияния вакцинации на определяемый методом ELISA сывороточный IgG против Е. coli (A), FimH (В), F. necrophorum (C), LKT (D), T. pyogenes (Ε) и PLO (F). На оси X показаны дни относительно дня отела, а на оси Y дано значение OD650 ELISA-определяемого сывороточного IgG против некоторых антигенов. Стандартные ошибки среднего представлены в виде "усов".
[14] На Фигуре 5 иллюстрируется пример анализа выживаемости Каплана-Майера в интервале отел-оплодотворение посредством обработки животных, распределенных по группам, содержащим контрольные животные, и по группам, получавшим подкожные вакцины и интравагинальные вакцины. Средний интервал отел-оплодотворение для подкожных вакцин (внутренняя прерывистая линия), интравагинальных вакцин (средняя прерывистая линия) и контроля (сплошная линия) составлял 94, 114 и 120 дней, соответственно (величина Ρ=0.04).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[15] Настоящее изобретение в целом относится к композициям и способам улучшения состояния здоровья жвачных животных и, более конкретно, к профилактике внутриутробного заболевания у жвачных животных.
[16] Мы анализировали несколько различных подходов к разработке композиций и методов, направленных на ослабление внутриутробных заболеваний у жвачных животных, и, среди прочих реакций, оценивали различное воздействие, которое они оказывают на возникновение метрита и эндометрита. Как известно из уровня техники, метрит обычно включает воспаление стенки матки, тогда как эндометрит обычно включает воспаление эндометрия. Наши подходы включали изготовление различных вакцинных препаратов и оценку действия различных препаратов и способов введения на различные аспекты состояния здоровья жвачных животных. Это действие включает стимуляцию иммунных реакций против бактерий и бактериальных белков, действие "на эндометрит и метрит, действие на внутриутробную бактериальную инфекцию, действие на симптомы, связанные с внутриутробным заболеванием, такие как ректальная температура, и действие на репродуктивную функцию. Результаты, которые мы получили, были неожиданными, так как мы обнаружили, что только подкожное введение предупреждало послеродовой метрит и только подкожное введение эффективно повышало репродуктивную функцию у жвачных животных. Мы также нашли, что интравагинальная и подкожная вакцинация индуцировала значительное повышение титров сывороточного IgG против всех антигенов, но подкожная вакцина более эффективно стимулировала продуцирование IgG. Однако, несмотря на положительные результаты в отношении профилактики метрита и повышения репродуктивной функции, полученные при подкожном введении, ни одна из вакцин, вне зависимости от способа введения, не защищала от эндометрита и не снижала вероятность внутриутробной бактериальной инфекции. Поэтому, как более подробно описано ниже, в настоящем изобретении включаются новые и эффективные композиции и способы профилактики послеродового метрита и повышения репродуктивной функции у жвачных животных, а также другие положительные свойства, которые будут понятны специалистам в данной области техники из настоящего описания.
[17] Согласно некоторым вариантам жвачным животным, которому вводится композиция по изобретению, является представитель рода Bos, такой как бык, корова или буйвол. Согласно одному варианту жвачное животное является молочной коровой.
[18] Настоящее изобретение включает композиции, содержащие цельные клетки и/или один или более других иммуногенов. Согласно некоторым вариантам композиции содержат цельные клетки, выбранные из цельных клеток Escherichia coli (Ε. coli), Trueperella pyogenes (T. pyogenes), Fusobacterium necrophorum (F. necrophorum) и их комбинаций. Согласно некоторым вариантам композиции содержат белки, выбранные из лейкотоксина (LKT) F. necrophorum, фимбриального адгезина (FimH) типа 1 Е. coli, пиолизина (PLO) Т. pyogenes, и их комбинации. Согласно некоторым вариантам композиции содержат любые комбинации цельных клеток и белков. Так, композиции могут содержать один, два или различных типа бактерий и/или один, два или три типа белков. Согласно некоторым вариантам ветеринарная композиция может включать более одного штамма бактерий любого типа. Ветеринарная композиция может также включать другие типы бактерий и белков.
[19] Любые белки, описанные в настоящей заявке, можно выделять из бактерий, которые эндогенно продуцируют эти белки, и, при необходимости, их можно очищать до любой степени чистоты. Любые белки можно также репродуцировать методами рекомбинантной ДНК, используя обычные методики, такие как экспрессия с использованием любого подходящего экспрессионного вектора и любой подходящей экспрессионной системы. Аминокислотные последовательности и полинуклеотидные последовательности, кодирующие аминокислотные последовательности каждого из белков, описанных в настоящей заявке, известны из уровня техники.
[20] Согласно некоторым вариантам композиция содержит приемлемый в ветеринарии носитель, эксципиент или разбавитель, вследствие чего композиция представляет собой ветеринарную композицию. Подходящие носители, эксципиенты и разбавители известны из уровня техники. Согласно некоторым вариантам ветеринарная композиция используется в качестве вакцины.
[21] Цельные бактериальные клетки в ветеринарной композиции можно инактивировать различными методами. Инактивированные бактерии представляют собой бактерии, которые были обработаны таким образом, что они стали менее патогенными по сравнению с бактериями, которые не подверглись подобной обработке. Согласно некоторым вариантам бактерии инактивировали, например, выдерживая их в органическом растворителе, неограничивающим примером которого является формалин.
[22] Ветеринарные композиции могут также содержать любые другие агенты, которые, как ожидается, принесут терапевтическую и/или профилактическую пользу реципиенту, такие как антибиотики и/или адъюванты. Адъюванты, которые подходят для применения в ветеринарных композициях, хорошо известны в уровне техники. Согласно одному варианту адъювант представляет собой гидроксид алюминия. Неограничивающие примеры других адъювантов включают липосомы и археосомы, соли кальция, масляные эмульсии, наночастицы и микрочастицы, сапонины, иммуностимулирующие комплексы, неионные блочные сополимеры, дериватизированные полисахариды, белки-носители, бактериальные продукты и их производные, цитокины, производные комплемента и т.д. Согласно некоторым вариантам этот способ можно осуществлять перед проведением, одновременно с проведением или после проведения антибактериального и противовоспалительного лечения, включая схемы с применением антибиотиков.
[23] Согласно одному варианту настоящее изобретение включает изделие, содержащее упаковку и по меньшей мере один герметичный контейнер. Герметичный контейнер может содержать ветеринарные композиции. Ветеринарные композиции содержат цельные клетки, выбранные из Е. coli, Т. pyogenes, F. necrophorum и их комбинаций. Контейнер может содержать белки, выбранные из F. necrophorum LKT, Ε. coli FimH, PLO и их комбинаций. Согласно некоторым вариантам контейнер включает любые комбинации цельных клеток и белков. Согласно некоторым вариантам упаковка может содержать более одного контейнера, который по отдельности содержит любые цельные клетки или белки, или любые комбинации цельных клеток и белков. Упаковка содержит печатный материал, в котором указано, что данная ветеринарная композиция предназначена для введения жвачному животному, и может содержаться описание подкожного введения и указание, что это введение проводится с целью профилактики метрита и/или для повышения репродуктивной функции жвачного животного.
[24] Согласно настоящему изобретению включаются способы приготовления ветеринарных композиций и изготовления изделий. Способ приготовления ветеринарной композиции включает обеспечение цельных клеток Е. coli, и/или Т. pyogenes, и/или F. necrophorum, и/или LKT, и/или FimH, и/или PLO, и смешение одного или более из этих агентов с приемлемым в ветеринарии носителем, эксципиентом и/или разбавителем с получением ветеринарной композиции для применения при профилактике метрита и/или для применения с целью повышения репродуктивной функции жвачного животного: Для получения изделия ветеринарные композиции помещают в подходящий контейнер и упаковывают. Упаковка изготовлена таким образом, чтобы включать печатный материал, в котором указано, что ветеринарные композиции предназначены для подкожного введения с целью профилактики метрита и/или для повышения репродуктивной функции жвачного животного. Печатный материал может являться частью упаковочного материала или он может представлять собой бумажный вкладыш или этикетку, прикрепленную, например, к контейнеру (к контейнерам).
[25] В другом аспекте настоящее изобретение включает способ стимуляции иммунного ответа у жвачного животного. Этот способ включает введение жвачному животному ветеринарной композиции по настоящему изобретению. Иммунный ответ может представлять собой гуморальный и/или клеточный иммунный ответ. Гуморальный ответ может включать повышение уровня иммуноглобулинов, специфических к любому антигену, экспрессируемому бактерией, и/или специфических к любому из белков, вводимых в составе ветеринарной композиции. Согласно некоторым вариантам стимулируемые иммуноглобулины представляют собой IgG. Согласно некоторым вариантам иммунный ответ обеспечивает профилактический эффект против послеродового метрита. В данном контексте термины "профилактика" и "профилактический" означает по меньшей мере частичную задержку появления и/или частичное угнетение стойкости симптомов, обусловленных внутриутробным заболеванием, и в частности, послеродовым метритом.
[26] Специалисты в данной области техники способны определить, с учетом настоящего описания, когда и как часто вводить композиции и сколько каждого иммуногенного агента следует включать. Как правило, факторы, которые принимаются в расчет, включают, но без ограничения, вид, размеры, возраст и общее состояние здоровья жвачного животного. Согласно некоторым вариантам композиции вводят жвачному животному перед отелом, но их можно вводить во время беременности или в любой момент жизненного цикла.
[27] Согласно некоторым вариантам настоящего изобретения подкожное введение ветеринарной композиции жвачному животному снижает повышенную ректальную температуру у жвачного животного, вызванную бактериальной инфекцией, по сравнению с ректальной температурой жвачного животного с бактериальной инфекцией, которому не вводили ветеринарную композицию.
[28] Согласно одному варианту введение жвачному животному ветеринарной композиции по настоящему изобретению повышает репродуктивную функцию жвачного животного. Повышение репродуктивной функции может включать уменьшение интервала отел-оплодотворение по сравнению с интервалом отел-оплодотворение у жвачного животного, которому не вводили ветеринарную композицию.
[29] Согласно некоторым вариантам настоящее изобретение включает способ снижения заболеваемости послеродовым метритом в группе животных, включающий подкожное введение ветеринарной композиции по настоящему изобретению членам группы животных, вследствие чего заболеваемость послеродовым метритом в этой группе становится ниже, чем в случае, когда эту композицию не вводили. Согласно некоторым вариантам группа животных представляет собой группу молочных коров. Группа животных может находиться, например, на молочной ферме любого масштаба, от фермы, содержащей несколько молочных коров, до товарной молочной фермы, в которой могут содержаться тысячи молочных коров.
[30] Для иллюстрации настоящего изобретения далее приводятся примеры. Их никоим образом не следует рассматривать как ограничивающие настоящее изобретение.
Пример 1
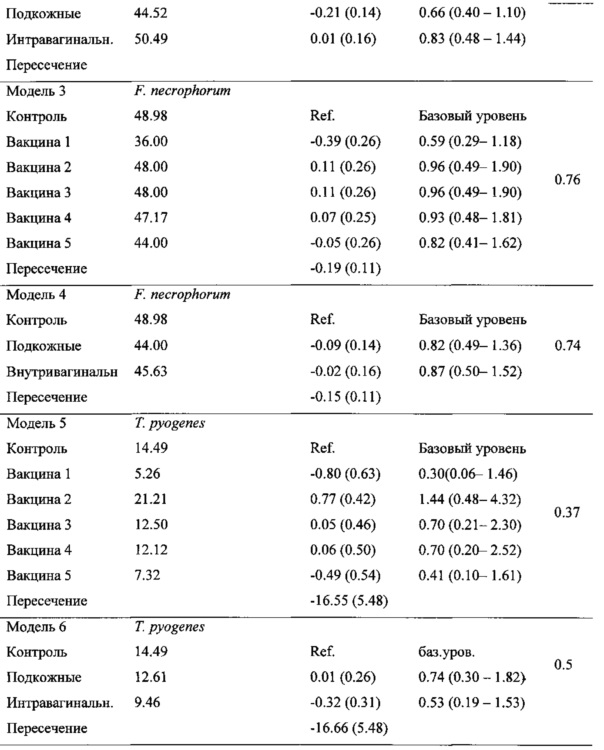
[31] В данном примере показана связь между видоспецифическими факторами вирулентности (VFs) бактерий, присутствующими в матке на 3х различных стадиях лактации (на 1-3, 8-10 и 34-36 дни лактации (раздоя) (DIM)) и частотой возникновения (заболеваемостью) метрита и клинического эндометрита у молочных коров. Были изучены гены следующих VF: plo (пиолизина), сbрА (коллагенсвязывающего белка) и fimA (экспрессия генов фимбрий), специфических к Arcanobacterium pyogenes; fimH (компонента пилий (фимбрий) типа 1), специфического к Escherichia coli; и lktA (лейкотоксина), специфического к Fusobacterium necrophorum. Мазки маточных выделений брали у 111 молочных коров после отела. Для определения наличия генов plo, cbpA, fimA, fimH и lktA применяли ПЦР (PCR). A. pyogenes cbpA был обнаружен только в 5 образцах и поэтому подробно не анализировался. Е. coli (fimH) был в значительной степени обусловлен метритом и эндометритом, если обнаруживался на 1-3 DIM; F. necrophorum (lktA) был в значительной степени обусловлен метритом, если обнаруживался на 1-3 и 8-12 DIM и эндометритом, если обнаруживался на 34-36 DIM; и А. pyogenes (fimA и plo) был обусловлен метритом (fimA), если обнаруживался на 1-3 DIM и эндометритом (fimA и plo) если обнаруживался на 8-10 и 34-36 DIM.
[32] Ферма, содержание животных и сбор образцов. Мазки маточных выделений брали после отела у 111 молочных коров, которые находились на товарной молочной ферме, расположенной около города Итака, штат Нью-Йорк (Ithaca, New York). Образцы отбирали с апреля 2010 года по июнь 2010 года. Для регулирования воспроизводства (репродукции) коров применяли комбинацию программ Presynch, Ovsynch, Resynch и определение течки (эструса) у 25-30% коров, осемененных искусственно (TAI), и остальных коров, осемененных после определения течки (эструса), только с помощью датчиков (ALPRO; DeLaval, Kansas City, МО). Образцы маточных выделений отбирали у каждой коровы три раза за время исследования (на 1-3 DIM, на 8-10 DIM и на 34-36 DIM). Применяли два метода отбора проб из матки: мазки выделений из матки для первого и второго образца и маточный лаваж для третьего образца. На 34-36 DIM матка обычно уменьшается до нормальных размеров, и объем жидкости в матке уменьшается. Поэтому в этот момент маточный лаваж является, возможно, лучшим способом отбора проб. Маточный лаваж также применялся на 34-36 DIM для диагностики эндометрита. Мазки выделений из матки брали следующим образом: движение коров ограничивали и область промежности очищали и дезинфицировали 70%- ным раствором этанола. Затем стерильный тампон (Наr-Vet™ McCullough Double-Guarded Uterine Culture Swab, Spring Valley, WI), покрытый стерильной пипеткой (внутри пластиковой оболочки) вводили в краниальную часть влагалища. Пипетку вводили через шейку в матку, затем оболочку разрывали и тампон соприкасался с маточным секретом. Тампон втягивали внутрь пипетки и хранили в среде для транспортировки при 4°С до анализа его в лаборатории. Отбирали образцы маточного лаважа. Говоря вкратце, движение коров ограничивали, и область промежности очищали и дезинфицировали 70%-ным раствором этанола. Пластиковую пипетку для вливания (внутри пластиковой оболочки) вводили в краниальную часть влагалища. Затем оболочку разрывали и чистый кончик пипетки вводили через шейку в матку. Всего 40 мл стерильного раствора хлорида натрия вводили в матку, осторожно перемешивали и образец жидкости отсасывали. Объем извлекаемой жидкости составлял от 5 до 15 мл. Образцы хранили на льду до момента анализа в лаборатории. Этот предлагаемый проект был рассмотрен и одобрен Комиссией по контролю за здоровьем и использованием животных Корнелльского университета (Cornell University Institutional Animal Care and Use Committee, # 2011-0111).
[33] Выявление заболевания. Послеродовой метрит клинически определялся наличием аномально увеличенной матки и зловонными водянистыми красно-бурыми маточными выделениями на фоне признаков системного заболевания (уменьшение надоев молока, вялость или другие признаки токсемии) на 8-10 дни после отела, и диагноз ставил один из ветеринаров научно-исследовательской группы. Клинический эндометрит определяли на 34-36 DIM визуальным изучением образца маточного лаважа. Таким образом мы могли гарантировать, что видимые признаки воспаления (гнойный или слизисто-гнойный экссудат) определяются выделениями из матки, а не из других органов. Все образцы маточного лаважа визуально оценивал один из исследователей, который определял наличие гнойного или слизисто-гнойного секрета в образце маточного лаважа. Оценки были от 0 до 2, причем оценка 0 указывала на отсутствие гнойного или слизисто-гнойного секрета в образце лаважа, оценка 1 говорила о том, что образец является кровянистым, но не гнойным, и оценка 2 указывает на присутствие гноя в лаваже. Коров с оценкой 2 рассматривали как коров, у которых диагностирован клинический эндометрит. Оценку упитанности в баллах проводили во время каждого маточного лаважа по пятибалльной шкале в системе из четырех пунктов. Кроме того, оцениваемую на ферме легкость отела в баллах от 1 до 5 (1 и 2 соответствовали самостоятельным родам, а оценки 3-5 соответствовали несамостоятельным, принудительным родам с увеличивающейся степенью тяжести), рождение мертвого теленка и частоту задержки отделения плаценты считали факторами риска.
[34] Экстракция, ПЦР, гель-электрофорез и секвенирование ДНК. Образцы мазков в 1 мл фосфатно-солевого буферного раствора (PBS) помещали в пробирку Falcon объемом 15 мл и перемешивали на вортексе, чтобы осуществить тщательное диспергирование слизи, бактерий или транспортной среды. Выделение тотальной ДНК из 400 мкл суспензии проводили, используя набор QIAmp DNA minikit (Qiagen, Santa Clara, CA) в соответствии с инструкциями производителя по очистке от крови и физиологических жидкостей. Некоторые подходящие модификации, такие как добавление 400 мкг лизоцима и инкубация в течение 12 час при 56°С, включали с целью максимального повышения экстракции бактериальной ДНК. Тотальную ДНК элюировали в 100 мл стерильной воды, не содержащей ДНКазы/РНКазы (Promega, Madison, WI). Концентрацию и чистоту ДНК определяли по оптической плотности на спектрофотометре Nanodrop ND-1000 (Nanodrop Technologies, Rockland, DE).
[35] ПЦР применяли для амплификации специфических участков генов VF. Из генов VF, которые вносят вклад в патогенный потенциал A. pyogenes, были амплифицирован три гена: plo, cbpA и fimA. Для характеристики (классификации) E.coli был выбран ген fimH. Ген лейкотоксина (lktA), который, по-видимому, является уникальным для F. necrophorum, был выбран в качестве VF бактерии. Подробности, относящиеся к последовательностям праймеров, температурам отжига и размеру ампликонов, можно найти в Таблице 1. Присутствие известных и предполагаемых VF генов A.pyogenes, E.coli и F.necrophorum определяли независимо. Параметры термических циклов корректировали в зависимости от целевой последовательности, как описано в Таблице 1. Все реакции проводили в объеме 25 мкл, используя 24 мкл системы реагентов 1× Green GoTaq Master Mix (приготовленной из 2×Green GoTaq Master Mix, состоящей из реакционного буфера Green GoTaq®, 400 мкМ dATP, 400 мкМ dGTP, 400 мкМ dCTP, 400 мкМ dTTP и 3 мМ MgCl2; Promega Corp., Madison, WI) и праймеров и 1 мкл экстракта ДНК. Все протоколы термических циклов осуществляли в амплификаторе ДНК (термоциклере) 2720 Thermal Cycler (Applied Biosystems, Foster City, CA). Негативные контрольные пробы, состоящие из ПЦР смеси, не содержащей ДНК, были включены во все опыты с ПЦР. Продукты амплификации разделяли с помощью электрофореза в 1.2% (вес/об) агарозном геле, окрашивали раствором 0.5 мкг/мл этидия бромида и визуализировали с помощью системы визуализации Kodak Gel Logic 100 Imaging System (GL 100, Scientific Imaging Systems, Eastman Kodak Co., New Haven, CT). Положительными результатами считали ампликоны с ожидаемым размером молекул.

[37] Для подтверждения происхождения продуктов ПЦР случайный образец из 5 ПЦР положительных образцов каждого из генов fimH, plo, fimA и lkta очищали и подвергали секвенированию. Полученные последовательности сравнивали с последовательностями в базе данных GenBank, используя алгоритм BLAST. Все последовательности соответствовали последовательностям нужных генов с идентичностью последовательностей >98%.
[38] Статистический анализ. Коров несколько раз делили на VF позитивные (1) или VF негативные (0). Чтобы установить соотношение между присутствием VF-гена и случаями метрита и клинического эндометрита, в соответствии с данными были построены две модели многомерной логистической регрессии; зависимыми переменными являлись метрит (да - нет) и клинический эндометрит (да - нет). Независимыми переменными, предлагаемыми для моделей, являлись: принудительные роды (оценка легкости отела ≥3), задержка отделения плаценты, паритетная (равноценная) группа (1, 2, ≥3), оценка состояния организма и VFs fimH, plo, fimA и lktА на DIM 1-3, 8-10 и 34-36. Термины, относящиеся к различным двусторонним взаимодействиям, добавляли к модели. Переменные вручную и постадийно исключали из моделей в порядке убывания Р-значения (обратное исключение). Статистически значимыми считали результаты, когда Ρ<0.05. Другую модель многомерной логистической регрессии создавали с целью оценки связи между факторами риска (принудительные роды, задержка отделения плаценты, количество родов, оценка состояния организма) и прошлые VFs, которые в значительной степени были обусловлены внутриутробным заболеванием.
[39] Анализ выживаемости Каплана-Мейера проводили для того, чтобы оценить связь генов VF (plo, cbpA, fimA, fimH и lktА) со способностью к воспроизводству, используя программу Medcalc, версия 10.4.0.0 (Mariakerke, Belgium); для вычисления величины Ρ применяли логранговый критерий (критерий Кокса). Временной переменной для этой модели служил интервал отел-оплодотворение или период последующего наблюдения; минимальный период последующего наблюдения составлял 150 дней, а максимальный - 250 дней. Статистически значимым считали результаты при Ρ<0.05.
[40] Нижеприведенные результаты получали, применяя вышеуказанные материалы и методы.
[41] Описательная статистика. В общей сложности в исследовании принимали участие 111 коров голштинской породы, из которых у 56 (50.4%) это были первые роды, у 34 (30.6%) вторые и у 21 (18.9%) это были третьи роды или более. А. pyogenes VF cbpA не был обнаружен в первом выборочном обследовании (1-3 DIM), у 2 и 3 коров он был идентифицирован на 8-10 и на 34-36 DIM, соответственно. Вследствие низкой встречаемости VF cbpA был исключен из всех ассоциативных анализов. А. pyogenes VFs fimA и plo преобладали во всех 3 различных выборках (1-3, 8-10 и 34-36 DIM), и чаще всего встречались на 8-10 DIM (Фигура 1). Наиболее распространенным VF являлся F. necrophorum VF lktА, который кодирует эндотоксин (лейкотоксин). Е. coli VF fimH также обнаруживали в пробах (выборках), отбиравшихся во все 3 периода, причем чаще всего он встречался на 8-10 DIM (Фигура 1). Общая заболеваемость метритом в данной исследуемой популяции составляла 40.5%, а частота случаев клинического эндометрита, диагностируемого на 34-36 DIM, составляла 19.8%.;
[42] Зависимость между видоспецифическими факторами вирулентности бактерий и распространенностью метрита. Было найдено, что два переменных фактора в значительной степени (Р<0.05) влияют на распространенность (частоту случаев) метрита: присутствие Е. coli fimH на 1-3 DIM и F. necrophorum lktА, обнаруживаемого на 8-10 DIM (Таблица 2). У коров, инфицированных fimH-позитивными Е. coli, случаи метрита обнаруживались в 4.7 раза чаще, чем у fimH-негативных коров (Р-значение <0.001). F. necrophorum VF lktА являлся единственным VF, который определялся на 8-10 DIM, что в значительной степени было обусловлено метритом; заболеваемость метритом составляла 54.1% для lktA-позитивных коров и 24% для lktА -негативных коров (Таблица 2).

[44] Зависимость между видоспецифическими факторами вирулентности бактерий и распространенностью клинического эндометрита. Было найдено, что три переменных фактора в значительной степени (Р<0.05) влияют на распространенность (частоту случаев) клинического эндометрита: присутствие Е. coli fimH на. 1-3 DIM и А. pyogenes fimA, диагностируемого на 8-10 и на 34-36 DIM (Таблица 3). Е. coli VF fimH был обусловлен значительным повышением числа случаев эндометрита только, когда обнаруживался в первой выборке (DIM 1-3); распространенность (число случаев) эндометрита составляла (-о) 38.1% и 15.6% для fimH-позитивных и негативных коров, соответственно (Р-значение <0.01). Arcanobacterium pyogenes fimA в значительной степени был обусловлен клиническим эндометритом, если обнаруживался на 8-10 и 34-36 дни после отела; у fimA-позитивных (выборка на 34-36 DIM) коров случаи клинического эндометрита наблюдались в 8.8 раз чаще, чем у негативных коров.

[46] Факторы риска для fimH на 1-3 DIM, fimA на 8-10 и 34-36 DIM и lktA на 8-10 DIM. Результаты, относящиеся к факторам риска, оказывающим значительное влияние на распространенность специфических VFs (fimH на 1-3 DIM, fimA на 8-10 и 34-36 DIM и ША на 8-10 DIM), представлены на Фигуре 4. У коров с задержкой отделения плаценты заражение fimH-позитивными Е. coli наблюдалось в 44.8 раз чаще, чем у коров, у которых не было задержки отделения плаценты, и это был наиболее сильный наблюдаемый эффект.


[48] Зависимость между видоспецифическими факторами вирулентности и способностью к воспроизводству. Единственным VF, в значительной степени связанным со способностью к воспроизводству, явился fimH на 1-3 DIM; вероятность подтверждения беременности у fimH-позитивных коров в первой выборке была в 2.1 раз меньше по сравнению с fimH-негативными коровами (Р<0.01, Фигура 2). Как очевидно из вышесказанного в данном примере, присутствие fimH-несущих бактерий Е. coli на 1-3 DIM в значительной степени было связано с метритом и клиническим эндометритом. Однако, бактерии Е. coli не были связаны с внутриутробными заболеваниями на более поздних стадиях лактации (на 8-10 и на 34-36 DIM), это дает основание предполагать, что Е. coli, по-видимому, находятся среди первых бактерий, которые колонизируют внутриутробную среду, возможно, вызывая изменения, которые способствуют будущей колонизации облигатными (F. necrophorum) и факультативными (A. pyogenes) анаэробными бактериями, которые в конечном счете вызывают клинические симптомы внутриутробного заболевания. Внутриутробные патогенные бактерии Е. coli (IUРЕС) содержат целый набор VFs (fimH, hlуА, cdt, kpsMII, ibeA и astA), ассоциированных с внекишечными патогенными Е. coli (ЕхРЕС). Из шести VFs, ассоциированных с метритом и эндометритом, fimH был наиболее важным вследствие высокого уровня его распространения и тесной связи с внутриутробными заболеваниями и неспособностью к воспроизводству.
[49] FimH представляет собой адгезии (из пилий (фимбрий) типа 1), который принадлежит к семейству белков, принимающих участие в бактериальном прилипании к различным мишеням, включая клетки хозяев-млекопитающих. Результаты одного более раннего исследования показали, что клональные Е. coli, выделенные из коров, больных метритом, были более адгезивными и инвазивными по отношению к эндометриальным эпителиальным и стромальным клеткам, чем клональные бактерии, выделенные из клинически не пораженных животных. В другом исследовании также был сделан вывод, что у бактерий отсутствовали гены патогенности, обычно ассоциированные с вирулентностью у Е. coli - они исследовали 17 VF генов и нашли, что ни один из них не был ассоциирован с внутриутробным заболеванием.
[50] В данном примере у FimH-позитивных коров на 1-3 DIM вероятность появления внутриутробного заражения F. necrophorum в 16.2 раза выше, чем на 8-10 DIM. Эти результаты подтверждают точку зрения, что на введение и устойчивость внутриутробной инфекции F. necrophorum и других грамотрицательных анаэробных бактерий влияет наличие подходящей внутриутробной среды, которая образуется после предшествующей инфекции Е. coli. Кроме того, в настоящем исследовании присутствие несущих fimH бактерий Е. coli на 8-10 или 34-36 DIM не было обусловлено метритом, клиническим эндометритом или репродуктивной недостаточностью. Фактически среди fimH-позитивных коров на 8-10 DIM случаев метрита в численном выражении было меньше (32.1%) по сравнению с fimH-негативными коровами (43.4%). Этот факт указывает на многофакторную этиологию послеродовых внутриутробных заболеваний и позволяет выдвинуть предположение, что внутриутробная популяция микробов изменяется по мере продолжения лактации. Свыше 90% fimH-позитивных на 1-3 DIM коров через неделю были инфицированы F. necrophorum, а присутствие F. necrophorum было важным фактором риска появления A. pyogenes.
[51] В образцах, собранных на 8-10 DIM, чаще всего наблюдалось присутствие бактерий по сравнению с двумя другими стадиями лактации - по меньшей мере один VF присутствовал у 71% коров. Интересным фактом является то, что было найдено, что A.pyogenes и F.necrophorum преобладают в образцах, взятых во второй период отбора. На 8-10 DIM VF lktА был единственным VF, в значительной мере связанным с метритом: распространенность метрита составляла 54.1% для F. necrophorum-позитивных коров и 24% для негативных коров.
[52] В данном примере было найдено, что внутриутробное заражение посредством F.necrophorum и A. pyogenes чаще всего встречается во второй и третий период отбора образцов. В данном примере обнаруженные в третьей выборке (третий период отбора образцов, DIM 34-36) как A. pyogenes, так и F. necrophorum в значительной мере были обусловлены клиническим эндометритом.
[53] В данном примере задержка отделения плаценты повышала частоту случаев внутриутробного заражения fimH-позитивными бактериями Е. coli в 44.8 раз. Кроме того, у коров, перенесших принудительные роды, был повышенный риск заражения посредством F. necrophorum и A. pyogenes. Следовательно, на внутриутробное заболевание влияют осложнения во время отела, и экзогенная бактериальная инфекция играет важную роль.
[54] В данном примере предоставляются доказательства того, что бактериальная этиология послеродовых внутриутробных заболеваний является изменчивой и многофакторной, причем значительный вклад в нее вносят по меньшей мере три различных вида бактерий: Escherichia coli, Fusobacterium necrophorum и Arcanobacterium pyogenes.
[55] Наконец, у коров, которые были fimH-позитивными при первом отборе образцов (DIM 1-3), вероятность забеременеть была в 2.1 раза меньше, чем у fimH-негативных коров; fimH был единственным геном VF, в значительной степени связанным с пониженной способностью к воспроизводству.
[56] Наличие Е. соli-специфического fimH и F. necrophrum-специфического lktА VF генов в значительной степени было обусловлено повышенной частотой случаев появления метрита, если его обнаруживали на 1-3 и 8-10 DIM, соответственно. Е. coli-специфический fimH и А. Рypgenes-специфический fimA VF гены в значительной степени были обусловлены повышенной частотой случаев клинического эндометрита, если их обнаруживали на 1-3 дни (fimH) и на 8-10 и на 34-36 (fimA) DIM.
ПРИМЕР 2
[57] В данном примере изучалась эффективность пяти вакцинных препаратов, содержащих различные комбинации белков (FimH; лейкотоксина, LKT; и пиолизина, PLO) и/или инактивированных цельных клеток (Escherichia coli, Fusobacterium necrophorum и Trueperella pyogenes), для профилактики послеродовых внутриутробных заболеваний. Изначально мы предполагали, что предродовая иммунизация против релевантных антигенов послеродовых внутриутробных заболеваний сможет предотвратить случаи послеродового метрита и эндометрита.
[58] Как подробнее описано ниже, инактивированные цельные клетки репродуцировали, используя два генетически различных штамма каждого вида бактерий (Е. coli, F. necrophorum и Т. pyogenes). Субъединицы FimH и PLO продуцировали, используя экспрессию рекомбинантных белков, a LKT получали посредством культивирования штамма бактерий F. necrophorum дикого типа. Были приготовлены гри вакцины для подкожного введения: вакцина 1 состояла из инактивированных цельных бактериальных клеток и белков; вакцина 2 состояла только из белков; и вакцина 3 состояла только из инактивированных цельных бактериальных клеток. Вакцина 4 состояла из инактивированных цельных бактериальных клеток и белков; и вакцина 5 состояла из PLO и LKT. Для определения эффективности вакцин проводили рандомизированное клиническое исследование на торговой молочной ферме; 371 телку весеннего отела произвольно помещали в одну из шести различных экспериментальных групп: контрольную группу, группы, получавшие вакцину 1, вакцину 2, вакцину 3, вакцину 4 и вакцину 5. Каждую из телок с поздним сроком беременности, отнесенных к одной из групп, получающих вакцину, вакцинировали дважды: на 230 день и 260 день беременности. После исследования вакцин и их деления на вакцины для подкожного и для интравагинального введения было найдено, что вакцины для подкожного введения заметно снижала заболеваемость послеродовым метритом. Кроме того, подкожная вакцинация заметно снижала ректальную температуру на 6±1 дни лактации. Способность к воспроизводству повышалась у коров, которым вакцину вводили подкожно. Как правило, вакцинация вызывала значительное повышение титров сывороточных антител IgG против всех антигенов, при этом подкожная вакцинация была более эффективной. В заключение можно сказать, что подкожная вакцинация инактивированными бактериальными компонентами и/или субъединицами белков Е. coli, F. necrophorum и Т. pyogenes может успешно предупреждать послеродовой метрит в период первой лактации молочных коров, что приводит к повышению способности к воспроизводству.
[59] Материалы и методы. Инактивированные бактериальные компоненты. В этом примере использовали штаммы Е. coli 4612-2 и 12714-2. Штаммы выращивали аэробно на бульоне Лурия-Бертани (Luria-Bertani, LB) (Sigma-Aldrich) при 37°С. Их инокулировали 1% ночной культурой и выращивали в 800 мл среды при перемешивании (150 об/мин). В случае штамма 12714-2 клетки собирали через 4 час, при значении ОD600 0.432 и плотности культуры 1.0×109 КОЕ/мл; в случае штамма 4612-2 клетки собирали через 3.5 час, OD600 0.473 и 1.2×109 КОЕ/мл. Культуры инактивировали 0.1% формалином в течение 12 час, и клетки концентрировали в 4 раза (конечный объем 200 мл), с тем, чтобы в конечном вакцинном препарате находилось 0.25 мл каждого штамма, примерно, с 109 КОЕ на дозу.
[60] Штаммы Trueperella pyogenes 10481-8 и 6375-1 выделяли из полости матки молочных коров. Штаммы вьфащивали на питательной среде VersaTREK REDOX 1 (Trek Diagnostic Systems, ОН) в атмосфере 7% СО2 при 37°С. Клетки собирали через 48 час, при плотности культуры 1.3×108 и 0.5×108 КОЕ/мл для штаммов 10481-8 и 6375-1, соответственно. Культуры инактивировали 0.1% формалином в течение 12 час и 1 мл каждого штамма добавляли в готовый вакцинный препарат с примерной плотностью 108 КОЕ на дозу.
[61] Штаммы Fusobacterium necrophorum 5663 и 513 выделяли из полости матки молочных коров. Штаммы выращивали на среде VersaTREK REDOX 2 (Trek Diagnostic Systems, ОН) анаэробно при 37°С. Все культуры инактивировали 0.1% формалином в течение 12 час, а затем клетки концентрировали. Клетки собирали через 12 час при плотности культуры 1.6×1012 и 1.8×1012 КОЕ/мл для штаммов 513 и 5663, соответственно. Культуры инактивировали 0.1% формалином в течение 12 час и 0.01 мл каждого штамма добавляли в готовый вакцинный препарат с примерной плотностью 1010 КОЕ на дозу.
[62] Экспрессия и очистка рекомбинантного белка. Условия выращивания и индукции бактериальных штаммов. Е. coli ТОР10 (Invitrogen, NY) выращивали либо на LB-aгape, либо на бульоне LB (Sigma-Aldrich, МО) при 37°С. При необходимости добавляли ампициллин (50 мкг/мл). Т. pyogenes 49698 (American Type Culture Collection, VA) выращивали на агаре на основе сердечно-мозговой вытяжки (BHI) или на бульоне BHI (BD BBL, MD), дополненном 5% дефибринированной лошадиной крови, при 37°С и 7% СO2.
[63] Для получения белков с His-меткой (His-PLO или FimH1-156-His) соответствующие культуры Е. coli выращивали при 37°С при перемешивании (200 об/мин) до оптической плотности при 600 нм ~ 0.6. В этот момент к культурам добавляли изопропил 1-тио-β-D-галактопиранозид (IPTG; Sigma) до концентрации 1 мМ, а затем культуры инкубировали при перемешивании по меньшей мере в течение 3 час.
[64] Манипуляции с ДНК и конструкции ДНК. Трансформацию Е. coli и выделение плазмид, рестрикцию, лигирование ДНК и гель-электрофорез в агарозном геле осуществляли стандартными методами. Праймеры были синтезированы в компании IDT, а ПЦР проводили на приборе GeneAmp PCR System 9700 (Applied Biosystems, CA). Для того чтобы удостовериться, что в ходе ПЦР не было введено никаких мутаций, все конструкции ДНК секвенировали на автоматическом секвенаторе ДНК (Cornell Biotechnology Resource Center, NY) и анализировали, используя программу LaserGene (DNASTAR, WI).
[65] Клонирование и очистка рекомбинантного His-PLO. Ген PLO, не содержащий кодирующей области для предсказанной сигнальной последовательности, амплифицировали с использованием геномной ДНК A. pyogenes АТСС49698 методом ПЦР с помощью 5' праймера, содержащего сайт XhoI (5'-ACAGCATCCTGGAGT GCCGGATTGGGAAAC-3' (SEQ ID NO:11)), и 3' праймера, содержащего сайт ЕсоRI (5'-TGGAATTCCCTAGGATTTGACATTGT-3' (SEQ ID NO:12)). Реакционная смесь (50 мкл) содержала 1×буфера для амплификации Pfx (Invitrogen) с 1 мМ MgSO4 (Invitrogen, NY), 0.3 мМ каждого dNTP, 0.3 мкМ каждого праймера, 1 Ед ДНК-полимеразы типа Platinum Pfx (Invitrogen, NY) и примерно 50 нг матричной (цепи) ДНК. Ниже даны параметры циклов амплификации: начальная денатурация 5 мин при 94°С, затем 30 циклов денатурации (94°С в течение 1 мин), отжиг (58°С в течение 1 мин), удлинение (72°С в течение 3 мин) и конечное удлинение при 72°С в течение 7 мин. Ампликон размером 1.5 т.п.н. расщепляли с помощью XhoI-ЕсоRI и клонировали в плазмиду pTrcHisB (Invitrogen, NY), расщепленную с помощью XhoI-ЕсоRI.
[66] После индукции в течение 3 часов клетки собирали, центрифугируя при 10,000×g в течение 10 мин, и клеточный осадок ресуспендировали в 1 X буфера для экстракции/отмывки (50 мМ фосфата натрия, 300 мМ NaCl) (рН 7.0). Добавляли лизоцим до конечной концентрации 0.75 мг/мл и смесь инкубировали при встряхивании при 4°С в течение 30 мин. Клетки разрушали, дважды пропуская через дезинтегратор клеток-пресс Френча (Amicon) при 20,000 ф/дюйм2 (138 МПа), и нерастворимый материал удаляли на центрифуге при 12,000×g в течение 30 мин. His-PLO очищали от растворимой фракции с помощью металл-аффинной хроматографии на смоле TALON (Clontech, СА) согласно инструкциям производителя. Выделенную фракцию, содержащую чистый белок, концентрировали с помощью волоконной мембраны для концентрации/обессоливания с использованием фильтра с исключением по молекулярной массе 10 кДа (Amicon ultra 100K, Millipore, MA) и подвергали SDS-PAGE (15%), используя систему Mini-PROTEAN Tetra Cell electrophoresis system (Bio-Rad, СА) в соответствии со стандартными протоколами. Концентрацию белка определяли по методу Мэрион Бредфорд.
[67] Для получения 321.4 мг His-PLO выращивали 30 л культуры. Конечный объем His-PLO был равен 41 мл и конечная концентрация составляла 7.83 мг/мл.
[68] Клонирование и очистка рекомбинантного белка FimH1-156-His. Часть гена FimH, кодирующего сигнальный пептид и первые 156 аминокислот (домен лектина LD, связывающего маннозу) зрелого белка амплифицировали из плазмиды pET-22b(+)-F3-LD, которая была предоставлена Dr. Evgeni Sokurenko, University of Washington, WA. Использованный праймер 5' содержал сайт ВатHI (5'-CGCGGATCCATGAAACGTGTTATTACCCTG-3' (SEQ ID NO:13)) и праймер 3' содержал сайт HindIII (5'-CCCAAGCTTCTAGTGATGGTGATGGTGATGGCCGCCAGTAGGCACCAC-3' (SEQ ID NO:14)) и шесть-гистидиновую метку после аутентичной последовательности белка. Использовали компоненты ПЦР реакции, описанные для амплификации гена PLO. Параметры циклов амплификации были следующими: начальная денатурация в течение 5 мин при температуре 94°С, с последующими 25 циклами денатурации (94°С в течение 1 мин), отжиг (61°С в течение 1 мин), удлинение (элонгация) (72°С в течение 3 мин), и окончательное удлинение при температуре 72°С в течение 7 мин. Ампликон размером примерно 0.6 кб (пар оснований), расщепляли ВаmHI-HindIII и клонировали в векторе pTrcHisA, расщепленном ВаmHI-HindIII (Invitrogen). Через 5 ч индукции проводили очистку FimH1-156-His, как описано для PLO.
[69] Для получения 216.34 г FimH1-156-His выращивали 92 л культуры. Конечный объем FimH1-156-His составлял 172.5 мл и концентрация этого белка была равна 1.25 мг/мл.
[70] Концентрированный супернатант культуры и аффинная очистка лейкотоксина. Штамм F. necrophorum 6586 выращивали на среде VersaTREK REDOX 2 в течение 12 ч в анаэробных условиях при температуре 37°С. Супернатант концентрировали при температуре 4°С в системе полые волокна/обессоливание с использованием фильтра с исключением молекул с молекулярной массой 100 кДа (Amicon ultra 100K, Millipore, MA). Аффинную очистку LKT осуществляли для определения концентрации LKT в концентрированном супернатанте культуры F. necrophorum 6586. Очищенный mAb F7B10 (3.5 мг) добавляли к 5 мл подложки для аффинной хроматографии Affi-Gel 10 (Bio-Rad, С А) и помещали в колонку размером 1×20 см. Концентрированный супернатант культуры F. necrophorum 6586 помещали в колонку и несвязанные вещества удаляли при пропускании 15 мл 0.5 M NaCl в среде PBS через колонку. Очищенный LKT элюировали 0.2 M смеси глицин-HCl (рН 3.0), сразу же нейтрализовали NaOH, затем промывали и концентрировали, используя фильтр Amicon ultra 10К. Чистоту токсина определяли методом SDS-PAGE (метод электрофореза в полиакриламидном геле).
[71] Для получения 220 мл концентрированного супернатанта, содержащего 0.186 мг/мл LKT, выращивали 10 л штамма F. necrophorum 6586. Наличие и концентрацию LKT в концентрированном супернатанте определяли методом аффинной очистки.
[72] Состав вакцины. Изготавливали пять различных вакцин: три вакцины для подкожного введения (вакцины 1-3) и две интравагинальных вакцины (вакцины 4-5). Вакцина 1 состояла из инактивированных цельных бактериальных клеток (Е. coli, Т. pyogenes и F. necrophorum) и белков (FimH, PLO и LKT); вакцина 2 состояла только из белков (FimH, PLO и LKT); и вакцина 3 содержала только инактивированные цельные бактериальные клетки (Е. coli, Т. pyogenes и F. necrophorum). Вакцина 4 состояла из инактивированных цельных бактериальных клеток (Е. coli, Т. pyogenes и F. necrophorum) и белков (FimH, PLO и LKT), и вакцина 5 содержала только белки (PLO и LKT). Адъювантом вакцины для подкожного введения был гидроксид алюминия (Rehydragel ΗΡΑ, General Chemical, NJ). Объем адъюванта, использованного в вакцинах для подкожного введения, составлял 25% от конечного объема вакцины. Гидроксид алюминия добавляли к каждому компоненту отдельно и осторожно перемешивали полученное вещество в течение ночи. Адъювантом интравагинальных вакцин служил токсин холеры (20 мкг/дозу (List Biological Laboratories, Inc., CA).
[73] Перед помещением готовой вакцины во флаконы проверяли стерильность всех компонентов вакцины. Стерильность определяли путем культивирования 100 мкл компонентов вакцины в аэробных условиях в бульоне LB broth, в аэробных условиях в присутствии 7% СО2 в питательной среде VersaTREK REDOX 1 и в анаэробных условиях в питательной среде VersaTREK REDOX 2 при температуре 37°С в течение 48 ч. Компоненты считались загрязненными, если наблюдался рост бактерий в любой из трех культур в конце периода инкубации.
[74] Оценку уровней эндотоксинов проводили с использованием метода анализа LAL Endpoint Assay (Hycult Biotech, The Netherlands) в соответствии с инструкциями производителя. Уровень эндотоксина во всех составах вакцины был меньше 105 EU/мл (единиц эндотоксина в мл).
[75] Ферма и система управления. Полевые испытания проводили на товарной молочной ферме, расположенной вблизи города Итака в штате New York. Коровы подвергались исследованию в период с 24 мая 2012 г. до 16 августа 2012 г.; период последующего наблюдения длился до 30 апреля 2013 г. Эта ферма была выбрана потому, что она связана длительными отношениями с клиникой Ambulatory and Production Medicine Clinic Корнелльского университета. Протокол исследований был рассмотрен и одобрен Комитетом по институциональному уходу и использованию животных Корнелльского университета (Протокол №2011-0111). На этой ферме производили доение 3,300 коров голштинской породы 3 раза в день в двухрядном доильном зале с 52 стойлами. Коровы находились в коровнике с бетонными стойлами, содержащими подстилку из твердого навоза. Все коровы получали общий смешанный рацион (TMR), состоящий из примерно 55% фуража (кукурузный силос, сенаж (травяной силос), пшеничная солома) и 45% концентрата (кукурузная мука, соевая мука, канола, семена хлопчатника и цитрусовый жом) в расчете на сухие вещества рациона. Кормовой рацион составляли с учетом требований NRC (Национальных норм кормления животных в США) к питательной ценности корма для молочных коров голштинской породы весом 650 кг, дающих 45 кг молока стандартной 3.5%-ной жирности. Регулирование воспроизводства корбв осуществляли с использованием программ Presynch, Ovsynch, Resynch и определения эструса у 25-30% коров, осемененных искусственно, и остальных коров, осемененных после определения эструса, только при помощи датчиков (ALPRO; DeLaval, Kansas City, МО).
[76] Экспериментальные группы и определение заболеваний. Стельные в поздней стадии телки отбирали еженедельно; критерии включения были следующими: 230±3 дней беременности, возраст 629-734 дня и показатель по балльной шкале оценки упитанности (BCS) более 2.5. В экспериментальную группу не включались прихрамывающие телки. Использовали дизайн рандомизированного полевого исследования; телок распределяли в случайном порядке в одну из шести групп, используя функцию получения случайных чисел в Excel (Microsoft, Redmond, MA). Всего в эксперименте участвовали 371 стельная телка; по 105, 54, 54, 53, 53 и 53 телок попали в контрольную группу, в группы, в которых животные получали вакцину 1, вакцину 2, вакцину 3, вакцину 4 и вакцину 5, соответственно. Телки в вакцинируемых группах получали две дозы вакцины: на 230±3 дня беременности и на 260±3 дня беременности.
[77] Оценку упитанности всех экспериментальных коров на 230±3 дня беременности, на 260±3 дня беременности, на 2±1 день лактации (DIM), 6±1 DIM и 35±3 DIM осуществлял один и тот же исследователь в слепом режиме с применением пятибалльной шкалы в системе из четырех пунктов. Для получения образцов сыворотки отбирали кровь из копчиковой вены/артерии при помощи вакуумной пробирки без антикоагулянта и вакуумной иглы калибра 20 (2.54 см) (Becton, Dickinson and Company, Franklin Lakes, NJ). Все образцы крови на льду перевозили в лабораторию и центрифугировали в центрифуге 2000×g в течение 15 мин при температуре 4°С; собирали сыворотку и замораживали % при температуре - 80°С. Образцы сыворотки получали на 230±3 дне беременности, на 260±3 дне беременности, на 2±1 день лактации (DIM), 6±1 DIM и 35±3 DIM.
[78] Тампоны с цервикальным секретом собирали на 2±1 день лактации (DIM), 6±1 DIM; коров фиксировали (обездвиживали), промывали и дезинфицировали промежность 70%-ным раствором этанола. После этого тампон помещали в цервикальный канал, где он пропитывался маточным секретом. Перед обработкой в лаборатории тампоны хранили в стерильном сосуде при температуре 4°С. Секрет на тампонах, собранных на 2±1 день лактации (DIM), культивировали в аэробных условиях на питательной среде Chromagar (Difco) при 37°С, колонии Е. coli отличались голубым цветом; секрет на тампонах, собранных на 6±1 DIM, культивировали в анаэробных условиях на агаре LKV (Anaerobe Systems), колонии F. Necrophoru определяли по морфологии.
[79] Диагностировали задержку отделения плаценты, послеродовой метрит, кетоз, и клинический мастит, обученный персонал фермы осуществлял лечение больных животных в соответствии со специальным протоколом диагностики, разработанным ветеринарами клиники Ambulatory and Medicine Clinic Корнелльского университета. Персонал фермы проводил лечение в произвольном порядке.
[80] После отела коров выдерживали в том же коровнике до 20 DIM. Работники фермы внимательно наблюдали за животными в этом коровнике, коровы подвергались полному физическому обследованию, если у них наблюдались признаки вялости и депрессии; у коров с дурно пахнущим водянистым красно-коричневым секретом и признаками лихорадки диагностировали послеродовой метрит и их подвергали лечению. Задержку отделения плаценты определяли, как состояние, при котором коровам не удавалось выделить послед в течение 24 ч после отела. Диагностирование послеродового метрита проводили на 6±1 DIM. Послеродовой метрит определяли при наличии дурно пахнущего водянистого красно-коричневого секрета и ректальной температуры выше 39.5°С. Персонал фермы и группа исследователей не обменивались информацией, касающейся диагностирования послеродового метрита. Данные, касающиеся признаков заболеваний и воспроизводства, были получены в базе данных фермы DairyComp 305® (Valley Agricultural Software, Tulare, CA).
[81] Клиническую картину эндометрита оценивали на 35±3 DIM при визуальном осмотре образца, полученного при промывке матки, на наличие гнойных выделений. Для получения образцов промывной жидкости ограничивали движение коров, промывали и дезинфицировали полость матки 70%-ным раствором этанола и вводили пластиковую инфузионную пипетку в шейку матки и через шейку матки в полость матки. В шейку матки путем инфузии вводили всего 20 мл стерильного раствора и осторожно перемешивали, затем из полости матки отбирали образец жидкости. Объем отобранной жидкости колебался от 5 до 15 мл. Все образцы визуально по шкале оценивал один и тот же исследователь, который проверял наличие гнойных или слизисто-гнойных выделений в образце промывной жидкости. Баллы менялись от 0 до 2, при этом балл 0 свидетельствовал об отсутствии гнойных или слизисто-гнойных выделений, 1 балл был у кровянистого, но не гнойного образца и балл 2 показывал наличие гноя в образце. Коровы, характеризующиеся баллом 2, рассматривались, как больные эндометритом. Образцы выдерживали на льду до культивирования в чашках с агаровой средой Mueller-Hinton (BBL™), дополненной 5% дефибринированной овечьей крови, в течение 48 ч в аэробных условиях в присутствии 5% СО2 при 38°С. Типичные колонии Т. pyogenes характеризовались морфологическими признаками, зоной постинкубационного гемолиза и характерным появлением пятна Грама.
[82] Ферментный иммуносорбентный анализ (ELISAs). При проведении анализа EMSAs использовали антигены, полученные для приготовления вакцин. Штаммы Е. coli собирает вместе как один антиген. То же самое было сделано со штаммами F. necrophorum and T. pyogenes.
[83] Образцы бычьей сыворотки до анализа размораживали и перемешивали. Были выбраны следующие протоколы ELISA. Покрытие микротитрационных планшетов (Greiner Bio-One, Germany) при осуществлении метода ELISA выполняли при использовании PBS (фосфатно-солевого буферного раствора 10Х, рН 7.4, Ambion®), содержащего 0.295 мкг/мл FimH1-156-His, 0.036 мкг/мл His-PLO, 0.186 мкг/мл LKT, 107 кл/мл Ε. coli, 1010 кл/мл F. necrophorum и 107 кл/мл Т. pyogenes для проведения тестирования иммуноглобулинов против FimH, против LKT, против PLO, против Е. coli, против F. necrophorum и против Т. pyogenes, соответственно. Связывание антигена с содержимым лунок микротитрационных планшетов выполнялось в течение ночи при температуре 4°С, сайты неспецифического связывания блокировали PBS, содержащий 1% казеина (Thermo Scientific, Rockford, IL). Затем в лунки добавляли разведенные образцы бычьей сыворотки; образцы сыворотки разводили в отношениях 1:1000, 1:5000, 1:5000, 1:150, 1:500 и 1:150 для проведения тестирования иммуноглобулинов против FimH, к LKT, против PLO, против Е. coli, против F. necrophorum и против Т. pyogenes, соответственно. Оптимальные концентрации антигенов и антител определяли в соответствии с протоколом количественного определения ELISA при меняющихся концентрациях. Серотип-специфическое антитело, сорбированное в лунках планшета, выявляли при помощи антитела против бычьего IgG, конъюгированного с пероксидазой хрена, разведенного в соответствии с инструкциями производителя (Sigma Aldrich, St. Louis, MO), с последующим добавлением субстрата, 3,3',5,5'-тетраметилбензидина - ТМВ (Sigma Aldrich, St. Louis, MO). Оптическую плотность содержимого каждой лунки определяли через 20 мин при длине волны 650 нм при помощи ридера ELISA Plate Readеr (Synergy HTmicroplate reader BioTek Instruments, VT). Интенсивность появившейся окраски была пропорциональна количеству первичного антитела, связанного с белками на дне лунок. Между стадиями анализа содержимое лунок микротитрационного планшета отсасывали и промывали лунки 3 раза промывочным раствором (1X Phosphate Buffered Saline Tween-20).
[84] Статистический анализ. Статистический анализ был выполнен в институте SAS с использованием процедуры FREQ (SAS Institute INC., Cary, NC). Для оценки действия вакцинации для определения RDPMET, FDPMET, эндометрита, результатов образования культур Е. coli, F. necrophorum и Т. pyogenes, обрабатывали модели логистической регрессии в системе SAS по логистической процедуре. Действие подкожных и интравагинальных вакцин на воспроизводство коров анализировали с помощью модели пропорциональных рисков Кокса, используя процедуру регрессии пропорциональных рисков в SAS. Для оценки влияния вакцинации на величину ректальной температуры на 6±1 DIM, для анализа полученных данных использовали смешанные общие линейные модели, используя JMP®PR09. Во всех моделях, описанных выше, использовали независимые переменные и их соответственные взаимодействия при Ρ<0.10, пытаясь снизить риск ошибок II рода при уровне ошибок I рода с наложенными ограничениями на уровне 5%. Во всех статистических моделях применяли обработку переменных даже в отсутствие статистической значимости. Во всех моделях использовали величину возраста экспериментальных коров в днях и BCS.
[85] При использовании материалов и методов, описанных в данной заявке, получили следующие результаты.
[86] Описательная статистика. Результаты описательной статистики, учитывающей средний возраст (в днях), среднюю величину BCS экспериментальных животных и послеродовой период, составляющий 6±1 дней, срок беременности и общее количество экспериментальных животных, представлены в Таблице 5. В этом исследовании принимали участие только беременные телки, что позволило нам получить наименьшее число вариаций среди животных.

[88] Влияние вакцинации на возникновение диагностированного исследователями послеродового метрита (RDPMET), диагностированного на ферме послеродового метрита (FDPMET) и на величину ректальной температуры на 6±1 DIM. Влияние вакцинации на возникновение диагностированного исследователями послеродового метрита (RDPMET) отражено в Таблице 6. В случае оценки вакцин в отдельности было установлено, что вакцины 1, 2 и 3 вызывали уменьшение случаев возникновения RDPMET, в то время как вакцины 4 и 5 приводили к увеличению случаев его возникновения. Однако это различие не было статистически значимым (величина Р=0.21). Когда вакцины оценивали группами, или как подкожные, или как интравагинальные, оказалось, что вакцины, вводимые подкожно, вызывали уменьшение случаев возникновения RDPMET (величина Р=0.03).

[90] Влияние вакцин на частоту заболеваемости FDPMET показано в Таблице 7. В случае оценки вакцин в отдельности частота заболеваемости FDPMET менялась от вакцины к вакцине (величина Р=0.064). Кроме того, когда вакцины оценивались группами, как подкожные или интравагинальные, подкожные вакцины приводили к меньшему шансу возникновения FDPMET (величина Р=0.047).

[92] Влияние вакцинации на величину ректальной температуры на 6±1 DIM показано на Фигуре 3. В группах с вакцинируемыми животными в случае проверки вакцин в отдельности величины ректальной температуры статистически не различались (величина Р=0.14). Однако эти величины статистически различались при оценке вакцин группами в виде контрольной, подкожных и интравагинальных вакцин (величина Р=0.018). Вакцинация при подкожном введении приводила к значительному снижению ректальной температуры на 6±1 DIM.
[93] Влияние вакцинации на частоту возникновения эндометрита и образование маточного секрета (маточного молочка). Испытанные вакцины не обеспечивали профилактику эндометрита при их оценке в отдельности или группами как подкожных и интравагинальных вакцин (величина Р=0.99). Частота заболеваемости эндометритом составляла 8.57%, 7.89%, 12.12%, 7.50%, 9.09% и 9.76% для контрольной вакцины, вакцины 1, вакцины 2, вакцины 4 и вакцины 5, соответственно. В случае введения подкожных и интравагинальных вакцин в группах частота заболеваемости эндометритом составляла 9.01% и 9.46%, соответственно. Кроме того, вакцинация не оказывала значительного влияния на вероятность внутриматочного бактериального загрязнения (Таблица 8).

[95] Влияние вакцинации на репродукцию. После подкожной вакцинации коровы в 1.36 раз чаще оплодотворяются по сравнению с коровами в контрольной группе (величина Р=0.04). Однако после интравагинальной вакцинации вероятность оплодотворения коров статистически не отличались от вероятности оплодотворения коров в контрольной группе (отношение шансов =1.12, величина Ρ=0.46). При проведении этого анализа в модели учитывались возраст экспериментальных животных в днях и их упитанность (BCS) в баллах (величина Ρ=0.02 и 0.01, соответственно). Повышение репродуктивного потенциала далее иллюстрируется анализом выживаемости (Фигура 5), который демонстрирует, что после подкожной вакцинации коровы гораздо быстрее становились беременными, чем коровы в контрольной группе и коровы, которым вводили вакцину интравагинально.
[96] Серологические ответы на вакцинацию. Влияние вакцинации на антитела IgG против нескольких антигенов, выявленное при проведении анализа ELISA, отражено на Фигуре 4. В общем, вакцинация вызывала значительное увеличение титров антитела IgG против всех антигенов в пробах сыворотки; подкожная вакцинация была более эффективной для увеличения титров антитела IgG в сыворотке, чем интравагинальная вакцинация.
[97] На Фигуре 5 показаны результаты анализа выживаемости по процедуре Каплана-Мейера для определения интервала отел-оплодотворение в экспериментальных группах коров: в контрольной группе и при введении подкожных и интравагинальных вакцин. Осуществляли введение вакцин: коровам в контрольной группе (вакцину не вводили), вводили подкожно (вакцины 1, 2 и 3 вместе) и интравагинально (вакцины 4 и 5 вместе). На оси Y указано количество в % небеременных коров и на оси X указано количество дней от отела до начала беременности. Медианные интервалы отел-оплодотворение в случае введения подкожных вакцин (нижняя прерывистая линия), интравагинальных вакцин (средняя прерывистая линия) и для контрольной группы (сплошная линия) составляли 94, 114 и 120, соответственно (величина Ρ=0.04). Наклон линии, показывающей результаты введения подкожной вакцины, является самым крутым и показывает, что в группе коров, которым вводили подкожную вакцину, количество беременных коров было больше, чем в группе коров, которым вводили интравагинальную вакцину, и в контрольной группе.
[98] Как следует из результатов этого Примера, описанных выше, влияние пяти различных вакцин (трех подкожных вакцин и двух интравагинальных вакцин), содержащих разные комбинации белков (FimH, лейкотоксин F. necrophorum (LKT), Т. pyogenes pyolysin (PLO) и инактивированные цельные клетки (Е. coli, F. necrophorum и T. pyogenes) на состояние матки молочных коров зависит от вида вакцины: подкожная вакцинация значительно снижала частоту возникновения послеродового метрита, в то время как интравагинальная вакцинация была неэффективной.
[99] Послеродовой метрит характеризуется воспалением толщи стенок матки и связан с признаками системного заболевания, такого как вялость, снизившийся надой молока и лихорадка. При наличии послеродового метрита, диагностированного исследователями, как описано в данной заявке, частота его возникновения составляла 12.12% и при диагностировании состояния матки персоналом фермы эта частота составляла 27.62%. Это расхождение приписывается наличию периода, во время которого осуществлялся мониторинг коров; персонал фермы проводил мониторинг коров ежедневно в течение первых 20 дн после отела, а исследователи осматривали коров на 6±1 день после отела. Коров осматривали в это время потому, что пик метрита наблюдается в первые 7 дн после отела. Однако, в общем, влияние вакцинации на частоту возникновения послеродового метрита, выявленное группой исследователей, согласуется с результатами, полученными персоналом фермы; подкожная вакцинация значительно снижала частоту возникновения послеродового метрита, в то время как интравагинальная вакцинация была неэффективной для предотвращения этого заболевания.
[100] Е. coli и F. necrophorum представляют собой грамотрицательные бактерии, характеризующиеся наличием липополисахарида (LPS) во внешней мембране, и они являются известными этиологическими агентами послеродового метрита; известно, что LPS вызывает повышение температуры у скота. Хотя вакцинация незначительно снижает количество коров с положительной реакцией на внутриматочные бактерии Е. coli и F. necrophorum, в случае подкожной вакцинации коров у них наблюдалась более низкая ректальная температура на 6±1 DIM. Это означает, что даже в присутствии бактерий в матке у иммунизированных коров в меньшей степени развивались системные признаки, вызванные наличием LPS, выделившихся из Е. coli и F. necrophorum. Известно, что снижение бактериальной нагрузки Е. coli уменьшает серьезность заболевания, следовательно, иммунизация снижала нагрузку патогена внутри матки.
[101] Иммунный ответ в слизистых оболочках может быть вызван при введении вакцин на слизистую оболочку, в то время как введение вакцин подкожно или внутримышечно не вызывает мукозного иммунитета и менее эффективно при предотвращении инфицирования мукозных поверхностей. Уже сообщалось о многообещающих результатах, касающихся вопросов профилактики UTI (инфекции мочеполовых путей) человека путем интравагинальной иммунизации при помощи вакцин на основе цельных клеток. Однако до сих пор неизвестно, как локальная выработка специфических антител антитело-секретирующими матки влияет на иммунитет матки. При проведении данного исследования оказалось, что интравагинальная иммунизация не эффективна для профилактики заболеваний матки.
[102] В общем, подкожная вакцинация приводила к увеличению содержания IgG против Е. coli, FimH, F. necrophorum, LKT, T. pyogenes и PLO в сыворотке.
[103] Известно, что LKT F. necrophorum очень токсичен по отношению к PMNs (семейству полиморфноядерных клеток) в организме быков, вызывая запрограммированную гибель этих клеток; при этом токсичность зависит от дозы. Возможно, что иммунизация коров против LKT может уменьшить вредное действие этого токсина на внутриматочные PMNs, повышая способность врожденной иммунной системы устранять бактериальные инфекции в полости матки путем фагоцитоза. Рекрутированные PMNs являются ключевыми факторами в иммунной защите матки; снизившаяся миграция PMNs в течение 2 нед до отела связана с задержкой плаценты, а более низкая фагоцитарная активность и способность PMNs к оксидантной реакции связана с возникновением метрита и эндометрита.
[104] Частота заболеваемости послеродовым метритом значительно уменьшалась при дородовой подкожной вакцинации при помощи вакцин, которые содержат различные комбинации белков (FimH, LKT, PLO) и инактивированных цельных клеток (Е. coli, F. necrophorum и Т. pyogenes). В противоположность этому, интравагинальная вакцинация не была эффективной для уменьшения частоты возникновения послеродового метрита. Таким образом, промышленная вакцина против метрита может стать неотъемлемой составной частью стратегической профилактики метрита, ожидается, что это снизит частоту возникновения этого заболевания и применение антибиотиков, что уменьшит и страдания животных, и общее негативное экономическое влияние метрита на производство молочных продуктов.
[105] Хотя в данном описании описаны конкретные варианты (некоторые из которых являются предпочтительными), специалистам в данной области следует иметь в виду, что они могут сделать различные изменения по форме и в деталях, не выходя за рамки и объем настоящего изобретения, описанного в данной заявке.
Реферат
Группа изобретений относится к охране здоровья жвачных животных и, более конкретно, к композициям и способам, позволяющим ослабить воздействие бактериальных инфекций, связанных с внутриутробным заболеванием. Способ профилактики послеродового метрита у жвачного животного и способ улучшения репродуктивной функции у жвачного животного включают подкожное введение ветеринарной композиции жвачному млекопитающему животному, при этом ветеринарная композиция содержит инактивированные цельные клетки Escherichia coli (Е. coli), Trueperella pyogenes (Т. pyogenes) и Fusobacterium necrophorum (F. necrophorum) или лейкотоксин (LKT) F. necrophorum, фимбриальный адгезин типа 1 E.coli с His-меткой (His-FimH) и пиолизин Т. pyogenes с His-меткой (His-PLO) или комбинацию указанных белков и цельных клеток, а также адъювант, представляющий собой гидроксид алюминия. Также раскрыты ветеринарные композиции и наборы для осуществления указанных способов. Группа изобретений обеспечивает уменьшение частоты заболеваемости послеродовым метритом, а также повышение репродуктивной функции у жвачного животного за счет подкожного введения ветеринарной композиции. 6 н. и 22 з.п. ф-лы, 5 ил., 8 табл., 2 пр.

Комментарии