Водный офтальмологический раствор и способ лечения синдрома сухих глаз - RU2688935C2
Код документа: RU2688935C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к водному офтальмологическому раствору. Настоящее изобретение также относится к контейнеру, содержащему водный офтальмологический раствор. Настоящее изобретение также относится к способу лечения синдрома сухих глаз с использованием нового водного офтальмологического раствора. Способ полезен для облегчения признаков и/или симптомов сухих глаз. Способ включает введение индивидууму, нуждающемуся в этом, водного офтальмологического раствора, содержащего тиолированный хитозан.
УРОВЕНЬ ТЕХНИКИ
Синдром сухих глаз (DES), также известный как болезнь сухих глаз, является очень распространенным заболеванием глазной поверхности. Около 40 миллионов американцев страдают некоторыми типами заболевания сухих глаз, значительная часть тех, которым 50 лет и старше, имеют сухие глаза в степени от умеренной до тяжелой (Schaumberg, Sullivan etal., 2003, Prevalence of dry eye syndrome among US women,Am J Ophthalmol(136):318-326; Schaumberg, Dana et al., 2009, Prevalence of dry eye disease among USmen: estimates from the Physicians' Health Studies, Arch Ophthalmol(127):763-768).
В широком смысле, болезнь сухих глаз может представлять собой любой синдром, связанный с нестабильностью слезной пленки и дисфункцией (например, увеличением испарения слезной жидкости и/или пониженной секрецией жидкости). К критериям, которые называются общим термином "болезнь сухих глаз", относятся: сухой кератоконъюнктивит (KCS), связанная с возрастом сухость глаз, синдром Стивенса-Джонсона, синдром Шегрена, рубцовая пузырчатка глаз, повреждение роговицы, инфекция глазной поверхности, синдром Райли-Дей, врожденная алакримия, нарушения или недостатки питания (в том числе витаминные недостаточности), фармакологические побочные эффекты, нарушения желез и тканей, аутоиммунные и другие иммунодефицитные расстройства, а также неспособность коматозных пациентов моргать. Также включенными являются симптомы сухих глаз, вызванных проникновением в окружающую среду взвешенных в воздухе частиц, дыма, смога, и чрезмерно сухого воздуха; а также непереносимость контактных линз и стресс глаз, вызванный работой за компьютером или компьютерными играми.
Есть и другие заболевания, которые имеют высокую степень коморбидности с болезнью сухих глаз: аллергический конъюнктивит (сезонный и хронический), блефарит и дисфункция мейбомиевой железы. Эти состояния влияют на качество и стабильность слезной пленки, что приводит к признакам и симптомам сухих глаз.
Процедуры лазерной коррекции зрения, такие как фоторефрактивная кератектомия (PRK), лазерная суб-эпителиальная кератэктомия (LASEK) и лазерный кератомилез in situ (LASIK) также отрицательно влияют на функциональность слезной пленки и часто вызывают (временное) заболевание сухих глаз.
В настоящее время умение обращаться с DES охватывает как фармакологические, так и нефармакологические способы лечения, в том числе управление окружающей средой, исключение усугубляющих факторов, гигиена век, слезные добавки (искусственные слезы), средства, усиливающее секрецию (для увеличения продуцирования слез), точечный свечи, противовоспалительные средства (циклоспорин, стероиды), камера повышенной влажности и даже автотрансплантация слюнных желез (Behrens, Doyle etal., 2006, Dysfunctional tear syndrome: a Delphi approach to treatment recommendations, Cornea(25):900-907). Доступные в настоящее время варианты лечения DES являются неполноценными. Даже слезная добавка не является идеальным вариантом лечения, поскольку оно требует повторение закапывания пациенту искусственных слез очень много раз в течение дня.
Различные полимеры были раскрыты в качестве возможных вспомогательных средств для обеспечения какой-либо пользы для облегчения симптомов DES, и действительно некоторые искусственные слезы содержат один или несколько полимеров, в том числе 5 наиболее продаваемых в настоящее время в ЕС отпускаемых без рецепта (OTC) продуктов для сухих глаз (Celluvisc®, Systane®, Hylo-Comod®, Optive® и Artelac®). Эти полимеры предназначены для защиты офтальмологических слизистых оболочек и обеспечивают смазку поверхности глаза. Примеры включают производные целлюлозы, гиалуроновую кислоту, жидкие полиолы, поливиниловый спирт, повидон, карбопол и гидроксипропил-гуару. Полимеры, используемые в продуктах для лечения DES имеют относительно короткое время присутствия на поверхности глазного яблока и требуют частого закапывания. Для увеличения времени присутствия на глазе, некоторые составы содержат вазелин или минеральное масло; при этом, из-за значительного размывания эти пастообразные продукты можно использовать только вечером перед сном (Abelson et al., 2008, Tear Substitutes. In: Albert and Miller, eds. Principles and Practices of Ophthalmology, 3rd edition, vol.1. Philadelphia: W.B. Saunders Company, 287-292). Все остальные заменители слезной жидкости нужно закапывать несколько раз в течение дня.
Некоторые потенциальные усовершенствования этих полимеров были раскрыты. Одним из потенциальных усовершенствований можно использовать полимер, который имеет значительные мукоадгезионные свойства с целью увеличения времени присутствия состава на поверхности глаза, без значительного размывания. Хитозан, поликатионный полимер, который получают из природного полимера хитина, хорошо известен своими мукоадгезивными свойствами. Время присутствия на глазе офтальмологических составов, содержащих хитозан может быть увеличено не только благодаря его свойствам увеличения вязкости, но и благодаря взаимодействию хитозана с отрицательно заряженными муцинами на поверхности глазного яблока (Wadhwa, Paliwal et al., 2009, Chitosan and its role in ocular therapeutics, Mini Rev Med Chem(9):1639-1647). Кроме того, хитозан обладает антимикробной активностью в отношении различных патогенных микроорганизмов (Felt, Carrel et al., 2000, Chitosan as tear substitute: a wetting agent endowed with antimicrobial efficacy, J Ocul Pharmaco lTher(16): 261-270; Dai, Tanaka et al., 2011, Chitosan preparations for wounds and burns: antimicrobial and wound-healing effects, Expert Rev Anti Infect Ther(9):857-879).
Было раскрыто тиолирование полимеров для дополнительного увеличения их мукоадгезионных свойств. ЕР 1126881 B1 раскрывает мукоадгезивный полимер, содержащий, по меньшей мере, одну неконцевую тиольную группу. Использование тиолированных полисахаридов для получения имплантата для наращивания тканей описано в заявке WO 2008/077172, в которой указанные тиолированные полимеры характеризуются образованием дисульфидных связей, что приводит к стабилизации полимерной сети. Приоритетная заявка WO 2008/077172, A 2136/2006, раскрывает дополнительные области применения для тиолированных полимеров.
Была раскрыта модификация хитозана путем ковалентного присоединения лигандов, несущих тиоловые группы (т.е. тиолирования). Кроме того, было выявлено, что тиолирование увеличивает мукоадгезивные свойства хитозана (Kast and Bernkop-Schnurch, 2001, Thiolated polymers - thiomers: development and in vitro evaluation of chitosan-thioglycolic acid conjugates, Biomaterials (22): 2345-2352;
Bernkop-Schnurch, Hornof et al., 2004, Thiolated chitosans,Eur J Pharm Biopharm (57):9-17; Bernkop-Schnurch, 2005, Thiomers: a new generation of mucoadhesive polymers ,Adv Drug Deliv Rev (57):1569-1582; Schmitz, Grabovac et al., 2008, Synthesis and characterization of a chitosan-N-acetyl cysteine conjugate, Int J Pharm (347):79-85). Также оценивалась антимикробная эффективность некоторых тиолированных хитозанов (WO2009132226A1; WO2009132227A1; WO2009132228A1; Geisberger, Gyenge et al., 2013, Chitosan-thioglycolic acid as a versatile antimicrobial agent, Biomacromolecules (14):1010-1017).
N-ацетилцистеин (NAC) является производным аминокислоты L-цистеина, несущей тиоловую группу. NAC является восстановителем с антиоксидантной активностью. Он также хорошо известен своей способностью понижать вязкость слизи за счет уменьшения дисульфидных связей муцина. Благодаря этим муколитическим свойствам NAC широко используется для снижения вязкости слизи при бронхолегочных заболеваниях с избыточным продуцированием слизи. Местные офтальмологические составы, содержащие муколитическое и антиоксидантное средство NAC, используются для лечения заболеваний роговицы, таких как дисфункция мейбомиевой железы и DES (Lemp, 2008, Management of dry eye disease, Am J Manag Care (14):S88-101; Akyol-Salman, Azizi et al., 2010, Efficacy of topical N-acetyl cysteine in the treatment of meibomian gland dysfunction, J Ocul Pharmacol Ther (26):329-333). ЕР 0551848 Bl раскрывает глазную фармацевтическую составаю для лечения DES, содержащую NAC в концентрации от 3% до 5% (масс/об) и поливиниловый спирт.
Было выявлено, что тиолирование хитозана с использованием NAC увеличивает его времени присутствия на глазах кролика по сравнению с нетиолированным хитозаном (Dangl, Hornof et al., 2009, In vivo Evaluation of Ocular Residence Time of124I-labelled Thiolated Chitosan in Rabbits Using MicroPET Technology, ARVO Meeting Abstracts(50):3689).
Было выявлено, что N-(N-ацетилцистеинил-)хитозан HCl имеет некоторый положительный эффект на поверхности глазного яблока глаз мыши в моделях сухих глаза на мышах (Hongyok, Chae et al., 2009, Effect of chitosan-N-acetyl cysteine conjugate in a mouse model of botulinum toxin B-induced dry eye, Arch Ophthalmol(127):525-532; Hornof, Goyal et al., 2009, Thiolated Chitosan for the Treatment of Dry Eye-Evaluation in Mice Using the Controlled-Environment Chamber Model, ARVO Meeting Abstracts(50):3663).
Дополнительные публикации, в которых рассматриваются и обсуждаются различные виды использования тиолированных полимеров, перечислены ниже:
Hornof et al., Mucoadhesive ocular insert based on thiolated poly(acrylic acid): development and in vivo evaluation in humans; Journal of Controlled Release 89 (2003) 419-428; Hornof, M., In vitro and in vivo evaluation of novel polymeric excipients in the ophthalmic field, Thesis, University of Vienna, 2003; Bernkop-Schnurch et al., Permeation enhancing polymers in oral delivery of hydrophilic macromolecules: Thiomer/GSH systems, J. Contr. Release 93(2003) 95-103; M. Hornof et al., In Vitro Evaluation of the Permeation Enhancing Effect of Polycarbophil-Cystein Conjugates on the Cornea of Rabbits, J. Pharm. Sci. 91 (12) 2002, 2588-2592; and Clausen et al., The Role of Glutathione in the Permeation Enhancing Effect of Thiolated Polymers, Pharm. Res. 19 (5) 2002, 602-608; Yamashita et al., Synthesis and Evaluation of Thiol Polymers, J. Macromol.Sc. 26 (1989), 9, 1291-1304; Zheng et al., Disulfide Cross-Linked Hyaluronan Hydrogels, Biomacromolecules 3 (6) 2002, 1304-1311; Wang et al., Chitosan-NAC Nanoparticles as a Vehicle for Nasal Absorption Enhancement of Insulin, J. Biomed Mater Res Part B: Appl Biomater 88B: 150-161, 2009; WO 2008/094675 A2; US 5 412 076 A.
Тем не менее, до сих пор не был раскрыт состав, содержащий тиолированный хитозан, который отвечает требованиям долгосрочной стабильности, переносимости, безопасности, эффективности при лечении синдрома сухих глаз и улучшения соблюдения пациентом режима и схемы лечения. Из-за неэффективности и неудобства существующих способов лечения сухих глаз сохраняется потребность в способе лечения синдрома сухих глаз, который удовлетворяет требованиям, указанным выше.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к водному офтальмологическому раствору, содержащему тиолированный хитозан. Более конкретно, настоящее изобретение относится к стерильному водному офтальмологическому раствору, содержащему от около 0,05% до около 0,5% (масс./масс.) N-(N-ацетилцистеинил-) хитозан или его фармацевтически приемлемую соль, в растворе-носителе, в котором с N-(N-ацетилцистеинил-) хитозан имеет содержание свободных тиоловых групп в количестве от около 80 мкмоль/г полимера до около 280 мкмоль/г полимера.
Настоящее изобретение, кроме того, относится к контейнеру, содержащему указанный водный офтальмологический раствор.
Настоящее изобретение также относится к конкретному применению указанного водного офтальмологического раствора для профилактики или лечения признаков и/ или симптомов синдрома сухих глаз. Соответственно, настоящее изобретение также относится к способу лечения указанных заболеваний и симптомов у пациента, нуждающегося в таком лечении. Способ включает сначала стадию идентификации индивидуума, страдающего от синдрома сухих глаз или симптомов сухих глаз, а затем введения индивидууму эффективного количества водного офтальмологического раствора, содержащего N-(N-ацетилцистеинил-)хитозан или его фармацевтически приемлемую соль.
В частности, настоящее изобретение пригодно для лечения признаков и/ или симптомов сухости глаз, вызванных или связанных с одним или несколькими из сухого кератоконъюнктивита (KCS), связанной с возрастом сухости глаз, синдрома Стивенса-Джонсона, синдрома Шегрена, рубцовой пузырчатки глаз, повреждения роговицы, инфекции, синдрома Райли-Дей, врожденной алакримии, лечения PRK, LASEK и/или LASIK, аллергического конъюнктивита, блефарита и дисфункции мейбомиевых желез, нарушения или недостаточности питания (в том числе нехватка витаминов), фармакологических побочных эффектов, нарушения желез и тканей, аутоиммунных и других иммунодефицитных расстройств, а также неспособности коматозных пациентов моргать. Также включенными являются симптомы сухих глаз, вызванных проникновением в окружающую среду взвешенных в воздухе частиц, дыма, смога, и чрезмерно сухого воздуха; а также непереносимость контактных линз и стресс глаз, вызванный работой за компьютером или компьютерными играми.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показано сравнение устойчивости свободных тиоловых групп в водном офтальмологическом растворе, содержащем 0,1% (масс/масс) N-(N-ацетилцистеинил-)хитозан.HCl, при долговременном хранении при 25°С и 40% относительной влажности с использованием различной упаковки, как описано в Примере 3. Серые полосы изображают содержание тиольных групп в различные моменты времени (начальная точка, 1 месяц, 2 месяца, 3 месяца, 6 месяцев, 9 месяцев и 12 месяцев) при хранении в 1-й группе (Упаковка и хранение с поглотителем кислорода), белые столбики изображают стабильность тиольных групп в группе 2 (Упаковки и хранение без поглотителя кислорода).
На Фигуре 2 показана стабильность свободных тиоловых групп в водном офтальмологическом растворе, содержащем 0,1% (масс/масс) N-(N-ацетилцистеинил-)хитозан.HCl во время кратковременного хранения единичных однократных доз в условиях окружающего воздуха, влажности и температуры в течение 30 дней, как описано в примере 4.
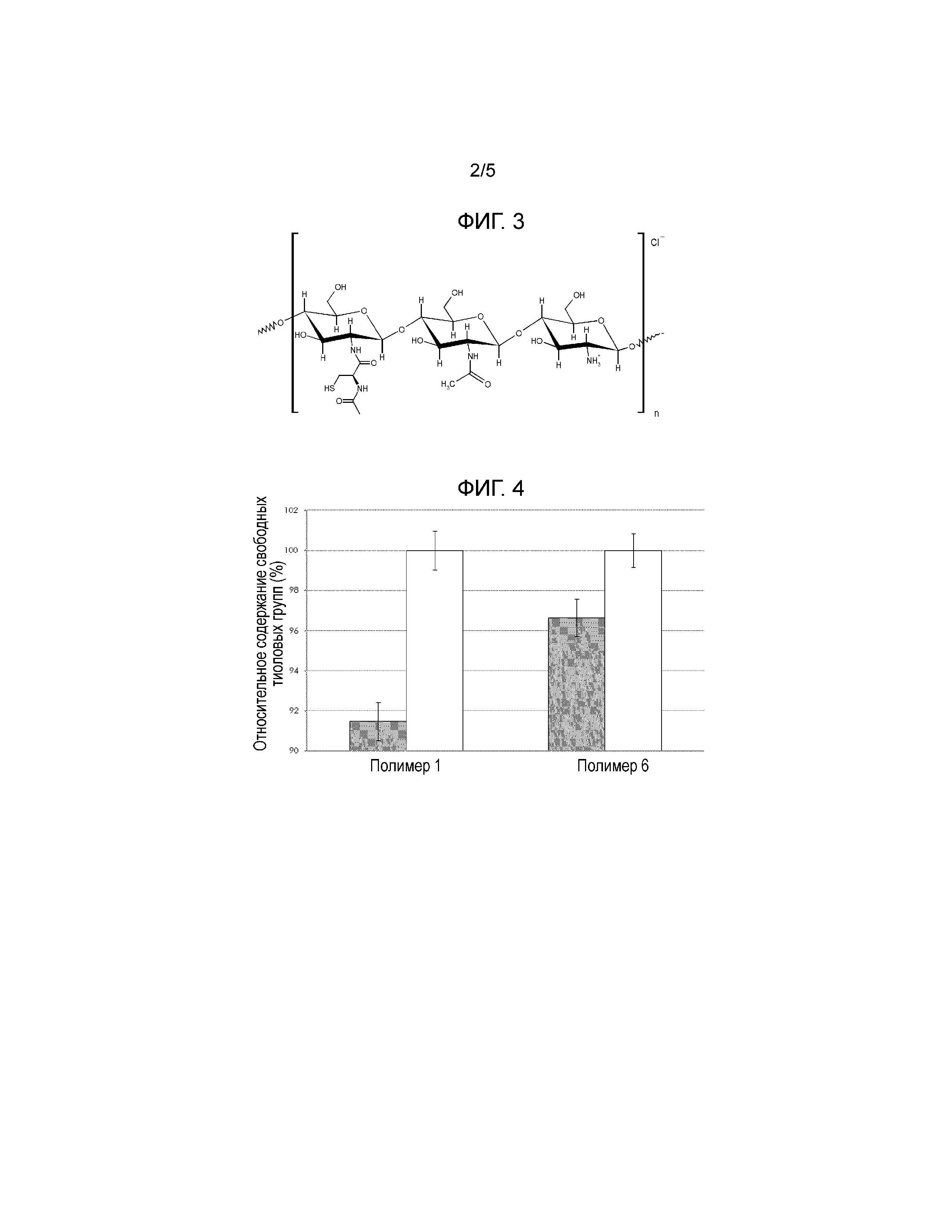
На Фигуре 3 показан схематический чертеж субструктуры N-(N-ацетилцистеинил-)хитозана.HCl.
На Фигуре 4 показаны результаты определений тиоловых групп (без ТСЕР: серые столбцы, после восстановления ТСЕР: белые столбцы; средние значения 3-х измерений со стандартными отклонениями) полимера 1 и полимера 6, которые были синтезированы, как описано в примере 6, и проанализированных как описано в примере 7.
На Фигуре 5 показаны результаты определения динамической вязкости (без ТСЕР: серые столбцы, после восстановления ТСЕР: белые столбцы) 0,5% (масс/масс) раствора полимера 1 и полимера 6, синтезированных, как описано в пример 6 и проанализированных, как описано в примере 7.
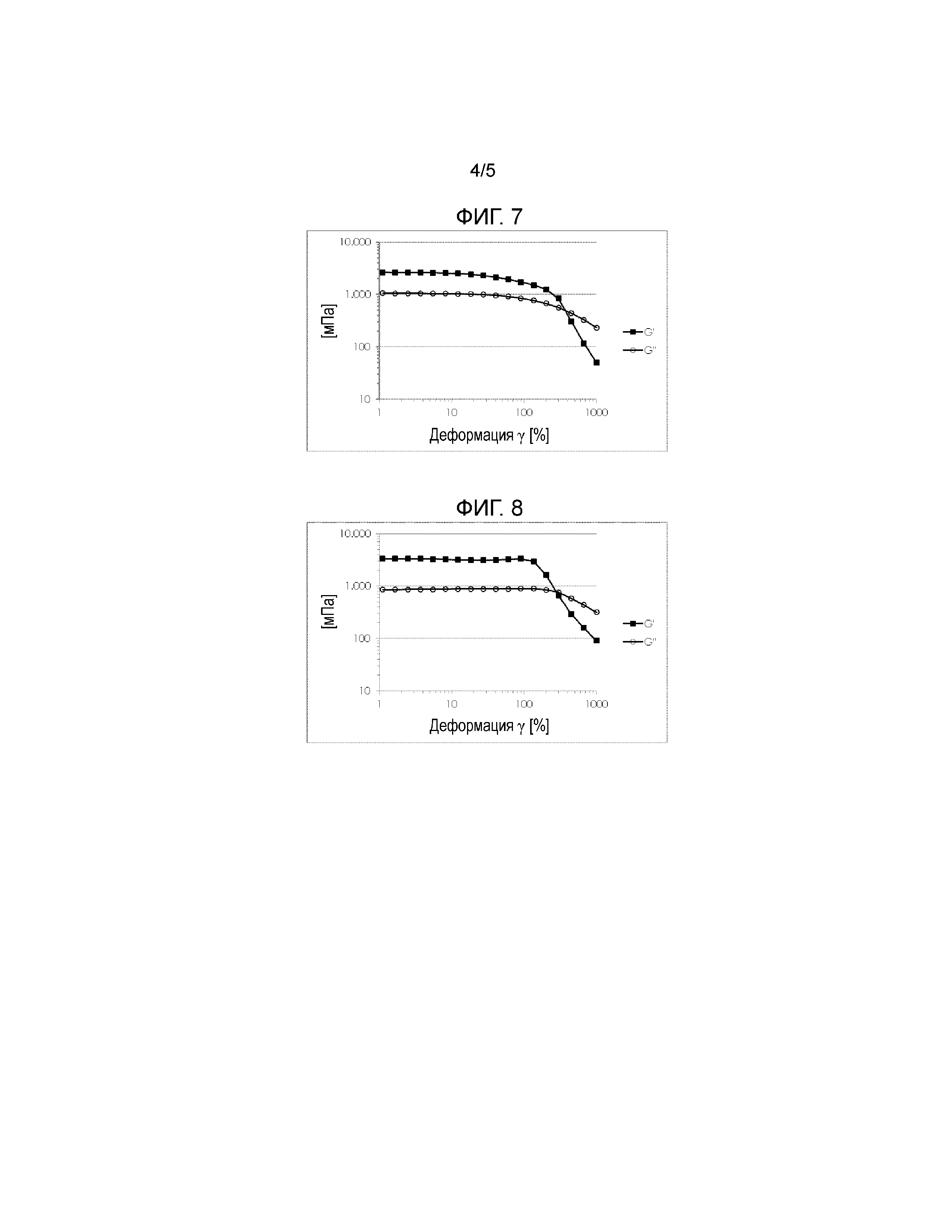
Фигуры 6, 7 и 8 показывают определение линейного диапазона вязкоупругости N-(N-ацетилцистеинил-)хитозана. HCl- сети муцина.
На Фигуре 9 показана расчетная площадь под значениями кривой (0-96ч), полученными из индивидуальных концентрационных кривых особенностей времени-радиоактивности глаз, обработанных124I-хитозан-NAC,124I-хитозан. HCl и Na124I, соответственно.
Фигура 10 показывает площадь под значениями кривой (AUC) (0-72ч), рассчитанными из индивидуальных концентрационных кривых особенностей времени-радиоактивности (% AD*ч/г) глаз, обработанных124I-хитозан-NAC и124I-меченым тиолированным гиалуронаном (HA-цистеамин).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно открыли стабильный офтальмологический раствор, которое является эффективным при лечении синдрома сухих глаз или для улучшения одного или более признаков и/или симптомов сухих глаз у пациентов, страдающих от синдрома сухих глаз, и/или улучшения качества слезной пленки у пациентов с заболеванием сухим глаз. Стерильный водный офтальмологический раствор по настоящему изобретению содержит от приблизительно 0,05% до приблизительно 0,5% (масс./ масс.) N-(N-ацетилцистеинил-)хитозана или его фармацевтически приемлемой соли в растворе-носителе, в котором N-(N-ацетилцистеинил-)хитозан имеет содержание свободных тиоловых групп в количестве от около 80 мкмоль/г полимера до около 280 мкмоль/г полимера. В предпочтительном варианте в качестве фармацевтически приемлемой соли используют хлористоводородную соль.
В дальнейшем термин "хитозан-NAC" означает как N-(N-ацетилцистеинил-)хитозан, так и его фармацевтически приемлемые соли.
Способ по настоящему изобретению представляет собой усовершенствование наиболее распространенного в настоящее время способа лечения заболевания сухих глаз - искусственные слезы (например, физиологический раствор или растворы, содержащие полимеры) и противовоспалительные средства (циклоспорин).
Настоящее изобретение пригодно для лечения любого синдрома сухих глаз. В широком смысле, синдром сухих глаз или заболевание сухих глаз, как относящиеся к настоящему изобретению, может представлять собой любой синдром, связанный с нестабильностью слезной пленки и/ или дисфункции (например, увеличенные слезные испарения и/ или пониженная секреция воды).
В частности, настоящее изобретение пригодно для лечения заболеваний сухих глаз, вызванных или связанных с одним или несколькими из сухого кератоконъюнктивита (KCS), связанной с возрастом сухости глаз, синдрома Стивенса-Джонсона, синдрома Шегрена, рубцовой пузырчатки глаз, повреждения роговицы, инфекции, синдрома Райли-Дей, врожденной алакримии, лечения PRK, LASEK и/или LASIK, аллергического конъюнктивита, блефарита и дисфункции мейбомиевых желез, нарушения или недостаточности питания (в том числе нехватка витаминов), фармакологических побочных эффектов, нарушения желез и тканей, аутоиммунных и других иммунодефицитных расстройств, а также неспособности коматозных пациентов моргать. Также включенными являются симптомы сухих глаз, вызванных проникновением в окружающую среду взвешенных в воздухе частиц, дыма, смога, и чрезмерно сухого воздуха; а также непереносимость контактных линз и стресс глаз, вызванный работой за компьютером или компьютерными играми.
Как указано в предпосылках, существуют и другие болезни, которые имеют высокую степень коморбидности с болезнью сухих глаз: аллергический конъюнктивит (сезонный и хронический), блефарит и дисфункция мейбомиевых желез. Эти условия влияют на качество и стабильность слезной пленки, что приводит к признакам и симптомам сухих глаз.
Процедуры лазерной коррекции зрения, такие как фоторефрактивная кератектомия (PRK), лазерная суб-эпителиальная кератэктомия (LASEK) и лазерный кератомилез (LASIK) также отрицательно влияют на функциональность слезной пленки и часто вызывают (временное) заболевание сухих глаз.
Данный способ лечения включает стадии: (I) идентификации индивидуума, страдающего от сухого заболевания глаза; и (II) введения в глаз индивидуума водного офтальмологического раствора, содержащего водный офтальмологический раствор, содержащий хитозан-NAC; в котором указанное заболевание сухих глаз вызвано или связано с одним или несколькими из заболеваний, синдромов и стресс-факторов, упомянутых выше.
Одним существенным преимуществом составаи по настоящему изобретению является то, что, после однократного закапывания на глаз индивидуума хитозан-NAC оказывает восстановительное действие на толщину слезной пленки в течение срока до 24 часов. Это означает, что индивидуум не должен постоянно закапывать продукт в глаза, как было бы необходимо для слезной заместительной терапии, например, при использовании искусственных слез. Суточная местная доза водного офтальмологического раствора хитозана-NAC, эффективного для уменьшения симптомов недостаточного увлажнения глаз и/ или улучшения состава слезной пленки, могут быть разделены между одной или несколькими введениями единичной дозы. Индивидуум применяет продукт по мере необходимости, однако это, как правило, не превышает двух раз в день, и во многих случаях продукт будет использоваться только один раз в день. Предпочтительным режимом для раствора с хитозаном-NAC по настоящему изобретению является одна капля 0,1% (масс./масс.) раствора в каждый глаз один раз в день. Таким образом, существенным преимуществом состава по настоящему изобретению является то, что он может представлять собой продукт для применения один раз в день и обеспечит лучшее соблюдение пациентом режима и схемы лечения.
После лечения способами по настоящему изобретению один или более признаков и/или симптомы сухих глазных уменьшаются или облегчены в индивидууме. Симптомы сухих глаз включают сухость, жжение, зуд в глазу, глазной дискомфорт, светобоязнь, ощущение инородного тела, расплывчатое зрение, зернистость и нарушение и/ или потерю зрения, в том числе нечеткость зрения, снижение скорости чтения, светобоязнь и потеря остроты зрения. Признаки сухих глаз оцениваются по результатам измерений, таких как: окрашивания роговицы и/ или конъюнктивы (с использованием флуоресцеина, лиссамина зеленого или красителя бенгальского розового), тестирование полосы Ширмера, нити Zone-Quick, осмолярность слезной пленки, время распада слезной пленки и высота слезного мениска.
Одной из причин улучшения признаков и/или симптомов DES с применением состава по настоящему изобретению, возможно, является восстанавливающее действие препарата на толщину слезной пленки глаза, которое может быть вызвано химическим взаимодействием тиолированного хитозана с муцинами глазной поверхности или наличие защитного покрытия на поверхности глазного яблока, которое образуется в результате сшивания хитозан-NAC после нанесения на поверхность глазного яблока, или комбинация обоих эффектов. «Эффективное количество» содержащего полимер хитозан-NAC водного офтальмологического раствора, вводимого индивидууму, является количество, эффективное для уменьшения клинических признаков и/ или симптомов заболевания сухих глаз. Эта количество включает от приблизительно 0,05% до приблизительно 0,5% (масс/масс) полимера хитозан-NAC в растворе-носителе.
В количестве менее 0,05% хитозан-NAC находится в такой низкой концентрации, что никакого клинического эффекта у пациента не наблюдается. При значительном превышении 0,5% переносимость пациента начинает падать и любые усиливающие проникновение эффекты хитозана являются более выраженными. Концентрация хитозана-NAC в водном офтальмологическом растворе предпочтительно составляет от 0,05 до 0,3% (масс/масс), более предпочтительно от 0,05 до 0,2% (масс/масс), наиболее предпочтительно от 0,08 до 0,16% (масс/масс). При концентрации намного ниже 0,05% мукоадгезивные свойства и, следовательно, клинический эффект не являются столь выраженными. При концентрации, значительно превышающей 0,3%, высокая вязкость состава хитозан-NAC приводит к образованию "сгустков" после глазного применения и раствор не так равномерно распределяется на поверхности глазного яблока. Растворы хитозан-NAC в диапазоне концентраций от 0,05% до 0,3% равномерно распределяются по поверхности глазного яблока, как показали исследования in vivo с иод124 радиоактивно меченым хитозаном-NAC (смотри примеры 9 и 10). Концентрация хитозана-NAC в водном офтальмологическом растворе, наиболее предпочтительно, составляет примерно 0,1%, поскольку как клинический эффект, так и переносимость пациента являются оптимальными.
Большой процент тиоловых групп, связанных с хитозаном-NAC, которые присутствуют в водном офтальмологическом растворе, должен быть в виде свободных тиоловых групп, то есть, не подвергнутых перекрестному сшиванию тиолов, как это определено ниже. Важно, что большинство из этих тиоловых групп остаются свободными, с тем, чтобы реагировать только при помещении на поверхность глазного яблока. В некоторых случаях количество свободных тиоловых групп может быть достаточно низким, и все же обеспечивает некоторое фармацевтическое преимущество для глаз, при закапывании. Тем не менее, предпочтительно, чтобы полимер хитозан-NAC в составе по настоящему изобретению имел содержание свободных тиоловых групп в количестве от примерно 80 мкмоль/г полимера до 280 мкмоль/г полимера; предпочтительно с диапазоном свободных тиоловых групп около 105 мкмоль/г полимера до 250 мкмоль/г полимера, более предпочтительно от 110 мкмоль/г полимера до 250 мкмоль/г полимера и наиболее предпочтительно от предпочтительно 140 до 250 мкмоль/г полимера.
При концентрации свободных тиоловых групп значительно ниже 80 мкмоль/г полимера взаимодействия между хитозаном-NAC и муцином являются слабыми и сравнимы с активностью немодифицированного хитозана НСl, однако при очень высоких концентрациях свободных тиоловых групп 300 мкмоль/г и более, физико-химические свойства полимерного ядра хитозана изменяются до такой степени, что полимер не является полезным для получения водного офтальмологического раствора из-за его редуцированного катионного характера и ограниченной растворимости в воде.
Это количество свободных тиоловых групп, иммобилизованных на хитозан-NAC должен присутствовать, когда глазная составая по настоящему изобретению, готов к использованию в глазах сухой больного глаза. Это означает, что свободные тиольные группы, присутствующие в водном растворе офтальмологической настоящего изобретения должны выжить относительно длительного времени хранения. Таким образом, полученный в результате сухой продукт глаз должен быть стабильным и сохранить вышеуказанные свободных тиоловых групп, по крайней мере, около 12 месяцев, более предпочтительно, по меньшей мере, около 18 месяцев, и еще более предпочтительно, по меньшей мере, около 24 месяцев.
Количество свободных тиоловых групп, иммобилизованных на хитозан-NAC в водном офтальмологическом растворе, может быть определено специалистом в данной области известным способом, таким как с помощью ресредства Эллмана (смотри пример 1).
В дополнение к тому, что большое количество свободных тиоловых групп на полимере хитозан-NAC в водном офтальмологическом растворе имеет важное значение, низкое количество сшитых тиолов (дисульфиды) в полимере хитозан-NAC в растворе по настоящему изобретению является также предпочтительным. Во время приготовления и хранения водного офтальмологического раствора могут возникать сшивки тиоловых групп, иммобилизованных на хитозане-NAC. Низкое количество сшитых тиолов, присутствующих в составе, является предпочтительным параметром состава полимерна хитозан-NAC по настоящему изобретению.
Таким образом, в соответствии с предпочтительным вариантом осуществления настоящего изобретения количество сшитых тиоловых групп в N-(N-ацетилцистеинил-)хитозане составляет 30% или менее от общего количества тиоловых групп в них, предпочтительно 25% или менее, наиболее предпочтительно 15% или менее.
В частности, в этом предпочтительном варианте осуществления количество сшитых тиоловых групп в N-(N-ацетилцистеинил-)хитозане составляет 30% или менее от общего количества тиоловых групп в них, предпочтительно 25% или менее, наиболее предпочтительно 20% или меньше после хранения раствора в течение, по меньшей мере, 12 месяцев при комнатной температуре.
Если количество сшитых тиоловых групп, присутствующих в формуле было слишком высоко, то свойства водного офтальмологического раствора может изменяться за пределами требуемых параметров, например, вязкость водного офтальмологического раствора может стать слишком высокой, чтобы быть пригодным для глазных капель.
Как объяснено ниже более подробно, было обнаружено, что возможно производить хитозан-NAC, тиоловые группы которого не сшиты или только в минимальной степени являются сшитыми, например, с количеством сшитых тиоловых групп менее чем 5%, предпочтительно 4% или менее от общего количества тиоловых групп. Особенно, если такой хитозан-NAC используется для изготовления офтальмологического раствора по настоящему изобретению, свободные тиольные группы, как правило, стабильны в течение всего жизненного цикла раствора:
Таким образом, было обнаружено, что при использовании такого хитозан-NAC в процессе производства препарата увеличение сшитых тиоловых групп составляет <10% от количества свободных тиоловых групп, первоначально присутствующих в исходном веществе хитозан-NAC. Кроме того, при хранении раствора в течение 12 месяцев или даже до 18 месяцев, увеличение сшитых тиоловых групп составляет <15% от количества свободных тиоловых групп, первоначально присутствующих в составе. И, наконец, даже если второй контейнер раствора (как определено ниже), который обеспечивает барьер для кислорода, открыт, через 30 дней после вскрытия увеличение сшитых тиоловых групп составляет <15% от количества свободных тиоловых групп, первоначально присутствующих в составе перед вскрытием.
По существу офтальмологический состав тиолированного хитозана по настоящему изобретению изготавливают в соответствии со следующими этапами:
1. Хитин выделяют из панцирей ракообразных, таких как панцири креветок или крабов-стригунов
2. Хитозан получают из хитина путем химического процесса, который хорошо известен в данной области техники, как, например щелочное деацетилирование;
3. Хитозан тиолируют путем ковалентного присоединения тиол-несущего лиганда, например, с использованием N-ацетилцистеина, как установлено в настоящем документе;
4. Хитозан-NAC затем составляют в виде водного офтальмологического раствора, как изложено в настоящем описании; и
5. Водный офтальмологический раствор, содержащий хитозан-NAC, затем помещают в подходящий контейнер, который обеспечивал бы его стабильность, как изложено в настоящем документе.
Как подробно описано в настоящем документе, хитозан химически представляет собой поликатионный биополимер с подходящими биологическими свойствами, такими как высокая биосовместимость и низкая токсичность. Источник исходного вещества для производства хитозана для состава по настоящему изобретению не имеет решающего значения при условии, что полученный в результате хитозан является достаточно чистым и свободным от примесей. Например, хитозана может быть также получен из источника, отличного от животного источника. Хитозан по настоящему изобретению можно обрабатывать различными способами, при условии, что хитозан обладает свойствами, необходимыми и изложенными в настоящем описании. Чаще всего, исходное вещество для хитозана происходит из хитина из оболочек ракообразных. Хитин может быть получен при добыче пищевых источников ракообразных, таких как омары, крабы и креветки. Одним из предпочтительных источником исходного вещества хитина для хитозана, обрабатываемого и используемого в составе в соответствии с настоящим изобретением, являются оболочки краба-стригуна (Chionoecetes opilio). Различные источники ракообразных могут быть использованы при получении хитина для получения хитозана, при условии, что источник является подходящим. Получение хитозана из сырья биологических источников хорошо известны и описаны в многочисленных научных публикациях, например (Chang, Tsaietal., 1997, Heterogeneous N-deacetylation of chitin in alkaline solution, Carbohydr Res (303):327-332; Dutta, Dutta et al., 2004, Chitin and chitosan: Chemistry,properties and applications,JSciIndRes(63):20-31).
Хитозан-NAC можно синтезировать путем взаимодействия хитозана с лигандом, несущим тиольную группу. Способы тиолирования раскрыты в многочисленных научных публикациях, например (Seki, Aoi et al., 1999, Partially deacetylated chitin or chitosan derivative with selectively substituted free amino group by amino acid and peptide and having substantially no substituted hydroxide group, and its manufacture, JP2000-302803; Bernkop-Schnurch, Hornof et al., 2004, Thiolated chitosans, Eur J Pharm Biopharm (57): 9-17; Schmitz, Grabovac et al., 2008, Synthesis and characterization of a chitosan-N-acetyl cysteine conjugate, Int J Pharm (347): 79-85; Zhu, Su et al., 2012, Synthesis of thiolated chitosan and preparation nanoparticles with sodium alginate for ocular drug delivery, Mol Vis (18): 1973-1982).
Хитозан-NAC, используемый в настоящем изобретении, должен быть растворим в воде в интервале концентраций, подходящих для подготовки водного офтальмологического раствора, и полученные растворы должны быть прозрачными и бесцветными. Образование соли хитозана-NAC с органическими или неорганическими кислотами повышает растворимость хитозана в воде. Подходящие соли тиолированной хитозана по настоящему изобретению включают любые фармацевтически приемлемые соли с органическими кислотами, такими как уксусная, лимонная, муравьиная и винная кислоты, а также неорганическими кислотами, такие как НСl и H2SO4. Гидрохлоридная соль хитозан-NAC представляет собой предпочтительный вариант осуществления настоящего изобретения.
Важно то, что используются такие пути реакции и условия реакции, что после синтеза и очистки, по существу, все тиольные группы, иммобилизованные на цепи хитозана, присутствуют в свободной форме, а не в сшитом виде, как дисульфиды, т.е. сшиты лишь в минимальной степени. Практически все присоединенные тиолы в тиолированном хитозане по настоящему изобретению находятся в виде свободных тиоловых групп, т.е. они не сшиты. Минимальное количество сшивок в процессе синтеза приемлемо только до тех пор, пока вязкость тиолированного хитозана остается в пределах указанных параметров, и его растворимость в воде является достаточной для получения водного офтальмологического раствора.
Было установлено, что можно изготовить хитозан-NAC с очень низкjq или даже нулевой степенью сшивания тиоловых групп, подвергая хитозан-NAC действию восстанавливающего средства после его синтеза, например, после щелочного гидролиза тиоацетиловых функциональных групп. Восстанавливающее средство может быть выбрано из группы, включающей DTT, TCEP или NaBH4, причем NaBH4 является предпочтительным. Кроме того, было обнаружено, что стадию восстановления следует проводить при повышенной температуре, такой как 30°C или более, или предпочтительно 40°C или более. Кроме того, большие количества восстанавливающих средств должны быть использованы, например, при стехиометрическом соотношении восстанавливающего средства к основному полимеру хитозана 2:1 или более.
Полимеры хитозан-NAC со степенью сшитых тиоловых групп менее 5%, предпочтительно 4% или менее от общего количества тиоловых групп могут быть синтезированы в соответствии с этим вариантом осуществления.
Вязкость в водном растворе конечного хитозана-NAC по настоящему изобретению предпочтительно находится в пределах определенного диапазона, и авторы настоящего изобретения неожиданно обнаружили, что вязкость хитозана-NAC падает только в пределах этого предпочтительного диапазона, если в процессе получения хитозана-NAC хитозан-NAC обрабатывается при определенных условиях и в пределах определенных параметров, в частности, в соответствии с условиями восстановления, указанными выше, что приводит к полимерам, которые являются сшитыми лишь в минимальной степени. Вязкость полученного продукта предпочтительно находится в пределах приемлемого диапазона так, что хитозан-NAC будет наиболее полезным в полученном в результате составе глазных капель. Таким образом, кинематическая вязкость (0,5% в воде при 25°C) полимера хитозана-NAC, предпочтительно находится в интервале от примерно 1 до 15 мм2/с, более предпочтительно в диапазоне от около 2 до 10 мм2/с. Если вязкость слишком высока, то полезный раствор глазных капель не может быть сделан с предпочтительным диапазоном концентрации хитозана-NAC в составе, поскольку полимер остается в виде нерастворимой вязкой массы в контейнере.
Хитозан-NAC должен быть очищен, чтобы быть полезным в составе по настоящему изобретению (например, после описанной выше стадии №3 и, в особенности, после обработки хитозана-NAC восстанавливающим средством). Хитозан-NAC следует промывать таким образом, что полученный продукт был чистым. Один известный способ описан в Kast and Bernkop-Schnurch, 2001, Thiolated polymers - thiomers: development and in vitro evaluation of chitosan-thioglycolic acid conjugates, Biomaterials (22): 2345-2352.
Другим способом было бы промывание хитозана-NAC полярными растворителями с последующей сушкой с целью удаления растворителей. Одним предпочтительным растворителем является изопропиловый спирт, так как он не токсичен, легко доступен и экономичен, однако другие растворители и другие, отличные от изопропилового спирта спирты могли бы работать. Это промывание можно повторять по мере необходимости, в зависимости от объема растворителя, используемого каждый раз. Предпочтительно, стадию промывки и сушки повторяют, по меньшей мере, один раз.
Стадию сушки можно проводить при комнатной температуре и при стандартной влажности, но этот процесс может потребовать очень много времени. Таким образом, процесс сушки предпочтительно проводят при повышенной температуре и/или при пониженном давлении. Сушку хитозана-NAC предпочтительно проводят при повышенной температуре, по меньшей мере, от примерно 40°C С до примерно 70°C и, предпочтительно, по меньшей мере, около пяти часов. Более предпочтительно, процесс сушки проводят при температурах, по меньшей мере, от примерно 50°C С до примерно 60°C в течение от приблизительно 10 до 24 часов. Один предпочтительный способ многостадийной очистки состоит в промывке полимера хитозан-NAC трижды изопропиловым спиртом и извлечении твердого вещества центрифугированием с последующей сушкой при температуре примерно 60°C в течение приблизительно от 15 до 20 часов.
Водный офтальмологический раствор по настоящему изобретению может содержать, по меньшей мере, один офтальмологический совместимый наполнитель. Можно использовать любой подходящий наполнитель, например, для регулирования тоничности, вязкости раствора или для стабилизации рН, для увеличения растворимости активного ингредиента, для увеличения комфорта глаза после нанесения или для стабилизации состава в целом.
Значение рН водного офтальмологического раствора регулируют добавлением любых физиологически и офтальмологически приемлемых регулирующих рН кислот, оснований или буферов, чтобы иметь рН в диапазоне от приблизительно 5,5 до приблизительно 7. Значение рН намного ниже приблизительно 5,5, будут вне физиологически приемлемых параметров (раствор вызовет серьезную жгучую боль или жжение в глазу). При рН намного выше 7 образование стабильного раствора хитозана-NAC, в котором он не выделяется из раствора, затруднено. Таким образом, из-за легкости составления устойчивого раствора, рН ниже 7 является предпочтительным. Предпочтительный рН водного офтальмологического раствора по настоящему изобретению составляет от около 5,8 до около 6,8, наиболее предпочтительный рН от 6,0 до 6,6.
Примеры подходящих кислот, используемых в составе по настоящему изобретению, включают соли уксусной, борной, лимонной, молочной, фосфорной, соляной и тому подобное, а примеры оснований включают гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат, трометамин, THAM (трисгидрометиламинометан) и тому подобное. Предпочтительный вариант осуществления настоящего изобретения представляет собой борную кислоту и систему натрийборатного буфера, который также содержит полиол, такой как маннит, чтобы увеличить емкость буфера в наиболее предпочтительном интервале рН от 6,0 до 6,6.
Примеры подходящих наполнителей, используемых в составе по настоящему изобретению для повышения стабильности состава, включают динатриевую соль этилендиаминтетрауксусной кислоты (Na2-ЭДТА), метабисульфит натрия, маннит, полиэтиленгликоль и тому подобное.
Осмоляльность местного офтальмологического состава по настоящему изобретению обычно составляет от примерно 150 до примерно 400 миллиосмоляров (мОсм), более предпочтительно от около 200 до около 350 мОсм, с наиболее предпочтительной осмоляльностью от около 250 до около 330 мОсм. Осмолярность можно регулировать с помощью соответствующего количества физиологически и офтальмологически приемлемого ионного или неионного средства. Хлорид натрия является общим осмотическим средством. Эквивалентные количества одной или нескольких солей, состоящих из катионов, таких как калий, аммоний и т.п., и анионов, таких как хлорид, цитрат, аскорбат, борат, фосфат, бикарбонат, сульфат, тиосульфат, бисульфат и тому подобное могут быть использованы в дополнение или вместо хлорида натрия для достижения осмолярности в вышеуказанном диапазоне. Кроме того, неионные средства, такие как маннит, декстроза, сорбит, глицерин, глюкоза и тому подобное, также могут быть использованы для регулировки осмолярности. Хлорид натрия и маннит являются предпочтительными средствами для регулировки осмотического давления.
Офтальмологический состав может содержать смазывающие вещества, чтобы обеспечить высокий уровень комфорта глаза, подходящий для регулярного применения, необходимые для лечения DES. Существует много типов смазывающих средств, таких как поливинилпирролидон, поливиниловый спирт, жидкие полиолы, гиалуроновая кислота и их фармацевтически приемлемые соли, лубрицином и производные целлюлозы; однако предпочтительными средствами являются полиэтиленгликоль и гидроксипропилцеллюлоза (НРМС).
В предпочтительном варианте осуществления офтальмологический раствор по настоящему изобретению содержит следующие наполнители в дополнение к гидрохлориду N-(N-ацетилцистеинил-)хитозана:
Борную кислоту в количестве от 1,0 до 16,0 мг/мл, предпочтительно от 8 до 16 мг/мл;
Полиэтиленгликоль 400 в количестве от 0,01 до 5,0 мг/мл, предпочтительно от 1 до 5 мг/мл; Na2-ЭДТА, в количестве от 0,01 до 0,5 мг/мл;
Маннит в количестве от 0,01 до 5,5 мг/мл, предпочтительно от 0,1 до 4 мг/мл;
Хлорид натрия в количестве от 0,01 до 9 мг/мл, предпочтительно от 1 до 3 мг/мл; и
Гидроксипропилметилцеллюлозу в количестве от 0,01 до 20 мг/мл, предпочтительно от 1 до 3мг/мл.
Офтальмологический раствор по настоящему изобретению должен быть стерильным и может быть стерилизован любым подходящим способом. Один конкретный предпочтительный способ стерилизации представляет собой стерильную фильтрацию. Офтальмологический раствор по настоящему изобретению может содержать консерванты, такие как хлорид бензалкония, хотя это менее предпочтительно.
Водный офтальмологический раствор, содержащий хитозан-NAC, можно вводить в глаз пациента с помощью любых подходящих средств для местного применения. Предпочтительно они представляют собой водный раствор глазных капель. Этот раствор может быть в контейнере для одноразового использования, который является стерильным до тех пор, пока не вскрыт, и, таким образом, не должен иметь консервант, или он может быть в виде многофункционального контейнера, который остается стерильным после вскрытия, или в многофункциональном контейнере с препаратом, содержащим консервант.
Тиоловые группы полимеров хитозан-NAC имеют тенденцию к образованию дисульфидных связей в водных растворах, тем самым уменьшая мукоадгезивные свойства хитозана-NAC. Было обнаружено, что эта тенденция зависит от присутствия кислорода в водном офтальмологическом растворе.
Было обнаружено, что можно стабилизировать свободные тиоловые группы хитозана-NAC, используемого в соответствии с настоящим изобретением, в водном растворе, тем более при хранении раствора в условиях отсутствия кислорода, или, по существу, свободных от кислорода условиях. Бескислородная атмосфера может представлять собой атмосферу азота, вакуумную атмосферу или атмосферу, состоящую из благородных газов.
Поэтому, когда раствор помещают в контейнер, это должно быть сделано, таким образом, в отсутствие кислорода. Кроме того, после того как контейнер заполнен водным офтальмологическим раствором согласно настоящему изобретению, он должен оставаться бескислородным. Таким образом, настоящее изобретение также относится к контейнеру, который поддерживает водный офтальмологический раствор свободным от кислорода во время хранения. Соответственно, один аспект настоящего изобретения включает в себя, по существу, не содержащий кислорода контейнер, содержащий водный офтальмологический раствор. В качестве "по существу не содержащий кислорода" следует понимать атмосферу с количеством кислорода 1,5% или менее. Концентрация растворенного кислорода в растворе в процессе производства препарата и разлива в контейнеры составляет ниже 1,0 мг/л, более предпочтительно ниже 0,5 мг/л, еще более предпочтительно в диапазоне от 0,1 мг/л.
В предпочтительном варианте осуществления контейнер выполнен из материала, который является непроницаемым для кислорода, так что после заполнения офтальмологический раствор остается, по существу, свободным от кислорода в течение длительного периода времени. Такие контейнеры могут являться стеклянными или эмалированными полимерами, металлическими или облицованными металлом полимерами. В другом предпочтительном варианте осуществления контейнер выполнен из полимера, который имеет содержащийся в нем поглотитель кислорода, который предотвращал бы от попадания кислорода в раствора через стенки контейнера. Такие поглотители кислорода включают соли железа, сульфиты, аскорбиновую кислоту, ненасыщенные соли жирных кислот, металл-полиамидные комплексы или системы, основанные на палладии/H2. Например, WO 09/32526 описывает пленку, имеющую активный слой кислородного барьера, содержащий удаляющую кислород композицию, смешанную с термопластичной смолы, имеющий углерод-углеродные двойные связи, по существу, в своей основной цепи, соль металла переходной валентности и не пропускающего кислород полимера со свойствами кислородного барьера.
Кроме того, сам контейнер может быть изготовлен из газонепроницаемого материала с внедренным поглотителем кислорода и безвоздушным запорным устройством.
В предпочтительном варианте осуществления, предусмотрен первый контейнер, содержащий офтальмологический раствор и второй контейнер, содержащий указанный первый контейнер.
Так, например, контейнер, который содержит офтальмологический раствор по настоящему изобретению, сам содержится внутри газонепроницаемого саше или мешочка. В частности, саше или мешочек, изготовленный из алюминия или алюминиевого ламината или алюминиевой композиции, может содержать в нем один или более суб-контейнеров (например, "первых контейнеров"), содержащих офтальмологический раствор в соответствии с изобретением. Второй контейнер, т.е. саше или мешочек может также содержать дополнительный поглотитель кислорода (например, PKT KH-20 Pharmakeep® или Stabilox® Oxygen Scavenger), как используется в некоторой стандартной упаковке. Даже в том случае, когда саше запаивают под вакуумом или в инертной атмосфере, добавление поглотителя кислорода может потребоваться для того, чтобы удалить остаточный кислород из суб-контейнера. Саше может содержать либо один, либо несколько контейнеров с одноразовой дозой, либо многодозовых контейнеров, например, пять контейнеров с одноразовой дозой на саше. В случае контейнера с несколькими дозами, оно должно сохранять офтальмологический раствор по настоящему изобретению в стерильном состоянии, и, по существу, в бескислородном состоянии.
Хитозан-NAC, содержащийся в контейнере в соответствии с изобретением, предпочтительно имеет содержание свободных тиоловых групп от 80 мкмоль/ г полимера до 250 мкмоль/ г полимера, предпочтительно от 105 мкмоль/ г полимера до 250 мкмоль/ г полимера после хранения не менее 12 месяцев при комнатной температуре. Это означает, что, в соответствии с настоящим изобретением, свободные тиольные группы остаются на хитозане-NAC и что полученный препарат стабилен в течение длительного периода времени. Этот период времени составляет, предпочтительно, по меньшей мере, около 12 месяцев, более предпочтительно, по меньшей мере, 18 месяцев, и еще более предпочтительно, по меньшей мере, около 24 месяцев. Такая долговременная стабильность предпочтительна из-за того, что некоторые продукты прекращаются, имея длительные времена хранения и задержки в коммерческих поставках и цепочках поставок, что может привести к менее стабильному продукту, выпадающему из допустимых параметров.
Кроме того, предпочтительное количество сшитых тиоловых групп в хитозане-NAC, содержащемся в контейнере согласно изобретению, составляет 30% или менее от общего количества тиоловых групп в них, предпочтительно 25% или менее, наиболее предпочтительно 20% или меньше после хранения в течение, по меньшей мере, 12 месяцев, более предпочтительно, по меньшей мере, 18 месяцев. Как уже упоминалось выше, стабильность свободных тиоловых групп в растворе особенно высока, если для изготовления раствора используется хитозан-НАС лишь с минимальной степенью сшивки тиоловых групп.
В описанном выше варианте осуществления, где имеется второй контейнер, например газонепроницаемое саше, содержащее один или несколько первых контейнеров, например, одноразовые контейнеры, изготовленные из полиэтилена низкой плотности, содержание свободных тиоловых групп в растворе предпочтительно остается в диапазоне, как это определено в соответствии с настоящим изобретением после открытия первого контейнера в течение, по меньшей мере, 30 дней. Терапевтическое время, необходимое для, например, 5 контейнеров составляет 5 дней, поэтому такой длительности стабильности более чем достаточно.
Как упоминалось выше, было установлено, что, особенно если используется хитозан-NAC только с минимальной степенью сшитых тиоловых групп для изготовления офтальмологического раствора по настоящему изобретению, свободные тиольные группы оставались стабильными даже после того, как был вскрыт второй контейнер, который обеспечивает кислородный барьер, то есть было установлено, что через 30 дней после вскрытия второго контейнера увеличение сшитых групп тиол составляло <15% количества тиоловых групп, первоначально присутствующих в растворе перед вскрытием.
Настоящее изобретение относится, прежде всего, к лечению человеческих индивидуумов, но также может быть использовано для лечения других млекопитающих, таких как собаки и кошки, для ветеринарных целей.
Изобретение далее проиллюстрировано следующими примерами, которые не должны быть истолкованы как ограничивающие изобретение конкретными процедурами, описанными в нем.
ПРИМЕРЫ
Пример 1: Определение содержания тиоловых групп
Количественное определение тиоловых групп основано на способе жидкостной химической обработки с применением 5,5' дитио-бис(2-нитробензойной кислоты, DTNB, "реагента Эллмана"). Свободные тиольные группы вступают в реакцию с реагентом с образованием смешанного дисульфида, в то время как освобождается один эквивалент 2-нитро-5-тиобензойной кислоты. В забуференной щелочной среде (рН=8,05) полученный в результате тиолят дает раствор отчетливо желтого цвета, поглощение которого можно измерить фотометрически при длине волны 450 нм.
119,0-121,0 мг тестируемого раствора, содержащего 0,1% гидрохлорида N-(N)ацетилцистеинил-хитозана, взвешивают в 1,5 мл сосудах Eppendorf. Три значения были определены для каждого раствора. 250,0 мг N-ацетилцистеина точно взвешивали и растворяли в 25,0 мл боратного буфера (рН 6,75). Затем этот раствор дополнительно разбавляли для калибровочной кривой. Боратный буфер использовали для пустых значений. К каждому раствору фосфатный буфер рН 8,0 добавляли до конечного объема 600 мкл. 600 мкл свежеприготовленного раствора Эллмана (содержащий 20 мг 5,5'-дитио-бис-(2-нитробензойной кислоты) в 100 мл фосфатного буфера (рН 8,0)) добавляли к каждому раствору (стандартному раствору, раствору образца и пустому значению). Растворы хорошо перемешивали и инкубировали в течение 1,5 ч при УФ-защитой. После этого тестируемые растворы, содержащие гидрохлорид N-(N-ацетилцистеинил-)хитозана, центрифугировали при 13400 оборотах в минуту в течение 5 минут. Наконец 1,1 мл каждого раствора (стандартный раствор, раствор образца и пустое значение) переносили в полумикрокюветы и тестировали при 450 нм в спектрофотометре против пустого значения.
Среднее содержание свободных тиоловых групп тиолированного хитозана в тестируемых растворах, как было определено, составляло 2,61% (масса/объем), что соответствует значению 178,5 мкМ свободных тиоловых групп/г полимера.
Пример 2: Композиция состава:
Следующий водный офтальмический раствор получали с использованием гидрохлорида N-(N- ацетилцистеинил-)хитозана с содержанием свободных тиоловых групп полимера 158 мкМ/г и кинематической вязкостью (25°С, 0,5% водный раствор) 5,63 мм2/с. Все остальные ингредиенты являются фармацевтическими добавками. Раствор стерилизовали с помощью стерильной фильтрации.
Состав глазных капель имел следующую композицию:
Таблица 1 Композиция водного офтальмологического раствора
Физико-химические свойства состава находились в пределах следующих характеристик:
Таблица 2 Физико-химические свойства водного офтальмологического раствора
Этот пример показывает, что хитозан-NAC можно составить в соответствии с настоящим изобретением для выполнения требований для офтальмологических препаратов.
Пример 3: Долговременная стабильность водного офтальмологического раствора:
Группа 1: Состав в соответствии с настоящим изобретением, содержащий 1 мг гидрохлорида N-(N-ацетилцистеинил-)хитозана/ мл готовили в инертных условиях, а затем асептически заполняли с использованием технологии вдува-наполнения-закупорки в карты контейнеров пяти одиночных доз, изготовленных из LDPE (полиэтилена низкой плотности) до объема 0,3 мл. Каждая карта была упакована в алюминиевое саше, содержащее абсорбент кислорода (PKT KH-20 Pharmakeep®).
Группа 2: Готовили состав в соответствии с настоящим изобретением, содержащий 1 мг гидрохлорида N-(N-ацетилцистеинил-)хитозана/ мл, заполненный в карты пяти контейнеров одиночных доз и упакованных в алюминиевые саше, как описано выше, но в этой группе алюминиевые саше не содержали поглотители кислорода.
Образцы составов, подготовленных в условиях изготовления для группы 1 и группы 2, хранили в контролируемых условиях при температуре 25°С и относительной влажности 40% в течение 18 месяцев. Содержание свободных тиоловых групп определяли, как описано в примере 1, в определенные промежутки времени. В то же время, когда концентрацию кислорода в саше определяли с помощью кислородного газоанализатора (PBI Dansensor CheckPoint II). Результаты определений тиоловых групп показаны на Фигуре 1 (группа 1: серые столбцы, группа 2: белые столбцы). Результаты показывают, что, когда водный офтальмологический состав по настоящему изобретению, содержащих полимер хитозан-NAC, хранится в практически бескислородной среде с максимальным содержанием кислорода менее 1,5% (что обеспечивает поглотитель кислорода), содержание свободных тиолов остается на высоком уровне, в пределах допустимых параметров в течение периода времени, по меньшей мере, 18 месяцев. Удивительно, но даже при хранении без поглотителя кислорода, содержание тиоловых группы раствора оставалось стабильным в течение периода времени примерно 1 месяц. Через 4 месяца содержание тиоловых групп по-прежнему оставалось в пределах допустимых параметров, но наблюдалось снижение содержания тиоловых групп на 20%. Уровень кислорода в саше из группы 2 находился в пределах диапазона от 3,0 до 5,7% в течение всего периода хранения 18 месяцев.
Пример 4: Кратковременная стабильность водного офтальмологического раствора после удаления контейнеров одиночных доз из алюминиевого саше
Состав по настоящему изобретению, содержащий 1 мг гидрохлорида N-(N-ацетилцистеинил-)хитозана/мл, готовили в инертных условиях, а затем асептически заполняли в карты контейнеров на пять единичных доз, изготовленных из LDPE (полиэтилен низкой плотности), до объема 0,3 мл с использованием технологии вдув-наполнение-закупорка. Каждая карта была упакована в алюминиевое саше, содержащее абсорбент кислорода (PKT KH-20 Pharmakeep®). Через месяц после производства карты извлекали из саше и хранили в закрытых формовых коробках в условиях окружающего воздуха, влажности и температурных условий, в течение 30 дней. Содержание свободных тиоловых групп в составе измеряли в день 0, 5-й день, 12-й день, 19-й день и 30-й день.
Результаты показаны на Фигуре 2 (средние значения 3-х партий со стандартными отклонения). Эти результаты указывают на то, что продукт остается в пределах требуемых параметров в течение периода времени до 30 дней при хранении в LDPE единицах однократных доз в присутствии кислорода в условиях окружающего воздуха. Уменьшение свободных тиоловых групп через 30 дней составило примерно 10%. Аналогичные результаты наблюдались даже тогда, когда алюминое саше, содержащее карты, хранили в течение 5 месяцев при температуре 40°C перед извлечением карты.
Пример 5: Синтез гидрохлорида N-(N-ацетилцистеинил-)хитозана
Полимеры гидрохлорида N-(N-ацетилцистеинил-)хитозана (Фигура 3) с различной степенью тиолирования синтезировали путем ковалентного присоединения N,S-диацетилцистеина к первичным аминам хитозана путем нуклеофильного замещения с последующим выделением свободных тиоловых групп в щелочной среде. Различные хитозаны были использованы в качестве сырья для синтеза (см Таблицу 3). Данные об источнике и степени деацетилирования были предоставлены поставщиком. Молекулярную массу определяли при помощи связанного с вытеснительной хроматографии (SEC) приема с двойным преобразованием частоты с использованием Viscotek TDA305 от Malvern Instruments. Образцы растворяли в 5% уксусной кислоте и разделяли изократически на колонках ViscoGEL.
Таблица 3 Перечень характеристик исходного вещества хитозана
Полученная в результате степень тиолирования зависит от соотношения массы хитозана и активного сложного эфира N'S-диацетилцистеина, а также от условий реакции (значения рН и температуры в процессе нуклеофильного замещения). Были синтезированы полимеры хитозан-NAC со степенью тиолирования в диапазоне от 40 мкΜ/г полимера до 400 мкΜ/г полимера.
Для синтеза 5 различных партий полимера хитозан-NAC, перечисленных в таблице 4, были использованы следующие условия реакции: хитозан с молекулярной массой от 100 кДа до 250 кДа (поставщик HMC+) был использован в качестве исходного материала. Массовое соотношение между хитозаном и активным эфиром N'S- диацетилцистеина составляло 1: 1 (масс.%), а массовое соотношение между хитозаном и восстанавливающим средством боргидридом натрия составляло 1: 2 (масс.%). Восстановление с использованием боргидрида натрия проводили при повышенной температуре около 40°С.
Таблица 4 Химические свойства полимеров хитозан-NAC с точки зрения молекулярной массы и степени тиолирования
Все полимеры хитозан-NAC, перечисленные в таблице 4, подходили для подготовки водного офтальмологического раствора в соответствии с настоящим изобретением в отношении растворимости в воде, вязкости и содержания тиоловых групп.
Пример 6: Условия реакции для синтеза минимально сшитого хитозан-NAC
Ковалентное присоединение N,S-диацетилцистеина к первичным аминам хитозана следовало за щелочным гидролизом тиоацетильных функциональных групп при рН 8±0,2. Полученные в результате внутри- и межмолекулярные дисульфидные связи затем восстанавливали в инертных условиях при 40°C с использованием большого избытка боргидрида натрия (хитозан: боргидрид натрия=1: 2 (масс.%). Затем избыток боргидрида натрия нейтрализовали добавлением 5N НСl, которая одновременно образует гидрохлорид хитозан-NAC при рН 1±0,1. Беловатый продукт осаждали 2-пропанолом, осаждали центрифугированием и высушивали в соответствии с определенной процедурой.
Как показано в многочисленных экспериментах, повышенные температуры, а также удивительно высокие количества восстанавливающего раегента имели важное значение для количественного и воспроизводимого восстановления, поскольку дисульфид сшитые полимеры хитозан-NAC образуют гидрогели или становятся нерастворимыми в водных системах (таблица 5).
Таблица 5. Восстанавливающие условия
Единственным вариантом потенциально использовать полимеры 1-5 для получения водного офтальмологического раствора в соответствии с данным изобретением было термически деструктурировать эти дисульфидные сшитые производные при температуре 60°C в течение более 4 дней (в зависимости от степени и типа (меж- и внутримолекулярных) сшивок), чтобы соответствовать характеристикам с точки зрения кинематической вязкости 0,5 масс.%- водного раствора, которая предпочтительно находится в диапазоне от 1 до 15 мм2/с. Кроме того, процесс сушки занимает очень много времени. В противоположность этому, сшитый в минимальной степени полимер хитозан-NAC №6, синтезированый в оптимальных условиях реакции, оказался в пределах предпочтительного диапазона вязкости после высушивания в течение менее 20 часов при температуре 60°C.
Пример 7: Характеризация минимально сшитого хитозана-NAC
Полимеры хитозан-NAC №№ 1 и 6 в соответствии с Примером 6 были охарактеризованы с точки зрения относительного содержания свободных тиоловых групп, молекулярной массы и динамической вязкости до и после селективного и количественного сокращения любых дисульфидов, присутствующих в конечных полимерах трис(2-карбоксиэтил) фосфином (ТСЕР).
Определение относительного содержания тиоловых групп: полимеры хитозан-NAC, солюбилизированные в виде 1,5% (масс/масс) водных растворов, инкубировали с/без ТСЕР (3 мг/мл) в течение 90 минут при комнатной температуре. После подкисления 1N НСl, полимеры хитозан-NAC неоднократно осаждали 2-пропанолом и осаждали центрифугированием. Остаток растворяли в дистиллированной воде с последующим добавлением 2,2'-дитиодипиридина, который образует стабильный тион при реакции со свободными тиоловыми функциональными группами. Это таутомерное вещество можно легко определить количественно с помощью УФ-анализа при 343 нм.
Измерение динамической вязкости: полимеры хитозан-NAC солюбилизировали в виде 0,5% (масс/масс) водных растворов, инкубировали с/ без ТСЕР (2 мг/мл) в течение 90 мин при комнатной температуре. Реологическую характеризацию проводили при помощи ротационных измерений при постоянной скорости сдвига 5s-1при 25°C.
Определение молекулярной массы (анализ SEC): Для того чтобы определить влияние условий проведения реакции от молекулярной массы остова хитозана, НСl соль немодифицированного хитозана получают с использованием условий реакции синтеза, идентичных с полимером 6, как это описано в примере 6, но без добавления активного эфира N'S-диацетилцистеина. Хитозан и полимеры хитозан-NAC растворили в 5% уксусной кислоте в концентрации 0,1% (масса/ масса), инкубировали с/без ТСЕР (1 мг/мл) в течение 90 минут при комнатной температуре. Молекулярные массы разделяли изократно при скорости потока 0,7 мл/мин и определяли тройной детекцией с использованием Viscotek TDA305 от Malvern Instruments.
Результаты определений тиоловых групп полимера 1 и полимера 6 показаны на Фигуре 4 (без ТСЕР: серые полосы, после восстановления ТСЕР: белые полосы; средние значения 3-х измерений со стандартными отклонениями). Результаты определения динамической вязкости 0,5% (масс/масс) раствора полимера 1 и полимера 6, соответственно, показаны на Фигуре 5 (без ТСЕР: серые полосы, после восстановления ТСЕР: белые столбики).
Эти результаты указывают на то, что даже наличие относительно небольшого количества дисульфидных сшитых структур (9% от общего числа N-ацетилцистеиновых групп, иммобилизованных на полимере в случае полимера 1, без обработки ТСЕР) имели огромное влияние на вязкость полимера хитозан-NAC в водном растворе, в то время как минимально сшитый хитозан-NAC лишь с около 3% своих тиоловых групп, присутствующих в виде дисульфидов, придавал растворимость в качестве водного раствора с низкой вязкостью, который был пригоден для подготовки глазных капель.
Кроме того, соотношение между реологическими свойствами полимеров и содержанием дисульфидных поперечных сшивок была подтверждена анализом SEC. Минимально сшитые полимеры хитозан-NAC (полимер 6) показали незначительное снижение молекулярной массы на 20-30% после количественного восстановения ТСЕР. После количественного уменьшения молекулярная масса полимера 6 была сравнима с молекулярной массой немодифицированного хитозана.HCl. Основное количество частично сшитого (9%) хитозана-NAC (полимер 1) при этом демонстрировало молекулярные массы за пределами исключения колонок, и даже анализируемая фракция (около 20%) давала молекулярные массы, в четыре раза от ее первоначальной массы. После количественного восстановления ТСЕР молекулярная масса полимера 1 находилась в том же диапазоне, что и молекулярная масса немодифицированного хитозана HCl. Как и ожидалось, реакция немодифицированного хитозана.HCl с ТСЕР не приводила к какому-либо снижению молекулярной массы.
Пример 8: Тестирование мукоадгезии
Мукоадгезивные свойства полимеров хитозан-NAC с различной степенью свободных тиоловых групп оценивали путем измерения их взаимодействия с выделенными муцинами. Полимеры хитозан-NAC синтезировали, как описано в примере 5, и использовали для получения водных офтальмологических составов, как это описано в примере 2. Немодифицированный хитозан.HCl использовали в качестве контроля.
Водные офтальмологические препараты, содержащие хитозан-NAC или хитозан.HCl, соответственно, инкубировали при 32°С в течение 30 мин с водными растворами выделенных и очищенных на градиенте хлорида цезия муцинах желудка свиней. Конечная концентрация полимера в каждом образце составляла 0,15% (масс/масс). Агрегатам давали возможность образовываться в течение ночи, и их удаляли из раствора путем центрифугирования на следующий день. После центрифугирования агрегаты ресуспендировали в дистиллированной воде для реологических измерений. Стабильность полученных суспензий оценивали с помощью свип-тестов амплитуды колебаний (Реометр MCR 101, измерительная система с конусообразной пластиной) при угловой частоте 10 рад/с, чтобы определить линейный диапазон вязкоупругости.
Результаты этого примера показали, что полимеры хитозан-NAC со степенью тиолирования в диапазоне примерно от 80мкΜ до 250мкΜ на г полимера сильно взаимодействовали с муцином, о чем свидетельствует широкая линейная вязкоупругая область и большая разница между модулем накопления G' и модулем потерь G". Один пример показан на Фигуре 8 (содержание свободных тиоловых групп 80 мкмоль/ г).
Описанный выше эффект зависел от степени тиолирования. Немодифицированный хитозан НСl и хитозан-NAC со степенью модификации 40мкΜ тиоловых групп/ г полимера показал лишь слабое взаимодействие с муцинами, о чем свидетельствует несущественная и очень узкая линейная область диапазона вязкоупругости, соответственно. Результаты показаны на Фигуре 6 (без тиолирования, немодифицированный хитозан.HCl) и Фигуре 7 (содержание свободных тиоловых групп 40 мкмоль/ г) и Фигура 8 и описаны в Таблице 6. Только тогда, когда степень тиолирования составляла около 80мкΜ/ г, полимер хитозан-NAC начал проявлять сильные мукоадгезионные свойства, о чем свидетельствует сильное взаимодействие с муцином.
Таблица 6 Определение силы взаимодействия полимер-муцин
Пример 9: Определение времени присутствия на глазе водных офтальмологических растворов, содержащих 0,1% радиоактивного изотопа хитозан-NAC после однократного закапывания в глаза кроликов
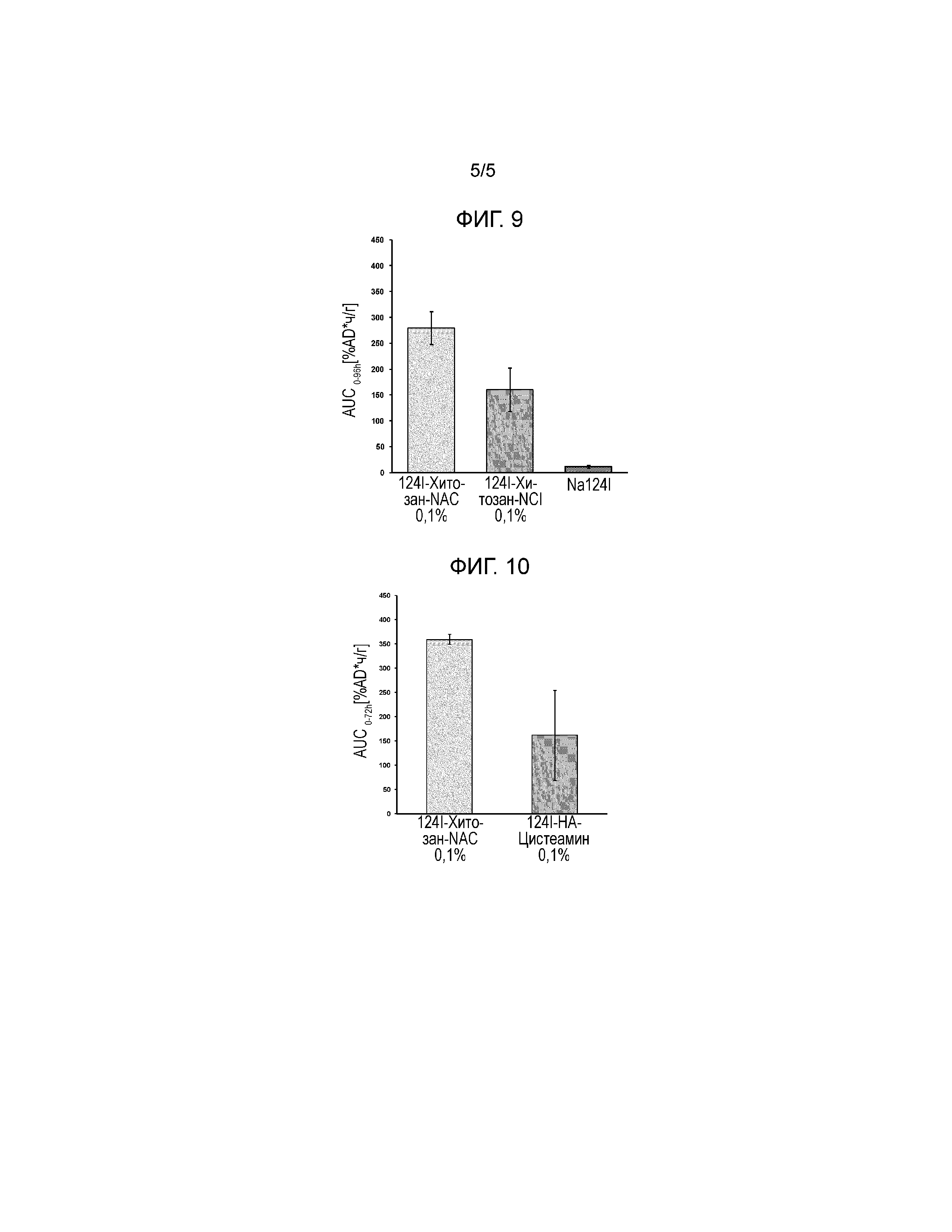
Цель исследования состояла в том, чтобы получить фармакокинетические данные124I-меченого хитозан-NAC в концентрации 0,1% (масс/масс) после однократного местного применения испытуемого вещества в физиологическом буферном растворе на глазе самок новозеландских белых кроликов. В рамках данного экспериментального исследования все четверо подопытных животных получали однократное местное закапывание124I- хитозан-NAC 0,1% (масс/масс) в правый глаз. В качестве контроля, два животных получили дополнительно одно местное применения124I-хитозан-HCl 0,1% (масс/масс) в левый глаз, а остальные два животных получали забуференный124I-NaI в левый глаз. Динамические microPET-измерения (энергетическое окно 350-650 кэВ, окно времени 6 нс) проводили в течение 1 часа после введения испытуемых веществ. Кроме того, 15-минутные статические сканирование проводили через 3, 6 и 9 часов, 30-минутные статические сканирование проводили в течение 24 часов и 60-минутные статические сканирование выполняли через 48, 72 и 96 часов после введения испытываемого вещества. В качестве основного параметра результата контролировали концентрации радиоактивности в участках применения. Калибровочный коэффициент для преобразования единиц изображений microPET в абсолютные концентрации радиоактивности сначала образовывали путем измерения калибровочного цилиндрического фантома, заполненного раствором Na124I с известной концентрацией радиоактивности. Концентрацию радиоактивного исследуемого вещества количественно определяли из каждого изображения с помощью программного обеспечения для анализа изображений AMIDE2. Представляющая интерес эллипсоидальная область (ROIs) была расположена на краю глаз на сагиттальном трансмиссионном изображении, в результате чего область с высокой активностью поглощения, находящаяся в карункуле (внутренний угол глаза), была исключена из ROI. Из определенных ROIs были вычислены концентрационные кривые времени-радиоактивности (TAC), которые означают концентрацию радиоактивности (мкКюри/г) в виде функции от времени в ткани, определенной ROI. Процент приложенной дозы на грамм ткани (%AD/ г) рассчитывали как среднюю тканевою концентрацию (мкКюри/г), деленную на полностью примененную радиоактивность (мкКюри) в начале эксперимента. Площадь под значениями кривой рассчитывали из концентрационных кривых времени-радиоактивности с использованием программного обеспечения PRISM5 (GraphPad Software, La Jolla, CA).
В качестве дополнительного параметра контроля качества содержание тиольных групп в растворе124I-меченого хитозан-NAC измеряли перед введением.
Результаты показаны на Фигуре 9. Na124I быстро смывался с глаза и с трудом обнаруживался через 6 часов после нанесения. Однократное введение 0,1% (масс/масс) раствора124I-меченого хитозан-NAC привело к увеличению концентрации активности на введенном глазе по сравнению с124I-меченым хитозан-HCl, что свидетельствует об увеличении мукоадгезивных свойств. Через 24 часов после введения, концентрация активности в глазах, обработанных 0,1%124I-меченым хитозаном-NAC, была почти в 2,2 раза выше по сравнению с глазами с124I-меченым хитозаном-HCl (2,16 ± 0,36 vs 1,21 ±0,26% AD/ г, соответственно). Эта разница сохранялась в течение следующего периода наблюдения так, что через 48 часов после введения было обнаружено 2,35 ±0,15% AD/ г (124I-хитозаном-NAC) vs. 1,06 ±0,30% AD/ г (124I- хитозан-HCl). Концентрации активности для обоих испытываемых веществ затем убывали, и практически сравнивались через 96 часов после введения.
Определение содержания тиоловых групп для растворов124I-меченого хитозана-NAC, используемых для данного исследования (два раствора, подготовленные в два разных дня), показали, что около 110 мкΜ и 130 мкΜ тиоловых групп/ г полимера, соответственно, оставались свободными, т.е. неокисленной формой после радиоактивного мечения реактивом Болтона-Хантера.
Пример 10: Сравнение времени присутствия на глазе водных офтальмологических растворов, содержащих 0,1% радиоактивно меченого хитозан-NAC или 0,1%, радиоактивно меченого HA-цистеамин после одногократного закапывания в глаза кроликов
В дополнение к вышеупомянутым исследованиям были получены фармакокинетические данные для124 I-меченого хитозана-NAC и124I-меченого тиолированного гиалуронана (HA-цистеамин) после местного применения испытуемого вещества в концентрации 0,1% (масс/ масс) в физиологическом буферном растворе на глазах самок новозеландских белых кроликов. В этом исследовании испытуемые получали однократное местное закапывание либо 0,1% (масс/ масс) I-HA-цистеамина (n=3) либо 0,1% (масс/ масс)124I-хитозан-NAC (n=2) в правый глаз, а левый глаз оставался необработанным. Повторные измерения microPET проводились в течение 3 дней (72 часов) после применения исследуемых веществ. В качестве основного параметра исследования отслеживали концентрации радиоактивности в участках применения. Поэтому измерения динамического microPET (энергетическое окно 350-650 кэВ, временное окно 6 нс) были выполнены в течение 1 часа после введения испытуемых веществ. Кроме того, 15-минутные статические сканирование проводили в течение 6 часов, 30-минутные статические сканирование проводили в течение 24 часов, и 60-минутные статические сканирование проводили через 48 часов и 72 часа после введения тестируемого вещества.
Количественный анализ полученных изображений microPET проводили, как описано выше, и результаты, показанные на Фигуре 10 приведены в качестве площади под значениями кривой (AUC), рассчитанными из концентрационных кривых времени-радиоактивности (%AD*ч/г). Определение содержания тиоловых групп в растворах124I меченого хитозана-NAC и124I-HA-цистеамина, используемые для этого исследования показали, что около 154 мкΜ и 54 мкΜ тиоловых групп/ г полимера, соответственно, остается в свободной, т.е. неокисленной форме после радиоактивного мечения.
Пример 11: Сравнение фармакокинетического поведения растворов 124I меченого хитозана-NAC после одного закапывания в глаза кроликов
Глазное распределение растворов124I меченого хитозана-NAC, содержащего124I меченый хитозан-NAC в концентрации 0,05%; 0,1%; 0,3% и 0,5% (масс/масс), соответственно, после одного закапывания оценивали с помощью качественной оценки сканирования проекционных изображений microPET суммированных данных в различные моменты времени. Результаты приведены в таблице 7.
Таблица 7 Качественная оценка глазного распределения 4-х различных растворов радиоактивно меченого хитозана-NAC
Качественная оценка глазного распределения поверхности 4-х различных растворов радиоактивно меченого хитозан-NAC четко показали, что растворы хитозана-NAC с концентрацией 0,1% и 0,3% показали лучшие результаты в плане равномерного распределения по поверхности глазного яблока кроликов в течение 24 часов. Раствор, содержащий 0,05%, быстрее смывался с поверхности глазного яблока. Раствор, содержащий 0,5% хитозана-NAC, не был равномерно распределен по глазу, а также быстрее смывался с поверхности глазного яблока.
Пример 12: Влияние хитозана-NAC на толщину слезной пленки у пациентов с синдромом сухих глаз
Целью данного исследования было изучение влияния глазных капель, содержащих 0,1% хитозан-NAC (171 мкмоль/ г свободных тиольных групп) на толщину слезной пленки у пациентов с синдромом сухих глаз после однократной дозы и после 5 дней лечения. Для этой цели были запланированы 2 когорты: В когорте I, глазные капли с хитозан-N-ацетилцистеином закапывали один раз в один из случайно выбранных глаз, в то время как парный глаз получал плацебо. Измерения толщины слезной пленки были выполнены при помощи оптической когерентной томографии (OCT) до закапывания и через 10 минут, 1 час, 2 часа, 4 часа, 8 часов, 10 часов, 12 часов и через 24 часа после инстилляции. Результаты (медианная толщина слезной пленки в мкм, диапазон в скобках, n=16), приведены в Таблице 8.
Таблица 8 Результаты измерения толщины слезной пленки у когорты I
В когорте II, 16 пациентов были рандомизированы для получения глазных капель 0,1% хитозана-NAC один раз в день в правый глаз и два раза в день в левый глаз или наоборот. Другой глаз получил плацебо для второго закапывания. Измерения толщины слезной пленки с помощью ОКТ проводили в каждый день исследования до утреннего закапывания и на следующий день после последнего закапывания. Индекс болезнь поверхности глазного яблока (OSDI) оценивали в качестве вторичной эффективности, переменной в когорте II при скрининге и на 6-й день.
Результаты измерений толщины слезной пленки в когорте II приведены в таблице 9 (медианная толщина слезной пленки (мкм) из группы "один раз в день" и "два раза в день» в когорте II, диапазон в скобках, n=16).
Таблица 9 Результаты измерений толщины слезной пленки у когорты II
На основе регрессионного анализа в течение всего 24 ч периода после введения дозы, увеличение толщины слезной пленки было статистически значимым, если группe лечения когорты I сравнивали с группой плацебо (Регрессионный анализ для выявления различий между лечениями во времени, Р <0,0001). Эти результаты показывают, что глазные капли хитозан-NAC вызывали статистически значимое увеличение толщины слезной пленки в течение периода времени 24 часа, что свидетельствует о длительном времени нахождения на роговице. Толщина слезной пленки была восстановлена до уровня, найденного у здоровых испытуемых (Werkmeister, Alex et al., 2013, Measurement of tear film thickness using ultrahigh-resolution optical coherence tomography, Invest Ophthalmol Vis Sci (54): 5578-5583). В когорте II закапывания один раз в день было достаточно, чтобы восстановить толщину слезной пленки, и это не уступало применению два раза в день.
В когорте II медианный показатель заболевания глазной поверхности при скрининге составлял 38,5 и улучшился до 13,0 на 6-й день, что соответствует снижению на 60,5%. Это указывает на то, что индивидуальная тяжесть DES, как оценивали при помощи OSDI, улучшилась после пяти дней лечения глазными каплями с 0,1% хитозаном-NAC.
Реферат
Группа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для профилактики или лечения синдрома сухого глаза или признаков и/или симптомов сухого глаза. Стерильный водный офтальмологический раствор содержит от 0,05% до 0,5% (мас./мас.) N-(N-ацетилцистеинил)хитозана или его фармацевтически приемлемой соли в растворе-носителе, причем N-(N-ацетилцистеинил)хитозан имеет содержание свободных тиоловых групп в количестве от 80 мкмоль/г полимера до 280 мкмоль/г полимера. Для профилактики или лечения синдрома сухого глаза или признаков и/или симптомов сухого глаза субъекту вводят эффективное количество указанного стерильного водного офтальмологического раствора. Другим воплощением является контейнер, содержащий указанный стерильный водный офтальмологический раствор, при этом раствор находится в атмосфере с содержанием кислорода 1,5% или менее. Использование группы изобретений обеспечивает эффективный, безопасный, с хорошей переносимостью и долгосрочной стабильностью офтальмологический раствор, позволяющий повысить эффективность профилактики или лечения синдрома сухого глаза или признаков и/или симптомов сухого глаза. 3 н. и 15 з.п. ф-лы, 10 ил., 9 табл., 12 пр.

Комментарии