Блистерная упаковка для фармацевтических картриджей - RU2569776C2
Код документа: RU2569776C2
Чертежи















Описание
Область техники, к которой относится изобретение
Раскрыта блистерная упаковка для фармацевтического инъекционного формованного картриджа или капсулы.
Уровень техники
Блистерные упаковочные системы можно использовать для защиты лекарственных продуктов, выпускаемых в фармацевтической промышленности, таких как капсулы, таблетки, порошки и жидкости. Как правило, блистерные упаковки состоят из твердого ячеистого подложечного листа, имеющего полости или открытые ячейки, и покровного листа или крышки. Каждая ячейка в упаковке обычно содержит лекарственный продукт в форме порошка, капсулы или таблетки.
Система доставки лекарственных средств для ингаляции может включать картридж для введения сухой порошковой композиции в дыхательные пути и легкие для лечения заболевания. Лекарственные композиции, содержащиеся в картридже, можно использовать с системой для ингаляции сухого порошка, которая доставляет лекарственное содержимое безопасным и надежным способом. Однако лекарственные композиции, используемые для легочной ингаляции с помощью картриджа в системе доставки, могут быть склонными к разложению, например, под действием влаги. Таким образом, для картриджа, содержащего порошковую композицию, может оказаться полезной усовершенствованная конструкция упаковки, которая защищает картридж и композицию от физического повреждения и факторов окружающей среды.
Сущность изобретения
В настоящем документе описаны блистерные упаковки для защиты картриджей, содержащих фармацевтические композиции, используемые с помощью ингалятора. В качестве одного примера, картриджи, используемые с системой для ингаляции сухого порошка, описаны в патенте US № D613849 и в патентной заявке US № 12/484137 (патентной публикации US № 2009/0308392). Блистерные упаковки могут быть предназначены для хранения, защиты, дозирования и/или повышения устойчивости фармацевтической композиции. В одном варианте осуществления композиции могут быть предназначены для легочной доставки при лечении заболеваний, включая системные и эндокринные заболевания, такие как диабет. Блистерные упаковки способы обеспечивать жесткость конструкции, которая противостоит свертыванию используемого материала, и могут также создавать защиту от факторов окружающей среды, таких как влага, свет и/или пыль; а также они способны упрощать выделение дозы лекарственного средства для введения пациенту. В одном варианте осуществления блистерная упаковка способна создавать высокую степень влагонепроницаемости для защиты картриджа, содержащего лекарственную композицию, во время транспортировки, погрузки и/или хранения лекарственных продуктов перед применением.
В одном варианте осуществления блистерные упаковки содержат множество блистеров, которые представляют собой однородные карманоподобные ячейки, чашеобразные ячеистые структуры и/или полости, расположенные в рядах или матрицах; при этом каждая ячейка блистерной упаковки имеет форму, предназначенную для совмещения с соответствующей структурой фармацевтического картриджа или капсулы, в которых содержится фармацевтическая композиция. В одном варианте осуществления каждая блистерная ячейка может содержать соответствующий картридж. В еще одном варианте осуществления блистерные упаковки могут содержать одну или несколько имеющих неправильную форму полостей или блистерных ячеек, причем каждая полость или блистерная ячейка имеет верхнюю часть, нижнюю часть, внешнюю поверхность, внутреннюю поверхность и свободное пространство. Нижняя часть может иметь внешнюю поверхность, имеющую по существу круглую форму, или купол, и по существу плоский торец или уступ, проходящую от области купола. В одном варианте осуществления по существу плоский край может иметь выемку или впадину, которая образует уступ или фиксирующее картридж приспособление на внутренней поверхности, и свободное пространство может быть предназначено для хранения картриджа, содержащего чашеобразный контейнер. В других вариантах осуществления блистерные упаковки могут содержать множество отдельных блистерных ячеек, которые отделяет друг от друга разделитель или сегмент необработанного подложечного материала, который соприкасается с соседней блистерной ячейкой. В этом варианте осуществления блистерная упаковка может содержать перфорации или надрезанные линии, окружающие каждую блистерную ячейку, для отделения блистерной ячейки и упрощения дозирования.
В одном варианте осуществления блистерные упаковки содержат одну или несколько блистерных ячеек в ряду и один или несколько рядов в блистерной упаковке. В вариантах осуществления, предусматривающих две или более блистерных ячеек в ряду блистерных ячеек, блистерные ячейки могут соприкасаться друг с другом, и внутренний объем или свободное пространство каждой блистерной ячейки может находиться в соединении со всеми блистерными ячейками. В качестве альтернативы, в некоторых вариантах осуществления, предусматривающих более чем одну блистерную ячейку, которые соприкасаются друг с другом, каждая блистерная ячейка может быть отделена таким образом, что объем и/или свободное пространство каждой ячейки может не находиться в соединении с соседней блистерной ячейкой, некоторыми или всеми другими блистерные ячейки. В одном варианте осуществления блистерные упаковки могут содержать один или несколько рядов блистерных ячеек, причем каждый ряд блистерных ячеек может быть отделен перфорационными линиями или надрезами вдоль рядов блистерных ячеек или вдоль линий, окружающих каждую ячейку блистерной упаковки.
Один вариант осуществления предусматривает блистерную упаковку, включающую подложечную структуру или материал со сформованными полостями, состоящими из термоформуемой многослойной подложки, и покровный материал, включающий мягкую алюминиевую фольгу с термоактивируемым герметизирующим материалом. Подложечный материал и/или структура может содержать один или несколько слоев термоформуемого пластического материала, включая поливинилхлорид, сложный полиэфир и/или фторполимер, например, полихлортрифторэтилен (PCTFE), такой как ACLAR® от компании Honeywell International Inc. (штат Нью-Джерси). В некоторых аспектах вариантов осуществления описанные в настоящем документе блистерные упаковки могут содержать подложечный материал, представляющий собой многослойный композитный материал. В одном варианте осуществления многослойный композитный материал может содержать по меньшей мере три слоя, выбранных из поливинилхлорида и фторполимера, в том числе слой ACLAR и/или материала, имеющего аналогичные характеристики термоформования. В одном варианте осуществления многослойный композитный материал может состоять из трехслойной пленочной структуры, содержащей первый слой из поливинилхлорида или полиэтилентерефталата (PET), второй слой из поливинилхлорида или PET и слой из фторполимера, включающего ACLAR, причем фторполимерный слой представляет собой средний слой многослойного композитного материала. В еще одном варианте осуществления блистерный подложечный лист может содержать фторполимер, такой как PCTFE, адгезионно присоединенный к PET.
В некоторых вариантах осуществления многослойный композитный материал, образующий подложечный материал, может быть изготовлен с различной толщиной, и его толщина может зависеть от степени влагонепроницаемости, требуемой для композиции. В одном варианте осуществления толщина многослойного композитного материала блистерного подложечного листа может находиться в интервале от приблизительно 230 мкм до приблизительно 720 мкм. В еще одном варианте осуществления многослойный композитный материал блистерный подложечный лист может иметь толщину, составляющую от приблизительно 360 мкм до приблизительно 610 мкм. В этом варианте осуществления изготовление блистерных упаковок с многослойной подложкой позволяет получать блистерные упаковки с подходящей жесткостью и влагонепроницаемой защитой, имеющие толщину, составляющую более чем 100 мкм.
В определенных вариантах осуществления блистерные упаковки могут содержать одну или несколько полостей и покрытие или крышку. Каждая из полостей предназначена для размещения картриджа, который может быть структурно приспособленным для сухого порошкового ингалятора, и картридж может включать композицию для легочного введения. Композиция может содержать активный ингредиент, включающий, но не ограниченный этим, низкомолекулярное соединение, белок, пептид, нуклеиновую кислоту или их сочетание. В данном и других вариантах осуществления картридж может содержать композицию для лечения, например, диабета, и активный ингредиент композиции можно выбирать из пептидов, включая, но не ограничиваясь этим, инсулин, глюкагоноподобный пептид (GLP) 1, их активные фрагменты, соответствующие аналоги или их сочетания. В других вариантах осуществления в качестве активного ингредиента можно выбирать любой пептид или активный ингредиент, который можно доставлять легочным путем, в том числе инсулин, окситоцин, глюкагон, паратиреоидный гормон, оксинтомодулин, пептид YY, глюкагоноподобный пептид 1, суматриптан, ингибитор пептидилпептидазы IV, паратиреоидный гормон, нейромедиаторный агонист и антагонисты, дезоксирибонуклеаза I, их активные фрагменты, соответствующие аналоги и их сочетания.
Блистерные упаковки можно изготавливать для одной дозы и/или множества доз, включая ежедневное дозирование фармацевтической композиции, дозирование для двух или более суток, или сочетание множества блистерных упаковок можно изготавливать для еженедельного или ежемесячного введения, если это необходимо.
В следующем варианте осуществления блистерные упаковки могут содержать картридж, содержащий композицию для лечения заболевания, которая представляет собой вдыхаемую сухую порошковую композицию, содержащую дикетопиперазин. В одном варианте осуществления дикетопиперазин может иметь формулу 3,6-бис-(4-X-аминобутил)-2,5-дикетопиперазин, причем радикал X выбран из группы, которую составляют сукцинил, глутарил, малеил и фумарил. В одном варианте осуществления сухая порошковая композиция может содержать соль дикетопиперазина; причем соль дикетопиперазина может представлять собой неорганическую соль, включающую натрий, калий, магний, литий, цезий и кальций. В еще одном варианте осуществления дикетопиперазин может представлять собой органическую соль, включающую триэтиламин, бутиламин, диэтаноламин и триэтаноламин. В следующем варианте осуществления предложены сухие порошковые композиции, в которых дикетопиперазин представляет собой 3,6-бис-(4-фумариламинобутил)-2,5-дикетопиперазин или соответствующую соль, и в которых содержится или не содержится фармацевтически приемлемый носитель или вспомогательный ингредиент. Блистерные упаковки могут также содержать картридж с композицией, в которой содержатся фармацевтически приемлемые носители и/или вспомогательные ингредиенты, в том числе, но не ограничиваясь этим, лактоза, декстран, аминокислоты, и т. п.
Краткое описание чертежей
Фиг. 1 представляет вид в перспективе блистерной упаковки согласно варианту осуществления, описанному в настоящем документе.
Фиг. 2 представляет первый вид сбоку блистерной упаковки согласно фиг. 1, иллюстрирующий равномерное расположение рядов блистерных ячеек внутри упаковки.
Фиг. 3 представляет второй вид сбоку блистерной упаковки согласно варианту осуществления на фиг. 1, представляющий ряды блистерных ячеек с противоположной стороны относительно фиг. 2.
Фиг. 4 представляет вид снизу блистерной упаковки согласно варианту осуществления на фиг. 1, иллюстрирующий расположение блистерных ячеек внутри упаковки.
Фиг. 5 представляет вид сверху блистерной упаковки согласно варианту осуществления на фиг. 1, иллюстрирующий крышку.
Фиг. 6 представляет вид спереди блистерной упаковки согласно варианту осуществления на фиг. 1, иллюстрирующий ряд из трех блистерных ячеек и их конфигурацию, включающую область купола и боковые выемки или фиксирующие картридж приспособления.
Фиг. 7 представляет вид сзади блистерной упаковки согласно варианту осуществления на фиг. 1.
Фиг. 8 представляет поперечное сечение ряда блистерных ячеек через плоскость 8-8 согласно фиг. 1.
Фиг. 9 представляет продольное сечение блистерной упаковки через плоскость 9-9, пересекающую средние точки блистерных ячеек.
Фиг. 10 иллюстрирует вид сверху блистерной упаковки, которая описана в настоящем документе.
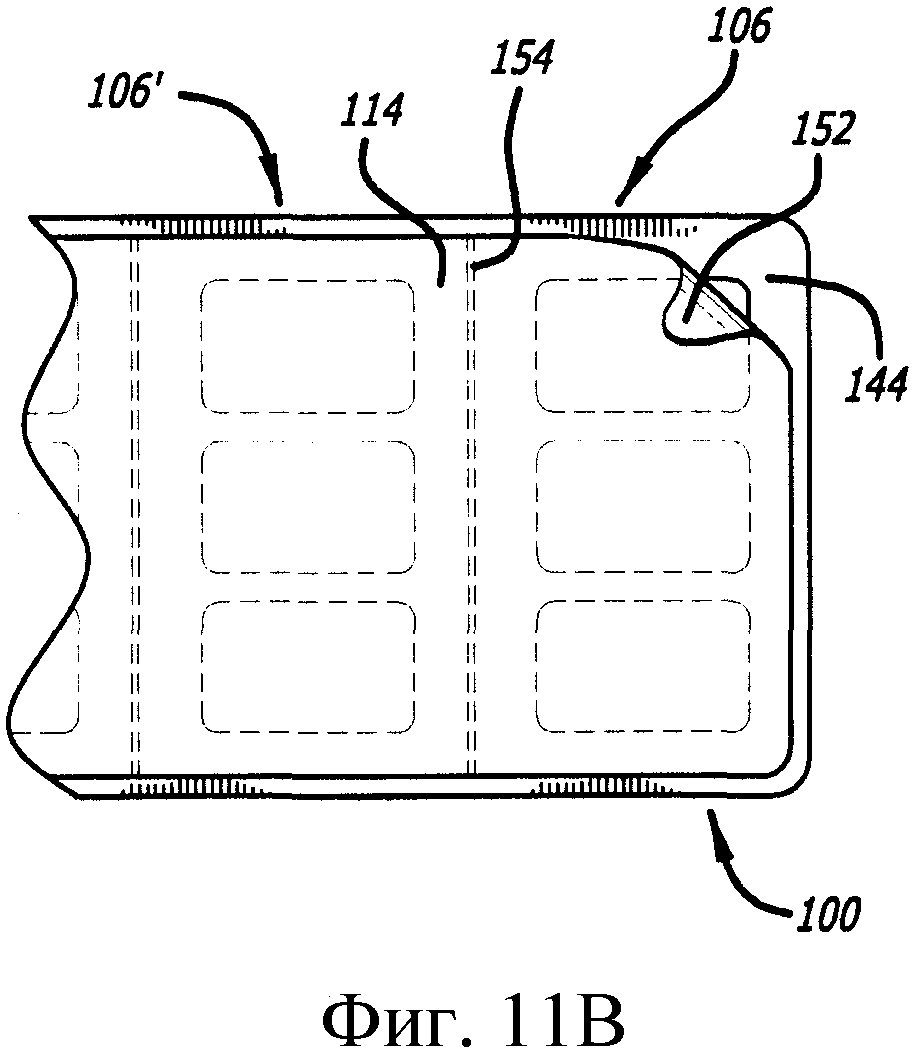
Фиг. 11A иллюстрирует вид сзади прокалываемого уплотнения, которое описано в настоящем документе. Фиг. 11B иллюстрирует отслаиваемое уплотнение, которое описано в настоящем документе.
Фиг. 12 представляет на графике данные, полученные в экспериментах и иллюстрирующие типичную скорость проникновения водяного пара (WVTR) блистерной упаковки согласно варианту осуществления, описанному в настоящем документе.
Фиг. 13 иллюстрирует вид сверху блистерной упаковки, которая описана в настоящем документе.
Фиг. 14 иллюстрирует профиль толщины блистерной упаковки, изготовленной из трехслойного материала PVC-ACLAR-PVC.
Фиг. 15 иллюстрирует профиль толщины блистерной упаковки, изготовленной из двухслойного материала PVC-ACLAR.
Фиг. 16 иллюстрирует профиль толщины блистерной упаковки, изготовленной из двухслойного материала CoPETG-ACLAR.
Фиг. 17 иллюстрирует среднеквадратические отклонения для графиков на фиг. 14-16.
Варианты осуществления настоящего изобретения представляют собой исключительно примеры и не ограничиваются теми, которые представляют чертежи на фиг. 1-17.
Подробное описание
В настоящем документе описаны блистерные упаковки, предназначенные для защиты картриджа или капсулы, в которых содержится фармацевтическая композиция для легочного введения. Данные картриджи или капсулы можно использовать в сочетании с ингалятором.
Фиг. 1 иллюстрирует изометрическое изображение примерного варианта блистерной упаковки 100, описанной в настоящем документе. Блистерная упаковка 100 содержит блистерную карту или ячеистый подложечный лист 102, имеющий множество формованных полостей 104, 104', 104", 104"', 104"" и т. д., которые расположены в один или несколько рядов 106, 106', 106", 106"', 106"" и т. д. В одном варианте осуществления три купола 108 могут присутствовать в каждом ряду 106. Полость 104 может содержать первый по существу круглый край или купол 108 и некоторую структуру с плоской поверхностью или уступ 110, который проходит от купола 108 и образует фиксирующее крышку картриджа приспособление 112, создающее выемку или впадину в полости внешней поверхности. Купол 108 может быть предназначен для помещения содержащего единичную дозу картриджного контейнера или колпачка, и уступ 110 может быть предназначен для содержания и фиксации секции крышки картриджа или верхней сборки в конфигурации герметизации картриджа или конфигурации предварительного дозирования. Фармацевтический картридж, который можно упаковать в блистерную упаковку согласно настоящему изобретению, может представлять собой, например, картридж, описанный в патенте US № D613849 и патентной заявке № US 2009/038390, описания которых во всей своей полноте включаются в настоящий документ в отношении всего, что касается картриджей.
Фиксирующее крышку картриджа приспособление или уступ может удерживать на месте крышку картриджа и/или препятствовать картриджам вступать в контакт с соседними картриджами в блистерных упаковках, содержащих множество картриджей. В одном варианте картриджа, хранящегося в блистерной ячейке согласно настоящему изобретению, где картридж включает крышку картриджа и контейнер в конфигурации герметизации или предварительного дозирования, контейнер картриджа приспособлен к куполу блистерной ячейки и подвешен с помощью крышки, приспособленной к уступу блистера. Таким образом, контейнер картриджа защищается от движения и сохраняется в герметичной конфигурации.
Фиг. 1 также иллюстрирует блистерную упаковку 100, содержащую пять рядов 106, каждый из которых содержит по три полости 104. Данный вариант осуществления может оказаться подходящим для введения пациенту по три дозы в сутки. В некоторых вариантах осуществления доза с каждым приемом пищи может представлять собой предписанную ингаляционную дозу инсулина или другого лекарственного средства для пациентов, имеющих соответствующее состояние, такое как, но не ограничиваясь этим, диабет. Альтернативные варианты осуществления можно использовать в зависимости от заболевания, подлежащего лечению.
Другие варианты осуществления могут предусматривать по одной, две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать или пятнадцать полостей в каждом ряду. Блистерная упаковка может также включать один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать или пятнадцать рядов.
Блистерная упаковка 100, проиллюстрированная на фиг. 1, может быть предназначена для укладки вместе с другой блистерной упаковкой таким образом, что блистерные ячейки из противоположных упаковок могут помещаться между двумя рядами 106 другой упаковки, уменьшая размер внешней упаковки во время транспортировки. Блистерную упаковку 100 можно сочетать с другой блистерной упаковкой, перевернутой на обратную сторону и сверху вниз, чтобы уменьшать размер упаковок. Могут быть предусмотрены и другие способы для уменьшения размера, объема или других параметров упаковки.
В вариантах осуществления, представленных в настоящем документе, блистерные упаковки могут быть предназначены для совмещения с определенным размером картриджа, подлежащего упаковке. Размер рядов в блистерной упаковке также может различаться в зависимости от ряда факторов, таких как число блистерных ячеек в каждом ряду и размер блистерных ячеек. В одном варианте осуществления каждая блистерная ячейка или полость 104 может иметь длину, составляющую более чем приблизительно 1 см, высоту купола 108, составляющую более чем 1 см, и ширину более чем 1 см. В одном варианте осуществления размеры полости 104 могут составлять приблизительно 1,5 см в ширину, приблизительно 2,5 см в длину и приблизительно 1,5 см в высоту; при этом каждый из рядов 106 в пределах блистерной упаковки может составлять приблизительно 6 см в длину и приблизительно 3,5 см в ширину. В этом и других вариантах осуществления полости 104 могут занимать центральное положение в пределах ряда ячеек или сегмента блистерной упаковки.
Фиг. 2 и 3 иллюстрируют противоположные виды сбоку блистерной упаковки 100, представленной на фиг. 1. На фиг. 2 и 3 проиллюстрировано равномерное расположение рядов 106 в пределах блистерной упаковки 100. Фиг. 2 и 3 также представляют купол 108 и уступ 110, форма которых может представлять собой в общем по существу вытянутую форму. Полости 104 могут иметь плоский край или уступ, проходящий сбоку от куполообразной структуры. Фиг. 2 и 3 также иллюстрируют ячеистый подложечный лист 102, образующий блистерные ячейки или полости 104, и крышку 114, которая представлена как герметизирующая полости 104.
Фиг. 4 представляет вид снизу блистерной упаковки 100, проиллюстрированной на фиг. 1, который представляет полости 104, расположенные в пределах блистерной упаковки 100. В этом варианте осуществления блистерная упаковка 100 содержит ряды 106, выполненные так, что имеется пространство 116 между рядами 106. В одном варианте осуществления купола 108 первой блистерной упаковки могут помещаться в пространстве 116 между рядами 106 второй блистерной упаковки, и уступы 110 первой блистерной упаковки могут упираться в уступы 110 второй блистерной упаковки.
Фиг. 5 представляет вид сверху блистерной упаковки 100, проиллюстрированной на фиг. 1, который представляет крышку 114, герметизирующую блистерную упаковку 100. Крышка 114 может быть присоединена или уплотнена таким образом, что крышка 114 прикрепляется к плоским поверхностям ячеистого подложечного листа 102. Одна часть ячеистого подложечного листа, где может прикрепляться крышка 144, представляет собой пространство 116 между полостями 104 и над каждым отверстием полости. Это прикрепление крышки 114 к ячеистому подложечному листу 102 способно приближать блистерную упаковку 100 и инкапсулировать один или несколько картриджей внутри полостей 104. В одном варианте осуществления крышка 114 может представлять собой единый лист, который покрывает весь ячеистый подложечный лист 102 и соединяется с ячеистым подложечным листом в областях, окружающих полости 104.
В некоторых вариантах осуществления, крышка 114 может прикрепляться к задней части ячеистого подложечного листа 102, сливаясь со всей оборотной стороной ячеистого подложечного листа 102. В других вариантах осуществления крышка 114 может прикрепляться к оборотной стороне ячеистого подложечного листа 102, но при этом она меньше ячеистого подложечного листа 102. В следующих вариантах осуществления крышка 114 может быть больше, чем оборотная сторона ячеистого подложечного листа 102, и обертываться вокруг краев ячеистого подложечного листа 102.
Фиг. 6 и 7 представляют, соответственно, виды спереди и сзади блистерной упаковки 100, проиллюстрированной на фиг. 1, и иллюстрируют блистерную упаковку 100, содержащую ряд 106, включающий три соединенные полости 104. Каждая секция полости 104 может включать купол 108 и его боковой уступ 110, имеющий выемки или фиксирующие картридж приспособления 112; при этом ряды блистерных ячеек герметизированы крышкой 114.
Фиг. 8 иллюстрирует поперечное сечение через ряд полостей, которые представлены на фиг. 1, через плоскость 8-8. Фиг. 8 иллюстрирует внутреннее пространство трех взаимно соединенных полостей и их соединение друг с другом в пределах ряда. Данный чертеж иллюстрирует внутренний объем 118 или свободное пространство ряда 106. Фиг. 8 также иллюстрирует вид варианта ячеистого подложечного листа 102, который представляет составляющие слои. В этом варианте осуществления ячеистый подложечный лист 102 содержит трехслойную ламинированную пленку, включающую первый слой 120, второй слой 122 и третий слой 124. Каждый из трех слоев может адгезионно присоединяться друг к другу. В других вариантах осуществления можно использовать более или менее чем три слоя. Например, можно использовать один, два, три, четыре, пять, шесть, семь, восемь, девять или десять слоев. В одном варианте осуществления число используемых слоев может представлять собой число или значение, которое необходимо, чтобы практически предотвращать инфильтрацию воды в герметизированную упаковку, которую составляют ячеистый подложечный лист и крышка.
В одном варианте осуществления ячеистый подложечный лист 102 можно изготавливать, используя термоформуемые пластмассы. В определенных вариантах осуществления ячеистый подложечный лист 102 может представлять собой термоформуемый многослойный материал, который образуют пленки, содержащие один или более чем один слой термоформуемой пластмассы, включая сложный полиэфир, поливинилхлорид и/или фторполимер, такой как ACLAR®. В других вариантах осуществления блистерная упаковка 100 изготовлена из многослойного композитного материала, содержащего по меньшей мере три слоя, в качестве которых выбирают поливинилхлоридный слой, полиэтилентерефталатный слой и фторполимерный слой, причем по меньшей мере один слой представляет собой фторполимер. В одном аспекте данного варианта осуществления ячеистый подложечный лист 102 может быть изготовлен из фторполимерного слоя и двух поливинилхлоридных слоев. В одном варианте осуществления первый слой 120 может представлять собой поливинилхлоридный слой, второй слой 122 может представлять собой фторполимерный слой, и третий слой 124 может представлять собой поливинилхлоридный слой. В таком варианте осуществления первый слой 120 и третий слой 124, каждый из которых представляет собой поливинилхлоридный слой, образуют внутреннюю поверхность 126 и внешнюю поверхность 128 каждой полости 104.
Другие полимеры, которые можно использовать индивидуально или в сочетании с вышеупомянутыми материалами, чтобы изготавливать ячеистый подложечный лист 102, могут представлять собой полимер L-молочной кислоты, поликапролактон, сополимер лактида и гликолида, сополимер этилена и винилацетата, сополимер гидроксибутирата и валерата, полидиоксанон, полимер сложного ортоэфира, полиангидрид, полигликолевую кислоту, полимер D,L-молочной кислоты, сополимер гликолевой кислоты и триметиленкарбоната, полимер сложного эфира фосфорной кислоты, полифосфоэфируретан, полиаминокислоты, цианоакрилаты, политриметиленкарбонат, полииминокарбонат, сополимер простых и сложных эфиров (например, PEO/PLA), полиуретаны, кремнийорганические полимеры, сложные полиэфиры, полиолефины, сополимеры полиизобутилена и этилена и альфа-олефинов, акриловые полимеры и сополимеры, полибутилметакрилат, винилгалогенидные полимеры и сополимеры (например, поливинилхлорид), полимеры простых виниловых эфиров (например, поливинилметиловый эфир), поливинилиденгалогениды (например, поливинилиденфторид и поливинилиденхлорид), полиакрилонитрил, поливинилкетоны, поливинилароматические соединения (например, полистирол), сложные эфиры поливинилового спирта (например, поливинилацетат), сополимеры акрилонитрила и стирола, сополимеры акрилонитрила, бутадиена и стирола (ABS), полиамиды (например, нейлон 66 и поликапролактам), поликарбонаты, полиоксиметилены, полиимиды, простые полиэфиры, вискоза, целлофан и карбоксиметилцеллюлоза.
Ячеистый подложечный лист 102 может быть прозрачным, частично прозрачным или непрозрачным. Частично прозрачный лист включает материалы, которые пропускают приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% света. Непрозрачные материалы способны практически не пропускать свет, и они могут оказаться полезными для хранения лекарственных средств, чувствительных к свету.
Толщина многослойного материала перед изготовлением ячеистого подложечного листа может составлять приблизительно 10 мкм, приблизительно 25 мкм, приблизительно 50 мкм, приблизительно 75 мкм, приблизительно 100 мкм, приблизительно 125 мкм, приблизительно 150 мкм, приблизительно 175 мкм, приблизительно 200 мкм, приблизительно 225 мкм, приблизительно 250 мкм, приблизительно 275 мкм, приблизительно 300 мкм, приблизительно 325 мкм, приблизительно 350 мкм, приблизительно 375 мкм, приблизительно 400 мкм, приблизительно 425 мкм, приблизительно 450 мкм, приблизительно 475 мкм, приблизительно 500 мкм, приблизительно 525 мкм, приблизительно 550 мкм, приблизительно 575 мкм, приблизительно 600 мкм, приблизительно 625 мкм, приблизительно 650 мкм, приблизительно 675 мкм, приблизительно 700 мкм, приблизительно 725 мкм, приблизительно 750 мкм, приблизительно 775 мкм, приблизительно 800 мкм, приблизительно 825 мкм, приблизительно 850 мкм, приблизительно 875 мкм, приблизительно 900 мкм, приблизительно 925 мкм, приблизительно 950 мкм, приблизительно 975 мкм, приблизительно 1000 мкм, приблизительно 1025 мкм, приблизительно 1050 мкм, приблизительно 1075 мкм, приблизительно 1100 мкм, приблизительно 1125 мкм, приблизительно 1150 мкм, приблизительно 1175 мкм или приблизительно 1200 мкм или принимать любое значение толщины в интервале, ограниченном или находящемся между любыми из перечисленных выше значений. В некоторых вариантах осуществления суммарная толщина может находиться в интервале от приблизительно 100 мкм до приблизительно 750 мкм.
Каждый слой многослойного материала может иметь определенную толщину, и суммарная толщина всех слоев может представлять собой суммарную толщину многослойного материала. Каждый слой может иметь толщину, составляющую приблизительно 10 мкм, приблизительно 25 мкм, приблизительно 50 мкм, приблизительно 75 мкм, приблизительно 100 мкм, приблизительно 125 мкм, приблизительно 150 мкм, приблизительно 175 мкм, приблизительно 200 мкм, приблизительно 225 мкм, приблизительно 250 мкм, приблизительно 275 мкм, приблизительно 300 мкм, приблизительно 325 мкм, приблизительно 350 мкм, приблизительно 375 мкм, приблизительно 400 мкм, приблизительно 425 мкм, приблизительно 450 мкм, приблизительно 475 мкм, приблизительно 500 мкм, приблизительно 525 мкм, приблизительно 550 мкм, приблизительно 575 мкм, приблизительно 600 мкм, приблизительно 625 мкм, приблизительно 650 мкм, приблизительно 675 мкм, приблизительно 700 мкм, приблизительно 725 мкм, приблизительно 750 мкм, приблизительно 775 мкм, приблизительно 800 мкм, приблизительно 825 мкм, приблизительно 850 мкм, приблизительно 875 мкм, приблизительно 900 мкм, приблизительно 925 мкм, приблизительно 950 мкм, приблизительно 975 мкм, приблизительно 1000 мкм, приблизительно 1025 мкм, приблизительно 1050 мкм, приблизительно 1075 мкм, приблизительно 1100 мкм, приблизительно 1125 мкм, приблизительно 1150 мкм, приблизительно 1175 мкм или любую толщину в интервале, ограниченном или находящемся между любыми из перечисленных выше значений. В вариантах осуществления, в которых используют ALCAR, толщина соответствующих слоев может находиться в интервале от приблизительно 230 мкм до приблизительно 720 мкм.
Структура ячеистого подложечного листа 102 может обеспечивать требуемые свойства паронепроницаемости и/или влагонепроницаемости, которые могут повышать устойчивость фармацевтической композиции, обеспечивая в то же время структурную жесткость, которая препятствует сворачиванию многослойного материала. Как обсуждалось выше, герметическое соединение ячеистого подложечного листа и крышки способно по существу предотвращать инфильтрацию воды внутрь герметизированной упаковки. Сворачивание многослойного материала представляет собой характерную особенность, которой обладают блистерные упаковки, изготовленные на предшествующем уровне техники, которые имеют такие размеры и длину, требуемые для содержания ингаляторного картриджа с размерами, описанными в настоящем документе.
Блистерная упаковка 100 на фиг. 8 может дополнительно содержать верхнюю часть или крышку 114, которая может быть изготовлена из пленки или листа, включающего один или несколько слоев материала. Материалы, подходящие для изготовления крышки 114, могут включать, но не ограничиваются этим, фольговый материал, такой как алюминий, медь и/или полимер или сополимер. Полимеры могут включать сложные полиэфиры, такие как полиэтилентерефталат (PET) и/или модифицированный гликолем полиэтилентерефталат (PETG). Другие полимеры, которые можно использовать, представляют собой полимер L-молочной кислоты, поликапролактон, сополимер лактида и гликолида, сополимер этилена и винилацетата, сополимер гидроксибутирата и валерата, полидиоксанон, полимер сложного ортоэфира, полиангидрид, полигликолевая кислота, полимер D,L-молочной кислоты, сополимер гликолевой кислоты и триметиленкарбоната, полимер сложного эфира фосфорной кислоты, полифосфоэфируретан, полиаминокислоты, цианоакрилаты, политриметиленкарбонат, полииминокарбонат, сополимеры простых эфиров и сложных эфиров (например, PEO/PLA), полиуретаны, кремнийорганические полимеры, сложные полиэфиры, полиолефины, сополимеры полиизобутилена и этилена и альфа-олефинов, акриловые полимеры и сополимеры, этилен совинилацетат, полибутилметакрилат, винилгалогенидные полимеры и сополимеры (например, поливинилхлорид), простые эфиры поливинилового спирта (например, поливинилметиловый эфир), поливинилиденгалогениды (например, поливинилиденфторид и поливинилиденхлорид), полиакрилонитрил, поливинилкетоны, поливинилароматические соединения (например, полистирол), сложные эфиры поливинилового спирта (например, поливинилацетат), сополимеры акрилонитрила и стирола, сополимеры ABS, полиамиды (например, нейлон 66 и поликапролактам), поликарбонаты, полиоксиметилены, полиимиды, простые полиэфиры, вискоза, полиуретаны, целлофан и карбоксиметилцеллюлоза.
Крышка 114 на фиг. 8 содержит двухслойную пленку. Однако в других вариантах осуществления можно использовать крышку 114, которая может включать один, два, три, четыре, пять, шесть, семь, восемь, девять или десять слоев. В одном варианте осуществления число используемых слоев может представлять собой число или значение суммарной толщины, которое требуется, чтобы по существу предотвращать инфильтрацию воды внутрь герметизированной упаковки. Крышка 114 может иметь суммарную толщину, составляющую от приблизительно 5 мкм до приблизительно 100 мкм, от приблизительно 10 мкм до приблизительно 75 мкм или от приблизительно 20 мкм до приблизительно 50 мкм. Каждый слой материала, который используют для изготовления крышки 114, может иметь толщину, составляющую приблизительно 5 мкм, приблизительно 10 мкм, приблизительно 15 мкм, приблизительно 20 мкм, приблизительно 25 мкм, приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 40 мкм, приблизительно 45 мкм, приблизительно 50 мкм, приблизительно 55 мкм, приблизительно 60 мкм, приблизительно 65 мкм, приблизительно 70 мкм, приблизительно 75 мкм, приблизительно 80 мкм, приблизительно 85 мкм, приблизительно 90 мкм или приблизительно 95 мкм, или любую толщину в интервале, ограниченном или находящемся между любыми из перечисленных выше значений. В одном варианте осуществления крышка 114 может иметь толщину в интервале между приблизительно 30 мкм и приблизительно 150 мкм. В еще одном варианте осуществления крышка 114 может иметь толщину, составляющую приблизительно 30 мкм, и включать внешний слой 130, который составляют мягкая алюминиевая фольга, грунтовочный материал и покровный лаковый слой, и внутренний слой 132 термически герметизированного полимерного покрытия. Мягкая фольга может обладать устойчивостью к проколам и разрывам, а также может обеспечивать определенный уровень долговечности упаковки.
Фиг. 9 иллюстрирует продольное сечение блистерной упаковки 100, содержащей пять рядов блистерных ячеек и подвижный купол 108 в каждом из рядов 106. На данном чертеже использован только один слой 134 полимерного материала для изготовления ячеистого подложечного листа 102, но, как описано выше, можно использовать и большее число слоев. Крышка 114 включает как внешний слой 130, так и внутренний слой 132. Однако, как описано выше, можно использовать большее или меньшее число слоев для изготовления крышки 114.
В одном варианте осуществления, который проиллюстрирован на фиг. 9, картридж 136 имеет форму, которая соответствует полости 104. Купольная часть 138 картриджа 136, в котором может находиться сухое порошковое лекарственное средство, может соответствовать куполу 108, и верхняя часть 140 картриджа 136 может находиться на соединении уступа 110 и фиксирующего крышку картриджа приспособления 112. Однако любой картридж может находиться внутри блистерной упаковки, как описано в настоящем документе. Ячеистые подложечные листы можно приспосабливать в соответствии с дополнительными и/или различными картриджами.
Фиг. 10 иллюстрирует вариант осуществления, в котором картридж может находиться в независимой полости 142. Здесь ячеистый подложечный лист 144 может соединяться с крышкой 114 в каждом пространстве между полостями 142, 142' 142" в ряду 106. По существу, в каждом пространстве между соседними полостями 142 может образоваться канал 146, в котором ячеистый подложечный лист и покровный материал могут присоединяться друг к другу. Как и в предыдущем случае, здесь каждая полость может по-прежнему включать купол 108, уступ 110 и фиксирующее крышку картриджа приспособление 112.
Кроме того, на фиг. 10 могут быть использованы перфорации 148 в ячеистом подложечном листе 144, чтобы предоставить пациенту возможность отрывать ряд блистерной упаковки 100 и уменьшать перевозимый объем. Поскольку в некоторых вариантах осуществления могут быть предусмотрены три дозы, простое отрывание ряда от блистерной упаковки может представлять собой полезное свойство для дней принятия лекарственного средства. В других вариантах осуществления могут быть предусмотрены перфорации, позволяющие отделять индивидуально каждую полость ячеистого подложечного листа 144.
Соединение между крышкой 114 и ячеистым подложечным листом 144 (см. фиг. 9) может различаться в зависимости от конкретного требования. В одном варианте осуществления соединение между крышкой 114 и ячеистым подложечным листом 144 может быть постоянным, таким образом, что фольгу необходимо разрывать для получения доступа к содержимому полости. Как проиллюстрировано на фиг. 11A, в крышке 114 можно сделать прокол 150, обеспечивающий извлечение отдельного картриджа из определенной полости 104 в ячеистом подложечном листе 144. В других вариантах осуществления, включающих ячеистый подложечный лист 102 (фиг. 4), крышку 114 можно прокалывать, чтобы обеспечивать извлечение нескольких, например, трех картриджей.
В еще одном варианте осуществления соединение между крышкой 114 и ячеистым подложечным листом 102 может быть полупостоянным, таким образом, что фольгу можно отслаивать, чтобы получать доступ к содержимому полости. Как проиллюстрировано на фиг. 11B, крышку 114 можно отслаивать 152, что позволяет извлекать отдельные картриджи из определенной полости 104 в ячеистом подложечном листе 144. В других вариантах осуществления, включающих ячеистый подложечный лист 102 (фиг. 4), крышку 114 можно отслаивать, обеспечивая извлечение нескольких, например, трех картриджей. В некоторых вариантах осуществления, отслаиваемая перфорация 154 может быть предусмотрена таким образом, что после отслаивания за рядом 106 крышку можно отрывать по отслаиваемой перфорации 154 и выбрасывать.
В еще одном варианте осуществления, описанном в настоящем документе, способы изготовления блистерных упаковок, которые описаны в настоящем документе, автоматизированы для работы в непрерывном режиме на имеющейся в продаже блистерной термоформовочной машине. Данные способы могут включать изготовление подложечного материала или листа и покровной пленки; помещение подложечного материала и покровной пленки в рулонной форме в машину и обработку подложечного материала и покровной пленки в машине. Данный процесс можно осуществлять согласно производственным рекомендациям. В одном варианте осуществления подложечный материал втягивают в формовочное устройство, где его можно формовать, используя нагревание при температуре, составляющей от приблизительно 120°C до приблизительно 150°C или от приблизительно 120°C до приблизительно 135°C; и/или давление воздуха и механические пробки, предназначенные для изготовления блистерных полостей или ячеек при заданной скорости, составляющей, например, от 10 до 30 оборотов в минуту или от приблизительно 12 до приблизительно 25 оборотов в минуту. В одном варианте осуществления давление воздуха может составлять от приблизительно 4 до приблизительно 7 бар (от 400 до 700 кПа) или от приблизительно 5 до приблизительно 6 бар (от 500 до 600 кПа). Используемое нагревание, давление воздуха и механические пробки будут зависеть от размера изготавливаемой блистерной ячейки и используемого подложечного материала. Изделие в форме картриджа можно автоматически помещать в блистерные полости, после чего поверх наносят покровный материал. Совместно сформованные и наполненные подложка и крышка поступают на герметизирующую установку, где нагретые инструменты осуществляют активацию слоя герметизирующего материала крышки, изготавливая герметизированную блистерную упаковку. После герметизации полотно из сформованных и наполненных блистерных упаковок поступает на перфорационную установку и затем, наконец, на высекательную установку, которая производит конечные блистерные упаковки.
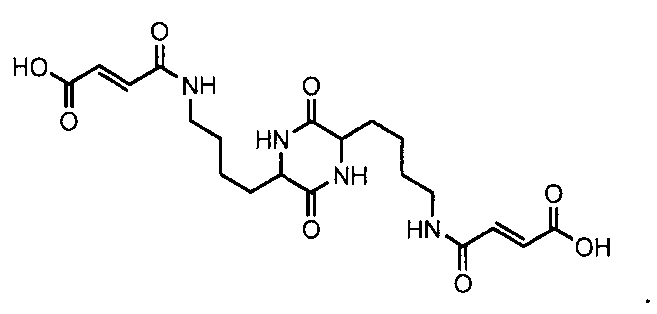
В одном варианте осуществления блистерная упаковка может быть предназначена для содержания 15 заполненных лекарственным средством картриджей. В таком варианте осуществления заполненные лекарственным средством картриджи могут быть расположены пятью рядами по три в каждом ряду. В еще одном варианте осуществления блистерная упаковка может быть предназначена для содержания 21 заполненного лекарственным средством картриджа. В таком варианте осуществления заполненные лекарственным средством картриджи могут быть расположены семью рядами по три в каждом ряду. Картриджи, которые можно использовать с блистерными упаковками, могут содержать фармацевтические композиции, предназначенные для легочного введения. В некоторых вариантах осуществления фармацевтические композиции, которые могут содержаться в картриджах, предназначены, в частности, для введения биологических препаратов, включающих пептиды и белки, которые являются склонными к разложению. В некоторых вариантах осуществления картридж в блистере содержит композицию, содержащую дикетопиперазин, такой как вещества, описанные в патентах US №№ 7794754, 7799344, 7803404, 6444226, 6555127, 6440463, 6428771, 6071497, 5352461 и 5503852 и патентной заявке US № 12/813839 (US № 2010/317574) и WO 2010/144789, описания которых во всей своей полноте включаются в настоящий документ в такой степени, насколько они относятся к дикетопиперазинам и лекарственным композициям. Примерный дикетопиперазин, включает фумарилдикетопиперазин или бис-3,6-(N-фумарил-4-аминобутил)-2,5-дикето-дикетопиперазин (FDKP). FDKP представляет собой примерный дикетопиперазин, который используется для легочного введения и имеет формулу:

FDKP образует предпочтительную матрицу из микрочастиц, потому что он имеет низкую растворимость в кислоте, но легко растворяется при нейтральном или основном значении pH. Эти свойства обеспечивают кристаллизацию FDKP, кристаллы которого самоорганизуются и образуют микрочастицы в кислой среде, которые являются подходящими для легочного введения, имея диаметр, составляющий от приблизительно 0,5 до приблизительно 10 мкм, что позволяет им проникать в легкие, успешно преодолевая большинство природных барьеров. Картриджи, содержащие композиции для легочного введения, в состав которых входят соли дикетопиперазинов, такие как соли, описанные в патенте US № 7820676, и другие композиции для использования в картриджах, также могут быть упакованы в блистерную упаковку согласно настоящему изобретению.
В одном варианте осуществления описан способ сборки блистерной упаковки, содержащей картридж в каждом блистере. В одном варианте осуществления картридж может представлять собой состоящий из двух деталей картридж (который описан выше), содержащий контейнер или чашу и крышку или верхнюю часть, как представлено и описано в патенте US № D613849 и патентной заявке US № 12/484137 (US № 2009/0308392), соответственно. Кроме того, картридж может иметь конфигурацию герметизации или предварительного дозирования и конфигурацию дозирования. В вариантах осуществления, описанных в настоящем документе, способ включает изготовление картриджей, состоящих из двух полученных инжекционным формованием частей, причем каждый картридж содержит крышку и чашу; наполнение чаши лекарственной композицией; помещение крышки картриджа поверх чаши и фиксации крышки на чаше в транспортировочной или герметичной конфигурации таким образом, что порошок лекарственного средства оказывается герметизированным в чаше. В этом и других вариантах осуществления блистерная упаковка предназначена для транспортировки картриджей, предотвращая несвоевременное перемещение чаши картриджа в конфигурацию дозирования.
Соответственно, блистерные упаковки могут быть предназначены для предотвращения движения картриджа внутри блистерной полости, что обеспечивается путем изготовления ряда сформованных приспособлений, которые фиксируют каждый картридж внутри блистерной ячейки, а также препятствуют их соприкосновению друг с другом. В этом и других вариантах осуществления блистерная упаковка 100 может быть выполнена таким образом, что каждая блистерная ячейка или полость 104 содержит площадь уступа 110, причем крышка картриджа в конфигурации герметизации может находиться на площади уступа 110, что, в свою очередь, позволяет подвешивать чашу внутри купола 108 или сферического свободного пространства блистера, защищая лекарственный продукт от механического воздействия. В этом варианте осуществления чаша картриджа в блистере может быть закругленной со всех сторон, имея куполообразную форму, и можно предотвращать соскальзывание чаши в положение дозирования во время нахождения картриджа в блистерной упаковке.
В одном варианте осуществления блистерная упаковка 100 может также иметь такую конструкцию и конфигурацию, которая предназначена для совмещения с блистерными ячейками другой блистерной упаковки таким образом, чтобы уменьшать размер товарной упаковки во время транспортировки и хранения продукта. В одном варианте осуществления способ включает переворачивание или опрокидывание одной блистерной упаковки 100 таким образом, что образующие пару блистерные упаковки могут быть обращены друг к другу своими полостями, и последующее приближение их друг к другу таким образом, что вступают в контакт оборотные стороны блистерных зон уступов 110 на обращенных друг к другу блистерных упаковках. Такое расположение может позволять паре блистерных упаковок перекрываться друг с другом, уменьшая суммарный объем по сравнению с тем объемом, который бы занимали блистерные упаковки при простой укладке. В одном варианте осуществления фармацевтическая упаковка может содержать одну или несколько блистерных упаковок, которые описаны в настоящем документе; при этом блистерная упаковка заключена в обертывающую фольгу, материал которой представляет собой мягкий алюминиевый материал.
В примерном варианте осуществления блистерную упаковку 100 можно использовать для приема лекарственного средства по три раза в сутки в течение пяти суток. Такую блистерную упаковку составляют пять термоформованных полостей 104, предназначенных для содержания по три заполненных лекарственным средством картриджа 136 в каждом ряду 106. Каждая полость 104, содержащая три картриджа, может занимать площадь, составляющую приблизительно по пять миллиметров в каждом направлении, и является герметизированной со всех четырех сторон, причем герметизирующие швы могут иметь рифление, что дополнительно увеличивает суммарную площадь герметизации.
Перфорация, которая описана выше, может быть предусмотрена вокруг каждой блистерной ячейки, в том числе секции или ряда 106, таким образом, что каждую секцию можно отделять от прилегающей секции. Отдельные полости 104, содержащие, например, один, два, три или более картриджей, можно отдельно помещать в карман или кошелек. Таким образом, конечный пользователь может носить с собой такое количество лекарственного продукта, которое может потребоваться для любого определенного случая дозировки. В одном варианте осуществления для извлечения картриджа пользователь нажимает на купол блистера большим или другим пальцем, в результате чего картридж извлекается через сломанную крышку из мягкой фольги. Такой способ открытия блистерной упаковки обычно называется продавливанием. Если его осуществлять аккуратно, один картридж можно извлекать из общей полости, объем которой содержит, например, три соприкасающихся картриджа, без перемещения двух остающихся картриджей. Можно изготавливать альтернативные конфигурации в зависимости от используемого лекарственного средства и числа доз, требуемых пациенту в течение данного периода времени.
В некоторых вариантах осуществления обработанные блистерные упаковки могут иметь воспроизводимую толщину многослойного материала во всех полостях. В некоторых вариантах осуществления среднеквадратическое отклонение может составлять от приблизительно 0,004 мм до приблизительно 0,023 мм.
В других вариантах осуществления после герметизации блистерная упаковка, описанная в настоящем документе, может не допускать практически никакого проникновения воды в течение периода, составляющего приблизительно 1 неделю, приблизительно 1 месяц, приблизительно 6 месяцев, приблизительно 1 год, приблизительно 2 года, приблизительно 3 года, приблизительно 4 года или приблизительно 5 лет. Например, менее чем приблизительно 0,05 г, менее чем приблизительно 0,02 г, менее чем приблизительно 0,01 г, менее чем приблизительно 0,001 г или менее чем приблизительно 0,0001 г воды может проникать внутрь герметизированной блистерной упаковки или в лекарственное средство. В еще одном варианте осуществления блистерные упаковки, описанные в настоящем документе, могут выдерживать проникновение воды в случае хранения при пониженной температуре, например, при 4°C.
В некоторых вариантах осуществления скорость проникновения водяного пара может составлять менее чем приблизительно 0,005 г воды на упаковку в сутки. В других вариантах осуществления скорость проникновения водяного пара может составлять менее чем приблизительно 0,003 г, 0,002 г, 0,001 г, 0,0005 г, 0,00005 г, 0,00001 г или 0,000005 г воды на упаковку в сутки. В одном варианте осуществления скорость проникновения водяного пара составляет менее чем приблизительно 4,0×10-5 г воды на упаковку в сутки.
На скорость проникновения водяного пара может также влиять температура хранения. Блистерные упаковки, описанные в настоящем документе, могут препятствовать проникновению воды в случае хранения при температуре, составляющей от приблизительно 10°C до приблизительно 35°C, от приблизительно 15°C до приблизительно 30°C, от приблизительно 20°C до приблизительно 25°C. В одном варианте осуществления блистерные упаковки, описанные в настоящем документе, могут препятствовать проникновению воды в случае хранения при комнатной температуре.
В одном варианте осуществления не только все блистерные упаковки являются герметизированными, но также картридж (картриджи) внутри блистерной упаковки могут также иметь герметизированный контейнер, включающий лекарственное средство. В некоторых вариантах осуществления лекарственное средство представляет собой сухой порошок, который описан в настоящем документе. В некоторых вариантах осуществления этот сухой порошок может не допускать по существу никакого проникновения воды в течение периода, составляющего приблизительно 1 неделю, приблизительно 1 месяц, приблизительно 6 месяцев, приблизительно 1 год, приблизительно 2 года, приблизительно 3 года, приблизительно 4 года, приблизительно 5 лет или приблизительно 10 лет.
Пример 1
Изготовление сборки блистерной упаковки
Рулоны, содержащие подложечный материал или лист и покровную пленку, изготавливали с использованием промышленного устройства для термоформования (Pharmworks TF-2X). Подложечный материал, состоящий из фторполимерного слоя между двумя поливинилхлоридными слоями, изготовлен компанией Klockner Pentaplast of America. Подложечный материал поступал при скорости, составляющей приблизительно 12 до 25 оборотов в минуту (об/мин), на установку для формования, где осуществлялось его формование с использованием сочетания нагревания, давления воздуха и механических пробок, размеры которых были предназначены для определенных размеров, требуемых для изготовления блистерных упаковок, как представлено на чертежах. В данном примере температура размягчения пластмассы для изготовления блистерных ячеек может находиться в интервале от приблизительно 130°C до приблизительно 150°C. Картриджи, содержащие фармацевтическую композицию, автоматически загружали в блистерные полости, затем покровный материал, который представляла собой мягкая алюминиевая фольга (Alcan), помещали поверх этой сборки. Сформованный и наполненный подложечный материал и покровный материал совместно поступали на герметизирующую установку, где инструменты, нагретые до температуры, составляющей от приблизительно 150°C до приблизительно 170°C, под давлением обеспечивали активацию слоя герметизирующего материала крышки, образуя герметизированный блистер. После герметизации полотно, содержащее сформованные и наполненные блистерные упаковки, поступало на перфорационную установку и затем, наконец, на высекательную установку, которая производила конечные блистерные упаковки.
Пример 2
Скорость проникновения водяного пара в блистерные упаковки
Блистерные упаковки, изготовленные в примере 1, испытывали на скорость проникновения водяного пара. Герметизированные блистерные упаковки, содержащие трехслойный ячеистый подложечный лист, включающий внешний и внутренний слои из поливинилхлорида и средний слой из ACLAR, и крышку из мягкой отпущенной фольги, сравнивали с блистерными упаковками, содержащими ячеистый подложечный лист, состоящий из одного слоя PET и имеющий такую же толщину, как трехслойный ячеистый подложечный лист, и крышку из мягкой фольги. В каждую блистерную упаковку впрыскивали по 3 мл воды (по 1 мл в каждую из трех блистерных ячеек), используя шприц с иглой № 29 (диаметр 0,33 мм, длина 13 мм), через подложку блистерной упаковки. После впрыскивания воды отверстие в подложечном материале закрывали пробкой из быстроотверждающегося эпоксидного клея. Проникновение водяного пара в упаковку анализировали в течение определенного периода, пропуская поток чистого сухого газообразного азота над упаковкой в герметизированном стеклянном контейнере и измеряя количество влаги, захваченной газообразным азотом. Измерение проникновения водяного пара в упаковку и выхода в герметизированный стеклянный контейнер анализировали в начале эксперимента и в течение последующего периода времени, используя прибор Mocon Permatran.
Фиг. 12 представляет график, иллюстрирующий данные из эксперимента, которые показывают типичные значения скорости проникновения водяного пара (WVTR) блистерной упаковки, которые выражены в граммах влаги в сутки и представлены на вертикальной оси, а значения времени представлены на горизонтальной оси. Кривая A (трехслойный ячеистый подложечный лист, содержащий ACLAR) и кривая B (полиэтилентерефталатный ячеистый подложечный лист) иллюстрируют результаты экспериментов. Данные показывают, что после короткого периода времени, когда измерительный прибор продували воздухом, значение WVTR быстро стабилизировалось на уровне, где скорость проникновения водяного пара является устойчивой, и почти не обнаруживалось после испытания в течение шести суток. Это демонстрирует, что целостность упаковки остается приемлемой с течением времени. Сравнительные данные для блистера, изготовленного с использованием традиционного полиэтилентерефталатного многослойного материала, которые представляет кривая B на фиг. 12, показывают, что этот материал не является настолько эффективным в предотвращении проникновения влаги через упаковку. Рассматривая фиг. 12, можно также отметить, что начальный пик, который содержит кривая A на фиг. 12, имеет отношение к водяному пару (атмосферному), присутствующему в начале эксперимента в резервуаре, для откачивания которого требуется приблизительно 12 часов.
Пример 3
Однородность полостей ячеистого подложечного листа
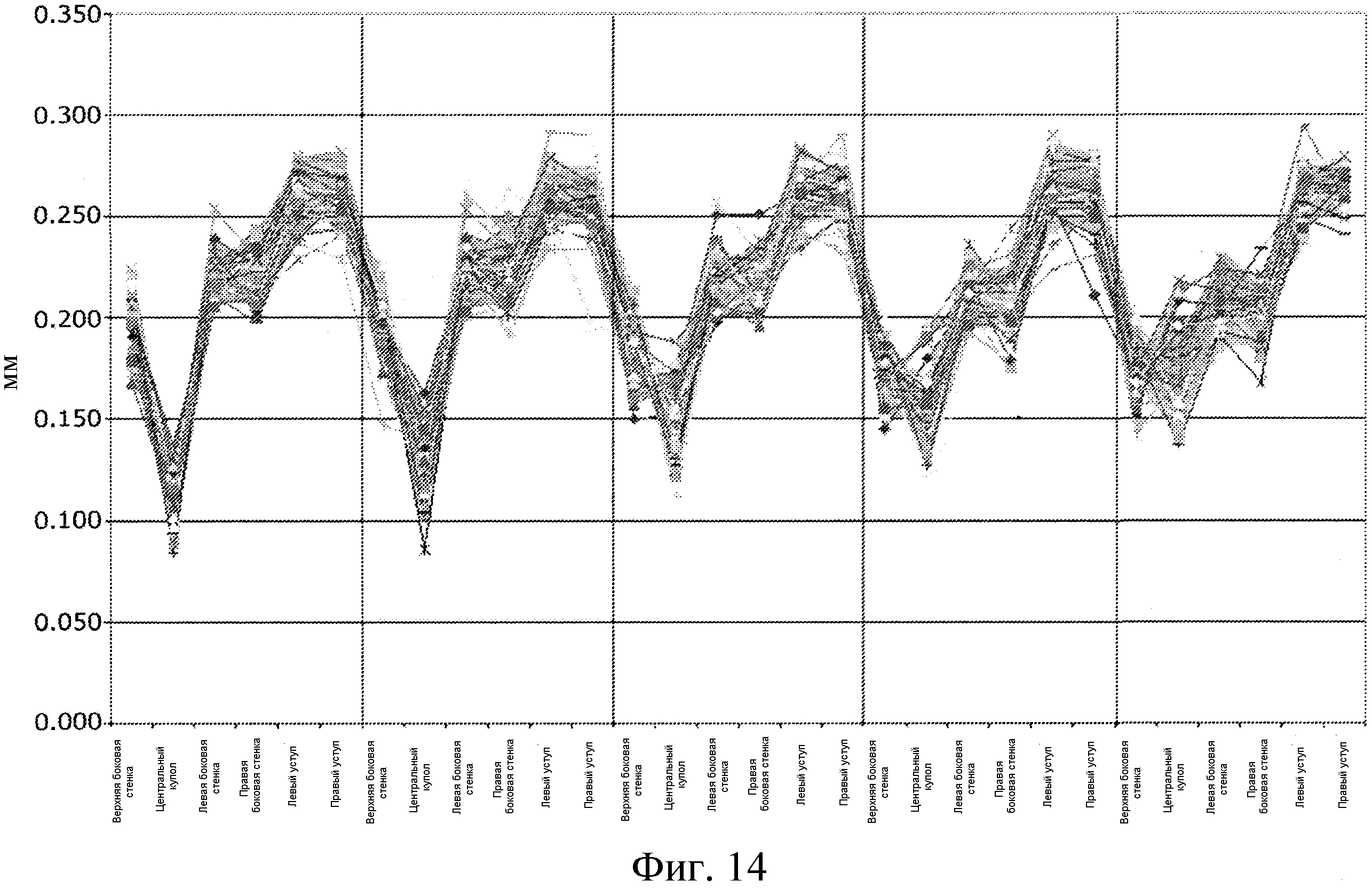
В данных экспериментах три различных многослойных ячеистых подложечных листа изготавливали аналогичным образом, как описано в примере 1, используя температуру, составляющую от 120 до 125°C для изготовления ячеистых подложечных листов, и температуру герметизации, составляющую от 155 и 165°C, при скорости от 12 до 25 оборотов в минуту и при давлении воздуха, составлявшем приблизительно 6 бар (600 кПа). Значения толщины полостей ячеистого подложечного листа измеряли в различных местах, как показано на фиг. 13, чтобы определять целостность и однородность блистерных ячеек или полостей.
Фиг. 14 представляет график, иллюстрирующий толщину в различных местах, обозначенных вдоль линии поперечного сечения, представленного на фиг. 13. Здесь ячеистый подложечный лист формовали из трехслойного материала, содержащего слои PVC, ACLAR и PVC, имеющие толщину 7,5 мил (0,19 мм), 3,0 мил (0,07 мм) и 7,5 мил (0,19 мм), соответственно. Самое тонкое место в ячеистом подложечном листе расположено у вершины купола, где толщина составляет от приблизительно 0,175 мм до приблизительно 0,075 мм), а наибольшие значения толщины были измерены на уступах, составляя от приблизительно 0,275 мм до приблизительно 0,225 мм.
Фиг. 15 представляет график, иллюстрирующий толщину в различных местах, обозначенных вдоль линии поперечного сечения, представленного на фиг. 13. Здесь ячеистый подложечный лист формовали из двухслойного материала, содержащего слои PVC и ACLAR, имеющие толщину 15 мил (0,38 мм) и 4,0 мил (0,10 мм), соответственно. Самое тонкое место в ячеистом подложечном листе расположено у вершины купола, где толщина составляет от приблизительно 0,187 мм до приблизительно 0,125 мм), а наибольшие значения толщины были измерены на уступах, составляя от приблизительно 0,225 мм до приблизительно 0,275 мм.
Фиг. 16 представляет график, иллюстрирующий толщину в различных местах, обозначенных вдоль линии поперечного сечения, представленного на фиг. 13. Здесь ячеистый подложечный лист формовали из двухслойного материала, содержащего слои CoPETG и ACLAR, имеющие толщину 12 мил (0,30 мм) и 4,0 мил (0,10 мм), соответственно. Самое тонкое место в ячеистом подложечном листе расположено у вершины купола, где толщина составляет от приблизительно 0,125 мм до приблизительно 0,165 мм), а наибольшие значения толщины были измерены на уступах, составляя от приблизительно 0,200 мм до приблизительно 0,275 мм.
Среднеквадратические отклонения для различных измерений, представленных на фиг. 14-16, проиллюстрированы на графике на фиг. 17. На основании графиков, представленных на фиг. 14-17, специалист в данной области техники может понимать, что значения толщины обработанных ячеистых подложечных листов могут быть воспроизводимыми, причем среднеквадратические отклонения составляют от приблизительно 0,004 до приблизительно 0,023 мм. Соотношение сигнала и шума для данных образцов может находиться в интервале от приблизительно 0,020 до приблизительно 0,135.
Пример 4
Проникновение водяного пара
Ячеистый подложечный лист, обернутый фольгой, выбирали вследствие характеристик проникновения водяного пара и пригодности для изготовления упаковки, имеющей соответствующую герметичность.
Технические условия поставщика в отношении характеристик проникновения водяного пара для материалов блистерных упаковок могут составлять менее чем 0,058 г воды/м2/сутки для многослойной подложечной пленки, менее чем 0,010 г воды/м2/сутки для многослойной крышки и менее чем 0,010 г воды/м2/сутки для многослойной обертки при измерении в соответствии со стандартом ASTM F1249 при температуре 37,8°C и относительной влажности 90%.
Герметичную сборку, состоящую из ячеистого подложечного листа и фольговой обертки, испытывали индивидуально, используя стандарт ASTM F1249 (Стандартный способ испытания скорости проникновения водяного пара через пластмассовую пленку и листы с использованием модулированного инфракрасного датчика). Образцы ячеистого подложечного листа изготавливали, вводя по 1 мл воды в каждую блистерную полоску и помещая непроницаемую эпоксидную смолу поверх отверстия, образованного иглой шприца. Так получался водный резервуар внутри блистерной полоски. Обернутые фольгой упаковки, содержащие блистерные ячейки, изготавливали, вводя по 1 мл воды в обертку и помещая непроницаемую эпоксидную смолу поверх отверстия, образованного иглой шприца. Характеристики проницаемости определяли, помещая образец в камеру прибора Mocon Permatran и продувая свободное пространство камеры сухим воздухом. Выходящий водяной пар может диффундировать и проникать через герметизированные исследуемые образцы, смешиваться с газом в свободном пространстве внутри камеры и поступать на инфракрасный датчик. Этот инфракрасный датчик измеряет долю энергии инфракрасного излучения, поглощаемого водяным паром, и производит электрический сигнал, амплитуда которого является пропорциональной концентрации водяного пара. Амплитуду электрического сигнала, производимого при исследовании образцов, затем сравнивали с сигналом, производимым при измерении калибровочной пленки, имеющей известную скорость проникновения водяного пара. Эту информацию затем использовали для вычисления скорости, при которой влага проникает через исследуемый материал. Исследование осуществляли при температуре 25°C и относительной влажности 100%.
Герметизированный ячеистый подложечный лист, который описан в настоящем документе и имеющий трехслойную структуру, в которой слой ACLAR находится между поливинилхлоридными слоями, составляющими внешние слои, проявляет скорость проникновения влаги, составляющую приблизительно 0,00004 г воды на блистерную упаковку в сутки, а сборка обернутой герметизированной упаковки проявляет скорость проникновения влаги, составляющую приблизительно 0,040 г воды на обернутую упаковку в сутки. Эти низкие значения демонстрируют пригодность данной конфигурации упаковки для картриджей, содержащих фармацевтические композиции. Данная конфигурация упаковки была проверена на практике во время долгосрочных исследований устойчивости путем испытания порошка компании Texas Instruments (TI) на содержание влаги. Данные не показывают никаких заметных изменений содержания влаги в отношении устойчивости в любых условиях (температура 5°C или 25°C и относительная влажность 60%), подтверждая пригодность для использования блистерной карты с фольговой оберткой в конфигурации упаковки инсулина TECHNOSPHERE®, производимого компанией MannKind Corp. (штат Калифорния).
Хотя настоящее изобретение конкретно представлено и описано со ссылкой на определенные варианты осуществления, следует отметить, что может оказаться желательным сочетание вариантов описанных выше и других отличительных признаков и функций или соответствующих альтернатив во множестве других различных систем или приложений. Кроме того, разнообразные непредсказуемые или непрогнозируемые в настоящее время соответствующие альтернативы, модификации, варианты или усовершенствования, которые могут быть сделаны впоследствии специалистами в данной области техники, также предназначены для включения в следующую формулу изобретения.
Если не указано иное, все числа, обозначающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и другие параметры, используемые в настоящем описании и формуле изобретения, следует во всех случаях дополнять термином "приблизительно". Соответственно, если не определено противоречащее условие, численные параметры, которые приведены в настоящем описании и прилагаемой формуле изобретения, представляют собой приближенные величины, которые могут изменяться в зависимости от желательных свойств, которые требуется получить посредством настоящего изобретения. По меньшей мере, не в качестве попытки ограничения применения доктрины эквивалентов к объему формулы изобретения, каждый численный параметр следует по меньшей мере истолковывать в свете количества приведенных значащих цифр и с использованием обычных правил округления.
Неопределенные и определенные артикли, а также аналогичные указатели, используемые в контексте описания настоящего изобретения (в частности, в контексте следующей формулы изобретения) следует истолковывать как относящиеся к единственному и множественному числу, если не определено другое условие в настоящем документе, или если это четко не противоречит контексту. Приведение интервалов значений в настоящем документе предназначено исключительно для того, чтобы служить в качестве способа краткого индивидуального описания каждого отдельного значения, находящегося в данном интервале. Если не указано иное в настоящем документе, каждое отдельное значение включается в описание, как если бы оно было индивидуально представлено в настоящем документе. Все способы, описанные в настоящем документе, можно осуществлять в любом подходящем порядке, если в настоящем документе не указано иное, или если это четко не противоречит контексту. Использование любых и всех примеров или обозначающих примеры выражений (например, "такой как"), которые присутствуют в настоящем документе, предназначено исключительно для улучшения представления настоящего изобретения и не устанавливает никакого ограничения в отношении объема настоящего изобретения, который представлен в формуле изобретения. Ни одно выражение в настоящем описании не следует истолковывать как указывающее, что какой-либо незаявленный элемент является существенным для практического осуществления настоящего изобретения.
Группировки альтернативных элементов или вариантов осуществления настоящего изобретения, которые описаны в настоящем документе, не следует истолковывать в качестве ограничений. Каждый элемент группы может быть представлен и заявлен индивидуально или в любом сочетании с другими элементами группы или с другими элементами, представленными в настоящем документе. Предполагается, что один или несколько элементов группы можно включать в группу или исключать из нее по соображениям удобства и/или патентоспособности. Когда происходит любое такое включение или исключение, настоящее описание следует рассматривать как содержащее группу в модифицированном виде, соответствуя, таким образом, письменному представлению всех групп Маркуша (Markush), которые используются в прилагаемой формуле изобретения.
В настоящем документе описаны определенные варианты осуществления настоящего изобретения, в том числе наилучший вариант, известный автору для осуществления настоящего изобретения. Разумеется, видоизменения этих описанных вариантов осуществления станут очевидными для обычных специалистов в данной области техники после ознакомления с представленным выше описанием. Автор настоящего изобретения предполагает, что специалисты в данной области техники будут использовать такие видоизменения соответствующим образом, и автор предусматривает, что настоящее изобретение может быть практически осуществлено иным образом, чем конкретно описано в настоящем документе. Соответственно, настоящее изобретение включает все модификации и эквиваленты предмета изобретения, приведенного в формуле изобретения, которое прилагается к настоящему описанию, насколько это разрешено действующим законодательством. Кроме того, любое сочетание описанных выше элементов во всех их возможных видоизменениях включается в настоящее изобретение, если в настоящем документе не указано иное, или если это четко не противоречит контексту.
Кроме того, в тексте настоящего описания содержатся многочисленные ссылки на патенты и печатные публикации. Каждая из представленных выше ссылок и печатных публикаций во всей своей полноте индивидуально включается в настоящий документ посредством ссылки.
В заключение, следует понимать, что варианты осуществления настоящего изобретения, которые описаны в настоящем документе, представляют собой иллюстрации принципов настоящего изобретения. Другие модификации, которые можно использовать, находятся в пределах объема настоящего изобретения. Таким образом, в качестве примера, но не ограничения, альтернативные конфигурации настоящего изобретения можно использовать в соответствии с описанием, представленным в настоящем документе. Соответственно, настоящее изобретение не является ограниченным только тем, что представлено и описано.
Реферат
Изобретение относится к блистерной упаковке для фармацевтического инъекционного формованного картриджа или капсулы. Блистерная упаковка содержит блистерный подложечный лист, одну или несколько полостей, имеющих свободное пространство, куполообразную структуру, уступ, внутреннюю поверхность и внешнюю поверхность, причем каждая из полостей предназначена для размещения картриджа, содержащего фармацевтическую композицию, и крышку, при этом полости имеют наружную и внутреннюю поверхность и уступ включает выемку или впадину, которая образует фиксирующее картридж приспособление на внутренней поверхности. Описан также способ изготовления такой упаковки. Блистерная упаковка по изобретению обеспечивает высокую степень влагонепроницаемости для защиты картриджа, содержащего лекарственную композицию, во время транспортировки и хранения. 2 н. и 34 з.п. ф-лы, 18 ил.
Формула
одну или несколько полостей, имеющих свободное пространство, куполообразную структуру, уступ, внутреннюю поверхность и внешнюю поверхность, причем каждая из указанных одной или нескольких полостей предназначена для размещения картриджа, содержащего фармацевтическую композицию; и
крышку, присоединенную к указанной блистерной упаковке,
при этом указанные одна или несколько полостей имеют наружную поверхность и внутреннюю поверхность, и уступ включает выемку или впадину, которая образует фиксирующее картридж приспособление на внутренней поверхности.

присоединение пленки к блистерному подложечному листу, при этом формуют одну или несколько полостей на ячеистом подложечном листе, содержащем по меньшей мере три слоя, выбранные из поливинилхлорида и ACLAR; причем картридж содержит контейнер и верхнюю часть и находится в указанных одной или нескольких полостях, когда пленку присоединяют к блистерному подложечному листу;
и блистерный подложечный лист опционально перфорируют для сегментирования полостей относительно друг друга.

Комментарии