Способ получения полидифенилен-n-арилфталимидинов - RU2713951C1
Код документа: RU2713951C1
Описание
Изобретение относится к химии высокомолекулярных соединений, в частности полиарилен-N-арилфталимидинов, конкретно к способу получения наиболее перспективных из них - полидифенилен-N-арилфталимидинов общей формулы I, содержащих как исключительно фталимидиновые группы, так и одновременно фталимидиновые и фталидные группы.

где Ar=С6Н5, 4-ClC6H4, 4-СН3С6Н4; p/q изменяется от 98/2 до 0/100.
Полидифениленфталиды и полидифенилен-N-арилфталимидины относятся к ароматическим термо-, тепло- и хемостойким полимерам, которые привлекают перспективами их использования для создания материалов с разнообразными ценными функциональными свойствами, в том числе исключительно важными при решении задач развития электроники, радиотехники и приборостроения [Салазкин С.Н. Высокомол. соед. Сер. Б, 2004, 46 (7), 1244-1269; Салазкин С.Н. Деп. в ВИНИТИ 17.03.2004, №449-В2004 (123 с); Лачинов А.Н., Воробьева Н.В. Усп. физ. наук, 2006, 176 (12), 1249-1266; Крайкин В.А., Беленькая С.К., Валямова Ф.Г., Салазкин С.Н. Высокомол. соед. Сер. А, 1999, 41 (10), 1655-1660].
Полидифенилен-N-арилфталимидины получают, используя два принципиально разных подхода.
Один из подходов - каталитическая самополиконденсация N-арил-3-хлор-3-(n-дифенил)фталимидинов по типу реакции электрофильного замещения Фриделя-Крафтса (схема 1) [Рафиков С.Р., Салазкин С.Н., Шуманский М.Е., Ахметзянов Ш.С., А.с. СССР SU 966093 (Б.И., 1982, №38, 123); Салазкин С.Н., Беленькая С.К., Земскова З.Г., Шуманский М.Е., Ахметзянов Ш.С, Крайкин В.А. Докл. РАН, 1997, 357 (1), 68-71].

Реакция протекает в нитробензоле при умеренных температурах (60-120°С) с использованием в качестве катализатора хлористого алюминия в количествах, в 2,5-3,5 раза превосходящих стехиометрические. Столь большое количество катализатора необходимо для эффективного осуществления поликонденсации, т.е. получения полимера с высокой молекулярной массой, и обусловлено, вероятней всего, сильным комплексованием катализатора с атомом азота фталимидиновой группировки в мономере и образующемся полимере (избыток катализатора необходим для компенсации его количеств, заблокированных в комплексе).
(Отметим, что катализаторы SbCl5 и InCl3, которые наиболее эффективны при получении электрофильным замещением по Фриделю - Крафтсу полидифениленфталида, в случае его азотистых аналогов -полидифениленфталимидинов - не работают, по-видимому, из-за мощного комплексования, полностью блокирующего катализатор [Салазкин С.Н., Беленькая С.К., Земскова З.Г., Шуманский М.Е., Ахметзянов Ш.С., Крайкин В.А. Докл. РАН, 1997, 357 (1), 68-71].)
Все полимеры, получаемые по схеме 1, не удается полностью очистить от катализатора, что является причиной их низкой термической стабильности. Этот существенный недостаток не позволяет рекомендовать рассматриваемый способ для получения полимера I (p/q ~ 0/100) с заявляемыми свойствами (прежде всего с высокой термостойкостью).
Другой подход - преобразование полидифениленфталида II под действием соли первичного ароматического амина с кислотой III в присутствии органического основания с атомом азота в основном центре при нагревании (схема 2) [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А. с. СССР SU 860484 (Б.И., 1982, №13, 265)].

На основании современных знаний и накопленного авторами опыта [Беленькая С.К.: Дис. … канд. хим. наук. Уфа: Ин-т химии БФ АН СССР, 1986; Салазкин С.Н. Деп. в ВИНИТИ 17.03.2004, №449-В2004 (123 с); Салазкин С.Н., Беленькая С.К., Земскова З.Г., Шуманский М.Е., Ахметзянов Ш.С., Крайкин В.А. Докл. РАН, 1997, 357 (1), 68-71] рассматриваемое преобразование можно представить как реакцию полидифениленфталида с первичным ароматическим амином IV в присутствии кислотного катализатора, поскольку соль ароматического амина с кислотой в присутствии основания да еще при высокой температуре реакции диссоциирует на амин (реагент) и кислоту, являющуюся катализатором реакции.
Первоначально в качестве соли первичного ароматического амина использовали гидрохлорид, в дальнейшем были использованы соли другого строения. В ряде случаев (ArNH2⋅HF, ArNH2⋅BF3, ArNH2⋅HBF4, ArNH2⋅H3BO3) это привело к повышению чистоты и улучшению термических характеристик получаемых полимеров, а также к ускорению реакции [Салазкин С.Н., Беленькая С.К., Земскова З.Г., Шуманский М.Е., Ахметзянов Ш.С., Крайкин В.А. Докл. РАН, 1997, 357 (1), 68-71; Беленькая С.К.: Дис. … канд. хим. наук. Уфа: Ин-т химии БФ АН СССР, 1986].
В качестве органического основания - акцептора кислоты используют сам ароматический амин IV (выполняющий одновременно роль реагента), или триалкиламины (триэтиламин, трибутиламин), или азаароматические соединения (пиридин, хинолин), или N-замещенный амид, например N-метилпирролидон (выступающий одновременно растворителем).
Реакцию осуществляют при 220-230°С как в открытой, так и в замкнутой (ампула) системе при использовании инертных растворителей и без них. В отсутствие инертного растворителя его роль выполняет первичный ароматический амин, используемый в избытке (в том числе твердый при комнатной температуре амин, поскольку при высокой температуре синтеза он находится в расплавленном состоянии). Полного превращения фталидных групп во фталимидиновые удается достичь в среде ароматического амина (молярное соотношение II: III: IV=1: 1-4: 8-20) или в толуоле в ампуле (молярное соотношение II: III: органическое основание = 1:8: 1,65). К сожалению, при атмосферном давлении ни в одном из использованных растворителей не удается осуществить полное превращение полиариленфталида II в полиариленфталимидин I (p/q ~ 0/100) даже при использовании 8-15-кратного избытка аминных реагентов III+IV [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А. с. СССР SU 860484 (Б.И., 1982, №13, 265)].
Превращение фталидных фрагментов полимера II во фталимидиновые фрагменты полимера I во всех рассмотренных условиях не сопровождается снижением молекулярной массы, т.е. основная полимерная цепь не подвергается деструкции. Выход продуктов превышает 87%.
Понижение температуры реакции и/или сокращение длительности реакции, а также уменьшение количества аминных реагентов снижает степень превращения фталидных фрагментов во фталимидиновые [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А. с. СССР SU 860484 (Б.И., 1982, №13, 265); Салазкин С.Н., Беленькая С.К., Земскова З.Г., Шуманский М.Е., Ахметзянов Ш.С., Крайкин В.А. Докл. РАН, 1997, 357 (1), 68-71]. (Отметим, что задача получения полидифенилен-N-арилфталимидинов I с р>0 не ставилась.)
Общий анализ результатов в этой области [Беленькая С.К.: Дис. … канд. хим. наук. Уфа: Ин-т химии БФ АН СССР, 1986; Салазкин С.И. Деп. в ВИНИТИ 17.03.2004, №449-В2004 (123 с); Салазкин С.Н., Беленькая С.К., Земскова З.Г., Шуманский М.Е., Ахметзянов Ш.С., Крайкин В.А. Докл. РАН, 1997, 357 (1), 68-71] убедительно свидетельствует о значительно лучшей термической устойчивости полидифенилен-N-арилфталимидинов, получаемых путем химического преобразования полидифениленфталидов по схеме 2. Поэтому именно этот способ был выбран нами в качестве прототипа.
К недостаткам способа-прототипа следует отнести:
1. Невозможность полного превращения исходного полидифениленфталида в полидифенилен-N-арилфталимидины в открытой системе во всех использованных высококипящих инертных органических растворителях (см. примеры 12-16 в [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А. с. СССР SU 860484 (Б.И., 1982, №13, 265)]);
2. Необходимость использования ароматического амина-реагента в качестве растворителя, т.е. в значительном избытке (см. примеры 1, 4, 5 в [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А. с. СССР SU 860484 (Б.И., 1982, №13, 265)]), или высокого давления при проведении реакции в толуоле (см. примеры 6, 7 в [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А. с. СССР SU 860484 (Б.И., 1982, №13, 265)]) для обеспечения полного превращения исходного полидифениленфталида в полидифенилен-N-арилфталимидины;
3. Сублимацию реагентов (солей ароматических аминов и твердых при комнатной температуре ароматических аминов) при проведении реакции в среде ароматического амина (главное препятствие в масштабной реализации получения полидифенилен-N-арилфталимидинов из полидифениленфталидов);
4. Отсутствие возможности регулировать получение сополимеров I с заданным соотношением фталидного и фталимидинового фрагментов за счет варьирования молярного соотношения реагентов.
Задачей настоящего изобретения является разработка более эффективного и технологичного способа получения полидифенилен-N-арилфталимидинов, в том числе содержащих заданное соотношение фталидных и фталимидиновых фрагментов.
Задача решается способом получения полидифенилен-N-арилфталимидинов общей формулы
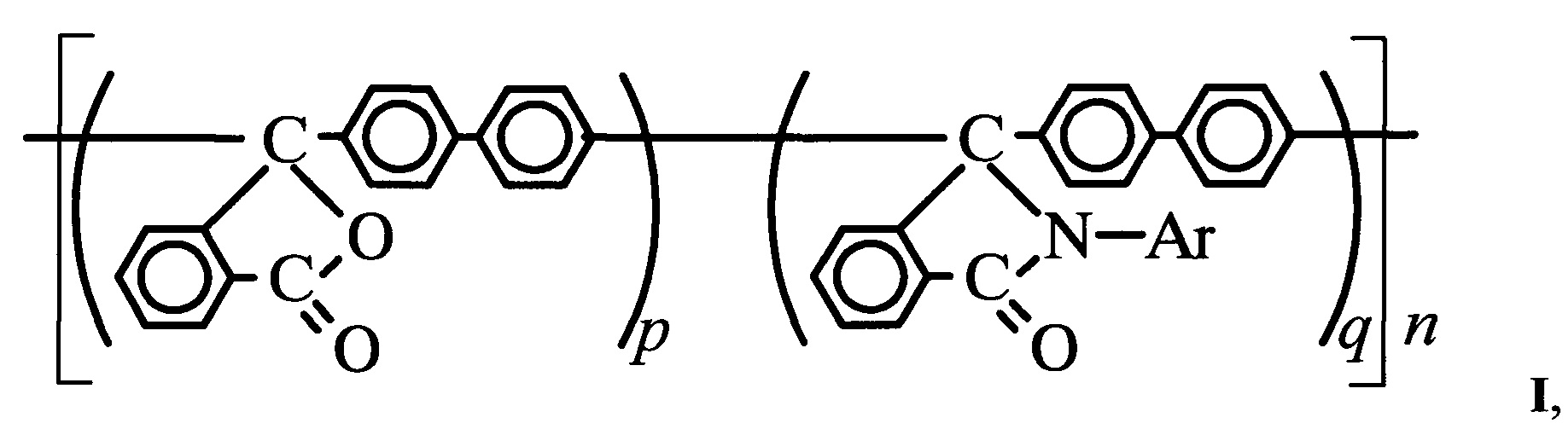
где Ar=С6Н5, 4-ClC6H4, 4-СН3С6Н4; p/q изменяется от 98/2 до 0/100,
включающим взаимодействие полидифениленфталида со смесью первичного ароматического амина и его соли с кислотой Бренстеда или Льюиса в инертном органическом растворителе при нагревании в открытой системе, при этом в качестве растворителя используют м-крезол (т. кип. 202-203°С).
В качестве соли первичного ароматического амина используют тетрафторборат, борфторид, гидрофторид или -хлорид, предпочтительно тетрафторборат вследствие повышенной реакционной способности (по сравнению с гидрохлоридом), безопасности и доступности (по сравнению с борфторидом и гидрофторидом), большей чистоты получаемого продукта (по сравнению с гидрохлоридом).
Реакцию осуществляют при нагревании от 170°С до температуры кипения реакционной смеси (превышающей 202-203°С с учетом увеличения температуры кипения раствора по сравнению с растворителем).
(Отметим, что отнесение м-крезола к инертным растворителям для рассматриваемого случая первоначально вызывало определенные сомнения, поскольку известно о протекании некоторых реакций между ароматическими аминами и гидроксилсодержащими соединениями, в частности фенолами (см. с. 21-32 в [Николаев Ю.Т., Якубсон A.M. Анилин. М.: Химия, 1984. - 148 с.]), однако в условиях экспериментов, проводимых авторами настоящего изобретения, подобных реакций не было обнаружено.)
В результате применения м-крезола в качестве растворителя неожиданно удалось достичь полного превращения исходного полидифениленфталида в гомополидифенилен-N-арилфталимидины в открытой реакционной системе при температуре кипения реакционной смеси за 24-30 ч с выходами 81-92% (см. примеры 1, 5-9, 11), о чем свидетельствуют ИК-спектры полученных полимеров (полное исчезновение полосы поглощения С=O-группы при 1780 см-1, характерной для валентных колебаний фталидного цикла, что при существующей точности определения состава полимера с помощью ИК-спектроскопии соответствует р≤0,5, и наличие полосы поглощения С=O-группы при 1680 см-1, характерной для валентных колебаний карбонильной группы фталимидинового цикла). Структура полученных гомополимеров подтверждается также результатами элементного анализа. Для полного превращения полидифениленфталида II в гомополидифениленфталимидины I было использовано от 0,85 до 2,01 моль соли ароматического амина с кислотой и от 3,57 до 5,19 моль ароматического амина на 1 моль полидифениленфталида.
Превращение не сопровождается снижением молекулярной массы, что подтверждается практически одинаковой приведенной вязкостью исходных полидифениленфталидов (с ηпр 0,20 и 0,60 дл/г) и полученных из них полидифенилен-N-арилфталимидинов. (Все измерения приведенной вязкости проводили для растворов, содержащих 0,5 г полимера в 100 мл хлороформа, при 25°С.)
Полидифенилен-N-арилфталимидины I (p/q ~ 0/100), полученные предлагаемым способом, имеют высокую термо- и теплостойкость, хорошие механические свойства, не уступая по этим характеристикам описанным ранее полимерам, полученным в среде избытка ароматических аминов. Например, полидифенилен-N-фенилфталимидин, синтезированный согласно примеру 1, имеет: температуру начала разложения на воздухе 480 и 520°С (определенную по потере 1% массы и по касательным соответственно), коксовое число 77-78, температуру начала размягчения ≥450°С, прочность пленки при разрыве 91 МПа и относительное удлинение при разрыве 12% (ср. с данными, приведенными в [Салазкин С.Н. Деп. в ВИНИТИ 17.03.2004, №449-В2004 (123 с.); Беленькая С.К.: Дис. … канд. хим. наук. Уфа: Ин-т химии БФ АН СССР, 1986]).
Как и при реализации способа-прототипа, сокращение длительности реакции (примеры 1-3), понижение температуры и количества ариламинных реагентов (примеры 3 и 4, 9 и 10) приводят к неполному превращению фталидных фрагментов полидифениленфталида в N-арилфталимидиновые с образованием сополимеров I (p/q≤98/2). В их ИК-спектрах присутствуют полосы поглощения С=O-группы, характерные как для фталидного, так и для фталимидинового циклов. Соотношение p/q определяют по соотношению интенсивностей (оптических плотностей) этих полос и по калибровочному графику, построенному по спектрам модельных соединений. Структуру полученных сополимеров подтверждают также данные элементного анализа.
В настоящем изобретении удалось осуществить с выходами 84-90% преобразование полифталида II в полифталимидины I с заданной степенью превращения за счет варьирования количества аминных реагентов по отношению к исходному полидифениленфталиду: для получения степени превращения q мольное соотношение II: III: IV должно составлять 1: ~(0,01q-0,02q): ~(0,035q-0,05q). (Отметим, что ранее задача получения полидифенилен-N-арилфталимидинов I с заданным соотношением фталидных и фталимидиновых фрагментов не ставилась.)
Заявляемый способ обеспечивает следующие существенные преимущества при получении полимеров I при атмосферном давлении по сравнению со способом-прототипом:
1. Сокращение расхода основного реагента (первичного ароматического амина) в несколько раз вследствие использования м-крезола вместо избытка ароматического амина в качестве растворителя (сравни пример 1 с примером 16 в таблице и пример 5 с примером 1 в [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А.с. СССР SU 860484 (Б.И., 1982, №13, 265)]);
2. Устранение забивания холодильника в процессе реакции и упрощение выгрузки реакционной массы из реактора в случае ароматических аминов, твердых при комнатной температуре (n-толуидина и n-хлоранилина), вследствие использования м-крезола вместо избытка ароматического амина в качестве растворителя;
3. Полное превращение полидифениленфталида в полидифенилен-N-арилфталимидины, не реализуемое в случае использования целого ряда отличных от м-крезола инертных органических растворителей [Рафиков С.Р., Салазкин С.Н., Земскова З.Г., Беленькая С.К. А.с. СССР SU 860484 (Б.И., 1982, №13,265)];
4. Возможность получения сополимеров I с заданным соотношением фталимидиновых и фталидных звеньев за счет варьирования количества ариламинных реагентов.
Можно утверждать, что заявляемый способ является надежной основой реализации масштабного получения полидифенилен-N-арилфталимидинов формулы I путем химического преобразования полидифениленфталида в открытой системе (при атмосферном давлении).
Технический результат изобретения - разработка эффективного и технологичного способа как полного преобразования полидифениленфталида в полидифенилен-N-арилфталимидины, так и с заданной степенью превращения.
Изобретение иллюстрируется примерами 1-16, результаты которых сведены в таблицу.
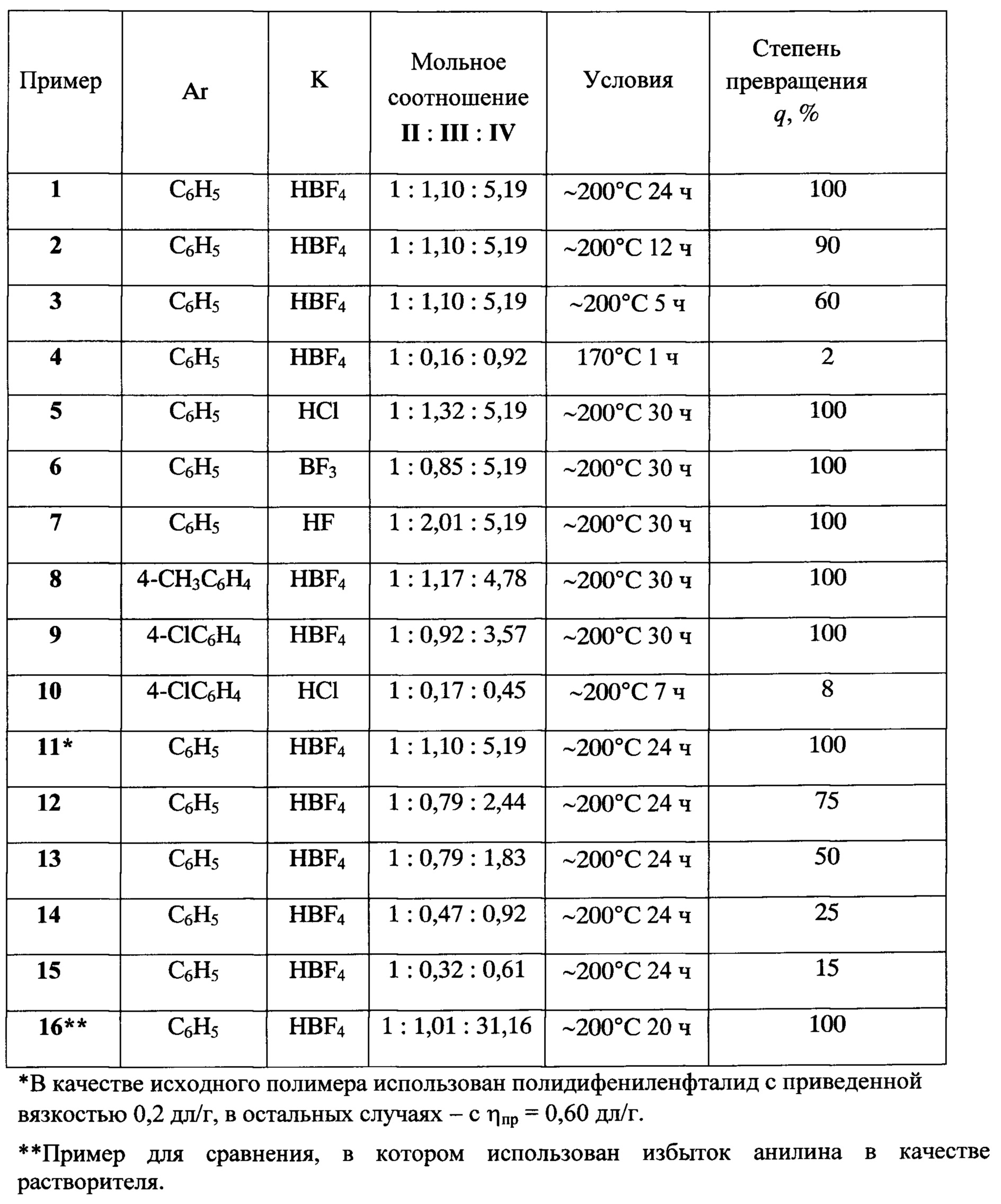
Пример 1
В четырехгорлую яйцевидную колбу, снабженную мешалкой с гидрозатвором, трубкой для подачи аргона, обратным воздушным холодильником с отводом для аргона и счетчиком пузырьков, после продувания аргоном загружают 1 г (3,52 ммоль - в расчете на молекулярную массу повторяющегося элементарного звена полимера) полидифениленфталида с
приведенной вязкостью (ηпр), равной 0,6 дл/г. Полимер растворяют в 5 мл м-крезола и к полученному раствору добавляют 0,7 г (3,87 ммоль) комплекса анилина с борфтористоводородной кислотой, 1,7 г (18,28 ммоль) анилина и 2 мл. м-крезола. В токе инертного газа при перемешивании реакционную массу нагревают на масляной бане до кипения и продолжают перемешивание при кипении в течение 24 ч. После охлаждения реакционную массу разбавляют хлороформом (17 мл) и выливают в метанол (70 мл). Выпавший полимер отфильтровывают, последовательно промывают метанолом, водой и ацетоном, высушивают в вакууме при ~ 100°С, вновь растворяют в хлороформе, осаждают метанолом, отфильтровывают, последовательно промывают метанолом, водой и ацетоном и высушивают в вакууме при постепенном подъеме температуры от 60 до 120°С. Выход полимера 1,1 г (87%), ηпр 0,61 дл/г. Степень превращения 100% (p/q≤0,5/99,5; р=0,5 - гарантированная чувствительность метода ИК-спектроскопии). Вычислено для C26H17NO, %: С 86,91; Н 4,74; N 3,90. Найдено, %: С 86,78; Н 4,92; N 4,08.
Пример 2
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при продолжительности реакции 12 ч. Выход полимера 1,1 г (89%), ηпр 0,61 дл/г. Степень превращения 90% (p/q=10/90).
Пример 3
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при продолжительности реакции 5 ч. Выход полимера 1,0 г (86%), ηпр 0,60 дл/г. Степень превращения 60% (p/q=40/60). Вычислено для 0,6C26H17NO+0,4C20H12O2, %: С 85,95; Н 4,53; N 2,34. Найдено, %: С 86,10; Н 4,45; N 2,21.
Пример 4
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при уменьшении количества комплекса анилина с борфтористоводородной кислотой до 0,1 г (0,55 ммоль) и анилина до 0,3 г (3,23 ммоль), понижении температуры до 170°С и продолжительности реакции до 1 ч. Выход полимера 0,9 г (90%), ηпр 0,60 дл/г. Степень превращения 2% (p/q=98/2).
Пример 5
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при использовании вместо комплекса анилина с борфтористоводородной кислотой его комплекса с хлористым водородом в количестве 0,6 г (4,63 ммоль) при продолжительности реакции 30 ч. Выход полимера 1,06 г (84%), ηпр 0,60 дл/г. Степень превращения 100% (p/q≤0,5/99,5). Вычислено для C26H17NO, %: С 86,91; Н 4,74; N 3,90. Найдено, %: С 87,15; Н 4,95; N 3,81.
Пример 6
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при использовании вместо комплекса анилина с борфтористоводородной кислотой его комплекса с трехфтористым бором в количестве 0,48 г (3,00 ммоль) при продолжительности реакции 30 ч. Выход полимера 1,1 г (87%), ηпр 0,60 дл/г. Степень превращения 100% (p/q≤0,5/99,5). Вычислено для C26H17NO, %: С 86,91; Н 4,74; N 3,90. Найдено, %: С 86,69; Н 4,98; N 4,12.
Пример 7
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при использовании вместо комплекса анилина с борфтористоводородной кислотой его комплекса с фтористым водородом в количестве 0,8 г (7,08 ммоль) при продолжительности реакции 30 ч. Выход полимера 1,07 г (85%), ηпр 0,60 дл/г. Степень превращения 100% (p/q≤0,5/99,5). Вычислено для C26H17NO, %: С 86,91; Н 4,74; N 3,90. Найдено, %: С 86,72; Н 4,99; N 4,01.
Пример 8
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при следующих загрузках: 1 г (3,52 ммоль) полидифениленфталида, 0,8 г (4,11 ммоль) комплекса n-толуидина с борфтористоводородной кислотой, 1,8 г (16,80 ммоль) n-толуидина и 7 мл м-крезола, при продолжительности 30 ч. Выделяют продукт так же, как описано в примере 1. Выход полимера 1,15 г (88%), ηпр 0,61 дл/г. Степень превращения 100% (p/q≤0,5/99,5). Вычислено для C27H19NO, %: С 86,86; Н 5,09; N 3,75. Найдено, %: С 86,65; Н 5,21; N 4,04.
Пример 9
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при следующих загрузках: 1 г (3,52 ммоль) полидифениленфталида, 0,7 г (3,25 ммоль) комплекса n-хлоранилина с борфтористоводородной кислотой, 1,6 г (12,55 ммоль) n-хлоранилина и 7 мл м-крезола, при продолжительности 30 ч. Выделяют продукт так же, как описано в примере 1. Выход полимера 1,23 г (89%), ηпр 0,61 дл/г. Степень превращения 100% (p/q≤0,5/99,5). Вычислено для C26H16ClNO, %: С 79,29; Н 4,07; С1 9,02; N 3,56. Найдено, %: С 79,08; Н 4,16; С1 9,20; N 3,71.
Пример 10
Синтез осуществляют в условиях, аналогичных описанным в примере 9, при следующих изменениях: использовании вместо комплекса n-хлоранилина с борфтористоводородной кислотой его комплекса с хлористым водородом в количестве 0,1 г (0,46 ммоль); уменьшении количества n-хлоранилина до 0,2 г (1,57 ммоль) и сокращении продолжительности синтеза до 7 ч. Выход полимера 0,95 г (92%), ηпр раствора полимера 0,60 дл/г. Степень превращения 8% (p/q=92/8).
Пример 11
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при использовании полидифениленфталида с ηпр=0,20 дл/г. Выход полимера 1,02 г (81%), ηпр 0,20 дл/г. Степень превращения 100% (p/q≤0,5/99,5).
Пример 12
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при уменьшении количества комплекса анилина с борфтористоводородной кислотой до 0,5 г (2,77 ммоль) и анилина до 0,8 г (8,60 ммоль). Выход полимера 1,08 г (90%), ηпр 0,61 дл/г. Степень превращения 75% (p/q=25/75).
Пример 13
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при уменьшении количества комплекса анилина с борфтористоводородной кислотой до 0,5 г (2,77 ммоль) и анилина до 0,6 г (6,45 ммоль). Выход полимера 0,99 г (87%), ηпр 0,60 дл/г. Степень превращения 50% (p/q=50/50).
Пример 14
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при уменьшении количества комплекса анилина с борфтористоводородной кислотой до 0,3 г (1,66 ммоль) и анилина до 0,3 г (3,23 ммоль). Выход полимера 0,90 г (84%), ηпр 0,60 дл/г. Степень превращения 25% (p/q=75/25).
Пример 15
Синтез осуществляют в условиях, аналогичных описанным в примере 1, при уменьшении количества комплекса анилина с борфтористоводородной кислотой до 0,2 г (1,10 ммоль) и анилина до 0,2 г (2,20 ммоль). Выход полимера 0,88 г (85%), ηпр 0,61 дл/г. Степень превращения 15% (p/q=85/15).
Пример 16 (сравнительный)
В четырехгорлую яйцевидную колбу, снабженную мешалкой с гидрозатвором, трубкой для подачи аргона, термометром, обратным воздушным холодильником с отводом для аргона и счетчиком пузырьков, после продувания аргоном загружают 1 г (3,52 ммоль) полидифениленфталида (с приведенной вязкостью 0,60 дл/г), 0,64 г (3,54 ммоль) комплекса анилина с борфтористоводородной кислотой и 10 мл анилина (110 ммоль). В токе аргона реакционную массу при перемешивании нагревают на масляной бане до кипения (~ 200°С) и продолжают перемешивание при этой температуре в течение 20 ч. Затем реакционную массу выгружают в подкисленную воду (50 мл воды и 7 мл концентрированной соляной кислоты); твердый продукт отфильтровывают, измельчают, промывают водой и сушат в вакууме при 100°С. Высушенный полимер растворяют в 20 мл хлороформа, профильтрованный раствор при перемешивании вливают в 150 мл метанола, выпавший полимер отфильтровывают и последовательно промывают метанолом и ацетоном, после чего высушивают в вакууме при 100-110°С. Выход полимера 1,12 г (89%), ηпр 0,61 дл/г.Степень превращения 100% (p/q≤0,5/99,5).
Реферат
Изобретение относится к химии высокомолекулярных соединений, конкретно к способу получения термо-, тепло- и хемостойких полидифенилен-N-арилфталимидинов общей формулы I, где Ar=СН, 4-ClCH, 4-СНСН; p/q от 98/2 до 0/100. Предложен способ получения полимера I взаимодействием полидифениленфталида со смесью первичного ароматического амина и его соли с кислотой, предпочтительно тетрафторбористоводородной, при атмосферном давлении в мета-крезоле при нагревании от 170°С до температуры кипения реакционной смеси. Технический результат изобретения - разработка эффективного и технологичного способа преобразования полидифениленфталида в полидифенилен-N-арилфталимидины с заданной степенью превращения q. 3 з.п. ф-лы, 16 пр., 1 табл.
Формула

Документы, цитированные в отчёте о поиске
Полиарилендифталиды и способ их получения
