Комбинации, включающие белки cry3aa и cry6aa, для предотвращения развития устойчивости у кукурузных корневых жуков (diabrotica spp.) - RU2576005C2
Код документа: RU2576005C2
Чертежи







Описание
Предпосылки создания изобретения
Люди выращивают кукурузу для применения в пищу и в качестве источника энергии. Кукуруза представляет собой важную сельскохозяйственную культуру. Она является важным источником пищи, пищевых продуктов и корма для животных во многих регионах мира. Насекомые употребляют в пищу и повреждают растения и, таким образом, подрывают эти усилия людей. Ежегодно миллиарды долларов тратятся для борьбы с насекомыми-вредителями, и еще миллиарды теряются вследствие причиняемого ими ущерба.
Вред, наносимый насекомыми-вредителями, является основным фактором потери урожаев кукурузы во всем мире, несмотря на использование защитных мер, таких как химические пестициды. В связи с этим, в сельскохозяйственные культуры, такие как кукуруза, методами генной инженерии были введены гены устойчивости к насекомым для борьбы с ущербом, наносимым насекомыми, и для снижения потребности в традиционных химических пестицидах.
Ежегодно, более 10 миллионов акров (более 4050000 га) кукурузных полей в США заражаются комплексом видов кукурузного корневого жука. Комплекс видов кукурузного корневого жука включает северного кукурузного корневого жука (Diabrotica barberi), южного кукурузного корневого жука (D. undecimpunctata howardi) и западного кукурузного корневого жука (D. virgifera virgifera). Другие виды включают Diabrotica virgifera zeae (Мексиканский кукурузный корневой жук), Diabrotica balteata (Бразильский кукурузный корневой жук) и комплекс Бразильского кукурузного корневого жука (Diabrotica viridula и Diabrotica speciosa).
Обитающие в почве личинки этих видов Diabrotica питаются корнями растений кукурузы, вызывая полегание. Полегание в конечном счете снижает урожайность и часто приводит к гибели растения. Употребляя в пищу пестичные столбики кукурузы, взрослые жуки уменьшают опыление и, поэтому, пагубно воздействуют на урожай зерна кукурузного растения. Кроме того, взрослые особи и личинки рода Diabrotica атакуют тыквенные культуры (огурцы, дыни, тыквы и т.д.) и многие овощные и полевые культуры в промышленном растениеводстве, а также такие, которые выращиваются в приусадебных огородах.
Синтетические органические химические инсектициды были первоочередными инструментами, используемыми для борьбы с насекомыми-вредителями, но биологические инсектициды, такие как инсектицидные белки, полученные из Bacillus thuringiensis (Bt), играли важную роль в некоторых регионах. Способность получения устойчивых к насекомым растений посредством трансформации генами инсектицидного белка Bt радикально изменила современное сельское хозяйство и повысила значение и ценность инсектицидных белков и их генов.
Инсектицидные кристаллические белки из некоторых штаммов Bacillus thuringiensis (B.t.) хорошо известны в данной области техники. См., например, Hofte et al, Microbial Reviews, Vol. 53, № 2, pp. 242-255 (1989). Эти белки обычно продуцируются бактериями в виде протоксинов с молекулярной массой приблизительно 130 кДа, которые затем расщепляются протеазами в средней кишке насекомых после попадания в пищеварительную систему насекомого для продукции корового токсина с молекулярной массой приблизительно 60 кДа. Эти белки известны как кристаллические белки, потому что в некоторых штаммах B.t. могут наблюдаться отчетливые кристаллические включения со спорами. Эти кристаллические включения часто составлены из нескольких различных белков.
Одной группой генов, которые использовались для получения трансгенных, устойчивых к насекомым культур, являются дельта-эндотоксины из Bacillus thuringiensis (B.t.). Дельта-эндотоксины были успешно экспрессированы в таких сельскохозяйственных культурах как хлопок, картофель, рис, подсолнечник, а также кукуруза, и, как оказалось, обеспечивают превосходный контроль над насекомыми-вредителями (Perlak, F.J et al. (1990) Bio/Technology 8, 939-943; Perlak, F.J. et al. (1993) Plant Mol. Biol. 22: 313-321; Fujimoto H. et al. (1993) Bio/Technology 11: 1151-1155; Tu et al. (2000) Nature Biotechnology 18: 1101-1104; PCT публикация международной патентной заявки WO 01/13731; и Bing J W et al. (2000) Efficacy of Cry IF Transgenic Maize, 14thBiennial International Plant Resistance to Insects Workshop, Fort Collins, Colo).
Несколько белков Bt использовались для создания устойчивых к насекомым трансгенных растений, которые были успешно зарегистрированы и в настоящее время запущены в серийное производство. Они включают Cry1Ab, Cry1Ac, Cry1F, Cry1A.105, Cry2Ab, Cry3Aa, Cry3Bb и Cry34/35Ab в кукурузе, Cry1Ac и Cry2Ab в хлопке и Cry3A в картофеле.
Выпускаемые в промышленном масштабе продукты, экспрессирующие эти белки, экспрессируют один белок, за исключением случаев, где желателен комбинированный инсектицидный спектр из 2 белков (например, Cry1Ab и Cry3Bb в кукурузе, комбинированные для обеспечения устойчивости соответственно к чешуекрылым вредителям и блошке длинноусой), или где независимое действие белков делает их полезными в качестве инструмента для задержки развития устойчивости у популяций восприимчивых насекомых (например, Cry1Ac и Cry2Ab в хлопке, комбинированные для обеспечения управления устойчивостью в отношении табачной совки).
Некоторые из качеств устойчивых к насекомым трансгенных растений, которые привели к быстрому и широко распространенному принятию этой технологии, также вызывают озабоченность, что у популяций вредителей разовьется устойчивость к инсектицидным белкам, продуцируемым этими растениями. Было предложено несколько стратегий для сохранения полезности признаков устойчивости к насекомым на основе Bt, которые включают размещение белков в высокой дозе в комбинации с резерватом, чередование с различными токсинами или совместное размещение с ними (McGaughey et al. (1998), "B.t. Resistance Management," Nature Biotechnol. 16: 144-146).
Белки, выбранные для использования в пакете Управления устойчивости к насекомым (IRM), должны быть активными с тем, чтобы устойчивость, развившаяся к одному белку, не придавала устойчивость ко второму белку (т.е. перекрестная устойчивость к белкам отсутствует). Если, например, популяция вредителей, выбранная для устойчивости к «белку A», чувствительна к «белку B», то можно сделать вывод, что нет перекрестной устойчивости, и что комбинация белка A и белка B будет эффективной в задержке устойчивости к одному белку A.
В отсутствие устойчивых к насекомым популяций, оценки могут осуществляться на основании других характеристик, считающихся связанными с потенциалом перекрестной устойчивости. При идентификации инсектицидных белков с вероятностью отсутствия проявления перекрестной устойчивости было предложено использование рецепторно опосредованного связывания (van Mellaert et al. 1999). Ключевым прогностическим показателем отсутствия перекрестной устойчивости, присущим этому подходу, является то, что инсектицидные белки не конкурируют за рецепторы у чувствительного вида насекомых.
В случае, когда токсины Bt конкурируют за один и тот же рецептор, то если этот рецептор мутирует в этом насекомом, так что один из токсинов больше не связывается с этим рецептором и, таким образом, больше не является инсектицидным против насекомого, в этом случае насекомое будет также устойчиво ко второму токсину (который конкурентно связан с тем же рецептором). То есть насекомое считается перекрестно устойчивым к обоим токсинам Bt. Однако если два токсина связываются с двумя различными рецепторами, то это может быть показателем того, что насекомое не будет одновременно устойчивым к этим двум токсинам.
Относительно более новая система инсектицидного белка была выявлена у Bacillus thuringiensis, как описано в международном патенте WO 97/40162. Эта система содержит два белка - один массой приблизительно 14-15 кДа, и другой массой приблизительно 44-45 кДа. См. также патенты США 6083499 и 6127180. Теперь эти белки были отнесены к их собственному классу и, соответственно, получили обозначение Cry соответственно Cry34 и Cry35. См. Crickmore et al. сайт интернета (biols.susx.ac.uk/home/Neil_Crickmore/Bt/). В настоящее время обнаружены многие другие родственные белки этого типа системы. См., например, патент США 6372480; международные патенты WO 01/14417 и WO 00/66742. Были также описаны оптимизированные для растений гены, которые кодируют такие белки, где гены созданы методами генной инженерии для использования кодонов для оптимизированной экспрессии у растений. См., например, патент США 6218188.
Точный тип действия системы Cry34/35 еще предстоит определить, но полагают, что она образует поры в мембранах клеток кишечника насекомых. См. Moellenbeck et al, Nature Biotechnology, vol. 19, p. 668 (July 2001); Masson et al., Biochemistry, 43 (12349-12357) (2004). Точный механизм действия остается неясным, несмотря на трехмерные атомарные координаты и структуры кристаллов, известные для белка Cry34 и Cry35. См. патенты США 7524810 и 7309785. Например, неясно, один или оба из этих белков связываются с конкретным видом рецептора, таким как щелочная фосфатаза или аминопептидаза.
Кроме того, ввиду того, что существуют различные механизмы, посредством которых у насекомого может развиться устойчивость к белку Cry (такие как измененным гликозилированием рецептора [см. Jurat-Fuentes et al. (2002) 68 AEM 5711-5717], удалением рецепторного белка [см. Lee et al. (1995) 61 AEM 3836-3842], мутированием рецептора или другими механизмами [см. Heckel et al., J. Inv. Pathol. 95 (2007) 192-197]), было невозможно заведомо прогнозировать, будет ли существовать перекрестная устойчивость между Cry34/35 и другими Cry-белками.
Прогнозирование конкурентного связывания для системы Cry34/35 также дополнительно осложняется тем, что два белка вовлечены в бинарную систему Cry34/35. Кроме того, неясно, связываются ли и насколько эффективно связываются эти белки с кишечником/клетками кишечника, и взаимодействуют ли они и как взаимодействуют или связываются друг с другом.
Другие варианты для борьбы с жесткокрылыми насекомыми включают токсины Cry3Bb, Cry3C, Cry6B, ET29, ET33 с ET34, TIC407, TIC435, TIC417, TIC901, TIC1201, ET29 с TIC810, ET70, ET76 с ET80, TIC851 и другие. Были также предложены подходы РНКi (интерференции РНК). См., например, Baum et al., Nature Biotechnology, vol. 25, № 11 (Nov. 2007) pp. 1322-1326.
Meihls et al. предлагают использование резервных культур для управления устойчивостью у кукурузного корневого жука. PNAS (2008) vol. 105, № 49, 19177-19182.
Краткое описание сущности изобретения
Настоящее изобретение относится частично к Cry3Aa в комбинации с Cry6Aa. Настоящее изобретение относится частично к удивительному открытию, что Cry3Aa и Cry6Aa могут использоваться для предотвращения развития устойчивости (к любой системе инсектицидного белка отдельно) у популяции кукурузного корневого жука (Diabrotica spp.). Как будет понятно специалисту в данной области после ознакомления с благоприятными аспектами раскрытого в настоящем описании изобретения, растения, продуцирующие эти инсектицидные Cry-белки, могут использоваться для уменьшения опасений того, что может развиться популяция кукурузного корневого жука, которая может быть устойчивой к любой из этих систем инсектицидного белка отдельно.
Настоящее изобретение частично подтверждается обнаружением того, что компоненты этих систем Cry-белка не конкурируют друг с другом за связывание с рецепторами кишечника кукурузного корневого жука.
Настоящее изобретение также частично относится к тройным пакетам или «пирамидам» из трех (или более) систем токсинов, где парой оснований являются Cry3Aa и Cry6Aa. Таким образом, растения (и посевная площадь, засаженная такими растениями), которые продуцируют эти две системы инсектицидных белков, включены в объем настоящего изобретения.
Краткое описание фигур
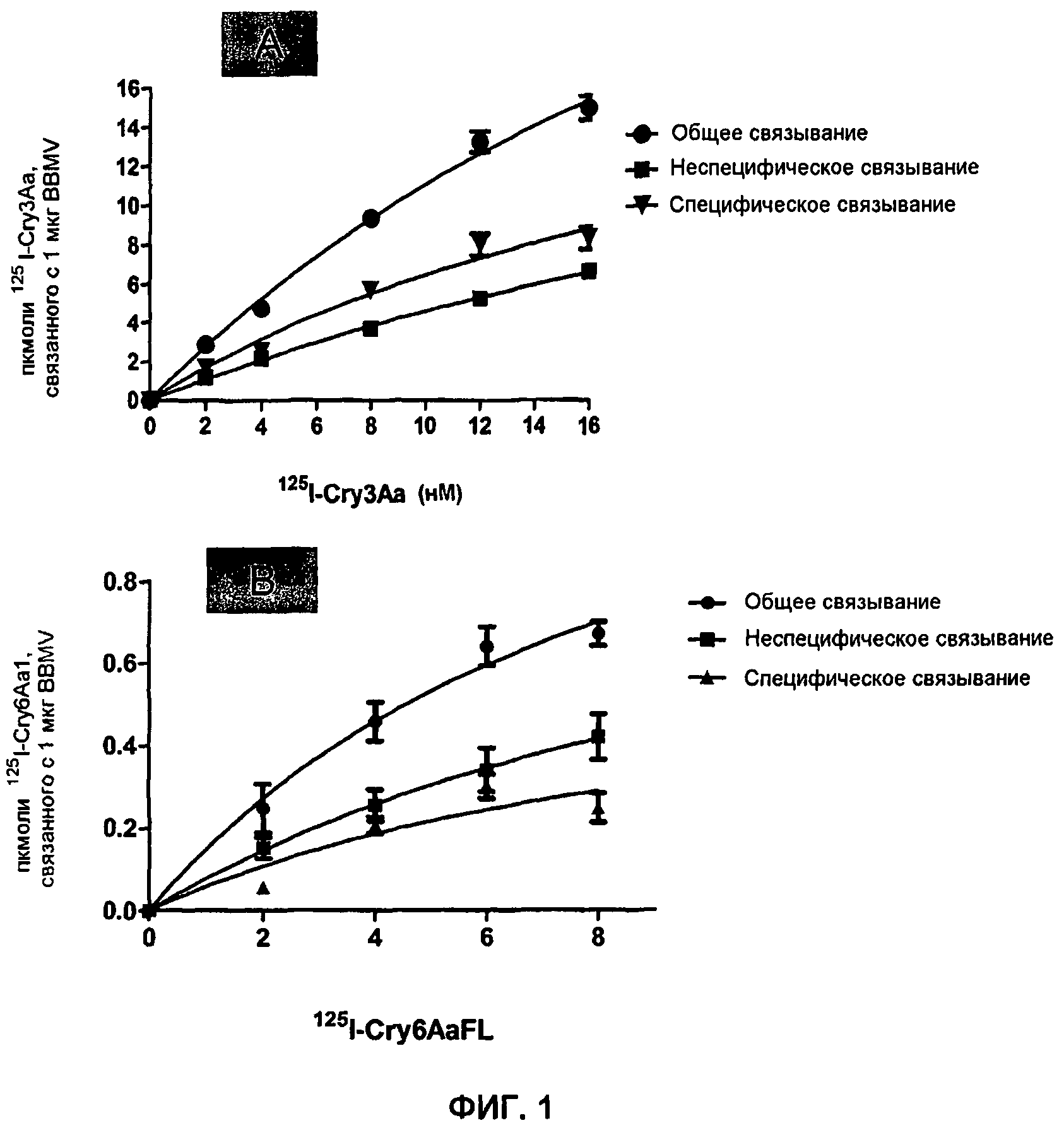
Фиг.1. Связывание трипсиновой сердцевины125I-Cry3Aa (фиг.1A) и125I-Cry6Aa1 (полной длины) (фиг.1B) как функция внесенных меченых радиоактивным изотопом Cry-токсинов в BBMV (мембранных пузырьках щеточной каемки), полученных из личинок западных кукурузных корневых жуков. Специфическое связывание=общее связывание-неспецифическое связывание, «усы»=SEM (стандартная ошибка средней).
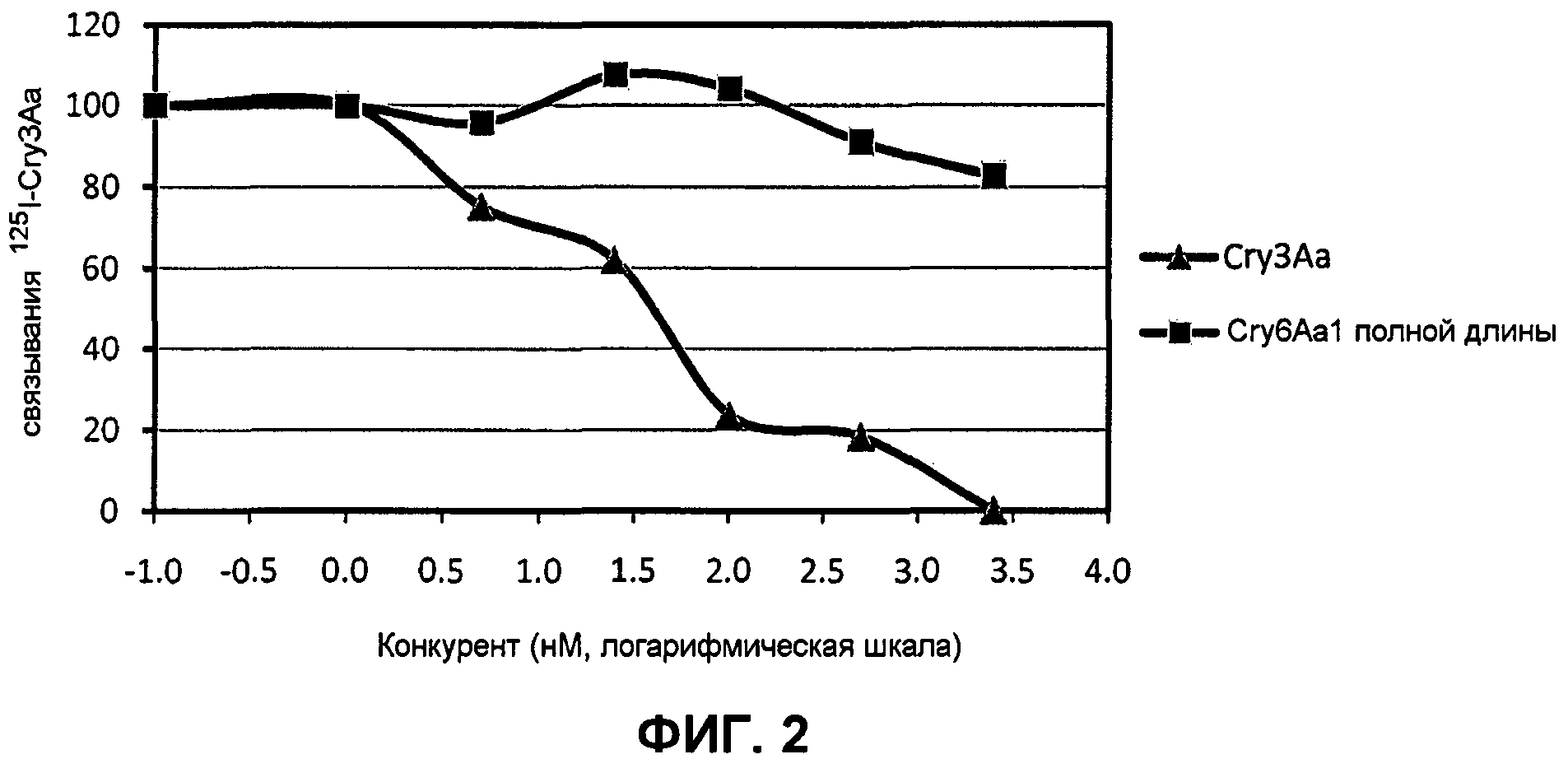
Фиг.2. Связывание125I-Cry3Aa с BBMV. Полученными из личинок при различных концентрациях немеченого конкурента (log0,1=-1,0, log1=0, log10=1,0, log100=2,0, log1000=3,0).
Краткое описание последовательностей
SEQ ID NO:1: Полная последовательность белка Cry3Aa
SEQ ID NO:2: Последовательность трипсинового корового белка Cry3Aa
SEQ ID NO:3: Полная последовательность белка Cry6Aa1
Подробное описание изобретения
Последовательности белков Cry3Aa и Cry6Aa могут быть получены, например, из изолятов Bacillus thuringiensis, как перечислено на сайте интернета Crickmore et al. (lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/intro.html).
Настоящее изобретение включает использование инсектицидных белков Cry3Aa в комбинации с токсином Cry6Aa для защиты кукурузы от повреждения и потери урожайности, вызванных употреблением в пищу популяциями кукурузных корневых жуков, у которых может развиться устойчивость к любому из этих систем белков Cry по отдельности (без другого).
Таким образом, в настоящем изобретении речь идет о пакете Управления устойчивости насекомых (IRM) для предотвращения развития у кукурузного корневого жука устойчивости к Cry6Aa и/или Cry3Aa.
Настоящее изобретение относится к композициям для борьбы с вредителями-корневыми жуками, содержащим клетки, которые продуцируют инсектицидный белок Cry6Aa и инсектицидный белок Cry3Aa.
Изобретение дополнительно включает хозяина, трансформированного для продукции как белка Cry6Aa, так и инсектицидного белка Cry3Aa, где указанный хозяин представляет собой микроорганизм или растительную клетку.
Дополнительно предполагается, что изобретение относится к способу борьбы с вредителями-корневыми жуками, включающему приведение в контакт указанных вредителей или среды обитания указанных вредителей с эффективным количеством композиции, которая содержит инсектицидный белок Cry3Aa.
Вариант осуществления изобретения включает маис, содержащий экспрессируемый растением ген, кодирующий инсектицидный белок Cry3Aa, и экспрессируемый растением ген, кодирующий белок Cry6Aa, и семена такого растения.
Дополнительный вариант осуществления изобретения включает маис, где экспрессируемый растением ген, кодирующий инсектицидный белок Cry3Aa, и экспрессируемый растением ген, кодирующий белок Cry6Aa, были интрогрессированы в указанный маис, и семена такого растения.
Как описано в разделе «Примеры», исследования конкурентного связывания с рецепторами с использованием меченного радиоактивным изотопом корового токсинного белка Cry3Aa показывают, что коровый токсинный белок Cry6Aa не конкурирует за связывание в образцах ткани насекомых CRW (кукурузных корневых жуков), с которыми связывается Cry3Aa. См. фиг.2. Эти результаты указывают на то, что комбинация белков Cry6Aa и Cry3Aa представляет собой эффективное средство для уменьшения развития устойчивости у популяций CRW к любой белковой системе отдельно.
Таким образом, частично на основании данных, описанных выше, и в других местах настоящего описания, белки Cry3Aa и Cry6Aa могут быть использованы для получения комбинаций IRM для предотвращения и уменьшения развития устойчивости у CRW. Другие белки могут быть добавлены к этой комбинации, например, для расширения спектра борьбы с насекомыми. Рассматриваемая комбинация также может быть использована в некоторых предпочтительных «тройных пакетах» или «пирамиде» в комбинации с еще одним белком для борьбы с корневыми жуками, таким как Cry3Ba или бинарные белки Cry34/35. Таким образом, такие дополнительные комбинации будут обеспечивать множественные типы действия против корневых жуков. РНКi против корневых жуков представляет собой еще один вариант. См., например, Baum et al., Nature Biotechnology, vol. 25, № 11 (Nov. 2007) pp. 1322-1326.
В свете описания заявки USSN 61/327240 (поданной 23 апреля, 2010 г.), относящейся к комбинациям белков Cry34Ab/35Ab и Cry3Aa, заявки USSN 61/388273 (поданной 30 сентября, 2010 г.), относящейся к комбинации белков Cry34Ab/35Ab и Cry6Aa, и заявки USSN 61/476005 (поданной 15 апреля, 2011 г.), относящейся к комбинациям белков Cry34Ab/35Ab и Cry3Ba, некоторые предпочтительные «тройные пакеты» или «множественные типы пакетов действия» настоящего изобретения включают белок Cry6Aa в комбинации с белком Cry3Aa, вместе с белком Cry3Ba или бинарными белками Cry34/35. Трансгенные растения, включая кукурузу, содержащую ген cry6Aa и ген cry3Aa (необязательно, с третьей или четвертой системой токсина, например, cry3B и/или cry34/35), включены в объем настоящего изобретения. Таким образом, такие варианты осуществления нацелены на насекомое, по меньшей мере, тремя типами действия.
Варианты размещения по настоящему изобретению включают использование белков Cry6Aa и Cry3Aa в областях выращивания кукурузы, где Diabrotica spp. являются проблематичными. Другим вариантом размещения может быть использование одного или обоих из белков Cry6Aa и Cry3Aa в комбинации с другими признаками.
Специалисту в данной области будет понятно, что токсины Bt, даже в пределах определенного класса, такого как Cry6Aa и Cry3Aa, могут в некоторой степени варьировать.
Гены и токсины. Термин «изолированный» относится к полинуклеотиду в не встречающемся в природных условиях конструкту или к белку в очищенном или иным образом не встречающемуся в природных условиях состоянию. Гены и токсины, используемые в соответствии с настоящим изобретением, включают не только полные описанные последовательности, но также фрагменты этих последовательностей, варианты, мутанты и слитые белки, которые сохраняют характерную пестицидную активность токсинов, конкретно проиллюстрированных в настоящем описании. Используемые в настоящем описании термины «варианты» или «изменения» генов относятся к нуклеотидным последовательностям, которые кодируют те же токсины, или которые кодируют эквивалентные токсины, обладающие пестицидной активностью. Используемый в настоящем описании термин «эквивалентные токсины» относится к токсинам, обладающим такой же или по существу такой же биологической активностью против вредителей-мишеней как заявленные токсины. То же относится к Cry3B и Cry34/35, если они используются в тройных/множественных пакетах в соответствии с настоящим изобретением. Домены/субдомены этих белков могут быть обменены, например, для получения химерных белков. См., например, патенты США 7309785 и 7524810 в отношении белков Cry34/35. В патенте '785 речь также идет об усеченных белках Cry35. Усеченные токсины также проиллюстрированы в настоящем описании.
Используемый в настоящем описании термин «границы» представляет идентичность последовательностей приблизительно 95% (белков Cry6Aa и Cry3Aa), 78% (белков Cry6A и Cry3A) и 45% (белков Cry6 и Cry3) в соответствии с «Revision of Nomenclature for Bacillus thuringiensis Pesticidal Crystal Proteins» N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, и D.H. Dean. Microbiology и Molecular Biology Reviews (1998) Vol 62: 807-813. То же относится к Cry3B при использовании в тройных пакетах, например, в соответствии с настоящим изобретением.
Для специалиста в данной области будет очевидно, что гены, кодирующие активные токсины, могут быть идентифицированы и получены несколькими способами. Определенные гены или части генов, проиллюстрированные в настоящем описании, могут быть получены из изолятов, депонированных в депозитарии культур. Эти гены или их части или варианты, также могут быть сконструированы синтетически, например, путем использования генного синтезатора. Варианты генов могут быть легко сконструированы с использованием стандартных технологий получения точечных мутаций. Также, фрагменты этих генов могут быть получены с использованием коммерчески доступных экзонуклеаз или эндонуклеаз, в соответствии со стандартными методиками. Например, ферменты, такие как Bal31 или сайт-направленный мутагенез могут быть использованы для систематической отсечки нуклеотидов от концов этих генов. Гены, которые кодируют активные фрагменты, также могут быть получены с использованием разнообразных рестрикционных ферментов. Протеазы можно использовать для непосредственного получения активных фрагментов белковых токсинов.
Фрагменты и эквиваленты, которые сохраняют пестицидную активность проиллюстрированных токсинов, будут входить в объем настоящего изобретения. Также, ввиду избыточности генетического кода, разнообразие различных последовательностей ДНК может кодировать аминокислотные последовательности, раскрытые в настоящем описании. Специалист в данной области вполне может создать альтернативные последовательности ДНК, кодирующие одинаковые или по существу одинаковые токсины. Эти вариантные последовательности ДНК входят в объем настоящего изобретения. Используемая в настоящем описании ссылка на «по существу одинаковую» последовательность относится к последовательностям, которые имеют аминокислотные замещения, делеции, добавления или вставки, которые существенно не воздействуют на пестицидную активность. Фрагменты генов, кодирующих белки, которые сохраняют пестицидную активность, также включены в это определение. Фрагменты генов, кодирующих белки, которые сохраняют пестицидную активность, также включены в настоящее определение.
Дополнительный способ идентификации генов, кодирующих токсины, и частей генов, используемых в соответствии с настоящим изобретением, осуществляют путем использования олигонуклеотидных зондов. Эти зонды представляют собой детектируемые нуклеотидные последовательности. Эти последовательности могут быть выявлены посредством соответствующей метки или могут быть получены эндогенно флуоресцентными, как описано в международной патентной заявке № W093/16094. Как хорошо известно в данной области, молекула зонда и образец нуклеиновой кислоты гибридизуются с образованием прочной связи между двумя молекулами, то можно резонно предположить, что зонд и образец имеют существенную гомологию. Предпочтительно, гибридизацию проводят в жестких условиях методиками, хорошо известными в данной области, как описано, например, в публикации Keller, G.H., M.M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Некоторые примеры солевых концентраций и температурных комбинаций следующие (в порядке увеличения жесткости условий): 2X SSPE (0,18M NaCl, 10 мМ NaHPO4, 1 мМ EDTA, pH 7,0)) или SSC (15 мМ цитрата натрия, 150 мМ хлорида натрия, pH 7,0) при комнатной температуре; 1X SSPE или SSC при 42°C; 0,1X SSPE или SSC при 42°C; 0,1X SSPE или SSC при 65°C. Выявление зонда обеспечивает средство для определения известным образом, произошла ли гибридизация. Такой зондовый анализ обеспечивает быстрый способ идентификации кодирующих токсин генов настоящего изобретения. Нуклеотидные сегменты, которые используются в качестве зондов в соответствии с изобретением, могут быть синтезированы с использованием синтезатора ДНК и стандартных методик. Эти нуклеотидные последовательности также могут быть использованы в качестве затравок ПЦР для амплификации генов по настоящему изобретению.
Вариантные токсины. В настоящем описании были специально проиллюстрированы определенные токсины по настоящему изобретению. Поскольку эти токсины просто иллюстрируют токсины по настоящему изобретению, то будет вполне очевидно, что настоящее изобретение включает вариантные или эквивалентные токсины (и нуклеотидные последовательности, кодирующие эквивалентные токсины), обладающие такой же или подобной пестицидной активностью как иллюстрируемый токсин. Эквивалентные токсины имеют гомологию аминокислот с иллюстрируемым токсином. Эта аминокислотная идентичность обычно составляет более чем 75%, или, предпочтительно, более чем 85%, предпочтительно, более чем 90%, предпочтительно, более чем 95%, предпочтительно, более чем 96%, предпочтительно, более чем 97%, предпочтительно, более чем 98%, или в некоторых вариантах осуществления, предпочтительно, более чем 99%. Аминокислотная идентичность обычно самая высокая в критических областях токсина, которые отвечают за биологическую активность или участвуют в определении трехмерной конфигурации, которая, в конечном счете, ответственна за биологическую активность. В этом отношении, приемлемы и могут ожидаться некоторые аминокислотные замещения, если эти замещения происходят в областях, которые не имеют решающего значения для активности или представляют собой консервативные аминокислотные замещения, которые не воздействуют на трехмерную конфигурацию молекулы. Например, аминокислоты могут быть размещены в следующие классы: неполярные, незаряженные полярные, основные и кислотные. Консервативные замещения, посредством которых аминокислота одного класса замещается другой аминокислотой того же типа, входят в объем настоящего изобретения, пока замещение существенно не изменяет биологическую активность соединения. В таблице 1 представлен список примеров аминокислот, относящихся к каждому классу.
В некоторых случаях также могут осуществляться неконсервативные замещения. Решающим фактором является то, что эти замещения не должны значительно снижать биологическую активность токсина.
Рекомбинантные хозяева. Гены, кодирующие токсины настоящего изобретения, могут вводиться в широкое разнообразие микробных или растительных хозяев. Экспрессия гена токсина приводит, прямо или косвенно, к внутриклеточной продукции и поддержанию пестицида. Конъюгальный перенос и рекомбинантный перенос могут быть использованы для создания штамма Bt, который экспрессирует оба токсина настоящего изобретения. Другие организмы хозяев также могут быть трансформированы одним или более генами токсина, используемыми затем для оказания синергического эффекта. С подходящими микробными хозяевами, например, Pseudomonas, микробы могут наноситься на местонахождение вредителя, где они пролиферируют и употребляются в пищу. Результатом является контроль над вредителем. Альтернативно, микроб, несущий ген токсина, может быть подвергнут обработке в условиях, которые продлевают активность токсина и стабилизируют клетку. Обработанная клетка, которая сохраняет токсическую активность, затем может вноситься в среду обитания вредителя-мишени. В объем настоящего изобретения включены нерегенерируемые/нетотипотентные растительные клетки из растения по настоящему изобретению (содержащие, по меньшей мере, один из рассматриваемых генов IRM).
Трансформация растения. Предпочтительным вариантом осуществления настоящего изобретения является трансформация растений генами, кодирующими рассматриваемый инсектицидный белок или его варианты. Трансформированные растения устойчивы к атаке целевым насекомым-вредителем за счет присутствия контролирующих количеств рассматриваемого инсектицидного белка или его вариантов в клетках трансформированного растения. При включении генетического материала, который кодирует инсектицидные свойства инсектицидных токсинов B.t., в геном растения, употребляемого в пищу определенным насекомым-вредителем, взрослые особи или личинки погибнут после употребления в пищу растения. Были трансформированы многочисленные члены односемядольных и двудольных классификаций. Трансгенные агрономические культуры, а также фрукты и овощи представляют промышленный интерес. Такие культуры включают, но без ограничения, маис, рис, сою, канолу, подсолнечник, люцерну, сорго, пшеницу, хлопок, арахис, томаты, картофель и тому подобное. Существует несколько технологий введения инородного генетического материала в клетки растений и получения растений, которые стабильно поддерживают и экспрессируют введенный ген. Такие технологии включают акселерацию генетического материала, нанесенного на микрочастицы, непосредственно в клетки (патент США 4945050 и патент США 5141131). Растения могут быть трансформированы с использованием технологии Agrobacterium, см. патент США 5177010, патент США 5104310, Европейскую патентную заявку № 0131624B1, Европейскую патентную заявку № 120516, Европейскую патентную заявку № 159418B1, Европейскую патентную заявку № 176112, патент США 5149645, патент США 5469976, патент США 5464763, патент США 4940838, патент США 4693976, Европейскую патентную заявку № 116718, Европейскую патентную заявку № 290799, Европейскую патентную заявку № 320500, Европейскую патентную заявку № 604662, Европейскую патентную заявку № 627752, Европейскую патентную заявку № 0267159, Европейскую патентную заявку № 0292435, патент США 5231019, патент США 5463174, патент США 4762785, патент США 5004863 и патент США 5159135. Другая технология трансформации включает технологию WHISKERS™, см. патент США 5302523 и патент США 5464765. Технология электропорации также использовалась для трансформации растений, см. Международный патент WO 87/06614, патент США 5472869, патент США 5384253, Международный патент WO 9209696 и Международный патент WO 9321335. Все эти патенты и публикации, относящиеся к трансформации, включены в настоящее описание посредством ссылки. В дополнение к многочисленным технологиям трансформации растений, тип ткани, которая контактирует с инородными генами, также может изменяться. Такая ткань включает, но не ограничивается ими, эмбриогенную ткань, I и II типы каллюсной ткани, гипокотиль, меристему и тому подобное. Почти все растительные ткани могут быть трансформированы во время дедифференциации с использованием соответствующих технологий в пределах квалификации специалиста в данной области.
Гены, кодирующие любой из рассматриваемых токсинов, могут быть вставлены в клетки растения с использованием разнообразных технологий, которые хорошо известны в данной области, как описано выше. Например, доступно большое число векторов клонирования, содержащих маркер, который обеспечивает возможность отбора трансформированных микробных клеток, и репликационная система, функциональная у Escherichia coli, для получения и модификации инородных генов для вставки в высшие растения. Такие манипуляции могут включать, например, введение мутаций, усечений, добавлений или замещений, как желательно для предполагаемого использования. Векторы включают, например, pBR322, группу pUC, группу M13mp, pACYC184 и т.д. Соответственно, последовательность, кодирующая Cry-белок или варианты, может быть вставлена в вектор в подходящий сайт рестрикции. Полученную плазмиду используют для трансформации клеток E. coli, клетки которых культивируют в подходящей питательной среде, затем собирают и лизируют с тем, чтобы были извлечены годные для обработки количества плазмиды. Анализ последовательности, анализ фрагментов рестрикции, электрофорез и другие биохимические-молекулярно-биологические способы обычно проводят в качестве способов анализа. После каждой манипуляции, используемая последовательность ДНК может быть расщеплена и соединена со следующей последовательностью ДНК. Каждая подвергнутая манипулированию последовательность ДНК может быть клонирована в ту же или другую плазмиду.
Использование содержащих T-ДНК векторов для трансформации клеток растений интенсивно исследовалось и достаточно описано в Европейском патенте EP 120516; публикациях Lee и Gelvin (2008), Fraley et al. (1986), и An et al. (1985), и достаточно общепринято в данной области.
Как только вставленная ДНК интегрируется в геном растения, она становится относительно устойчивой во всех последующих поколениях. Вектор, используемый для трансформации клетки растения, обычно содержит выбранный маркерный ген, кодирующий белок, который придает трансформированным клеткам растений устойчивость к гербициду или антибиотику, такому как, наряду с другими, биалафос, канамицин, G418, блеомицин или гигромицин. Соответственно, отдельно используемый выбранный маркерный ген должен обеспечить возможность выбора трансформированных клеток, в то время как рост клеток, которые не содержат вставленную ДНК, подавляется селекционным соединением.
Доступно большое число способов вставки ДНК в клетку растения-хозяина. Эти способы включают трансформацию T-DNA, доставленную Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве агента трансформации. Дополнительно, может быть использовано слияние протопластов растения с липосомами, содержащими подлежащую доставке ДНК, прямая инъекция ДНК, трансформация биологической баллистикой (бомбардировкой микрочастицами) или электропорация, а также другие возможные способы.
В предпочтительном варианте осуществления настоящего изобретения, растения трансформируются генами, где использование кодона кодирующей белок области было оптимизировано для растений. См., например, патент США 5380831, который включен в настоящее описание посредством ссылки. Также, преимущественно используются растения, кодирующие усеченный токсин. Усеченный токсин обычно кодирует примерно от 55% до примерно 80% токсина полной длины. Способы создания синтетических генов B.t. для использования в растениях известны в данной области (Stewart, 2007).
Независимо от методики трансформации, ген предпочтительно включают в вектор переноса гена, адаптированный для экспрессирования генов инсектицидного токсина B.t и варианты в растительной клетке включением в вектор растительного промотора. В дополнение к растительным промоторам, в растительных клетках для экспрессирования чужеродных генов могут эффективно использоваться промоторы из разнообразных источников. Например, возможно использование промоторов бактериального происхождения, таких как промотор октопинсинтазы, промотор нопалинсинтазы и промотор маннопинсинтазы. В некоторых предпочтительных вариантах осуществления могут использоваться промоторы, не связанные с Bacillus thuringiensis. Могут использоваться промоторы, происходящие из растительных вирусов, например, промоторы 35S и 19S вируса мозаики цветной капусты, промотор из вируса мозаики жилок кассавы и тому подобное. Растительные промоторы включают, но без ограничения, малую субъединицу (ssu), промотор бета-конглицинина, промотор фазеолина, промотор ADH (алкогольдегидрогеназы), промоторы теплового шока, промотор ADF (деполимеризации актина), промотор убиквитина, промотор актина и тканеспецифические промоторы. Промоторы могут также содержать определенные энхансерные элементы последовательности, которые могут повысить эффективность транскрипции. Конкретные энхансеры включают, но без ограничения, ADH1-интрон 1 и ADH1-интрон 6. Могут использоваться конститутивные промоторы. Конститутивные промоторы направляют непрерывную генную экспрессию почти во всех типах клеток и почти в любое время (например, актина, убиквитина, CaMV 35S). Тканеспецифические промоторы ответственны за генную экспрессию в определенных типах клеток или ткани, таких как листья или семена (например, промоторы зеина, олеозина, напина, ACP (ацил белка-носителя)), и эти промоторы также могут быть использованы. Могут также использоваться промоторы, которые активны во время определенной стадии развития растений, а также активны в определенных тканях и органах растений. Примеры таких промоторов включают, но без ограничения, промоторы, которые являются специфичными для корней, специфичными для пыльцы, специфичными для зародышей, специфичными для «шелка» кукурузы, специфичными для хлопковых волокон, специфичными для эндоспермы семян, специфичными для флоэмы, и тому подобное.
В определенных условиях может быть желательным использование индуцируемого промотора. Индуцируемый промотор ответствен за экспрессию генов в ответ на специфический сигнал, такой как физический стимул (например, гены теплового шока); свет (например, RUBP карбоксилаза); гормон (например, глюкокортикоид); антибиотик (например, тетрациклин); метаболиты; и стресс (например, засуху). Могут использоваться другие желательные транскрипционные и трансляционные элементы, которые функционируют в растениях, такие как 5' нетранслированные лидерные последовательности, РНК последовательности транскрипции терминации и сигнальные последовательности добавления полиаденилата. В данной области известны многочисленные специфичные для растений векторы переноса генов.
Трансгенные культуры, содержащие признаки устойчивости к насекомым (IR), являются преобладающими в растениях кукурузы и хлопка по всей Северной Америке, и использование этих признаков распространяется по всему миру. Промышленные трансгенные культуры, комбинирующие признаки IR и устойчивость к гербицидам (HT), были разработаны множеством семенных компаний. Они включают комбинации признаков IR, приданных инсектицидными белками B.t., и признаков HT, таких как устойчивость к ингибиторам ацетолактатсинтазы (ALS), таким как сульфонилмочевины, имидазолиноны, триазолпиримидин, сульфонанилиды и тому подобное, ингибиторам глутаминсинтетазы (GS), таким как биалафос, глюфосинат и тому подобное, ингибиторам 4-гидроксифенилпируватдиоксигеназы (HPPD), таким как мезотрион, изоксафлутол и тому подобное, ингибиторам 5-энолпирувилшикимат-3-фосфатсинтазы (EPSPS), таким как глифосат и тому подобное, ингибиторам ацетилкоэнзим-A-карбоксилазы (ACCase), таким как галоксифоп, квилазофоп, диклофоп и тому подобное. Известны другие примеры, в которых трансгенно полученные белки обеспечивают устойчивость растений к химическим классам гербицидов, таким как гербициды на основе феноксикислот и гербициды на основе ауксинпиридилоксиацетатов (см. Международную патентную заявку WO 2007/053482 A2), или гербициды на основе феноксикислот и гербициды на основе арилоксифеноксипропионатов (см. Международную патентную заявку 2005107437 A2, A3). Способность контролировать множественные связанные с вредителями проблемы посредством признаков IR представляет собой ценную концепцию промышленного продукта, и удобство этой продуктовой концепции повышается, если признаки, обеспечивающие контроль над насекомыми, и признаки, обеспечивающие контроль над сорняками, комбинируются в одном растении. Дополнительно, повышенная значимость может быть получена посредством комбинаций в одном растении признаков IR, приданных инсектицидным белком B.t., таким как инсектицидный белок по настоящему изобретению, с одним или более дополнительными признаками HT, такими как указано выше, плюс один или более дополнительных вводимых признаков (например, устойчивости к другим насекомым, приданной происходящими из B.t. или из других инсектицидных белков, устойчивости к насекомым, приданной такими механизмами как РНКi и тому подобное, устойчивости к нематодам, устойчивости к заболеваниям, устойчивости к стрессу, улучшенной утилизации азота и тому подобных), или продуктивные признаки (например, высокое содержание масел, полезный для здоровья состав, улучшение питательной ценности и тому подобное). Такие комбинации могут быть получены или обычной селекцией (селекционный пакет), или совместно в виде нового явления трансформации, включающего одновременное введение множественных генов (молекулярный пакет). Благоприятные эффекты включают способность справляться с вредителями и улучшенную борьбу с сорняками культур растений, что обеспечивает вторичные выгоды для производителя и/или потребителя. Таким образом, настоящее изобретение может быть использовано в комбинации с другими признаками для обеспечения полного агрономического пакета улучшенного качества культуры со способностью гибко и экономически рентабельно регулировать любое число агрономических вопросов.
Трансформированные клетки растут внутри растений обычным образом. Они могут образовывать зародышевые клетки и передавать трансформированный признак(и) потомству растений.
Такие растения могут быть выращены обычным образом и скрещены с растениями, которые имеют такие же трансформированные наследственные факторы или другие наследственные факторы. Полученные гибридные индивиды имеют соответствующие фенотипические свойства.
В предпочтительном варианте осуществления настоящего изобретения растения трансформируются генами, где использование кодона было оптимизировано для растений. См., например, патент США 5380831. Кроме того, способы создания синтетических генов Bt для использования в растениях известны в данной области (Stewart и Burgin, 2007). Одним неограничивающим примером предпочтительного трансформированного растения является фертильное растение маиса, содержащее экспрессируемый растением ген, кодирующий белок Cry6Aa, и дополнительно содержащий второй набор экспрессируемых растением генов, кодирующих белки Cry3Aa.
Перенос (или интрогрессия) определяемого(ых) белками Cry6Aa и Cry3Aa признака(ов) в инбредные линии маиса может быть достигнут рекуррентным селекционным разведением, например, обратным скрещиванием. В этом случае, желательного рекуррентного родителя сначала скрещивают с инбредным донором (нерекуррентным родителем), который несет соответствующий(ие) ген(ы) для определяемых Cry признаков. Затем потомство этого однократного скрещивания снова спаривают с рекуррентным родителем с последующей селекцией в полученном потомстве для переноса желательного признака(ов) от нерекуррентного родителя. После трех, предпочтительно, четырех, более предпочтительно, пяти или более поколений обратного скрещивания с рекуррентным родителем с селекцией желательного признака(ов), потомство будет гетерозиготным в отношении локусов, контролирующих переносимый(ые) признак(и), но будет как рекуррентный родитель в отношении большинства или почти всех других генов (см., например, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory and Technique, 360-376).
Стратегии управления устойчивостью к насекомым (IRM). Roush et al., например, описывают «двухтоксинные» стратегии, также называемые «пирамидированием» или «пакетированием», для управления инсектицидными трансгенными культурами. (Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786).
Агентство США по защите окружающей среды на своем сайте в интернете (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) публикует следующие требования к обеспечению не трансгенных (т.е. не содержащих B.t. белки) резервных культур (блока культур, не содержащих B.t. белки/кукурузы) для использования с трансгенными культурами, продуцирующими один белок Bt, активный против вредителей-мишеней.
«Специфические структурированные требования к защищенным от кукурузного мотылька Bt (Cry1 Ab или Cry 1F) кукурузным продуктам следующие:
Структурированные резерваты: 20% не защищенных от чешуекрылых Bt кукурузных резервных культур в Кукурузной полосе;
50% не защищенных от чешуекрылых Bt резервных культур в Хлопковой полосе.
Блоки
Внутренний (т.е. в пределах поля Bt).
Внешний (т.е. отдельные поля в пределах 1/2 мили (804 м) (если возможно, 1/4 мили (402 м)) от поля Bt для максимизации случайного спаривания).
Полосы внутри поля
Полосы должны быть шириной, по меньшей мере, 4 ряда (предпочтительно, 6 рядов) для уменьшения эффектов передвижения личинок».
Кроме того, Национальная Ассоциация фермеров, выращивающих кукурузу на своем сайте интернета:
(ncga.com/insect-resistance-management-fact-sheet-bt-corn)
также публикует аналогичное руководство в отношении требований к резервату. Например:
«Требования к IRM в отношении кукурузного мотылька:
- Засейте, по меньшей мере, 20% вашего кукурузного поля гибридами немодифицированных семян.
- В областях, продуцирующих хлопок, резерват должен составлять 50%.
- Должны быть засеяны в пределах 1/2 мили (804 м) от гибридов немодифицированных семян.
- Немодифицированные семена могут засеваться в виде полос в пределах поля Bt; полосы резервных культур должны иметь ширину, по меньшей мере, 4 ряда.
- Резервные культуры могут обрабатываться обычными пестицидами, только если для насекомого-мишени достигаются экономические пороги.
- Распыляемые инсектициды на основе Bt не могут использоваться на немодифицированной кукурузе.
- Соответствующая резервная культура должна высеваться на каждой ферме с Bt кукурузой».
Как указано Roush et al. (например, на стр. 1780 и 1784 в правой колонке), пакетирование или «пирамидирование» из двух различных белков, каждого эффективного против вредителей-мишеней и с небольшой или отсутствующей перекрестной устойчивостью может обеспечить возможность использования меньшего резервата. Roush предполагает, что для успешного пакета, размер резервата менее чем 10%, может обеспечить управление устойчивостью, сравнимое примерно с 50% резерватом для одного (не «пирамидированного») признака. Для доступных в настоящее время «пирамидированных» Bt кукурузных продуктов, Агентство США по защите окружающей среды требует засева значительно меньшего (как правило, 5%) структурированного резервата, не содержащего Bt белки, кукурузой, чем для продуктов с одним признаком (как правило, 20%).
Существуют различные пути обеспечения эффектов IRM резервата, включая различные геометрические типы посева на полях (как указано выше) и смеси семян в мешке, как дополнительно обсуждается Roush et al. (см. выше), и в патенте США 6551962.
Указанные выше процентные доли или подобные соотношения резервата могут использоваться для рассматриваемых двойных или тройных пакетов или пирамид.
Все патенты, патентные заявки, временные заявки и публикации, приведенные в виде ссылки или процитированные в настоящем описании, полностью включены посредством ссылки в той степени, в которой они не противоречат определенным положениям настоящего описания.
Ниже приведены примеры, которые иллюстрируют методы осуществления изобретения. Эти примеры не следует рассматривать как ограничивающие. Если не указано иное, все процентные доли представлены по массе, и все пропорции смесей в растворителе представлены по объему. Все величины температуры представлены в градусах Цельсия.
Если специально на указано иное или не подразумевается иное, единственное число означают используемый в настоящем описании термин «по меньшей мере, один».
ПРИМЕРЫ
Пример 1 - Конструирование экспрессионных плазмид, кодирующих токсины полной длины Cry3Aa и Cry6Aa
Стандартные способы клонирования использовали при конструировании экспрессионных плазмид Pseudomonas fluorescens (Pf), сконструированных для продукции соответственно Cry-белков Cry3Aa и Cry6Aa полной длины. Рестрикционные эндонуклеазы из биологических лабораторий Новой Англии (NEB; Ipswich, MA) использовали для переваривания ДНК, и T4 ДНК лигазу от компании Invitrogen использовали для лигирования ДНК. Плазмиды получали с использованием набора Plasmid Mini (Qiagen, Valencia, CA), следуя инструкциям поставщика. Фрагменты ДНК очищали, используя картридж Millipore Ultrafree®-DA (Billerica, MA) после гель-электрофореза в агарозном геле с трис-ацетатным буфером. Основная стратегия клонирования предусматривала субклонирование кодирующих последовательностей (CDS) Cry-белков полной длины в pMYC1803 для Cry3Aa и в pDOW1169 для Cry6Aa, в рестрикционные сайты SpeI и XhoI (или SalI, который совместим с XhoI), соответственно, посредством чего их помещали под контроль соответственно промотора Ptac и терминатора rrnBT1T2 или rrnBT2 из плазмиды pKK223-3 (PL Pharmacia, Milwaukee, WI). pMYC1803 представляет собой среднюю копию плазмиды с происхождением репликации из RSF1010, гена устойчивости к тетрациклину, и сайтом связывания рибосомы, предшествующим сайту распознавания рестрикционного фермента, в которые могут быть внесены фрагменты ДНК, содержащие кодирующие белок области (заявка на патент США № 20080193974). Экспрессионную плазмиду для Cry3Aa (рекомбинантную pMYC1803) трансформировали электропорацией в штамм MB214 P. fluorescens, извлеченный в среде SOC-соевый гидролизат, и высевали на чашки с лизогенной бульонной (LB) средой, содержащей 20 мкг/мл тетрациклина. Вектор экспрессии pDOW1169 аналогичен pMYC1803, но pDOW1169 несет ген pyrF, кодирующий урацил, который использовали в качестве маркера для скрининга трансформантов, когда урацил-ауксотрофный штамм P. fluorescens (такой как DPf10) использовали для трансформации на чашке с минимальной средой M9, в которой отсутствовал урацил (Schneider et al. 2005). Подробности микробиологических манипуляций доступны в заявке на патент США № 20060008877, заявке на патент США № 20080193974 и заявке на патент США № 20080058262, включенных в настоящее описание посредством ссылки. Проводили скрининг колоний рестрикционным перевариванием мини-препарата плазмидной ДНК. Последовательность плазмидной ДНК выбранных клонов, содержащих вставки, определяли по контракту с коммерческой организацией, проводящей определение последовательностей, такой как MWG Biotech (Huntsville, AL). Данные последовательностей собирали и анализировали, используя программное обеспечение Sequencher™ (Gene Codes Corp., Ann Arbor, MI).
Пример 2 - Рост и экспрессия
Анализ роста и экспрессии во встряхиваемых колбах и продукцию токсинов Cry3Aa и Cry6Aa для характеристики, включая связывание рецептора Bt и биологический анализ насекомых, осуществляли содержащими экспрессионные конструкты штаммами P. fluorescens, выращенными во встряхиваемых колбах (например, клона pMYC3122 для Cry3Aa, и pDAB102018 для Cry6Aa). Высеваемые культуры для Cry3Aa, выращенные в течение ночи в среде P. fluorescens с добавкой 20 мкг/мл тетрациклина, использовали для инокуляции 200 мл той же среды с 20 мкг/мл тетрациклина. Однако высеваемую культуру для Cry6Aa выращивали в минимальном бульоне M9 в течение ночи и использовали для инокуляции 200 мл среды P. fluorescens без антибиотика. Экспрессию токсинов Cry3Aa и Cry6Aa посредством промотора Ptac индуцировали добавлением изопропил-β-D-1-тиогалактопиранозида (IPTG) после первоначальной инкубации в течение 24 часов при 28-30°C при встряхивании при 300 об/мин. Образцы культуры брали во время индукции и в различные временные точки после индукции. Плотность клеток измеряли по оптической плотности при 600 нм (OD600).
Пример 3 - Фракционирование клеток и анализ SDS-PAGE (электрофорезом в полиакриламидном геле с додецилсульфатом натрия) образцов из встряхиваемых колб
В каждую временную точку взятия проб плотность клеток образцов доводили до OD600=20 и аликвоты объемом по 1 мл центрифугировали при 14000×g в течение 5 минут. Клеточные осадки после центрифугирования замораживали при -80°C. Растворимые и нерастворимые фракции из замороженных образцов клеточных осадков после центрифугирования из встряхиваемых колб генерировали с использованием раствора для экстракции бактериального белка EasyLyse™ (EPICENTRE® Biotechnologies, Madison, WI). Каждый клеточный осадок ресуспендировали в 1 мл раствора EasyLyse™ и дополнительно разводили 1:4 в литическом буфере и инкубировали со встряхиванием при комнатной температуре в течение 30 минут. Лизат центрифугировали при 14000 об/мин в течение 20 минут при 4°C, и супернатант извлекали в виде растворимой фракции. Затем осадок после центрифугирования (нерастворимую фракцию) ресуспендировали в равном объеме забуференного фосфатом солевого раствора (PBS; 11,9 мМ Na2HPO4, 137 мМ NaCl, 2,7 мМ KCl, pH 7,4). Образцы смешивали в соотношении 3:1 с буфером образца 4X Laemmli, содержащим β-меркаптоэтанол, и кипятили в течение 5 минут перед загрузкой на гели NuPAGE Novex 4-20% Bis-Tris (Invitrogen, Carlsbad, CA). Электрофорез выполняли в рекомендуемом буфере NuPAGE MOPS. Гели окрашивали безопасной краской SimplyBlue™ Safe Stain в соответствии с протоколом производителя (Invitrogen) и визуализировали с использованием визуализирующей системы Typhoon (GE Healthcare Life Sciences, Pittsburgh, PA).
Пример 4 - Получение телец включения
Препараты телец включения (IB) Cry-белка получали на клетках в результате ферментации P. Fluorescens, что обеспечивало продукцию нерастворимого инсектицидного белка B.t., как было продемонстрировано SDS-PAGE и MALDI-MS (лазерной десорбцией при содействии матрицы/ионизационной масс-спектрометрией). Клеточные осадки P. fluorescens после центрифугирования, полученные через 48 часов после индукции, оттаивали на водяной бане при 37°C. Клетки ресуспендировали до 25% масс./об. в литическом буфере (50 мМ Трис, pH 7,5, 200 мМ NaCl, 20 мМ динатриевой соли EDTA (этилендиаминтетрауксусной кислоты), 1% Triton X-100 и 5 мМ дитиотреитола (DTT); непосредственно перед использованием добавляли 5 мл/л коктейля ингибитора бактериальной протеазы (P8465 Sigma-Aldrich, St. Louis, MO). Клетки суспендировали, используя гомогенизатор при установке на самый низкий режим (Tissue Tearor, BioSpec Products, Inc., Bartlesville, OK). К клеточной суспензии добавляли лизоцим (25 мг Sigma L7651 из белка куриного яйца) смешиванием металлическим шпателем и суспензию инкубировали при комнатной температуре в течение одного часа. Суспензию охлаждали на льду в течение 15 минут, затем обрабатывали ультразвуком, используя ультразвуковой генератор Branson Sonifier 250 (два 1-минутных сеанса, при 50% рабочем цикле, производительность 30%). Лизис клеток проверяли микроскопией. При необходимости, добавляли дополнительные 25 мг лизоцима и инкубацию и обработку ультразвуком повторяли. Когда лизис клеток подтверждался микроскопией, то лизат центрифугировали при 11500×g в течение 25 минут (4°C) для образования осадка IB, и супернатант удаляли. Осадок IB ресуспендировали 100 мл литического буфера, гомогенизировали ручной мешалкой и центрифугировали, как указано выше. Осадок IB повторно промывали ресуспензированием (в 50 мл литического буфера), гомогенизацией, обработкой ультразвуком и центрифугированием до тех пор, пока супернатант не становился бесцветным, и осадок IB становился плотным и не совсем белым по цвету. Для конечного промывания, осадок IB ресуспендировали в подвергнутой стерилизационной фильтрации (через фильтр с размером пор 0,22 мкм) дистиллированной воде, содержащей 2 мМ EDTA, и центрифугировали. Конечный осадок ресуспендировали в подвергнутой стерилизационной фильтрации дистиллированной воде, содержащей 2 мМ EDTA, и хранили в 1 мл аликвотах при -80°C.
Пример 5 - Анализ SDS-PAGE и количественное определение
Анализ SDS-PAGE и количественное определение белка в препаратах IB проводили оттаиванием 1 мл аликвоты осадка IB и разведением 1:20 подвергнутой стерилизационной фильтрации дистиллированной водой. Затем разбавленный образец кипятили с 4X восстанавливающего буфера образца [250 мМ Трис, pH 6,8, 40% глицерин (об./об.), 0,4% бромфенол синий (масс./об.), 8% SDS (масс./об.) и 8% β-меркаптоэтанол (об./об.)] и загружали на Novex® 4-20% Трис-глицин, 12+2-луночный гель (Invitrogen), работающий с буфером IX Трис/глицин/SDS (Invitrogen). Гель задействовали в течение приблизительно 60 мин при 200 вольтах, затем окрашивали и обесцвечивали следующими процедурами с использованием безопасного красителя SimplyBlue™ Safe Stain (Invitrogen). Количественное определение целевых полос проводили сравнением денситометрических величин для полос, в сравнении с образцами бычьего сывороточного альбумина (BSA), обработанными на том же геле, для построения стандартной кривой, используя программное обеспечение Bio-Rad Quantity One.
Пример 6 - Солюбилизация телец включения
10 мл суспензий телец включения из клонов P. fluorescens MR832 и DPf13032 (содержащих соответственно 50-70 мг/мл белков Cry3Aa и Cry6Aa) центрифугировали при установке на самый высокий режим микроцентрифуги Eppendorf модели 5415C (приблизительно 14000×g) для осаждения включений. Супернатант буфера для хранения удаляли и заменяли 25 мл 50 мМ буфера CAPS [3-(циклогексамино)-1-пропансульфоновой кислоты], pH 10,5, как для Cry3Aa, так и для Cry6Aa, в конической пробирке емкостью 50 мл. Включения ресуспендировали, используя пипетку и перемешивали в вихревой мешалке для тщательного смешивания. Пробирки помещали на медленно вращающуюся платформу при 4°C в течение ночи для экстракции белков Cry3Aa и Cry6Aa полной длины. Экстракты центрифугировали при 30000×g в течение 30 мин при 4°C, и сохраняли полученные супернатанты, содержащие солюбилизированные Cry-белки полной длины.
Пример 7 - Усечение протоксинов полной длины
Белок Cry3Aa полной длины переваривали трипсином для генерирования активной формы Cry-белка, устойчивой к дальнейшему перевариванию трипсином. В частности, солюбилизированный белок Cry3Aa полной длины инкубировали с трипсином (из бычьей поджелудочной железы) (Sigma, St. MO) при (20:1=Cry-белок:фермент, масс./масс.) в 100 мМ буфера карбоната натрия, pH 11, при комнатной температуре в течение 1-3 часов. Полную активацию или усечение подтверждали анализом SDS-PAGE. Молекулярная масса Cry3Aa полной длины соответственно составила ≈73 кДа, и трипсиновой сердцевины ≈55 кДа. Аминокислотные последовательности полной длины и химотрипсиновой сердцевины Cry3Aa представлены в виде SEQ ID NO:1 и SEQ ID NO:2. Cry6Aa полной длины значительно активнее для нацеливания на кукурузного корневого жука, чем его химотрипсиновая или трипсиновая сердцевина. Таким образом, Cry6Aa полной длины использовали для анализов связывания. Аминокислотная последовательность Cry6Aa представлена в виде SEQ ID NO:3.
Пример 8 - Очистка Cry-токсинов
Дополнительно очищали трипсинизированный Cry3Aa и Cry6Aa полной длины с использованием ионообменной хроматографией. В частности, их дополнительно очищали, используя систему жидкостной хроматографии ATKA (Amersham Biosciences). Как для Cry3Aa, так и Cry6Aa, буфер A представлял собой буфер 10 мМ CAPS, pH 10,5, и буфер B представлял собой буфер 10 мМ CAPS, pH 10,5+1M NaCl. Использовали колонку Capto Q (5 мл) (GE). После полного уравнивания колонки с использованием буфера A, раствор Cry-токсина инжектировали в колонку со скоростью потока 5 мл/мин. Элюирование выполняли, используя градиент 0-100% буфера B со скоростью потока 5 мл/мин при 1 мл/фракция. После анализа SDS-PAGE выбранных фракций для дополнительного отбора фракций, содержащих белок-мишень наилучшего качества, фракции объединяли. Буфер заменяли как для очищенной трипсиновой сердцевины Cry3Aa, так и для Cry6Aa полной длины на 10 мМ CAPS, pH 10,5 посредством диализа. Образцы хранили при 4°C для анализа позднее после количественного определения с использованием SDS-PAGE и системы визуализации Typhoon (GE) с BSA в качестве стандарта.
Пример 9 - Препараты BBMV
Препараты пузырьков мембраны щеточной каемки (BBMV) средней кишки насекомых широко используются для анализов связывания Cry-токсина с рецептором. Препараты BBMV, используемые в настоящем изобретении, получали из изолированных средних кишок третьей возрастной стадии западного кукурузного корневого жука (Diabrotica virgifera virgifera LeConte), используя способ, описанный Wolferberger et al. (1987). Лейцинаминопептидазу использовали в качестве маркера мембранных белков в препарате, и активность лейцинаминопептидазы неочищенного гомогената и препарата BBMV определяли, как описано ранее (Li et al. 2004a). Концентрацию белка в препарате BBMV измеряли, используя способ Bradford (1976).
Пример 10 - Мечение125I
Очищенная трипсиновая сердцевина Cry3Aa и Cry6Aa полной длины метили, используя125I, для анализов насыщающего и конкурентного связывания. Для удостоверения в том, мечение радиоактивным изотопом не устраняет биологическую активность Cry-токсинов, проводили йодирование в холодном виде, используя NaI, в соответствии с инструкциями по использованию гранул для йодирования Pierce® (Pierce Biotechnology, Thermo Scientific, Rockford IL). Результаты биоанализа показали, что и йодированная трипсиновая сердцевина Cry3Aa и Cry6Aa полной длины оставались активными против личинок западного кукурузного корневого жука.125I-Cry3Aa и125I-Cry6Aa получали йодированием гранулами для йодирования Pierce® (Pierce) и Na125I. Колонки для обессоливания по выбору Zeba™ (Pierce) использовали для удаления не включенного или свободного Na125I из йодированного белка. Величины удельной радиоактивности йодированных Cry-белков находились в диапазоне от 1 до 5 мкКи/мкг. Проводили множественные серии мечения и анализов связывания.
Пример 11 - Анализы специфического связывания
Анализы специфического связывания выполняли, используя меченые125I Cry-токсины, как описано ранее (Li et al. 2004b). Для определения специфического связывания и оценки аффинности связывания (константы диссоциации, Kd) и концентрации сайтов связывания (максимальное количество токсина, специфически связанного с данным количеством BBMV, Bmax) Cry3Aa и Cry6Aa с BBMV насекомых, серии возрастающих концентраций или125I-Cry3Aa, или125I-Cry6Aa инкубировали с данной концентрацией (0,1 мг/мл) BBMV насекомых соответственно в 150 мкл 20 мМ Bis-Tris, pH 6,0, 150 мМ KCl с добавлением 0,1% BSA при комнатной температуре в течение 60 мин при осторожном встряхивании. Токсин, связанный с BBMV, отделяли от свободных токсинов в суспензии центрифугированием при 20000×g при комнатной температуре в течение 8 мин. Осадок после центрифугирования дважды промывали 900 мкл ледяного такого же буфера, содержащего 0,1% BSA. Радиоактивность, остающуюся в осадке после центрифугирования, измеряли автоматически гамма-счетчиком COBRAII Auto-Gamma (Packard, Canberra company) и учитывали общее связывание. Параллельно проводили другую серию реакций связывания, и 500-1000-кратный избыток немеченого соответствующего токсина включали в каждую из реакций связывания для того, чтобы он полностью занял все участки специфического связывания немеченого соответствующего токсина на BBMV, который использовали для определения неспецифического связывания. Специфическое связывание оценивали вычитанием неспецифического связывания из общего связывания. Величины Kd и Bmax этих токсинов оценивали, используя число молекул токсина (пкмоль), специфически связанных на микрограмм белка BBMV, в сравнении с концентрациями использованного меченого токсина, путем программного обеспечения GraphPad Prism 5.01 (GraphPad Software, San Diego, CA). Графики составляли с использованием программ или Microsoft Excel, или GraphPad Prism. Эксперименты повторяли, по меньшей мере, три раза. Эти эксперименты связывания продемонстрировали, что как125I-Cry3Aa, так и125I-Cry6Aa были способны специфически связываться с BBMV (фиг.1A и 1B).125I-Cry3Aa и125I-Cry6Aa имели аффинность связывания Kd=24,0±9,76 и 10,14±8,29 (нМ), соответственно, и концентрацию участков связывания Bmax=21,97±5,99 пкмоль/мкг, 0,66±0,33 (пкмоль/мкг BBMV), соответственно.
Пример 12 - Анализы конкурентного связывания
Анализы конкурентного связывания дополнительно проводили для определения того, разделяют ли трипсиновая сердцевина Cry3Aa и Cry6Aa полной длины участки связывания BBMV. Для анализов гомологичного конкурентного связывания Cry3Aa, увеличивающиеся количества (0-2500 нМ) немеченого Cry3Aa сначала смешивали с 5 нМ меченого Cry3Aa, и затем инкубировали с данной концентрацией (0,1 мг/мл) BBMV при комнатной температуре в течение 60 мин, соответственно. Процентные доли связанного125I-Cry3Aa с BBMV определяли для каждой из реакций, по сравнению с первоначальным специфическим связыванием в отсутствие немеченого конкурента. Анализ гетерологического конкурентного связывания между125I-Cry3Aa и немеченым Cry6Aa выполняли для идентификации того, разделяют ли они одинаковый набор рецептора (рецепторов). Это достигалось увеличением количества немеченого Cry6Aa в качестве конкурента, включенного в реакции, для конкуренции за предполагаемый рецептор(ы) на BBMV с меченым Cry3Aa. Эксперименты повторяли, по меньшей мере, три раза. Экспериментальные результаты продемонстрировали, что Cry3Aa был способен полностью вытесняться примерно на 60%, когда молярная концентрация увеличивалась приблизительно до 2500 нМ (500-кратный избыток, по сравнению с 5 нМ125I-Cry3Aa). Остающиеся примерно 40% считали неспецифическим связыванием, которое было неспособно вытесняться на основании результатов насыщающего связывания, описанных в другом месте, и определения неспецифического связывания, и, таким образом, неспецифическое связывание вычитали, и оно здесь не показано. Это свидетельствует о том, что специфическое связывание полностью вытеснялось 500-кратным избытком немеченого Cry3Aa (фиг.2). Однако Cry6Aa был неспособен вытеснить125I-Cry3Aa. Эти данные указывают на то, что Cry3Aa не разделяет рецептор или участок связывания Cry6Aa.
Ссылки:
Bradford, M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing principle of protein-dye binding, Anal. Biochem. 72, 248-254.
Li, H., Oppert, B., Higgins, R.A., Huang, F., Zhu, K.Y., Buschman, L.L., 2004a. Comparative analysis of proteinase activities of Bacillus thuringiensis-XQsistant and -susceptible Ostrinia nubilalis (Lepidoptera: Crambidae). Insect Biochem. Mol. Biol. 34, 753-762.
Li, H., Oppert, B., Gonzalez-Cabrera, J., Ferre, J., Higgins, R.A., Buschman, L.L. and Zhu, K.Y. and Huang, F. 2004b. Binding analysis of Cry1Ab and Cry1Ac with membrane vesicles from Bacillus thuringiensis-resistant and -susceptible Ostrinia nubilalis (Lepidoptera: Crambidae). Biochem. Biophys. Res. Commun. 323, 52-57.
Schneider, J.C. Jenings AF, Mun DM, McGovern PM, Chew LC. 2005. Auxotrophic markers pyrF and proC can replace antibiotic markers on protein production plasmids in high-cell-density Pseudomonas fluorescens fermentation. Biotechnology Progress 21, 343-348.
Wolfersberger, M.G., Luthy, P., Maurer,A., Parenti, P., Sacchi, F., Giordana, B., Hanozet, G.M., 1987. Preparation and partial characterization of amino acid transporting brush border membrane vesicles from the larval midgut of the cabbage butterfly (Pieris brassicae). Comp. Biochem. Physiol. 86A, 301-308.
US Patent Application № 20080193974. 2008. BACTERIAL LEADER SUQUENCES FOR INCREASED EXPRESSION
US Patent Application № 20060008877, 2006. Expression systems with sec-system secretion.
US Patent Application № 20080058262, 2008. rPA optimization.
Реферат
Изобретение относится к области биохимии, в частности к трансгенному растению, которое имеет устойчивость к кукурузному корневому жуку (Diabrotica spp.), содержащему ДНК, кодирующую белок Cry3Aa, и ДНК, кодирующую белок Cry6Aa, его семени и клетке, а также к способу замедления развития устойчивости к белкам Cry3Aa и Cry6Aa у кукурузного корневого жука с его использованием. Также раскрыто множество растений на поле, содержащее множество вышеуказанных трансгенных растений и не содержащие Bacillus thuringiensis (Bt) белки растения (non-Bt растения), и смесь семян, содержащая семена от non-Bt растений и множество вышеуказанных семян. Изобретение также относится к способу борьбы с кукурузным корневым жуком приведением в контакт указанного насекомого с белком Cry3Aa и белком Cry6Aa. Изобретение позволяет эффективно бороться с кукурузным корневым жуком. 7 н. и 13 з.п. ф-лы, 2 ил., 1 табл., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Фрагмент гибридного токсина bacillus thuringiensis, обладающий инсектицидной активностью, кодирующая его рекомбинантная днк, способ борьбы с насекомыми

Комментарии