Комбинации, включающие белки cry34ab/35ab и сry3ba, для предотвращения развития устойчивости у кукурузных корневых жуков (diabrotica spp.) - RU2591519C2
Код документа: RU2591519C2
Чертежи









Описание
Предпосылки создания изобретения
Люди выращивают кукурузу для применения в пищу и в качестве источника энергии. Кукуруза представляет собой важную сельскохозяйственную культуру. Она является важным источником пищи, пищевых продуктов и корма для животных во многих регионах мира. Насекомые употребляют в пищу и повреждают растения и, таким образом, подрывают эти усилия людей. Ежегодно миллиарды долларов тратятся для борьбы с насекомыми-вредителями, и еще миллиарды теряются вследствие причиняемого ими ущерба.
Вред, приносимый насекомыми-вредителями, является основным фактором потери урожаев кукурузы во всем мире, несмотря на использование защитных мер, таких как химические пестициды. В связи с этим, в сельскохозяйственные культуры, такие как кукуруза, методами генной инженерии были введены гены устойчивости к насекомым для борьбы с ущербом, наносимым насекомыми, и для снижения потребности в традиционных химических пестицидах.
Ежегодно, более 10 миллионов акров (более 4050000 га) кукурузных полей в США заражаются комплексом видов кукурузного корневого жука. Комплекс видов кукурузного корневого жука включает северного кукурузного корневого жука (Diabrotica barberi), южного кукурузного корневого жука (D. undecimpunctata howardi) и западного кукурузного корневого жука (D. virgifera virgifera). (Другие виды включают Diabrotica virgifera zeae (Мексиканский кукурузный корневой жук), Diabrotica balteata (Бразильский кукурузный корневой жук), и комплекс Бразильского кукурузного корневого жука (Diabrotica viridula и Diabrotica speciosa).
Обитающие в почве личинки этих видов Diabrotica питаются корнями растений кукурузы, вызывая полегание. Полегание, в конечном счете, снижает урожайность и часто приводит к гибели растения. Потребляя в пищу, пестичные столбики кукурузы, взрослые жуки уменьшают опыление и, поэтому, пагубно воздействуют на зерно кукурузного растения. Кроме того, взрослые особи и личинки рода Diabrotica атакуют тыквенные культуры (огурцы, дыни, тыквы и т.д.) и многие овощные и полевые культуры в промышленном растениеводстве, а также такие, которые выращиваются в приусадебных огородах.
Синтетические органические химические инсектициды были первоочередными инструментами, используемыми для борьбы с насекомыми-вредителями, но биологические инсектициды, такие как инсектицидные белки, полученные из Bacillus thuringiensis (Bt), играли важную роль в некоторых регионах. Способность получения устойчивых к насекомым растений посредством трансформации генами инсектицидного белка Bt радикально изменила современное сельское хозяйство и повысила значение и ценность инсктицидных белков и их генов.
Инсектицидные кристаллические белки из некоторых штаммов Bacillus thuringiensis (B.t.) хорошо известны в данной области техники. См., например, Hofte et al, Microbial Reviews, Vol. 53, No. 2, pp. 242-255 (1989). Эти белки обычно продуцируются бактериями в виде протоксинов с молекулярной массой приблизительно 130 кДа, которые затем расщепляются протеазами в средней кишке насекомых после попадания в пищеварительную систему насекомого для продукции корового токсина с молекулярной массой приблизительно 60 кДа. Эти белки известны как кристаллические белки, потому что в некоторых штаммах B.t. могут наблюдаться отчетливые кристаллические включения со спорами. Эти кристаллические включения часто составлены из нескольких различных белков.
Одной группой генов, которые использовались для получения трансгенных, устойчивых к насекомым культур, являются дельта-эндотоксины из Bacillus thuringiensis (B.t.). Дельта-эндотоксины были успешно экспрессированы в таких сельскохозяйственных культурах как хлопок, картофель, рис, подсолнечник, а также кукуруза, и, как оказалось, обеспечивают превосходный контроль над насекомыми-вредителями. (Perlak, F.J et al. (1990) Bio/Technology 8, 939-943; Perlak, F.J. et al. (1993) Plant Mol. Biol. 22: 313-321; Fujimoto H. et al. (1993) Bio/Technology 11: 1151-1155; Tu et al. (2000) Nature Biotechnology 18: 1101-1104; PCT публикация международной патентной заявки WO 01/13731; и Bing J W et al. (2000) Efficacy of Cry IF Transgenic Maize, 14thBiennial International Plant Resistance to Insects Workshop, Fort Collins, Colo.).
Несколько белков Bt использовались для создания устойчивых к насекомым трансгенных растений, которые были успешно зарегистрированы и в настоящее время запущены в серийное производство. Они включают Cry1Ab, Cry1Ac, Cry1F, Cry3Aa и Cry3Bb в кукурузе, Cry1Ac и Cry2Ab в хлопке и Cry3A в картофеле. Имеется также SMART STAX в кукурузе, который содержит Cry1A.105 и Cry2Ab.
Выпускаемые в промышленном масштабе продукты, экспрессирующие эти белки, экспрессируют один белок, за исключением случаев, где желателен комбинированный инсектицидный спектр из 2 белков (например, Cry1Ab и Cry3Bb в кукурузе, комбинированные для обеспечения устойчивости к чешуекрылым вредителям и блошке длинноусой? соответственно), или где независимое действие белков делает их полезными в качестве инструмента для задержки развития устойчивости у популяций восприимчивых насекомых (например, Cry1Ac и Cry2Ab в хлопке, комбинированные для обеспечения управления устойчивостью в отношении табачной совки).
Некоторые из качеств устойчивых к насекомым трансгенных растений, которые привели к быстрому и широко распространенному принятию этой технологии, также вызывают озабоченность, что у популяций вредителей разовьется устойчивость к инсектицидным белкам, продуцируемым этими растениями. Было предложено несколько стратегий для сохранения полезности признаков устойчивости к насекомым на основе Bt, которые включают размещение белков в высокой дозе в комбинации с резерватом, чередование с различными токсинами или совместное размещение с ними (McGaughey et al. (1998), "B.t. Resistance Management," Nature Biotechnol. 16: 144-146).
Белки, выбранные для использования в пакете Управления устойчивости к насекомым (IRM) должны быть активными с тем, чтобы устойчивость, развившаяся к одному белку, не придавала устойчивость ко второму белку (т.е. перекрестная устойчивость к белкам отсутствует). Если, например, популяция вредителей, выбранная для устойчивости к «белку A», чувствительна к «белку B», то можно сделать вывод, что нет перекрестной устойчивости, и что комбинация белка A и белка B будет эффективной в задержке устойчивости к одному белку A.
В отсутствие устойчивых к насекомым популяций, оценки могут осуществляться на основании других характеристик, считающихся связанными с потенциалом перекрестной устойчивости. При идентификации инсектицидных белков с вероятностью отсутствия проявления перекрестной устойчивости было предложено использование рецепторно опосредованного связывания (van Mellaert et al. 1999). Ключевым прогностическим показателем отсутствия перекрестной устойчивости, присущим этому подходу, является то, что инсектицидные белки не конкурируют за рецепторы у чувствительного вида насекомых.
В случае, когда токсины Bt конкурируют за один и тот же рецептор, то если этот рецептор мутирует в этом насекомом, так что один из токсинов больше не связывается с этим рецептором и, таким образом, больше не является инсектицидным против насекомого, то в этом случае, насекомое будет также устойчиво ко второму токсину (который конкурентно связан с тем же рецептором). То есть, насекомое считается перекрестно устойчивым к обоим токсинам Bt. Однако если два токсина связываются с двумя различными рецепторами, то это может быть показателем того, что насекомое не будет одновременно устойчивым к этим двум токсинам.
Относительно более новая система инсектицидного белка была выявлена у Bacillus thuringiensis, как описано в международном патенте WO 97/40162. Эта система содержит два белка - один массой приблизительно 15 кДа, и другой массой приблизительно 45 кДа. См. также патенты США 6083499 и 6127180. Теперь эти белки были отнесены к их собственному классу и, соответственно, получили обозначение Cry соответственно Cry34 и Cry35. См. Crickmore et al. сайт интернета (biols.susx.ac.uk/home/Neil_Crickmore/Bt/). В настоящее время обнаружены многие другие родственные белки этого типа системы. См., например, патент США 6372480; международные патенты WO 01/14417 и WO 00/66742. Были также описаны оптимизированные для растений гены, которые кодируют такие белки, где гены созданы методами генной инженерии для использования кодонов для оптимизированной экспрессии у растений. См. например патент США 6218188.
Точный тип действия системы Cry34/35 еще предстоит определить, но полагают, что она образует поры в мембранах клеток кишечника насекомых. См. Moellenbeck et al, Nature Biotechnology, vol. 19, p. 668 (July 2001); Masson et al., Biochemistry, 43 (12349-12357) (2004). Точный механизм действия остается неясным, несмотря на трехмерные атомарные координаты и структуры кристаллов, известные для белка Cry34 и Cry35. См. патенты США 7524810 и 7309785. Например, неясно, один или оба из этих белков связываются с конкретным видом рецептора, такого как щелочная фосфатаза или амиопептидаза.
Кроме того, ввиду того, что существуют различные механизмы, посредством которых у насекомого может развиться устойчивость к белку Cry (такие как измененным гликозилированием рецептора [см. Jurat-Fuentes et al. (2002) 68 AEM 5711-5717], удалением рецепторного белка [см. Lee et al. (1995) 61 AEM 3836-3842], мутированием рецептора или другими механизмами [см. Heckel et al., J. Inv. Pathol. 95 (2007) 192-197]), было невозможно заведомо прогнозировать, будет ли существовать перекрестная устойчивость между Cry34/35 и другими белками Cry. Прогнозирование конкурентного связывания для системы Cry34/35 также дополнительно осложняется тем, что два белка вовлечены в бинарную систему Cry34/35. Кроме того, неясно, связываются ли и насколько эффективно связываются эти белки с кишечником/клетками кишечника, и взаимодействуют ли они и как взаимодействуют или связываются друг с другом.
Другие варианты для борьбы с жесткокрылыми насекомыми включают следующие белки: Cry3Bb, Cry3C, Cry6B, ET29, ET33 с ET34, TIC407, TIC435, TIC417, TIC901, TIC1201, ET29 с TIC810, ET70, ET76 с ET80, TIC851 и другие. Были также предложены подходы РНКi (интерференции РНК). См. например, Baum et al., Nature Biotechnology, vol. 25, no. 11 (Nov. 2007) pp. 1322-1326.
Краткое описание сущности изобретения
Настоящее изобретение относится частично к Cry34Ab/35Ab в комбинации с Cry3Ba. Настоящее изобретение относится частично к удивительному открытию, что Cry34Ab/Cry35Ab и Cry3Ba могут использоваться для предотвращения развития устойчивости (к любой системе инсектицидного белка отдельно) у популяции кукурузного корневого жука (Diabrotica spp.). Как будет понятно специалисту в данной области после ознакомления с благоприятными аспектами раскрытого в настоящем описании изобретения, растения, продуцирующие эти инсектицидные Cry-белки, могут использоваться для уменьшения опасений того, что может развиться популяция кукурузного корневого жука, которая может быть устойчивой к любой из этих систем инсектицидного белка отдельно.
Настоящее изобретение частично подтверждается обнаружением того, что компоненты этих систем белка Cry не конкурируют друг с другом за связывание с рецепторами кишечника кукурузного корневого жука.
Настоящее изобретение также частично относится к тройным пакетам или «пирамидам» из трех (или более) систем токсинов, причем парой оснований являются Cry34Ab/Cry35Ab и Cry3Ba. Таким образом, растения (и посевная площадь, засаженная такими растениями), которые продуцируют эти две системы инсектицидных белков, включены в объем настоящего изобретения.
Краткое описание фигур
Подробное описание фигур в частности относится к сопровождающим фигурам, на которых:
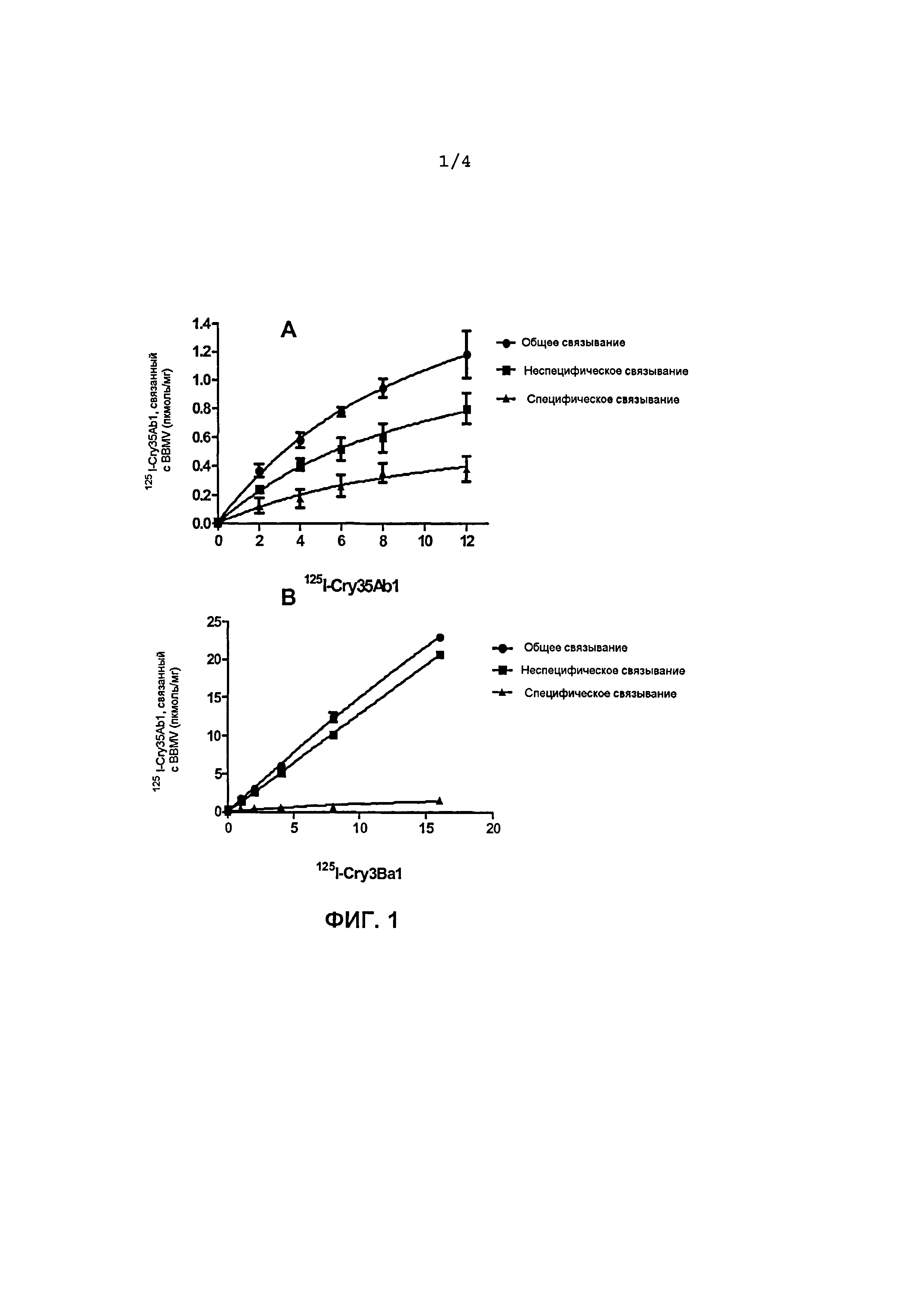
Фиг.1A. Связывание125I-Cry35Ab1 как функция внесенных меченных радиоактивным изотопом Cry-токсинов в BBMV (мембранных пузырьках щеточной каемки), полученных из личинок западных кукурузных корневых жуков. Специфическое связывание=общее связывание-неспецифическое связывание, «усы»=SEM (стандартная ошибка средней).
Фиг.1В. Связывание125I-Cry35Ba1 как функция внесенных меченных радиоактивным изотопом Cry-токсинов в BBMV, полученных из личинок западных кукурузных корневых жуков. Специфическое связывание=общее связывание-неспецифическое связывание, «усы»=SEM (стандартная ошибка средней).
На Фиг.1А-1В указано связывание125I-Cry35Abl (А) и125I-Cry3Bal (В) как функция внесенных меченых радиоактивным изотопом Cry-токсинов (нМ) в BBMV (мембранных пузырьках щеточной каемки) в концентрации 0,1 мг/мл, полученных из личинок западных кукурузных корневых жуков. Специфическое связывание = общее связывание - неспецифическое связывание, «усы» = SEM (стандартная ошибка средней). Cry35Abl: химотрипсинизированная сердцевина (40 кДа); и Cry3Bal: трипсинизированная сердцевина (55 кДа).
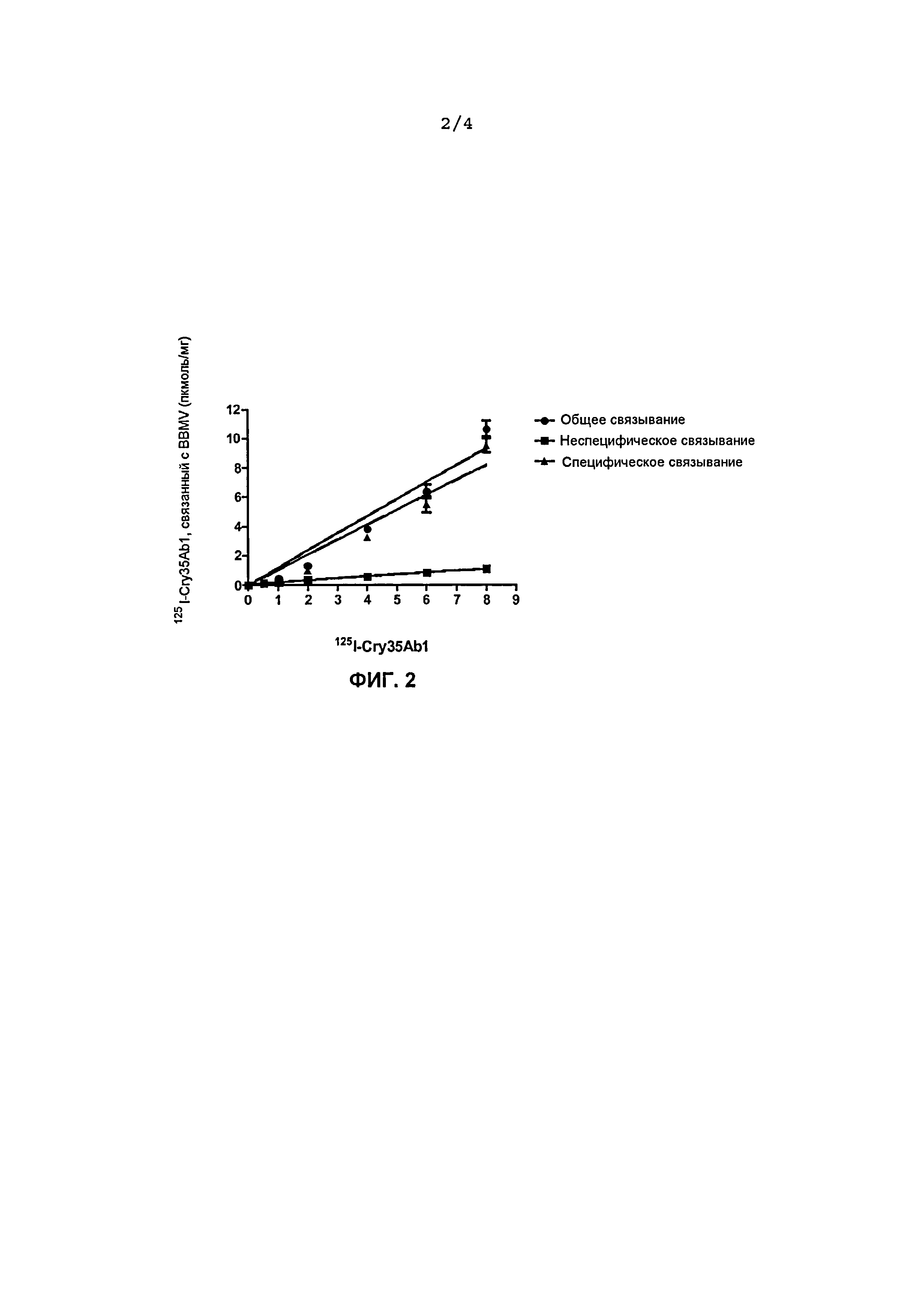
Фиг.2. Связывание125I-Cry35Ab1 с BBMV, полученными из личинок западных кукурузных корневых жуков, при различных концентрациях немеченого конкурента (log 0,1=-1,0, log 10=1,0, log100=2,0, log1000=3,0).
Связывание125I-Cry35Abl в присутствии Cry34Abl (1:50 = молярное отношение125I-Cry35Abl: Cry34Abl) как функция вносимого меченого радиоактивным изотопом Cry35Abl (нМ) в BBMV в концентрации 0,03 мг/мл, полученных из личинок западных кукурузных корневых жуков. Специфическое связывание = общее связывание - неспецифическое связывание, «усы» = SEM (стандартная ошибка средней). Cry35Abl: химотрипсинизированная сердцевина (40 кДа)
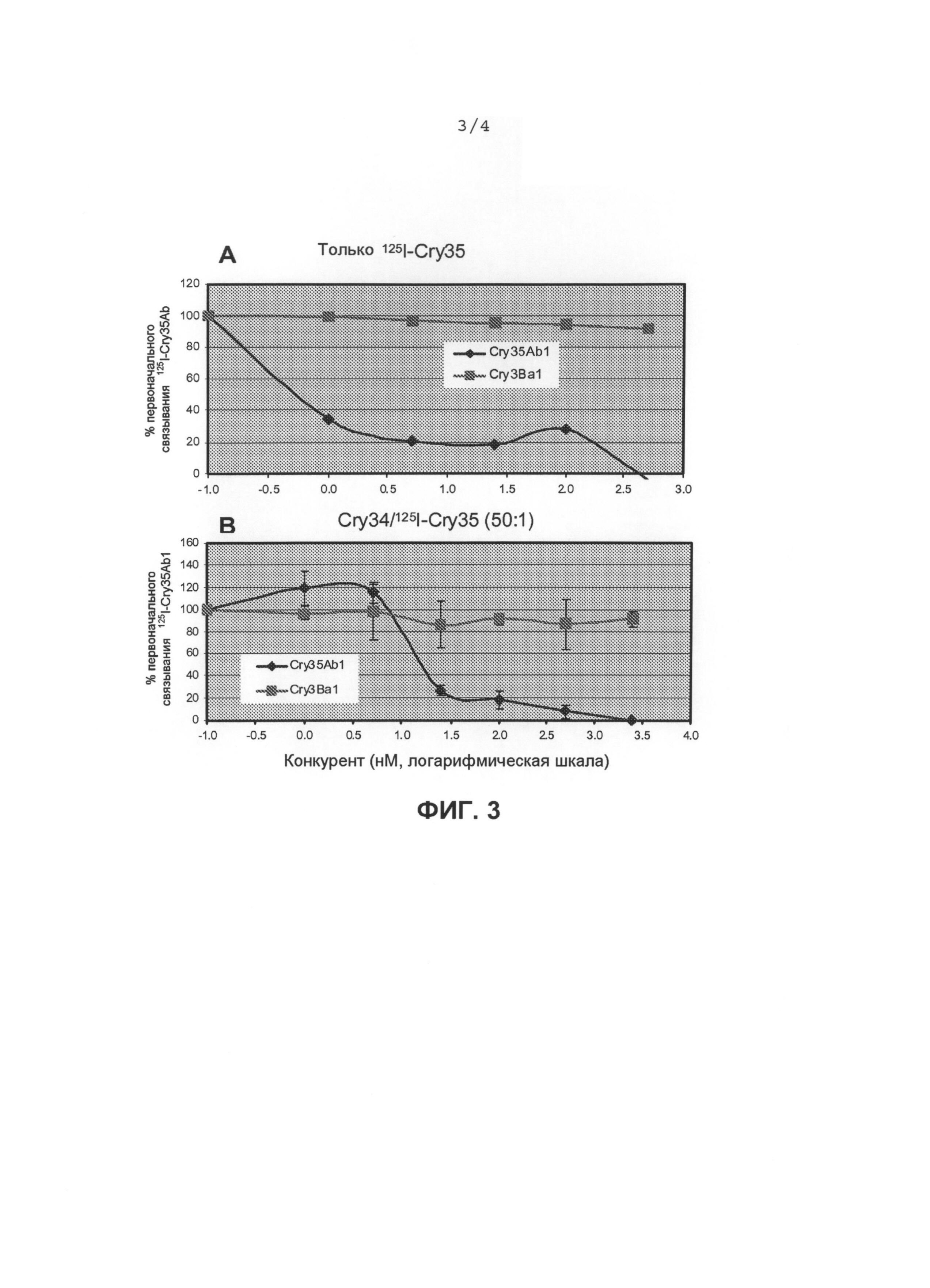
Фиг.3А. Связывание в процентах125I-Cry35Abl с BBMV,
полученными из личинок западных кукурузных корневых жуков, в отсутствие Cry34Ab1.
Фиг.3В. Связывание в процентах125I-Cry35Ab1 с BBMV, полученными из личинок западных кукурузных корневых жуков, в присутствии Cry34Ab1.
Процентная доля первоначального специфического связывания125I-Cry35Abl с BBMV в концентрации 0,1 мг/мл (панель А) или в концентрации 0,03 мг/мл (панель В), полученными из личинок западных кукурузных корневых жуков, при различных концентрациях немеченых конкурентов, инкубированных с 5 нМ125I-Cry35Abl отдельно (панель А) или с 250 нМ Cry34Abl+5 нМ Cry35Abl (панель В). Cry34Abl: полной длины (14 кДа); Cry35Abl: химотрипсинизированная сердцевина (40 кДа); и Cry3Bal: трипсинизированная сердцевина (55 кДа); Iog0,1=-1,0, log1=0, log10=1,0, log100=2,0, log1000=3,0.
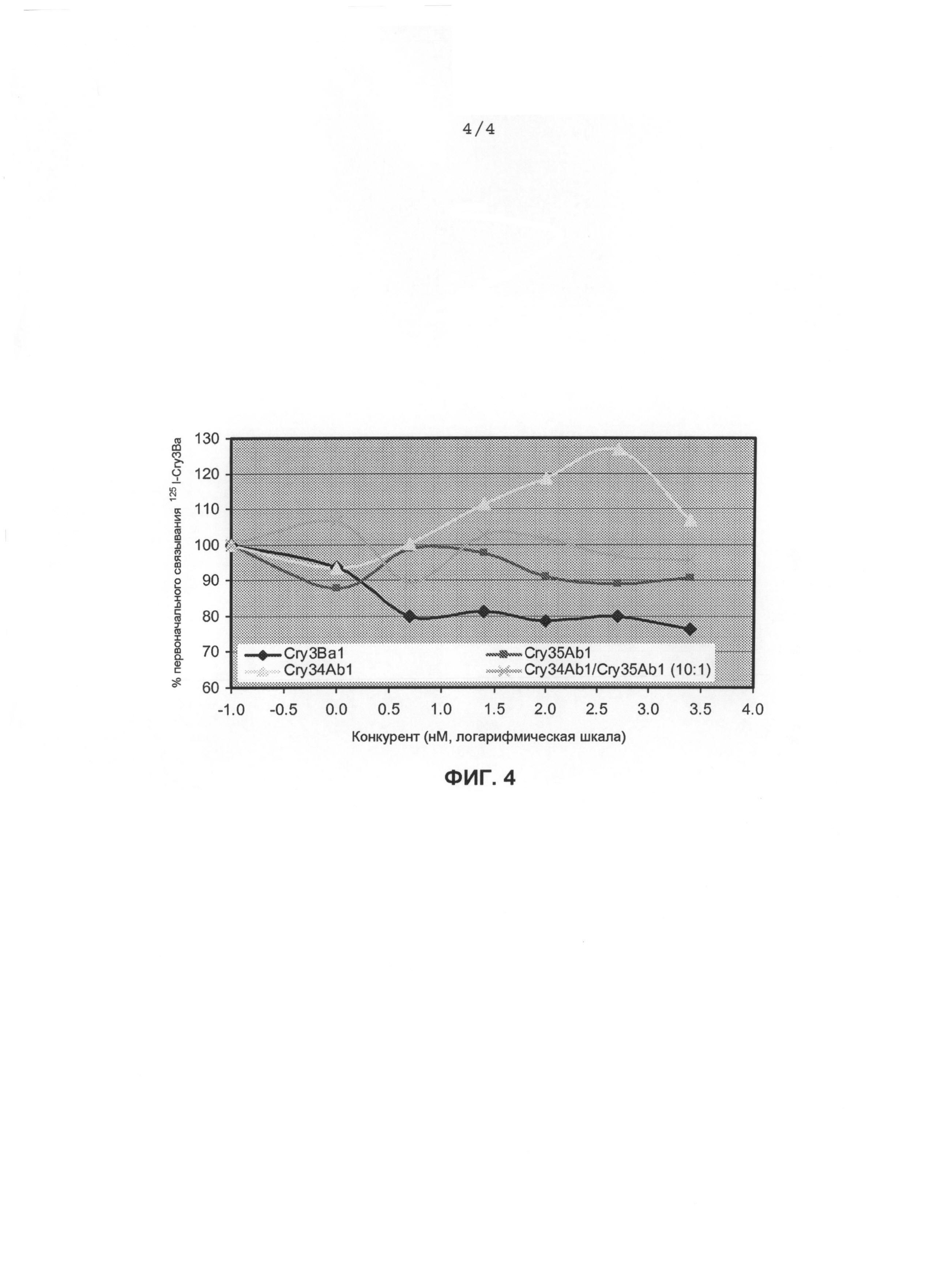
Фиг.4. Связывание в процентах125I-Cry3Ba1 с BBMV, полученными из личинок западных кукурузных корневых жуков, в присутствии различных концентраций варьирующихся немеченых конкурентов.
Процентная доля первоначального специфического связывания125I-Cry3Bal с BBMV в концентрации 0,1 мг/мл, полученными из личинок западных кукурузных корневых жуков, при различных концентрациях немеченых конкурентов, инкубированных с 5 нМ125I-Cry3Bal. Cry34Abl: полной длины (14 кДа); Cry35Abl: химотрипсинизированная сердцевина (40 кДа); и Cry3Bal: трипсинизированная сердцевина (55 кДа); log 0,1=-1,0, log 1=0, log10=1,0, log100=2,0, log1000=3,0.
Краткое описание последовательностей
SEQ ID NO:1: Полная последовательность нативного белка Cry35Ab1.
SEQ ID NO:2: Усеченная химотрипсином последовательность коревого белка Cry35Ab1.
SEQ ID NO:3: Полная последовательность нативного белка Cry3Ba1.
SEQ ID NO:4: Последовательность коревого белка Cry3Ba1 трипсина.
SEQ ID NO:5: Полная последовательность нативного белка Cry34Ab1.
Подробное описание
Последовательности белка Cry34Ab/35Ab могут быть получены, например, из изолята Bacillus thuringiensis PS149B1. Другие гены, белковые последовательности и изоляты-источники для использования в соответствии с настоящим изобретением описаны, например, Crickmore et al. на сайте интернета (lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/intro.html).
Настоящее изобретение включает использование инсектицидных белков Cry34Ab/35Ab в комбинации с токсином Cry3Ba для защиты кукурузы от повреждения и потери урожайности, вызванных поеданием кукурузным корневым жуком, популяциями кукурузных листоедов, у которых может развиться устойчивость к любому из этих систем белков Cry по отдельности (без другого).
Таким образом, в настоящем изобретении речь идет о пакетах Управления устойчивости насекомых (IRM) для предотвращения развития у кукурузного корневого жука устойчивости к Cry3Ba и/или Cry34Ab/35Ab.
Настоящее изобретение относится к композициям для борьбы с вредителями-корневыми жуками, содержащим клетки, которые продуцируют белок токсина Cry3Ba и систему токсина Cry34Ab/35Ab.
Изобретение дополнительно включает хозяина, трансформированного для продукции и белка Cry3Ba, и бинарного токсина Cry34Ab/35Ab, где указанный хозяин представляет собой микроорганизм или растительную клетку.
Дополнительно предполагается, что изобретение относится к способу борьбы с вредителями-корневыми жуками, включающему приведение в контакт указанных вредителей или среды обитания указанных вредителей с эффективным количеством композиции, которая содержит белок Cry3Ba, и дополнительно содержит бинарный токсин Cry34Ab/35Ab.
Вариант осуществления изобретения включает маис, содержащий экспрессируемый растением ген, кодирующий бинарный токсин Cry34Ab/35Ab, и экспрессируемый растением ген, кодирующий белок Cry3Ba, и семена такого растения.
Дополнительный вариант осуществления изобретения включает маис, где экспрессируемый растением ген, кодирующий бинарный токсин Cry34Ab/35Ab, и экспрессируемый растением ген, кодирующий белок Cry3Ba, были интрогрессированы в указанный маис, и семена такого растения.
Как описано в разделе «Примеры», исследования конкурентного связывания с рецепторами с использованием меченого радиоактивным изотопом корового токсинного белка Cry35Ab показывают, что коровый токсинный белок Cry3Ba не конкурирует за связывание в образцах ткани насекомых CRW (кукурузных корневых жуков), с которыми связывается Cry35Ab. См. фиг.2. Эти результаты указывают на то, что комбинация белков Cry3Ba и Cry34Ab/35Ab представляет собой эффективное средство для уменьшения развития устойчивости у популяций CRW к любой белковой системе отдельно.
Таким образом, частично на основании данных, описанных выше, и в других местах настоящего описания, белки Cry34Ab/35Ab и Cry3Ba могут использоваться для получения комбинаций IRM для предотвращения и уменьшения развития устойчивости у CRW. Другие белки могут добавляться к этой комбинации, например, для расширения спектра борьбы с насекомыми. Рассматриваемая комбинация (белков Cry34Ab/35Ab и Cry3Ba) может также использоваться в некоторых предпочтительных «тройных пакетах» или «пирамидах» в комбинации с еще одним белком для борьбы с корневыми жуками, таким как Cry3Aa и/или Cry6Aa; следовательно, такие дополнительные комбинации будут обеспечивать множественные типы действия против корневого жука. РНКi против корневых жуков представляет собой еще один вариант. См., например, Baum et al., Nature Biotechnology, vol. 25, no. 11 (Nov. 2007) pp. 1322-1326.
В свете описания заявки USSN 61/327240 (поданной 23 апреля 2010 г.), относящейся к комбинациям белков Cry34Ab/35Ab и Cry3Aa, USSN 61/388273 (поданной 30 сентября 2010 г.), относящейся к комбинациям белков Cry34Ab/35Ab и Cry6Aa, и USSN 61/477447 (поданной 20 сентября 2011 г.), относящейся к комбинациям белков Cry3Aa и Cry6Aa, некоторые предпочтительные «тройные пакеты» или «множественные типы пакетов действия» настоящего изобретения включают белок Cry3Ba в комбинации с белками Cry34Ab/35Ab, вместе с белком Cry6Aa и/или белком Cry3Ba. Трансгенные растения, включая кукурузу, содержащие ген cry3Ba, гены cry34Ab/35Ab и третью или четвертую систему токсинов (например, ген(ы) cry3Aa и/или cry6Aa), включены в объем настоящего изобретения. Таким образом, такие варианты осуществления нацелены на насекомое, по меньшей мере, тремя типами действия.
Варианты размещения по настоящему изобретению включают использование белков Cry3Ba и Cry34Ab/35Ab в местах выращивания кукурузы, где Diabrotica spp. являются проблематичными. Другим вариантом размещения может быть использование одного или обоих белков Cry3Ba и Cry34Ab/35Ab в комбинации с другими признаками.
Специалисту в данной области будет понятно, что токсины Bt, даже в пределах определенного класса, такие как Cry3Ba и Cry34Ab/35Ab, могут в некоторой степени варьироваться.
Гены и токсины. Термин «изолированный» относится к полинуклеотиду в не встречающемся в природных условиях конструкту или к белку в очищенном или иным образом не встречающемуся в природных условиях состоянию. Гены и токсины, используемые в соответствии с настоящим изобретением, включают не только полные описанные последовательности, но также фрагменты этих последовательностей, варианты, мутанты и слитые белки, которые сохраняют характерную пестицидную активность токсинов, конкретно проиллюстрированных в настоящем описании. Используемые в настоящем описании термины «варианты» или «изменения» генов относятся к нуклеотидным последовательностям, которые кодируют те же токсины, или которые кодируют эквивалентные токсины, обладающие пестицидной активностью. Используемый в настоящем описании термин «эквивалентные токсины» относится к токсинами, обладающим такой же или по существу такой же биологической активностью против вредителей-мишеней как заявленные токсины. Это относится к Cry3 и Cry34/35, а также Cry6 (при использовании в тройных/множественных пакетах) в соответствии с настоящим изобретением. Домены/субдомены этих белков могут быть обменены для получения химерных белков. См. например, патенты США 7309785 и 7524810 в отношении белков Cry34/35. В патенте '785 речь также идет об усеченных белках Cry35. Усеченные токсины также проиллюстрированы в настоящем описании.
Используемый в настоящем описании термин «границы» представляет идентичность последовательностей приблизительно 95% (Cry3Ba и Cry34Abи Cry35Ab), 78% (Cry3B и Cry 34A и Cry35A) и 45% (Cry6 и Cry34 и Cry35) в соответствии с «Revision of Nomenclature for Bacillus thuringiensis Pesticidal Crystal Proteins» N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, и D.H. Dean. Microbiology и Molecular Biology Reviews (1998) Vol 62: 807-813. То же относится к Cry3A и/или Cry6 при использовании в тройных пакетах/множественных пакетах, например, в соответствии с настоящим изобретением.
Для специалиста в данной области будет очевидно, что гены, кодирующие активные токсины, могут быть идентифицированы и получены несколькими способами. Определенные гены или части генов, проиллюстрированные в настоящем описании, могут быть получены из изолятов, депонированных в депозитарии культур. Эти гены или их части или варианты, также могут быть конструированы синтетически, например, путем использования генного синтезатора. Варианты генов могут быть легко сконструированы с использованием стандартных технологий получения точечных мутаций. Также, фрагменты этих генов могут быть получены с использованием коммерчески доступных экзонуклеаз или эндонуклеаз, в соответствии со стандартными методиками. Например, ферменты, такие как Bal31, или сайт-направленный мутагенез могут использоваться для систематической отсечки нуклеотидов от концов этих генов. Гены, которые кодируют активные фрагменты, могут также быть получены с использованием разнообразных рестрикционных ферментов. Протеазы могут использоваться для непосредственного получения активных фрагментов белковых токсинов.
Фрагменты и эквиваленты, которые сохраняют пестицидную активность иллюстративных токсинов, будут входить в объем настоящего изобретения. Также, ввиду избыточности генетического кода, разнообразие различных последовательностей ДНК может кодировать аминокислотные последовательности, раскрытые в настоящем описании. Специалист в данной области вполне может создать эти альтернативные последовательности ДНК, кодирующие одинаковые или по существу одинаковые токсины. Эти вариантные последовательности ДНК входят в объем настоящего изобретения. Используемая в настоящем описании ссылка на «по существу одинаковую» последовательность относится к последовательностям, которые имеют аминокислотные замещения, делеции, добавления или вставки, которые существенно не воздействуют на пестицидную активность. Фрагменты генов, кодирующих белки, которые сохраняют пестицидную активность, также включены в это определение. Фрагменты генов, кодирующих белки, которые сохраняют пестицидную активность, также включены в настоящее изобретение.
Дополнительный способ идентификации генов, кодирующих токсины, и частей генов, используемых в соответствии с настоящим изобретением, осуществляют путем использования олигонуклеотидных зондов. Эти зонды представляют собой детектируемые нуклеотидные последовательности. Эти последовательности могут быть детектированы посредством соответствующей метки или могут быть получены эндогенно флуоресцентными, как описано в международной патентной заявке № WO 93/16094. Как хорошо известно в данной области, молекула зонда и образец нуклеиновой кислоты гибридизуются с образованием прочной связи между двумя молекулами, то можно резонно предположить, что зонд и образец имеют существенную гомологию. Предпочтительно, гибридизацию проводят в жестких условиях методиками, хорошо известными в данной области, как описано, например, в публикации Keller, G.H., M.M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Некоторые примеры солевых концентраций и температурных комбинаций следующие (в порядке увеличения жесткости условий): 2X SSPE или SSC при комнатной температуре; 1X SSPE или SSC при 42°C; 0,1X SSPE или SSC при 42°C; 0,1X SSPE или SSC при 65°C. Выявление зонда обеспечивает средство для определения известным образом, произошла ли гибридизация. Такой зондовый анализ обеспечивает быстрый способ идентификации кодирующих токсин генов настоящего изобретения. Нуклеотидные сегменты, которые используются в качестве зондов в соответствии с изобретением, могут быть синтезированы с использованием синтезатора ДНК и стандартных методик. Эти нуклеотидные последовательности могут также использоваться в качестве затравок ПЦР для амплификации генов по настоящему изобретению.
Вариантные токсины. В настоящем описании были специально проиллюстрированы определенные токсины по настоящему изобретению. Поскольку эти токсины просто иллюстрируют токсины по настоящему изобретению, то должно быть вполне очевидно, что настоящее изобретение включает вариантные или эквивалентные токсины (и нуклеотидные последовательности, кодирующие эквивалентные токсины), обладающие такой же или подобной пестицидной активностью как иллюстрируемый токсин. Эквивалентные токсины имеют гомологию аминокислот с иллюстрируемым токсином. Эта аминокислотная идентичность обычно составляет более чем 75%, или, предпочтительно, более чем 85%, предпочтительно, более чем 90%, предпочтительно, более чем 95%, предпочтительно, более чем 96%, предпочтительно, более чем 97%, предпочтительно, более чем 98%, или в некоторых вариантах осуществления, предпочтительно, более чем 99%. Аминокислотная идентичность обычно самая высокая в критических областях токсина, которые отвечают за биологическую активность или участвуют в определении трехмерной конфигурации, которая, в конечном счете, ответственна за биологическую активность. В этом отношении, приемлемы и могут ожидаться некоторые аминокислотные замещения, если эти замещения происходят в областях, которые не имеют решающего значения для активности или представляют собой консервативные аминокислотные замещения, которые не воздействуют на трехмерную конфигурацию молекулы. Например, аминокислоты могут быть размещены в следующие классы: неполярные, незаряженные полярные, основные и кислотные. Консервативные замещения, посредством которых аминокислота одного класса замещается другой аминокислотой того же типа, входят в объем настоящего изобретения, пока замещение существенно не изменяет биологическую активность соединения. В таблице 1 представлен список примеров аминокислот, относящихся к каждому классу.
В некоторых случаях могут также осуществляться неконсервативные замещения. Решающим фактором является то, что эти замещения не должны значительно снижать биологическую активность токсина.
Рекомбинантные хозяева. Гены, кодирующие токсины настоящего изобретения, могут быть введены в широкое разнообразие микробных или растительных хозяев. Экспрессия гена токсина приводит, прямо или косвенно, к внутриклеточной продукции и поддержанию пестицида. Конъюгальный перенос и рекомбинантный перенос можно использовать для создания штамма Bt, который экспрессирует оба токсина настоящего изобретения. Другие организмы хозяев могут также трансформироваться одним или более генами токсина, используемым затем для оказания синергического эффекта. С подходящими микробными хозяевами, например, Pseudomonas, микробы могут наноситься на местонахождение вредителя, где они пролиферируют и употребляются в пищу. Результатом является контроль над вредителем. Альтернативно, микроб, несущий ген токсина, может быть подвергнут обработке в условиях, которые продлевают активность токсина и стабилизируют клетку. Обработанная клетка, которая сохраняет токсическую активность, затем может вноситься в среду обитания вредителя-мишени. В предмет настоящего изобретения включены нерегенерируемые/нетотипотентные растительные клетки из растения по настоящему изобретению (содержащие, по меньшей мере, один из рассматриваемых генов IRM).
Трансформация растения. Предпочтительным вариантом осуществления настоящего изобретения является трансформация растений генами, кодирующими рассматриваемый инсектицидный белок или его варианты. Трансформированные растения устойчивы к атаке целевым насекомым-вредителем за счет присутствия контролирующих количеств рассматриваемого инсектицидного белка или его вариантов в клетках трансформированного растения. При включении генетического материала, который кодирует инсектицидные свойства инсектицидных токсинов B.t., в геном растения, употребляемого в пищу определенным насекомым-вредителем, взрослые особи или личинки погибнут после употребления в пищу растения. Были трансформированы многочисленные члены односемядольных и двудольных классификаций. Трансгенные агрономические культуры, а также фрукты и овощи представляют промышленный интерес. Такие культуры включают, но без ограничения, маис, рис, сою, канолу, подсолнечник, люцерну, сорго, пшеницу, хлопок, арахис, томаты, картофель и тому подобное. Существует несколько технологий введения инородного генетического материала в клетки растений и для получения растений, которые стабильно поддерживают и экспрессируют введенный ген. Такие технологии включают акселерацию генетического материала, нанесенного на микрочастицы, непосредственно в клетки (патент США 4945050 и патент США 5141131). Растения могут быть трансформированы с использованием технологии Agrobacterium, см. патент США 5177010, патент США 5104310, Европейскую патентную заявку № 0131624B1, Европейскую патентную заявку № 120516, Европейскую патентную заявку № 159418B1, Европейскую патентную заявку № 176112, патент США 5149645, патент США 5469976, патент США 5464763, патент США 4940838, патент США 4693976, Европейскую патентную заявку № 116718, Европейскую патентную заявку № 290799, Европейскую патентную заявку № 320500, Европейскую патентную заявку № 604662, Европейскую патентную заявку № 627752, Европейскую патентную заявку № 0267159, Европейскую патентную заявку № 0292435, патент США 5231019, патент США 5463174, патент США 4762785, патент США 5004863 и патент США 5159135. Другая технология трансформации включает технологию WHISKERS™, см. патент США 5302523 и патент США 5464765. Технология электропорации также использовалась для трансформации растений, см. Международный патент WO 87/06614, патент США 5472869, патент США 5384253, Международный патент WO 9209696 и Международный патент WO 9321335. Все эти патенты и публикации, относящиеся к трансформации, включены в настоящее описание посредством ссылки. В дополнение к многочисленным технологиям трансформации растений, тип ткани, которая контактирует с инородными генами, также может изменяться. Такая ткань включает, но не ограничивается ими, эмбриогенную ткань, I и II типы каллюсной ткани, гипокотиль, меристему и тому подобное. Почти все растительные ткани могут быть трансформированы во время дедифференциации с использованием соответствующих технологий в пределах квалификации специалиста в данной области.
Гены, кодирующие любой из рассматриваемых токсинов, могут быть вставлены в клетки растения с использованием разнообразных способов, которые хорошо известны в данной области, как описано выше. Например, доступно большое число векторов клонирования, содержащих маркер, который обеспечивает возможность отбора трансформированных микробных клеток, и репликационная система, функциональная у Escherichia coli, для получения и модификации инородных генов для вставки в высшие растения. Такие манипуляции могут включать, например, введение мутаций, усечений, добавлений или замещений, как желательно для предполагаемого использования. Векторы включают, например, pBR322, группу pUC, группу M13mp, pACYC184 и т.д. Соответственно, последовательность, кодирующая Cry-белок или варианты, может быть вставлена в вектор в подходящий сайт рестрикции. Полученная плазмида используется для трансформации клеток E. coli, клетки которых культивируют в подходящей питательной среде, затем собирают и лизируют с тем, чтобы было извлечено годное для обработки количество плазмиды. Анализ последовательности, анализ фрагментов рестрикции, электрофорез и другие биохимические-молекулярно-биологические способы в целом проводят в качестве способов анализа. После каждой манипуляции, используемая последовательность ДНК может быть расщеплена и соединена со следующей последовательностью ДНК. Каждая подвергнутая манипулированию последовательность ДНК может быть клонирована в одну и ту же или другие плазмиды.
Использование содержащих T-ДНК векторов для трансформации клеток растений интенсивно исследовалось и достаточно описано в Европейском патенте EP 120516; публикациях Lee и Gelvin (2008), Fraley et al. (1986), и An et al. (1985), и достаточно установлено в данной области.
Как только вставленная ДНК интегрируется в геном растения, она становится относительно устойчивой во всех последующих поколениях. Вектор, используемый для трансформации клетки растения, обычно содержит выбранный маркерный ген, кодирующий белок, который придает трансформированным клеткам растений устойчивость к гербициду или антибиотику, такому как, наряду с другими, биалафос, канамицин, G418, блеомицин или гигромицин. Соответственно, отдельно используемый выбранный маркерный ген должен обеспечить возможность выбора трансформированных клеток, в то время как рост клеток, которые не содержат вставленную ДНК, подавляется селекционным соединением.
Доступно большое число способов вставки ДНК в клетку растения-хозяина. Эти способы включают трансформацию T-DNA, доставленную Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве агента трансформации. Дополнительно, можно использовать слияние протопластов растения с липосомами, содержащими подлежащую доставке ДНК, прямую инъекцию ДНК, трансформацию биологической баллистикой (бомбардировкой микрочастицами) или электропорацию, а также другие возможные способы.
В предпочтительном варианте осуществления настоящего изобретения растения трансформируются генами, где использование кодона кодирующей белок области было оптимизировано для растений. См., например, патент США 5380831, который включен в настоящее описание посредством ссылки. Также, преимущественно используются растения, кодирующие усеченный токсин. Усеченный токсин обычно кодирует примерно от 55% до примерно 80% токсина полной длины. Способы создания синтетических генов B.t. для использования в растениях известны в данной области (Stewart, 2007).
Независимо от методики трансформации, ген предпочтительно включают в вектор переноса гена, адаптированный для экспрессирования генов инсектицидного токсина B.t, и варианты в растительной клетки включением в вектор растительного промотора. В дополнение к растительным промоторам, в растительных клетках для экспрессирования чужеродных генов можно эффективно использовать промоторы из разнообразных источников. Например, возможно использование промоторов бактериального происхождения, таких как промотор октопинсинтазы, промотор нопалинсинтазы и промотор маннопинсинтазы. В некоторых предпочтительных вариантах осуществления могут использоваться промоторы, не связанные с Bacillus thuringiensis. Могут использоваться промоторы, происходящие из растительных вирусов, например, промоторы 35S и 19S вируса мозаики цветной капусты, промотор из вируса мозаики жилок кассавы и тому подобное. Растительные промоторы включают, но без ограничения, малую субъединицу (ssu), промотор бета-конглицинина, промотор фазеолина, промотор ADH (алкогольдегидрогеназы), промоторы теплового шока, промотор ADF (деполимеризации актина), промотор убиквитина, промотор актина и тканеспецифические промоторы. Промоторы могут также содержать определенные энхансерные элементы последовательности, которые могут повысить эффективность транскрипции. Конкретные энхансеры включают, но без ограничения, ADH1-интрон 1 и ADH1-интрон 6. Могут использоваться конститутивные промоторы. Конститутивные промоторы направляют непрерывную генную экспрессию почти во всех типах клеток и почти в любое время (например, актина, убиквитина, CaMV 35S). Тканеспецифические промоторы ответственны за генную экспрессию в определенных типах клеток или ткани, таких как листья или семена (например, промоторы зеина, олеозина, напина, ACP (ацил белка-носителя)), и эти промоторы также могут использоваться. Могут также использоваться промоторы, которые активны во время определенной стадии развития растений, а также активны в определенных тканях и органах растений. Примеры таких промоторов включают, но без ограничения, промоторы, которые являются специфичными для корней, специфичными для пыльцы, специфичными для зародышей, специфичными для «шелка» кукурузы, специфичными для хлопковых волокон, специфичными для эндоспермы семян, специфичными для флоэмы, и тому подобное.
В определенных условиях может быть желательным использование индуцируемого промотора. Индуцируемый промотор ответствен за экспрессию генов в ответ на специфический сигнал, такой как физический стимул (например, гены теплового шока); свет (например, RUBP карбоксилаза); гормон (например, глюкокортикоид); антибиотик (например, тетрациклин); метаболиты; и стресс (например, засуху). Могут использоваться другие желательные транскрипционные и трансляционные элементы, которые функционируют в растениях, такие как 5' нетранслированные лидерные последовательности, РНК последовательности транскрипции терминации и сигнальные последовательности добавления полиаденилата. В данной области известны многочисленные специфичные для растений векторы переноса генов.
Трансгенные культуры, содержащие признаки устойчивости к насекомым (IR), являются преобладающими в растениях кукурузы и хлопка по всей Северной Америке, и использование этих признаков распространяется по всему миру. Промышленные трансгенные культуры, комбинирующие признаки IR и устойчивость к гербицидам (HT), были разработаны множеством семенных компаний. Они включают комбинации признаков IR, приданных инсектицидными белками B.t. и признаков HT, таких как устойчивость к ингибиторам ацетолактатсинтазы (ALS), таким как сульфонилмочевины, имидазолиноны, триазолпиримидин, сульфонанилиды и тому подобное, ингибиторам глутаминсинтетазы (GS), таким как биалафос, глюфосинат и тому подобное, ингибиторам 4-гидроксифенилпируватдиоксигеназы (HPPD), таким как мезотрион, изоксафлутол и тому подобное, ингибиторам 5-энолпирувилшикимат-3-фосфатсинтазы (EPSPS), таким как глифосат и тому подобное, ингибиторам ацетилкоэнзим-A-карбоксилазы (ACCase), таким как галоксифоп, квилазофоп, диклофоп и тому подобное. Известны другие примеры, в которых трансгенно полученные белки обеспечивают устойчивость растений к химическим классам гербицидов, таким как гербициды на основе феноксикислот и гербициды на основе ауксинпиридилоксиацетатов (см. международную патентную заявку WO 2007/053482 A2), или гербициды на основе феноксикислот и гербициды на основе арилоксифеноксипропионатов (см. международную патентную заявку 2005107437 A2, A3). Способность контролировать множественные связанные с вредителями проблемы посредством признаков IR представляет собой ценную концепцию промышленного продукта, и удобство этой продуктовой концепции повышается, если признаки, обеспечивающие контроль над насекомыми, и признаки, обеспечивающие контроль над сорняками, комбинируются в одном растении. Дополнительно, повышенная значимость может быть получена посредством комбинаций в одном растении признаков IR, приданных инсектицидным белком B.t., таким как инсектицидный белок по настоящему изобретению, с одним или более дополнительными признаками HT, такими как указано выше, плюс один или более дополнительных вводимых признаков (например, устойчивости к другим насекомым, приданной происходящими из B.t. или из других инсектицидных белков, устойчивости к насекомым, приданной такими механизмами как РНКi и тому подобное, устойчивости к нематодам, устойчивости к заболеваниям, устойчивости к стрессу, улучшенной утилизации азота и тому подобных), или продуктивные признаки (например, высокое содержание масел, полезный для здоровья состав, улучшение питательной ценности и тому подобное). Такие комбинации могут быть получены или обычной селекцией (селекционный пакет), или совместно в виде нового явления трансформации, включающего одновременное введение множественных генов (молекулярный пакет). Благоприятные эффекты включают способность справляться с вредителями и улучшенную борьбу с сорняками культур растений, что обеспечивает вторичные выгоды для производителя и/или потребителя. Таким образом, настоящее изобретение может быть использовано в комбинации с другими признаками для обеспечения полного агрономического пакета улучшенного качества культуры со способностью гибко и экономически рентабельно регулировать любое число агрономических вопросов.
Трансформированные клетки растут внутри растений обычным образом. Они могут образовывать зародышевые клетки и передавать трансформированный признак(и) потомству растений.
Такие растения можно выращивать обычным образом и скрещивать с растениями, которые имеют такие же трансформированные наследственные факторы или другие наследственные факторы. Полученные гибридные индивиды имеют соответствующие фенотипические свойства.
В предпочтительном варианте осуществления настоящего изобретения растения трансформируются генами, где использование кодона было оптимизировано для растений. См., например, патент США 5380831. Кроме того, способы создания синтетических генов Bt для использования в растениях известны в данной области (Stewart и Burgin, 2007). Одним неограничивающим примером предпочтительного трансформированного растения является фертильное растение маиса, содержащее экспрессируемый растением ген, кодирующий белок Cry3Ba, и дополнительно содержащий второй экспрессируемый растением ген, кодирующий белок Cry34Ab/35Ab.
Перенос (или интрогрессия) определяемого(ых) белками Cry3Aa и Cry34Ab/35Ab признака(ов) в инбредные линии маиса может быть достигнут рекуррентным селекционным разведением, например, обратным скрещиванием. В этом случае, желательного рекуррентного родителя сначала скрещивают с инбредным донором (нерекуррентным родителем), который несет соответствующий(ие) ген(ы) для определяемых Cry признаков. Затем потомство этого однократного скрещивания снова спаривают с рекуррентным родителем с последующей селекцией в полученном потомстве для переноса желаемого признака(ов) от нерекуррентного родителя. После трех, предпочтительно, четырех, более предпочтительно, пяти или более поколений обратного скрещивания с рекуррентным родителем с селекцией желаемого признака(ов), потомство будет гетерозиготным в отношении локусов, контролирующих переносимый(ые) признак(и), но будет как рекуррентный родитель в отношении большинства или почти всех других генов (см., например, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory и Technique, 360-376).
Стратегии управления устойчивостью к насекомым (IRM). Roush et al., например, описывают «двухтоксинные» стратегии, также называемые «построением пирамиды» или «пакетированием», для управления инсектицидными трансгенными культурами. (Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786).
Агентство США по защите окружающей среды на своем сайте в интернете (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) публикует следующие требования к обеспечению не трансгенных (т.е. не-B.t.) резервных культур (блока не-Bt культур/кукурузы) для использования с трансгенными культурами, продуцирующими один белок Bt, активный против вредителей-мишеней.
«Специфические структурированные требования к защищенным от кукурузного мотылька Bt (Cry1Ab или Cry1F) кукурузным продуктам следующие:
Структурированные резерваты: 20% не-чешуекрылый Bt кукурузный резерват в Кукурузной полосе;
50% не-чешуекрылый Bt резерват в Хлопковой полосе.
Блоки
Внутренний (т.е., в пределах поля Bt);
Внешний (т.е., отдельные поля в пределах Ѕ мили (804 м) (если возможно, 1/4 мили (402 м)) от поля Bt для максимизации случайного спаривания).
Полосы внутри поля
Полосы должны быть шириной, по меньшей мере, 4 ряда (предпочтительно, 6 рядов) для уменьшения эффектов передвижения личинок».
Кроме того, Национальная Ассоциация фермеров, выращивающих кукурузу на своем сайте интернета:
(ncga.com/insect-resistance-management-fact-sheet-bt-corn)
также публикует аналогичное руководство в отношении требований к резервату. Например:
«Требования к IRM в отношении кукурузного мотылька:
- Засейте, по меньшей мере, 20% вашего кукурузного поля гибридами резервных семян.
- В областях, продуцирующих хлопок, резерват должен составлять 50%.
- Должны быть засеяны в пределах 1/2 мили (804 м) от гибридов резервной культуры.
- Резервные семена могут засеваться в виде полос в пределах поля Bt; полосы резервной культуры должны иметь ширину, по меньшей мере, 4 ряда.
- Резервная культура может обрабатываться обычными пестицидами, только если для насекомого-мишени достигаются экономические пороги.
- Распыляемые инсектициды на основе Bt не могут использоваться на резервной кукурузе.
- Соответствующие резервные культуры должны высеваться на каждой ферме с Bt кукурузой».
Как указано Roush et al. (например, на стр. 1780 и 1784 в правой колонке), пакетирование или «пирамидирование» из двух различных белков, каждого эффективного против вредителей-мишеней и с небольшой или отсутствующей перекрестной устойчивостью может обеспечить возможность использования меньшего резервата. Roush предполагает, что для успешного пакета, размер резервата менее чем 10% может обеспечить управление устойчивостью, сравнимое примерно с 50% резерватом для одного (не «пирамидированного») признака. Для доступных в настоящее время «пирамидированных» Bt кукурузных продуктов, Агентство США по защите окружающей среды требует засева значительно меньшего (в целом, 5%) структурированного резервата, не содержащие белки Bt кукурузы, чем для продуктов с одним признаком (в целом, 20%).
Существуют различные пути обеспечения эффектов IRM резервата, включая различные геометрические типы посева на полях (как указано выше) и смеси семян в мешке, как дополнительно обсуждается Roush et al. (см. выше), и в патенте США 6551962.
Указанные выше процентные доли или подобные соотношения резервата могут использоваться для рассматриваемых двойных или тройных пакетов или пирамид. Ввиду того, что настоящее изобретение обеспечивает множественные, неконкурентные типы действия против насекомого-мишени корневого жука, настоящее изобретение может обеспечить «нулевой резерв», то есть поле, лишенное резервных растений (потому что они не требуются). Обычно требуется разрешение для засевания полей размером больше примерно 10 акров (40,5 га) конкретными трансгенными растениями B.t. Таким образом, настоящее изобретения включает поле размером больше 10 акров (40,5 га) или более с «нулевым резервом» или растений, не содержащих белки Bt; поля такого размера ранее потребовали бы значительного резерва, не содержащего белки Bt.
Все патенты, патентные заявки, временные заявки и публикации, приведенные в виде ссылки или процитированные в настоящем описании, полностью включены посредством ссылки в той степени, в которой они не противоречат определенным положениям настоящего описания.
Ниже приведены примеры, которые иллюстрируют методы осуществления изобретения. Эти примеры не следует рассматривать как ограничивающие. Если не указано иное, все процентные доли представлены по массе, и все пропорции смесей в растворителе представлены по объему. Все величины температуры представлены в градусах Цельсия.
Если специально не указано иное или не подразумевается иное, единственное число означает используемый в настоящем описании термин «по меньшей мере, один».
ПРИМЕРЫ
Пример 1 -Конструирование экспрессионных плазмид, кодирующих токсины полной длины Cry34Ab1, Cry35Ab1 и Cry3Ba1
Стандартные способы клонирования использовали при конструирования экспрессионных плазмид Pseudomonas fluorescens (Pf), сконструированные для продукции соответственно Cry-белков Cry34Ab1, Cry35Ab1 и Cry3Ba1. Рестрикционные эндонуклеазы из биологических лабораторий Новой Англии (NEB; Ipswich, MA) использовали для переваривания ДНК, и T4 ДНК лигазу от компании Invitrogen использовали для лигирования ДНК. Плазмиды получали с использованием набора Plasmid Midi (Qiagen), следуя инструкциям поставщика. Фрагменты ДНК очищали, используя картридж Millipore Ultrafree®-DA (Billerica, MA) после гель-электрофореза в агарозном геле с трис-ацетатным буфером. Основная стратегия клонирования предусматривала субклонирование кодирующих последовательностей (CDS) белков Cry34Ab1 и Cry35Ab1 полной длины в pMYC1803 в рестрикционные сайты SpeI и XhoI (или XbaI) и CDS белка Cry3Ba1 полной длины в pMYC1050 в рестрикционные сайты KpnI и XbaI, соответственно, посредством чего их помещали под контроль экспрессии соответственно промотора Ptac и терминатора rrnBT1T2 из плазмиды pKK223-3 (PL Pharmacia, Milwaukee, WI). pMYC1803 представляет собой среднюю копию плазмиды с происхождением репликации из RSF1010, гена устойчивости к тетрациклину, и сайтом связывания рибосомы, предшествующим сайты распознавания рестрикционного фермента, в которые могут быть внесены фрагменты ДНК, содержащие кодирующие белок области (заявка на патент США 2008/0193974). Экспрессионную плазмиду трансформировали электропорацией в штамм MB214 P. fluorescens, извлеченный в среде SOC-соевый гидролизат и высевали на чашки с лизогенной бульонной средой Luria (LB), содержащей 20 мкг/мл тетрациклина. Подробности микробиологических манипуляций доступны в заявке на патент США № 2006/0008877, заявке на патент США № 2008/0193974, и заявке на патент США № 2008/0058262, включенных в настоящее описание посредством ссылки. Проводили скрининг колоний рестрикционным перевариванием мини-препарата плазмидной ДНК. Последовательность плазмидной ДНК выбранных клонов, содержащих вставки, определяли по контракту с коммерческой организацией, проводящей определение последовательностей, такой как MWG Biotech (Huntsville, AL). Данные последовательностей собирали и анализировали, используя программное обеспечение Sequencher™ (Gene Codes Corp., Ann Arbor, MI).
Пример 2 - Рост и экспрессия
Анализ роста и экспрессии во встряхиваемых колбах и продукцию токсинов Cry34Ab1, Cry35Ab1 и Cry3Ba1 для характеристики, включая связывание рецептора Bt и биологический анализ насекомых, осуществляли содержащими экспрессионные конструкты штаммами P. fluorescens, выращенными во встряхиваемых колбах (например, клона pMYC2593 для Cry34Ab1, pMYC3122 для Cry35Ab1, и pMYC1177 для Cry3Ba1). Высеваемые культуры, выращенные в среде LB с добавкой 20 мкг/мл тетрациклина, использовали для инокуляции 200 мл той же среды с 20 мкг/мл тетрациклина. Экспрессию токсинов Cry34Ab1, Cry35Ab1 и Cry3Ba1 посредством промотора Ptac индуцировали добавлением изопропил-β-D-1-тиогалактопиранозида (IPTG) после первоначальной инкубации в течение 24 часов при 30°C при встряхивании. Образцы культуры брали во время индукции и в различные временные точки после индукции. Плотность клеток измеряли по оптической плотности при 600 нм (OD600).
Пример 3 - Фракционирование клеток и анализ SDS-PAGE (электрофорезом в полиакриламидном геле с додецилсульфатом натрия) образцов из встряхиваемых колб
В каждую временную точку взятия проб плотность клеток образцов доводили до OD600=20 и аликвоты объемом по 1 мл центрифугировали при 14000×g в течение 5 минут. Клеточные осадки после центрифугирования замораживали при -80°C. Растворимые и нерастворимые фракции из замороженных образцов клеточных осадков после центрифугирования из встряхиваемых колб генерировали с использованием раствора для экстракции бактериального белка EasyLyse™ (EPICENTRE® Biotechnologies, Madison, WI). Каждый клеточный осадок ресуспендировали в 1 мл раствора EasyLyse™ и дополнительно разбавляли 1:4 в литическом буфере и инкубировали со встряхиванием при комнатной температуре в течение 30 минут. Лизат центрифугировали при 14000 об/мин в течение 20 минут при 4°C, и супернатант извлекали в виде растворимой фракции. Затем осадок после центрифугирования (нерастворимую фракцию) ресуспендировали в равном объеме забуференного фосфатом солевого раствора (PBS; 11,9 мМ Na2HPO4, 137 мМ NaCl, 2,7 мМ KCl, pH 7,4). Образцы смешивали в соотношении 1:1 буфером образца 2X Laemmli, содержащим β-меркаптоэтанол, и кипятили в течение 5 минут перед загрузкой на гели NuPAGE Novex 4-20% Bis-Tris (Invitrogen, Carlsbad, CA). Электрофорез выполняли в рекомендуемом буфере XT MOPS. Гели окрашивали безопасной краской SimplyBlue™ Safe Stain в соответствии с протоколом производителя (Invitrogen) и визуализировали с использованием визуализирующей системы Typhoon (GE Healthcare Life Sciences, Pittsburgh, PA).
Пример 4 - Получение телец включения
Препараты телец включения (IB) белка Cry получали на клетках в результате ферментации P. Fluorescens, что обеспечивало продукцию инсектицидного белка B.t., как было продемонстрировано SDS-PAGE и MALDI-MS (лазерной десорбцией при содействии матрицы/ионизационной масс-спектрометрией). Ферментационные осадки P. fluorescens оттаивали на водяной бане при 37°C. Клетки ресуспендировали до 25% масс./об. в литическом буфере [50 мМ Трис, pH 7,5, 200 мМ NaCl, 20 мМ динатриевой соли EDTA (этилендиаминтетрауксусной кислоты), 1% Triton X-100 и 5 мМ дитиотреитола (DTT)]; непосредственно перед использованием добавляли 5 мл/л коктейля ингибитора бактериальной протеазы (P8465 Sigma-Aldrich, St. Louis, MO). Клетки суспендировали, используя гомогенизатор при установке на самый низкий режим (Tissue Tearor, BioSpec Products, Inc., Bartlesville, OK). К клеточной суспензии добавляли лизоцим (25 мг Sigma L7651 из белка куриного яйца) смешиванием металлическим шпателем и суспензию инкубировали при комнатной температуре в течение одного часа. Суспензию охлаждали на льду в течение 15 минут, затем обрабатывали ультразвуком, используя ультразвуковой генератор Branson Sonifier 250 (два 1-минутных сеанса, при 50% рабочем цикле, производительность 30%). Лизис клеток проверяли микроскопией. При необходимости, добавляли дополнительные 25 мг лизоцима и инкубацию и обработку ультразвуком повторяли. Когда лизис клеток подтверждался микроскопией, лизат центрифугировали при 11500×g в течение 25 минут (4°C) с образованием осадка IB, и супернатант удаляли. Осадок IB ресуспендировали 100 мл литического буфера, гомогенизировали ручной мешалкой и центрифугировали, как указано выше. Осадок IB повторно промывали ресуспендированием (в 50 мл литического буфера), гомогенизацией, обработкой ультразвуком и центрифугированием до тех пор, пока супернатант не становился бесцветным, и осадок IB становился плотным и не совсем белым по цвету. Для конечного промывания, осадок IB ресуспендировали в подвергнутой стерилизационной фильтрации (через фильтр с размером пор 0,22 мкм) дистиллированной воде, содержащей 2 мМ EDTA, и центрифугировали. Конечный осадок ресуспендировали в подвергнутой стерилизационной фильтрации дистиллированной воде, содержащей 2 мМ EDTA, и хранили в 1 мл аликвотах при -80°C.
Пример 5 - Анализ SDS-PAGE и количественное определение
Анализ SDS-PAGE и количественное определение белка в препаратах IB проводили оттаиванием 1 мл аликвота осадка IB и разведением 1:20 подвергнутой стерилизационной фильтрации дистиллированной водой. Затем разбавленный образец кипятили с 4X восстанавливающего буфера образца [250 мМ Трис, pH 6,8, 40% глицерол (об./об.), 0,4% бромфенол синий (масс./об.), 8% SDS (масс./об.) и 8% β-меркаптоэтанол (об./об.)] и загружали на Novex® 4-20% Трис-глицин, 12+2-луночный гель (Invitrogen), работающий с буфером IX Трис/глицин/SDS (Invitrogen). Гель задействовали в течение приблизительно 60 мин при 200 вольтах, затем окрашивали и обесцвечивали следующими процедурами с использованием безопасного красителя SimplyBlue™ Safe Stain (Invitrogen). Количественное определение целевых полос проводили сравнением денситометрических величин для полос, в сравнении с образцами бычьего сывороточного альбумина (BSA), обработанными на том же геле, для построения стандартной кривой, используя программное обеспечение Bio-Rad Quantity One.
Пример 6 - Солюбилизация телец включения
10 мл суспензий телец включения из клонов P. fluorescens MR1253, MR1636 и MR832 (содержащих 50-70 мг/мл белков Cry34Ab1, Cry35Ab1 и Cry3Ba1, соответственно) центрифугировали при установке на самый высокий режим микроцентрифуги Eppendorf модели 5415C (приблизительно 14000×g) для осаждения включений. Супернатант буфера для хранения удаляли и заменяли 25 мл 100 мМ буфера ацетата натрия, pH 3,0, и соответственно для Cry34Ab1, и для Cry35Ab1, и 100 мМ буфера карбоната натрия, pH 11, для Cry3Ba1, в конической пробирке емкостью 50 мл. Включения ресуспендировали, используя пипетку, и перемешивали в вихревой мешалке для тщательного смешивания. Пробирки помещали на медленно вращающуюся платформу при 4°C в течение ночи для экстракции белков Cry34Ab1, Cry35Ab1 и Cry3Ba1 полной длины. Экстракты центрифугировали при 30000×g в течение 30 мин при 4°C и сохраняли полученные супернатанты (содержащие солюбилизированные Cry-белки полной длины).
Пример 7 - Усечение протоксинов полной длины
Белки Cry35Ab1 и Cry3Ba1 полной длины были усечены или расщеплены химотрипсином или трипсином для получения химотрипсиновых или трипсиновых фрагментов их сердцевины, которые представляют собой активную форму белков. В частности, солюбилизированный белок Cry35Ab1 полной длины инкубировали с химотрипсином (из бычьей поджелудочной железы) (Sigma, St. MO) при (50:1=Cry-белок:фермент, масс./масс.) в 100 мМ буфера ацетата натрия, pH 3,0 (пример 6), при 4°C при осторожном встряхивании в течение 2-3 дней, в то время как белок Cry3Ba1 полной длины инкубировали с трипсином (из бычьей поджелудочной железы) (Sigma, St. MO) при (20:1=Cry-белок:фермент, масс./масс.) в 100 мМ буфера карбоната натрия, pH 11 (пример 6), при комнатной температуре в течение 1-3 часов. Полную протеолитическую переработку подтверждали анализом SDS-PAGE. Молекулярная масса Cry35Ab1 и Cry3Ba1 полной длины была равна приблизительно 44 и приблизительно равна 73 кДа, и их химотрипсиновой или трипсиновой сердцевины была равна приблизительно 40 и приблизительно равна 55 кДа, соответственно. Аминокислотные последовательности полной длины и химотрипсиновой сердцевины Cry35Ab1 представлена в виде SEQ ID NO:1 и SEQ ID NO:2, и аминокислотные последовательности полной длины и трипсиновой сердцевины Cry3Ba1 представлены в виде SEQ ID NO:3 и SEQ ID NO:4. Ни химотрипсиновая, ни трипсиновая сердцевина не доступна для Cry34Ab1, и таким образом, для анализов связывания использовали Cry34Ab1 полной длины. Аминокислотная последовательность Cry34Ab1 полной длины представлена в виде SEQ ID NO:5.
Пример 8 - Очистка усеченных токсинов
Очищали сердцевинные фрагменты химотрипсинизированного Cry35Ab1 и трипсинизированного Cry3Ba1. В частности, расщепленные материалы центрифугировали при 30000×g в течение 30 мин при 4°C для удаления липидов, и полученный супернатант концентрировали в 5 раз, используя устройство с центрифужным фильтром из регенерированной целлюлозы Amicon Ultra-15 (отсечка молекулярной массы 10000; Millipore). Затем буферы образцов заменяли буфером 20 мМ ацетата натрия, pH 3,5, как для Cry34Ab1, так и для Cry35Ab1, и 10 мМ CAPS [3-(циклогексамино)-1-пропансульфоновую кислоту], pH 10,5, для Cry3Ba1, используя одноразовые колонки PD-10 (GE Healthcare, Piscataway, NJ) или диализ. Конечные объемы доводили до 15 мл, используя соответствующий буфер для очистки с использованием системы жидкостной хроматографии ATKA Explorer (Amersham Biosciences). Для Cry35Ab1, буфер A представлял собой буфер в виде 20 мМ ацетата натрия, pH 3,5, и буфер B представлял собой буфер A+1M NaCl, pH 3,5. Использовали колонку HiTrap SP (5 мл) (GE). После того как колонка была полностью уравновешена с использованием буфера A, раствор Cry35Ab1 инжектировали в колонку при скорости потока 5 мл/мин. Элюирование выполняли с использованием градиента 0-100% буфера B при 5 мл/мин с 1 мл/фракцию. Для Cry3Ba1, буфер A представлял собой буфер в виде 10 мМ CAPS, pH 10,5, и буфер B представлял собой буфер в виде 10 мМ CAPS, pH 10,5+1M NaCl. Использовали колонку Capto Q, 5 мл (5 мл) (GE), и все другие процедуры были аналогичны процедурам для Cry35Ab1. После анализа SDS-PAGE выбранных фракций для дополнительного выбора фракций, содержащих белок-мишень наилучшего качества, фракции объединяли. Буфер для очищенной химотрипсиновой сердцевины Cry35Ab1 заменяли 20 мМ Bist-Tris, pH 6,0, как описано выше. Для очищенной трипсиновой сердцевины Cry3Ba1, соль удаляли, используя одноразовые колонки PD-10 (GE Healthcare, Piscataway, NJ) или диализ. Образцы хранили при 4°C для позднее проводимого анализов связывания после количественного определения с использованием SDS-PAGE и анализов системой визуализации Typhoon (GE) с BSA в качестве стандарта.
Пример 9 - Препарат BBMV
Препараты пузырьков мембраны щеточной каемки (BBMV) средней кишки насекомых широко используются для анализов связывания Cry-токсина с рецептором. Препараты BBMV, используемые в настоящем изобретении, получали из изолированных средних кишок третьей возрастной стадии западного кукурузного корневого жука (Diabrotica virgifera virgifera LeConte), используя способ, описанный Wolferberger et al. (1987). Лейцинаминопептидазу использовали в качестве маркера мембранных белков в препарате, и активность лейцинаминопептидазы неочищенного гомогената и препаратов BBMV определяли, как описано ранее (Li et al. 2004a). Концентрацию белка в препаратах BBMV измеряли, используя способ Bradford (1976).
Пример 10 - Мечение125I
Очищенный Cry34Ab1 полной длины, химотрипсинизированный Cry35Ab1 и трипсинизированный Cry3Ba метили, используя125I, для анализов гомологичного и конкурентного связывания. Для удостоверения в том, мечение радиоактивным изотопом не устраняет биологическую активность Cry-токсинов, проводили йодирование в холодном виде, используя NaI, в соответствии с инструкциями по использованию гранул для йодирования Pierce® (Pierce Biotechnology, Thermo Scientific, Rockford IL). Результаты биоанализа показали, что йодированная химотрипсиновая сердцевина Cry35Ab1 оставалась активной против личинок западного кукурузного корневого жука, но йодирование инактивировало Cry34Ab1. Специфическое связывание меченого радиоактивным изотопом125I-Cry34Ab1 с BBMV насекомых было невозможно выявить и, таким образом, требовался другой способ мечения для оценки связывания Cry34Ab1 с мембранными рецепторами. Поскольку трипсинизированный Cry3Ba1 имел ограниченную активность против западного кукурузного корневого жука, то, следовательно, считалось, что биоанализом с кукурузным корневым жуком при использовании йодированной трипсиновой сердцевины Cry3Ba1 в холодном состоянии трудно оценить изменение активности. Кроме того, специфическое связывание125I-Cry3Ba1 с BBMV выявляли, даже хотя уровень был низким. Йодирование Cry3Ba1 в холодном состоянии и анализ его токсичности игнорировали. Меченые радиоактивным изотопом125I-Cry35Ab1 и125I-Cry3Ba1 получали посредством йодирования гранулами для йодирования Pierce® (Pierce) и Na125I. Колонки для обессоливания по выбору Zeba™ (Pierce) использовали для удаления не включенного или свободного Na125I из йодированного белка. Величины удельной радиоактивности йодированных Cry-белков находились в диапазоне от 1 до 5 мкКи/мкг. Проводили множественные серии мечения и анализов связывания.
Пример 11 - Анализы насыщающего связывания
Анализы специфического или насыщающего связывания выполняли, используя меченые125I Cry-токсины, как описано ранее (Li et al. 2004b). Для определения специфического связывания и оценки аффинности связывания (константы диссоциации, Kd) и концентрации сайтов связывания (Bmax) Cry35Ab1 и Cry3Ba с BBMV насекомых, серии возрастающих концентраций или125I-Cry35Ab1, или125I-Cry3Ba1 инкубировали с данной концентрацией (0,1 мг/мл) BBMV насекомых соответственно в 150 мкл 20 мМ Bis-Tris, pH 6,0, 150 мМ KCl с добавлением 0,1% BSA при комнатной температуре в течение 1 часа при осторожном встряхивании. Токсин, связанный с BBMV, отделяли от свободного токсина в суспензии центрифугированием при 20000×g при комнатной температуре в течение 8 мин. Осадок после центрифугирования дважды промывали 900 мкл (ледяного) такого же буфера, содержащего 0,1% BSA. Радиоактивность, остающуюся в осадке после центрифугирования, измеряли автоматически гамма-счетчиком COBRAII Auto-Gamma (Packard, Canberra company) и учитывали общее связывание. Параллельно проводили другую серию реакций связывания, и 500-1000-кратный избыток немеченого соответствующего токсина включали в каждую из реакций связывания для того, чтобы он полностью занял все участки специфического связывания немеченого соответствующего токсина на BBMV, который использовали для определения неспецифического связывания. Специфическое связывание оценивали вычитанием неспецифического связывания из общего связывания. Величины Kd и Bmax этих токсинов оценивали, используя специфическое связывание, в сравнении с концентрациями меченого токсина, используя программное обеспечение GraphPad Prism 5.01 (GraphPad Software, San Diego, CA). Графики составляли с использованием программ или Microsoft Excel, или GraphPad Prism. Эксперименты повторяли, по меньшей мере, четыре раза и результаты наносили на графики, показанные на фиг.1A (связывание125I-Cry35Ab1 с BBMV) и фиг.1B (связывание125I-Cry3Ba1 с BBMV). Эти эксперименты связывания продемонстрировали, что как125I-Cry35Ab1, так и125I-Cry3Ba1 были способны специфически связываться с BBMV (фиг.1A и 1B).125I-Cry35Ab1 и125I-Cry3Ba1 имели аффинность связывания Kd=11,66±11,44, 7,35±3,81 (нМ), соответственно, и концентрацию сайтов связывания Bmax=0,78±0,46, 0,55±0,13 (пкмоль/мг BBMV), соответственно.
Специфическое связывание125I-Cry35Ab1 проводили в присутствии немеченого Cry34Ab1 (молярное отношение 1:50=125I-Cry35Ab1:Cry34Ab1). Параметры связывания (Kd и Bmax) не были получены, потому что специфическое связывание125I-Cry35Ab1 не было насыщающим (фиг.2). Однако на специфическое связывание125I-Cry35Ab1 приходилось приблизительно 90% общего связывания в присутствии немеченого Cry34Ab1.
Пример 12 - Анализы конкурентного связывания
Анализы конкурентного связывания проводили для определения того, разделяют ли Cry34Ab1 и Cry35Ab1 отдельно плюс их смесь в качестве бинарного токсина один и тот же набор сайтов связывания с Cry3Ba1. Для анализов гомологичного конкурентного связывания Cry3Ba1, увеличивающиеся количества (0-2500 нМ) немеченого Cry3Ba1 сначала смешивали с 5 нМ125I-Cry3Ba1, и затем инкубировали с BBMV насекомых в концентрации 0,1 мг/мл при комнатной температуре в течение 1 часа соответственно для обеспечения им возможности конкурировать за предполагаемые рецептор(ы) на BBMV. Аналогичным образом, гомологичную конкуренцию Cry35Ab1 завершали 5 нМ125I-Cry35Ab1 в отсутствие или в присутствии немеченого Cry35Ab1 (в молярном отношении125I-Cry35Ab1:Cry34Ab1 1:50) и с BBMV в концентрации 0,03 мг/мл, соответственно. Процентные доли связанного с125I-Cry3Ba1 или125I-Cry35Ab1 с BBMV определяли для каждой из реакций, по сравнению с исходным общим (или специфическим) связыванием в отсутствие немеченого конкурента.
Анализы гетерогенного конкурентного связывания между125I-Cry35Ab1 и немеченым Cry3Ba1 проводили в отсутствие или в присутствии немеченого Cry34Ab1 для идентификации того, разделяют ли они один и тот же набор сайта(ов) связывания. Это было достигнуто увеличением количества немеченого Cry3Ba1 в качестве конкурента для конкуренции за связывание с одним125I-Cry35Ab1 или125I-Cry35Ab1+Cry34Ab1 (молярное отношение125I-Cry35Ab1:Cry34Ab1 1:50). Аналогичным образом, также проводили анализы реципрокного гетерогенного конкурентного связывания, которое достигалось увеличением количества немеченого Cry35Ab1 и Cry34Ab1 отдельно или смеси Cry35Ab1+Cry34Ab1 (молярное отношение Cry35Ab1:Cry34Ab1 1:50) в качестве одного или двух конкурентов, включенных в реакции, для конкуренции за связывание с меченым Cry3Ba1, соответственно. Эксперименты повторяли, по меньшей мере, три раза, и результаты наносили на графики, показанные на фиг.3A (связывание в процентах одного125I-Cry35Ab) и фиг.3B (связывание в процентах125I-Cry35Ab1 в присутствии Cry34Ab1).
Результаты экспериментов продемонстрировали, что Cry35Ab1 был способен превзойти в конкурентном специфическом связывании125I-Cry35Ab1, независимо от отсутствия (фиг.3A) или присутствия (фиг.3B) Cry34Ab1. Однако Cry3Ba1 был не способен конкурировать за специфическое связывание с125I-Cry35Ab1 как в отсутствие, так и в присутствии Cry34Ab1. В анализах реципрокного конкурентного связывания Cry3Ba также был способен сместиться выше 20% общего связывания, что отражает то, что он полностью превзошел в конкуренции за его специфическое связывание, потому что специфическое связывание составляет только небольшую фракцию (см. фиг.1B). Однако ни Cry34Ab1, ни Cry35Ab1 отдельно, ни смесь Cry35Ab1+Cry34Ab1 (1:10) не была способна вытеснить125I-Cry3Ba1. Эти данные указывают на то, что один Cry35Ab1 или смесь Cry35Ab1+Cry34Ab1 не разделяют рецепторный сайт связывания с Cry3Ba1.
Ссылки
Bradford, M.M. 1976. A rapid и sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Anal. Biochem. 72, 248-254.
Li, H., Oppert, B., Higgins, R.A., Huang, F., Zhu, K.Y., Buschman, L.L., 2004a. Comparative analysis of proteinase activities of Bacillus thuringiensis -resistant and -susceptible Ostrinia nubilalis (Lepidoptera: Crambidae). Insect Biochem. Mol. Biol. 34, 753-762.
Li, H., Oppert, B., Gonzalez-Cabrera, J., Ferre, J., Higgins, R.., Buschman, L.L. and Zhu, K.Y. и Huang, F. 2004b. Binding analysis of Cry1 Ab and Cry 1 Ac with membrane vesicles from Bacillus thuringiensis-resistant and -susceptible Ostrinia nubilalis (Lepidoptera: Crambidae). Biochem. Biophys. Res. Commun. 323, 52-57.
Wolfersberger, M.G., Luthy, P., Maurer, A., Parenti, P., Sacchi, F., Giordana, B., Hanozet, G.M., 1987. Preparation and partial characterization of amino acid transporting brush border membranevesicles from the larval midgut of the cabbage butterfly (Pieris brassicae). Comp. Biochem. Physiol. 86A, 301-308.
US Patent Application No. 20080193974. 2008. BACTERIAL LEADER SEQUENCES FOR INCREASED EXPRESSION
US Patent Application No. 20060008877, 2006. Expression systems with sec-system secretion.
US Patent Application No. 20080058262, 2008. rPA optimization.
Реферат
Изобретение относится к области биохимии, в частности к трансгенному растению, которое имеет устойчивость к кукурузному корневому жуку (Diabrotica spp.), содержащему ДНК, кодирующую белок Cry34Ab1, ДНК, кодирующую белок Cry35Ab1 и ДНК, кодирующую белок Cry3Ba1, его семени и клетке, а также к способу замедления развития устойчивости к белкам Cry34Ab1, Cry35Ab1 и Cry3Ba1 у кукурузного корневого жука с его использованием. Также раскрыто множество растений на поле, содержащее множество вышеуказанных трансгенных растений и растений, не содержащих белки Bacillus thuringiensis (Bt) (non-Bt растения), и смесь семян, содержащая семена от non-Bt растений и множество вышеуказанных семян. Изобретение также относится к способу борьбы с кукурузным корневым жуком приведением в контакт указанного насекомого с белком Cry34Ab1, белком Cry35Ab1 и белком Cry3Ba1. Изобретение позволяет эффективно бороться к кукурузным корневым жуком. 7 н. и 14 з.п. ф-лы, 4 ил., 1 табл., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Фрагмент гибридного токсина bacillus thuringiensis, обладающий инсектицидной активностью, кодирующая его рекомбинантная днк, способ борьбы с насекомыми

Комментарии