Способ и система для введения легочного сурфактанта путем пульверизации - RU2671205C2
Код документа: RU2671205C2
Чертежи






Описание
Область техники, к которой относится изобретение
Изобретение относится к инстилляции медикамента в заглоточное пространство и, более конкретно, к способу и системе для введения легочного сурфактанта посредством распыления (пульверизации).
Уровень техники
Введение медикамента в легкие часто сталкивается с проблемой достижения правильного баланса между эффективностью и инвазивностью воздействия. Особенно трудно достичь баланса в отношении младенцев (далее в качестве синонима термину "младенцы" используется термин "новорожденные"). У недоношенных новорожденных может развиться респираторный дистресс-синдром новорожденных (РДСН) - легочное заболевание вследствие общего недоразвития, которое приводит к отсутствию легочного сурфактанта. В течение многих лет лечение РДСН предусматривало введение экзогенных легочных сурфактантов в форме болюсов посредством их эндотрахеальной инстилляции интубированным недоношенным новорожденным, в отношении которых проводится механическая вентиляция. Хотя это лечение весьма эффективно, что доказывается снижением смертности, оно может иметь определенные недостатки (волюмо/баротравмы), присущие механической вентиляции и процедуре интубации, которая в любом случае является инвазивной.
С учетом потенциальных осложнений, ассоциированных с интубацией и механической вентиляцией, большое внимание уделялось другим подходам к введению экзогенных легочных сурфактантов.
Так, в качестве возможной поддержки дыхательной функции в интенсивной неонатальной терапии начали применять неинвазивные процедуры вентиляции, такие как метод самостоятельного дыхания под постоянным положительным давлением в дыхательных путях (СРАР, continuous positive airway pressure) через нос (nasal continuous positive airway pressure, nCPAP). В данном методе воздух подается в легкие через специально разработанные назальные устройства, такие как маски, канюли и др.
В развитие данного направления в последние пятнадцать лет значительное внимание уделялось также поиску альтернативных путей введения легочного сурфактанта. Большинство проведенных исследований, основанных на гипотезе, что более мягкое и более постепенное введение способно предотвратить значительные флуктуации церебрального кровообращения, которые могут иметь место при болюсном введении, было сфокусировано на введении распыленного сурфактанта (т.е. частиц с волюметрическим диаметром <10 мкм) посредством коммерческих небулайзеров, подключаемых к контуру вентиляции (см. например Mazela J., Merrit Т.A, Finner N.N. "Aerosolized surfactants", Curr Opin Pediatr. 2007; 19(2): 155, или Mazela J., Polin R.A. "Aerosol delivery to ventilated newborn infants: Historical challenges and new directions", Eur J Pediatr. 2011: 1-12, или Shah S. "Exogenus surfactant: Intubated present, nebulized future?", World Journal of Pediatrics 2011; 7(1): 11-15). Несмотря на более однородное распределение сурфактанта, улучшения в функционировании легких, достигнутые в различных исследованиях, являются весьма противоречивыми, причем они не свидетельствуют об эффективности подхода на основе распыления.
В других исследованиях система распыления сурфактанта была связана с неинвазивными вентиляторными средствами (т.е. создавалось СРАР через назальные канюли). В этих условиях количество распыленного сурфактанта, попадающего в легкие, оценивается как пренебрежимо малое (менее 20%). Кроме того, распыленный сурфактант, введенный в условиях СРАР, не оказывает бесспорного полезного влияния на функционирование легких, как это было показано в пилотных исследованиях на недоношенных новорожденных (см., например, Berggren Е., Liljedhal М., Winbladh В., Andreasson В., Curstedt Т., Robertson В. et al. "Pilot study of nebulized surfactant therapy for neonatal respiratory distress syndrome", Acta Paediatrica 2000; 89 (4): 460-4, или Finner N.N., Merritt T. A., Bernstein G., Job L, Mazela J., Segal R. "An open label, pilot study of Aerosurf combined with nCPAP to prevent RDS in preterm neonates", Journal of aerosol medicine and pulmonary drug delivery. 2010; 23(5): 303-9, или Jorch G., Hartl H., Roth В., Kribs A., Gortner L, Schaible T. et al. "Surfactant aerosol treatment of respiratory distress syndrome in spontaneously breathing premature infants", Pediatr Pulmonol. 1997; 24(3): 222-4). Исследования были весьма разнообразными, и авторы создавали различные условия в отношении нескольких параметров, например: 1) расположения и типа аэрозольного генератора, 2) типа вентиляции, 3) влажности, 4) расхода воздуха, 5) размера частиц, 6) моделей РДСН, 7) степени разбавления сурфактанта и т.д.
Это затрудняет проведение качественного сравнения данных исследований. При этом известные системы обычно являются не очень эффективными.
Кроме того, если сурфактант в форме аэрозоля вводится посредством небулайзера через маску без синхронизации с дыханием новорожденного, какая-то его часть может выдыхаться при выдохе, так что она осаждается либо в верхних дыхательных путях, либо в трубках/соединениях или выводится через патрубки выдоха. Кроме того, доставка распыленного сурфактанта увеличивает "мертвое пространство" дыхательных контуров и, с учетом того что недоношенные новорожденные могут иметь дыхательный объем, равный 1 мл или даже менее, это может способствовать удерживанию СO2, что постепенно может стать опасным, если будет достигнута конечная ситуация гиперкапнии.
Интересный подход, который может частично ослабить описанный риск, был предложен Вагнером и его соавторами (Wagner М.Н., Amthauer Н., Sonntag J., Drenk F., Eichstadt H.W., Obladen M. "Endotracheal surfactant atomization: an alternative to bolus instillation?", Crit Care Med. 2000; 28(7): 2540) и показал обнадеживающие результаты. Он основан на использовании модифицированной трахеальной трубки с распылителем, вводимым (только при вдохе, как это было идентифицировано оператором) на кончике трубки и образующим частицы со средним объемно-поверхностным диаметром (средним диаметром Саутера) >100 мкм. Установка распылителя в трубку была связана со сложными технологическими проблемами.
Обещающие результаты подхода, предложенного Вагнером, возможно, обусловлены довольно большими размерами частиц, что позволяет получить распределение и поглощение легочного сурфактанта, схожие с вариантом болюсного введения. В частности, можно выдвинуть гипотезу о том, что крупные частицы будут осаждаться в более центральных областях дыхательных путей и окажутся способными достичь нерасширенных альвеол за счет градиента диффузии, эффекта Марангони и капиллярности. Мелкие распыленные частицы, которые способны пройти через верхние дыхательные пути, напротив, с высокой вероятностью будут либо выдохнуты при выдохе, либо осядут в уже открытых альвеолах, что приведет к наличию потока воздуха при дыхании, не достигающего ателектатической области легкого и вносящего вклад в еще более неоднородное распределение легочных временных постоянных. Другое преимущество подхода Вагнера состоит в том, что легочный сурфактант вводится только в фазе вдоха, и это позволяет лучше управлять количеством эффективно доставляемого медикамента, что соответствует улучшениям в терминах экономии медикамента и клинических результатов.
Недостатком этого метода является то, что трубка должна быть введена до трахеи (где будет находиться небулайзер), чтобы обеспечить возможность доставки относительно крупных частиц, которые были бы отфильтрованы верхними дыхательными путями, а эта процедура является инвазивной и может создавать проблемы, особенно для новорожденных. С другой стороны, все известные системы, реализующие неинвазивные (т.е. не использующие введения трахеальной трубки) способы доставки, способны вводить только частицы малых размеров, которые способны преодолеть наружный барьер, но менее эффективны в плане достижения всех областей легких, нуждающихся в лечении.
Кроме того, согласно эксперименту Вагнера "синхронизация" доставки медикамента с дыхательным ритмом осуществляется вручную, что не является идеальным по очевидным причинам, включающим потери продукта. С другой стороны, все известные попытки осуществления такой синхронизации, например описанные в ЕР 692273, требуют присутствия соответствующего устройства, такого как механический вентилятор. Однако такое решение требует подсоединения к воздушным путям новорожденного, увеличения мертвого пространства и механической нагрузки на дыхание пациента.
Раскрытие изобретения
По всем этим причинам представляется весьма желательным создание улучшенных неинвазивных способа и системы для введения экзогенного сурфактанта, которые способны совместить преимущества метода Вагнера с полноценной автоматической синхронизацией доставки.
Таким образом, задача, решаемая изобретением, состоит в преодолении по меньшей мере некоторых проблем, свойственных уровню техники.
Изобретение предлагает способ и систему, охарактеризованные в прилагаемых пунктах формулы.
Согласно одному аспекту изобретения предлагается система для доставки медикамента, содержащего легочный сурфактант, пациентам со спонтанным дыханием. Система содержит:
- i) катетер, адаптированный для введения в заглоточную область пациента и имеющий по меньшей мере первый канал, адаптированный для подачи в область глотки пациента потока жидкого медикамента, и по меньшей мере второй канал, адаптированный для подачи в область глотки пациента потока газа под давлением,
- ii) первое насосное средство, подсоединенное к первому концу по меньшей мере одного первого канала и выполненное с возможностью создания давления, продвигающего столб жидкого медикамента ко второму концу по меньшей мере одного первого канала;
- iii) второе насосное средство, подсоединенное к первому концу по меньшей мере одного второго канала и выполненное с возможностью создания потока сжатого газа, обеспечивающего, при встрече в полости глотки со столбом жидкого медикамента, дробление указанного столба на множество мелких частиц с обеспечением доставки распыленного медикамента в легкие пациента;
- iv) детектор давления, пространственно отделенный от первого и второго каналов и служащий для измерения значений, характеризующих давление в полости глотки пациента и предназначенных для использования при определении того, находится ли пациент в фазе вдоха или в фазе выхода, причем первое насосное средство адаптировано для селективного активирования только в фазе вдоха.
В предпочтительном варианте дыхательная активность оценивается путем измерения колебаний давления в заглоточной области. В более предпочтительном варианте детектор давления содержит: третий канал, адаптированный для подачи в область глотки пациента потока водного раствора; третье насосное средство для создания постоянного потока водного раствора и датчик давления, подсоединенный к третьему каналу для измерения значения, характеризующего давление в потоке водного раствора.
Использование заполненного жидкостью просвета (встроенного в узел катетера или полностью отделенного от него) для оценки колебаний давления в полости глотки обеспечивает следующие особые преимущества по сравнению с другими подходами.
1) Оно обеспечивает очень быстрый отклик системы преобразования давления (жидкости являются несжимаемыми и вносят в измерительную систему минимальные усложнения, что приводит к очень малым постоянным времени). В результате обеспечивается оперативное детектирование фаз дыхания новорожденного (частота дыхания у недоношенных новорожденных может превышать 60 дыханий в минуту, что на порядок больше, чем у взрослых).
2) Присутствие жидкости в просвете предотвращает окклюдирование катетера текучими средами, всегда присутствующими в глотке, например слюной или влагой, обусловленной насыщением окружающего пространства водяным паром. Данное преимущество является существенным по сравнению с использованием для детектирования давления просветов, заполненных воздухом.
Катетер предпочтительно изготовлен из гибкого пластика; альтернативно, он может содержать частично жесткий каркас. По меньшей мере второй канал предпочтительно состоит из группы каналов, расположенных вокруг первого канала.. В предпочтительном варианте третий канал встроен в узел катетера. В конкретном варианте третий канал является одним из каналов, расположенных вокруг первого канала.
Медикамент в форме аэрозоля предпочтительно содержит экзогенный легочный сурфактант, например выбранный из группы, состоящей из модифицированных природных легочных сурфактантов (например, представленных порактантом альфа), синтетических сурфактантов и воспроизводящих сурфактантов. Сжатый газ в предпочтительном варианте включает воздух или кислород.
Согласно еще одному варианту катетер снабжен упорами, находящимися на его наружной поверхности. В результате, когда катетер будет позиционирован для введения аэрозоля, второй конец каждого из по меньшей мере первого и по меньшей мере второго каналов будет пространственно отделен от стенки полости глотки.
Согласно второму аспекту изобретения предлагается способ предотвращения и/или лечения респираторного дистресс-синдрома у пациентов со спонтанным дыханием. Предлагаемый способ включает операции доставки распыленного медикамента в заглоточную область пациента посредством многоканального гибкого катетера с формированием столба жидкого медикамента, имеющего низкое давление и подводимого по меньшей мере по первому каналу указанного катетера, и формирования потока газа под давлением, подаваемого по меньшей мере по второму каналу указанного катетера. При этом столб жидкого медикамента дробится на множество частиц, когда столб жидкости и поток газа под давлением встречаются в заглоточной области, а способ дополнительно включает операцию детектирования, посредством датчика давления, связанного по меньшей мере с третьим каналом, адаптированным для подачи потока водного раствора в заглоточную область, дыхательной активности пациента, причем операцию доставки осуществляют только в фазе вдоха. В предпочтительном варианте водный раствор представляет собой физиологический водно-солевой раствор, содержащий 0,9% хлорида натрия, опционно буферизованный до физиологического рН. Способ по изобретению предпочтительно включает применение к пациенту неинвазивной вентиляционной процедуры, такой как nСРАР.
Согласно третьему аспекту изобретения предлагается комплект, содержащий: а) фармацевтическую композицию, содержащую легочный сурфактант, суспендированный в фармацевтически приемлемой водной среде; b) систему согласно изобретению; с) средство для позиционирования и/или для облегчения введения катетера в заглоточную область и d) контейнерное средство для размещения указанных фармацевтической композиции, системы и средства для позиционирования. В одном из вариантов изобретения средство для позиционирования содержит ларингеальную маску. Согласно четвертому аспекту изобретения предлагается способ предотвращения и/или лечения респираторного дистресс-синдрома у недоношенных новорожденных со спонтанным дыханием. Данный способ включает операцию доставки легочного сурфактанта в заглоточную область новорожденных только в фазе вдоха, которую детектируют посредством датчика давления. Еще один аспект изобретения охватывает компьютерную программу для управления описанным способом.
Способ и система согласно предпочтительным вариантам изобретения позволяют оптимизировать подачу сурфактанта с эффективной доставкой его распыленных частиц в легкие без необходимости использовать инвазивную операцию для позиционирования катетера. Способ и система по изобретению обладают рядом преимуществ, включающих:
более мягкий процесс распыления благодаря применению катетера, распыляющего посредством дробления воздухом, т е. оказывающего минимальное механическое воздействие на сурфактант;
возможность отслеживать дыхательный паттерн пациента и соответственно синхронизировать подачу сурфактанта без подключения отдельного датчика в дыхательных путях или во втором просвете;
гибкость применения устройства, которое может использоваться либо при спонтанном дыхании, либо при обеспечении неинвазивной респираторной поддержки, например при nCPAP или других неинвазивных вентиляционных процедурах, таких как назальная неинвазивная вентиляция с перемежающимся положительным давлением (intermittent positive-pressure ventilation, IPPV);
использование компонентов, уже знакомых больничному персоналу, например катетеров и одноразовых датчиков давления (схожих с датчиками, применяемыми для инвазивного мониторинга кровяного давления);
низкая стоимость всех контактирующих с легочным сурфактантом и пациентом частей, которые являются одноразовыми; это соответствует более гигиеничным и безопасным лечебным процедурам, чем применяемые в настоящее время, что имеет особое значение, когда пациентом является недоношенный новорожденный.
Краткое описание чертежей
Примеры осуществления изобретения иллюстрируются чертежами.
На фиг. 1 приведена блок-схема предпочтительного варианта изобретения.
На фиг. 2 проиллюстрированы два примера узла катетера согласно варианту изобретения, содержащего многопросветный катетер и третий канал для измерения давления в заглоточной полости.
На фиг. 3 представлен пример конкретного профиля каналов в многопросветном катетере согласно варианту изобретения.
На фиг. 4а и 4b представлены соответственно датчик давления согласно варианту изобретения и контур управления этим датчиком.
На фиг. 5 представлен пример сигнала, характеризующего давление в заглоточной области недоношенного новорожденного.
На фиг. 6 иллюстрируются операции способа согласно предпочтительному варианту изобретения.
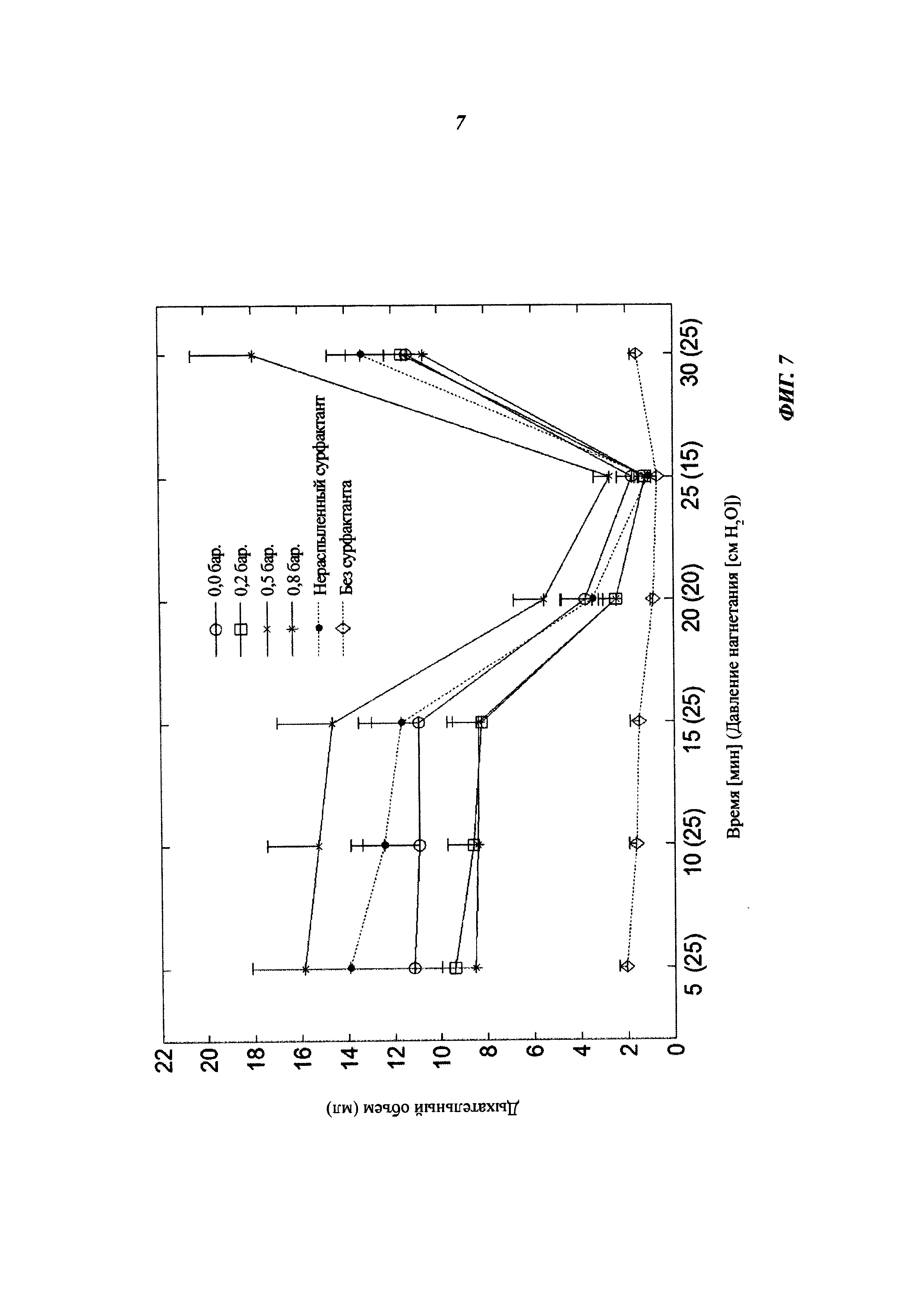
На фиг. 7 приведены графики дыхательного объема для зародышей, по отношению к которым использовались способ и система согласно варианту изобретения.
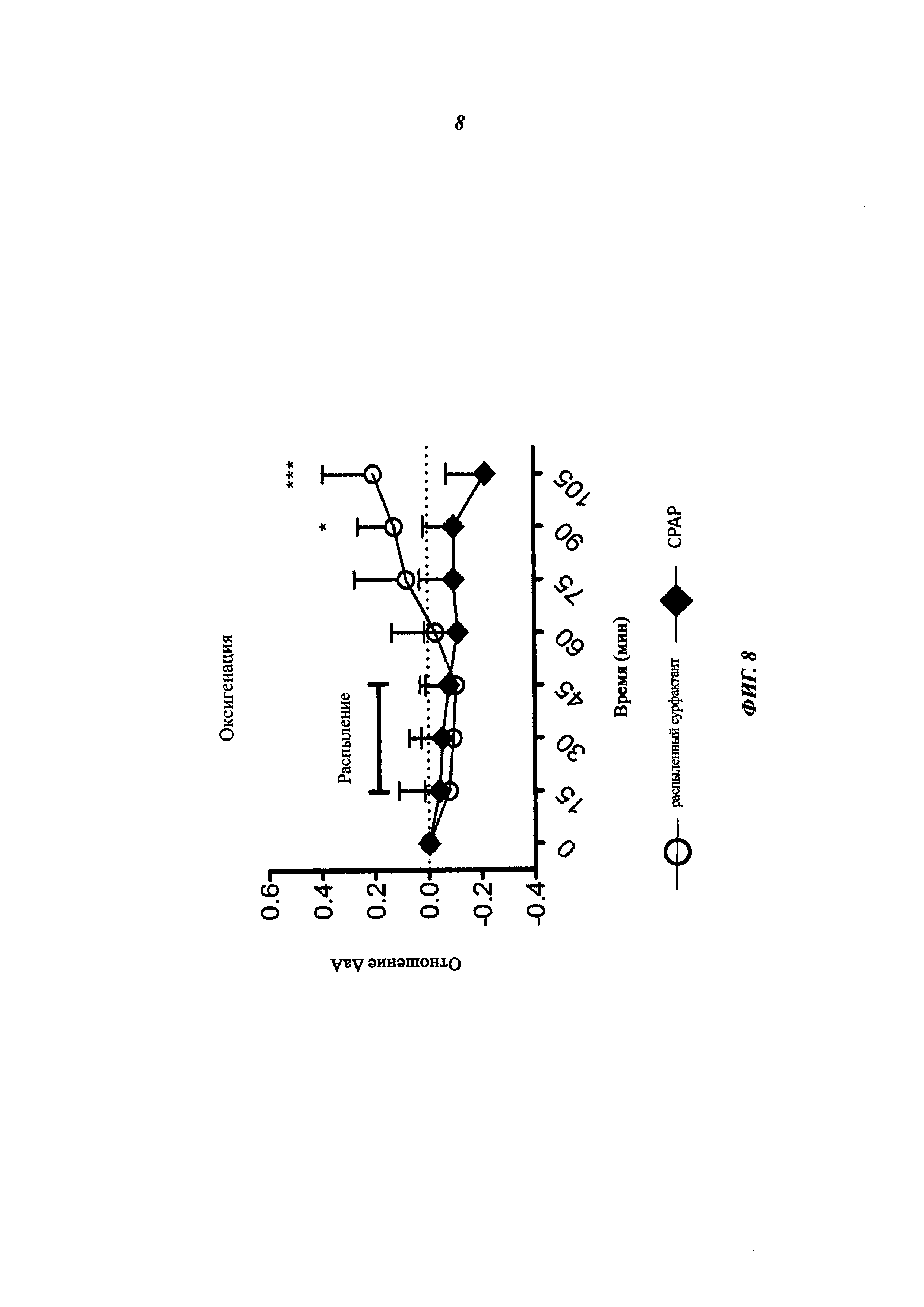
На фиг. 8 иллюстрируется влияние распыленного сурфактанта на отношение альвеолярной-артериальной кислородной концентрации (отношение ΔаА). Светлые кружки: ягнята, получившие распыленный сурфактант; черные ромбы: контрольная группа, получившая только СРАР. Оксигенация измерялась в течение 105 мин от рождения.
Поскольку значения базовой линии отношения ΔаА сильно варьируют, приведенные данные соответствуют отклонениям от базовой линии. Группа, соответствующая распылению, демонстрирует статистически большее изменение в ΔаА для 90 и 105 мин после рождения (р<0,05 и р<0,001 соответственно, согласно двухфакторному дисперсионному анализу AN OVA с апостериорными тестами Сидака) по сравнению с группой, получавшей СРАР.
Определения
Под "легочным сурфактантом" понимается экзогенный легочный сурфактант, который вводится в легкие и может принадлежать к одному из следующих классов.
i) "Модифицированные природные" легочные сурфактанты, которые являются липидными экстрактами измельченного легкого млекопитающего или лаважем легкого. Эти препараты содержат варьирующиеся количества протеинов SP-B и SP-C и, в зависимости от способа экстракции, могут содержать липиды, отличные от легочного сурфактанта, протеины или другие компоненты. Некоторые из присутствующих на рынке модифицированных природных легочных сурфактантов, например Survanta™, содержат небольшие количества синтетических компонентов, таких как трипальмитин, дипальмитоилфосфатидилхолин и пальмитиновая кислота.
ii) "Синтетические" легочные сурфактанты, которые являются просто смесями синтетических химических соединений, в основном, фосфолипидов и других липидов, которые должны воспроизводить композицию и поведение липидов природного легочного сурфактанта. Они не содержат протеинов легочного сурфактанта.
iii) "Воспроизводящие" легочные сурфактанты, являющиеся синтетическими легочными сурфактантами, к которым добавлены протеины/пептиды легочного сурфактанта, выделенные из животных или изготовленные по рекомбинантной технологии (как это описано в WO 95/32992), или аналоги протеина синтетического легочного сурфактанта, такие как описанные в WO 89/06657, WO 92/22315 и в WO 00/47623.
Термин "неинвазивная вентиляция" соответствует варианту вентиляции, обеспечивающему поддержку дыхания без необходимости в интубации.
Осуществление изобретения
На фиг. 1 иллюстрируются способ и система согласно предпочтительному варианту изобретения. Представленный пример направлен на решение проблемы доставки пациенту нужного количества распыленного медикамента: Более конкретно, рассматривается введение, например, недоношенным новорожденным легочного сурфактанта (например порактанта альфа), коммерчески доступного под маркой Curosurf® от фирмы Chiesi Farmaceutici SpA).
Однако для осуществления изобретения может оказаться пригодным любой легочный сурфактант, который применяется в настоящее время или будет разработан позднее для использования в системе для лечения респираторного дистресса и других легочных заболеваний. Эти сурфактанты могут являться модифицированными природными, синтетическими или воспроизводящими легочными сурфактантами (ЛС).
Используемые модифицированные природные ЛС включают (не ограничиваясь ими) легочный сурфактант на основе бычьего липида (BLES™, фирма BLES Biochemicals, Inc., Канада), калфактант (Infasurf™, фирма Forest Pharmaceuticals, США), бовактант (Alveofact™, фирма Thomae, Германия), бычий легочный сурфактант (Pulmonary surfactant ТА™, фирма Tokyo Tanabe, Япония), порактант альфа (Curosurf®, фирма Chiesi Farmaceutici SpA, Италия) и берактант (Survanta™, фирма Abbott Laboratories, Inc., США).
Примеры синтетических сурфактантов включают (не ограничиваясь ими) пумактант (Alec™, фирма Britannia Pharmaceuticals, Великобритания) и колфосцерил пальмитат (Exosurf™, фирма GlaxoSmithKline, pic, Великобритания).
Примеры воспроизводящих сурфактантов включают (не ограничиваясь ими) лусинактант (lucinactant, Surfaxin™, фирма Discovery Laboratories, Inc., США) и продукт, состав которого приведен в Таблице 2 Примера 2 заявки WO 2010/139442 (содержание которой включено в данное описание посредством ссылки).
Легочный сурфактант предпочтительно представляет собой модифицированный природный сурфактант или воспроизводящий сурфактант. Более предпочтительно легочным сурфактантом является порактант альфа (Curosurf®). В другом предпочтительном варианте используется воспроизводящий сурфактант с составом, приведенным в Таблице 2 Примера 2 заявки WO 2010/139442.
Подлежащая введению доза легочного сурфактанта зависит от размеров и возраста пациента, а также от тяжести его состояния. Специалисты в соответствующей области легко смогут оценить эти факторы и подобрать соответствующую дозировку.
В медикамент согласно изобретению целесообразно включить и другие активные ингредиенты, в том числе малые количества химических веществ, макромолекулы, такие как протеины, пептиды, олигопептиды, полипептиды, полиаминокислоты, нуклеиновая кислота, полинуклеотиды, олигонуклеотиды и полисахариды с большой молекулярной массой, а также мезенхимальные стволовые клетки, извлеченные из любой ткани, в частности из ткани новорожденного. В конкретном варианте химические вещества, содержащиеся в малых количествах, включают вещества, используемые для предотвращения и/или лечения неонатальных респираторных заболеваний, например вдыхаемые кортикостероиды, такие как беклометазона дипропионат и будезонид.
Катетер 101 доставляет распыленный медикамент (например, сурфактант) непосредственно в заглоточную область, чтобы повысить эффективность введения медикамента без применения инвазивных средств: Это особенно важно для очень маленьких пациентов, таких как недоношенные новорожденные, страдающие респираторным дистресс-синдромом новорожденных (РДСН). Согласно предпочтительному варианту изобретения катетер изготовлен из биосовместимого гибкого материала (например, из пластика). Катетер может быть соединен с жестким каркасом (например, металлическим), чтобы увеличить жесткость устройства и облегчить операции по его позиционированию. В предпочтительном варианте изобретения доставка распыленного медикамента осуществляется методом дробления воздухом. Применение воздуха, чтобы облегчить распыление, - это хорошо известный метод, обеспечивающий полностью завершенное распыление, в том числе, когда требуются низкое давление и низкий расход газа (см., например, Arthur Lefebvre, "Atomization and spray", Taylor and Francis, 1989). Данный метод основан на использовании относительно малых количеств газа (например воздуха, хотя применимы и другие сжатые газы, например кислород, азот или гелий), который подается по одному или более каналам (отличным от канала медикамента, который подается в жидкой форме). Поток воздуха ускоряется и разбивает (дробит) струю жидкости, вызывая распыление медикамента. Таким образом, многопросветный катетер 101 содержит несколько каналов (по меньшей мере два, один для медикамента и один для воздуха) с целью одновременного формирования потоков медикамента и воздуха.
Струя жидкого медикамента дробится на капельки вследствие турбулентности, создаваемой в результате того, что поток воздуха течет рядом с потоком медикамента или вокруг него, когда оба потока (воздуха и жидкого медикамента) выходят из каналов катетера и встречаются в заглоточной области. Медианный диаметр распыленных капелек составляет по меньшей мере 20 мкм, предпочтительно не менее 40 мкм, более предпочтительно не менее 60 мкм. Предполагается, что этот эффект обусловлен действием потока воздуха, который усиливает нестабильность слоя текучей среды. Воздух способствует также диспергированию капелек, предотвращая их сталкивание между собой и облегчая диффузию медикамента в легкие благодаря снижению вероятности контакта между частицами и стенками заглоточной полости. В предпочтительном варианте поперечное сечение каналов для воздуха уменьшается вблизи выхода, как это показано на фиг. 3. Согласно закону Пуазейля сопротивление потоку пропорционально длине катетера и обратно пропорционально четвертой степени радиуса просвета. Следовательно, используя катетер с просветом, увеличенным на большей части его длины, можно существенно уменьшить суммарное сопротивление в канале для воздуха, что позволит снизить давление, которое требуется приложить к входу катетера, чтобы распылить препарат.
Согласно варианту изобретения можно придать каналам для воздуха такой профиль, чтобы модифицировать не только скорость, но и направление потока газа. Например, можно придать каналам форму крыльев, что позволит варьировать угол выброса. В предпочтительном варианте изобретения медикамент (например, сурфактант) подается посредством насосного устройства, конкретно насоса 103, подсоединенного к одному концу катетера и обеспечивающего выдачу жидкого медикамента из противоположного конца катетера, где он встречается с потоком воздуха (подаваемого по другому каналу катетера) и распыляется, т.е. дробится сжатым воздухом на множество мелких частиц (капелек). Насос 103 может быть реализован в виде устройства, способного создавать поток, такого как инфузионный насос. В предпочтительном варианте изобретения насос 103 содержит раму, несущую конструкцию, которая фиксирует шприц с жидким медикаментом, и шаговый двигатель, который перемещает поршень шприца. В варианте изобретения насос 103 может управляться блоком 109 управления; который может представлять собой компьютер, микропроцессор или, в общем случае, любое устройство, пригодное для обработки данных. К одному или более каналам, подающим поток воздуха, подсоединено насосное устройство 105 для подачи воздуха (которое может содержать источник сжатого воздуха, регулятор давления и фильтр). Специалистам в данной области будет понятно, что термины "насос" и "насосное устройство" в данном описании охватывают любое устройство, способное создавать давление в потоке жидкости или газа. Устройство 105 может управляться блоком управления, подобным блоку, описанному в связи с насосом 103. Расход, обеспечиваемый насосом 103, должен составлять 9-18 мл/ч, тогда как для насосного устройства 105 он должен быть менее 1 л/мин, в предпочтительном варианте менее 0,75 л/мин, чтобы не создавать помех для любой спонтанной или управляемой дыхательной активности.
В предпочтительном варианте изобретения катетер 101 содержит несколько каналов, причем главный (например, центральный) канал, по которому доставляется сурфактант, окружен дополнительными (например боковыми) каналами, доставляющими поток сжатого воздуха. Описываемый метод дробления воздухом обладает преимуществом, состоящим в более мягком фрагментировании сурфактанта. Современные распылители для доставки медикамента обычно основаны на применении малых отверстий, тогда как способ согласно изобретению основан на применении распыляющего катетера, реализующего принцип дробления воздухом. Геометрическая конфигурация канала с отверстием для жидкости обычно предусматривает сужение отверстия у конца катетера, т.е. сопло, которое ускоряет жидкость, создавая в случае значительного падения давления (более чем на 100 кПа) высокую нестабильность и, как следствие, фрагментацию жидкости на частицы. В отличие от этого, катетер для дробления воздухом согласно предпочтительному варианту изобретения является многопросветным катетером: сурфактант течет по главному просвету, тогда как потоки сжатого воздуха текут в боковых каналах. Турбулентность, создаваемая небольшими потоками воздуха, очень мягко фрагментирует сурфактант. Кроме того, использование мелких отверстий, чтобы обеспечить распыление, потребовало бы очень высокого дифференциального давления на сопле, тогда как распылитель посредством дробления воздухом не требует приложения к сурфактанту высокого подающего давления, поскольку процесс распыления происходит под действием турбулентности воздуха вокруг сурфактанта. Легочный сурфактант предпочтительно вводится, как суспензия в стерильной и фармацевтически приемлемой водной среде, предпочтительно в буферизованном солевом физиологическом растворе (содержащем 0,9% хлорида натрия).
Концентрация раствора должна быть подобрана специалистом.
Желательная концентрация сурфактанта может составлять 2-160 мг/мл, предпочтительно 10-100 мг/мл, более предпочтительно 40-80 мг/мл.
Подаваемый объем обычно не превышает 5,0 мл, предпочтительно не превышает 3,0 мл. В некоторых вариантах он может составлять 1,5 мл или 3 мл.
Введение легочного сурфактанта синхронизовано с фазой дыхания пациента. Чтобы реализовать это свойство, должно иметься средство, чувствительное к любой переменной, связанной с дыхательной активностью, и служащее для непрямого, но точного измерения фаз дыхания. Возможные варианты такого чувствительного средства включают применение микродатчика давления на кончике катетера, респираторной индуктивной плетизмографии и оптоволоконного датчика давления. Согласно предпочтительному варианту изобретения средство, воспринимающее давление, содержит специализированный канал 111 (третий канал, например катетер, отличный от по меньшей мере одного первого канала, доставляющего медикамент-сурфактант, и от по меньшей мере одного второго канала, доставляющего воздух для осуществления дробления воздухом). Данный канал доставляет водный раствор, например физиологический солевой раствор на водной основе (содержащий 0,9% хлорида натрия). Этот раствор может быть буферизован до физиологического уровня рН в соответствии с условиями, хорошо известными специалистам. Как это показано на фиг. 1, датчик 107 давления отслеживает ритм дыхания, воспринимая давление в столбе солевого раствора в заглоточной области. Система согласно предпочтительному варианту изобретения содержит также не изображенное на фиг. 1 третье насосное устройство (которое может содержать источник давления, регулятор давления и фильтр), присоединенное к третьему каналу, доставляющему водный раствор. Специалистам в данной области будет понятно, что под "насосным" здесь понимается любое устройство, способное обеспечить постоянный поток жидкости. Это, третье насосное устройство может управляться блоком управления типа описанного применительно к устройствам 103 и 105. Чтобы избежать подачи слишком большого количества жидкости в глотку в процессе доставки сурфактанта, расход, обеспечиваемый третьим насосом, предпочтительно составляет 0,1-10 мл/ч.
Два возможных варианта для узла 200 катетера представлены на фиг. 2. Более конкретно, на фиг. 2а представлен на двух видах (в сечении и на виде сбоку) узел катетера согласно варианту изобретения, в котором третий канал 205 полностью отделен от многопросветного катетера, имеющего просвет (канал) 201 для медикамента и группу просветов (каналов) 203 для воздуха. На фиг. 2b показан, на аналогичных видах, вариант, в котором третий канал прикреплен к многопросветному катетеру. В предпочтительном варианте диаметр поперечного сечения центрального просвета для медикамента составляет 0,25-0,5 мм, а каналов для воздуха - 0,05-0,15 мм, тогда как отношение площади поперечного сечения канала для сурфактанта к общей площади каналов для воздуха на конце катетера должно составлять от 0,2 до 2. Датчик давления связан с третьим каналом, т.е. введен в катетер для водного раствора. Такой вариант измерений возможен в связи с относительно низким давлением в канале, подающем водный раствор. Данный вариант позволяет использовать непрерывный столб водного раствора для измерения давления в заглоточной области с целью синхронизировать распыление с паттерном дыхания пациента и облегчать медицинскому персоналу установку катетера в нужное место, а также осуществлять мониторинг сохранения катетером этого положения в процессе лечебного воздействия, позволяя идентифицировать неверное позиционирование кончика катетера (например, в пищеводе). Как было упомянуто, третье насосное устройство обеспечивает постоянный расход жидкости, чтобы избежать закупорки отверстия третьего канала.
Как было упомянуто, на фиг. 2 проиллюстрированы конкретные выполнения многоканального катетера согласно предпочтительному варианту изобретения. Распылитель на основе дробления воздухом по данному варианту реализован посредством многопросветного катетера с центральным внутренним просветом 201, окруженным несколькими меньшими просветами 203. Сурфактант течет в главном центральном просвете под воздействием инфузионного насоса, тогда как газ (например, воздух, обогащенный кислородом, или чистый кислород) течет по боковым просветам. Падение давления в центральном канале катетера зависит от его длины и внутреннего диаметра. В предпочтительном варианте изобретения катетер может иметь длину 7-15 см и внутренний диаметр 0,6-0,8 мм. Согласно предпочтительному варианту просвет для сурфактанта имеет диаметр 0,75 мм, тогда как боковой просвет для газа может представлять собой единственный просвет по всей длине катетера, за исключением дистального отрезка (у конца катетера) длиной 5 мм, на котором его профиль может быть преобразован в несколько просветов, коаксиальных с просветом для сурфактанта. Такое решение позволяет уменьшить полное сопротивление просвета для газа и, тем самым, уменьшить давление газа, требуемое для распыления. Кроме того, повышается скорость газа, что облегчает процесс распыления. В этом случае при расходе сурфактанта 3 мл/20 мин падение давления составляет 3,5-8 см водяного столба (см H2O, примерно 35-80 Па). В данном варианте не требуется сопла, а размер частиц определяется, в основном, потоком воздуха, текущим в боковом канале. Чтобы создать поток газа в боковых каналах, может быть использован компрессор или источник сжатого газа (например, баллон или встроенный в стенку кран для подачи газа для медицинских целей): Давление модулируется регулятором давления с механическим фильтром, чтобы избежать попадания в систему пыли.
Используемый поток сжатого газа неспособен значительно изменить давление в глотке, т.к. поток является ограниченным, а анатомические структуры являются открытыми в атмосферу: в предпочтительном варианте расход газа не превышает 1 л/мин.
На фиг. 3а показан возможный вариант катетера, в котором третий канал 301 (подающий водный раствор) является одним из каналов, расположенных вокруг первого (центрального) канала 201. Каналы 203, расположенные вместе с каналом 301 вокруг центрального канала, подают сжатый воздух, тогда как по каналу 301 подается водный раствор.
На фиг. 3b показана опционная особенность узла катетера по изобретению, состоящая в том, что каналы 203 для воздуха имеют поперечное сечение, уменьшающееся в направлении выхода. Вид на фиг. 3b соответствует продольному сечению. В предпочтительном варианте такое уменьшение поперечного сечения каналов для воздуха обеспечено соответствующим расширением центрального (несущего медикамент) просвета 201. Вариант по фиг. 3b соответствует только одному из возможных решений рассматриваемой задачи. Возможная альтернатива ограничения просветов для воздуха может состоять в увеличении толщины наружной стенки многопросветного катетера у его конца. Еще один возможный вариант может предусматривать уменьшение полного поперечного сечения многопросветного катетера при сохранении неизменным размера центрального канала (просвета).
Распределение частиц по размерам, получаемое посредством предпочтительного варианта изобретения, было охарактеризовано коммерческим лазерным дифракционным анализатором размеров частиц (модель Insitec RT фирмы Malvern). Измерения проводились при давлении сжатого воздуха 75 кПа; расход сурфактанта (составлявший от 9 мл/ч до 1,2 мл/мин) в этих условиях не влияет на размер частиц. Как следствие, размеры большинства частиц находятся в пределах 20-100 мкм.
В качестве возможной дополнительной особенности катетер, используемый в способе и системе по изобретению, может быть снабжен несколькими находящимися на его наружной поверхности упорами, которые облегчают позиционирование и обеспечивают поддержание минимального расстояния между катетером и стенками заглоточной полости. Это расстояние гарантирует, что распыленный сурфактант транспортируется вдыхаемым потоком воздуха в легкие, а не попадает на стенки глотки. В качестве примера, упоры могут иметь вид ребер, расположенных вдоль наружной поверхности катетера. Эти ребра могут также выполнять функцию повышения жесткости катетера (альтернативно упомянутой выше металлической раме). Возможны и другие профили упоров; например, они могут быть выполнены, как одно или более колец, окружающих катетер и расположенных на заданном расстоянии одно от другого: Специалистам в данной области будет понятно, что может быть использовано несколько эквивалентных альтернативных решений.
Другим средством, приемлемым для позиционирования катетера в заглоточной полости, может служить ларингоскоп, прибор, хорошо известный специалистам.
Кроме того, введение катетера можно облегчить, используя щипцы Магилла, ротоглоточные канюли и воздуховоды, такие как канюля Майо (Mayo) или воздуховод Гиделя (Guedel) или Сафара (Safar), или Бермана (Berman), а также ларингеальную маску. В одном варианте канюля Майо используется, чтобы облегчить и введение, и удерживание кончика катетера в правильном положении, т.е. невплотную к стенке глотки и с ориентацией к входу в трахею в течение всего периода доставки сурфактанта. В другом варианте может использоваться ларингеальная маска.
Третий канал, как уже упоминалось, должен быть отделен от по меньшей мере одного первого канала, подающего медикамент-сурфактант, и от по меньшей мере одного второго канала для потока воздуха, поскольку измерение давления слишком близко к области, в которой происходит дробление воздухом, может привести к неточным измерениям. При этом возможны несколько различных решений, включая выполнение третьего канала полностью отделенным или присоединение каким-то образом третьего канала к другим каналам. Можно также сконструировать узел катетера так, чтобы он включал в себя третий канал, пространственно разделив выход третьего канала и выходы каналов для медикамента и воздуха. Другая возможная реализация включает встраивание канала, несущего водный раствор (третьего канала), в позиционирующий инструмент, например в канюлю Майо.
На фиг. 4а иллюстрируется возможная реализация упомянутого выше датчика 107 давления, который используется согласно варианту изобретения для детектирования давления воздуха, выходящего из полости глотки или входящего в нее. Такое измерение давления служит индикатором ритма дыхания пациента, в соответствии с которым система синхронизирует введение медикамента. Эта синхронизация создает большие преимущества в терминах эффективности лечения и в уменьшении потерь медикамента. Повышение эффективности достигается транспортированием распыленного медикамента вдыхаемым воздухом; тогда как сокращение потерь обусловлено тем, что медикамент подается только тогда, когда это требуется, что позволяет избежать его неоправданного расхода, когда пациент выдыхает. В варианте изобретения датчик давления вводится через линию подачи водного раствора (третий канал) и передает давление от кончика катетера (т.е. давление в глотке новорожденного) на чувствительный элемент, который функционирует как переменное сопротивление. При включении двигателя поршень шприца мягко продвигает сурфактант в распыляющий катетер, чтобы обеспечить средний расход 0,5-3 мл/ч, предпочтительно 2,4 мл/ч (этот параметр может быть настроен в зависимости от программы лечения). Расход водного раствора в третьем канале может быть сделан как можно более низким, чтобы предотвратить адгезию слизи, например равным 1 мл/ч. Показанный на фиг. 4b датчик использует пьезорезистивный эффект, чтобы преобразовать механическое давление в падение напряжения. Он подключен к мосту Уитстона, таким образом, он имеет внутреннюю компенсацию в отношении флуктуаций окружающей температуры.
Датчик может быть, например, одноразовым, аналогичным используемым для инвазивных измерений кровяного давления.
Введение сурфактанта только во время фазы вдоха является одним из преимуществ, достигаемых изобретением: оно обеспечивает улучшенное управление эффективным количеством сурфактанта, достигающего альвеол, и позволяет избежать излишнего расхода подаваемого сурфактанта. Для этого требуется измерять сигнал, связанный с дыхательным паттерном, в условиях вентилирования легких недоношенного новорожденного (который имеет спонтанное дыхание и для которого обеспечивается nCPAP или другая процедура неинвазивной вентиляции, например неинвазивная вентиляция с перемежающимся положительным давлением (NIPPV)), чтобы детектировать конец вдоха и конец выдоха и предсказывать "будущий" дыхательный паттерн младенца. Согласно варианту изобретения введение сурфактанта начинают до начала вдоха и прекращают до начала выдоха с целью:
1) учета механических задержек в процессе распыления и
2) предотвращения потери сурфактанта в связи с тем, что сурфактант, доставленный в конце вдоха, к началу выдоха все еще находится в полости глотки, так что он будет выдохнут.
На фиг. 5 представлены записи давления в заглоточной области репрезентативного недоношенного младенца с внутриутробным возрастом 28 недель и массой тела 1650 г. На фиг. 5а представлена полная запись, характеризующаяся очень высокой вариабельностью с рядом пичков и флуктуациями базовой линии. На фиг. 5b показана, в увеличенном масштабе, часть той же записи. Был проведен статистический анализ данных и разработан предиктивный алгоритм, основные этапы которого представлены в виде блок-схемы на фиг. 6 с указанием соответствующих функций. Более конкретно, после устранения трендов и высокочастотного шума, производится интегрирование сигнала, чтобы получить новый сигнал, пропорциональный легочному объему, причем поиск максимумов и минимумов позволяет детектировать точки конца вдоха и выдоха. Статистический анализ включает также измерение соответствующего давления, которое во всех различных условиях составляет около 1 см H2O (9,8 Па).
Использование данного подхода позволило авторам в модельном эксперименте ввести 97±0,8% сурфактанта в течение 60±21 мин 7 недоношенным новорожденным с внутриутробным возрастом 29,5±3 недели и массой тела 1614±424 г.
Все описываемые операции системы проводились под микропроцессорным управлением (например, посредством микроконтроллеров из семейства PIC18F фирмы Microchip Technology Inc. или более сложных версий) с использованием программы, адаптированной для осуществления способа согласно предпочтительному варианту.
Должно быть понятно, что без выхода за пределы изобретения в него можно вносить различные видоизменения и модификации. Разумеется, многочисленные модификации могут вноситься в описанные решения специалистом в данной области, чтобы удовлетворить конкретные локальные требования. В частности, хотя изобретение было подробно описано применительно к его предпочтительным вариантам, должно быть понятно, что в отношении форм и выполнения его частей допустимы различные исключения, замены и изменения. Возможны также и другие варианты. Кроме того, следует специально подчеркнуть, что конкретные элементы и/или операции способа, описанные в связи с любым описанным вариантом изобретения, могут быть использованы в любом другом подходящем варианте в соответствии с этим вариантом.
Например, схожие с описанными соображения применимы, если компоненты (например, микропроцессоры или компьютеры) имеют различные структуры или содержат эквивалентные блоки. В любом случае компьютеры могут быть заменены любым устройством для выполнения кода (таким как карманный компьютер, мобильный телефон и др.).
Схожие соображения применимы, если программа (которая используется при осуществлении некоторых вариантов изобретения) может быть структурирована различным образом или если предусмотрены дополнительные модули или функции. Аналогично, возможно использование различных типов запоминающих устройств, или они могут быть заменены эквивалентными объектами (необязательно содержащими физическую запоминающую среду). Кроме того, предлагаемое решение может быть осуществлено эквивалентным способом (включающим схожие или дополнительные операции или операции, выполняемые в другой последовательности). В любом случае программа может иметь любую форму, пригодную для ее выполнения любой системой обработки данных, включая внешнюю или резидентную программу, встроенную программу или микрокод (включая объектный код или исходный код). При этом программа может быть записана в любой машиночитаемой среде. Эта среда может быть реализована в форме любого компонента, способного содержать, хранить, передавать, распространять или переносить программу. Примерами таких сред являются жесткие диски (на которые может быть загружена программа), внешние диски, ленты, карты, провода, оптические волокна, беспроводные соединения, сети, радиоволны и т.п. Примерами подходящих сред могут служить электронные, магнитные, оптические, электромагнитные, инфракрасные или полупроводниковые среды.
В любом случае решение, предлагаемое изобретением, может быть реализовано посредством аппаратных средств (например, интегрированных в полупроводниковый кристалл), или комбинации программных и аппаратных средств. Система по изобретению особенно эффективна для предотвращения и/или лечения респираторного дистресс-синдрома новорожденных (РДСН) Однако она может быть успешно использована и для предотвращения и/или лечения острого респираторного дистресс-синдрома взрослых (ОРДСВ), связанного с дефицитом сурфактанта или дисфункцией, а также с условиями, в которых респираторный дистресс может присутствовать как следствие, например, синдрома аспирации мекония, легочной инфекции (например, пневмонии), прямого повреждения легких и бронхолегочной дисплазии.
Система по изобретению эффективна в отношении недоношенных новорожденных со спонтанным дыханием, предпочтительно новорожденных с внутриутробным возрастом 24-35 недель, имеющих экстремально низкую массу тела при рождении, очень малую массу тела при рождении и малую массу тела при рождении, обнаруживающих ранние симптомы респираторного дистресс-синдрома, проявляющиеся в виде клинических признаков и/или дополнительной потребности в кислороде (как доли вдыхаемого кислорода, превышающей 30%).
При этом к подобным новорожденным целесообразно применение nCPAP в соответствии с процедурами, известными специалистам в данной области.
Предпочтительно используются назальная маска или назальные канюли; при этом можно использовать любые коммерчески доступные назальные маски, например предлагаемые фирмами The СРАР Store LLC и СРАР Company.
Режим nCPAP в типичном варианте осуществляется при давлениях в интервале 1-12 см водяного столба (примерно 10-120 Па), предпочтительно 20-80 Па, хотя давление может варьировать в зависимости от возраста новорожденного и состояния легких.
Альтернативно, к новорожденным можно применять и другие неинвазивные процедуры вентиляции, например неинвазивной вентиляции с перемежающимся положительным давлением (NIPPV), использование назальных канюль с высоким потоком (high flow nasal cannula, HFNC) или двухуровневого положительного давления в дыхательных путях (bilevel positive airway pressure, BiPAP).
Возможные альтернативные варианты включают следующие объекты.
1. Компьютеризованный способ доставки распыленного медикамента пациенту со спонтанным дыханием, включающий:
- селективное активирование первого насосного средства для формирования, посредством по меньшей мере первого канала многоканального катетера, в заглоточной полости столба жидкого медикамента, имеющего низкое давление и подводимого по меньшей мере по одному первому каналу указанного катетера;
- селективное активирование второго насосного средства для формирования потока газа под давлением, подаваемого по меньшей мере по одному второму каналу указанного катетера;
- подачу под давлением непрерывного потока водного раствора по меньшей мере по одному третьему каналу;
- детектирование, посредством датчика давления, связанного по меньшей мере с одним третьим каналом, дыхательной активности пациента;
при этом столб жидкого медикамента дробится на множество частиц, когда столб жидкости и поток газа под давлением встречаются в заглоточной области, в результате чего в легкие пациента поступает распыленный медикамент; а операцию подачи жидкого медикамента по меньшей мере по первому каналу многоканального катетера осуществляют только в фазе вдоха.
2. Компьютерную программу для осуществления, при ее выполнении компьютером, операций вышеописанного способа.
3. Способ предотвращения и/или лечения респираторного дистресс-синдрома у пациента со спонтанным дыханием, включающий операции:
доставки медикамента, представляющего собой распыленный легочный сурфактант, в заглоточную область пациента посредством многоканального гибкого катетера с формированием столба жидкого медикамента, имеющего низкое давление и подводимого по меньшей мере по одному первому каналу указанного катетера, и
формирования потока газа под давлением, подаваемого по меньшей мере по одному второму каналу указанного катетера,
при этом столб жидкого медикамента дробится на множество частиц, когда столб жидкости и поток газа под давлением встречаются в заглоточной области, а способ дополнительно включает операцию детектирования, посредством датчика давления, связанного по меньшей мере с одним третьим каналом, адаптированным для подачи потока водного раствора в заглоточную область, дыхательной активности пациента, причем указанную операцию доставки осуществляют только в фазе вдоха.
Кроме того, при осуществлении данного способа пациенту обеспечивают nCPAP с использованием назального устройства, такого как маска или канюли.
Далее изобретение иллюстрируется следующими неограничивающими примерами.
Примеры
ПРИМЕР 1 - ЭФФЕКТИВНОСТЬ IN VIVO
Эффективность in vivo распыленного сурфактанта (в этом примере вышеупомянутого порактанта альфа) оценивалась на недоношенных новорожденных кроликах на 27-й день вынашивания (нормальный срок = 31±1 дней). Выбранная модель очень близка к условиям лечения недоношенных младенцев с РДСН в том отношении, что легкие этих животных еще не в состоянии вырабатывать собственный сурфактант, но способны осуществлять газообмен, так что они могут расширяться в ответ на введение экзогенного сурфактанта.
Воздействие осуществлялось интратрахеально с введением дозы 2 мл/кг, что соответствует 160 т/кг. Зародыши, парализованные введением панкурония бромида (0,02 мг i.p.), затем помещали в плетизмограф при 37°С и проводили их вентилирование чистым кислородом при постоянном давлении (при частоте 40 мин-1 и отношении вдох/выдох 60/40). Постоянное положительное давление в конце выдоха (positive end expiratory pressure, PEEP) не применялось. Сначала, в течение 1 мин, подавалось "начальное" давление, равное 35 см водного столба (около 350 Па), чтобы преодолеть исходное сопротивление, обусловленное капиллярностью в мелких проводящих дыхательных путях. Далее 15 мин подавалось давление около 250 Па, 5 мин около 300 Па, 5 мин около 150 Па и снова, последние 5 мин, около 250 Па.
Респираторный поток измерялся каждые 5 мин посредством трубки Флейша, подсоединенной к каждой камере плетизмографа. Дыхательный объем (VT) определялся автоматически, путем интегрирования кривой расхода.
Были проведены две группы экспериментов.
В первой группе вводились 5 образцов (по 1 мл каждый). В каждом образце вводился один из следующих легочных сурфактантов: нераспыленный порактант альфа, порактант альфа, распыленный при давлении воздуха 0, 20, 50 и 80 кПа. Легочный сурфактант распылялся согласно предпочтительному варианту изобретения.
В эту группу экспериментов была включена контрольная группа, к которой не применялось никакого воздействия.
Все распыленные образцы, включая вводимые без приложения какого-либо давления, были столь же эффективны, что и нераспыленный порактант альфа (Р<0,05 согласно однофакторному дисперсионному анализу (one-way ANOVA) с последующим тестом Тьюки; использовалась программа Graphpad Prism). Никакой статистически значимой разницы между различными условиями распыления не обнаружено.
Во второй группе вводились 3 образца (по 1 мл каждый). В каждом образце вводился один из следующих легочных сурфактантов: нераспыленный порактант альфа и порактант альфа, распыленный при давлении воздуха 0,2, 0,5 и 0,8 бар (20, 50 и 80 кПа).
В эту группу экспериментов были включены также две дополнительные группы: контрольная группа, к которой не применялось никакого воздействия, и группа, для которой использовался порактант альфа, уже выпущенный на рынок.
Во второй группе экспериментов наблюдались те же результаты.
Поскольку результаты для обеих групп были совместимы, данные по ним были объединены (фиг. 7). Статистический анализ этих данных подтвердил предыдущие результаты.
В заключение следует отметить, что прохождение через распылитель в соответствии с предпочтительным вариантом изобретения не влияет на эффективность порактанта альфа в недоношенных новорожденных кроликах. Более конкретно, распыление при давлениях между 20 и 80 кПа не оказывает существенного влияния на эффективность порактанта альфа, причем наиболее подходящим представляется давление 50 кПа, хотя между различными условиями распыления не было выявлено статистически значимых различий.
ПРИМЕР 2 - ИССЛЕДОВАНИЕ ОСАЖДЕНИЯ
1. ГРУППЫ
Использовались поросята с массой 0,8-2,0 кг.
1.1 Контрольная группа
После воздействия седативными средствами (дексмедетомидином и кетамином) и после местной анестезии глотки спреем лидокаина поросята орально интубировались. Анестезия была дополнена малыми дозами пропофола (вводимого, по мере необходимости, интравенно). Положение трубки проверялось билатеральной аускультацией легких и тщательной оценкой глубины введения эндотрахеальной трубки. Поросят укладывали на бок, определяемый протоколом рандомизации. Curosurf® тщательно смешивался с 300 МБк наноколлоида, помеченного технецием (Тс), и животным инстиллировалось по 200 мг/кг (80 мг/мл) Curosurf® через катетер, введенный через трубку, заканчивающуюся точно за 5 мм за кончиком катетера. После инстилляции Curosurf® легкие вентилировались посредством вентиляции с поддержкой давления (pressure-support, PS) с приложением давления, превышающего PEEP примерно на 40-80 Па и при PEEP около 100 Па в течение 1 мин с последующей PS, превышающей PEEP на 40 Па, через эндотрахеальную трубку в течение по меньшей мере 30 мин. После этого животные переносились в гамма-камеру для оценки осаждения указанного сурфактанта в легких.
1.2 Группа для проведения nCPAP с катетером согласно изобретению
Процедура осуществлялась следующим образом: Поросята вдыхали 10 мг лидокаина, а лидокаиновый гель наносился в ротоглотке непосредственно перед введением канюли Майо для распыления в ротоглотке. Затем поросят укладывали на бок согласно протоколу рандомизации, после чего посредством фибробронхоскопии оценивалось правильное позиционирование канюли точно над входом в гортань. Curosurf® тщательно смешивали с 300 мг Тс-наноколлоида, и животные получали 200 мг/кг (80 мг/мл) Curosurf® через распылительный катетер, находящийся внутри ротоглоточного дыхательного канала. Процедура распыления сурфактанта была разбита на 4 стадии (дозы): Каждая стадия состояла в доставке четверти суммарной дозы сурфактанта при спонтанном дыхании поросенка при осуществлении nCPAP (через специальную "маску-намордник" - см. подраздел "Методы"). Затем в течение 5 мин проводилась PS-вентиляция с PEEP (через маску), чтобы избежать ателектаза и способствовать доставке сурфактанта к нижним дыхательным путям. После доставки всего сурфактанта канюлю удаляли, и поросенок получал PS-вентиляцию в течение 15 мин. FiO2 (фракционная концентрация кислорода во вдыхаемой газовой смеси) регулировалась для поддерживания уровня насыщения выше 85%. Чтобы поддерживать дыхательные пути при транспортировании в гамма-камеру и на сцинтиграфию, производилась эндотрахеальная интубация животных и вентиляция с помощью ручного устройства Laerdal Silicone для искусственной вентиляции.
2. МЕТОДЫ
Премедикация поросят производилась с в/м введением кетамина, мидазолама и атропина; кроме того, в ушную вену вводилась канюля, и животным постоянно вводилось в/в седативное средство путем инфузии дексмедетомидина и кетамина. Это введение дополнялось, по мере необходимости, небольшими болюсами пропофола, вводимого в/в. В бедренную артерию под местной анестезией вводили артериальный катетер. Применительно ко всем животным проводили инвазивный мониторинг кровяного давления, а также мониторинг пульс-оксиметрии, церебральной оксиметрии и электрической активности диафрагмы (с использованием NAVA-катетера).
Газы крови отбирались после подготовки, перед началом введения сурфактанта, через 15 мин после начала введения и через 2 мин после завершения введения.
Распределение по группам было случайным и проводилось таким образом, что поросята одного опороса, по мере возможности, равномерно распределялись между группами. При введении сурфактанта поросят укладывали на правый или левый бок согласно протоколу рандомизации.
Исследовались следующие группы поросят, получавших 2,5 мл/кг (80 мг/мл) Curosurf®:
1 - Группы, для которых обеспечивались nCPAP и распыление посредством катетера согласно изобретению, т.е. nCPAP + доставка Curosurf® через специальную канюлю, вводимую в ротоглотку непосредственно над входом в гортань и надгортанник.
2 - "Контрольный протокол": проводились инстилляция Curosurf® через эндотрахеальную трубку и PS-вентиляция через эндотрахеальную трубку при спонтанном дыхании животных по меньшей мере в течение 30 мин.
2.1 Вентиляция
Для групп с nCPAP была разработана специальная "маска-намордник", закрывающая ноздри поросенка, с "перчаточным пальцем" и коннектором для эндотрахеальной трубки. Эта маска помогала уменьшить утечки из СРАР-системы и, видимо, обеспечивала более комфортные условия для животных, которым в этом случае требовался меньший объем анестезии. Данную маску подсоединяли к Y-образной детали в составе вентиляторных трубок и инициировали СРАР посредством вентилятора SERVO-i фирмы (Maquet, Швеция). В зависимости от дыхательного паттерна поросят и степени обструкции дыхательного пути вентилятор настраивался так, чтобы поддерживать постоянное положительное давление в дыхательных путях (СРАР), составляющее примерно 40-80 Па. При этом FiO2 при вдохе, равная 40%, регулировалась в процессе введения таким образом, чтобы обеспечить степень насыщения кислородом выше 85%. Рот удерживался закрытым, насколько это было возможным. В конце процедуры, перед интубацией и транспортированием в гамма-камеру, поросята получали PS-вентиляцию в течение 15 мин.
В контрольной группе использовался вентилятор SERVO-i для PS-вентиляции с PEEP 100 Па в течение 1 мин после инстилляции и для последующей PS-вентиляции с PEEP 40 Па. FiO2 равнялась 40%.
2.2 Измерение распределения сурфактанта
Объем Curosurf®, подлежащий введению посредством распыления каждому поросенку, составлял 2,5 мл/кг (80 мг/мл). Однако для заправки доставочного катетера и шприца требовалось дополнительно в среднем 2,5 мл сурфактанта на поросенка. Поэтому доза Тс-наноколлоида была увеличена в этом исследовании до 300 МБк (по сравнению с 200 МБк в предыдущем исследовании, проведенном заявителем). Активность Тс-наноколлоида измерялась для каждого поросенка счетчиком излучения. Частицы в количестве 300 МБк наноколлоида (помеченного Тс) тщательно смешивались с Curosurf® непосредственно перед заправкой катетера.
Распределение распыленного или инстиллированного сурфактанта исследовалось методом гамма-сцинтиграфии. Изображения получали до и после в/в инъекции помеченного Тс макроагрегированного сывороточного альбумина человека (МАЧ), вещества, которое захватывается легочными капиллярами, что позволяет обрисовать легочные поля. В дополнение, инъекция МАЧ использовалась для калибровки изображений. Данный метод позволял определить количество Тс-наноколлоида, осажденного в легких, и отсюда вывести также количество осажденного сурфактанта.
Перед транспортированием в гамма-камеру животные интубировались, чтобы защитить дыхательные пути и предотвратить развитие ателектаза и гиповентиляции.
3. РЕЗУЛЬТАТЫ
Главная цель исследования состоит в определении доли Curosurf®, осажденного в легких, которая может быть выведена из уровня радиоактивности, определенной сцинтиграфией по методике, известной специалистам в данной области.
3.1 РЕЗУЛЬТАТЫ ОСАЖДЕНИЯ
Если не указано иное, результаты в этом подразделе представлены, как усредненные (по интервалу). Посредством сегментирования изображений можно было разделить области, в которых имело место осаждение сурфактанта, на четыре части: задняя часть глотки, трахея, легкие и желудок. В Таблице 1 приведены средние значения для каждой части и относительные среднеквадратические отклонения (СКО).
Из Таблицы 1 можно определить, что более 48% сурфактанта было осаждено в легких, причем менее 10% достигло желудка.

Дальнейший анализ можно производить, вводя более детальные подразделения, как это будет пояснено далее. Сурфактант, осажденный в трахее, будет перетекать в легкие; вместе с тем, ожидается, что сурфактант, осажденный в задней части глотки, будет проглочен и осажден в желудке. Таким образом, имеется возможность определить: 1) респираторную область, соответствующую сумме трахеи и легких, и 2) остальную область, которая соответствует сумме сурфактанта в желудке и в глотке.
Данный подход позволяет рассчитать долю сурфактанта, достигающего респираторной области, от общего количества, введенного в тело поросенка.
Полученные результаты приведены в Таблице 2

Среднее суммарное количество сурфактанта, достигшего респираторной части, составляет 69,4% при СКО, равном 8,2%; индивидуальные значения варьируют от 62,4% до 84,4%. Таким образом, около 70% сурфактанта осаждается в респираторной части.
В заключение можно сделать вывод, что результаты исследований показывают: в легочной части осаждается значительное количество сурфактанта, более 61%. Этот результат мог быть достигнут благодаря как способу доставки, заключающемсуя в распылении сурфактанта в глотке, так и (на 95%) высоким показателям устройства, которое обеспечивает введение сурфактанта точно при вдохе.
ПРИМЕР 3 - ИССЛЕДОВАНИЕ IN VIVO НА НЕДОНОШЕННЫХ ЯГНЯТАХ
Цель этого исследования заключалась в сравнении эффективности распыления экзогенного сурфактанта при спонтанном дыхании и СРАР и при проведении только СРАР применительно к модельному недоношенному ягненку с неонатальным респираторным заболеванием.
1. Животные
Исследовались овцы породы бордер-лейстер на 130-134-й день вынашивания. Для премедикации овец использовались кетамин (250 мг) и ксилазин (3 мг); при анестезии применялись закись азота, изофлуран и пропофол. Интубация и катетеризация осуществлялись артериальным и венозным катетерами. Легкая анестезия поддерживалась закисью азота, инфузией пропофола и самой низкой возможной концентрацией (<2%) изофлурана; вентиляция животных осуществлялась посредством SIMV+ с поддержкой давления, выбранная частота равнялась 12-15 мин-1, дыхательный объем составлял 10 мл/кг, а начальное значение FiO2 составляло 0,4-0,5. Отбиралась проба газов в артериальной крови, и производительность вентилятора, дыхательный объем и FiO2 настраивались соответственно. Животных укладывали на спину и подготавливали для кесарева сечения.
2. Приготовление легочного сурфактанта
С использованием ультразвуковой мешалки сурфактант был помечен оксидом самария (SmO3) с концентрацией 0,33 мг SmO3 на 3 мл (одну ампулу) Curosurf®.
3. Оборудование, использованное применительно к зародышам
После выведения головы и шеи зародыша в результате гистеротомии катетеры с внешним диаметром 5 FG вводились, с выполнением разреза, в сосуды шеи. Рана на шее зашивалась и пропитывалась бупивакаином. Датчик (Transonic) артериального кровопотока имплантировался вокруг сонной артерии для измерения церебрального кровопотока (ЦКП). С этого момента анестезия овцы поддерживалась при наименьшей возможной концентрации пропофола с уменьшением, по возможности, содержания изофлурана до 0%. Затем голова зародыша высушивалась, и в обе ее ноздри вводился спрей лигнокаина (марки Xylocaine pump spray, фирма Astra Zeneca, Австралия) с концентрацией 10%, который подводился к голосовым складкам под прямым наблюдением с помощью ларингоскопа. Затем проводили оральную интубацию зародыша введением эндотрахеальной трубки размером 4,0 на 5 см ниже голосовых складок. После этого через ноздрю по направляющей проволоке диаметром 0,64 мм с J-образным концом вводили баллонный глоточный катетер (катетер Foley размером 10FG фирмы Covidien, США) и позиционировали его в пищеводе. После раздувания баллона подачей 3 мл солевого раствора удостоверялись, что катетер установлен в средней части шейного отдела, примерно на 6 см ниже перстневидного хряща. Затем в другую ноздрю с помощью стилета и направляющей проволоки на глубину 7 см вводили эндотрахеальную трубку (ЭТТ) размером 4,0 и к ней подсоединяли специально изготовленный адаптер для СРАР, позволяющий подключить систему к стандартной Т-образной детали стандартного F&P контура.
При сохранении плацентарной поддержки выводили грудь зародыша и отбирали легочную жидкость, требуемое количество которой составляло не менее 10 мл/кг. Затем ЭТТ убирали и плотно обертывали морду эластичным бинтом (марки Coban фирмы 3М, США), чтобы удерживать рот закрытым.
Для ягнят, отнесенных к группе с распылением (см. далее), система доставки распылением вводилась в ротоглотку таким образом, чтобы ее кончик находился на 1,0 см выше надгортанника и за языком. Через введенное устройство можно было позднее ввести распыляющий катетер так, чтобы в процессе распыления он был отделен от стенок ротоглотки, соответствующей части верхних дыхательных путей (надгортанника) и пищевода. Позиционирование проводили под прямым визуальным контролем, с помощью оптоволоконного прибора и метки глубины введения, имеющейся на устройстве, которое затем удаляли.
В заключение вокруг груди и брюшной полости помещали ленты для регистрации результатов респираторной индукционной плетизмографии (РИП). До начала введения производили отсасывание влаги из ротоглотки, чтобы удалить любую накопленную околоплодную жидкость. Некоторым ягнятам вводили также электроды для импедансной томографии (ИТ). Используемые для этого методы были описаны ранее (Tingay et al. Ped Res Nov 2013).
4. Группы
4.1. СРАР без сурфактанта. Ягнята этой группы получали СРАР с PEEP примерно 60-100 Па в течение не менее 90 мин после установления СРАР и при общей продолжительности исследования не более 2,5-2,75 ч.
4.2. Распыление: После установления СРАР в ротоглотку повторно вводили распыляющий катетер согласно изобретению, используя полученные ранее результаты по позиционированию, и фиксировали его бинтом Coban после энергичного отсасывания с целью очистки от секреций. После введения распыляющего катетера производили заправку и проверку системы. Увеличивали FiO2 шагами по 0,1 и доводили PEEP до 100 Па.
Распыление 200 мг/кг Curosurf® начинали после анализа газов в артериальной крови через 15 мин после ввода системы. По завершении периода распыления (обычно составлявшего 45-75 мин) распыляющую систему удаляли и поддерживали ягненка только посредством СРАР. Исследование продолжали в течение 2,5-2,75 ч, но не менее 90 мин после начала распыления.
4.3. Контрольная группа. Для небольшой группы ягнят был выбран способ, описанный в Примере 2. Три из исследованных животных были временно интубированы по истечении по меньшей мере 15 мин стабилизации посредством СРАР и получения 200 мг/кг Curosurf™, введенных посредством замкнутой системы доставки во время проведения PPV посредством Neopuff при пиковом давлении вдоха (PIP) 400 Па и частоте 30-40 мин-1. Сразу же после этого животных экстубировали для обеспечения СРАР. Дальнейшее обращение с ними было такое же, как для группы 4.1.
5. Измерения по завершении введения
Измерения периферийного кислородного насыщения (SpO2), частота сердцебиений, артериального давления и ректальной температуры проводились при рождении и после этого непрерывно выводились на дисплей (HP48S фирмы Hewlett Packard, США). Дыхательный объем (VT) и дыхательный паттерн измеряли посредством РИП (плетизмограф Respitrace 200™, фирма NIMS Inc., США) со снятием отсчетов с частотой 200 Гц, используя метод, описанный в статье Tingay D.G. et al. Crit Care Med. 2013; 41(1); 237-44.
Анализ газов в артериальной крови производили периодически, с интервалом 15-30 мин. ЦКП измеряли датчиком кровотока (модель Transonic, фирма AD Instruments, Австралия), расположенного вокруг сонной артерии, причем качество сигнала поддерживали, по мере необходимости, посредством ультразвукового геля.
6. Анализ посредством вскрытия
Легкие и трахея удалялись полностью из грудной клетки и раздувались с использованием ЭТТ (при отсутствии утечек) и Neopuff под давлением 300 Па в течение 15 с, а затем под давлением 150 Па в течение 15-30 с. В раздутом состоянии легкие упаковывались в алюминиевую фольгу и быстро замораживались (оставаясь раздутыми) в жидком азоте и хранились при -20°С для анализа концентрации в них SmO3.
7. Сбор и анализ данных
Данные по каждому образцу газов в артериальной крови регистрировались вручную. Значения SpO2, частоты сердцебиений, артериального кровяного давления, давления в дыхательных путях, РИП, профили грудной клетки и живота, дыхательный объем и дыхательный поток (только в периоды интубации), температура и график церебрального кровопотока переводились в цифровую форму (в системе PowerLab™) и регистрировались с частотой 1000 Гц с использованием платформы LabChart™ V7 (фирма AD Instruments, Австралия) для последующего анализа. Одновременно велась запись (методом ИТ) паттерна вентиляции груди. Все данные вводились в компьютер центра Neonatal Research (MCRI). Зарегистрированные вручную данные о газах крови непосредственно вводились в программе Excel для интегрирования с данными платформы LabChart.
Через каждые 30 с стабильного состояния дыхания считывались репрезентативные данные о дыхательном паттерне животных и условиях, имевших место в момент считывания, и рассчитывались следующие параметры:
1. Оксигенация: SpO2, FiO2, отношение ΔаА (наименьшее значение, соответствующее тяжелому легочному заболеванию) и AaDO2.
2. PaCO2
3. Приложенное PEEP (и PIP, если возможно)
4. Частота сердцебиений, артериальное кровяное давление (среднее, систолическое и диастолическое), профили церебрального кровопотока (ЦКП). Амплитуда и минимальное значение ЦКП находились с использованием программы LabChart Peak Analysis.
5. Профили РИП (суммарной, груди и живота) для всего 30-секундного периода. По этим данным определяли частоту дыхания. Данные по амплитуде суммарной РИП использовали, чтобы определить относительный дыхательный объем (VT) для каждого случая спонтанного дыхания, выраженный в безразмерных единицах (см. Tingay D.G. et al. Crit Care Med. 2013 Jan; 41(1), 237-44) и соотносимый с VT при t0, чтобы оценить изменения этого объема во времени.
6. Данные по статичной легочной механике по кривым FOT и PV.
7. Данные ИТ за тот же 30-секундный период реконструировались с помощью специально разработанной программы анализа, учитывающей уникальную форму груди ягненка. Последующие изображения анализировались с помощью программ MatLab и AUSPEX, чтобы сгенерировать функциональные ИТ-сканы распределения дыхательной вентиляции в течение 30 с для каждого из 32 (передних и задних) срезов легких из правой и левой половин груди, полученных способом, описанным в статье Frerichs I. et al. Am J Respir Crit Care Med. 2006; 174(7); 772-9.
Из этих данных определяли паттерн локальной вентиляции (сопоставляемой с общей вентиляцией) для различных областей легких при t0, t60 (сразу же после введения сурфактанта в соответствующих группах) и t90 (через 30 мин после введения сурфактанта).
Статистический анализ был полностью проведен в центре MCRI с использованием программы PRISM (фирма GraphPad Software, США). Данные тестировались на нормальность, и анализ проводился с использованием (в зависимости от применимости) параметрических или непараметрических тестов. Результаты сравнений различных групп анализировали с помощью двухфакторного дисперсионного анализа с апостериорными тестами Сидака, используя в качестве переменных время и стратегию введения сурфактанта.
Учитывались также качественные данные, включая оценку комфортности для ягненка, требуемые вмешательства, паттерны дыхания, осложнения и наблюдения персонала.
8. Результаты
Для большинства ягнят распыляющая система согласно изобретению была терпимой и демонстрировала обещающий дыхательный профиль. В частности, как можно оценить по фиг. 8, она улучшает отношение ΔaAO2 по сравнению с использованием только СРАР.
Реферат
Группа изобретений относится к медицинской технике. Система для доставки медикамента, содержащего легочный сурфактант, пациентам, представляющим собой недоношенных новорожденных со спонтанным дыханием, содержит катетер для введения в заглоточную область пациента и имеющий по меньшей мере первый канал, адаптированный для подачи в область глотки пациента потока жидкого медикамента, и по меньшей мере второй канал, адаптированный для подачи в область глотки пациента потока газа под давлением. Первое насосное средство подсоединено к первому концу первого канала и выполнено с возможностью создания давления, продвигающего столб жидкого медикамента ко второму концу по меньшей мере одного первого канала. Второе насосное средств подсоединено к первому концу второго канала и выполнено с возможностью создания потока сжатого газа, обеспечивающего, при встрече в полости глотки со столбом жидкого медикамента, дробление указанного столба на множество мелких частиц с обеспечением доставки распыленного медикамента в легкие пациента. Детектор давления пространственно отделен от первого и второго каналов и служит для измерения значений, характеризующих давление в полости глотки пациента и предназначенных для использования при определении того, находится ли пациент в фазе вдоха или в фазе выхода. Детектор давления содержит третий канал, адаптированный для подачи в область глотки пациента потока водного раствора; третье насосное средство, подсоединенное к первому концу третьего канала и выполненное с возможностью создания потока водного раствора; и датчик давления, подсоединенный к третьему каналу для измерения значения, характеризующего давление в потоке водного раствора. Первое насосное средство адаптировано для селективного активирования только в фазе вдоха. Раскрыт комплект для доставки медикамента посредством распыления в заглоточное пространство пациента. Технический результат состоит в обеспечении автоматической синхронизации доставки медикамента с дыхательным ритмом. 2 н. и 11 з.п. ф-лы, 8 ил., 2 табл.

Комментарии