Покрытие для медицинского устройства, включающее антитромботический конъюгат - RU2472529C2
Код документа: RU2472529C2
Чертежи





Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к материалу, предназначенному для нанесения по меньшей мере на часть поверхности изделия или для введения в изделие. В частности, изобретение относится к гребенчатому биоабсорбируемому полимеру, в структуру которого включена антитромботическая композиция, причем в полимерной матрице биоабсорбируемого полимера может содержаться антирестенозное средство. Кроме того, изобретение относится к устройству, поверхность которого покрыта конъюгатом или конъюгат содержится в самом устройстве.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Стеноз представляет собой сужение или сжатие сосуда, происходящее вследствие отложения жира, холестерина и других веществ с течением времени. В тяжелых случаях стеноз может полностью закупорить сосуд. Для открытия стенозированных сосудов применялись хирургические методики. Одним из примеров хирургической методики является чрескожная транслюминальная коронарная ангиопластика (PTCA) или баллонная коронарная ангиопластика. В этой методике для устранения блокирования сосуда в его суженную часть вводят баллонный катетер и производят его расширение. Примерно одна треть пациентов, которым была проведена PTCA, страдает рестенозом, при котором в течение примерно шести месяцев с момента процедуры происходит повторное блокирование сосуда. Таким образом, рестенозные артерии могут потребовать повторной ангиопластики. Чтобы избежать повторной PTCA, после проведения PTCA или вместо PTCA в сосуды помещали имплантируемые медицинские устройства, например стенты. Тем не менее, рестеноз мог по-прежнему возникать даже при имплантации стента.
Возникновение рестеноза можно сдержать с помощью обычной процедуры, которая состоит во введении стента в пораженную область артерии, вместо или наряду с ангиопластикой. Стент представляет собой трубку, изготовленную из металла или пластмассы, которая может иметь либо сплошные, либо сетчатые стенки. Большинство находящихся в употреблении стентов изготовлено из металла, причем они расширяются либо самостоятельно, либо с помощью баллона. Решение об осуществлении процедуры введения стента зависит от некоторых особенностей стеноза артерии. Эти особенности включают размер артерии и место расположения сужения. Функция стента заключается в поддержании артерии, которая незадолго до того была расширена с применением ангиопластики или если ангиопластика не применялась, стент используют для предотвращения упругого возврата артерии в исходное состояние. Стенты, как правило, имплантируют через катетер. В случае стента с расширением под действием баллона, стент сжимают до небольшого диаметра и вводят через баллонный катетер. Затем катетер продвигают через сосудистую систему пациента к месту поражения или участку, где артерия была недавно расширена. Как только необходимый участок достигнут, стент раздвигают и укрепляют на месте. Стент остается в артерии постоянно, удерживает ее в открытом состоянии, улучшает кровоток через артерию и ослабляет симптомы заболевания (обычно боль в грудной клетке).
Стент не является полностью эффективным в предотвращении рестеноза на участке имплантации. Рестеноз может возникнуть по длине стента и/или за его пределами. В последнее время врачами применяются новые типы стентов, которые покрыты тонкой полимерной пленкой, с введенным в нее лекарственным средством, которое ингибирует пролиферацию гладкомышечных клеток. Покрытие наносят на стент до введения в артерию, с применением способов, хорошо известных в технике, например методики выпаривания растворителя. Методика выпаривания растворителя включает смешивание полимера и лекарственного средства в растворителе. Затем раствор, включающий полимер, лекарственное средство и растворитель, может быть нанесен на поверхность стента либо погружением, либо распылением. Затем стент подвергают высушиванию, во время которого растворитель удаляют выпариванием, и полимерный материал, с диспергированным в нем лекарством, образует на стенте тонкослойную пленку.
Механизм высвобождения лекарственного средства из полимерного материала зависит от природы полимерного материала и лекарственного средства, которое предполагается в него включить. Лекарство диффундирует через полимер к поверхности раздела полимер-жидкость и затем в жидкость. Высвобождение может иметь место за счет разрушения полимерного материала. Разрушение полимерного материала может происходить путем гидролиза или под действием ферментов, что приводит к высвобождению находящегося внутри лекарственного средства в окружающие ткани.
Важным фактором при применении стентов с покрытием является скорость высвобождения лекарственного средства из покрытия. Желательно, чтобы терапевтически эффективное количество лекарственного средства высвобождалось из стента в течение достаточно долгого промежутка времени, позволяющего охватить продолжительность биологического процесса, следующего за процедурой ангиопластики или имплантации стента. Импульсное высвобождение, т.е. высвобождение с высокой скоростью сразу после имплантации является нежелательной и постоянной проблемой. Хотя это, как правило, не наносит вреда пациенту, при импульсном высвобождении попусту растрачивается ограниченный запас лекарственного средства за счет выделения такого его количества, которое в несколько раз превышает требуемое эффективное количество и сокращения продолжительности периода высвобождения. В попытках уменьшить импульсное высвобождение было разработано несколько методик. Например, в патенте США № 6258121 B1, выданном Yang и соавторам, раскрыт способ изменения скорости высвобождения за счет смешивания двух полимеров, обеспечивающих различающиеся скорости высвобождения, и включения их в один слой.
Потенциальный недостаток, связанный с имплантацией стента, выделяющего лекарственное средство (DES), заключается в том, что в различные сроки после имплантации или установки стента может развиваться тромбоз. Тромбоз представляет собой образование сгустков крови в кровеносном сосуде на имплантированном устройстве или возле него. Сгусток обычно образуется за счет агрегации факторов крови, в первую очередь, тромбоцитов и фибрина, с захватом клеточных элементов. Тромбоз, как и стеноз, часто вызывает закупорку сосудов в месте своего образования. Как рестеноз, так и тромбоз являются двумя серьезными и потенциально смертельно опасными состояниями, которые требуют медицинского вмешательства. Образование тромба на поверхности стента часто ведет к смерти, приводя к высокому проценту смертности у пациентов, страдающих тромбозом сосудов, составляющему от 20 до 40%.
Будучи эффективными для уменьшения рестеноза, некоторые из компонентов, применяемых в покрытиях для профилактики рестеноза, могут увеличивать риск появления тромбоза. Стенты, выделяющие лекарственное средство, как правило, не связаны с усилением острого и подострого тромбоза (SAT), или среднесрочного тромбоза (30 дней после имплантации стента), следующих за установкой стента. Однако исследование долговременных клинических последствий дало основание предположить, что эти устройства могут быть вовлечены в увеличение частоты появления очень долгосрочного тромбоза (LST). Хотя было найдено, что увеличение числа случаев LST составляет менее 1%, с LST обычно связан высокий уровень смертности. Один из путей предотвращения указанной опасности состоит во включении в состав покрытия на устройстве антикоагулянта, например гепарина.
Один из способов принятия мер против возникновения тромба на стенте заключается в применении антикоагулянта, такого как гепарин. Гепарин представляет собой вещество, которое хорошо известно своей способностью предотвращать коагуляцию. В технике известно нанесение тонкого полимерного покрытия, содержащего гепарин, на поверхность стента с применением методики выпаривания растворителя. Например, в патенте США № 5837313, выданном Ding и соавторам, описан способ получения композиции гепаринового покрытия. Однако недостаток применения гепарина заключается в том, что он не может нормально сосуществовать со средствами, которые предотвращают рестеноз. Например, если смешать гепарин с антитромботическим средством в полимерном покрытии, гепарин, благодаря своей гидрофильной природе, будет мешать получению желаемого профиля элюирования антирестенозного средства. Например, терапевтическое средство включают в матрицу полимерного покрытия с помощью обработки растворителем. Если антикоагулянт также включен в полимерную матрицу, он будет неуправляемым образом притягивать воду. Это может случиться во время производства покрытия или когда покрытое устройство имплантировано, и окажет неблагоприятное воздействие на стабильность или эффективность средства и/или помешает получению желаемого профиля элюирования.
Тем не менее, было предложено несколько подходов для объединения антитромботических и терапевтических средств в покрытиях имплантируемых медицинских устройств. В патенте США № 5525348 Whitbourne раскрывает способ, включающий образование комплекса фармацевтического средства (содержащего гепарин) с четвертичными аммониевыми компонентами или другими ионными ПАВ и связывание с нерастворимыми в воде полимерами в качестве способа получения композиции антитромботического покрытия. Недостатком этого способа является возможность введения природного полимера, например целлюлозы или ее производных, которые являются гетерогенными по своей природе и могут вызывать нежелательные воспалительные реакции в месте имплантации. Упомянутые ионные комплексы между антитромботическим средством, например гепарином и противоположно заряженным полимерным носителем, также могут отрицательно влиять на интеграцию покрытия и, если присутствуют дополнительные фармацевтические средства, могут оказывать влияние на устойчивость при хранении и кинетику высвобождения этих фармацевтических средств.
Несколько отличающийся подход раскрыт в патентах США № 6702850, 6245753 и 7129224 Byun, в которых антитромботические средства, например гепарин, перед применением в покрывающем составе ковалентно связывают неабсорбируемым полимером, таким как полиакриловая кислота. Общую гидрофобность таких конъюгатов дополнительно регулируют добавлением гидрофобного средства, например октадециламина, который представляет собой амин с длинной углеводородной цепью. Этот подход имеет несколько потенциальных недостатков, например известная токсичность полиакриловой кислоты, остающейся после метаболизма гепарина in vivo. Добавление гидрофобного амина также увеличивает проблемы совместимости с тканями и повторного проведения реакций замещения на каждой стадии. Кроме того, остающиеся компоненты покрытия не являются биоразрушаемыми.
Другой подход к получению антитромботического покрытия раскрыт в патентах США № 6559132-Holmer, 6461665-Scholander и 6767405-Eketrop, где молекулу носителя, например хитозана, конъюгируют с активированной поверхностью металлического устройства. После этого гепарин ковалентно связывают с промежуточной молекулой. Этот способ может быть повторен несколько раз до получения желаемого антитромботического слоя. С другой стороны, это покрытие может быть получено в режиме периодического процесса. Однако этот подход нелегко применить к медицинскому устройству, которое покрыто полимерным покрытием, содержащим фармацевтическое средство/средства. Некоторые из эффективных антирестенозных средств, например сиролимус, могут быть повреждены во время процесса образования конъюгатов, в частности потому, что образование конъюгатов включает реакции, проходящие в воде.
В заявке PCT WO 2005/097223 A1 Stucke и соавторы раскрывают способ, в котором получают смесь гепарина, связанного с фотоактивным кросслинкером, который растворен или диспергирован с другими устойчивыми полимерами, например поли(бутилметакрилатом) и поли(винилпирролидоном) в одном покрывающем растворе, и производят сшивание УФ-светом в растворе или после нанесения покрытия. Потенциальный недостаток такого подхода заключается в том, что включенное в смесь лекарственное средство/средства могут подвергаться неблагоприятному влиянию УФ-света, обладающего высокой энергией, во время процесса сшивания или, что еще хуже, лекарственное средство/средства могут быть сшиты с полимером матрицы, если оно содержит функциональные группы, которые могут быть активированы энергией УФ-излучения.
В другом общем подходе, раскрытом в заявках US 2005/0191333 A1, US 2006/0204533 A1 и WO 2006/099514 A2 Hsu, Li-Chien и соавторами, применяют комплекс гепарина низкой молекулярной массы и противоиона (стерилалконийгепарин), или комплекс с полиэлектролитом высокой молекулярной массы, таким как декстран, пектин, для образования комплексной формы антитромботического средства. Далее эти антитромботические комплексы диспергируют на полимерной матрице, которая может дополнительно содержать лекарственное средство. Такой подход позволяет создать гетерогенную матрицу из лекарственного средства и гидрофильных частиц гепарина, в которой гидрофильные частицы притягивают воду до и после имплантации, нарушая стабильность и кинетику высвобождения лекарственного средства. Кроме того, желаемое антитромботическое действие гепарина или подобного ему средства предпочтительно должно проявляться на поверхности, не подвергаясь вымыванию с поверхности медицинского устройства с покрытием.
Таким образом, сохраняется потребность в покрывающем материале, предназначенном для нанесения по меньшей мере на одну поверхность медицинского устройства, который может отвечать описанным выше жестким требованиям и который может быть получен способом, совместимым с чувствительными фармацевтическими и терапевтическими средствами, включенными в покрытия. Это поможет удовлетворить потребность в покрытиях, которые как противодействуют рестенозу, так и предотвращают тромбоз при их нанесении на внешнюю поверхность стента, выделяющего лекарственное средство.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Разработан конъюгат гепарина и гребенчатого биоабсорбируемого полимера со свободной концевой карбоксильной группой, а также устройство, в котором этот конъюгат нанесен на поверхность или включен в его структуру. Внешний слой покрытия включает конъюгат по настоящему изобретению, который предотвращает тромбоз, и, кроме того, служит для регулирования кинетики высвобождения средства (средств), содержащегося во внутреннем слое (слоях) покрытия.
Первый подслой покрытия получают смешиванием полимерного материала и биологически активного средства с растворителем, формируя тем самым гомогенный раствор. Полимерный материал может быть выбран из широкого круга синтетических материалов, но в одном из типовых вариантов осуществления применяют поли(лактидгликолид) (PLGA). Биологически активное средство выбирают в зависимости от желаемых терапевтических результатов. Например, во внутренний слой могут быть включены антипролиферативные средства, такие как паклитаксел, иммунодепрессанты, такие как рапамицин и/или противовоспалительные средства, такие как дексаметазон. После получения раствор может быть нанесен на устройство способами погружения или распыления. Во время высушивания растворитель испаряется, и на стенте остается тонкослойное покрытие из полимерного материала с включенным в него биологически активным средством. Следует отметить, что настоящее изобретение не ограничено именно одним внутренним слоем или одним биологически активным средством в слое. В объем настоящего изобретения входит добавление одного или нескольких различных биологически активных средств в каждый из слоев, и/или наличие более чем одного внутреннего слоя, включающего биологически активное средство.
Второй или внешний слой включает антитромботический конъюгат гепарин-биоабсорбируемый полимер. Это покрытие может быть нанесено поверх внутреннего слоя, содержащего лекарственное средство, с применением, например, способов погружения или распыления. В одном из типовых вариантов осуществления настоящего изобретения внешний слой включает конъюгат гепарин-биоабсорбируемый полимер, который может быть растворен в смешанной системе растворителей, включающей этилацетат (EA) и изопропанол (IPA). Затем раствор распыляют на поверхность устройства, которая уже была покрыта описанным выше слоем, содержащим лекарственное средство. После высушивания антитромботический конъюгат гепарин-биоабсорбируемый полимер остается во внешнем слое покрытия, оставляя возможность элюирования лекарственного средства из внутреннего слоя через внешний слой.
Устройство с нанесенным покрытием помещают в пораженный участок организма, например сосуд, такой как коронарная артерия, применяя подходящую методику, выбор которой зависит от свойств устройства. Будучи помещенным в необходимое место, устройство будет удерживать сосуд в открытом состоянии. Биологически активное средство будет высвобождаться из первого слоя, обеспечивая тем самым желаемый терапевтический результат, например ингибирование пролиферации гладких клеток. Антитромботический конъюгат гепарин-биоабсорбируемый полимер во внешнем слое подвергается частичной гидратации и предотвращает коагуляцию крови на устройстве или вокруг него, тем самым препятствуя тромбозу и подострому тромбозу, связанному с устройством. Кроме того, антитромботический конъюгат гепарин-биоабсорбируемый полимер во внешнем слое может дополнительно уменьшать или предотвращать импульсное высвобождение биологически активного средства из внутреннего слоя, содержащего лекарственное средство, давая тем самым возможность проходить высвобождению в течение относительно продолжительного периода времени.
С другой стороны, могут быть созданы частицы, в которых гребенчатый полимер и гепаринсодержащий конъюгат играют роль носителя терапевтического средства, которое включено в полимерную матрицу. В этом варианте осуществления указанное средство представляет собой какое-либо средство, связанное с гидрофобным ядром гребенчатого полимера. Это средство растворяют совместно с конъюгатом, применяя растворитель, который позже выпаривают, получая частицы, в ядре которых содержится терапевтическое средство. Эти частицы идеально подходят для помещения внутрь конструкции устройства. Например, устройство может иметь такие структурные элементы, как лунки, углубления, складки или каналы, внутри которых содержатся частицы. Это дает возможность помещать частицы, имеющие различные свойства, в различные места устройства. Кроме того, частицы, включающие как минимум два различных средства, могут помещаться в один и тот же структурный элемент. Средства высвобождаются из структурного элемента по мере разрушения частиц. В то же время присутствие гепарина будет предотвращать возникновение тромбоза в месте расположения устройства.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Отличительные признаки и преимущества настоящего изобретения будут ясны рядовому специалисту из следующего далее подробного описания, в котором:
Фиг.1 представляет собой схематическое отображение полимеризации с раскрытием цикла димера лактона (лактида) с поливиниловым спиртом (PVA) в качестве инициатора, в результате которой образуется полимер гребенчатого типа.
Фиг.2 представляет собой схематическое отображение получения конъюгата гепарина с гребенчатым биоразрушаемым полимером, полученным из PVA и PLA.
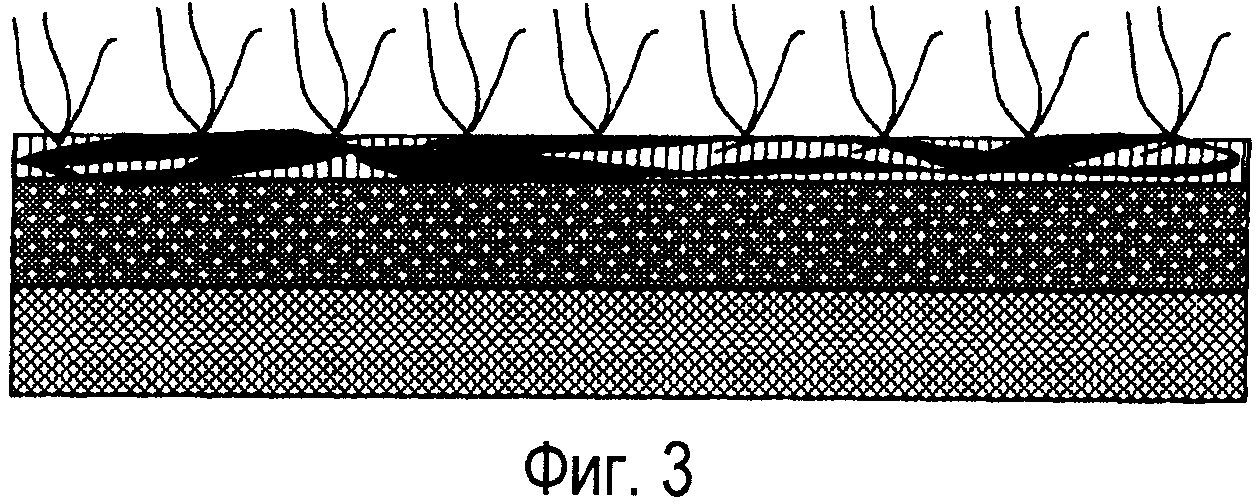
Фиг.3 представляет собой схематическое изображение нанесенного на поверхность устройства покрытия, включающего конъюгат гепарина с биоразрушаемым гребенчатым полиэфиром по настоящему изобретению, присутствующий во внешнем слое.
Фиг.4 представляет собой схематическое изображение, показывающее конъюгат гепарина с биоразрушаемым гребенчатым полиэфиром по настоящему изобретению, предварительно смешанный с лекарственным средством с образованием наночастиц или микросфер.
Фиг.5 представляет собой изометрическое изображение расширяемого медицинского устройства с частицами, селективно нанесенными на структурные элементы устройства.
Фиг.6 представляет собой вид поперечного сечения расширяемого медицинского устройства, содержащего частицы по настоящему изобретению, в первом ряду отверстий.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
На медицинское устройство наносят один или несколько слоев полимерной композиции для формирования покрытия или загружают эту композицию в структурный элемент медицинского устройства. Полимерная композиция выполняет различные функции. Например, один слой может представлять собой подложку, которая позволяет другим слоям удерживаться на ней. Дополнительный слой (слои) может содержать в своей полимерной матрице биологически активные средства. С другой стороны, может быть применено однослойное покрытие, в котором полимерная композиция обладает такими свойствами, что покрытие выполняет многочисленные функции, например удерживает покрытия на устройстве и содержит в себе средство, которое предотвращает тромбоз. В число других функций входит размещение средства для профилактики рестеноза.
Химическая природа того или иного средства может ограничивать количество средств, которые могут включаться в покрытие. Например, антитромботическое средство имеет тенденцию к гидрофильности, тогда как антипролиферативное средство скорее является относительно гидрофобным. Следовательно, желательно заключить гидрофобное средство в матрицу полимерного покрытия, чтобы ограничить его взаимодействие с водой и регулировать его элюирование из матрицы. В настоящем изобретении два средства, имеющие различающиеся свойства, удерживаются в непосредственной близости с помощью образования конъюгата антикоагулянта, такого как гепарин, и биоабсорбируемого полимера со свободной концевой карбоксильной группой. Эта конфигурация приведет к тому, что гидрофильное средство, т.е. гепарин, будет в основном удалено от гидрофобного средства, которое находится внутри полимерной матрицы. Таким образом, при нанесении на медицинское устройство покрытие, включающее конъюгат, гарантирует, что антитромботическое средство в основном ориентировано в противоположную сторону от всех гидрофобных средств, которые могут содержаться в полимерной матрице.
Следующие определения приведены для легкости понимания настоящего изобретения, и они не должны истолковываться как ограничивающие описание изобретения каким-либо образом.
В настоящем описании термин «стент» означает в основном трубчатую конструкцию, изготовленную из любого биосовместимого материала, которая помещена в канал с целью сохранения его просвета открытым и предотвращения его закрытия из-за сужения или внешнего давления.
В настоящем описании термин «биологически активное средство» означает лекарственное средство или другое вещество, которое обладает терапевтической ценностью для живого организма, включая, но не ограничиваясь перечисленным, антитромботические средства, противораковые средства, антикоагулянты, антиагрегационные средства, тромболитики, антипролиферативные средства, противовоспалительные средства, средства, ингибирующие рестеноз, ингибиторы пролиферации гладкомышечных клеток, антибиотики и т.п., и/или их смеси и/или любые вещества, которые могут содействовать другим веществам в осуществлении функции обеспечения терапевтической пользы живому организму.
Типовые противораковые препараты включают ацивицин, акларубицин, акодазол, акроницин, адозелезин, аланозин, алдезлейкин, аллопуринол натрий, алтретамин, аминоглутетимид, амонафид, амплиген, амсакрин, андрогены, ангуидин, афидиколин глицинат, асали, аспарагиназу, 5-азацитидин, азатиоприн, вакцину Кальметте-Герена (BCG), антифолат Бейкера (растворимый), бета-2'-дезокситиогуанозин, бизантрен HCl, блеомицина сульфат, бусульфан, бутионин сульфоксимин, керацемид, карбетимер, карбоплатин, кармустин, хлорамбуцил, хлорхиноксалин-сульфонамид, хлорзотоцин, хромомицин А3, цисплатин, кладрибин, кортикостероиды, Corynebacterium parvum, CPT-11, криснатол, циклоцитидин, циклофосфамид, цитарабин, цитембена, дабис малеат, дакарбазин, дактиномицин, даунорубицин HCl, деазауридин, дексразоксан, диангидрогалактиол, диазикон, дибромдульцитол, дидемин В, диэтилдитиокарбамат, дигликоальдегид, дигидро-5-азацитидин, доксорубицин, эхиномицин, эдатрексат, эделфозин, эфломитин, раствор Эллиотта, элсамитруцин, эпирубицин, эзорубицин, эстрамустин фосфат, эстрогены, этанидазол, этиофос, этопозид, фадразол, фазарабин, фенретинид, филграстим, финастерид, флавонуксусную кислоту, флоксуридин, флударабин фосфат, 5-фторурацил, Fluosol®, флутамид, нитрат галлия, гемицитабин, грозерелин ацетат, гепсульфам, гексаметилен бисацетамид, гомохаррингтонин, сульфат гидразина, 4-гидроксиандростендион, гидроксимочевину, идарубицин HCl, ифосфамид, интерферон альфа, интерферон бета, интерферон гамма, интерлейкин-1 альфа и бета, интерлейкин-3, интерлейкин-4, интерлейкин-6, 4-ипомеанол, ипроплатин, изотретиноин, лейковорин кальций, леупролид ацетат, левамизол, липосомальный даунорубицин, доксорубицин, инкапсулированный в липосомы, ломустин, лонидамин, майтанзин, меклоретамин гидрохлорид, мелфалан, меногарил, мербарон, 6-меркаптопурин, месну, остаток экстракции метанолом вакцины Кальметта-Герена, метотрексат, N-метилформамид, мифепристон, митогуазон, митомицин-С, митотан, митоксантрон гидрохлорид, моноцитарно/макрофагальный колониестимулирующий фактор, набилон, нафоксидин, неокарциностатин, октреотид ацетат, ормаплатин, оксалиплатин, паклитаксел, палу, пентостатин, пиперазиндион, пипоброман, пирарубицин, пиритрексим, пироксантрон гидрохлорид, PIXY-321, пликамицин, порфимер натрий, преднимустин, прокарбазин, прогестины, пиразофуран, разоксан, сарграмостим, семустин, спирогерманий, спиромустин, стрептонигрин, стрептозоцин, сулофенур, сурамин натрий, тамоксифен, таксотер, тегафур, тенипозид, терефталамидин, тероксирон, тиогуанин, тиотепу, инъекцию тимидина, тиазофурин, топотекан, торемифен, третиноин, трифлуоперазин гидрохлоид, трифлуридин, триметрексат, фактор некроза опухолей, урацил иприт, винбластин сульфат, винкристин сульфат, виндезин, винорелбин, винзолидин, Yoshi 864, зорубицин, а также их смеси.
Типовые противовоспалительные лекарственные средства включают классические нестероидные противовоспалительные средства (NSAIDS), такие как аспирин, диклофенак, индометацин, сулиндак, кетопрофен, флурбипрофен, ибупрофен, напроксен, пироксикам, теноксикам, толметин, кеторолак, оксапрозин, мефенамовую кислоту, фенопрофен, намбуметон (релафен), ацетаминофен (Tylenol®), а также их смеси; ингибиторы COX-2, такие как нимезулид, NS-398, флозулид, L-745337, целекоксиб, рофекоксиб, SC-57666, DuP-697, парекоксиб натрий, JTE-522, валдекоксиб, SC-58125, эторикоксиб, RS-57067, L-748780, L-761066, APHS, этодолак, мелоксикам, S-2474, а также их смеси; глюкокортикоиды, такие как гидрокортизон, кортизон, преднизон, преднизолон, метилпреднизолон, мепреднизон, триамцинолон, параметазон, флупреднизолон, бетаметазон, дексаметазон, флудрокортизон, дезоксикортикостерон, а также их смеси; а также смеси препаратов перечисленных классов.
В настоящем описании термин «эффективное количество» означает количество фармакологически активного средства, которое не является токсичным, но оказывается достаточным для обеспечения желаемого местного или системного эффекта и проведения какого-либо медицинского лечения при разумном сопутствующем соотношении польза/риск.
На фиг.3 показан типовой вариант покрытия (покрытий) по настоящему изобретению, нанесенного на поверхность 2. Поверхность 2 расположена, например, на имплантируемом медицинском устройстве. Покрытие включает первый или внутренний слой 4, состоящий из полимерной пленки с включенным в нее биологически активным средством, которое, например, предотвращает пролиферацию гладких клеток и миграцию. Первый слой покрытия 4 может содержать более чем одно биологически активное средство.
Один из способов, которым упомянутое средство помещают внутрь полимерной матрицы, включает применение растворителя или смеси растворителей, в которой растворяют средство и полимер. При высыхании смеси растворитель удаляется, оставляя средство включенным в матрицу полимера. Типовые полимеры, которые могут применяться для получения внутреннего/первого полимерного слоя, включают полиуретаны, полиэтилентерефталат (ПЭТ), сополимер PLLA-полигликолевая кислота (PGA) (PLGA), поликапролактон (PCL), сополимер поли(гидроксибутират/гидроксивалерат) (PHBV), поли(винилпирролидон) (PVP), политетрафторэтилен (PTFE, Teflon®), поли(2-гидроксиэтилметакрилат) (поли-HEMA), поли(эфируретанмочевина), силиконы, акриловые полимеры, эпоксиды, полиэфиры, уретаны, парилены, полифосфазеновые полимеры, фторсодержащие полимеры, полиамиды, полиолефины и их смеси. Типовые биоабсорбируемые полимеры, которые могут применяться для изготовления внутренней/первой полимерной пленки, включают поликапролактон (PCL), поли-D,L-молочную кислоту (DL-PLA), поли-L-молочную кислоту (L-PLA), поли(гидроксибутират), полидиоксанон, полиортоэфир, полиангидрид, поли(гликолевую кислоту), полифосфоэфир, поли(аминокислоты), поли(триметиленкарбонат), поли(иминокарбонат), полиалкиленоксалаты, полифосфазены и алифатические поликарбонаты.
Второй или внешний слой 6 может включать антитромботический конъюгат гепарин-биоабсорбируемый полимер с сильными антикоагуляционными свойствами. Второй слой, состоящий из антитромботического конъюгата гепарин-биоабсорбируемый полимер, может дополнительно обеспечивать эффект предотвращения импульсного выделения биологически активного средства, диспергированного в первом или внутреннем слое 4, позволяя получить относительно продолжительный период, в течение которого слой 4 может содержать более чем одно биологически активное средство. Кроме того, конъюгат 4 дает возможность сориентировать гидрофильную молекулу гепарина 8 в основном в направлении от гидрофобного внутреннего слоя 4.
Для целей иллюстрации настоящего изобретения покрытие (покрытия) наносят на медицинское устройство, например стент и/или стент-имплантат. Стенты в основном изготавливают из металла, например из нержавеющей стали или сплавов кобальта и хрома. Однако, кроме того, стенты можно изготавливать из полимерных материалов. Помимо этого следует понимать, что на любой субстрат, медицинское устройство или его часть, соприкасающиеся с органической жидкостью или подобной средой, также может быть нанесено покрытие по настоящему изобретению. Например, другие устройства, такие как фильтры полых вен и анастомотические устройства, могут применяться с покрытиями, внутри которых имеются лекарственные средства, или же устройства сами по себе могут быть изготовлены из полимерных материалов, внутри которых содержатся лекарственные средства. Любой из стентов или других медицинских устройств, описанных в настоящей заявке, может применяться для доставки лекарства в данное место или область. Стенты, расширяемые с помощью баллона, могут применяться в любом количестве сосудов или протоков и особенно хорошо подходят для применения в коронарных артериях. С другой стороны, саморасширяющиеся стенты особенно хорошо подходят для применения в сосудах, где решающим фактором является восстановление от сдавливания, например, в сонной артерии.
Желательно, но необязательно, чтобы первое покрытие 4 и второе покрытие 6 или слои покрывали хотя бы часть общей поверхности стента 2. Нанесение первого слоя 4 проводят способом выпаривания растворителя или каким-либо другим известным способом, например, обрызгиванием растворителем. Способ выпаривания растворителя включает смешивание полимерного вещества и биологически активного средства с растворителем, например, тетрагидрофураном (ТГФ), с последующим перемешиванием для получения смеси. Иллюстративные полимерные материалы первого слоя включают полиуретан, и иллюстративные биологически активные средства включают рапамицин. Смесь наносят на поверхность 2 стента либо распылением раствора на стент, либо погружением стента в раствор. После нанесения смеси стент подвергают высушиванию, во время которого растворитель испаряется и полимерный материал вместе с биологически активным средством образуют тонкую пленку на поверхности стента. В качестве альтернативы в первый слой 4 может быть добавлено несколько биологически активных средств.
Второй или внешний слой покрытия стента 6 включает антитромботический конъюгат гепарин-биоабсорбируемый полимер. Антитромботический конъюгат гепарин-биоабсорбируемый полимер может быть растворим в органических растворителях или смесях органических растворителей различной полярности. Гепарин 8 может включать нефракционированный гепарин, фракционированный гепарин, гепарин низкой молекулярной массы, десульфатированный гепарин и гепарины, полученные из различных млекопитающих. В число типовых антитромботических средств могут входить: антагонисты витамина К, такие как аценокумарол, клориндион, дикумарол (дикумарол), дифенадион, этилбискумацетат, фенпрокумон, фениндион, тиокломарол, варфарин; ингибиторы агрегации тромбоцитов гепариновой группы, такие как антитромбин III, бемипарин, далтепарин, данапароид, эноксаприн, гепарин, надропарин, парнапарин, ревипарин, сулодексид, тинзапарин; другие ингибиторы агрегации тромбоцитов, такие как абсиксимаб, ацетилсалициловая кислота (аспирин), алоксиприн, берапрост, дитазол, карбазалат кальция, клорикромен, клопидогрел, дипиридамол, эптифибатид, индобуфен, илопрост, пикотамид, празугрел, простациклин, тиклопидин, тирофибан, трепростинил, трифлусал; ферментные антикоагулянты, такие как алтеплаза, анкрод, антистреплаза, бриназа, дротрекогин альфа, фибринолизин, белок С, ретеплаза, саруплаза, стрептокиназа, тенектеплаза, урокиназа; прямые ингибиторы тромбина, такие как аргатробан, бивалирудин, дабигатран, дезирудин, гирудин, лепирудин, мелагатран, ксимелагатран; а также другие антитромботические средства, такие как дабигатран, дефибротид, дерматан сульфат, фондапринукс, ривароксабан.
Как показано на фиг. 1 и 2, типовой антитромботический конъюгат гепарин-биоабсорбируемый сополимер получают следующим образом. Во-первых, как показано на фиг.1, циклический димер d,l-лактид полимеризуют при повышенной температуре, равной примерно 140°C, в присутствии катализатора октоата олова (Sn(Oct)2) и заранее определенного количества поли(винилового спирта) (PVA, в значительной степени гидролизованного для придания растворимости в воде), применяемого в качестве инициатора раскрытия цикла. Полимеризация с раскрытием цикла приводит к конечному продукту, который содержит гомополимер полиэфира с концевыми гидроксильными группами. Молекулярная масса каждого полимера определяется соотношением между циклическим димером и инициатором PVA. Чем больше соотношение между циклическим димером и инициатором, тем выше молекулярная масса сополимера PVA-PLA.
В одном из вариантов осуществления настоящего изобретения гидроксильная группа на одном из концов полученного сополимера PVA-PLA может быть далее превращена в карбоксильную группу, которая может найти применение в последующей реакции образования конъюгата с молекулой гепарина. Хотя в реакции сочетания для получения конечного антитромботического конъюгата гепарин-биоабсорбируемый полимер можно применять любую молекулу гепарина, а именно рекомбинантный гепарин, производные гепарина или аналоги гепарина (имеющие предпочтительную молекулярную массу 1000-1000000 Дальтон), предпочтительно применять десульфатированный гепарин для увеличения эффективности реакции сочетания.
Если получен антитромботический конъюгат гепарин-биоабсорбируемый полимер, второй слой, содержащий указанный конъюгат, может быть нанесен непосредственно поверх первого слоя с применением способа выпаривания растворителя или другого подходящего способа. После выпаривания растворителя с поверхности имплантируемого медицинского устройства на внешней поверхности этого устройства образуется тонкая пленка антитромботического конъюгата гепарин-биоабсорбируемый полимер. С другой стороны, гребенчатый антитромботический биосовместимый сополимер может быть переработан в форму микросфер или наносфер, которые также содержат лекарственное средство, предварительно добавленное в медицинское устройство, выделяющее лекарственное средство.
Следующие ниже примеры иллюстрируют получение конъюгата и его применение в соответствии с основными идеями настоящего изобретения.
I. Пример 1. Получение гребенчатого биоразрушаемого PLA полимеризацией димеров лактона (лактидов) с раскрытием цикла, с применением поли(винилового спирта) (PVA) в качестве инициатора
Как показано на фиг.1, заранее определенное количество d,l-лактида (от Purac, USA) помещали в высушенный стеклянный круглодонный реактор, снабженный ротором магнитной мешалки. В стеклянный реактор добавляли заранее установленное количество поли(винилового спирта) (например, полностью гидролизованного Elvanol 70-03 от Du Pont, Inc.) и октоата олова (Sigma, St.Louis, USA). Затем реактор плотно закрывали пробкой и осуществляли три цикла откачки-заполнения газообразным аргоном для удаления из реактора воздуха и кислорода. Затем закрытый реактор постепенно нагревали до 140°C в вакууме, перемешивая реакционную смесь магнитной мешалкой. По завершении реакции полимер растворяли в хлористом метилене, осаждали в метаноле и высушивали в вакууме при слабом нагревании.
II. Пример 2. Получение антитромботического конъюгата гепарина и гребенчатого биоабсорбируемого полимера
Как показано на фиг.2, гребенчатый PLA, полученный согласно методике примера 1 выше, растворяли в безводном диметилформамиде (ДМФА), после чего растворяли янтарный ангидрид и дициклогексилкарбодиимид (DCC). Полученный раствор выдерживали в вакууме при комнатной температуре в течение 5 часов. Побочный продукт, т.е. дициклогексилмочевину (DCU) и не вступившие в реакцию DCC и NHS удаляли фильтрованием. Затем полученный интермедиат повторно осаждали метанолом и высушивали в вакуумной печи. Затем полученный интермедиат с концевой группой карбоновой кислоты активировали добавлением N-гидроксилсукцинимида (NHS) в диметилформамиде и далее вводили во взаимодействие с гепарином в течение 4 часов при комнатной температуре для получения конечного конъюгата гребенчатого биоразрушаемого полимера с гепарином по настоящему изобретению. Полученный конъюгат осаждали и подвергали лиофильной сушке.
III. Пример 3. Покрытие стента, выделяющего лекарственные средства, внешним слоем, включающим конъюгат гребенчатого абсорбируемого полимера с гепарином
Как показано на фиг.3, поверхность 10 стента из сплава кобальта и хрома покрывали распылением полимерным раствором, содержащим лекарственное средство, который может включать, например, этилацетат (EA), содержащий PLGA и рапамицин. Массовое соотношение PLGA и рапамицина составляло 2:1. Затем слой, содержащий лекарственное средство, высушивали и на этот слой 20 распылением наносили раствор, содержащий конъюгат гребенчатого абсорбируемого полимера и гепарина. После высушивания этого слоя на внешней поверхности формировалась тонкая пленка 30, содержащая конъюгат гребенчатого абсорбируемого полимера и гепарина.
Покрытия, например, такие как описано выше, могут быть тонкими, как правило, глубиной от 5 до 8 микронов. По сравнению с толщиной покрытия площадь поверхности устройства, например стента, очень велика, так что все количество лекарственного средства должно пройти очень короткий путь диффузии, чтобы выделиться в окружающие ткани. Образующийся при этом кумулятивный профиль высвобождения лекарственного средства характеризуется большим исходным всплеском выделения, с последующим быстрым приближением к асимптоте, а не желаемым «равномерным продолжительным высвобождением» или линейным высвобождением. Часто желательно изменить модель выделения терапевтического средства из устройства, например, стента. Кроме того, часто желательно изменить количество средства в разных частях поверхности устройства. Этого можно достичь размещением средства в структурных элементах устройства.
Как показано на фиг.5, расширяемое устройство имеет большое количество структурных элементов, которые облегчают размещение хотя бы одного лекарственного средства на поверхности устройства. Расширяемое медицинское устройство 10, показанное на фиг.5, может быть вырезано из трубки, изготовленной из соответствующего материала, с получением цилиндрического расширяемого устройства. Расширяемое медицинское устройство 10 включает в себя несколько цилиндрических секций 12, связанных между собой многочисленными соединительными элементами 14. Соединительные элементы 14 позволяют сгибать устройство в осевом направлении при прохождении извилистого пути по сосудистой системе к месту размещения и позволяют устройству сгибаться в осевом направлении, когда необходимо соответствовать кривизне просвета. Цилиндрическая трубка 12 состоит из решетки удлиненных планок 18, которые соединены между собой гибкими сочленениями 20 и кольцевыми планками 22. Во время расширения медицинского устройства 10 гибкие сочленения 20 деформируются, тогда как планки 18 не подвергаются деформации. Дополнительные подробности, относящиеся к типовому примеру расширяемого медицинского устройства, описаны в патенте США № 6241762, включенном в настоящую заявку во всей полноте в качестве ссылки.
Удлиненные планки 18 и кольцевые планки 22 включают такие структурные элементы, как отверстия 30, некоторые из которых селективно заполнены средством для выделения в просвет сосуда, в который имплантировано расширяемое медицинское устройство. Глубина отверстий 30 задается толщиной планок 22. Другие структурные элементы могут включать выступающие секции или лунки, прорези, удлиненные отверстия, дополнительные материалы и любые элементы, которые могут захватывать или содержать вещество, которое желательно поместить на расширяемое устройство. Кроме того, структурные элементы могут присутствовать в других частях устройства 10, например в соединительных элементах 14. В конкретном примере, показанном на фиг.5, отверстия 30 находятся в недеформируемых частях устройства 10, например планках 18, так что отверстия являются недеформируемыми, и лекарственное средство доставляется без риска дробления, выталкивания или другого повреждения во время расширения устройства. Дальнейшее описание одного из примеров способа, в котором лекарственное средство может быть загружено в отверстия 30, имеется в патенте США 6764507, включенном в настоящую заявку во всей полноте в качестве ссылки.
Для облегчения размещения лекарственного средства или нескольких лекарственных средств в структурном элементе устройства, которое показано на фиг.5, могут быть созданы частицы 40 с применением конъюгата гребенчатого полимера и гепарина в качестве носителя для терапевтического средств, как показано на фиг.4. В данном варианте осуществления лекарственное средство 42 до некоторой степени связано с гидрофобным ядром 46 гребенчатого полимера 44. Средство 42 растворяют совместно с конъюгатом, применяя растворитель, который затем выпаривают, получая частицы, в ядре которых имеется лекарственное средство. Эти частицы идеально подходят для помещения в конструкцию устройства, которое показано на фиг.5. Например, устройство может иметь такие структурные элементы, как лунки, углубления, складки или каналы, внутри которых могут помещаться частицы. Это дает возможность помещать частицы, имеющие различные свойства, в различные места устройства. Кроме того, частицы, включающие как минимум два различных средства, могут быть расположены в одном и том же структурном элементе. Лекарственные средства высвобождаются из структурных элементов по мере распада частиц. В то же время наличие гепарина будет предотвращать тромбоз в месте расположения устройства.
На фиг.6 показан вид поперечного сечения отверстия 50, имеющегося в устройстве 10 фиг.5. Масса частиц 40 помещена между двумя слоями 52 и 54. Слои 52 и 54 могут различаться по составу и толщине, что позволяет регулировать воздействие водной среды на частицы 40. Это даст возможность управлять высвобождением лекарственных средств из ядра частиц 40. Кроме того, можно получить частицы из одного вещества и поместить в отверстия 50 устройства 10.
Ниже приведены примеры способов получения наночастиц и микрочастиц для помещения на или в структурные элементы устройства.
IV. Пример 4. Образование наночастиц с применением конъюгата гребенчатый биоабсорбируемый полимер-гепарин и паклитаксела
Двадцать мг паклитаксела и 200 мг поли(лактид-гликолида) PLGA50/50 растворяли в 16 мл хлористого метилена при осторожном перемешивании. Полученный раствор вводили в 250 мл водного раствора, содержащего 4% поли(винилового спирта) (PVA) в качестве эмульгатора. Объединенный раствор обрабатывали ультразвуком с выходной мощностью 50 мВт в импульсном режиме генератора ультразвука в течение 90 сек. Затем эмульсию перемешивали в течение ночи при комнатной температуре для удаления растворителя. Таким образом получали наносферы, содержащие паклитаксел, которые отделяли центрифугированием при 12000 об/мин и затем 4 раза промывали деионизованной водой для удаления избытка эмульгаторов. Продукт перед применением подвергали лиофильной сушке.
V. Пример 5. Образование микрочастиц с применением конъюгата гребенчатый биоабсорбируемый полимер-гепарин и паклитаксела
Двадцать мг паклитаксела и 200 мг поли(лактид-гликолида) PLGA50/50 растворяли в 16 мл этилацетата (EA) при осторожном перемешивании. Восемьдесят мл воды (категории чистоты воды для инъекций) нагревали до 50°C и перемешивали с помощью магнитной мешалки. Для образования водного раствора добавляли заранее определенное количество эмульгатора (PVA, 0,4 г). Затем раствор охлаждали до комнатной температуры при постоянном перемешивании. При осторожном перемешивании в водный раствор добавляли этилацетат (3,2 мл). Затем раствор паклитаксела и PLGA медленно выливали в эмульгированный водный раствор, который перемешивали при 500 об/мин. Эмульсию перемешивали в течение еще 4 часов при комнатной температуре для затвердевания микрочастиц. затем полученные микрочастицы собирали фильтрованием и промывали 2 раза водой WFI. Полученные в итоге микросферы перед последующим применением подвергали лиофильной сушке в течение ночи.
На фиг.4 показаны частицы, полученные согласно приведенным выше примерам, помещенные в отверстие устройства, показанного на фиг.5. Частицы могут быть помещены в эти отверстия способом осаждения порошка, например способом электростатического осаждения. Эти устройства, содержащие частицы, могут быть впоследствии обработаны для регулировки кинетики высвобождения лекарственного средства таким способом, как распыление растворителя, и для дополнительного регулирования кинетики высвобождения отверстия могут быть также покрыты дополнительными покрытиями, чтобы точно отрегулировать кинетику высвобождения лекарственного средства.
Хотя выше настоящее изобретение было описано со ссылками на конкретные варианты осуществления, специалисту в данной области техники должно быть очевидно, что в описанные решения могут быть внесены многочисленные модификации и изменения без отступления от сути и основных особенностей изобретения. Соответственно, при определении объема изобретения следует обращаться к приложенной формуле изобретения, а не к предшествующему описанию. Описания приведены в заявке только с иллюстративной целью и не предназначены ни для ограничения изобретения, ни для сужения каким-либо образом объема изобретения, области применения или установления каких-либо явно выраженных формулировок об исключениях.
Реферат
Изобретение относится к материалу для имплантируемых медицинских устройств. Материал представляет собой конъюгат, содержащий биосовместимый, биоабсорбируемый гребенчатый сополимер PVA-PLA, включающий гидрофильные антитромботические концевые группы гепарина. Гребенчатый антитромботический конъюгат может быть нанесен на поверхность имплантируемого медицинского устройства для предотвращения возникновения тромбоза в месте расположения устройства и противодействия рестенозу. 6 ил., 5 пр.
Формула

где n представляет собой целое число, равное 2-1000; и m представляет собой целое число от 100 до 5000; LA представляет собой повторяющиеся звенья молочной кислоты; SA означает янтарную кислоту; Hp означает гепарин.
Документы, цитированные в отчёте о поиске
Перекрывающее кровоток твердофазное средство с покрытием из иммобилизованного связывающего средства

Комментарии