Биоразлагаемый эндоваскулярный стент с памятью формы и способ его изготовления - RU2731318C1
Код документа: RU2731318C1
Чертежи















Описание
Область техники, к которой относится изобретение
Изобретение относится к биоразлагаемым эндоваскулярным стентам с памятью формы, которые могут быть установлены без применения расширяющего баллона или иных расширяющих средств.
Уровень техники
Эндоваскулярные стенты применяются для лечения атеросклеротических, радиационных, посттравматических и т.п. поражений, приводящих к гемодинамически значимому артериостенозу или окклюзии артерии. Сокращение количества рестенозов и поддержание просвета сосуда достигается за счет биоразложения стентов, которое определяется наличием подверженных деградации связей в молекулярной структуре материала, геометрией стента и местом его имплантации. Снижение количества тромбозов достигается плотным прилеганием стента к стенкам сосуда и отсутствием рекойла, что достигается за счет эффекта памяти формы. Применение стентов с эффектом памяти формы делает необязательным использование расширяющих средств, в частности, расширяющего баллона, что упрощает процедуру установки стента и улучшает физиоанатомические свойства сосуда после установки стента, в частности, позволяет артерии совершать физиологические сокращения, необходимые для полноценного выполнения функции сосудов. Кроме того, стенты с эффектом памяти формы способны принимать форму извилистых сосудов, что невозможно в случае применения стентов с баллонным расширением.
В настоящее время безбаллонная технология установки стентов доступна лишь для металлических стентов с памятью формы, биологическое разложение которых не всегда имеет требуемые временные характеристики и, кроме того, последствия введения таких стентов в среду организма приемлемы не для всех пациентов.
Поэтому в связи с прогрессом в области биоразлагаемых полимерных конструкционных материалов внимание исследователей было обращено на полимерные биоразлагаемые эндоваскулярные стенты с памятью формы, о чем свидетельствует значительное количество патентных и непатентных документов последних двух десятилетий.
Из патентных документов US2007132155A1, US2007135899, US2007134289A1, CA2570890A1, CA2571128A1, CA2571141A1, CA2571152A1, CA2571157A1, CA2571193A1, CA2579477A1, CA2590310A1, CA2590318A1 CA2590355A1, CA2579250A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, с однослойным расположением страт в стенке, недостатком которого является малое радиальное усилие вследствие неоптимальной конфигурации страт.
Из патентного документа US2009035350A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, в котором предпринята попытка улучшить механические свойства за счет применения двух или более сегментов из материалов с различной температурой стеклования. В документе не раскрыта конструкция стента, поэтому эффективность такого подхода остается неясной.
Из патентных документов US20090182404A1, US20100016940A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, недостатком которого является плетеная конструкция стенки, уменьшающая рабочий просвет сосуда.
Из патентных документов WO2010135433A1 WO2013158619A2 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, недостатком которого является плетеная конструкция стенки, уменьшающая рабочий просвет сосуда.
Из патентного документа CA2822321A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, в котором предпринята попытка улучшить механические свойства за счет применения двуслойной стенки стента, где один слой представляет собой каркас, а другой – мелкую сетку; однако сетка в силу своей ограниченной эластичности препятствует полному раскрытию стента, кроме того, применение двуслойной стенки усложняет технологию изготовления стента и накладывает ограничения на его применение.
Из патентных документов US2012271396A1, WO2013003644A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, с однослойным расположением страт в стенке, недостатком которого является малое радиальное усилие вследствие неоптимальной конфигурации страт.
Из патентного документа US20140090231A1 известен биоразлагаемый стент, изготовленный из полимерного материала, в котором для увеличения гибкости и снижения повреждений при кримпинге и установке стента некоторые фрагменты страт выполнены меньшей ширины, чем другие; этот стент требует применения расширяющего баллона при установке.
Из патентных документов WO2015112915A1, US2016213499A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, с однослойным расположением страт в стенке, недостатком которого является малое радиальное усилие вследствие неоптимальной конфигурации страт.
Из патентного документа US2015359647A1 известен биоразлагаемый саморасширяющийся стент, изготовленный из полимерного материала, с однослойным расположением страт в стенке, недостатком которого является малое радиальное усилие вследствие неоптимальной конфигурации страт.
В непатентном документе [1] описано применение сополимеров PCTBV, содержащих poly(ɛ-caprolactone) (PCL) для изготовления биоразлагаемых саморасширяющихся стентов.
В непатентном документе [2] описано применение oligo(ε-caprolactone) (bOCL) для изготовления устройств медицинского назначения.
В непатентном документе [3] описано применение полимерных материалов с памятью формы для изготовления биоразлагаемых кардиоваскулярных стентов.
В непатентном документе [4] описано применение полимерных материалов с памятью формы для изготовления различных устройств, в том числе, медицинского назначения.
В непатентном документе [5] описано применение полимерных материалов с памятью формы на основе poly(lactide acid), в том числе, биоразлагаемых материалов медицинского назначения.
В непатентном документе [6] описано получение полимерных материалов с памятью формы на основе poly-l-lactic acid (PLLA), в том числе, биоразлагаемых материалов медицинского назначения.
В непатентном документе [7] описано применение полимерных материалов с памятью формы с применением p-dioxanone, diglycolide или ε-caprolactone в качестве сополимера для изготовления биоразлагаемых материалов медицинского назначения.
В непатентном документе [8] описано влияние структуры и длины молекул сегментированных poly(ε-caprolactone) полиуретанов, полученных из poly(ε-caprolactone)diol, на свойство памяти формы.
В непатентном документе [9] описано применение хитозан-полиэфирных структур с чувствительностью к влажности для изготовления биоразлагаемых стентов.
В непатентном документе [10] описано применение l-lactide, glycolide и trimethylene carbonate терполимеров с восстановлением формы при температуре тела для изготовления биоразлагаемых устройств медицинского назначения.
В непатентном документе [11] описано применение полимерных материалов с памятью формы на основе oligo(ε-caprolactone)diol для изготовления биоразлагаемых устройств медицинского назначения.
В непатентном документе [12] описано применение полимерных материалов с памятью формы на основе poly(ε-caprolactone)dimethacrylate для примеения in vivo.
В непатентном документе [13] описаны термические и механические свойства сополимеров на основе лактидов: poly(lactide-co-glycolide) (PLGA), poly(lactide-co-p-dioxanone) (PLDON) и poly(lactide-co-caprolactone) (PLC), пригодных для изготовления биоразлагаемых саморасширяющихся стентов.
В непатентном документе [14] описаны термические и механические свойства сополимеров на основе сополимеров PEG-PCL в сравнении с PEG/ε-CL.
В непатентном документе [15] описано применение poly(ε-caprolactone-co-DL-lactide) с эффектом памяти формы для изготовления биоразлагаемых стентов.
В непатентном документе [16] описаны радиологические свойства материалов на основе poly(ε-caprolactone), пригодных для изготовления биоразлагаемых стентов.
В непатентном документе [17] описано применение poly(ε-caprolactone) с эффектом памяти формы для изготовления биоразлагаемых стентов.
В непатентном документе [18] описано применение poly(lactide-co-glycolide) (PLGA) и poly(L-lactic acid) (PLLA) с эффектом памяти формы для изготовления биоразлагаемых стентов.
В непатентном документе [19] описано применение poly(ε-caprolactone) (PCL) с эффектом памяти формы для изготовления биоразлагаемых стентов.
В непатентном документе [20] описано применение материалов на основе poly(ε-caprolactone) (cPCL) и poly(sebacic anhydride) (PSA) для изготовления биоразлагаемых устройств медицинского назначения.
Тем не менее, задача создания биоразлагаемых полимерных стентов с памятью формы с приемлемым соотношением механических, биохимических и технологических характеристик оказалась нетривиальной и до последнего времени такие стенты серийно не выпускались.
Таким образом, задача создания биоразлагаемых полимерных стентов с памятью формы и улучшенным соотношением механических, биохимических и технологических характеристик остается актуальной.
Раскрытие изобретения
Задача настоящего изобретения состоит в реализации линейки биоразлагаемых стентов различного размера с памятью формы и улучшенным соотношением механических, биохимических и технологических характеристик, конструкция и технология изготовления которых были бы пригодны для серийного промышленного производства.
Эта задача решена созданием биоразлагаемого саморасширяющегося стента, изготовленного из полимера, в котором страты образуют закрытоячеистую структуру.
В таком стенте соотношение внутреннего диаметра стента в состоянии до кримпинга и после кримпинга может составлять от 3 до 5. Это позволяет помещать стенты различного назначения в сжатом состоянии в устройства доставки, применимые для имплантации стентов в различные сосуды, протоки и т.п. Наружный диаметр стента до кримпинга может составлять от приблизительно 0,25 мм до приблизительно 40 мм, в зависимости от назначения стента, а длина может составлять от 5 мм до 250 мм, в зависимости от назначения стента.
Средняя молекулярная масса полимера для изготовления стента может составлять от 20 кДа до 600 кДа, предпочтительно от 100 кДа до 400 кДа, а индекс полидисперсности полимера может составлять от 1,3 до 2,5, предпочтительно, от 1,5 до 2,0. Полимер может иметь основную температуру стеклования выше 37°С, предпочтительно, выше 42°С.
Полимер может быть получен сополимеризацией мономеров, выбранных из группы: L-лактид, D-лактид, D,L-лактид, мезо-лактид, гликолид, ε-капролактон, триметиленкарбонат, п-диоксанон и соединения, содержащие фотополимеризующиеся функциональные группы. В частности, полимер может представлять собой собой сополимер L,L-лакдида и ε-капролактона.
Ширина страт стента может составлять от 0,01 мм до 1 мм, а толщина страт может составлять от 0,02 мм до 0,5 мм, в зависимости от его диаметра.
Страты в состоянии до кримпинга могут иметь по существу синусоидальную форму и увеличенную ширину в местах наибольших механических напряжений, возникающих при изготовлении и/или в ходе эксплуатации стента. При этом страты могут иметь уменьшенную толщину и/или отверстия в местах наименьших механических напряжений, возникающих при изготовлении и/или в ходе эксплуатации стента.
Молекулы полимера могут иметь по существу круговую ориентацию в поперечном сечении стента.
Задача настоящего изобретения также решена созданием способа изготовления биоразлагаемого саморасширяющегося стента, включающего в себя следующие стадии:
- экструдируют трубку из полимерного материала, при этом экструзия трубки из полимерного материала может выполняться таким образом, чтобы молекулы полимера имели по существу круговую ориентацию в поперечном сечении трубки;
- выполняют отжиг экструдированной полимерной трубки;
- выполняют лазерную резку экструдированной полимерной трубки с получением заготовки стента, в которой страты образуют закрытоячеистую структуру, которая может быть образована стратами по существу синусоидальной формы в состоянии до кримпинга;
- выполняют нагревание заготовки стента до температуры выше температуры стеклования полимерного материала и резкое обжатие равномерно по всей наружной поверхности с последующим быстрым охлаждением, в частности, до температуры приблизительно –20°С или ниже;
- помещают охлажденный стент на/в средство доставки;
- выполняют упаковку, маркировку и стерилизацию.
Технический результат, достигаемый заявленным изобретением, заключается в обеспечении возможности изготовления линейки биоразлагаемых стентов различного размера с памятью формы и улучшенным соотношением механических, биохимических и технологических характеристик, конструкция и технология изготовления которых пригодны для серийного промышленного производства.
Закрытая форма страт обеспечивает соотношение внутреннего диаметра стента в состоянии до кримпинга и после кримпинга в диапазоне от 3 до 5, что позволяет изготавливать стенты широкого размерного ряда и покрывать большой диапазон назначений стентов, она также способствует обеспечению увеличенного усилия при расширении стента за счет эффекта памяти формы и повышенной нагрузочной способности стента после его установки. Кроме того, закрытая форма страт позволяет реализовать увеличенную ширину страт в местах наибольших механических напряжений, возникающих при изготовлении и/или в ходе эксплуатации стента, что также улучшает механические характеристики стента. Синусоидальная или близкая к синусоидальной форма страт близка к оптимальной с точки зрения обеспечения указанных выше свойств стента.
Уменьшенная толщина и/или наличие отверстий в местах наименьших механических напряжений, возникающих при изготовлении и/или в ходе эксплуатации стента, позволяет выровнять механические напряжения в материале стента и обеспечить более равномерную и лучше прогнозируемую деградацию материала стента, что снижает риск отрыва и миграции фрагментов страт по кровеносному руслу.
Средняя молекулярная масса полимера для изготовления стента и его индекс полидисперсности в заявленных диапазонах значений обеспечивают требуемые временные параметры эксплуатации стента в среде организма, включая срок сохранения его механических характеристик на приемлемом уровне и срок его полного разложения.
По существу круговая ориентация молекул полимера в поперечном сечении стента способствует повышению его механических характеристик, в частности, увеличению усилия, развиваемого стентом при его установке и повышению нагрузочной способности стента после завершения его имплантации.
Краткое описание чертежей
На фиг. 1 представлен рисунок страт стента согласно изобретению в развернутом виде.
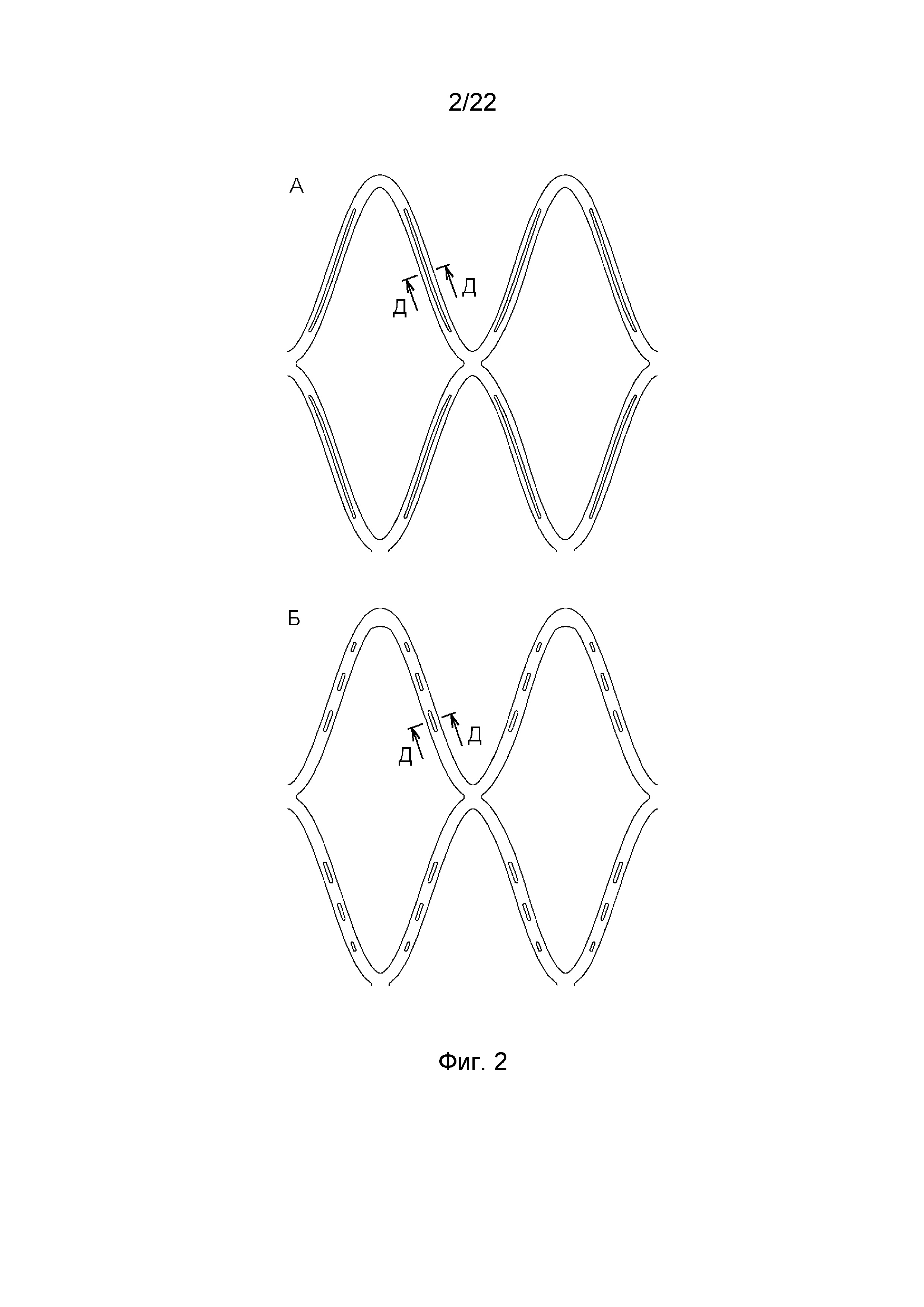
На фиг. 2 представлены варианты исполнения страт стента согласно изобретению.
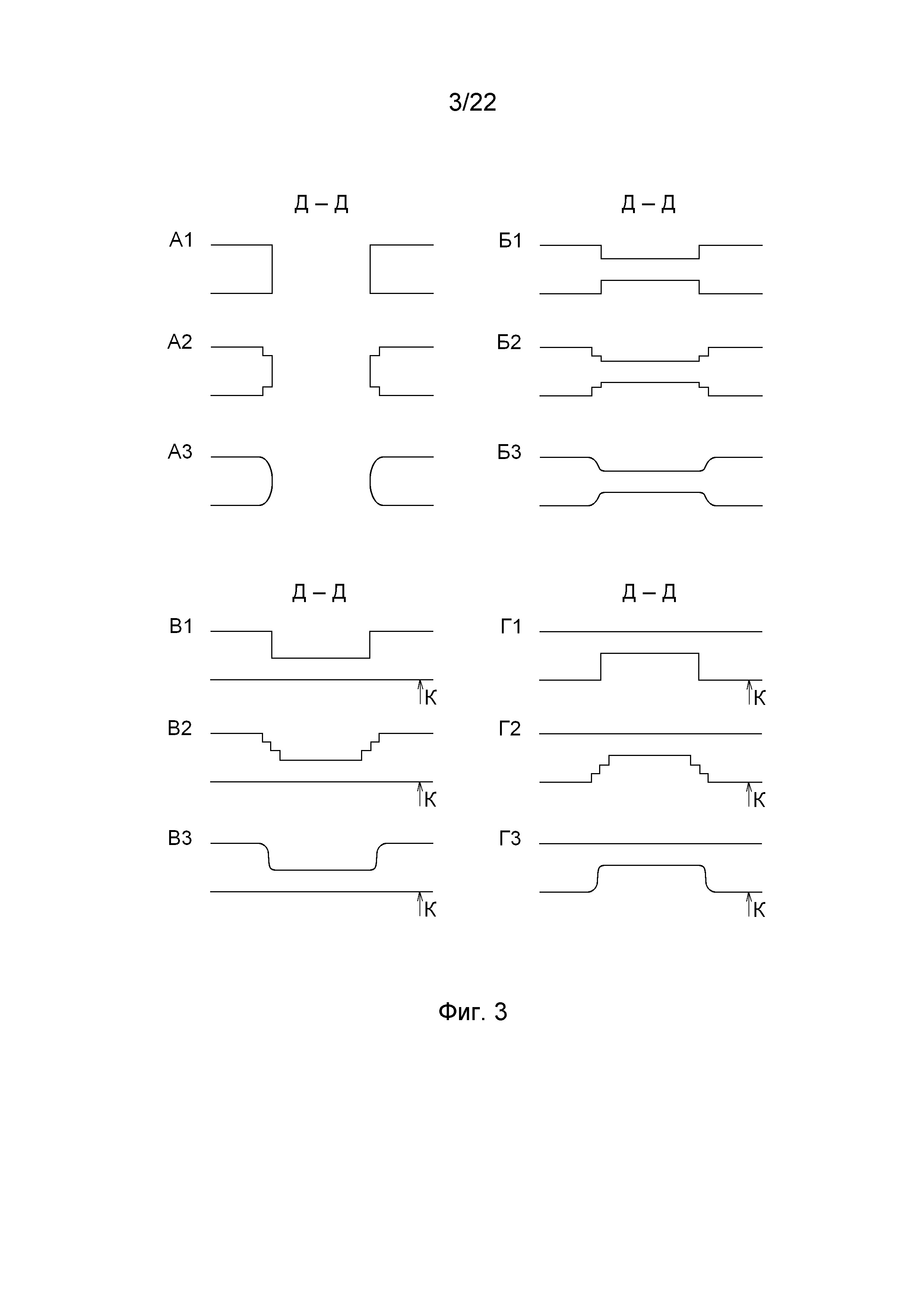
На фиг. 3 представлены варианты исполнения отверстий или участков меньшей толщины в стенте согласно изобретению.
На фиг. 4 представлено расположение характерных технологических точек и зон процесса изготовления стента на температурной шкале; Тст – температура стеклования, Тпл – температура плавления.
На фиг. 5 представлена обобщенная схема технологического процесса, обеспечивающего продольно-радиальную ориентацию молекул материала трубки согласно [21].
На фиг. 6 представлена по существу круговая ориентация молекул материала трубки в ее поперечном сечении.
На фиг. 7 представлена модель кольцевого элемента эндоваскулярного стента согласно изобретению.
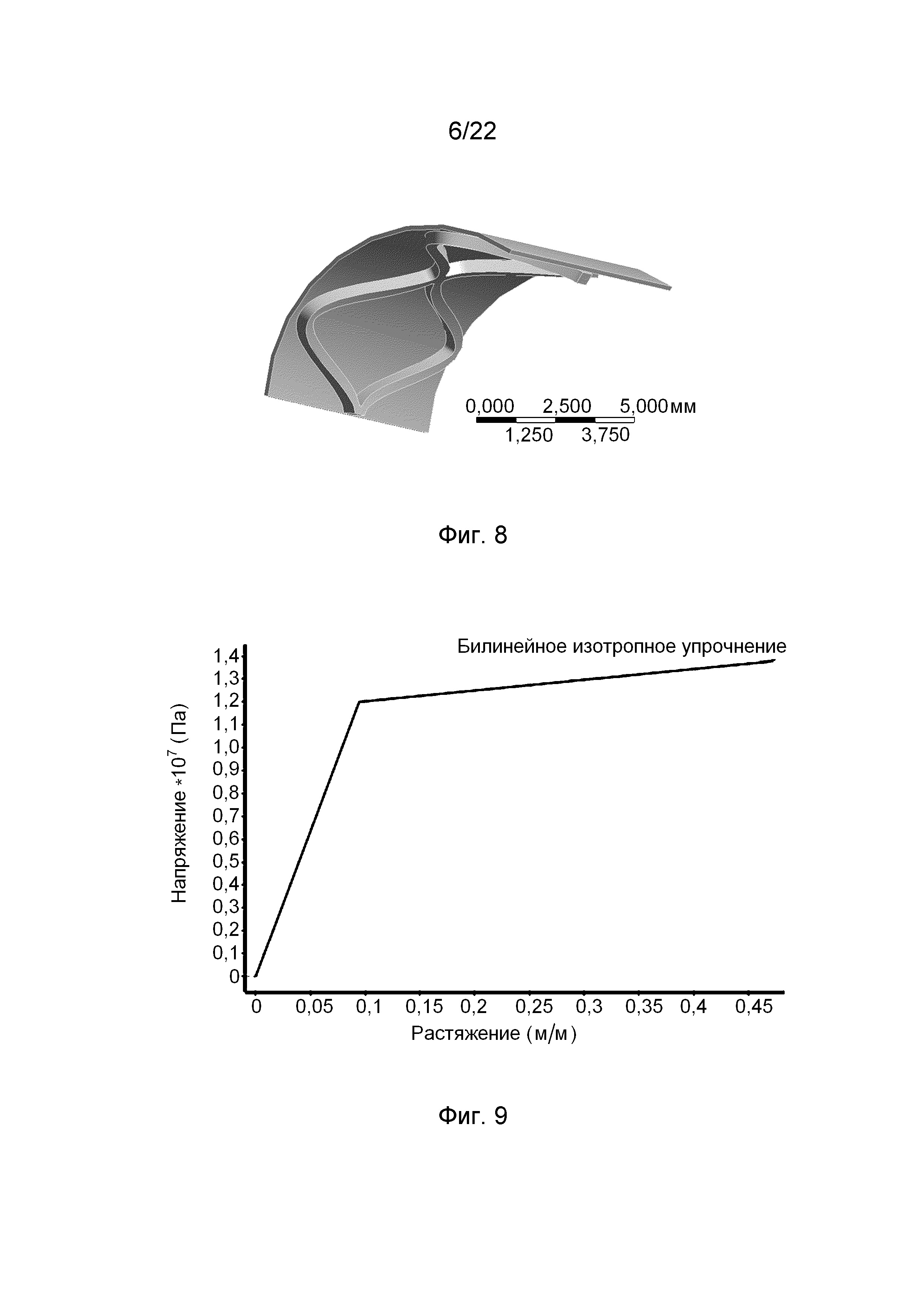
На фиг. 8 представлен сегмент модели кольцевого элемента эндоваскулярного стента согласно изобретению, использованный при расчетах.
На фиг. 9 представлена конечно-элементная модель материала стента согласно изобретению, полученная на основе диаграммы одноосного растяжения, представленной на фиг. 10.
На фиг. 10 представлена диаграмма одноосного растяжения, на основе которой получена конечно-элементная модель материала стента согласно изобретению, представленная на фиг. 9.
На фиг. 11 представлены стадии процесса кримпинга стента согласно изобретению с начальным внутренним диаметром 10 мм и конечным внутренним диаметром 2,5 мм.
На фиг. 12 представлен график изменения механического напряжения, возникающего в стенте согласно изобретению при кримпинге.
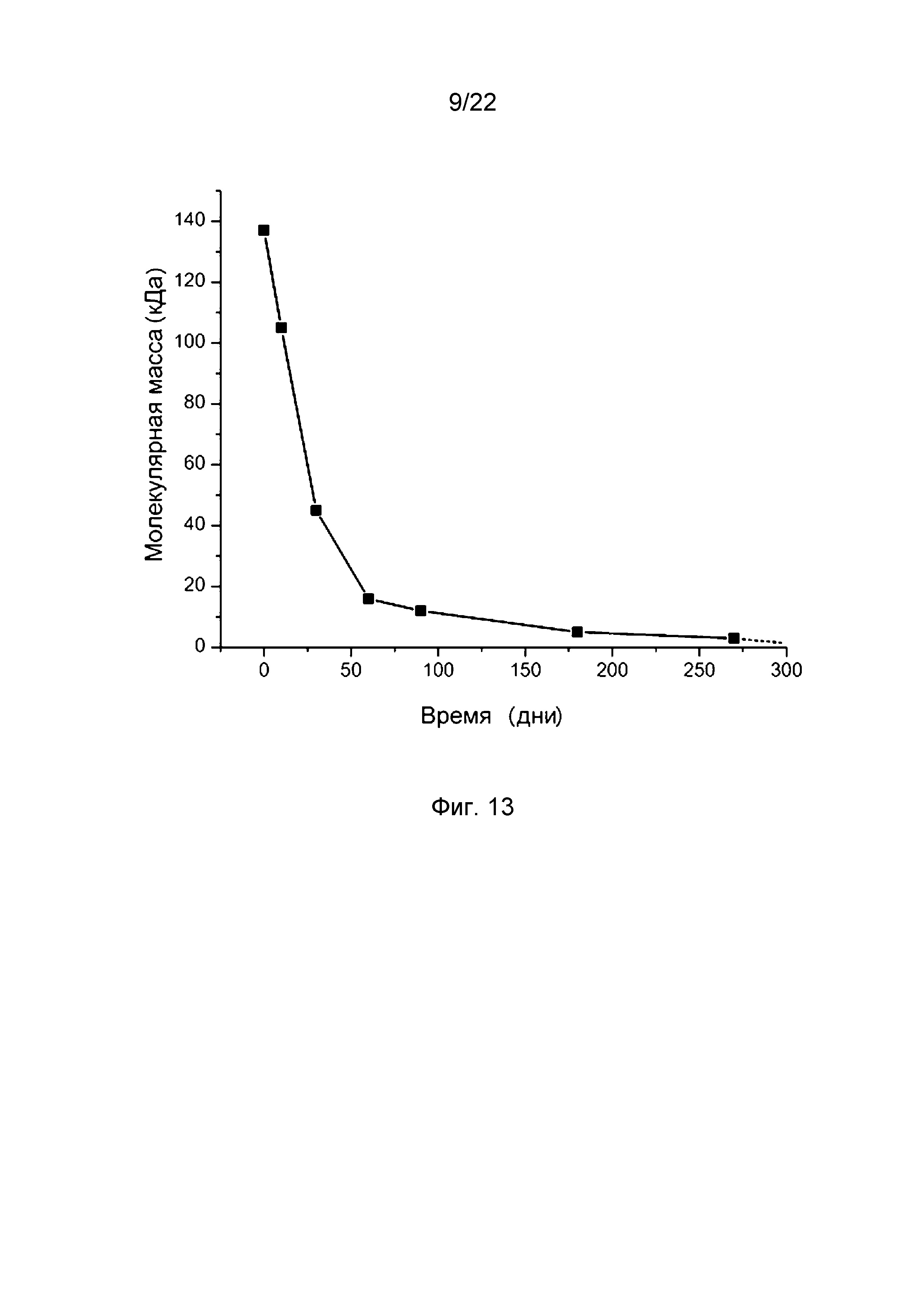
На фиг. 13 представлен график деградации полимера, использованного в стенте согласно изобретению, в фосфатном буфере при 37°С.
На фиг. 14 представлены деформационные кривые образцов пластины из полимера, использованного в стенте согласно изобретению, при различных температурах.
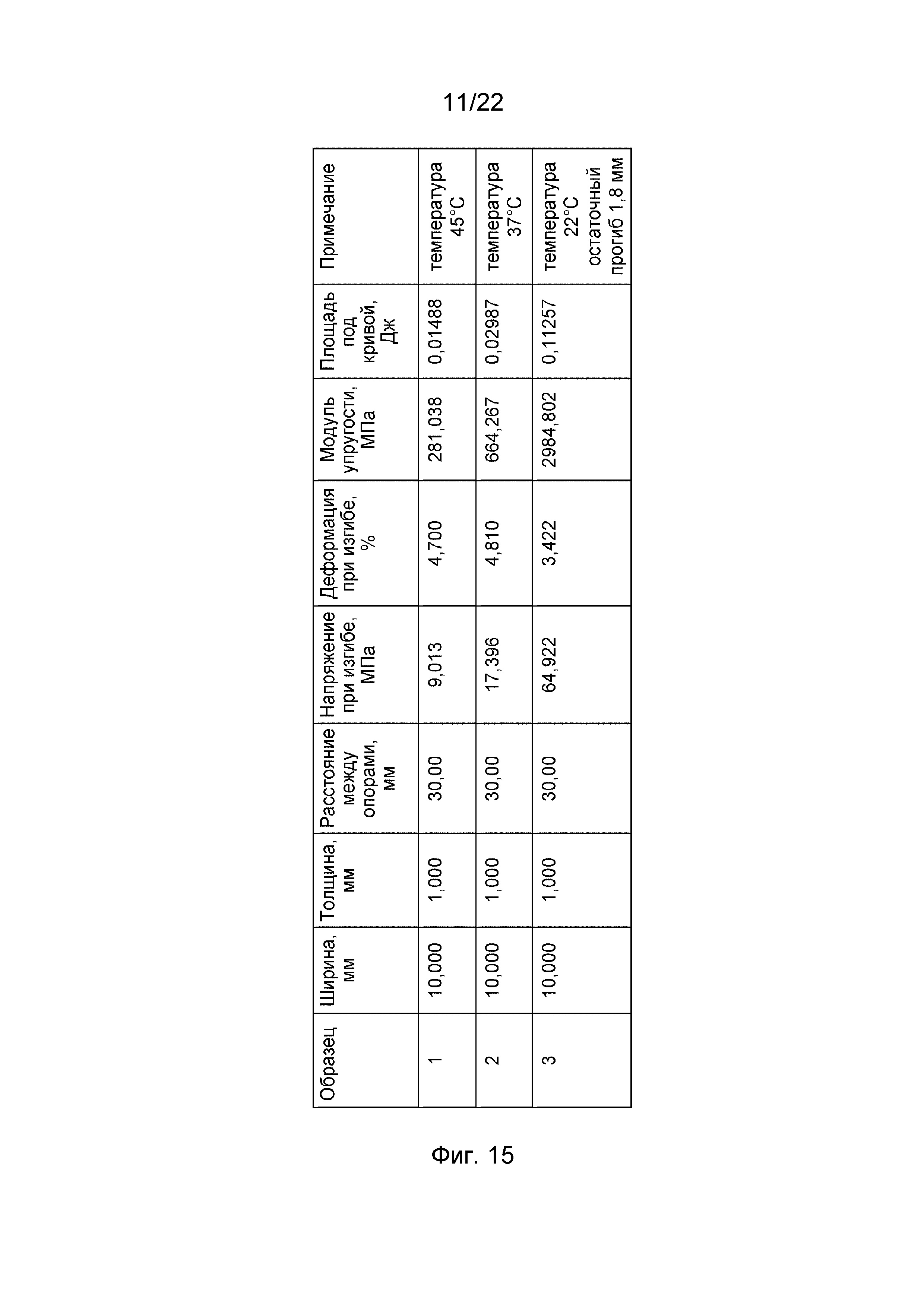
На фиг. 15 представлены результаты измерений зависимости механических характеристик полимера, использованного в стенте согласно изобретению, от температуры.
На фиг. 16А представлен вид испытательной установки перед началом деформирования образца полимера, использованного в стенте согласно изобретению.
На фиг. 16Б представлен вид испытательной установки по окончании деформирования образца полимера, использованного в стенте согласно изобретению.
На фиг. 16В представлена форма образца полимера, использованного в стенте согласно изобретению, сразу после охлаждения.
На фиг. 16Г представлена форма образца полимера, использованного в стенте согласно изобретению, после выдерживания в течение 1,5 часа при комнатной температуре.
На фиг. 16Д представлена форма образца полимера, использованного в стенте согласно изобретению, по окончании испытаний.
На фиг. 17 представлен график изменения во времени силы сопротивления образца полимера, использованного в стенте согласно изобретению, при постоянной деформации в ходе разогрева испытательной камеры.
На фиг. 18 представлен график зависимости силы сопротивления образца пластины из полимера, использованного в стенте согласно изобретению, от температуры при постоянной деформации.
На фиг. 19 представлен другой рисунок страт стента согласно изобретению в развернутом виде.
На фиг. 20 в увеличенном виде представлена ячейка другого типа согласно изобретению.
На фиг. 21 представлены подробности формы ячейки с фиг. 20.
На фиг. 22–25 представлены графики зависимости относительного усилия, развиваемого стентом с рисунком страт по фиг. 19, от величины деформации для различных образцов стента.
На фиг. 26 представлены графики зависимости относительного усилия, обеспечиваемого стентами с рисунком страт по фиг. 1, по фиг. 19 и контрольным металлическим стентом, от наружного диаметра.
Осуществление изобретения
Конструкция и размеры
Форма стента обусловлена анатомией сосудов, в которые стент имплантируется. Обычно стент имеет форму полого цилиндра. Тем не менее, стент может иметь иную форму, например, форму полого усеченного конуса. Если стент устанавливается в местах ответвлений или слияний сосудов, в его стенках могут быть предусмотрены отверстия для пропуска потока крови или иной текучей среды.
На фиг. 1 представлен один вариант рисунка страт стенки стента в развернутом виде. Стенка стента образована ячеистой структурой закрытого типа. Закрытые ячейки обеспечивают стенту повышенную радиальную жесткость. Страты имеют утолщения в местах наибольшей концентрации механических напряжений (например, см. увеличенный фрагмент на фиг. 1), что обеспечивает повышенную прочность стента и позволяет ему успешно противостоять воздействию однократных (при кримпинге) и многократных (при сокращении стенок сосуда) нагрузок. Это снижает вероятность возникновения микротрещин в материале страт и, соответственно, предотвращает их преждевременное разрушение, с которым связан риск отрыва и миграции фрагментов страт по кровеносному руслу, обеспечивает более равномерное и лучше прогнозируемое разложение стента. Кроме того, это увеличивает площадь контакта стента и стенок сосуда, что снижает вероятность и дальность миграции стента в русле сосуда.
На фиг. 2 представлены варианты исполнения страт. Известно, что скорость деградации полимерных стентов зависит от концентрации механических напряжений в материале стента, которые являются следствием внешних усилий и вызванных ими деформаций. Расчеты показывают, что при кримпинге (обжатии) стента в процессе его изготовления и при восприятии стентом радиальной нагрузки во время эксплуатации в центральной части страт вдоль оси симметрии локализуются области малых напряжений, вплоть до нулевых. Это означает, что конструкция в данных областях недогружена. Для более равномерного распределения напряжений и, как следствие, для обеспечения равномерного разложения стента страты могут иметь перфорацию или участки меньшей толщины в упомянутой области малых напряжений. Отверстия или участки меньшей толщины могут иметь форму различных геометрических фигур и их сочетаний, в том числе протяженных (например, как показано на фиг. 2А) или малоразмерных (например, как показано на фиг. 2Б), прямых или криволинейных. Отверстия и участки меньшей толщины могут сочетаться в страте, например, они могут перемежаться.
На фиг. 3 представлены варианты исполнения отверстий или участков меньшей толщины. Отверстия могут быть выполнены с прямолинейными (фиг. 3А1), ступенчатыми (фиг. 3А2), криволинейными (фиг. 3А3) стенками или со стенками комбинированной формы. Участки меньшей толщины могут быть выполнены с одноступенчатыми (фиг. 3Б1), многоступенчатыми (фиг. 3Б2), криволинейными (фиг. 3Б3) переходами или с комбинированными переходами. Ступенчатые переходы технологически проще для реализации, криволинейные переходы обеспечивают более равномерное распределение механических напряжений. Участки меньшей толщины могут быть расположены симметрично (фиг. 3Б1, 3Б2, 3Б3) или несимметрично (фиг. 3В1, 3В2, 3В3, фиг. 3Г1, 3Г2, 3Г3) по толщине страты. Символом «К» обозначена поверхность контакта со стенкой сосуда. Выполнение участков меньшей толщины согласно фиг. 3В1, 3В2, 3В3 позволяет сохранить площадь контакта стента и стенок сосуда, что снижает вероятность и дальность миграции стента в русле сосуда при малом радиальном усилии, развиваемом стентом в расширенном состоянии. Выполнение участков меньшей толщины согласно фиг. 3Г1, 3Г2, 3Г3 обеспечивает большее усилие удержания стента за счет неровностей его контактной поверхности, что снижает вероятность и дальность миграции стента в русле сосуда при большом радиальном усилии, развиваемом стентом в расширенном состоянии. Упомянутое радиальное усилие может зависеть от диаметра стента и ряда других факторов. Таким образом, возможность выбора варианта исполнения отверстий или участков меньшей толщины позволяет подобрать оптимальную конструкцию стента для конкретных условий его применения.
Стент для лечения людей может иметь длину от приблизительно 5 мм до приблизительно 100 мм, которая зависит от характера сосудистых поражений. Минимальное значение длины обусловлено размерами атеросклеротических бляшек, подвергаемых лечению эндоваскулярным методом. Пациентов с сосудистыми поражениями протяженностью более 100 мм обычно вместо стентирования подвергают классическому лечению с применением шунтирующих операций или эндартерэктомии. Наружный диаметр стента в раскрытом состоянии может составлять от приблизительно 0,25 мм до приблизительно 40 мм. Минимальное значение наружного диаметра зависит от минимального просвета коронарных артерий, а максимальное значение – от максимального просвета нижней полой вены и аорты.
Размер поперечного сечения страт (ширина и толщина), помимо требуемых механических характеристик стента, также зависит и от места имплантации стента, с чем связана необходимость создания обтекаемых страт – это позволяет избавиться от важной составляющей триады Вирхова (комплекса причин, вызывающих тромбозы) – турбулентного кровотока.
В частности, для периферических артерий оптимальный размер страт зависит от назначения и места имплантации стента: в случае почечных артерий толщина страт может варьироваться от 0,02 мм до 0,5 мм, а ширина – от 0,01 мм до 1 мм. Для подвздошных и каротидных артерий диаметром до 20 мм толщина страт может составлять от 0,08 мм до 0,5 мм, а ширина – от 0,08 мм до 1 мм. Эти параметры выбраны таким образом, чтобы не вызывать турбулентного кровотока в артериях. При имплантации в коронарные артерии, диаметр которых может достигать 5 мм, толщина страт может составлять 0,02 мм до 0,2 мм, а ширина – от 0,02 мм до 0,2 мм. Толщина страт – это размер поперечного сечения в радиальном направлении стента, а ширина страт – это размер поперечного сечения в направлении, перпендикулярном радиальному.
Указанные выше размеры стентов и их конструктивных элементов характерны для периферических стентов. Тем не менее, настоящее изобретение применимо и в отношении иных видов стентов, например, билиарных и пищеводных стентов, а также кава-фильтров. Диаметр билиарных стентов и размеры их страт могут быть сопоставимыми с соответствующими размерами периферических стентов, но их длина может составлять более 200 мм. Пищеводные стенты могут иметь диаметр до 40 мм и длину до 250 мм, кава-фильтры также могут иметь диаметр до 40 мм и длину до 150 мм.
Стенты могут быть покрыты слоем, содержащим лекарство и/или обладающим рентгеноконтрастными свойствами. Лекарственные средства могут быть, например, антипролиферативными, антикоагулянтными средствами. Рентгеноконстрастность может достигаться, например, использованием полимеров на основе тирозина. В качестве покрытия также может быть использовано наноструктурированное покрытие с терапевтическими или диагностическими агентами и/или с изотопами для диагностики и лечения онкологических и других заболеваний.
В случае применения стентов для лечения животных размеры стента могут выходить за указанные выше пределы, а размеры его отдельных элементов могут отличаться от указанных выше, в зависимости от размеров сосудов животного.
Материал
Для изготовления биоразлагаемых стентов с памятью формы, обладающих механическими характеристиками при температуре тела человека и теплокровных животных, достаточными для поддержания просвета сосуда, полимерный материал должен обладать следующими свойствами.
(1) В молекулярной структуре материала должна быть сложноэфирная или другая гидролизуемая химическая связь, обеспечивающая постепенную деградацию материала при контакте с водой.
(2) Полимерный материал должен содержать одно высокомолекулярное соединение либо композицию из нескольких высокомолекулярных и/или олигомерных соединений. При этом высокомолекулярные соединения могут быть блочными, микроблочными, статистическими, градиентными, звездообразными, разветвленными и другими видами сополимеров на основе одного или нескольких видов мономерных звеньев. Мономерные звенья могут быть представлены циклическими сложными эфирами (L-лактид, D-лактид, D,L-лактид, мезо-лактид, гликолид, ε-капролактон, триметиленкарбонат, п-диоксанон), а также соединениями, содержащими фотополимеризующиеся функциональные группы, например акриловую или фумаровую. Сополимер заданного состава получают сополимеризацией мономерных звеньев или олигомеров на их основе, либо путем химического связывания предварительно синтезированных олигомерных или полимерных цепей. Сополимер с молекулярной массой от 20 кДа до 600 кДа, предпочтительно от 100 кДа до 400 кДа может быть представлен поли(L,L-лактид-со-ε-капролактоном), поли(L,L-лактид-со-триметиленкарбонатом), поли(гликолид-со-ε-капролактоном) и другими сополимерами в соотношении от приблизительно 100:1 до приблизительно 1:100. Композиция на основе нескольких материалов может быть получена путем смешивания в экструдере. Такая композиция может быть представлена, например, смесью поли(L,L-лактида) и поли(D,D-лактид-со-ε-капролактона), в которой цепи поли(L,L-лактида) и участки цепей поли(D,D-лактида-со-ε-капролактона), представленные звеньями D,D-лактида, образуют стереокомплекс с повышенной температурой плавления и улучшенными физико-механическими характеристиками.
(3) Материал должен обладать основной температурой стеклования и основной температурой плавления выше 37°С, что обеспечивает механические характеристики изделия при функционировании в организме человека, достаточные для поддержания просвета сосуда.
(4) Молекулярная структура материала должна быть стереорегулярной или способной к образованию сшивок, обеспечивая возможность кристаллизации материала при его отжиге, либо способной к образованию молекулярной сетки для формирования постоянной формы изделия.
(5) Молекулярная структура полимерного материала должна содержать дополнительный полимерный или олигомерный компонент, который при нагревании до 30–37°С и/или при контакте с водой и/или при другом заранее заданном внешнем воздействии претерпевает релаксационный и/или фазовый переход, сопровождающийся изменением временной формы стента в заранее заданную постоянную форму.
(6) Формирование временной формы стента должно выполняться путем его нагревания выше температуры стеклования или плавления его дополнительного компонента, но ниже температуры стеклования или плавления его основного компонента и последующей резкой деформации до требуемой временной формы. Если дополнительный полимерный или олигомерный компонент представлен аморфной фазой, то после деформации изделие резко охлаждают до –20°С или ниже. Если этот компонент представлен кристаллизующимися полимерными или олигомерными цепями, то проводят отжиг при температуре кристаллизации для фиксации временной формы.
(7) Возможно изменение ранее заданной постоянной формы стента путем отжига деформированного до новой требуемой постоянной формы стента при температуре выше основной температуры стеклования, но ниже основной температуры плавления.
Как указано выше, молекулярная масса сополимера может составлять от 20 кДа до 600 кДа, предпочтительно от 100 кДа до 400 кДа. Нижняя граница молекулярной массы обусловлена необходимостью сохранения изделием механических характеристик в течение не менее 1 месяца с момента имплантации. Верхняя граница обусловлена высокой вязкостью расплава материала и связанных с этим технологических сложностей при экструзии заготовки стента. Другим фактором, ограничивающим верхнюю границу молекулярной массы, является слишком медленное разложение высокомолекулярного полимера (молекулярная масса материала стента постепенно снижается в процессе эксплуатации стента вследствие его биологического разложения в среде организма).
Индекс полидисперсности (PDI) сополимера должен составлять от 1,3 до 2,5, предпочтительно от 1,5 до 2,0. Диапазон допустимых значений индекса полидисперсности должен быть достаточно узким, чтобы обеспечить контролируемую деградацию стента. При значении PDI выше 2,5 имеющиеся в материале олигомерные фракции могут вызвать автоускорение деградации за счет повышенной концентрации кислотных групп. Это, в свою очередь, способно привести к преждевременной потере механических характеристик изделия. Ограничение значения PDI снизу связано с технологическими ограничениями для указанных выше материалов, в частности, значение PDI менее 1,3 труднодостижимо на практике.
Приведенные выше теоретические обоснования и описанные ниже практические эксперименты дают авторам изобретения основания утверждать, что реализация назначения стента и его заявленные характеристики достигаются во всем диапазоне указанных выше значений молекулярной массы полимера и индекса полидисперсности.
Температура стеклования основного компонента должна составлять не менее 37°С. При более низких значениях температуры стеклования стент будет функционировать в организме в условиях выше температуры стеклования, что повлечет за собой критическое снижение его механических характеристик. Предпочтительно, температура стеклования основного компонента должна составлять не менее 42°С для обеспечения механических характеристик стента при повышенной температуре организма в условиях интенсивного иммунного отклика.
На фиг. 4 представлено расположение характерных технологических точек и зон процесса изготовления стента на температурной шкале.
Модуль упругости материала при температуре 37°С должен составлять не менее 400 МПа. Предел прочности материала на разрыв при температуре 37°С должен составлять не менее 10 МПа. При более низких значениях указанных параметров стент не будет обладать удовлетворительными механическими характеристиками, т.е. он окажется неспособным поддерживать требуемый просвет сосуда.
Энтальпия плавления отожженного материала (для кристаллизующихся материалов) должна составлять не менее 20 Дж/г. Степень кристалличности напрямую связана с энтальпией плавления. Для обеспечения необходимых механических характеристик при функционировании в среде организма стент должен обладать частично кристалличной структурой. Поскольку стент функционирует при температуре, лишь незначительно ниже температуры стеклования материала, его аморфная часть находится в высокоэластическом состоянии и при недостаточной степени кристалличности его модуль упругости окажется недостаточно высоким для выполнения поддерживающей функции.
Технология изготовления
Технологический процесс изготовления стента состоит из ряда технологических операций (ТО). Далее в качестве примера описаны ТО, выполняемые при изготовлении стента наружным диаметром 10 мм в расширенном состоянии (постоянная форма) и 2,5 мм в сжатом состоянии (временная форма).
ТО-1: сушка материала. На вход подают гранулы полимерного материала, которые в ходе операции сушат в вакуумном шкафу при температуре 70°С в течение приблизительно 3 ч при давлении 0,1 Мпа. На выходе операции получают обезвоженные гранулы полимерного материала. Обезвоживание применяют для минимизации разрушения материала в процессе его обработки экструдером и, соответственно, для обеспечения указанных выше химических и физических характеристик материала.
ТО-2: экструзия. На вход подают обезвоженные гранулы полимерного материала, которые загружают в экструдер с фильерой для получения трубки. Без дополнительной обработки материал трубки на выходе из экструдера будет аморфным. Для получения частично кристалличной трубки проводят ее отжиг, т.е. выдерживают ее при температуре выше 100°С в течение 15–60 минут. Стадия отжига может выполняться в непрерывном режиме, например, путем ее пропускания через длинный нагреватель, или в прерывистом режиме, например, путем загрузки партии экструдированной трубки в нагреватель. Также возможно использование фильер специальной конструкции, позволяющих выполнять ориентирование молекул материала с одновременной кристаллизацией трубки. Чем выше степень кристалличности материала стента после отжига, тем выше его механические свойства после восстановления формы. На выходе операции получают частично кристалличную трубку требуемого диаметра.
Экструзия трубки может быть заменена напылением материала на основу с последующим съемом образованной трубки. Также возможно получение трубки путем периодического окунания основы в расплав материала с последующим отверждением. Относительно большие изделия можно получать посредством горячего прессования, литьем в пресс-автоматах или осаждением специальной смеси в ротационных машинах. В некоторых случаях для формирования трубки возможно применение блоу-стретчинга при температуре выше основной температуры стеклования, но ниже основной температуры плавления.
Обычные (статические) экструзионные головки обеспечивают продольную ориентацию молекул материала трубки в силу своего принципа действия. В [21] предложено обеспечивать продольно-радиальную (под углом порядка 30° к продольной оси трубки) ориентацию молекул за счет расширяющейся конусной конструкции фильеры. На фиг 5. показана обобщенная схема технологического процесса согласно [21]. По мнению авторов данного изобретения, такое решение не способно существенно улучшить механические характеристики стента в месте его применения.
Для улучшения механических характеристик стента в настоящем изобретении предусмотрена иная ориентация молекул материала трубки. В иллюстративном варианте осуществления изобретения предусмотрена их спиральная ориентация, обеспечиваемая за счет вращательного движения экструзионной головки в процессе экструзии. При достаточно большом отношении числа оборотов экструзионной головки к продольной скорости экструзии возможно получить спираль с малым шагом, т.е. добиться по существу круговой ориентации молекул материала трубки в ее поперечном сечении, как показано на фиг. 6. Такая ориентация молекул позволяет значительно увеличить радиальное усилие, развиваемое стентом при его установке, и радиальное давление, которое стент способен воспринимать при эксплуатации без заметного сужения просвета сосуда, в котором он установлен, по сравнению с продольной или с продольно-радиальной ориентацией, известной из уровня техники.
ТО-3: лазерная резка. На вход подают частично кристалличную трубку требуемого диаметра, например, 10 мм, которую подвергают лазерной резке с получением ажурной стенки с ячейкой закрытого типа, например, согласно фиг. 1, и нарезают на отрезки требуемой длины. Далее стент промывают в воде и/или в спирте и/или в ином подходящем растворителе для удаления технологических загрязнений и отходов материала на поверхности и сушат, например, в вакуумном шкафу. На выходе операции получают стент по существу того же диаметра, соответствующего постоянной форме стента, к которой тот будет возвращаться за счет эффекта памяти формы при нагревании до приблизительно 37°С.
ТО-4: кримпинг, ТО-5: стерилизация, ТО-6: упаковка, ТО-7: маркировка. На вход подают стент требуемого диаметра, например, 10 мм, который помещают в установку, позволяющую выполнить его обжатие равномерно по всей наружной поверхности («диафрагменные тиски»). Кримпинг стента производят путем его нагревания до 50–60°С и резкого сжатия до диаметра, соответствующего диаметру средства доставки. После кримпинга сжатый стент немедленно вводят в доставочное устройство (катетер), после чего резко охлаждают до температуры приблизительно –20°С или ниже, подвергают стерилизации, например, радиационной (гамма- или бета-излучением) или химической (этиленоксидом) или плазменной (низкотемпературной плазмой H2O2), герметично упаковывают, надлежащим образом маркируют и помещают для хранения в морозильную камеру, которой поддерживают температуру приблизительно –20°С.
Важно обеспечить резкое (не более чем за 30 секунд) охлаждение стента после кримпинга, в противном случае релаксация полимерных цепей при более медленном охлаждении может привести к существенному снижению эффекта памяти формы и, соответственно, к уменьшению допустимой радиальной нагрузки стента при его эксплуатации.
Технология применения
Предоперационная подготовка. Перед операцией следует использовать неинвазивные методы обследования, позволяющие определять степень стеноза, например, цветное дуплексное сканирование брахиоцефальных артерий и/или спиральную компьютерную томографию в ангиографическом режиме. При этом важно иметь данные о состоянии всех экстракраниальных сосудов (ветвей дуги аорты) и виллизиева круга. Помимо этого, необходимо проводить тщательный неврологический осмотр, а также компьютерную томографию и/или МРТ-исследование головного мозга, чтобы оценить динамику изменений после операции. У больных с тяжелыми сопутствующими заболеваниями необходимо дополнительно обследовать органы и системы (ЭКГ, ЭхоКГ, консультация терапевта и т.д.). За 2–3 дня до операции пациентам целесообразно назначать антиагреганты (например, клопидогрел по 75 мг в день).
Методика проведения. Операцию осуществляют под местной анестезией с внутривенной седацией. Это позволяет проводить мониторинг неврологического статуса на протяжении всей операции. Для контроля динамики линейной скорости кровотока по средней мозговой артерии, а также для контроля прохождения микроэмболов операцию необходимо проводить при доплерографическом мониторинге. Окончательное суждение о степени стеноза можно вынести после получения ангиографических данных.
В большинстве случаев используют трансфеморальный доступ, и только при наличии причин, препятствующих этому доступу, можно использовать иной (через лучевую или подмышечную артерии). Непосредственно после пункции артерии внутривенно вводят 5000 ед. гепарина (далее каждые 40–60 мин гепарин вводят повторно, контролируя активированное время свертывания). Селективная ангиография ветвей дуги аорты позволяет выявить мультифокальные поражения подвздошных артерий и наметить (или изменить) тактику лечения.
Стентирование. В некоторых случаях возникает необходимость в проведении предварительной дилатации артерии (раздувание баллона на уровне стеноза перед имплантацией стента). Она показана при выраженном сужении сосуда, когда введение системы доставки стента не представляется возможным.
Следующий этап – доставка и имплантация стента. Стенты практически не подвержены деформации и оказывают постоянное радиальное давление на стенку сосуда после имплантации. Стент позиционируют таким образом, чтобы дистальная и проксимальная его части перекрывали зону стеноза не менее чем на 5 мм. Сразу после имплантации проводят контрольную ангиографию, позволяющую определить степень остаточного стеноза. В большинстве случаев радиального усилия, развиваемого стентом согласно настоящему изобретению, достаточно для обеспечения требуемого просвета сосуда. Дополнительная дилатация (раздувание баллона внутри имплантированного стента) показана в тех случаях, когда степень остаточного стеноза превышает 30%. После завершения стентирования с помощью специального устройства извлекают фильтр-ловушку, если она была установлена. После извлечения фильтра проводят контрольную ангиографию.
Подтверждение возможности достижения технического результата
Для подтверждения возможности достижения технического результата авторами настоящего изобретения были выполнены теоретические расчеты с компьютерным моделированием и практические эксперименты.
Моделирование кримпинга и оценка механических свойств стента
На фиг. 7 представлена модель кольцевого элемента эндоваскулярного стента со следующими геометрическими параметрами: толщина страт – 400 мкм, ширина страт – 350 мкм, длина кольцевого элемента – 10,7 мм, внутренний диаметр – 10 мм, тип ячеек рисунка страт – представленный на фиг. 1.
Следует отметить, что длина стента не ограничена длиной кольцевого элемента. Стент может состоять из несколько кольцевых элементов, составляющих единое целое. Предпочтительно, нарезку стентов по длине выполняют кратно длине кольцевого элемента, но при необходимости нарезка может выполняться в любом месте.
Для снижения вычислительной нагрузки при численном решении задачи моделирования в расчетах был использован сегмент кольцевого элемента и соответствующий ему сегмент кримпера величиной 120°, как представленно на фиг. 8. В моделировании применялся программный пакет ANSYS, основанный на методе конечных элементов. Для определения оптимального размера конечных элементов (КЭ) был проведен тест (Mesh Independence Test), по результатам которого размер КЭ стента был выбран равным 0,07 мм, а размер КЭ кримпера – 0,1 мм.
Моделирование предварительного обжатия стента выполнялось путем радиального перемещения внешней поверхности кримпера. На кромки накладывались граничные условия с учетом симметрии модели. Для исключения смещения тела стента как жесткого целого на внешнюю поверхность стента дополнительно накладывалось ограничение перемещения в направлении окружности. В расчетах использовалась конечно-элементная модель материала стента (фиг. 9), полученная на основе диаграммы одноосного растяжения при 50°С (фиг. 10). Сходимость решения контролировалась по силе и перемещению. Для описания больших перемещений элементов использовалась функция Large Deformations.
На фиг. 11 представлены стадии процесса кримпинга стента с начальным внутренним диаметром 10 мм и конечным внутренним диаметром 2,5 мм. Анализ механических напряжений, возникающих в стенте при кримпинге с указанными выше параметрами, показал, что зависимость этих напряжений сохраняет линейный характер вплоть до радиального смещения при обжатии, приблизительно равного 3,75 мм, что соответствует конечному диаметру стента 10 – 2×3,75 = 2,5 мм (фиг. 12), при этом деформации не превышают допустимых значений, что обеспечивает отсутствие трещин в материале стента. Дальнейшее обжатие затруднено контактом страт между собой и может привести к разрушению стента в процессе производства либо к чрезмерно быстрой деградации стента в среде организма. Тем не менее, анализ, проведенный авторами изобретения, показал, что путем доработки формы страт возможно обеспечить уменьшение допустимого внутреннего диаметра до 2,0 мм.
Выводы на основе моделирования
Для обеспечения кримпинга стента на доставочное устройство с внешним диаметром 2 мм необходимо уменьшить длину ячейки. Это позволит увеличить радиальную жесткость конструкции и обеспечить плотное прилегание ламелей к поверхности доставочного устройства. Анализ напряженно-деформированного состояния конструкции стента показывает, что возникающие напряжения и деформации не превосходят критических, что исключает образование трещин в потенциально опасных зонах. Высокая пластичность материала при температуре 50°С позволяет деформировать стент без возникновения в изделии чрезмерных усилий, которые могли бы привести к его разрушению или ухудшению эксплуатационных характеристик. Значения радиального усилия (не менее 0,05 Н при внутреннем диаметре 2,5 мм) обусловлено механическими свойствами материала при температуре 50°C и особенностями деформационного поведения стента.
В целом, моделирование показало, что изменение диаметра стента в пять раз при кримпинге не должно сопровождаться возникновением трещин и иных дефектов в материале стента. При этом фактическая степень сжатия стента зависит от ряда факторов, в частности, от начального диаметра стента. Например, для стентов малого диаметра (для мелких сосудов) изменение диаметра стента при кримпинге может составлять четыре или три, в зависимости от вида и характеристик системы доставки стента.
Экспериментальные исследования
Молекулярно-массовые характеристики полимера определяли методом гель-проникающей хроматографии на аналитическом хроматографе Knauer, снабженном дегазатором, насосом, термостатом и рефрактометрическим детектором. Пробу растворяли в тетрагидрофуране со степенью чистоты «для ВЭЖХ» и инжектировали в хроматографическую систему. В качестве элюента использовали тетрагидрофуран со степенью чистоты «для ВЭЖХ» при скорости потока 1 мл/мин. Колонку Agilent PLgel с размером пор 105 Å и размером частиц 5 мкм термостатировали при 40°С, калибровку проводили по полистирольным стандартам.
Химический состав материала исследовали методом ядерного магнитного резонанса на ядрах 1H. Пробу растворяли в дейтерированном хлороформе. По интегральной интенсивности сигналов на ЯМР-спектре рассчитывали химический состав полимерного материала. Исследование физико-механических характеристик материалов и изделий проводили на испытательной машине Instron.
Для исследования деградации полимера в фосфатном буфере при 37°С использовали прямоугольные пластины размером 55×10×1 мм из сополимера L-лактида и ε-капролактона с начальной молекулярной массой приблизительно равной 140 кДа. Результат эксперимента приведен на фиг. 13. Из него видно, что молекулярная масса быстро снижалась в первые 50 дней с начального значения до приблизительно 20 кДа, затем деградация заметно замедлялась. В целом характер зависимости степени деградации от времени носил приблизительно экспоненциальный характер.
Для исследования зависимости механических характеристик полимера от температуры использовали прямоугольные пластины размером 55×10×1 мм из сополимера L-лактида и ε-капролактона при прогибе величиной 10 мм. Результаты эксперимента, приведенные на фиг. 14 (деформационные кривые при различных температурах) и фиг. 15 (значения модуля упругости), показывают, что величина нагрузки, требуемой для прогиба 10 мм, при температуре 37°С существенно ниже нагрузки при температуре 22°С и несколько выше нагрузки при температуре 45°С, а модуль упругости материала резко снижается с приблизительно 2985 МПа при температуре 22°С до приблизительно 664 МПа при температуре 37°С и далее до приблизительно 281 МПа при температуре 45°С.
Для исследования эффекта памяти формы использовали образцы, аналогичные описанным выше. Образец поместили в испытательную камеру, предварительно разогретую до температуры 45°С, и выдержали в течение 5 минут. Затем образец деформировали со скоростью 100 мм/мин до получения прогиба величиной 10 мм (фиг. 16А, 16Б), резко охладили жидким азотом и извлекли из камеры.
После этого образец поместили в условия комнатной температуры и наблюдали изменение остаточной деформации во времени. На фиг. 16В представлен образец сразу после охлаждения (его длина составила приблизительно 45 мм), а на фиг. 16Г представлен образец спустя 1,5 часа (его длина составила приблизительно 50 мм). Этот результат указывает на достаточно стабильную форму деформированного образца при комнатной температуре (приблизительно 22°С).
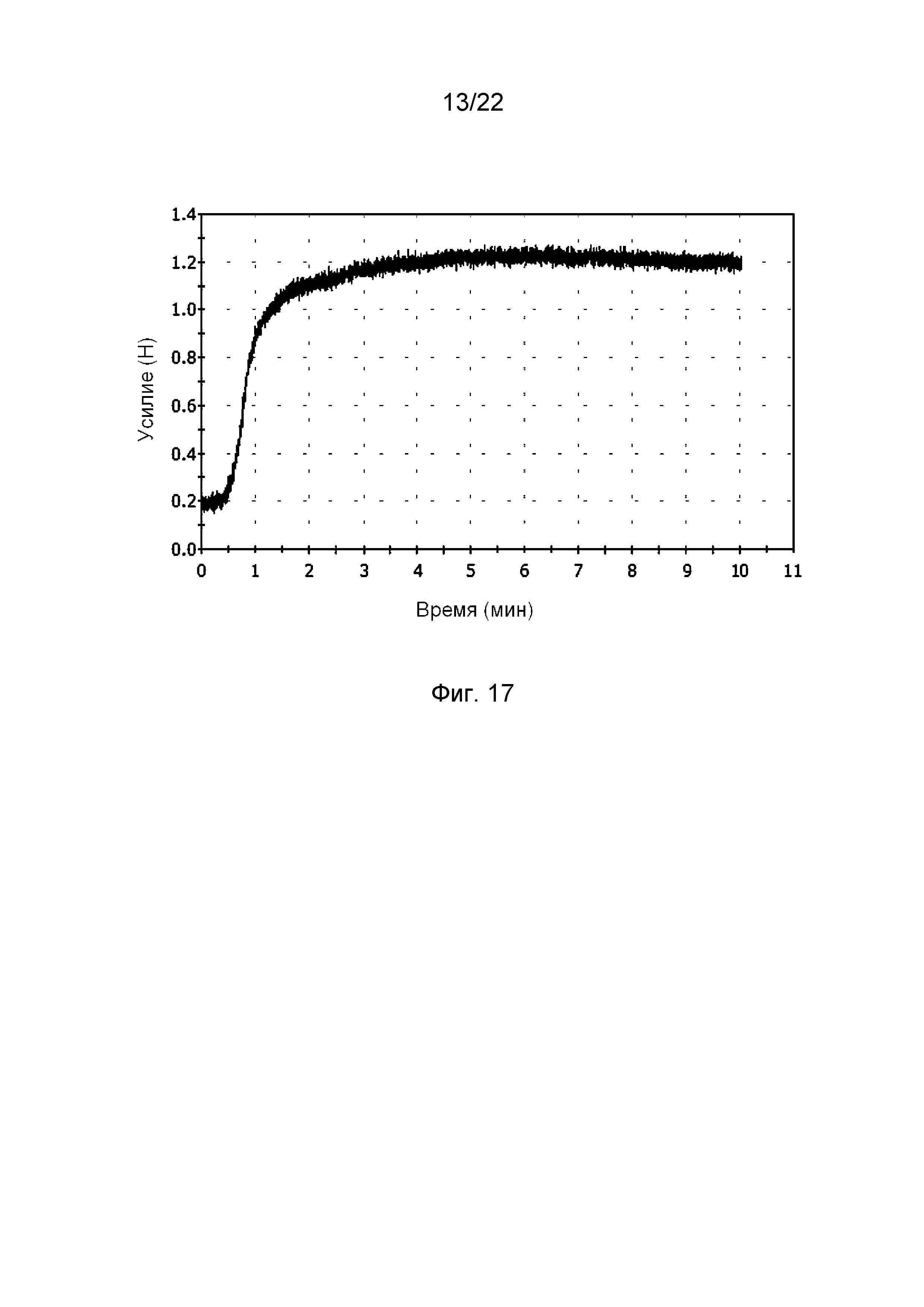
Далее изучали изменение механических свойств образца во времени в ходе повышения температуры до 37°С. Для этого после выдерживания образца при комнатной температуре его поместили в испытательную камеру, установив в ней температуру 22°С, и обеспечили нагрузку, приблизительно равную 0,2 Н, на центральную часть образца, как показано на фиг. 16Б. Затем задали нагрев камеры до 37°С и регистрировали изменение силы сопротивления образца при постоянной деформации. Результат измерения представлен на фиг. 17. Он показывает, что на участке от 0 до 1 минуты в ходе разогрева камеры со скоростью приблизительно 15°С/мин сила сопротивления быстро нарастала вследствие проявления эффекта памяти формы, на участке от 1 до 4 минуты наблюдался переходный процесс с замедлением роста силы сопротивления, а на участке от 4 до 10 минуты в по существу изотермических условиях (температура приблизительно 37°С) сила сопротивления оставалась почти неизменной.
Далее изучали механические свойства образца при повышении температуры до 40°С. При изменении температуры от 22°С до 40°С сила сопротивления монотонно росла в диапазоне от приблизительно 30°С до приблизительно 40°С (фиг. 18). Высота столбцов на диаграмме отражает изменение нагрузки в пределах одного градуса. Это испытание провели 2 раза на разных образцах и, как видно из графика на фиг. 18, их результаты оказались очень близкими.
После снятия нагрузки и выдерживания в течение 3 минут при температуре 37°С наблюдали почти полное восстановление первоначальной формы образца (фиг. 16Д).
Выводы на основе экспериментов
А. При уменьшении молекулярной массы материала до 1 кДа и менее материал становится растворимым в воде и метаболизируется организмом через цикл Кребса. Оценочный срок полного рассасывания сополимера составляет 300 дней. Оценочный срок сохранения механической прочности в среде организма составляет 2–3 месяца.
Б. Максимальное напряжение образца при испытаниях на изгиб при температуре тела составило 17,5 МПа, а модуль упругости – 664 МПа, что позволяет предположить приемлемые механические характеристики у стента, изготовленного по предложенной технологии.
В. Образцы из сополимера способны сохранять временную (согнутую) форму при комнатной температуре и реагировать на нагревание. При этом восстановление формы начинается с приблизительно 31°С. Возникающее при этом усилие практически не снижается после 10 мин выдерживания при температуре 37°С.
Примеры практической реализации
Для подтверждения на практике приведенных выше теоретических обоснований возможности достижения технического результата был изготовлен периферический стент цилиндрической формы длиной 53 мм и наружным диаметром 10 мм в раскрытом состоянии с рисунком страт, представленным на фиг.1.
Состав материала контролировали описанным выше способом, который дал следующие результаты: материал – поли(L,L-лакдид-ко-ε-капролактон) с молярным соотношением L,L-лакдид: 68,5%, ε-капролактон: 31,5%; средняя молекулярная масса не менее 200 кДа, индекс полидисперсности 2,0. Перед переработкой материал сушили при 70°С в течение 3 ч в вакуумном шкафу.
Материал загрузили в экструдер Minilab производства «Haake» с соответствующей фильерой и при температуре 200°С в соответствии с инструкцией производителя экструдера получили на выходе аморфную трубку наружным диаметром 10 мм. Для получения частично кристалличной трубки провели ее отжиг при температуре 110°С и давлении 0,1 МПа в течение 20 мин.
Частично кристалличную трубку подвергли лазерной резке в соответствии с вариантом рисунка ажурной сетки, описанным выше, и нарезали на отрезки длиной 53 мм, получив отдельные стенты. После резки стенты промыли в воде и этиловом спирте для удаления возможных загрязнений и высушили в вакуумном шкафу при температуре +40°С в течение 20 мин.
Для придания временной (сжатой) формы и упаковки стента в катетер каждый стент помещали в установку для кримпинга типа «диафрагменные тиски». Кримпинг проводили путем нагревания стента до 50°С и резкого сжимания до 2 мм наружного диаметра. После кримпинга сжатый стент немедленно вводили в доставочное устройство (катетер), затем резко охлаждали до –20°С, герметично упаковывали, помещали в морозильную камеру и далее хранили до применения при температуре от –20°С до –25°С. Стерилизацию проводили гамма-облучением, доза 25 кГр, после упаковки.
Измерение характеристик стентов опытной партии дало следующие результаты:
- наружный диаметр в сжатом состоянии: 2,1±0,1 мм;
- наружный диаметр в раскрытом состоянии: 9,8±0,5 мм;
- ширина страт 350±50 мкм;
- толщина страт 400±5 мкм;
- время раскрытия стента до 80% от исходного диаметра при 37°С: 3 минуты;
- время полного раскрытия стента при +37°С: 15 минут;
- модуль упругости при температуре 37°С: не менее 540 МПа;
- срок сохранения механических характеристик стента на уровне не менее 70% исходных значений – 80 суток;
- срок полного рассасывания стента – от 300 до 500 суток.
На фиг. 19 представлен другой вариант рисунка страт стенки стента в развернутом виде. Как и в варианте на фиг. 1, стенка стента также образована ячеистой структурой закрытого типа, но иной конструкции. Ячейка в этом варианте имеет более сложную форму, которая крупно показана на фиг. 20. Ячейка в состоянии до кримпинга может быть представлена набором страт, соединенных между собой под углами α, β, γ. Страты могут иметь скругления радиусом R1–R9, как показано на фиг. 21.
Такая конструкция ячейки позволяет снизить напряжения, возникающие в стратах при кримпинге, и в то же время уменьшить турбулизацию потока крови без снижения радиальной жесткости стента в раскрытом состоянии. Ячейки подобной формы позволяют обеспечить баланс между высокой радиальной жесткостью, упругостью и гибкостью стента.
Ширина страт стента может составлять от 0,01 мм до 1 мм, а их толщина – от 0,02 мм до 0,5 мм, в зависимости от диаметра стента. Характеристический угол α связан с углами β и γ соотношением
и его величина зависит от диаметра стента и ширины страт. В примере, представленном на фиг. 21, значения этих углов составляют: α = γ = 110°, β = 90°. Радиусы R1–R9 скруглений могут составлять от 0,025 мм до 1 мм. Величины этих радиусов в конкретных вариантах осуществления изобретения зависят от геометрических размеров элементов стента, в частности от ширины страт. Например, R2 = R1+ W, где W – ширина страты в месте закругления, при этом величина R1 также коррелирует с W. Величины радиусов R1, R3, R4, R5, R7 и R9, а также R2 и R8 могут быть по существу одинаковыми или достаточно близкими (в пределах технологического разброса).
На фиг. 19–21 показаны страты с прямоугольными участками между скруглениями. Тем не менее, эти участки могут быть криволинейными или представлять собой сочетание прямолинейных и криволинейных участков.
Как и в варианте на фиг. 1, страты согласно фиг. 19 могут иметь увеличенную ширину в местах наибольших механических напряжений, возникающих при изготовлении и/или в ходе эксплуатации стента. Страты также могут иметь уменьшенную толщину и/или отверстия в местах наименьших механических напряжений, возникающих при изготовлении и/или в ходе эксплуатации стента.
Опытные образцы стентов с рисунком страт согласно фиг. 19 были подвергнуты испытаниям, результаты которых приведены далее со ссылкой на фиг. 22–26. Технология изготовления образцов по существу совпадает с описанной выше.
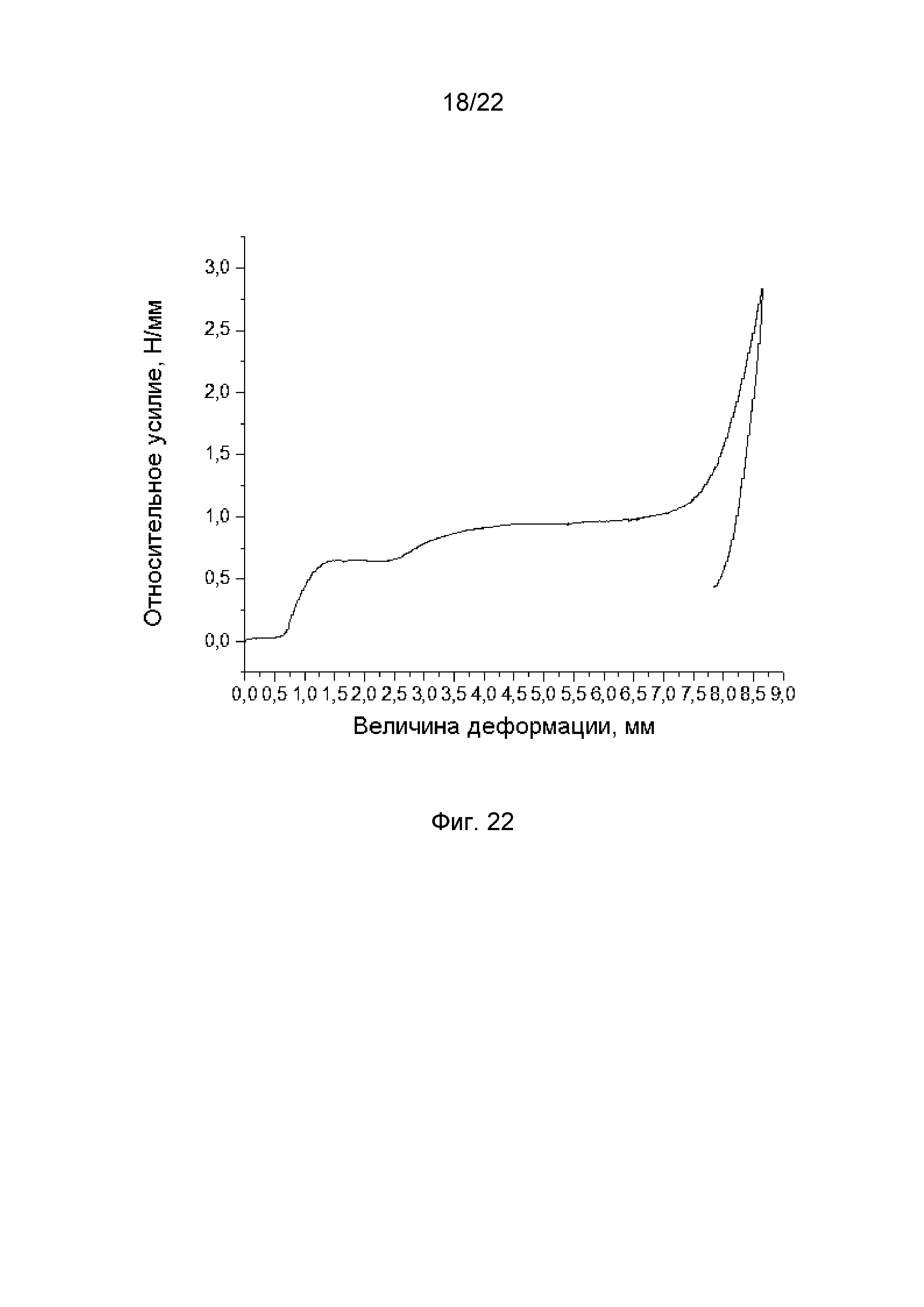
Образец 1У: наружный диаметр до деформации 10,0 мм, наружный диаметр после деформации 7,6 мм, длина до деформации 20,2 мм, длина после деформации 25,0 мм, количество ячеек – 5, ширина страт 0,2 мм, материал стента отжигался. Образец подвергли сжатию до наружного диаметра 2,3 мм по диаметру при температуре 36,6°С со скоростью деформации 1 мм/мин. Выдержали 10 секунд и произвели снятие нагрузки с той же скоростью. График зависимости удельной радиальной силы при сопротивлении внешней нагрузке от линейной деформации при температуре 36,6°С представлен на фиг. 22.
Образец 2У: наружный диаметр до деформации 10,2 мм, наружный диаметр после деформации 7,7 мм, длина до деформации 20,4 мм, длина после деформации 25,4 мм, количество ячеек – 5, ширина страт 0,2 мм, материал стента отжигался. Образец подвергли сжатию до наружного диаметра 2,3 мм по диаметру при температуре 36,6°С со скоростью деформации 1 мм/мин. Выдержали 10 секунд и произвели снятие нагрузки с той же скоростью. График зависимости удельной радиальной силы при сопротивлении внешней нагрузке от линейной деформации при температуре 36,6°С представлен на фиг. 23.
Образец 3У: наружный диаметр до деформации 10,0 мм, наружный диаметр после деформации 6,0 мм, длина до деформации 22,5 мм, длина после деформации 26,2 мм, количество ячеек – 5, ширина страт 0,2 мм, материал стента не отжигался. Образец подвергли сжатию до наружного диаметра 2,3 мм по диаметру при температуре 36,6°С со скоростью деформации 1 мм/мин. Выдержали 10 секунд и произвели снятие нагрузки с той же скоростью. График зависимости удельной радиальной силы при сопротивлении внешней нагрузке от линейной деформации при температуре 36,6°С представлен на фиг. 24.
Образец 4У: cтент, аналогичный образцу 2У, подвергли кримпингу: прогрели в течение 10 минут при температуре 50°С, сжали его со скоростью 1000 мм/мин (максимально возможная скорость) и охладили в жидком азоте в течение 10 минут. Перед испытаниями стенту дали раскрыться и выдержали при температуре 36,6°С до стабилизации формы. Наружный диаметр до деформации 8,5 мм, наружный диаметр после деформации 8,2 мм, длина до деформации 24,2 мм, длина после деформации 24,5 мм, количество ячеек – 5, ширина страт 0,2 мм, материал стента отжигался. Образец подвергли сжатию до наружного диаметра 2,3 мм по диаметру при температуре 36,6°С со скоростью деформации 1 мм/мин. Выдержали 10 секунд и произвели снятие нагрузки с той же скоростью. График зависимости удельной радиальной силы при сопротивлении внешней нагрузке от линейной деформации при температуре 36,6°С представлен на фиг. 25.
На фиг. 26 представлен график зависимости удельной радиальной силы от внешнего диаметра стента для стентов с рисутком страт согласно фиг. 1 и согласно фиг. 19. Для сравнения приведен также аналогичный график для лучшего в своем классе металлического стента Niti Stent Cordis (Smart) диаметром в исходном состоянии 5,0 мм и длиной 35,0 мм. Следует обратить внимание на сопоставимые показатели подвергнутого кримпингу полименного стента согласно изобретению (образец 4У) и металлического стента (Cordis) в среднем диапазоне диаметров (4,2–4,6 мм) и на существенно лучшие показатели этого полименного стента в диапазоне бόльших диаметров (4,6–5 мм).
Указанные выше результаты экспериментов указывают на возможность дальнейшего улучшения механических характеристик стента согласно изобретению за счет совершенствования рисунка закрытоячеистой структуры стенки стента. Это подтверждает возможность достижения изобретением заявленного технического результата.
Таким образом, технология согласно данному изобретению позволяет создавать биоразлагаемые полимерные стенты для периферических, коронарных и церебральных артерий и вен, бифуркационные стенты, стент-графты, стенты для билиарной системы и пищевода, а также кава-фильтры.
Возможные направления совершенствования изобретения
Дальнейшее улучшение характеристик стента согласно данному изобретению возможно путем оптимизации молекулярной и надмолекулярной структуры материала, что может обеспечить ускорение расширения стента в месте его установки и повышение его нагрузочной способности. Кроме того, возможно применение покрытий, обеспечивающих уменьшение скорости деградации материала стента в течение первых недель после его установки в организме, например, гидрофобных покрытий, ограничивающих контакт материала стента с водой. Такие покрытия позволяют придать кривой деградации полимера (фиг. 13) ступенчатую форму с более плоским участком в начале этой кривой.
Следует отметить, что последовательность действий, описанная в иллюстративном варианте осуществления изобретения, может быть иной в других вариантах осуществления. Например, стерилизация готового стента может выполняться до его упаковки или после нее, в зависимости от применяемого способа стерилизации. Нарезка заготовки стента на отрезки может выполняться до лазерной резки, после лазерной резки до кримпинга или после кримпинга, в зависимости от размеров стента и/или технологических возможностей производителя. Таким образом, последовательность действий в описании способа носит иллюстративный характер и в различных вариантах осуществления изобретения эта последовательность может отличаться от описанной при условии сохранения выполняемой функции и достигаемого результата.
Следует также отметить, что в приведенном выше описании отражены лишь те действия, которые наиболее существенны для достижения цели изобретения. Специалисту понятно, что для получения требуемого результата следует выполнить и другие необходимые действия, определяемые технологией изготовления и/или применения стента согласно изобретению.
Части и признаки настоящего изобретения могут сочетаться в различных вариантах осуществления изобретения, в той степени, в которой они не противоречат друг другу. Описанные выше варианты осуществления изобретения приведены исключительно с иллюстративной целью и не предназначены для ограничения объема настоящего изобретения, определяемого формулой изобретения. Все разумные модификации, модернизации и эквивалентные замены в конструкции, составе и принципе действия, выполненные в пределах сущности настоящего изобретения, входят в объем настоящего изобретения.
Список непатентной литературы
1. Liang Xue, Shiyao Dai, Zhi Li. Biodegradable shape-memory block co-polymers for fast self-expandable stents. DOI: 10.1016/j.biomaterials.2010.07.043
2. Koji Nagahama, Yuichi Ueda, Tatsuro Ouchi, Yuichi Ohya. Biodegradable Shape-Memory Polymers Exhibiting Sharp Thermal Transitions and Controlled Drug Release. DOI: 10.1021/bm9002078
3. Christopher Michael Yakacki, Robin Shandas, Craig Lanning, Bryan Rech, Alex Eckstein, Ken Gall. Unconstrained recovery characterization of shape-memory polymer networks for cardiovascular applications. DOI: 10.1016/j.biomaterials.2007.01.030
4. Debdatta Ratna, J. Karger-Kocsis. Recent advances in shape memory polymers and composites: a review. DOI: 10.1007/s10853.007.2176.7
5. Maria Balk, Marc Behl, Christian Wischke, Jörg Zotzmann, Andreas Lendlein. Recent advances in degradable lactide-based shape-memory polymers. DOI: 10.1016/j.addr.2016.05.012
6. Subbu S Venkatraman, Lay Poh Tan, Joe Ferry D Joso, Yin Chiang Freddy Boey, Xintong Wang. Biodegradable stents with elastic memory. DOI: 10.1016/j.biomaterials.2005.09.002
7. Andreas Lendlein, Jörg Zotzmann, Yakai Feng, Armin Alteheld, Steffen Kelch. Controlling the switching temperature of biodegradable, amorphous, shape-memory poly(rac-lactide)urethane networks by incorporation of different comonomers. DOI: 10.1021/bm900038e
8. Peng Ping, Wenshou Wang, Xuesi Chen, Xiabin Jing. Poly(ε-caprolactone) polyurethane and its shape-memory property. DOI: 10.1021/bm049477j
9. Mei-Chin Chen, Hung-Wen Tsai, Yen Chang, Wei-Yun Lai, Fwu-Long Mi, Chin-Tang Liu, Hen-Sheng Wong, Hsing-Wen Sung. Rapidly Self-Expandable Polymeric Stents with a Shape-Memory Property. DOI: 10.1021/bm7004615
10. Elisa Zini, Mariastella Scandola, Piotr Dobrzynski, Janusz Kasperczyk, Maciej Bero. Shape memory behavior of novel (l-lactide-glycolide-trimethylene carbonate) terpolymers. DOI: 10.1021/bm700773s
11. Ward Small, Pooja Singhal, Thomas S. Wilsona, Duncan J. Maitland. Biomedical applications of thermally activated shape memory polymers. DOI: 10.1039/B923717H
12. Sabine Neuss, Iris Blomenkamp, Rebekah Stainforth, Dagmar Boltersdorf, Marc Jansen, Nick Butz, Alberto Perez-Bouza, Ruth Knüchel. The use of a shape-memory poly(ε-caprolactone)dimethacrylate network as a tissue engineering scaffold. DOI: 10.1016/j.biomaterials.2008.12.027
13. Changchun Min, Wenjin Cui, Jianzhong Bei, Shenguo Wang. Effect of comonomer on thermal/mechanical and shape memory property of L-lactide-based shape-memory copolymers. DOI: 10.1002/pat.865
14. Chien-Shen Yang, Hsi-Chin Wu, Jui-Sheng Sun, Hao-Ming Hsiao, Tzu-Wei Wang. Thermo-induced shape-memory peg-pcl copolymer as a dual-drug-eluting biodegradable stent. DOI: 10.1021/am4032295
15. Xiongjun Yu, Lin Wang, Maotao Huang, Tao Gong, Wenbing Li, Yaling Cao, Daijin Ji, Ping Wang, Jing Wang, Shaobing Zhou. A shape memory stent of poly(ε-caprolactone-co-DL-lactide) copolymer for potential treatment of esophageal stenosis. DOI: 10.1007/s10856.011.4475.4
16. Wolfgang Wagermaier, Thomas Zander, Dieter Hofmann, Karl Kratz, U. Narendra Kumar, Andreas Lendlein. In situ x-ray scattering studies of poly(ε-caprolactone) networks with grafted poly(ethylene glycol) chains to investigate structural changes during dual- and triple-shape effect. DOI: 10.1002/marc.201000122
17. Christopher M. Yakacki, Ken Gall. Shape-Memory Polymers for Biomedical Applications. DOI: 10.1007/12.2009.23
18. Y. S. Wong, Y. Xiong, S. S. Venkatraman. Shape memory in un-cross-linked biodegradable polymers. DOI: 10.1163/156856208783432516
19. Liang Xue, Shiyao Dai, Zhi Li. Synthesis and characterization of elastic star shape-memory polymers as self-expandable drug-eluting stents. DOI: 10.1039/C2JM15918J
20. Yu Xiao, Lin Wang, Xiaotong Zheng, Tao Gong. Crosslinked poly(ε-caprolactone)/poly(sebacic anhydride) composites combining biodegradation, controlled drug release and shape memory effect. DOI: 10.1016/j.compositesb.2010.07.001
21. Bioresorbable Scaffolds. From Basic Concept to Clinical Application. Edited by Yoshinobu Onuma & Patrick W.J.C. Serruys. CRC Press, 2017. ISBN 9781498779746
Реферат
Группа изобретений относится к области медицинской техники, а именно к биоразлагаемым эндоваскулярным стентам с памятью формы, которые могут быть установлены без применения расширяющего баллона или иных расширяющих средств, и способам их изготовления. Биоразлагаемый саморасширяющийся стент, изготовленный из полимера, в котором страты образуют закрытоячеистую структуру и соотношение внутреннего диаметра стента в состоянии до кримпинга и после кримпинга составляет от 3 до 5. Способ изготовления биоразлагаемого саморасширяющегося стента, включает в себя следующие стадии: экструдируют трубку из полимерного материала; выполняют отжиг экструдированной полимерной трубки; выполняют лазерную резку экструдированной полимерной трубки с получением заготовки стента, в которой страты образуют закрытоячеистую структуру; выполняют нагревание заготовки стента до температуры выше температуры стеклования полимерного материала и резкое обжатие равномерно по всей наружной поверхности с последующим быстрым охлаждением так, что соотношение внутреннего диаметра стента в состоянии до обжатия и после обжатия составляет от 3 до 5; помещают охлажденный стент на/в средство доставки; выполняют упаковку, маркировку и стерилизацию. Технический результат, достигаемый заявленной группой изобретений, заключается в обеспечении возможности изготовления линейки биоразлагаемых стентов различного размера с памятью формы и улучшенным соотношением механических, биохимических и технологических характеристик, конструкция и технология изготовления которых пригодны для серийного промышленного производства. 2 н. и 20 з.п. ф-лы, 26 ил.

Комментарии