Противогрибковые агенты - RU2727520C2
Код документа: RU2727520C2
Чертежи







Описание
Область, к которой относится изобретение
Настоящее изобретение относится к пиррольным соединениям, комбинациям и композициям, содержащим пиррольное соединение и дополнительный противогрибковый агент, и их терапевтическому применению в предотвращении или лечении грибковых заболеваний. Оно также относится к применению соединения, комбинаций и композиций в качестве сельскохозяйственных фунгицидов
Область техники изобретения
Инвазивные грибковые инфекции хорошо известны как болезни иммунокомпрометированного хозяина. За последние двадцать лет наблюдалось значительное увеличение количества зарегистрированных случаев грибковой инфекции. Частично это связано с повышением осведомленности и улучшением диагностики грибковой инфекции. Однако основной причиной этого увеличения заболеваемости является значительное увеличение числа восприимчивых лиц. Это связано с рядом факторов, включая новые и агрессивные иммунодепрессанты, повышенную выживаемость в условиях интенсивной терапии, увеличение количества процедур трансплантации и более широкое использование антибиотиков во всем мире.
В некоторых группах пациентов грибковая инфекция встречается с высокой частотой; реципиенты трансплантатов легких обладают частотой до 20% колонизации и инфицирования грибковым организмом, а грибковая инфекция у реципиентов аллогенных гемопоэтических стволовых клеток достигает 15% (Ribaud et al., 1999, Clin Infect Dis. 28:322-30).
В последнее время наблюдается повышенная осведомленность о вкладе грибковой сенсибилизации, колонизации, аллергии и локализованной инфекции в обострение существующих респираторных заболеваний. Здесь грибы участвуют в астме, ХОБЛ, брохоэктазе и кистозном фиброзе. Аллергический бронхолегочный аспергиллез (АВРА) - это состояние нижних дыхательных путей, вызванное колонизацией грибов, обычно Apsergillus fumigatus. АВРА можно увидеть у астматиков с частотой 0,7-3,5% и у болеющих кистозным фиброзом с частотой 7-9%.
В настоящее время существует четыре класса противогрибковых препаратов для лечения системных грибковых инфекций. Это полиены (например, амфотерицин В), азолы (например, кетоконазол или итраконазол), эхинокандины (например, каспофунгин) и флуцитозин.
Полиены являются самым старым классом противогрибковых агентов, впервые введенном в 1950-х годах. Точный способ действия остается неясным, но полиены эффективны только против организмов, содержащих стерины в своих наружных мембранах. Было высказано предположение, что амфотерицин В взаимодействует с мембранными стеринами с образованием пор, что позволяет вытекать цитоплазматическим компонентам с последующей гибелью клеток.
Азолы действуют путем ингибирования 14α-деметилазы через механизм, зависящий от цитохрома Р450. Это приводит к деплеции мембранного стеринового эргостерина и накоплению стериновых предшественников, что приводит к плазматической мембране с измененной текучестью и структурой. Эхинокандины действуют путем ингибирования синтетического фермента β-глюкансинтазы клеточной стенки. Это приводит к образованию аномальной клеточной стенки, осмотической чувствительности и клеточному лизису.
Флуцитозин является пиримидиновым аналогом, мешающим клеточному пиримидиновому метаболизму, а также синтезу ДНК, РНК и белка. Однако широко распространенная резистентность к флуцитозину ограничивает его терапевтическое применение.
Можно видеть, что на сегодняшний день доступные противогрибковые агенты действуют в основном только против двух клеточных целей; мембранных стеролов (полиены и азолы) и β-глюкансинтазы (эхинокандины).
Широко сообщалось о резистентности к азолам и полиенам, оставляя только недавно введенные эхинокандины для борьбы с инвазивными грибковыми инфекциями. По мере увеличения использования эхинокандинов неизбежно возникает устойчивость грибов.
Необходима идентификация новых классов противогрибковых средств с обещанием положительных терапевтических результатов для пациентов.
Соединения пиррола также идентифицированы как противогрибковые агенты. В WO 2009130481 описаны соединения пиррола, которые могут быть использованы для профилактики или лечения грибковых заболеваний.
Краткое изложение сущности изобретения
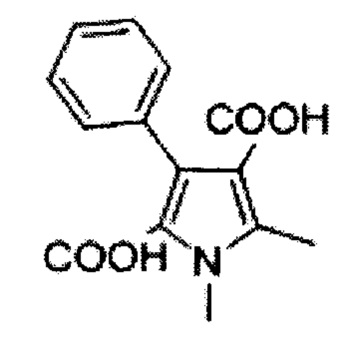
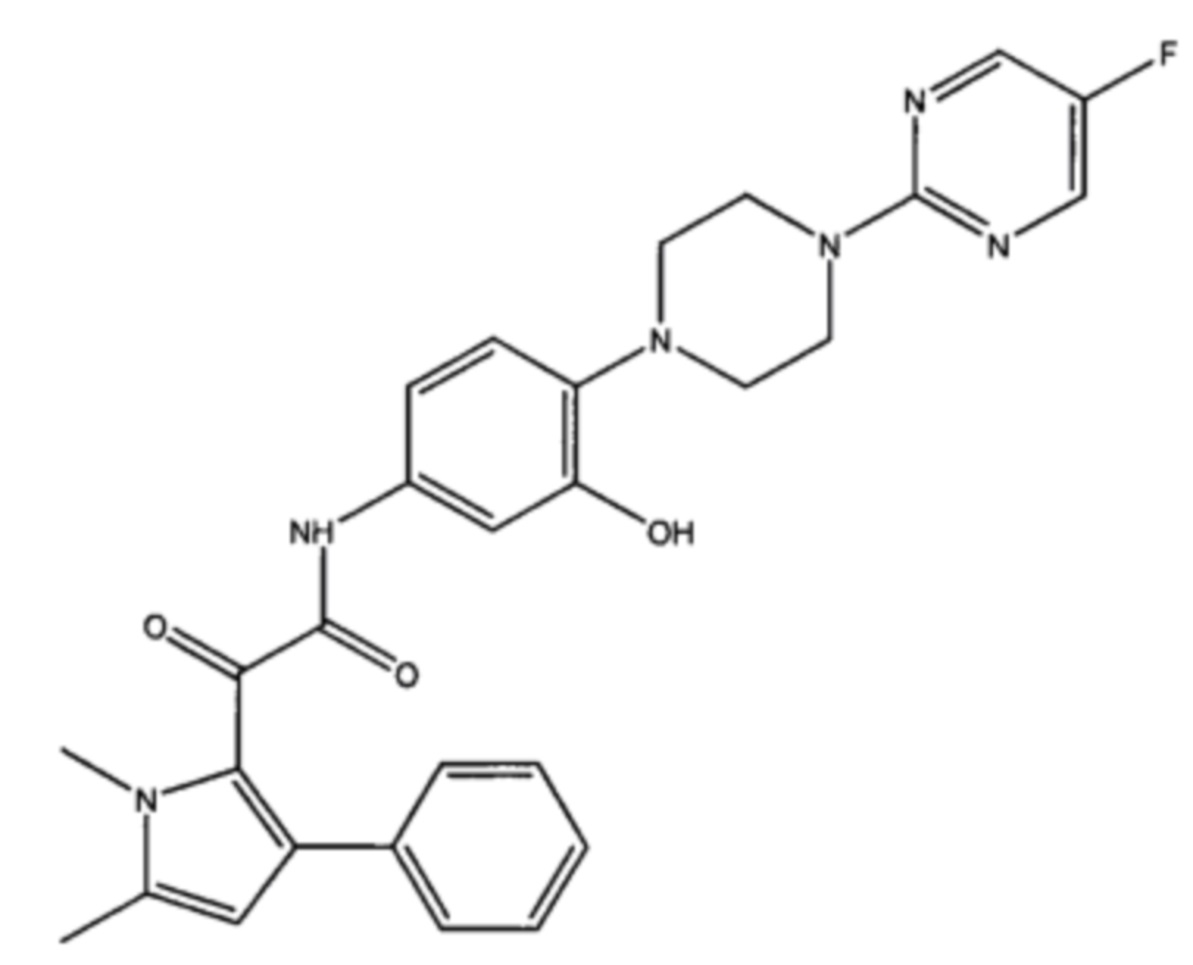
Авторы настоящего изобретения обнаружили, что пиррольное соединение 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид является в частности эффективным противогрибковым агентом. Он показал высокую эффективность в тестах ингибирования ферментов и ингибирования грибов и обладает хорошей биодоступностью и низкой токсичностью. Тесты показали, что это пиррольное соединение ингибирует рост большого количества грибов, в частности патогенного для человека грибка Aspergillus. Это конкретное соединение, как было показано, обладает активностью против широкого спектра видов внутри рода Aspergillus, по сравнению с другими, ранее известными, пиррольными соединениями. Кроме того, соединение показало повышенную эффективность in vivo, по сравнению с известным противогрибковым лекарственным средством Вориконазолом, в частности улучшенную эффективность против гриба Scedosporium. Соединение 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид может, таким образом, применяться для эффективного лечения широкого разнообразия грибковых инфекций и заболеваний.
Также было установлено, что 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид также проявляет хорошую активность. Добавление гидроксила на фенил, смежный с пиперазинильной группой способствует растворимости и проницаемости.
Было обнаружено, что дейтерированные производные 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамида и 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида также обладают высокой активностью.
Соответственно, в настоящем изобретении предложено соединение, которое представляет собой:
(a) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его дейтерированное производное, или
(b) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его дейтерированное производное, или
(c) пролекарство соединения (а) или (b), или
фармацевтически приемлемая соль или сельскохозяйственно приемлемая соль (а), (b) или (с).
В одном воплощении соединение представляет собой фармацевтическое соединение, которое является:
(a) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его дейтерированное производное, или
(b) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его дейтерированное производное, или
(c) пролекарство соединения (а) или (b), или
фармацевтически приемлемая соль (а), (b) или (с).
В другом воплощении соединение представляет собой сельскохозяйственное соединение, которое является:
(a) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или
(b) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид, или
сельскохозяйственно приемлемая соль (а) или (b).
В другом воплощении соединение представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль или сельскохозяйственно приемлемая соль.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая фармацевтическое соединение по настоящему изобретению вместе с один или более фармацевтически приемлемыми носителями и/или эксципиентами.
Также предложена сельскохозяйственная композиция, содержащая: (а) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль; или (b) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль. Обычно, сельскохозяйственная композиция также содержит один или более сельскохозяйственно приемлемых носителей и/или разбавителей.
В другом аспекте в настоящем изобретении предложена фармацевтическая комбинация, содержащая: (i) фармацевтическое соединение по изобретению; и (ii) второй противогрибковый агент.
В еще одном аспекте в настоящем изобретении предложено фармацевтическое соединение по изобретению, композиция, как определено выше, или комбинация, как определено выше, для применения в способе лечения человека или животного терапией.
В настоящем изобретении также предложено фармацевтическое соединение по изобретению, композиция, как определено выше, или комбинация, как определено выше, для применения в предотвращении или лечении грибкового заболевания.
В другом аспекте, в настоящем изобретении предложен набор, содержащий, в смеси или в отдельных контейнерах, фармацевтическое соединение по изобретению и второй противогрибковый агент. Набор обычно содержит инструкции для введения фармацевтического соединения и второго противогрибкового агента.
Также в настоящем изобретении предложен способ контролирования грибкового заболевания у растения, который содержит приложение к части растения соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль; и возможно второго противогрибкового агента.
В настоящем изобретении также предложено применение соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль; возможно вместе со вторым противогрибковым агентом, в качестве сельскохозяйственного фунгицида.
В другом аспекте, в настоящем изобретении предложен способ предотвращения или лечения грибкового заболевания у субъекта, который включает введение указанному субъекту эффективного количества фармацевтического соединения по изобретению, композиции, как определено выше, или комбинации, как определено выше.
В еще одном другом аспекте в настоящем изобретении предложено применение фармацевтического соединения по изобретению, композиции, как определено выше, или комбинации, как определено выше, при производстве лекарственного средства для предотвращения или лечения грибковых заболеваний.
Краткое описание фигур
На Фиг. 1 показаны ЯМР данные для 2-(1, 5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(5-фтор-пиримидин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамида (1Н NMR (400 MHz, CDCl3)).
На Фиг. 2а показаны ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид (1Н NMR (400 MHz, CDCl3)).
На Фиг. 2b показаны ЯМР данные для 5-(2-(1, 5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетамидо)-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил 2-(1,4-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетата (1Н NMR (400 MHz, CDCl3)).
На Фиг. 3 показаны ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил-2,2,3,3,5,5,6,6-d8)фенил)-2-оксоацетамида (1Н NMR (400 MHz, CDCl3)).
На Фиг. 4 показаны ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил-2,3,5,6-d4)-2-оксоацетамида (1Н NMR (400 MHz, CDCl3)).
На Фиг. 5 показаны кривые выживания, полученные в исследовании выживания, приведенном далее, который рассматривает выживание мышей, получавших различные пероральные дозы 2-(1, 5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(5-фтор-пиримидин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамида.
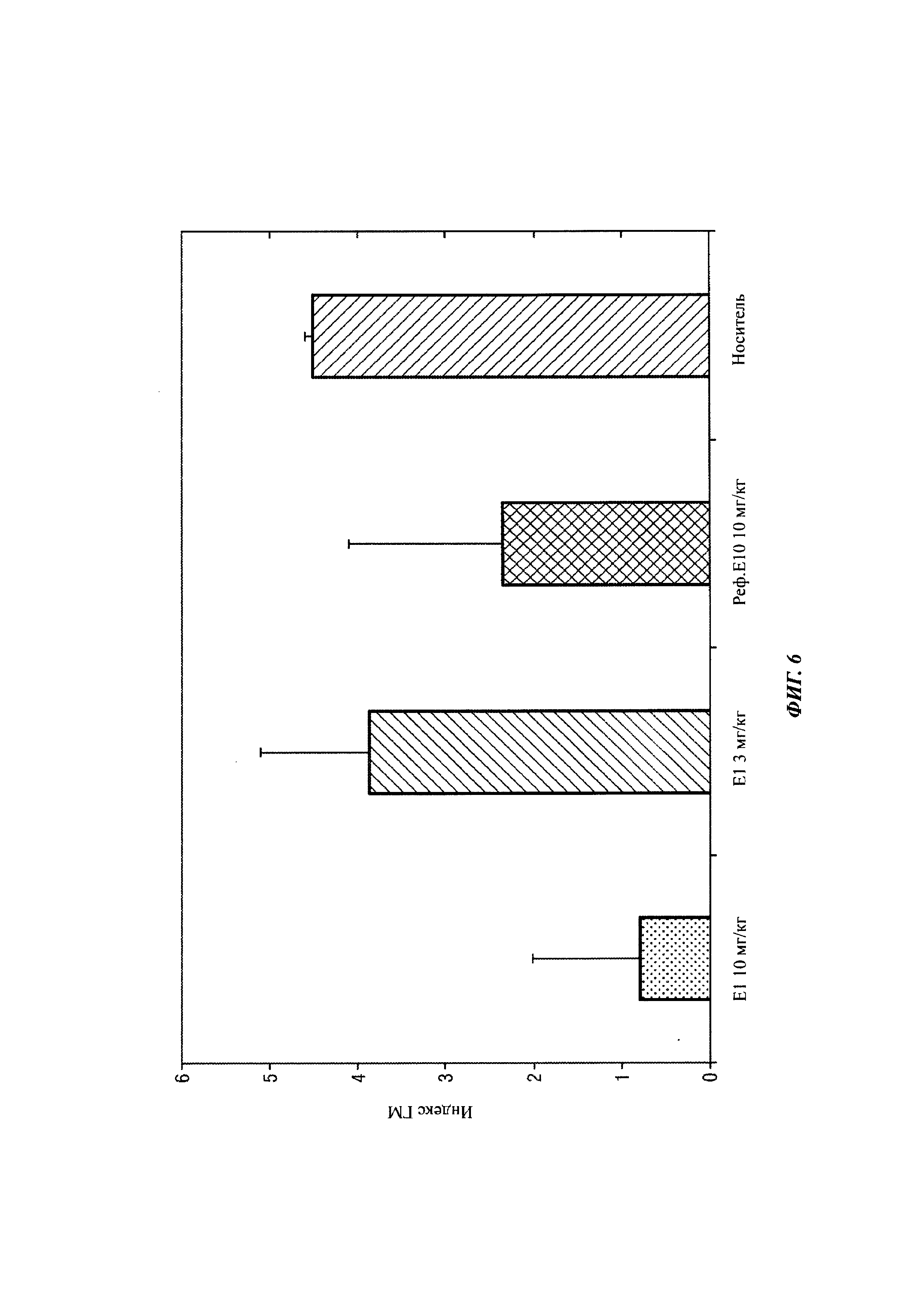
На Фиг. 6 показан средние показатели галактоманнана в крови, полученные в исследовании выживания.
На Фиг. 7 показана кумулятивная смертность иммуносупрессированных мышей, инфицированных L prolificans FMR 3569, получавших лечение с помощью (a) VRC, вориконазола при 25 мг/кг перорально, через желудочный зонд QD; (b) Пример 1 при 20 мг/кг, перорально через желудочный зонд BID и (с) не получавших лечение.
Подробное описание изобретения
В настоящем изобретении предложено соединение, которое представляет собой
(а)
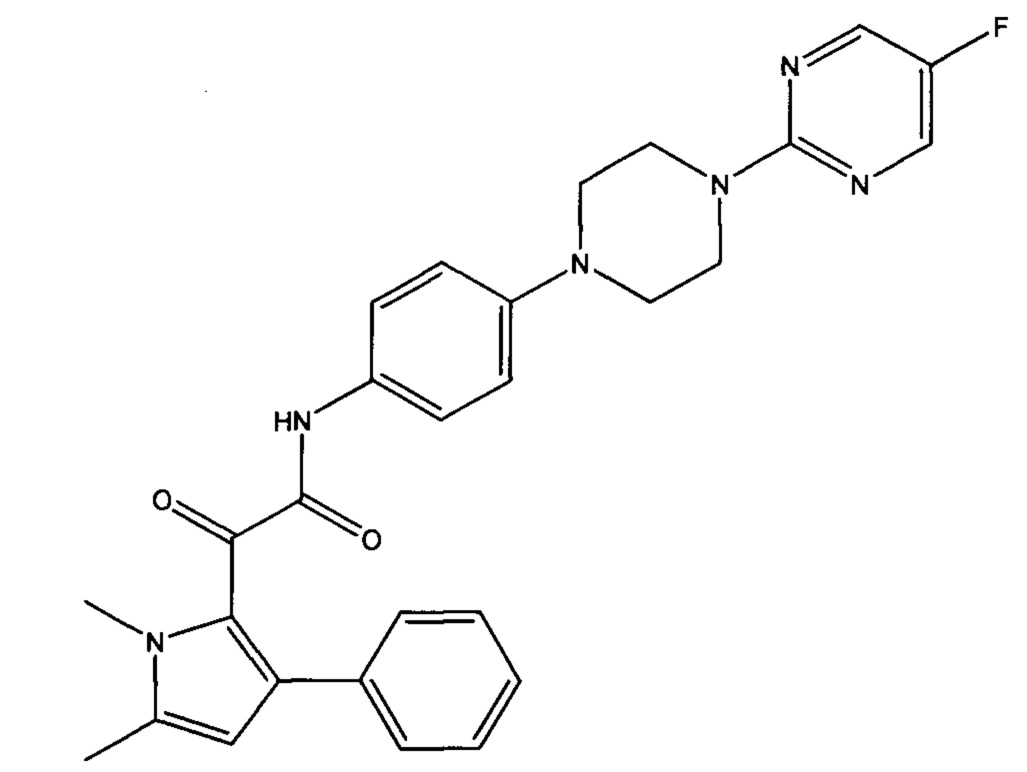
2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его дейтерированное производное, или
(b)

2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его дейтерированное производное, или
(с) пролекарство соединения (а) или пролекарство соединения (b), или
фармацевтически приемлемая соль или сельскохозяйственно приемлемая соль соединений (а), (b) или (с).
Соединение может, например, представлять собой 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль или сельскохозяйственно приемлемая соль, в частности 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль.
Альтернативно, соединение может представлять собой 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его фармацевтически приемлемая соль или сельскохозяйственно приемлемая соль, в частности 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его фармацевтически приемлемая соль. Как упоминалось выше, добавление гидроксильной группы способствует растворимости и проницаемости. В частности, включение гидроксильной группы снижает cLogP и увеличивает PSA (площадь полярной поверхности). Значение cLogP соединения представляет собой логарифм его коэффициента распределения между логарифмами н-октанола и воды (Соктанол/Свода). Оно дает меру гидрофильности соединения. Подходящий способ для измерения LogP можно найти в "Leo et al., Chem. Rev., 1971, 71 (6), pp 525-616". Подходящий способ для измерения PSA можно найти в "Ertl, P. ei al., J. Med. Chem. 2000, 43: 3714-3717".
Для избегания неясности, соединение может, если необходимо, применяться в виде сольвата. Кроме того, для избегания неясности, соединение может, если необходимо, применяться в любой таутомерной форме.
Как здесь используется, фармацевтически приемлемая соль представляет собой соль с фармацевтически приемлемой кислотой или основанием. Фармацевтически приемлемые кислоты включают как неорганические кислоты, такие как соляная, серная, фосфорная, дифосфорная, бромистоводородная, иодистоводородная или азотная кислота, так и органические кислоты, такие как лимонная, фумаровая, малеиновая, яблочная, аскорбиновая, янтарная, винная, бензойная, уксусная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, муравьиная, уксусная, пропионовая, гликолевая, молочная, пировиноградная, щавелевая, салициловая, трихлоруксусная, пикриновая, трифторуксусная, коричная, памовая, малоновая, миндальная, бисметиленовая салициловая, этандисульфоновая, глюконовая, цитраконовая, аспарагиновая, стеариновая, пальмитиновая, ЭДТА, п-аминобензойная или глутаминовая кислота, сульфаты, нитраты, фосфаты, перхлораты, бораты, ацетаты, бензоаты, гидроксинафтоаты, глицерофосфаты или кетоглутараты. Другие примеры фармацевтически приемлемых солей присоединения неорганических или органических кислот включают фармацевтически приемлемые соли, перечисленные в Journal of Pharmaceutical Science, 66, 2 (1977), которые известны специалисту в данной области. Фармацевтически приемлемые основания включают гидроксиды щелочных металлов (например, натрий или калий) и щелочноземельных металлов (например, кальций или магний) и органические основания, такие как алкиламины, аралкиламины и гетероциклические амины, лизин, гуанидин, диэтаноламин и холин.
Также пригодными в качестве фармацевтически приемлемых кислотно-аддитивных солей являются гидраты, которые может образовывать настоящее соединение.
Кислотно-аддитивные соли могут быть получены в виде прямых продуктов синтеза соединений. В альтернативном варианте свободное основание может быть растворено в подходящем растворителе, содержащем подходящую кислоту, и соль выделяют путем выпаривания растворителя или иным образом разделяют соль и растворитель.
Соединение может образовывать сольваты со стандартными низкомолекулярными растворителями с использованием способов, известных специалисту в данной области.
Пролекарства
В настоящем изобретении также предложено пролекарство соединения (а) или пролекарство соединения (b). Соединение может, например, представлять собой пролекарство 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида или соединение может представлять собой пролекарство 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида. Пролекарство может, например, обеспечивать повышенную растворимость, проницаемость, адсорбцию, распределение и составление и/или более низкую токсичность.
Пролекарство представляет собой аналог соединения по изобретению, который будет превращаться in vivo в требуемое активное соединение. Подходящие способ известны квалифицированному специалисту.
В частности, подходящие пролекарства включают те, в которых атом азота соединения кватернизован посредством добавления эфирной или алкилэфирной группы. Например, атом азота аминогруппы может быть кватернизован посредством добавления группы -CH2-O-COR, где R обычно представляет собой метили или трет-бутил.
Другие подходящие пролекарства включают те, в которых добавляют остаток к фенильному кольцу, смежному с пиперазиновой группой. В отношении амидного (-NH-CO-) остатка, он может быть присоединен к фенильному кольцу в орто или мета положении, предпочтительно в мета-положении. Пролекарство может, например, обладать следующей общей формулой:

где R представляет собой группу формулы -O-CO-OR1, -O-CO-R1, -O-CO-NR1R2, -O-CO-(CH2)z-NR1R2, -OR1, -O-(CR1R2)z-O-CO-R3-, -O-P(O)(OR4)(OR5) или -O-(CH2)z-O-P(O)(OR4)(OR5), где: R1, R2 и R3 независимо представляют собой водород, С1-С4 алкил, С2-С4 алкенил, С2-С4 алкинил, С3-С6 циклоалкил, незамещенную 5-до 7-членную гетероциклическую группу, или 5- до 7-членную гетероциклическую группу, замещенную вплоть до трех заместителями, выбранными из С1-С4 ал кила и С1-С4 алкокси; R4 и R5 независимо представляют собой водород, С1-С4 алкил, С2-С4 алкенил, С2-С4 алкинил или элемент I группы, такой как Na; a z представляет собой 1, 2, 3 или 4.
Как здесь используется, С1-С4 алкильная группа или остаток могут быть линейными или разветвленными, но предпочтительно является линейной. Такие подходящие алкил группы и остатки включают метил, этил, н-пропил, i-пропил, н-бутил, втор-бутил и трет-бутил.
Как здесь используется, С2-С4 алкенильная группа или остаток могут быть линейными или разветвленными, но предпочтительно является линейной. Она содержит одну или более двойных связей углерод-углерод. Она представляет собой предпочтительно С2-С3 алкенильную группу. Такие подходящие алкенильные группы и остатки включают винил, аллил, пропенил и бутенил, например, СН2С(Ме)=СН2.
Как здесь используется, С2-С4 алкинильная группа или остаток могут быть линейными или разветвленными, но предпочтительно является линейной. Она содержит одну или более тройных связей углерод-углерод. Она представляет собой предпочтительно С2-С3 алкинильную группу. Подходящие алкинильные группы и остатки включают этинил, пропинил, и бутинил, и их изомеры.
Как здесь используется, С3-С6 циклоалкильная группа обычно представляет собой С4, С5 или С6 циклоалкильную группу, более предпочтительно С5 или С6 циклоалкильную группу.
Группа алкил, алкенил, алкинил или циклоалкил является незамещенной.
Как здесь используется и, если не указано иного, гетероциклильная группа или остаток является насыщенной 5- до 7-членной кольцевой системой, в которой кольцо содержит по меньшей мере один гетероатом. Обычно кольцо содержит вплоть до трех гетероатомов, например один или два гетероатома, выбранных из О, S и N. Так гетероциклильная группа или остаток обычно представляет собой 5-до 7-членное кольц, содержащее один, два или три гетероатома, выбранных из О, S и N. Такие подходящие гетероциклильные группы и остатки включают, например, моноциклические насыщенные 5- до 7-членные кольца, более предпочтительно моноциклические насыщенные 5- до 6-членные кольца, такие как тетрагидрофуранил, пиперидинил, оксазолидинил, морфолинил, тиоморфолинил, пирролидинил, диоксоланил, пиперидонил, пиперазинил, тетрагидропиранил и 1,4-диазепанил, более предпочтительно пирролидинил, пиперазинил, тетрагидропиранил и пиперидинил.
Гетероциклическая группа может быть замещенной или незамещенной. Каждый кольцевой атом может быть незамещенным или может нести один или два заместителя. Если необходимо, атом азота может быть дизамещенным и атом серы может быть замещенным, давая заряженный гетероатом. Обычно, гетероциклическая группа несет вплоть до трех заместителей, например, один или два заместителя. Гетероцикл может быть соединен с остатком молекулы посредством связи по любому из доступных кольцевых положений. Подходящие заместители представляют собой С1-С4 алкил и С1-С4 алкокси, например, метил, этил, метокси и этокси, предпочтительно метил.
Предпочтительно, R1, R2 и R3 независимо представляют собой водород, С1-С4 алкил, С2-С4 алкенил, С2-С4 алкинил, С3-С6 циклоалкил, или незамещенную 5-до 6-членную гетероциклическую группу. Более предпочтительно, R1, R2 и R3 независимо представляют собой водород, С1-С4 алкил, С3-С6 циклоалкил, или незамещенную пирролидинильную, пиперазинильную, тетрагидропиранильную или пиперидинильную группу.
Предпочтительно, R4 и R5 независимо представляют собой водород, С1-С4 алкил, или элемент I группы, такой как Na. Более предпочтительно, R4 и R5 независимо представляют собой водород, метил, этил, или Na.
Предпочтительно, z представляет собой 1 или 2. Более предпочтительно z представляет собой 1.
Предпочтительно R представляет собой группу формулы -O-CO-OR1, -О-CO-R1, -O-CO-NR1R2, -O-CO-(CH2)z-NR1R2, -OR1, -O-(CR1R2)z-O-CO-R3 или -O-P(O)(OR4)(OR5). Более предпочтительно, R представляет собой группу формулы -O-COR1, -O-CO-NR1R2, -O-CO-(CH2)z-NR1R2, -OR1, -O-(CR1R2)z-O-CO-R3 или -O-P(O)(OR4)(OR5).
В одном воплощении, R представляет собой группу формулы -O-CO-OR1, -O-CO-R1, -O-CO-NR1R2, -O-CO-(CH2)z-NR1R2, -OR1, -O-(CR1R2)z-O-CO-R3 или -O-P(O)(OR4)(OR5), где: R1, R2 и R3 независимо представляют собой водород, С1-С4 алкил, С2-С4 алкенил, С2-С4 алкинил, С3-С6 циклоалкил, или незамещенную 5- до 6-членную гетероциклическую группу; R4 и R5 независимо представляют собой водород, С1-С4 алкил, или элемент I группы, такой как Na; и z представляет собой 1 или 2. Более предпочтительно R представляет собой группу формулы -O-COR1, -O-CO-NR1R2, -O-CO-(CH2)z-NR1R2, -OR1, -O-(CR1R2)z-O-CO-R3 или -O-P(O)(OR4)(OR5), где R1, R2 и R3 независимо представляют собой водород, С1-С4 алкил, С3-С6 циклоалкил, или незамещенную пирролидинильную, пиперазинильную, тетрагидропиранильную или пиперидинильную группу; R4 и R5 независимо представляют собой водород, метил, этил, или Na; и z представляет собой 1.
R может представлять, например, -OP(O)(ONa)2, -ОР(O)(ОН)2, -OC(=O)CH2N(H)CH3, -OC(=O)C4NH8, -ОС(=O)СН3, -OC(=O)N(CH3)2 или -ОСН2ОС(=O)С(СН3)3.
В одном воплощении, соединение представляет собой фармацевтически приемлемую соль пролекарства.
Дейтерированные производные
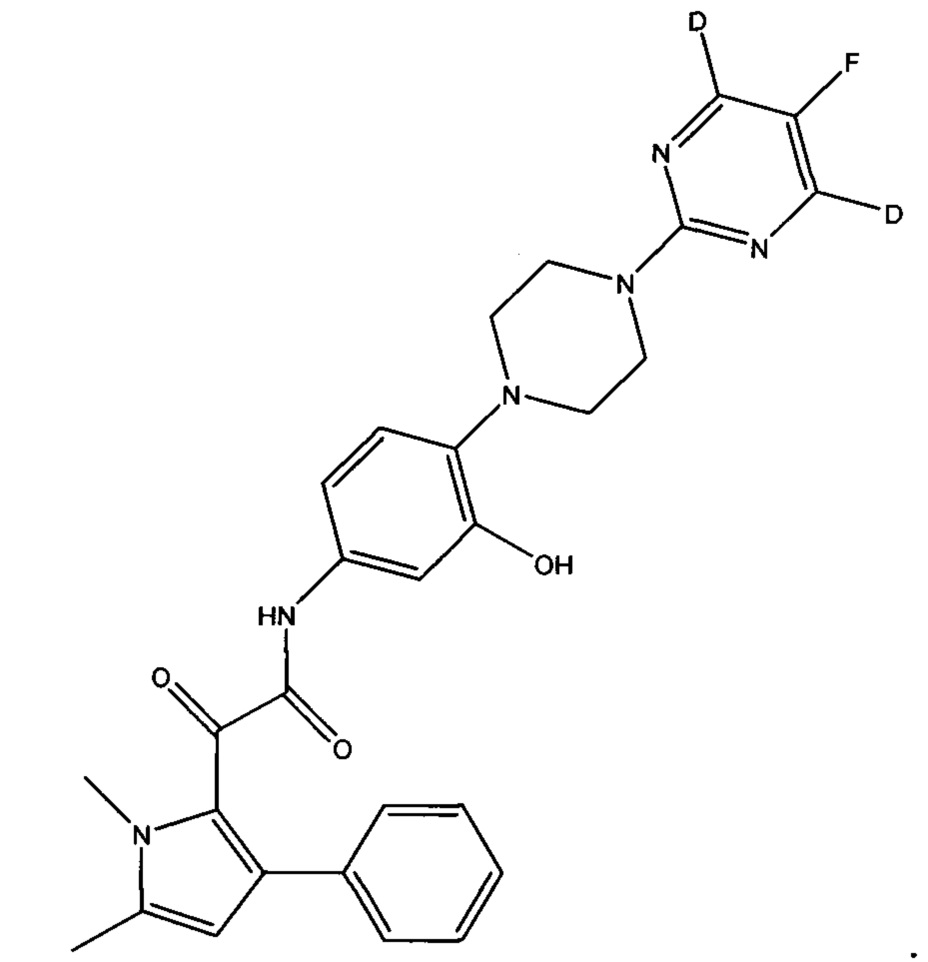
Соединение по изобретению может быть дейтерированным производным 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида. Было обнаружено, что дейтерированные производные соединений по изобретению являются высокоактивными противогрибковыми агентами.
Термин дейтерированное производное, как здесь используется, относится к соединению, в котором по меньшей мере один атом водорода заменен на дейтерий, например, от 1 до 10 атомов водорода могут быть заменены на дейтерий. Два или более атомов водорода могут быть заменены на дейтерий. Например, все атомы водорода на конкретном кольце внутри соединения по изобретению могут быть заменены на дейтерий.
Когда, например, соединение представляет собой дейтерированное производное 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида:
(a) все атомы водорода на пиперазинильном кольце могут быть заменены на дейтерий
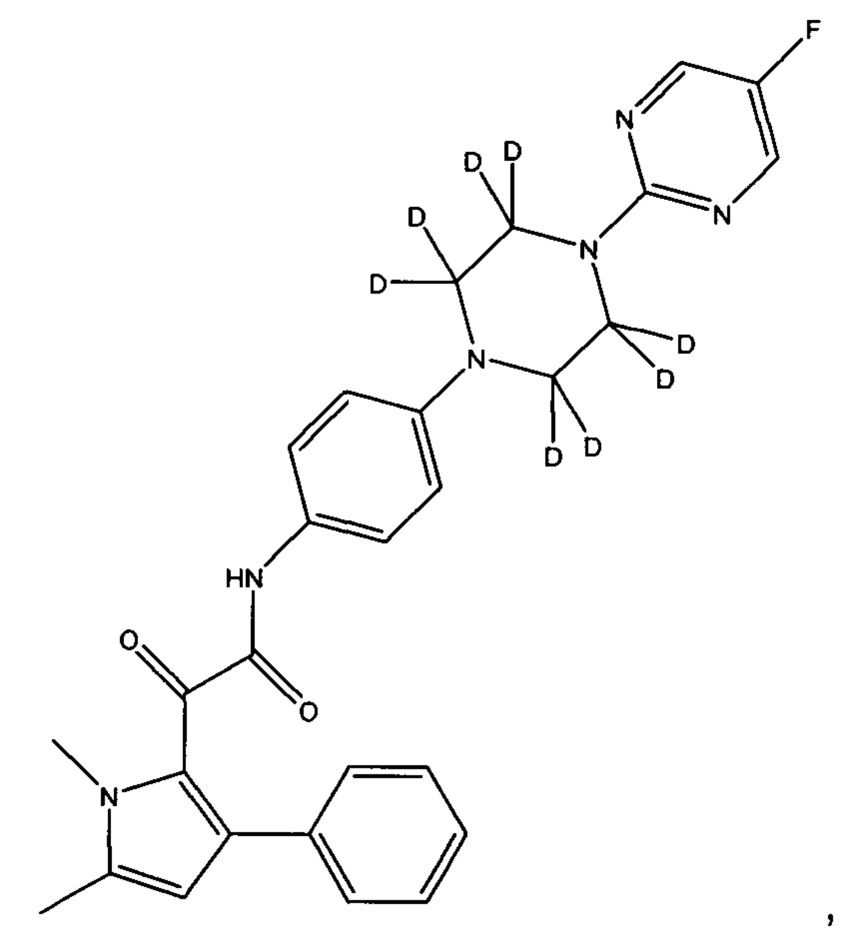
(b) все атомы водорода на фенильном кольце, смежном с пиперазинильным кольцом, могут быть заменены на дейтерий
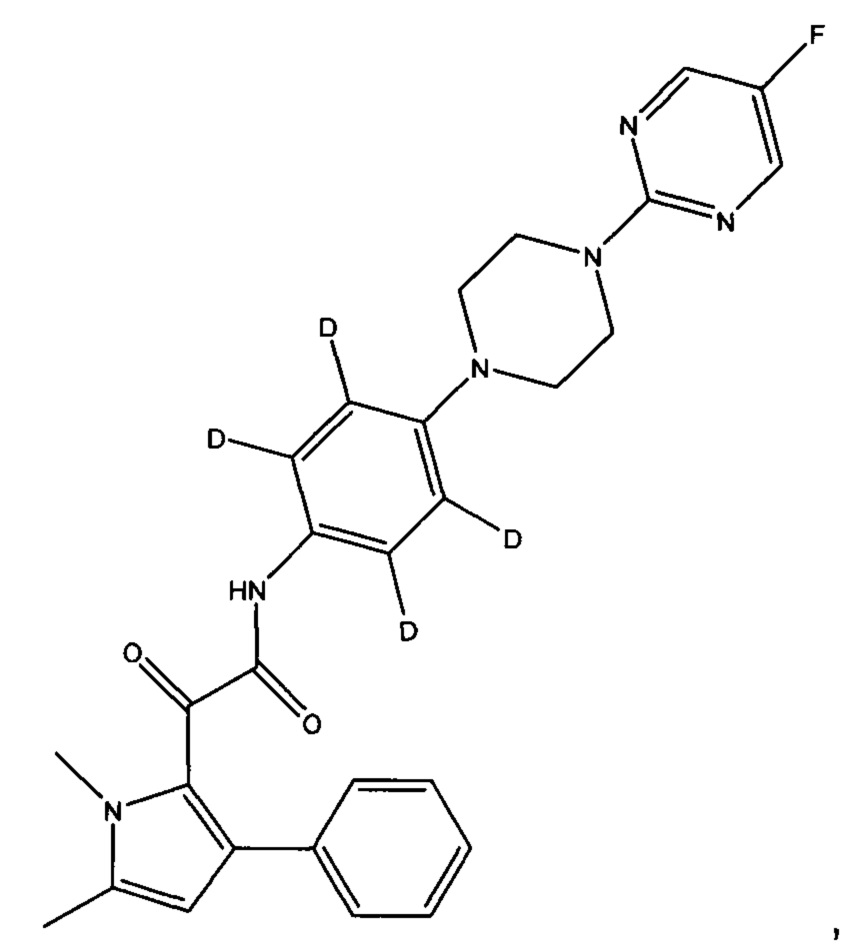
(с) все атомы водорода на пиримидинильном кольце могут быть заменены на дейтерий

Предпочтительно, (а) все атомы водорода на пиперазинильном кольце заменены на дейтерий, или (b) все атомы водорода на фенильном кольце, смежном с пиперазинильным кольцом, заменены на дейтерий.
Когда, например, соединение представляет собой дейтерированное производное 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид:
(а) все атомы водорода на пиперазинильном кольце могут быть заменены на дейтерий

(b) все атомы водорода на фенильном кольце, смежном с пиперазинильным кольцом, могут быть заменены на дейтерий
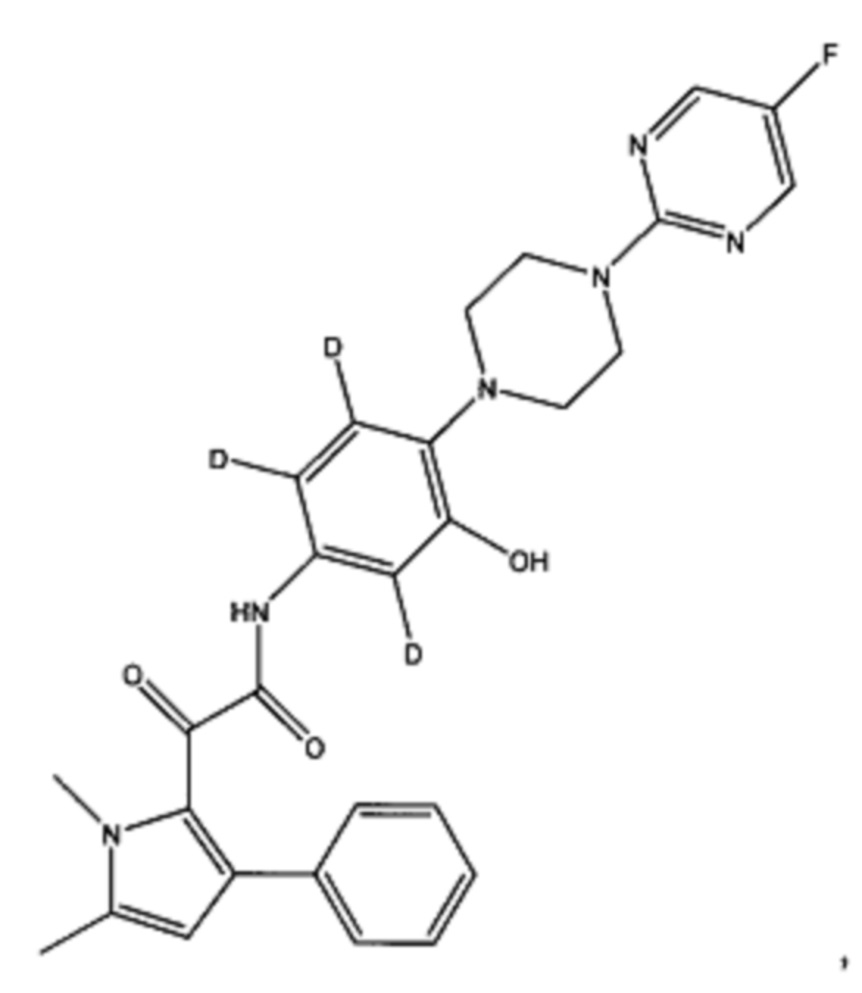
(c) все атомы водорода на пиримидинильном кольце могут быть заменены на дейтерий
Предпочтительно, (а) все атомы водорода на пиперазинильном кольце заменены на дейтерий, или (b) все атомы водорода на фенильном кольце, смежном с пиперазинильным кольцом, заменены на дейтерий.
Соединение может быть, например, фармацевтически приемлемой солью дейтерированного производного.
Синтез
В одном воплощении, соединение по изобретению представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль.
Указанное соединение может быть синтезировано посредством взаимодействия соединения формулы (II) с соединением формулы (III). Обычно взаимодействие проводится в присутствии органического растворителя и основания. Предпочтительно растворитель представляет собой дихлорметан или тетрагидрофуран и основание представляет собой триэтиламин или пиридин. Обычно взаимодействие проводится при 0°С на первой стадии при добавлении реагентов и затем перемешивают при комнатной температуре до завершения реакции. Соединение формулы (III) обычно доступно из коммерческих источников или может быть получено известными способами.


Соединение формулы (II) может быть получено взаимодействием соединения формулы (IV), с предпочтительно оксалилхлоридом. Обычно взаимодействие проводится в органическом растворителе. Предпочтительно, растворитель представляет собой дихлорметан. Обычно взаимодействие проводится при 0°С на первой стадии при добавлении реагентов и затем перемешивают при комнатной температуре до завершения реакции.
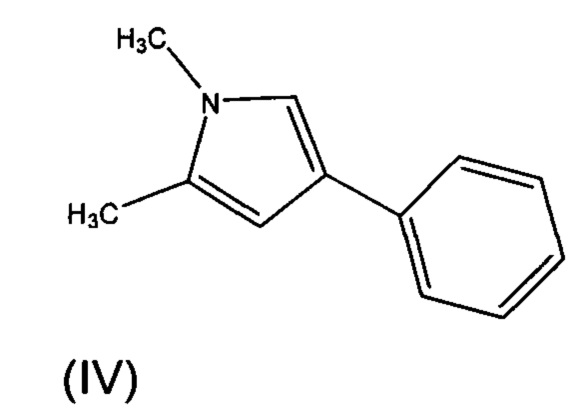
Все исходные вещества, на которые ссылаются упомянутые выше реакции доступны из коммерческих источников или могут быть получены по аналогии с известными способами.
В другом воплощении, соединение по изобретению представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид, или его фармацевтически приемлемую соль. В этом воплощении соединение (III) обладает ОН группой на фенильном кольце в мета положении по отношению к группе -NH2.
Дейтерированные производные могут быть синтезированы из дейтерированных исходных соединений, где водородные атомы в исходных соединениях заменены на дейтерий подходящим образом, чтобы получить целевой продукт. Например, для синтезирования дейтерированного производного, в котором атомы водорода на пиперазинильном кольце заменены на дейтерий, вышеуказанное соединение (III) может содержать дейтерий вместо водорода на пиперазинильном кольце.
В экспериментальном разделе предложены конкретные примеры синтеза.
Фармацевтическая композиция
В одном воплощении в настоящем изобретении предложена фармацевтическая композиция, содержащая фармацевтическое соединение по изобретению вместе с одним или более фармацевтически приемлемым носителем и/или эксципиентом.
Композиция может, например, содержать соединение, которое представляет собой 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его фармацевтически приемлемую соль, вместе с одним или более фармацевтически приемлемым носителем и/или эксципиентом.
Фармацевтическая композиция по изобретению обычно содержит до 85 мас. % фармацевтического соединения (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамида или его фармацевтически приемлемая соль). Более конкретно она содержит до 50 мас% фармацевтического соединения (например 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его фармацевтически приемлемая соль). Предпочтительные фармацевтические композиции являются стерильными и свободными от пирогенов.
Фармацевтическая комбинация
В настоящем изобретении также предложена фармацевтическая комбинация, содержащая: (i) фармацевтическое соединение по изобретению, и (ii) второй противогрибковый агент.
Комбинация может, например, содержать: (i) соединение, которое представляет собой 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемую соль; и (ii) второй противогрибковый агент.
Обычно, фармацевтическая комбинация представляет собой фармацевтическую комбинацию, в которой фармацевтическое соединение (i) и второй противогрибковый агент (ii) составлены для раздельного, одновременного или последовательного введения. Для одновременного введения, (i) и (ii) могут, например, быть в виде единой композиции. Для раздельного или последовательного введения (i) и (ii) могут, например, быть в виде набора.
Второй противогрибковый агент, применяемый в изобретении, может быть любым подходящим противогрибковым агентом, который будет рассматриваться квалифицированным специалистом в качестве подходящего в конкретных обстоятельствах. Конкретные подходящие классы противогрибковых агентов включают азолы, полиены, пуриновые нуклеотидные ингибиторы, пиримидиновые нуклеотидные ингибиторы, ингибиторы маннана, ингибиторы фактора удлинения белка, ингибиторы хитинсинтазы, ингибиторы бета-глюкансинтазы, эхинокандины, аллиламины, антитела против HSP90, бактерицидные / индуцирующие проницаемость белковые продукты и полиоксины. Другие подходящие противогрибковые средства, которые не попадают в вышеуказанные классы, включают соединения 5-фтор-1,3-дигидро-1-гидрокси-2,1-бензоксаборал (AN269), 5-хлор-1,3-дигидро-1-гидрокси-2,1-бензоксаборал (AN2718) и икофунгипин. Например, второе противогрибковое средство может быть выбрано из группы, состоящей из азолов, полиенов, пуриновых нуклеотидных ингибиторов, пиримидиновых нуклеотидных ингибиторов, ингибиторов маннана, ингибиторов фактора удлинения белка, эхинокандинов, аллиламинов, антител против HSP90, бактерицидных / индуцирующих проницаемость белковых продуктов или полиоксинов, или одно из соединений 5-фтор-1,3-дигидро-1-гидрокси-2,1-бензоксаборал (AN269), 5-хлор-1,3-дигидро-1-гидрокси-2,1-бензоксаборал (AN2718), икофунгипин, VT116 или SCY078
VT116 представляет собой 2-пиридинэтанол, α-(2,4-дифторфенил)-β,β-дифтор-α-(1Н-тетразол-1-илметил)-5-[4-(2,2,2-трифторэтокси)фенил]-, (αR)-,

и SCY078 078 (или MK-3118) представляет собой полусинтетическое производное энфумафунгина, 4Н-1,4а-пропано-2R-фенантро[1,2-с]пиран-7-карбоновой кислоты, 15-[(2R)-2-амино-2,3,3-триметилбутокси]-8-[(1R)-1,2-диметилпропил]-1,6,6а,7,8,9,10,10а,10b,11,12,12а-додекагидро-1,6а,8,10а-тетраметил-14-[5-(4-ппиридинил)-1Н-1,2,4-триазол-1-ил]-, (1S,4aR,6aS,7R,8R,10aR,10bR,12aR,14R,15R):

Предпочтительными азолами являются клотримазол, эконазол, бифоназол, бутоконазол, фентиконазол, флуконазол, изоконазол, итраконазол, кетоконазол, миконазол, оксиконазол, сертаконазол, сульконазол, тиоконазол, ивакуконазол, равуконазол, позаконазол, терконазол и вориконазол, луликоназол. Предпочтительными эхинокандинами являются анидулафунгин, каспофунгин микафунгин и бифунгин. Предпочтительными аллиламинами являются тербинафин, бутенафин, аморолфин и нафтифин. Предпочтительными полиенами являются амфотерицин В и нистатин. Предпочтительным примером пуринового или пиримидинового нуклеотидного ингибитора является флуцитозин. Предпочтительным ингибитором маннана является прадамицин. Предпочтительным ингибитором фактора удлинения белка является сордарин и его аналоги. Предпочтительным полиоксином является никкомицин Z.
Особенно предпочтительными вторыми противогрибковыми агентами являются каспофунгин, микафунгин, анидулофунгин, амфотерицин В, вориконазол, позаконазол, ивакуконазол, флуконазол и итраконазол.
Фармацевтическая комбинация может быть составлена в виде одиночной композиции. Так, фармацевтическая композиция может, например, содержать (i) фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), (ii) второй противогрибковый агент, как здесь определено, и (iii) фармацевтически приемлемый носитель или разбавитель.
Медицинские применения
В одном воплощении, (i) фармацевтическое соединение по изобретению, например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль, (ii) фармацевтическая композиция, как здесь определено, или (iii) фармацевтическая комбинация, как здесь определено, могут быть для применения в способе лечения человека или животного терапией.
Соответственно, (i) фармацевтическое соединение по изобретению, (ii) фармацевтическая композиция, как здесь определено, или (iii) фармацевтическая комбинация, как здесь определено, может быть для применения в предотвращении или лечении грибкового заболевания, например, (i) или (ii) могут применяться в комбинации со вторым противогрибковым агентом. В частности, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль могут применяться в комбинации со вторым противогрибковым агентом, как описано. Второй противогрибковый агент может быть вторым противогрибковым агентом, как здесь определено.
Фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), фармацевтические комбинации по изобретению и фармацевтические композиции по изобретению могут быть введены в различных лекарственных формах. Таким образом, их можно вводить перорально, например, в виде таблетки, пастилки, капсул, лепешек, водной или масляной суспензии, диспергируемого порошка или гранул. Фармацевтическое соединение по изобретению (например 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), фармацевтические комбинации по изобретению и фармацевтические композиции по изобретению могут быть также введены парентерально, подкожно, внутривенно, внутримышечно, внутривенно, трансдермально или инфузионными способами, например, фармацевтические комбинации по изобретению и фармацевтические композиции по изобретению могут быть введены внутривенно. В зависимости от используемого носителя и концентрации лекарственные средства могут быть суспендированы или растворены в носителе. Преимущественно адъюванты, такие как местный анестетик, консервант и буферный агент, могут быть растворены в носителе. Фармацевтическое соединение по изобретению (например 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль,) фармацевтические комбинации и фармацевтические композиции также могут быть введены в виде суппозиториев. Фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), фармацевтические комбинации и фармацевтические композиции могут быть введены ингаляцией в виде аэрозоля с помощью ингалятора или небулайзера. Фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), фармацевтические комбинации и фармацевтические композиции могут быть введены местно, например, в виде крема, пены, геля, лосьона или масла.
Фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), и возможно второй противогрибковый агент, обычно составляют для введения с фармацевтически приемлемым носителем или разбавителем. Например, твердые пероральные формы могут содержать вместе с активным соединением солюбилизирующие агенты, например, циклодекстрины или модифицированные циклодекстрины; разбавители, например, лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазочные вещества, например, кремний, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связывающие агенты; например крахмал, аравийскую камедь, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезагрегирующие агенты, например, крахмал, альгиновую кислоту, альгинаты или крахмалгликолят натрия; шипучие смеси; красители; подсластители; смачивающие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и, в общем, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических препаратах. Такие фармацевтические препараты могут быть изготовлены известным образом, например, путем смешивания, гранулирования, таблетирования, нанесения покрытия сахаром или пленки.
Жидкие дисперсии для перорального введения могут представлять собой растворы, сиропы, эмульсии и суспензии. Раствор может содержать солюбилизирующие агенты, например, циклодекстрины или модифицированные циклодекстрины. Сиропы могут содержать в качестве носителей, например, сахарозу или сахарозу с глицерином и/или маннитом и/или сорбитом.
Суспензии и эмульсии могут включать фармацевтически активные соединения, в которых средний размер частиц подвергается уменьшение методами микронизации или наноизмельчения. Например, средний размер частиц соединения по изобретению может подвергнуться уменьшению с помощью технологий микронизации или наноизмельчения.
Суспензии и эмульсии могут содержать в качестве носителя, например, природную камедь, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло, этил-олеат, гликоли, например, пропиленгликоль; солюбилизирующие агенты, например, циклодекстрины или модифицированные циклодекстрины и, при необходимости, подходящее количество гидрохлорида лидокаина.
Растворы для внутривенных или инфузии могут содержать в качестве носителя, например, стерильную воду и солюбилизирующие агенты, например, циклодекстрины или модифицированные циклодекстрины, или предпочтительно они могут быть в форме стерильных водных изотонических солевых растворов.
Предусмотрены также нанопрепараты.
Для местного применения на кожу соединение может, например, быть превращено в крем, лосьон или мазь. Композиции крема или мази, которые могут быть использованы для лекарственного средства, являются общепринятыми препаратами, хорошо известными в данной области, например, как описано в стандартных учебниках фармацевтики, таких как Британская фармакопея.
Для местного применения путем ингаляции соединение может быть составлено для доставки аэрозолем, например, с помощью струйного распылителя под давлением или ультразвуковых распылителей, или предпочтительно с помощью дозированных аэрозолей с пропеллентом или введения без использования пропеллентов микронизированных порошков, например, ингаляционных капсул или других систем доставки "сухой порошок". Вспомогательные вещества, такие как, например, пропелленты (например, Frigen в случае дозированных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы и наполнители (например, лактоза в случае порошковых ингаляторов) могут присутствовать в таких ингаляционных препаратах. Для ингаляции доступно большое количество аппаратов, с помощью которых можно создавать и вводить аэрозоли с оптимальным размером частиц, используя технику ингаляции, подходящую для пациента. В дополнение к использованию адаптеров (спейсеров, расширителей) и грушевидных контейнеров (например, Nebulator®, Volumatic®) и автоматических устройств, излучающих аэрозоль-распылитель (Autohaler®), для дозированных аэрозолей, в частности, в случае порошковых ингаляторов, имеется ряд технических решений (например, Diskhaler®, Rotadisk®, Turbohaler® или ингаляторы, например, как описано в заявке на Европейский патент ЕР 0505321).
Для местного нанесения на глаза соединение может быть превращено в раствор или суспензию в подходящем стерильном водном или неводном носителе. Добавки, например буферы, такие как метабисульфит натрия или динатриевый эдта; консерванты, включая бактерицидные и фунгицидные агенты, такие как ацетат фенилртути или нитрат, хлорид бензалкония или хлоргексидин, и загустители, такие как гипромеллоза, также могут быть включены.
Терапевтически эффективное количество фармацевтического соединения по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) могут быть введены пациенту. Обычная дневная доза достигает 200 мг, например, до 100 мг или до 50 мг на кг массы тела, например от 0.001 до 200 или от 0.001 до 50 мг на кг массы тела, в соответствии с активностью фармацевтического соединения по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) или применяемой комбинации конкретных противогрибковых агентов, возраста, веса и состояния субъекта, подвергаемого лечению, а также видом и тяжестью заболевания и частоты и способа введения. Предпочтительно уровни дневной дозы достигают до 200 мг, например, до 150 мг, до 100 мг, до 50 мг или до 40 мг на кг массы тела. Уровни дневной дозы составляют по меньшей мере 1 мг, по меньшей мере 2 мг или по меньшей мере 5 мг на кг массы тела. В одном воплощении уровень дневной дозы составляет от 0.05 мг до 2 г, предпочтительно от 0.1 мг до 10 мг. В случае введения комбинации, фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) обычно вводится в количестве по меньшей мере 0.05 мг, предпочтительно по меньшей мере 0.1 мг, 2 мг или по меньшей мере 5 мг. Предпочтительный верхний лимит количества вводимого соединения по изобретению составляет обычно 200 мг, например, 100 мг, 50 мг или 25 мг. Второй противогрибковый агент обычно вводится в или ниже стандартной дозы, используемой для лекарственного средства. Преимуществом комбинаций настоящего изобретения является то, что известные противогрибковые агенты могут быть введены в сниженных дозах, чем обычно используются, приводя к снижению токсических эффектов. Фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), комбинация по изобретению или композиция по изобретению обычно вводятся пациенту в нетоксических количествах.
В случае, когда, например, фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) является частью фармацевтической комбинации, как здесь определено, составленной для раздельного, одновременного или последовательного введения, (а) фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль), и (b) второй противогрибковый агент могут быть введены с помощью одинакового режима введения или различных режимов введения.
Обычно, фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) предназначено для применения в предотвращении или лечении посредством внутривенного введения грибкового заболевания. Так, обычно, фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) вводится внутривенно. Если второй противогрибковый агент вводится отдельно, одновременно или последовательно, второй противогрибковый агент может быть введен внутривенно или различными режимами введения, которые могут быть такими, как здесь определено.
Предпочтительно, грибковое заболевание содержит инфекцию, вызванную грибками, например, Аскомицетами. Предпочтительно, грибковое заболевание содержит инфекцию, вызванную организмами, выбранными из рода Absidia; Acremonium; Alternaria; Aspergillus; Bipolaris; Blastomyces; Blumeria; Cladosporium; Coccidioides; Colletotrichium; Curvularia; Encephalitozoon; Epicoccum; Epidermophyton; Exophiala; Exserohilum; Fusarium; Histoplasma; Leptosphaeria; Mycrosporum; Mycosphaerella; Neurospora, Paecilomyces; Penicillium; Phytophthora; Plasmopara; Pneumocystis; Pyricularia; Pythium; Puccinia; Rhizoctonia; Rhizomucor; Scedosporium; Scopulariopsis; Trichophyton; Trichosporon; и Ustilago.
Предпочтительно, грибковое заболевание содержит инфекцию, вызванную организмом из рода Aspergillus, Scedosporium или Fusarium, например, грибковое заболевание содержит инфекцию, вызванную организмом из рода Aspergillus или Scedosporium, в частности Aspergillus. В одном воплощении грибковое заболевание содержит инфекцию, вызванную организмом из рода Aspergillus. В другом воплощении, грибковое заболевание содержит инфекцию, вызванную организмом из рода Scedosporium.
Предпочтительно, грибковое заболевание содержит инфекцию, вызванную организмом, выбранным из видов Absidia corymbifera; Acremonium spp; Alternaria alternata; Aspergillus flavus; Aspergillus fumigatus; Aspergillus nidulans; Aspergillus niger; Aspergillus parasiticus; Aspergillus terreus; Bipolaris spp; Blastomyces dermatitidis; Blumeria graminis;; Cladosporium cladosporoides; Cladosporium herbarium; Coccidioides immitis; Coccidioides posadasii; Curvularia lunata; Colletotrichium trifolii;; Encephalitozoon cuniculi; Epicoccum nigrum; Epidermophyton floccosum; Exophiala spp; Exserohilum rostratum; Fusarium graminarium; Fusarium solani; Fusarium sporotrichoides; Histoplasma capsulatum; Leptosphaeria nodorum; Mycrosporum canis; Mycosphaerella graminicola; Paecilomyces lilanicus; Paecilomyces varioti; Penicillium chrysogenum; Phytophthora capsici; Phytophthora infestans; Plasmopara viticola; Pneumocystis jiroveci; Puccinia coronata; Puccinia graminis; Pyricularia oryzae; Pythium ultimum; Rhizoctonia solani; Rhizomucor spp; Rhizopus spp; Scedosporium apiospermum; Scedosporium prolificans; Scedosporium species d; Scopulariopsis brevicaulis; Trichophyton mentagrophytes; Trichophyton interdigitale; Trichophyton rubrum; Trichosporon asahii; Trichosporon beigelii; и Ustilago maydis.
Предпочтительно, грибковое заболевание содержит инфекцию, вызванную A. fumigatus, A. flavus, A. terreus, A. niger, A, lentulus, S. apiospermum, S. prolificans, или S. species d. В частности, грибковое заболевание содержит инфекцию, вызванную A. fumigatus, A. flavus, A. terreus или A. niger. В одном воплощении, грибковое заболевание содержит инфекцию, вызванную S. prolificans.
Примеры грибковых заболеваний, которые можно предотвращать или лечить с применением соединения по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) включают как системные, так и поверхностные инфекции. Грибковые заболевания включают инвазивные грибковые заболевания, вызванные видами Aspergillus, такими как аспергиллез, а также местные формы этих инфекций. Например, грибковые заболевания включают инвазивные грибковые заболевания, вызванные такими видами Aspergillus, как аспергиллез, но также местные формы этих инфекций. Соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) являются в частности полезными против заболеваний, вызванных видами Aspergillus, для которых необходимо фунгицидное лекарственное средство, которое обладает более низкой токсичностью, чем амфотерицин. В настоящем изобретении также предложено лечение дерматологических инфекций.
В одном воплощении фармацевтическое соединение по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) предназначено для применения в предотвращении или лечении заболевания, вызванного видами Aspergillus. Заболевания, вызванные видами Aspergillus, включают заболевания, вызванные A. fumigatus, A. flavus, A. terreus и А. niger.
Примеры системных инфекций, которые могут предотвращаться или лечиться с применением фармацевтического соединения по изобретению (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) включают: легочный аспергиллез, например, у пациентов с ослабленным иммунитетом, таких как реципиенты костного мозга или больные СПИДом; системный аспергиллез; носоглоточный мукомикоз; бластомикоз; гистоплазмоз; кокцидиомикоз; паракокцидиомикоз; лобомикоз; споротрихоз; хромобластомикоз; феогифомикоз; и распространенный споротрихоз,
Примеры поверхностных инфекций, которые можно предотвращать или лечить с применением фармацевтического соединения (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемая соль) включают: личинки златки грушевой; эпидермофития стопы; и дерматофитный онихомикоз (ногтевая инфекция).
Примеры заболеваний или состояний, которые вызываются грибками или когда грибки обостряют аллергический ответ, и которые можно предотвращать или лечить с применением фармацевтического соединения (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его фармацевтически приемлемая соль), включают аллергический бронхолегочный аспергиллез (АВРА); астму, тяжелую астму с грибковой сенсибилизацией (SAFS), грибковую колонизацию кистозного фиброза, риносинусит и синусит. Например, заболевание может быть вызвано грибковой сенсибилизацией, или заболеванием может быть аллергический бронхолегочный аспергиллез (АВРА) или астма.
В настоящем изобретении также предложен набор, содержащий, в смеси или в отдельных контейнерах, соединение, как здесь определено, и второй противогрибковый агент.
Например, набор может содержать, в смеси или в отдельных контейнерах, соединение, которое представляет собой 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его фармацевтически приемлемую соль, и второй противогрибковый агент.
Также в настоящем изобретении предложен способ предотвращения или лечения грибкового заболевания у субъекта, который включает введение указанному субъекту эффективного количества: (i) фармацевтического соединения по изобретению как здесь определено, (ii) композиции, содержащей фармацевтическое соединение вместе с одним или более фармацевтически приемлемым носителем и/или эксципиентом, или (iii) комбинации, содержащей: (а) фармацевтическое соединение по изобретению; и (b) второй противогрибковый агент.
Второй противогрибковый агент может быть вторым противогрибковым агентом как здесь определено выше.
Грибковое заболевание может быть таким, как здесь определено. Например, заболевание может быть вызвано кожным грибком. Альтернативно, заболевание может быть аллергическим бронхолегочным аспергиллезом (АВРА) или SAFS. В качестве дополнительной альтернативы заболевание может быть астмой.
В настоящем изобретении также предложено применение фармацевтического соединения, композиции или комбинации по изобретению при производстве лекарственного средства для предотвращения или лечения грибкового заболевания.
Второй противогрибковый агент может быть вторым противогрибковым агентом как здесь определено выше.
Грибковое заболевание может быть грибковым заболеванием, как здесь определено. Например, заболевание может быть вызвано кожным грибком. Альтернативно, заболевание может быть аллергическим бронхолегочным аспергиллезом (АВРА) или SAFS. В качестве дополнительной альтернативы заболевание может быть астмой.
Сельскохозяйственное применение
В настоящем изобретении также предложен способ контролирования грибкового заболевания у растения, который содержит приложение к части растения соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль. Возможно второй противогрибковый агент может также присутствовать.
Например, указанный способ может содержать приложение к части растения соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, и возможно второго противогрибкового агента.
Указанное соединение (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его сельскохозяйственно приемлемая соль), может, например, контактировать с семенами растения, со средой (например, почва или вода), в которой растение растет, или с листьями растения.
Соединение (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его сельскохозяйственно приемлемая соль) предпочтительно применяется при предотвращении или лечении грибковых заболеваний. Примеры грибковых заболеваний растений, которые можно контролировать с применением соединения (например, 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль) включают грибковые заболевания, вызванные патогенами растений: Blumeria graminis; Colletotrichium trifolii; Fusarium graminearium; Fusarium solani; Fusarium sporotrichoides; Leptosphaeria nodorum; Magnaporthe grisea; Mycosphaerella graminicola; Neurospora crassa; Phytophthora capsici; Phytophthora infestans; Plasmopara viticola; Puccinia coronata; Puccinia graminis; Pyricularia oryzae; Pythium ultimum; Rhizoctonia solani; Trichophyton rubrum; и Ustilago maydis.
Настоящее изобретение включает сельскохозяйственную композицию, содержащую соединение, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль; и сельскохозяйственно приемлемый носитель или разбавитель.
Сельскохозяйственная композиция может, например, содержать соединение, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, и сельскохозяйственно приемлемый носитель или разбавитель.
Альтернативно, сельскохозяйственная композиция может, например, содержать соединение, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, и сельскохозяйственно приемлемый носитель или разбавитель
В одном воплощении настоящего изобретения, композиция дополнительно содержит второй противогрибковый агент. Примеры включают такие, как здесь определено.
Указанная сельскохозяйственная композиция обычно содержит до 85 мас. %: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль. Более конкретно, она содержит до 50 мас. %: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль. При использовании в сельскохозяйственной композиции квалифицированный специалист без труда сможет определить подходящие уровни введения. В качестве примеров противогрибковый агент (ы) может быть использован на уровне от 5 г до 10 кг на гектар, например от 10 г до 5 кг на гектар, например от 100 г до 2 кг на гектар.
Подходящие сельскохозяйственно приемлемые соли включают соли с приемлемыми в сельском хозяйстве кислотами, как неорганическими кислотами, такими как соляная, серная, фосфорная, дифосфорная, бромистоводородная или азотная кислота и органическими кислотами, такими как лимонная, фумаровая, малеиновая, яблочная, аскорбиновая, янтарная, винная, бензойная, уксусная, метансульфоновая, этансульфоновая, бензолсульфоновая или п-толуолсульфоновая кислота. Соли также могут быть образованы с приемлемыми в сельском хозяйстве основаниями, такими как гидроксиды щелочных "металлов (например, натрия или калия) и гидроксиды щелочных металлов (например, кальция или магния) и органические основания, такие как алкиламины, аралкиламины или гетероциклические амины. Предпочтительной сельскохозяйственно приемлемой солью является гидрохлорид.
2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, и необязательно второй противогрибковый агент, могут применяться в комбинации с инертными носителями или разбавителями, например, в водных спреях, гранулах и пылевых препаратах в соответствии с установившейся практикой в данной области. Водный спрей обычно получают путем смешивания смачиваемого порошка или эмульгируемого концентрата в соответствии с изобретением с относительно большим количеством воды для образования дисперсии.
Смачиваемые порошки могут содержать однородную, тонко измельченную смесь соединения по изобретению, инертный твердый носитель и поверхностно-активный агент. Инертный твердый носитель обычно выбирают из аттапульгитовых глин, каолиновых глин, монтмориллонитовых глин, диатомовой земли, тонкоизмельченного кремнезема и очищенных силикатов. Эффективные поверхностно-активные вещества, которые обладают смачивающей, проникающей и диспергирующей способностью, обычно присутствуют в составе смачиваемого порошка в пропорциях от 0,5 до 10 мас. %. Среди поверхностно-активных веществ, обычно используемых для этой цели, находятся сульфированные лигнины, нафталинсульфонаты и конденсированные нафталинсульфонаты, алкилбензолсульфонаты, алкилсульфаты и неионные поверхностно-активные вещества, такие как продукты конденсации этиленоксида с алкилфенолами.
Эмульгируемые концентраты могут включать раствор 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамида или его сельскохозяйственно приемлемую соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида или его сельскохозяйственно приемлемую соль в жидком носителе, который представляет собой смесь водонерастворимого растворителя и поверхностно-активного вещества, включая эмульгатор. Полезные растворители включают ароматические углеводородные растворители, такие как ксилолы, алкилнафталины, нефтяные дистилляты, терпеновые растворители, эфирные спирты и растворители органических эфиров. Подходящие эмульгаторы, диспергирующие и смачивающие агенты могут быть выбраны из тех же классов продуктов, которые используются для приготовления смачиваемых порошков.
В настоящем изобретении также предложено применение соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, возможно вместе со вторым противогрибковым агентом, в качестве сельскохозяйственного фунгицида.
Применение может, например, быть применением соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или его сельскохозяйственно приемлемую соль, возможно вместе со вторым противогрибковым агентом, в качестве сельскохозяйственного фунгицида.
Альтернативно, применение может, например, быть применением соединения, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид, или его сельскохозяйственно приемлемую соль, возможно вместе со вторым противогрибковым агентом, в качестве сельскохозяйственного фунгицида.
Второй противогрибковый агент может быть любым противогрибковым агентом, подходящим для применения в сельском хозяйстве. Примеры включают такие, как здесь определено.
Фунгицидные препараты предпочтительно содержат от 0.1 процента до 95 процентов по массе: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, или в случае комбинации противогрибковых агентов общего веса противогрибкового агента и от 0.1 до 75 процентов инертного носителя или ПАВ. Непосредственное применение к семенам растений перед посадкой может в некоторых случаях сопровождаться смешиванием порошкообразного твердого вещества: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамида или его сельскохозяйственно приемлемой соли, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида или его сельскохозяйственно приемлемой соли, или порошкового препарата с семенами с получением по существу одинакового покрытия, которое является очень тонким и составляет только один или два процента по весу или менее по отношению к весу семян. В некоторых случаях, однако, нефитотоксичный растворитель, такой как метанол, обычно применяют в качестве носителя для обеспечения равномерного распределения: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамида или его сельскохозяйственно приемлемой соли, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида или его сельскохозяйственно приемлемой соли, по поверхности семян.
Когда соединение, которое представляет собой: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемая соль, или в случае комбинации противогрибковых агентов один из применяемых противогрибковых агентов вносится в почву в качестве предвсходовой защиты, гранулярные препараты или порошки иногда более предпочтительны, чем спреи. Обычный гранулярный препарат содержит: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, или 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид или его сельскохозяйственно приемлемую соль, диспергированные в инертном носителе, таком как глина крупного помола, или глина, которую конвертировали в гранулы обработкой прокатного слоя порошкообразного материала небольшим количеством жидкости в аппарате для грануляции. В обычном способе получения гранулированных композиций раствор активного соединения распыляют на гранулы, когда их перемешивают в подходящем перемешивающем устройстве, после чего гранулы сушат в потоке воздуха во время непрерывного перемешивания. Порошковые препараты обычно используют по существу те же самые инертные разбавители, что и смачиваемые порошки и гранулы, но хорошо перемешиваются в порошкообразной форме и обычно не содержат эмульгаторов. Порошки могут содержать некоторые поверхностно-активные агенты для облегчения равномерного распределения активного ингредиента в препарате и для улучшения однородности и адгезии порошкового покрытия на семенах и растениях. Коллоидную дисперсию порошковых препаратов в воздухе обычно предотвращают путем включения в препарат незначительного количества масляного или воскообразного материала, чтобы вызвать агломерацию частиц коллоидного размера. Таким образом, тонкодисперсный порошок может быть нанесен на семена или растения без образования аэрозоля, загрязняющего воздух.
Следующие примеры иллюстрируют изобретение, но не предназначены для ограничения объема изобретения. В связи с этим важно понимать, что конкретные анализы, используемые в разделе «Примеры», предназначены только для того, чтобы свидетельствовать о противогрибковой активности. Существует множество анализов для определения такой активности, и поэтому отрицательный результат в любом конкретном анализе не является определяющим.
Примеры
Синтез соединений по изобретению
1. Синтез примера 1: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид
Схема синтеза ниже отражает способ синтеза соединения:


2-Гидроксиимино-3-оксо-3-фенилпропионовой кислоты этиловый эфир (А)

Раствор нитрита натрия (1.07 кг, 45.62 моль) в воде (4 л) медленно добавили в раствор этилбензоилацетата (2 кг, 10.41 моль) в ледяной уксусной кислоте (6 л), при 0-10°С в течение периода 2 ч. Продукт начал преципитироваться в процессе добавления. Реакционную массу нагрели до комнатной температуры и перемешивали в течение дополнительного 1 ч. Воду (2.5 л) добавили и смесь перемешивали в течение дополнительного 1 ч. Отфильтровали под вакуумом, промыли водой (2 л). Осадок растворили в хлороформе (8 л) и промыли водой (2×500 мл), солевым раствором (2×500 мл), высушили над безводным сульфатом натрия и сконцентрировали под вакуумом досуха с получением 2.0 кг (86%) 2-гидроксиимино-3-оксо-3-фенилпропионовой кислоты этилового эфира А в виде белого осадка. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.28].
5-метил-3-фенил-1Н-пиррол-2,4 дикарбоновой кислоты диэтиловый эфир (B)

Смесь этилацетоацетата (329 г, 2.53 моль), цинковой пыли (443 г, 6.78 моль) и безводного ацетата натрия (463 г, 5.65 моль) в ледяной уксусной кислоте (800 мл) нагрели до 60°С. Раствор соединения А (500 г, 2.26 моль) в ледяной уксусной кислоте (1.5 л) добавили тремя порциями при энергичном перемешивании в течение периода ~1 ч. Температура поднялась до приблизительно 93°С во время добавления. Реакционную смесь поддерживали при 60-75°С в течение 3 ч. Дополнительное количество цинковой пыли (221 г, 3.39 моль) добавили в реакционную массу в течение 15 мин и смесь перемешивали при 60-75°С в течение 1 ч, охладили до комнатной температуры и отфильтровали осадки. Фильтрат эвапорировали под вакуумом и остаток подвергли дистилляции совместно с толуолом (2×500 мл). Воду (5 л) и этилацетат (1 л) добавили в остаток и перемешивали до получения двух прозрачных слоев. Органический слой промыли последовательно водой (2×500 мл), насыщенным раствором бикарбоната (2×500 мл), солевым раствором (2×500 мл), высушили над безводным сульфатом натрия и сконцентрировали с получением 360 г неочищенного смолистого продукта. Его перемешивали со смесью дихлорметана в петролейном эфире (200 мл: 1200 мл; 1:6) при комнатной температуре в течение 15 мин, отфильтровали и промыли петролейным эфиром (100 мл) с получением 250 г (36%) 5-метил-3-фенил-1Н-пиррол-2,4 дикарбоновой кислоты диэтилового эфира В в виде серо-белого осадка. [Система ТСХ: этилацетат : Петролейный эфир (3:7); Rf значение: 0.45]. Аналогично 1.5 кг (500 гх3) А конвертировали в 500 г [245 г (36%) +255 г (37%) +250 г (36%)] соединения В тремя порциями.
1,5-диметил-3-фенил-1Н-пиррол-2,4-дикарбоновой кислоты диэтиловый эфир (С)
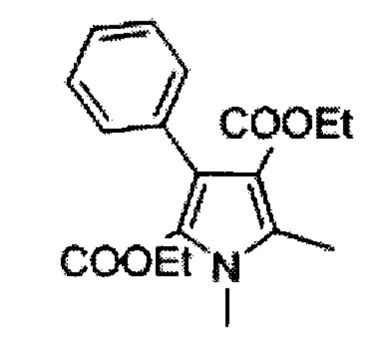
Раствор соединения В (1 кг, 3.322 моль) в безводном тетрагидрофуране (4 л) добавили к суспензии гидрида натрия (60% мас./мас.; 254 г, 6.644 моль) в безводном тетрагидрофуране (4 л) при 0°С в течение 1 ч. Реакционную массу нагревали до комнатной температуры и перемешивали в течение 1 ч и снова охладили до 0°С. Метилйодид (517 мл; 8.305 моль) добавили в течение получаса и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Погасили водой со льдом (100 мл) и 1 н соляную кислоту (2 л) добавили. Органический слой разделили и водный слой экстрагировали дихлорметаном (2×500 мл). Объединенные органические слои промыли последовательно солевым раствором (2×200 мл), высушили над безводным сульфатом натрия и сконцентрировали досуха с получением 950 г (91%) 1,5-диметил-3-фенил-1Н-пиррол-2,4-дикарбоновой кислоты диэтилового эфира С в виде желтого осадка [Система ТСХ: этилацетат : Петролейный эфир (3:7); Rf значение: 0.56].
1,5-диметил-3-фенил-1Н-пиррол-2,4-дикарбоновая кислота (D)
Раствор гидроксида натрия (1.21 кг, 30.25 моль) в воде (3.6 л) добавили в раствор соединения С (950 г, 3.025 моль) в этаноле (5 л) и нагревали при кипении с обратным холодильником в течение 15 ч. Этанол эвапорировали при пониженном давлении, остаток разбавили водой (1 л) и остудили до 0°С. Концентрированную соляную кислоту (2 л) медленно добавили для доведения рН до ~2, поддерживая температуру ниже 10°С, и перемешивали в течение 1 ч. Преципитировавшийся осадок отфильтровали, промыли водой (1 л) и петролейным эфиром (1 л) и высушили под вакуумом при 60°С, с получением 550 г (70%) 1,5-диметил-3-фенил-1Н-пиррол-2,4-дикарбоновой кислоты D в виде белого осадка. [Система ТСХ: этилацетат : Петролейный эфир (3:7); Rf значение: 0.15].
1,2-диметил-4-фенил-1Н-пиррол (Е)

Суспензию соединения Е (550 г, 2.123 моль) в этаноламине (1.5 л) нагрели до 175°С (в атмосфере N2) и поддерживали в течение 1 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой (500 мл) и экстрагировали этилацетатом (3×200 мл). Объединенные органические слои промыли последовательно водой (2×100 мл) и солевым раствором (2×100 мл), высушили над безводным сульфатом натрия и сконцентрировали под вакуумом ниже 40°С с получением неочищенного продукта. Флеш-хроматография через нейтральную окись алюминия с использованием 5% этилацетата в петролейном эфире в качестве элюента дала 280 г (77%) 1,2-диметил-4-фенил-1Н-пиррола Е, в виде белого осадка. [Система ТСХ: этилацетат : Петролейный эфир (3:7); Rf значение: 0.75].
(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-оксо-ацетилхлорид (F)

Оксалилхлорид (116 мл, 1.286 моль) медленно добавили к охлажденному раствору соединения Е (250 г, 1.169 моль) в безводном дихлорметане (3×200 мл) при 0°С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Растворитель эвапорировали досуха под вакуумом с получением 340 г (89%) 1,5-диметил-3-фенил-1Н-пиррол-2-ил)-оксо-ацетилхлорида F в виде коричневой маслянистой жидкости. [Система ТСХ: этилацетат: Петролейный эфир (3:7); Rf значение: 0.65]
4-Нитрофенилпиперазин (G)

Раствор 1-хлор-4-нитробензола (650 г, 4.140 моль) в диглиме (1 л) добавили в раствор пиперазина (2.84 кг, 33.12 моль) в диглиме (500 мл) при 100°С и получившуюся массу перемешивали при 100°С в течение 6 ч. Смесь охладили до 40-45°С, воду (5 л) добавили; нагрели до комнатной температуры и перемешивали в течение 1 ч. Преципитированный осадок отфильтровали, промыли водой (1 л), петролейным эфиром (500 мл) и высушили с получением 700 г (81%) 4-нитрофенилпиперазина G в виде желтого осадка. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.70].
5-фтор-2-[4-(4-нитро-фенил)-пиперазин-1-ил]-пиримидин (Н)

2-хлор-5-фторпиримидин (281 г, 2.12 моль) добавили к суспензии 4-нитрофенилпиперазина G (400 г, 1.93 моль) и карбоната калия (532 г, 3.85 моль) в диглиме (2.5 л), получившуюся смесь перемешивали при 100°С в течение 6 ч. После завершения смесь охладили до 0°С и отфильтровали, осадок растворили в воде (5 л) и перемешивали в течение 30 мин. Суспензию отфильтровали, осадок на фильтре промыли водой (1 л), петролейным эфиром (1 л) и высушили под вакуумом с получением 500 г (85%) 5-фтор-2-[4-(4-нитро-фенил)-пиперазин-1-ил]-пиримидина Н в виде желтого осадка. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.70].
4-[4-(5-фтор-пиримидин-2-ил)-пиперазин-1-ил]-фениламин (I)

Раствор дитионита натрия (1.27 кг, 7.32 моль) в воде (6 л) добавили к суспензии соединения Н (500 г, 1.83 моль) и бикарбоната натрия (614 г, 7.32 моль) в метаноле (6 л) при 65°С. Получившуюся смесь перемешивали при 65°С в течение 2 ч. Реакционную массу охладили до 10-15°С и отфильтровали. Остаток разделили между водой (2 л) и этилацетатом (5 л), органический слой промыли водой (2 л), солевым раствором (2 л) и высушили над безводным сульфатом натрия. Сконцентрировали под вакуумом с получением 290 г (64%) 4-[4-(5-фтор-пиримидин-2-ил)-пиперазин-1-ил]-фениламина I в виде осадка. [Система ТСХ: Метанол : Хлороформ (1:9); Rf значение: 0.50].
2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(5-фтор-пиримидин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамид

Раствор соединения F (332 г, 1.27 моль) в дихлорметане (3 л) добавили к перемешанному раствору соединения I (290 г, 1.06 моль) и триэтиламина (294 мл, 2.12 моль) в дихлорметане (3 л) при 0°С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Реакционную смесь погасили водой и экстрагировали дихлорметаном (6×500 мл). Объединенные органические слои промыли последовательно насыщенным раствором бикарбоната натрия (1.5 л), водой (1 л), солевым раствором (1.5 л) и в заключение высушили над безводным сульфатом натрия. Органический слой перемешивали с нейтральной окисью алюминия (1 кг) при комнатной температуре в течение 30 мин и отфильтровали. Фильтрат сконцентрировали под вакуумом с получением неочищенного соединения, которое промыли диэтиловым эфиром (300 мл) с последующим тритурированием с этанолом (3 л) при 80°С в течение 1 ч и охладили до комнатной температуры, отфильтровали, промыли этанолом (500 мл) с последующим гексаном (200 мл) и высушили с получением 340 г (64%) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(5-фтор-пиримидин-2-ил-пиперазин-1-ил]-фенил}-2-оксо-ацетамида в виде желтого осадка. [Система ТСХ: Этилацетат : петролейный эфир (1:1); Rf значение: 0.65].
ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(5-фтор-пиримидин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамида (1Н NMR (400 MHz, CDCl3)) даны на Фиг. 1. Сигнал детектировали в МС диапазоне при 499.1 [М+Н]+.
2. Синтез примера 2: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид

2-фтор-5-(пиперазин-1-ил) пиримидин (K)

5-хлор-2-фторпиримидин (3.0 г, 22.64 ммоль) добавили к пиперазину (9.73 г, 113.2 ммоль) при комнатной температуре. Получившуюся смесь нагрели до 130°С в течение 4 ч. Реакционную смесь охладили до комнатной температуры, погасили водой, экстрагировали дихлорметаном. Объединенный органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением 3.5 г (85%) 2-фтор-5-(пиперазин-1-ил)пиримидина K в виде осадка. [Система ТСХ: Метанол : Дихлорметан (1:9); Rf значение: 0.21].
1-хлор-2-(4-метоксибензилокси)-4-нитробензол (J)

4-метоксибензилхлорид (2.69 г, 17.29 ммоль) добавили к перемешанной суспензии 2-хлор-5-нитрофенола (3.0 г, 17.29 ммоль) и карбоната калия (7.16 г, 51.87 ммоль) в ацетонитриле (30 мл) при комнатной температуре. Получившуюся смесь нагрели до 80°С в течение 12 ч. Реакционную смесь охладили до комнатной температуры, погасили водой, экстрагировали этилацетатом. Органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 4.0 г (80%) 1-хлор-2-(4-метоксибензилокси)-4-нитробензола J в виде осадка [Система ТСХ: Этилацетат : петролейный эфир (2:8); Rf значение: 0.71].
5-фтор-2-(4-(2-(4-метоксибензилокси)-4-нитрофенил)пиперазин-1-ил)пиримидин L
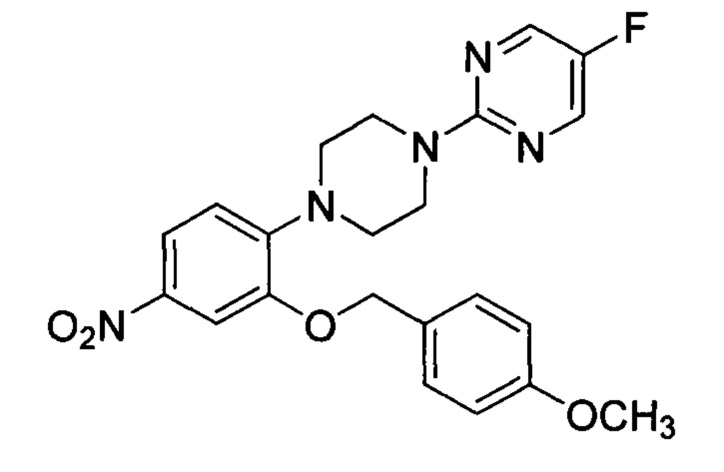
Карбонат цезия (23.35 г, 71.67 ммоль) добавили к перемешанному раствору 1-хлор-2-(4-метоксибензилокси)-4-нитробензола J (3.5 г, 11.94 ммоль) и 2-фтор-5-(пиперазин-1-ил)пиримидина K (2.17 г, 11.94 ммоль) в толуоле (40 мл) при комнатной температуре. Суспензию продули аргоном в течение 20 минут. Затем 2'-(дициклогексилфосфино)-N,N-диметилбифенил-2-амин (0.47 г, 1.19 ммоль), ацетат палладия (0.806 г, 1.19 ммоль) добавили к дегазированной смеси, затем продули аргоном дополнительные 10 минут. Получившуюся смесь нагрели до 120°С в течение 12 ч. Реакционную смесь охладили до комнатной температуры, погасили водой, экстрагировали этилацетатом. Органический слой промыли водой, солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением неочищенного соединения. Очистка посредством колоночной хроматографии через силикагель (100-200 меш) с использованием 20-25% этилацетата в петролейном эфире в качестве элюента дала 4.2 г (80%) 5-фтор-2-(4-(2-(4-метоксибензилокси)-4-нитрофенил)пиперазин-1-ил)пиримидина L в виде осадка желтого цвета. [Система ТСХ: Этилацетат : петролейный эфир (1:1); Rf значение: 0.55].
5-амино-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенол М

10% палладий на угле (0.2 г) добавили в раствор 5-фтор-2-(4-(2-(4-метоксибензилокси)-4-нитрофенил)пиперазин-1-ил)пиримидина L (4 г, 9.11 ммоль) в метаноле (20 мл) при комнатной температуре. Получившуюся смесь гидрогенизировали в аппарате Парра при давлении 40 фунт/кв. дюйм при комнатной температуре в течение 3 ч. Реакционную смесь отфильтровали через целит и фильтрат сконцентрировали под вакуумом с получением 1.5 г (56.9%) 5-амино-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенола М в виде осадка. [Система ТСХ: Этилацетат : петролейный эфир (1:1); Rf значение: 0.40].
2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид (Пример 2) и 5-(2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетамидо)-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)рфенил 2-(1,4-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетат (Пример 2')
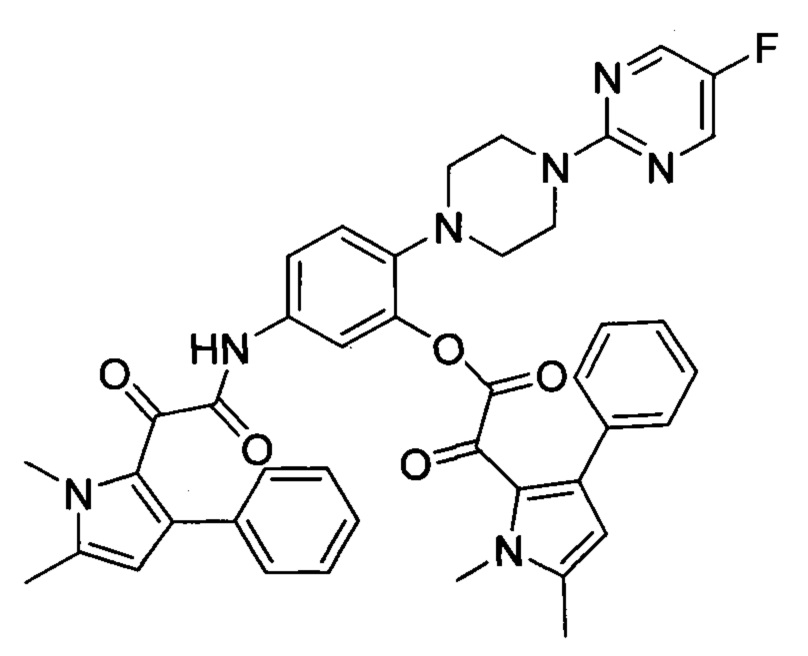
Раствор соединения F (1.5 г, 5.81 ммоль) в дихлорметане (5 мл) медленно добавили к перемешанному раствору 5-амино-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил) фенола М (1.4 г, 4.84 ммоль) и триэтиламина (1046 г, 14.52 ммоль) в дихлорметане при -60°С в течение 30 мин. Получившуюся смесь перемешивали в течение 30 минут при -60°С. Реакционную смесь погасили водой, экстрагировали дихлорметаном. Органический слой промыли водой, солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали при пониженном давлении с получением неочищенного соединения, которое очистили посредством колоночной хроматографии через силикагель (100-200 меш) с использованием 25-75% этилацетата в петролейном эфире в качестве элюента с получением 0.557 г (22%) 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида Пример 2 и 10 мг 5-(2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетамидо)-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил-2-(1,4-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетата Пример 2' в виде осадка [Система ТСХ: Этилацетат : петролейный эфир (1:1); Rf значение: 0.32].
ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамида (1Н NMR (400 MHz, CDCl3)) показаны на Фиг. 2. Сигнал детектировали в диапазон МС при 515.3 [М+Н]+.
ЯМР данные для 5-(2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетамидо)-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил 2-(1,4-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксоацетата (1Н NMR (400 MHz, CDCl3)) показаны на Фиг. 2b. Сигнал детектировали в диапазон МС при 740.43 [М+Н]+.
3. Синтез дейтерированных производных
Пример 3: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил-2,2,3,3,5,5,6,6-d8)фенил)-2-оксоацетамид
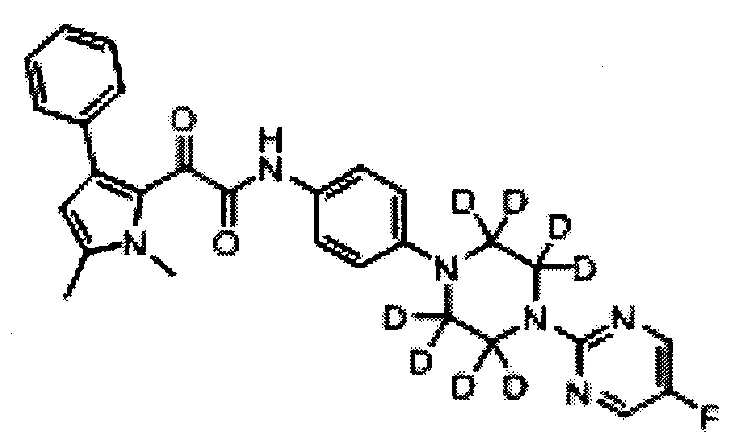
Синтез соединения (N)
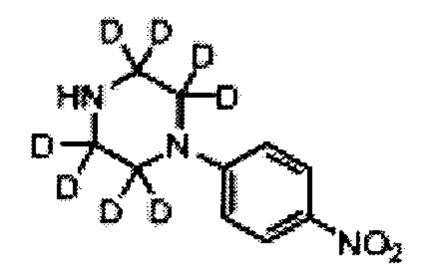
Раствор 1-хлор-4-нитробензола (750 мг, 4.7 ммоль) в диглиме (5 мл) добавили в раствор пиперазина - d8 (2.71 г, 28.7 ммоль) в диглиме (5 мл) при 100°С и получившуюся массу перемешивали при 100°С в течение 6 ч. Смесь охладили до 40-45°С, воду (50 мл) добавили; нагрели до комнатной температуры и перемешивали в течение 1 ч. Преципитированный осадок отфильтровали, промыли водой (50 мл), петролейным эфиром (50 мл) и высушили с получением 800 мг (80%) соединения N в виде желтого осадка. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.70].
Синтез соединения (Р)

2-хлор-5-фторпиримидин (541 мг, 4.0 ммоль) добавили к суспензии соединения N (800 мг, 3.72 ммоль) и карбонат калия (1.0 г, 7.44 ммоль) в диглиме (15 мл), получившуюся смесь перемешивали при 100°С в течение 6 ч. После завершения смесь охладили до 0°С и отфильтровали, осадок растворили в воде (50 мл) и перемешивали в течение 30 минут. Суспензию отфильтровали, осадок на фильтре промыли водой (50 мл), петролейным эфиром (15 мл) и высушили под вакуумом с получением 1.0 г (86%) соединения Р в виде осадка желтого цвета. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.70].
Синтез соединения (Q)

Раствор дитионита натрия (2.24 г, 12.8 ммоль) в воде (15 мл) добавили к суспензии соединения Р (1.0 г 3.21 ммоль) и бикарбоната натрия (1.088 г, 12.8 ммоль) в метаноле (20 мл) при 65°С. Получившуюся смесь перемешивали при 65°С в течение 2 ч. Реакционную массу охладили до 10-15°С и отфильтровали. Остаток разделили между водой (30 мл) и этилацетатом (20 мл), органический слой промыли водой (50 мл), солевым раствором (30 мл) и высушили над безводным сульфатом натрия. Сконцентрировали под вакуумом с получением 800 мг (88%) соединения Q в виде белого осадка. [Система ТСХ: Метанол : Хлороформ (1:9); Rf значение: 0.50].
Синтез дейтерированного производного

Раствор соединения Q (826 мг, 35.6 ммоль) в дихлорметане (20 мл) добавили к перемешанному раствору соединения F (750 мг, 26.6 ммоль) и триэтиламина (0.750 мл, 53.3 ммоль) в дихлорметане (10 мл) при 0°С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Реакционную смесь погасили водой и экстрагировали дихлорметаном (6×30 мл). Объединенные органические слои промыли последовательно насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл), солевым раствором (50 мл) и в заключение высушили над безводным сульфатом натрия. Органический слой перемешивали с нейтральной окисью алюминия (100 г) при комнатной температуре в течение 30 мин и отфильтровали. Фильтрат сконцентрировали под вакуумом с получением неочищенного соединения, которое промыли диэтиловым эфиром (30 мл) и затем тритурировали с этанолом (20 мл) при 80°С в течение 1 ч и охладили до комнатной температуры, отфильтровали, промыли этанолом (10 мл) с последующим гексаном (20 мл) и высушили с получением 430 мг (89%) дейтерированного производного в виде осадка желтого цвета. [Система ТСХ: Этилацетат : петролейный эфир (1:1); Rf значение: 0.65].
ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил-2,2,3,3,5,5,6,6-d8)фенил)-2-оксоацетамида (1Н NMR (400 MHz, CDCl3)) показаны на Фиг. 3. Сигнал детектировали в диапазон МС при 507.5 [М+Н]+.
4. Синтез дейтерированного производного
Пример 4: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил-2,3,5,6-d4)-2-оксоацетамид

Синтез соединения (R)

Раствор 1-хлор-4-нитробензола-d4 (2.0 г, 12.4 ммоль) в диглиме (15 мл) добавили в раствор пиперазина (8.5 г, 99.3 ммоль) в диглиме (15 мл) при 100°С и получившуюся массу перемешивали при 100°С в течение 6 ч. Смесь охладили до 40-45°С, воду (50 мл) добавили; нагрели до комнатной температуры и перемешивали в течение 1 ч. Преципитированный осадок отфильтровали, промыли водой (50 мл), петролейным эфиром (50 мл) и высушили с получением 2.0 г (80%) соединения R в виде осадка желтого цвета. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.70].
Синтез соединения (S)

2-хлор-5-фторпиримидин (1.44 г, 10.9 ммоль) добавили к суспензии соединения R (2.1 г, 99.5 ммоль) и карбоната калия (2.7 г, 19.8 ммоль) в диглиме (15 мл), получившуюся смесь перемешивали при 100°С в течение 6 ч. После завершения смесь охладили до 0°С и отфильтровали, осадок растворили в воде (100 мл) и перемешивали в течение 30 мин. Суспензию отфильтровали; осадок на фильтре промыли водой (50 мл), петролейным эфиром (50 мл) и высушили под вакуумом с получением 2.9 г (94%) соединения S в виде осадка желтого цвета. [Система ТСХ: Этилацетат : петролейный эфир (3:7); Rf значение: 0.70].
Синтез соединения (Т)

Раствор дитионита натрия (4.52 г, 26 ммоль) в воде (20 мл) добавили к суспензии соединения S (2.0 г 65 ммоль) и бикарбоната натрия (2.21 г, 26 ммоль) в метаноле (20 мл) при 65°С. Получившуюся смесь перемешивали при 65°С в течение 2 ч. Реакционную массу охладили до 10-15°С и отфильтровали. Остаток разделили между водой (30 мл) и этилацетатом (20 мл), органический слой промыли водой (50 мл), солевым раствором (30 мл) и высушили над безводным сульфатом натрия. Сконцентрировали под вакуумом с получением 1.5 г (83%) соединения Т в виде белого осадка. [Система ТСХ: Метанол : Хлороформ (1:9); Rf значение: 0.50].
Синтез дейтерированного производного

Раствор соединения Т (715 мг, 26.9 ммоль) в дихлорметане (20 мл) добавили к перемешанному раствору соединения F (835 мг, 32 ммоль) и триэтиламина (0.750 мл, 53.3 ммоль) в дихлорметане (10 мл) при 0°С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Реакционную смесь погасили водой и экстрагировали дихлорметаном (6×30 мл). Объединенные органические слои промыли последовательно насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл), солевым раствором (50 мл) и в заключение высушили над безводным сульфатом натрия. Органический слой перемешивали с нейтральной окисью алюминия (100 г) при комнатной температуре в течение 30 мин и отфильтровали. Фильтрат сконцентрировали под вакуумом с получением неочищенного соединения. Неочищенное соединение очистили с помощью препаративной ВЭЖХ с получением 430 мг (89%) дейтерированного производного в виде осадка желтого цвета. [Система ТСХ: Этилацетат : Петролейный эфир (1:1); Rf значение: 0.65].
ЯМР данные для 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил-2,3,5,6-d4)-2-оксоацетамида (1Н NMR (400 MHz, CDCl3)) показаны на Фиг. 4. Сигнал детектировали в диапазон МС при 503.4 [М+Н]+.
Референсные примеры
Данные, показывающие, что 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид ингибирует рост широкого диапазона грибов показаны ниже. Также показано сравнение этого пиррольного соединения и структурно похожих соединений. Соединения представляют собой:
Пример 1: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид.
Референсный Пример 1: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-[3-фтор-4-(4-пиридин-2-ил-пиперазин-1-ил)-фенил]-2-оксо-ацетамид.
Пример 2: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-3-гидроксифенил)-2-оксоацетамид
Пример 3: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил-2,2,3,3,5,5,6,6-d8)фенил)-2-оксоацетамид
Пример 4: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил-2,3,5,6-d4)-2-оксоацетамид
Референсный Пример 2: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-[2-фтор-4-(4-пиридин-2-ил-пиперазин-1-ил)-фенил]-2-оксо-ацетамид.
Референсный Пример 3: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(4,6-диметил-пиридин-2-ил)-пиперазин-1-ил]-3-метил-фенил}-2-оксо-ацетамид.
Референсный Пример 4: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(4-метил-пиридин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамид.
Референсный Пример 5: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(6-метил-пиридин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамид.
Референсный Пример 6: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксо-N-[4-(4-пиридин-2-ил-пиперазин-1-ил)-фенил]-ацетамид.
Референсный Пример 7: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(4,6-диметил-пиридин-2-ил)-пиперазин-1-ил]-3-гидрокси-фенил}-2-оксо-ацетамид.
Референсный Пример 8: N-{2-хлор-4-[4-(4,6-диметил-пиридин-2-ил)-пиперазин-1-ил]-фенил}-2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксо-ацетамид.
Референсный Пример 9: N-{3-хлор-4-[4-(4,6-диметил-пиридин-2-ил)-пиперазин-1-ил]-фенил}-2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-2-оксо-ацетамид.
Референсный Пример 10: 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-{4-[4-(4,6-диметил-пиридин-2-ил)-пиперазин-1-ил]-фенил}-2-оксо-ацетамид.
Синтез референсных примеров 1-10 описан в WO 2009130481, в разделе Примеров в WO 2009130481. Информация, относящаяся к синтезу референсных примеров включена сюда посредством ссылки.
Пример Активности: Измерение минимальных ингибирующих концентраций (МИК)
2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-[4-(5-фтор-пиримидин-2-ил-пиперазин-1-ил]-фенил}-2-оксо-аиетамид
От 1 до 5 мг соединения точно взвесили в стерильной пробирке эппендорф. Соединение растворили в ДМСО с получением раствора, содержащего 5 мг/мл. Пробирки хранили при -20°С до использования.
В день тестирования растаявшие растворы смешали на вортексе для гомогенности. 30 мкл раствора взяли и добавили в 570 мкл стерильной воды в отдельном стерильном эппендорфе. Тщательно перемешанный раствор использовали для приготовления серии двойных разведений в воде, в планшете с глубокими лунками. Тринадцать повторных планшетов получили с использованием Minitrak отбором по 20 мкл из каждой лунки в одиннадцать чистых полистирольных 96-луночных планшетов.
Споры Aspergillus и Scedosporium засеяли из культур, росших на агаре Sabarauds в течение 5 дней, и ресуспендированных в PBS/Tween 80 до приблизительной концентрации 1×107 КОЕ/мл. Суспензию каждого организма разбавили в среде RPMI, содержащей 2% глюкозы и 0.135 М буфера MOPS (рН 7.0) до 0.5-2×104 КОЕ/мл. 80 мкл суспензии организма добавили в каждую лунку планшета, содержащего разведения лекарственного средства.
Это дало МИК планшеты с диапазоном лекарственного средства 50-0.05 мг/л и инокулятом организма 1-2×104 КОЕ/мл. Все планшеты инкубировали в течение 24-48 ч при 35°С. Рост оценивали с помощью мониторинга оптической плотности при 485 нм для каждой лунки. МИК соединения представляет собой наиболее низкую концентрацию лекарственного средства, которая ингибирует рост организма на >80% по сравнению с контролем, свободным от лекарственного средства.
Тестировались следующие организмы: Aspergillus niger, Aspergillus fumigates, Aspergillus terreus, Aspergillus flavus, Aspergillus terreus 49, Aspergillus fumigatus 210, Scedosporium apiospermum 13486, Scedosporium apiospermum 15848, Scedosporium apiospermum 451, Scedosporium apiospermum 4883, Scedosporium apiospermum 7935, Scedosporium apiospermum 8353, Scedosporium prolificans 18389, Scedosporium prolificans 206, Scedosporium prolificans 6322, Scedosporium species 15849, Scedosporium apiospermum 13486, Scedosporium prolifican 201, Scedosporium prolifican 13486, Scedosporium prolifican 7935, Scedosporium prolifican 15848, Scedosporium prolifican 8353, Scedosporium prolifican 451, Scedosporium prolifican 4883, Scedosporium prolifican 15849, Scedosporium prolifican 1121 и Scedo apiospermum 1124.
Другие грибы, включая Absidia corymbifera; Acremonium spp; Alternaria alternata; Aspergillus nidulans; Aspergillus parasiticus; Bipolaris spp; Blastomyces dermatitidis; Blumeria graminis; Cladosporium herbarium; Coccidioides immitis; Coccidioides posadasii; Colletotrichium trifolii; Curvularia lunata; Colletotrichium trifolii; Cryptococcus neoformans; Encephalitozoon cuniculi; Epicoccum nigrum; Epidermophyton floccosum; Exophiala spp; Exserohilum rostratum; Fusarium graminearium; Fusarium solani; Fusarium sporotrichoides; Histoplasma capsulatum; Leptosphaeria nodorum; Magnaporthe grisea; Mycrosporum canis; Mycosphaerella graminicola; Neurospora crassa; Paecilomyces lilanicus; Paecilomyces varioti; Penicillium chrysogenum; Phytophthora capsici; Phytophthora infestans; Plasmopara viticola; Pneumocystis jiroveci; Puccinia coronata; Puccinia graminis; Pyricularia oryzae; Pythium ultimum; Rhizomucor sp.; Rhizoctonia solani; Rhizomucor spp.; Rhizopus spp.; Scopulariopsis brevicaulis; Trichophyton interdigitale; Trichophyton mentagrophytes; Trichophyton rubrum; Trichosporon asahii; Trichosporon beigelii; и Ustilago maydis также могут быть использованы в вышеприведенном тестировании. Грибы культивируют обычными способами, известными квалифицированному специалисту, а концентрации МИК определяют, как указано выше.
Результаты Aspergillus МИК в мг/л (среда RPMI):
Следующие результаты МИК были сгруппированы по степени. Так, степень F отражает значение МИК большее, чем 0.06 мг/л. Степень Е отражает значение МИК большее, чем 0.04 мг/л, но меньшее чем, или эквивалентное 0.06 мг/л. Степень D отражает значение МИК большее, чем 0.02 мг/л, но меньшее чем, или эквивалентное 0.04 мг/л. Степень С отражает значение МИК большее, чем 0.01 мг/л, но меньшее чем, или эквивалентное 0.02 мг/л. Степень В отражает значение МИК большее, чем 0.005 мг/л, но меньшее чем, или эквивалентное 0.01 мг/л. Степень А отражает значение МИК меньшее чем, или эквивалентное 0.005 мг/л.

Результаты Scedosporium МИК в мг/л (среда RPMI):
Следующие результаты МИК были сгруппированы по степени, как определено выше.


Аналогичные описанным выше эксперименты МИК показали, что соединение примера 1 обладает также хорошей противогрибковой активностью в отношении S. dehoogii, S. boydii и S. aurantiacum.
Пример тестирования In vivo
Краткое изложение моделей выживания при инфекции Aspergillus fumigatus
Модели выживаемости мышей часто используются для оценки эффективности противогрибковых препаратов против Aspergillus. Модели, использованные при разработке примера 1, проводились в Euprotec Ltd (Манчестер) в исследовательской организации по контракту (CRO) с обширным опытом оценки противогрибковых препаратов. Типичная модель включает использование групп из 6-10 самцов мыши CD-1 на группу лечения. Мышей иммуносупрессировали 200 мг/кг циклофосфамида, вводимого внутрибрюшинно за 3 дня до заражения. A. fumigatus штамм А1163 культивируют на агаре Sabourauds в течение 4-6 дней при 35°С. Споры собирают в фосфатно-солевом буфере (PBS)/Твин, суспензию разбавляют и количество спор подсчитывают. Затем мышей инфицируют внутривенной инъекцией спор A. fumigatus через латеральную хвостовую вену. Типичный инокулят составляет 6-8×104 КОЕ/мышь и достаточен для того, чтобы убить всех необработанных животных на 4-6 день. Животные умирают от IA, а организмы Aspergillus обнаруживаются во многих тканях организма. Лечение обычно начинают вскоре после заражения, но задержка в течение 24 часов после заражения приводят к более сложной модели. Лечение продолжается в течение 7-9 дней. Лечение может быть до 3 раз в день с использованием перорального введения. После прекращения лечения животных наблюдают в течение 1-2 дней, затем умерщвляют. Релевантные контроли, леченные пероральным носителем без лекарственного средства, всегда включены; в идеале в этой группе не должно быть выживших. Использовали положительный контроль, состоящий из противогрибкового препарата, такого как Референсный Пример 10. Это соединение стабильно дает 100% выживаемость при дозах 10 мг/кг два раза в сутки вводится пероральным путем. Большинство моделей начинаются как временные нейтропенические модели, при которых вводится только одна доза циклофосфамида.
Нагрузка грибами в почках может быть определена на животных, выживших до конца исследования, и это может помочь получить эффективную дискриминацию между группами, в которых выживают все животные. Тканевая нагрузка выявляется путем удаления почек у животных, когда они отбираются в конце исследования. Их гомогенизируют в физиологическом растворе и наносят на агар Sabourauds и инкубируют при 35°С в течение 72 часов. Подсчитывают колонии Aspergillus и подсчитывают количество аспергилл на грамм почки. Результаты выражены в колоний образующих единицах на грамм (КОЕ/г). Одной из проблем, связанных с исследованиями тканевой нагрузки, является отсутствие сопоставимого контроля, поскольку животные, прошедшие лечение, все умирают до окончания исследования. Однако данные исследований, в которых тканевую нагрузку выявляли на необработанных животных на 4 или 5 день, показали, что тканевая нагрузка обычно превышает 20000 КОЕ/г и может превышать 100000 КОЕ/г в некоторых исследованиях.
Измерения галактоманнана
Галактоманнан представляет собой углеводный материал, присутствующий в клеточной стенке аспергилла. По мере роста организма галактоманнан выделяется во внеклеточную среду. Его можно обнаружить в плазме инфицированных людей и животных, и его присутствие является достоверным показателем активного заболевания. Обнаружение галактоманнана в плазме человека в настоящее время считается важным диагностическим тестом для аспергиллеза человека. В последнее время было показано, что успешное лечение аспергиллеза такими препаратами, как вориконазол, может снижать концентрации галактоманнана в сыворотке у людей и животных, позволяя использовать последовательные показатели галактоманнана в качестве оценки терапевтической эффективности. Измерения галактоманнана потенциально могут быть полезным биомаркером для оценки реакции на противогрибковую терапию в клинических исследованиях. Повышение уровня указывает на терапевтическую неудачу, в то время как снижение уровня указывает на терапевтический успех. Однако препараты эхинокандина, такие как каспофунгин, хотя они и эффективны на животных моделях аспергиллеза, не снижают уровень галактоманнана. Цель этой работы состояла в том, чтобы определить, уменьшает ли пример 1 уровни галактоманнана в моделях инфекции аспергиллеза мыши и может ли он использоваться в качестве маркера для прогнозирования эффективности в будущей работе.
В некоторых исследованиях выживаемости, описанных ниже, образцы сыворотки собирали у выживших мышей в конце исследования или у мышей, которые подвергались инфекции во время исследования, чтобы изучить эффект соединения примера 1 на уровни галактоманнана и посмотреть, есть ли связь между уровнями галактоманнана и выживанием.
Анализы галактоманнана проводили на образцах сыворотки, которые были заморожены при -80°С. Образцы оттаивали и анализировали с использованием набора для иммуноферментного анализа (ELISA) Platelia Aspergillus Ag (Biorad). Анализ немного изменили, чтобы учесть небольшие объемы проб, доступные от мышей. Если результаты анализа были высокими, повторный тест проводили на образце, разбавленном в нормальной мышиной сыворотке. Количество галактоманнана в образце представлено как индекс галактоманнана. Был рассчитан средний индекс галактоманнана для каждой группы и представлен графически в отношении каждого режима лечения.
Исследование выживаемости
В исследовании по выживаемости оценивали дозу - ответ для примера 1. Пример 1 дозировался перорально мышам, зараженным A. fumigatus 2 уровнями доз 10 мг/кг дважды в день и 3 мг/кг дважды в день. Терапию начали через 24 часа после инфицирования, и терапия продолжалась в течение 8 дней. В конце исследования у выживших животных измеряли почечную нагрузку. Кроме того, образцы сыворотки были взяты в конце исследования у всех выживших животных и от каждого животного, которое умерло в ходе исследования. Они хранились в замороженном состоянии при -80°С для измерения галактоманнана. Кривые выживаемости показаны на Фиг. 5.
Это исследование показывает, что Пример 1, дозируемый перорально при 10 мг/кг дважды в день дает отличную эффективность в мышиных моделях инвазивного аспергиллеза. Пероральные дозы 3 мг/кг дважды в день Примера 1 показывают некоторую эффективность в этой модели, но не могут предотвратить смерть у всех животных. На конец исследования нагрузка тканей составляла 1114 КОЕ/г и 3021 КОЕ/г для дозы 10 мг/кг дважды в день и 3 мг/кг дважды в день соответственно.
Показатели галактоманнана, полученные в исследовании выживаемости 3, показаны на Фиг. 6. Доза примера 1 10 мг/кг дважды в день, которая привела к 100% выживанию в конце исследования, давала очень низкие показатели галактоманнана. У животных, получавших 3 мг/кг дважды в день дозу примера 1 приводила к выживанию только 10% в конце исследования, а показатели галактоманнана были соответственно высокими, примерно такими же, как у необработанных животных. Это наглядно демонстрирует, что низкие показатели галактоманнана хорошо коррелируют с выживаемостью, и что при пероральном введении в подходящей дозе Пример 1 способен снижать показатели галактоманнана у инфицированных A. fumigatus мышей.
Пример 1 против Lomentospora prolificans FMR 3569 в модели диссеминированной инфекции
Культура
L. prolificans (также называемый Scedosporium prolificans или S. prolificans) рос на картофельном агаре с декстрозой (PDA) в течение 5 дней при 35°С. В день заражения культуры были затоплены стерильным солевым раствором и отфильтрованы через стерильную марлю, чтобы удалить колонии конидий и гифы. Получившуюся суспензию корректировали по счету гемоцитометра и по серийному плакированию для подтверждения жизнеспособности.
Животные
В эксперименте использовались самцы мышей OF-1 со средним весом 30 г. Мышей размещали в стандартных клетках с пищей и водой по требованию. Все процедуры на животных контролировались и утверждались Комитетом по охране здоровья животных и этики Университета Ровира и Виргили.
Иммуносупрессия
Мышам делали нейтропению за два дня до заражения внутрибрюшинной (i.p.) инъекцией 200 мг/кг циклофосфамида и один раз каждые 5 дней после этого (Clemons et al, 2005).
Инфекция
Мышей инфицировали 5×104 КОЕ/животное организма L. prolificans FMR 3569, в объеме 0.2 мл стерильного физраствора в латеральную хвостовую вену.
Лечение
Лечение состояло из (а) вориконазола (VRC) (Vfend; Pfizer S.A., Madrid, Spain) при 25 мг/кг перорально, с помощью желудочного зонда один раз в день; (b) Пример 1 при 20 мг/кг, перорально, с помощью желудочного зонда дважды в день; и (с) отсутствие лечения. За 3 дня до заражения мыши, получившие VRC, вместо воды получали грейпфрутовый сок (Sugar & Liu, 2001). Все лечение начиналось через 1 день после заражения, и терапия длилась 9 дней. Контроли не получали никакого лечения.
Для исследований выживаемости для каждого лечения были созданы случайные группы по 10 мышей. Смертность регистрировалась ежедневно до конца эксперимента. Для исследований тканевой нагрузки организовывали группы из 5 животных. Мышей проверяли дважды в день, на 13-й день после заражения группы тканевой нагрузки были подвергнуты эвтаназии с помощью аноксии CO2. Легкие, почки и мозг удалили, гомогенизировали в стерильном физиологическом растворе и нанесли на PDA для расчета КОЕ/г ткани.
Статистический анализ
Среднее время выживания (MST) оценивали по методу Каплана-Мейера и сравнивали между группами с использованием логрангового критерия. В исследованиях тканевой нагрузки количество колоний было log10-трансформировано и сравнивалось с двухсторонним U-критерием Манна-Уитни, используя Graph Pad Prism 5 для Windows. Значения Р≤0,05 считались статистически значимыми.
Результаты выживаемости
Результаты выживаемости показаны на Фиг. 7. Из представленных данных ясно, что применение вориконазола не обеспечивает существенного увеличения в степени выживаемости по сравнению с контролем. Пример 1, в противоположность, обеспечивает увеличение степени выживаемости.
Статистика выживаемости

Статистика нагрузки тканей
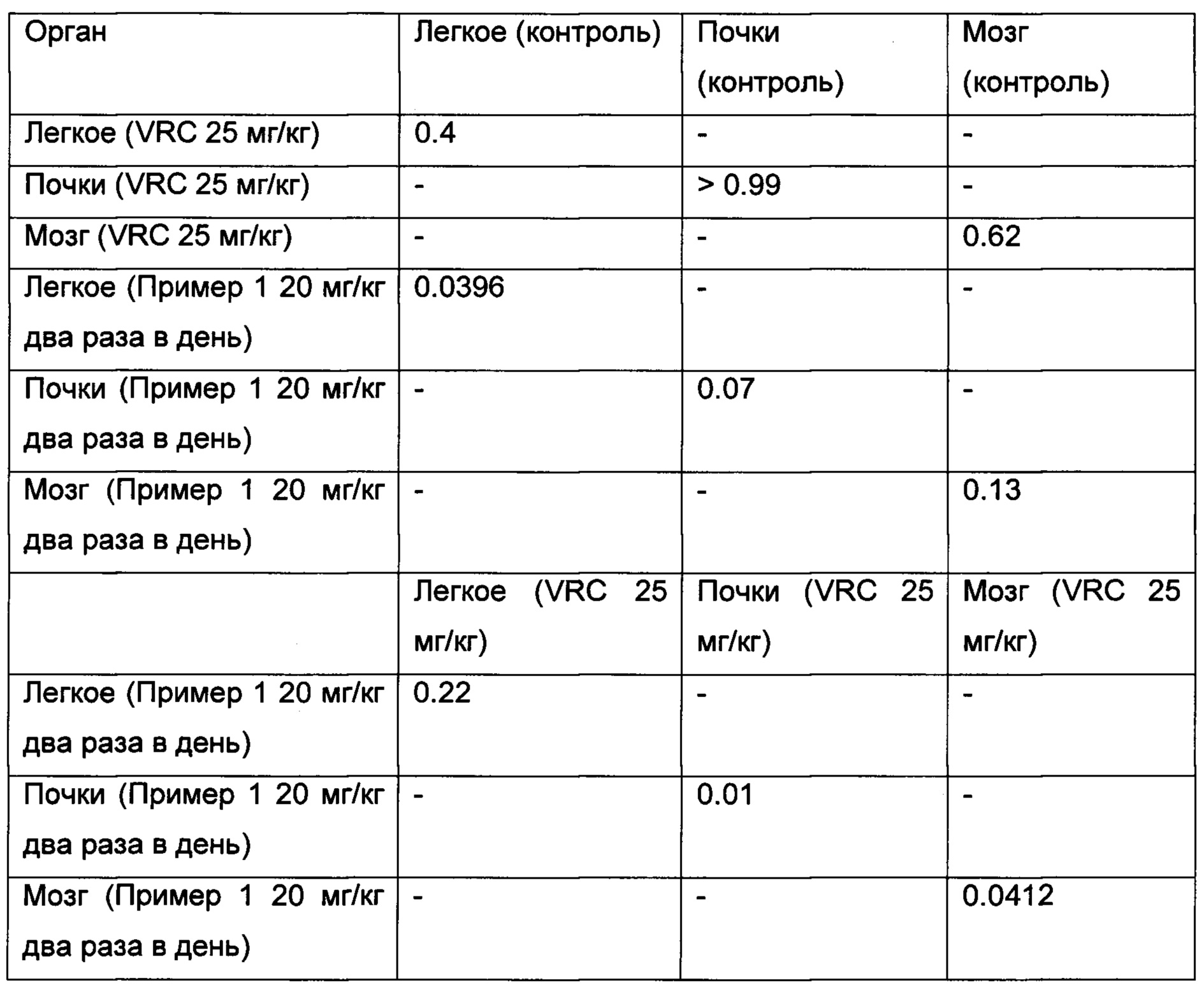
Реферат
Изобретение относится к соединению, которое представляет собой 2-(1,5-диметил-3-фенил-1Н-пиррол-2-ил)-N-(4-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)фенил)-2-оксоацетамид, или к его фармацевтически приемлемой соли. Изобретение также относится к применениям соединения, к фармацевтической композиции, к способу предотвращения или лечения грибкового заболевания, к применению композиции. Технический результат: получено новое соединение, которое может применяться для предотвращения или лечения грибкового заболевания. 6 н. и 4 з.п. ф-лы, 8 ил., 4 пр.
Формула

Документы, цитированные в отчёте о поиске
Ацильные производные азолонов, способ их получения, фармацевтическая композиция на их основе и способ ее получения

Комментарии