Способ и система настройки контроллера с замкнутым контуром регулирования для искусственной поджелудочной железы - RU2652059C2
Код документа: RU2652059C2
Чертежи



Описание
ПРИОРИТЕТ
В настоящей заявке заявляется приоритет согласно п. 35, §119 и 120 Свода федерального законодательства США, а также Парижской конвенции на основании ранее поданной заявки на патент США № 13/708032, который был подан 7 декабря 2012 года (патентный реестр № ANM5278USNP), содержание которого полностью включено в настоящую заявку посредством ссылки.
Предпосылки создания изобретения
Сахарный диабет - хроническое метаболическое расстройство, вызванное неспособностью организма вырабатывать достаточное количество гормона инсулина, что приводит к снижению способности организма усваивать глюкозу. Такая неспособность ведет к гипергликемии, т.е. избыточному содержанию глюкозы в плазме крови. Устойчивая гипергликемия и/или гипоинсулинемия связаны с различными серьезными симптомами и долговременными, угрожающими жизни осложнениями, такими как обезвоживание, кетоацидоз, диабетическая кома, сердечно-сосудистые заболевания, хроническая почечная недостаточность, повреждение сетчатки и повреждение нервов с риском ампутации конечностей. Поскольку восстановить выработку эндогенного инсулина пока невозможно, необходима постоянная терапия для обеспечения непрерывного контроля гликемии, чтобы концентрация глюкозы в крови всегда оставалась в пределах нормы. Такой контроль гликемии достигается путем регулярного введения в организм пациента инсулина извне с целью снижения повышенной концентрации глюкозы.
Экзогенные биологические препараты, такие как инсулин, обычно назначаются в виде смеси быстродействующих лекарственных средств и препаратов с промежуточной длительностью действия, вводимой посредством многократных ежедневных подкожных инъекций с помощью шприца. Обнаружено, что достижимая таким способом степень контроля гликемии ниже оптимальной, так как подобная доставка препарата отличается от физиологической выработки гормона, когда гормон поступает в кровь с меньшей скоростью и на протяжении более длительного времени. Улучшить контроль гликемии возможно с помощью так называемой интенсивной гормональной терапии, основанной на многократных ежедневных инъекциях, включающих в себя одну или две инъекции гормона длительного действия в сутки для создания базальной концентрации гормона и дополнительные инъекции быстродействующего гормона перед каждым приемом пищи в количестве, пропорциональном размеру порции пищи. Хотя инсулиновые шприцы-ручки по меньшей мере частично заменили традиционные шприцы, частые инъекции очень неудобны для пациентов, особенно тех, кто не в состоянии делать себе инъекции надлежащим образом.
Разработка устройства для доставки лекарственных средств значительно улучшила лечение диабета, избавив пациента от необходимости многократных ежедневных инъекций с помощью шприцев или шприц-ручек. Устройство для доставки лекарственного средства позволяет вводить лекарственное средство способом, более близким к естественным физиологическим процессам, и может регулироваться в соответствии со стандартными или индивидуальными протоколами, чтобы добиться лучшего контроля гликемии у пациента.
Кроме того, устройства для доставки лекарств позволяют вводить лекарственные средства непосредственно во внутрибрюшинное пространство или внутривенно. Устройства для доставки лекарственных средств могут быть сконструированы в виде имплантируемых устройств для установки под кожу или в виде внешних устройств с инфузионной системой для подкожных инфузий посредством чрескожного катетера, канюли или трансдермального транспорта лекарственного средства, например через пластырь. Внешние устройства для доставки лекарственных средств размещаются поверх одежды, прячутся под одежду или внутри нее либо размещаются на поверхности тела и обычно управляются с помощью встроенного пользовательского интерфейса или отдельного устройства для дистанционного управления.
Для достижения приемлемого контроля гликемии необходимо периодическое измерение концентрации глюкозы в крови или тканевой жидкости. Например, доставка соответствующего количества инсулина с помощью устройства для доставки лекарственных средств требует от пациента регулярного определения концентрации глюкозы в его крови и ручного ввода этого значения с помощью пользовательского интерфейса для внешних насосов, который затем рассчитывает требуемое изменение протокола введения инсулина по умолчанию или текущего протокола, т.е. дозировки и времени введения, и взаимодействует с устройством для доставки лекарственного средства с целью регулировки его работы соответствующим образом. Для определения концентрации глюкозы в крови обычно используются устройства для эпизодического измерения, например ручные электронные анализаторы, использующие тест-полоски для анализа крови ферментативным методом и вычисляющие концентрацию глюкозы на основании ферментативной реакции.
На протяжении последних 20 лет также используется непрерывный контроль глюкозы в сочетании с устройствами для доставки лекарственных средств, что позволяет управлять инфузией больным диабетом инсулина с помощью механизма обратной связи. Для обеспечения возможности контроля инфузии инсулина применяются пропорционально-интегрально-дифференциальные (ПИД) контроллеры с математической моделью взаимодействий между глюкозой и инсулином у человека. ПИД-контроллеры можно настраивать на основании простых правил метаболических моделей. Однако если конфигурировать или настроить ПИД-контроллеры на агрессивную регулировку концентрации глюкозы в крови у пациента, то может произойти передозировка, превышающая установленный уровень, за которой часто следуют колебания, крайне нежелательные в контексте регуляции концентрации глюкозы в крови. Были исследованы альтернативные контроллеры. Установлено, что контроллер с прогнозирующей моделью (КПМ), применяющийся в нефтехимической промышленности и характеризующийся значительными временными задержками и системными откликами, наиболее подходит для регулировки сложных взаимоотношений между инсулином, глюкагоном и глюкозой в крови. Показано, что КПМ более устойчив, чем ПИД, так как КПМ учитывает эффекты изменений в ближайшем будущем и ограничения при определении выхода КПМ, в то время как ПИД обычно учитывает только предыдущие выходы при определении будущих изменений. В КПМ могут использоваться ограничения, например, таким образом, чтобы КПМ предотвращал выход системы из-под контроля, когда предел уже достигнут. Другим преимуществом КПМ является то, что модель в КПМ может в некоторых случаях теоретически компенсировать динамические изменения системы, в то время как при регулировке по принципу обратной связи, такой как ПИД-контроль, подобная динамическая компенсация невозможна.
Таким образом, КПМ можно рассматривать как сочетание регулирования по принципу обратной связи и опережающего регулирования. Однако КПМ обычно требует метаболической модели, как можно точнее имитирующей взаимоотношения между инсулином и глюкозой в биологической системе. Таким образом, из-за индивидуальных биологических различий процесс разработки и уточнения КПМ все еще продолжается; детали КПМ, варианты КПМ и математических моделей, представляющих сложные взаимодействия между глюкозой и инсулином, показаны и описаны в следующих документах:
патент США № 7,060,059;
заявки на патент США № 2011/0313680 и 2011/0257627;
Международная публикация WO 2012/051344;
Percival et al., «Closed-Loop Control and Advisory Mode Evaluation of an Artificial Pancreatic β Cell: Use of Proportional-Integral-Derivative Equivalent Model-Based Controllers» Journal of Diabetes Science and Technology, Vol. 2, Issue 4, July 2008;
Paola Soru et al., «MPC Based Artificial Pancreas; Strategies for Individualization and Meal Compensation» Annual Reviews in Control 36, p. 118-128 (2012);
Cobelli et al., «Artificial Pancreas: Past, Present, Future» Diabetes Vol. 60, Nov. 2011;
Magni et al., «Run-to-Run Tuning of Model Predictive Control for Type 1 Diabetes Subjects: In Silico Trial» Journal of Diabetes Science and Technology, Vol. 3, Issue 5, September 2009;
Lee et al., «A Closed-Loop Artificial Pancreas Using Model Predictive Control and a Sliding Meal Size Estimator» Journal of Diabetes Science and Technology, Vol. 3, Issue 5, September 2009;
Lee et al., «A Closed-Loop Artificial Pancreas based on MPC: Human Friendly Identification and Automatic Meal Disturbance Rejection» Proceedings of the 17th World Congress, The International Federation of Automatic Control, Seoul Korea July 6-11, 2008;
Magni et al., «Model Predictive Control of Type 1 Diabetes: An in Silico Trial» Journal of Diabetes Science and Technology, Vol. 1, Issue 6, November 2007;
Wang et al., «Automatic Bolus and Adaptive Basal Algorithm for the Artificial Pancreatic β-Cell» Diabetes Technology and Therapeutics, Vol. 12, No. 11, 2010;
Percival et al., «Closed-Loop Control of an Artificial Pancreatic β-Cell Using Multi-Parametric Model Predictive Control» Diabetes Research 2008.
Все статьи или документы, процитированные в этой заявке, включены в нее во всей своей полноте посредством ссылок.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Заявители изобрели методику, которая позволяет осуществлять настройку контрольной прогнозирующей модели на основе двух переменных, относящихся к калибровочным и потерянным или неполным данным, полученным в ходе непрерывного контроля глюкозы (НКГ). В частности, способ используется для контроля инфузионного насоса при помощи контроллера, предназначенного для управления насосом и получения данных по меньшей мере от одного датчика глюкозы. Способ может быть реализован путем следующих этапов, на которых происходит измерение концентрации глюкозы у пациента при помощи датчика глюкозы, обеспечивающее по меньшей мере одно определение концентрации за каждый временной интервал из серии индексированных дискретных временных интервалов (k); проводится калибровочное измерение глюкозы в течение по меньшей мере одного временного интервала из серии индексированных интервалов для получения калибровочного индекса; устанавливается, не было ли пропущено одно или более измерений глюкозы в течение временного интервала из серии индексированных интервалов, для получения индекса пропуска; на основании калибровочного индекса и индекса пропуска определяется коэффициент настройки; вычисляется количество инсулина для доставки при помощи контроллера на основе контроллера с прогнозирующей моделью, в котором используется: (a) множество измерений глюкозы для прогнозирования изменений концентрации глюкозы, исходя из оценок метаболического состояния пациента, и (b) коэффициент настройки для получения вычисленного количества инсулина для доставки пациенту для каждого индексированного интервала времени; доставляется инсулин, количество которого было определено на этапе вычисления.
В еще одном аспекте предлагается система контроля диабета, которая содержит глюкометр для эпизодического измерения, глюкометр для непрерывного измерения и соединенный с контроллером инфузионный насос. Глюкометр для эпизодического измерения выполнен с возможностью определения концентрации глюкозы в крови пациента через дискретные и неоднородные временные интервалы и представления подобных эпизодических концентраций глюкозы в крови в виде калибровочных индексов для каждого временного интервала в индексированном интервале времени (k). Глюкометр для непрерывного измерения, который постоянно измеряет концентрацию глюкозы в крови пациента через дискретные и, как правило, равномерные временные интервалы и представляет концентрацию глюкозы для каждого интервала в виде данных измерения глюкозы, в которых любой пропуск измерения глюкозы через любой интервал времени сохраняется в виде индекса пропуска. Инфузионный насос для инсулина управляется контроллером для доставки инсулина пациенту. Контроллер связан с насосом, глюкометрами для эпизодического и непрерывного измерения, при помощи которых контроллер определяет коэффициент настройки на основании (a) калибровочного индекса, полученного при эпизодическом измерении глюкозы в крови, и (b) индекса пропуска для контрольной прогностической модели, благодаря чему контроллер определяет скорость доставки инсулина для каждого временного интервала в индексированном временном интервале (k) из контрольной прогностической модели, основанной: (1) на необходимой концентрации глюкозы, (2) концентрации глюкозы, измеренной глюкометром для непрерывного измерения в каждом временном интервале в индексированном интервале времени (k), и (3) коэффициенте настройки.
В любом из описанных выше аспектов также можно использовать следующие элементы в комбинации с каждым из аспектов. Например, по меньшей мере один датчик глюкозы может содержать датчик глюкозы для непрерывного определения и глюкометр для эпизодического измерения, а коэффициент настройки может быть получен из уравнения следующего вида:

где: (k) может быть коэффициентом настройки в каждом временном интервале в индексированном интервале времени k
так, что Rмин≤R(k)μRмакс;
Rном может быть предварительно заданным номинальным коэффициентом настройки;
k может быть дискретным индексом временного интервала;
RНОМ≤RМАКС≤100*RНОМ;
RНОМ/100≤RМИН
(RМАКС-RМИН)/500≤r1≤(RMАКС-RMИН)/50;
(RМАКС-RМИН)/50≤r2≤(RMАКС-RMИН)/5;
КАЛ(k) может быть калибровочным индексом, при этом
КАЛ(k)=k-kкал-6(для k-kкал≥6) или
КАЛ(k)=k-kкал2-6(для k-kкал<6);
kкал может быть индексом образца из самой последней калибровки датчика глюкозы для непрерывного измерения;
kкал2 может быть индексом образца из предпоследней калибровки датчика глюкозы для непрерывного измерения;
ПРОПУСК(k) может быть индексом пропуска, при котором одно или более значений концентрации глюкозы, полученные в течение серии временных интервалов с индексом k, были пропущены или не учтены контроллером.
В каждом из приведенных выше аспектов значение r1 может принимать любое значение приблизительно от 1 до 50, а r2 может принимать любое значение приблизительно от 10 до 500.
Эти и другие варианты осуществления, признаки и преимущества станут очевидны специалистам в данной области после изучения представленного ниже более подробного описания различных примеров осуществления настоящего изобретения в сочетании с сопроводительными чертежами, которые кратко описаны в начале заявки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Сопроводительные чертежи, включенные в настоящий документ и составляющие неотъемлемую часть настоящего описания, иллюстрируют предпочтительные в настоящее время варианты осуществления настоящего изобретения и в сочетании с приведенным выше общим описанием и представленным ниже подробным описанием призваны разъяснить признаки настоящего изобретения (причем аналогичными номерами указаны аналогичные элементы).
На фиг. 1 показана система, в которой контроллер насоса или датчик(и) глюкозы отделен от инфузионного насоса и датчика(ов) глюкозы и в которой контроллер можно подключить к сети с целью проведения контроля в реальном времени.
На фиг. 2А показан пример осуществления системы для лечения диабета в схематической форме.
На фиг. 2В показана кривая значений концентрации глюкозы для значений индекса k от 0 до 300, где другие события, такие как потеря данных НКГ или калибровочные измерения, наложены на кривую значений концентрации глюкозы.
На фиг. 2С показан коэффициент настройки по той же шкале индекса k от 0 до 300, причем значение коэффициента настройки R зависит от потери данных НКГ и калибровочного измерения.
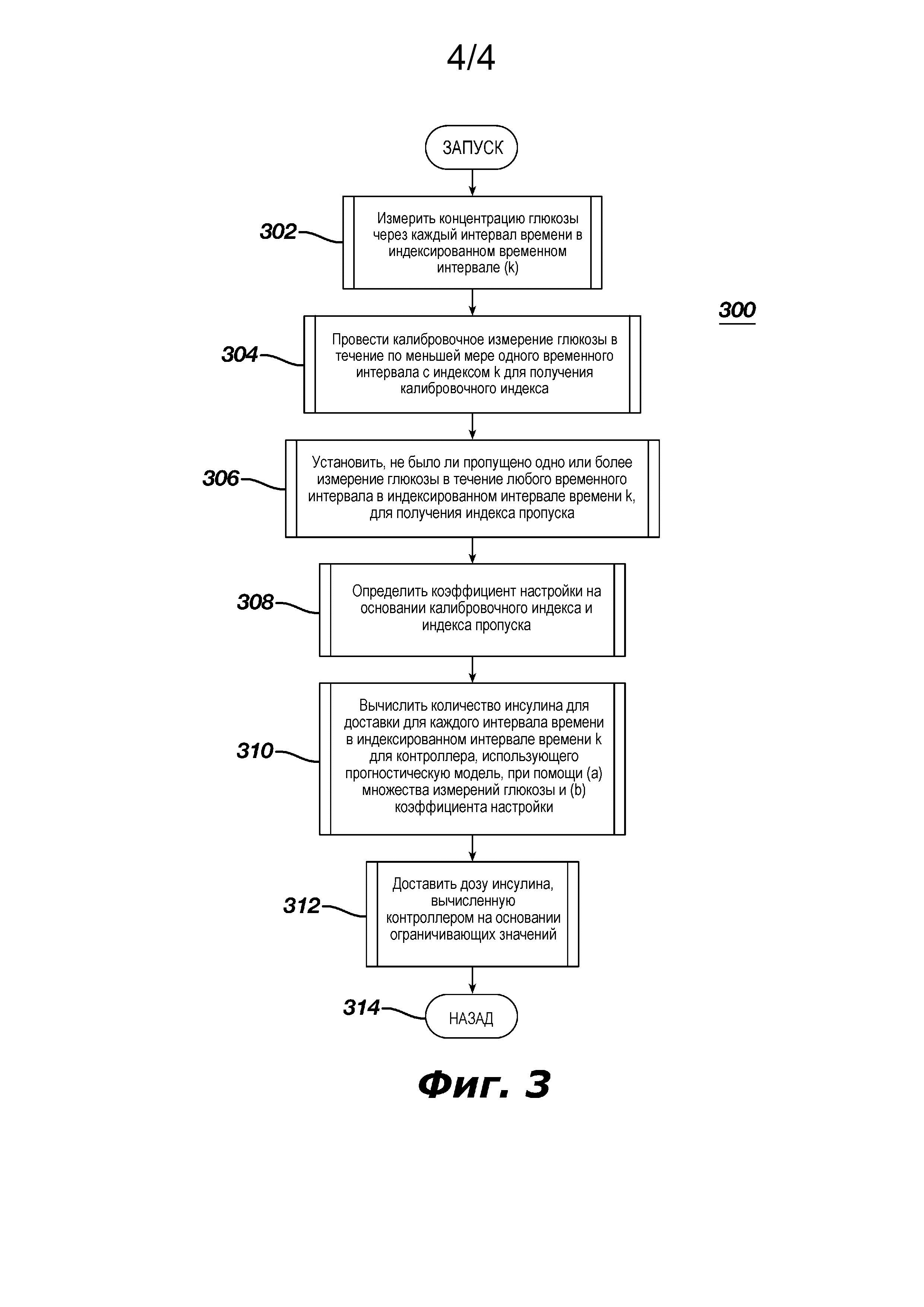
На фиг. 3 показана логика, применяющаяся в контроллере согласно фиг. 1 или 2А.
ВАРИАНТЫ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Приведенное ниже подробное описание следует толковать со ссылкой на чертежи, на которых аналогичные элементы на разных чертежах пронумерованы идентично. Чертежи, не обязательно выполненные в масштабе, показывают выбранные варианты осуществления и не призваны ограничить объем настоящего изобретения. В подробном описании принципы настоящего изобретения описаны с помощью примеров, которые не имеют ограничительного характера. Несомненно, настоящее описание позволяет специалистам в данной области реализовать и применять настоящее изобретение и включает несколько вариантов осуществления, адаптаций, вариаций, альтернатив и применений настоящего изобретения, включая те, которые в настоящее время считаются наилучшими вариантами реализации настоящего изобретения.
В настоящем документе термин «приблизительно» в отношении любых числовых значений или диапазонов указывает на применимый допуск на размер, который позволяет отдельной детали или совокупности компонентов выполнять функцию, предусмотренную для них в настоящем документе. Кроме того, в настоящем документе термины «пациент», «оператор», «пользователь» и «субъект» относятся к любому субъекту-человеку или субъекту-животному и не предполагают ограничения применения систем или способов только у человека, хотя применение предмета изобретения у пациента-человека представляет собой предпочтительный вариант осуществления. Кроме того, термин «пользователь» включает в себя не только пациента, использующего инфузионную помпу для введения лекарственного средства, но и ответственных за него лиц (например, родителей или опекунов, сестринский персонал или работников, обеспечивающих уход за пациентом на дому). Термин «лекарственное средство» может включать в себя гормон, биологически активные материалы, фармацевтические препараты или другие химические вещества, вызывающие биологическую реакцию (например, гликемическую реакцию) в организме пользователя или пациента.
На фиг. 1 представлена система 100 доставки лекарственного средства в соответствии с примером осуществления, в котором используются принципы настоящего изобретения. Система 100 доставки лекарственного средства включает устройство 102 доставки лекарственного средства и удаленный контроллер 104. Устройство 102 доставки лекарственного средства соединено с инфузионным набором 106 посредством гибкой трубки 108.
Устройство 102 доставки лекарственного средства выполнено с возможностью передачи данных на удаленный контроллер 104 и приема данных от него, например по радиочастотной связи 112. Устройство 102 доставки лекарственного средства также может функционировать как самостоятельное устройство со своим собственным встроенным контроллером. В одном варианте осуществления устройство для доставки лекарственного средства 102 представляет собой устройство для инфузии инсулина, а удаленный контроллер 104 - ручной портативный контроллер. В таком варианте осуществления данные, переданные от устройства для доставки лекарственного средства 102 на удаленный контроллер 104, могут включать такую информацию, как, например, данные о доставке инсулина, информация о концентрации глюкозы в крови, базальной концентрации, болюсном введении, соотношении инсулина и углеводов или коэффициенте чувствительности к инсулину, в качестве нескольких примеров. Конфигурация контроллера 104 включает КПМ-контроллер 10, запрограммированный таким образом, чтобы непрерывно получать результаты измерения глюкозы от датчика для непрерывного измерения концентрации глюкозы в крови 112. Данные, переданные от удаленного контроллера 104 на устройство для доставки инсулина 102, могут включать результаты измерения глюкозы и базу данных о приеме пищи, чтобы устройство для доставки лекарственного средства 102 могло вычислить количество инсулина, которое должно быть доставлено устройством для доставки 102. Альтернативно удаленный контроллер 104 может выполнять расчеты базальной дозы или болюсного введения и направлять результаты таких расчетов на устройство доставки лекарственного средства. В альтернативном варианте осуществления глюкометр 114 для эпизодического измерения может применяться отдельно или в сочетании с датчиком 112 НКГ, подавая данные на контроллер 104 и/или устройство 102 доставки лекарственного средства. Альтернативно удаленный контроллер 104 может совмещаться с глюкометром 114 в (a) интегрированном цельном устройстве или (b) двух отдельных устройствах, которые могут соединяться друг с другом с образованием интегрированного устройства. Каждое из устройств 102, 104 и 114 имеет подходящий микроконтроллер (не показан для краткости), запрограммированный на выполнение различных функций.
Устройство 102 доставки лекарственного средства также может быть сконфигурировано для двунаправленной беспроводной связи с удаленной станцией 116 контроля состояния здоровья через, например, беспроводную сеть связи 118. Удаленный контроллер 104 и удаленная станция 116 контроля могут быть сконфигурированы для двунаправленной проводной связи через, например, сеть связи на основе телефонной линии. Удаленная станция 116 контроля может применяться, например, для загрузки обновленного программного обеспечения на устройство 102 доставки лекарственного средства и для обработки информации от устройства 102 доставки лекарственного средства. Примеры удаленных станций 116 контроля могут включать без ограничений персональный или сетевой компьютер 126, сервер 128 с памятью для хранения, карманный персональный компьютер, другой мобильный телефон, базовую станцию контроля в больнице или специальную удаленную станцию клинического контроля.
Устройство 102 для доставки лекарственного средства включает в себя компоненты для обработки электронного сигнала, том числе центральный процессор и элементы памяти для хранения программ управления и операционных данных, радиочастотный модуль 116 для отправки и приема радиокоммуникационных сигналов (т.е. сообщений) на удаленный контроллер 104 или от него, дисплей для отображения рабочей информации для пользователя, множество навигационных кнопок, позволяющих пользователю вводить информацию, аккумулятор для подачи питания системы, предупреждения (визуальные, звуковые или тактильные) для обратной связи с пользователем, вибрационное устройство для обратной связи с пользователем, механизм доставки лекарственного средства (например, насос и приводной механизм) для вытеснения инсулина из инсулинового резервуара (например, патрона с инсулином) через боковое отверстие, к которому подключена инфузионная система 108/106, в тело пользователя.
Уровни или концентрации глюкозы можно определять с применением датчика 112 НКГ. Датчик 112 для непрерывного контроля глюкозы использует технологию амперометрического электрохимического измерения для определения глюкозы с помощью трех электродов, функционально связанных с электроникой датчика и покрытых чувствительной мембраной и биоинтерфейсной мембраной, которые присоединены с помощью зажима.
Верхние концы электродов находятся в контакте с электролитной фазой (не показана), которая представляет собой свободно плавающую жидкую фазу, расположенную между чувствительной мембраной и электродами. Чувствительная мембрана может включать фермент (например, глюкооксидазу), который покрывает фазу электролита. В данном примере датчика предложен противоэлектрод для уравновешивания тока, генерируемого веществом при измерении на рабочем электроде. В случае датчика глюкозы на основе глюкооксидазы веществом, измеряемым на рабочем электроде, является H2O2. Ток, получаемый на рабочем электроде (и протекающий через схему к противоэлектроду), пропорционален диффузионному потоку H2O2. Соответственно, можно получить необработанный сигнал, который представляет концентрацию глюкозы в теле пациента и поэтому может быть использован для оценки содержательного значения глюкозы. Подробная информация о датчике и сопутствующих компонентах показана и описана в патенте США № 7276029, который полностью включен в настоящий документ посредством ссылки. В одном варианте осуществления может быть использован датчик непрерывного измерения глюкозы из системы Dexcom Seven® (производитель - компания Dexcom Inc.) с примерами осуществления, описанными в настоящем документе.
В одном варианте осуществления могут использоваться следующие компоненты в качестве системы для лечения диабета, созданной по типу искусственной поджелудочной железы: система для лечения диабета OneTouch Ping® корпорации Animas, содержащая по меньшей мере один инфузионный насос и датчик глюкозы для эпизодического измерения; система DexCom® SEVEN PLUS® для НКГ корпорации DexCom с интерфейсом для соединения этих компонентов, запрограммированным на языке программирования MATLAB®; вспомогательное аппаратное обеспечение для соединения компонентов друг с другом и алгоритм управления в виде КПМ, который автоматически регулирует скорость доставки инсулина на основании концентрации глюкозы у пациента, предыдущих измерений глюкозы, предполагаемых изменений концентрации глюкозы в будущем и индивидуальной информации о пациенте.
На фиг. 2А показана схема 200 системы 100 с фиг. 1, запрограммированной с использованием разработанного заявителями решения, чтобы предотвратить снижение эффекта системы управления на основе обратной связи ниже желаемого. В частности, на фиг. 2А представлен КПМ, запрограммированный как модуль логического управления 10, использующийся в контроллере 104. Модуль логического управления 10 КПМ получает необходимую концентрацию глюкозы или диапазон концентрации глюкозы 12 (наряду с любой модификацией от фильтра обновления 28) так, чтобы быть способным поддерживать выходной сигнал (т.е. концентрацию глюкозы) пациента в необходимом диапазоне концентрации глюкозы.
Как показано на фиг. 2А, первый выход 14 устройства 10 логического управления с активированным КПМ может быть управляющим сигналом для инсулинового насоса 16 на доставку желаемого количества инсулина 18 пациенту 20 через предварительно заданные временные интервалы, которые могут индексироваться каждые 5 минут при помощи индекса временных интервалов k. Второй выход в форме прогнозируемого значения концентрации глюкозы 15 может использоваться в управляющем соединении B. Датчик глюкозы 22 (или 112 на фиг. 1) измеряет концентрацию глюкозы у пациента 20, чтобы подать сигналы 24, отражающие фактическую или измеренную концентрацию глюкозы, на управляющее соединение B, которое учитывает различие между результатом измерения концентрации глюкозы 24 и прогнозами КПМ относительно этой измеренной концентрации глюкозы. На основании этого различия на фильтр обновлений 26 переменных состояний модели подается информация. Разница 26 служит параметром оценки (также фильтр обновлений 28) и позволяет оценить переменные состояния в модели, которые нельзя измерить непосредственно. Предпочтительно, когда фильтр обновлений 28 является рекурсивным фильтром в форме фильтра Кальмана с подстройкой параметров для модели. Выходной сигнал фильтра обновлений 28, или рекурсивного фильтра, передается на управляющее соединение A, выход которого используется КПМ в устройстве 10 логического управления для дальнейшего уточнения управляющего сигнала 14 к насосу 16 (или 102 на фиг. 1). Коэффициент настройки 34 используется с контроллером 10 КПМ для «настройки» контроллера при доставке инсулина. Для достижения этой цели для корректировки коэффициента настройки заявители разработали применение модуля 30 калибровочного индекса и модуля 32 пропуска данных. Модуль 30 калибровочного индекса выполнен с возможностью отслеживания количества калибровок измерения глюкозы, которое обычно проводится глюкометром для эпизодического измерения, такого как, например, тест-полоска для определения глюкозы в крови и система для измерения. Модуль 32 пропуска данных выполнен с возможностью отслеживания количества пропущенных измерений или данных, полученных от глюкометра 22 для непрерывного измерения глюкозы.
Здесь необходимо привести краткий обзор упомянутого выше КПМ, в котором используется устройство 10 логического управления. Логика КПМ формулируется таким образом, чтобы она обеспечивала контроль концентрации глюкозы у пациента в пределах зоны безопасных значений глюкозы, причем нижняя граница концентрации глюкозы в крови в данной зоне составляет 80-100 мг/дл, а верхняя граница концентрации глюкозы в крови составляет 140-180 мг/дл; в дальнейшем этот алгоритм будет называться КПМ-зоной. В целом контроль желаемой зоны применяется к контролируемым системам, в которых отсутствует специфическое установленное значение, при этом цель контроллеров заключается в поддержании контролируемой переменной (КП), например значения глюкозы, в пределах установленной зоны. Контроль с целью поддержания в определенной зоне (т.е. нормогликемической зоне) очень хорошо подходит для искусственной поджелудочной железы по причине отсутствия установленного значения гликемии в естественных условиях. Кроме того, преимуществом метода контроля в определенной зоне является способность к ограничению срабатывания/активности насоса таким образом, что при сохранении концентрации глюкозы в пределах зоны дополнительной коррекции не предлагается.
В реальном времени правило, регулирующее скорость доставки инсулина ID при КПМ-зоне, вычисляется путем оптимизации в реальном времени, при этом в каждый момент времени получения выборки оценивается скорость доставки следующей дозы инсулина. Оптимизация в каждый момент времени получения выборки основывается на оценке метаболического состояния (концентрация глюкозы в плазме, подкожное введение инсулина), полученной из динамической модели, сохраненной в модуле 10.
Устройство 10 логического управления КПМ включает в себя подробную модель динамики глюкозы-инсулина у человека при сахарном диабете I типа. Модель используется для прогнозирования будущих значений концентрации глюкозы и для вычисления будущих действий контроллера для приведения графика концентраций глюкозы в желаемый диапазон. КПМ в контроллерах формулируется для использования в системах с дискретным и непрерывным отсчетом времени; контроллер устанавливается на дискретное время, при этом индекс




В связи с этим мы начинаем с исходной линейной модели различия, применяемой для КПМ-зоны:
ур. (1)
где:
k является индексом дискретного временного интервала, имеющим серию индексных счетчиков, где k=1, 2, 3…
G' является измеренной концентрацией глюкозы;
IM является «инсулином, внесенным в схему введений», количество которого не было измерено;
I'D является доставленным инсулином или регулируемой переменной;
коэффициенты a1~2,993; a2~(-3,775); a3~2,568; a4~(-0,886); a5~0,09776; b~(-1,5); c1~1,665; c2~(-0,693); d1~0,01476; d2~0,01306.
При помощи одобренной FDA метаболической модели, известной специалистам в данной области, ур. (1) может быть упрощено до следующей линейной модели различия в ур. (2):

где:
G' является переменной величиной отклонения (мг/дл) выхода концентрации глюкозы (G), т.е.
мг/дл;
ID' является переменной величиной отклонения (Ед/ч) входа скорости инфузии инсулина (ID ), т.е.

Приемпищи является входом потребления углеводов (граммы углеводов);
IM является скоростью подкожной инфузии инсулина в соответствии со схемой введения (Ед/ч);
ПриемпищиM является входом потребления углеводов в соответствии со схемой введения (граммы углеводов).
Динамическая модель в ур. (2) относится к влиянию скорости инфузии инсулина (ID) и входа потребленных углеводов (Приемпищи) на концентрацию глюкозы в плазме. Эта модель представляет собой единичную среднюю модель для общей популяции субъектов. Модель и ее параметры фиксированы.
Передаточные функции входов второго порядка, описанные в частях (b) и (c) в ур. (2), применяются для генерации искусственных сведений о вводах в памяти при использовании схемы КПМ-зоны для предотвращения передозировки инсулина и, следовательно, гипогликемии. Во избежание доставки чрезмерного количества инсулина при оценке любого последовательного введения инсулина необходимо учитывать инсулин, введенный в последний раз, в сравнении с длительностью действия инсулина. Однако линейная модель различия одного состояния с относительно низким порядком использует выход (гликемию) в качестве основного источника предыдущих вводов (инсулина) в памяти. В связи с несоответствием модели возможен шум или изменение чувствительности пациента к инсулину, что может привести к доставке недостаточного или избыточного количества инсулина. Этот эффект можно снизить добавлением двух дополнительных состояний (IM и ПриемпищиM) для внесенных в схему введений инсулина и приемов пищи с более длительной памятью об инсулине.
КПМ-зона применяется, когда специфическое установленное значение контролируемой переменной (КП) имеет низкую значимость по сравнению с зоной, задающейся верхней и нижней границами. Кроме того, в присутствии шума и несоответствия модели использование фиксированной установки не имеет практического значения. КПМ-зона была разработана в ходе исследований, проводимых в Калифорнийском университете в Санта-Барбаре и Институте изучения диабета Сансума. Подробная информация о разработке методики КПМ-зоны представлена и описана в следующих источниках: Benyamin Grosman, Ph.D., Eyal Dassau, Ph.D., Howard C. Zisser, M.D., Lois Jovanovič, M.D. и Francis J. Doyle III, Ph.D. «Zone Model Predictive Control: A Strategy to Minimize Hyper and Hypoglycemic Events» Journal of Diabetes Science and Technology, Vol. 4, Issue 4, July 2010, и публикации заявки на патент США № 2011/0208156, принадлежащей Doyle et al., под названием «Systems, Devices, and Methods to Deliver Biological Factors or Drugs to a Subject», которая была опубликована 25 августа 2011 года и включена в настоящий документ посредством ссылки с копией в приложении. Дополнительная информация о КПМ-зоне показана и описана в публикации заявки на патент США № 20110208156, включенной в настоящий документ посредством ссылки с копией в приложении. Похожая разработка КПМ-зоны была представлена в работе Maciejowski JM., «Predictive Control with Constraints» Harlow, UK: Prentice-Hall, Pearson Education Limited, 2002. КПМ-зона вводится путем задания фиксированных верхней и нижней границ в качестве гибких ограничивающих значений, чтобы величины при оптимизации переключались между нулем и некоторыми окончательными значениями, когда предсказанные КП находятся внутри или вне желаемой зоны соответственно. Прогнозируемые разности обычно определяются как различие между КП, выходящей за пределы желаемой зоны, и ближайшей границей. КПМ-зона обычно делится на три разные зоны. Разрешенный диапазон является целью контроля и определяется верхней и нижней границами. Верхняя зона представляет нежелательные высокие прогнозируемые значения гликемии. Нижняя зона представляет нежелательные низкие прогнозируемые значения гликемии, что представляет зону гипогликемии или защитную область перед гипогликемией, которая считается нижней зоной предупреждения. КПМ-зона оптимизирует прогнозируемую гликемию путем манипуляций с действиями, направленными на контроль инсулина в ближайшем будущем, чтобы концентрация оставалась в разрешенной зоне, ограниченной указанными значениями.
Сущность КПМ-зоны заключается в целевой функциональной формулировке, которая содержит формулировку зоны. КПМ-зона, как и любые другие формы КПМ, прогнозирует будущие результаты с помощью подробной модели с использованием прошлых данных о вводах/выходах и будущих входных сигналов, которые нужно оптимизировать. Однако вместо приведения к специфическому фиксированному установленному значению попытки оптимизации направлены на поддержание или смещение прогнозируемых результатов в зону, заданную верхней и нижней границами. С помощью линейной модели различия прогнозируется динамика гликемии и проводится оптимизация, снижающая колебания гликемии в будущем за пределы зоны, определенной ограничениями и значениями, заданными в ее функции стоимости.
Используемая в представленной работе целевая функция J КПМ-зоны обозначена следующим образом:

или применимо к нашей задаче:

где:
Q является коэффициентом взвешивания для прогнозируемого значения глюкозы;
R является коэффициентом настройки для предполагаемых будущих входов в рамках целевой функции;
f является прогнозирующей функцией (в ур. (2));
вектор ID содержит набор доз инсулина для инфузии, предлагаемых в ближайшем будущем. Он является «регулируемой переменной», поскольку она корректируется в соответствии с поиском минимального значения J.
G-зона является переменной, количественно выражающей отклонение спрогнозированных в модели будущего НКГ значений G от пределов конкретной гликемической зоны и определенной путем проведения следующих сравнений:

где гликемическая зона ограничена верхним пределом GZH и нижним пределом GZL.
Таким образом, если все спрогнозированные значения глюкозы находятся в пределах зоны, то каждый элемент Gзоны равен 0, вследствие чего функция J сведена к минимуму при базальном режиме ID для этого времени дня, т.е. для пациентов с текущей базальной скоростью инфузии инсулина используется алгоритм по умолчанию. С другой стороны, если любое из спрогнозированных значений глюкозы выходит за пределы зоны, то G-зона > 0, что оказывает влияние на целевую функцию. В этом случае предлагаемые в ближайшем будущем дозы инсулина для инфузии ID будут отличаться от базальных для предотвращения какого-либо отклонения G-зоны за пределы зоны, что также оказывает влияние на целевую функцию. Затем находят количественный баланс при помощи оптимизации, основанной на коэффициенте взвешивания R.
Для решения проблем с оптимизацией уравнений (2)-(5) используется имеющееся в продаже программное обеспечение (например, функция «fmincon.m» MATLAB). При использовании этой функции для каждой оптимизации используются следующие параметры:
Начальное приближение для скорости доставки инсулина ID’(0) является нулевым вектором

Максимальное количество допустимых оцениваний при помощи функции Max_f = 100*M, где M является описанным ранее контрольным интервалом.
Максимальное количество итераций Max_i=400, оно является фиксированным.
Прекращение вычисления целевой функции происходит при значении Term_cost = 1e-6, оно является фиксированным.
Прекращение вычисления отклонения Term_tol для регулируемых переменных ID’ составляет 1e-6.
К регулируемым переменным (ID’) применяются следующие жесткие ограничения:

где базальный режим является базальной скоростью доставки, которая была установлена пациентом или его/ее врачом;
ожидаемые значения находятся в диапазоне 0,6-1,8 Ед/ч.
Хотя значения параметра контрольного интервала M и параметра предполагаемого интервала P значительно влияют на рабочие характеристики контроллера и в норме применяются для настройки контроллера на основе КПМ, они могут быть настроены эвристически на основании знаний системы. Правила настройки хорошо известны специалистам в данной области. В соответствии с этими правилами M и P могут принимать значения в следующих диапазонах:

В предпочтительных вариантах осуществления мы использовали номинальные значения M=5 и P=108.
Отношение коэффициента взвешивания ошибки выходной величины Q и весовой матрицы изменений входа или коэффициента настройки R может принимать значения в диапазоне:

В предпочтительных вариантах осуществления мы использовали номинальное значение R/Q=500.
После включения и запуска контроллера вычисления в реальном времени выполняются каждые 5 минут в соответствии со временем отбора проб для измерения датчиком глюкозы. Первый элемент ID доставляется пациенту в виде дозы инсулина при помощи инсулинового насоса, после истечения пяти минут станет доступно новое считывание в рамках НКГ и процесс повторяется. Следует заметить, что будущие действия контроллера имеют жесткие ограничения, обусловленные способностью инсулинового насоса к доставке инсулина на максимальной скорости или неспособностью к доставке отрицательных значений инсулина. Прочие детали, связанные с предметом, включая оценку состояния и другие КПМ, описаны здесь: Rachel Gillis et al., «Glucose Estimation and Prediction through Meal Responses Using Ambulatory Subject Data for Advisory Mode Model Predictive Control» Journal of Diabetes Science and Technology Vol. 1, Issue 6, Nov. 2007, и Youqing Wang et al., «Closed-Loop Control of Artificial Pancreatic β-Cell in Type 1 Diabetes Mellitus Using Model Predictive Iterative Learning Control» IEEE Transactions on Biomedical Engineering, Vol. 57, No. 2, February 2010, которые полностью включены в настоящую заявку посредством ссылки.
Известно, что коэффициент настройки (обозначаемый в данном документе как «R») может оказывать значительное воздействие на качество контроля глюкозы. Параметр, известный как фактор агрессивности, коэффициент усиления и т.д., определяет скорость ответа алгоритма на изменения концентрации глюкозы. При относительно завышенном значении R контроллер замедляет свою работу для регуляции дозы инсулина для инфузии (относительно базальной) в ответ на изменения концентрации глюкозы; с другой стороны, относительно агрессивное значение R приводит к тому, что контроллер быстро отвечает на изменения концентрации глюкозы. В принципе, агрессивный режим работы контроллера может привести к лучшему контролю глюкозы, если 1) имеющиеся измерения глюкозы точны и, более того, 2) прогнозирующая модель будущих изменений концентрации глюкозы точна. Если эти условия не соблюдены, безопаснее использовать контроллер с завышенными значениями коэффициента.
Обсуждение коэффициента настройки R (упоминаемого здесь как 34) на фиг. 2А целесообразно на данном этапе. Если определение точности измерений глюкозы в режиме онлайн или точности прогнозов модели затруднительно, возможно, будет сложно понять, следует ли использовать в данных условиях фактор агрессивности 34 или R. Тем не менее при определенных обстоятельствах это возможно установить с высокой степенью уверенности, если непрерывный контроль глюкозы (НКГ) стал «менее точным» или «более точным» с количественной точки зрения.
Заявители считают разумным предположить, что НКГ может стать менее точным при анализе каждого следующего образца после калибровки и НКГ внезапно станет менее точным, когда не может сообщить результат измерения глюкозы. Потерянные или пропущенные измерения при НКГ могут быть связаны с неопределенными изменениями концентрации глюкозы (особенность алгоритма НКГ) или просто из-за проблем с передачей данных по радиочастотной связи. Аналогичным образом разумно предположить, что НКГ станет более точным после калибровки и восстановления сообщений со значениями глюкозы после пропуска одного считывания или более.
Затем заявители обнаружили, что возможно использовать эти идеи для автоматической настройки контроллера, т.е. использовать более завышенное значение R для фактора агрессивности, когда НКГ станет менее точным, и более агрессивное значение, когда НКГ станет более точным. В общем смысле это представлено ниже.
Пусть фактор агрессивности R будет ограничен постоянными Rмин (для наиболее агрессивного режима работы контроллера) и Rмакс (для наименее агрессивного режима работы контроллера):
Rмин<=R<=Rмакс ур. (9)
Пусть будут два номинальных приращения строго положительной величины: r1, относительно малое приращение, связанное с точностью НКГ в зависимости от времени проведения калибровки, и r2, большее приращение, связанное с точностью НКГ в зависимости от наличия пропущенных образцов.
Фактор агрессивности, использующийся при вычислении КПМ для текущего момента измерения, индексированного при помощи индекса k, является R(k), где R(k) автоматически обновляется для каждого образца на основании номинального значения R, RNOM, которое обычно должно отличаться у каждого пользователя:
R(k)=RНОМ+r1*КАЛ(k)+r2*ПРОПУСК(k), ур. (10)
и Rмин<=R(k)<=Rмакс ур. (11)
КАЛ(k)=k-kкал-6 для k-kкал>=6 ур.(12)
КАЛ(k)=k-kкал2-6 для k-kкал<6 ур.(13)
где: RНОМ≤RМАКС≤100*RНОМ
RНОМ/100≤RМИН≤RНОМ
(RМАКС-RМИН)/500≤r1≤(RMАКС-RMИН)/50
(RМАКС-RМИН)/50≤r2≤(RMАКС-RMИН)/5
КАЛ(k) является калибровочным индексом.
Следует отметить, что RНОМ может принимать значения от 0 до приблизительно 1000 (т.е. 0≤RНОМ≤1000); хотя необходимо отметить, что данное значение и диапазон зависят от конкретной целевой функции в определенной используемой модели и специалист в данной области должен быть способен к настройке соответствующего диапазона RНОМ в зависимости от используемой модели. В примерах вариантов осуществления r1 может принимать любое значение приблизительно от 1 до 50, а r2 может принимать любое значение приблизительно от 10 до 500.
Индекс текущего образца обозначается как k, где kкал является индексом образца, использованного при проведении последней калибровки НКГ при помощи подходящего контрольного анализатора глюкозы или глюкометра 114, и kкал2 является индексом образца, использованного при проведении предпоследней калибровки при помощи контрольного глюкометра 114. Таким образом, через 30 мин (например, 6 образцов) после калибровки при помощи контрольного глюкометра 114 модуль 32 калибровочного индекса, или КАЛ(k), равен нулю. После этого КАЛ увеличивается на один после каждого образца до того, как пройдет 30 минут после следующей калибровки. Такая корректировка коэффициента настройки R модуля 34 для случая k (т.е. R(k)) приводит к работе контроллера с чуть более завышенными значениями (т.е. большими значениями R в уравнении (4)) при каждом следующем измерении НКГ датчиком 112 для каждого индексированного временного интервала k вплоть до следующей калибровки. Наличие 30-минутного буферного периода непосредственно после калибровки, во время которого устройство 10 логического управления будет действовать с учетом относительно завышенных значений, приводит к возможному появлению значительных перепадов значений НКГ непосредственно после калибровок.
Модуль 32 пропуска данных, или модуль ПРОПУСК(k), определяет количество (или индексы) потерянных или пропущенных образцов для НКГ датчиком 112 среди пяти последних случаев отбора проб на глюкозу. Таким образом, если модуль 32 пропуска данных, или модуль ПРОПУСК(k), возвращается к нулю, или 0, то это означает, что ни одно из недавних измерений НКГ датчиком 112 не было потеряно или пропущено, а устройство 10 логического управления больше не работает в режиме завышенных значений. С другой стороны, когда 1<=ПРОПУСК(k)<=5, было найдено по меньшей мере одно потерянное или пропущенное недавнее измерение НКГ датчиком 112, а фактор агрессивности R или коэффициент настройки 34 увеличится на r2*ПРОПУСК(k).
Для демонстрации работы варианта осуществления настоящего осуществления представляется ссылка на фиг. 2B, 2C и таблицу 1. В данном примере предполагается, что RНОМ составляет около 50, r1 составляет около 5, r2 составляет около 50, RМИН составляет около 50 и RMАКС составляет около 500. Для дополнительной демонстрации в данном примере того, как индекс пропуска (называемый «ПРОПУСК(k)») и калибровочный индекс (называемый «КАЛ(k)») используются для определения коэффициента настройки R(k), в таблице 1 представлена часть (от индекса k=110 до k=160) данных, нанесенных на графики на фиг. 2B и 2C.
На фиг. 2B можно увидеть, что был один случай «а» при отсутствии калибровки (▼) во временном интервале с индексами 110-146 (из таблицы 1) и что было множество случаев «b» потери данных НКГ (во временном интервале с индексами 117-132 из таблицы 1). На основании допущений, сделанных заявителями относительно потерянных или пропущенных данных НКГ и отсутствия калибровки во временном интервале с индексом k от 118 до 123, неудивительно, что коэффициент настройки R возрастает в момент «c» с началом уклона в момент «d», который станет почти вертикальным до момента «e», падает в момент «f» и восстанавливается в момент «g» в связи с калибровкой («a» на фиг. 2B) в индексированном временном интервале 146 (таблица 1). Таким образом, можно увидеть, что от k~110 до k~160 коэффициент R изменяется в зависимости от двух индексов (т.е. калибровочного индекса «КАЛ» и индекса пропуска «ПРОПУСК») для обеспечения того, чтобы значения глюкозы крови пациента находились в пределах верхнего предела, составляющего приблизительно 200 мг/дл (фиг. 2В).
Напомним, что система на фиг. 2A предложена для лечения диабета у пациента. В этой системе используются следующие компоненты: глюкометр 29 для эпизодического измерения, датчик 22 для непрерывного измерения глюкозы, насос 16 и контроллер 10. Глюкометр 29 измеряет уровень глюкозы в крови пациента через дискретные неравномерные временные интервалы (например, каждые 4 часа) и представляет концентрацию глюкозы в крови, полученную при эпизодическом измерении, как калибровочный индекс 30 для каждого временного интервала в индексированном временном интервале (k, где интервал времени между k и k+1 составляет около 5 минут). Глюкометр для непрерывного измерения постоянно измеряет концентрацию глюкозы в крови пациента через дискретные и, как правило, равномерные временные интервалы (например, приблизительно каждые 30 секунд или каждую минуту) и представляет концентрацию глюкозы для каждого интервала в виде данных измерения глюкозы, в которых любой пропуск измерения глюкозы через любой интервал времени сохраняется в виде индекса пропуска 32. Инфузионный насос для инсулина управляется контроллером 10 для доставки инсулина пациенту 20. Контроллер 10 запрограммирован на выполнение соответствующей программы КПМ для управления насосом и связи с глюкометром для эпизодического измерения и глюкометром для непрерывного измерения. В данном аспекте контроллер определяет коэффициент настройки 34 на основании (a) калибровочного индекса 30, полученного при эпизодических измерениях глюкозы, и (b) индекса пропуска 32 для КПМ 10 таким образом, чтобы контроллер определял скорость доставки инсулина для каждого временного интервала в индексированном временном интервале (k) по контрольной прогнозирующей модели на основе (1) необходимой концентрации глюкозы 12, (2) концентрации глюкозы 24, измеренной глюкометром 22 в каждый интервал времени в индексированном интервале времени (k), и (3) коэффициента настройки 34.
Благодаря описанию, представленному в настоящем документе, заявители также заявили способ управления инфузионным насосом для управления инфузионным насосом при помощи контроллера, предназначенного для управления насосом и получения данных по меньшей мере от одного датчика глюкозы. Пример способа может быть описан со ссылкой на фиг. 3. Способ начинается с измерения концентрации глюкозы у пациента на этапе 302 при помощи датчика глюкозы (22 или 29) для обеспечения проведения по меньшей мере одного измерения глюкозы за каждый временной интервал из серии индексированных дискретных временных интервалов (k). На этапе 304 способ подразумевает проведение калибровочного измерения глюкозы в течение по меньшей мере одного временного интервала из серии индексированных временных интервалов k для получения калибровочного индекса, который может быть использован для вычисления коэффициента настройки на этапе 308. На этапе 306 система устанавливает, не было ли пропущено одно (или более) измерение глюкозы в течение временного интервала из серии индексированных временных интервалов k, для получения индекса пропуска, который также может быть использован для вычисления коэффициента настройки R. На этапе 308 способ предусматривает определение коэффициента настройки на основании полученных ранее калибровочного индекса и индекса пропуска. На этапе 310 способ подразумевает вычисление количества вводимого инсулина контроллером с управлением, основанным на прогнозирующей модели, который использует: (a) множество результатов измерения концентрации глюкозы для прогнозирования изменения концентрации глюкозы на основании оценок метаболического состояния пациента и (b) коэффициент настройки, необходимый для вычисления количества инсулина для введения пациенту на протяжении каждого интервала из индексированного интервала времени k. На этапе 312 насосом управляют для доставки инсулина, количество которого было определено на этапе вычислений 310. На этапе 314 процедуру выполняют с этапа 302 или переходят к выполнению другой процедуры.
Клинические сценарии. В исследовании с использованием компьютерного моделирования образец алгоритма изучали на одобренной FDA симуляционной базе данных 100 взрослых пациентов в условиях заранее определенного клинического протокола. Ключевые особенности клинического протокола:
Управление на основе обратной связи при помощи КПМ в течение 26 часов, начавшихся в номинальные 16 ч в день 1 и истекших в номинальные 18 ч в день 2.
Три приема пищи происходят в номинальные 18 ч в день 1 («обед»), 7 ч в день 2 («завтрак») и 12 ч в день 2 («второй завтрак»). Поскольку предложенный клинический протокол обладает гибкостью в отношении углеводной (УВ) составляющей пищи, которая может варьироваться в диапазоне 30-70 г УВ, выполняли отдельные симуляционные сценарии, в которых принималась пища, содержащая 30 и 70 г УВ.
Зависящее от пищи болюсное введение инсулина проводится в соответствии с отношением инсулина к УВ у пациента, однако оно не включает коррекцию.
Расчет времени болюсного введения относительно приемов пищи был разработан с учетом поправок на два подхода, которые были изучены при помощи компьютерного моделирования.
«Введение во время приема пищи». При этом подходе все зависящие от пищи болюсные введения проводятся в начале приема пищи.
«Введение до приема пищи» При этом подходе зависящие от пищи болюсные введения проводятся за 20 минут до еды, если текущее значение НКГ составляет 100 мг/дл или выше. Если текущее значение НКГ составляет менее 100 мг/дл, болюсное введение проводится в начале приема пищи.
В случае получения красного сигнала тревоги при гипогликемии симулируемому пациенту вводили 16 г УВ.
На первой фазе клинических исследований использовали относительно завышенное значение коэффициента настройки R=500. На основании этих результатов мы изучили не только данное завышенное значение, но и два дополнительных значения: среднее значение R=250 и агрессивное значение R=50.
С учетом этого протокола и связанных с ним корректируемых параметров было создано 12 уникальных симуляционных сценариев, в которых изучался широкий спектр возможных комбинаций, которые были предложены для клинического исследования. Эти 12 сценариев приведены в таблице 2.
Каждый сценарий из таблицы 2 был проверен на 100 взрослых пациентах из одобренной FDA базы данных, что в общем итоге позволило получить 1200 уникальных симуляций исследований на стадии 5.
Результаты. В таблице 3 обобщены результаты каждого сценария на стадии 5 симуляционного исследования с точки зрения значений НКГ. Вне зависимости от сценария ни у одного из пациентов не было обнаружено заметного количества значений НКГ ниже 70 мг/дл. В случае меньшего приема пищи с 30 г УВ менее чем 1 % значений НКГ составил свыше 180 мг/дл. Прием большего количества пищи с 70 г УВ привел к большим затратам времени при определении значений НКГ свыше 180 мг/дл, однако даже при «худшем» сценарии развития событий - 8 B, в котором болюсное введение проводилось во время приема пищи, а фактор агрессивности был завышен, - только 5,5 % времени обратной связи было потрачено на борьбу с повышенной концентрацией глюкозы.
В таблице 3 также указано, что влияние фактора агрессии и расчета времени болюсного введения относительно приема пищи на итоговые уровни НКГ было едва различимым. В случае приемов пищи с 30 г УВ либо подходов к расчету времени болюсного введения корректировка фактора агрессии с завышенного значения до агрессивного значения повлияла на частоту появления значений НКГ в пределах 70–180 мг/дл только в 0,1 % случаев. В случае приемов пищи с 70 г УВ это значение составило уже 0,7 %.
Разница в значениях НКГ между болюсным введением во время приема пищи и введением за 20 минут до него также была едва различимой. В случае приемов пищи с 70 г УВ, например, болюсное введение перед приемом пищи привело к увеличению затрат времени на 2,6 % в диапазоне 70–180 мг/дл в сравнении с болюсным введением во время приема пищи.
При помощи 12 сценариев из таблицы 3 были изучены пределы диапазонов корректируемого параметра алгоритма (фактора агрессии R КПМ-зоны) и корректируемых параметров протокола (количество принятой пищи и расчет времени болюсного введения).
В таблицах 4a и 4b представлены данные из таблицы 3 в более наглядном виде для оценки влияния фактора агрессии или расчета времени болюсного введения, в то время как остальные значения оставались постоянными.
В таблице 4a указано, что в случае приемов пищи с 30 г УВ практически нет никакой разницы (с точки зрения частоты значений НКГ в диапазоне 70-180 мг/дл) при изменении либо фактора агрессии, либо расчета времени болюсного введения. Аналогичным образом в таблице 4b указаны лишь малые различия в этом значении.
В таблице 5 подсчитана разница в инфузии инсулина при всех значениях агрессивности алгоритма относительно соответствующих базальных значений. Значения представляют собой усредненные скорости доставки инсулина по протоколу в виде разницы с соответствующими значениями базальной скорости (например, значение 0 % говорит о том, что доставляемое по алгоритму количество равно базальному). Зона была определена при помощи симуляций с концентрациями 90-140 мг/дл. Запись «н/д» указывает на то, что отклонения ниже нижнего предела зоны отсутствовали у всех 100 пациентов при воздействии комбинации фактора агрессивности и симуляционного протокола. Все применимые значения были отрицательными (запись «н/д» означает, что отклонения ниже нижнего предела зоны у всех пациентов отсутствовали), что указывает на то, что даже при отклонениях выше верхнего предела зоны по алгоритму доставлялось меньше инсулина, чем при соответствующей базальной скорости доставки. Возможно, что этот нелогичный результат связан с тем фактом, что большинство отклонений (если не все), которые выше верхнего предела зоны, происходили вслед за приемом пищи и соответствующим болюсным введением; алгоритм учитывает это болюсное введение и поэтому может ограничить инфузию инсулина после приема пищи.
Основное наблюдение, почерпнутое из таблицы 5, гласит, как и ожидалось, что большая агрессивность значений приводит к большему количеству доставленного инсулина при отклонениях выше верхнего предела зоны, однако при отклонениях ниже нижнего предела зоны доставлялось меньше инсулина.
Хотя разница в количественных показателях концентрации глюкозы и характеристиках инфузии инсулина была едва заметна при изменении значения фактора агрессии R с «завышенного» на «агрессивное», важно принимать во внимание, что это исследование было симуляционным. Таким образом, возможно, что влияние изменения значения фактора агрессии будет более выражено при лечении настоящих пациентов.
Хотя настоящее изобретение было описано в терминах конкретных модификаций и иллюстрирующих чертежей, средние специалисты в данной области определят, что настоящее изобретение не ограничивается описанными модификациями или чертежами. Например, контроллер с замкнутым контуром регулирования не обязательно должен быть контроллером КПМ, а может быть, при соответствующей модификации специалистами, ПИД контроллером, ПИД контроллером с управлением с внутренней моделью (УВМ), с модельно-алгоритмическим управлением (МАУ), как обсуждается в публикации Percival et al., «Closed-Loop Control and Advisory Mode Evaluation of an Artificial Pancreatic β Cell: Use of Proportional-Integral-Derivative Equivalent Model-Based Controllers» Journal of Diabetes Science and Technology, Vol. 2, Issue 4, July 2008. Кроме того, лицам, имеющим средний навык в данной области, будет очевидно, что в тех случаях, когда описанные выше способы и этапы указывают на наступление определенных событий в определенном порядке, этот порядок для некоторых этапов может быть изменен и что такие изменения соответствуют возможным вариантам осуществления настоящего изобретения. Кроме того, по возможности определенные этапы могут выполняться одновременно в рамках параллельного процесса, а также могут выполняться последовательно, как описано выше. Таким образом, в той мере, в которой возможны вариации настоящего изобретения, которые соответствуют сущности описания или эквивалентны изобретениям, описанным в формуле изобретения, настоящий патент призван охватывать также и все такие вариации.
Реферат
Группа изобретений относится к медицинской технике, а именно к способу управления инфузионным насосом при помощи контроллера, предназначенного для управления насосом и получения данных от датчика глюкозы и системы лечения диабета. Способ содержит получение серии измерений концентрации глюкозы у пациента. Измерения глюкозы были измерены датчиком глюкозы для проведения измерения глюкозы за каждый временной интервал из серии индексированных дискретных временных интервалов. Затем получают калибровочное измерения глюкозы в течение временного интервала из серии индексированных временных интервалов времени для получения калибровочного индекса. Далее устанавливают, не было ли проведено измерение глюкозы вне временного интервала из серии индексированных временных интервалов, для получения индекса пропуска. Потом определяют коэффициент настройки на основании калибровочного индекса и индекса пропуска. Затем вычисляют количество вводимого инсулина контроллером с управлением, основанным на прогнозирующей модели. Прогнозирующая модель использует: множество результатов измерения глюкозы для прогнозирования изменения концентрации глюкозы на основании оценок метаболического состояния пациента и коэффициент настройки, необходимый для вычисления количества инсулина для доставки пациенту на протяжении каждого интервала из индексированного интервала времени. Система для лечения диабета содержит глюкометр для эпизодического измерения глюкозы в крови пациента через временные интервалы и представления подобной эпизодической концентрации глюкозы в крови в виде калибровочных индексов для каждого временного интервала в индексированном интервале времени. Также система содержит глюкометр для непрерывного измерения концентрации глюкозы в крови пациента через дискретные равномерные временные интервалы и представления концентрации глюкозы для каждого интервала в виде данных измерения глюкозы, в которых любой пропуск измерения глюкозы через любой интервал времени сохраняется в виде индекса пропуска. Система содержит инфузионный насос для инсулина для доставки инсулина и контроллер, соединенный с насосом и гликометрами. Контроллер определяет коэффициент настройки на основании калибровочного индекса, полученного при эпизодических измерениях глюкозы, и индекса пропуска для контрольной прогностической модели. Контроллер определяет скорость доставки инсулина для каждого временного интервала в индексированном временном интервале по контрольной прогнозирующей модели на основе необходимой концентрации глюкозы. Техническим результатом является осуществление настройки контрольной прогнозирующей модели на основе двух переменных, полученных в ходе непрерывного контроля глюкозы. 2 н. и 5 з.п. ф-лы, 5 табл., 4 ил.
Формула

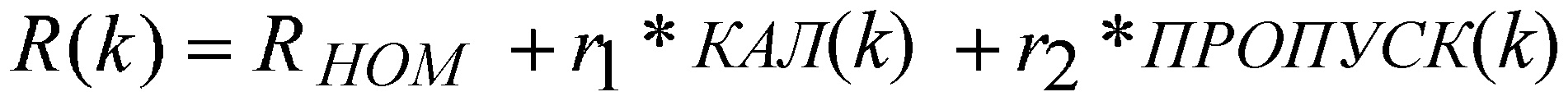

Комментарии