Устройство и способ для выделения клеток, биочастиц и/или молекул из жидкостей с целью применения у животных, в биотехнологии (включая биологическое исследование) и медицинской диагностике - RU2386967C2
Код документа: RU2386967C2
Чертежи





Описание
Изобретение относится к устройству и способу для выделения клеток, биочастиц и/или молекул из жидкостей. С помощью этого устройства и при использовании подходящих носителей и известных способов иммобилизации можно распознать и разделить конкретные биочастицы. Область применения изобретения включает использование его для животных, биотехнологию (включая биологическое исследование) и медицинскую диагностику.
Выделение клеток, биочастиц и/или молекул из жидкостей имеет значение во многих областях техники, кроме того, известны многочисленные способы выделения.
Анализ клеток и разделение клеток десятилетиями осуществляли с помощью флюоресцентно-активируемой клеточной сортировки (FACS). Этот способ является предпочтительным для анализа конкретных популяций клеток по поверхностным маркерам. Применение FACS создает проблемы при выделении большого количества клеток. Среда, содержащая клетки, должна быть сильно разбавленной, время разделения больших количеств клеток относительно длинное, и соблюдение норм асептики создает проблемы. В общем, этот способ сопряжен со значительными затратами.
Для распознавания и выделения биочастиц и клеток уже более 10 лет все чаще используются методы магнитного разделения. Для магнитного разделения или молекулы иммобилизации нагружают железом, или микрочастицы, содержащие железное ядро, покрывают молекулами иммобилизации. Разделение производится сильным магнитным полем. Иммуномагнитное разделение, успешно реализованное на рынке среди прочих фирмой Dynal and Miltenyi Biotec, утвердилось как несложный способ разделения клеток с относительно небольшой стоимостью. Магнитное разделение, особенно по сравнению с проточной цитометрией, доказало свою значимость для выделения относительно редких типов клеток, например для выделения эмбриональных клеток из крови матери для пренатальной диагностики. Дополнительным применением служит выявление опухолевых клеток в крови после хирургического удаления первичной опухоли, чтобы начать дополнительное лечение.
Для терапевтических целей сингенные CD34+-периферические стволовые клетки крови от пациентов, страдающих определенными злокачественными заболеваниями кроветворной системы, в настоящее время стандартно получают для реимплантации. Предпочтительно стволовые клетки получают путем очистки от лейкоцитов с помощью специфических антител, соединенных с магнитными гранулами. Для фракционирования клеток во время заготовки крови/клеток доступен ряд систем, которые используют различный размер и определенную плотность клеток крови для разделения в поле тяжести (центрифугированием).
Недостаток всех способов сортировки заключается в том, что они не могут производиться непрерывно, иначе говоря, после взятия пробы крови или лимфоцитов клетки инкубируют с иммуномагнитными частицами. После разделения и промывки от клеток отделяют магнитные частицы, после чего клетки могут использоваться для терапевтических целей. Хороший краткий обзор FACS и MACS дан в «Flow Cytometry and Sorting» (Ed. Melamed et al., Wiley & Sons, Inc., New York, 1990).
Другие способы выделения и/или удаления клеток описаны в EP 12311956A2, US 6900029, US 6432630, US 2002/0012953A1, DE 10022635A1, US 5246829, US 5739033, US 5763203, EP 0016552A1, WO 00/38762, EP 0502213B1 и EP 0554460B1.
В основу изобретения была положена задача разработки простой системы для разделения клеток, биочастиц и других молекул, которые могут использоваться у животных, а также в биотехнологии, включая биологическое исследование, и также в медицинской диагностике.
Предполагается, что изобретение описывается независимыми пунктами формулы, а зависимые пункты формулы изобретения являются предпочтительными вариантами.
Изобретение относится к простому методу разделения, который может использоваться везде, где можно функционально иммобилизовать специфический лиганд на поверхности агента из разделяемой смеси веществ. Фактически разделение осуществляется сортировкой по размеру частиц (фильтрация, рассеивание).
Для решения данной задачи используются стандартные способы связывания специфических лигандов с твердым носителем.
Используемые твердые носители являются известными биополимерами, такими как мембраны или частицы органических или синтетических полимеров. Поверхность может быть биологически совместимой и содержать коллаген, очищенные белки, очищенные пептиды, полисахариды, например хитозан, альгинат, декстран, целлюлозу, гликозаминогликаны или синтетические полимеры, такие как полистирол, сложный полиэфир, простой полиэфир, полиангидрид, полиалкилцианоакрилат, полиакриламид, полиортоэфир, поливинилацетат, блоксополимеры, полипропилы, политетрафторэтилен (PTFE) или полиуретан. Кроме того, полимеры могут содержать полимеры молочной кислоты или сополимеры (молочной кислоты и/или гликолевой кислоты (PLGA)). Используемые поверхности могут быть биоразлагаемыми или не биоразлагаемыми.
Специфические лиганды, используемые для связывания молекул-мишеней на поверхности клеток, могут иметь природное или искусственное происхождение, например представлять из себя антитела, фрагменты антител, пептиды, полипептиды, гликопептиды, растворимые рецепторы, стероиды, гормоны, митогены, антигены, суперантигены, факторы роста, цитокины, лептины, вирусные белки, молекулы адгезии или хемокины.
Для конкретного применения используется по меньшей мере одно антитело или фрагмент антитела со специфическими лигандами ковалентно связанным с ними или фиксированным к ним с помощью спейсеров или линкеров. Вещество носителя может иметь произвольную конфигурацию. Мембраны, такие как капилляры или частицы, обеспечивают преимущество большой поверхности. Для способа, который будет описан, используются микрочастицы с диаметром >10 мкм и <800 мкм, предпочтительно 50-500 мкм. Для других задач также могут использоваться более крупные или более мелкие частицы.
Микрочастицы, активизированные определенными лигандами (например, антителами к CD34, или CD1d, или gp120 ВИЧ), ex vivo приводят в контакт с взятой кровью, обработанной обычными антикоагулянтами. Это производится в отдельной реакционной области. Если реакционная область должна служить частью экстракорпорального кровообращения, шланговые разъемы, клапаны, фильтры и насосы, связанные с устройством безопасности, гарантируют, что системой можно управлять без побочных эффектов для пациентов после соответствующей антикоагуляции.
Целевые клетки связываются функционализированными микрочастицами. Разделение микрочастиц, теперь нагруженных, производится гидростатическим давлением с использованием мембраны (сита), предпочтительно в форме трубки, которая беспрепятственно пропускает все компоненты крови (размер пор >10 мкм и <800 мкм), но задерживает микрочастицы. Фильтрация может осуществляться за счет как вертикальных, так и тангенциальных эффектов давления. Частицы, оставшиеся в полости, возвращают в реакционный сосуд или отводят для аналитических или препаративных целей.
После остановки тока крови реакционный сосуд может использоваться для отделения клеток от микрочастиц. Взвешенные клетки, выделенные таким образом, можно отделить от частиц тем же самым способом, теперь они доступны для диагностических применений.
Дополнительным применением служит целенаправленное выделение различных типов клеток с целью совместного культивирования всякий раз, когда обсуждаемые типы клеток для выполнения требуемой функции нуждаются в поверхностных молекулах и/или биомолекулах, подобных цитокинам других типов клеток. Чтобы достичь достаточной близости требуемых клеток-мишеней для необходимого межклеточного контакта, с одной частицей может связываться ряд специфических лигандов.
Конкретными клетками для данного применения могут быть, среди прочих, Т-лимфоциты, В-лимфоциты или стволовые клетки. Способы могут использоваться как периодически, так и непрерывно. Высокая вариабельность строения частиц, которая касается модификации материала, диаметра и поверхности, приводит к огромному разнообразию возможностей применения у животных, в медицинской диагностике, но также и в биотехнологии и биологическом исследовании.
Вариант осуществления 1:
Выделение CD4-положительных клеток из цельной крови крыс
Асцитические антитела (RIB 5/2) обрабатывались по протоколу с помощью Millipore Montage Antibody Purification Kit (LSK2 ABG 20). Затем степень очистки проверяли с помощью денатурирущего геля SDS (10%).
Связывание антител к CD4 с частицами полиметилакрилата (PMA)
1. 1 мл PMA (диаметр частиц=40 мкм±10 мкм; 10 мг/мл; модифицированы COOH/PEG-COOH) центрифугировали в течение 2 мин при 3000 g, супернатант отбрасывали и адсорбировали в 1 мл 0,1 M буфера MES с рН 6,3.
2. Растворяли 2 мг EDC и 2,4 мг N-гидроксисукцинимида в 0,5 мл 0,1 М буфера MES с рН 6,3 и добавляли к суспензии частиц PMA. Инкубировали 1 час при комнатной температуре с перемешиванием (активация частиц).
3. Отделяли частицы PMA центрифугированием и дважды промывали 0,1 М буфером MES с pH 6,3.
4. Абсорбировали активированные частицы РМА в 1 мл 0,1 М буфера MES с pH 6,3 с 100-150 мкг антител; реакция связывания происходила при комнатной температуре 16 часов (в течение ночи).
5. Свободные связывающие точки нейтрализовали, добавляя 100 мкл 1 М этаноламинов с последующей инкубацией в течение 1 часа.
6. Функционализированные частицы РМА отделяли центрифугированием и трехкратно промывали PBS.
7. Абсорбировали анти-CD4 частицы PMA в 1 мл PBS с рН 7,4 и хранили при 4°C. Проверяли связывание антител с помощью козлиных антител к антителам мыши, меченных РЕ (фиг. 1).
Выделение конкретных клеток из CD4-положительных клеток цельной крови.
1. 4 мл цельной крысиной крови с добавкой антикоагулянта смешивали с 1 мл суспензии (1 мг частиц) функционализированных анти-CD4 частиц PMA.
2. Инкубировали, покачивая, при комнатной температуре в течение 60 мин.
3. Анти-CD4 частицы PMA (со связанными клетками и без таковых) отделяли от цельной крови фильтрацией смеси крови и частиц с использованием специальной камеры с клеточным ситом (40 мкм).
4. Анти-CD4 частицы PMA промывали 30 мл PBS (1% FCS).
5. Абсорбировали частицы из камеры с ситом примерно в 1 мл PBS с помощью вихревого перемешивания в течение 15-20 секунд.
6. Брали пробу частиц для микроскопического анализа (фиг. 2).
7. Анализировали с помощью FACS фракции лейкоцитов из цельной крысиной крови до и после обработки анти-CD4 частицами PMA (фиг. 3 и 4).
Отделение клеток от частиц и оценка пригодности клеток.
1. Анти-CD4 частицы PMA с присоединенными клетками осаждали осторожным центрифугированием.
2. Абсорбировали осадок в PBS, 2 мМ ЭДТА, 3 мМ меркаптоэтанола и 20 ЕД папаина.
3. Инкубировали при перемешивании в течение 30 мин.
4. Разделяли клетки и частицы фильтрацией с использованием специальной камеры с клеточным ситом (40 мкм); частицы промывали 30 мл PBS (1% FCS); частицы с клеточного сита абсорбировали примерно в 1 мл PBS; подвергали вихревому перемешиванию в течение 15-20 секунд и промывку повторяли.
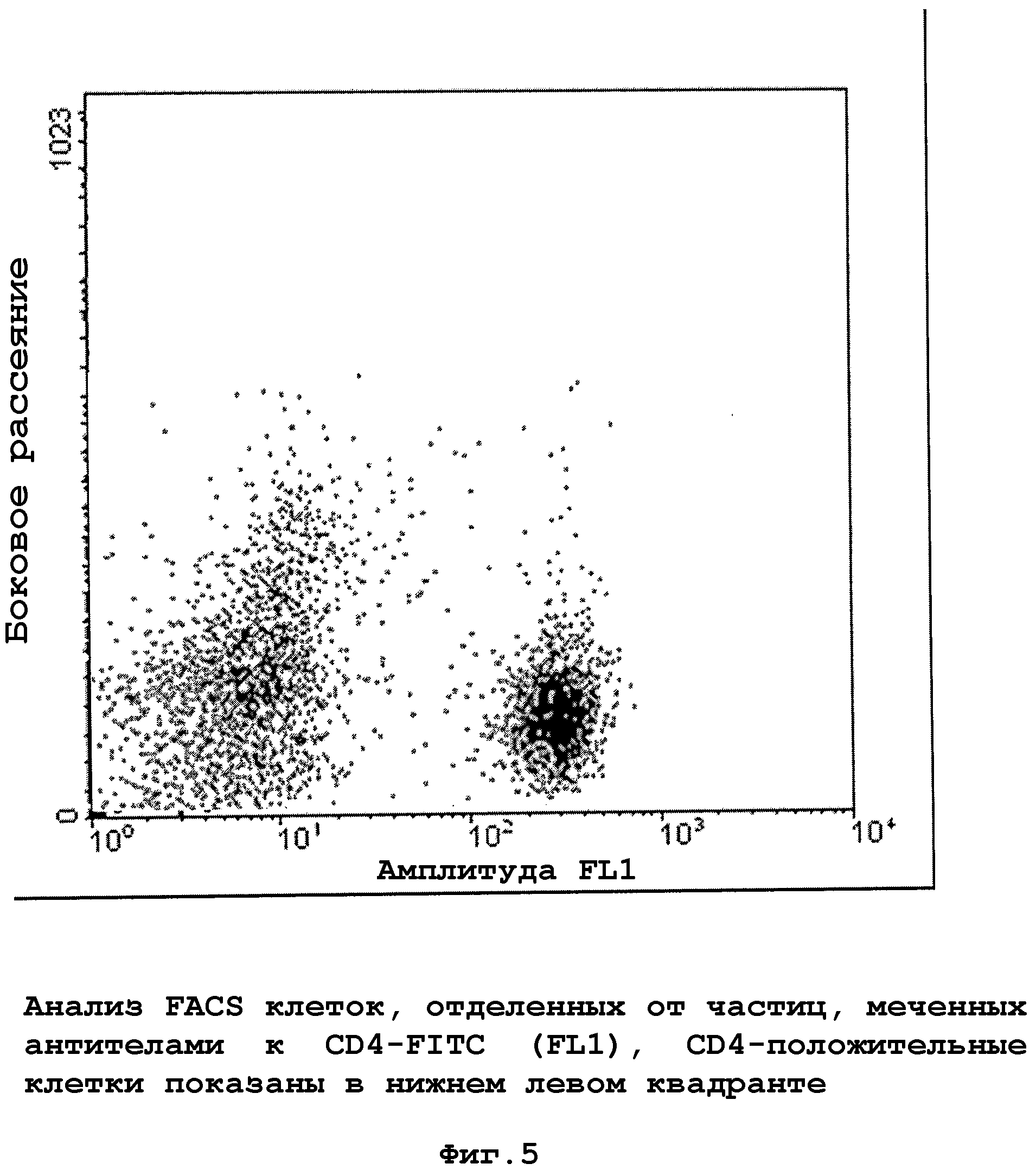
5. Выделенную фракцию лимфоцитов концентрировали центрифугированием при 350 g и анализировали с помощью FACS (фиг. 5).
Вариант осуществления 2:
Выделение белка (IgG) из лизата клеток
Асцитные антитела (RIB 5/2) подвергали обработке по протоколу с помощью Millipore Montage Antibody Purification Kit (LSK2 ABG 20). Затем степень чистоты проверяли с использованием денатурирующего геля SDS (10%).
Связывание антител к CD4 (мышиный IgG2) с частицами полиметилакрилата (PMA)
1. 1 мл РМА (диаметр частиц=40 мкм±10 мкм; 10 мг/мл; модифицированные COOH/PEG-COOH) центрифугировали 2 мин при 3000 g, супернатант отбрасывали и абсорбировали в 1 мл 0,1 буфера MES с pH 6,3.
2. Растворяли 2 мг EDC и 2,4 мг N-гидроксисукцинимида в 0,5 мл 0,1 М буфера MES с pH 6,3 и добавляли к суспензии частиц РМА. Инкубировали 1 час при комнатной температуре с перемешиванием (активация частиц).
3. Отделяли частицы РМА центрифугированием и дважды промывали 0,1 М буфера MES с pH 6,3.
4. Абсорбировали активированные частицы РМА в 1 мл 0,1 М буфера MES с pH 6,3 с 100-150 мкг антител; реакция связывания происходила при комнатной температуре в течение 16 часов (в течение ночи).
5. Нейтрализовали свободные точки связывания, добавляя 100 мкл 1 М этаноламинов с последующей инкубацией в течение 1 часа.
6. Функционализированные частицы РМА отделяли центрифугированием и трехкратно промывали PBS.
7. Абсорбировали частицы PMA с мышиным IgG в 1 мл PBS с рН 7,4 и хранили при 4°C. Связывание антител проверяли с помощью козьих антител к антителам мыши, меченных РЕ (фиг. 1).
Специфическое выделение козьих антител к IgG мыши из лизата клеток
1. 1 мл лизата клеток (HepG2, 4x106) смешивали с 1 мл козьих антител к IgG мыши.
2. 0,1 мл (100 мкг частиц) суспензии частиц РМА, функционализированных мышиным IgG, добавляли к смеси белков.
3. Инкубировали при комнатной температуре 60 мин.
4. Частицы РМА с мышиным IgG (со связанным козьими антителами к мышиному IgG и без них) отделяли от лизата клеток фильтрацией с использованием специальной камеры с сетчатой мембраной (10 мкм).
5. Частицы PMA троекратно промывали, используя каждый раз 5 мл PBS.
Отделение белка от частиц и оценка пригодности белка.
1. Абсорбировали функционализированные частицы РМА с присоединенными белками из камеры с ситом в 0,5 мл цитратного буфера с рН 2,2; инкубировали 30 мин.
2. Отделяли частицы фильтрацией с помощью специальной камеры с сетчатой мембраной (10 мкм); промывали частицы 2 мл цитратного буфера.
3. Анализировали выделенные белки в цитратном буфере (фиг. 6).
Вариант осуществления 3
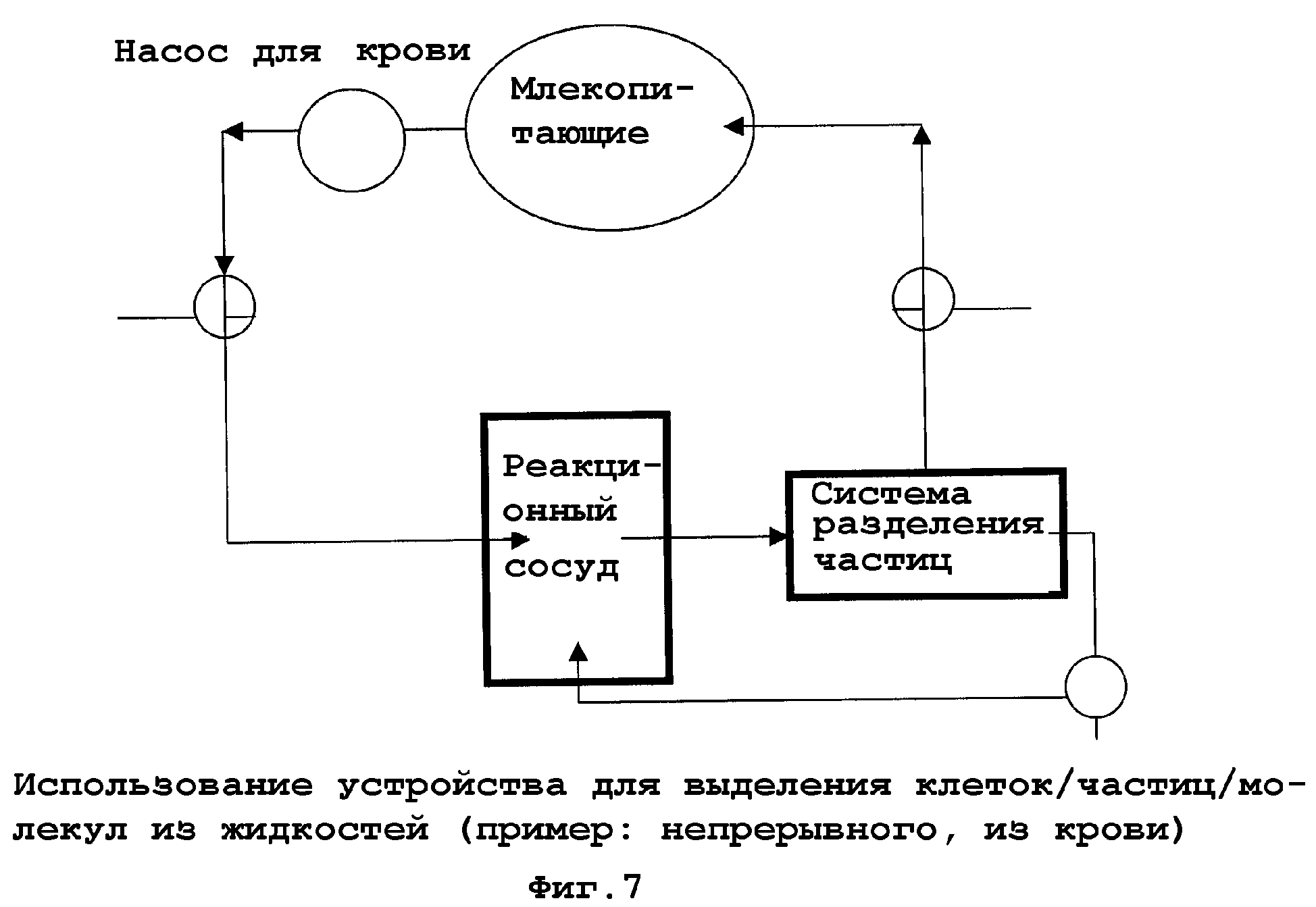
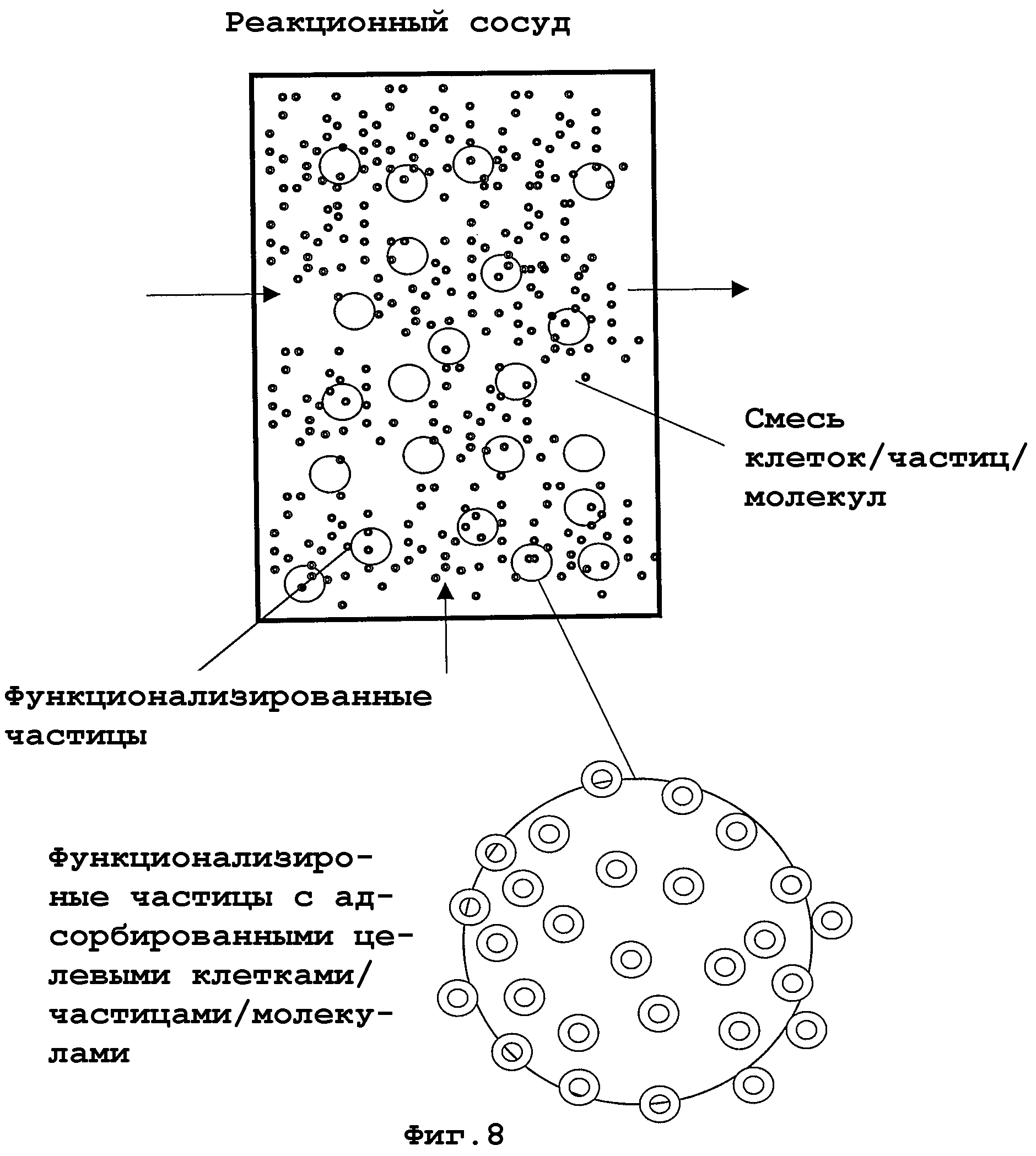
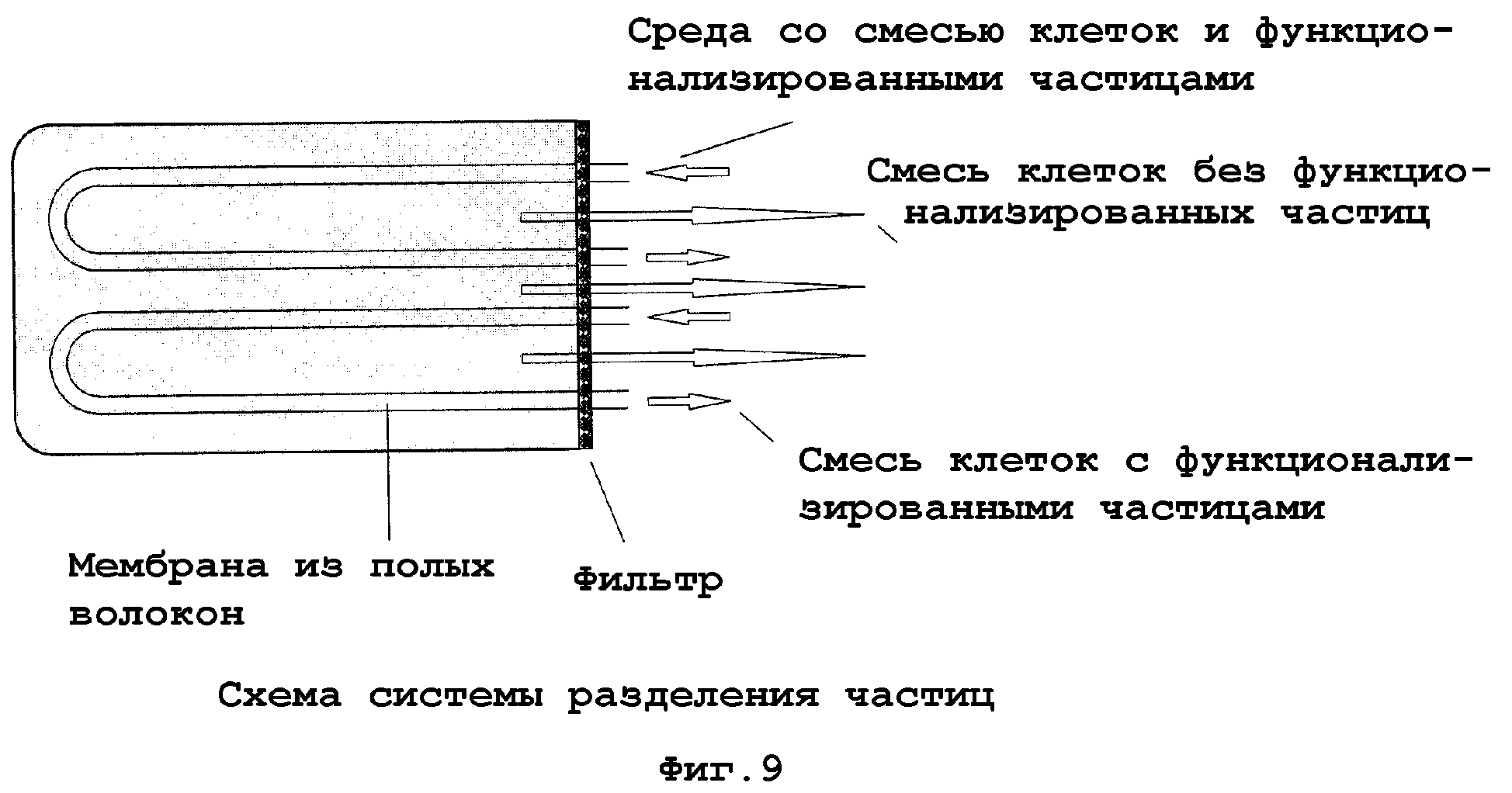
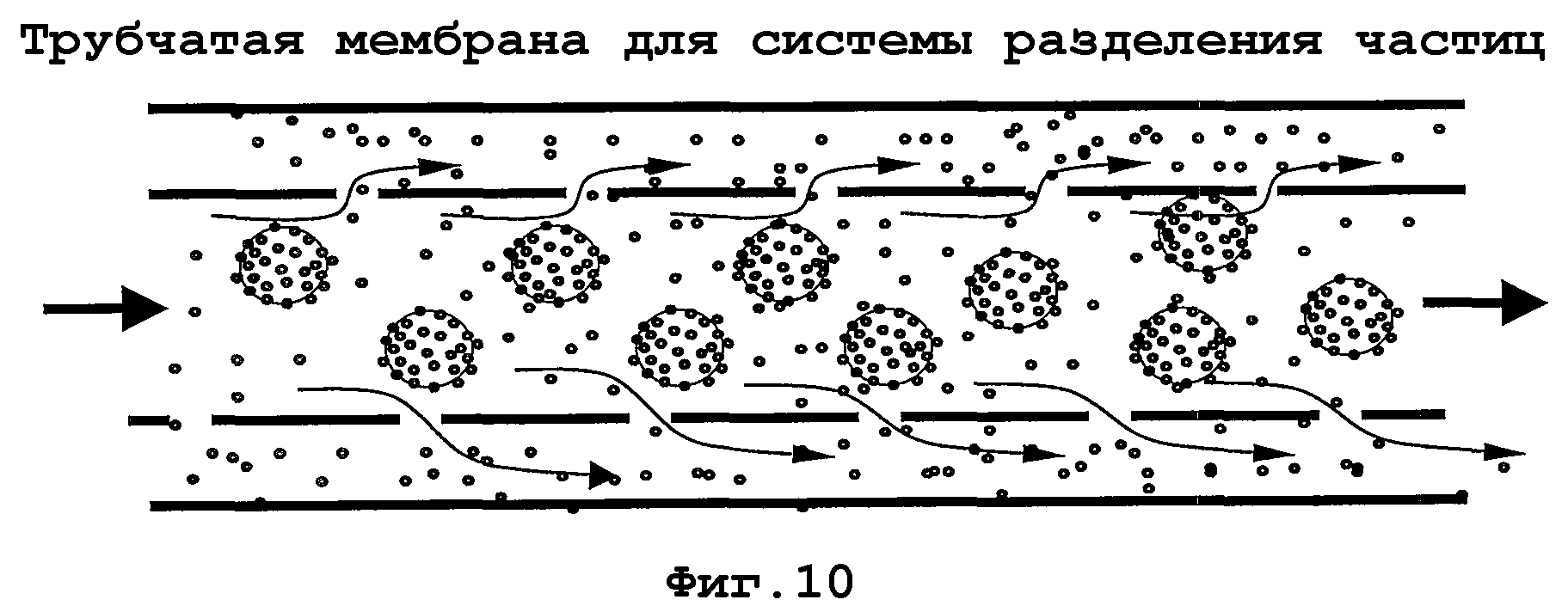
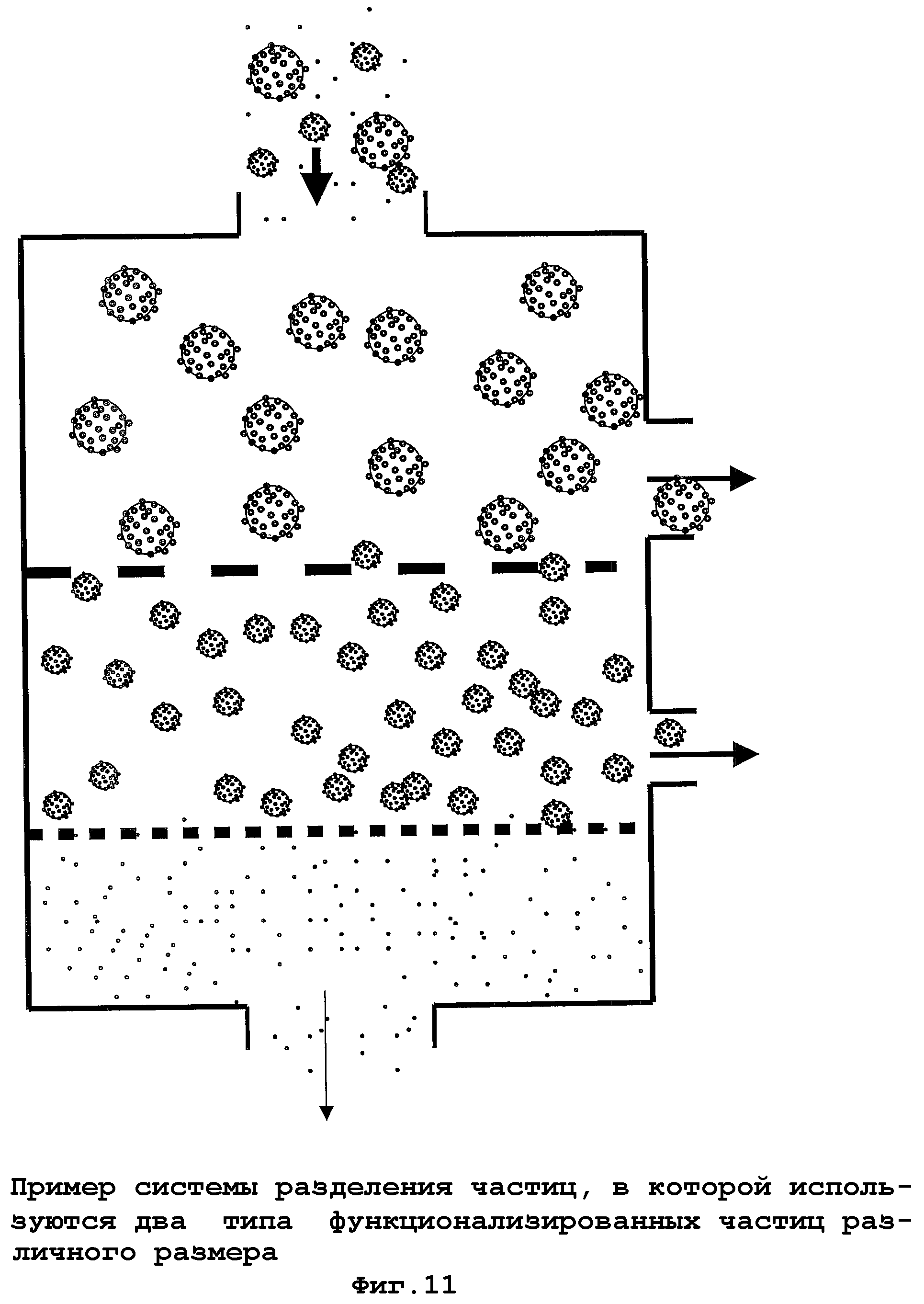
На фиг. 7-11 показаны примеры аппаратной реализации изобретения или его частей, в зависимости от обстоятельств. На фиг. 7 показана система, которая является типично применимой для непрерывного применения. Пунктирные стрелки представляют систему шлангов, стрелками отмечено направление тока жидкости. Начиная от организма (млекопитающих), жидкость организма, например кровь, посредством насоса для крови и клапана накачивается или направляется в реакционный сосуд, содержащий функционализированные частицы, которые, возможно, взаимодействуют с компонентами жидкости организма в смеси (взяты на иллюстрации в кружки (фиг. 8)). Затем среда со смесью клеток и функционализированными частицами направляется в систему разделения частиц. В одном примере среда со смесью клеток и функционализированными частицами проходит через сито и через мембрану из полых волокон и разделяется на смесь клеток без функционализированных частиц и смесь клеток с функционализированными частицами (фиг. 9). В то время как смесь пониженной концентрации без функционализированных частиц отводится через клапан и подается в организм, смесь клеток с функционализированными частицами и целевыми клетками/биочастицами/молекулами, связанными с ними, подается назад в реакционный сосуд (фиг. 7). На фиг. 10 показан образец принципа разделения на мембране из полого волокна. Среда со смесью клеток и функционализированными частицами проходит через трубчатую мембрану, последняя имеет поры с размером (пунктир), который пропускает только смесь клеток, теперь по существу более не содержащую целевые клетки/биочастицы/молекулы, тогда как функционализированные частицы с отделенными целевыми клетками/биочастицами/молекулами остаются внутри системы полых трубок. На фиг. 11 изображены детали соответствующей системы разделения частиц, которая может использоваться для двух типов функционализированных частиц с различными диаметрами.
Реферат
Изобретение относится к биологии и биотехнологии. Предложены устройство и способ, с помощью которых различные частицы биологического происхождения и растворенные в крови биомолекулы могут распознаваться и выделяться из жидкостей при использовании подходящих носителей и известных способов иммобилизации. Устройство может использоваться как для прерывистой, так и для непосредственной и непрерывной обработки жидкостей. Область применения изобретения включает применение для животных, биотехнологию, включая биологические исследования, и медицинскую диагностику. 2 н. и 10 з.п.ф-лы, 11 ил.
Формула
а. реакционный сосуд из биологически совместимого материала, в который помещают смесь клеток, частиц и/или молекул,
b. функционализированные микрочастицы, которые распознают и связывают необходимую популяцию клеток, биочастиц и/или молекул,
с. систему разделения частиц, основанную на одной или более мембране (мембранах) с порами, которые пропускают цельную кровь, клетки, биочастицы и/или молекулы, но не микрочастицы, за счет чего клетки, биочастицы и/или молекулы, которые связываются с микрочастицами разделяются согласно их размерам,
d. и, для непрерывного применения, различные системы шлангов, мембран, насосов и клапанов, которые способны выполнить все действия по выделению, разделению, обработке и удалению клеток, биочастиц и/или молекул.
конкретными клетками, биочастицами и/или молекулами являются соматические клетки, субклеточные структуры, белки и/или нуклеиновые кислоты и, если применимо, вирусы, бактерии и/или простейшие, и жидкостями являются пробы секретов и экскретов, крови, лимфы, ликвора, промывных вод или суспензии разделенных клеток из удаленных органов, или питательная среда, или осадок после ферментации, которые содержат клетки, биочастицы и/или молекулы; и/или
разделение клеток/биочастиц/молекул объединено с адсорбцией клеток, биочастиц и/или молекул при помощи дополнительно функционализированных микрочастиц, в особенности, когда объединенные функционализированные микрочастицы отличаются по своему размеру, предпочтительно, когда функция стимуляции клеток для живых клеток может иметь место посредством дополнительного лиганда (лигандов), или предпочтительно, когда по меньшей мере два отличающихся типа клеток, приводящие к стимуляции по меньшей мере одного типа клеток посредством взаимодействия мембраны/медиатора, являются разделенными дополнительным лигандом (лигандами); и/или
указанные функционализированные микрочастицы несут более одного специфического лиганда, и, таким образом, две и более отличающиеся клетки, биочастицы и/или молекулы специфично адсорбированы на микрочастицах.
функционализированные микрочастицы взвешены в жидкости и обладают свободной подвижностью; и/или
микрочастицы удерживаются в суспензии с помощью механических воздействий; и/или
жидкость из реакционной области, содержащая микрочастицы, освобождается от микрочастиц фильтрацией; и/или
для фильтрации используются мембраны, отличающиеся порами с диаметром, который пропускает все компоненты, неспецифично адсорбированные, но не используемые микрочастицы; и/или
для разделения используются плоские или трубчатые мембраны с диаметром пор более 1 мкм и менее 1000 мкм; и/или
реакционный сосуд используется для дополнительной обработки выделенных клеток.
а. реакционным сосудом из биологически совместимого материала, в который помещают смесь клеток, частиц и молекул,
b. функционализированными микрочастицами, которые распознают и связывают необходимую популяцию клеток, биочастиц и/или молекул, где микрочастицы обладают свободной подвижностью и могут направляться из реакционного сосуда в систему разделения частиц,
с. системой разделения частиц, основанной на одной или более мембране (мембранах)/сите (ситах) с порами, которые пропускают клетки, биочастицы и/или молекулы, но не микрочастицы, для разделения среды со смесью клеток и микрочастицами гидростатическим давлением на смесь клеток с микрочастицами и смесь клеток без микрочастиц, или разделения среды со смесью клеток и микрочастицами гидростатическим давлением на смесь клеток со свободными микрочастицами, не связанными с клетками вне мембраны, и на среду на этой стороне мембраны, содержащей только специфические комплексы функционализированных микрочастиц и целевых клеток,
е. ситом/мембраной из полых волокон, где последние снабжены порами с размером, который пропускает только смесь клеток без микрочастиц,
f. если применимо, насосом, чтобы перекачивать/направлять жидкость в реакционный сосуд через клапан,
g. клапаном, через который жидкость накачивается/направляется в реакционный сосуд,
h. клапаном, через который смесь клеток без микрочастиц удаляется из системы разделения частиц,
i. системой шлангов для (А) направления или перекачки жидкости со смесью клеток в реакционный сосуд, содержащий функционализированные микрочастицы, через клапан, и (В) отведения среды со смесью клеток и функционализированных микрочастиц из реакционного сосуда через сито с мембраной из полых волокон для разделения среды на смесь клеток без функционализированных микрочастиц и смесь клеток с функционализированными микрочастицами или отведения среды со смесью клеток и функционализированных микрочастиц из реакционного сосуда через сито для разделения среды на смесь клеток со свободными микрочастицами, не связанными с клетками вне мембраны, и среду на этой стороне мембраны, которая содержит только специфические комплексы функционализированных микрочастиц и целевых клеток, и (С) для отведения смеси разделенных клеток без функционализированных микрочастиц через клапан, и (D) для отведения смеси разделенных клеток с функционализированными микрочастицами и связанными с ними клетками/биочастицами/молекулами назад в реакционный сосуд или отведения смеси клеток с функционализированными микрочастицами и связанными с ними клетками/биочастицами/молекулами для аналитических или препаративных целей,
d. и, для непрерывного применения, различными системами шлангов, мембран, насосов и клапанов для обеспечения выполнения всех действий по выделению, разделению, обработке и удалению клеток, биочастиц и/или молекул.
лиганд ковалентно или нековалентно связан с микрочастицами; и/или
в качестве твердых носителей используются биологически совместимые полимеры; и/или
лиганды предпочтительно соединены с сефарозой; и/или
происходит непрерывное или периодическое разделение клеток, биочастиц и/или молекул; и/или
реакционные сосуды с отличающимися функционализированными микрочастицами могут быть подключены последовательно в виде отдельных модулей в произвольном количестве; и/или
для непрерывного разделения функционализированные микрочастицы вводятся в реакционный сосуд, через который течет жидкость, предпочтительно кровь, содержащая клетки, биочастицы и/или молекулы; и/или
клетки, биочастицы и/или молекулы отделяются от микрочастиц с помощью применения определенных буферов; и/или
высвобождение клеток и, если требуется, высвобождение дополнительных клеток, биочастиц и/или молекул осуществляется в том же самом реакционном сосуде; и/или
клетки, биочастицы и/или молекулы отделяются от суспензии микрочастиц посредством той же самой мембранной фильтрации, которая используется для разделения жидкостей; и/или
выделенные клетки, биочастицы и/или молекулы используются для аналитических целей и/или дополнительной обработки, и/или биохимической обработки без цели применения у человека; и/или
выделенные клетки, биочастицы и/или молекулы могут вводиться животным в необработанном или модифицированном виде в целях исследования или для лечения болезней.
жидкость с клетками накачивается или направляется через клапан в биологически совместимый реакционный сосуд, содержащий функционализированные микрочастицы, которые, если применимо, взаимодействуют с компонентами жидкости в смеси,
среда со смесью клеток и функционализированными частицами отводится из реакционного сосуда в систему разделения частиц с ситом и мембраной из полых волокон, где последняя снабжена порами с размером, который пропускает только смесь клеток без функционализированных частиц, в результате чего среда со смесью клеток и функционализированными частицами разделяется гидростатическим давлением при прохождении сита и мембраны из полых волокон на смесь клеток без функционализированных частиц и смесь клеток с функционализированными частицами,
разделенная смесь клеток без функционализированных частиц отводится из системы разделения частиц через клапан, и
смесь клеток с функционализированными частицами и, если применимо, целевые клетки/биочастицы/молекулы направляются назад в реакционный сосуд или отводятся для аналитических или препаративных целей.

Комментарии