N-замещенные мономеры и полимеры - RU2470040C2
Код документа: RU2470040C2
Описание
Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет предварительной заявки US 60/852471, поданной 17 октября 2006 года и озаглавленной «N-Substituted Monomers and Polumers», содержание которой во всей своей полноте посредством ссылки включается в настоящий документ.
Область техники
Данное изобретение относится к N-замещенным мономерам и полимерам, способам получения таких мономеров и полимеров и способам их использования в различных областях применения, таких как медицинские устройства.
Уровень техники
Тирозиновые мономеры из патента US 5099060 полимеризуются с образованием полимеров, характеризующихся повышенными вязкостями расплава или раствора, что в результате может привести к неудовлетворительной перерабатываемости. Как следствие, получение полимеров требует использования повышенных температур, повышенных давлений или повышенных и температур и давлений, что соответствует низкой экономичности, а также может привести к разложению полимера или любых добавок (таких как биологические или фармацевтические средства).
Такие повышенные вязкости расплава или раствора могут иметь место в случае тирозиновых полимеров, таких как полииминокарбонаты из патента US 4980449, поликарбонаты из патента US 5099060, полиарилаты из патента US 5216115, поли(алкиленоксидные) блок-сополимеры из патента US 5658995, фосфорсодержащие полимеры из патентов US 5912225 и 6238687, анионные полимеры из патента US 6120491, поли(амидкарбонаты) и поли(эфирамиды) на основе сложных эфиров из патента US 6284862, полимеры, непроницаемые для ионизирующей радиации, из документа US 6,475,477 и простые полиэфиры из патента US 6602497. Описания всех вышеупомянутых патентов во всей своей полноте посредством ссылки включаются в настоящий документ.
Существует потребность в полимерах, характеризующихся пониженными вязкостями расплава, которые можно было бы подвергать переработке в расплаве и/или переработке в растворе с большей легкостью, при меньших температурах и/или давлениях.
Краткое изложение изобретения
Данную потребность удовлетворяет настоящее изобретение. В настоящее время было обнаружено, что амидные связи, присутствующие в тирозиновых поликарбонатах и других биосовместимых полимерах, участвуют в образовании межцепных водородных связей, что может повлиять на термическую перерабатываемость полимера, поскольку водородная связь между полимерными цепями увеличивает вязкость расплава или раствора. В свою очередь, это привело к открытию возможности значительного ослабления эффекта, обусловленного образованием водородной связи у мономеров и полимеров, имеющих пептидные соединительные звенья, в результате замещения атома водорода у амидного азота метильной или другой алкильной группами.
Как это ни удивительно, но было обнаружено, что замещение амидного водорода заместителем, не образующим водородную связь, исключает роль данного источника межмолекулярного взаимодействия или значительно ослабляет ее в такой степени, что растворимость полимера в органических растворителях увеличивается, вязкость расплава уменьшается, и точно так же уменьшается температура стеклования полимера. Данные изменения свойств полимера могут быть настолько глубокими, что некоторые полимеры, которые первоначально были неперабатываемыми, в настоящее время можно подвергать переработке при использовании разнообразных производственных технологий, включающих формование в результате окунания в раствор, прядение по мокрому способу и из расплава, прямое прессование, экструдирование и литьевое формование.
Следовательно, N-замещенный вариант полимера можно будет подвергать переработке при пониженных температурах (например, в сопоставлении с температурой стеклования полимера или Тg) при меньшей степени термического/окислительного разложения. Это создает окно температурной переработки для полимера, например полимеры, характеризующиеся повышенными значениями Тg, могут быть подвергнуты переработке при температурах существующих способов, а полимеры, характеризующиеся подобными значениями Тg, могут быть подвергнуты переработке при пониженных температурах.
Подобным же образом полимеры, сольватированные в относительно неполярных растворителях, таких как дихлорметан, могут быть подвергнуты переработке при повышенных концентрациях твердого вещества и пониженных вязкостях раствора.
Поэтому в соответствии с одним аспектом настоящего изобретения предлагаются биосовместимые биорассасываемые полимеры, содержащие множество мономерных повторяющихся звеньев, имеющих амидную группу, где амидные группы являются N-замещенными, а N-заместитель и степень N-замещения являются эффективными для уменьшения вязкости расплава, вязкости раствора или обеих вязкостей в сопоставлении со случаем того же самого полимера в отсутствие N-замещения. В соответствии с одним вариантом реализации N-заместители и степень N-замещения являются эффективными для уменьшения вязкости расплава, вязкости раствора или обеих вязкостей, по меньшей мере, приблизительно на 5%, а в еще одном варианте реализации имеет место уменьшение, по меньшей мере, приблизительно на 10%. В соответствии с еще одним вариантом реализации N-заместители представляют собой С1-С6 алкильные группы. В соответствии с еще одним другим вариантом реализации N-заместитель представляет собой метальную группу. В соответствии с еще одним вариантом реализации настоящее изобретение включает полимеры, содержащие одно или несколько повторяющихся звеньев, описывающихся формулой (I):

где каждый из X1 и X2 в формуле (I) независимо выбирают из Вr и I; каждый из у1 и у2 в формуле (Iа) независимо равен нулю или целому числу в диапазоне от 1 до 4, и R1 выбирают из замещенных или незамещенных, насыщенных или ненасыщенных, прямоцепных или разветвленных алифатических групп, содержащих вплоть до 48 атомов углерода, замещенных или незамещенных ароматических групп, содержащих вплоть до 48 атомов углерода, и замещенных или незамещенных аралифатических групп, содержащих вплоть до 48 атомов углерода, в которых алифатические части являются прямоцепными или разветвленными и насыщенными или ненасыщенными, и R1 содержит от 2 до 8 гетероатомов, выбранных из О, S и N. где два из гетероатомов образуют амидную группу основной цепи полимера, которая является N-замещенной. Если группа R1 будет иметь поли(алкиленоксидные) группы, то тогда будут присутствовать и дополнительные гетероатомы,.
Если только для конкретного варианта реализации не будет указано другого, то N-замещенные амины будут замещенными замещенной или незамещенной, прямой или разветвленной, насыщенной или ненасыщенной алифатической группой, содержащей вплоть до 30 атомов углерода, замещенной или незамещенной ароматической группой, содержащей вплоть до 30 атомов углерода, и замещенной или незамещенной аралифатической группой, содержащей вплоть до 30 атомов углерода, в которой алифатическая часть является прямоцепной или разветвленной и насыщенной или ненасыщенной. В соответствии с одним вариантом реализации группы R1 содержат от приблизительно 18 до приблизительно 36 атомов углерода. В соответствии с еще одним вариантом реализации N-заместители представляют собой C1-С6алкильные группы. В соответствии с еще одним другим вариантом реализации N-заместитель представляет собой метильную группу.
В соответствии с одним вариантом реализации R1 имеет боковую группу карбоновой кислоты или боковую группу сложного эфира или N-замещенного амида карбоновой кислоты. В соответствии с одним вариантом реализации R1 имеет боковую группу N-замещенного третичного амина. В соответствии с одним вариантом реализации R1 имеет как боковую группу карбоновой кислоты или боковую группу сложного эфира или N-замещенного амида карбоновой кислоты, так и боковую группу N-замещенного третичного амина. В соответствии с еще одним вариантом реализации R1 в формуле (I) представляет собой:
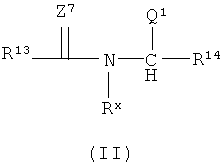
в которой каждый из R13 и R14 независимо содержит от 0 до 8 атомов углерода, включительно, и независимо выбирается из (-CHR1)e-CH=СH-(CHR1-)e и (-CHR1)f-(CHNQ2)g(-CHR1)f, где R представляет собой Н или низший алкил, каждый е независимо находится в диапазоне от 0 до 6, включительно, каждый f независимо находится в диапазоне от 0 до 8, включительно, a g равен 0 или 1; Rx выбирают из необязательно замещенного разветвленного или неразветвленпого C1-С30алкила и необязательно замещенного С6-С30арила; Q1 представляет собой C(=Z5)-R8, где Z5 представляет собой О или S; Q2 представляет собой -(N(Rx)2 или N(RxQ1); R8 выбирают из Н, терапевтически активного фрагмента, поли(алкиленоксида), Х3-C1-C18алкила, Х3-алкенила, Х3-алкинила, -Х5-циклоалкила, -Х5-гетероциклила, -X5-арила и -Х5-гетероарила;
Х3 выбирают из связи, О, S и N-алкила; X4 выбирают из О, S и N-алкила; X5 выбирают из связи, низшего алкила, О, S и N-алкила, и Z7 представляет собой из О.
Алкильные, алкенильные, алкинильные, циклоалкильные, гетероциклильные, арильные и гетероарильные группы, за исключением случаев указания другого, содержат вплоть до 30 атомов углерода. В соответствии с одним вариантом реализации группы содержат вплоть до 18 атомов углерода. Низшие алкильные группы, за исключением случаев указания другого, являются прямыми или разветвленными и содержат вплоть до 6 атомов углерода. Алкильные, алкенильные и алкинильные группы также являются прямыми или разветвленными и содержат от 0 до восьми гетероатомов, а низшие алкильные группы также содержат 0, 1 или 2 гетероатомов. Гетероатомы независимо выбирают из О, S и N-низшего алкила. Гетероциклильные и гетероарильные группы также содержат от одного до восьми гетероатомов, выбранных из О, S и N-низшего алкила.
В соответствии с одним вариантом реализации поли(алкиленоксидные) группы R8включают имеющие концевые алкильные группы поли(алкиленоксиды), имеющие молекулярную массу в диапазоне от 100 до 10000, примеры которых включают имеющие концевые метокси-группы поли(этиленгликоли) (ПЭГ), имеющие концевые метокси-группы поли(пропиленгликоли) (ППГ) и имеющие концевые метокси-группы блок-сополимеры ПЭГ и ППГ. В соответствии с еще одним вариантом реализации поли(алкиленоксидные) группы имеют молекулярную массу в диапазоне от приблизительно 400 до приблизительно 4000. В соответствии с еще одним вариантом реализации поли(алкиленоксиды) представляют собой поли(этиленгликоли), имеющие молекулярные массы в диапазоне от приблизительно 1000 до приблизительно 2000.
В соответствии с еще одним вариантом реализации одно или оба ароматических кольца могут быть замещенными 1-4 группами, независимо выбираемыми из галогена, низшего алкила, карбоксила, нитро, простого тиоэфира, сульфоксида и сульфонила, до тех пор, пока схемы замещения будут еще химически возможны. Любая комбинация заместителей, содержащая более чем два нитрозаместителя, является потенциально взрывоопасной и недвусмысленно исключается из данных концепций. Мономеры и полимеры, содержащие достаточное количество ароматических колец, достаточно замещенных бромом или йодом, по самой своей природе являются непроницаемыми для ионизирующих излучений. У предпочтительных мономеров и полимеров, непроницаемых для ионизирующих излучений, по меньшей мере, одно мономерное ароматическое кольцо является замещенным йодом, так что сумма у1 и у2 в формуле (I) является большей, чем ноль, предпочтительно, по меньшей мере, в одном, а более предпочтительно в обоих орто-положениях кольца по отношению к фенольному кислороду. Предпочтительно оба ароматических кольца являются йод-замещенными в обоих орто-положениях.
В соответствии с еще одном другим вариантом реализации R1 в формуле (I) выбирают из:
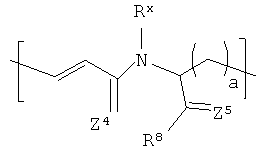

где Rx и R8 представляют собой то же самое, что описанное ранее в отношении формулы II; а и b находятся в диапазоне от 0 до 8, включительно, и каждый из Z4 и Z5 независимо представляет собой О или S. В соответствии с более конкретными вариантами реализации а=1 и b=2.
Полимеры, соответствующие настоящему изобретению, включают поликарбонаты, полиарилаты, полииминокарбонаты, полифосфазены и сложные полифосфоэфиры, обладающие структурой, описывающейся формулой (Iа)

где X1, X2, у1, у2 и R1 и варианты их реализации представляют собой то же самое, что и описанное ранее в отношении формулы (I), а А1 выбирают из группы, состоящей из:





где R10 выбирают из Н, C1-С30алкила, алкенила или алкинила и С2-С30гетероалкила; гетероалкенила или гетероалкинила, а R12 выбирают из группы, состоящей из C1-С30 алкилена, алкенилена или алкинилена, C1-С30гетероалкилена; гетероалкенилена или гетероалкинилена, С5-С30гетероалкиларилена, гетероалкениларилена, гетероалкиниларилена, С6-С30алкиларилена, алкениларилена, алкиниларилена и С5-С30гетероарилена.
В одном варианте реализации Rx представляет собой разветвленный или неразветвленный C1-С6алкил. В одном конкретном варианте реализации Rx представляет собой метил. В одном варианте реализации Q1 представляет собой группу, обладающую структурой:

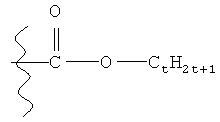
где t в вышеприведенных группах независимо находится в диапазоне от 0 до приблизительно 18.
Полимер, содержащий повторяющееся звено формулы (I), может быть сополимеризован с любым количеством других повторяющихся звеньев. В одном варианте реализации полимер, содержащий повторяющееся звено формулы (I), дополнительно содержит повторяющиеся звенья полиалкиленоксидного блока формулы (III):
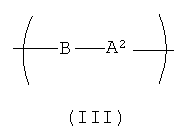
где В представляет собой -О- ((СНR6)р-O)q-; каждый R6 независимо представляет собой Н или С1-С3 алкил; р представляет собой целое число в диапазоне от приблизительно одного до приблизительно четырех; q представляет собой целое число в диапазоне от приблизительно пяти до приблизительно 3000; а А2 представляет собой то же самое, что и А1 в формуле (Iа). Один вариант реализации блок-сополимеризованного полимера характеризуется мольной долей алкиленоксида в диапазоне от приблизительно 0,1 до приблизительно 25%. Еще один вариант реализации характеризуется мольной долей алкиленоксида в диапазоне от приблизительно 0,5 до приблизительно 10%. Еще один другой вариант реализации характеризуется мольной долей алкиленоксида в диапазоне от приблизительно 1 до приблизительно 5%.
N-замещенные полимеры, соответствующие настоящему изобретению, получают в результате полимеризации дифенолов, соответствующих структуре, описывающейся формулой (I), и полученных в соответствии со способами, описанными в вышеупомянутом патенте US 5099060, описание которого во всей своей полноте посредством ссылки включается в настоящий документ. Полимеры могут быть получены в результате сополимеризации с дифенолами, которые не являются N-замещенными. Полимеры, соответствующие настоящему изобретению, включают варианты реализации, в которых мольная доля N-замещенного мономера находится в диапазоне от приблизительно 1 до приблизительно 50%. Еще один вариант реализации предлагает полимеры, характеризующиеся мольной долей N-замещенного мономера в диапазоне от приблизительно 5 до приблизительно 25%. Еще один другой вариант реализации предлагает полимеры, характеризующиеся мольной долей N-замещенного мономера в диапазоне от приблизительно 7,5 до приблизительно 12,5%.
Таким образом, N-замещенные дифенольные соединения представляют собой новые и подходящие для использования соединения, соответствующие настоящему изобретению. Поэтому настоящее изобретение также включает дифенольные соединения, имеющие амидные группы, которые являются N-замещенными. Один вариант реализации включает дифенольные соединения, у которых N-заместитель представляет собой С1-С6 алкильную группу. Еще один вариант реализации включает дифенольные соединения, обладающие структурой, описывающейся формулой (IV):

где Х1, X2, у1, у2 и R1 и варианты их реализации представляют собой то же самое, что и описанное ранее в отношении формулы (I).
В соответствии с одним вариантом реализации с использованием дифенола R1 выбирают таким образом, чтобы мономер, описывающийся формулой IV, представлял бы собой N-замещенный дитирозин, такой как изображенный далее N,N-диметилдитирозин, полученный в результате N-метилирования изображенного далее дитирозина:


Дитирозины и их получение описаны в литературе, и дитирозины могут быть подвергнуты N-замещению по методикам, описанным в настоящем документе. Настоящее изобретение также включает полимеры, описывающиеся формулой I и формулой Iа и полученные в результате полимеризации N-замещенных дитирозинов настоящего изобретения.
В общем случае полимеры, соответствующие настоящему изобретению, характеризуются превосходными физическими свойствами и перерабатываемостью в расплаве и могут быть сформованы в виде различных трехмерных структур, предназначенных для конкретных вариантов использования, по обычным методикам формования полимера, таким как экструдирование и литьевое формование. Также могут быть использованы и методики формования в результате окунания в раствор и прямого прессования, описанные в ранее упомянутых патентах, описывающих полимеры, полученные в результате полимеризации тирозиновых дифенольных соединений. Поэтому в соответствии с еще одним аспектом настоящего изобретения предлагаются медицинские устройства, находящиеся в контакте с кровью или имплантируемые в ткани и изготовленные из полимеров настоящего изобретения. Предпочтительно устройства изготавливают по способу термического формования. Такие устройства включают устройства для грыжесечения.
В соответствии с одним вариантом реализации данного аспекта изобретения медицинское устройство представляет собой стент, предназначенный для лечения полости организма. Предпочтительные стенты изготавливают из непроницаемых для ионизирующих излучений полимеров, соответствующих настоящему изобретению, или покрывают покрытием из них, для того чтобы при регулировании позиционирования устройства можно было бы использовать рентгеновское изображение. Предпочтительный непроницаемый для ионизирующих излучений биорассасываемый стент, соответствующий одному варианту реализации настоящего изобретения, изготавливают из биорассасываемого полимера, содержащего атомы галогена в количестве, достаточном для придания стенту собственной видимости в методе рентгеноскопии во время размещения стента.
В соответствии с еще одним аспектом данного варианта реализации настоящего изобретения медицинское устройство представляет собой продукт для эмболотерапии. Продукты для эмболотерапии, соответствующие настоящему изобретению, представляют собой дисперсные рецептуры биосовместимых биорассасываемых полимеров, соответствующих настоящему изобретению. В одном предпочтительном варианте реализации полимер содержит атомы галогена в количестве, достаточном для придания продукту для эмболотерапии собственной непроницаемости для ионизирующих излучений.
Другие конкретные области применения, в которых полимеры настоящего изобретения также являются в особенности хорошо подходящими для использования, включают матрицы для тканевой инженерии, на которые при конструировании новых тканей могут быть трансплантированы популяции изолированных клеток. Полимеры формуют в виде пористых устройств, описанных в работах Мikos еt аl., Вiomaterials, 14, 323-329 (1993) или Schugens еt аl., J. Biomed. Маter. Res., 30, 449-462 (1996) или в патенте US 6103255, которые обеспечивают фиксацию и рост клеток, как это описывается в работе Вulletin оf the Маterial Research Society, Special Issue оn Тissue Еngineering (Quest Еbitor: Joachim Кohn), 21(11), 22-26 (1996). Поэтому еще один аспект настоящего изобретения предлагает матрицу для ткани, обладающую пористой структурой, предназначенную для фиксации и пролиферации клеток либо in vitro либо in vivo, и сформованную из полимеров, соответствующих настоящему изобретению.
Еще одна конкретная область применения включает имплантируемые устройства для доставки лекарственных средств, где фармацевтически активное средство для его медленного высвобождения примешивают к полимерной матрице, в том числе устройства для доставки офтальмологических лекарственных средств. Поэтому в одном варианте реализации настоящего изобретения полимеры объединяют с определенным количеством биологически или фармацевтически активного соединения, достаточным для обеспечения его терапевтической эффективности в качестве системы доставки лекарственных средств локализованного или системного действия, как это описывается в работах Gutowska еt аl., J.Biometer. Res, 29, 811-21 (1995) и Нoffman, J. Соntrolled Release, 6, 297-305 (1987). Кроме того, еще один аспект настоящего изобретения предлагает способ доставки лекарственных средств локализованного или системного действия, заключающийся в имплантации в организм пациента, нуждающегося в этом, имплантируемого устройства для доставки лекарственных средств, содержащего терапевтически эффективное количество биологически или физиологически активного соединения в комбинации с полимером настоящего изобретения.
Полимеры, соответствующие настоящему изобретению, могут быть получены обладающими хорошими пленкообразующими свойствами. Важное явление, наблюдающееся для полимеров настоящего изобретения, содержащих сегменты поли(алкиленоксидного) блок-сополимера, заключается в наличии у полимерного геля или полимерного раствора в водных растворителях температурно-зависимого фазового перехода. По мере увеличения температуры гель полимеров претерпевает фазовый переход в схлопнутое состояние, в то время как полимерные растворы при определенной температуре или в пределах определенных температур подвергаются осаждению. Полимеры настоящего изобретения, содержащие поли(алкиленоксидные) сегменты, и в особенности те, которые во время нагревания претерпевают фазовый переход при приблизительно 30-40°С, могут быть использованы в качестве биоматериалов для высвобождения лекарственных средств и материалов для клинической имплантации. Конкретные области применения включают пленки и листы для предотвращения спайкообразования и регенерации ткани.
Поэтому в еще одном варианте реализации настоящего изобретения поли(алкиленоксидные) блок-сополимеры, соответствующие настоящему изобретению, могут быть сформованы в виде листа или покрытия, предназначенных для нанесения на незащищенные поврежденные ткани с целью использования в качестве барьера, предотвращающего спайкообразование во время хирургической операции, как это описывается в работе Urry еt аl., Маt. Rеs. Sос. Symp. Рrос., 292, 253-64 (1993). Поэтому еще один аспект настоящего изобретения предлагает способ предотвращения образования спаек между поврежденными тканями, заключающийся во вставлении в качестве барьера между поврежденными тканями листа или покрытия из полимеров, соответствующих настоящему изобретению, в виде непроницаемых для ионизирующих излучений поли(алкиленоксидных) блок-сополимеров.
Поли(алкиленоксидные) сегменты уменьшают поверхностную адгезию полимеров настоящего изобретения. По мере увеличения мольной доли поли(алкиленоксида) поверхностная адгезия уменьшается. Таким образом, могут быть получены полимерные покрытия, содержащие поли(алкиленоксидные) сегменты, соответствующие настоящему изобретению, которые демонстрируют стойкость по отношению к фиксации клеток и являются подходящими для использования в качестве нетромбогенных покрытий на поверхностях, находящихся в контакте с кровью. Такие полимеры в данной, а также и в других медицинских областях применения демонстрируют также и стойкость по отношению к фиксации бактерий. Поэтому настоящее изобретение включает находящиеся в контакте с кровью устройства и медицинские имплантаты, имеющие поверхности с нанесенным покрытием из поли(алкиленоксидных) блок-сополимеров настоящего изобретения.
Поверхности с нанесенным покрытием предпочтительно представляют собой полимерные поверхности. Способы, соответствующие настоящему изобретению, включают имплантацию в организм пациента находящегося в контакте с кровью устройства или медицинского имплантата, имеющего поверхность с нанесенным покрытием из полимеров настоящего изобретения, содержащих сегменты поли(алкиленоксидного) блок-сополимера.
В результате варьирования мольной доли поли(алкиленоксидных) сегментов в блок-сополимерах настоящего изобретения могут быть отрегулированы соотношения гидрофильных/гидрофобных свойств полимеров, что обеспечит настройку способности полимерных покрытий модифицировать поведение клеток. Увеличивающиеся уровни содержания поли(алкиленоксида) подавляют фиксацию, миграцию и пролиферацию клеток, в то время как увеличение количества боковых свободных карбокислотных групп фиксацию, миграцию и пролиферацию клеток промотирует. Поэтому в соответствии с еще одним другим аспектом настоящего изобретения предлагается способ регулирования фиксации, миграции и пролиферации клеток, заключающийся во введении живых клеток, тканей или биологических жидкостей, содержащих живые клетки, в контакт с полимерами настоящего изобретения.
Благодаря наличию боковых свободных карбокислотных групп производные биологически и фармацевтические активных соединений, в том числе лекарственных средств, могут быть зафиксированы на основной цепи полимера в результате соединения через ковалентные связи с боковой цепью карбоновой кислоты. Это обеспечивает получение замедленного высвобождения биологически или фармацевтически активного соединения в результате прохождения гидролиза ковалентной связи между лекарственным средством и основной цепью полимера. Поэтому настоящее изобретение также включает и варианты реализации полимера, в которых R представляет собой биологически или фармацевтически активное соединение, ковалентно зафиксированное на основной цепи полимера.
В дополнение к этому, полимеры настоящего изобретения, имеющие боковые карбокислотные группы, характеризуются рH-зависимой скоростью растворения. Это дополнительно способствует использованию полимеров в качестве покрытий для носителей, высвобождающих лекарственные средства в желудочно-кишечном тракте, которые защищают некоторые биологически и фармацевтически активные соединения, такие как лекарственные средства, от разложения в кислотной среде желудка. Сополимеры настоящего изобретения, характеризующиеся относительно высокой концентрацией боковых карбокислотных групп, являются стабильными и нерастворимыми в воде в кислотных средах, но быстро растворяются/разлагаются при воздействии нейтральных или основных сред. В противоположность этому сополимеры, характеризующиеся низкими соотношениями между количествами кислоты и сложного эфира, являются более гидрофобными и не будут быстро разлагаться/рассасываться ни в основных, ни в кислотных средах. Поэтому еще один аспект настоящего изобретения предлагает систему доставки лекарственных средств с контролируемой скоростью высвобождения, у которой на биологически или фармацевтически активное средство наносят физически покрытие из полимера настоящего изобретения, имеющего свободные карбокислотные группы.
Другие признаки настоящего изобретения будут указаны в следующих далее описании и формуле изобретения, которые раскрывают принципы изобретения и наилучшие варианты, которые предусматриваются в настоящее время для их реализации.
Подробное описание предпочтительных вариантов реализации
Настоящее изобретение представляет новый класс мономеров и сополимеров, полученных в результате их полимеризации, у которых аминокислоты или структурные производные аминокислот соединяют друг с другом до получения новых мономеров, а после этого полимеризуют до получения новых подходящих для использования полимеров, описанных формулой (I). Дифенольные мономеры, описывающиеся формулой IV, получают в соответствии со стандартными методиками пептидной химии, такими как описанные в работах J.Р.Greenstein аnd М.Winitz, Сhemistry оf the Аmino Асids, (John Wiley & Sons, New Yоrk 1961) и Воdanszky, Рractice оf Рeptide Synthesis (Springer-Verlag, New York, 1984).
Говоря конкретно, реакции сочетания с участием карбодиимида в присутствии гидроксибензотриазола проводят в соответствии с методикой, описанной в документах US 5,587,507 и US 5,670,602, при этом описания обоих данных документов посредством ссылки включаются в настоящий документ. В данных документах описываются подходящие для использования карбодиимиды. Предпочтительным карбодиимидом является гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (ЕDCI.НСl). Неочищенные мономеры могут быть дважды перекристаллизованы, сначала из 50%-ной смеси уксусной кислоты и воды, а после этого из смеси этилацетата, гексана и метанола с соотношением количеств компонентов 20:20:1, или в альтернативном варианте применяют флеш-хроматографию на силикагеле с использованием в качестве подвижной фазы смеси метиленхлорид: метанол с составом 100:2.
Тиоамидные мономеры (Z5=S) могут быть получены при использовании способа, описанного в работе А.Kjaer (Асta Сhemica Scandinavica, 6, 1374-83 (1952)). Амидная группа в мономерах или полимерах также может быть превращена в тиоамидные группы под действием фтористого аналога реагента Лоссона (f6LR), структура которого приводится далее (Каleta, Z., еt аl., Оrg. Lett., 8(8), 1625-1628 (2006)). Второй способ является предпочтительным, поскольку он позволяет сначала получить мономер, а после этого превратить амидную группу в тиоамидную группу:

Фтористый реагент Лоссона (ФРЛ)
Обработка амида под действием данного реагента с молярным соотношением 1:1 в ТГФ приводит к получению соответствующего тиоамида с выходом >88% после очистки по способу хроматографии или по другим способам.
Для превращения тирозиновых амидных мономеров в соответствующие тиоамиды фенольные группы мономеров сначала защищают в результате их превращения в диацетиловые сложные эфиры, как это продемонстрировано для I2DТЕ в случае обработки под действием Ас2О/пиридина. После этого O-защищенный I2DТЕ вводят в реакцию с f6LR с последующим основным гидролизом до получения тиоамид-I2DTE, как это продемонстрировано на схеме. При использовании подобной методики преобразование также можно провести и для полимера:

Схема. Превращение амидной группы в мономере в тиоамидную группу.
N-замещенные мономеры и полимеры настоящего изобретения могут быть получены в результате замещения коммерчески доступными N-замещенными исходными материалами исходных материалов в виде мономеров, имеющих амидные группы, таких как мономеры, описанные в патенте US 5099060, или в результате N-замещения мономеров, имеющих амидную группу, таких как мономеры, полученные в соответствии с патентом US 5099060, используя не-N-замещенные исходные материалы. Существует несколько способов, описанных в научной литературе, которые реализуют такие превращения. Например, кислые атомы водорода амидных групп могут быть замещены алкильными группами в мономере в результате проведения реакции между мономером или полимером и параформальдегидом с последующим гидрированием под действием Рd/С/H2 или под действием цианборгидрида натрия.
В настоящем изобретении предлагается способ получения предшественников N-алкильных/N-арильных мономеров формулы АА-1. Специалисты в соответствующей области техники, направляемые описанием изобретения из настоящего документа, при создании N-алкилированного/N-арилированного мономера, который соответствует описанным ранее полимерам, могут воспользоваться стадиями N-алкилирования/N-арилирования процесса получения предшественника мономера, описанного в настоящем документе.
Получение N-замещенного мономера:

Предшественники мономеров формулы АА-1 легко получают по нескольким отличающимся друг от друга маршрутам синтеза, выбирая конкретный маршрут, исходя из легкости получения соединения, коммерческой доступности исходных материалов и тому подобного. В некотором варианте реализации соединения формулы АА-1 могут быть синтезированы так, как это описывается в патенте US 6096782 авторов Аudia еt аl.; у авторов Аurelio еt аl. (Аurelio еt аl., «Synthetic Preparation оf N-Меthyl-α-аmino Асids», Сhem. Rev., 2004, 5823-5846); Fukuyama еt аl. (Fukuama еt аl., «2,4-Dinitrobenzenesulfonamides: А simple and Рractical Меthod for the Рreparaton оf a Variety оf Secondary Аmines аnd Diamines», Теt Lett., 1997, 5831-5834); и Ма еt аl. (Ма еt аl., «СuI-Саtаlyzed Coupling Reaction оf β-Аmino Асids оr Еsters with Аryl Наlides аt Теmperature Lower Тhan Тhat Еmployed in the Normal Ullmann Reaction. Facile Synthesis of SB-214857», Оrg. Lett., 3 (16), 2001, 2583-2586), при этом содержание каждого упомянутого документа во всей своей полноте посредством ссылки включается в настоящий документ.Например, предшественники мономеров формулы АА-1 могут быть синтезированы так, как это продемонстрировано в приведенных далее схемах 8 и 9. Другие неограничивающие способы синтеза предшественников, описывающихся формулой АА-1, продемонстрированы далее. Повсеместная распространенность модифицированных аминокислот в литературе позволит специалисту в соответствующей области техники воспользоваться широким ассортиментом дополнительных способов получения N-модифицированных аминокислот.
В одном варианте реализации в предшественнике мономера, описывающемся формулой АА-1, различные RA могут представлять собой защищенную или незащищенную боковую цепь аминокислоты. Например, RA может представлять собой боковую цепь аланина, цистеина, глицина, гистидина, изолейцина, фенилаланина, серина, треонина, триптофана, тирозина и валина. В одном примере варианта реализации RA может представлять собой боковую цепь тирозина, где фенольная гидрокси-группа является защищенной. Например, фенольная гидрокси-группа триптофана может быть защищенной в результате образования метилового простого эфира, как это продемонстрировано у предшественника, описывающегося приведенной далее формулой АА-W:

В одном варианте реализации у предшественника мономера, описывающегося формулой АА-1, различные RB могут представлять собой необязательно замещенного алкильного или арильного заместителя. Например, RB может представлять собой разветвленный или неразветвленный С1-С30алкил или необязательно замещенный С6-С30арил.
В одном варианте реализации предшественник мономера для формулы АА-1 представлен в формуле 8-А:

где различные Х могут представлять собой Сl, Вr, I, тозилат, мезилат, трифторметансульфонат (трифлат) и тому подобное.
Схемы синтеза: предшественники N-алкильного мономера
Маршрут 1 схемы 8
В одном варианте реализации может быть осуществлен продемонстрированный в маршруте 1 схемы 8 способ введения N-заместителя R8 предшественника мономера АА-1 в результате проведения реакции замещения, где RA и R8 определяют так же, как и ранее, а Х может представлять собой Сl, Вr, тозилат или мезилат, определенные так же, как и ранее. Например, в соединении 8-А различные Х представляют собой хорошо уходящую группу и могут быть замещены соответствующим арил- или алкиламином (8-В) до получения предшественника мономера АА-1, как это описывается в патенте US 3598859, который во всей своей полноте посредством ссылки включается в настоящий документ. В дополнение к этому, по данному способу могут быть использованы подходящие сложноэфирные производные соединения 8-А:
Схема 8
Маршрут 1

В некоторых вариантах реализации реакция сочетания между соединением 8-А и первичным, арил- или гетероариламином формулы 8-В, в соответствующих условиях может позволить получить соединение АА-1. Данная реакция описывается, например, в патенте US 3598859. В одном варианте реализации реакция протекает в результате объединения приблизительно стехиометрических эквивалентов соединения 8-А, где Х представляет собой Сl, Вr или I, и соединения 8-В в подходящем для использования инертном разбавителе, таком как вода, диметилсульфоксид (ДМСО) и тому подобное. Реакция использует избыток подходящего основания, такого бикарбонат натрия, гидроксид натрия и тому подобное, для удаления кислоты, образованной в ходе реакции. Реакцию предпочтительно проводят при температуре в диапазоне от приблизительно 25°С до приблизительно 100°С вплоть до завершения реакции, что обычно происходит в пределах от 1 до приблизительно 24 часов. По завершении реакции соединение АА-1 может быть выделено по обычно используемым способам, таким как осаждение, хроматография, фильтрование и тому подобное.
Маршрут 2 схемы 8
В одном варианте реализации может быть осуществлен способ введения N-заместителя RB предшественника мономера АА-1 в результате проведения реакции восстановительного аминирования, как это продемонстрировано в маршруте 2 схемы 8, где RA, RB и Х определяют так же, как и ранее. Сложный α-кетоэфир 8-С может быть подвергнут обработке под действием соответствующего арил- или алкиламина (8-В) в условиях восстановительного аминирования до получения соединения АА-1, как это описывается в патенте US 3598859:
Схема 8
Маршрут 2

Например, в одном примере варианта реализации приблизительно стехиометрические количества сложного α-кетоэфира, описывающегося формулой 8-С, и алкил- или арилампна, описывающегося формулой 8-В, могут быть объединены в растворителе, таком как метанол, этанол и тому подобное, и подвергнуты реакции в условиях, которые обеспечивают получение имина (не показано). После этого полученный «по месту» имин может быть восстановлен в обычных условиях под действием подходящего восстановителя, такого как цианборгидрид натрия, Н2/палладий на углероде и тому подобное, до получения сложного эфира N-арил- или N-алкиламинокислоты 8-D. В одном обычном варианте реализации восстановитель представляет собой Н2/палладий на углероде, который вводят в первоначальную реакционную смесь, что делает возможным восстановление имина «по месту» по однореакторной методике до получения сложного эфира N-арил- или N-алкиламинокислоты 8-D. Последующий гидролиз сложного эфира 8-D может позволить получить предшественника мономера АА-1. Например, сложный эфир может быть подвергнут гидролизу под действием влажного основного метанола.
Маршрут 3 схемы 8
В одном варианте реализации может быть осуществлен способ введения N-заместителя RB предшественника мономера АА-1 в результате проведения реакции алкилирования для соединения, описывающегося формулой 8-Е, и последующего преобразования, продемонстрированного в маршруте 3 схемы 8. В некоторых вариантах реализации RA и Х определяют так же, как и ранее, RB может представлять собой разветвленный или неразветвленный С1-С30 алкил или необязательно замещенный С6-С30 арил, RF может представлять собой Н, С1-С6 алкил или арил(СН2)-, а RE может быть выбран из группы, состоящей из групп СF3С(О)-, Сbz- (карбобензилокси). Воc- (трет-бутоксикарбонила), тозила- (толуолсульфонила) или нозила- (2-нитробензолсульфонила или 2-нитробензолсульфонила), 2,4-динитробензолсульфонила и тому подобного. N-замещенное соединение, описывающееся формулой 8-Е, в подходящих условиях может быть подвергнуто обработке под действием алкилирующего агента (8-В) до получения соединения 8-G, а последующее преобразование соединения 8-G может привести к получению предшественника мономера АА-1, как это продемонстрировано далее:
Схема 8
Маршрут 3

Например, в одном примере варианта реализации авторы Аurelio еt аl. описывают способы получения N-метиламинокислот, в общем случае данные способы используют для получения дополнительных N-замещенных аминокислот, таких как в случае N-метила, N-этила, N-бензила и тому подобного.
В одном варианте реализации обработка соединения 8-Е, где RE представляет собой Сbz- или Воc-; RF представляет собой Н; и RA представляет собой Ме или -СН2фенил, под действием метилиодида в присутствии Аg2O в ДМФА позволяет получить соединение 8-Е, где RB представляет собой метил, и RF представляет собой метил. Последующий гидролиз метилового сложного эфира и удаление защитной группы карбаматного типа позволяют получить N-метиламинокислоту АА-1. Данный способ может быть модифицирован в результате использования вместо метилиодида этилиодида, что позволяет получить N-этиламинокислоты формулы АА-1. В дополнение к этому, для получения N-метильных полимеров данный способ может быть применен к полимерам в соответствии с методикой авторов Das еt аl. (Das, еt аl., «N-methylation оf N-асуl оligopeptides», Вiochem Вiophys Res. Соmmun 1967, 29, 211), содержание данной работы посредством ссылки включается в настоящий документ.
В одном варианте реализации обработка соединения 8-Е, где RF представляет собой Сbz- или Воc-; RF представляет собой Н; и RA представляет собой Ме или -СН2фенил, под действием гидрида натрия с последующим добавлением метилиодида в ДМФА/ТГФ при 80°С в течение 24 ч позволяет получить соединение 8-Е, где RBпредставляет собой метил, и RF представляет собой метил. Последующий гидролиз метилового сложного эфира под действием гидроксида натрия в смеси метанол/ТГФ, а после этого удаление защитной группы карбаматного типа позволяют получить N-метиламинокислоту АА-1. Данный способ может быть модифицирован в результате использования вместо метилиодида этилиодида, что позволяет получить N-этиламинокислоты, описывающиеся формулой АА-1. В еще одном варианте реализации та же самая методика может быть использована для алкилирования соединения 8-Е, где RFпредставляет собой метил.
В одном варианте реализации в соответствии с методикой авторов Веlagali еt аl. (Веlagali еt аl., «А Highly Еfficient Меthod оf N-Меthylation For Тhe Аmino-Асid Dervatives», Indian J. Сhem.Sect. В, 1995, 34(1), 45), содержание работы которых во всей своей полноте посредством ссылки включается в настоящий документ, обработка соединения 8-Е, где RE представляет собой Воc-; RF представляет собой Н; и RA представляет собой Ме или -СН2фенилОН, под действием гексаметилдисилазана натрия в ТГФ с последующим добавлением метилиодида позволяет получить соединение 8-Е, где RB представляет собой метил, и RF представляет собой метил. Последующий гидролиз метилового сложного эфира, а после этого удаление защитной группы карбаматного типа позволяют получить N-метиламинокислоту АА-1. Данный способ может быть модифицирован в результате использования вместо метилиодида этилиодида, что позволяет получить N-этиламинокислоты, описывающиеся формулой АА-1. В еще одном варианте реализации та же самая методика может быть использована для алкилирования соединения 8-Е, где RF представляет собой метил.
В одном варианте реализации в соответствии с методикой авторов Fukuyama еt аl. обработка соединения 8-Е, где RE представляет собой нозил; RF представляет собой метил; и RA представляет собой -СН2фенил, под действием К2СО3 в ДМФА с последующим добавлением RB-X, где RB-X представляет собой пропилиодид, приводит к получению соединения 8-Е, где RB представляет собой пропил, и RF представляет собой метил. Последующий гидролиз метилового сложного эфира, а после этого удаление защитной группы карбаматного типа могут привести к получению N-пропиламинокислоты АА-1. Данный способ может быть модифицирован в результате использования вместо пропилиодида этилиодида, что позволяет получить N-этиламинокислоты, описывающиеся формулой АА-1.
Маршрут 4 схемы 8
В одном обычном варианте реализации в соответствии с методикой авторов Fukuyama еt аl. раствор сложного эфира аминокислоты, описывающегося формулой (8-ЕА), в ДМФА может быть подвергнут обработке под действием этилбромида в присутствии К2СО3 до получения соединения 8-GА. После этого 2,4-динитробензолсульфонильная группа может быть удалена, а сложноэфирная группа может быть гидролизована до получения соединения АА-1А. Например, 2,4-динитробензолсульфонильная группа может быть удалена в результате обработки соединения 8-GА под действием тиофенола и К2СО3 в ДМФА с последующим гидролизом метилового сложного эфира под действием NаОН в системе метанол/ТГФ до получения соединения АА-1А. По способам, известным специалисту в соответствующей области техники, N-замещенная β-аминокислота (АА-1А) может быть превращена в сложный эфир N-замещенной β-аминокислоты. Например, N-замещенная β-аминокислота может быть подвергнута обработке под действием НСl в растворителе, таком как этанол или метанол, до получения соответствующих этилового или метилового сложных эфиров N-арил-β-аминокислоты:
Схема 8
Маршрут 4

Маршрут 5 схемы 8
В альтернативном варианте в одном примере варианта реализации раствор трет-бутилового сложного эфира аминокислоты, описывающегося формулой (8-ЕВ), в ДМФА может быть подвергнут обработке под действием этилбромида в присутствии К2СО3 до получения соединения 8-GВ. После этого 2,4-динитробензолсульфонильная группа может быть удалена до получения трет-бутилового сложного эфира АА-1 В. Например, 2,4-динитробензолсульфонильная группа может быть удалена в результате обработки соединения 8-GВ под действием тиофенола и К2СО3 в ДМФА до получения соединения АА-1 В.
Схема 8
Маршрут 5

Предшественники N-арильных мономеров
Схема 9
В одном варианте реализации может быть синтезирован предшественник мономера АА-1, где RB представляет собой арильную группу, а Х представляет собой хлорид, бромид или иодид, как это продемонстрировано в схеме 9. Например, предшественник мономера, описывающийся формулой АА-1, может быть синтезирован по реакции Ульмана, например по методике авторов Ма еt аl.
Схема 9

RB=арил
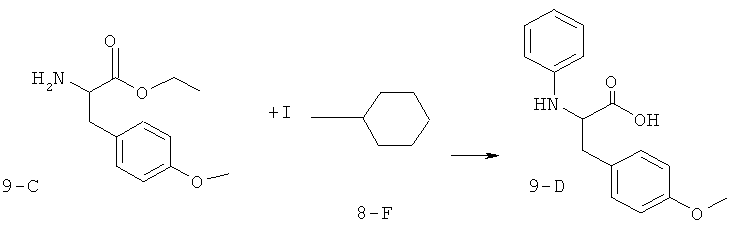
В одном примере варианта реализации сложный эфир аминокислоты 9-А может быть превращен в соединение 9-В, как это продемонстрировано в схеме 9. Например, в присутствии фенилиодида, Сul и К2СО3 в ДМФА при 100°С. В одном варианте реализации сложный эфир аминокислоты 9-С может быть подвергнут обработке под действием фенилиодида (8-F), СuI и К2СО3 в ДМФА при 100°С до получения соединения 9-D, как это продемонстрировано в схеме 9-А. N-арил-β-аминокислота (9-D) может быть превращена в сложный эфир N-арил-β-аминокислоты по способам, известным специалистам в соответствующей области техники. Например,N-арил-β-аминокислоту можно подвергнуть обработке под действием НСl в растворителе, таком как этанол или метанол, до получения соответствующих этилового или метилового сложных эфиров N-арил-β-аминокислоты:
Схема 9-A
В данных способах синтеза исходные материалы могут содержать хиральный центр (например, аланин), и в случае использования рацемического исходного материала получающийся в результате продукт представляет собой смесь диастереомеров или R,S-энантиомеров. В альтернативном варианте может быть использован хиральный изомер исходного материала, и если использующийся протокол реакции не приводит к рацемизации данного исходного материала, то тогда получают хиральный продукт. Такие протоколы реакции могут включать инверсию хирального центра во время синтеза.
В соответствии с этим, если только не будет указано другого, то продукты данного изобретения представляют собой смесь диастереомеров (в случае присутствия двух и более хиральных центров) или R,S-энантиомеров (в случае присутствия только одного хирального центра). Однако предпочтительно в случае желательности хирального продукта хиральный продукт будет соответствовать производному L-аминокислоты. В альтернативном варианте хиральные продукты могут быть получены по методикам очистки, которые выделяют диастереомеры или энантиомеры из R,S-смеси, обеспечивая получение того или другого стереоизомера. Такие методики хорошо известны в уровне техники.
Полимеры, соответствующие настоящему изобретению, содержат множество мономерных повторяющихся звеньев, имеющих амидную группу, где амидные группы являются N-замещенными, а N-заместители и степень N-замещения эффективно придают полимеру перерабатываемость по желательному способу переработки. Предпочтительно используют минимальное количество N-замещенного мономера. Оно может находиться в диапазоне от одного до трех мольных процентов для придания нерастворимому полимеру растворимости в заданном растворителе и доходить вплоть до приблизительно 25 мольных процентов для придания тому же самому полимеру формуемости по способу литьевого формования. Оно может быть легко определено специалистом в соответствующей области техники без проведения излишних экспериментов.
Предпочтительными являются N-алкильные заместители, содержащие от одного до шести атомов углерода, при этом более предпочтительными N-метильные заместители.
После этого мономерные соединения полимеризуют для получения биологически совместимых биоэродируемых полимеров, предназначенных для медицинского использования. Дифенольные мономеры могут быть использованы в любом обычном способе полимеризации, использующем дифенольные мономеры, в том числе в тех способах, по которым синтезируют полимеры, традиционно считающиеся гидролитически стабильными и бионеразлагаемыми.
Сюда включают сложные полиэфиры, поликарбонаты, полииминокарбонаты, полиарилаты, полиуретаны, полифосфазинполифосфонаты и простые полиэфиры, а также статистические блок-сополимеры, полученные из данных полимеров и поли(алкиленоксидов), как это описывается в патенте US 5658995, описание которого посредством ссылки включается в настоящий документ.
Также необходимо понимать, что представление различных формул полимеров, которые представляют структуры полимеров, может включать гомополимеры и гетерополимеры, которые включают стереоизомеры. В настоящем документе гомополимеры используют для обозначения полимера, целиком состоящего из одного и того же типа мономеров. Гетерополимер в настоящем документе используют для обозначения полимера, образованного из двух и более различных типов мономера, который также называют сополимером. Гетерополимер или сополимер может относиться к типу, известному под наименованием блочного, статистического и чередующегося. Кроме того, что касается представления различных формул полимеров, то продукты, соответствующие вариантам реализации настоящего изобретения, могут быть образованы из гомополимера, гетерополимера и/или смеси таких полимеров.
Полииминокарбонаты синтезируют из дигидрокси- и дифенольных мономеров по одному из соответствующих способов, описанных в патенте US 4980449, описание которого посредством ссылки включается в настоящий документ.В соответствии с одним способом часть дигидрокси- или дифенольного соединения превращают в соответствующий дицианат, после этого эквимолярные количества дигидрокси- или дифенольного соединения и дицианата полимеризуют в присутствии сильного основного катализатора, такого как алкоксид металла или гидроксид металла.
Соединения мономеров, описывающиеся формулой I, также можно вводить в реакцию с фосгеном до получения поликарбонатов, содержащих соединительные звенья -O-С(=O)-O-. Данный способ по существу представляет собой обычно использующийся способ полимеризации диолов до получения поликарбонатов. Подходящие для использования способы, связанные с ними катализаторы и растворители известны из уровня техники и описываются в работе Schnell, Chemistry and Physics of Polycarbonates, (Interscience, New York, 1964), положения которой посредством ссылки также включаются в настоящий документ.
Другие способы, адаптируемые для использования при получении поликарбонатных полимеров настоящего изобретения, описываются в патентах US 6120491 и 6475477, описания которых посредством ссылки включаются в настоящий документ. Поликарбонаты также могут быть получены в результате растворения мономера формулы I, в метиленхлориде, содержащем пиридин или триэтиламин с концентрацией 0,1 моль/л. С постоянной скоростью, обычно в течение приблизительно двух часов, при использовании шприцевого насоса или другого устройства добавляют раствор фосгена в толуоле с концентрацией, находящейся в диапазоне от приблизительно 10 до приблизительно 25% (масс.), а предпочтительно равной приблизительно 20% (масс.). Реакцию в реакционной смеси гасят в результате примешивания тетрагидрофурана (ТГФ) и воды, после чего полимер выделяют в результате осаждения под действием изопропанола (ИПС). После этого остаточный пиридин (в случае использования такового) удаляют в результате перемешивания раствора полимера в ТГФ и сильнокислотной смолы, такой как AMBERLYST 15.
Соединения мономеров, описывающиеся формулой IV, также могут быть непосредственно введены в реакцию с алифатическими или ароматическими дикарбоновыми кислотами по способу с участием карбодиимида, описанному в патенте US 5216115, при использовании в качестве катализатора п-толуолсульфоната 4-(диметиламино)пиридиния (ТСДП), что позволяет получить алифатические или ароматические поли(эфирамиды) на основе сложных эфиров. Описание патента US 5216115 посредством ссылки включается в настоящий документ. Дикарбоновые кислоты, соответствующие одному варианту реализации настоящего изобретения, обладают структурой, описывающейся формулой V:

в которой для алифатических сополимеров R5 выбирают из насыщенных и ненасыщенных, замещенных и незамещенных алкильных групп, содержащих вплоть до 18 атомов углерода, а предпочтительно от 2 до 12 атомов углерода, и необязательно также может включать вплоть до восьми атомов N, О, Р или 8. Для ароматических сополимеров R3 выбирают из арильных и алкиларильных групп, содержащих вплоть до 24 атомов углерода, а предпочтительно от 13 до 20 атомов углерода, и необязательно также может включать вплоть до восьми атомов N, О, Р или S. Для уменьшения значения Тg и вязкости расплава полимера N-гетероатомы могут быть N-замещенными.
Данный способ позволяет получить полимеры, содержащие соединительные звенья -O-С(=O)-R5-С(=O)-O-. R5 может быть выбран таким образом, чтобы дикарбоновые кислоты, использующиеся в качестве исходных материалов, представляли бы собой либо важные встречающиеся в природе метаболиты либо высокобиосовместимые соединения. Поэтому алифатические дикарбокислотные исходные материалы включают промежуточные дикарбоновые кислоты для пути дыхания клетки, известного под наименованием цикла Кребса. Дикарбоновые кислоты включают α-кетоглутаровую кислоту, янтарную кислоту, фумаровую кислоту и щавелевоуксусную кислоту (R5 в формуле III представляет собой -СН2-СН2-С(=O)-, -СН2-СН2-, -СН=СН- и -СН2-С(=O)- соответственно).
Еще одной встречающейся в природе алифатической дикарбоновой кислотой является адипиновая кислота (R5 представляет собой (-СН2-)4), обнаруживаемая в свекловичном соке. Дополнительной еще одной другой биосовместимой алифатической дикарбоновой кислотой является себациновая кислота (R5 представляет собой (-СН2-)8), которую широко исследовали и признали нетоксичной в рамках части клинической оценки сополимера поли(бис(п-карбоксифенокси)пропан-ангидрид себациновой кислоты) в работе Laurencin et al., J. Biomed. Mater. Res., 24, 1463-81 (1990).
Другие биосовместимые алифатические дикарбоновые кислоты включают щавелевую кислоту (R5 представляет собой связь), малоновую кислоту (R5 представляет собой -СН2-), глутаровую кислоту (R5 представляет собой (-СН2-)3), пимелиновую кислоту (R5 представляет собой (-СН2-)5), пробковую кислоту (R5 представляет собой (-СН2-)6) и азелаиновую кислоту (R5 представляет собой (-СН2-)7). Таким образом, R5 представляет собой (-СН2-)Q, где Q находится в диапазоне от 0 до 8 включительно. В число подходящих для использования ароматических дикарбоновых кислот попадают терефталевая кислота, изофталевая кислота и бис(п-карбоксифенокси)алканы, такие как бис(п-карбоксифенокси)пропан.
R5 также могут обладать структурой, описывающейся формулой VI:

где а находится в диапазоне от 1 до 3, включительно, m находится в диапазоне от 1 до 500000, включительно, и R4 представляет собой водород или низшую алкильную группу, содержащую от одного до четырех атомов углерода. R4 предпочтительно представляет собой водород, а предпочтительно равен 1, и m предпочтительно находится в диапазоне от приблизительно 10 до приблизительно 100, а более предпочтительно от приблизительно 10 до приблизительно 50.
Дикислоты, описывающиеся формулой VI, получают в результате окисления поли(алкиленоксидов) в соответствии с хорошо известными способами. Одним примером такого соединения является бискарбоксиметилполи(этиленгликоль), который является коммерчески доступным.
R5 также может обладать структурой, описывающейся формулой VII:

где а, m и R4 и их предпочтительные варианты представляют собой то же самое, что и описанное ранее в отношении формулы VI. R3 выбирают из связи или прямой и разветвленной алкильной и алкиларильной групп, содержащих вплоть до 18 атомов углерода.
Дикарбоновые кислоты, описывающиеся формулой VII, представляют собой поли(алкиленоксиды), бисфункционализованные под действием дикарбоновых кислот, обладающих структурой, описывающейся формулой V, где R5 представляет собой то же самое, что и описанное ранее для формулы V, и предпочтительно содержит вплоть до 12 атомов углерода.
Поли(алкиленоксиды), описывающиеся формулой VII, которые являются бисфункционализованными под действием дикарбоновой кислоты, получают в результате проведения реакции между нефункционализованным поли(алкиленоксидом) и избытком либо дикарбоновой кислоты (с участием агента реакции сочетания, такого как дициклогексилкарбодиимид), либо ангидрида (например, ангидрида янтарной кислоты) в присутствии пиридина или триэтиламина, либо хлорангидрида дикарбоновой кислоты (например, адипоилхлорида) в присутствии акцептора кислоты, подобного триэтиламину.
Непроницаемыми для ионизирующих излучений являются полимеры, полученные из мономерных исходных материалов формулы IV настоящего изобретения, содержащих, по меньшей мере, одно бром- или йодзамещенное ароматическое кольцо, такие как полимеры, полученные из непроницаемых для ионизирующих излучений дифенольных соединений, полученных в соответствии с описанием патента US 6475477, а также описанием находящейся на рассмотрении одновременно с данной и имеющей общего с ней патентообладателя патентной заявки US 10/592202, при этом описания обоих данных документов посредством ссылки включаются в настоящий документ. Йодированные и бромированные дифенольные мономеры настоящего изобретения также могут быть использованы в качестве непроницаемых для ионизирующих излучений биосовместимых нетоксичных добавок к другим полимерным биоматериалам.
Бром- и йодзамещенные ароматические мономеры настоящего изобретения получают по хорошо известным методикам йодирования и бромирования, которыми без проведения излишних экспериментов легко могут воспользоваться специалисты в соответствующей области техники, будучи направляемыми вышеупомянутыми выданным патентом и находящейся на рассмотрении заявкой (в настоящее время опубликованной). Галогенированные ароматические соединения, из которых получают галогенированные ароматические мономеры настоящего изобретения, подвергаются орто-направленному галогенированию. Термин «орто-направленный» в настоящем документе используется для обозначения ориентации атома (атомов) галогена по отношению к спиртовой фенокси-группе.
Статистические или блочные сополимеры в виде описывающихся формулой I полимеров настоящего изобретения, содержащих поли(алкиленоксид), можно получить в соответствии со способом, описанным в патенте US 5658995, описание которого посредством ссылки также включается в настоящий документ. Поли(алкиленоксид) предпочтительно представляет собой поли(этиленгликолевый) блок/звено, обычно имеющий молекулярную массу меньшую, чем приблизительно 10000 на одно звено. Более часто поли(этиленгликолевый) блок/звено имеет молекулярную массу меньшую, чем приблизительно 4000 на одно звено. Молекулярная масса предпочтительно находится в диапазоне от приблизительно 1000 до приблизительно 2000 на одно звено.
Мольная доля поли(этиленгликолевых) звеньев в блок-сополимерах может находиться в диапазоне от более, чем ноль, до менее, чем 1, а обычно является большей, чем ноль, и доходящей вплоть до приблизительно 0,5 включительно. Более предпочтительно мольная доля является меньшей, чем приблизительно 0,25, а еще более предпочтительно меньшей, чем приблизительно 0,1. В более предпочтительных вариантах мольная доля может варьироваться в диапазоне от более, чем приблизительно 0,001, до приблизительно 0,08, а наиболее предпочтительно от приблизительно 0,025 до приблизительно 0,035.
Если только не будет указано другого, то мольные доли, приведенные в настоящем документе, будут базироваться на совокупном молярном количестве поли(алкиленгликолевых) и негликолевых звеньев в полимерах.
Заявители также выявили, что по мере увеличения степени галогенирования и мольной доли звеньев, имеющих свободные карбокислотные группы, температура стеклования полимера увеличивается. При выдерживании температуры стеклования полимера в пределах диапазона желательного для области конечного применения, для полимеров, характеризующихся повышенными уровнями йодирования и/или повышенными мольными долями звеньев, имеющих свободные карбокислотные группы, обычно используют повышенные массовые процентные содержания поли(алкиленоксида). N-алкилирование представляет собой альтернативный способ уменьшения температуры стеклования полимера, так что количество поли(алкиленоксида) может быть уменьшено или исключено без оказания неблагоприятного воздействия на свойства расплава полимера. Таким образом, в распоряжение специалиста по полимерной химии настоящее изобретение предоставляет больше средств тонкого регулирования физико-механических свойств полимеров изобретения.
Полимеры, описывающиеся формулой I, имеют среднемассовые молекулярные массы, большие, чем приблизительно 20000, а предпочтительно большие, чем приблизительно 80000, при расчете по методу гельпроникающей хроматографии (ГПХ) по отношению к полистирольным стандартам при использовании тетрагидрофурана (ТГФ) в качестве элюента без дополнительной коррекции.
Полимеры настоящего изобретения определяют как включающие полимеры, полученные в результате полимеризации мономеров, описывающихся формулой IV и имеющих боковые свободные карбокислотные группы (R8=ОН). Однако полимеры, имеющие боковые свободные карбокислотные группы, невозможно получить в результате полимеризации соответствующих мономеров, имеющих боковые свободные карбокислотные группы, без прохождения перекрестной реакции между свободной карбокислотной группой и сомономером. В соответствии с этим, полимеры, соответствующие настоящему изобретению и имеющие боковые свободные карбокислотные группы, получают из гомополимеров и сополимеров бензилового и трет-бутилового сложноэфирных мономеров настоящего изобретения, обладающих структурой, описывающейся формулой IV, у которых R8 представляет собой бензильную или трет-бутильную группу.
Гомополимеры и сополимеры, содержащие звенья бензилового сложного эфира, могут быть превращены в соответствующие гомополимеры и сополимеры, имеющие свободные карбокислотные группы, в результате селективного удаления бензильных групп по способу катализируемого палладием гидрогенолиза, описанному в находящемся на рассмотрении одновременно с данной заявкой и имеющем общего с ней патентообладателя патенте US 6120491, описание которого посредством ссылки включается в настоящий документ.
Гомополимеры и сополимеры, содержащие звенья трет-бутилового сложного эфира, могут быть в превращены в соответствующие гомополимеры и сополимеры, имеющие свободные карбокислотные группы, в результате селективного удаления трет-бутильных групп по способу ацидолиза, описанному в вышеупомянутой патентной заявке US 10/592202, также посредством ссылки, включенной в настоящий документ.
Каталитический гидрогенолиз или ацидолиз необходимы, поскольку лабильность основной цепи полимера не допускает использования методик более жесткого гидролиза.
Заявители осознают, что в соответствии с настоящим изобретением мольная доля звеньев, имеющих свободные карбокислотные группы, в полимерах настоящего изобретения может быть отрегулирована, имея целью подобное регулирование разложения/рассасываемости устройств, изготовленных из таких полимеров. Например, заявители осознают, что в то время как сополимер поли(карбонат ДТЕ-35% (моль) ДТ) (тирозиновый поликарбонат, содержащий приблизительно 35% звеньев, имеющих свободные карбокислотные группы) на 90% рассасывается в течение приблизительно 15 дней, поликарбонаты, характеризующиеся меньшими количествами свободных карбокислотных групп, в желательном случае будут характеризоваться более продолжительными временами жизни в организме. Кроме того, в результате другого регулирования количества свободных карбокислотных групп в полимерах во всем диапазоне предпочтительной мольной доли получающиеся в результате полимеры могут быть адаптированы для использования в различных областях применения, требующих различные по продолжительности времени жизни устройства. В общем случае, чем большей будет мольная доля звеньев, имеющих свободные карбокислотные группы, тем более короткой будет продолжительность времени жизни устройства в организме, и тем более подходящими будут такие устройства для использования в областях применения, где потребуются более короткие продолжительности времени жизни. В определенных вариантах реализации, в которых требуются продолжительности времени жизни, равные 6 месяцам и более, желательно использовать полимеры, характеризующиеся предпочтительными в настоящем документе диапазонами содержания звеньев, имеющих свободные карбокислотные группы.
Настоящее изобретение также включает N-замещенные варианты мономеров и полимеров из публикации патентной заявки US 2006-0115449 автора Pacetti, во всей своей полноте посредством ссылки включенной в настоящий документ, полученные в соответствии со способами N-замещения, описанными в настоящем документе.
В соответствии с предпочтительными вариантами реализации настоящего изобретения по завершении полимеризации может быть проведена надлежащая переработка полимеров по любому из широкого ассортимента известных способов, обычно используемых в области синтетических полимеров, целиком полученных из биологически совместимых мономеров, для получения широкого ассортимента подходящих для использования изделий, обладающих ценными физическими и химическими свойствами. Подходящие для использования изделия могут быть изготовлены по обычно использующимся методикам формования полимера, таким как экструдирование, прямое прессование, литьевое формование, формование в результате окунания в раствор, центробежное формование, прядение по мокрому способу, комбинация двух и более данных способов и тому подобное. Формованные изделия, полученные из полимеров, являются подходящими для использования, помимо прочего, в качестве разлагаемых биоматериалов для областей применения медицинских имплантатов. Такие области применения включают использование формованных изделий в качестве сосудистых трансплантатов и стентов.
Способы изготовления стентов могут дополнительно включать двухмерные способы изготовления, такие как резка экструдированных листов полимера по способам лазерной резки, травления, механической резки или другим способам, и сборка полученных в результате резки частей до получения стентов, или подобные способы трехмерного изготовления устройств из твердых форм. В определенных других вариантах реализации полимеры получают в виде покрытий на поверхности имплантируемого устройства, в особенности стента, изготовленного либо из полимера настоящего изобретения либо из другого материала, такого как металл. Такие покрытия могут быть получены на стентах по методикам, таким как окунание, нанесение покрытия распылением, их комбинации и тому подобное. Кроме того, стенты могут состоять, по меньшей мере, из одного волоконного материала, отверждаемого материала, ламинированного материала и/или тканого материала. Подробности по продуктам в виде стентов и их изготовлению, где могут быть использованы полимеры настоящего изобретения, описываются в находящейся на рассмотрении одновременно с данной и имеющей общего с ней патентообладателя патентной заявке US с регистрационным номером 10/952202, поданной 27 сентября 2004 года, описание которой посредством ссылки включается в настоящий документ. Стенты предпочтительно изготавливают из непроницаемых для ионизирующих излучений полимеров настоящего изобретения, что делает возможным рентгеноскопическое позиционирование устройства.
Исключительно выгодная комбинация свойств, связанных с предпочтительными полимерами, соответствующими вариантам реализации настоящего изобретения, хорошо подходит для использования при получении широкого ассортимента медицинских устройств помимо стентов, в особенности имплантируемых медицинских устройств, которые предпочтительно являются непроницаемыми для ионизирующих излучений, биосовместимыми и характеризуются различными по продолжительности временами биорассасывания. Например, заявители осознают то, что в определенных вариантах реализации полимеры являются подходящими для использования при изготовлении имплантируемых устройств для ортопедии, тканевой инженерии, областей применения в стоматологии, ушивания ран, желудочных бандажей, доставки лекарственных средств, лечения рака, других областей применения для сердечно-сосудистой системы, стентов, не предназначенных для сердечно-сосудистой системы, таких как для желчных протоков, пищевода, влагалища, легкого-трахеи/бронха и тому подобного. В дополнение к этому, полимеры являются подходящими для использования при изготовлении имплантируемых, непроницаемых для ионизирующих излучений дисков, пробок и других устройств, использующихся для отслеживания удаления участков тканей, например при удалении тканей и органов, пораженных раком, а также скобок и клипсов, подходящих для использования при ушивании ран, фиксации ткани на кости и/или хряще, прекращении кровотечения (гомеостаз), трубной перевязке, предотвращении спайкообразования во время хирургической операции и тому подобном. Заявители также осознают то, что полимеры настоящего изобретения являются хорошо подходящими для использования при изготовлении широкого ассортимента покрытий для медицинских устройств, в особенности имплантируемых медицинских устройств.
Кроме того, в некоторых предпочтительных вариантах реализации настоящие полимеры могут быть с выгодой использованы при изготовлении различных ортопедических устройств, в том числе, например, непроницаемых для ионизирующих излучений биоразлагаемых винтов (канюлированных винтов), непроницаемых для ионизирующих излучений биоразлагаемых фиксаторов для хирургической нити и тому подобного, что предназначено для использования в областях применения, включающих исправление, профилактику, регенерацию и заживление для передней крестообразной связки (ПКС), мышц плечевого пояса/плечевой сумки и при других деформациях скелета.
Другие устройства, которые могут быть с выгодой изготовлены из полимеров настоящего изобретения, включают устройства, предназначенные для использования в тканевой инженерии. Примеры подходящих для использования устройств включают матрицы и трансплантаты для тканевой инженерии (такие как сосудистые трансплантаты, трансплантаты или имплантаты, использующиеся при регенерации нерва). Настоящие полимеры также могут быть использованы для изготовления широкого ассортимента устройств, эффективных для использования при ушивании внутренних ран. Например, могут быть изготовлены биоразлагаемые хирургические нити, клипсы, скобки, колючие или сетчатые хирургические нити, имплантируемые опоры для органов и тому подобное, что предназначено для использования в различных областях применения в хирургии, косметологии и при ушиваниях ран на сердце.
В соответствии с предпочтительными аспектами настоящего изобретения могут быть с выгодой изготовлены различные устройства, находящие себе применение в вариантах использования в стоматологии. Например, выгоду из непроницаемости для ионизирующих излучений могут извлечь устройства, предназначенные для направленной регенерации тканей, замены альвеолярного отростка у владельцев зубных протезов, и устройства для регенерации челюстно-лицевых костей, так что хирург/дантист сможет удостовериться в размещении и непрерывном функционировании таких имплантатов при использовании простого рентгенологического исследования.
Настоящие полимеры также являются подходящими для изготовления желудочных бандажей, предназначенных для использования при лечении ожирения. Изготовление непроницаемых для ионизирующих излучений бандажей делает возможными более эффективное отслеживание устройств в организме человека и более эффективное лечение ожирения.
В дополнение к внутрисосудистым стентам и стентам, не предназначенным для сердечно-сосудистой системы, настоящие полимеры являются подходящими для использования в нескольких других устройствах для сердечно-сосудистой и сосудистой систем. Например, для использования при восстановлении функций клапанов, трубок сердца и тому подобного в результате их замены могут быть изготовлены клапаны, эндопротезы сухожильных хорд, аннулопластические кольца, заплаты для восстановления створок клапана, сосудистые трансплантаты, трубки сосудов, заплаты для дефектов перегородки, устройства (пробки) для закрытия доступа в артерии и вены. В дополнение к этому, из полимеров настоящего изобретения могут быть изготовлены части искусственного сердца, такие как гранулярный/фиброидный слой (сильфонные насосы).
Полимеры настоящего изобретения также являются подходящими для использования при изготовлении биорассасываемых, обладающих собственной непроницаемостью для ионизирующих излучений полимерных продуктов для эмболотерапии, предназначенных для временного и терапевтического ограничения или блокирования кровоснабжения при лечении опухолей и аномалий сосудистой системы, например фибром матки, новообразований (то есть химиоэмболизация), кровоизлияния (например, во время травмы с кровотечением) и аномалий, свищей и аневризм артериовенозной системы, чего добиваются при использовании катетера или шприца. Подробности по продуктам для эмболотерапии и способам изготовления, где могут быть использованы полимеры настоящего изобретения, описываются в находящейся на рассмотрении одновременно с данной и имеющей с ней общего патентообладателя патентной заявке US с регистрационным номером 10/952274, поданной 27 сентября 2004 года, описание которой посредством ссылки включается в настоящий документ. Способ лечения в случае эмболотерапии по самой своей природе является локализованным, а не системным, и продукты предпочтительно изготавливают из непроницаемых для ионизирующих излучений полимеров настоящего изобретения, что позволяет проводить рентгеноскопическое отслеживание доставки продукта и лечения.
Кроме того, настоящие полимеры являются подходящими для использования при изготовлении широкого ассортимента устройств для доставки терапевтических средств. Такие устройства могут быть адаптированы для использования с широким ассортиментом терапевтических средств, в том числе, например, фармацевтических средств (то есть лекарственных средств) и/или биологических средств, определенных ранее и включающих биомолекулы, генетический материал и переработанные биологические материалы и тому подобное. Может быть изготовлено любое количество систем транспортировки, способных доставлять терапевтические средства в организм, включающих устройства для доставки терапевтических средств при лечении рака, устранении внутрисосудистых проблем, проблем в стоматологии, ожирения, инфекционного заболевания и тому подобного.
В определенных вариантах реализации любое из вышеупомянутых устройств, описанных в настоящем документе, может быть адаптировано для использования в качестве устройства для доставки терапевтического средства (в дополнение к любой другой своей функциональности. Могут быть получены системы доставки терапевтических средств с контролируемой скоростью высвобождения, где терапевтическое средство, такое как биологически или фармацевтически активное и/или пассивное средство, физически внедряют в полимерную матрицу или диспергируют в ней или физически примешивают к полимеру настоящего изобретения. Системы доставки терапевтических средств с контролируемой скоростью высвобождения также могут быть получены в результате непосредственного нанесения терапевтического средства на поверхность имплантируемого медицинского устройства, такого как устройство в виде биорассасываемого стента (образованного, по меньшей мере, из одного из настоящих полимеров), без использования данных полимеров в качестве покрытия или при использовании других полимеров или веществ для нанесения покрытия.
Боковые группы Q1 полимеров настоящего изобретения также могут быть дериватизированы в результате ковалентной фиксации терапевтического средства. В зависимости от того, будет ли Q1 определять свободную карбокислотную группу, группу амида карбоновой кислоты, гидроксильную группу и тому подобное, и в зависимости от фрагментов, присутствующих на недериватизованном терапевтическом средстве, ковалентная связь может представлять собой амидную связь или сложноэфирную связь. Обычно терапевтическое средство дериватизируют по группе первичного или вторичного амина, гидроксила, кетона, альдегида или карбоновой кислоты. Методики химической фиксации описываются в патентах US 5219564 и 5660822; работах Nаthan et al., ВiO. Cong. Chem., 4, 54-62 (1993) и Nathan, Macromolecules, 25, 4476 (1992), описания которых посредством ссылки включаются в настоящий документ.Терапевтическое средство может быть сначала ковалентно зафиксировано на мономере, который после этого заполимеризуют, или сначала может быть проведена полимеризация с последующей ковалентной фиксацией терапевтического средства.
В случае активности терапевтического средства в конъюгированной форме используют гидролитически стабильные конъюгаты. В случае неактивности терапевтического средства в конъюгированной форме используют гидролизуемые конъюгаты.
Соединения для доставки терапевтического средства также могут быть получены в результате физического перемешивания доставляемого терапевтического средства и полимеров настоящего изобретения при использовании обычных методик, хорошо известных специалистам в соответствующей области техники. Для данного варианта доставки терапевтического средства наличие у полимера боковых групп, предназначенных для ковалентной фиксации терапевтического средства, является несущественным.
Полимерные композиции настоящего изобретения, содержащие терапевтические средства, вне зависимости от их пребывания в форме полимерных конъюгатов или физических смесей полимера и терапевтического средства, являются подходящими для использования в областях применения, в которых желательной является локализованная доставка, а также в ситуациях, в которых желательной является системная доставка. Полимерные конъюгаты и физические смеси могут быть имплантированы в организм пациента, нуждающегося в этом, по методикам, которые по существу являются обычными и хорошо известными специалистам в соответствующей области техники.
Таким образом, имплантируемые медицинские устройства, которые также используются для доставки терапевтического средства к месту имплантации, могут быть изготовлены из системы доставки терапевтического средства настоящего изобретения или покрыты покрытием из нее, где полимер настоящего изобретения включает терапевтическое средство, физически примешанное к нему или ковалентно связанное с ним, как, например, стент, элюирующий лекарственное средство. Для доставки терапевтического средства также могут быть изготовлены и частицы для эмболотерапии.
Примеры биологически или фармацевтически активных терапевтических средств, которые могут быть ковалентно зафиксированы на полимерах настоящего изобретения, включают ацикловир, цефрадин, мальфален, прокаин, эфедрин, адриамицин, дауномицин, плюмбагин, атропин, хинин, дигоксин, хинидин, биологически активные пептиды, хлорин e.sub.6, цефрадин, цефалотин, пролин и пролиновые аналоги, такие как цис-гидрокси-L-пролин, мальфален, пенициллин V, аспирин и другие нестероидные противовоспалительные средства, никотиновую кислоту, хемодеоксихолевую кислоту, хлорамбуцил, противоопухолевые и антипролиферативные средства, в том числе антипролиферативные средства, которые предотвращают возникновение рестеноза, гормоны, такие как эстроген, и тому подобное. Биологически активные соединения, предназначенные для использования в целях настоящего соединения, дополнительно определяют как включающие медиаторы фиксации клеток, биологически активные лиганды и тому подобное.
Изобретение, описанное в настоящем документе, также включает различные лекарственные формы фармацевтических средств, содержащие комбинации полимер-терапевтическое средство настоящего изобретения. Комбинация может представлять собой объемную матрицу, предназначенную для имплантации, или мелкие частицы, предназначенные для применения по традиционным способам, в случае чего лекарственные формы включают те, которые являются общепризнанными, например таблетки, капсулы, жидкости и растворы для перорального применения, капли, растворы и суспензии для парентерального применения, эмульсии, порошки для перорального применения, растворы или порошки для ингаляционного применения, аэрозоли, растворы, суспензии, эмульсии, кремы, лосьоны, мази для местного применения, жидкости для трансдермального применения и тому подобное.
Лекарственные формы могут включать один или несколько фармацевтически приемлемых носителей. Такие материалы являются нетоксичными для реципиентов при использованных дозировках и концентрациях и включают разбавители, солюбилизаторы, смазывающие средства, суспендирующие средства, инкапсулирующие материалы, интенсификаторы впитываемости, растворители, мягчители, загустители, диспергаторы, буферы, такие как фосфат, цитрат, ацетат и соли других органических кислот, антиоксиданты, такие как аскорбиновая кислота, консерванты, низкомолекулярные (менее, чем приблизительно 10 остатков) пептиды, такие как полиаргинин, белки, такие как сывороточный альбумин, желатин или иммуноглобулины, другие гидрофильные полимеры, такие как поли(винилпирролидинон), аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин, моносахариды, дисахариды и другие углеводы, в том числе целлюлоза или ее производные, глюкозу, маннозу или декстрины, хелатообразователи, такие как ЭДТК, спирты на основе сахаров, такие как маннит или сорбит, поверхностно-активные вещества с противоионами, такими как натриевый, и/или неионные поверхностно-активные вещества, такие как твин, плюроники или ПЭГ.
Терапевтические средства, вводимые в полимерные конъюгаты и физические смеси данного изобретения, могут находиться в физиологически приемлемом носителе, лекарственной среде, стабилизаторе и тому подобном и могут присутствовать в виде рецептур для замедленного высвобождения или синхронизированного высвобождения, дополнительных для полимерной рецептуры, полученной в данном изобретении. Жидкие носители и разбавители для водных дисперсий являются подходящими для использования также и совместно с полимерными конъюгатами и физическими смесями.
При использовании комбинаций полимер-терапевтическое средство данного изобретения пациенты, нуждающиеся в лечении, обычно млекопитающие, могут применять лекарственные формы, которые будут обеспечивать достижение оптимальной эффективности. Дозировка и способ применения будут варьироваться при переходе от одного пациента к другому и будут зависеть от таких факторов, как тип излечиваемого млекопитающего, его пол, масса, рацион питания, текущее лекарственное лечение, общее клиническое состояние, конкретные использованные соединения, конкретный вариант применения, для которого используют данные соединения, и других факторов, о которых специалисты в соответствующей области медицины должны иметь представление. Комбинации полимер-терапевтическое средство данного изобретения могут быть получены предназначенными для хранения в условиях, подходящих для выдерживания активности терапевтического средства, а также сохранения целостности полимеров, и обычно являются подходящими для хранения при комнатных или пониженных температурах.
Аэрозольные препараты обычно являются подходящими для использования при назальной или пероральной ингаляции и могут иметь форму порошка или раствора в комбинации со сжатым газом, обычно сжатым воздухом. В дополнение к этому, аэрозоли могут быть использованы для местного применения. В общем случае могут быть составлены рецептуры препаратов для местного применения, позволяющие наносить надлежащую дозировку на пораженную зону один раз в день и вплоть до трех-четырех раз в день по мере надобности.
В зависимости от конкретного выбранного соединения вариантом выбора может являться трансдерамальная доставка, обеспечивающая относительно непрерывную доставку лекарственного средства, что в определенных обстоятельствах будет предпочтительным. Трансдерсмальная доставка обычно включает использование соединения в растворе совместно со спиртовой средой, необязательно интенсификатором впитываемости, таким как поверхностно-активное вещество, и другими необязательными ингредиентами. Примерами подходящих для использования трансдермальных систем являются системы трансдермальной доставки матричного и резервуарного типа. Трансдермальная доставка отличается от обычного местного лечения тем, что лекарственная форма обеспечивает доставку пациенту системной дозировки терапевтического средства.
Рецептуры полимер-лекарственное средство данного изобретения также можно применять и в форме липосомальных систем доставки, таких как маленькие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть использованы по любому из надлежащих способов применения, описанных в настоящем документе. Например, могут быть составлены рецептуры липосом, которые можно будет применять перорально, парентерально, трансдермально или ингаляционно. Таким образом, в результате селективной доставки в пораженную зону токсичность терапевтического средства может быть уменьшена. Например, если терапевтическое средство будет инкапсулировано в липосомах и инъецировано внутривенно, то тогда использующиеся липосомы будут поглощаться клетками сосудов, и с течением времени внутри стенки кровеносного сосуда могли бы высвобождаться локально высокие концентрации терапевтического средства, что в результате приведет к получению улучшенного действия терапевтического средства. Терапевтические средства, инкапсулированные в липосомах, предпочтительно применяют парентерально, а в особенности в виде внутривенной инъекции.
Для высвобождения терапевтического средства липосомы могут быть направлены в конкретное место. Это позволит обойти использование избыточных дозировок, которые зачастую необходимы для получения терапевтически подходящей дозировки терапевтического средства по месту его действия, и, следовательно, проявление токсичности и побочных эффектов, связанных с повышенными дозировками.
В желательном случае терапевтические средства, введенные в полимеры данного изобретения, могут дополнительно включать средства, облегчающие системную доставку терапевтических средств до желательной цели, до тех пор, пока средство, облегчающее доставку, будет удовлетворять тем же самым критериям правомочности использования, что и описанные ранее терапевтические средства. Доставляемые активные терапевтические средства таким образом могут быть объединены с антителами, фрагментами антител, факторами роста, гормонами или другими целевыми веществами, с которыми молекулы терапевтического средства вступают в реакцию сочетания.
Комбинации полимер-терапевтическое средство данного изобретения также можно получать в виде формованных деталей, таких как клапаны, стенты, трубки, протезы и тому подобное.
Терапевтически эффективные дозировки могут быть определены по методам либо in vitro либо in vivo. Для определения оптимальной требуемой дозировки каждого конкретного соединения настоящего изобретения могут быть проведены индивидуальные определения. Само собой разумеется, что на диапазон терапевтически эффективных дозировок будут оказывать влияние способ применения, цели терапии и состояние пациента. Для различных подходящих способов применения эффективность всасывания необходимо индивидуально определять для каждого лекарственного средства по методам, хорошо известным в фармакологии. В соответствии с этим, для получения оптимального терапевтического действия по мере надобности от терапевта могут потребоваться титрование дозировки и модифицирование способа применения. Определение эффективных уровней дозировок, то есть уровней дозировок, необходимых для достижения желательного результата, не будет выходить за пределы компетенции специалиста в соответствующей области техники. Обычно применение соединения начинается с пониженных уровней дозировок при увеличении уровней дозировок вплоть до достижения желательного действия. В пределы стандартного уровня знаний специалиста в соответствующей области техники попадает также и варьирование скорости высвобождения из рецептур данного изобретения для определения выгодного профиля, зависящего от излечиваемых терапевтических состояний.
Обычная дозировка может находиться в диапазоне от приблизительно 0,001 мг/кг до приблизительно 1000 мг/кг, предпочтительно от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг, а более предпочтительно от приблизительно 0,10 мг/кг до приблизительно 20 мг/кг. В выгодном случае соединения данного изобретения можно применять несколько раз в день, но подходящими для использования могут быть также и другие режимы применения лекарственной формы.
При реализации способов данного изобретения на практике комбинации полимер-терапевтическое средство могут быть использованы индивидуально или в комбинации с другими терапевтическими или диагностическими средствами. Соединения данного изобретения могут быть использованы in vivo, как правило для млекопитающих, таких как приматы, такие как люди, овцы, лошади, крупный рогатый скот, свиньи, собаки, кошки, крысы и мыши, или in vitro.
Одним основным преимуществом использования непроницаемых для ионизирующих излучений, биорассасываемых полимеров настоящего изобретения в областях применения при доставке терапевтического средства является легкость отслеживания высвобождения терапевтического средства и присутствия имплантируемой системы доставки терапевтического средства. Поскольку непроницаемость для ионизирующих излучений у полимерной матрицы обусловлена ковалентно зафиксированными галогеновыми заместителями, уровень непроницаемости для ионизирующих излучений непосредственно связан с остаточным количеством разлагающейся матрицы для доставки терапевтического средства, все еще присутствующим по месту имплантации в любой данный момент времени после имплантации. В предпочтительных вариантах реализации скорость высвобождения терапевтического средства из разлагающейся системы доставки терапевтического средства будет коррелировать со скоростью рассасывания полимера. В таких предпочтительных вариантах реализации прямое количественное измерение остаточной степени непроницаемости для ионизирующих излучений будет представлять собой для лечащего врача способ отслеживания уровня высвобождения терапевтического средства из имплантируемой системы доставки терапевтического средства.
Определенные аспекты изобретения иллюстрируют следующие неограничивающие примеры, представленные в настоящем документе далее. Все части и процентные содержания получают при расчете на мольные проценты, если только не будет указано другого, и если только не будет указано другого, то все температуры приводятся в градусах Цельсия. Все растворители имели марку «чистый для ВЭЖХ», а все другие реагенты имели марку «чистый для анализа» и использовались без дополнительной переработки, если только не будет указано другого.
ПРИМЕРЫ
Пример 1. N-алкильное замещение
В работающей под давлением емкости соединение 8-ЕВ растворяют в ДМФА совместно с К2СО3 (2 эквивалента) при комнатной температуре, а после этого подвергают обработке в результате покапельного добавления этилбромида (1,1 эквивалента) при использовании шприца. После этого работающую под давлением емкость герметизируют и реакционную смесь нагревают до 60°С, с интервалами в 30 мин реакционной смеси позволяют охладиться до комнатной температуры и ход реакции отслеживают по методам ТСХ (тонкослойной хроматографии) или ЖХ/МС. Реакцию гасят водой и водный слой экстрагируют. Органический слой высушивают над Nа2SO4, отфильтровывают, а растворитель удаляют при пониженном давлении до получения соединения 8-GВ. Промежуточное соединение 8-GВ растворяют в ДМФА в присутствии избытка К2СО3, после этого добавляют тиофенол и смесь перемешивают при комнатной температуре вплоть до завершения реакции, на что указывает метод ТСХ. Твердое вещество удаляют в результате фильтрования, а растворитель удаляют при пониженном давлении. После этого неочищенную смесь растворяют во влажной смеси метанол/ТГФ в присутствии каталитического NаОН, по завершении гидролиза сложного эфира растворитель удаляют при пониженном давлении. Остаток растворяли в воде, подкисляли до значения рН 5 и экстрагировали при использовании этилацетата до получения соединения АА-1 В.
Пример 2. N-арильное замещение
К раствору фенилиодида (1 ммоль) и сложного эфира β-аминокислоты (9-С) (1 ммоль) в ДМФА (5 мл) добавляют карбонат калия (2,5 ммоль), 0,1 мл воды и СuI (0,1 ммоль) в атмосфере азота. После перемешивания смеси при 100°C в течение 48 часов в атмосфере азота охлажденный раствор концентрируют в вакууме. Остаток растворяют в воде, подкисляют до значения рН 5 и экстрагируют при использовании этилацетата. Объединенные органические слои концентрируют и очищают по методу хроматографии до получения соответствующей N-арил-β-аминокислоты (9-D).
N-арил-β-аминокислота (9-D) может быть превращена в N-арил-β-аминокислоту по способам, известным специалисту в соответствующей области техники. Например, N-арил-β-аминокислота может быть подвергнута обработке под действием НСl в растворителе, таком как этанол или метанол, до получения соответствующих этилового или метилового сложных эфиров N-арил-β-аминокислоты.
Пример 3. -N-замещенные мономеры
Мономер: РР-IА
Он может быть синтезирован из предшественника мономера, описывающегося формулой АА-1. В одном обычном варианте реализации, продемонстрированном в схеме 10, предшественник полимеризации 10-С может быть синтезирован из соединения АА-1В. Йодирование 3-(4-гидроксифенил)пропионовой кислоты (10-А) позволяет получить 3-(4-гидрокси-3,5-дииодфенил)пропановую кислоту. Последующая реакция сочетания между соединением 10-В и соединением АА-1В с дальнейшим удалением фенольной защитной группы позволяет получить предшественника полимеризации 10-С. Например, обработка 3-(4-гидроксифенил)пропионовой кислоты (10-А) под действием хлориодида позволяет получить 3-(4-гидрокси-3,5-дииодфенил)пропионовую кислоту (10-В). Реакция сочетания между соединением 10-В и соединением АА-1В при использовании гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (ЕВСI) с последующим удалением с фенольной группы защитной группы может позволить получить предшественника полимеризации 10-С. Удаление метальной защитной группы может быть осуществлено под действием трибромида бора (ВВr3) в метиленхлориде (ДХМ). Предшественник полимеризации 10-С может быть превращен в полимерную форму в соответствии со способами, описанными в схеме синтеза 1-6. Дополнительные мономерные субзвенья могут быть синтезированы из предшественников мономеров, описывающихся формулой АА-1, в соответствии со способом схемы 10 при надлежащих модификациях, легко понятных для специалиста в соответствующей области техники.
Схема 10
Пример 4. Получение дииодированных ароматических оксикислот
Раствор КIСl2 с концентрацией 2 моль/л получали при использовании методики, описанной в литературе. В химическом стакане объемом 2 л размещали и перемешивали 166,2 г (1,0 моль) ВАТ и 800 мл 2-пропанола. К получающемуся в результате раствору добавляли 158 г (2,0 моль) пиридина и 1 л (2,0 моль) раствора КIСl2 с концентрацией 2 моль/л. По истечении 1 ч перемешивания к реакционной смеси добавляли 3 л воды и продукт, который осаждался, собирали по способу фильтрования и промывали водой. Для дополнительной очистки неочищенный продукт растворяли в 4 л воды, содержащей 80 г (2,0 моль) гидроксида натрия, и отфильтровывали. Фильтрат охлаждали до комнатной температуры и при использовании уксусной кислоты подкисляли до значения рН 5,5. Продукт выделяли в результате фильтрования и промывали несколькими порциями воды, а после этого высушивали в вакууме до достижения постоянной массы, что приводило к получению 375 г (90%-ный выход) 3-(3,5-дииод-4-гидроксифенил)пропионовой кислоты (I2DAT). При использовании подобных методик йодированию подвергали 4-гидроксифенилуксусную кислоту и 4-гидроксибензойную кислоту до получения соответствующих дииодированных соединений.
Пример 5. Синтез мономера I2DAT-NMeTyr-OMe
Дифенольный мономер получали по реакции сочетания между 3-(3,5-дииод-4-гидроксифенил)пропионовой кислотой (I2DAT) из примера 1 и соли, полученной из метилового сложного эфира N-метилтирозина и НСl, (NМeTM.HCl) (Bache Biosciences, Inc., Кинг-оф-Праша, Пенсильвания) при использовании в качестве агента реакции сочетания гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЕDС). В частности, в круглодонной колбе объемом 50 мл при 0-5°С перемешивали 1,6 г (3,8 ммоль) I2DAT, 0,99 г (4,02 ммоль) NМеТМ.НСl, 54 мг (0,40 ммоль) гидроксибензотриазола и 20 мл тетрагидрофурана. После этого в колбу добавляли ЕDС (0,81 г, 4,2 ммоль).
Реакционную смесь перемешивали при 0-5°С в течение 1 ч, а после этого при комнатной температуре в течение 3 ч. Основную часть ТГФ выпаривали и реакционную смесь перемешивали с 50 мл этилацетата и 50 мл раствора НСl с концентрацией 0,2 моль/л. Слои разделяли при использовании делительной воронки. Органический слой промывали по схеме 3×25 мл раствора НСl с концентрацией 0,2 моль/л, 3×25 мл 5%-ного раствора бикарбоната натрия и 25 мл 20%-ного раствора NаСl. После этого органический слой концентрировали и получали масло. По методам1Н ЯМР и элементного анализа продукт идентифицировали как N-метил-I2DТЕ. В методе ВЭЖХ получили пик при ожидаемом времени удерживания для второстепенного побочного продукта, который обычно присутствует даже в случае использования тирозиновых сложных эфиров простой структуры.
Пример 6. Полимеризация NМе-I2DТЕ
Дифенольный мономер NМе-I2DТЕ из примера 2 полимеризовали до получения поликарбоната при использовании стандартной методики фосгенирования, описанной в патенте US 5099060.
Пример 7. Синтез мономеров из сложных эфиров N-алкилтирозина
Получение дифенольных мономеров из сложных эфиров N-алкилтирозина проиллюстрировано на примере синтеза N-этил-I2DТЕ. В частности, в круглодонной колбе объемом 50 мл при 0-5°С перемешивали 1,6 г (3,8 ммоль) I2DAT, 1,10 г (4,02 ммоль) соли, полученной из этилового сложного эфира N-этилтирозина и НСl, (NЕtТЕ.НСl -получена по способу, описанному в работе Aurelio, et al., Chem Rev., 104. 5823-46 (2004), описание которой во всей своей полноте посредством ссылки включается в настоящий документ), 54 мг (0,40 ммоль) гидроксибензотриазола и 20 мл тетрагидрофурана. После этого в колбу добавляли ЕDС (0,81 г, 4,2 ммоль). Реакционную смесь перемешивали при 0-5°С в течение 1 ч, а после этого при комнатной температуре в течение 3 ч. Основную часть ТГФ выпаривали и реакционную смесь перемешивали с 50 мл этилацетата и 50 мл раствора НСl с концентрацией 0,2 моль/л. Слои разделяли при использовании делительной воронки. Органический слой промывают по схеме 3×25 мл раствора НСl с концентрацией 0,2 моль/л, 3×25 мл 5%-ного раствора бикарбоната натрия и 25 мл 20%-ного раствора NаСl. После этого органический слой концентрируют и получают масло. Продукт охарактеризован по методам1H ЯМР, элементного анализа и ВЭЖХ.
Пример 8. Синтез тиоамида и N-алкилирование
В трубке Шленка размещают диацетил-I2DTE (693 мг, 1,0 ммоль), f6LR (1,13 г, 1,0 ммоль) и 20 мл ТГФ. Трубку Шленка нагревают в масляной бане при 55°С в течение 4 ч. После этого к реакционной смеси добавляют 10 г оксида алюминия и в результате выпаривания растворитель удаляют. Неочищенный продукт очищают при использовании короткой колонки с набивкой из фтористого обращенно-фазового диоксида кремния. После этого продукт подвергают гидролизу под действием разбавленного раствора гидроксида натрия с последующим подкислением до получения I2DTE-тиоамида. После этого соединение подвергают N-метилированию в соответствии с примером 7.
Описание предпочтительных вариантов реализации должно рассматриваться как иллюстрирующее, а не как ограничивающее настоящее изобретение, определенное формулой изобретения. Легко понять, что без отклонения от настоящего изобретения, представленного в формуле изобретения, могут быть использованы и многочисленные комбинации описанных ранее признаков. Такие вариации не рассматриваются в качестве отклонения от объема и сущности изобретения, и все такие модификации предполагаются включенными в объем следующей далее формулы изобретения.
Реферат
Изобретение относится к N-замещенным мономерам и полимерам, применимым в медицинских устройствах. Предложен полимер, предназначенный для использования в имплантируемых медицинских устройствах, содержащий множество мономерных повторяющихся звеньев, содержащих N-замещенный амид формулы (I), где каждый Xи Xнезависимо выбирают из Вr и I; каждый у1 и у2 независимо равен нулю или целому числу в диапазоне от 1 до 4, и Rвыбирают из замещенных или незамещенных, насыщенных или ненасыщенных, прямоцепных или разветвленных алифатических групп, содержащих вплоть до 48 атомов углерода, замещенных или незамещенных ароматических групп, содержащих вплоть до 48 атомов углерода, и замещенных или незамещенных аралифатических групп, содержащих вплоть до 48 атомов углерода, у которых алифатические части являются прямоцепными или разветвленными и насыщенными или ненасыщенными, причем Rсодержит от 2 до 8 гетероатомов, выбираемых из О, S и N, где два из гетероатомов образуют амидную группу основной цепи полимера, которая является N-замещенной C-Салкильной группой. Предложены также соответствующие мономеры, а также варианты применения предложенного полимера в медицине. Технический результат - предложенные полимеры характеризуются пониженными вязкостями расплава, легко перерабатываются без разложения. 5 н. и 19 з.п. ф-лы, 8 пр.
Формула
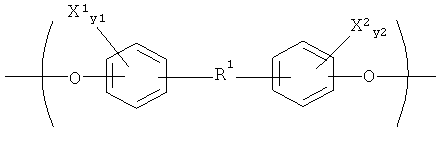
где каждый из X1 и X2 независимо выбирают из Вr и I; каждый из у1 и у2 независимо равен нулю или целому числу от 1 до 4, и R1 выбирают из группы, состоящей из замещенных или незамещенных, насыщенных или ненасыщенных, прямоцепных или разветвленных алифатических групп, содержащих вплоть до 48 атомов углерода, замещенных или незамещенных ароматических групп, содержащих вплоть до 48 атомов углерода, и замещенных или незамещенных аралифатических групп, содержащих вплоть до 48 атомов углерода, у которых алифатические части являются прямоцепными или разветвленными и насыщенными или ненасыщенными, и R1 содержит от 2 до 8 гетероатомов, выбираемых из О, S и N, где два из гетероатомов образуют амидную группу основной цепи полимера, которая является N-замещенной C1-С6 алкильной группой.

где каждый из X1 и X2 независимо выбирают из Вr и I; каждый из у1 и у2 независимо равен нулю или целому числу от 1 до 4, и R1 выбирают из группы, состоящей из замещенных или незамещенных, насыщенных или ненасыщенных, прямоцепных или разветвленных алифатических групп, содержащих вплоть до 48 атомов углерода, замещенных или незамещенных ароматических групп, содержащих вплоть до 48 атомов углерода, и замещенных или незамещенных аралифатических групп, содержащих вплоть до 48 атомов углерода, у которых алифатические части являются прямоцеппыми или разветвленными и насыщенными или ненасыщенными, и R1 содержит от 2 до 8 гетероатомов, которые выбирают из О, S и N, где два гетероатома образуют амидную группу основной цепи полимера, которая является N-замещенной C1-С6 алкильной группой, и
А1 выбирают из группы, состоящей из:





где R10 выбирают из группы, состоящей из Н, C1-С30 алкила, алкенила, алкинила и С2-С30 гетероалкила; гетероалкенила и гетероалкинила, а R12 выбирают из группы, состоящей из C1-С30 алкилена, алкенилена или алкинилена, C1-С30 гетероалкилена; гетероалкенилена или гетероалкинилена, С5-С30 гетероалкиларилена, гетероалкениларилена, гетероалкиниларилена, С6-С30 алкиларилена, алкениларилена, алкиниларилена и С5-С30 гетероарилена.
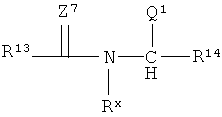
где каждый из R13 и R14 независимо содержит от 0 до 8 атомов углерода включительно и независимо выбирается из (-CHR1)e-CH=CH-(CHR1-)e и (-CHR1)f(CHNQ2)g(-CHR1)f, где R1 представляет собой Н или низший алкил, каждый е независимо находится в диапазоне от 0 до 6 включительно, каждый f независимо находится в диапазоне от 0 до 8 включительно, a g равен 0 или 1; Rx представляет собой C1-С6алкильную группу; Q1 представляет собой C(=Z5)-R8, где Z5 представляет собой О или S; Q2 представляет собой -N(Rx)2 или N(RxQ1), и R8 выбирают из Н, ОН, терапевтически активного фрагмента, поли(алкиленоксида), -Х3-C1-C18 алкила, -Х3-алкенила, -Х3-алкинила, -Х5-циклоалкила, -Х5-гетероциклила, -X5-арила и -Х5-гетероарила;
Х3 выбирают из связи, О, S и N-алкила и Х5 выбирают из связи, низшего алкила, О, S и N-алкила и
Z7 представляет собой кислород.


где t находится в диапазоне от нуля до приблизительно 18.

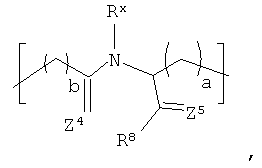
где Rx представляет собой C1-С6 алкильную группу; Z4 и Z5 каждый независимо представляет собой О или S; а и b независимо находятся в диапазоне от 0 до 8 включительно; R8 выбирают из группы, состоящей из Н, ОН, терапевтически активного фрагмента, поли(алкиленоксида), -Х3-C1-C18 алкила, -Х3-алкенила, -Х3-алкинила, -X5-циклоалкила, -Х5-гетероциклила, -Х5-арила и -Х5-гетероарила;
Х3 выбирают из связи, О, S и N-алкила и X5 выбирают из связи, низшего алкила, О, S и N-алкила.
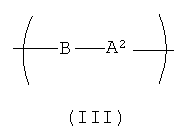
где В представляет собой -O-((CHR6)p-O)q-; каждый R6 независимо представляет собой Н или C1-С3 алкил; р представляет собой целое число от 1 до 4 включительно; q представляет собой целое число от приблизительно 5 до приблизительно 3000; а А2 представляет собой то же, что и А1.

где каждый из X1 и X2 независимо выбирают из Вr и I; каждый из у1 и у2 независимо равен нулю или целому числу от 1 до 4, и R1 выбирают из группы, состоящей из замещенных или незамещенных, насыщенных или ненасыщенных, прямоцепных или разветвленных алифатических групп, содержащих вплоть до 48 атомов углерода, где R1 представляет собой

где каждый из R13 и R14 независимо содержит от 0 до 8 атомов углерода включительно и независимо выбирается из (-CHR1)e-CH=CH-(CHR1-)e и (-CHR1)f(-CHNQ2)g(-CHR1)f, где R1 представляет собой Н или низший алкил, каждый е независимо находится в диапазоне от 0 до 6 включительно, каждый f независимо находится в диапазоне от 0 до 8 включительно, a g равен 0 или 1; Rx представляет собой C1-С6 алкильную группу; Q1 представляет собой C(=Z5)-R8, где Z5 представляет собой О или S; Q2 представляет собой -N(Rx)2 или N(RxQ1) и R8 выбирают из Н, терапевтически активного фрагмента, поли(алкиленоксида), -Х3-C1-C18 алкила, -Х3-алкенила, -Х3-алкинила, -Х5-циклоалкила, -Х5-гетероциклила, -Х5-арила и -Х5-гетероарила;
Х3 выбирают из связи, О, S и N-алкила и Х5 выбирают из связи, низшего алкила, О, S и N-алкила и
Z7 представляет собой кислород.

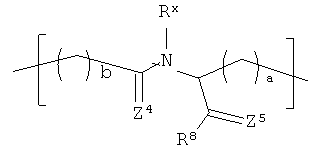
где Rx представляет собой C1-С6 алкильную группу; Z4 и Z5 каждый независимо представляет собой О или S; а и b независимо находятся в диапазоне от 0 до 8 включительно; R8 выбирают из группы, состоящей из Н, терапевтически активного фрагмента, поли(алкиленоксида), -Х3-C1-C18алкила, -Х3-алкенила, -Х3-алкипила, -X5-циклоалкила, -Х5-гетероциклила, -Х5-арила и -Х5-гетероарила;
Х3 выбирают из связи, О, S и N-алкила и
Х5 выбирают из связи, низшего алкила, О, S и N-алкила.
Документы, цитированные в отчёте о поиске
Способ окрашивания кератиновых волокон, композиция для окислительного окрашивания и набор для окрашивания

Комментарии