Местная доставка комбинации агонистов аденозиновых рецепторов подтипа а2а/ингибитора фосфодиэстеразы в сосудах для уменьшения тяжести поражения миокарда - RU2565403C2
Код документа: RU2565403C2
Чертежи


















Описание
ОТСЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает преимущества предварительной заявки на патент США серийный № 61/415056, поданной 18 ноября 2010 г.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
1. Область применения изобретения
Настоящее изобретение относится к местному введению лекарственных средств и/или сочетаний лекарственных средств для уменьшения степени поражения миокарда после острого инфаркта миокарда и, более конкретно, к внутрипросветным медицинским устройствам для местной доставки лекарственных средств и/или сочетаний лекарственных средств для восстановления перфузии и снижения тяжести поражения миокарда после острого инфаркта миокарда.
2. Обсуждение существующего уровня техники
Многие люди страдают от болезней системы кровообращения или сосудистых заболеваний, вызываемых нарастающим закупориванием или сужением кровеносных сосудов, которые снабжают кровью сердце и другие жизненно-важные органы. У таких людей, закупоривание кровеносных сосудов более тяжелой степени часто приводит к артериальной гипертензии, ишемическому повреждению, инсульту или инфаркту миокарда. Атеросклеротические повреждения, которые ограничивают или затрудняют коронарный кровоток, являются основной причиной развития ишемической болезни сердца. С другой стороны, спонтанный разрыв воспаленного атеросклеротического очага или нестабильной бляшки может приводить к интермиттирующей или полной окклюзии артерии, вызывающей ишемическое повреждение, такое как инсульт и/или острый инфаркт миокарда. Чрескожная транслюминальная коронарная ангиопластика представляет собой медицинскую процедуру, цель которой заключается в увеличении кровотока через артерию. Чрескожная транслюминальная коронарная ангиопластика представляет собой основной способ лечения стеноза коронарной артерии. Возрастающая частота применения этой процедуры связана с относительно высокой результативностью и минимальной инвазивностью по сравнению с операцией коронарного шунтирования. Ограничением для чрескожной транслюминальной коронарной ангиопластики является внезапное закрытие сосуда, которое может возникнуть сразу после процедуры, и рестеноз, который развивается постепенно после процедуры. Кроме того, рестеноз является хронической проблемой у пациентов, прошедших шунтирование с помощью подкожной вены бедра. Представляется, что механизм острой тромботической окклюзии задействует несколько факторов, причина может заключаться в сосудистом возврате, вызывающим закрытие артерии и/или отложением тромбоцитов и фибрина вдоль длины пораженного участка вновь открытого кровеносного сосуда.
Рестеноз после чрескожной транслюминальной коронарной ангиопластики представляет собой более постепенный процесс, запускаемый повреждением сосуда. В развитии рестеноза участвуют различные процессы, включая тромбоз, воспаление, фактор роста и высвобождение цитокинов, пролиферацию клеток, миграцию клеток и процесс синтеза внеклеточного матрикса.
При расширении под давлением интракоронарного баллонного катетера во время ангиопластики, повреждаются гладкомышечные клетки и эндотелиальные клетки сосудистой стенки, что приводит к развитию тромботической и воспалительной реакции. Клеточные факторы роста, такие как тромбоцитарный фактор роста, основной фактор роста фибробластов, эпидермальный фактор роста, тромбин и т.д., высвобождаемые из тромбоцитов, мигрирующих макрофагов и/или лейкоцитов, или непосредственно из гладкомышечных клеток, провоцируют реакцию на миграцию и пролиферацию в гладкомышечных клетках медиального слоя. Происходит переход этих клеток из сократительного фенотипа в синтетический, для которого характерны лишь небольшое количество пучков сократительных волокон, обширный шероховатый эндоплазматический ретикулум, аппарат Гольджи и свободные рибосомы. Пролиферация/ миграция обычно начинаются в течение одного-двух дней после повреждения и достигают максимума через несколько дней (Campbell (Кэмпбелл) и Campbell (Кэмпбелл), 1987; Clowes (Клоуз) и Schwartz (Шварц), 1985).
Дочерние клетки мигрируют в слой интимы клеток гладких мышц артерии и продолжают пролиферировать и выделять значимые количества белков внеклеточного матрикса. Пролиферация, миграция и синтез внеклеточного матрикса продолжаются, пока не восстанавливается эндотелиальный слой, в это время замедляется пролиферация в интиме, обычно это происходит через семь - четырнадцать дней после повреждения. Вновь образовавшаяся ткань называется неоинтима. Дальнейшее сужение сосуда, которое происходит в течение периода от трех до шести месяцев, вызвано, в первую очередь, отрицательным или сократительным ремоделированием.
Одновременно с местной пролиферацией и миграцией происходит прилипание воспалительных клеток к участку сосудистого повреждения. В течение периода от трех до семи дней после повреждения, воспалительные клетки мигрируют в более глубокие слои сосудистой стенки. В моделях на животных, с применением повреждения от баллона или имплантации стента, воспалительные клетки могут персистировать на участке сосудистого повреждения по меньшей мере тридцать дней ((Tanaka (Танака) и соавт., 1993; Edelman (Эдельман) и соавт., 1998). В связи с этим, имеются воспалительные клетки, и они могут участвовать как в острой, так и в хронической фазах рестеноза.
В отличие от системной лекарственной терапии, подтверждено, что стенты значимо снижают частоту рестеноза. Обычно стенты представляют собой расширяемые с помощью баллона металлические трубки с множеством прорезей (обычно, кроме прочего, из нержавеющей стали или кобальтохромовых сплавов), которые расширяются внутри просвета коронарной артерии, прошедшей ангиопластику, обеспечивают структурную поддержку артериальной стенки с помощью жесткого каркаса. Такая поддержка помогает сохранить проходимость просвета сосуда. В двух рандомизированных клинических исследованиях, при оценке методом ангиографии, при применении стентов повышалась частота благоприятных исходов после чрескожной транслюминальной коронарной ангиопластики, благодаря увеличению минимального диаметра просвета и сокращения, но не исключения, частоты развития рестеноза через шесть месяцев (Serruys (Серруйс) и соавт., 1994; Fischman (Фишман) и соавт., 1994). Кроме того, стенты являются терапией выбора для реваскуляризации тромбированной коронарной артерии (острый инфаркт миокарда), в этом случае быстрое восстановление кровотока к ишемизированной ткани миокарда является определяющим фактором долгосрочной клинической эффективности. Установлено, что полное восстановление коронарного кровотока с помощью стента в течение 6 часов после проявления симптомов, а желательно менее чем через 3 часа, приводило к гораздо более благоприятным клиническим исходам в отношении устранения тромботической окклюзии по сравнению с введением тромболитических препаратов (тканевой активатор плазминогена, стрептокиназа и т.д.).
Стенты, применяемые для местной доставки рапамицинов, включая сиролимус, эверолимус и другие аналоги или производные рапамицина (ингибитор mTOR - мишень рапамицина у млекопитающих), подтвердили свою более высокую эффективность в значимом снижении частоты рестеноза и связанных с ним осложнений после чрескожной транслюминальной коронарной ангиопластики и других аналогичных процедур на артериях/венах по сравнению с непокрытыми металлическими стентами. Рапамицины могут наноситься на стент или внедряться в него различными способами. Например, рапамицины могут внедряться в полимерную матрицу, а затем присоединяться к поверхности стента с помощью любых приемлемых средств. Другим способом, рапамицины могут внедряться в полимерную матрицу, а затем загружаться в резервуар на стенте или в нем. Тем или иным способом, рапамицины элюируют из полимерной матрицы в окружающую ткань в течение заданного периода времени.
Кроме того, покрытие стентов гепарином, как представляется, дает дополнительные преимущества в уменьшении подострого тромбоза после имплантации тента. Таким образом, длительное механическое расширение суженной коронарной артерии стентом способствует предотвращению рестеноза, а покрытие стентов рапимицинами и гепарином является целесообразным и клинически ценным для местной доставки лекарственных препаратов на участок поврежденной ткани.
Принимая во внимание, что продемонстрирована целесообразность и желательность местной доставки лекарственных препаратов, стенты, как и другие имплантируемые медицинские устройства, могут использоваться для доставки других препаратов или лекарственных средств как в артерии, так и в органы, расположенные ниже по кровотоку от места размещения стента или другого медицинского устройства, для терапии других патологических состояний. Например, существует необходимость местной доставки лекарственных препаратов для уменьшения степени поражения миокарда после острого инфаркта миокарда. Более обобщенно, существует необходимость местного введения лекарственных препаратов для снижения степени ишемического поражения. Кроме того, возможна местная доставка сочетаний лекарственных средств для лечения других осложнений или состояний, потенциально связанных или не связанных с поражением.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Местная доставка через стент или любое другое подходящее устройство, селективного агониста аденозиновых рецепторов, в соответствии с настоящим изобретением, может использоваться для преодоления недостатков лечения, указанных выше.
В соответствии с одним из аспектов, настоящее изобретение направлено на создание медицинского устройства для местной доставки селективного агониста аденозиновых рецепторов в сочетании, по меньшей мере, с одним дополнительным лекарственным средством для лечения поражения миокарда после острого инфаркта миокарда. Медицинское устройство, содержащее расширяющееся внутрипросветное устройство, выполненное для открытия и восстановления кровотока в кровеносном сосуде, который, по меньшей мере, частично закупорен, селективный агонист аденозиновых рецепторов, прикрепляющийся с возможностью высвобождения, к расширяющемуся внутрипросветному устройству, селективный агонист аденозиновых рецепторов, предназначенный для элюирования в кровоток со скоростью по меньшей мере десять микрограмм в час в течение по меньшей мере четырех (4) часов после восстановления кровотока в кровеносном сосуде, и ингибитор фосфодиэстеразы, зафиксированный на расширяющемся внутрипросветном устройстве и предназначенный для элюирования, по меньшей мере, в одно из сосудистого русла и окружающей ткани.
В соответствии с другим аспектом, настоящее изобретение направлено на создание способа лечения поражения миокарда после острого инфаркта миокарда. Способ, включающий расширение внутрипросветного устройства для открытия и восстановления кровотока в кровеносном сосуде, который, по меньшей мере, частично закупорен, высвобождение селективного агониста аденозиновых рецепторов из расширяющегося внутрипросветного устройства в кровоток со скоростью по меньшей мере десять микрограмм в час в течение по меньшей мере четырех (4) часов после восстановления кровотока в кровеносном сосуде, и высвобождение ингибитора фосфодиэстеразы из расширяющегося внутрипросветного устройства, по меньшей мере, в одно из сосудистого русла и окружающей ткани.
Стент или другое имплантируемое медицинское устройство для местной доставки агониста аденозиновых рецепторов подтипа A2A может использоваться для уменьшения поражения миокарда после острого инфаркта миокарда. В максимально короткие сроки после острого инфаркта миокарда стент или другое подходящее устройство, содержащее или способное доставить агонист аденозиновых рецепторов подтипа A2A помещают в кровеносный сосуд, в котором возникло закупоривание, вызвавшее инфаркт. После размещения, стент или другое внутрипросветное устройство расправляется для устранения закупорки и восстановления кровотока в определенной области, участке или объеме ткани сердца. После определенного периода времени, описанного более подробно далее, агонист аденозиновых рецепторов подтипа A2A высвобождается из стента или другого устройства в нижележащий коронарный кровоток, направляющийся к ткани сердца, пораженной гипоксией, в течение времени, достаточного для снижения уровня поражения миокарда. Как описывается в этом документе, настоящее изобретение может также применяться для лечения других органов.
Раннее и постоянное высвобождение агониста аденозиновых рецепторов подтипа A2A может уменьшить поражение миокарда, сокращая размер или объем пораженной инфарктом ткани миокарда, снижая уровень гибели мышечных клеток, уменьшая степень реперфузионного повреждения, сохраняя лучшее функционирование капиллярного мышечного русла, и/или ослабляет так называемое состояние невосстановленного кровотока. Такие действия, в свою очередь, улучшают сердечный выброс, фракцию выброса и морфометрические показатели сердечной мышцы после инфаркта. Доставка агониста аденозиновых рецепторов подтипа A2A из стента или другого устройства к ткани, пораженной гипоксией, начинается немедленно после того, как закупоренный кровеносный сосуд становится проходимым после раскрытия устройства, или, более конкретно, доставка препарата из устройства не начинается до восстановления кровотока к участку лечения, поскольку лекарственный препарат переносится ниже с током крови. В случае со стентом с лекарственным покрытием или стентом, в котором лекарственный препарат содержится в резервуаре, доставка агониста аденозиновых рецепторов подтипа A2A будет начинаться немедленно после расширения стента и извлечения баллона, что делает возможным элюирование агониста. При применении саморасширяющего стента, доставка агониста будет начинаться после раскрытия стента и вхождение в контакт с кровью.
Кроме того, применение комбинации сиролимуса и цилостазола представляется более эффективным, чем использование одного лекарственного вещества для уменьшения пролиферации и миграции гладкомышечных клеток. Цилостазол может также применяться для достижения продолжительного действия против отложения тромбоцитов и предотвращения тромбоза на стенте или другом медицинском устройстве. Кроме того, цилостазол, являющийся ингибитором ФДЭ-III, также обладает действием, аналогичным действию селективных агонистов аденозиновых рецепторов подтипа A2A, описанных в этом документе. Действие ингибиторов фосфодиэстеразы обусловлено блокировкой или замедлением ферментативного превращения циклического аденозинмонофосфата (цАМФ) в 5'-аденозинмонофосфат (АМФ). Аденозиновые рецепторы подтипа A2A являются рецепторами, связанными с Gs белком, которые соединяются для активации аденилатциклазы. Агонист аденозиновых рецепторов подтипа A2A может, в связи с этим, повышать внутриклеточные уровни цАМФ в целевых клетках для осуществления их биологического действия. Поскольку уровни цАМФ в ткани непосредственно связаны со стимуляцией аденозиновых рецепторов, блокировка распада цАМФ с помощью ингибиторов ФДЭ приведет к еще более интенсивной стимуляции тех же аденозиновых рецепторов, что и рецепторы, на которые нацелено действие экзогенных агонистов аденозиновых рецепторов. В этом отношении, при совместной доставке ингибитора ФДЭ и селективного агониста аденозиновых рецепторов в комбинации обеспечивается более высокий уровень стимуляции аденозиновых рецепторов, чем при их доставке по-отдельности. Следовательно, сочетание препаратов можно применять для лечения рестеноза, тромбоза и уменьшения поражения миокарда после острого инфаркта миокарда, при доставке со стента или другого медицинского устройства.
Местная доставка может применяться в сочетании с системной доставкой того же лекарственного препарата и/или других лекарственных препаратов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеизложенные и прочие характеристики и преимущества настоящего изобретения станут понятны после следующего более подробного описания предпочтительных вариантов осуществления настоящего изобретения, проиллюстрированных с помощью прилагаемых изображений.
На фигуре 1 представлен продольный вид стента (концы не показаны) до расширения; показывающий наружную поверхность стента и характерную полосчатую структуру.
На фигуре 2 представлен вид в перспективе вдоль стента, изображенного на фиг. 1, имеющего резервуары в соответствии с настоящим изобретением.
На фигуре 3 представлена изометрическая проекция расширяющегося медицинского устройства с лечебным средством, загруженным в отверстия в соответствии с настоящим изобретением.
На фигуре 4 представлен увеличенный вид сбоку части расширяющегося медицинского устройства с отверстиями, заполненными лечебным средством, в перемычных элементах, в соответствии с настоящим изобретением.
На фигуре 5 представлен схематичный вид сбоку части стента, высвобождающего лекарственные препараты, в соответствии с настоящим изобретением.
На фигуре 6 представлено графическое изображение коронарного кровотока у свиней, находящихся под наркозом, со вскрытой грудной клеткой, которым имплантировали непокрытые металлические стенты и стенты, элюирующие ATL-359 в соответствии с настоящим изобретением.
На фигуре 7 представлено схематическое изображение первого примера осуществления изобретения в виде стента, покрытого комбинацией сиролимуса и цилостазола в соответствии с настоящим изобретением.
На фигуре 8 представлено графическое изображение кинетики высвобождения в условиях in vitro комбинации сиролимуса и цилостазола, покрывающей стент, из первого примера осуществления в соответствии с настоящим изобретением.
На фигуре 9 представлено схематическое изображение второго примера осуществления изобретения, включающего стент, покрытый комбинацией сиролимуса и цилостазола в соответствии с настоящим изобретением.
На фигуре 10 представлено графическое изображение кинетики высвобождения в условиях in vitro комбинации сиролимуса и цилостазола, покрывающей стент, из второго примера осуществления в соответствии с настоящим изобретением.
На фигуре 11 представлено схематическое изображение третьего примера осуществления изобретения, включающего стент, покрытый комбинацией сиролимуса и цилостазола в соответствии с настоящим изобретением.
На фигуре 12 представлено графическое изображение активности комбинации сиролимуса и цилостазола, элюирующихся со стента, в условиях in vitro, в экспериментальной модели кровеносной системы с использованием бычьей крови в соответствии с настоящим изобретением.
На фигуре 13 представлено графическое изображение кинетики высвобождения, в условиях in vivo, сиролимуса и цилостазола из стента, показанного на фигуре 15.
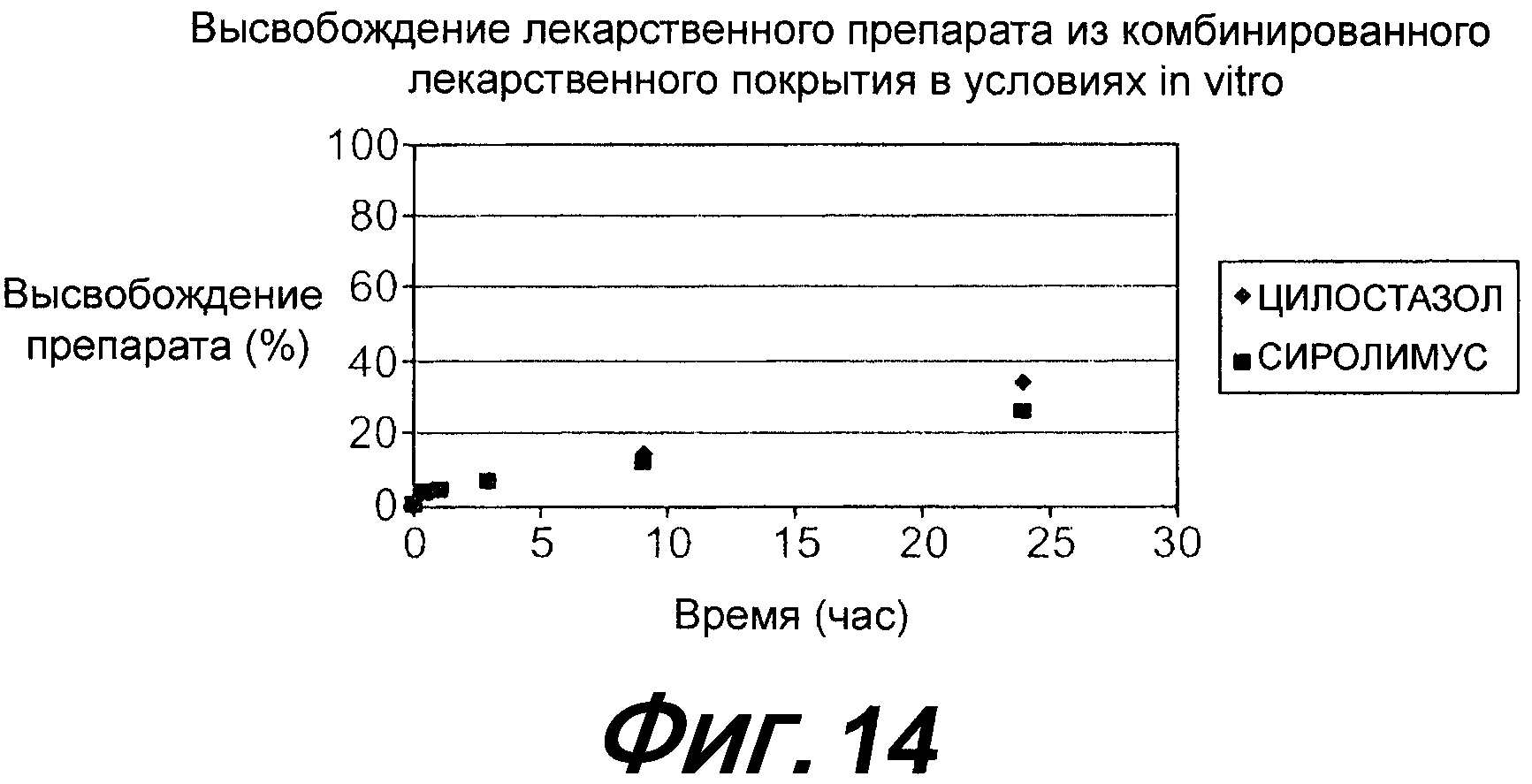
На фигуре 14 представлено графическое изображение кинетики высвобождения в условиях in vitro высвобождения сиролимуса и цилостазола из стента, показанного на фигуре 15.
На фигуре 15 представлено схематическое изображение четвертого примера осуществления изобретения, включающего стент, покрытый комбинацией сиролимуса и цилостазола, согласно настоящему изобретению.
На фигуре 16 представлено графическое изображение кинетики высвобождения, в условиях in vivo сиролимуса и цилостазола из стента, показанного на фигуре 7.
На фигуре 17 представлено графическое изображение кинетики высвобождения, в условиях in vitro, сиролимуса и цилостазола из стента, показанного на фигуре 7.
На фигуре 18 представлено графическое изображение кинетики высвобождения, в условиях in vivo, сиролимуса и цилостазола, из стента с двойным лекарственным покрытием в соответствии с настоящим изобретением.
На фигуре 19 представлено графическое изображение кинетики высвобождения ATL-359 в условиях in vitro в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Хотя примеры осуществления настоящего изобретения будут описываться применительно к лечению рестеноза или уменьшению поражения миокарда после острого инфаркта миокарда, важно отметить, что местная доставка препарата/сочетания препаратов может применяться для лечения широкого спектра состояний с использованием любого количества медицинских устройств, или для улучшения функционирования и/или увеличения срока службы устройства. Например, искусственные хрусталики, имплантируемые для восстановления зрения после удаления катаракты часто провоцируют развитие вторичной катаракты. Последняя, как правило, является результатом чрезмерного разрастания клеток на поверхности хрусталика, которое потенциально можно свести к минимуму при использовании устройства в сочетании с лекарственным препаратом или препаратами. Другие медицинские устройства, которые часто выходят из строя вследствие врастания ткани или отложения белкового материала внутри, на поверхности или вокруг устройства, такого как шунты при гидроцефалии, катетеры для диализа, устройства для прикрепления калоприемников, ушные дренажные трубки, электроды кардиостимуляторов и имплантируемых дефибрилляторов, могут также выиграть при сочетании устройства доставки и препарата. Устройства, которые служат для улучшения структуры и функции ткани или органа, в сочетании с подходящим лекарственным препаратом или препаратами также могут принести больше пользы. Например, возможно достичь более эффективной остеоинтеграции протезов для улучшения стабилизации имплантируемых устройств с помощью сочетания с такими препаратами, как костный морфогенетический белок. Аналогичным образом, другие хирургические устройства, шовный материал, скобки, устройства для анастомоза, позвоночные диски, костные стержни, фиксаторы шовного материала, гемостатические барьеры, зажимы, винты, пластинки, клипсы, сосудистые протезы, тканевой клей и герметики, тканевые каркасы, различные виды перевязочного материала, заменители кости, внутрипросветные устройства и сосудистые каркасы также могут обеспечивать для пациентов повышение результативности лечения при сочетании устройства доставки и препарата. Особенно эффективными могут являться периваскулярные обертывания, применяемые сами по себе или в сочетании с другими медицинскими устройствами. Периваскулярные обертывания могут обеспечивать доставку дополнительных лекарственных препаратов к месту лечения. В сущности, любое медицинское устройство может быть покрыто или загружено каким-либо способом лекарственным препаратом или сочетанием лекарственных препаратов, что улучшает результативность лечения по сравнению с применением устройства или фармацевтического препарата по отдельности.
Наряду с различными медицинскими приспособлениями, покрытие этих устройств может использоваться для доставки терапевтических и фармацевтических веществ, включая: антипролиферативные/ противоопухолевые средства, включая препараты природного происхождения, например, алкалоиды барвинка (т.е. винбластин, винкристин и винорелбин), паклитаксел, эпиподофиллотоксины (т.е. этопозид, тенипозид), антибиотики (дактиномицин (актиномицин D), даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин, ферменты (L-аспарагиназа, участвующая в системном метаболизме L-аспарагина и уменьшающая количество клеток, неспособных синтезировать собственный аспарагин); антитромботические средства, такие как, ингибиторы гликопротеина (ГП) llb/llla и антагонисты рецептора витронектина; антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (мехлоретамин, циклофосфамид и его аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты - бусульфан, производные нитрозомочевины (кармустин (БИКНУ) и его аналоги, стрептозоцин), триазены - дакарбазин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (фторурацил, флоксуридин и цитарабин), аналоги пурина и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлородеоксиаденозин {кладрибин}); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглутетимид; гормоны (т.е. эстроген); антикоагулянты (гепарин, синтетические соли гепарина и другие ингибиторы тромбина); фибринолитические средства (такие как тканевой активатор плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрел, абциксимаб; вещества, препятствующие миграции; антисекреторные препараты (брефельдин); противовоспалительные средства: такие как адренокортикальные стероиды (кортизол, кортизон, флудрокортизон, преднизон, преднизолон, 6α-метилпреднизолон, триамцинолон, бетаметазон и дексаметазон), нестероидные препараты (производные салициловой кислоты, т.е. аспирин); производные пара-аминофенола, т.е. ацетаминофен; индол- и инден-уксусные кислоты (индометацин, сулиндак и этодолак), гетероарил-уксусные кислоты (толметин, диклофенак и кеторолак), арилпропионовые кислоты (ибупрофен и его производные), антраниловые кислоты (мефенамовая кислота и меклофенамовая кислота), энолиевые кислоты (пироксикам, теноксикам, фенилбутазон и оксифентатразон), набуметон, соединения золота (ауранофин, ауротиоглюкоза, ауротиомалат натрия); иммунодепрессанты: (циклоспорин, такролимус (FK-506), азатиоприн, мофетила микофенолат); ангиогенные средства: фактор роста эндотелия сосудов (ФРЭС), фактор роста фибробластов (ФРФ); блокаторы рецептора ангиотензина; доноры оксида азота; антисмысловые олигонуклеотиды и их сочетания; ингибиторы клеточного цикла, ингибиторы mTOR, такие как сиролимус, эверолимус и другие аналоги рапамицина и ингибиторы киназы трансдукции сигналов рецепторов фактора роста; ретиноиды; ингибиторы циклина/циклин-зависимой киназы; ингибиторы кофермент-а редуктазы ЧМГ (статины); и ингибиторы протеазы.
Стент обычно представляет собой трубчатую конструкцию, которая вставляется в просвет канала для устранения закупорки. Обычно стент вставляют в просвет в сложенной форме, а затем расширяют автономно или при помощи другого устройства in situ. Типичным методом расширения является расширение при помощи баллона для ангиопластики, установленного на катетере; баллон надувается внутри стенозированного сосуда или канала тела для того, чтобы рассечь и разорвать обтурации, связанные с компонентами сосудистой стенки, и расширить просвет сосуда. Однако возможно использование саморасширяющихся стентов без баллона.
На фигуре 1 представлен пример стента 100, который может использоваться в соответствии с примером осуществления настоящего изобретения. Расширяемый цилиндрический стент 100 содержит структуру с многочисленными отверстиями, предназначенную для размещения в кровеносном сосуде, канале или просвете для удержания сосуда, канала или просвета в открытом состоянии, а более конкретно, для защиты сегмента артерии от рестеноза после ангиопластики. Стент 100 может расширяться по окружности и поддерживаться в расширенной конфигурации, которая остается жесткой по окружности или радиально. Стент 100 является гибким в осевом направлении, и при сгибании по полосе у стента 100 будут отсутствовать какие-либо выступающие наружу части.
Стент 100 обычно содержит первый и второй конец с промежуточным участком между ними. Стент 100 имеет продольную ось и содержит совокупность продольно расположенных полос 102, при этом, каждая полоса 102 очерчивает непрерывную волну вдоль сегмента, параллельного продольной оси. Совокупность звеньев 104, расположенных по окружности, удерживает полосы 102 в существенной степени трубчатой структуре 102. В сущности, каждая продольно расположенная полоса 102 соединяется в нескольких периодически расположенных местах со смежной полосой 102 при помощи коротких звеньев 104, расположенных по окружности. Волны, соотносимые с каждой из полос 102 обладают приблизительно одинаковой основной пространственной частотой на промежуточном участке, а полосы 102 расположены таким образом, чтобы волны, соотносимые с ними, в целом выравнивались таким образом, чтобы в общем совпадать по фазе друг с другом. Как изображено, каждая продольно расположенная полоса 102 проходит приблизительно два цикла волны до того, как соединяется с помощью звена со смежной полосой 102.
Стент 100 может изготавливаться с использованием любого количества способов. Например, стент 100 может изготавливаться из полой или формованной трубки из нержавеющей стали, которая может быть механически обработана при помощи лазера, электроразрядной фрезеровки, путем химического травления или другими способами. Стент 100 вводится в тело и помещается на желаемом месте в нерасширенном виде. В одном варианте осуществления, расширение в кровеносном сосуде происходит с помощью баллонного катетера, при этом окончательный диаметр стента 100 является функцией диаметра используемого баллонного катетера, а также конструкции (степень расширения) стента.
Следует учитывать, что стент 100, в соответствии с настоящим изобретением, может выполняться из материала с памятью формы, включая, например, подходящий сплав никеля и титана или нержавеющую сталь. Конструкции, выполненные из нержавеющей стали, могут быть саморасширяющимися, благодаря тому, что нержавеющей стали придается заранее определенная форма, например, ее скручивают в плетеную форму. В этом варианте осуществления, после формирования стента 100, его можно сжать так, чтобы он занимал в существенной степени малое пространство для обеспечения возможности его введения в кровеносный сосуд или другую ткань при помощи средств введения, которые включают подходящий катетер или гибкий стержень. При выходе из катетера стент 100, благодаря своей структуре, расширяется, принимая необходимую форму, при этом расширение происходит автоматически или инициируется с помощью изменения давления, температуры или путем электрической стимуляции.
На фигуре 2 представлен пример осуществления настоящего изобретения с использованием стента 100, представленного на фигуре 1, с внесением незначительных модификаций. Как изображено, после внесения модификаций стент 100 может заключать в себе один или несколько резервуаров 106. Каждый из резервуаров 106 может по желанию быть открытым или закрытым. Эти резервуары 106 могут специально выполняться для содержания в них препарата/комбинации препаратов, предназначенных для доставки. Независимо от конструкции стента 100, предпочтительно, чтобы дозировка вносимого препарата/комбинации препаратов обладала достаточной специфичностью и необходимой концентрацией для обеспечения эффективной дозировки для патологического состояния, по поводу которого проводится лечение. При этом, желательно, чтобы размер резервуаров, расположенных в полосах 102, был достаточным для внесения дозы препарата/комбинации препаратов в необходимом месте и в требуемом количестве. Однако важно отметить, что стент, представленный на фигуре 1, также может применяться для доставки препарата/комбинации препаратов. Например, поверхность стента может покрываться непосредственно препаратом/комбинацией препаратов, или они могут составлять часть полимерной матрицы, прикрепляемой к поверхности стента. Другими словами, покрытие поверхности стента является или действует как депо доставки препарата.
На фигуре 3 представлен альтернативный вариант расширяемого медицинского устройства, имеющего совокупность сквозных отверстий, содержащих лекарственное вещество для доставки в ткань или кровоток с помощью расширяющегося медицинского устройства. Расширяющееся медицинское устройство 300, представленное на фигуре 3, вырезано из материала цилиндрической формы, подходящего для изготовления цилиндрического расширяющегося медицинского устройства. Расширяющееся медицинское устройство 300 заключает в себе совокупность цилиндрических секций 302, связанных между собой совокупностью перемычечных элементов 304. Перемычечные элементы 304 позволяют устройству, поддерживающему ткань, сгибаться в осевом направлении, проходя по извилистому тракту сосудистого русла к месту развертывания, и позволяют устройству сгибаться в осевом направлении для соответствия изгибу просвета, требующего поддержки. Каждая цилиндрическая секция 302 образована сетью вытянутых стоек 306, которые соединены между собой пластическими шарнирами 308 и круговыми поперечинами 310. При расширении медицинского устройства 300 происходит деформация пластических шарниров 308, тогда как не происходит деформации вытянутых стоек 306.
Как показано на фигуре 3, в вытянутых стойках 306 и круговых поперечинах 310 выполнены отверстия 312, некоторые из которых, или они все, содержат лечебное средство для доставки в просвет, в котором имплантировано расширяющееся медицинское устройство. Кроме того, другие части устройства 300, такие как перемычечные элементы 304, могут заключать в себе отверстия, как показано на фигуре 4. В устройстве 400, представленном на фигуре 4, конструкция перемычечных элементов 402 может претерпеть модификацию по сравнению с той, что изображена на фигуре 3, с целью совмещения с дополнительными отверстиями или резервуарами 404. Желательно, чтобы отверстия или резервуары 404 в перемычечных элементах 402 и отверстия или резервуары 406 в оставшихся частях устройства 400 выполнялись в недеформируемых частях устройства 400 так, чтобы отверстия не подвергались деформации, а лечебное средство поставлялось без риска дробления, вытеснения или повреждения другого типа во время расширения устройства.
Примеры осуществления стента по настоящему изобретению, представленные на фигуре 3, могут далее конкретизироваться с помощью анализа методом конечных элементов и других методов для оптимизации внесения лечебных средств внутри отверстий 312. По существу, возможна модификация формы и расположения отверстий 312 для максимального увеличения объема пустот, при этом необходимо сохранять относительно высокий уровень прочности и жесткости поперечин относительно пластических шарниров 308. Обычно отверстия 312 заполнены менее чем на сто (100) процентов для любого применения.
В соответствии с примерами вариантов осуществления настоящего изобретения, единичные лечебные средства могут быть загружены в резервуары или отверстия, выполненные в стенте, или нанесены на его поверхность. Кроме того, множественные лечебные средства могут быть загружены в резервуары или отверстия, выполненные в стенте, или нанесены на его поверхность. Использование резервуаров или отверстий для высвобождения препарата или вещества, в соответствии с описанным выше в отношении фигуры 3, облегчает использование различных лечебных средств, а также обеспечивает ряд преимуществ, описанных далее в этом документе. Различные лечебные средства, содержащие различные лекарственные препараты, могут помещаться в различные отверстия в стенте. Это обеспечивает доставку двух или более лечебных средств одним стентом в соответствии с любой предпочтительной схемой доставки и с независимыми профилями скорости высвобождения препарата. В другом варианте, различные лечебные средства, содержащие один лекарственный препарат в различных концентрациях, могут помещаться в разные отверстия. Это позволяет равномерно распределять лекарственный препарат в ткани при неравномерной структуре самого устройства.
Два или более разных лечебных средств, используемых в устройствах, описываемых в настоящем документе, могут содержать (1) разные лекарственные препараты; (2) различные концентрации одного и того же препарата; (3) один и тот же препарат с разной кинетикой высвобождения, т.е. разной скоростью эрозии матрицы; или (4) разные формы одного и того же препарата. Примеры различных лечебных средств, содержащих в своем составе один и тот же лекарственный препарат с различной кинетикой высвобождения, могут использоваться с различными носителями для получения профилей элюирования разной формы. Некоторые примеры различных форм одного и того же лекарственного препарата содержат формы лекарственного препарата, обладающие различными гидрофильностью и липофильностью.
В дополнение к размещению различных лечебных средств в разных отверстиях для достижения различных концентраций препарата в различных целевых участках ткани или в кровотоке, загрузка различных лечебных средств в разные отверстия может служить для улучшения пространственного распределения лечебного средства при неравномерном распределении отверстий на расширяющемся медицинском устройстве.
Использование разных лекарственных препаратов в различных отверстиях в чередующемся или рассеянном порядке позволяет осуществлять доставку двух различных лекарственных веществ, когда их невозможно доставить, комбинируя внутри одного и того же матричного состава, содержащего полимер и лекарственный препарат. Например, в случае если сами лекарственные препараты взаимодействуют друг с другом нежелательным образом. Или же два лекарственных препарата не совместимы с одними и теми же полимерами для образования матрицы, или с одними и теми же растворителями для доставки матрицы, включающей полимер и лекарственный препарат, в отверстия.
Принимая во внимание, что отверстия в стенте, представленном на фигуре 3, являются сквозными, может применяться компонент конструкции для загрузки в отверстия одного или нескольких лечебных средств для определения направления высвобождения одного или нескольких лечебных средств, например, в основном в люминальную или аблюминальную стороны расширяющегося медицинского устройства. В дополнение к доставке различных лечебных средств в пристеночную или аблюминальную сторону расширяющегося медицинского устройства для лечения сосудистой стенки, лечебные средства могут доставляться в люминальную сторону расширяющегося медицинского устройства для предотвращения или сокращения тромбоза, или для прямой или местной доставки веществ в кровоток для лечебного воздействия на органы, лежащие ниже по току крови от участка имплантации, как описывается более подробно далее. Лекарственные препараты, которые доставляются в кровоток из люминальной стороны устройства, могут быть размещены на проксимальном конце устройства, дистальном конце устройства или в любых других желательных участках устройства
Методы загрузки различных лечебных средств в различные отверстия в расширяющемся медицинском устройстве могут включать известные способы, например, погружение и покрытие, а также известные способы пьезоэлектрического микроинжектирования. Микроинжекционные устройства могут управляться с помощью компьютера для доставки известным способом точного количества одного или нескольких лечебных средств в жидкой форме в точно определенные места на расширяющемся медицинском устройстве. Например, с помощью устройства или процесса инжектирования двух средств возможна доставка в отверстия двух агентов одновременно или последовательно. Когда лечебные средства загружены в сквозные отверстия расширяющегося медицинского устройства, люминальная сторона сквозных отверстий может блокироваться при помощи гибкого мандрена, что позволяет доставлять лечебные средства в жидкой форме, такие как растворитель. Также возможна загрузка лечебных средств с помощью устройств ручного инжектирования.
В соответствии с настоящим изобретением, в этом документе описывается стент с отверстиями или резервуарами, заключающими в себе агонист аденозиновых рецепторов. Однако представляется важным отметить, что селективный агонист аденозиновых рецепторов может наноситься на поверхность стента. Например, селективный агонист аденозиновых рецепторов может наноситься непосредственно на поверхность устройства или смешиваться с полимерной матрицей и затем фиксироваться на поверхности устройства. Кроме того, селективные агонисты аденозиновых рецепторов могут наноситься на поверхность других медицинских устройств, таких как ангиопластические баллоны, которые используются для местной доставки веществ в желаемый участок лечения с помощью стента или без него, или с помощью другой внутрипросветной каркасной структуры. Использование стента с резервуарами, позволяет достичь различных скоростей высвобождения лекарственного средства в различных концентрациях или дозах. Например, лекарственный препарат может избирательно высвобождаться в разных фазах и/или в разных дозах в зависимости от времени. Этого можно достичь с помощью заполнения резервуаров материалом, который изменяет скорость элюирования лекарственного препарата, с использованием разных концентраций того же препарата и/или разных форм того же препарата.
Аденозиновые рецепторы содержат четыре подтипа рецепторов, связанных с G-белком, обозначаемых A1, A2A, A2B и A3. Каждый из четырех подтипов содержит селективные агонисты, из которых более десятка оцениваются в настоящее время или прошли оценку в клинических исследованиях методов лечения различных патологических состояний. В примере варианта осуществления, описываемого в этом документе, селективный агонист аденозиновых рецепторов содержит агонист аденозиновых рецепторов подтипа A2A. Однако важно отметить, что возможно использование других селективных агонистов аденозиновых рецепторов.
Стент или другое имплантируемое медицинское устройство для местной доставки агониста аденозиновых рецепторов подтипа A2A может использоваться для уменьшения поражения миокарда после острого инфаркта миокарда. В максимально короткие сроки после острого инфаркта миокарда стент или другое подходящее устройство, содержащее или способное доставить агонист аденозиновых рецепторов типа A2A, размещают в кровеносном сосуде, в котором возникло закупоривание, вызвавшее инфаркт. После размещения, стент или другое внутрипросветное устройство расправляется для устранения закупорки и восстановления кровотока в определенной области, участке или объеме ткани сердца. После определенного периода времени, описанного более подробно далее, агонист аденозиновых рецепторов подтипа A2A высвобождается из стента или другого устройства в нижележащий коронарный кровоток, направляющийся к ткани сердца, пораженной гипоксией, в течение времени, достаточного для снижения уровня поражения миокарда.
Раннее и пролонгированное высвобождение агониста аденозиновых рецепторов подтипа A2A может уменьшить поражение миокарда, сокращая размер или объем пораженной инфарктом ткани миокарда, снижая уровень гибели мышечных клеток, уменьшая степень реперфузионного повреждения, сохраняя лучшее функционирование капиллярного мышечного русла, и/или ослабляет так называемое состояние невосстановленного кровотока, что, в свою очередь, улучшает сердечный выброс, фракцию выброса и морфометрические показатели сердечной мышцы после инфаркта. Доставка агониста аденозиновых рецепторов типа A2A из стента или другого устройства к ткани, пораженной гипоксией, начинается немедленно после того, как закупоренный кровеносный сосуд стал проходимым после раскрытия устройства (реперфузия), или, более конкретно, доставка лекарственного средства из устройства не начинается до восстановления кровотока к участку лечения, поскольку лекарственное средство переносится ниже с током крови. В случае со стентом с лекарственным покрытием или стентом, в котором лекарственный препарат содержится в резервуаре, доставка агониста аденозиновых рецепторов типа A2A будет начинаться немедленно после раскрытия стента и извлечения баллона, что делает возможным элюирование агониста. При применении саморасширяющего стента, доставка агониста аденозиновых рецепторов A2A начинается после раскрытия стента и вхождения в контакт с кровью.
Местная доставка агониста аденозинового рецептора подтипа A2Aв ткань с повышенным риском может продолжаться с момента реканализации артерии в течение периода от одного (1) до семидесяти двух (72) часов. Предпочтительно, чтобы агонист аденозиновых рецепторов подтипа A2A доставлялся в течение периода от (4) до двадцати четырех (24) часов после инфаркта. Количество агониста аденозиновых рецепторов подтипа A2A, доставляемого к ткани, пораженной гипоксией, в течение определенного периода времени составляет около 2 миллиграмм или 2000 микрограмм. Предпочтительным агонистом аденозиновых рецепторов подтипа A2A, используемым в настоящем изобретении, является высокоактивный агонист аденозиновых рецепторов подтипа A2A, обладающий более высокой активностью, чем сам аденозин, такой как ATL-359, поставляемый фирмой "PGxHealth LLC". Другие агонисты аденозиновых рецепторов подтипа A2A включают ATL-1222 и/или ATL-146e, которые также поставляются фирмой "PGxHealth LLC". Подробное описание профиля элюирования, а также комплекса лекарственных средств для загрузки в стент, представлено ниже.
Аденозин характеризуется несколькими свойствами, включая свойства коронарного вазодилататора, противовоспалительные свойства, свойства медиатора ишемического прекондиционирования и ограничения состояния невосстановленного кровотока и размера инфаркта. Агонисты аденозиновых рецепторов, как описано ниже, определяются как коронарные вазодилалтаторы, чья активность, более чем в сто раз превышает активность аденозина, обладающие способностью улучшать коронарную перфузию и сокращать размер инфаркта. Однако, важно отметить, что агонисты аденозиновых рецепторов, описываемые в этом документе, могут доставляться местно для лечения ишемизированных тканей в любом месте организма, включая головной мозг.
В типичном устройстве для элюирования препарата, препарат смешан с несколькими компонентами, такими как полимеры. Возможно применение любого количества биосовместимых полимеров. Желательно, чтобы полимер, который служит для удержания препарата в полости резервуара и снижения скорости элюирования препарата, являлся биорассасывающимся полимером. Примеры биорассасывающихся полимеров включают, помимо прочего, сложные эфиры поли-альфа-гидрокси кислоты, такие как полимолочная кислота (ПМК или DL-ПМК), полигликолевая кислота, сополимер молочной и гликолевой кислот (PLGA), сополимер полимолочной кислоты и капролактона, полимеры поли(блок-этилен оксид-блок лактид ко-гликолид) (ПЭО-блок-PLGA и ПЭО-блок-PLGA-блок-ПЭО); полиэтиленгликоль (ПЭГ) и полиэтиленоксид (ПЭО), поли(блок-этиленоксид-блок-проипленоксид-блок-этиленоксид), полоксамеры; поливинилпирролидон (ПВП); полиортоэфиры (ПОЭ); полисахариды или производные полисахарида, такие как полигиалуроновая кислота, гепарин, поли (глюкоза), поли (альгиновая кислота), хитин, хитозан, производные хитозана, целлюлоза, метил целлюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза; полипептиды и белки, такие как полилизин, полиглютаминовая кислота, альбумин; полиангидриды; полигидрокси акланоаты, такие как полигидрокси валерианат, полигидрокси бутират и т.п.
На фигуре 5 представлен схематичный вид сбоку части стента, высвобождающего лекарственные препараты, в соответствии с настоящим изобретением. Хотя схема доставки терапевтического средства или лекарственного вещества может индивидуально подбираться для различных ситуаций или сценариев лечения, как описано выше, для простоты понимания, предполагается, что смежные резервуары содержат два разных лекарственных препарата. Стент 500, элюирующий лекарственные препараты, изображен, как имеющий два резервуара 502 и 504, один из которых заполнен первой лекарственной комбинацией 506, а другой заполнен второй лекарственной комбинацией 508. На люминальной стороне стента 500 может располагаться барьерный слой 510, чтобы обеспечить элюирование первой комбинации 506, в первую очередь, в направлении сосудистой стенки и в ткань, содержащую сосудистую стенку, как показано стрелкой 512. На аблюминальной стороне стента 500 может располагаться барьерный слой 514, чтобы обеспечить элюирование второй комбинации 508, в первую очередь, в направлении просвета сосуда и кровотока, как указано стрелкой 516. Как изображено, применение барьерных слоев может легко использоваться для контроля направления элюирования. В настоящем изобретении, по причинам, указанным в этом документе, предпочтительным является элюирование агониста аденозинового рецептора подтипа A2A в кровоток для лечения органа, расположенного ниже по току крови, такого как сердце и, желательно, участок сердца, снабжаемый или перфузируемый закупоренным ранее сосудом.
На фигуре 5 изображены комбинации и барьерные слои как отдельные участки внутри отверстий; однако, следует понимать, что эти участки не представляют собой четко разделенные участки в местах их формирования из-за смешивания разных участков и материалов, из которых они выполнены. Таким образом, хотя барьерные слои, в первую очередь, состоят из полимера без включения препарата, в зависимости от применяемых технологий производства, некоторое количество лекарственного препарата из следующего участка может внедряться в барьерный слой.
Как описывалось выше, препараты могут помещаться или загружаться в резервуары стента с использованием любого количества способов. В примере осуществления, лекарственные комбинации вводятся или загружаются в лунки резервуаров или резервуары в ходе двух отдельных и поочередных этапов, включая, во-первых, помещение жидкой комбинации растворов в резервуары и, во-вторых, выпаривание большей части, если не всего, растворителя заполняющего раствора. В идеальном варианте растворитель отсутствует; однако, процессы и материалы, применяемые в настоящее время, не обеспечивают создания смеси растворителей, не дающей осадка. Комбинации, в соответствии с настоящим изобретением, как описано в этом документе, являются твердыми материалами, которые остаются в резервуарах после удаления практически всего, а в предпочтительном варианте, всего растворителя из состава заполняющего раствора.
Жидкие комбинации, применяемые для образования твердых комбинаций, содержащих агонисты аденозиновых рецепторов подтипа A2A, содержат биорассасывающийся или биопоглощаемый полимер, предпочтительно, сополимер лактида с гликолидом, PLGA, подходящий растворитель, такой как диметилсульфоксид, ДМСО, или N-метилпирролидон, NMP, агонист аденозиновых рецепторов подтипа A2A, такого как ATL-359 и, в качестве опции, стабилизатора или антиоксиданта, такого как БГТ. Альтернативные варианты диметилсульфоксида (ДМСО) и N-метилпирролидона (NMP) содержат диметилацетамид (ДМАс) или диметилформамид (ДМФ). Предпочтительным вариантом является ДМСО, поскольку ATL-359 более стабилен в присутствии ДМСО, и ДМСО более биосовместим с растворителем.
Каждая последовательно наносимая жидкая комбинация может содержать одни и те же ингредиенты, или последовательно наносимые заполняющие растворы могут приготавливаться из заполняющих растворов, состоящих из различных ингредиентов. В предпочтительном варианте первая серия образования отложений из заполняющих растворов содержит полимер, лекарственный препарат и растворитель, после каждого этапа заполнения растворы высушивают. Эта часть процесса приводит к образованию или формированию структуры основного лекарственного препарата. Вторая серия образования отложений из заполняющих растворов содержит только полимер и растворитель, которые высушиваются после каждого этапа заполнения. Благодаря такой технологической последовательности операций в резервуаре образуется лекарственная комбинация, в которой ATL-359 достигает более высокой концентрации на люминальной поверхности резервуара и относительно более низкой концентрации в области аблюминальной поверхности каждого резервуара. Такая конфигурация, как подробно описано выше, удлиняет путь или создает более высокое сопротивление элюированию лекарственного препарата к аблюминальной поверхности, по сравнению с элюированием лекарственного вещества к люминальной поверхности, благодаря этому практически весь ATL-359 доставлялся к люминальной стороне стента и в артериальный кровоток. Другими словами, конструкция части резервуаров, доставляющих ATL-359 преимущественно в люминальном направлении, предполагает выполнение емкости резервуара на аблюминальной поверхности стента или вблизи нее преимущественно из полимера и незначительного количества ATL-359, а емкости того же резервуара на люминальной поверхности или вблизи нее - преимущественно из ATL-359 и меньшего количества полимера.
Предпочтительно, чтобы комбинация агониста аденозинового рецептора подтипа A2A внутри резервуара содержала агонист аденозиновых рецепторов подтипа A2A, биорассасывающийся полимер, растворитель и, в качестве опции, стабилизатор, которые находятся в определенной пропорции друг к другу. Предпочтительно, чтобы общая доза или количество ATL-359, доступная на стенте с элюированием препарата, составляла от 10 до 2000 микрограмм, еще более предпочтительно, от 30 до 450 микрограмм (для стента 7 мм), что при высвобождении со стента размером 3,5x17 мм составит от 0,2 до 2,75 микрограмм на квадратный миллиметр площади артериальной ткани, при этом площадь артериальной ткани определяется как площадь поверхности теоретического цилиндра, диаметр и длина которого представляют собой диаметр и длину расширенного стента после раскрытия в артерии. Общая доставляемая доза ATL-359 или другого агониста аденозиновых рецепторов подтипа A2A зависит от диаметра и длины стента.
Как указывалось выше, саморассасывающимся полимером, применяемым в комбинации, является PLGA. В более предпочтительном варианте комбинация содержит полимер PLGA с молярным отношением остатка лактида к остатку гликолида (L:G) в полимерной цепи от 85:15 до 65:35. Еще более предпочтительно, чтобы комбинация содержала полимер PLGA с молярным отношением остатка лактида к остатку гликолида (L:G) в полимерной цепи от 80:20 до 70:30. Истинная вязкость PLGA должна составлять предпочтительно от 0,1 до 0,9 дл/г. В примерах варианта осуществления, комбинация включает полимер PLGA с молярным соотношением лактида к гликолиду (L:G) в полимерной цепи, составляющим 75/25 как в лекарственной комбинации, так и барьерном слое, и с истинной вязкостью, составляющей 0,68 в лекарственной комбинации и 0,21 в барьерном слое. Предпочтительно, чтобы соотношение ATL-359 к PLGA по массе, обозначаемое как соотношение D/P, находилось в диапазоне от 95/5 с верхним пределом объема, равным четырем (4) процентам, и дозой, составляющей около 523 микрограмм на стенте размером 3,5×17 мм для общего соотношения D/P от 85,7/14,3 до около 60/40 с верхним пределом, равным восемнадцати (18) процентам и дозой 275 микрограмм для общего соотношения D/P, равного 47,5/52,5. Эти величины зависят от дозы и размера стента. Все соотношения даны в процентном содержании по массе.
Для приготовления заполняющего раствора из вышеописанных компонентов требуется подходящий растворитель. Предпочтительным растворителем является диметилсульфоксид, ДМСО, и желательно его использование с ATL-359 в количестве, составляющим от 1 процента до приблизительно 30 процентов по массе относительно общей массы заполняющего раствора ДМСО. Еще более предпочтительным является использование ATL-359 в количестве, составляющим от приблизительно 10 процентов до приблизительно 25 процентов по массе относительно общей массы заполняющего раствора ДМСО. И еще более предпочтительным является использование ATL-359 в количестве, составляющем от приблизительно 15 процентов до приблизительно 21 процента по массе относительно общей массы заполняющего раствора ДМСО.
Важно отметить, что загрузка препарата или дозы для каждого препарата могут выражаться различными способами, включая перечисленные выше. В предпочтительном примере варианта осуществления диапазоны доз могут выражаться в виде сгруппированных абсолютных диапазонов массы лекарственного препарата, исходя из стандартного размера стента 3,5×17 мм. Таким образом, диапазон доз зависит от размера стента и числа резервуаров. Например, в стенте размером 3,5×17 мм количество отверстий или резервуаров равно 585. В других примерах вариантов осуществления количество резервуаров для указанного размера стента может включать 211 резервуаров для стента 2,5×8 мм, 238 для стента 3,0×8 мм, 290 резервуаров для стента 3,5×8 мм, 311 резервуаров для стента 2,5×12 мм, 347 резервуаров для стента 3,0×12 мм, 417 резервуаров для стента 3,5×12 мм, 431 резервуаров для стента 2,5×17 мм, 501 резервуаров для стента 3,0×17 мм, 551 резервуаров для стента 2,5×22 мм, 633 резервуаров для стента 3,0×22 мм, 753 резервуаров для стента 3,5×22 мм, 711 резервуаров для стента 2,5×28 мм, 809 резервуаров для стента 3,0×28 мм, 949 резервуаров для стента 3,5×28 мм, 831 резервуаров для стента 2,5×33 мм, 963 резервуаров для стента 3,0×33 мм и 1117 резервуаров для стента 3,5×33 мм.
На фигуре 6 представлено графическое изображение показателей улучшенного кровотока через стент, высвобождающий ATL-359 в сосудистое русло, по сравнению с показателями кровотока через непокрытый металлический стент. Кривая 602 построена по результатам измерений кровотока через непокрытые металлические стенты, а кривая 604 построена по результатам измерений через стенты, элюирующие ATL-359. Как явственно видно при сравнении двух кривых, высвобождение ATL-359 из стента приводит к значимому повышению кровотока.
Данные, по которым построены кривые 602 и 604, получены в результате экспериментальных исследований на домашних свиньях, находящихся под наркозом. В данном эксперименте свиньям, анестезированным газом изофлураном, имплантировали один стент (3,0×17 мм) в середину передней нисходящей ветви левой коронарной артерии через бедренный доступ. Всего использовали девять свиней. У шести свиней стенты содержали ATL-359, как описывалось выше, и у оставшихся свиней использовали такие же стенты, но без ATL-359. После имплантации стентов осуществляли непрерывную регистрацию гемодинамических показателей в течение четырех часов, результаты представлены на фигуре 6.
Другие селективные агонисты содержат селоденозон (DTI0009), текаденозон (CVT-510), CVT-2759, биноденозон (MRE0470), регаденозон(CVT-3146), MRE0094, BAY-60-6583), CF101 (IB-MECA), CF102 (CI-IB-MECA), CF502 (MRS3558) и AMP-579.
Стент, элюирующий лекарственный препарат, по настоящему изобретению может применяться для лечения ряда патологических состояний, как указано выше, включая рестеноз, тромбоз, острый инфаркт миокарда, реперфузионное повреждение, состояние невосстановленного капиллярного кровотока, ишемические заболевания. Кроме агониста аденозиновых рецепторов подтипа A2A, возможно добавление и других лекарственных препаратов в устройство. Например, допускается добавление антитромботических средств, таких как гепарин, цилостазол или тирофибан. Дополнительные препараты могут наноситься в качестве покрытия, или загружаться в резервуары. Важно отметить, что возможно использование любого количества лекарственных препаратов и комбинаций резервуаров, а также покрытий, для адаптации устройства к конкретному патологическому состоянию. Например, сиролимус, известный как эффективный ингибитор роста гладкомышечных клеток, может использоваться в сочетании с селективным агонистом аденозиновых рецепторов для создания эффективного средства для лечения рестеноза. Более определенно, в стенте, указанном на фигуре 5, рапамицин может доставляться в сосудистую стенку, в то время как агонист аденозиновых рецепторов может доставляться в кровоток. На том же устройстве, гепарин или аналогичный препарат могут фиксироваться на поверхности вне резервуара, и таким образом, для лечения рестеноза, ткани, пораженной гипоксией, и тромбоза можно использовать одно устройство.
В соответствии с другим вариантом осуществления, возможно применение дополнительных сочетаний лекарственных средств для лечения острого инфаркта миокарда и/или реперфузионного повреждения, а также других состояний, связанных с повреждением, такими как рестеноз. Через введение одного или нескольких лекарственных веществ, описанных в этом документе, посредством доставки со стента или других подходящих устройств, сочетание лекарственных веществ может повышать внутриклеточные уровни циклического аденозинмонофосфата (цАМФ) в местных целевых клетках (гладкомышечные, эндотелиальные, воспалительные клетки и клетки миокарда). Повышение уровней цАМФ обусловливают расширение сосудов гладких мышц и ингибирование пролиферации, снижение активации тромбоцитов, снижение воспаления и положительный инотропный эффект. Лекарственные вещества, которые повышают цАМФ, содержат ингибиторы фосфодиэстеразы, которые ингибируют ферментативное расщепление цАМФ до 5'-АМФ, и агонисты аденозиновых рецепторов подтипа A2A, которые соединяются для активации аденилатциклазы, ответственной за превращения АТФ в цАМФ. Ингибиторы ФДЭ могут применяться с агонистами аденозиновых рецепторов подтипа A2A, описанных выше, и с рапамицином для достижения преимуществ, которые могут превышать преимущества, получаемые при применении отдельных препаратов, которые раскрываются более подробно далее.
Желательно, чтобы доставка ингибитора ФДЭ из стента или другого устройства начиналась немедленно или через очень короткое время после раскрытия стента с лекарственным покрытием или стента, в котором лекарственный препарат содержится в резервуаре, и восстановления кровотока в коронарных сосудах, пораженных в результате острого инфаркта миокарда. Желательно, чтобы доставка ингибитора ФДЭ из стента или другого медицинского устройства приводила к улучшению распределения кровотока в ишемизированной ткани, уменьшению размеров инфарктной или некротической зоны миокарда, снижению степени поражения при так называемом реперфузионном повреждении, которое развивается при восстановлении кровотока к пораженной ткани с помощью открытия закупоренной коронарной артерии стентом или другим устройством, и долговременного, связанного с ишемией, действия на ткань. Необходимо еще раз подчеркнуть, что устройство и лекарственные средства, описываемые в этом документе, могут применяться в лечении других органов.
Ингибиторы фосфодиэстеразы III типа или соединения, активные в отношении ФДЭ-III представляют собой подгруппу ингибиторов ФДЭ, которые, как ожидается, обеспечивают наиболее высокое положительное действие в коронарных сосудах, включая более мелкие артериолы и капилляры, и ткани миокарда. Эти лекарственные вещества содержат цилостазол, милринон, инамрион, цилостамид, сатеринон, мотапизон, ликсазинон, эноксимон (феноксимон), имазодан, пимобендан. Неспецифические соединения, активные по отношению к ФДЭ, которые гораздо менее предпочтительны, но могут применяться, включают теофиллин и аминофиллин. Соединения, активные по отношению к ФДЭ-V (ингибиторы циклической гуанозинмонофосфат-специфической фосфодиэстеразы), которые также могут применяться, содержат силденафил и тадалафил. Среди ингибиторов ФДЭ предпочтительным является использование ингибиторов ФДЭ типа III, и более предпочтительным ингибитором ФДЭ является цилостазол, который обеспечивает преимущества, подробно описанные ниже.
В примере варианта осуществления, представленного ниже, применяются рапамицин и цилостазол из стента с лекарственным покрытием по сравнению со стентом, в котором лекарственные средства содержатся в резервуаре. Кроме того, для лекарственной матрицы применяются различные полимеры. Однако необходимо отметить, что применение этих двух препаратов в сочетании с агонистом аденозиновых рецепторов подтипа A2A, как описывалось выше, так же эффективно и из стента, в котором лекарственные препараты содержатся в резервуаре, в соответствии с описанием и иллюстрациями, представленными в этом документе. Иными словами, рапамицин, цилостазол и селективный агонист аденозиновых рецепторов подтипа A2A могут загружаться в резервуары в любой желаемой комбинации для достижения желаемого терапевтического эффекта, как более подробно раскрывается ниже. В примерах вариантов осуществления, представленных ниже, показана эффективность комбинации рапамицина и ингибитора ФДЭ в лечении рестеноза и тромбоза.
Рапамицин представляет собой макроциклический триеновый антибиотик, продуцируемый Streptomyces hygroscopicus, согласно патенту США № 3929992. Установлено, что рапамицин, помимо прочего, ингибирует пролиферацию гладкомышечных клеток сосудов в условиях in vivo. Таким образом, рапамицин может применяться в лечении гиперплазии гладкомышечных клеток интимы, рестеноза и закупорки сосудов у млекопитающих, в особенности после биологического или механического повреждения сосудов или в условиях, которые провоцируют такие сосудистые повреждения у млекопитающих. Рапамицин ингибирует пролиферацию гладкомышечных клеток и не препятствует повторной эндотелиализации сосудистых стенок.
Рапамицин сокращает сосудистую гиперплазию, противодействуя пролиферации гладкомышечных клеток в ответ на митогенные стимулы, вырабатываемые при повреждении в результате ангиопластики. Считается, что главным механизмом действия рапамицина является ингибирование пролиферации гладкомышечных клеток, опосредованной фактором роста и цитокином, в поздней фазе G1 клеточного цикла. Однако известно, что при системном введении рапамицин предотвращает Т-клеточную пролиферацию и дифференциацию. На этом основано его иммуносупрессивное действие и его способность предотвращать отторжение имплантата.
В рамках настоящего изобретения термин "рапамицин" включает рапамицин и все его аналоги, производные и конъюгаты, которые связываются с FKBP12 и другими иммунофилинами, и обладает такими же фармакологическими свойствами, что и рапамицин, включая ингибирование TOR.
Хотя противопролиферативное действие рапамицина может обеспечиваться при системном применении, достижение наилучших результатов возможно при местной доставке соединения. Рапамицин, главным образом, действует в тканях, находящихся в непосредственной близости от соединения, и по мере удаления от устройства доставки эффект снижается. Для использования преимущества этого действия, необходимо обеспечить непосредственный контакт рапамицина со стенками внутри сосуда.
Как раскрывается выше, рапамицин может использоваться в сочетании с цилостазолом. Цилостазол {6[4-(1-циклогексил-1H-тетразол-5-ил)-бутокси]-3,4-дигидро-2-(1H)-хинолон} представляет собой ингибитор фосфодиэстеразы III типа (специфической к циклическому АМФ) и обладает антитромботическими и сосудорасширяющими свойствами. Изначально цилостазол был разработан как селективный ингибитор фосфодиэстеразы 3 циклических нуклеотидов. Ожидалось, что ингибирование фосфодиэстеразы 3 в тромбоцитах и гладкомышечных клетках сосудов обеспечит антитромботическое и сосудорасширяющее действие; однако, доклинические исследования показали, что цилостазол также обладает способностью ингибировать накопление аденозина различными клетками, свойство, которое отличает цилостазол от других ингибиторов фосфодиэстеразы 3, таких как милринон. Таким образом, установлено, что цилостазол обладает уникальными антитромботическими и сосудорасширяющими свойствами, исходя из новых механизмов действия.
Исследования также подтвердили эффективность цилостазола в уменьшении частоты рестеноза после имплантации стента. См., например, Matsutani M.(Мацутани М.), Ueda H.(Уэда Х.) и соавт.: “Действие цилостазола в предотвращении рестеноза после чрескожной транслюминальной коронарной ангиопластики", журнал "Am. J. Cardiol" 1997, 79:1097-1099, Kunishima T. (Кунишима Т.), Musha H. (Муша Х.), Eto F. (это Ф.), и соавт.: "Рандомизированное исследование терапии аспирином по сравнению с терапией цилостазолом после успешной имплантации коронарного стента", журнал "Clin Thor" 1997, 19:1058-1066, и Tsuchikane E. (Цучикане Е.), Fukuhara A. (Фукухара А.), Kobayashi T. (Кобаяши Т.) и соавт.: Воздействие цилостазола на рестеноз после чрескожной коронарной баллонной ангиопластики, журнал "Circulation" 1999, 100:21-26.
В соответствии с настоящим изобретением цилостазол может изготавливаться для замедленного высвобождения из медицинского устройства или покрытия медицинского устройства, чтобы способствовать снижению отложения тромбоцитов и образования тромбоза на поверхности медицинского устройства. Как описано выше, такие медицинские устройства включают в себя любые имплантаты, короткого или длительного срока действия, находящиеся в постоянном контакте с кровью, такие как кардиоваскулярные, периферические и внутричерепные стенты. В качестве опции, возможно внедрение цилостазола в соответствующее полимерное покрытие или матрицу в сочетании с рапамицином или другими сильнодействующими лекарственными средствами, чье действие направлено против рестеноза.
Внедрение и последующее пролонгированное высвобождение цилостазола из медицинского устройства или покрытия медицинского устройства, в предпочтительном варианте, уменьшает отложения тромбоцитов и частоту образования тромбоза на поверхности медицинского устройства. Как описано выше, имеются данные доклинических и клинических испытаний, подтверждающие, что цилостазол действует против рестеноза, отчасти благодаря своей противопролиферативной активности. Таким образом, цилостазол эффективен, по меньшей мере, в двух аспектах устройств, контактирующих с кровью, таких как стенты, элюирующие лекарственные препараты. В связи с этим, комбинации цилостазола с другим сильнодействующим лекарственным веществом, чье действие направлено против рестеноза, включая рапамицин, такой как сиролимус, его аналоги, производные, родственные вещества и конъюгаты, или паклитаксел, его аналоги, производные, родственные вещества и конъюгаты, могут применяться для местного лечения сердечно-сосудистых заболеваний и снижения отложения тромбоцитов и частоты образования тромбоза на поверхности медицинского устройства. Хотя вышеизложенное описание приведено применительно к стентам, важно отметить, что комбинации лекарственных препаратов, описанные в рамках данного примера осуществления, могут также применяться с различными медицинскими устройствами, некоторые из которых описаны в этом документе.
На фигуре 7 представлен первый пример конфигурации комбинации цилостазола и рапамицина на стенте. В данном примере осуществления, стентом является стент "Bx Velocity® ", поставляемый компанией "Cordis Corporation". В данной конкретной конфигурации стент 700 имеет трехслойное покрытие. Первый слой или внутренний слой 702 содержит сто восемьдесят (180 мкг) микрограмм сиролимуса, что эквивалентно по массе сорока пяти (45) процентам к общей массе внутреннего слоя 702, и сополимерную матрицу сополимера (поли)этилена и винилацетата и полибутилметакрилата, СЭВА/ПБМА, эквивалентной по массе пятидесяти пяти (55) процентам к общей массе внутреннего слоя 702. Второй слой или внешний слой 704 содержит сто (100 мкг) микрограмм цилостазола, что эквивалентно по массе сорока пяти (45) процентам к общей массе внешнего слоя 704, и сополимерную матрицу СЭВА/ПБМА, эквивалентной по массе пятидесяти пяти (55) процентам к общей массе внешнего слоя 704. Третий слой или диффузионное внешнее покрытие 706 содержит двести (200 мкг) микрограмм ПБМА. Коэффициент восстановления содержания составлял восемьдесят пять (85) процентов от номинального содержания лекарственного препарата для сиролимуса и девяносто восемь (98) от номинального содержания лекарственного препарата для цилостазола. Кинетика высвобождения как цилостазола, так и сиролимуса в условиях in vitro показана на фигуре 8 и более подробно описана ниже.
На фигуре 9 представлен второй пример конфигурации комбинации цилостазола и рапамицина на стенте. Как описано выше, стент является стентом "Bx Velocity®", поставляемым компанией "Cordis Corporation". В данном варианте осуществления стент 900 имеет трехслойное покрытие. Первый слой или внутренний слой 902 содержит сто восемьдесят (180 мкг) микрограмм сиролимуса, что эквивалентно по массе сорока пяти (45) процентам к общей массе внутреннего слоя 902, и сополимерную матрицу СЭВА/ПБМА, эквивалентной по массе пятидесяти пяти (55) процентам к общей массе внутреннего слоя 902. Второй слой или внешний слой 904 содержит сто (100 мкг) микрограмм цилостазола, что эквивалентно по массе сорока пяти (45) процентам к общей массе внешнего слоя 904 и сополимерную матрицу СЭВА/ПБМА, эквивалентной по массе пятидесяти пяти (55) процентам к общей массе внешнего слоя 904. Третий слой или внешнее диффузионное покрытие 906 содержит сто (100 мкг) микрограмм БМА. Еще раз, коэффициент восстановления содержания составлял восемьдесят пять (85) процентов от номинального содержания лекарственного препарата для сиролимуса и девяносто восемь (98) процентов от номинального содержания лекарственного препарата для цилостазола. Кинетика высвобождения цилостазола и сиролимуса в условиях in-vitro представлена на фигуре 10 и более подробно описана ниже.
Как можно легко увидеть при сравнении фигур 8 и 10, наблюдалась сравнительно более низкая скорость высвобождения препарата как для сиролимуса, так и для цилостазола из конфигурации, включающей диффузное внешнее покрытие БМА большей толщины, т.е. двести микрограмм, в отличие от ста микрограмм. Соответственно, избирательное применение диффузионных покрытий позволяет дополнительно контролировать скорость элюирования обоих лекарственных препаратов, что более подробно описывается в данном документе. При избирательном применении диффузионных покрытий учитывается толщина нанесения, а также другие особенности, в том числе химическая несовместимость.
На фигуре 11 показан третий вариант примера конфигурации комбинации цилостазола и рапамицина на стенте. Эта конфигурация идентична по своей структуре конфигурации, представленной на фигуре 7, однако количество цилостазола сокращено до пятидесяти (50 мкг) микрограмм. Как и в предыдущем варианте осуществления, здесь использован стент 1100 и три дополнительных слоя 1102, 1104 и 1106. Процентное соотношение по массе, однако, остается таким же.
Антитромботическая эффективность трех конфигураций, описанных выше, проиллюстрирована на фигуре 12. На фигуре 12 показаны антитромботические свойства покрытий, содержащих комбинацию сиролимус/цилостазол, описанных выше, в условиях in vitro в экспериментальной модели кровеносной системы с использованием бычьей крови. В экспериментальной модели кровеносной системы с использованием бычьей крови в условиях in vitro свежую бычью кровь гепаринизируют, чтобы довести значение активированного времени свертывания крови (АВСК) до двухсот (200) секунд. Тромбоциты в крови метят с помощью индия 111. В ходе исследования стент помещают в силиконовую трубку, которая является частью замкнутой системы, в которой циркулирует кровь. Гепаринизированная кровь циркулирует в замкнутой системе при помощи циркуляционного насоса. С течением времени на поверхности стента скапливаются активированные тромбоциты, фибрин и образуется тромб, снижающий скорость кровотока в стентированной замкнутой системе. Циркуляцию останавливают, когда скорость кровотока снижается до пятидесяти (50) процентов от первоначального значения или через девяносто (90) минут, если ни один из испытуемых стентов не снизил скорость кровотока на пятьдесят (50) процентов. Общую радиоактивность (In 111) на поверхности стента рассчитывают при помощи счетчика бета-частиц, значения нормализуют с помощью значения, полученного при испытании контрольного устройства, принятого за сто (100) процентов в технологической карте. Более низкое значение указывает на более низкие тромбообразующие свойства поверхности. Все три группы двойных лекарственных покрытий, включающих сиролимус/цилостазол, уменьшали отложение тромбоцитов и образование тромба на поверхности стента более чем на девяносто (90) процентов по сравнению с контрольным покрытым стентом, не содержащим дополнительного соединения цилостазола. Столбец 1202 обозначает контрольный покрытый стент, нормализованный до ста (100) процентов. В качестве контрольного покрытого стента использовался коронарный покрытый стент Cypher®, элюирующий сиролимус, поставляемый компанией "Cordis Corporation". Столбец 1204 обозначает стент "HEPACOAT®, покрытый гепарином; поставляемый компанией "Cordis Corporation", под торговой маркой коронарных стентов "Bx Velocity®". Столбец 1206 обозначает стент, выполненный в соответствии с данными, указанными в документе, с учетом архитектуры, представленной на фигуре 7. Столбец 1208 обозначает стент, выполненный в соответствии с данными, указанными в документе, с учетом архитектуры, представленной на фигуре 9. Столбец 1210 обозначает стент, выполненный в соответствии с данными, указанными в документе, с учетом архитектуры, представленной на фигуре 11. Как можно увидеть на фигуре 12, цилостазол значимо уменьшает образование тромба.
Другим критическим параметром тромборезистентности устройства, покрытого цилостазолом, является продолжительность высвобождения лекарственного препарата из покрытия. Это имеет особое значение в первые две недели после имплантации устройства. В исследованиях фармакокинетики на свиньях, в которых оценивалось элюирование лекарственных препаратов из двойного покрытия, как цилостазол, так и сиролимус медленно высвобождались из покрытия, что, в результате, давало профиль замедленного высвобождения. Цель фармакокинетического исследования на свиньях состоит в оценке фармакокинетики покрытого стента, элюирующего лекарственный препарат в течение заданного времени имплантации. Как правило, имплантируют три стента в три различные коронарные артерии свиньи в течение заданного периода времени, затем стенты извлекаются для проведения анализа общего восстановления лекарственного препарата. Стенты извлекаются в заранее заданные временные точки; а именно, на 1, 3 и 8 сутки. Стенты извлекают, и определяют общее количество лекарственного вещества, оставшегося на стенте, с помощью анализа методом ВЭЖХ (высокоэффективной жидкостной хроматографии). Разница между исходным количеством лекарственного вещества на стенте и количеством извлеченного лекарственного вещества в заданное время представляет собой количество лекарственного вещества, высвобожденного за этот период. Непрерывное высвобождение лекарственного вещества в окружающую артериальную ткань является фактором, препятствующим разрастанию неоинтимы и образованию рестеноза в коронарной артерии. График нормального распределения представляет процентное соотношение общего объема высвобожденного лекарственного вещества (%, ось y) и периода имплантации (день, ось x). Как показано на фигуре 13, приблизительно восемьдесят процентов (80%) двух лекарственных веществ оставалось в лекарственном покрытии через восемь (8) дней после имплантации. Кроме того, оба лекарственных вещества высвобождались с аналогичной скоростью, несмотря на относительно большую разницу их соответствующих логарифмически обработанных значений P и водорастворимости. Кривая 1302 отображает цилостазол, а кривая 1304 отображает сиролимус. Соответствующие профили высвобождения в условиях in vitro представлены на фигуре 14. Аналогично профилю высвобождения в условиях in vivo как сиролимус, обозначаемый квадратами, так и цилостазол, обозначаемый ромбами, высвобождались достаточно медленно, так что высвобождение обоих лекарственных веществ составило только около тридцати пяти (35) процентов. На фигурах 13 и 14 представлены скорости высвобождения в условиях in vivo и in vitro из стента, покрытого в соответствии с конфигурацией, представленной на фигуре 15, где сиролимус и цилостазол содержатся в одном слое, а не в двух отдельных слоях. В данном примере конфигурации стент 1500 имеет двухслойное покрытие. Первый слой 1502 содержит композицию из сиролимуса, цилостазола и сополимерной матрицы СЭВА/ПБМА. Второй слой или диффузионное внешнее покрытие 1504 включает только ПБМА. Более конкретно, в данном варианте осуществления изобретения первый слой 1502 содержит комбинацию сиролимуса и цилостазола, которая составляет по массе сорок пять (45) процентов от общей массы первого слоя 1502, и сополимерную матрицу СЭВА/ПБМА, которая по массе составляет пятьдесят пять (55) процентов от общей массы первого слоя 1502. Диффузионное внешнее покрытие содержит сто (100 мкг) микрограмм ПБМА.
На фигурах 16 и 17 представлены скорости высвобождения в условиях in vivo и in vitro из стента, покрытого в соответствии с конфигурацией, представленной на фигуре 7, соответственно. Многослойное покрытие, элюирующее два лекарственных препарата, характеризовалось сравнительно более высокой скоростью высвобождения в том же фармакокинетическом исследовании с использованием свиней в качестве животной модели по сравнению с базовым покрытием, содержащим два лекарственных препарата, как можно ясно увидеть при сравнении фигур 16 и 13. На фигуре 16 кривая 1602 отображает цилостазол, а кривая 1604 отображает сиролимус. Однако процент высвобождения обоих лекарственных веществ был сопоставим в каждой временной точке. Соответствующие профили скорости высвобождения лекарственных веществ в условиях in vitro представлены на фигуре 16, где ромбами обозначен цилостазол, а квадратами - сиролимус. По сравнению с базовым покрытием, содержащим два лекарственных препарата, оба препарата высвобождались гораздо быстрее, отражая профили быстрого высвобождения, показанные в фармакокинетическом исследовании в условиях in vivo. Таким образом, при объединении лекарственных препаратов в одном слое обеспечивается более высокая степень контроля скорости элюирования.
Использование комбинации рапамицина, такого как сиролимус, и цилостазола, как описано выше, представляется более эффективным, чем использование каждого лекарственного препарата по отдельности, для уменьшения пролиферации и миграции гладкомышечных клеток. Кроме того, как указано в настоящем документе, высвобождение цилостазола из комбинированного покрытия можно постоянно контролировать для достижения длительного предотвращения отложения тромбоцитов с образованием тромбоза на поверхности стента или поверхности другого медицинского устройства, контактирующего с кровью. В составе комбинированного покрытия цилостазол может быть внедрен в один слой вместе с сиролимусом или в отдельный слой, вне слоя, содержащего сиролимус. Вследствие своей достаточно низкой растворимости в воде цилостазол потенциально может удерживаться в покрытии внутри организма в течение достаточно длительного периода времени после развертывания стента или другого медицинского устройства. Относительно медленное элюирование в условиях in vitro по сравнению с сиролимусом во внутреннем слое предполагает такую возможность. Цилостазол представляет собой стабильное соединение, растворимое в большинстве органических растворителей и совместимое с различными техниками нанесения покрытия, описанными в этом документе. Также важно отметить, что как сиролимус, так и цилостазол могут быть внедрены в нерассасывающуюся полимерную матрицу или рассасывающуюся матрицу.
Как указано выше, использование комбинации сиролимуса и цилостазола, представляется более эффективным, чем использование каждого лекарственного препарата по отдельности, для уменьшения пролиферации и миграции гладкомышечных клеток. Цилостазол может также применяться для достижения продолжительного действия против отложения тромбоцитов и предотвращения тромбоза на стенте или другом медицинском устройстве. Кроме того, цилостазол, являющийся активным веществом в отношении ФДЭ-III, также действует синергетически с селективными агонистами аденозиновых рецепторов подтипа A2A, описанными в этом документе. Действие ингибиторов фосфодиэстеразы обусловлено блокировкой или замедлением ферментативного превращения циклического аденозинмонофосфата (цАМФ) в 5'-аденозинмонофосфат (5'-АМФ). Агонисты аденозиновых рецепторов, воздействуют на рецепторы, связанные с G-белком, которые активируют аденилатциклазу и повышают внутриклеточную цАМФ. В этом отношении, при совместной доставке ингибитора ФДЭ и селективного агониста аденозиновых рецепторов в комбинации обеспечивается более высокий уровень стимуляции аденозиновых рецепторов, чем при их доставке по отдельности. Следовательно, сочетание препаратов можно применять для лечения рестеноза, тромбоза и уменьшения поражения миокарда после острого инфаркта миокарда, при доставке со стента или другого медицинского устройства.
Стент со сквозными резервуарами, как описано в этом документе, может применяться для доставки одного или нескольких лекарственных средств для лечения одного или нескольких патологических состояний в соответствии с описанным выше. Возможно использование множества резервуаров для доставки одного или нескольких лекарственных средств люминально - в просвет сосудистого русла, аблюминально - в ткань вокруг устройства, или как люминально, так и аблюминально. Например, рапамицин, по отдельности или в сочетании с цилостазолом, может доставляться в ткань вокруг устройства для лечения рестеноза, тромбоза и воспаления. Как описано выше, эти лекарственные средства могут усиливать действие друг друга при лечении этих патологических состояний. Цилостазол может также предназначаться для доставки в кровоток по отдельности или в сочетании с селективным агонистом аденозиновых рецепторов подтипа A2A для лечения и уменьшения поражения миокарда. Другими словами, комбинация селективного агониста аденозиновых рецепторов подтипа A2A, рапамицина, такого как сиролимус и ингибитора ФДЭ, такого как цилостазол, может применяться для повышения уровня аденозина в ткани, лежащей ниже по направлению кровотока, и для более эффективного предотвращения рестеноза и образования тромбоза.
На фигуре 18 представлено графическое изображение кривых кинетики высвобождения для сиролимуса 1902 и цилостазола 1904 в течение тридцати (30) дней по данным исследования кинетики высвобождения в условиях in vivo. В соответствии с изображением, оба препарата характеризуются аналогичной кинетикой высвобождения, приблизительно семьдесят (70) процентов обоих препаратов высвобождается из стента в течение тридцати (30) дней (скорость высвобождения сиролимуса немного превышает скорость высвобождения цилостазола). В исследовании использовали стент размером 3,5×17 мм с резервуарами. Каждый лекарственный препарат помещали в резервуар отдельно, располагая резервуары с препаратами в шахматном порядке. Основной компонент наполнения каждого резервуара составляла основа (люминальная сторона стента), включающая только полимер (PLGA75/25) без препарата, лекарственная матрица, содержащая или 120,4 микрограмм цилостазола и 197,1 микрограмм полимера (PLGA75/25), или 146,9 микрограмм сиролимуса и 175,0 микрограмм полимера (PLGA75/25) и крышка, содержащая только полимер (PLGA75/25). Стент помещали в стандартную модель коронарной артерии свиньи для оценки в условиях in vivo кинетики высвобождения и концентрации в ткани обоих лекарственных препаратов, высвобождаемых из стента с течением времени.
На фигуре 19 представлено графическое изображение кривых кинетики высвобождения для ATL-359 в течение шести (6) дней по данным исследования кинетики высвобождения в условиях in vitro. Это исследование проводили использованием стента размером 3,5×17 мм. Для определения профиля высвобождения препарата использовался инструмент USP-7 и среда высвобождения - фосфатно-солевой буферный раствор, содержащий 4 процента по массе бычьего сывороточного альбумина при температуре 37°C. Кривая 1902 характеризует кинетику высвобождения для соотношения препарата (ATL-359) и полимера (PLGA75/25), или соотношения D/P, равного 50/50. Кривая 1904 характеризует кинетику высвобождения для соотношения лекарственного препарата (ATL-359) и полимера (PLGA75/25), или соотношения D/P, равного 60/40. Кривая 1906 характеризует кинетику высвобождения для соотношения лекарственного препарата (ATL-359) и полимера (PLGA75/25), или соотношения D/P, равного 70/30. Кривая 1908 характеризует кинетику высвобождения для соотношения лекарственного препарата (ATL-359) и полимера (PLGA75/25), или соотношения D/P, равного 90/10. Как ожидалось, чем выше соотношение D/P, тем быстрее происходит элюирование препарата из стента. Исходя из этого, используя соотношение препарата и полимера, можно регулировать кинетику высвобождения препарата для соответствия желаемому профилю высвобождения, описываемому в этом документе.
Хотя показанные и описанные варианты осуществления считаются наиболее практичными и предпочтительными, очевидно, что специалистам в данной области представляются возможности отступления от конкретных описанных и показанных конструкций и способов, и их можно использовать, не выходя за пределы сущности и объема настоящего изобретения. Настоящее изобретение не ограничивается отдельными конструкциями, описанными и показанными в настоящем документе, но все его конструкции должны быть согласованы со всеми модификациями, которые могут входить в объем приложенной формулы изобретения.
Реферат
Изобретение относится к медицине. Описано медицинское устройство для местной доставки селективного агониста аденозиновых рецепторов в сочетании с другими лекарственными средствами, используется для уменьшения поражения миокарда после острого инфаркта миокарда. В максимально короткие сроки после острого инфаркта миокарда стент или другое подходящее устройство, заключающее в себе или способное доставить селективный агонист аденозиновых рецепторов, размещают в кровеносном сосуде, в котором возникло закупоривание, вызвавшее инфаркт. После размещения стент или другое внутрипросветное устройство расправляется для устранения закупорки и восстановления кровотока в определенной области, участке или объеме ткани сердца. В течение заданного периода времени селективный агонист аденозиновых рецепторов по отдельности или в сочетании с другими лекарственными средствами элюирует из стента или другого устройства в нижележащий коронарный кровоток, направляющийся к ткани сердца, пораженной гипоксией в течение времени, достаточного для снижения уровня поражения миокарда. Стенты значительно снижают частоту рестеноза. 12 з.п. ф-лы, 19 ил.
Формула
расширяющееся внутрипросветное устройство, выполненное для открытия и восстановления кровотока в кровеносном сосуде, который, по меньшей мере, частично закупорен, при этом расширяющееся внутрипросветное устройство имеет длину и диаметр в расширенном виде и множество сквозных резервуаров;
терапевтическую композицию количества селективного агониста аденозиновых рецепторов в комбинации с количеством по меньшей мере одного полимера, где терапевтическая композиция содержится в виде депо по меньшей мере в одном из сквозных резервуаров в расширяющемся внутрипросветном устройстве, где количества селективного агониста аденозиновых рецепторов и по меньшей мере одного полимера приводят к высвобождению селективного агониста аденозиновых рецепторов в сосудистое русло со скоростью по меньшей мере десять микрограммов в час в течение по меньшей мере четырех часов после восстановления кровотока в кровеносном сосуде; и при этом селективный агонист аденозиновых рецепторов присутствует в количестве от 0,2 до 2,75 микрограммов на квадратный миллиметр площади поверхности цилиндра, имеющего длину и диаметр, равные длине и диаметру расширяющегося внутрипросветного устройства; и
ингибитор фосфодиэстеразы, зафиксированный на расширяющемся внутрипросветном устройстве и предназначенный для элюирования по меньшей мере в одно: из сосудистого русла и окружающей ткани.

Комментарии