Новые гепариновые частицы и способы их применения - RU2576803C2
Код документа: RU2576803C2
Чертежи







Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается медицинских субстратов, содержащих иммобилизованные активные частицы (entities), сохраняющие свою биологическую активность после стерилизации. В частности, настоящее изобретение касается новых гепариновых частиц и способов их применения.
Уровень техники
Хорошо известны медицинские устройства, служащие заменителями кровеносных сосудов, в качестве синтетических и внутриглазных линз, электродов, катетеров и т.п. в организме и на теле или в виде экстракорпоральных устройств, предназначенных для подключения к организму для содействия при хирургических операциях или диализе. Однако применение биоматериалов в медицинских устройствах может вызывать отрицательные реакции организма, включая быстрое тромбогенное действие. В запуске отложения тромбоцитов и фибрина на поверхности биоматериалов играют роль различные белки плазмы. Эти действия ведут к сужению сосудов, которое затрудняет кровоток, а последующие воспалительные реакции могут привести к потере функции медицинского устройства. Для устройств, контактирующих с кровью, особый интерес представляют биологически активные частицы (entities), уменьшающие или ингибирующие образование тромбов на поверхности биоматериала и/или покрывающего материала. Предпочтительными антитромботическими средствами в общем являются гликозаминогликаны, причем особенно предпочтительны гепарин, аналоги и производные гепарина.
Для улучшения био- и гемосовместимости широко исследовали иммобилизацию на биоматериалах таких гликозаминогликанов, как гепарин. Считается, что механизм, ответственный за снижение тромбогенности гепаринизированных материалов, состоит в способности гепарина вызывать ускорение инактивации сериновых протеаз (ферментов свертывания крови) антитромбином III (АТIII). При этом АТIII образует комплекс с хорошо определенной пентасахаридной последовательностью в гепарине, подвергаясь конформационному изменению и тем самым усиливая способность АТIII к образованию ковалентной связи с активными центрами таких сериновых протеаз, как тромбин. Затем образовавшийся комплекс сериновая протеаза-АТIII отделяется от гепарина, оставляя его свободным для последующих циклов инактивации через каталитический процесс.
Иммобилизация на биоматериалах таких биологически активных частиц, как гепарин в биологически активной форме, включает оценку химизма частиц и биоматериала соответственно. В области медицинских устройств распространенными биоматериалами являются керамические, полимерные и/или металлические материалы. Эти материалы могут применяться для имплантируемых устройств, диагностических устройств или экстракорпоральных устройств. Для иммобилизации биологически активных частиц на биоматериале зачастую требуется модификация химического состава биоматериала. Такая модификация обычно осуществляется путем обработки поверхности биоматериала с образованием популяции химически реактивных молекул или групп с последующей иммобилизацией биологически активных частиц по соответствующей методике. Что касается других биоматериалов, то поверхность биоматериала покрывают материалом, содержащим введенные в него реактивные химические группы. Затем биологически активные частицы иммобилизируют на биоматериале через реактивные химические группы материала покрытия. Описан целый ряд схем нанесения покрытий на биоматериалы. Репрезентативные примеры биологически активных частиц, иммобилизованных на биоматериале с нанесенным покрытием, описаны в US 4,810,784; 5,213,898; 5,897,955; 5,914,182; 5,916,585; и 6,461,665.
При иммобилизации биологически активных соединений, композиций или частиц на биологической активности этих "биопрепаратов" может отрицательно сказаться процесс иммобилизации. Биологическая активность многих биопрепаратов зависит от конформации и структуры (т.е. первичной, вторичной, третичной и т.д.) биопрепарата в иммобилизованном состоянии. Наряду с тщательным выбором процесса иммобилизации могут потребоваться химические изменения биопрепарата для того, чтобы включить его в покрывающий материал с такой конформацией и структурой, которые сделают его достаточно активным для выполнения предназначенной ему функции.
Несмотря на оптимизацию схемы нанесения покрытия и иммобилизации, дополнительная обработка типа стерилизации может ухудшить биологическую активность иммобилизованного биопрепарата. Для имплантируемых медицинских устройств перед употреблением необходима стерилизация. Стерилизация также может потребоваться для диагностических устройств in vitro, чувствительных к загрязнению. Стерилизация таких устройств часто требует подвергать их высокой температуре, давлению и влажности, зачастую на протяжении нескольких циклов. В некоторых случаях в процесс стерилизации включают противомикробные стерилизаторы типа газообразного этиленоксида (EtO) или паров перекиси водорода. Наряду со стерилизацией механическое сжатие и расширение или длительное хранение иммобилизованного биопрепарата могут ухудшить его активность.
Существует потребность в медицинских устройствах с иммобилизованными на них биологически активными частицами, которые можно подвергать стерилизации, механическому сжатию и растяжению и/или хранению без существенной потери биологической активности. Такие медицинские устройства должны иметь биологически совместимые композиции или соединения, включенные вместе с иммобилизованными биологическими частицами, служащие для минимизации ухудшения биологической активности частиц при стерилизации, механическом сжатии и растяжении и/или при хранении. В некоторых случаях дополнительные биологически совместимые композиции или соединения могут увеличивать биологическую активность некоторых биологически активных частиц после процедуры стерилизации.
Раскрытие изобретения
Таким образом, настоящее изобретение охватывает медицинские субстраты, содержащие гепариновые частицы, иммобилизованные на субстрате. Гепариновые частицы по изобретению сохраняют значительную биологическую активность после иммобилизации, стерилизации, механического сжатия и растяжения и/или хранения по сравнению с другими покрытиями медицинских субстратов.
Одно воплощение изобретения составляют медицинские субстраты, содержащие гепариновые частицы, связанные с субстратом через по меньшей мере одну молекулу гепарина, причем связанные гепариновые частицы чувствительны к гепариназе. В другом воплощении субстрат выбирается из группы, состоящей из полиэтилена, полиуретана, силикона, полиамидных полимеров, полипропилена, политетрафторэтилена, пенополитетрафторэтилена, фторполимеров, полиолефинов, керамических материалов и биосовместимых металлов. В другом воплощении субстратом является пенополитетрафторэтилен. В другом воплощении биосовместимым металлом является никель-титановый сплав типа Nitinol. В другом воплощении субстрат является компонентом медицинского устройства. В другом воплощении медицинское устройство выбирается из группы, состоящей из трансплантатов, сосудистых трансплантатов, стентов, эндопротезов, раздвоенных трансплантатов, раздвоенных стентов, раздвоенных эндопротезов, пластырей, пробок, устройств для доставки лекарств, катетеров, отводов кардиостимуляторов, баллонов и вживленных сосудистых фильтров. В другом воплощении гепарин или его фрагменты после обработки гепариназой не будут обнаруживаться на субстрате.
Следующее воплощение изобретения составляют гепариновые частицы, содержащие по меньшей мере одну молекулу гепарина и по меньшей мере одну каркасную (core) молекулу таким образом, что при связывании гепариновых частиц на субстрате через по меньшей мере одну молекулу гепарина данные гепариновые частицы будут чувствительны к гепариназе. В одном воплощении каркасная молекула выбирается из группы, состоящей из белков (включая полипептиды), углеводородов, аминогликозидов, полисахаридов и полимеров. В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату по концевой точке. В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату петлеобразно.
Следующее воплощение изобретения составляют АТIII-связывающие частицы, содержащие каркасную молекулу, по меньшей мере одну полисахаридную цепь, присоединенную к каркасной молекуле, и по меньшей мере одну свободную концевую группировку альдегида на полисахаридной цепи. В одном воплощении полисахаридная цепь представлена гепарином или фрагментом гепарина. В другом воплощении каркасная молекула выбирается из группы, состоящей из белков (включая полипептиды), углеводородов, аминогликозидов, полисахаридов и полимеров. В другом воплощении субстрат выбирается из группы, состоящей из полиэтилена, полиуретана, силикона, полиамидных полимеров, полипропилена, политетрафторэтилена, пенополитетра-фторэтилена, фторсодержащих полимеров, полиолефинов, керамических материалов и биосовместимых металлов. В другом воплощении АТIII-связывающие частицы связаны на субстрате по концевой точке или петлеобразно. В другом воплощении субстрат является компонентом медицинского устройства.
Следующее воплощение изобретения составляет способ определения структуры гепариновых частиц, связанных с субстратом, который включает стадии обеспечения субстрата, содержащего гепариновые частицы, деполимеризации гепариновых частиц с образованием смеси растворимых фрагментов гепарина, выявления всех растворимых фрагментов гепарина в смеси методом колоночной хроматографии, идентификации каждого детектируемого фрагмента гепарина из предыдущей стадии, и выведения структуры гепариновых частиц из структур выявленных фрагментов гепарина. В одном воплощении деполимеризация осуществляется с помощью гепариназы. В другом воплощении колоночная хроматография представляет собой жидкостную хроматографию высокого разрешения на сильном анионообменнике (SAX-HPLC).
Следующее воплощение изобретения составляет система определения структуры гепариновых частиц, связанных с субстратом, которая включает раствор для деполимеризации, раствор метящего реагента и детектор. В другом воплощении раствор для деполимеризации содержит гепариназу. В другом воплощении раствор метящего реагента содержит толуидиновый синий и трис(4-метилтио)бензоат тербия. В другом воплощении детектор включает SAX-HPLC, эпифлуоресцентный микроскоп и абсорбционный спектроскоп.
Краткое описание чертежей
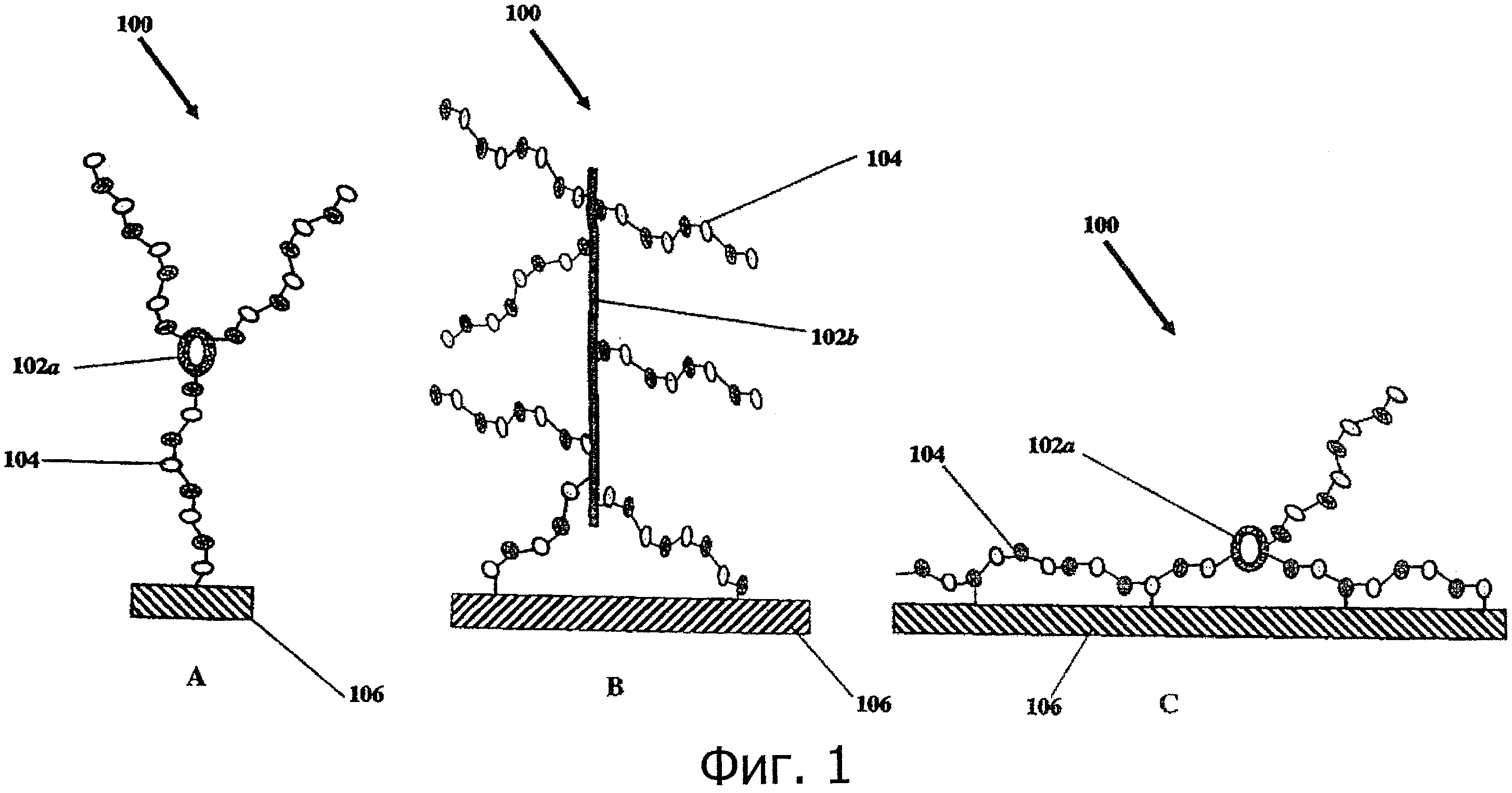
На фиг.1 представлено несколько гепариновых частиц по изобретению и способы прикрепления гепариновых частиц к субстрату.
На фиг.2 представлена АТIII-связывающая способность различных альдегидсодержащих гепариновых частиц, конъюгированных на пенополитетрафторэтилене (ePTFE) и подвергавшихся множественной стерилизации ЕtO. Альдегидсодержащие гепариновые частицы классифицированы по каркасной молекуле, использовавшейся при синтезе данных гепариновых частиц. При этом колистинсульфат в качестве каркасной молекулы относится к примеру 1, неомицин - к примеру 2, поли-L-лизин - к примеру 4, капреомицин - к примеру 3, полиэтиленимин (PEI) - к примеру 5, и этилендиамин (EDA) - к примеру 6. Все столбики означают средние значения образцов по номерам, а планки погрешностей - стандартное отклонение.
На фиг.3, А и В представлены световые микрофотографии гепариновых частиц, содержащих свободные концевые альдегиды и иммобилизованных на субстрате ePTFE методом прикрепления по одному концу, до (3А) и после (3В) обработки гепариназой-1 и окрашенных толуидиновым синим. Отсутствие окраски на фиг.3, В по сравнению с 3, А свидетельствует о том, что гепариновые частицы, содержащие свободные концевые альдегиды, иммобилизованные на субстрате ePTFE методом прикрепления по одному концу, в основном подверглись деполимеризации из поверхности после обработки гепариназой-1.
На фиг.3, С представлены нормализированные изменения яркости до и после обработки гепариназой-1 для гепарина, иммобилизованного через концевой альдегид и через множественные точки прикрепления, причем гепариновые частицы содержат каркас из неомицина, иммобилизованного через концевую точку и через множественные точки прикрепления по меньшей мере к одной молекуле гепарина, и для гепарина USP, иммобилизованного через множественные точки прикрепления. Низкие нормализованные значения изменений яркости для гепарина с концевым альдегидом, для гепариновых частиц, содержащих гепарин и неомициновый каркас с концевым альдегидом, и для гепарина USP со множественными точками прикрепления к субстрату означают, что их поверхности не чувствительны к гепариназе-1 и все еще содержат много гепарина на поверхности.
На фиг.4, А-С представлены световые микрофотографии гепариновых частицы, содержащих гепарин и каркас из EDA и иммобилизованных на субстрате ePTFE методом прикрепления по одному концу, до (4, А и 4, В) и после (4, С) обработки гепариназой-1 и окрашенных толуидиновым синим. Окрашивание образцов свидетельствуют о наличии гепариновых частиц. Образцы 4 В and 4С подвергали однократной стерилизации и промывали только деионизированной водой после стерилизации. Окраска на фиг.4С после стерилизации и обработки гепариназой-1 означает, что гепариназа-1 не распознает гепариновые частицы на поверхности.
На фиг.4, D и Е представлены световые микрофотографии гепариновых частиц, содержащих гепарин и каркас из EDA и иммобилизованных на субстрате ePTFE методом прикрепления по одному концу, до (4, D) и после (4, Е) обработки гепариназой-1 и окрашенных толуидиновым синим. Эти образцы подвергали однократной стерилизации и промывали деионизированной водой и борной кислотой после стерилизации. Отсутствие окраски на фиг.4, Е после стерилизации означает, что гепариназа-1 распознает гепариновые частицы на поверхности и подвергает их деполимеризации.
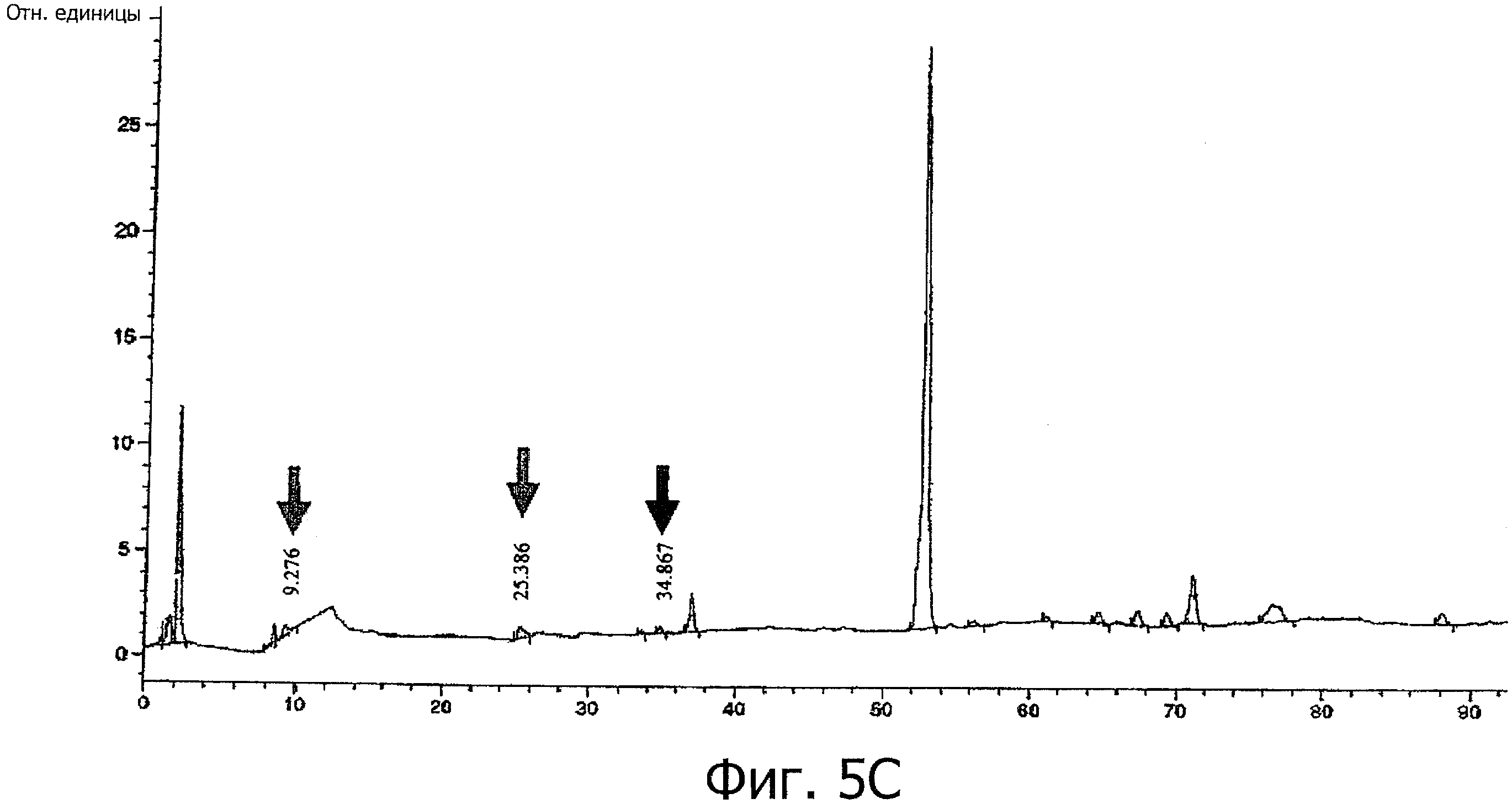
На фиг.5, А-С представлены хроматограммы SAX-HPLC при деполимеризации гепариназой-1 (А) гепарина USP, (В) гепариновых частиц, состоящих из гепарина и колистина сульфата, и (С) гепариновых частиц, состоящих из гепарина и неомицина сульфата.
На фиг.6, А и В представлены хроматограммы SAX-HPLC при деполимеризации гепариназой-1 иммобилизованных на поверхности ePTFE (А) гепарина USP, связанного по свободному концевому альдегиду, и (В) гепариновых частиц, состоящих из гепарина и колистина сульфата, связанных по свободным концевым альдегидам.
Осуществление изобретения
Настоящее изобретение касается медицинских субстратов, содержащих гепариновые частицы, иммобилизованные на субстрате. Гепариновые частицы по изобретению сохраняют значительную биологическую активность после иммобилизации и стерилизации по сравнению с другими медицинскими субстратами с покрытием.
В контексте данного изложения применяется ряд терминов. Представлены следующие определения. В настоящем изобретении и прилагаемой формуле изобретения формы единственного числа включают значения множественного числа, если только из контекста четко не вытекает иное.
В настоящем изобретении термином "гепариновые частицы (entities)" обозначаются молекулы гепарина, ковалентно присоединенные к каркасной молекуле. Такие молекулы гепарина могут присоединяться к каркасной молекуле по концевой точке (как описано ниже и в основном описано в US 4,613,665, включенном в виде ссылки на все случаи) или другими способами, известными в данной области (например, см. GT Hermanson, Bioconjugate Techniques, Academic Press, 1996; HG Garg et al., Chemistry and Biology of Heparin and Heparan Sulfate, Elsevier, 2005).
В настоящем изобретении термином "каркасная молекула" обозначается полифункциональная молекула, к которой присоединяется гепарин. В целях настоящего изобретения данная каркасная молекула и субстрат означают не одно и то же, хотя каркасная молекула и субстрат могут состоять из одного и того же материала.
В настоящем изобретении термином "существенно очищенный" обозначается то, что данная разновидность является преобладающей (т.е. в пересчете на моль она более распространена, чем любая другая индивидуальная разновидность в композиции), а предпочтительно существенно очищенной фракцией является композиция, в которой данная разновидность составляет по меньшей мере 50% (в молях) от всех присутствующих видов макромолекул. В общем, существенно очищенная композиция должна составлять более 80-90% от всех присутствующих в композиции видов макромолекул. Более предпочтительно, данная разновидность очищена практически до гомогенности (примеси в композиции не обнаруживаются обычными способами детекции), при этом композиция состоит практически из одного вида макромолекул.
В настоящем изобретении термином "гепариназа" обозначается любая энзиматическая реакция деполимеризации (т.е. расщепления) гепарина. Примеры гепариназ включают, без ограничения, гепариназу-1, гепариназу-2, гепариназу-3, гепараназы, экзосульфатазы, бактериальные экзоферменты и гликозидазы, которые способны деполимеризировать гепарин.
В настоящем изобретении термином "чувствительность к гепариназе" обозначается то, что после обработки гепариназой субстрата, содержащего гепариновые частицы, и окрашивания данного субстрата толуидиновым синим субстрат не должен заметно окрашиваться (в основном, как изображено на фиг.3, В и фиг.4, Е). Термин также означает то, что с остаточным гепарином или его фрагментами должно связываться незначительное количество толуидинового синего, а показания от детектора, способного измерить количество толуидинового синего (или других меток) на субстрате, как то спектрофотометра, люминометра, денситометра, жидкостного сцинтилляционного счетчика, гамма-счетчика и т.п., должно быть на уровне фона или незначительно отличаться от уровня фона при сравнении с субстратом без гепариновых частиц и окрашенным толуидиновым синим или же быть ниже чувствительности данного детектора при сравнении с субстратом, содержащим гепариновые частицы и окрашенным толуидиновым синим без обработки гепариназой. Термин также означает то, что метка, связывающаяся с гепарином или его фрагментами, не должна детектировать значительное количество гепарина или его фрагментов после обработки гепариназой субстрата, содержащего гепариновые частицы.
В настоящем изобретении термины "связанный", "присоединенный" или "конъюгированный" и их производные в отношении гепариновых частиц и/или гепарина означают ковалентно связанный, если не указано иначе.
Обращаясь к фиг 1, А-С, одно воплощение изобретения составляет медицинский субстрат, содержащий гепариновые частицы 100, связанные на субстрате 106 через по меньшей мере одну молекулу гепарина 104, причем связанные гепариновые частицы чувствительны к гепариназе. Подходящие материалы субстрата для иммобилизации или связывания гепариновых частиц составляют такие полимеры, без ограничения, как полиамиды, поликарбонаты, полиэфиры, полиолефины, полистирен, полиуретан, поли(эфиры уретана), поливинилхлориды, силиконы, полиэтилены, полипропилены, полиизопрены, политетрафторэтилены и пенополитетрафторэтилены (ePTFE, как описано в US 4,187,390). В одном воплощении субстратом является пено- или пористый политетрафторэтилен (ePTFE).
Дополнительные субстраты включают, без ограничения, гидрофобные субстраты, как то политетрафторэтилен, пенополитетрафторэтилен, пористый политетрафторэтилен, фторированный полиэтилен-пропилен, гексафторпропилен, полиэтилен, полипропилен, нейлон, полиэтилентерефталат, полиуретан, каучук, силиконовый каучук, полистирен, полисульфон, полиэфир, полигидроксикислоты, поликарбонат, полиимид, полиамид, полиаминокислоты, регенерированная целлюлоза и такие белки, как шелк, шерсть и кожа. Методы получения материалов из пористого политетрафторэтилена описаны в US 3,953,566 и 4,187,390, каждый из которых включен в виде ссылки. В другом воплощении данный ePTFE может быть инпрегнирован, заполнен, пропитан или покрыт по меньшей мере одним химическим соединением, вызывающим биоактивный ответ. Соединения, вызывающие биоактивный ответ, включают противомикробные (например, противобактериальные и противовирусные), противовоспалительные (например, дексаметазон и преднизон), антипролиферативные (например, таксол, паклитаксель и доцетаксель) и антикоагулирующие средства (например, абциксимаб, эптифибатид и тирофибран). В одном воплощении противовоспалительным средством является стероид. В другом воплощении стероид представлен дексаметазоном. Способы покрытия субстратов хорошо известны в данной области. В другом воплощении субстрат включает гепариновые частицы по изобретению и покрытие, содержащее соединение, вызывающее биоактивный ответ. Такой субстрат включает материалы, приведенные выше и ниже. В одном воплощении субстрат представлен ePTFE.
Другими подходящими субстратами являются, без ограничения, производные целлюлозы, агароза, альгинат, полигидроксиэтилметакрилат, поливинилпирролидон, поливиниловый спирт, полиаллиламин, полиаллиловый спирт, полиакриламид и полиакриловая кислота.
Кроме того, в качестве субстратов в настоящем изобретении могут применяться некоторые металлы и керамические вещества. Подходящими металлами являются, без ограничения, титан, нержавеющая сталь, золото, серебро, родий, цинк, платина, рубидий и медь, к примеру. Подходящими сплавами являются сплавы кобальта и хрома типа L-605, MP35N, Elgiloy, сплавы никеля и хрома (как-то Nitinol) и такие сплавы ниобия, как Nb-1% Zr и др.
Подходящими материалами для керамических субстратов являются, без ограничения, оксиды кремния, оксиды алюминия, глинозем, кремнезем, гидроксиапатиты, стекла, оксиды кальция, полисиланолы и оксиды фосфора. В другом воплощении могут применяться субстраты на основе белков типа коллагена. В другом воплощении могут применяться субстраты на основе полисахаридов типа целлюлозы.
Некоторые субстраты могут иметь множество реактивных химических групп, заполняющих по меньшей мере часть их поверхности, с которыми могут связываться гепариновые частицы по изобретению. Гепариновые частицы по изобретению ковалентно связываются с материалом субстрата через данные реактивные химические группы. Поверхности этих субстратов могут быть гладкими, неровными, пористыми, изогнутыми, плоскими, угловатыми, неправильной формы или комбинированными. В некоторых воплощениях субстраты с порами на поверхности содержат внутренние пустые пространства, простирающиеся от пористой поверхности материала вглубь материала. Эти пористые субстраты содержат внутренний материал субстрата, окаймляющий поры, который часто составляет поверхность, пригодную для иммобилизации биологически активных молекул. И пористые, и непористые субстраты могут иметь вид нитей, пленок, листов, трубочек, ячеек, сетчатых и несетчатых структур и их комбинаций.
Субстраты без реактивных химических групп на их поверхностях (или не имеющие соответствующих реактивных химических групп) могут быть покрыты, по меньшей мере частично, полимерным покрывающим материалом, несущим множество реактивных химических групп, с которыми могут связываться гепариновые частицы. Полимерные субстраты также могут быть модифицированы вдоль их поверхности или вдоль их полимерного остова различными методами, включая гидролиз, аминолиз, фотолиз, травление, плазменную модификацию, плазменную полимеризацию, введение карбенов, введение нитренов и т.д. Гепариновые частицы ковалентно прикрепляются к или связываются с полимерным покрывающим материалом через реактивные химические группы покрывающего материала или непосредственно с субстратом, подвергавшимся модификации. Полимерный покрывающий материал может образовывать по меньшей мере один слой по крайней мере на части субстрата.
Существует много других модификаций поверхности типа тех, что описаны в US 4,600,652 и US 6,642,242, на основе субстратов со слоем полиуретанмочевины, с которыми может связываться ковалентными связями гепарин, содержащий альдегидные группы после модификации путем окисления азотистой кислотой или периодатом. Подобная технология описана в US 5,032,666, в котором поверхность субстрата покрывается богатой аминами фторированной полиуретан-мочевиной перед иммобилизацией антитромбогенного агента типа активированного альдегидами гепарина. Другая антитромбогенная модификация поверхности, которую можно привести, описана в публикации WO 87/07156. Поверхность устройства подвергается модификации путем покрытия слоем лизоцима или его производного, на который налипает гепарин. Еще одна модификация поверхности для получения антитромбогенных изделий описана в US 4,326,532. В этом случае покрытая антитромбогенным слоем поверхность содержит полимерный субстрат, хитозан, связанный с полимерным субстратом, и антитробогенный агент, связанный с хитозановым покрытием. Другие сообщали об антитромбогенном гемофильтре тоже с хитозановым слоем для связывания гепарина. Другой способ получения антитромбогенных поверхностей описан в WO 97/07834, при этом гепарин смешивают с достаточным количеством периодата с тем, чтобы прореагировало не более двух сахаридных звеньев на молекулу гепарина. Эта смесь наносится на поверхность модифицированного субстрата медицинского устройства, при этом данная модификация поверхности содержит аминогруппы. Вышеприведенные способы добавления реактивных групп к субстратам составляют лишь небольшой пример того, как это может осуществляться. Вышеприведенный перечень никоим образом не является полным. Более того, ясно, что тип процесса, используемого для добавления реактивных химических групп к субстрату, зависит от свойств субстрата, известных специалистам в данной области.
В другом воплощении изобретения данный медицинский субстрат, содержащий гепариновые частицы, связанные через по меньшей мере одну молекулу гепарина, являются компонентом медицинского устройства. Медицинские устройства включают, без ограничения, трансплантаты, сосудистые трансплантаты, стенты, эндопротезы, раздвоенные трансплантаты, раздвоенные стенты, раздвоенные эндопротезы, грыжевые пластыри, грыжевые пробки, периодонтальные трансплантаты, хирургические ткани, устройства доставки лекарств, катетеры, отводы кардиостимуляторов, баллоны и вживленные фильтры. В одном воплощении стенты могут применяться в кардиологических, периферических или неврологических применениях. В другом воплощении эндопротезы могут применяться в кардиологических, периферических или неврологических применениях.
Другое воплощение изобретения составляют гепариновые частицы, содержащие по меньшей мере одну молекулу гепарина и по меньшей мере одну каркасную молекулу. Как видно из фиг.1, каркасная молекула 102 является "остовом" гепариновой частицы 100, с которым связаны молекулы гепарина 104. Каркасная молекула 102 может быть циклической (102а, фиг.1, А и 1, С), линейной (102b, фиг.1, В), разветвленной, древовидной, Y-образной, Т-образной или "звездчатой", как описано в Freudenberg U., Biomaterials, 30, 5049-5060, 2009; и Yamaguchi N., Biomacromolecules, 6, 1921-1930, 2005. В одном воплощении каркасная молекула выбирается из группы, состоящей из белков (включая полипептиды), углеводородов, липидов, аминогликозидов, полисахаридов и полимеров. Белки включают, без ограничения, антитела, ферменты, рецепторы, факторы роста, гормоны, серпины и другие глобулярные белки. Специфические белки и полипептиды включают, без ограничения, альбумин, колистин, коллаген, полилизин, антитромбин III, фибрин, фибриноген, тромбин, ламинин, кератин и т.п. В другом воплощении каркасная молекула может представлять собой полипептид. Такой полипептид необязательно является длинным и может содержать один или несколько повторов аминокислот, к примеру повторов остатков серина, глицина (например, Ser-Gly-Gly-Ser-Gly), лизина или орнитина. С другой стороны, можно использовать и другие последовательности аминокислот, к примеру колистин, полилизин и полимиксин.
Примеры полисахаридов включают, без ограничения, нейтральные полисахариды, такие как целлюлоза, крахмал, агароза, карбоксиметилцеллюлоза, нитроцеллюлоза и декстран, анионные полисахариды, такие как альгинат, гепарин, гепаринсульфат, декстрансульфат, ксантан, гиалуроновая кислота, каррагенан, гумимиарабик, трагакант, арабиногалактан и пектин; макроциклические полисахариды, такие как циклодекстрин и гидроксипропилциклодекстрин; и поликатионные полисахариды, такие как хитин и хитозан.
Примеры синтетических полимеров включают, без ограничения, полиэтиленгликоль (ПЭГ) 200, 300, 400, 600, 1000, 1450, 3350, 4000, 6000, 8000 и 20000, политетрафторэтилен, полипропиленгликоль, поли(этиленгликоль-с-пропиленгликолем), сополимеры полиэтиленгликоля, сополимеры полипропиленгликоля, сополимеры тетрафторэтилена с винилацетатом и виниловым спиртом, сополимеры этилена с винил ацетатом и виниловым спиртом, поливиниловым спиртом, полиэтиленимином, полиакриловой кислотой; полиоли, такие как поливиниловый спирт и полиаллиловый спирт; полианионы, такие как акриловая кислота и полиметакриловая кислота. Поликатионные полимеры включают полиаллиламин, полиэтиленимин, полигуанидин, поливиниламин, полиэтиленгликоль-диамин, этилендиамин и поличетвертичные амины; полиакрилонитрилы, такие как гидролизованный полиакрилонитрил, полиакриламид-с-акрилонитрилом и их сополимеры. Другие полимеры включают фторированные сополимеры, в том числе сополимеры тетрафторэтилена и винилового спирта, винил-ацетата, винилформамида, акриламида и виниламина. В другом воплощении каркасная молекула может представлять собой аминогликозид, включая, без ограничения, амикацин, арбекацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, родо-стсрептомицин, стрептомицин, тобрамицин и апрамицин.
Гепарин - это мукополисахарид, выделенный из кишечника свиньи или легких быка, и он гетерогенен по молекулярному размеру и химической структуре. Гепарин состоит из чередующихся звеньев глюкуроновой кислоты и глюкозамина. Звенья глюкуроновой кислоты состоят из D-глюкуроновой кислоты и L-идуроновой кислоты. Они соединяются по D- и L-(1,4), соответственно, со звеньями D-глюкозамина. Большая часть остатков L-идуроновой кислоты сульфатирована в положении 2. Звенья D-глюкозамина N-сульфатированы, сульфатированы в положении 6 и соединяются по α-(1,4) с остатками уроновой кислоты. Некоторые звенья D-глюкозамина также сульфатированы в положении 3. Гепарин содержит материал с молекулярным весом в пределах от 6000 дальтон до 30000 дальтон. Гидроксильные и аминогруппы в различной степени подвергаются сульфатированию и ацетилированию. Активная последовательность гепарина, отвечающая за его антикоагулирующие свойства, представлена уникальной пентасахаридной последовательностью, которая связывается со своим лигандом антитромбином III (АТIII). Последовательность состоит из трех остатков D-глюкозамина и двух остатков уроновой кислоты. Молекулы гепарина также можно классифицировать по содержанию пентасахарида. Примерно одна треть гепарина содержит цепи с одной копией уникальной последовательности пентасахарида (см. Choay, Seminars in Thrombosis and Hemostasis 11:81-85 (1985), включено в виде ссылки) с высоким сродством к АТIII, тогда как гораздо меньшая часть (оценивается на уровне 1% от всего гепарина) состоит из цепей, содержащих более одной копии пентасахарида с высоким сродством (см. Rosenberg et al, Biochem. Biophys. Res. Comm. 86:1319-1324 (1979), включено в виде ссылки). Остальной (прибл. 66%) гепарин не содержит последовательности пентасахарида. Таким образом, так называемый "стандартный гепарин" составляет смесь из трех разновидностей: "высокоаффинный" гепарин обогащен молекулами, содержащими по меньшей мере одну копию пентасахарида, и "очень высокоаффинный" гепарин составляет около 1% молекул, содержащих более одной копии последовательности пентасахарида. Эти три разновидности можно отделить друг от друга обычными методами хроматографии, как то аффинной хроматографии через колонку с антитромбином (например, Сефарозой-АТ; например, см. Lam et al., Biochem. Biophys. Res. Comm. 69:570-577 (1976); и Homer, Biochem. J. 262:953-958 (1989), которые включены в виде ссылки).
В одном воплощении гепарин получают из животных. В другом воплощении гепарин получают из быка или свиньи. В следующем воплощении гепарин представлен синтетическим гепарином, т.е. он не происходит из животного источника (например, фондапаринукс или еноксапарин). В другом воплощении гепариновые частицы по изобретению содержат гепарин, который подвергался очистке и содержит практически чистый "высокоаффинный" гепарин. В другом воплощении гепариновые частицы по изобретению содержат гепарин, который подвергался очистке и содержит комбинацию из практически чистого "высокоаффинного" и "очень высокоаффинного" гепарина.
Другое воплощение изобретения составляет связывание гепариновых частиц с медицинским субстратом через по меньшей мере одну молекулу гепарина. Как видно из фиг.1, гепариновые частицы изобретения связываются с субстратом через по меньшей мере одну молекулу гепарина. Так, в одном воплощении связанная молекула гепарина прикрепляется к субстрату по концевой точке (как изображено на фиг.1, А и 1, В). В другом воплощении связанная молекула гепарина прикрепляется к субстрату через концевой альдегид. Это может осуществляться в основном, как описано в US 4,613,665, который включен в виде ссылки во всей полноте, и как описано ниже.
В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату "петлеобразно". Петлеобразное прикрепление, как показано на фиг.1, С, это такое прикрепление гепариновых частиц через по меньшей мере один гепарин, при котором гепарин слабо связан с субстратом по немногим местам, тем самым позволяя значительной части связанного гепарина подвергаться действию гепариназы (в отличие от более распространенных способов, когда гепарин тесно связан по многим местам). Более распространенные методы прикрепления гепарина к субстрату включают реакцию с большинством функциональных групп, случайным образом расположенных по всей длине молекулы гепарина (например, с помощью конденсирующих реагентов, таких как карбодиимиды, эпоксиды и полиальдегиды). Эти методы дают высокую вероятность того, что активная последовательность (уникальная пентасахаридная последовательность, описанная выше) будет связываться с субстратом, что приводит к снижению и/или потере активности. При петлеобразном прикреплении гепарина лишь небольшое количество функциональных групп гепарина реагирует и связывается с субстратом. Таким образом, существует высокая вероятность того, что активная последовательность прикрепленного гепарина не будет связываться с субстратом, что позволит ей связываться со своим лигандом. В другом воплощении изобретение охватывает гепариновые частицы с множественным прикреплением к субстрату, при этом активная последовательность не связывается с субстратом. В другом воплощении молекула гепарина, связывающая гепариновую частицу с субстратом, прикрепляется к субстрату петлеобразно.
Как изложено выше, прикрепление по концевой точке и петлеобразное прикрепление дает возможность значительной части молекул гепарина (в гепариновой частице) не связываться с субстратом. В настоящем изобретении термин "значительная часть" означает, что около 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% и 99% молекул гепарина не связываются с субстратом. В другом воплощении термин также означает то, что по меньшей мере одна молекула гепарина (в гепариновой частице) из числа связанных с субстратом связывается с субстратом не через свою активную последовательность. Таким образом, поскольку активная последовательность не связана с поверхностью субстрата, то она с большей вероятностью будет взаимодействовать со своим лигандом. Иными словами, если активная последовательность связана с поверхностью субстрата, то у гепарина будет очень мало шансов для связывания со своим лигандом.
Однако поскольку гепариновые частицы прикрепляются через гепарин посредством концевых и/или петлеобразных связей, то гепарин будет чувствителен к гепариназе. Таким образом, после обработки гепариназой на поверхности субстрата останется очень немного или вообще не будет гепарина или его фрагментов. В противоположность этому, при некоторых наиболее распространенных способах прикрепления гепарина к поверхности субстрата (содержащей множественные связи по всей молекуле гепарина, как описано выше) после обработки гепариназой останется значительное количество гепарина или его фрагментов, прикрепленных к поверхности субстрата. Таким образом, после обработки гепариназой на поверхности субстрата будет выявляться гепарин или его фрагменты. Не придерживаясь какой-либо определенной теории, авторы изобретения открыли, что чем более чувствительным к гепариназе является связанный гепарин или гепариновые частицы, тем большую биологическую активность они проявляют. Это может быть следствием того, что активная последовательность связанного гепарина или гепариновых частиц не прикреплена к поверхности субстрата, поэтому у связанного гепарина или гепариновых частиц имеется больше шансов для связывания со своим лигандом.
Гепарин должен иметь интактную конформацию и структуру для того, чтобы его разпознавал АТIII, а если такая конформация и структура теряется, то гепарин будет проявлять слабую активность. К тому же потеря такой конформации и структуры ослабляет распознавание другими белками, такими как гепариназа-1, что приводит к устойчивости гепарина к деполимеризации. Например, модификация растворимого гепарина карбодиимидом изменяет структуру растворимого гепарина таким образом, что он больше не распознается гепариназой-1, а модифицированный растворимый гепарин проявляет снижение антикоагулирующей активности в цельной крови (см. Olivera G.B., Biomaterials, 24, 4777-4783, 2003). Авторы изобретения открыли, что чувствительность к гепариназе прикрепленного гепарина или гепариновых частиц предсказывает АТIII-связывающую активность данного прикрепленного гепарина или гепариновых частиц. Не придерживаясь какой-то определенной теории, если прикрепленный гепарин или гепариновые частицы сохраняют специфичность к определенным ферментам типа гепариназы-1, то прикрепленный гепарин или гепариновые частицы в значительной степени сохраняют первичную/вторичную/третичную структуру и будут обладать специфичностью к АТIII. Таким образом, авторы изобретения открыли, что если прикрепленный гепарин или гепариновые частицы распознаются гепариназой-1, то данный прикрепленный гепарин или гепариновые частицы также распознаются АТIII, о чем свидетельствует высокая активность связывания.
Авторы изобретения также показали, что промывание борной кислотой восстанавливает чувствительность к гепариназе у инактивированного прикрепленного гепарина или гепариновых частицы (инактивированных при стерилизации, механическом сжатии и растяжении или длительном хранении, к примеру). Так, следующее воплощение изобретения составляет способ восстановления чувствительности к гепариназе у гепарина или гепариновых частиц, связанных на субстрате, который включает промывание данного субстрата раствором борной кислоты. В одном воплощении субстрат подвергается циклу стерилизации. В другом воплощении субстрат подвергается механической обработке, снижающей активность гепариназы-1.
В следующем воплощении изобретения после обработки гепариназой медицинского субстрата со связанными гепариновыми частицами на данном субстрате не будет выявляться гепарин или его фрагменты. В другом воплощении после обработки гепариназой медицинского субстрата со связанными гепариновыми частицами гепарин или его фрагменты будут выявляться на значительно более низком уровне, чем до обработки гепариназой. Значительно более низкий уровень выявления означает очень слабое выявление после окрашивания и/или мечения на гепарин.
В следующем воплощении гепарин или его фрагменты не будут выявляться визуально (макроскопически) после окрашивания или включения метки. Гепарин или его фрагменты могут выявляться такой меткой, которая прямо или косвенно связывается с гепарином или его фрагментами. В одном воплощении такая метка, которая связывается с гепарином или его фрагментами, выбирается из группы, состоящей из красителей, антител и белков. Примеры меток включают, без ограничения, белки, включая антитела против гепарина (поликлональные или моноклональные) и АТIII; метахроматические красители, включая толуидиновый синий, азур А, альциановый синий, victoria blue 4R, night blue, метиленовый синий; метки с радиоактивным йодом, включая радиойодный толуидиновый синий, радиойодный метиленовый синий, радиойодные антитела к гепарину, радиойодный АТIII; тритиевые метки, включая тритиевый толуидиновый синий, тритиевый азур А, тритиевый альциановый синий, тритиевый victoria blue 4R, тритиевый night blue, тритиевый метиленовый синий; метки с углеродом-14, включая14С-толуидиновый синий,14С-азур А,14С-альциановый синий,14C-victoria blue 4R,14C-night blue,14С-метиленовый синий; флуоресцентные метки, включая меченные родамином антитела к гепарину, меченные флуоресцеином антитела к гепарину, меченный родамином АТIII, меченный флуоресцеином АТIII. В другом воплощении красителем является толуидиновый синий. В другом воплощении после обработки гепариназой с гепарином или его фрагментами будет связываться незначительное количество толуидинового синего, но он не будет визуально выявляться на данном субстрате (в основном так, как представлено на фиг.3, В и 4, Е). В другом воплощении после обработки гепариназой с остаточным гепарином или его фрагментами будет связываться незначительное количество толуидинового синего, а показания детектора, измеряющего количество толуидинового синего (или других меток, описанных выше) на субстрате (например, спектрофотометра, люминометра, денситометра, жидкостного сцинтилляционного счетчика, гамма-счетчика и т.п.), будут на уровне фона или будут незначительно отличаться от уровня фона по сравнению с субстратом без гепариновых частиц. В другом воплощении после обработки гепариназой показания детектора, измеряющего количество толуидинового синего (или других меток, описанных выше) на субстрате, будут значительно отличаться по сравнению с субстратом, содержащим гепариновые частицы и окрашенным толуидиновым синим (или другими метками, описанными выше) без обработки гепариназой.
Следующее воплощение изобретения составляют гепариновые частицы, содержащие по меньшей мере одну молекулу гепарина, присоединенную к каркасной молекуле, причем частицы связаны с субстратом через молекулу гепарина и при этом после обработки гепариназой и толуидиновым синим на субстрате макроскопически почти не выявляется толуидиновый синий на его поверхности (как представлено на фиг.3, В и фиг.4, Е).
Следующее воплощение изобретения составляют гепариновые частицы, содержащие по меньшей мере одну молекулу гепарина и одну каркасную молекулу таким образом, что при связывании гепариновой частицы на субстрате через по меньшей мере одну молекулу гепарина данная гепариновая частица будет чувствительной к гепариназе. В одном воплощении субстрат выбирается из группы, состоящей из полиэтилена, полиуретана, силикона, полиамидных полимеров, полипропилена, политетрафторэтилена, пенополитетрафторэтилена, биосовместимых металлов, керамических материалов, белков, полисахаридов и любых субстратов, описанных выше. В другом воплощении субстрат представлен пенополитетрафторэтиленом. В другом воплощении субстрат является компонентом медицинского устройства. В другом воплощении медицинское устройство выбирается из группы, состоящей из трансплантатов, сосудистых трансплантатов, стентов, эндопротезов, раздвоенных трансплантатов, раздвоенных стентов, раздвоенных эндопротезов, пластырей, пробок, устройств доставки лекарств, катетеров и отводов кардиостимуляторов. В другом воплощении стенты могут применяться в кардиологических, периферических или неврологических применениях. В другом воплощении эндопротезы могут применяться в кардиологических, периферических или неврологических применениях. В другом воплощении медицинские устройства могут применяться в ортопедических, дерматологических или гинекологических применениях. В другом воплощении каркасная молекула составляет циклическую, линейную, разветвленную, древовидную, Y-образную, Т-образную или звездчатую молекулярную структуру. В другом воплощении каркасная молекула выбирается из группы, состоящей из белков, полипептидов, углеводородов, полисахаридов, аминогликозидов, полимеров и фторполимеров.
В следующем воплощении гепарин или его фрагменты выявляются по меткам, связывающимся с гепарином или его фрагментами. В другом воплощении метка, связывающаяся с гепарином или его фрагментами, выбирается из группы, состоящей из красителей, поликлональных антител и белков. В другом воплощении красителем является толуидиновый синий. В другом воплощении после обработки гепариназой с остаточным гепарином или его фрагментами будет связываться незначительное количество толуидинового синего и он не будет выявляться визуально на данном субстрате. В другом воплощении после обработки гепариназой с остаточным гепарином или его фрагментами будет связываться незначительное количество толуидинового синего, а показания детектора, измеряющего количество толуидинового синего (или других меток, описанных выше) на субстрате (например, спектрофотометра, люминометра, денситометра, жидкостного сцинтилляционного счетчика, гамма-счетчика и т.п.), будут на уровне фона или будут незначительно отличаться от уровня фона по сравнению с субстратом без гепариновых частиц. В другом воплощении после обработки гепариназой показания детектора, измеряющего количество толуидинового синего (или других меток, описанных выше) на субстрате, будут значительно отличаться по сравнению с субстратом, содержащим гепариновые частицы и окрашенным толуидиновым синим (или другими метками, описанными выше) без обработки гепариназой.
В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату через концевую связь. В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату через концевой альдегид. В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату петлеобразно. В другом воплощении гепариновые частицы связаны на субстрате через по меньшей мере одну молекулу гепарина, причем связанная молекула гепарина прикрепляется к субстрату через альдегиды по всей длине гепарина.
Следующее воплощение изобретения составляют АТIII-связывающие частицы, содержащие каркасную молекулу, полисахаридную цепь, присоединенную к каркасной молекуле, и свободную концевую группировку альдегида на полисахаридной цепи. При этом такие АТIII-связывающие частицы могут прикрепляться к субстрату по концевой точке через концевой альдегид. Следующее воплощение изобретения составляют АТIII-связывающие частицы, содержащие каркасную молекулу, полисахаридную цепь, присоединенную к каркасной молекуле, и свободные концевые группировки альдегида по всей длине полисахаридной цепи. При этом такие АТIII-связывающие частицы могут прикрепляться к субстрату петлеобразно через альдегиды по всей длине полисахаридной цепи. В другом воплощении полисахаридная цепь представлена гепарином. В другом воплощении каркасная молекула выбирается из группы, состоящей из белков, полипептидов, углеводородов, аминогликозидов, полимеров, фторполимеров или других описанных здесь каркасных молекул. В другом воплощении гепарин связан с каркасной молекулой через концевое соединение. В другом воплощении субстрат выбирается из группы, состоящей из полиэтилена, полиуретана, силикона, полиамидных полимеров, полипропилена, политетрафторэтилена, пенополитетрафторэтилена и биосовместимых металлов или любых описанных здесь субстратов. В другом воплощении биосовместимый металл представляет собой Nitinol. В другом воплощении субстратом является пенополитетрафторэтилен. В другом воплощении субстрат является компонентом медицинского устройства. В другом воплощении медицинское устройство выбирается из группы, состоящей из трансплантатов, сосудистых трансплантатов, стентов, эндопротезов, раздвоенных трансплантатов, раздвоенных стентов, раздвоенных эндопротезов, пластырей, пробок, устройств доставки лекарств, катетеров и отводов кардиостимуляторов. В другом воплощении медицинское устройство может применяться в кардиологических, периферических, неврологических, ортопедических, гинекологических или дерматологических применениях.
Следующее воплощение изобретения составляют имплантируемые медицинские устройства, содержащие медицинский субстрат, причем медицинский субстрат содержит гепариновые частицы, связанные на субстрате через по меньшей мере одну молекулу гепарина, причем гепариновые частицы чувствительны к гепариназе. В одном воплощении медицинское устройство выбирается из группы, состоящей из трансплантатов, сосудистых трансплантатов, стентов, эндопротезов, раздвоенных трансплантатов, раздвоенных стентов, раздвоенных эндопротезов, пластырей, пробок, устройств доставки лекарств, катетеров и отводов кардиостимуляторов. В другом воплощении стенты могут применяться в кардиологических, периферических или неврологических применениях. В другом воплощении стенты могут представлять собой раздвигаемый баллоном и/или самораздвижной стент. Стенты могут состоять из любого биосовместимого материала, включая любые полимеры или металлы, как описано выше. В другом воплощении стенты состоят из Nitinol и/или нержавеющей стали. В другом воплощении стенты содержат трансплантаты. В другом воплощении трансплантаты и/или стенты содержат гепариновые частицы по изобретению.
Гепариновые частицы по изобретению сохраняют значительную биологическую активность после иммобилизации и стерилизации по сравнению с другими покрытиями медицинских субстратов. Так, в одном воплощении медицинский субстрат содержит гепариновые частицы, связанные на субстрате через по меньшей мере одну молекулу гепарина, причем связанные гепариновые частицы чувствительны к гепариназе и обладают АТIII-активностью примерно в 300 пмоль/см2. В другом воплощении АТIII-активность составляет 250 пмоль/см2, 200 пмоль/см2, 150 пмоль/см2, 100 пмоль/см2, 50 пмоль/см2, 40 пмоль/см2, 30 пмоль/см2, 20 пмоль/см2, 10 пмоль/см2 или около 5 пмоль/см2. В другом воплощении после первого цикла стерилизации АТIII-активность медицинского субстрата составляет 250 пмоль/см2, 200 пмоль/см2, 150 пмоль/см2, 100 пмоль/см2, 50 пмоль/см2, 40 пмоль/см2, 30 пмоль/см2, 20 пмоль/см2, 10 пмоль/см2 или около 5 пмоль/см2. В другом воплощении после второго цикла стерилизации АТIII-активность медицинского субстрата составляет 100 пмоль/см2, 90 пмоль/см2, 80 пмоль/см2, 70 пмоль/см2, 60 пмоль/см2, 50 пмоль/см2, 40 пмоль/см2, 30 пмоль/см2, 20 пмоль/см2, 10 пмоль/см2 или около 5 пмоль/см2. В другом воплощении после третьего цикла стерилизации АТIII-активность медицинского субстрата составляет 50 пмоль/см2, 70 пмоль/см2, 60 пмоль/см2, 50 пмоль/см2, 40 пмоль/см2, 30 пмоль/см2, 20 пмоль/см2, 10 пмоль/см2 или около 5 пмоль/см2. Способы оценки АТIII-активности хорошо известны в данной области и по меньшей мере один описан ниже. В другом воплощении гепариновые частицы по изобретению сохраняют значительную биологическую активность после сжатия и растяжения медицинского устройства. В другом воплощении гепариновые частицы по изобретению сохраняют значительную биологическую активность после хранения медицинских устройств в сжатом и/или растянутом состоянии.
Следующее воплощение изобретения составляют способы определения структуры гепариновых частиц, связанных с субстратом. Один способ определения структуры гепариновых частиц, связанных с субстратом, включает стадии: обеспечения субстрата, содержащего гепариновые частицы, деполимеризации гепариновых частиц с образованием смеси растворимых фрагментов гепарина, выявления всех растворимых фрагментов гепарина в смеси методом колоночной хроматографии, определения идентичности каждого из выявленных растворимых фрагментов гепарина из предыдущей стадии и выведения структуры гепариновых частиц из идентичностей выявленных растворимых фрагментов гепарина. В одном воплощении деполимеризация осуществляется с помощью гепариназы-1. В другом воплощении колоночная хроматография представляет собой жидкостную хроматографию высокого разрешения на сильном анионообменнике или SAX-HPLC.
Следующее воплощение изобретения составляют имплантируемые медицинские устройства, содержащие медицинский субстрат, причем медицинский субстрат содержит гепариновые частицы, связанные на субстрате через по меньшей мере одну молекулу гепарина, причем связанные гепариновые частицы чувствительны к гепариназе. В одном воплощении медицинское устройство выбирается из группы, состоящей из трансплантатов, сосудистых трансплантатов, стентов, эндопротезов, раздвоенных трансплантатов, раздвоенных стентов, раздвоенных эндопротезов, пластырей, пробок, устройств доставки лекарств, катетеров, отводов кардиостимуляторов, баллонов и вживленных фильтров. В другом воплощении стенты могут применяться в кардиологических, периферических или неврологических применениях. В другом воплощении стенты могут представлять собой раздвигаемый баллоном и/или самораздвижной стент. Стенты могут состоять из любого биосовместимого материала, включая любые полимеры или металлы, как описано выше. В другом воплощении стенты состоят из Nitinol и/или нержавеющей стали. В другом воплощении стенты содержат трансплантаты. В другом воплощении трансплантаты и/или стенты содержат гепариновые частицы по изобретению.
Следующее воплощение изобретения составляют способы определения пространственного распределения гепариновых частиц, связанных с субстратом. Один из способов определения пространственного распределения гепариновых частиц, связанных с субстратом, включает стадии: обеспечения субстрата, содержащего гепариновые частицы, деполимеризации гепариновых частиц с образованием поверхности, содержащей связанные с ней ненасыщенные фрагменты гепарина, проведения реакции поверхности с метящим реагентом, вводящим детектируемый компонент в связанные с поверхностью ненасыщенные фрагменты гепарина, выявления связанных с поверхностью ненасыщенных фрагментов гепарина через данный детектируемый компонент и выведения пространственного распределения гепариновых частиц по наличию связанных с поверхностью ненасыщенных фрагментов гепарина. В одном воплощении деполимеризация осуществляется с помощью гепариназы-1. В другом воплощении метящим реагентом служит лантаноидный органический комплекс включения по Michaels. В другом воплощении метящим реагентом служит трис(4-метилтио)бензоат тербия. В другом воплощении данный органический комплекс содержит хемосорбированные наночастицы золота. В другом воплощении детектирование осуществляется методом эпифлуоресцентной микроскопии или трансмиссионной электронной микроскопии.
Следующее воплощение изобретения составляет система определения структуры гепариновых частиц, связанных с субстратом, которая включает раствор для деполимеризации, раствор метящего реагента и детектор. Система представляет собой комплект реагентов и инструментов, используемых для выявления структуры и типа связывания гепариновых частиц с субстратом. В одном воплощении раствор для деполимеризации содержит гепариназу-1. В другом воплощении раствор метящего реагента содержит толуидиновый синий и трис(4-метилтио)бензоат тербия. В другом воплощении детектор включает SAX-HPLC, эпифлуоресцентный микроскоп и абсорбционный спектроскоп. В другом воплощении данный комплект реагентов может представлять собой набор.
После энзиматической деполимеризации гепариназой-1 гепарина и/или гепариновых частиц, прикрепленных по концевым точкам, на поверхности остаются фрагменты гепарина, которые ненасыщены, т.е. они содержат двойную связь углерод-углерод. Энзиматическая деполимеризация гепариназой включает отщепление невосстанавливающего концевого остатка уроновой кислоты до 4,5-ненасыщенного производного. При этом образуются остаточные связанные с поверхностью ненасыщенные фрагменты гепарина, связанные с субстратом, которые содержат двойную связь углерод-углерод. Таким образом, структура остаточного связанного с поверхностью фрагмента гепарина ненасыщена и может реагировать с различными детектирующими молекулами, включая те, которые содержат такие комплексы включения по Michaels, как тиоловые соединения и тиоловые флуоресцентные соединения типа трис(4-метилтио)бензоата тербия. Таким образом, в следующем воплощении изобретения после энзиматической деполимеризации гепариназой-1 прикрепленных по концевым точкам гепариновых частиц выявляются остаточные связанные с поверхностью ненасыщенные фрагменты гепарина, связанные с субстратом и содержащие двойную связь углерод-углерод. Этим способом можно определить, что прикрепленный гепарин и/или гепариновые частицы прикрепляются к субстрату по концевым точкам. В другом воплощении детектирование двойных связей сочетается с любыми способами детекции и/или характеристики, описанными выше.
Далее настоящее изобретение раскрывается на следующих примерах, которые не следует воспринимать как ограничивающие. Содержание всех чертежей и ссылок включено в настоящее изобретение в виде ссылок.
Примеры
Пример 1
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и колистин сульфат в качестве каркаса. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
Колистин сульфат (0.10 г, Alpharma, Inc.) растворяли в 300 мл деионизированной (деион.) воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific). Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS, Thermo Scientific) и 4 г 1-этил-3-(3-диметиламинопропил)карбодиимида (гидрохлорид EDC, Sigma-Aldrich, St. Louis, МО). Проводили реакцию при комнатной температуре в течение 4 часов с последующим диализом в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток (около 350 мл из 500 мл) переносили в стакан и охлаждали до 0°С. Добавляли нитрит натрия (10 мг) и уксусную кислоту (2 мл) и проводили реакцию в течение 1 часа при 0°С. Затем проводили диализ в течение ночи через мембрану с отсечением м.в. 50000 с добавлением 1 г NaCl в диализную жидкость. После замораживания и лиофилизации остатка получали мелкозернистый порошок.
Пример 2
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и неомицин сульфат в качестве каркаса. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
Неомицин сульфат (0.0646 г, Spectrum Chemical) растворяли в 300 мл деион. воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific). Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS) и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов с последующим диализом в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток (около 400 мл из 505 мл) переносили в стакан и охлаждали до 0°С. Добавляли нитрит натрия (10 мг) и уксусную кислоту (2 мл) и проводили реакцию в течение 1 часа при 0°С. Затем проводили диализ в течение ночи через мембрану с отсечением м.в. 50000 с добавлением 1 г NaCl в диализную жидкость. Диализированный остаток фильтровали два раза через ситовый анализатор на 20 мкм стандарта U.S.A. в 0.00079 дюймов по спецификации A.S.T.M.E.-11 No. 635 для удаления мелких частиц. После замораживания и лиофилизации фильтрата получали мелкозернистый порошок.
Пример 3
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и капреомицин сульфат в качестве каркаса. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
Капреомицин сульфат (0.0501 г, Sigma-Aldrich, St. Louis, МО) растворяли в 300 мл деион. воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific). Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS) и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов. Реакционную смесь фильтровали один раз через ситовый анализатор на 20 мкм стандарта U.S.A. в 0.00079 дюймов по спецификации A.S.T.M.E.-11 No. 635 для удаления мелких частиц, а фильтрат диализировали в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток (около 400 мл из 515 мл) переносили в стакан и охлаждали до 0°С. Добавляли нитрит натрия (10 мг) и уксусную кислоту (2 мл) и проводили реакцию в течение 1 часа при 0°С. Затем проводили диализ в течение ночи через мембрану с отсечением м.в. 50000 с добавлением 1 г NaCl в диализную жидкость. Остаток фильтровали два раза через ситовый анализатор на 20 мкм стандарта U.S.A. в 0.00079 дюймов по спецификации A.S.T.M.E.-11 No. 635 для удаления мелких частиц. После замораживания и лиофилизации фильтрата получали мелкозернистый порошок.
Пример 4
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и поли-L-лизин в качестве каркаса. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
Поли-L-лизин (0.1776 г, Sigma-Aldrich, молекулярный вес от 1000 до 5000 г/моль) растворяли в 300 мл деион. воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific). Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS) и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов с последующим диализом в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток (около 400 мл из 505 мл) переносили в стакан и охлаждали до 0°С. Добавляли нитрит натрия (10 мг) и уксусную кислоту (2 мл) и проводили реакцию в течение 1 часа при 0°С. Затем проводили диализ в течение ночи через мембрану с отсечением м.в. 50000 с добавлением 1 г NaCl в диализную жидкость. После замораживания и лиофилизации остатка получали мелкозернистый порошок.
Пример 5
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и полиэтиленимин (PEI) в качестве каркаса. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
PEI (Lupasol, BASF, 1.7756 г) растворяли в 300 мл деион. воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific). Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS) и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов с последующим диализом в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток (около 400 мл из 505 мл) переносили в стакан и охлаждали до 0°С. Добавляли нитрит натрия (10 мг) и уксусную кислоту (2 мл) и проводили реакцию в течение 1 часа при 0°С. Затем проводили диализ в течение ночи через мембрану с отсечением м.в. 50000 с добавлением 1 г NaCl в диализную жидкость. После замораживания и лиофилизации остатка получали мелкозернистый порошок.
Пример 6
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и этилендиамин (EDA) в качестве каркаса. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
EDA (0.0043 г, Sigma-Aldrich, St. Louis, МО) нейтрализировали до рН 4.7 равным объемом разбавленной деион. водой НСl с использованием ледяной бани, а затем растворяли в 300 мл деион. воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific). Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS) и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов с последующим диализом в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток (около 400 мл из 505 мл) переносили в стакан и охлаждали до 0°С. Добавляли нитрит натрия (10 мг) и уксусную кислоту (2 мл) и проводили реакцию в течение 1 часа при 0°С. Затем проводили диализ в течение ночи через мембрану с отсечением м.в. 50000 с добавлением 1 г NaCl в диализную жидкость. После замораживания и лиофилизации остатка получали мелкозернистый порошок.
Пример 7
Гепариновые частицы, содержащие свободные концевые альдегиды из примеров 1 -6, иммобилизировали на поверхности субстрата ePTFE и тестировали на АТIII-активность.
Материал субстрата ePTFE в виде листов получали от W.L. Gore & Associates, Inc., Flagstaff, AZ под торговой маркой GORE™ Microfiltration Media (GMM-406). Материал покрытия в виде основы наносили на материал ePTFE, надевая его на обруч для вышивания диаметром 10 см и погружая материал ePTFE на подложке сначала в 100% изопропиловый спирт (IPА) примерно на 5 мин, а затем в раствор полиэтиленимина (PEI, Lupasol, BASF) и IP А в соотношении 1:1. Обезвоженный PEI марки Lupasol® получали от BASF, разводили до концентрации в 4% и доводили до рН 9.6. После погружения материала ePTFE в раствор примерно на 15 мин материал вынимали из раствора и промывали деион. водой при рН 9.6 в течение 15 минут.PEI, оставшийся на материале ePTFE, подвергали перекрестному сшиванию 0.05% водным раствором глутаральдегида (Amresco) при рН 9.6 в течение 15 мин. На конструкцию наносили дополнительный PEI, помещая ее в 0.5% водный раствор PEI при рН 9.6 на 15 мин, и снова промывали деион. водой при рН 9.6 в течение 15 мин. Имин, образовавшийся в результате реакции между глутаральдегидом и слоем PEI, восстанавливали раствором цианборгидрида (NaCNBH3) (5 г, растворяли в 1 л деион. воды, рН 9.6) в течение 15 мин и промывали деион. водой в течение 30 мин.
На конструкцию наносили дополнительный слой PEI погружением ее в 0.05% водный раствор глутаральдегида при рН 9.6 на 15 мин, после чего погружали в 0.5% водный раствор PEI при рН 9.6 на 15 мин. Затем конструкцию промывали деион. водой при рН 9.6 в течение 15 мин. Образовавшиеся имины восстанавливали погружением конструкции в раствор NaCNBH3 (5 г, растворяли в 1 л деион. воды, рН 9.6) на 15 мин, а затем промывали деион. водой в течение 30 мин. Третий слой наносили на конструкцию, повторяя эти операции. В результате получали пористый гидрофобный фторполимерный материал основы или диск с гидрофильным покрытием из прошитой полимерной основы практически на всех экспонированных и промежуточных поверхностях материала основы.
В порядке подготовки к нанесению на конструкцию еще одного слоя PEI на покрытии из полимерной основы закрепляли промежуточный химический слой. Промежуточный заряженный ионный слой получали при инкубации конструкции в растворе декстрана сульфата (Amersham Pharmacia Biotech) и хлористого натрия (0.15 г декстрана сульфата и 100 г NaCl растворяли в 1 л деион. воды, рН 3) при 60°С в течение 90 мин с последующим промыванием деион. водой в течение 15 мин.
Слой PEI, именуемый здесь "завершающим слоем", закрепляли на промежуточном слое, помещая конструкцию в 0.3% водный раствор PEI (рН 9) примерно на 45 мин с последующей промывкой раствором хлористого натрия (50 г NaCl растворяли в 1 л деион. воды) в течение 20 мин. Заключительную промывку деион. водой проводили в течение 20 мин.
Гепариновые частицы, содержащие свободные концевые альдегиды из примеров 1-6, закрепляли или конъюгировали на слоях PEI, помещая конструкцию в содержащий гепариновые частицы раствор хлористого натрия (примерно 0.9 г гепариновых частиц, содержащих свободные концевые альдегиды, и 5.88 г NaCl растворяли в 200 мл деион. воды, рН 3.9), и держали в течение 10 мин при 60°С. В раствор (200 мл) гепариновых частиц добавляли 572 мкл 2.5% (w/v) водного раствора NaCNBH3. Образцы держали еще 110 мин при вышеуказанной температуре.
Образцы затем промывали деион. водой в течение 15 мин, раствором боратного буфера (10.6 г борной кислоты, 2.7 г NaOH и 0.7 г NaCl растворяли в 1 л деион. воды, рН 9.0) в течение 20 мин, и в заключение деион. водой в течение 15 мин с последующей лиофилизацией всей конструкции, получая высушенную конструкцию, содержащую гепариновые частицы, связанные с поверхностью материала субстрата ePTFE. Присутствие гепарина и однородность макромолекулярной конструкции определяли путем окрашивания образцов конструкции с обеих сторон толуидиновым синим. Окрашивание давало равномерную окраску поверхности, указывая на присутствие гепарина и на то, что он равномерно связан с материалом ePTFE.
Из конструкции отрезали образцы с номинальным размером примерно один квадратный сантиметр (1 см2) и определяли активность гепарина измерением АТIII-связывающей способности гепариновых частиц, содержащих свободные концевые альдегиды, которые были закреплены по концевым точкам на поверхности субстрата ePTFE. Измерение описано в Larsen M.L. et al. "Assay of plasma heparin using thrombin and the chromogenic substrate H-D-Phe-Pip-Arg-pNA (S-2238)." Thromb Res 13:285-288 (1978); и в Pasche В. et al. "A binding-of antithrombin to immobilized heparin under varying flow conditions." Artif. Organs 15:281-491 (1991), которые оба включены в виде ссылки на все случаи. Результаты выражали в виде количества связанного АТIII на единицу площади поверхности материала субстрата в пикомолях на квадратный сантиметр (пмоль/см). Все образцы содержали во влажном состоянии во время измерения. Важно отметить то, что хотя образцы площадью в 1 см2 имеют общую площадь поверхности в 2 см2, если учитывать обе стороны материала, но для расчета АТIII-активности гепариновых частиц в пмоль/см2 использовали только одну поверхность образца (т.е. 1 см2).
Лиофилизованные образцы, представляющие каждую из конъюгированных конструкций, полученных в примерах 1-6, помещали в индивидуальные самоуплотняющиеся мешочки Tower Dualpeel® Self Sealing Pouch (Allegiance Healthcare Corp., McGraw Park, IL) и запечатывали для стерилизации с помощью ЕtO. Стерилизацию этиленоксидом проводили в условиях кондиционирования в течение 1 часа, подачи газообразного ЕtO на 1 час при заданной температуре в 55°С и продолжительности аэрации в 12 часов. Стерилизацию с помощью ЕtO повторяли вплоть до 3 раз с отбором проб после каждой стерилизации.
На фиг.2 представлена гистограмма, показывающая АТIII-связывающую способность гепариновых частиц, содержащих свободные концевые альдегиды из примеров 1-6, иммобилизованных на поверхности ePTFE и подвергавшихся вплоть до трех циклов стерилизации EtO. Активность связывания антитромбина III выражена в пикомолях связанного антитромбина III на квадратный сантиметр материала субстрата. Как видно из результатов, все конъюгированные частицы гепарина, содержащие свободные концевые альдегиды, проявляли высокую активность связывания антитромбина III до стерилизации и после вплоть до трех циклов стерилизации ЕtO. Все столбики представляют средние значения образцов по номерам, а планки погрешностей - стандартное отклонение.
Пример 8
Гепариновые частицы, содержащие свободные концевые альдегиды и полученные в примерах 2, 3, 4 и 6, подвергали анализу для определения их абсолютного молекулярного веса.
Использовали детектор Waters 2414 RI вместе с программой Wyatt ASTRA 5.3.4.10 для определения величины dn/dc для гепарина USP в 100 мМ NaNO3 с 0.02% NaN3 при длине волны лазера в 660 нм. Величину dn/dc (изменение показателя преломления, деленное на изменение концентрации) для гепарина USP определяли нанесением на график известных концентраций гепарина против показаний детектора RI и вычислением наклона.
Для измерения абсолютного молекулярного веса гепариновые частицы подвергали анализу с помощью 18-углового детектора светорассеяния Wyatt-Dawn Helleos-II (Wyatt Technology Corp.), причем детекторы 1, 2, 3, 4, 17 и 18 не использовали. Готовили маточные растворы гепариновых частиц в 100 мМ NaNO3 с 0.02% NaN3 в качестве подвижной фазы. Из этих маточных растворов делали следующие концентрации: 0.5 мг/мл, 1.0 мг/мл, 1.5 мг/мл, 2.0 мг/мл и 2.5 мг/мл для гепариновых частиц из примеров 3 и 4. Для гепариновых частиц из примеров 2 и 6 делали концентрации в 0.25 мг/мл, 0.5 мг/мл, 1.0 мг/мл, 1.5 мг/мл и 2.0 мг/мл. Каждый образец перед введением в детектор светорассеяния фильтровали через шприц-фильтр на 0.02 мкм с помощью шприца на 5 мл. По всем образам проводили групповой анализ данных на графике Zimm, используя значение dn/dc для гепарина USP (0.126 л/г). В табл.1 приведены абсолютные значения молекулярного веса.
Все гепариновые частицы, проанализированные на абсолютный молекулярный вес, проявляли большие значения, чем у гепарина USP (14,810 г/моль), со значениями в диапазоне от 17,710 г/моль для гепариновых частиц, содержащих гепарин и капреомицин в качестве каркасной молекулы, до 21,850 г/моль для гепариновых частиц, содержащих гепарин и EDA в качестве каркасной молекулы.
Пример 9
В этом примере представлен способ определения способа прикрепления гепарина или гепариновых частиц на поверхности субстрата. В частности, в этом примере рассматривается прикрепление гепарина или гепариновых частиц через иммобилизацию на субстрате ePTFE с прикреплением по одной точке, содержащей свободные концевые альдегиды, и с прикреплением по нескольким точкам, включающим конъюгирование карбодиимидом.
Гепарин с концевым альдегидом получали согласно US 4,613,665 и иммобилизовали на субстратах PEI-ePTFE, как описано в примере 7. При этом получали поверхность, на которой гепарин был иммобилизован по концевой точке. Прикрепление гепарина выявляли окрашиванием образца толуидиновым синим и регистрацией окраски, как показано на фиг.3, А.
Также получали поверхность, на которой гепарин с концевым альдегидом прикреплялся не по свободному концевому альдегиду, а по нескольким карбоксильным остаткам по всей длине цепи гепарина с помощью 1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC). Известно, что при конъюгации гепарина с помощью EDC он связывается на поверхности по нескольким сайтам. Содержащий PEI диск из примера 7 погружали в 300 мл 0.1 М MES-буфера (рН 4.7). В этот раствор добавляли 1 г гепарина с концевыми альдегидами и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов. Диск с иммобилизированным гепарином промывали деион. водой, боратным буфером и в заключение деион. водой.
Также получали поверхность, на которой с помощью EDC прикреплялся гепарин USP, не содержащий свободных концевых альдегидов, по множественным сайтам связывания на поверхности. Содержащий PEI диск из примера 7 погружали в 300 мл 0.1 М MES-буфера (рН 4.7). В этот раствор добавляли 1 г гепарина с концевыми альдегидами и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов. Диск с иммобилизированным гепарином промывали деион. водой, боратным буфером и в заключение деион. водой.
Также получали гепариновые частицы из примера 2, иммобилизованные на поверхности ePTFE/PEI, как описано в примере 7. В качестве альтернативы гепариновые частицы из примера 2 иммобилизировали на ePTFE/PEI методом конъюгирования карбодиимидом. Содержащий PEI диск из примера 7 погружали в 300 мл 0.1 М MES-буфера (рН 4.7). В этот раствор добавляли 1 г гепариновых частиц из примера 2 и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов. Диск с иммобилизированными гепариновыми частицами промывали деион. водой, боратным буфером и в заключение деион. водой.
Чтобы убедиться в том, что гепарин и гепариновые частицы были иммобилизированы каждым из способов, описанных ранее, образцы размером примерно 1×1 см окрашивали толуидиновым синим. Как оказалось, все образцы окрашивались толуидиновым синим аналогично фиг.3, А (на которой представлен гепарин с концевым альдегидом, иммобилизованный по концевой точке).
Для каждого из различных дисков ePTFE-PEI, конъюгированных с гепарином и гепариновыми частицами, отрезали квадратики 2×2 см и помещали в пробирку на 1.5 мл. Туда же добавляли 1 мл гепариназы-1 (из Flavobacterium heparinum, Е.С.4.2.2.7, Sigma-Aldrich, St. Louis, MO), разведенной до 1 мг/мл в следующем буфере: 20 мМ трис-HCl, рН 7.5, 50 мМ NaCl, 4 мМ СаСl2, 0.01% BSA. Образцы инкубировали в течение 30 мин при комнатной температуре, промывали деион. водой и окрашивали толуидиновым синим. Образцы, прикрепленные по концевой точке, а не по множественным точкам, выглядели значительно менее окрашенными, как видно из фиг.3, В для гепарина USP с концевым альдегидом, иммобилизованного по концевой связи. Гепариновые частицы, иммобилизованные по множественным точкам, сохраняли окраску.
Количественную оценку окрашивания проводили по измерению яркости для каждого из образцов. Образцы монтировали на предметных стеклах и закрепляли кусочком пластыря. Делали цифровые снимки с помощью микроскопа Olympus SZX12 (Olympus America Inc.), снабженного цифровой камерой Olympus DP71 под управлением программы DP Controller 3.1.1.267. Снимки делали с использованием линзы IX при 7-кратном увеличении, при экспозиции в 1/350 сек и верхнем освещении кольцевой лампой. Перед сохранением окончательных изображений их осматривали с тем, чтобы не было перенасыщения. Важно отметить, что окрашенные образцы, т.е. те, что хорошо окрашивались толуидиновым синим, давали низкие значения яркости, тогда как те, что плохо окрашивались, давали высокие значения яркости (шкала яркости в этом примере составляла от 0 до 255).
Яркость всех сохраненных цифровых снимков оценивали с помощью Adobe Photoshop Elements 2.0 (Adobe Systems Inc., San Jose, CA). Снимок загружали в Adobe Photoshop Elements 2.0 (разрешение 144 пикселя на дюйм) и выделяли репрезентативный прямоугольный участок образца с помощью инструмента "выделение прямоугольником". На верхней панели инструментов выбирали "изображение", а затем "гистограмма". Открывалось окно гистограмм, в нем выбирали канал "яркость". Выбирали "среднее" для записи средних значений яркости.
Все образцы, конъюгированные с гепарином или гепариновыми частицами (значения яркости приведены в табл.2), хорошо окрашивались толуидиновым синим, что указывает на плотное покрытие субстрата прикрепленным гепарином и гепариновыми частицами. Значения яркости после иммобилизации и окрашивания составляли от 27.3 для гепарина с концевым альдегидом, иммобилизованного по концевой точке, до 139.1 для гепарина USP, иммобилизованного по множественным точкам с помощью EDC. После обработки гепариназой-1 и окрашивания значения яркости возрастали у всех образцов, что означает потерю гепарина и связанное с этим снижение окрашивания и окраски. Это изменение было более существенным у образцов, более чувствительных к гепариназе-1. Это изменение представлено на графике нормализованных изменений яркости. Термин "нормализованное изменение яркости" определяется как значение яркости после обработки гепариназой-1 за вычетом значения яркости после иммобилизации, деленное на значение яркости после иммобилизации и умноженное на 100, т.е. {[(яркость(после гепариназы) - яркость(до гепариназы)] ÷ яркость(до гепариназы)} × 100. Нормализованные изменения яркости для каждого из образцов в табл.2 приведены на фиг.3, С и представлены в зависимости от типа гепариновых частиц и способа прикрепления при иммобилизации. Нормализованные изменения яркости гепарина с концевым альдегидом зависели от способа прикрепления при иммобилизации, при этом прикрепление по концевой точке давало значение 603, а прикрепление по множественным точкам давало значение 66. Такая же зависимость наблюдалась и для гепариновых частиц с неомицином, со значением 231 при прикреплении по концевой точке и 16 по множественным точкам. Гепарин USP при прикреплении по множественным точкам также проявлял низкое значение нормализованного изменения яркости, равное 14. Низкие значения нормализованного изменения яркости указывают на устойчивость поверхности к гепариназе-1 и вследствие этого небольшое количество удаленного гепарина.
Гепариназа-1 эффективно удаляла гепарин или гепариновые частицы из поверхности, о чем свидетельствует отсутствие заметного окрашивания толуидиновым синим и связанное с этим отсутствие окраски и высокие значения нормализованного изменения яркости. Гепариназу-1 использовали для выяснения того, что гепарин или гепариновые частицы прикреплялись через свободные концевые альдегиды или же по множественным точкам при конъюгировании карбодиимидом.
Пример 10
В этом примере представлен способ определения способа прикрепления гепариновых частиц на субстрате после стерилизации. В частности, в этом примере рассматривается прикрепление гепариновых частиц через иммобилизацию на субстрате ePTFE с прикреплением по одной точке, содержащей свободные концевые альдегиды, с последующей стерилизацией и промывкой борной кислотой.
Гепариновые частицы из примера 6 иммобилизировали на ePTFE, как описано в примере 7. Было показано, что образцы хорошо покрыты гепарином, о чем свидетельствует окрашивание толуидиновым синим (как видно из фиг.4, А). Другие образцы с прикреплением по концевой точке подвергали стерилизации, как описано в примере 7, за 3 цикла обработки EtO, как описано в примере 7. Часть этих образцов после стерилизации и перед окрашиванием толуидиновым синим промывали деион. водой в течение 15 мин, раствором боратного буфера (10.6 г борной кислоты, 2.7 г NaOH и 0.7 г NaCl растворяли в 1 л деион. воды, рН 9.0) в течение 20 мин и в заключение деион. водой в течение 15 мин и измеряли яркость, как описано в примере 9.
Образцы, подвергавшиеся стерилизации, но не промытые борной кислотой, окрашивали толуидиновым синим перед обработкой гепариназой-1 (фиг.4, В) и после нее (фиг.4, С). Оба образца проявляли присутствие гепариновых частиц по окраске и по низким значениям яркости в 31. 7 и 85.6 соответственно. Стерилизация явно снижала способность гепариназы-1 к деполимеризации гепариновых частиц, связанных по свободным концевым альдегидам, по сравнению с не подвергавшимися стерилизации гепариновыми частицами.
Образцы, подвергавшиеся стерилизации и промывке борной кислотой, окрашивали толуидиновым синим перед обработкой гепариназой-1 (фиг.4, D) и после нее (фиг.4, Е). На плотное покрытие гепарином перед обработкой гепариназой-1 указывает окрашивание толуидиновым синим и значение яркости в 54.4, тогда как образец, подвергавшийся промывке борной кислотой и обработке гепариназой-1, практически не окрашивался толуидиновым синим и его значение яркости составляло 186.3, что свидетельствует о заметной чувствительности к гепариназе прикрепленных гепариновых частиц.
Этот пример показывает, что борная кислота восстанавливает конформацию гепарина в прикрепленных гепариновых частицах, о чем свидетельствует высокая специфичность к АТIII и чувствительность к гепариназе. Не придерживаясь какой-либо теории, предполагаем, что стерилизация изменяет конформацию слоя иммобилизованных гепариновых частиц, существенно снижая специфичность к АТIII (о чем свидетельствует низкая активность) и уменьшая чувствительность к гепариназе (о чем свидетельствует заметное окрашивание толуидиновым синим). Также предполагаем, что промывка борной кислотой восстанавливает конформацию слоя прикрепленных гепариновых частиц, измененную при стерилизации. Восстановление конформации привело к тому, что прикрепленные гепариновые частицы стали чувствительными к деполимеризации гепариназой-1, о чем свидетельствует отсутствие окрашивания на фиг.4, Е. Также предполагаем, что если прикрепленные гепариновые частицы имеют конформацию, которая распознается гепариназой-1, то АТIII тоже будет распознавать прикрепленные гепариновые частицы, и наоборот (vice versa).
Пример 11
В этом примере представлен способ детектирования для определения состава гепариновых частиц при помощи картирования олигосахаридов в деполимеризованных гепариназой-1 гепариновых частицах методом жидкостной хроматографии высокого разрешения на сильном анионообменнике (SAX-HPLC).
Гепарин USP и гепариновые частицы из примеров 1 и 2 растворяли по 0.1 мг в 100 мкл 50 мМ ацетатного буфера, рН 7.3, содержащего 2.5 мМ ацетата кальция. Гепарин USP и гепариновые частицы из примеров 1 и 2 подвергали деполимеризации до их составных олигосахаридов добавлением 6 миллиединиц гепариназы-1 в течение 15 часов при 30°С и быстро замораживали при -85°С.
Анализ олигасахаридов из каждого образца проводили методом SAX-HPLC и количественно измеряли при 232 нм на колонке с 5 мкм SAX (150×4.6 мм; Spherisorb, Waters). Изократическое разделение проводили с 0 до 5 мин при 50 мМ NaCl, рН 4.0, а разделение в линейном градиенте проводили с 5 до 90 мин от 100% 50 мМ NaCl, рН 4.0, до 100% 1.2 М NaCl, рН 4.0, со скоростью в 1.2 мл/мин.
На фиг.5 представлены качественные карты (А) деполимеризованного гепарина USP, (В) деполимеризованных гепариновых частиц из примера 1, содержащих гепарин и каркас из колистина сульфата, и (С) деполимеризованных гепариновых частиц из примера 2, содержащих гепарин и каркас из неомицина сульфата. Хроматограмма для гепарина USP представляла базовую линию и служила стандартом для гепариновых частиц из примеров 1 и 2. Каждый пик на фиг.5, А представляет уникальный деполимеризованный олигосахаридный фрагмент, характерный для гепарина USP. Новые пики, отмеченные вертикальными стрелками на фиг.5, В и С, представляют новые олигосахаридные звенья, отличные от гепарина USP, поэтому они позволяют идентифицировать гепариновые частицы по этим характерным пикам.
Для гепариновых частиц из примера 1, содержащих гепарин и каркас из колистина сульфата, на хроматограмме из фиг.5, В проявляются по меньшей мере 3 отдельных пика по сравнению с хроматограммой гепарина USP через 15.581, 24.699 и 35.023 минут (отмечены вертикальными стрелками). Структурно, эти новые пики связаны с каркасной молекулой колистина сульфата, использовавшейся при конструировании гепариновых частиц. При деполимеризации гепариновых частиц гепариназой-1 образовались новые отличные по структуре полисахаридные звенья, содержащие каркасную молекулу колистина сульфата.
Для гепариновых частиц из примера 2, содержащих гепарин и каркас из неомицина сульфата, на хроматограмме из фиг.5, С проявляются по меньшей мере 3 отдельных пика по сравнению с хроматограммой гепарина USP через 8.276, 25.386 и 34.867 минут (отмечены вертикальными стрелками). Структурно эти новые пики связаны с каркасной молекулой неомицина сульфата, использовавшейся при конструировании гепариновых частиц. При деполимеризации гепариновых частиц гепариназой-1 образовались новые отличные по структуре полисахаридные звенья, содержащие каркасную молекулу неомицина сульфата.
Пример 12
В этом примере представлен способ детектирования для определения состава гепариновых частиц, иммобилизованных на поверхности, при помощи картирования олигосахаридов в деполимеризованных гепариназой-1 гепариновых частицах методом жидкостной хроматографии высокого разрешения на сильном анионообменнике (SAX-HPLC).
Гепарин, содержащий свободные концевые альдегиды, иммобилизировали на дисках из ePTFE/PEI согласно примеру 9. Гепариновые частицы из примера 1 иммобилизировали на дисках из ePTFE/PEI согласно примеру 7. Образцы каждого диска примерно по 4 см2 помещали в отдельные пробирки. Эти образцы подвергали деполимеризации до их составных олигосахаридов добавлением 1 мл ацетатного буфера (состоящего из 50 мМ ацетата натрия, 2.5 мМ ацетата кальция, рН 7.3) в каждую пробирку вместе с 60 мкл раствора гепариназы-1. Раствор гепариназы-1 содержал ацетатный буфер (50 мМ ацетата натрия, 2.5 мМ ацетата кальция, рН 7.3) с гепариназой-1 (ЕС 4.2.2.7, Sigma-Aldrich) в концентрации 1.67 МЕ/мл. Пробирки инкубировали при 30°С в течение 18 ч, из них отбирали образцы жидкости по 0.5 мл и быстро замораживали при -85°С для анализа методом SAX-HPLC, как описано в примере 11.
На фиг.6 представлены качественные SAX-HPLC карты деполимеризованного на поверхности (А) гепарина, содержащего свободные концевые альдегиды и иммобилизованного на ePTFE, и (В) гепариновых частиц, состоящих из гепарина и каркаса из колистина сульфата и иммобилизованных на ePTFE. Хроматограмма для гепарина, содержащего свободные концевые альдегиды и иммобилизованного на ePTFE, представляла базовую линию и служила стандартом для гепариновых частиц из примера 1. Каждый пик на фиг.6, А представляет уникальный олигосахарид, характерный для гепарина, содержащего свободные концевые альдегиды и иммобилизованного на ePTFE. Новые пики, отмеченные вертикальными стрелками на фиг.6 В, представляют дополнительные олигосахаридные звенья, отличные от гепарина, содержащего свободные концевые альдегиды и иммобилизованного на ePTFE, поэтому они позволяют идентифицировать гепариновые частицы, состоящие из гепарина и каркаса из колистина сульфата и иммобилизованные на ePTFE.
Пример 13
В этом примере описано конструирование гепариновых частиц, содержащих гепарин и каркас из поли-L-лизина. Эти гепариновые частицы не содержат свободных концевых альдегидов, которые могут использоваться для прикрепления к поверхности субстрата. Эта гепариновые частицы могут использоваться для прикрепления к поверхности субстрата через ионные связи.
Поли-L-лизин гидробромид с молекулярным весом от 1000 до 5000 (0.1776 г, Sigma-Aldrich, St. Louis, МО) растворяли в 300 мл деион. воды, содержащей MES-буфер (рН 4.7, ВuрН™ фирмы Thermo Scientific), и доводили до рН 4.7. Туда же добавляли 10 г гепарина USP, 4 г N-гидроксисульфосукцинимида (сульфо-NHS) и 4 г гидрохлорида EDC. Проводили реакцию при комнатной температуре в течение 4 часов с последующим диализом в течение ночи через мембрану с отсечением м.в. 50000 (Spectra/Por®). Остаток переносили в пробирки на 50 мл, быстро замораживали и лиофилизировали, получая мелкозернистый порошок. Далее этот порошкообразный продукт использовали для иммобилизации гепариновой конструкции с каркасом из поли-L-лизина на листе материала ePTFE через ионные связи.
Пример 14
Гепариновые частицы из примера 13 иммобилизировали на поверхности субстрата ePTFE через ионные связи.
Готовили диски из ePTFE/PEI согласно примеру 7. Гепариновые частицы из примера 13, содержащие каркас из поли-L-лизина и не содержащие свободных концевых альдегидов, прикрепляли через ионные связи на слой PEI, помещая 5 образцов 1×1 см конструкции ePTFE в содержащий гепариновые частицы раствор хлорида натрия (0.247 г гепариновых частиц с каркасом из поли-L-лизина, не содержащих альдегидов, 0.16 г безводного цитрата натрия и 1.607 г NaCl растворяли в 55 мл деион. воды, рН 3.9) и держали в течение 120 мин при 60°С.
Затем образцы промывали деион. водой в течение 15 мин, раствором боратного буфера (10.6 г борной кислоты, 2.7 г NaOH и 0.7 г NaCl растворяли в 1 л деион. воды, рН 9.0) в течение 20 мин и в заключение деион. водой в течение 15 мин с последующей лиофилизацией всей конструкции, получая сухой гепарин, связанный с материалом ePTFE. Присутствие и однородность гепарина, содержащего каркас из поли-L-лизина, определяли окрашиванием образцов конструкции с обеих сторон толуидиновым синим. Окрашивание давало равномерную окраску поверхности, указывая на присутствие гепарина и на то, что он равномерно связан с материалом ePTFE.
Пример 15
В этом примере представлен способ определения способа конъюгации для иммобилизации гепарина и гепариновых частиц на поверхности. В частности, в этом примере рассматривается детектирование связанных с поверхностью ненасыщенных фрагментов гепарина или "шишек" на поверхности иммобилизованного гепарина или гепариновых частиц после деполимеризации гепариназой-1. Деполимеризация гепарина гепариназой-1 включает энзиматическое отщепление невосстанавливающей концевой уроновой кислоты гепарина до 4,5-ненасыщенного производного, способного реагировать с различными детектирующими молекулами типа флуоресцентных молекул тиола тербия. Включали и отрицательный контроль связанного ионными связями гепарина (пример 14).
Использовали флуоресцентные молекулы на основе тиола тербия. Растворяли 5 г гидроксипропил-β-циклодекстрина в 50 мл деион. воды и растворяли 0.03894 г трис(4-метилтио)бензоата тербия [Тb(4МТВ3)] в 10 мл раствора N,N-диметилацетамида (DMAc). После этого в раствор гидроксипропил-β-циклодекстрина по каплям добавляли раствор Тb(4МТВ3), получая прозрачный бесцветный раствор. Затем раствор фильтровали через фильтрующий элемент Sterix на 0.22 мкм перед применением.
Образцы покрытых ePTFE субстратов размером 1×1 см из примера 14 и образцы размером 1×1 см гепариновых частиц из примера 1, содержащих гепарин и каркас из колистина сульфата и иммобилизованных согласно примеру 7, перед реакцией с тиолом тербия подвергали деполимеризации гепариназой-1. Для сравнения также использовали гепарин с концевыми альдегидами (полученный согласно US 4,613,665), иммобилизованный на субстратах PEI-ePTFE согласно примеру 7; при этом получали поверхность, на которой гепарин был иммобилизован с прикреплением по концевой точке.
Образцы подвергали деполимеризации с помощью 100 единиц гепариназы-1 (ЕС 4.2.2.7, Sigma-Aldrich), разведенной в 1 мл буфера (20 мМ трис, 50 мМ NaCl, 10 мМ СаСl2, 0.01% BSA, рН 7.5), в течение 35 мин на качалке при комнатной температуре. Это приводило к возникновению небольших "шишек" из связанных с поверхностью ненасыщенных фрагментов гепарина, связанных с поверхностью субстрата ePTFE. Образцы затем промывали деион. водой в течение 15 мин, раствором боратного буфера (10.6 г борной кислоты, 2.7 г NaOH и 0.7 г NaCl растворяли в 1 л деион. воды, рН 9.0) в течение 20 мин и хранили в деион. воде до применения при заключительном анализе. Проводили флуоресцентное мечение образцов посредством включения тиолового соединения тербия по Michaels в ненасыщенный фрагмент гепарина, связанный с поверхностью субстрата ePTFE, помещая каждый образец во флакон, содержащий раствор Тb(4МТВ3)/ гидроксипропил-β-циклодекстрина, продували азотом в течение 1 минуты, закрывали крышкой и инкубировали в течение ночи при 70°С. Образцы вынимали из пробирок, промывали 10% раствором гидроксипропил-β-циклодекстрина в деион. воде и помещали на предметные стекла для исследования под микроскопом.
Изображения образцов получали под микроскопом Nikon Е-6000 с коротковолновым источником возбуждения Ocean Optics Deuterium под косым углом. Делали флуоресцентные снимки при возбуждении и дневным светом, и УФ, используя кубический фильтр FITC. Все образцы во время съемки поддерживали во влажном состоянии для минимизации фонового светорассеяния, а снимки делали с помощью черно-белой камеры. При съемке образцов с возбуждением УФ светом к изображению искусственно добавляли зеленое тонирование в целях визуализации.
Отмечались различия по УФ-флуоресценции и, следовательно, детектировании ненасыщенных фрагментов гепарина, связанных с поверхностью субстрата ePTFE ("шишек"), между образцами гепарина с концевым альдегидом и гепариновыми частицами, содержащими гепарин и каркас из колистина сульфата. Отмечалось отсутствие УФ флуоресценции у макромолекулярной конструкции из связанного ионными связями гепарина и поли-L-лизина, не содержащей альдегидов.
Пример 16
В этом примере описано конструирование и применение такого воплощения настоящего изобретения, в котором присутствует сильное связывание гепарина с антитромбином III (АТIII) у гепариновых частиц, содержащих гепарин и каркас из аминосодержащего фторполимера. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
Аминосодержащий фторполимер получали по следующей методике. Готовили сополимер, содержащий тетрафторэтилен и винилацетат в молярном отношении 20:80. В продутый азотом напорный реактор на 1 л под вакуумом вносили 500 г деион. воды, 2 г 20% жидкого перфторооктаноата аммония, 30 мл дистиллированного винилацетата, 10 г н-бутанола и 0.2 г персульфата аммония. Затем в реактор вводили тетрафторэтиленовый мономер до тех пор, пока давление в реакторе не достигнет 1500 кПа. Смесь перемешивали и нагревали до 50°С. Когда отмечалось падение давления, в реактор медленно вносили 25 мл винилацетата. Реакцию останавливали, когда давление падало еще на 150 кПа после добавления винилацетата. При коагуляции латексной эмульсии методом замораживания-оттаивания получали сополимер, который осветляли путем экстракции смесью метанол/вода. Затем сополимер подвергали гидролизу. В круглодонную колбу на 50 мл вносили 0.5 г сополимера, 10 мл метанола и 0.46 г NaOH в 2 мл деион. воды. Смесь перемешивали и нагревали до 60°С в течение 5 час. Затем реакционную смесь подкисляли до рН 4 и осаждали деион. водой. После этого гидролизованный сополимер подвергали ацетилированию. Гидролизованный сополимер растворяли в метаноле до 2.5% масс. К 50 г этого раствора добавляли 33 мл деион. воды на вибрационной мешалке, получая гомогенный раствор. В этот раствор добавляли 0.153 г диметилацеталя аминобутиральдегида и 0.120 мл 37% раствора НСl. Раствор подвергали реакции с перемешиванием в атмосфере азота при 80°С в течение 48 час. По каплям добавляли гидроокись натрия из 1М раствора до достижения рН 9.0. Образовшийся сополимер политетрафторэтилена с виниловым спиртом и винилацеталем аминобутиральдегида (TFE-VOH-AcAm) выделяли осаждением в избытке деион. воды. Осадок фильтровали, снова растворяли в метаноле и переосаждали в избытке деион. воды еще 2 раза. Конечный продукт высушивали под вакуумом при 60°С в течение 3 час. Полимерную структуру сополимера политетрафторэтилена с виниловым спиртом и винилацеталем аминобутиральдегида подтверждали методом FTIR и 14С-ЯМР.
Растворяли 48 мг модифицированного альдегидом гепарина (полученного согласно US 4,613,665) в 30 мл деион. воды. В этот раствор добавляли 86 мкл 2.5% раствора цианоборгидрида натрия (Aldrich) и доводили до рН 3.8 с помощью НС1. Отдельно растворяли сополимер TFE-VOH-AcAm в перегретом метаноле до 2.5% масс., а затем охлаждали до комнатной температуры. К 20 мл раствора TFE-VOH-AcAm добавляли по каплям 13 мл раствора гепарина до получения слегка молочной эмульсии. Эмульсию держали при 60°С в течение 2.5 час, а затем при комнатной температуре еще 2 часа. Эмульсию диализировали против деион. воды через мембрану на 50 кДа (SpectraPor) в течение 18 час, быстро замораживали при -80°С, а затем лиофилизировали, получая порошок. 10 мг порошка суспендировали в 2.5 мл ледяной деион. воды с добавлением 0.1 мг нитрита натрия (Sigma) и 20 мкл уксусной кислоты (Baker). После проведения реакции в течение 2 час при 0°С суспензию диализировали против деион. воды через мембрану на 10 кДа (SpectaPor) в течение 18 час, быстро замораживали при -80°С, а затем лиофилизировали.
Пример 17
В этом примере описано конструирование и применение такого воплощения настоящего изобретения, в котором присутствует сильное связывание гепарина с АТIII у гепариновых частиц, содержащих гепарин и каркас из аминосодержащего фторполимера. Эти гепариновые частицы содержат альдегиды по всей длине гепариновой компоненты, которые можно использовать для прикрепления к поверхности субстрата.
Растворяли 48 мг модифицированного альдегидом гепарина (полученного согласно US 4,613,665) в 30 мл деион. воды. В этот раствор добавляли 86 мкл 2.5% раствора цианоборгидрида натрия (Aldrich) и доводили до рН 3.8 с помощью НСl. Отдельно растворяли сополимер TFE-VOH-AcAm из примера 16 в перегретом метаноле до 2.5% масс., а затем охлаждали до комнатной температуры. К 20 мл раствора TFE-VOH-AcAm добавляли по каплям 13 мл раствора гепарина до получения слегка молочной эмульсии. Эмульсию держали при 60°С в течение 2.5 час, а затем при комнатной температуре еще 2 часа. Эмульсию диализировали против деион. воды через мембрану на 50 кДа (SpectraPor) в течение 18 час, быстро замораживали при -80°С, а затем лиофилизировали, получая порошок.
Готовили раствор, содержащий 100 мл деион. воды, 0.82 г ацетата натрия и 0.128 г периодата натрия (ICN). В 12 мл этого раствора суспендировали 12 мг порошка. После проведения реакции в течение 30 мин в темноте добавляли 1.2 мл глицерина для остановки реакции, суспензию диализировали против деион. воды через мембрану на 10 кДа (SpectaPor) в течение 18 час, быстро замораживали при -80°С, а затем лиофилизировали.
Пример 18
Гепариновые частицы из примеров 16 и 17, содержащие гепарин и каркас из аминосодержащего фторполимера, иммобилизовали на субстратах ePTFE/PEI по методике, описанной в примере 7, за исключением образцов, не подвергавшихся обработке ЕtO. АТIII-связывающую активность измеряли по методике, описанной в примере 7.
Пример 19
В этом примере описано конструирование и применение такого воплощения настоящего изобретения, в котором присутствует сильное связывание гепарина с АТIII у гепариновых частиц, содержащих гепарин и каркас из аминосодержащего фторполимера. Эти гепариновые частицы содержат свободные концевые альдегиды, которые можно использовать для прикрепления к поверхности субстрата.
Аминосодержащий фторполимер получали по следующей методике. В реактор на 4 л вносили 2 л трет-бутанола. Добавляли 50 г тетрафторэтилена (TFE), 200 г перфтор-метилвинилового эфира (PMVE) и 100 г N-винилформамида (NFA) вместе с 0.4 г диизопропилпероксидикарбоната в качестве инициатора. Раствор перемешивали при 800 об/мин при 70°С в течение 3 час. Из реактора извлекали осадок, сушили на воздухе в течение 2 час и высушивали при 40°С под вакуумом в течение 24 час. Анализ методами Н- и F-ЯМР подтвердил, что полимер TFE-PMVE-NFA состоит из 46% масс. NFA, 27% масс. PTFE и 27% масс. PMVE. Этот полимер растворялся в метаноле и разбухал в воде.
25 г полимера TFE-PMVE-NFA диспергировали в 100 мл деион. воды. Смесь нагревали до 70°С и медленно добавляли 30 мл 37% НСl. Раствор держали при 90°С в течение 4 час. Гидролизованный полимер извлекали осаждением в ацетоне, сушили на воздухе в течение 2 час и высушивали при 40°С под вакуумом в течение 24 час. Анализ методом FTIR подтвердил гидролиз винилформамидных групп до виниламиновых (VA) групп. Полимер TFE-PMVE-VA растворялся в воде.
В одном флаконе растворяли 2 г гепарина USP в 50 мл 0.1М MES-буфера, содержащего 0.8 г EDC и 0.8 г сульфо-NHS. Во втором флаконе готовили второй раствор, содержащий 1 г полимера TFE-PMVE-VA и 30 мл 0.1М MES-буфера. В раствор полимера по каплям добавляли раствор гепарина на протяжении 4 час при комнатной температуре, поддерживая рН 4.7 с помощью 1.0N NaOH. Реакцию проводили в течение ночи при комнатной температуре. Раствор диализировали в деион. воде в течение двух дней через мембрану с отсечением м.в. 10 000 (Spectra/Por®). Остаток концентрировали на роторном испарителе.
К остатку добавляли 0.01 г NaNO2, 100 мл деион. воды и 2 мл уксусной кислоты. Проводили реакцию при 0°С в течение 2 час, после чего диализировали против деион. воды в течение двух дней, быстро замораживали при -80°С, а затем лиофилизировали.
Специалистам в данной области должно быть ясно, что в настоящем изобретении можно проводить различные модификации и изменения, не отходящие от сути и не выходящие за рамки изобретения. Так, предусматривается, что настоящее изобретение охватывает все модификации и вариации данного изобретения при условии, что они остаются в рамках формулы изобретения и ее эквивалентов.
Реферат
Изобретение относится к медицине и касается медицинского субстрата, включающего гепариновые частицы, связанные на субстрате через, по меньшей мере, одну молекулу гепарина, причем эта гепариновая частица содержит, по меньшей мере, одну гепариновую молекулу и, по меньшей мере, одну каркасную молекулу, причем связанные гепариновые частицы чувствительны к гепариназе, и эта гепариновая частица связана с субстратом: по концевой точке, либо петлеобразно, либо через концевой альдегид, либо через альдегиды по всей длине данного гепарина. Изобретение обеспечивает значительную биологическую активность гепариновых частиц после иммобилизации, стерилизации, механического сжатия и растяжения и/или хранения по сравнению с другими покрытиями медицинских субстратов. 20 з.п. ф-лы, 6 ил., 3 табл., 19 пр.
Формула
гепариновые частицы, связанные на субстрате через, по меньшей мере, одну молекулу гепарина, причем эта гепариновая частица содержит, по меньшей мере, одну гепариновую молекулу и, по меньшей мере, одну каркасную молекулу, причем связанные гепариновые частицы чувствительны к гепариназе, и эта гепариновая частица связана с субстратом: по концевой точке, либо петлеобразно, либо через концевой альдегид, либо через альдегиды по всей длине данного гепарина.

Комментарии