Имплантат для восстановления позвонков и трубчатых костей - RU2261116C2
Код документа: RU2261116C2
Чертежи




Описание
Изобретение относится к имплантату, который содержит комплекс активных ингредиентов, со следующими отличающимися друг от друга компонентами в форме, как минимум, одного структурного компонента, как минимум, одного компонента, обеспечивающего миграцию клеток, как минимум, одного адгезионного компонента и, как минимум, одного компонента, способствующего росту и созреванию.
В уровне техники уже известен комплекс активных ингредиентов для создания биологических деталей, в частности, органов живых существ с вышеупомянутыми компонентами. В этом уже известном комплексе активных ингредиентов структурный компонент может состоять, например, из различных коллагенов, эластина или протеогликанов. В качестве компонента, обеспечивающего миграцию клеток, в этом комплексе активных ингредиентов можно назвать, в частности, факторы, обеспечивающие хемотаксис, например пептиды, такие как N-F-Met-Leu-Phe- и/или, например, метаболиты арахидоновой кислоты, такие как лейкотриены. Роль адгезионного компонента могут играть белковые тела типа фибронектина или ламинина, а также факторы клеточной адгезии, такие как L-CAM, N-CAM, и факторы адгезии межклеточного вещества, такие как цитотактин, тенасцин, коллагены IV, V, VII типов, синтетические пептиды и трансмембранные соединительные пептиды, такие как интегрин. Вышеприведенные примеры адгезионных компонентов - фибронектин и ламинин - при описании комплекса активных ингредиентов в данной работе следует отнести к факторам адгезии межклеточного вещества. В качестве следующего компонента вышеуказанный комплекс активных ингредиентов содержит, как минимум, один компонент, обеспечивающий рост и созревание, предпочтительно в форме одного или нескольких цитокинов. Примерами таких цитокинов являются: при получении крови - колониестимулирующие факторы, при получении соединительной ткани - фактор роста фибробластов, при получении кожи - эпидермальный фактор роста, при получении хряща - фактор, индуцирующий образование хряща, при получении селезенки или лимфатических узлов - фактор, активирующий лимфоциты, а также пептиды селезенки, при получении тимуса - фактор роста Т-клеток, а также пептиды тимуса, при получении кости - фактор роста кости, а также трансформирующий фактор роста, при получении кровеносных сосудов - фактор ангиогенеза. Кроме того, применяются следующие цитокины: интерлейкин, инсулиноподобные факторы роста, фактор некроза опухолей, простагландины, лейкотриены, трансформирующие факторы роста, фактор роста, происходящий из тромбоцитов, интерфероны, а также фактор роста, происходящий из клеток эндотелия.
Подробности относительно этого комплекса активных ингредиентов можно узнать из европейского патента №0500556, содержание которого полностью включено в настоящее изобретение.
Этот комплекс активных ингредиентов после изготовления первоначально имеет консистенцию, напоминающую вату. Если необходимо заполнить большие дефекты костей, комплекс активных ингредиентов, используемый в качестве имплантата, должен иметь достаточную собственную прочность, чтобы он не сжимался окружающими мягкими тканями или костными структурами. Поэтому перед вышеуказанным применением он должен быть уже сжат, что приводит к повышению механической прочности, но, одновременно, и к большому расходу материала, в противном случае совместно с комплексом активных ингредиентов нужно использовать достаточно стабильный опорный материал. Соединение опорных материалов с комплексом активных ингредиентов, однако, совсем не является беспроблемным. По имеющимся к настоящему времени данным о комплексе активных ингредиентов и его сложном механизме действия можно опасаться, как минимум, нарушения образования или восстановления соответствующих биологических деталей, подлежащих лечению, например регенерации костей. Также подозревается существование опасности реакции тканевой токсичности.
Кроме того, до сих пор невозможны применения этого комплекса активных ингредиентов при таких болезнях или дефектах, при которых имплантат, состоящий из комплекса активных ингредиентов, подвергается столь высоким механическим нагрузкам, что невозможно обеспечить столь же высокую механическую прочность сжатого материала.
Исходя из этого, в основе настоящего изобретения лежала задача создать имплантат, с помощью которого может быть достигнута высокая механическая прочность, чтобы расширить таким образом возможности применения комплекса активных веществ.
Эта задача решается с помощью имплантата, в котором металлическое, неметаллическое или керамическое полое тело покрыто вышеуказанным комплексом активных ингредиентов или содержит в своем составе этот комплекс активных ингредиентов, в результате чего образуется имплантат, который может быть использован для, как минимум, частичного создания, воссоздания или стабилизации тел позвонков или трубчатых костей. Компоненты комплекса активных ингредиентов при этом адаптированы для получения костей, куда относится также образование всех структур, необходимых для обеспечения функции костей или позвонков, например кровеносных сосудов и нервов.
Решение задачи является далеко не очевидным, так как (как уже было разъяснено выше) очень сложно разработать комбинацию комплекса активных ингредиентов и опорного материала, который покрыт комплексом активных ингредиентов или содержит его в своем составе, поскольку при этом функции комплекса активных ингредиентов, например, в области дефекта кости, нарушаются или, как минимум, могут быть осложнены вероятными иммунными реакциями.
Металлическое полое тело предпочтительно состоит из титана или титановых сплавов. При этом, прежде всего был исследован сплав, включающий в качестве компонентов титан, алюминий и ванадий. В предпочтительном примере осуществления металлические опоры имеют форму цилиндрических полых тел с решетчатой структурой.
В качестве неметаллического материала прежде всего следует назвать углерод, который можно использовать в форме так называемых "углеродных клеток" или "углеродных каркасов", состоящих из углеродных волокон, которые также могут образовывать цилиндрические полые тела. Как титановые (полые) тела, так и углеродные каркасы заполняют комплексом активных ингредиентов или на их внутренние поверхности наносят покрытие, состоящее из комплекса активных ингредиентов.
Вышеуказанные титановые полые тела или углеродные каркасы, после того как они были заполнены комплексом активных ингредиентов или покрыты слоем комплекса активных ингредиентов, могут быть использованы для создания, воссоздания или стабилизации тел позвонков. При этом возникает единственная в своем роде возможность восстановить дефекты позвонков или поврежденный позвонок позвоночного столба посредством блокировки тел позвонков и полной регенерации позвонка.
Блокировка тел позвонков часто необходима в тех случаях, когда из-за дегенеративных процессов в межпозвоночных дисках, опухолей или метастазов в телах позвонков позвоночного столба или из-за остеопороза снижена несущая способность позвоночника, так что существует угроза переломов позвонков или расстройств функций нервов. В этих случаях необходимо обеспечить непрерывность позвоночного столба механически стабильным имплантатом, таким как титановое тело или углеродный каркас. Необходимую перемычку между костями до сих пор пытались создать только из полученного в ходе второй операции аутологичного губчатого вещества кости, например - губчатого вещества из гребня подвздошной кости, что создает ряд проблем, связанных, например, со второй операцией и связанным с ней хирургическим риском в сочетании с дополнительной опасностью инфекции, ограниченным количеством губчатого вещества, которое можно получить, и с осложнениями на месте забора губчатого вещества, такими как инфекции или хронические болевые симптомы. Кроме того, применимость таких аутотрансплантатов ограничена.
Благодаря заполнению или покрытию титанового полого тела или углеродного каркаса комплексом активных ингредиентов удалось за короткое время создать перемычку между костями без необходимости в аутологичном губчатом веществе кости. Решетчатая структура титанового полого тела обеспечила быструю васкуляризацию, в том числе внутри формообразующего компонента, так что комплекс активных ингредиентов мог проявить свою активность, а образование кости происходило по всему необходимому объему, причем механические силы не нарушали формы новообразующейся кости. Кроме применения в области тел позвонков, такое титановое полое тело или углеродный каркас, а также описанные ниже керамические полые тела могут использоваться и при любых других видах имплантаций, как например, в области челюстей, в трубчатых костях и, в принципе, для увеличения массы костей.
До сих пор при использовании комплекса активных ингредиентов блокирование позвонков было невозможно потому, что он не мог выдерживать механическую нагрузку внутри позвоночного столба. Заполненные или покрытые комплексом активных ингредиентов полые тела или каркасы обеспечивают механическую стабильность, не вызывая при этом побочных иммунологических реакций или снижения эффективности комплекса активных ингредиентов.
Наряду с металлическими или неметаллическими полыми телами можно использовать также полые тела, изготовленные из керамических материалов. Среди керамических опорных материалов следует, прежде всего, назвать ситаллы, например керамические материалы на основе фосфата кальция, окиси алюминия и гидроксилапатита.
Керамические материалы на основе фосфата кальция основаны на системе CaO/P2O5. Существует пять различных бинарных соединений на основе этой системы. При этом доказано, что для целей настоящего изобретения пригодны трикальцийфосфат (ТКФ) и тетракальцийфосфат.
ТКФ получают прессованием и последующим спеканием исходных материалов - окиси кальция (СаО) и пятиокиси фосфора (P2O5). Альтернативно его можно получить в одностадийном производственном процессе путем горячего прессования.
Тетракальцийфосфат получают аналогично ТКФ в две стадии, причем вначале исходные вещества уплотняют до расстояний между узлами кристаллической решетки, равных 5-10 мкм, а затем обжигают керамическую массу при 1100-1500°С.
Гидроксилапатит получают в процессе керамического обжига порошка пентакальцийгидрокситрифосфата при 1250°С. Кроме того, для изготовления гидроксилапатитной керамики можно использовать также природный материал, такой как карбонатный скелет красных водорослей. При этом после процессов промывки и сушки вначале удаляют органические компоненты путем пиролиза при температуре, примерно равной 700°С. После этого производят преобразование в гидроксилапатит посредством добавления раствора фосфата при повышенном давлении и повышенной температуре.
При еще одном способе изготовления гидроксилапатитной керамики (на основе природного скелета кораллов) карбонат кальция кораллов преобразуют посредством гидротермического преобразования в гидроксилапатит или в смесь гидроксилапатита и других минеральных структур. У полученного таким образом материала сохраняется коралловая структура, то есть, в частности, система соединяющихся между собой пор, характерная для кораллов.
Керамические материалы на основе окиси алюминия, которые имеют поликристаллическое строение, содержат примерно 99,7% окиси алюминия, а также небольшие количества окиси магния и/или окиси циркония. Их после предварительного уплотнения под высоким давлением при температурах от 1500 до 1800°С спекают в твердое тело. Для целей настоящего изобретения были использованы микропористые алюмооксидные керамики. Также можно использовать монокристаллические формы (сапфиры).
Сам комплекс активных ингредиентов можно дополнительно нанести на опорные материалы, которые выбраны из полимеров и коллагенов. При этом можно уменьшить количество комплекса активных ингредиентов, необходимое для заполнения соответствующего полого тела, чтобы снизить расходы, сохранив, в основном, эффективность в отношении образования кости.
Из полимерных опорных материалов рассматриваются, в частности, полимеры, состоящие из природных мономеров, такие как полиаминокислоты (полилизин, полиглутаминовая кислота и т.д.) и полимеры молочной кислоты. Можно также использовать сополимеры, например состоящие из полимолочной кислоты и гидроксиуксусной кислоты.
Полилактаты являются полиэфиром молочной кислоты с химической формулой:
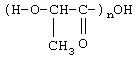
При прямой полимеризации мономеров образуются полимеры с относительно малым молекулярным весом. Верхняя граница лежит на уровне примерно 20000 Д. Большие молекулярные веса можно получить посредством соединения циклических димеров при высокой температуре, низком давлении и в присутствии катализаторов. Полимеры молочной кислоты являются биодеградируемыми, биосовместимыми, нерастворимыми в воде и отличаются высокой прочностью.
Далее в качестве опорных материалов могут использоваться различные коллагены. Здесь, в частности, следует назвать коллагены типов I, IV, V, VII. Коллагены можно использовать в форме ваты или гелей, и они, в частности, проявляют хорошую иммунологическую совместимость, а также легко обрабатываются.
Далее изобретение будет разъяснено на основании примеров и со ссылкой на прилагаемые чертежи, которые изображают:
Фиг.1 - схематическое изображение новообразования костей у кролика при использовании комплекса активных ингредиентов, по сравнению с холостой пробой,
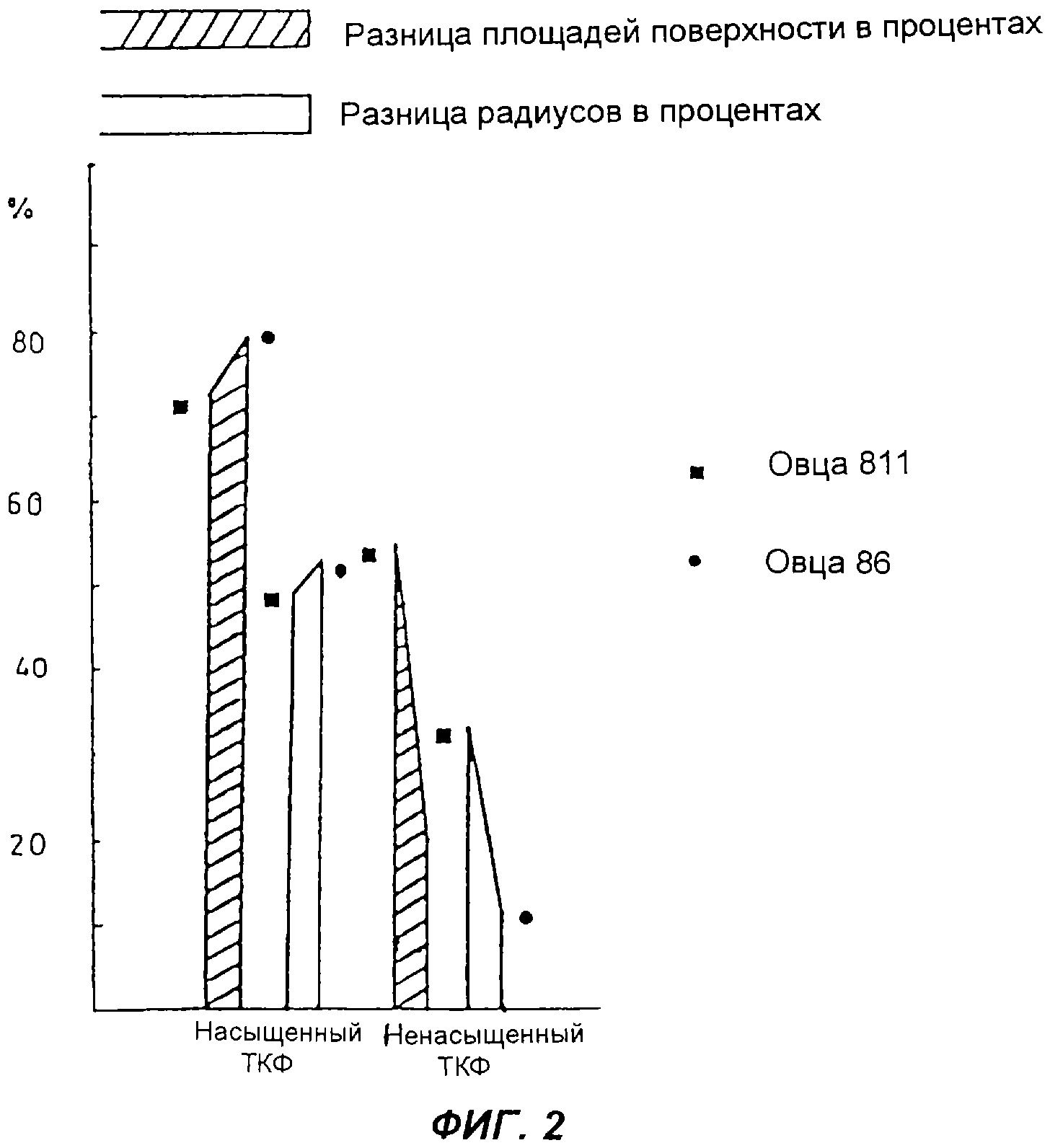
Фиг.2 - схематическое изображение новообразования костей у овцы при использовании комплекса активных ингредиентов с трикальцийфосфатом в качестве опорного материала, по сравнению с чистым трикальцийфосфатом,
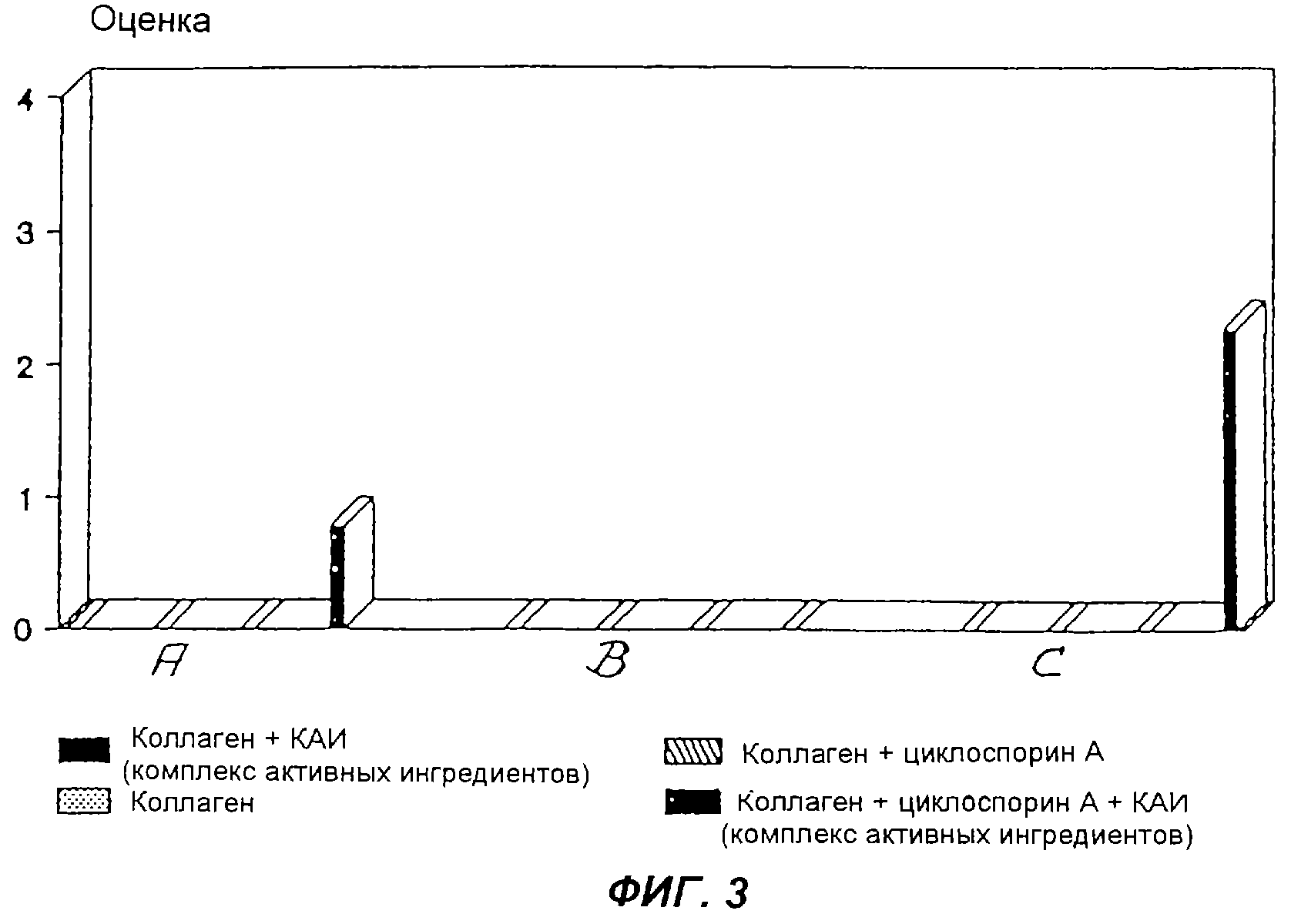
Фиг.3 - схематическое изображение новообразования костей у крыс при использовании комплекса активных ингредиентов с различными коллагенами в качестве опорного материала, по сравнению с чистыми коллагенами,
Фиг.4 - схематическое изображение полого тела, состоящего из углеродных волокон и не имеющего решетчатой структуры, с двумя камерами для сравнения комплекса активных ингредиентов и аутологичного губчатого вещества кости,
Фиг.5а-в - схематическое изображение полого тела из титана с решетчатой структурой, которое заполнено комплексом активных ингредиентов и используется для блокирования тел позвонков,
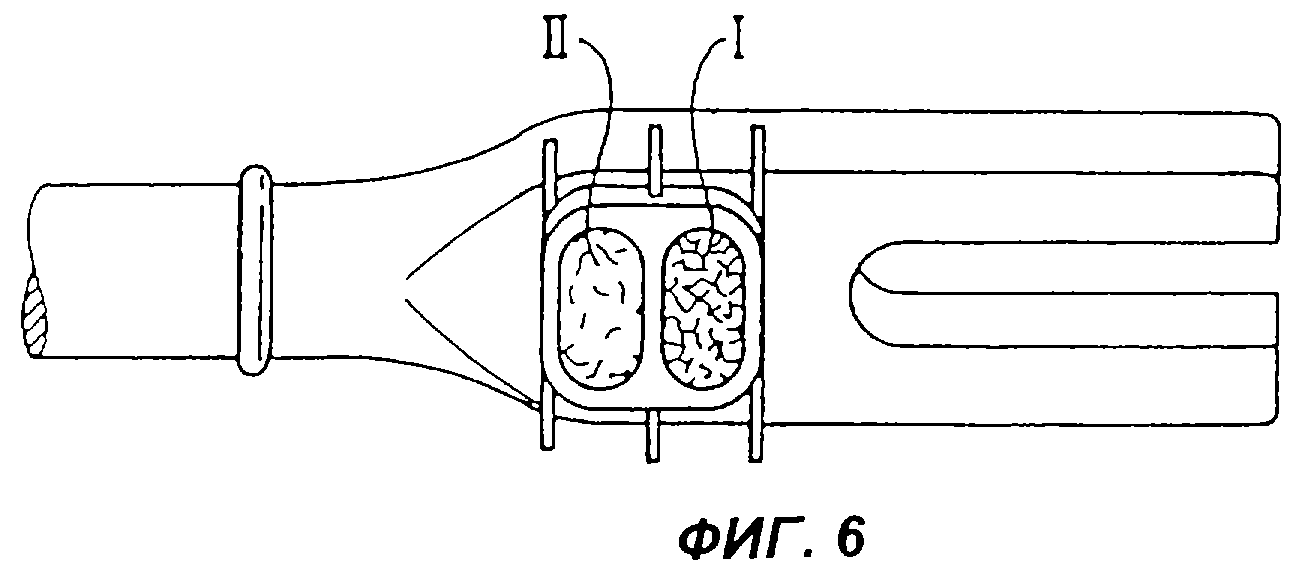
Фиг.6 - изображение устройства для установки или размещения каркаса, который представляет собой углеродный каркас с двумя камерами,
Фиг.7а,б - рентгенографические изображения значительно уменьшенных расстояний между поясничными позвонками в сегментах L5/S1 до операции,
Фиг.8а,б - рентгенографическое изображение имплантата между позвонками L4 и L5 поясничного отдела позвоночника с введенным с целью стабилизации фиксатором,
Фиг.9 - полученная с помощью компьютерной томографии последовательность снимков соответственно через три, шесть и девять недель после установки имплантата типа углеродного каркаса с комплексом активных ингредиентов и аутологичным губчатым веществом кости.
I. Изготовление комплекса активных ингредиентов
Далее будут описаны основные стадии процесса изготовления комплекса активных ингредиентов.
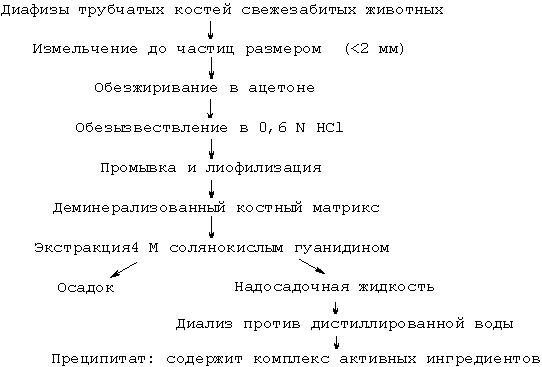
Трубчатые кости телят, овец, кроликов и крыс очищали и, среди прочего, освобождали от костного мозга, а затем замораживали. Замороженные кости измельчали на кусочки размером менее 2 мм. Измельченные кусочки костей обезжиривали в ацетоне и обезызвествляли в 0,6 N соляной кислоте. После этого их лиофилизировали и получали деминерализованный костный матрикс, который экстрагировали 4 молярным раствором солянокислого гуанидина. Раствор, полученный после экстракции, диализировали против дистиллированной воды и получали комплекс активных ингредиентов посредством центрифугирования и лиофилизации преципитата.
Этот основной способ изготовления еще раз представлен в приведенной ниже поэтапной схеме.
Поэтапная схема изготовления комплекса активных ингредиентов
II. Эффективность комплекса активных ингредиентов без использования опорных материалов
Для демонстрации того, что комплекс активных ингредиентов сам по себе является эффективным, вначале будет представлен опыт, в котором комплекс активных ингредиентов был имплантирован без дополнительных опор или опорных материалов.
1. Животные, использованные в опыте
Были использованы самки кроликов породы шиншилла, имеющие средний вес тела, равный 3089 г. Они, по потребности, получали корм, предназначенный для содержания кроликов, и подкисленную соляной кислотой до рН 4,5 дважды озонированную водопроводную воду.
Животных наркотизировали путем подкожной инъекции смеси кетамина и ксилацина.
2. Подготовка дефекта кости у кролика
Охлаждаемым изнутри бором препарировали полость для введения имплантата диаметром 4 мм и глубиной около 9 мм в коленном суставе (дистальный конец бедренной кости) кролика. Затем полученную таким образом полость заполняли, соответственно, 30 и 90 мг комплекса активных ингредиентов, который был изготовлен так, как описано в разделе I. Соответственно вторая высверленная полость служила "пустой полостью" для контроля новообразования кости.
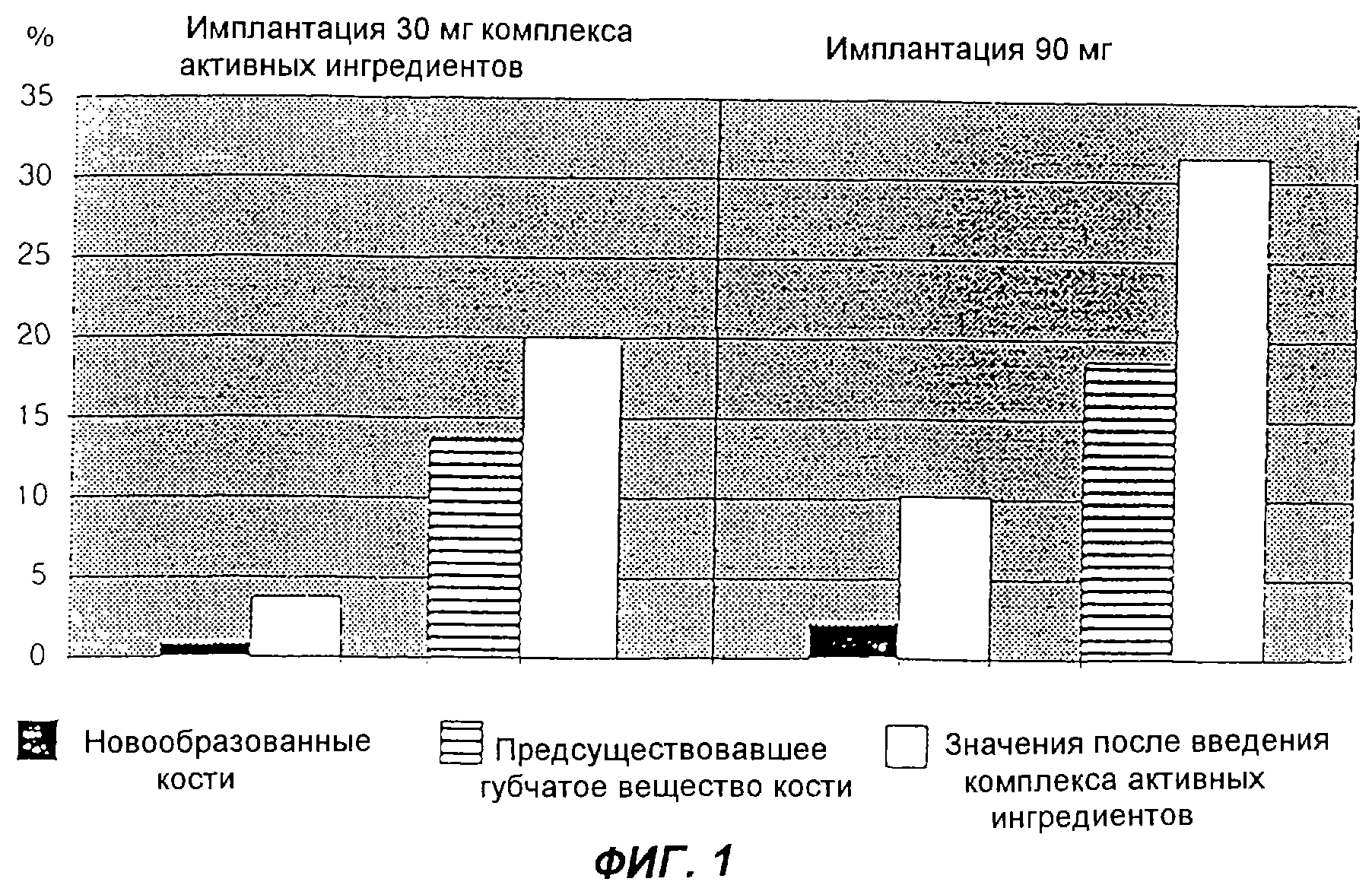
Фиг.1 изображает новообразование кости в пустой полости и в полости после имплантации комплекса активных ингредиентов, а также плотность окружающего отверстие предсуществовавшего губчатого вещества кости через 28 дней после операции (n=2/количество активного вещества).
При оценке результатов опыта было установлено, что плотность окружающего отверстия губчатого вещества кости после имплантации 30 мг комплекса активных ингредиентов была на 45% больше, а после имплантации 90 мг комплекса активных ингредиентов - на 69% больше, чем вокруг незаполненной полости. При этом количество предсуществовавшего губчатого вещества кости не оказывало влияния на регенерацию в области дефекта, так как новообразование кости после введения комплекса активных ингредиентов не выходило за границы высверленной полости, а равномерно распределялось по дефекту.
III. Образование кости в нижней челюсти овец при использовании трикальцийфосфата (ТКФ)
1. Животные, использованные в опыте
В описанных ниже опытах были использованы взрослые домашние овцы из скотоводческого центра Sudwest AG в Штуттгарте. В качестве корма они получали сено и воду, а также пюре из гранул Альтромина в течение трех дней перед оперативным вмешательством.
Премедикацию животных производили путем внутримышечной инъекции 1 мл Ксилацина и 1 мл Кетанеста. Затем овец наркотизировали нембуталом.
2. Подготовка имплантата
ТКФ суспензировали в растворе 100 мг комплекса активных ингредиентов в 10 мл воды и при непрерывном перемешивании подвергали глубокому замораживанию в жидком азоте. После лиофилизации в течение 24 часов и заключительной газовой стерилизации (этиленоксидом) ТКФ, насыщенный комплексом активных ингредиентов, вводили в описанный ниже дефект нижней челюсти овцы. Кроме того, второй дефект нижней челюсти, служивший контролем, заполняли ненасыщенным, стерилизованным в автоклаве ТКФ.
3. Подготовка дефекта нижней челюсти у овцы
В соответствующим образом подготовленной нижней челюсти овцы при охлаждении физиологическим раствором поваренной соли с помощью трепанационного бора диаметром 5 мм вырезали и удаляли нормированный цилиндрический участок кости. Затем высверленное таким образом отверстие заполняли ТКФ, насыщенным комплексом активных ингредиентов, согласно описанию опыта 1, а второе отверстие заполняли ненасыщенным ТКФ.
С целью облегчения анализа результаты по росту кости в дефектах нижней челюсти представлены графически на Фиг.2. Длительность опыта составляла 26 или 41 день.
Оказалось, что в результате насыщения ТКФ комплексом активных ингредиентов было достигнуто ускорение регенерации кости в дефекте нижней челюсти у обеих овец, имевших номера 811 и 86, в начальной фазе примерно на 100%. Через 41 день ускорение регенерации кости все еще было больше на 10%. Таким образом, заживление кости, особенно вначале, происходило гораздо быстрее, чем при отсутствии остеопродуктивного эффекта имплантата, насыщенного комплексом активных ингредиентов.
IV. Опыты с коллагенами в качестве опорных материалов
При изготовлении комплекса активных ингредиентов количественный выход его при требуемом уровне чистоты очень низок. Поэтому было исследовано, имеются ли опорные материалы, которые можно было бы соединить с комплексом активных ингредиентов, чтобы уменьшить таким образом количество комплекса активных ингредиентов, необходимое для соответствующей задачи, не снизив при этом его эффективность в отношении образования кости.
1. Комплекс активных ингредиентов
Комплекс активных ингредиентов, использованный для достижения цели описанного ниже опыта, был изготовлен точно так же, как описано в Разделе I, причем были использованы трубчатые кости телят.
2. Подопытные животные
Были использованы самцы крыс линии Вистар весом от 350 до 400 г, которых содержали в климатической камере для содержания животных при 23°С и относительной влажности воздуха около 50%. Их кормили кормом, предназначенным для содержания крыс и мышей.
Каждому подопытному животному в мышцы живота вводили два имплантата, изготовленные из одного и того же опорного материала, один из которых был покрыт слоем комплекса активных ингредиентов, тогда как другой, являвшийся контрольным имплантатом, не имел покрытия. Животных умерщвляли через 21 день, эксплантировали области, окружавшие имплантат в мышцах живота, и проводили их гистологическое исследование.
3. Использованные опорные материалы
Для этих опытов были использованы коллагеновые материалы, имеющиеся в продаже. Коллаген А был чистым, стерильным, нативным, резорбируемым коллагеном кожи быка, не содержащим каких-либо чужеродных добавок, таких как стабилизаторы или дезинфектанты.
Коллаген В был очищенным, лиофилизированным, с небольшим количеством поперечных связей, стерильным и не пирогенным коллагеном кожи быка со слабыми антигенными свойствами. Геликальная структура коллагена оставалась сохранной.
Коллаген С состоял из чистых, нативных и резорбируемых фибрилл коллагена быка.
Все использованные коллагены имели форму ваты. Отрезали куски коллагеновой ваты весом по 50 мг и добавляли к ним по 1 мл раствора комплекса активных ингредиентов (3 мг/мл). В случае контрольных имплантатов вместо этого добавляли 1 мл дистиллированной воды. Обработанные таким образом куски коллагеновой ваты замораживали при -20°С, лиофилизировали и получали имплантаты с диаметром, примерно равным 10 мм, и толщиной, примерно равной 5 мм. Фиг.3 изображает результаты образования кости на коллагеновых имплантатах А, В и С с покрытием и без покрытия комплексом активных ингредиентов у животных с угнетенным иммунитетом (циклоспорин А) и у животных с не угнетенным иммунитетом через 21 день. При этом оценка соответствует среднему арифметическому значению оценок тремя независимыми людьми шести имплантатов в каждой группе.
Коллаген А с покрытием из комплекса активных ингредиентов после этого периода у животных с угнетенным иммунитетом продемонстрировал костеобразующий эффект, тогда как для коллагена В этот эффект продемонстрировать не удалось. В отличие от этого, коллаген С продемонстрировал очень сильно выраженный костеобразующий эффект.
Из этого следует, что эффект обусловлен препаратом соответствующего использованного коллагена, и отсюда следует его пригодность в качестве опорного материала. Коллагены, являющиеся иммуногенными, непригодны для использования в качестве опорных материалов.
V. Испытание металлических и керамических материалов на их биосовместимость
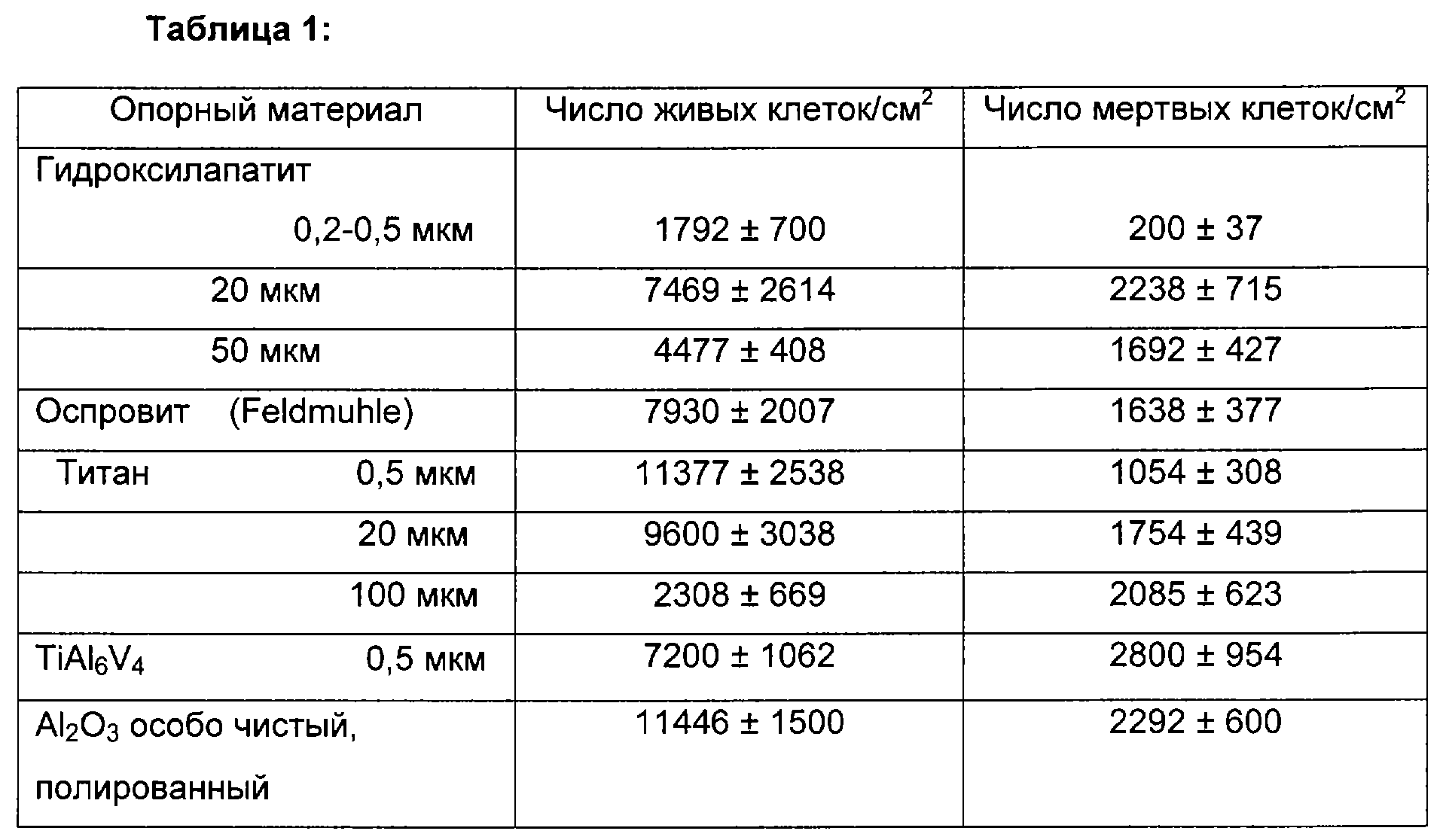
Были использованы титановые пластинки с различной шероховатостью (100, 20 и 0,5 мкм), сплав TiAl6V4 (0,5 мкм) и пластинки из Al2О3 производства фирмы Friedrichsfeld, а также пластинки из гидроксилапатита производства фирмы Feldmuhle AG.
Покрытия из комплекса активных ингредиентов, который был изготовлен по приведенной выше общей схеме способа с использованием трубчатых костей телят, были нанесены с помощью способа нанесения покрытия, называемого "покрытием погружением". Под "покрытием погружением" понимают способ нанесения покрытия, при котором предмет, на который необходимо нанести покрытие, в данном случае пластинку, погружают в раствор с желаемой, предварительно заданной концентрацией вещества, из которого необходимо создать покрытие, в данном случае комплекса активных ингредиентов. Затем его лиофилизируют. Получают тонкие слои или покрытия. Испытание вышеуказанных материалов на их биосовместимость проводилось, прежде всего, в отношении шероховатости их наружных поверхностей (n=20; по 4 пластинки). В Таблице 1 приведены полученные при этом результаты.
При этом испытании исследуемых материалов на биосовместимость оказалось, что титан, в связи с наивысшим числом живых клеток, а также наилучшим соотношением живых и мертвых клеток, очень хорошо подходит для использования в качестве опорного материала. В то время как гидроксилапатит также дал хороший результат, TiAl6V4 дал значительно худшие результаты.
Что касается шероховатости поверхности, то, в целом, оказалось, что самые гладкие наружные поверхности, то есть поверхности с диаметром пор 0,2-0,5 мкм, давали наилучшие результаты, за исключением TiAl6V4. С увеличением шероховатости или диаметров пор снижались и количество живых клеток, и соотношение живых и мертвых клеток. При диаметре пор, примерно равном 0,5 мкм, была получена наибольшая доля живой (костной) ткани в непосредственной близости от поверхности пластинок.
VI. Титановые тела и углеродные каркасы
После того как исследования, представленные в Разделе IV, продемонстрировали принципиальную биосовместимость титана, появилась исключительная возможность использовать комплекс активных ингредиентов в сохраняющих форму каркасах из титана для блокирования тел позвонков (спондилодез). Кроме того, обнаружилось, что для этого подходят и углеродные каркасы.
Удалось произвести и документировать вмешательство в позвоночный столб человека по поводу спондилодеза, которое позволило сравнить использование аутологичного губчатого вещества кости и комплекса активных ингредиентов.
Для этого был использован углеродный каркас с двумя камерами. Такой углеродный каркас схематично изображен на Фиг.4. Вместо углеродного каркаса может быть, абсолютно равнозначно, использовано полое тело из титана, которое схематично изображено на Фиг.5а, б, в. Фигуры 5а-5в изображают различные проекции заполненного комплексом активных ингредиентов полого тела из титана.
Для настоящих исследований был использован углеродный каркас без решетчатой структуры, так как он имелся в распоряжении с двумя камерами (I, II), чтобы с одной стороны поместить комплекс активных ингредиентов, а с другой - аутологичное губчатое вещество кости в качестве контроля.
Использованный комплекс активных ингредиентов был получен из костей телят так, как описано в Разделе I, и помещен в одну камеру (I) углеродного каркаса, тогда как другую камеру (II) заполнили аутологичным губчатым веществом кости больного, подлежащего лечению. Подготовленный таким образом углеродный каркас с помощью устройства для размещения или установки каркаса поместили в область L5/S1 сегментов позвоночника (поясничные позвонки в области межпозвоночных дисков). Устройство для размещения, уже содержащее углеродный каркас, представлено на Фиг.6, при этом на Фиг.6 правая камера (I) содержит комплекс активных ингредиентов, а левая камера (II) - аутологичное губчатое вещество кости.
Фиг.7а,б демонстрируют очень малое расстояние между позвонками L5 и S1 перед введением имплантата.
Фиг.8а,б демонстрируют опору, созданную посредством введения имплантата между позвонками L4 и L5, и введенный для стабилизации "внутренний фиксатор".
Фиг.9 демонстрирует (слева направо) изображение полученной с помощью компьютерной томографии последовательности сканов через три, шесть и девять недель после введения имплантата в форме каркаса, причем левая камера каркаса содержит аутологичный трансплантат губчатого вещества кости, а правая камера - комплекс активных ингредиентов. Ясно видно, что в левой камере с губчатым веществом оптическая плотность для рентгеновского излучения, являющаяся признаком образования кости, значительно ниже, тогда как в правой камере с комплексом активных ингредиентов оптическая плотность для рентгеновского излучения, являющаяся признаком образования кости, выше в течение всего периода времени. Имплантат согласно настоящему изобретению демонстрирует через девять недель, как минимум, такой же результат в отношении образования кости, как признанный "золотым стандартом" согласно современному уровню техники аутотрансплантат в отношении разрушения кости. При использовании имплантата согласно настоящему изобретению не требуется второе, сопряженное с риском хирургическое вмешательство, и не требуется времени для первичного разрушения кости.
В Таблице 2 приведены значения оптической плотности, измеренные в исследованиях, представленных графически на Фиг.9.
Реферат
Изобретение относится к медицине, а именно к созданию имплантатов, предназначенных для, как минимум, частичного создания, восстановления или стабилизации тел позвонков или трубчатых костей. В этом имплантате металлическое, неметаллическое или керамическое полое тело покрыто комплексом активных ингредиентов, предназначенным для получения костей, или содержит в своем составе указанный комплекс активных ингредиентов. Указанный комплекс активных ингредиентов включает следующие компоненты: как минимум, один структурный компонент на основе внеклеточного вещества, как минимум, один компонент, обеспечивающий миграцию клеток, как минимум, один адгезионный компонент и, как минимум, один компонент, обеспечивающий рост или созревание. Металлическое полое тело предпочтительно состоит из титана или титанового сплава и изготовлено в форме цилиндра с решетчатой структурой. Имплантат обеспечивает механическую стабильность при сохранении высокой эффективности комплекса активных ингредиентов и отсутствии побочных иммунологических реакций. 4 з.п. ф-лы, 2 табл., 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Материал-заменитель костного вещества

Комментарии