Полифункциональный биосовместимый гидрогель и способ его получения - RU2205034C1
Код документа: RU2205034C1
Чертежи






Описание
Область
техники
Изобретение относится к рецептуре и способу получения биосовместимого гидрогеля на основе поперечно-сшитого сополимера акриламида со сшивающими агентами, который может быть
использован в качестве материала медицинского назначения, например:
- при эндопротезировании путем целенаправленных инъекций гидрогеля для пластики мягких тканей лица, молочных желез, пениса,
икроножных мышц, голосовых связок и других тканей, плотность которых соответствует плотности гидрогеля;
- в качестве наполнителя при изготовлении эндопротезов, в том числе и эндопротезов
молочной железы;
- в качестве депо для лекарственных препаратов при длительном медикаментозном лечении, например, опухолей или абсцессов;
- в качестве носителя для культивирования
клеток человека и животных с последующим имплантированием гидрогеля, содержащего указанные клетки, в организм млекопитающих.
Предшествующий уровень техники
В медицинской
практике стоит задача получения искусственных материалов для замещения мягких тканей - мышечной ткани и подкожной клетчатки, достаточно дешевых и простых в изготовлении, и обладающих необходимыми
физико-химическими (определенная плотность и химическая инертность, способность к усадке или набуханию после помещения в организм) и биологическими (биологическая инертность, в частности, отсутствие
реакции отторжения или иной тканевой реакции) свойствами. Кроме того, материал должен иметь форму, удобную для введения его в мышечную ткань с минимальными травмами для организма пациента.
В качестве такого материала могут быть использованы гидрогели на основе полиакриламида.
Известен гидрогель на основе сополимера акриламида с метилен-бис-акриламидом в качестве сшивающего агента, описанный в патенте GB 2114578, предназначенный для изготовления хрусталика глаза, содержащий 11,0 мас.% сополимера акриламида и метилен-бис-акриламида, взятых в массовом соотношении 100:2,26, и 89 мас. % физиологического раствора.
Способ получения такого гидрогеля, описанный там же (GB 2114578), состоит в том, что проводят сополимеризацию растворенных в физиологическом растворе акриламида и метилен-бис-акриламида, в присутствии инициаторов полимеризации, одним из которых является тетраметилэтилендиамин, с последующей отмывкой конечного гидрогеля от непрореагировавших мономеров. Реакцию сополимеризации производят в одну стадию при комнатной температуре.
Однако полученный таким способом гидрогель не пригоден для использования при пластике мягких тканей в силу своей высокой плотности. Кроме того, вследствие одностадийного процесса сополимеризации, такой гель содержит большое количество свободных радикалов и мономеров, которые отрицательно влияют на тканевую реакцию организма.
Известен биосовместимый гидрогель, описанный в заявке ЕР 742022, содержащий от 3,5 до 9,0 мас.% поперечно-сшитого сополимера акриламида со сшивающим агентом - метилен-бис-акриламидом и 96,5 - 99,0 мас.% воды.
Этот гидрогель получен способом, описанным там же (ЕР 742022), заключающимся в том, что проводят реакцию сополимеризации акриламида с метилен-бис-акриламидом в водной среде, в присутствии пероксидных инициаторов полимеризации, с выдержкой реакционной смеси при комнатной температуре в течение 20 минут для сшивки сополимера. При этом процесс сополимеризации проводят в одну стадию, в качестве пероксидных инициаторов полимеризации используют смесь персульфата аммония и тетраметилэтилендиамина, а в качестве водной среды берут апирогенную воду или раствор хлорида натрия.
Гидрогель, полученный этим способом, имеет недостаточную степень сшивки, что обусловлено низким температурным режимом проведения процесса сополимеризации и его одностадийностью. Это приводит к быстрому прорастанию соединительной ткани в имплантированнный гель и к его быстрой усадке и резорбции (A. B. Shekhter et all "Injectable hydrophilic polyacrylamide gel Formacryl and tissue response to its implantation", в журн. "Анналы пластической, реконструктивной и эстетической хирургии", 1997, 2, стр.19).
Кроме того, полученный таким способом гидрогель содержит несвязанные молекулы тетраметилэтилендиамина, свободные МН2 радикалы и мономеры акриламида в количестве 1,0-1,2 мкг на 1 грамм полимера (1,0-1,2 ppm). Это может вызывать активную асептическую воспалительную реакцию на ранней стадии введения гидрогеля в организм (см. A.B. Shekhter et all "Injectable hydrophilic polyacrylamide gel Formacryl and tissue response to its implantation", в журн. "Анналы пластической, реконструктивной и эстетической хирургии", 1997, 2, стр.19).
Известен биосовместимый гидрогель, описанный в патенте RU 2127129, содержащий от 1,0 до 8,0 мас.% поперечно-сшитого сополимера акриламида со сшивающим агентом - метилен-бис-акриламидом и 92,0-99,0 мас.% воды. Способ получения этого материала также описан в патенте RU 2127129 и заключается в сополимеризации акриламида с метилен-бис-акриламидом в водной дисперсионной среде в присутствии пероксидного инициатора полимеризации. При этом в качестве водной среды берут подвергнутую электролизу воду, имеющую рН 9,0-9,5. Сшивку сополимера ведут при инкубации реакционной смеси в две стадии: при температуре 20-90oС в течение 2-24 часов и затем при температуре 100-105oС в течение 2-4 часов.
Полученный этим способом гидрогель не содержит тетраметилэтилендиамина, содержит чуть больше 1% свободных NH2 радикалов и мономеры акриламида в количестве 0,6-0,8 мкг на 1 грамм полимера (0,6-0,8 ppm). Однако после имплантации этого материала в организм пациента наблюдается его усадка в зависимости от содержания в нем воды до 12-20% от первоначальной массы. Это снижает косметический эффект пластической операции и, в некоторых случаях требует дополнительного введения этого материала. Кроме того, полиакриламидные гидрогели могут, как и агар-агар, служить носителем для размножения бактерий, что создает опасность развития воспалительного процесса в случае попадания в имплантат микрофлоры, в том числе и из организма реципиента.
Раскрытие изобретения
Основной задачей, на решение которой
направлено предлагаемое изобретение, является уменьшение степени резорбции и степени усадки биосовместимого гидрогеля на основе поперечно-сшитого полиакриламида после его имплантации в организм
пациента.
Другой задачей является понижение возможности заселения указанного гидрогеля болезнетворными микроорганизмами.
Еще одной задачей является уменьшение тканевой реакции организма на имплантат путем уменьшения содержания в гидрогеле свободных радикалов и мономеров.
Поставленные задачи решены тем, что предложен полифункциональный биосовместимый
гидрогель, содержащий поперечно-сшитый сополимер акриламида со сшивающим агентом и воду, который, согласно изобретению, в качестве сшивающего агента содержит смесь N,N'-метилен-бис-акриламида, N,
N'-этилен-бис-акриламида и повиаргола при следующем соотношении компонентов, мас.%:
Акриламид - 65,0-99,5
N,N'-метилен-бис-акриламид - 0,2-6,5
N,N'-этилен-бис-акриламид - 0,
2-34,0
Повиаргол - 0,1-3,0
В качестве сшивающего агента указанный сополимер может дополнительно содержать винилпирролидон или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид или их
смесь, при следующем соотношении компонентов, мас.%:
Акриламид - 65,0-99,4
N,N'-метилен-бис-акриламид - 0,2-6,5
N,N'-этилен-бис-акриламид - 0,2-34,0
Повиаргол - 0,
1-3,0
Винилпирролидон или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид, или их смеси - 0,1-2,5
В качестве воды указанный биосовместимый гидрогель содержит бидистиллированную
апирогенную воду.
Биосовместимый гидрогель имеет рН 3,5-7,5.
Указанный поперечно-сшитый сополимер составляет по массе от 2,0 до 15,0 мас.% от общей массы гидрогеля.
Указанный биосовместимый гидрогель содержит следующее соотношение компонентов, мас.%:
Акриламид - 1,3-15
N,N'-метилен-бис-акриламид - 0,004-0,975
N,
N'-этилен-бис-акриламид - 0,004-5,1
Повиаргол - 0,002-0,45
Вода - До 100
Указанный биосовместимый гидрогель может содержать также следующее соотношение компонентов,
мас.%:
Акриламид - 1,3-15
N,N'-метилен-бис-акриламид - 0,004-0,975
N,N'-этилен-бис-акриламид - 0,004-5,1
Повиаргол - 0,002-0,45
Винилпирролидон и/или
этилен-бис-(оксиэтиленнитрил)-тетрацетик ацид - 0,002-0,375
Вода - До 100
Поставленные задачи решаются также тем, что предложен способ получения полифункционального биосовместимого
гидрогеля путем сополимеризации акриламида со сшивающим агентом в водной среде в присутствии пероксидного инициатора полимеризации при инкубации реакционной смеси в две стадии, первую из которых
проводят при температуре 20-90oС в течение 2-24 часов, в котором, согласно изобретению, в качестве сшивающего агента берут смесь N,N'-метилен-бис-акриламида, N, N'-этилен-бис-акриламида и
повиаргола при следующем соотношении компонентов, мас.%:
Акриламид - 1,3-15
N,N'-метилен-бис-акриламид - 0,004-0,975
N,N'-этилен-бис-акриламид - 0,004-5,1
Повиаргол
- 0,002-0,45
Вода - До 100
а вторую стадию инкубации реакционной смеси проводят при температуре 107-130oС в течение не более 2 часов.
Способ может быть
осуществлен также, когда в качестве сшивающего агента берут смесь N,N'-метилен-бис-акриламида, N,N'-этилен-бис-акриламида, повиаргола, винилпирролидона и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик
ацида, при следующем соотношении компонентов, мас.%:
Акриламид - 1,3-15
N,N'-метилен-бис-акриламид - 0,004-0,975
N,N'-этилен-бис-акриламид - 0,004-5,1
Повиаргол - 0,
002-0,45
Винилпирролидон и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид - 0,002-0,375
Вода - До 100
После первой стадии инкубации реакционной смеси гидрогель промывают
в горячей воде, имеющей температуру 70-110oС, в течение по меньшей мере 3-х часов при массовом соотношении гидрогеля и воды 1: 8-10. В качестве инициатора полимеризации берут перекись
водорода и/или персульфат аммония в количестве не более 0,33 мас.% от суммарного веса исходных компонентов.
В качестве водной среды берут бидистиллированную апирогенную воду.
Как известно, материал в виде гидрогеля на основе сополимера акриламида и сшивающих агентов представляет собой трехмерную сеть поперечно-сшитого сополимера акриламида со сшивающими агентами, в ячейках которой удерживается водная среда, в которой содержится некоторое неустановленное количество несвязанного инициатора полимеризации, так как некоторое, также неустановленное количество инициатора полимеризации непосредственно встраивается в структуру сополимера (см. М. Н. Савицкая, Ю.Д. Холодова "Полиакриламид", Изд-во "Техника" 1969 г., стр. 103), или же вымывается из гидрогеля в случае его отмывки.
При этом биологически-активные свойства такого гидрогеля в значительной степени зависят от структуры сетчатого полимера, которая в свою очередь зависит от условий его синтеза, а именно качественного и количественного соотношения исходных реагентов, в том числе сшивающих агентов и инициаторов полимеризации, которые химическими и водородными связями встраиваются в структуру сополимера (по группам NH, CH, COOH, NH2, СН2), а также температурного режима осуществления полимеризации.
Сущность изобретения заключается в том, что включение в гидрогель на основе акриламида и N,N'-метилен-бис-акриламида в качестве сшивающих агентов N, N'-этилен-бис-акриламида и повиаргола, а также подбор условий проведения сополимеризации позволили уменьшить количество несвязанных аминогрупп, свободных NH2 радикалов, и непредельных двойных связей. Также удалось увеличить степень сшивки за счет образования структурных групп (HC-NH-CH), (-CO-NH-CR-O-R), (-CO-NH-NH-CO-), (H-COR-NH-CR-O-R), (-CONH-R-NH-CO), где R- СН3, СН2, NH2, С2Н5, и увеличения количества поперечных сшивок - N-N связей.
Все это позволило уменьшить тканевую реакцию организма на имплантацию предлагаемого гидрогел, обеспечить его высокую формоустойчивость при имплантации за счет уменьшения степени его резорбции и усадки в организме пациента, и понизить возможность заселения его микроорганизмами, в том числе из организма реципиента, и их размножения.
Краткое описание иллюстраций.
Для лучшего понимания изобретения ниже приведены примеры конкретного получения предлагаемого биосовместимого гидрогеля со сылками на прилагаемые иллюстрации,
где:
На фиг.1а представлен инфракрасный (ИК) спектр поглощения предлагаемого гидрогеля.
Фиг. 1б - ИК-спектр поглощения гидрогеля - прототипа, выпускаемого в России по патенту RU 2127129 под торговым наименованием "Формакрил".
Оба ИК-спектра выполнены в области 4000-500 см-1. (По оси "x" - указана длина волны света (см-1). по оси "y" - степень поглощения света Т (в %).
На фиг.2а представлена хроматограмма экстракта предлагаемого гидрогеля,
Фиг. 2б - хроматограмма экстракта гидрогеля "Формакрил". Обе
хроматограммы получены методом высокоэффективной жидкостной хроматографии с ультрафиолетовым детектором при длине волны 240 нм, и выполнены на хроматографической бумаге, на которой колонка цифр слева
определяет высоту пиков,
где пик 1 соответствует времени удерживания на колонке растворителя (ацетонитрила), пик 2 является количественным отражением содержания мономеров в вытяжке из
гидрогеля, полученной с помощью указанного растворителя. Единица (1см) высоты пика 2 на хроматограмме соответствует 0,057 мкг мономомеров, содержащихся в 1 г полимера (0,057 ррm).
На фиг. 3а представлена фотография гистологического среза биопсии ткани крысы, взятой через 30 суток после подкожной инъекции предлагаемого гидрогеля (окраска гематоксилин-эозином, х200).
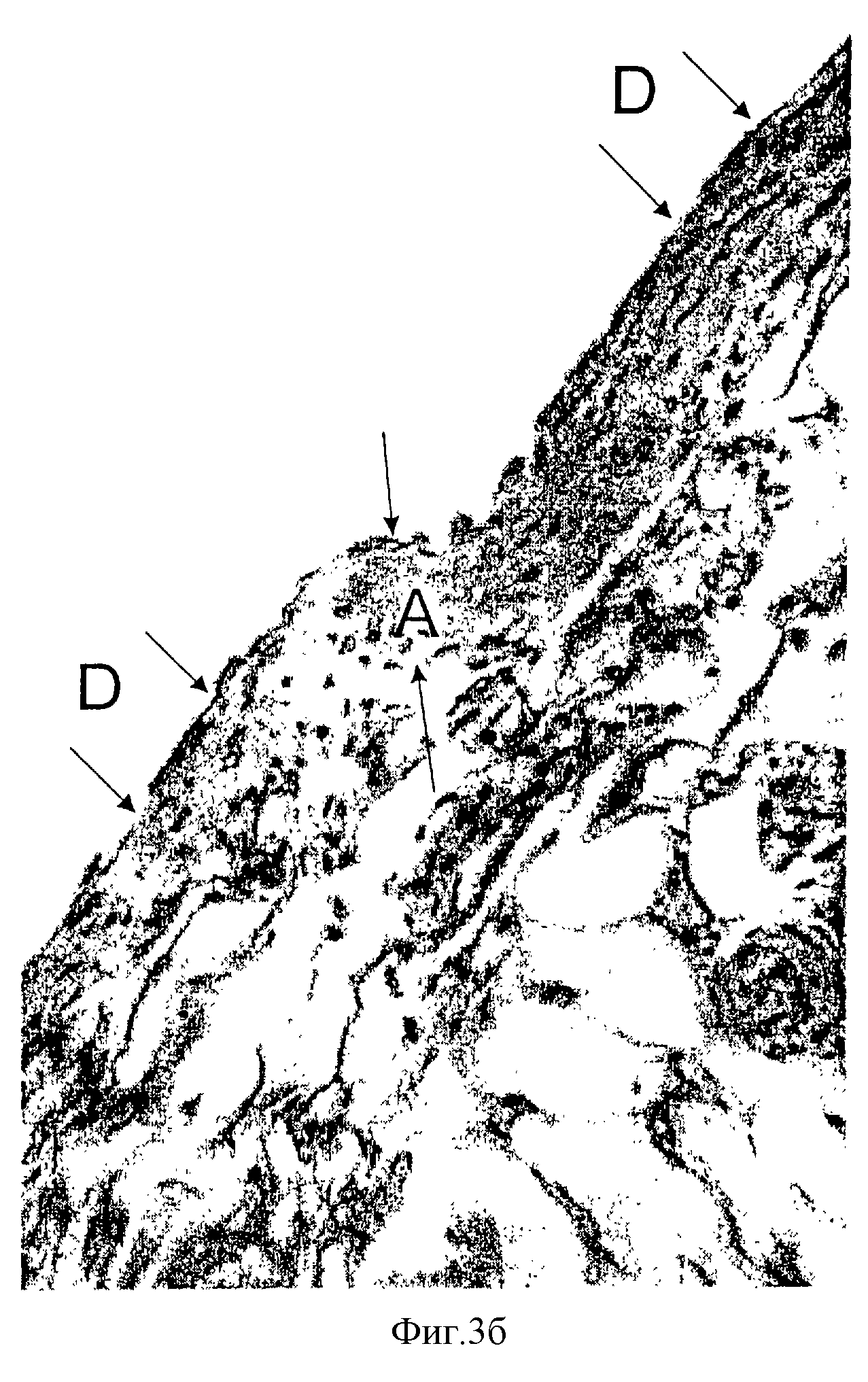
Фиг. 3б - фотография гистологического среза биопсии ткани крысы, взятой через 30 суток после подкожной инъекции гидрогеля "Формакрил" (окраска гематоксилин-эозином, х200).
На фиг. 4а представлена фотография гистологического среза биопсии ткани собаки, взятой через 9 месяцев после подкожной инъекции предлагаемого гидрогеля (окраска гематоксилин-эозином, х200).
Фиг. 4б - фотография гистологического среза биопсии ткани собаки, взятой через 9 месяцев после подкожной инъекции гидрогеля "Формакрил" (окраска гематоксилин-эозином, х400).
На фиг. 5а
представлена фотография гистологического среза биопсии ткани человека, взятой через 12 месяцев после субгландулярной имплантации предлагаемого гидрогеля для маммапластики (окраска гематоксилин-эозином,
х400),
где А - соединительно-тканная капсула,
В - закапсульная зона,
С - фрагмент гидрогеля,
D - макрофаги на поверхности капсулы А со стороны имплантата,
Е - зона лизиса гидрогеля,
F - тяжи соединительной ткани.
Варианты осуществления изобретения.
Для получения предлагаемого биосовместимого гидрогеля берут:
- Акриламид (acrylamide): С3Н5NО, мол. масса 71.08, белый кристаллический порошок без запаха; температура плавления 84,5oС; производство фирмы Sigma (Каталог
"Реактивы для биохимии и исследований в области естественных наук" SIGMA, 1999, с. 47, каталожный А8887).
- N,N'-метилен-бис-акриламид (N,N'-methylene-bis-acrylamide): C7 H10N2O2, мол. масса 154,16, белый кристаллический порошок без запаха, температура плавления 185oС, производство фирмы Sigma (Каталог "Реактивы для биохимии и исследований в области естественных наук" SIGMA, 1999, с. 696, каталожный М7256).
- N, N'-этилен-бис-акриламид (N,N'-ethylene-bis-acrylamide): C8H12N2 O2, мол. масса 168,2, производство фирмы Sigma (Каталог "Реактивы для биохимии и исследований в области естественных наук" SIGMA, 1999, с. 428, каталожный Е2763).
- Повиаргол (poviargolum) - серебросодержащий детергент, порошок, 97/167/7 от Института высокомолекулярных соединений РАН (Россия), Ф.Г.: 11.2 (Регистр лекарственных средств в России -Аптекарь, 2001, с. 1067), представляющий собой высокодисперсное металлическое серебро, стабилизированное поли-N-винилпирролидоном-2 (см. WWW: http; //home. comset.net/poviarg/; RU 2088234, опубл. 27.08.97).
- Этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид (ethylenebis(oxyethylenenitrilo)tetraacetic acid):[-C2H2OCH2CH2N(CH2CO2
H2)2]2, мол. масса 380,35, температура плавления 249oС, производство фирмы Aldrich (Catalog handbook of Fine Chemicals Aldrich, 1994-1995, c.664,
каталожный 23,453-2);
- 1-винил-2-пирролидон(винилпирролидон), (1-vinyl-2-pyrrolidone): C6H9NO, мол. масса 111,4; tпл 93oC; порошок белого цвета,
производство фирмы Fluka (Каталог Fluka Chemika-Biochemika, Switzerland, sFr, 1993/94, с. 1384, каталожный 95060);
- Персульфат аммония: (NH4)2S2O8
- мол. масса 228.19. бесцветные плоские кристаллы; температура разрушения 120oС; производство фирмы Sigma (Каталог "Реактивы для биохимии и исследований в области естественных наук" SIGMA,
1999, с. 117).
- Перекись водорода: Н2О2 - мол. масса 34,0; бесцветная жидкость, плотность при 0oС - 1,465; температура плавления -0,89oС; производство фирмы Sigma (Каталог "Реактивы для биохимии и исследований в области естественных наук" SIGMA, 1999, с. 556, каталожный Н6520).
Все вышеуказанные мономеры берут пригодными для биологических целей и не требующими дополнительной очистки.
Воду берут бидистиллированную апирогенную (рН=5,6).
Способ осуществляют следующим образом.
Для приготовления реакционной смеси берут бидистиллированную апирогенную воду, имеющую рН 5,6.
Готовят водный раствор акриламида и сшивающих агентов, например, смеси N, N'-метилен-бис-акриламида, N,N'-этилен-бис-акриламида и повиаргола (взятых в заданном массовом соотношении в пределах: 65,0-99,5: 0,2-6,5: 0,2-34,0: 0,1-3,0), или смеси N,N'-метилен-бис-акриламида, N, N'-этилен-бис-акриламида, повиаргола, винилпирролидона или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида, или суммы последних (взятых в заданном массовом соотношении в пределах: 65,0-99,4: 0,2-6,5: 0,2-34,0:0,1-3,0: 0,1-2,5), при этом общая масса исходных мономеров в растворе составляет 2,0-15,0%. (Варьируя количество исходных мономеров в смеси, получают гидрогель различной плотности и эластичности).
В полученный раствор вводят инициаторы полимеризации перекись водорода в количестве 0,1-0,3 мас. %, или персульфат аммония в количестве 0,0006-0,03 мас.%, или их смесь в любом соотношении и в количестве, не превышающем сумму их максимальных значений. Варьируя количество перекиси водорода и персульфата аммония, получают материал, имеющий желаемый рН в диапазоне 3,5-7, 5.
Готовую реакционную смесь фильтруют через бактерицидные полимерные фильтры, например, марки F8273 с размером пор 0,45 mm CA/CN, производитель Sigma (США), и помещают на инкубацию при температуре 20-90oС в течение 2-24 часов. После этой инкубации производят промывание гидрогеля, уже имеющего вид геля, горячей водой, для чего помещают гель в емкость с водой, имеющей температуру 90-100oС при соотношении объема геля и воды 1:8-10 на 4-6 часов. Затем проводят вторую стадию инкубации при 107-130oС в течение 1,0-1,5 часа.
Полученный гель фасуют в необходимом объеме во флаконы или шприцы и стерилизуют автоклавированием (при температуре 120oС, р=1,2 атм) в течение 20 минут.
Были проведены физико-химические, санитарно-химические и токсикологические исследования образцов предлагаемого гидрогеля, включая полученные в нижеприведенных Примерах 1-5, в соответствии со Стандартом ИСО 10993 "Оценка биологического действия медицинских изделий", "Методическими указаниями по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения" (Минздрав СССР, М. , 1988 г.), и Методическими рекомендациями "Допустимые количества миграции химических веществ, выделяющихся из полимерных и других материалов, контактирующих с пищевыми гидрогелями и методы их определения" СанПиН 42-122-42-40-86.
Определение содержания мономеров акриламида, N,N'- метилен-бис-акриламида, N, N'-этилен-бис-акриламида, и этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида проводили в соответствии с методикой, описанной в работе V.V. Kuznetsov et al. "Determination of Acrylamide in Polyacrylamidic gels"// The 52-nd Pittsburgh Conference on Analytical Chemistry and Applied Spectroscopy. - New Orleany, LA, 2001, Abstract Book, 1648.
Этими исследованиями было установлено, что предлагаемый гидрогель имеет следующие физико-химические характеристики.
Внешний вид - гель.
Цвет - от бесцветного до полупрозрачного темнокоричневого, опалесцирующего.
Показатель преломления - 1,328-1,360.
Плотность - 1,0-1,2 г/см3.
рН - 3,5-7,5.
Содержание мономеров - до 0,4 ppm.
Уровень бромируемости - не выше 1,0 (мг брома на 1 л).
Санитарно-химические испытания показали, что миграция металлов - Сu, Fe, Ni, Zn, Al, Ti, Аg в водную вытяжку из гидрогеля, определяемая атомно-абсорбционным методом, не найдена в пределах
чувствительности метода (0,02; 0,05; 0,05; 0,02; 0,005; 0,04 мг/л соответственно), что существенно ниже допустимых уровней, принятых для питьевой воды; миграция натрия составила не более 0,12 мг/л при
допустимом уровне в питьевой воде 200 мг/л;
Токсикологические испытания показали, что водные вытяжки из гидрогеля не проявили гемолитического эффекта в опытах "in vitro" с изолированными
эритроцитами кроликов. Установлен гемолиз 0,04% при допустимом значении показателя 2%.
Зона задержки роста золотистого стафилококка Staphylococcus aureus) вокруг вырезанных из образцов гидрогеля дисков, определенная как описано в методическом пособии "Метод определения антибиотической чувствительности микроорганизмов методом дисковой диффузии". М., Минздрав, 1984, составляла в зависимости от плотности образца (содержания в нем полиакриламида) 1,5-3 мм.
В остром опыте на белых мышах при парентеральном введении образцов гидрогеля в дозе 50,0 мл на 1 кг массы тела не отмечено гибели животных и клинических признаков интоксикации: общее состояние опытных мышей, их поведение, поедание корма, состояние шерстного покрова не отличались от контрольных.
При вскрытии опытных мышей установлено, что ткани в месте введения гидрогеля, региональные лимфатические узлы, внутренние органы (печень, почки, селезенка) были в пределах физиологической нормы и контроля.
Не было отмечено статистически достоверных отличий динамики массы тела, клинико-биохимических показателей крови, коэффициентов внутренних органов у опытных животных по сравнению с контролем при подкожной имплантации геля сроком на 2,5 месяца.
Не выявлено сенсибилизирующего эффекта гидрогеля при проведении иммунологической диагностической реакции дегрануляции тучных клеток (РДТК).
Микроядерным тестом на препаратах костного мозга не установлено мутагенного эффекта действия гидрогеля. Гистологическое изучение области имплантации гидрогеля и внутренних органов (печень, почки, селезенка, семенники) показало наличие слабо выраженной тканевой реакции на гидрогель только в первые дни после имплантации и отсутствие дистрофических и некротических изменений в органах.
Ниже приведены конкретные примеры получения предлагаемого биосовместимого гидрогеля и применения его для пластики мягких тканей.
Пример 1.
Для получения гидрогеля брали 384 мл бидистиллированной апирогенной воды, имеющей рН 5,6, и растворяли в ней 13 г акриламида, 0,5 г N,N'-метилен-бис-акриламида, 2,3 г N, N'-этилен-бис-акриламида и 0,2 г повиаргола, пригодных для биологических целей. Затем в исходный раствор вносили 0,04 г персульфата аммония и 2 мл 30%-ной перекиси водорода. Полученную смесь фильтровали через бактерицидный полимерный фильтр марки F8273 с размером пор 0,45 mm CA/CN, производитель Sigma (США) и помещали в емкость, которую ставили для инкубации на водяную баню при температуре 30oС в течение 22 часов. Затем гидрогель в виде геля промывали в горячей воде при соотношении воды и геля 10:1, при температуре 90o в течение 4 часов и еще раз инкубировали 1 час при температуре 125oС.
Полученный гидрогель стерилизовали автоклавированием (при температуре 120oС и давлении 1,2 атм.) в течение 20 минут.
Полученный гель содержит 96 мас.% водной фазы и 4 мас.% сополимера, в котором на 81,25 мас.% акриламида приходится 3,125 мас.% N,N'-метилен-бис-акриламида, 14,375 мас.% N, N'-этилен-бис-акриламида и 1,25 мас.% повиаргола и имеет рН=5,4.
Исследовали следующие характеристики гидрогеля:
показатель преломления (по методике, описанной в "Практикуме
по физической химии". М., 1974 г., стр.86-97); - рН (по методике, приведенной в книге "Методические указания по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения".
М., 1988 г. стр. 18,19); - уровень бромируемости (по методике, описанной в "Сборнике руководящих методических материалов по токсикологическим исследованиям полимерных материалов и изделий на их основе
медицинского назначения". М., МЗ СССР, 1987 г., стр.27-29);
- содержание мономеров - по методике, разработанной нами для определения содержания мономеров в водосодержащих полимерах: V. V.
Kuznetsov et al. "Determination of Acrylamide in Polyacrylamidic gels"// The 52-nd Pittsburgh Conference on Analytical Chemistry and Applied Spectroscopy. - New Orleany, LA, 2001, Abstract Book,
1648.
Полученный образец гидрогеля имел следующие физико-химические характеристики.
Внешний вид - бесцветный, полупрозрачный, опалесцирующий гель.
Показатель преломления - 1,348.
рН - 5,4.
Плотность - 1,0 г/см3.
Содержание мономеров 0,1 ppm.
Уровень бромируемости - 0,1(мг брома на 1 л).
Были получены ИК-спектр и хроматограмма экстракта этого гидрогеля, представленные соответственно на фиг.1а и фиг.2а.
Для сравнения на фиг.1б и фиг.2б представлены ИК-спектр и хроматограмма экстракта известного гидрогеля-прототипа, выпускаемого в России по патенту RU 2127129 под торговым названием "Формакрил", который содержит 96 мас.% водной фазы и 4 мас.% сополимера, где на 96 мас.% акриламида приходится 4,0 мас. % N,N'-метилен-бис-акриламида, имеет рН=5,4, уровень бромируемости 0,27 (мг брома на 1 л), и получен при инкубации исходной смеси в присутствии перекиси водорода и персульфата аммония в суммарном количестве 0,3 мас.%, при температуре 60oС в течение 12 часов, а затем при температуре 100oС еще 2 часа.
Как видно из спектра, представленного на фиг.1а, в нем отсутствуют полосы 1620 см-1, отвечающие за деформационные колебания NH2 радикалов, и 3200 см-1 и 3600 см-1, отвечающие за валентные колебания этих радикалов. Это свидетельствует о том, что в структуре полимера содержание свободных NH2 радикалов составляет не более 1% от общего количества функциональных групп.
Как видно из спектра, представленного на фиг.16 присутствует незначительная полоса - 1620 см-1, что указывает на наличие NН2 радикалов в количестве чуть более 1%.
Как видно из хроматограммы, представленной на фиг.2а, пик 2, соответствующий суммарному содержанию мономеров акриламида, N, N'-метилен-бис-акриламида, N,N'-этилен-бис-акриламида не превышает 5,1 см, что соответствует содержанию мономеров в количестве 0,29 ppm.
Как видно из хроматограммы, представленной на фиг.2б, содержание мономеров акриламида и N,N'-метилен-бис-акриламида в "Формакриле" составляет 0,6 ррm, высота пика 2 равна 10,7 см.
Исследовали также бактериостатические свойства полученного образца гидрогеля диско-диффузионным методом с использованием штамма золотистого стафилококка.
Было установлено, что зона отсутствия роста кокков вокруг образца составляла 1,5±0,1мм, в то время как вокруг контрольного образца, в качестве которого был взят такой же плотности гидрогель "Формакрил", зоны отсутствия роста бактерий не наблюдалось. Более того, наблюдался рост бактерий непосредственно под диском гидрогеля "Формакрил".
Исследовали степень усадки предлагаемого гидрогеля в сравнении с аналогичным свойством гидрогеля "Формакрил". Для этого имплантировали подкожно образцы объемом 30 мл предлагаемого гидрогеля и гидрогеля "Формакрил" животным, в частности собакам, с последующей выемкой этих образцов и проверкой содержания сухого остатка и водной фазы гидрогеля через один, три и шесть месяцев после пребывания имплантата в организме животного. Было установлено, что даже после пребывания предлагаемого имплантата в организме животного в течение 6 месяцев потеря водной фазы составила не больше 5% от ее исходного содержания в имплантате. В то время как потеря водной фазы в имплантированных образцах гидрогеля "Формакриле" составляла при аналогичных условиях около 10%. Количество сухого остатка и в том и в другом случае оставалось практически неизменным.
Была исследована тканевая реакция на имплантацию полученного образца гидрогеля в экспериментально-морфологическом и клинико-морфологическом исследованиях.
Исследования проводили на 160 крысах-самцах линии Август весом 200 г и 10 собаках.
Крысам вводили по 1 мл гидрогеля подкожно. Сроки морфологического исследования составляли 3, 7, 14, 30, 60 и 90 суток.
Длительные сроки имплантации (6-12 месяцев) изучали на собаках, которым вводили по 15 мл гидрогеля подкожно.
В клинике морфологическое исследование тканей после имплантации такого же гидрогеля пяти пациентам проводили: через 1 месяц после имплантации под кожу лицевой области, через 1,5 и 3,5 месяцев после внутримышечной имплантации в голени, и через 6 и 12 месяцев после имплантации с целью увеличивающей маммапластики путем наполнения гелем полости фиброзной капсулы после удаления силиконовых протезов.
Для проведения гистологического исследования тканевые блоки фиксировали в 96o этиловом спирте или нейтральном формалине и заливали в парафин. Срезы окрашивали гематоксилин-эозином, пикрофуксином по Ван-Гизону, серебрением по Гомори для изучения волокнистых компонентов, толуидиновым синим на кислые гликозаминогликаны, исследовали PAS-реакцию на гликоген и гликопротеины, а также реакцию Браше на РНК.
Некоторые результаты гистологических исследований представлены на фиг. 3а, 4а, 5.
Морфологическое исследование тканевой реакции организма на имплантацию полученного образца предлагаемого гидрогеля, проведенное на крысах, показало, что эта реакция минимальна. В ранние сроки (через 3-7 суток после имплантации) она ограничивается слабой лимфомакрофагальной инфильтрацией с единичными нейтрофилами и слабым отеком ткани, что свидетельствует о минимальной воспалительной реакции. На 3 сутки начинается пролиферация фибробластов в узкой зоне вокруг имплантанта, а к 7 суткам там формируется очень тонкая соединительно-тканная капсула, состоящая из фибробластов и тонких коллагеновых волокон. Эта капсула изнутри выстлана слоем макрофагов, граничащих с имплантантом. Через 14 суток капсула оформляется более четко, но остается тонкой и рыхлой. В толще капсулы, а также между ней и клетчаткой (в закапсульной зоне) видны небольшие фрагменты гидрогеля, окруженные макрофагами и отдельными гигантскими многоядерными клетками. Через 30 суток после имплантации капсула А (фиг. 3а) остается тонкой. Она состоит из зрелой соединительной ткани, количество фибробластов в которой уменьшается, а в оставшихся клетках снижается содержание РНК (RNA). В закапсульной зоне В остаются фрагменты С гидрогеля, которые резорбируются макрофагами. Внутренняя поверхность капсулы частично выстлана макрофагами. В последующие сроки (60 и 90 суток) структура капсулы не меняется, внутрь геля от капсулы местами проникают небольшие тяжи фибропластов.
Для сравнения на фиг.3б, представлена фотография гистологического среза биопсии ткани крысы, взятой через 30 суток после подкожной инъекции гидрогеля - прототипа ("Формакрил"), который содержит 96 мас.% водной фазы и 4 мас. % сополимера, где на 96 мас.% акриламида приходится 4,0 мас.% N,N'-метилен-бис-акриламида, имеет рН=5,4, уровень бромируемости 0,27 (мг брома на 1 л), и получен при инкубации исходной смеси в присутствии перекиси водорода и персульфата аммония в суммарном количестве 0,3 мас.%, при температуре 60oС в течение 12 часов, а затем при температуре 100oС еще 2 часа.
Как видно из фотографии на фиг.3б соединительно-тканная капсула А вокруг имплантата более толстая, чем при имплантации заявляемого материала. Внутри капсулы на ее внутренней поверхности и в закапсулированной зоне увеличено содержание макрофагов D, гигантских многоядерных клеток и нейтрофилов, что свидетельствует о незначительно выраженном воспалительном процессе.
Тканевая реакция в более поздние сроки (6, 9 и 12 месяцев) была исследована при подкожной имплантации гидрогеля собакам. Как видно на фиг.4а, имплантированный гидрогель С через 9 месяцев после имплантации в основном сохраняет свою гомогенную структуру. Вблизи очень тонкой и плотной соединительно-тканной капсулы А видна узкая зона Е просветления (лизиса) гидрогеля, который здесь резорбируется макрофагами и прорастает тяжами F фибробластов. Глубокой инфильтрации клеток в гидрогель у собак, как и у крыс, не выявлено, что и является причиной его длительной устойчивости. Отложений извести в капсуле и в самом гидрогеле как у собак, так и у крыс не наблюдается. Отсутствуют и дистрофические изменения клеток в ткани вокруг имплантанта, которые могли бы свидетельствовать о токсическом воздействии гидрогеля.
Для сравнения на фиг.4б представлена фотография гистологического среза биопсии ткани собаки, взятой также через 9 месяцев после подкожной инъекции образца (такого же, как и для фиг.3б) гидрогеля-прототипа (окраска гематоксилин-эозином, х400).
Как видно из этой фотографии гель С прорастает тяжами F соединительной ткани, содержащими фибробласты, макрофаги, лейкоциты и отдельные нейтрофильные лейкоциты. Отмечен частичный лизис Е геля и его резорбция.
Клинико-морфологические наблюдения, выполненные через 1 месяц после инъекции 90 мл образца предложенного гидрогеля для дермотензии кожно-жирового лоскута на лице с целью последующей пластики рубцов показали, что на границе между гидрогелем и тканями формируется очень тонкая и рыхлая соединительно-тканная капсула, состоящая всего из нескольких слоев коллагеновых волокон и фибробластов. Клеточная лимфомакрофогальная инфильтрация минимальна. В некоторых участках снаружи от капсулы видны тканевые вакуоли, оставшиеся на месте резорбированного геля. Там отмечается слабо выраженная макрофагальная и гигантоклеточная реакция.
Аналогичные результаты были получены в двух случаях наблюдений контурной пластики мягких тканей голени путем введения гидрогеля, полученного предлагаемым способом. Через 1,5 и 3,5 месяца после имплантации гидрогель оставался в основном гомогенным и прорастал соединительной тканью только возле капсулы. На фиг. 5 представлены результаты морфологического исследования биопсии, взятой через 12 месяцев после введения образца предложенного гидрогеля в количестве 200 мл на место удаленного силиконового протеза в полость оставшейся фиброзной капсулы.
Как видно из фиг.5, тканевая реакция на гель выражена слабо. "Старая" фиброзная капсула почти везде подвергнута обратному развитию. Имплантат С окружен тонкой соединительно-тканной капсулой А без внутреннего миофибробластического слоя, имеющего место в капсулах вокруг силиконового протеза. Местами в "новой" капсуле видны немногочисленные макрофаги D и лимфоциты без воспалительной нейтрофильной реакции. Сосуды капсулы немногочисленны, дистрофических изменений и отложений кальциевых солей в ней не обнаружено.
Вблизи капсулы А имеется неглубокое прорастание тонких соединительно-тканных тяжей (фибробластов, макрофагов и тонких незрелых коллагеновых волокон) в гидрогель. Часть макрофагов имеют крупную пенистую цитоплазму (активный фагоцитоз). Тяжи соединительной ткани разделяют гель вблизи капсулы на фрагменты.
Таким образом, приведенные результаты гистологических исследований, полученные в длительной динамике на животных, а также на биопсийном клиническом материале, свидетельствуют о высокой биосовместимости предложенного гидрогеля.
В ранние сроки после введения образцов предложенного гидрогеля в организм имелась очень слабая и быстро исчезающая воспалительная реакция, фибробластическая реакция была замедленной и слабой, капсула формировалась поздно и оставалась тонкой в течение всего периода наблюдения.
Характерно, что глубокой инвазии в гидрогель макрофагов и микрофагов не наблюдалось, что подтверждает его устойчивость к резорбции в организме. При этом гидрогель не снижает функциональной активности клеток и не приводит к их дистрофии, что свидетельствует об отсутствии миграции из него в ткань токсических веществ. Отсутствует также кальцификация гидрогеля и окружающих его тканей.
Полученный гидрогель был введен больной Л-кой 55 лет, вместо гидрогеля, который 5 лет тому назад был использован для первичной пластики груди и который вызвал воспалительный процесс обеих молочных желез. Больная наблюдалась в послеоперационном периоде в течение 8 месяцев с ежемесячными осмотрами. Рецидив воспалительного процесса не установлен. Получен положительный результат: молочные железы приобрели форму и размеры, соответствующие телосложению пациентки, и упругость, характерную для ткани здоровой молочной железы.
Пример 2.
Для получения гидрогеля брали 870 мл бидистиллированной апирогенной воды, имеющей рН, 5,6, растворяли в ней 81,0 г акриламида, 11,5 г N,N'-метилен-бис-акриламида, 32,9 г N, N'-этилен-бис-акриламида, 4,6 г повиаргола. Затем в исходный раствор вносили 8 мл перекиси водорода для инициации полимеризации. Полученную смесь фильтровали, как описано в примере 1, и помещали на инкубацию при температуре 80oС в течение 2 часов, затем проводили отмывание геля в горячей воде объемом 10 литров при температуре 80oС в течение 5,5 часов и инкубировали еще 1,5 часа при температуре 125oС.
Полученный гидрогель стерилизовали, как описано в примере 1.
Гидрогель имел следующие физико-химические характеристики, которые были определены в соответствии с методиками, указанными в примере 1.
Внешний вид - полупрозрачный слабо-желтой окраски гель.
Показатель преломления - 1,336.
рН - 4,0.
Плотность - 1,0 г/см3.
Содержание мономеров акриламида и бисакриламида - до 0,4 ррm.
Уровень бромируемости - 0,9 (мг брома на 1 л).
Бактериостатические
свойства:
зона подавления роста бактерий - 2,5 мм.
Полученный гидрогель был использован для пластики икроножной мышцы. Гидрогель в объеме 50 мл, был введен в икроножную мыщцу больной И., 42 года, для устранения дефекта после полученной травмы. Больная наблюдалась в послеоперационный период 6 месяцев.
Воспалительных явлений и отеков не' наблюдалось. Миграция геля отсутствовала. Косметологический эффект был достигнут.
Пример 3.
Для получения гидрогеля брали 972 мл бидистиллированной апирогенной воды, имеющей рН 5, 6, растворяли в ней 22,5 г акриламида, 0,375 г N,N'-метилен-бис-акриламида, 5 г N, N'-этилен-бис-акриламида, 0,06 г повиаргола и 0,065 г этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида. Затем в исходный раствор вносили 2,5 г персульфата аммония. Полученную смесь фильтровали, как описано в примере 1, и помещали на инкубацию при температуре 80oС в течение 2 часов, затем проводили отмывание геля в горячей воде объемом 8 литров при температуре 100oС в течение 5,5 часов и инкубировали еще 1,5 часа при температуре 125oС.
Полученный гидрогель стерилизовали, как описано в примере 1.
Гидрогель имел следующие физико-химические характеристики, которые были определены в соответствии с методиками, указанными в примере 1.
Внешний вид - бесцветный гель.
Показатель преломления - 1,334.
рН - 6,8.
Плотность - 1,0 г/см3.
Содержание мономеров акриламида - отсутствуют.
Содержание остальных мономеров 0,02 ppm.
Уровень бромируемости - 0,15 (мг брома на 1 л).
Бактериостатические
свойства:
зона подавления роста бактерий 1,5 мм.
Были проведены сравнительные исследования степени усадки образцов предлагаемого гидрогеля и прототипа - "Формакрил", содержащих одинаковое 2,8 мас. % количество полиакриламида.
Для этого одинаковые по объему (30 мл) образцы гидрогеля были имплантированы подкожно собакам и извлечены через 3 и 6 месяцев.
Определение сухого остатка и водной фазы в извлеченных имплантатах показало, что
- "Формакрил" через 4 месяца после имплантации теряет 20% воды, а через 6 месяцев
после имплантации теряет 30% воды;
- предлагаемый гидрогель, содержащий в качестве сшивающего агента смесь N, N'-метилен-бис-акриламида, N,N'-этилен-бис-акриламида и повиаргола, через 4
месяца после имплантации теряет 10% воды, а через 6 месяцев после имплантации теряет 15% воды;
- предлагаемый гидрогель, содержащий в качестве сшивающего агента смесь N,
N'-метилен-бис-акриламида, N,N'-этилен-бис-акриламида, повиаргола и этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида, через 4 месяца после имплантации теряет 5% воды, а через 6 месяцев после
имплантации теряет 9% воды.
Таким образом, введение в состав гидрогеля этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида (или винилпирролидона или их смеси) обеспечивает уменьшение усадки имплантата, которая более характерна для гидрогелей с низким содержанием сухого остатка.
Гидрогель с низким содержанием сухого остатка до 3% легко вводится через тонкие иглы и может быть использован для пластики мягких тканей лица. Однако без введения в состав полимера этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида он может давать усадку до 30%. Добавка этилен-бис-(оксиэтиленнитрил)-тетраацетик ацида позволяет получить гель, который, с одной стороны, легко вводится через тонкую иглу, а с другой стороны, имеет усадку до 10%, присущую гидрогелю с более высоким содержанием сухого остатка.
Полученный гидрогель был использован для пластики подкожной клетчатки при удалении морщин на лице. Гидрогель в объеме 1 мл был введен больной С., 47 лет. Больная наблюдалась в послеоперационном периоде в течение 12 месяцев с периодическими осмотрами раз в три месяца. Воспалительных и аллергических явлений не установлено. Желаемый косметический эффект был достигнут.
Пример 4.
Для получения гидрогеля брали 965 мл бидистиллированной апирогенной воды рН 5,6, и растворяли в ней 28,7 г акриламида, 2,08 г N, N'-метилен-бис-акриламида, 3,5 г N,N'-этилен-бис-акриламида, 0,1 г повиаргола и 0,82 г винилпирролидона. Затем в исходный раствор вносили 0,03 г персульфата аммония. Полученную смесь фильтровали, как описано в примере 1, и помещали на инкубацию при температуре 60oС в течение 12 часов, затем проводили отмывание геля в 10 л горячей воды при температуре 100oС в течение 4,5 часов и инкубировали еще 1,5 часа при температуре 120oС.
Полученный гидрогель стерилизовали автоклавированием, как описано в примере 1.
Материал имел следующие физико-химические характеристики.
Внешний вид - бесцветный, опалесцирующий, полупрозрачный гель.
pН - 5,2.
Плотность - 1,0 г/см3.
Содержание мономеров 0,04 ppm.
Уровень бромируемости - 0,05(мг брома на 1 л).
Бактериостатические свойства: зона подавления роста бактерий - 2,0 мм.
Полученный гидрогель был использован для устранения носогубных складок. Гидрогель в количестве 2 г вводился больной К., 27 лет. Больная наблюдалась в послеоперационном периоде в течение 12 месяцев с периодическими осмотрами раз в три месяца. Воспалительных явлений и отеков не наблюдалось. Желаемый косметический эффект был достигнут.
Добавка в смесь сшивающих агентов винилпирролидона также позволяет получить гидрогель, который легко вводится через тонкую иглу, как гель, имеющий содержание полиакриламида до 4 мас.%, и имеет усадку до 10%, присущую гелю с более высоким содержанием сухого остатка.
Пример 5.
Для получения гидрогеля брали 375 мл бидистиллированной апирогенной воды рН 5,6, и растворяли в ней 23,75 г акриламида, 1,075 г N,N'-метилен-бис-акриламида, 0,145 г N,N'-этилен-бис-акриламида, 0,03 г повиаргола. Затем в исходный раствор вносили 0,02 г персульфата аммония и 1 мл 30%-ной перекиси водорода. Полученную смесь фильтровали, как описано в примере 1, и помещали на инкубацию при температуре 50oС в течение 16 часов, затем проводили отмывание геля в 3,5 л горячей воды при температуре 100oС в течение 4,0 часов и инкубировали еще 1 час при температуре 130oС.
Полученный гидрогель стерилизовали автоклавированием, как описано в примере 1.
Материал имел следующие физико-химические характеристики.
Внешний вид - бесцветный гель.
Показатель преломления - 1,348.
рН - 4,8.
Плотность - 1,0 г/см3.
Содержание мономеров 0,03 ppm.
Уровень бромируемости - 0,12(мг брома на 1 л).
Бактериостатические свойства: обеспечивает зону подавления роста бактерий шириной 2,0 мм.
Полученный гидрогель был введен больной Л-овой, 36 лет., вместо силиконового протеза, который 3 года тому назад был использован для проведения первичной пластики груди и который уже через 7 месяцев после операции вызвал фиброз обеих молочных желез. Была проведена операция по удалению силиконовых протезов с открытой капсулотомией и с отсроченным введением по 180 г в каждую железу полученного гидрогеля. Через 3 месяца было введено еще по 100 г такого же гидрогеля. Больная наблюдалась в послеоперационном периоде в течение 7 месяцев с осмотрами один раз в два месяца. Рецидива фиброза нет. В результате операции молочные железы приобрели форму и размеры, соответствующие телосложению пациентки, и упругость, характерную для ткани здоровой молочной железы. Желаемый косметический эффект был получен.
Промышленная применимость
Таким образом, приведенные примеры конкретного выполнения
подтверждают, что предлагаемый биосовместимый гидрогель может быть получен с помощью предлагаемого способа.
Кроме того, предлагаемый гидрогель практически не вызывает тканевой реакции, не вызывает сенсибилизации организма, не вызывает дистрофические и некротические изменения и может быть использован для эндопротезирования и контурной пластики мягких тканей, а также для эндопротезирования суставов и в качестве синовиальной среды в суставах и протезах суставов.
По сравнению с известным гидрогелем-прототипом (гидрогель "Формакрил") предлагаемый гидрогель имеет более низкую тканевую реакцию организма на его имплантацию, более высокую формоустойчивость при имплантации и более низкую возможность заселения и размножения в нем патогенной микрофлоры.
Предлагаемый гидрогель может быть использован также в качестве наполнителя при изготовлении эндопротезов, содержащих оболочку и наполнитель, а также в качестве депо для лекарственных препаратов при длительном медикаментозном лечении, например, опухолей или абсцессов, и в качестве носителя для культивирования клеток человека и животных с последующим имплантированием гидрогеля, содержащего указанные клетки, в организм млекопитающих.
Введение в состав предлагаемого гидрогеля дополнительных сшивающих агентов, таких как 1-винил-2-пирролидон и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид, обеспечивает уменьшение степени его усадки без изменения других физико-механических характеристик.
Реферат
Полифункциональный биосовместимый гидрогель, содержащий в мас.% акриламида - 1,3-15, сшивающих агентов - N,N'-метилен-бис-акриламида - 0,004-0,975, N, N-этилен-бис-акриламида - 0,004-5,1, повиаргола - 0,002-0,45 и воды - до 100. Гидрогель получают сополимеризацией акриламид со сшивающими агентами в водной среде в присутствии пероксидного инициатора полимеризации, при инкубации реакционной смеси в две стадии, первую из которых проводят при температуре 20-90oС в течение 2-24 часов, вторую стадию - при температуре 107-130oС в течение не более 2 часов. Гидрогель обладает пониженной тканевой реакцией организма на его имплантацию и низкой возможностью заселения патогенной микрофлоры. 2 c. и 14 з.п.ф-лы, 9 ил.

Формула
Акриламид - 65,0 - 99,5
N, N'-метилен-бис-акриламид - 0,2 - 6,5
N, N'-этилен-бис-акриламид - 0,2 - 34,0
Повиаргол - 0,1 - 3,0
3. Полифункциональный биосовместимый гидрогель по п. 1, отличающийся тем, что он содержит следующее соотношение компонентов, мас. %:
Акриламид - 1,3 - 15
N, N'-метилен-бис-акриламид - 0,004 - 0,975
N, N'-этилен-бис-акриламид - 0,004 - 5,1
Повиаргол - 0,002 - 0, 45
Вода - До 100
4. Полифункциональный биосовместимый гидрогель по п. 1, отличающийся тем, что в качестве сшивающего агента указанный поперечно-сшитый сополимер дополнительно содержит винилпирролидон и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид.
Ариламид - 65,0 - 99,4
N, N'-метилен-бис-акриламид - 0,2 - 6,5
N, N'-этилен-бис-акриламид - 0,2 - 34,0
Повиаргол - 0,1 - 3,0
Винилпирролидон и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид - 0,1 - 2,5
6. Полифункциональный биосовместимый гидрогель по п. 4, отличающийся тем, что он содержит следующее соотношение компонентов, мас. %:
Акриламид - 1,3 - 15
N, N'-метилен-бис-акриламид - 0,004 - 0,975
N, N'-этилен-бис-акриламида - 0,004 - 5,1
Повиаргол - 0,002 - 0,45
Винилпирролидон и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид - 0,002 - 0,375
Вода - До 100
7. Полифункциональный биосовместимый гидрогель по п. 1, отличающийся тем, что указанный поперечно-сшитый сополимер составляет от 2,0 до 15,0 мас. % от общей массы указанного биосовместимого гидрогеля.
Акриламид - 1,3 - 15
N, N'-метилен-бис-акриламид - 0,004 - 0,975
N, N'-этилен-бис-акриламид - 0,004 - 5,1
Повиаргол - 0,002 - 0,45
Вода - До 100
вторую стадию инкубации реакционной смеси проводят при 107-130oС в течение не более 2 ч.
Акриламид - 1,3 - 15
N, N'-метилен-бис-акриламид - 0,004 - 0,975
N, N'этилен-бис-акриламид - 0,004 - 5,1
Повиаргол - 0, 002 - 0,45
Винилпирролидон и/или этилен-бис-(оксиэтиленнитрил)-тетраацетик ацид - 0,002 - 0,375
Вода - До 100
12. Способ по п. 10, отличающийся тем, что указанный гидрогель после первой стадии инкубации промывают в горячей воде.

Комментарии