Сополимер и медицинский материал, содержащий его - RU2757274C2
Код документа: RU2757274C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к сополимеру и медицинскому материалу, содержащему его.
УРОВЕНЬ ТЕХНИКИ
[0002] Медицинские материалы и медицинские устройства, которые вступают в контакт с кровью (например, искусственные почки, искусственные легкие, искусственные кровеносные сосуды, искусственные клапаны, стенты, стенты-графты, катетеры, устройства захвата тромбов, ангиоскопы, шовные нити, контуры циркуляции крови, трубки, канюли, мешки для крови и шприцы), должны обладать сильными антитромботическими свойствами для того, чтобы предотвращать гипофункцию из-за коагуляции крови. До настоящего времени, чтобы усовершенствовать антитромботические свойства медицинских материалов и медицинских устройств, использовали прием внедрения гепарина или производного гепарина в качестве антикоагулянтного лекарственного средства на поверхность материала основы.
[0003] Примером описанного способа внедрения гепарина или производного гепарина на поверхность материала основы является способ иммобилизации гепарина или производного гепарина посредством ионной связи с положительно заряженным катионным соединением, вводимы в поверхность материала основы (патентные документы с 1 до 3).
[0004] Между тем, в качестве способа связывания антитромботического соединения, отличного от гепарина или производного гепарина, с поверхностью материала основы, приведен способ иммобилизации соединения, обладающего характеристикой активации антитромбина, на поверхности материала основы (патентные документы 4 и 5).
[0005] Кроме того, также приведен способ сшивки и иммобилизации сополимера винилпирролидона/винилацетата, обладающего характеристикой подавления адгезии тромбоцитов, на поверхности материала основы, выполненного из полой волоконной мембраны посредством облучения излучением в воде (патентные документы 6 и 7).
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006] Патентный документ 1: японский патент № 4152075
Патентный документ 2: японский патент № 3497612
Патентный документ 3: японский патент № 4273965
Патентный документ 4: международная публикация № 2012/176861
Патентный документ 5: международная публикация № 2015/080176
Патентный документ 6: японский патент № 4888559
Патентный документ 7: японский патент № 5857407
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
[0007] Однако прием внедрения гепарина или производного гепарина в поверхность материала основы как в патентных документах с 1 до 3, нельзя использовать у пациентов с индуцированной гепарином тромбоцитопенией или пациентов с кровотечениями. Кроме того, поскольку гепарин и производные гепарина представляют собой компоненты животного происхождения, следует уделять внимание введению и обращению с этими соединениями.
[0008] Кроме того, прием внедрения соединения, обладающего характеристикой активации антитромбина, в поверхность материала основы, описанный в патентных документах 4 и 5, сложно использовать у пациентов с кровотечением, поскольку может быть сложно останавливать кровотечение в ходе лечения, если соединение вымывается. Кроме того, соединение, обладающее характеристикой активации антитромбина, является значительно более дорогостоящим, чем полимерные соединения и т. п., поскольку оно представляет собой антикоагулянтное лекарственное средство.
[0009] Сополимер винилпирролидона/винилацетата, описанный в патентных документах 6 и 7, когда его используют в медицинском устройстве, которое можно использовать в течение более чем одних суток в организме, таком как стент или катетер, может вызывать тромбоз на поверхности материала основы из-за длительного использования. Кроме того, сополимер можно иммобилизовать на поверхности материала основы только посредством сшивки и иммобилизации через облучение излучением. Следовательно, сополимер может не достаточно проявлять антитромботические свойства из-за его трехмерной сшивки или модификации.
[0010] Следовательно, цель настоящего изобретения состоит в том, чтобы предоставить сополимер, который можно иммобилизовать на материале основы, при этом сохраняя сильные антитромботические свойства постоянно без необходимости введения гепарина или антикоагулянтного лекарственного средства на поверхность материала основы, и медицинский материал, содержащий сополимер.
РЕШЕНИЯ ПРОБЛЕМ
[0011] В результате тщательного исследования для решения указанных выше проблем, авторы настоящего изобретения пришли к следующим изобретениям с (1) до (11).
(1) Сополимер содержащий мономерное звено A, мономерное звено B и мономерное звено C, которые представлены общей формулой (I), представленной далее, где молярная фракция мономерного звена C на основе всех мономерных звеньев, которые образуют сополимер, составляет от 0,5 до 40%:
[0012] [Химическая формула 1]

[0013] где RA представляет функциональную группу, имеющую амидную связь, RB представляет алкил или алкенил, имеющий от 2 до 20 атомов углерода, RC представляет алкил или алкенил, где произвольный атом водорода замещают по меньшей мере одной функциональной группой, выбранной из группы, состоящей из аминогруппы, азидогруппы, иминогруппы, карбоксигруппы, хлорангидридной группы, кислой ангидридной группы, альдегидной группы, гидроксильной группы, группы фосфорной кислоты, тиоловой группы, изоцианатной группы, тиоизоцианатной группы, эпоксигруппы, галогенированной алкильной группы, цианогруппы, винильной группы, этинильной группы, нитрогруппы и нитрозогруппы и их ионизированных функциональных групп (где произвольный атом углерода в алкиле или алкениле из RC необязательно замещают атомом азота, атомом кислорода или атомом серы) и каждый из X1, X2 и X3 представляет атом водорода или метильную группу.
(2) Сополимер в соответствии с (1), в котором мономерное звено A представлено любой одной из общих формул с (II) до (IV), представленных далее:
[0014] [Химическая формула 2]

[0015] [Химическая формула 3]

[0016] [Химическая формула 4]

[0017] где m представляет целое от 1 до 5.
(3) Сополимер в соответствии с (1) или (2), где мономерное звено A, мономерное звено B и мономерное звено C расположены случайно.
(4) Сополимер в соответствии с любым одним из с (1) до (3), имеющий среднечисловую молекулярную массу от 1000 до 100000.
(5) Сополимер в соответствии с любым одним из с (1) до (4), где RC представляет собой алкильную группу, в которой произвольный атом водорода замещают по меньшей мере одной функциональной группой, выбранной из аминогруппы, изоцианатной группы и эпоксигруппы.
(6) Медицинский материал, содержащий сополимер в соответствии с любым одним из с (1) до (5) и материал основы, связанный с сополимером.
(7) Медицинский материал в соответствии с (6), в котором материал основы выполняют из полимера, имеющего повторяющееся звено, содержащее сложноэфирную связь в основной цепи.
(8) Медицинский материал в соответствии с (6), который дополнительно содержит производное фосфоновой кислоты или производное катехола, где материал основы выполняют из металла, сополимер связывают с производным фосфоновой кислоты или производным катехола, производное фосфоновой кислоты связывают с материалом основы через его группу фосфоновой кислоты и производное катехола связывают с материалом основы через его группу катехола.
(9) Устройство захвата тромбов, содержащее медицинский материал в соответствии с любым одним из с (6) до (8).
(10) Медицинский материал в соответствии с (6), где материал основы выполняют из полимера, часть которого содержит гидроксильную группу или карбоксигруппу, введенную в него, и где по меньшей мере один атом водорода в основной цепи замещают атомом хлора, или полимера, часть которого содержит гидроксильную группу или карбоксигруппу, введенную в него, и который имеет силоксановую связь в по меньшей мере его части, и сополимер связывают с материалом основы через гидроксильную группу или карбоксигруппу.
(11) Контур циркуляции крови, содержащий медицинский материал в соответствии с (10).
[0018] В результате тщательного исследования для решения указанных выше проблем, авторы настоящего изобретения также пришли к следующим изобретениям с (12) до (20).
(12) Сополимер, содержащий мономерное звено A, мономерное звено B и мономерное звено C, которые представлены общей формулой (I), представленной далее, где молярная фракция мономерного звена C на основе всех мономерных звеньев, которые образуют сополимер, составляет от 0,5 до 40%:
[0019] [Химическая формула 5]

[0020] где RA представляет функциональную группу, имеющую амидную связь, RB представляет алкил или алкенил, имеющий от 2 до 20 атомов углерода, и RC представляет алкил или алкенил, где произвольный атом водорода замещают по меньшей мере одной функциональной группой, выбранной из группы, состоящей из аминогруппы, азидогруппы, иминогруппы, карбоксигруппы, хлорангидридной группы, кислой ангидридной группы, альдегидной группы, гидроксильной группы, группы фосфорной кислоты, тиоловой группы, изоцианатной группы, тиоизоцианатной группы, эпоксигруппы, галогенированной алкильной группы, цианогруппы, винильной группы, этинильной группы, нитрогруппы или нитрозогруппы или их ионизированных функциональных групп (где произвольный атом углерода в алкиле или алкениле из RC необязательно замещают атомом азота, атомом кислорода или атомом серы).
(13) Сополимер в соответствии с (12), в котором мономерное звено A представлено посредством общими формулами с (II) до (IV), представленными далее:
[0021] [Химическая формула 6]

[0022] [Химическая формула 7]

[0023] [Химическая формула 8]

[0024] где m представляет целое от 1 до 5.
(14) Сополимер в соответствии с (12) или (13), в котором мономерное звено A, мономерное звено B и мономерное звено C расположены случайно.
(15) Сополимер в соответствии с любым одним из с (12) до (14), имеющий среднечисловую молекулярную массу от 1000 до 100000.
(16) Сополимер в соответствии с любым одним из с (12) до (15), в котором RC представляет собой аминогруппу.
(17) Медицинский материал, содержащий сополимер в соответствии с любым одним из с (1) до (5) и материал основы, связанный с сополимером.
(18) Медицинский материал в соответствии с (17), где материал основы выполняют из полимера на основе сложного полиэфира.
(19) Медицинский материал, содержащий сополимер в соответствии с любым одним из с (12) до (16), производное фосфоновой кислоты или производное катехола и материал основы, выполненный из металла, где сополимер связывают с производным фосфоновой кислоты или производным катехола, производное фосфоновой кислоты связывают с материалом основы через его группу фосфоновой кислоты, и производное катехола связывают с материалом основы через его группу катехола.
(20) Устройство захвата тромбов, содержащее медицинский материал в соответствии с любым одним из с (17) до (19).
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0025] Поскольку сополимер по настоящему изобретению можно иммобилизовать на материале основы, при этом поддерживая сильные антитромботические свойства постоянно, сополимер предпочтительно можно использовать в медицинском материале и устройстве захвата тромбов, для которых необходимы антитромботические свойства.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0026] На фиг. 1 представлено устройство захвата тромбов в соответствии с первым вариантом осуществления настоящего изобретения, устройство содержит сополимер по настоящему изобретению.
На фиг. 2 представлено устройство захвата тромбов в соответствии со вторым вариантом осуществления настоящего изобретения, устройство содержит сополимер по настоящему изобретению.
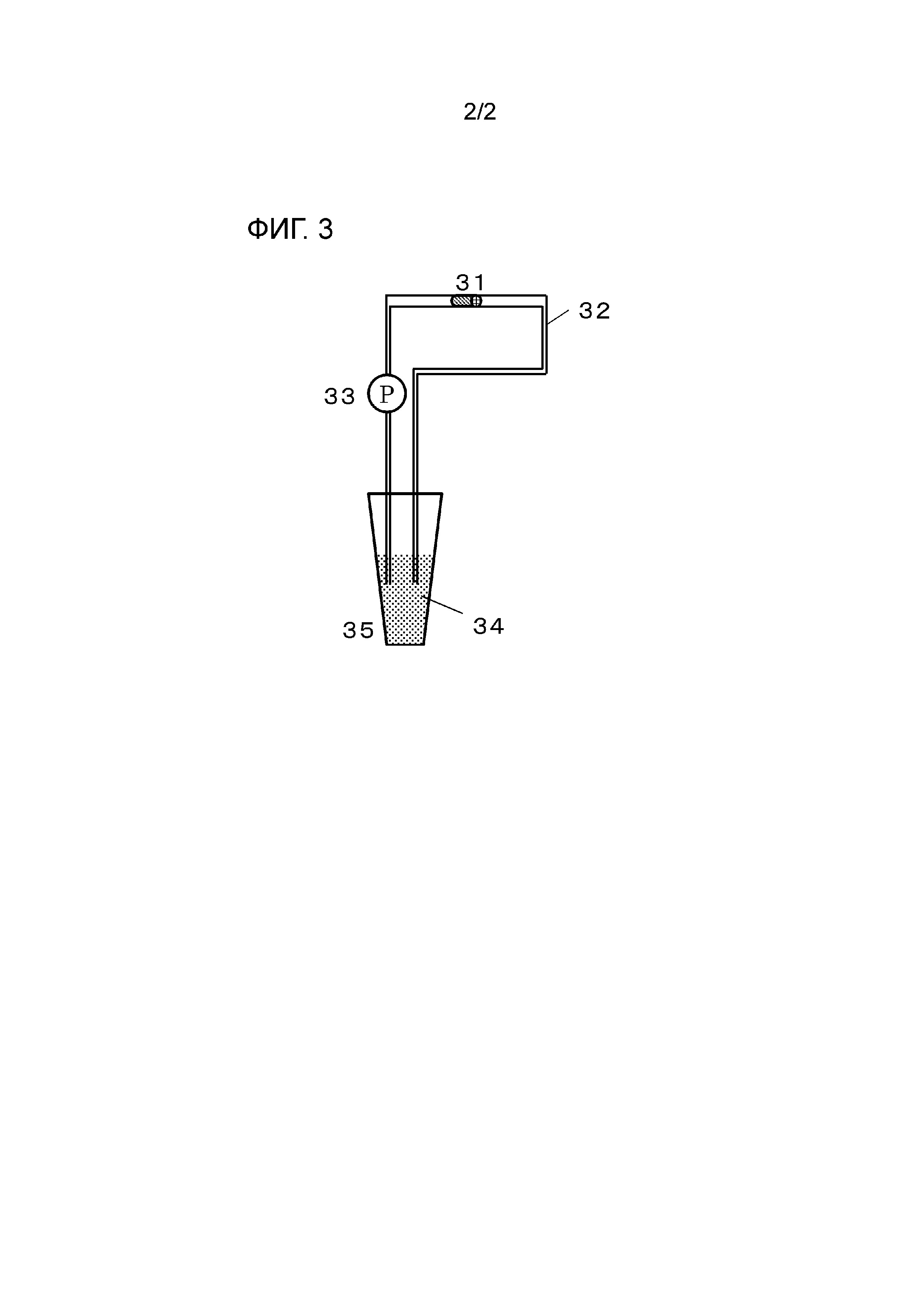
На фиг. 3 представлено схематическое изображение теста циркуляции крови.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0027] Сополимер по настоящему изобретению содержит мономерное звено A, мономерное звено B и мономерное звено C, которые представлены общей формулой (I), представленной далее, и молярная фракция мономерного звена C на основе всех мономерных звеньев, которые образуют сополимер, составляет от 0,5 до 40%.
[0028] [Химическая формула 9]

[0029] В формуле RA представляет функциональную группу, имеющую амидную связь, RB представляет алкил или алкенил, имеющий от 2 до 20 атомов углерода, RC представляет алкил или алкенил, где произвольный атом водорода замещают по меньшей мере одной функциональной группой, выбранной из группы, состоящей из аминогруппы, азидогруппы, иминогруппы, карбоксигруппы, хлорангидридной группы, кислой ангидридной группы, альдегидной группы, гидроксильной группы, группы фосфорной кислоты, тиоловой группы, изоцианатной группы, тиоизоцианатной группы, эпоксигруппы, галогенированной алкильной группы, цианогруппы, винильной группы, этинильной группы, нитрогруппы и нитрозогруппы и их ионизированных функциональных групп (где произвольный атом углерода в алкиле или алкениле из RC необязательно замещают атомом азота, атомом кислорода или атомом серы), и каждый из X1, X2 и X3 представляет атом водорода или метильную группу.
[0030] Если не указано иное, термины, используемые в настоящем описании, имеют следующие определения.
[0031] «Сополимер» относится к полимерному соединению, получаемому посредством сополимеризации мономеров двух или больше типов.
[0032] «Мономерное звено» относится к повторяющемуся звену в гомополимере или сополимере, которые получают посредством полимеризации мономеров.
[0033] Сополимер может содержать мономерное звено A, мономерное звено B и мономерное звено C одного типа или двух или больше типов каждое.
[0034] В настоящем изобретении, предпочтительно использовать, в качестве мономерного звена A, гидрофильный мономер, имеющий амидную связь, такой как N-винилацетамид, N-винилпропиламид, N-метилвинилацетамид, винилпирролидон, винилкапролактам, акриламид, N-метилакриламид, N,N-диметилакриламид или амидоалкил(мет)акрилат, поскольку эти мономеры не обладают слишком сильной гидрофильностью. Это обусловлено тем, что слишком сильная гидрофильность может вызывать дестабилизацию структуры тромбоцитов или белков и может вызывать тромбоз, несмотря на то, что эффективно гидрофилизуют материал основы медицинского материала для того, чтобы подавлять адгезию тромбоцитов или белков.
[0035] в настоящем описании, «гидрофильный мономер» определяют как мономер, гомополимер которого (имеющий среднечисловую молекулярную массу 1000 или больше и 50000 или меньше) легко растворим в воде. В настоящем описании, «легко растворим в воде» обозначает, что релевантное вещество имеет растворимость, превышающую 1 г, предпочтительно 10 г или больше в 100 г чистой воды при 20°C.
[0036] Прежде всего, мономерное звено A предпочтительно представлено любой одной из общих формул с (II) до (IV), представленных далее, поскольку такое мономерное звено делает возможным синтез сополимера посредством радикальной полимеризации и не обладает ни слишком сильной гидрофильностью, ни слишком сильной гидрофобностью.
[0037] [Химическая формула 10]

[0038] [Химическая формула 11]

[0039] [Химическая формула 12]

[0040] В формуле m представляет целое от 1 до 5.
[0041] Для того чтобы мономерное звено A могло не обладать слишком сильной гидрофильностью или гидрофобностью, m предпочтительно представляет собой целое от 1 до 5.
[0042] Примеры мономерного звена общей формулы (II) включают винилпирролидон (m=3) и винилкапролактам (m=5).
[0043] Примеры мономерного звена общей формулы (III) включают N-винилацетамид (m=1) и N-винилпропиламид (m=2).
[0044] Примеры мономерного звена общей формулы (IV) включают N-метилакриламид (m=1) и N-бутилакриламид (m=4).
[0045] В частности, мономерное звено A предпочтительно представляет собой мономерное звено, представленное общей формулой (II) или (III), по причине легкости сополимеризации с мономерным звеном B, и более предпочтительно представляет собой винилпирролидон или N-винилацетамид, по причине высокой безопасности для организма человека.
[0046] Мономерное звено B имеет, в качестве RB, алкил или алкенил, имеющий от 2 до 20 атомов углерода. Когда число атомов углерода мало, сополимер в целом имеет низкую подвижность и не проявляет характеристику подавления адгезии тромбоцитов и белков. С другой стороны, когда число атомов углерода велико, сополимер в целом имеет высокую гидрофобность и индуцирует адгезию тромбоцитов или белков. Число атомов углерода в RB более предпочтительно составляет от 2 до 9, еще более предпочтительно от 2 до 5.
[0047] RB может представлять линейный, разветвленный или циклический алкил или линейный, разветвленный или циклический алкенил, связанный с атомом углерода сложноэфирной группы, присутствующей в боковой цепи мономерного звена B. Например, в случае винилацетата RB представляет CH3- и в случае винилбутирата RB представляет CH3CH2CH2-. RB не ограничен линейной группой, такой как этильная группа, н-пропильная группа, н-бутильная группа, н-пентильная группа и н-гексильная группа, и может представлять собой разветвленную группу, такую как изопропильная группа и трет-бутильная группа, или циклическую группу, такую как циклопропильная группа, циклобутильная группа и фенильная группа. С точки зрения доступности, линейная группа является предпочтительной. Кроме того, RB может быть алифатическим или ароматическим, но предпочтительно является алифатическим с точки зрения антитромботических свойств. Кроме того, RB может иметь гетероатом, такой как атом азота или атом кислорода, но предпочтительно его формируют только из атома углерода и атома водорода с точки зрения доступности.
[0048] «Число атомов углерода» относится к числу атомов углерода, которые образуют RB. Например, винилацетат имеет число атомов углерода 1, а винилбутират имеет число атомов углерода 3.
[0049] Кроме того, сополимер по настоящему изобретению содержит мономерное звено C. В мономерном звене C, RC представляет алкил или алкенил, где произвольный атом водорода замещают по меньшей мере одной функциональной группой, выбранной из группы, состоящей из аминогруппы, азидогруппы, иминогруппы, карбоксигруппы, хлорангидридной группы, кислой ангидридной группы, альдегидной группы, гидроксильной группы, группы фосфорной кислоты, тиоловой группы, изоцианатной группы, тиоизоцианатной группы, эпоксигруппы, галогенированной алкильной группы, цианогруппы, винильной группы, этинильной группы, нитрогруппы и нитрозогруппы и их ионизированных функциональных групп. Произвольный атом углерода в алкиле или алкениле в RC необязательно замещают атомом азота, атомом кислорода или атомом серы. Алкил или алкенил в RC может быть линейным, разветвленным или циклическим и может иметь ароматическое кольцо.
[0050] Прежде всего, функциональная группа RC в мономерном звене C предпочтительно представляет собой аминогруппу, карбоксигруппу или эпоксигруппу с точки зрения стабильности в ходе синтеза сополимера. Кроме того, гидроксильную группу и карбоксигруппу можно легко вводить на поверхность материала основы медицинского материала посредством обработки озоном или обработки плазмой. Следовательно, функциональная группа RC в мономерном звене C предпочтительно представляет собой аминогруппу, изоцианатную группу или эпоксигруппу с точки зрения простоты введения в сополимер на поверхности материала основы. Это обусловлено тем, что аминогруппа способна формировать амидную связь с карбоксигруппой; изоцианатная группа способна формировать уретановую связь с гидроксильной группой; и эпоксигруппа способна формировать простую эфирную связь с гидроксильной группой.
[0051] С точки зрения снижения стерического затруднения из-за основной цепи посредством размещения функциональной группы в положении, удаленном от основной цепи сополимера с тем, чтобы облегчать реакцию функциональной группы с материалом основы, RC в сополимере более предпочтительно представляет собой алкильную группу, замещенную по меньшей мере одной функциональной группой, выбранной из аминогруппы, изоцианатной группы и эпоксигруппы.
[0052] Когда функциональная группа RC в мономерном звене C представляет собой аминогруппу, аминогруппа может представлять собой алифатическую аминогруппу или ароматическую аминогруппу. Алифатическая аминогруппа является предпочтительной по причине ее высокой реакционной способности. Примеры мономерного звена, имеющего алифатическую аминогруппу в боковой цепи, включают виниламин, аллиламин, алкиленамин, п-аминоалкилстирол и аминоалкил(мет)акрилат.
[0053] Когда функциональная группа RC в мономерном звене C представляет собой карбоксигруппу, карбоксигруппа может представлять собой алифатическую карбоксигруппу или ароматическую карбоксигруппу. Ароматическая карбоксигруппа является предпочтительной по причине ее высокой реакционной способности. Примеры мономерного звена, имеющего карбоксигруппу в боковой цепи, включают (мет)акриловую кислоту, 3-бутеновую кислоту и п-карбоксистирол. Среди них, п-карбоксистирол, имеющий ароматическую карбоксигруппу, является предпочтительным.
[0054] Сополимер предпочтительно имеет структуру, в которой мономерное звено A, мономерное звено B и мономерное звено C расположены случайно, вместо структуры, в которой расположение мономеров является неравномерным, как в блок-сополимере. Это служит цели устранения неравномерности в расположении мономеров для того, чтобы предотвращать частичную неравномерность между гидрофильностью и гидрофобностью, и предотвращения реакции системы свертывания, начинающейся в месте неравномерности. В настоящем описании «блок-сополимер» относится к сополимеру, имеющему молекулярную структуру, в которой полимеры по меньшей мере двух типов, имеющие различные повторяющиеся звенья, ковалентно связаны вместе для того, чтобы формировать длинную цепь. «Случайно расположенный» обозначает, что сополимер не является блок-сополимером.
[0055] Компоненты, отличные от мономерного звена A, мономерного звена B и мономерного звена C, можно сополимеризовать до тех пор, пока эффект по настоящему изобретению может быть сохранен. Сумма молярных фракций мономерного звена A, мономерного звена B и мономерного звена C на основе всех мономерных звеньев, которые образуют сополимер, предпочтительно составляет 70% или больше, более предпочтительно 80% или больше. Верхний предел суммы молярных фракций составляет 100%.
[0056] Молярная фракция мономерного звена A предпочтительно достаточно мала для того, чтобы предотвращать дестабилизацию структуры тромбоцитов или белков из-за слишком сильной гидрофильности сополимера в целом, и предпочтительно достаточно велика для того, чтобы не увеличивать гидрофобность сополимера в целом слишком сильно. Следовательно, молярная фракция мономерного звена A на основе всех мономерных звеньев, которые образуют сополимер, предпочтительно составляет от 10 до 90%, более предпочтительно от 30 до 85%, еще более предпочтительно от 45 до 80%.
[0057] Молярная фракция мономерного звена B предпочтительно достаточно мала для того, чтобы не увеличивать гидрофобность сополимера в целом слишком сильно, и предпочтительно достаточно велика для того, чтобы не снижать подвижность сополимера в целом. Следовательно, молярная фракция мономерного звена B на основе всех мономерных звеньев, которые образуют сополимер, предпочтительно составляет от 10 до 90%, более предпочтительно от 20 до 75%, еще более предпочтительно от 25 до 60%.
[0058] Кроме того, поскольку многие из функциональных групп RC в мономерном звене C имеют полярность, слишком большая молярная фракция мономерного звена C может дестабилизировать структуру тромбоцитов или белков. Например, известно, что гомополимер полиэтиленимина, имеющий аминогруппу, активирует тромбоциты. С другой стороны, слишком малая молярная фракция мономерного звена C препятствует иммобилизации достаточного количества сополимера на поверхности материала основы медицинского материала, так что медицинский материал может иметь недостаточные антитромботические свойства. Следовательно, молярная фракция мономерного звена C на основе всех мономерных звеньев, которые образуют сополимер, предпочтительно составляет от 0,5 до 40%, более предпочтительно от 1 до 25%, еще более предпочтительно от 1,5 до 10%.
[0059] Молярную фракцию вычисляют, например, по соотношению площади пика каждого мономерного звена и площади пика всех мономерных звеньев, которые образуют сополимер, с помощью измерения ядерного магнитного резонанса (ЯМР). Если молярную фракцию нельзя вычислять с помощью измерения ЯМР по таким причинам, как перекрытие пиков, молярную фракцию можно вычислять с помощью элементного анализа.
[0060] Сополимер предпочтительно имеет среднечисловую молекулярную массу от 1000 до 100000. Среднечисловая молекулярная масса предпочтительно составляет 1000 или больше, более предпочтительно 2000 или больше, еще более предпочтительно 4000 или больше. Это обусловлено тем, что слишком малая среднечисловая молекулярная масса может не достаточно проявлять эффект подавления адгезии, оказываемый на тромбоциты или белки. Между тем, несмотря на то, что верхний предел среднечисловой молекулярной массы сополимера конкретно не ограничен, слишком большая среднечисловая молекулярная масса может снижать растворимость. Следовательно, среднечисловая молекулярная масса предпочтительно составляет 100000 или меньше, более предпочтительно 50000 или меньше, еще более предпочтительно 20000 или меньше. Среднечисловую молекулярную массу сополимера можно измерять посредством гельпроникающей хроматографии (GPC), как описано далее. В настоящем изобретении другие мономеры также можно сополимеризовать до такой степени, в которой они не ингибируют действие/функцию сополимера.
[0061] Сополимер изготавливают, например, посредством следующего способа изготовления, но способ не ограничен этим.
[0062] Смешивают мономеры, которые образуют сополимер, растворитель для полимеризации и инициатор полимеризации и смесь перемешивают при предварительно определяемой температуре в течение предварительно определяемого периода времени в атмосфере азота для того, чтобы вызывать реакцию полимеризации. Реакционную жидкость охлаждают до комнатной температуры для того, чтобы останавливать реакцию полимеризации, и жидкость загружают в растворитель, такой как гексан. Осажденный осадок собирают и сушат при пониженном давлении, чтобы получать сополимер.
[0063] Температура реакции в реакции полимеризации предпочтительно составляет от 30 до 150°C, более предпочтительно от 50 до 100°C, еще более предпочтительно от 70 до 80°C.
[0064] Давление в реакции полимеризации предпочтительно представляет собой нормальное давление.
[0065] Время реакции в реакции полимеризации надлежащим образом выбирают в соответствии с условиями, такими как температура реакции, и предпочтительно оно составляет 1 час или больше, более предпочтительно 3 часа или больше, еще более предпочтительно 5 часов или больше. Когда время реакции не слишком мало, возможно предотвращать побочные реакции, такие как формирование димера, и делать управление молекулярной массой более простым. С другой стороны, время реакции предпочтительно составляет 24 часа или меньше, более предпочтительно 12 часов или меньше. Когда время реакции не слишком велико, возможно препятствовать тому, чтобы мономеры оставались после реакции полимеризации.
[0066] Растворитель для полимеризации, используемый в реакции полимеризации, конкретно не ограничен до тех пор, пока он представляет собой растворитель, совместимый с мономерами. Его примеры включают растворители простые эфиры, такие как диоксан и тетрагидрофуран, амидные растворители, такие как N,N-диметилформамид, сульфоксидные растворители, такие как диметилсульфоксид, ароматические углеводородные растворители, такие как бензол и толуол, спиртовые растворители, такие как метанол, этанол, изопропиловый спирт, амиловый спирт и гексанол, и воду. С точки зрения низкой токсичности, предпочтительно используют спиртовой растворитель или воду.
[0067] Инициатор полимеризации для реакции полимеризации может представлять собой, например, фотоинициатор полимеризации или тепловой инициатор полимеризации. Можно использовать инициатор полимеризации, который образует любое из радикалов, катионов и анионов. Радикальный инициатор полимеризации предпочтительно используют по той причине, что он едва ли вызывает побочные реакции с функциональной группой RC в мономерном звене C. Примеры радикального инициатора полимеризации включают инициаторы азо-типа, такие как азобисизобутиронитрил, азобисдиметилвалеронитрил и диметилазобис(изобутират), и пероксидные инициаторы, такие как пероксид водорода, бензоилпероксид, ди-трет-бутилпероксид и пероксид дикумила.
[0068] Растворитель, в который раствор реакции полимеризации загружают после остановки реакции полимеризации, не ограничен до тех пор, пока он представляет собой растворитель, в котором сополимер оседает. Примеры пригодных растворителей включают углеводородные растворители, такие как пентан, гексан, гептан, октан, нонан и декан, и растворители простые эфиры, такие как диметиловый простой эфир, этилметиловый простой эфир, диэтиловый простой эфир и дифениловый простой эфир.
[0069] Когда функциональная группа RC в мономерном звене C имеет высокую реакционную способность, сополимер можно синтезировать посредством предварительного блокирования функциональной группы защитной группой и снятия защиты с функциональной группы после полимеризации.
[0070] Медицинский материал по настоящему изобретению содержит сополимер и материал основы, связанный с сополимером.
[0071] Положение иммобилизации сополимера на материале основы варьирует, и сополимер можно распределять по всему материалу основы медицинского материала или можно неравномерно распределять на поверхности материала основы. С точки зрения простоты изготовления медицинского материала, сополимер предпочтительно иммобилизуют с тем, чтобы неравномерно распределять на поверхности материала основы.
[0072] Медицинский материал изготавливают, например, через формирование связи посредством функциональной группы RC в мономерном звене C сополимера с функциональной группой на поверхности материала основы и иммобилизацию сополимера на материале основы. В медицинском материале также возможно, что сополимер иммобилизуют на материале основы через формирование связи посредством функциональной группы RC в мономерном звене C сополимера с другой молекулой и формирование связи с помощью молекулы с функциональной группа на поверхности материала основы.
[0073] В настоящем описании, «формирование связи» обозначает, что сополимер не вымывается, даже когда медицинский материал очищают растворителем, который растворяет сополимер. Примеры связи включают ковалентную связь, ионную связь и координационную связь. Ковалентная связь является предпочтительной по причине высокой прочности связи.
[0074] «Ковалентная связь» относится к связи, формируемой, когда атомы имеют друг с другом общие электроны. В настоящем изобретении, ковалентная связь представляет собой ковалентную связь между атомами сополимера и атомами на поверхности материала основы, такими как атомы углерода, азота, кислорода и серы, и может представлять собой одинарную связь или многократную связь. Тип ковалентной связи не ограничен, и ее примеры включают дисульфидную связь, амидную связь, азидную связь, сложноэфирную связь и уретановую связь. Среди них амидная связь является более предпочтительной с точки зрения простоты формирования ковалентной связи и стабильности после образования связи.
[0075] «Материал основы» относится к компоненту, имеющему наибольшее объемное содержание среди компонентов, которые образуют медицинский материал. Материал основы в настоящем изобретении конкретно не ограничен, но металл или гидрофобный полимер является предпочтительным в качестве материала основы с точки зрения придания достаточной прочности медицинскому материалу.
[0076] Существование сополимера на поверхности материала основы медицинского материала можно подтвердить посредством времяпролетной масс-спектрометрии вторичных ионов (TOF-SIMS) и рентгеновской фотоэлектронной спектроскопии (XPS). Когда композицию поверхности материала основы анализируют посредством измерения TOF-SIMS, обнаруживают ионы карбоксилата, получаемые из мономерного звена B винилкарбоксилата. Когда осуществляют измерение XPS, пики атомов углерода амидной связи, происходящей из мономерного звена A, и атомов углерода сложноэфирной группы, происходящей из винилкарбоксилата, обнаруживают в пиках C1s, что указывает на существование атомов углерода. «Поверхность» относится к части вплоть до глубины 10 нм, как измеряют посредством TOF-SIMS и XPS.
[0077] В случае, когда материал основы выполняют из гидрофобного полимера, материал основы предпочтительно выполняют, например, из полимера на основе сложного полиэфира, вспененного пористого политетрафторэтилена (далее в настоящем описании обозначаемого как «ePTFE»), полиуретана, полиэфируретана, полиамида, полимера на основе винилхлорида, поликарбоната, полистирола, полиэтилена, полипропилена, полиметилпентена, полиметилметакрилата или поливинилацетата. Среди них, предпочтительным является полимер, имеющий сложноэфирную группу, такой как полимер на основе сложного полиэфира, полиметилметакрилат или поливинилацетат. С точки зрения высокой общей универсальности, в медицинском материале в соответствии с первым предпочтительным аспектом настоящего изобретения, материал основы более предпочтительно выполняют из полимера на основе сложного полиэфира, то есть полимера, имеющего повторяющееся звено, содержащее сложноэфирную связь в основной цепи. Примеры полимера на основе сложного полиэфира включают полиэтилентерефталат (далее в настоящем описании обозначают «PET»), политриметилентерефталат, полибутилентерефталат, полиэтиленнафталат и полибутиленнафталат. Среди них, PET является более предпочтительным в качестве материала основы антитромботического материала по причине его высокой общей универсальности. В настоящем описании «полимер на основе сложного полиэфира» обозначает полимер, имеющий повторяющееся звено, содержащее сложноэфирную связь в основной цепи.
[0078] «Гидрофобный полимер» относится к полимеру, имеющему растворимость 0,1 г или меньше в 100 г чистой воды при 20°C при среднечисловой молекулярной массе полимера 1000 или больше и 50000 или меньше.
[0079] Например, когда гидрофобный полимер имеет функциональную группу, такую как уретановая группа, возможно ковалентно связывать функциональную группу с сополимером, содержащим мономерное звено C, имеющее гидроксильную группу или тому подобное, и иммобилизовать сополимер на поверхности материала основы.
[0080] Даже когда гидрофобный полимер не имеет функциональную группу, аналогичным образом возможно иммобилизовать сополимер на поверхности материала основы посредством обработки поверхности материала основы плазмой, коронным разрядом или тому подобным для того, чтобы вводить функциональную группу на поверхность.
[0081] Кроме того, в случае материала основы, выполненного из полимера на основе сложного полиэфира, несмотря на то, что конкретно не ограничено, можно использовать следующий способ. То есть, сложноэфирную связь на поверхности материала основы гидролизуют посредством кислотной или щелочной обработки, и карбоксильную группу, которая появляется на поверхности материала основы, и функциональную группу RC в мономерном звене C сополимера подвергают реакции конденсации для ковалентного связывания вместе. В этом случае, если функциональная группа RC в мономерном звене C представляет собой аминогруппу, аминогруппа образует амидную связь с ковалентно связанным сополимером с материалом основы. В этих способах сополимер можно приводить в контакт с поверхностью материала основы для реакции или альтернативно сополимер, растворенный в растворителе, можно приводить в контакт с поверхностью материала основы для реакции.
[0082] В настоящем изобретении, более предпочтительным является гидролиз и окисление поверхности материала основы, выполненного из полимера на основе сложного полиэфира. Гидролиз и окисление поверхности материала основы, выполненного из полимера на основе сложного полиэфира, вызывает гидролиз и окисление сложноэфирной связи с тем, чтобы более легко иммобилизовать сополимер. Конкретный пример предпочтительного способа гидролиза и окисления представляет собой способ обработки поверхности материала основы кислотой или щелочью и окислителем. Способ гидролиза и окисления можно осуществлять только с использованием кислоты или щелочи. Однако способ обработки поверхности материала основы кислотой или щелочью и окислителем особенно предпочтительно использовать с целью увеличения количества введенного сополимера для того, чтобы усовершенствовать антитромботические свойства. Это обусловлено тем, что такой способ позволяет предотвращать смешивание гидроксильных групп и карбоксильных групп, образуемых посредством гидролиза сложноэфирной связи, эффективно способствуя реакции конденсации с функциональной группой RC в мономерном звене C сополимера и, кроме того, восстанавливая существующие гидроксильные группы для того, чтобы предотвращать активацию комплемента при контакте медицинского материала с кровью.
[0083] Предпочтительная комбинация средств на стадии гидролиза и окисления сложноэфирной связи на поверхности материала основы, выполненного из полимера на основе сложного полиэфира, с использованием кислоты или щелочи и окислителя в настоящем изобретении представляет собой комбинацию кислоты и окислителя. Также возможно обрабатывать поверхность материала основы щелочью и затем обрабатывать поверхность кислотой и окислителем.
[0084] Тип используемой кислоты конкретно не ограничен, и ее примеры включают неорганические кислоты, такие как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, гипохлористая кислота, хлористая кислота, перхлорная кислота, серная кислота, фторсульфоновая кислота, азотная кислота, фосфорная кислота, гексафторсурьмяная кислота, тетрафторборная кислота, хромовая кислота и борная кислота, сульфоновые кислоты, такие как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, трифторметансульфоновая кислота, и полистиролсульфонат натрия, карбоновые кислоты, такие как уксусная кислота, лимонная кислота, муравьиная кислота, глюконовая кислота, молочная кислота, щавелевая кислота и винная кислота, виниловые карбоновые кислоты, такие как аскорбиновая кислота и кислота Мельдрума, и нуклеиновые кислоты, такая как дезоксирибонуклеиновая кислота и рибонуклеиновая кислота. Среди них, соляная кислота, серная кислота и т. п. являются более предпочтительными с точки зрения удобства в обращении и т. п.
[0085] Тип используемого основания конкретно не ограничен, и его примеры включают гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид рубидия и гидроксид цезия, гидроксиды тетраалкиламмония, такие как гидроксид тетраметиламмония и гидроксид тетраэтиламмония, гидроксиды щелочноземельных металлов, такие как гидроксид кальция, гидроксид стронция, гидроксид бария, гидроксид европия и гидроксид таллия, гуанидиновые соединения, гидроксиды амминных комплексов, такие как гидроксид диамминсеребра (I) и гидроксид тетраамминмеди (II), гидроксид триметилсульфония и гидроксид дифенилйодония. Среди них, гидроксид лития, гидроксид натрия, гидроксид калия и т. п. более предпочтительны с точки зрения удобства в обращении и т. п.
[0086] Тип используемого окислителя конкретно не ограничен, и его примеры включают галогены, такие как нитрат калия, гипохлористая кислота, хлористая кислота, перхлорная кислота, фтор, хлор, бром и йод, перманганатные соли, такие как перманганат калия, тригидрат перманганата натрия, перманганат аммония, перманганат серебра, гексагидрат перманганата цинка, перманганат магния, перманганат кальция и перманганат бария, пероксиды, такие как нитрат церия аммония, хромовая кислота, дихромовая кислота и водный пероксид водорода, реактив Толленса и диоксид серы. Среди них, перманганатные соли являются более предпочтительными с точки зрения силы окислителя и их способности умеренно препятствовать ухудшению материала.
[0087] Медицинский материал в соответствии со вторым предпочтительным аспектом настоящего изобретения дополнительно содержит производное фосфоновой кислоты или производное катехола, материал основы выполняют из металла, сополимер связывают с производным фосфоновой кислоты или производным катехола, производное фосфоновой кислоты связывают с материалом основы через его группу фосфоновой кислоты и производное катехола связывают с материалом основы через его группу катехола. Другими словами, в медицинском материале в соответствии со вторым предпочтительным аспектом настоящего изобретения, медицинский материал содержит указанный выше сополимер, производное фосфоновой кислоты или производное катехола и материал основы, выполненный из металла, сополимер связывают с производным фосфоновой кислоты или производным катехола, производное фосфоновой кислоты связывают с материалом основы через его группу фосфоновой кислоты, и производное катехола связывают с материалом основы через его группу катехола.
[0088] «Металл» относится к материалу, содержащему металлический элемент. В частности, используемый металл предпочтительно выбирают из группы, состоящей из железа, титана, алюминия, олова, золота, серебра, меди, платины, хрома, кобальта, никеля, цинка, вольфрама, магния, тантала и сплавов, их оксидов металлов и гидроксидов металлов. Среди них, металл, выбранный из группы, состоящей из нержавеющей стали, кобальт-хромового сплава, никель-титанового сплава, тантала, титана, титанового сплава и магниевого сплава, о котором известно, что он имеет высокую биосовместимость, является более предпочтительным. Несмотря на то, что геометрическая форма металла конкретно не ограничена, геометрическая форма может представлять собой, например, пластину, лист, стержень, проволоку, порошок, содержащий мелкие частицы, и тонкую пленку.
[0089] В случае материала основы, выполненного из металла, способ иммобилизации сополимера конкретно не ограничен, но предпочтительно этот сополимер связывают с производным фосфоновой кислоты или производным катехола, производное фосфоновой кислоты связывают с материалом основы через его группу фосфоновой кислоты, и производное катехола связывают с материалом основы, выполненным из металла, через его группу катехола. Это обусловлено тем, что этот способ позволяет вводить сополимер на поверхность металла с высокой плотностью. Более конкретно, в случае металла и группы фосфоновой кислоты, предпочтительно атом металла и атом фосфора ковалентно связывают через атом кислорода (металл-O-P), и в случае металла и группы катехола, предпочтительно атом металла и атом углерода в бензольном кольце ковалентно связывают через атом кислорода (металл-O-Ph).
[0090] Среди них предпочтительно используют производное фосфоновой кислоты, поскольку оно обладает сильным взаимодействием между молекулами (например, вандерваальсовы силы и гидрофильные и гидрофобные взаимодействия) и имеет высокую устойчивость к ультразвуковой очистки с использованием хорошего растворителя и погружения в фосфатный буфер, имитирующий физиологическое окружение, так что его сложно десорбировать.
[0091] Производное фосфоновой кислоты представляет собой соединение, представленное химической формулой (V), представленной далее, и имеет группу фосфоновой кислоты на одном конце алкильной группы и произвольную функциональную группу на другом ее конце.
[0092] [Химическая формула 13]... (V)
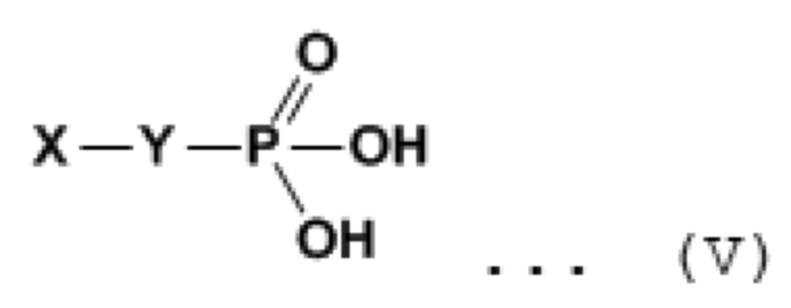
[0093] Предпочтительные конкретные примеры X и Y в химической формуле (V) приведены далее.
[0094] X предпочтительно представляет собой высоко реакционноспособную функциональную группу с целью иммобилизации других веществ или тому подобного. Ее предпочтительные конкретные примеры включают аминогруппу, карбоксигруппу, альдегидную группу, гидроксильную группу, тиоловую группу, изоцианатную группу и тиоизоцианатную группу, эпоксигруппу, галогенированную алкильную группу и винильную группу. Это позволяет располагать высоко реакционноспособную функциональную группу производного фосфоновой кислоты на поверхности металла, так что сополимер возможно иммобилизовать при высокой плотности. В случае, когда функциональная группа RC в мономерном звене C представляет собой аминогруппу, X предпочтительно представляет собой карбоксигруппу, поскольку она может формировать амидную группу с аминогруппой.
[0095] Кроме того, Y предпочтительно представляет собой алкиленовую группу, имеющую от 5 до 20 атомов углерода (часть или все атомы водорода на алкиленовой группе необязательно замещают атомами фтора). Y предпочтительно представляет собой алкиленовую группу, имеющую 5 или больше атомов углерода, поскольку межмолекулярные силы в производном фосфоновой кислоты сильно действуют для того, чтобы содействовать увеличению поверхностной плотности. Y предпочтительно представляет собой алкиленовую группу, имеющую 20 или меньше атомов углерода, поскольку не сложно синтезировать производное фосфоновой кислоты и обращаться с ним.
[0096] По указанным выше причинам, производное фосфоновой кислоты, например, предпочтительно представляет собой карбоксиалкилфосфоновую кислоту или аминоалкилфосфоновую кислоту и более предпочтительно представляет собой карбоксиалкилфосфоновую кислоту. Число атомов углерода производного карбоксиалкилфосфоновой кислоты конкретно не ограничено. Например, можно отметить соединения, представленные общими формулами (VI) и (VII), представленными далее.
[0097] [Химическая формула 14]...

[0098] [Химическая формула 15]

[0099] Производное катехола представляет собой органическое соединение, в котором группу катехола, представленную общей формулой (VIII), представленной далее, связывают с атомом углерода в соединении.
[0100] [Химическая формула 16]

[0101] В формуле, n представляет целое от 2 до 5.
R представляет собой алкильную группу, имеющую реакционноспособную функциональную группу на конце. Алкильная группа может содержать амидную связь или сложноэфирную связь.
[0102] Производное катехола конкретно не ограничено до тех пор, пока оно представляет собой соединение, в котором группу катехола, представленную общей формулой (VIII), связывают с атомом углерода в соединение. Конкретные примеры структуры соединения включают общие формулы с (IX) до (XII), представленные далее.
[0103] [Химическая формула 17]

[0104] [Химическая формула 18]

[0105] [Химическая формула 19]
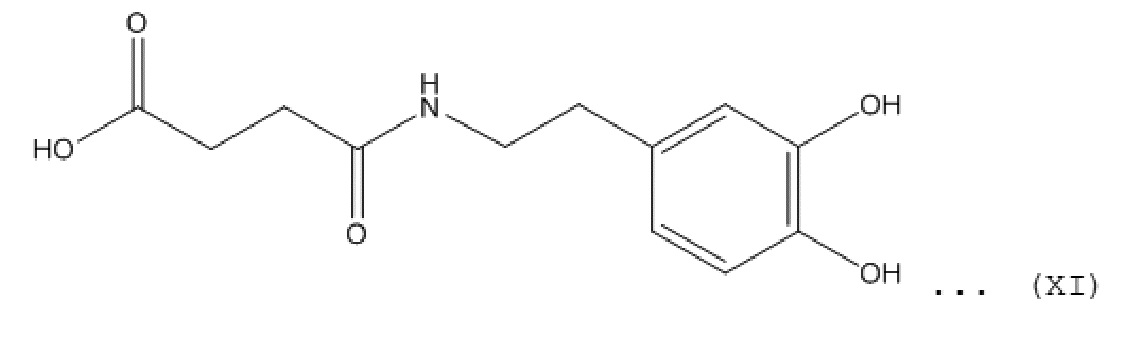
[0106] [Химическая формула 20]

[0107] Предпочтительно очищать поверхность металла перед иммобилизацией производного фосфоновой кислоты или производного катехола на поверхности. Это обусловлено тем, что можно удалять адсорбированные вещества, которые ингибируют иммобилизацию производного фосфоновой кислоты или производного катехола, такие как диоксид углерода, вода и органические вещества, и содействовать иммобилизации производного фосфоновой кислоты или производного катехола. Примеры способа очистки включают ультразвуковую очистку в органическом растворителе, Ar травление и облучение ультрафиолетом. Кроме того, можно комбинировать множество способов очистки. Кроме того, предпочтительно очищать поверхность металла с использованием раствора «пиранья» в способе очистки. Поскольку раствор «пиранья» представляет собой смешанный раствор пероксида водорода и серной кислоты и обладает чрезвычайно высокой окислительной силой, он может не только удалять больше органических веществ с поверхности металла, но также может увеличивать количество гидроксильных групп на поверхности металла, чтобы увеличивать количество иммобилизации производного фосфоновой кислоты.
[0108] Примеры способа ковалентного связывания производного фосфоновой кислоты или производного катехола с поверхностью металла включают следующие способы. Металлический материал погружают в раствор производного фосфоновой кислоты или производного катехола в тетрагидрофуране (далее в настоящем описании обозначают «THF») при комнатной температуре и затем раствор концентрируют с использованием испарителя и затем сушат под вакуумом. Раствор нагревают при 120°C, оставляют остывать, осуществляют ультразвуковую очистку с метанолом, очищают водой и затем сушат под вакуумом. Альтернативно очищенный металлический материал погружают в этаноловый раствор производного фосфоновой кислоты или производного катехола при 37°C на ночь, затем очищают этанолом и водой и затем сушат под вакуумом.
[0109] Затем сополимер ковалентно связывают с производным фосфоновой кислоты или производным катехола. В частности, в случае, когда используют производное фосфоновой кислоты, функциональную группу RC в мономерном звене C и группу фосфоновой кислоты производного фосфоновой кислоты ковалентно связывают вместе, и в случае, когда используют производное катехола, функциональную группу RC в мономерном звене C и группу катехола производного катехола ковалентно связывают вместе. Таким образом, сополимер можно иммобилизовать на поверхности металла.
[0110] Присутствие производного фосфоновой кислоты на поверхности металла подтверждают посредством по меньшей мере одного пика, выбранного из группы, состоящей из пика31P-, пика47PO-, пика63PO2-, пика79PO3-, пика94CH3PO3-, пика107C2H4PO3- и пика265C11H22PO5- отрицательных вторичных ионов и пика65PH2O2+, пика82PH3O3+, пика96CH5PO3+, пик249C11H22PO4+ и пика277C12H22PO5+ положительных вторичных ионов, которые наблюдают с помощью TOF-SIMS.
[0111] Присутствие производного катехола на поверхности металла подтверждают с помощью по меньшей мере одного пика, выбранного из группы, состоящей из пика98C4H4NO2-, пика116C4H6NO3-, пика122C7H6O2-, пика135C8H7O2- и пика252C12H14NO5- отрицательных вторичных ионов и пика137C8H9O2+, пика154C8H12NO2+, пика208C12H18NO2+ и пика254C12H16NO5+ положительных вторичных ионов, которые наблюдают с помощью GCIB-TOF-SIMS.
[0112] В случае материала основы, выполненного из металла, материал основы предпочтительно можно использовать в медицинском устройстве, выполненном из металлического материала, которое должно иметь антитромботические свойства, в частности, постоянно пребывающем медицинском устройстве, таком как стент, стент-графт и устройство захвата тромбов.
[0113] Способ проведения химической реакции карбоксигруппы, аминогруппы или гидроксильной группы производного фосфоновой кислоты или производного катехола, связанного с металлом, карбоксигруппы, введенной посредством гидролиза полимера на основе сложного полиэфира, или гидроксильной группы или карбоксильной группы, введенной в часть полимера на основе винилхлорида, описанного далее, с функциональной группой RC в мономерном звене C сополимера может представлять собой способ реакции конденсации с использованием дегидратирующего конденсирующего средства или тому подобного.
[0114] Тип используемого дегидратирующего конденсирующего средства конкретно не ограничен, и его примеры включают карбодиимидные соединения, такие как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид, 1-эфир-3-(3-диметиламинопропил)карбодиимид, 1-эфир-3-(3-диметиламинопропил) карбодиимидгидрохлорид (далее в настоящем описании обозначают «EDC»), 1,3-бис(2,2-диметил-1,3-диоксолан-4-илметил)карбодиимид, N-{3-(диметиламино)пропил-}-N'-этилкарбодиимид, N-{3-(диметиламино)пропил-}-N'-этилкарбодиимидметйодид, N-трет-бутил-N'-этилкарбодиимид, N-циклогексил-N'-(2-морфолиноэтил)карбодиимид мезо-п-толуолсульфонат, N,N'-ди-трет-бутилкарбодиимид и N,N'-ди-п-трикарбодиимид, и триазиновые соединения, такие как 4(-4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорида n гидрат (далее в настоящем описании обозначают «DMT-MM»).
[0115] Дегидратирующее конденсирующее средство можно использовать вместе с ускорителем конденсации дегидратацией. Используемый ускоритель конденсации дегидратацией конкретно не ограничен, и его примеры включают пиридин, 4-диметиламинопиридин (далее в настоящем описании обозначают «DMAP»), триэтиламин, изопропиламин, 1-гидроксибензотриазол и N-гидроксисукцинимид.
[0116] Можно проводить реакцию сополимера, полимера на основе металла или сложного полиэфира, дегидратирующего конденсирующего средства и ускорителя конденсации дегидратацией в форме смешанного водного раствора, или их можно добавлять по порядку и подвергать реакции.
[0117] Количество иммобилизации сополимера на поверхности материала основы можно вычислять посредством измерения XPS. В частности, пик N1s, указывающий на присутствие атомов азота, происходящих из амидной группы мономерного звена A, наблюдают около значения энергии связи от 396 эВ до 403 эВ. Соотношение площади пика N1s и общей площади пика предпочтительно составляет от 1,0 до 20,0% атомн., более предпочтительно от 1,5 до 12,0% атомн., еще более предпочтительно от 3,0 до 10,0% атомн. Если количество иммобилизации сополимера мало, медицинский материал обладает недостаточными антитромботическими свойствами, тогда как если количество иммобилизации слишком велико, тромбоциты и белки могут быть захвачены молекулярной цепью сополимера. В частности, уровень относительного содержания атомов азота относительно всех атомов вычисляют посредством округления уровня до одного десятичного разряда.
[0118] В медицинском материале в соответствии с третьим предпочтительным аспектом настоящего изобретения, материал основы выполняют из полимера, часть которого содержит гидроксильную группу или карбоксигруппу, введенную в него, и в котором по меньшей мере один атом водорода в основной цепи замещают атомом хлора, или полимера, часть которого содержит гидроксильную группу или карбоксигруппу, введенную в него, и который имеет силоксановую связь по меньшей мере в его части, и сополимер связывают с материалом основы через гидроксильную группу или карбоксигруппу. То есть, в третьем предпочтительном аспекте настоящего изобретения, медицинский материал содержит сополимер и материал основы, выполненный из полимера на основе винилхлорида, часть которого содержит гидроксильную группу или карбоксигруппу, введенную в него, или материал основы, выполненный из полимера на силиконовой основе, часть которого содержит гидроксильную группу или карбоксигруппу, введенную в него, и сополимер связывают с материалом основы через гидроксильную группу или карбоксигруппу.
[0119] «Полимер на основе винилхлорида» обозначает полимер, в котором по меньшей мере один атом водорода в основной цепи замещают атомом хлора, и его примеры включают поливинилхлорид, поливинилиденхлорид и политетрахлорэтилен. Кроме того, другие мономеры можно сополимеризовать до тех пор, пока не нарушают эффективность полимера на основе винилхлорида. «Полимер на силиконовой основе» обозначает полимер, имеющий силоксановую связь по меньшей мере в его части.
[0120] В третьем предпочтительном аспекте предпочтительно гидроксильную группу или карбоксигруппу вводят в часть материала основы, выполненную из полимера на основе винилхлорида, чтобы вызывать реакцию конденсации с функциональной группой RC в мономерном звене C сополимера для образования ковалентной связи.
[0121] Существуют различные способы получения медицинского материала, содержащего полимер на основе винилхлорида, в качестве материала основы. Примером способа является способ покрытия поверхности материала основы сополимером, содержащим мономерное звено, имеющее гидроксильную группу или карбоксигруппу, и мономерное звено на основе винилхлорида, и инициации реакции конденсации с функциональной группой RC для того, чтобы иммобилизовать сополимер. Альтернативно, медицинский материал также можно получать посредством ковалентного связывания сополимера, содержащего мономерное звено, имеющее гидроксильную группу или карбоксильную группу, и мономерное звено на основе винилхлорида, с сополимером, предварительно имеющим RC, чтобы синтезировать привитой полимер, и покрытия материала основы, выполненного из полимера на основе винилхлорида, привитым полимером. Примеры мономерного звена, имеющего гидроксильную группу или карбоксигруппу, включают виниловый спирт, акриловую кислоту, метакриловую кислоту и 2-гидроксиэтилметакрилат.
[0122] Медицинский материал по настоящему изобретению предпочтительно можно использовать в медицинских устройствах (например, искусственных почках, искусственных легких, искусственных кровеносных сосудах, искусственных клапанах, стентах, стентах-графтах, катетерах, устройствах захвата тромбов, ангиоскопах, шовных нитях, контурах циркуляции крови, трубках, канюлях, мешках для крови и шприцах). Особенно предпочтительным является то, что медицинский материал используют в устройстве захвата тромбов.
[0123] Устройство захвата тромбов по настоящему изобретению содержит медицинский материал. В устройстве захвата тромбов по настоящему изобретению предпочтительно используют медицинский материал в соответствии с первым предпочтительным аспектом или вторым предпочтительным аспектом настоящего изобретения. Поскольку устройство захвата тромбов входит в контакт с кровью при высокой скорости сдвига, устройство предпочтительно содержит материал основы, связанный с сополимером, или содержит сополимер, производное фосфоновой кислоты или производное катехола и материал основы, выполненный из металла.
[0124] «Устройство захвата тромбов» относится к медицинскому устройству, содержащему фильтр, выполненный из сетки или пористой пленки для захвата свободных тромбов. Материал материала основы, то есть материал фильтра, предпочтительно представляет собой нержавеющую сталь, кобальт-хромовый сплав, никель-титановый сплав, тантал, титан, титановый сплав и магниевый сплав, полимер на основе сложного полиэфира, полиалкил(мет)акрилат, полиуретан, полимер на основе винилхлорида, поликарбонат или политетрафторэтилен. В частности, полимер на основе сложного полиэфира, в частности PET, является предпочтительным по причине его высокой гибкости и стабильности in vivo. Эти материалы можно использовать по отдельности или в комбинации из двух или более их типов.
[0125] В случае, когда фильтр имеет геометрическую форму сетки для того, чтобы захватывать свободные тромбы более точно, диаметр одиночной нити волокна, которое образует сетку, предпочтительно составляет от 10 до 50 мкм, более предпочтительно от 20 до 40 мкм. Кроме того, отверстие сетки предпочтительно составляет от 10 до 200 мкм, более предпочтительно от 50 до 150 мкм.
[0126] В устройстве захвата тромбов важно усовершенствовать антитромботические свойства фильтра, поскольку скорость сдвига крови является наивысшей и в фильтре склонна к возникновению турбулентность крови.
[0127] Примеры формы устройства захвата тромбов включают форму, содержащую, как в первом устройстве захвата тромбов, представленном на фиг. 1, фильтр 11, преобразованный в форме мешка, кольцевидную часть 12 и часть 13 линии поддержки для поддержания геометрической формы фильтра и центральную часть 14, и форму, содержащую, как во втором устройстве захвата тромбов, представленном на фиг. 2, фильтр 21, цилиндрическую несущую часть 22 и центральную часть 23.
[0128] Кольцевидная часть 12, часть 13 линии поддержки, центральная часть 14, цилиндрическая несущая часть 22 и центральная часть 23 конкретно не ограничены, но нержавеющая сталь, кобальт-хромовый сплав, никель-титановый сплав, тантал, титан, титановый сплав и магниевый сплав, полимер на основе сложного полиэфира, полиалкил(мет)акрилат, полиуретан, полимер на основе винилхлорида и поликарбонат и политетрафторэтилен являются предпочтительными.
[0129] Возможно собирать устройство захвата тромбов в форме, показанной на фиг. 1 или 2, после иммобилизации сополимера на фильтре. Альтернативно, также возможно собирать устройство захвата тромбов в определенной форме и затем иммобилизовать сополимер на фильтре.
[0130] Контур циркуляции крови по настоящему изобретению содержит медицинский материал в соответствии с третьим предпочтительным аспектом. «Контур циркуляции крови» представляет собой трубку, через которую кровь течет в ходе лечения посредством экстракорпоральной циркуляции крови, и его используют посредством соединения с искусственной почкой или искусственным легким. Время работы контура циркуляции крови варьирует в соответствии с типом лечения, но контур циркуляции крови можно использовать непрерывно в течение нескольких суток. Следовательно, контур циркуляции крови должен иметь сильные антитромботические свойства.
[0131] Материал основы контура циркуляции крови предпочтительно выполняют из полимера на основе винилхлорида или полимера на силиконовой основе. Полимер на основе винилхлорида является более предпочтительным по причине его высокой общей универсальности. Следовательно, предпочтительно используют медицинский материал в соответствии с третьим предпочтительным аспектом.
ПРИМЕРЫ
[0132] Далее в настоящем описании настоящее изобретение описано со ссылкой на примеры, но настоящее изобретение не ограничено этими примерами.
<Способы оценки>
(1) Измерение ЯМР
В 2 мл хлороформа-D 99,7% (содержащего 0,05% об./об. TMS, производства Wako Pure Chemical Industries, Ltd.) растворяли 2 мг сополимера и раствор помещали в пробирку для ЯМР образцов и проводили измерение ЯМР (сверхпроводящий FTNMR EX-270 производства JEOL Ltd.). Температура представляла собой комнатную температуру и накопленное число составляло 32 раза.
(2) Среднечисловая молекулярная масса
0,1 Н раствор LiNO3 в воде/метаноле=50/50 (объемное соотношение) корректировали и использовали в качестве проявляющего раствора для GPC. В 2 мл этого раствора растворяли 2 мг сополимера. В систему Prominence GPC производства SHIMADZU CORPORATION выливали 100 мкл раствора и проводили измерение. Конфигурация устройства представляла собой следующее.
[0133] Насос: LC-20AD
Автоматический пробоотборник: SIL-20AHT
Колоночный термостат: CTO-20A
Колонка: GMPWXL (7,8 мм (внутренний диаметр) × 30 см, размер частицы: 13 мкм) производства Tosoh Corporation
[0134] Скорость потока составляла 0,5 мл/мин, а время измерения составляло 30 минут. Обнаружение осуществляли с использованием дифференциального детектора показателя преломления RID-10A (производства SHIMADZU CORPORATION) и среднечисловую молекулярную массу сополимера вычисляли по пику, полученному из сополимера, который возникал приблизительно ко времени элюирования 15 минут. Среднечисловую молекулярную массу сополимера вычисляли посредством округления числа до ближайшей сотни. Стандартный образец полиэтиленоксида (от 0,1 кД до 1258 кД) производства Agilent использовали для получения калибровочной кривой.
(3) Измерение XPS
Медицинский материал (например, PET сетку), содержащий иммобилизованный сополимер, обрезали до размера 1 см в ширину и 1 см в длину. Уровень относительного содержания атомов азота относительно всех атомов на поверхности медицинского материала вычисляли посредством измерения XPS при следующих условиях.
[Условия измерения]
Аппарат: ESCALAB 220iXL (производства VG Scientific Ltd.)
Возбужденное рентгеновское излучение: монохроматический Al K α1,2 пучок (1486,6 эВ)
Диаметр рентгеновского излучения: 1 мм
Угол выхода X-электрона: 90° (наклон детектора относительно поверхности медицинского материала)
(4) Тест на свертывание крови
Крышку полиэтиленовой пробирки для центрифуги (производства AS ONE Corporation) использовали в качестве тестового сосуда. Медицинский материал, обрезанный до подходящего размера, помещали в тестовый сосуд, затем туда добавляли 1 мл крови человека, не содержащей какое-либо антикоагулянтное лекарственное средство, и тестовый сосуд встряхивали на 100 об./мин в течение 30 минут. Медицинский материал собирали и очищали с использованием физиологического солевого раствора в течение 10 с. Затем вычисляли процентную долю площади, где прилипали тромбы, в площади всей поверхности собранного медицинского материала. Процентную долю площади, где прилипали тромбы, определяли посредством бинаризации изображения собранного медицинского материала на белый или черный и вычисления процентной доли черной площади.
(5) Тест циркуляции крови
Оба конца полипропиленовой тестовой микропробирки (производства Eppendorf Co., Ltd., объем: 0,5 мл) обрезали с тем, чтобы тестовая микропробирка имела цилиндрическую форму 1 см в длину, и приклеивали PET сетку к одной стороне тестовой микропробирки мгновенным клеем для того, чтобы получать устройство захвата тромбов. Как показано на фиг. 3, собирали тестовую систему, содержащую устройство 31 захвата тромбов, контур 32 циркуляции крови, выполненную из винилхлорида, насос 33 и пробирку 35 для центрифуги для хранения крови 34, и осуществляли циркуляцию 24 мл крови человека, в которую добавляли гепарин, чтобы иметь концентрацию 0,5 Ед/мл, в тестовой системе при скорости потока 50 мл/мин в течение 60 минут. Собирали PET сетку и вычисляли процентную долю площади, где прилипали тромбы, в площади всей поверхности собранной PET сетки аналогичным образом, как в тесте свертывания крови.
<Способ изготовления сополимера>
(Пример 1)
Все используемое - мономер, растворитель для полимеризации и инициатор полимеризации - было производства Tokyo Chemical Industry Co., Ltd. То есть, смешивали 19,5 г винилпирролидона, 17,5 г винилпропаноата, 1,0 г гидрохлорида аллиламина, 56 г т-амилового спирта в качестве растворителя для полимеризации и 0,175 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 80°C в течение 6 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию, и загружали в гексан. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов. Затем сополимер растворяли в водном растворе гидрокарбоната натрия (производства Wako Pure Chemical Industries, Ltd.), скорректированном до pH 8, чтобы удалять соляную кислоту, и влагу удаляли с использованием испарителя для того, чтобы получать статистический сополимер винилпирролидона/винилпропаноата/аллиламина.
[0135] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и аллиламина относительно всех составляющих мономерных звеньев составляли 72,0%, 25,0% и 3,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 4300. Сополимер обозначали как сополимер A.
(Пример 2)
Статистический сополимер винилпирролидона/винилпропаноата/аллиламина получали посредством той же процедуры синтеза, что и для сополимера A, за исключением того, что загружаемое количество гидрохлорида аллиламина меняли на 0,33 г.
[0136] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и аллиламина относительно всех составляющих мономерных звеньев составляли 58,8%, 40,0% и 1,2%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 11000. Сополимер обозначали как сополимер B.
(Пример 3)
Статистический сополимер винилпирролидона/винилпропаноата/аллиламина получали посредством той же процедуры синтеза, что и для сополимера A, за исключением того, что загружаемое количество гидрохлорида аллиламина меняли на 2,33 г.
[0137] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и аллиламина относительно всех составляющих мономерных звеньев составляли 48,0%, 20,0% и 32,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 2700. Сополимер обозначали как сополимер C.
(Пример 4)
Все используемое - мономер, растворитель для полимеризации и инициатор полимеризации - было производства Tokyo Chemical Industry Co., Ltd. То есть, смешивали 4,1 г N-винилацетамида, 15,0 г винилпивалата, 0,18 г гидрохлорида аллиламина, 30 г т-амилового спирта в качестве растворителя для полимеризации и 0,107 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 80°C в течение 6 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию и выгружать в гексан. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов. Затем сополимер растворяли в водном растворе гидрокарбоната натрия (производства Wako Pure Chemical Industries, Ltd.), скорректированном до pH 8, чтобы удалять соляную кислоту, и влагу удаляли с использованием испарителя для того, чтобы получать статистический сополимер N-винилацетамида/винилпивалата/аллиламина.
[0138] По результатам измерения1H-ЯМР, молярные фракции N-винилацетамида, винилпивалата и аллиламина относительно всех составляющих мономерных звеньев составляли 48,0%, 50,0% и 2,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 4600. Сополимер обозначали как сополимер D.
(Пример 5)
Все используемое - мономер, растворитель для полимеризации и инициатор полимеризации - было производства Tokyo Chemical Industry Co., Ltd. То есть, смешивали 18,7 г винилпирролидона, 18,3 г винилмиристата, 0,18 г гидрохлорида аллиламина, 56 г т-амилового спирта в качестве растворителя для полимеризации и 0,120 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 80°C в течение 6 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию и выгружать в гексан. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов. Затем сополимер растворяли в водном растворе гидрокарбоната натрия (производства Wako Pure Chemical Industries, Ltd.), скорректированном до pH 8 для того, чтобы удалять соляную кислоту, и влагу удаляли с использованием испарителя для того, чтобы получать статистический сополимер N-винилпирролидона/винилмиристата/аллиламина.
[0139] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилмиристата и аллиламина относительно всех составляющих мономерных звеньев составляли 78,0%, 20,0% и 2,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 3800. Сополимер обозначали как сополимер E.
(Пример 6)
Все используемое - мономер, растворитель для полимеризации и инициатор полимеризации - было производства Tokyo Chemical Industry Co., Ltd. То есть, смешивали 9,5 г винилпирролидона, 9,5 г винилпропаноата, 0,7 г 2-изоцианатоэтилакрилата, 40 г тетрагидрофурана в качестве растворителя для полимеризации и 0,1 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 70°C в течение 5 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию и выгружать в гексан. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов для того, чтобы получать статистический сополимер винилпирролидона/винилпропаноата/2-изоцианатоэтилакрилата.
[0140] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и 2-изоцианатоэтилакрилата относительно всех составляющих мономерных звеньев составляли 75,0%, 23,0% и 2,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 3500. Сополимер обозначали как сополимер F.
(Пример 7)
Статистический сополимер винилпирролидона/винилпропаноата/глицидилметакрилата получали посредством той же процедуры синтеза, что и для сополимера F, за исключением того, что глицидилметакрилат использовали вместо 2-изоцианатоэтилакрилата.
[0141] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и глицидилметакрилата относительно всех составляющих мономерных звеньев составляли 71,0%, 26,0% и 3,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 15200. Сополимер обозначали как сополимер G.
(Сравнительный пример 1)
Сначала смешивали 19,5 г винилпирролидона, 17,5 г винилпропаноата, 56 г т-амилового спирта в качестве растворителя для полимеризации и 0,175 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 80°C в течение 6 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию и выгружать в гексан. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов для того, чтобы получать статистический сополимер винилпирролидона/винилпропаноата.
[0142] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона и винилпропаноата относительно всех составляющих мономерных звеньев составляли 60,0% и 40,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 12500. Сополимер обозначали как сополимер F. Сополимер H не содержит мономерное звено C.
(Сравнительный пример 2)
Статистический сополимер винилпирролидона/винилпропаноата/аллиламина получали посредством той же процедуры синтеза, что и для сополимера A, за исключением того, что загружаемое количество гидрохлорида аллиламина меняли на 8,33 г.
[0143] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и аллиламина относительно всех составляющих мономерных звеньев составляли 37,0%, 18,0% и 45,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 1200. Сополимер обозначали как сополимер I.
(Сравнительный пример 3)
Статистический сополимер винилпирролидона/винилпропаноата/аллиламина получали посредством той же процедуры синтеза, что и для сополимера A, за исключением того, что загружаемое количество гидрохлорида аллиламина меняли на 0,03 г.
[0144] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилпропаноата и аллиламина относительно всех составляющих мономерных звеньев составляли 56,0%, 43,6% и 0,4%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 10600. Сополимер обозначали как сополимер J.
(Сравнительный пример 4)
Сначала смешивали 10,8 г винилпирролидона, 11,5 г винилацетата, 1,0 г гидрохлорида аллиламина, 56 г т-амилового спирта в качестве растворителя для полимеризации и 0,175 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 70°C в течение 6 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию и выгружать в гексан. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов. Затем сополимер растворяли в водном растворе гидрокарбоната натрия, скорректированном до pH 8, чтобы удалять соляную кислоту, и влагу удаляли с использованием испарителя для того, чтобы получать статистический сополимер винилпирролидона/винилацетата/аллиламина.
[0145] По результатам измерения1H-ЯМР, молярные фракции винилпирролидона, винилацетата и аллиламина относительно всех составляющих мономерных звеньев составляли 58,0%, 40,0% и 2,0%, соответственно. Кроме того, среднечисловая молекулярная масса сополимера, вычисленная по результату измерения GPC, составляла 3700. Сополимер обозначали как сополимер K. В сополимере K число атомов углерода на конце боковой цепи винилкарбоксилата составляет 1.
[0146] Число атомов углерода, молярная фракция каждого мономерного звена и среднечисловая молекулярная масса из примеров с 1 до 7 и сравнительных примеров с 1 до 4 сведены в следующей таблице 1.
[0147] [Таблица 1]
[0148] (Пример 8)
Пластинчатый материал SUS304 (длина: 1 см × ширина: 0,5 см, далее в настоящем описании обозначают «пластина SUS») использовали в качестве металла. В качестве стадии очистки металла пластинчатый материал подвергали ультразвуковой очистке и очистке с использованием раствора «пиранья». Сначала пластину SUS подвергали ультразвуковой очистке в порядке гексан, ацетон, метанол и дистиллированная вода (два раза) и сушили под вакуумом. Затем пластину SUS погружали в раствор «пиранья» на 1 час, очищали ультразвуком 5 раз с использованием дистиллированной воды и затем сушили под вакуумом. Используя 10-карбоксидецилфосфоновую кислоту (далее в настоящем описании обозначают «10-CDPA»), которая является соединением, представленным общей формулой (VI), пластину SUS подвергали ультразвуковой обработке в ксилоле для того, чтобы получать суспензию, содержащую 1 мМ 10-CDPA. В качестве стадии погружения пластину SUS после стадии очистки металла погружали в ксилоловую суспензию, содержащую 10-CDPA, при 37°C на 6 часов и вынимали. После сушки под вакуумом, пластину SUS нагревали при 130°C в течение 48 часов, чтобы химически связывать металл с 10-CDPA. Пластину SUS очищали ультразвуком с использованием тетрагидрофурана и метанола для того, чтобы удалять 10-CDPA, химически не связанную с металлом, и затем сушили под вакуумом.
[0149] Затем пластину SUS погружали в водный раствор 0,5% масс. DMT-MM (производства Wako Pure Chemical Industries, Ltd.) и 5,0% масс. сополимера A и проводили реакцию при 50°C в течение 2 часов для того, чтобы ковалентно связывать сополимер A с карбоксигруппой в 10-CDPA. Водный раствор после реакции удаляли и пластину SUS очищали дистиллированной водой. В качестве результата теста свертывания крови, тромбоз не наблюдали, и процентная доля площади, где прилипали тромбы, составляла 0%.
(Сравнительный пример 5)
Получали необработанную пластину SUS и осуществляли тест свертывания крови. Тромбы образовывались на всей поверхности пластины SUS, и процентная доля площади, где прилипали тромбы, составляла 100%.
(Пример 9)
В качестве материала основы использовали полипропиленовый пластинчатый материал (длина: 1 см × ширина: 1 см, далее в настоящем описании обозначают «PP пластина»). Поверхность PP пластины подвергали обработке плазмой для того, чтобы формировать карбоксигруппу. PP пластину погружали в водный раствор 0,5% масс. DMT-MM и 5,0% масс. сополимера A и проводили реакцию при 50°C в течение 2 часов для того, чтобы ковалентно связывать сополимер A с карбоксигруппой на поверхности PP пластины. Водный раствор после реакции удаляли и PP пластину очищали дистиллированной водой. В качестве результата теста свертывания крови, тромбоз не наблюдали, и процентная доля площади, где прилипали тромбы, составляла 0%.
(Сравнительный пример 6)
Получали необработанную PP пластину и осуществляли тест свертывания крови. Тромбы формировались на всей поверхности PP пластины, и процентная доля площади, где прилипали тромбы, составляла 100%.
(Пример 10)
PET сетку (длина: 1 см × ширина: 1 см, диаметр одиночной нити: 27 мкм, отверстие: 100 мкм) в качестве материала основы погружали в водный раствор 3,0% масс. перманганата калия (производства Wako Pure Chemical Industries, Ltd.) и 0,6 моль/л серной кислоты (производства Wako Pure Chemical Industries, Ltd.), и проводили реакцию при 60°C в течение 3 часов для того, чтобы гидролизовать и окислять PET сетку. Водный раствор после реакции удаляли и PET сетку очищали 6 Н соляной кислотой (производства Wako Pure Chemical Industries, Ltd.) и дистиллированной водой.
[0150] Затем PET сетку погружали в водный раствор 0,5% масс. DMT-MM и 5,0% масс. сополимера A и проводили реакцию при 50°C в течение 2 часов для того, чтобы ковалентно связывать сополимер A с PET сеткой. Водный раствор после реакции удаляли и PET сетку очищали дистиллированной водой. В качестве результата измерения XPS, уровень относительного содержания атомов азота составлял 4,6% атомн. Кроме того, в качестве результата теста свертывания крови, тромбоз не наблюдали, и процентная доля площади, где прилипали тромбы, составляла 0%.
(Пример 11)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер B использовали вместо сополимера A. В качестве результата измерения XPS, уровень относительного содержания атомов азота составлял 1,8% атомн. Кроме того, в качестве результата теста свертывания крови, тромбоз наблюдали с трудом, и процентная доля площади, где прилипали тромбы, составляла 5%.
(Пример 12)
После стадий из примера 9, PET сетку погружали в водный раствор 0,5% масс. DMT-MM (производства Wako Pure Chemical Industries, Ltd.) и 5,0% масс. сополимера B и проводили реакцию при 50°C в течение 2 часов для того, чтобы ковалентно связывать сополимер B с PET сеткой. Водный раствор после реакции удаляли и PET сетку очищали дистиллированной водой. В качестве результата измерения XPS, уровень относительного содержания атомов азота составлял 4,0% атомн. Кроме того, в качестве результата теста свертывания крови, тромбоз не наблюдали, и процентная доля площади, где прилипали тромбы, составляла 0%.
(Пример 13)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер C использовали вместо сополимера A. В качестве результата теста свертывания крови, тромбоз наблюдали с трудом, и процентная доля площади, где прилипали тромбы, составляла 10%.
(Пример 14)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер D использовали вместо сополимера A. В качестве результата теста свертывания крови, тромбоз не наблюдали, и процентная доля площади, где прилипали тромбы, составляла 0%.
(Пример 15)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер E использовали вместо сополимера A. В качестве результата теста свертывания крови, процентная доля площади, где прилипали тромбы, составляла 15%.
(Сравнительный пример 7)
Получали необработанную PET сетку и осуществляли тест свертывания крови. Как результат, тромбы формировались на всей поверхности, и процентная доля площади, где прилипали тромбы, составляла 100%.
(Сравнительный пример 8)
Водный раствор сополимера винилпирролидона/винилацетата 10 ч./млн (Kollidon VA64 (зарегистрированный товарный знак) производства BASF) корректировали и необработанную PET сетку погружали в водный раствор. PET сетку облучали с использованием 25 кГр γ-лучей для того, чтобы сшивать и иммобилизовать сополимер винилпирролидона/винилацетата. PET сетку очищали дистиллированной водой и осуществляли тест свертывания крови. Как результат, тромбы формировались на всей поверхности, и процентная доля площади, где прилипали тромбы, составляла 100%. Это вероятно, поскольку число атомов углерода на конце боковой цепи мономерного звена B в сополимере винилпирролидона/винилацетата составляло 1, и сополимер винилпирролидона/винилацетата сшивали и иммобилизовали, и он обладал недостаточными антитромботическими свойствами.
(Сравнительный пример 9)
PET сетку сшивали и иммобилизовали аналогичным образом, как в сравнительном примере 8 за исключением того, что сополимер H использовали вместо сополимера винилпирролидона/винилацетата. В качестве результата теста свертывания крови, процентная доля площади, где прилипали тромбы, составляла 95%. Это вероятно, поскольку сополимер H сшивали и иммобилизовали, и он не проявлял достаточных антитромботических свойств.
(Сравнительный пример 10)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что полиэтиленимин (LUPASOL (зарегистрированный товарный знак) производства BASF) использовали вместо сополимера A. В качестве результата теста свертывания крови, тромбы формировались на всей поверхности, и процентная доля площади, где прилипали тромбы, составляла 100%. Это вероятно, поскольку полиэтиленимин не имеет мономерные звенья A и B и не обладал превосходными антитромботическими свойствами.
(Сравнительный пример 11)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер H использовали вместо сополимера A. В качестве результата теста свертывания крови, тромбы формировались на всей поверхности, и процентная доля площади, где прилипали тромбы, составляла 100%. Это вероятно, поскольку сополимер E не имеет реакционноспособную функциональную группу в мономерном звене C, и его не иммобилизовали на поверхности.
(Сравнительный пример 12)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер I использовали вместо сополимера A. В качестве результата теста свертывания крови, процентная доля площади, где прилипали тромбы, составляла 95%. Это вероятно, поскольку молярная фракция аллиламина на основе всех мономерных звеньев, которые образуют сополимер I, была велика, и сополимер I обладал недостаточными антитромботическими свойствами.
(Сравнительный пример 13)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер J использовали вместо сополимера A. В качестве результата теста свертывания крови, тромбы формировались на всей поверхности, и процентная доля площади, где прилипали тромбы, составляла 100%. Это вероятно, поскольку молярная фракция аллиламина на основе всех мономерных звеньев, которые образуют сополимер J, была мала, и только небольшое количество сополимера J иммобилизовали на поверхности.
(Сравнительный пример 14)
PET сетку обрабатывали аналогичным образом, как в примере 10, за исключением того, что сополимер K использовали вместо сополимера A. В качестве результата теста свертывания крови, процентная доля площади, где прилипали тромбы, составляла 80%. Это вероятно, поскольку число атомов углерода на конце боковой цепи мономерного звена B в сополимере I составляло 1, и сополимер I обладал недостаточными антитромботическими свойствами.
(Пример 16)
Из PET сетки, полученной в примере 10, вырезали круг диаметром 1,0 см. Его использовали в качестве фильтра для получения устройства захвата тромбов, и осуществляли тест циркуляции крови. Тромбоз не наблюдали на поверхности фильтра, сформированного из PET сетки, с которой ковалентно связывали сополимер A, и процентная доля площади, где прилипали тромбы, составляла 0%.
(Сравнительный пример 15)
Из необработанной PET сетки вырезали круг диаметром 1,0 см. Его использовали в качестве фильтра для получения устройства захвата тромбов, и осуществляли тест циркуляции крови. Тромбы формировались на всей поверхности фильтра, сформированного из PET сетки, и процентная доля площади, где прилипали тромбы, составляла 100%.
[0151] (Пример 17)
В качестве материала основы использовали пластинчатый материал из поливинилхлорида (длина: 1 см × ширина: 1 см, далее в настоящем описании обозначают «пластина из винилхлорида»). Пластину из винилхлорида погружали в тетрагидрофурановый раствор 1,0% масс. статистического сополимера винилхлорида/винилового спирта (VINNOL E15/48A (зарегистрированный товарный знак) производства TOMOE ENGINEERING CO., LTD.) на 3 минуты и при этом покрывали для того, чтобы вводить гидроксильную группу в поверхность. Затем пластину из винилхлорида погружали в тетрагидрофурановый раствор 5,0% масс. сополимера F на 3 минуты, сушили под вакуумом и проводили реакцию при 50°C в течение 2 часов для образования ковалентной связи. В качестве результата теста свертывания крови, процентная доля площади, где прилипали тромбы, составляла 10%.
[0152] (Пример 18)
Получали тетрагидрофурановый раствор 5% масс. сополимера F и 1,5% масс. статистического сополимера винилхлорида/винилового спирта (VINNOL E15/48A (зарегистрированный товарный знак) производства TOMOE ENGINEERING CO., LTD.) и проводили реакцию при 70°C в течение 2 часов, и продукт реакции выливали в чистую воду. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов для того, чтобы получать привитый сополимер, состоящий из статистического сополимера винилхлорида/винилового спирта и сополимера F. Пластину из винилхлорида погружали в тетрагидрофурановый раствор 5,0% масс. привитого сополимера на 3 минуты для того, чтобы вводить сополимер F в форме привитого сополимера в поверхность материала основы. В качестве результата теста свертывания крови, тромбоз не наблюдали, и процентная доля площади, где прилипали тромбы, составляла 0%.
[0153] (Пример 19)
Получали тетрагидрофурановый раствор 5% масс. сополимера G и 1,5% масс. статистического сополимера винилхлорида/винилового спирта (VINNOL E15/48A (зарегистрированный товарный знак) производства TOMOE ENGINEERING CO., LTD.) и проводили реакцию при 80°C в течение 5 часов, и продукт реакции выливали в чистую воду. Осажденный осадок белого цвета собирали и сушили при пониженном давлении при 20°C в течение 12 часов для того, чтобы получать привитой сополимер, состоящий из статистического сополимера винилхлорида/винилового спирта и сополимера G. Пластину из винилхлорида погружали в тетрагидрофурановый раствор 5,0% масс. привитого сополимера на 3 минуты для того, чтобы вводить сополимер G в форме привитого сополимера в поверхность материала основы. В качестве результата теста свертывания крови, процентная доля площади, где прилипали тромбы, составляла 5%.
[0154] (Сравнительный пример 16)
Получали необработанную пластину из винилхлорида и осуществляли тест свертывания крови. Как результат, тромбы формировались на всей поверхности, и процентная доля площади, где прилипали тромбы, составляла 100%.
[0155] Тест свертывания крови из примеров с 8 до 15 и с 17 до 19 и сравнительных примеров с 5 до 14 и 16 сведен в следующую таблицу 2. Тест циркуляции крови из примера 16 и сравнительного примера 15 сведен в следующую таблицу 3.
[0156] [Таблица 2]
[0157] [Таблица 3]
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0158] Поскольку сополимер по настоящему изобретению обладает сильным антитромботическими свойствами, и его можно иммобилизовать на поверхности медицинского материала, его можно использовать в широком диапазоне медицинских материалов и медицинских устройств.
ОПИСАНИЕ ССЫЛОЧНЫХ ПОЗИЦИЙ
[0159]
11: Фильтр
12: Кольцевидная часть
13: Часть линии поддержки
14: Центральная часть
21: Фильтр
22: Цилиндрическая несущая часть
23: Центральная часть
31: Устройство захвата тромбов
32: Контур циркуляции крови
33: Насос
34: Кровь
35: Пробирка для центрифуги
Реферат
Настоящее изобретение относится к сополимеру, медицинскому материалу, устройству захвата крови и контору циркуляции крови. Данный сополимер содержит мономерное звено A, мономерное звено B и мономерное звено C общей формулы:. Молярная фракция мономерного звена C на основе всех мономерных звеньев, которые образуют сополимер, составляет от 0,5 до 40%. Медицинский материал содержит данный сополимер и материал основы, связанный с сополимером. Материал основы выполнен из полимера или металла. Технический результат – разработка сополимера, который можно иммобилизовать на материале основы, при этом сохраняя сильные антитромботические свойства постоянно без необходимости введения гепарина или антикоагулянтного лекарственного средства на поверхность материала основы. 4 н. и 7 з.п. ф-лы, 3 ил., 3 табл., 19 пр.
Формула


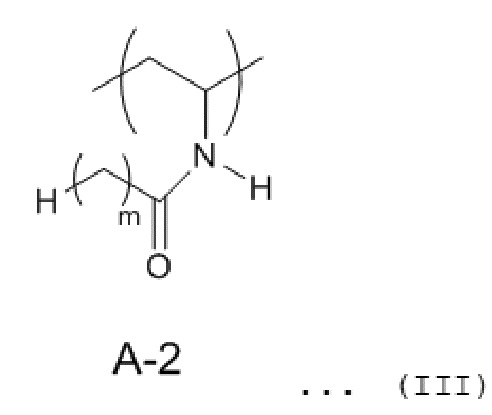




Комментарии