Способы получения волосяных микрофолликулов и de novo сосочков и их применение для in vitro тестов и in vivo имплантаций - RU2507254C2
Код документа: RU2507254C2
Чертежи




Описание
Данное изобретение касается способа получения волосяных микрофолликулов совместным культивированием de navo сосочков с другой клеточной популяцией волосяного фолликула в сосудах с ультранизким прикреплением культуры. Данное изобретение также касается способа получения de novo сосочков, применяемых в способе получения волосяного микрофолликула. Целью данного изобретения также являются волосяные микрофолликулы и de novo сосочки, полученные вышеупомянутыми способами. Волосяные микрофолликулы и/или de novo сосочки можно использовать как имплантаты для лечения состояния уменьшения волос и для in vitro тестирования модулирующих волосы эффектов или токсических эффектов веществ.
Из-за критической роли, которую волос играет в невербальном общении человека, пострадавшему индивидууму требуется помощь, когда рост волос уменьшается. Конечная терапия, конечно, заключается в восстановлении или регенерации новых, здоровых, циклических волосяных фолликулов. До недавнего времени медицина не могла предложить какое-либо действенное лечение таким пациентам. В двадцатом веке имелись в продаже некоторые лекарственные средства, которые, однако, слабо и несовместимо стимулировали рост волос. Примерами являются миноксидил, финастерид и латанопрост. Сложный тайминг и бесчисленные изменения экспрессии генов, необходимых для управления развитием волосяных фолликулов и циклирования, вероятно, препятствуют простому фармацевтическому подходу к лечению развившейся алопеции. Следовательно, эти эффекты не достигают конечной цели образования новых волосяных фолликулов на лишенной волос коже головы. Использующая типы клеток, известные как формирующие волосяной фолликул, основанная на клетках терапия будет признана в клинике скорее, чем чисто молекулярный подход.
Один подход основанной на клетках волосяных фолликулов терапии будет заключаться в удалении небольшого числа волосяных фолликулов, выделении компетентных и/или индуктивных клетки из них, а затем наращивании этих клеток ex vivo при поддерживании их особой способности образовывать новые волосяные фолликулы. Очевидно, необходимы условия клеточной культуры, которые поддерживают индуктивную способность кожных фолликулярных клеток и компетентность эпителиальных клеток волосяных фолликулов, чтобы основанная на клетках любого типа терапия алопеции могла развиваться. Поскольку ранние исследования показали, что индуктивная способность кожных клеток ослабевает со временем in vitro, изучение сосредотачивалось на поддерживании трихогенных свойств клеток волосяных фолликулов в культуре. Большое количество недавних достижений являются результатом успехов методологии культур для интактных волосяных фолликулов и их клеточных компонентов. Человеческие клетки волосяных фолликулов, растущих в культуре, включают фибробласты фолликулярных сосочков, кератиноциты наружной корневой оболочки (ORS) и герминативные эпидермальные клетки из волосяной матрицы (Tobin et al., J. Invest. Dermatology 104(1), 86-88, 1995).
Целью текущих биоинженерных усилий является образование или воссоздание полностью организованных и функциональных систем органов, начинающихся от диссоциированных клеток, которые размножены при определенных условиях тканевых культур. Уже давно признано, что волосяной фолликул обладает сильной регенеративной способностью, заключающейся в том, что он проходит цикл развития за время жизни индивидуума и воспроизводит свою нижнюю половину цикл за циклом. Фибробласты кожного волосяного сосочка и соединительнотканевой оболочки подобны стволовым клеткам по характеру и обладают специфическими индуцирующими рост волоса свойствами. Волосяной фолликул восстанавливает себя посредством взаимодействий между компетентными эпителиальными стволовыми клетками и мощными индуктивными кожными клетками в течение их цикла роста. Можно воспроизвести полный волосяной фолликул из эпителиальных и мезенхимальных стволовых клеток волосяных фолликулов.
Основные трудности, которые необходимо преодолеть с любым типом основанного на клетке лечения алопеции, включают эффективность формирования волосяных фолликулов и выбор типа клеток, которые подытожены Stenn & Cotsarelis, Curr. Opinion Biotech. 16, 493-497, 2005. Для биоинженерии волосяного фолликула можно было бы начать с кожных элементов из диссоциированных фолликулов с или без компетентных клеток из фолликула или других эпителиальных источников. Ряд диссоциированных клеток можно наращивать в культуре, а затем кожные клетки отдельно или в комбинации с компетентными эпителиальными клетками повторно вводить в лысеющую кожу головы. Предшествующие исследования показали, что из правильно помещенных индукторных кожных клеток будут формироваться новые фолликулы. Кроме того, из комбинации диссоциированных или агрегированных, трихогенных эпителиальных и кожных клеток, как также доказано, эффективно получаются новые волосяные фолликулы.
Первые попытки в основанных на клетках подходах в лечении алопеции заключаются в применении аутологической ткани для биоинженерии волосяных фолликулов, чтобы избежать иммунного отторжения донорных клеток. Однако, существует вероятность, что гетерологичную (аллогенную) ткань волосяного фолликула можно было бы разработать для тканевой трансплантации на основе концепции, что волосяной фолликул является иммунно-привилегированным участком, который не экспрессирует антигены класса I MHC (главный комплекс гистосовместимости). Тем не менее, безопасное тестирование и нормативные препятствия для подхода такого типа потребует огромных финансовых ресурсов.
Другой возможный подход биоинженерии волосяных фолликулов включает фактически формирование волосяных фолликулов как мини органов in vitro, a затем трансплантацию заново образованных фолликулов обратно на лысеющую кожу головы. Из патента Германии №10162814 В4 известно, что эквивалент кожи и волоса может быть получен путем обеспечения псевдодермиса или препарата псевдодермиса, а также псевдососочков, включая культивированные клетки кожных сосочков на приемлемом носителе или в приемлемой матрице, или псевдососочковых предшественников, включая культивированные клетки кожных сосочков на приемлемой формирующей матрицу среде, способной формировать матрицу in situ, и введения псевдососочков или псевдососочкового предшественника в псевдодермис или препарат псевдодермиса. Для подхода такого рода будет требоваться намного более сложная система клеточной культуры, включающая трехмерные матрицы, возможно встроенные с соответствующими ростовыми факторами, чтобы позволить и кожным, и эпидермальным клеткам дифференцироваться для трехмерной структуры нормального волосяного фолликула. В частности, структура сосочка получается только путем формирования полостей, например, путем перфорирования или пробивания, в указанном псевдодермисе и помещения туда указанных псевдососочков, которые сформированы так, что их размеры соответствуют полостям, сформированным в PD. В подходе отсутствует свободная организация клеток в приблизительной физиологической структуре сосочка, а также прямые клеточные контакты.
Недавно был показан другой способ получения популяции мультипотентных стволовых клеток или их потомства, которые происходят от волосяного фолликула или его части, содержащей кожный сосочек. Способ по WO 2005/071063 А1 включает культуру указанного волосяного фолликула или части, содержащей кожный сосочек, в условиях, при которых мультипотентные стволовые клетки растут и пролиферируют неприкрепленными. Кожные сосочки не получаются с помощью этой процедуры, но выделенные мультипотентные стволовые клетки непосредственно используются для индуцирования роста волоса или регенерации кожи у млекопитающего. Однако, также признается в этом документе, что определенное количество прикрепленных клеток сформировано по WO 2005/113747 А2, которая раскрывает способ получения многоклеточных совокупностей, по меньшей мере, от двух мультипотептных или плюрипотентных типов зрелых стволовых клеток путем культивирования в стерильных условиях. В настоящее время органоидные тела ограничены вышеупомянутыми стволовыми клетками, собранными из экзокринной железистой ткани.
Поэтому, техническая проблема, составляющая основу данного изобретения, заключается в преодолении вышеупомянутых недостатков известного уровня техники и в обеспечении способа образования восстановленного волосяного фолликула и сосочов, которые свободно и легко принимают размер и форму физиологического кожного сосочка (DP). Другой проблемой, которой занимается данное изобретение, является поиск эквивалента волоса или заместителя кожи, которые были бы приемлемыми как in vitro модель, конкретнее для тестирования и/или оценивания активных веществ, наиболее конкретно в волосяном фолликуле.
Данное изобретение решает проблему путем обеспечения способа получения волосяного микрофолликула млекопитающего, включающего этапы, на которых:
(a) обеспечивают, по меньшей мере, один de novo сосочек,
(b) обеспечивают, по меньшей мере, одну другую клеточную популяцию, выбранную из группы, включающей фибробласты, кератиноциты и меланоциты, и
(c) совместно культивируют de novo сосочек, по меньшей мере, с одной другой клеточной популяцией при условиях неприкрепленной культуры.
Выражения "de novo сосочки" или "неососочки" применяются в данном документе взаимозаменяемо и означают клеточные совокупности фибробластов кожного волосяного сосочка (DPF) млекопитающих, которые имеют, по меньшей мере, половину размера и приблизительную форму физиологического кожного сосочка (DP) волосяного фолликула после выделения. De novo сосочки могут включать покрытие, включающее один или множество разных внеклеточных матричных белков, предпочтительно коллаген IV, фибронектин и/или ламиниы. Такое покрытие может быть образовано с помощью кожного волосяного сосочка (DPF), которые сами формируют de novo сосочек, или может быть добавлено на любой стадии перед тем, как de novo сосочки будут совместно культивироваться согласно этапу (с) способа получения волосяных микрофолликулов.
Выражения "микрофолликул" и "неофолликул" применяются в данном документе взаимозаменяемо и означают неполную структуру волосяного фолликула млекопитающего, которая составляет кожный клеточный каркас, но не имеет других клеточных типов, таких как мышечные клетки, нервы, кровеносные сосуды и т.п., что приводит к уменьшению размера по сравнению с натуральным фолликулом. Микрофолликул данного изобретения включает de novo сосочек, который стабильно покрыт или колонизирован клетками, по меньшей мере, одной другой клеточной популяции, выбранной из группы, включающей фибробласты, кератиноциты и/или меланоциты. Фибробласты, кератиноциты и/или меланоциты не должны происходить от волосяного фолликула млекопитающего, но могут быть получены из других тканей млекопитающего. Предпочтительно микрофолликул данного изобретения включает de novo сосочек, который стабильно покрыт или колонизирован клетками, по меньшей мере, одной другой клеточной популяции, которая является получаемой и/или полученной из волосяного фолликула млекопитающего, например, выбранная из группы, включающей фибробласты соединительнотканевой оболочки, кератиноциты и/или меланоциты. Трехмерная форма указанного микрофолликула имитирует трехмерный вид физиологического волосяного фолликула млекопитающего. Микрофолликулы, в частности, могут быть сформированными трехмерно, факультативно пространственно разделенными, восстановленными de novo сосочками с подобными фолликулу структурами на поверхности de novo сосочков, включая напоминающие раннюю стадию морфогенеза волоса и включая клетки кожных сосочков.
Данное изобретение касается способа получения волосяных микрофолликулов, включающего несколько этапов.
Эти этапы включают обеспечение de novo сосочков. По данному изобретению de novo сосочки, которые должны быть обеспечены, можно получить любым приемлемым способом, предпочтительно используются de novo сосочки, полученные по одному из способов получения de novo сосочков по данному изобретению, раскрытых ниже.
Этапы включают далее обеспечение других клеточных популяций. Другая клеточная популяция может быть получена из волосяного фолликула млекопитающего, предпочтительно из того же волосяного фолликула, что используется для получения кожного сосочка (DP), и совместного культивирования de novo сосочков, по меньшей мере, с одной другой клеточной популяцией в сосудах с отсутствием прикрепления культуры. По меньшей мере, 4 разных клеточных популяции, т.е. Кожные волосяные сосочки (DPF), фибробласты соединительнотканевой оболочки (CTSF), кератиноциты (КС) и меланоциты (МС), могут быть выделены из волосяного фолликула млекопитающего определенным способом, отдельно культивированы при стандартных условиях и впоследствии размножены. Также можно формировать клеточные культуры с длительной жизнеспособностью из таких изолятов и использовать их, например, для способов скрининга.
В предпочтительном варианте осуществления данного изобретения другие клеточные популяции выбраны из группы, включающей фибробласты, кератиноциты и меланоциты. Фибробласты, кератиноциты и/или меланоциты не должны происходить от волосяного фолликула млекопитающего, а могут быть получены из других тканей млекопитающего. Фибробласты происходят предпочтительно из соединительнотканевой оболочки.
Предпочтительно, по меньшей мере, одна другая клеточная популяция является получаемой и/или полученной из волосяного фолликула млекопитающего, которая выбрана из группы, включающей фибробласты соединительнотканевой оболочки, кератиноциты и/или меланоциты.
В другом предпочтительном варианте осуществления данного изобретения de novo сосочки совместно культивируют с кератиноцитами, по меньшей мере. Кератиноциты являются дополнением для основной регенерации микрофолликулов. В еще одном предпочтительном варианте осуществления данного изобретения кератиноциты и меланоциты одновременно обеспечены для культуры сосочка. Добавление меланоцитов особенно полезно для исследований пигментации волос или для цели будущей имплантации с желаемым цветом волос. Другие отдельно нарощенные клеточные компоненты могут быть добавлены в сосуд с отсутствием прикрепления культуры, описанный ниже, для способа получения de novo сосочков, такой как сосуды с ультранизким прикреплением культуры, в котором неососочки уже получены. Кератиноциты или смеси кератиноцитов и меланоцитов добавлены к покрытым неососочкам при специфическом соотношение смешивания и инкубируются в приемлемой среде в сосудах с отсутствием прикрепления культуры в течение нескольких дней. Предпочтительные соотношения КС к МС составляют 2:1, 5:1, 10:1 или 20:1. Совместное культивирование длится, по меньшей мере, 12 часов, предпочтительно от 1 дня до 5 недель, более предпочтительно от 2 дней до 3 недель, наиболее предпочтительно 1 неделя или в основном 2 дня. Для разработки многослойного неофолликула, который еще лучше имитирует структуру и функцию волосяного фолликула, его можно получить путем покрытия образованного неофолликула CTSF в течение определенного периода времени, выбранного из 12 часов - 10 дней, предпочтительно 1-5 дней, наиболее предпочтительно в основном 2 дня. При этих условиях смесь клеток развивается в фолликулярную структуру, формирующую типичные признаки волосяного фолликула, такие как развитие ости волоса. Подобная органу структура называется микрофолликуломом для формирования приблизительной ости волоса.
В предпочтительном варианте осуществления способа данного изобретения получения волосяного микрофолликула
(a) обеспечивают de novo сосочки;
(b) de novo сосочки приводят в контакт с КС, МС или смесью КС и МС с заранее определенным соотношением и совместно культивируют в сосуде с отсутствием прикрепления культуры в течение заранее определенного времени;
(b') факультативно повторяют этап (b), предпочтительно, где для контакта и совместного культивирования применяют клетки другого клеточного типа, чем применяемые в первом цикле;
(c) факультативно покрытые de novo сосочки этапа (b) или (b') могут быть покрыты внеклеточным матричным белком, предпочтительно коллагеном IV, до и/или одновременно с этапом (d);
(d) покрытые de novo сосочки этапа (b), (b') или (с) совместно культивируют с CTSF в течение заранее определенного времени в сосуде с отсутствием прикрепления культуры.
Данное изобретение также направлено на обеспечение способа получения de novo сосочков, включающего этапы, на которых:
(a) обеспечивают, по меньшей мере, один кожный сосочек (DP), по меньшей мере, из одного волосяного фолликула млекопитающего,
(b) выделяют фибробласты кожного волосяного сосочка (DPF) из кожного сосочка (DP) механическим фиксированием указанного кожного сосочка (DP) на поверхности сосуда для клеточной культуры, посредством чего базальная пластинка перфорируется, чтобы позволить указанным кожным волосяным сосочкам (DPF) выходить,
(c) наращивают выделенные кожные волосяные сосочки (DPF) в монослойной культуре без коллагенового покрытия, где указанные кожные волосяные сосочки (DPF) пересевают, по меньшей мере, один раз,
(d) сгущают нарощенные кожные волосяные сосочки (DPF) в клеточные совокупности, которые проявляют размер и форму физиологического кожного сосочка (DP), где указанные кожные волосяные сосочки (DPF) дифференцируются в сосудах с отсутствием прикрепления культуры при концентрации клеток на поверхности сосуда от 1000 до 100000 DPF/см2, факультативно нарощенные кожные волосяные сосочки (DPF) сгущаются в течение, по меньшей мере, 48 часов, и
(е) покрывают de novo сосочки внеклеточными матричными белками, предпочтительно коллагеном IV, фибронектином и/или ламинином.
Данное изобретение также направлено на обеспечение способа получения de novo сосочков, включающего этапы, на которых:
(а) обеспечивают, по меньшей мере, один кожный сосочек (DP), по меньшей мере, из одного волосяного фолликула млекопитающего,
(b) выделяют фибробласты кожного волосяного сосочка (DPF) из кожного сосочка (DP) механическим фиксированием указанного кожного сосочка (DP) на поверхности сосуда для клеточной культуры, посредством чего базальная пластинка перфорируется, чтобы позволить указанным кожным волосяным сосочкам (DPF) выходить,
(c) наращивают выделенные кожные волосяные сосочки (DPF) в монослойной культуре без коллагенового покрытия, где указанные кожные волосяные сосочки (DPF) пересевают, по меньшей мере, один раз,
(d) сгущают нарощенные кожные волосяные сосочки (DPF) в клеточные совокупности, которые проявляют размер и форму физиологического кожного сосочка (DP), где указанные кожные волосяные сосочки (DPF) дифференцируются в сосудах с отсутствием адгезии культуры при концентрации клеток на поверхности сосуда от 1000 до 100000 DPF/см2, и где нарощенные кожные волосяные сосочки (DPF) сгущаются в течение, по меньшей мере, 48 часов;
(e) факультативно покрывают de novo сосочки внеклеточными матричными белками, предпочтительно коллагеном IV, фибронектином и/или ламинином.
Особенно наращивание выделенных DPF и форма физиологического введения являются ограничивающими факторами для применения этих клеток в индукции роста волос в известном уровне техники. Необходимо несколько циклов размножения для достижения необходимого количества клеток, в ходе которых клетки культивируются в монослойных культурах, особенно из фибробластов кожного сосочка, теряют свои индуктивные способности, а именно, как показал опыт, через 5-8 циклов размножения. Клетки, обработанные таким образом, дедифференцируют и экспрессируют маркеры стволовых клеток, но не могут больше использоваться для образования волосяных фолликулов.
В данном изобретении показано, что клетки достигают уровня дифференциации и стабилизации или снова обретают свою способность индуцировать рост волос после от нескольких дней до нескольких недель в специфических условиях культуры данного изобретения, где DPF, нарощенные вследствие культивирования клеток, переносятся при хорошо определенной концентрации в специальные сосуды с отсутствием адгезии клеточной культуры. В добавок к вновь приобретенным индуктивным свойствам, обнаружили, что, как результат активных контактов клетки с клеткой и обмена сигнальными молекулами, клетки впоследствии формируют клеточные совокупности и дифференцируются. При таких специфических условиях клетки, обработанные таким образом, уплотняются до приблизительной формы и размера, соответствующих физиологической форме кожного сосочка в волосяном фолликуле после выделения. С этой целью соотношение используемых клеток к поверхности сосуда для культуры является критически важным.
До этапа (а) волосяной фолликул берут у млекопитающего, являющегося пациентом или донором. Особенно образец берут у человека, грызуна, свиньи, псовых, обезьяны, овцы, кошки или собаки, предпочтительно человека. Особенно предпочтительно брать образец ткани путем кожной биопсии, особенно взятой близко к месторасположению заболевания. В данном изобретении образец волосяного фолликула предпочтительно взят из волос головы, бороды, бровей, генитальных волос или других волос тела. Взятие волосяного фолликула происходит в соответствии с медицинской практикой. Образец может быть очищен для удаления разрушающих веществ.
Обеспечение DP из волосяных фолликулов и выделение DPF согласно этапу (а) происходит по вновь разработанным из ранее существующих стандартных протоколов. При использовании небольших кусочков биопсий кожи эпидермис отделяется от лежащей в основе дермы и жировой ткани, например, с использованием скальпеля. Жировая ткань слегка сжимается, например, с использованием пинцета, так, что расположенные там волосяные луковицы, легко препарируются под препаровальной лупой. Такие выделенные волосяные фолликулы фиксируются на ости волоса, например, опять посредством пинцета, и соединительнотканевая оболочка аккуратно отделяется диаметральным способом, например, посредством еще одного пинцета, так, что луковица выворачивается, чтобы показать DPF и ость волоса с волосяной матрицей. Таким путем проксимальная часть луковицы вместе с фибробластами соединительнотканевой оболочки и кожные сосочки легко отделяются от остальной части волосяного фолликула, например, путем использования иглы или канюли. Также ость волоса, которая включает также необходимые кератиноциты и меланоциты волосяной матрицы, оптимально подготовлена для дальнейшего культивирования.
Затем на этапе (b) выделенные кожные сосочки переносятся в сосуд для клеточной культуры и механически фиксируются на поверхности сосуда. Предпочтительно DPF получают путем механического задерживания выделенных кожных сосочков на дне сосуда для культуры, предпочтительнее с использованием острия иголки или скальпеля, а не подвергая их ферментативному отделению. Предпочтительно инкубировать 1-8 DP на сосуд для культуры. В частности, 2-4 DP переносятся в каждую лунку 6-луночных или 12-луночных планшетов для клеточной культуры, например, и фиксируются на дне планшета. В результате базальная пластинка слегка перфорируется, но морфология сосочка приблизительно поддерживается, и DPF могут выходить из кожного сосочка и пролиферировать.
Культивирование DPF на этапе (с) осуществляется без коллагенового покрытия в стандартной среде, предпочтительно включающей пониженное количество фетальной бычьей сыворотки (FCS), например, 10% по сравнению с традиционными 20% FCS, и дополнительно дополненной антибиотиками, такими как 1х пенициллин/стрептомицин. После выделения первая замена среды предпочтительно производится через 1 неделю, как минимум, и через 2 недели, как максимум. Как только клетки вырастают из DP, среда может заменяться один - два раза в неделю, в зависимости от плотности клеток. Когда клетки достигают 70-80% слияния, они отделяются от дна планшета, например, путем использования трипсина/EDTA при комнатной температуре, и пересеваются в другие сосуды для культуры, такие как колбы Т25 для клеточной культуры. В ходе культивирования клетки могут быть далее нарощены для непосредственного применения в экспериментах или заморожены в жидком азоте для будущего использования. Хотя число пересевов не ограничено, так что клетки могут быть нарощены до любой высокой плотности, если дана жизнеспособность, предпочтительно указанные DPF пересевать, по меньшей мере, два раза, более предпочтительно, по меньшей мере, пять раз, наиболее предпочтительно не более девяти раз. Для высокопроизводительной процедуры предпочтительны восемь пересевов. Следовательно, в другом предпочтительном варианте осуществления данного изобретения способ выполняется путем сгущения неиндуктивных DPF. Обнаружено, что такие DPF, у которых отсутствуют индуктивные свойства, еще можно использовать для тканевой инженерии.
Следующей является фаза сгущения этапа (d), где отделенные, размноженные DPF культивируются в сосудах с отсутствием прикрепления культуры со средой, включающей хорошо определенные компоненты, т.е. стандартной культуральной средой. В этой системе поверхность специального сосуда или специальное покрытие поверхности сосуда, особенно поверхность дна, снижает прикрепление клеток или даже препятствует прикреплению клеток к поверхности. Предпочтительно сосуды с отсутствием адгезии культуры сделаны из стекла, полистирола, и/или поверхность обработана с противоадгезивным слоем. Более предпочтительно в сосудах применяется PTFE- или поли-НЕМА-покрытая поверхность. Применение сосудов с ультранизким прикреплением культуры особенно предпочтительны в объеме данного изобретения, которые, например, доступны от Coming, Inc., США. Такие сосуды с отсутствием прикрепления и покрытия известны специалисту в данной области, и их можно легко купить или изготовить.
В результате свободного контакта клеточная совокупность определенного размера через несколько дней формирует совокупности, которые похожи на оригинальный сосочек размером и формой. Нарощенные DPF предпочтительно сгущаются в течение, по меньшей мере, 48 часов, 2-5 дней, более предпочтительно в течение 2-3 дней, наиболее предпочтительно в основном 2 дня и факультативно далее культивируются в течение 3-15 дней, предпочтительно в течение 5-10 дней или 2-21 дней. Размер и форма формирующихся скоплений, кроме того, зависят от области, из которой были отделены кожные биопсии. DPF, которые отделены из бороды, волоса тела, бровей, генитального волоса или волоса головы и подвержены наращиванию, формируют клеточные совокупности разного размера, которые, в свою очередь, определяют соответствующую форму, размер и длину волоса. Еще более важным является начальное число клеток, инокулированных в сосуде, которое должно быть пропорционально поверхности сосуда. В другом варианте осуществления способа концентрация клеток на поверхности сосуда составляет 2000-50000 DPF/см2 на этапе (d), предпочтительно 3000-20000 DPF/см2, более предпочтительно 5000-10000 DPF/см2, наиболее предпочтительно в основном 6666 DPF/см2.
На этой стадии самостоятельно полученная матрица уже сформирована вокруг скопления. Для ускорения этого процесса и оказания влияния на него целевым образом, физиологические матричные компоненты добавляют в среду в этой точке для формирования капсулы, имитирующей свойства кожного сосочка. На следующем этапе (е) процесса de novo сосочки, полученные таким образом, покрывают композицией внеклеточных матричных белков. Эта композиция сделана так, чтобы имитировать физиологическую. Она может предпочтительно включать коллаген IV, фибронектин и/или ламинин. Особенно предпочтительно, что внеклеточные матричные белки являются смесью коллагена IV, фибронектина и ламинина в долях 2-6:0,5-2:0,5-2 весовых частей, наиболее предпочтительно имеют соотношения в основном 4:1:1,15 весовых частей. Не исключено, однако, что вышеупомянутые внеклеточные матричные белки также могут использоваться отдельно или с переменными объемными процентными соотношениями, или в комбинации с другими матрицами. В другом варианте осуществления данного изобретения внеклеточные матричные белки дополнительно включают другие коллагены (например, 1, 10 Al, 18 Al), глюкозаминогликаны и/или протеогликаны, предпочтительно гепарап сульфат, декорин, кератан сульфат, бигликаны, аггрекан, версикан, перлекан, CD44v3 и/или синдекан. Также такое покрытие неососочков выполняется в сосуде с минимальной адгезией с клеточной культуры, например, в сосудах с ультранизким прикреплением с клеточной культуры. Покрытие выполняется в течение 1-5 дней, предпочтительно в течение 1-2 дней.
Данное изобретение также касается de novo сосочков и волосяных микрофолликулов, получаемых способами по данному изобретению. Изложенное ранее в данном описании, касающемся способов получения неососочков и микрофолликулов, соответственно, расценивается как действующее и применимое без ограничений продуктами способов получения, если целесообразно.
И de novo сосочки, и/или волосяные микр о фолликулы данного изобретения можно использовать для получения кожных эквивалентов. Предпочтительно кожные эквиваленты сконструированы, например, путем использования Matriderm (Dr.Suwelack Skin & Health Care AG), согласно стандартным способам, и участки вставки для микрофолликулов вырезаны с равными интервалами посредством 2-фотонного лазера или предварительно перфорируются пробойником. Следовательно, кожные эквиваленты, включающие de novo сосочки и/или волосяные микрофолликулы данного изобретения составляют другую цель данного изобретения. Кроме восстановленных кожных сосочков они включают один или более слоев кератиноцитов, которые могут сами формироваться в эпидермальной структуре или перидермальной структуре, и факультативно один или более слоев меланоцитов, которые могут накладываться на структуру кожных сосочков.
De novo сосочки и/или волосяные микрофолликулы по данному изобретению также могут использоваться как имплантаты. Поэтому, еще одной целью данного изобретения является имплантат, включающий в качестве активного ингредиента эффективное количество de novo сосочков данного изобретения и/или волосяных микрофолликулов данного изобретения, факультативно вместе с фармацевтически допустимыми адъювантами.
Подобным образом, кожный эквивалент данного изобретения можно использовать как трансплантат. Следующая цель данного изобретения заключается в обеспечении трансплантата, включающего в качестве активного ингредиент эффективное количество кожного эквивалента по данному изобретению, факультативно вместе с фармацевтически допустимыми адъювантами.
Выражение "эффективное количество" означает количество имплантата или трансплантата, соответственно, обладающее профилактически или терапевтически релевантным эффектом на болезнь или патологические состояния. Профилактический эффект предупреждает начало болезни или даже инфекции патогеном после инфильтрации отдельных представителей так, что последующее распространение патогена строго сокращается, или даже он полностью инактивируется. Терапевтически релевантный эффект облегчает до некоторой степени один или более симптомов болезни или возвращает к норме или частично, или полностью один или более физиологических или биохимических параметров, связанных с или вызывающих болезнь или патологические состояния. Соответствующее количество для введения имплантата или трансплантата, соответственно, является достаточно высоким для того, чтобы достичь желаемого профилактического или терапевтического эффекта уменьшения симптомов снижения количества волос. Будет понятно, что уровень специфической дозы, частота и период введения любому отдельному млекопитающему будет зависеть от ряда факторов, включая активность используемых специфических компонентов, возраст, вес тела, общее состояние здоровья, пол, диету, время введения, способ введения, комбинацию лекарственных средств и серьезность специфической терапии. Используя хорошо известные средства и способы, специалист в данной области сможет определить точное количество, как сущность стандартного эксперимента.
Имплантаты или трансплантаты данного изобретения получены известным путем с использованием общих твердых или жидких носителей, разбавителей, и/или добавок, и обычных адъювантов для фармацевтической инженерии и в соответствующем количестве в зависимости от намеченного способа применения. Эти фармацевтически приемлемые вспомогательные средства включают соли, буферы, наполнители, хелатирующие средства, антиоксиданты, растворители, связывающие средства, смазочные средства, покрытия, добавки, консерванты и суспендирующие средства. В значении данного изобретения "адъювант" означает каждое вещество, которое делает возможным, усиливает или модифицирует специфический ответ организма как результат имплантации или трансплантации, если вводится одновременно, совместно или последовательно. Количество вспомогательного вещества, которое скомбинировано с активным ингредиентом для получения отдельной лекарственной формы варьирует в зависимости от реципиента, которого лечат, и конкретного способа введения.
В зависимости от способа введения имплантат или трансплантат, соответственно, может быть сформулирован рядом способов. Концентрация терапевтически активных ингредиентов в составе может изменяться от около 0,1 до 100 вес.%. Они могут вводиться отдельно или в комбинации с другими видами лечения.
Данное изобретение также касается de novo сосочков, волосяных микрофолликулов и/или кожных эквивалентов по данному изобретению для профилактического или терапевтического лечения состояния снижения количества волос. Вышеупомянутые продукты способов по данному изобретению предпочтительно используются для терапевтического лечения. Терапевтически релевантный эффект облегчает до некоторой степени один или более симптомов снижения количества волос или возвращает к норме, или частично, или полностью, один или более физиологических параметров, связанных с или вызывающих патологические состояния. Мониторинг расценивается как вид лечения, при условии, что продукты способов по данному изобретению вводятся с различными интервалами, например, для активации пролиферационного ответа и полного устранения симптомов состояния. Могут применяться либо идентичные продукты, либо разные продукты. В значении данного изобретения целесообразно профилактическое лечение, если у субъекта есть какая-либо предрасположенность для начала потери волос, такая как семейная предрасположенность, генетический дефект или перенесенная ранее болезнь.
Патологические состояния пониженного количества волос, касающиеся данного изобретения, могут быть результатом алопеции (например, андрогенетическая алопеция, очаговая алопеция и т.д.), наследственной безволосости, рубцевания, ожогов, лучевой терапии, химиотерапии, потери волос, связанной с болезнью, случайного повреждения, повреждения волосяного фолликула, хирургической травмы, оперционной раны или раны донорного участка от кожного трансплантата.
Данное изобретение также касается применения de novo сосочков, волосяных микрофолликулов и/или кожных эквивалентов по данному изобретению для получения имплантата или трансплантата, соответственно, для профилактического или терапевтического лечения состояния снижения количества волос. Имплантат и трансплантат могут либо вводиться для предотвращения начала потери волос млекопитающего, предпочтительно человека, и в результате проблемы заранее, либо для лечения возникших и продолжающихся симптомов.
Другой целью данного изобретения является обеспечение способа лечения состояния снижения количества волос, где de novo сосочки, волосяные микро фолликулы и/или кожные эквиваленты по данному изобретению включены в кожу млекопитающего, нуждающегося в таком лечении. Микроорганоидные фолликулы, особенно аутологические/аллогенные человеческие предшественники волосяных фолликулов, используются для имплантации с целью индуцирования роста волос, тогда как заменители кожи действительно регенерируют кожу, предпочтительно кожу головы. Микроорганоидные фолликулы включаются в отверстия предварительно депилированных, уменьшенных в размере волосяных фолликулов (место сужения) поврежденных зон кожи. Предпочтительно de novo сосочки и волосяные микрофолликулы вводятся, более предпочтительно посредством специально сконструированного устройства размером около 150 мкм. Также предпочтительно, что все компоненты использовуются в аутологической форме и обработаны при GLP/GMP условиях. Неососочки, волосяные микрофолликулы или компартменты волосяных фолликулов стимулируют новое развитие роста волос, например, в случае наследственной безволосости, рубцевания (ожогов), потери волос, связанной с болезнью, потери волос, индуцированной химиотерапией/облучением, и подобного, как уже раскрыто в ходе данного описания. Созревание микрофолликулов в волосяных фолликулах, обладающих длительной жизнеспособностью, стимулируется микросредой, т.е. постоянным, дистальным волосяным фолликулом.
Данное изобретение также касается применения вышеупомянутых продуктов для прямого фармакологического и косметического in vitro тестирования веществ, которые оказывают на волос модулирующее влияние. Модулирующие волосы эффекты особенно выбраны из группы роста волоса, формы волоса, структуры волоса, цвета волоса и пигментации волоса. Предпочтительно анализировать эффект модифицирования роста волоса с целью стимулирования роста волоса в случаях потери волос, например, вызванной алопецией, а также ингибирования роста волос в случаях чрезмерного, нежелательного роста волос, например, вызванного гипертрихозом и/или гирсутизмом, или роста бороды у женщин, или нежелательных волос тела. В частности, применение высоко производительного способа позволяет фармацевтической и косметической отраслям эффективно тестировать существующие или новые вещества на потенциальный эффект модулирования роста волос. Вещества включают фармацевтические средства, косметические средства, химические соединения, полимерные соединения, факторы роста, клеточные продукты, живые клетки и/или биомолекулы. Кроме того, если добавить меланоциты, т.е. формирующие пигмент клетки, к микрофолликулам, можно изучить влияние веществ на пигментацию и/или окрашивание ости волоса, подлежащего формированию. Более того, влияние веществ на форму волоса и структуру волоса можно тестировать, например, формирование завитков и т.п.
Следующие конечные точки можно оценить или измерить для получения информации эффективности веществ в отношении улучшения структуры волоса и воздействия на рост волоса: анализ формирования ости волоса, длина роста и характеристики ости волоса, анализ массы волос, объем и структура кожного сосочка, измерение пролиферации (например, Ki67 экспрессия, BrdU внедрение и т.п.), измерение апоптоза (например, TUNEL, ферментативное испытание, измерение аннексина и т.п.), дифференциальный маркерный анализ (например, иммуногистология, in situ гибридизация, RT-PCR и т.п.), определение щелочной фосфатазы как DPF маркера, анализ определенных специфических для волоса белков (например, специфических для волоса кератинов и т.п.), анализ цитокинов, факторов роста, хемокинов и всех видов информационных веществ, сформированных inter alia кожным сосочком (например, с помощью BioPlex, ELISA и т.п.), и/или анализ протеома или экспрессии матричных белков, факторов роста (например, MSP, HGF, CTGF и т.п.), факторов транскрипции, молекул пути wnt (например, DKK1, ВМР2-4 и т.п.), интерлейкинов (например, IL-6 и т.п.) и/или хемокинов/хемокиновых рецепторов (например, CXCR и т.п.), которые проявляют усиленное появление, а также индуцирующих апоптоз молекул и/или стимулирующих пролиферацию молекул, которые проявляют пониженное появление. Влияние на пигментацию волоса можно измерить посредством организации/миграции меланоцитов, формированием/распределением меланиновых гранул, активности тирозиназы, и/или серийным анализом экспрессии генов, вовлеченных в синтез меланина. Другие варианты осуществления, модификации и варианты данного изобретения будут очевидны для экспертов при чтении описания и могут быть осуществлены на практике без отступления от объема данного изобретения.
Кроме того, de novo сосочки или микрофолликулы данного изобретения можно применять отдельно или в соединении с образованием кожных эквивалентов с волосяными фолликулами для фармакологического и токсикологического in vitro тестирования веществ в медицине, фармакологии и косметологии. Такое применение, например, выполненное как высокопроизводительный способ, представляет особый интерес для фармацевтической, химической и косметической отраслей при необходимости тестирования их веществ и продуктов на токсические эффекты. Новые правовые предписания требуют замены предыдущих тестов на животных приемлемыми способами in vitro тестов. Поэтому, микрофолликулы сами по себе, а также искусственные системы заменителей кожи со встроенными микрофолликулами можно использовать как идеальные системы скрининга для токсикологических исследований, включая раздражения, генотоксические эффекты и т.п. Модельные структуры данного изобретения могут полностью заменить тесты на животных, а также заменить менее приемлемые in vitro модели, применяемые в настоящее время, поскольку данные модели делают возможным анализ сложных физиологических процессов. Такие тесты можно выполнять, подвергая модельную структуру действию вещества интереса в биореакторе. После специфического для вещества периода инкубации, который, в частности, составляет от 3 минут до 4 часов, модель промывают средой, а затем анализируют приемлемым испытанием, в качестве примера описанным ранее в ходе описания.
Данное изобретение дополнительно раскрывает способ скрининга веществ, которые модулируют свойства волос, включающий этапы обеспечения образца de novo сосочков, волосяных микрофолликулов и/или кожного эквивалента по данному изобретению, деления соответствующего образца на части, инкубирования, по меньшей мере, одной части с веществами, подлежащими скринингу, и сравнения параметров свойств волоса в одной части с другой частью, которую не инкубировали с веществами. Кратко, способ по данному изобретению делает возможным идентификацию и анализ веществ, которые осуществляют влияние на волос, с помощью модельных структур данного изобретения. Образец, который, как подразумевается, включает определенное число продуктов-субъектов по данному изобретению, делят на несколько частей. Обеспечивают, по меньшей мере, две подгруппы; одну используют для скрининга, а другая служит отрицательным контролем. Предпочтительно число частей для скрининга превышает число контрольных частей. Обычно многочисленные части подвергают высокопроизводительному скринингу. Вещества, подлежащие скринингу в способе по данному изобретению, не ограничивают каким-либо образом. В варианте осуществления данного изобретения вещества выбирают из группы, включающей нуклеиновые кислоты, включая PHKi, рибозимы, аптамеры, антитела, пептиды, углеводы, полимеры, небольшие молекулы с молекулярным весом от 50 до 1000 Да и белки, предпочтительно антитела, цитокины и липокалины. Эти вещества часто доступны в библиотеках. Предпочтительно инкубировать отдельное соединение с определенной частью образца. Однако, возможно исследовать объединенный эффект веществ путем инкубирования, по меньшей мере, двух веществ с одной частью. Следующая подгруппа субъектов одновременно инкубируется без веществ. Процесс инкубации зависит от различных параметров, например, типы клеток и чувствительность выявления, оптимизация которых выполняется стандартными процедурами, известными специалисту в данной области. Идентификацию эффективных веществ в значении данного изобретения выполняют непрямым путем, предпочтительно путем определения экспрессионных паттернов и/или жизнеспособности клеток, которые изменяются. Определение выполняют в определенный момент и сравнивают с сигнальной силой в начале эксперимента и с отрицательным контролем. Приемлемые тесты известны специалисту в данной области или могут быть легко разработаны в обычном порядке.
Кроме того, данное изобретение можно осуществить как набор, включающий de novo сосочки, волосяные микрофолликулы, кожный эквивалент, имплантат и/или трансплантат по данному изобретению, особенно для выполнения способов по данному изобретению для лечения состояния снижения количества волос или скрининга веществ, соответственно. Набор данного изобретения может включать изделие, которое включает письменные инструкции или указания для пользователя с письменными инструкциями по поводу осуществления способов данного изобретения. Для дальнейших деталей ссылка может быть сделана на вышеупомянутые наблюдения способа лечения, а также на способ скрининга по данному изобретению, который также применяется для набора данного изобретения.
В объеме данного изобретения способы получения de novo сосочков и волосяного микрофолликула, в которых применяется сгущение нарощенных DPF в физиологических клеточных совокупностях посредством трехмерного культивирования и определенное соотношение концентрации клеток к поверхности сосуда, представлены первый раз. Как видно из формирования продуцирующих ость волоса микрофолликулов и посредством анализов генной и белковой экспрессии, DPF вновь обеспечивает свои оригинальные, индуктивные свойства после специфического сгущения. Поскольку индуктивные свойства клеток можно восстановить в ходе данного способа, число пересевов для наращивания клеток не имеет значения. Таки образом, можно успешно применять постоянные и высокие количества исходных клеток и выполнять контролированную подачу среды в воспроизводимой форме при использовании трехмерного культивирования в сосудах с отсутствием прикрепления культуры. По сравнению с другими способами 3D культивирования для общих экспериментов дифференциации, таких как микромасса, пеллетная культура или метод висячей капли, клетки в системе культивирования данного изобретения не были вынуждены контактировать друг с другом, но им было позволено ассоциироваться индивидуально для формирования клеточных совокупностей, а в случае DPF подобных сосочку скоплений.
Обеспечение de novo сосочков, волосяных микрофолликулов и кожных эквивалентов, как определено процессом продуцирования, дает имплантаты или трансплантаты, соответственно, для профилактического или терапевтического лечения состояний снижения количества волос. Настоящие продукты данного изобретения дают ряд преимуществ. И эквиваленты волосяных фолликулов, и заменитель кожи более стандартизованные, чем выделенный волосяной фолликул. Они снижают потребность в волосяных фолликулах и являются более близкими к in vivo ситуации, чем какая-либо модель известного уровня техники. Сложные трехмерные модели данного изобретения имитируют волосяной фолликул in vivo по его структуре и гистологической композиции, что дает высокий уровень релевантности информации по эффективности и совместимости активных веществ. Все продукты данного изобретения, кроме того, характеризуются высокой стабильностью, низкими производственными затратами, удобной обработкой и доступны в любое время. Эти особенности формируют основу для воспроизводимого действия по стандартизированным протоколам и для надежного и безопасного взаимодействия с соответствующими им эффекторными молекулами. Их применение является многообещающим, новым подходом для широкого спектра терапии, вызывающим прямое и непосредственное уменьшение симптомов.
Продукты по данному изобретению приемлемы для различных применений в медицинских, фармацевтических и косметических областях, например, для развития косметических продуктов или для обнаружения активных веществ с биологическим эффектом на волосяной фолликул путем воздействия на пигментацию волоса, рост волоса, структуру волоса и подобное, которые могут выполняться на in vitro тестовых системах или процессах скрининга, тем самым обеспечивая информацию по эффекту веществ на клетки волосяных фолликулов с in vivo релевантностью. Обеспечение продуктов, сформированных таким образом, особенно выгодно для крупномасштабных скрининговых тестов. Все их можно использовать в скрининговых процедурах, приемлемых для высокой производительности, для идентификации активных веществ или композиций активных вещество для стимулирования или ингибирования роста волоса и в токсикологическом тестировании веществ и химикатов. Способы получения, а также являющиеся результатом способы скрининга данного изобретения можно выполнять просто и быстро. Кроме того, соответствующий набор является рационально полученным.
Следует понимать, что данное изобретение не ограничено конкретными способами, продуктами, набором или применениями, описанными в данном документе, которые, по сути, могут варьировать. Также следует понимать, что терминология, используемая в данном документе, служит цели только описания конкретных вариантов осуществления и не предназначена ограничивать объем данного изобретения, который определяется только приложенной формулой изобретения. Как используется в данном документе, включая приложенную формулу изобретения, формы единственного числа слов включают соответствующие им ссылки на множественное число, если контекст четко не диктует иное. Таким образом, например, ссылка на "сосуд" включает один или более сосудов, которые могут быть или идентичными, или различными по размеру, форме, или сборными, а ссылка на "способ" включает ссылку на эквивалентные этапы и способы, известные специалисту в данной области, и подобное. Если не определено иное, все технические и научные выражения, используемые в данном документе, имеют то же значение, что обычно понимается специалистом области, к которой принадлежит данное изобретение.
Хотя способы и материалы, подобные или эквивалентные описанным в данном документе, можно использовать в осуществлении или тестировании данного изобретения, ниже описаны приемлемые примеры. Следующие примеры представлены путем иллюстрации, а не путем ограничения. В примерах используются стандартные реагенты и буферы, которые свободны от загрязняющих активностей (когда бы не использовались).
ФИГУРЫ:
На Фиг.1 показано:
A) Пункционная биопсия донорной кожи, взятой при подтягивающей хирургии. Пунктирная линия показывает линию разреза границы между кожей и подкожной клетчаткой для последующего выделения волосяного фолликула.
B) "Отсеченный" и разрезанный волосяной фолликул (выделенный прямоугольник) диссоциирован новой методикой: соединительнотканевая оболочка извлекается диаметрально над остью волоса, что приводит к чистому отделению ости волоса с кератиноцитами и меланоцитами внешней и внутренней корневой оболочки, с одной стороны, и кожным сосочком и соединительнотканевой оболочкой, с другой стороны.
C) Разрезанная соединительнотканевая оболочка с ее фибробластами плюс соседний кожный сосочек, который можно быть аккуратно отсечен (выделенный прямоугольник).
D) Разрезанный кожный сосочек под электронным микроскопом.
Е) Разрастание фибробласта кожного сосочка от слегка процарапанного и закрепленного кожного сосочка, покидающего свою капсульную структуру почти интактным.
F) Культивированный фибробласт кожного сосочка 3-го пересева в 75 см колбах с непокрытой культурой.
G) Фибробласт кожного сосочка, формирующий подобные кожному сосочку скопления в 75 см2 колбах с ультранизким прикреплением.
Н) Увеличение скопления фибробластов кожного сосочка, готового быть обработанным до неососочка, с внеклеточными матричными компонентами в 6-лунковых планшетах с низким прикреплением.
На Фиг.2 показано:
A) Неососочек (белая стрелка) с внеклеточной матрицей и окруженный кератиноцитами, которые добавлены в планшет с ультранизким прикреплением, формирующий многоклеточное скопление.
B) Первые признаки формирования фолликулярных структур через 24 часа в культуре с ультранизким прикреплением.
C) Формирование неофолликула через 1 неделю. Четко видно формирование примитивной ости волоса.
D) Формирование неофолликула под DIC световым микроскопом, иллюстрирующим структуру интактного кожного сосочка через 1 неделю культивирования.
Е) Неофолликулы, вставленные в кожный эквивалент, показывающий определенные структуры, подобные волосяному фолликулу. Выделенный прямоугольник показывает растущий вниз волосяной фолликул. В инвертированный микроскоп видно проксимальную часть фолликула/кожного эквивалента.
F) Следующая культура неофолликулов с кожным эквивалентом, демонстрирующая четкое закрепление волосяного фолликула и непрерывный рост.
На Фиг.3 показано:
Неофолликул, полученный с помощью КС и МС из источников, отличных от волосяного фолликула млекопитающего, на разных стадиях развития и формирования:
A) Стадия 1: неососочек (без добавления экзогенных внеклеточных матричных белков), окруженный меланоцитами и кератиноцитами, которые добавлены в планшет с ультранизким прикреплением, формирующий раннее многоклеточное скопление.
B) Стадия 2: первые признаки формирования фолликулярных структур через 24 часа в культуре с ультранизким прикреплением (отмечается выступ в верхней части). Прикрепленные клетки прилипают к неососочку и принимают уплощенную форму.
C) Стадия 3: начало формирования неофолликула через 1 неделю с развитием подобной волосяному фолликулу оболочки.
D) Стадия 4: в неофолликуле четко видимое формирование базовой ости волоса становится заметным.
На Фиг.4 показано:
Формирование функциональных неососочков в две разные точки времени;
A) через 48 часов сгущения; и
B) через 7 дней сгущения; на день 7 агрегация клеток становится намного более плотной и формирование собственного происхождения внеклеточной матрицы становится заметным.
ПРИМЕРЫ
ПРИМЕР 1: Выделение и культура человеческих фолликулярных фибробластов кожного сосочка (DPF), фибробластов соединительнотканевой оболочки (CTSF), кератиноцитов (КС) и меланоцитов (МС)
Отдельные волосяные фолликулы получили после микрорассечения образцов кожи головы человека от излишка подтягивающих хирургических операций, полученные с соблюдением правил. Для выделения матричных КС и МС, CTSF и фибробластов кожного сосочка (DPF) кожу разрезали по границе между кожей и подкожной клетчаткой скальпелем и волосяные фолликулы на анагенной стадии (фаза роста) извлекли хирургическими щипцами под препаровальным микроскопом.
В отличие от ранее описанных методик выделения (например, Mageri et al., Methods Exp. Dermat. 11, 381-385, 2002), чистые фракции желаемых клеточных популяций получили продольным разрезанием на слои соединительной ткани верхней части разрезанного волосяного фолликула. С помощью фиксирования ости волоса на одном месте CTS можно диаметрально извлечь из волосяной матрицы хирургическими щипцами по направлению к нижней проксимальной части. Такой методикой DP клетки автоматически раскрыли, избегая повреждения и смешивания типов клеток. Таким образом, CTS и кожный сосочек, а также волосяная матрица, включающая КС и МС клетки, четко разделены и могут быть легко отсечены скальпелем.
DP и CTS изоляты отдельно культивировали в 6-луночных планшетах для клеточной культуры (2-4 в одной лунке) путем фиксирования их к культур альному планшету иглой. Для активирования быстрого разрастания, но в то же время поддержания капсульной морфологии и ниши фибробласта, тонкую мембрану слегка процарапали, чтобы выпустить внеклеточные матричные компоненты (ЕСМ). Клетки погрузили в DMEM+ (Gibco/lnvitrogen) плюс 10% фетальной бычьей сыворотки (FCS), до роста фибробласта, наблюдаемого через 1-2 недели в зависимости от донорных вариаций. Затем клетки переместили в 25 см2 культуральную колбу еще на неделю, а затем пересеяли в 75 см2культуральную колбу. После достижения субслияния пересев 3 разделили на три 75 см2 колбы, получив 1,5-2 миллионов DPF или CTSF, соответственно.
КС и амеланотический волосяной фолликул МС удалили из оставшейся ости волоса, прикрепили волосяную матрицу путем трипсинизации (0,05% трипсина и 0,53 мМ EDTA), разделили путем дифференциальной трипсинизации и культивировали стандартными способами, как описано у Tobin et al., J. Invest. Dermatology 104(1), 86-88, 1995.
ПРИМЕР 2: Формирование неососочков
Оптимизированное количество 500000 DPF высеяли в 75 см2 колбы с ультранизким прикреплением культуры (Coming), содержащие DMEM+, и им позволили формировать клеточные совокупности. Через 48 часов выдерживания их неподвижными эти совокупности приняли размер нативного человеческого кожного сосочка волосяного фолликула. Скопления затем перенесли в 6-луночный планшет с ультранизким прикреплением и добавили в лунки смесь ламинина (окончательная концентрация 11,5 мкг/мл), фибронектина (окончательная концентрация 10 мкг/мл) и коллагена IV (окончательная концентрация 40 мкг/мл). Через 24-48 часов в культуре, свойственная ЕСМ секреция и добавленные белки построили стабильную матричную обертку, и неососочки сформировались. Для облегчения более быстрого ЕСМ накопления и дифференциации альтернативно можно добавить в среду факторы роста, т.е. гепатоцитный фактор роста (30 нг/мл) и/или соединительнотканевый фактор роста (20 нг/мл). Эти неососочки готовы быть имплантированы в кожу in vivo для развития индуктивных свойств волоса.
ПРИМЕР 3: Формирование неофолликулов
250000 КС и МС (10:1) добавили к неососочкам в колбе с ультранизким прикреплением культуры (6 лунок, Corning), a DMEM+ среду заменили на определенную кератиноцитную безсывороточную среду (Gibco). Через 1 неделю покрытые неососочки формировали структуры, подобные волосяным фолликулам. Эти неофолликулы уже могли использоваться для тестирования. Для улучшения многослойного неофолликула, который еще лучше имитирует структуру и функцию волосяного фолликула, можно получить путем покрытия образованного неофолликула смесью коллагена IV (60 мкг/мл) с CTSF (200000 клеток) в планшетах с ультранизким прикреплением с DMEM+ 10% FCS в течение дополнительных 2 дней и с заменой среды каждый следующий 3-ий день.
ПРИМЕР 4: Образование кожных эквивалентов с неофолликулами
Ювенильные человеческие фибробласты крайней плоти выделили с использованием ранее описанных способов (Toma et al., Stem Cells 23, 727-37, 2005) и культивировали в DMEM+10% FCS. 250000 кожных фибробластов (также использовали DPF или CTSF, но фибробласты крайней плоти были предпочтительными с точки зрения обработки) смешали с фибриногеновым раствором (Sigma, 3 мг/мл) и добавили 2,0% (объем/объем) апротинина (20 мкг/мл) и 2,5% (объем/объем) тромбина 1,25 единицы/мл. Этим охлажденным раствором заполнили камеры Transwell для культуры, избегая воздушных пузырьков. После регулирования температуры в течение 2-3 минут при комнатной температуре 30-40 неофолликулов осторожно ввели в раствор, и выполнили полимеризацию до геля в течение 10 минут при 37°С. Составленную матрицу пропитывали DMEM+ средой в течение 48 часов.
Кожные кератиноциты выделили из кожных биопсий, полученных от лицевых подтягивающих хирургических операций или из крайней плоти (Barrandon & Green, Proc Natl. Acad. Sci. 82, 5390-4, 1985). Кратко, лежащую в основе жировую ткань и дерму отсекли, а оставшийся эпидермис расщепляли на протяжении ночи в растворе трипсина/EDTA (РАА) при 4°С. КС собрали с помощью клеточного скребка, а после пропускания через 70 мкм клеточное сито (Becton Dickinson) их высеяли в покрытые коллагеном I культуральные колбы. Определенную кератиноцитную безсывороточную среду (Gibco) заменяли дважды в неделю, а КС пересевали или собирали при 60-80% слиянии.
КС (250000) добавили в верхнюю часть матрицы и оставили их прилипать в течение 24 часов. Излишние клетки отобрали при замене определенной кератиноцитной безсывороточной среды (Gibco), и после достижения слияния камеры Transwell подняли до границы раздела фаз воздуха и жидкости, чтобы произошла КС дифференциация.
Также тестировали клеточные линии (а именно HaCat для КС и HS27 для фибробластов) на образование подобной коже модели, поскольку они легче культивируются и снижают донорные вариации. Их выращивали на DMEM+ (Gibco), дополненной 5% фетальной бычьей сыворотки (FCS, Gibco).
ПРИМЕР 5: Формирование неофолликулов, включающих клетки полученные не из волосяных фолликулов млекопитающего
Неофолликулы получили, как описано в Примере 3, с использованием КС и МС, полученных по схеме ниже.
Клеточная культура человеческих кератиноцитов и фибробластов крайней плоти:
Фибробласты и кератиноциты крайней плоти человека выделили при обрезании крайней плоти с использованием ранее описанных способов (Toma et al., Stem Cells 23, 727-37, 2005, Barrandon and Green, Proc Nati Acad Sci. 1985, 82:5390-4). Кратко, лежащую в основе жировую ткань и дерму отсекли, а оставшийся эпидермис расщепляли на протяжении ночи в растворе диспазы (4 мг/мл, Sigma) при 4°С на протяжении ночи. Затем кератиноциты собрали с использованием клеточного скребка и после пропускания через 70 мкм клеточное сито (Becton Dickinson) высеяли в культуральные колбы. Все кератиноциты росли в покрытых коллагеном I колбах для клеточной культуры и в определенной кератиноцитной безсывороточной среде (Gibco). Среду заменяли дважды в неделю и кератиноциты пересевали или собирали при 60-80% слиянии. Фибробласты культивировали в DMEM+10% FCS.
Клеточная культура человеческих эпидермальных меланоцитов:
Начиная с криопробирки человеческих зрелых эпидермальных меланоцитов (приобретенных у CellMade) процедуры с клеточными культурами выполнили согласно протоколу производителя. Кратко, 15 мл меланоцитной ростовой среды добавили в Т-75 культуральную колбу. Клетки быстро растопили путем погружения нижней половины сосуда в 37°С водяную баню на 1 минуту. Клетки ресуспендировали в Т-75 колбе, содержащей меланоцитную ростовую среду. Т-75 колбу поместили в 37°С с 5% СО2 увлажненный инкубатор. Меланоцитную ростовую среду заменяли каждые 2-3 дня. Клетки субкультивировали, когда культура достигла 80% слияния.
Полученные неофолликулы изображены на Фиг.3. Показаны различные стадии развития неофолликулов, полученных с использованием КС и МС, происходящих из источников, отличных от волосяного фолликула млекопитающего. На стадии 1 неососочки (без добавления экзогенных внеклеточных матричных белков) окружены меланоцитами и кератиноцитами, которые добавили в планшет с ультранизким прикреплением, формирующими раннее многоклеточное скопление. Создана свободная совокупность. На стадии 2 можно увидеть первые признаки формирования фолликулярных структур в культуре с ультранизким прикреплением. Прикрепленные клетки прилипают к неососочку и принимают плоскую форму, в то время как на верхней части скопления формируется выступ. Приблизительно через 1 неделю неофолликул начинает формировать подобные волосяному фолликулу оболочки. В закончившем начальный рост неофолликуле примитивная ость волоса становится четко видимой.
ПРИМЕР 6: Анализ генной экспрессии различных происходящих от человеческого кожного сосочка клеточных образцов с использованием олиго микрочипов цельного человеческого генома Agilent (одноцветный)
1. SuperAmp™ РНК амплификация
Два выделенных нативных кожных сосочка, 1×103 однослойно культивированные фибробласты кожного сосочка, повторно сгущенные фибробласты кожного сосочка через 48 часов и повторно сгущенные фибробласты кожного сосочка через 14 дней получили, как описано выше. Четыре образца человеческих клеток лизировали с использованием лизисного буфера SuperAmp™.
Перечень образцов
SuperAmp РНК амплификацию выполнили по процедуре Miltenyi Biotec. Кратко, амплификация основана на общем протоколе PCR с использованием иРНК-полученной кДНК. иРНК выделили методикой магнитных гранул. Амплифицированные кДНК образцы количественно оценили с использованием спектрофотометра ND-1000 (NanoDrop Technologies).
Краткое изложение выходов кДНК
Целостность кДНК проверили с использованием платформы Agilent 2100 Bioanalyzer (Agilent Technologies). Результаты работы биоанализатора анализировали с использованием гелевого изображения и электроферогарммы с использованием экспертного программного обеспечения Agilent 2100 Bioanalyzer. Средняя длина высоко амплифицированных кДНК продуктов варьировала от 200 до 1000 п.о.
2. Гибридизация олиго микрочипов цельного генома Agilent
Использовали 250 нг каждой из кДНК, как шаблон для Cy3 мечения, которое выполняли по протоколу Miltenyi Biotec. Меченные Cy3 кДНК гибридизировали на протяжении ночи (17 часов, 65°С) с олиго микрочипами цельного человеческого генома Agilent 4x 44K (таблица 3) с использованием рекомендованной Agilent гибридизационной камеры и печи.
Схема гибридизации
В заключение, микрочипы промыли один раз 6х SSPE буфером, содержащим 0,005% N-лауроилсаркозин, в течение 1 минуты при комнатной температуре с последующим вторым промыванием предварительно нагретым 0,06х SSPE буфером (37°С), содержащим 0,005% N-лауроилсаркозин, в течение 1 минуты. Последний этап промывания выполняли с ацетонитрилом в течение 30 секунд.
3. Результаты сканирования
Флуоресцентные сигналы гибридизированных микрочипов Agilent обнаруживали с использованием сканерной системы микрочипов Agilent (Agilent Technologies).
4. Анализ изображения и данных
Программное обеспечение Agilent Feature Extraction (FES) использовали для считывания и обработки файлов изображений микрочипа. Программное обеспечение определяет характерные интенсивности (включая вычитание фона), отклоняет аномальные значения и рассчитывает статистические достоверности. Для определения дифференциальной генной экспрессии FES полученные файлы выходных данных далее анализировали с использованием системы анализа данных генной экспрессии Rosetta Resolver® (Rosetta Biosoftware). Это программное обеспечение предлагает, наряду с другими особенностями, возможность сравнивать два отдельных профиля интенсивности в эксперименте по анализу соотношения. Все образцы пометили с Cy3, в этот момент эксперименты по анализу соотношения обозначены как контрольные против (vs.) экспериментов по анализу образцов (автоматический вывод данных системы Resolver®). Следует отметить, что соотношения всегда рассчитываются путем деления образцовой сигнальной интенсивности на контрольную сигнальную интенсивность.
5. Перечни генов, перечень одноэкспериментных необработанных данных, перечень одноэкспериментных нормализованных данных, перечень соотношения генов / перечень предварительно отобранных кандидатных генов
Выходные данные программного обеспечения Agilent Feature Extraction включают перечни генов с полными наборами необработанных данных, названные перечнем одноэкспериментных необработанных данных. Кроме того, сигнальные интенсивности из перечней одноэкспериментных необработанных данных нормализуют путем деления значений интенсивности на их среднее. Эти нормализованные сигнальные интенсивности объединяены в общую таблицу перечня одноэкспериментных нормализованных данных. Этот перечень включает кроме нормализованных значений интенсивности признак glsPosAndSignif, который показывает при значении = 1, что сигнальная интенсивность положительная и значительно выше фона, а при значении = 0, что сигнальная интенсивность не является положительной и значительно выше фона. Программное обеспечение Resolver® позволяет экспорт генного перечня со всеми нормализованными соотношениями образец/контрольlog10 и -кратными изменениями, описаниями последовательностей, р-значениями и т.п., названными перечень генных соотношений (всех генов). Например: "-10 кратное изменение" в перечнях генных соотношений, таким образом, показывает генную экспрессию, в 10 раз большую в контроле по сравнению с образцом. Предполагаемые кандидатные гены с кратным изменением >2 и р-значением <0,01 приведены в перечне предварительно отобранных кандидатных генов. Выборка из такого перечня, включающего некоторые из дифференциально экспрессированных генов, показана в таблице 4.
Уровень (соотношение) определенных генов, измеренных микрочипным анализом в фибробластах (однослойных, сгущенных 48 часов, сгущенных 14 дней) по сравнению с нативными фибробластами кожного сосочка.
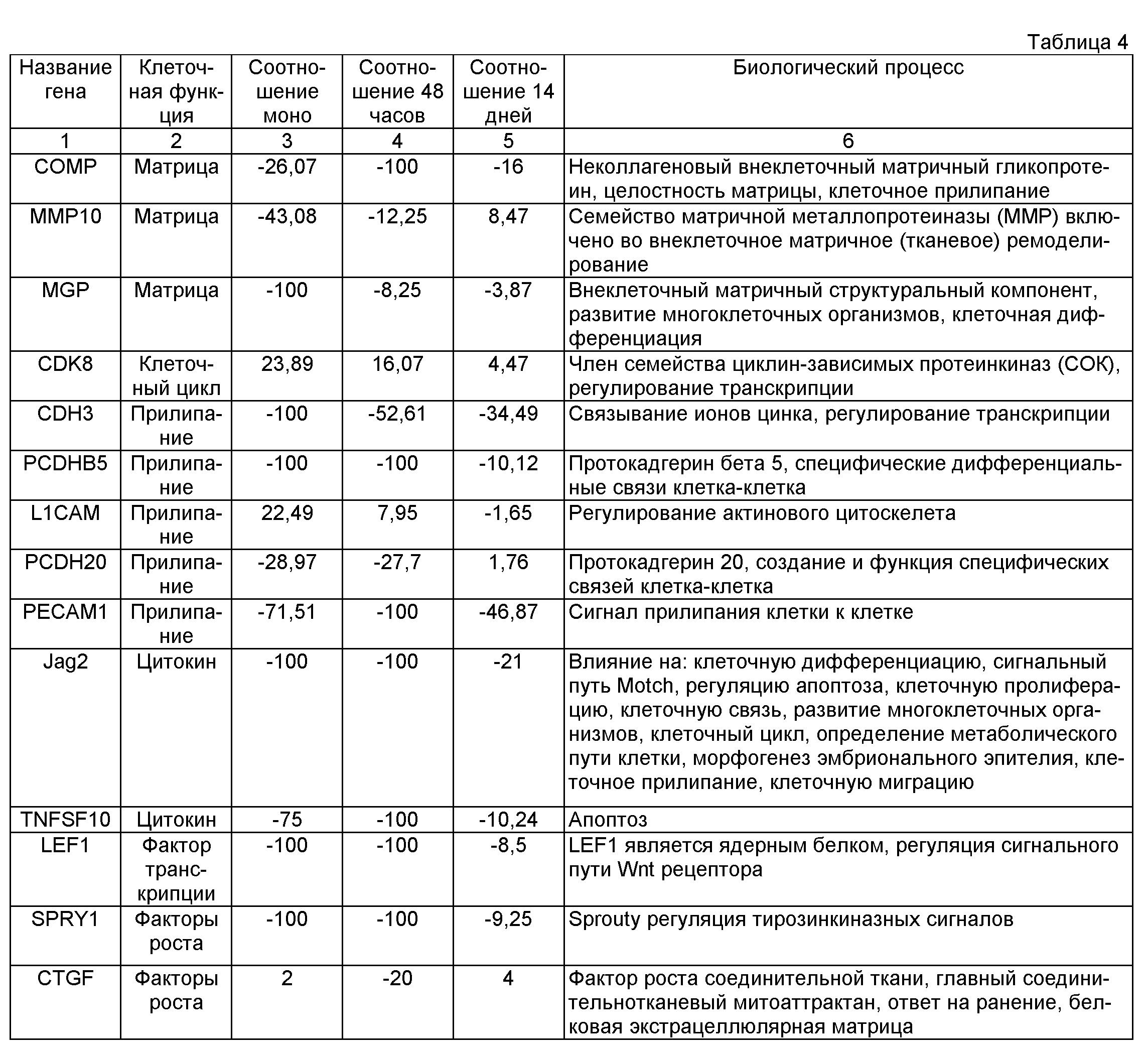
Из таблицы 4 видно, что при длительном культивировании уровень экспрессии генов, вовлеченных в трехмерную организацию и формирование ткани, достигает уровня экспрессии, наблюдаемого у нативных фибробластов кожного сосочка.
Композиция среды DMEM+- модифицированной Дюльбекко среды Игла (Gibco)
Реферат
Группа изобретений относится к области дерматолгии, в частности к способу получения волосяного микрофолликула и de novo сосочка, а также кожных эквивалентов, имплантатов и трансплантатов на их основе. Способ получения волосяного микрофолликула млекопитающего включает следующие этапы: обеспечивают de novo сосочек и другую клеточную популяцию, выбранную из группы, включающей фибробласты, кератиноциты и/или меланоциты и совместно культивируют de novo сосочек с другой клеточной популяцией при условиях неприкрепленной культуры. При этом получение de novo сосочков состоит из следующих этапов: обеспечивают кожный сосочек из волосяного фолликула млекопитающего; выделяют фибробласты кожного волосяного сосочка из кожного сосочка механическим фиксированием указанного кожного сосочка на поверхности сосуда для клеточной культуры, посредством чего базальная пластинка перфорируется, чтобы позволить указанным кожным волосяным сосочкам выходить; наращивают выделенные кожные волосяные сосочки в монослойной культуре без коллагенового покрытия, где указанные кожные волосяные сосочки пересевают; сгущают нарощенные кожные волосяные сосочки в клеточные совокупности, которые проявляют размер и форму физиологического кожного сосочка, где указанные кожные волосяные сосочки дифференцируются в сосудах с отсутствием адгезии культуры при концентрации клеток на поверхности сосуда от 1000 до 100000 кожных волосяных сосочков /сми покрывают de novo сосочки внеклеточными/ матричными белками. Заявленные изобретения позволяют сформировать волосяной микрофолликул, способный к формированию ости волоса. 12 н. и 4 з.п. ф-лы, 4 ил., 5 табл., 6 пр.
Формула
(a) обеспечивают, по меньшей мере, один de novo сосочек, который получают способом по п.4,
(b) обеспечивают, по меньшей мере, одну другую клеточную популяцию, выбранную из группы, включающей фибробласты, кератиноциты и/или меланоциты, и
(c) совместно культивируют de novo сосочек, по меньшей мере, с одной другой клеточной популяцией при условиях неприкрепленной культуры.
(a) обеспечивают, по меньшей мере, один кожный сосочек, по меньшей мере, из одного волосяного фолликула млекопитающего,
(b) выделяют фибробласты кожного волосяного сосочка из кожного сосочка механическим фиксированием указанного кожного сосочка на поверхности сосуда для клеточной культуры, посредством чего базальная пластинка перфорируется, чтобы позволить указанным кожным волосяным сосочкам выходить,
(c) наращивают выделенные кожные волосяные сосочки в монослойной культуре без коллагенового покрытия, где указанные кожные волосяные сосочки пересевают, по меньшей мере, один раз,
(d) сгущают нарощенные кожные волосяные сосочки в клеточные совокупности, которые проявляют размер и форму физиологического кожного сосочка, где указанные кожные волосяные сосочки дифференцируются в сосудах с отсутствием адгезии культуры при концентрации клеток на поверхности сосуда от 1000 до 100000 кожных волосяных сосочков /см2, и
(e) покрывают de novo сосочки внеклеточными матричными белками, предпочтительно коллагеном IV, фибронектином и/или ламинином.

Комментарии