Усовершенствованные иммобилизованные биологические объекты - RU2625756C2
Код документа: RU2625756C2
Чертежи







Описание
Настоящее изобретение относится к иммобилизованным биологическим объектам, к устройствам, имеющим на поверхности покрытие, содержащее в себе такие биологические объекты; а также к способам и промежуточным продуктам, используемым для их получения. В частности, настоящее изобретение относится к иммобилизованным антикоагулянтным объектам, таким как гепарин, а также к устройствам, например медицинским, аналитическим и разделяющим устройствам, имеющим на поверхности покрытия, содержащие иммобилизованный гепарин.
Уровень техники
Когда медицинское устройство помещают в организм или приводят в контакт с жидкостями организма, запускается ряд различных реакций, некоторые из которых приводят к коагуляции крови, контактирующей с поверхностью такого устройства. Для противодействия этому серьезному побочному эффекту перед помещением медицинского устройства в организм пациента или перед приведением устройства в контакт с жидкостями организма системно вводят хорошо известное антикоагулянтное соединение гепарин, обеспечивающее антитромботический эффект.
Тромбин является одним из нескольких факторов коагуляции, которые вместе обеспечивают образование тромбов на поверхности, контактирующей с кровью. Антитромбин (также известный как антитромбин III («AT» или «ATIN»)) является наиболее известным ингибитором коагуляции. Он нейтрализует действие тромбина и других факторов коагуляции, и таким образом ограничивает или прекращает коагуляцию крови. Гепарин резко повышает скорость, с которой антитромбин ингибирует факторы коагуляции.
Однако системная терапия высокими дозами гепарина часто связана с серьезными побочными эффектами, среди которых преобладают кровотечения. Другим редким, но серьезным осложнением гепариновой терапии является развитие иммунологического ответа, называемого гепарин-индуцированной тромбоцитопенией (ГИТ), которая может привести к тромбозу (как к венозному, так и к артериальному). Системное введение высоких доз гепарина, например, во время операции, также требует частого мониторинга активированного времени свертывания (используемого для контроля и управления гепариновой терапией), и соответствующих изменений дозировки, если они необходимы.
Таким образом, желательно иметь решения, при которых системное введение гепарина пациенту является необязательным или может быть ограничено. Предполагается, что этого можно добиться путем модификации поверхности медицинских устройств с использованием антикоагулянтных свойств гепарина. Таким образом, был разработан ряд более или менее успешных методик, где на поверхность медицинского устройства наносился слой гепарина, обеспечивающий нетромбообразующие свойства поверхности. Для устройств, в которых необходима долговременная биологическая активность, слой гепарина предпочтительно является устойчивым к вымыванию и деградации.
Гепарин является полисахаридом, несущим отрицательно заряженные группы сульфатов и карбоновых кислот на сахаридных единицах. Предпринимались попытки ионного связывания гепарина с поликатионными поверхностями, но такие модификации поверхности имеют тенденцию к потере стабильности со временем, что приводит к исчезновению нетромбообразующей функции в результате вымывания гепарина с поверхности.
Затем исследовались различные модификации поверхности, в которых гепарин ковалентно связывался с группами на поверхности.
Одним из наиболее успешных способов получения нетромбообразующего медицинского устройства является ковалентное связывание фрагмента гепарина с модифицированной поверхностью устройства. Общий способ и его усовершенствования раскрыты в Европейских патентах EP-B-0086186, EP-B-0086187, EP-B-0495820, а также в US 6,461,665.
В этих патентах описывается получение субстратов с модифицированной поверхностью путем первоначального избирательного расщепления полисахаридной цепи гепарина, например с использованием азотистой кислоты, приводящего к формированию концевых альдегидных групп. После этого на поверхность медицинского устройства вводят один или несколько слоев, модифицирующих поверхность и несущих первичные аминогруппы, и затем осуществляют реакцию альдегидных групп полисахаридной цепи с аминогруппами на модифицирующих поверхность слоях с последующим восстановлением промежуточных оснований Шиффа с получением стабильных вторичных аминогрупп.
Известны и другие способы модификации поверхностей. Например, в US 2005/0059068 описывается субстрат, предназначенный для использования в микроанализах. Активированный полиаминовый дендример ковалентно связан с поверхностью субстрата через силансодержащие группы. Дендример имеет точки ветвления, которые являются третичными аминами, и концевые остатки, которые являются NH2, OH, COOH или SH группами. Молекулы, содержащие функциональные группы OH или NH2, могут быть связаны с дендримером через концевые остатки дендримера. Поскольку субстрат предназначен для применения в микроанализах, он обычно имеет форму ровной поверхности, бусин, луночного планшета, мембраны и т.д., а компонент, содержащий OH или NH2 группу, является нуклеиновой кислотой, белком или пептидом.
В WO 03/057270 описывается устройство, например контактные линзы, с гладким покрытием, обладающим высокой поверхностной гидрофильностью. Приведен ряд примеров покрывающих материалов, включающий гликозаминогликаны (например, гепарин или хондроитинсульфат) и ПАМАМ (полиамидоаминовые) дендримеры. ПАМАМ дендримеры являются наиболее предпочтительными покрытиями. В этом документе в качестве примера приведены контактные линзы, содержащие множество слоев из ПАМАМ дендримера и сополимера полиакриламид-полиакриловая кислота (сополимер ПААм-ПАА). Покрытия формируют путем последовательного погружения контактных линз в растворы двух покровных материалов, причем ПААм-со-ПАА является внешним слоем.
В US 2003/0135195 описывается медицинское устройство, такое как катетер, с гидрофильной оболочкой высокой гладкости, полученной из смеси коллоидного алифатического полиуретанового полимера, водного раствора поли(1-винилпирролидон-со-2-диметиламиноэтилметакрилат)-ПВП и дендримеров. Этот документ раскрывает, что покрытие можно нанести на устройство путем погружения устройства в коллоидную дисперсию алифатического полиуретанового полимера в растворе поли(1-винилпирролидон-со-2-диметиламиноэтилметакрилат)-ПВП и активного агента (например, гепарина) в смеси дендримера, воды, N-метил-2-пирролидона и триэтиламина. В этом документе раскрыто, что гепарин может содержаться в полостях внутри дендримера. Также раскрыто, что содержащийся гепарин элюируется из гидрофильного полимерного матрикса с заданной скоростью.
В US 2009/0274737 описываются имплантаты, такие как стенты, имеющие гидрофильную поверхность с углом смачивания ≤80°. Один, два или более антикоагулянтных ингредиентов могут быть перманентно связаны с такой поверхностью, и примеры антикоагулянтов включают гепарин и некоторые дендримеры, особенно сульфатированные дендримеры. Поверхность может быть функционализирована для связывания антикоагулянта, и примерами функционализации является силанизация и реакция с 1,1'-карбонилдиимидазолом (КДИ).
Документ US 4,944,767 относится к полимерному материалу, способному адсорбировать высокие количества гепарина. Материал является блок-сополимером, в котором полиуретановые цепи соединяются с полиамидоаминовыми цепями.
Более ранняя заявка авторов настоящего изобретения, WO 2010/029189, относится к медицинскому устройству, имеющему покрытие с антикоагулянтными молекулами, такими как гепарин, ковалентно присоединенными через 1,2,3-триазольный линкер. Указанный документ описывает азидную или алкиновую функционализацию полиамина; получение гепарина с алкиновой или азидной функциональной группой (как нативного, так и деполимеризованного под действием азотистой кислоты); а также реакцию связывания модифицированного гепарина с модифицированным полимером через 1,2,3-триазольный линкер.
Продукт, описанный в WO 2010/029189, имеет много преимуществ, однако авторы изобретения попытались разработать усовершенствованный материал, в котором биодоступность гепарина или другой прикрепленной антикоагулянтной молекулы была бы повышена, и который обладал бы большей стабильностью во времени, и который можно было бы получать надежным способом, обеспечивающим стабильное получение целевого продукта.
Гепарины способны связывать широкий ряд биомолекул, включая ферменты, ингибиторы сериновых протеиназ (такие как антитромбин), факторы роста и белки экстрацеллюлярного матрикса, ферменты модификации ДНК и рецепторы гормонов. При использовании в хроматографии гепарин является не только аффинным лигандом, но также ионообменником с высокой плотностью заряда. Таким образом, биомолекулы можно специфически и обратимо адсорбировать гепаринами, иммобилизованными на нерастворимом носителе. Таким образом, иммобилизованные гепарины имеют ряд полезных немедицинских областей применения, в частности при анализе и разделении.
Раскрытие изобретения
В соответствии с настоящим изобретении, описываются, среди прочего: устройство, имеющее поверхность, содержащую слоистое покрытие, в котором внешний слой покрытия содержит множество молекул катионного сверхразветвленного полимера, характеризующегося (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да; (ii) общей молекулярной массой 1,500-1,000,000 Да; (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1); и (iv) наличием функциональных концевых групп, где одна или несколько указанных концевых групп содержат антикоагулянтные объекты, ковалентно присоединенные к этим группам.
Краткое описание чертежей
Фиг.1 является схематической двумерной иллюстрацией различных типов сверхразветвленных полимеров, в которых A представляет собой полимер, имеющий (теоретически) точки ветвления в каждой мономерной единице; B представляет собой разветвленный полимер с линейным остовом и прикрепленными к нему разветвленными клиньями, называемыми дендронами; C представляет собой полимер с точками ветвления, встроенными в линейные сегменты; a D представляет собой дендример.
Фиг.2 является двумерной иллюстрацией примера ПАМАМ дендримера, имеющего 3 генерации (в трехмерном виде структура является примерно сферической).
Фиг.3 является схематической двумерной иллюстрацией примера дендримера второго генерации, в котором центральная часть содержит три реакционно-способных функциональных группы, все из которых являются замещенными; первый слой имеет шесть реакционно-способных функциональных групп, все из которых являются замещенными; а второй слой имеет двенадцать реакционно-способных функциональных групп. Такой дендример в трехмерном виде имеет по существу сферическую форму.
Фиг.4 показывает, как первая функциональная группа гепаринового компонента (или другого антикоагулянтного объекта) может реагировать со второй функциональной группой, которая является концевой группой дендримера или другого сверхразветвленного полимера.
Фиг.5 показывает, как несколько дендримеров или других сверхразветвленных полимеров могут быть поперечно сшиты друг с другом перед функционализацией гепарином или другим антикоагулянтным объектом.
Фиг.6 показывает, как несколько дендримеров или других сверхразветвленных полимеров, функционализированных гепарином или другим антикоагулянтным объектом, могут быть поперечно сшиты друг с другом.
Фиг.7 является схематической иллюстрацией компонентов изобретения. Показано, как несущие антикоагулянтные объекты сверхразветвленные полимеры во внешнем слое покрытия взаимодействуют (посредством ковалентных связей и/или ионных взаимодействий) с нижележащими и другими сверхразветвленными полимерами во внешнем слое покрытия.
Фиг.8 показывает процент тромбоцитов, остающихся в крови после контакта с различными нетромбообразующими покрытиями (см. Пример 6).
Фиг.9 показывает пример окраски толуидиновым синим ПВХ трубки до и после нанесения гепаринсодержащего покрытия по настоящему изобретению (см. Пример 3.2 и Пример 6.3). На фиг.9: часть A - до нанесения; часть B - после.
На Фиг.10 показан процент тромбоцитов, остающихся в крови после контакта с различными нетромбообразующими оболочками (См. Пример 11).
Подробное описание изобретения
Антикоагулянтные объекты
Антикоагулянтными объектами являются объекты, способные взаимодействовать с кровью млекопитающих так, чтобы предотвращать коагуляцию или образование тромба.
Антикоагулянтные объекты хорошо известны специалистам в данной области техники, и многие из них являются олигосахаридами или полисахаридами. Некоторые из этих объектов являются гликозаминогликанами, включающими соединения, содержащие глюкозамин, галактозамин и/или уроновую кислоту. Среди них наиболее подходящими гликозаминогликанами являются «гепариновые объекты», и особенно гепарин полной длины (т.е. нативный гепарин).
Термин «гепариновый компонент» относится к гепариновой молекуле, фрагменту гепариновой молекулы или производному гепарина или аналогу гепарина. Производные гепарина могут соответствовать любому функциональному или структурному варианту гепарина. Иллюстративные вариации включают соли гепарина и щелочного металла или щелочноземельного металла, такие как гепарин натрия (например, Гепсал или Пуларин), гепарин калия (например, Кларин), гепарин лития, гепарин кальция (например, Кальципарин), гепарин магния (например, Кутепарин), и гепарин с низкой молекулярной массой (например, полученный путем окислительной деполимеризации или деаминирующего расщепления, например Ардепарин натрия или Далтепарин). Другие примеры включают гепаран-сульфат, гепариноиды, соединения на основе гепарина и гепарин, содержащий гидрофобный противоион. Другие желательные антикоагулянтные объекты включают синтетические гепариновые композиции, обозначаемые как композиции «фондапаринукса» (например, Arixtra от GlaxoSmithKline), подразумевающие антитромбин-опосредованное ингибирование фактора Xa. Дополнительные производные гепарина включают гепарины и гепариновые компоненты, модифицированные в результате, например, умеренной деградации под действием азотистой кислоты (US 4,613,665) или периодатного окисления (US 6,653,457), а также других модифицирующих реакций, известных в данной области техники, в результате которых сохраняется биоактивность гепаринового компонента.
Термин гепариновые компоненты также включает случаи, когда такие компоненты связаны с линкером или спейсером, как описано ниже. Десульфатированный гепарин или гепарин, функционализированный, например, по карбоксильной группе фрагмента уроновой кислоты, менее пригоден, чем другие формы гепарина, поскольку у него в целом снижены антикоагулянтные свойства по сравнению с другими формами гепарина. Монофункционализированные карбоновые кислоты, или карбоновые кислоты с низкой степенью функционализации, могут быть пригодными для настоящего изобретения, если у них сохраняется биоактивность гепарина.
Соответственно, каждый антикоагулянтный объект в какой-то одной точке прикреплен к молекуле сверхразветвленного полимера, в частности прикреплен к ней концевой группой. Прикрепление осуществляется через функциональные концевые группы на молекуле сверхразветвленного полимера, как обсуждается далее. Когда антикоагулянтный объект является прикрепленным в одной точке гепариновым компонентом, он, соответственно, присоединен к молекуле сверхразветвленного полимера через восстанавливающий конец (иногда обозначаемый как положение C1 восстанавливающего конца). Преимущество прикрепления по концевой группе, а особенно прикрепления к восстанавливающей концевой группе, состоит в том, что биологическая активность антикоагулянтного объекта (например, гепаринового компонента) оказывается максимальной, благодаря повышенной доступности участков взаимодействия с антитромбином, по сравнению с прикреплением где-либо в другом месте антикоагулянтного объекта (например, гепаринового компонента).
Когда используется несколько антикоагулянтных объектов, например гепариновых компонентов, все или некоторые из них могут относиться к различным типам; однако обычно они относятся к одному типу.
Антикоагулянтные объекты обычно являются анионными (как в случае гепариновых компонентов).
Можно также рассматривать возможность использования и других антикоагулянтных объектов, таких как гирудин, кумадины (антагонисты витамина K класса 4-гидроксикумаринов, такие как варфарин), антитромбоцитарные лекарственные средства (такие как клопидогрел и абциксимаб), аргатробан, тромбомодулин или антикоагулянтные белки (такие как протеины C, S или антитромбин). Антикоагулянтные объекты могут также включать ферменты, такие как апираза. Такие вещества могут быть заряженными (например, анионными) или незаряженными. Метод их присоединения к сверхразветвленному полимеру с сохранением биоактивности может быть разработан любым специалистом в данной области техники.
Сверхразветвленные полимеры
Примеры различных типов сверхразветвленных полимеров схематически показаны на Фиг.1, типы A-D. На фиг.1A обозначает полимер, теоретически обладающий точками ветвления в каждой мономерной единице; B представляет собой разветвленный полимер с линейным остовом и присоединенными к нему разветвленными клиньями, называемыми дендронами; C представляет собой полимер с точками ветвления, встроенными в линейные сегменты; a D представляет собой дендример. Эти полимеры являются примерами сверхразветвленных полимеров, подходящих для осуществления настоящего изобретения, если центральный сегмент является достаточно малым по отношению к общему размеру молекулы.
Термин «молекула сверхразветвленного полимера» хорошо известен в данной области техники и относится к молекуле, имеющей трехмерную структуру, подобную дереву, исходящему из центрального фрагмента, обычно располагающегося в середине. В контексте настоящего изобретения этот термин также включает дендримеры, которые хорошо известны и являются сверхразветвленными полимерными молекулами, в которых степень ветвления составляет 100% (иногда обозначаются как «полностью разветвленные», т.е. 100% функциональных групп, способных разветвляться, являются разветвленными), и которые, таким образом, являются высоко симметричными по отношению к центральной части.
Сверхразветвленные полимеры состоят из трех основных структурных компонентов: (i) центральной части, (ii) внутренней части и (iii) функциональных концевых групп. Центральная часть располагается в центре молекулы, и к ней присоединяются разветвленные клинья, называемые дендронами. Дендроны могут быть полностью разветвленными, или менее чем полностью разветвленными.
Центральная часть молекулы сверхразветвленного полимера является полифункциональной (с несколькими функциональностями одного и того же типа, или с несколькими функциональностями разных типов), и количество несомых ею функциональных групп определяет количество ветвей, которые можно иметь молекула. Обычно все функциональные группы центральной части используются при разветвлении. Аналогичным образом, форма молекулы сверхразветвленного полимера определяется формой центральной части: по существу тетраэдрические центральные части дают начало по существу сферическим молекулам сверхразветвленных полимеров, а более удлиненные центральные части дают начало яйцевидным или палочковидным молекулам сверхразветвленных полимеров.
В настоящем изобретении центральный фрагмент может быть относительно небольшим по сравнению с общим размером полимера, имеющего молекулярную массу от 14 до 1,000 Да, обычно от 40 до 300 Да, например от 50 до 130 Да.
Дендримеры являются полностью разветвленными молекулами, в которых степень ветвления составляет 100%. Таким образом, их структура является высоко упорядоченной, и для такого исходного материала единственной переменной является число слоев или генераций дендримера. Генерации условно нумеруются по направлению вовне от центральной части. См., например, Таблицы 2-4 ниже. Фиг.2 иллюстрирует третью генерацию дендримера, а Фиг.3 иллюстрирует вторую генерацию дендримера. Благодаря высоко согласованной и симметричной структуре, распределение по молекулярной массе для дендримеров данной генерации является крайне узким, что является особенно предпочтительным, поскольку обеспечивает высокооднородный по свойствам продукт.
Тем не менее, другие сверхразветвленные молекулы также содержат большое количество ветвей, например степень ветвления обычно составляет по меньшей мере 30%, 40% или 50%, например по меньшей мере 60%, 70%, 80% или 90%. В отличие от дендримеров, структура таких сверхразветвленных молекул не вполне регулярна, но они также могут принимать в целом глобулярную структуру.
Обычно центральный фрагмент не идентичен повторяющейся единице(ам) полимера. Однако в одном из вариантов осуществления изобретения центральная часть является компонентом того же самого типа, что и повторяющаяся единица (или одна из повторяющихся единиц) полимера.
Молекулы сверхразветвленного полимера обычно готовят либо с помощью дивергентного метода, в рамках которого слои выстраивают от центральной части, или с помощью конвергентного метода, в котором фрагменты сначала выстраивают, строят, а затем конденсируют. Дендримеры обычно получают с помощью дивергентного метода.
В синтезе дендримеров необходима высокая степень контроля над реакцией добавления каждой новой единицы ветвления, и полученные продукты характеризуются индексом полидисперсности (ИПД) от 1,00 до 1,05. Размер дендрона зависит от числа мономерных слоев, и каждый добавленный слой представляет собой генерацию (G). Внутренняя часть состоит из разветвленных мономеров, которые имеют функциональность ABx, где x≥2. Тщательная подготовка единиц ветвления делает возможным контроль реакции между A и B', где B' является активированным состоянием B. В результате большие дендримеры дают начало структурам глобулярной формы с размером наномасштабе и низкой внутренней вязкостью.
Традиционно, дендримеры синтезируют с использованием итерационной методики, в рамках которой ABx мономеры поочередно добавляют к растущим частицам, после чего следует этап активации/снятия защиты. Эти методики нуждаются в эффективных реакциях, обеспечивающих полную замену терминальных групп B'. Любое отклонение ведет к структурным дефектам, накапливающимся во время роста дендримера и приводящим к затрудненности или невозможности очистки.
Для дальнейшего обсуждения синтеза и номенклатуры дендримеров см. статью: Aldrichimica Acta (2004) 37(2) 1-52, «Dendrimers: building blocks for nanoscale synthesis», включенную в настоящий документ посредством ссылки во всей своей полноте, например страницы 42-43.
Сверхразветвленные полимеры, которые являются дендримерами со структурными дефектами такого типа, также можно использовать в настоящем изобретении.
Сверхразветвленные полимеры, которые не являются дендримерами, могут, например, быть получены путем полимеризации реактивного мономера или нескольких реактивных мономеров. Например, сверхразветвленные полимеры, являющиеся полиаминами, можно получать путем полимеризации азиридина, например путем обработки основанием.
Иллюстративные центральные компоненты включают амины, такие как фрагмент аммиака (М.м. 14 Да), диаминов (например, этилендиамин (М.м. 56 Да), пропилендиамин (М.м. 70 Да), или 1,4-диаминобутан (М.м. 84 Да)) и триаминов (например, диэтилентриамин (NCH2CH2NHCH2CH2N) (М.м. 99 Да) или 1,2,3-триаминопропан (М.м. 89 Да)). Другие центральные части могут быть кислородсодержащими, включая C(Me)(CH2O)3 (М.м. 117 Да), или серосодержащими, включая (NCH2CH2S-SCH2CH2N) (М.м. 148 Да).
Катионные сверхразветвленные полимеры имеют преимущественно положительный заряд при pH около 7, то есть они содержат только незаряженные группы и положительно заряженные группы при pH 7, или (менее предпочтительно) они содержат отрицательно заряженные группы при pH 7, но число положительно заряженных групп выше, чем число отрицательно заряженных групп. Катионные сверхразветвленные полимеры по настоящему изобретению обычно в качестве функциональных концевых групп содержат первичные амины.
Сверхразветвленные полимеры по настоящему изобретению могут иметь несколько функциональных групп, например они могут быть полиаминами (полностью или по большей части содержащими группы вторичных и третичных аминов, с первичными аминами в качестве концевых функциональных групп), полиамидоаминами (амидные группы и группы вторичных и третичных аминов, с первичными аминами в качестве концевых функциональных групп) или полиэфирами с функциональными аминогруппами (например, такими полиэфирами, как ПЭГ, в которых концевые группы трансформированы в группы из первичных аминов).
Иллюстративным семейством сверхразветвленных полимеров являются полиамидоамины (ПАМАМ), в которых компонент аммония или ди- или триамина (например, этилендиамин) может применяться в качестве центрального фрагмента, а добавление генераций разветвленной молекулы может осуществляться путем реакции аммония или свободных аминогрупп, например с метилакрилатом, а потом с этилендиамином, обеспечивая структуру с рядом свободных аминогрупп на внешней поверхности. Последующие генерации можно строить с помощью дальнейшей реакции с метилакрилатом и этилендиамином. Структура, в которой все первичные аминогруппы из внутренних слоев прореагировали с метилакрилатом и этилендиамином, является дендримером. ПАМАМ дендримеры поставляются под торговой маркой Starburst® и производятся Dendritech Inc. Дендримеры Starburst поставляются Dendritech Inc., Sigma Aldrich и Dendritic Nanotechnologies (DNT).
Другие иллюстративные сверхразветвленные полимеры могут включать полиамины, такие как полипропилениминовые (ППИ) и полиэтилениминовые (ПЭИ) полимеры, полученные в результате полимеризации соответствующих структурных единиц. Сверхразветвленные полимеры на основе ППИ можно также синтезировать из центральной части, такой как диаминобутан, и строить путем реакции первичных аминогрупп с акрилонитрилом с последующим гидрированием. ППИ дендримеры поставляются под торговой маркой Astramol™ компаниями DSM и Sigma Aldrich. Полиэтилениминовые полимеры поставляются, например, BASF, Nippon Shokubai и Wuhan Bright Chemical.
Таким образом, сверхразветвленный полимер может быть выбран из полиамидоамина, полипропиленимина, полиэтиленимина и других полиаминовых полимеров и сополимеров, содержащих один или несколько из полиамидоаминовых, полипропилениминовых, полиэтилениминовых и полиаминовых сверхразветвленных полимеров.
В целом, катионные сверхразветвленные полимеры, содержащие первичные аминогруппы в качестве функциональных концевых групп, например ПАМАМ или полиэтиленимины или полипропиленимины, особо предпочтительны для применения в настоящем изобретении.
Сверхразветвленные аминированные полимеры, содержащие сложные эфиры, карбонаты, ангидриды и полиуретаны, менее пригодны, поскольку имеют тенденцию к деградации. Однако биологическая стабильность может зависеть от числа и соотношений биодеградируемых групп, и таким образом, некоторые из них могут быть пригодны для осуществления настоящего изобретения.
Свойства некоторых сверхразветвленных полимеров описаны в Таблице 1 внизу.
ПАМАМ, проиллюстрированный на Фиг.2, основан на этилендиамине в качестве центрального фрагмента. Свойства в зависимости от числа генераций показаны в Таблице 2 внизу.
Схема 1. Синтез Дендримера ПАМАМ-G0. На Схеме 1 «a» является метилакрилатом, а «b» является этан-1,2-диамином.

Синтез иллюстративного ПЭИ сверхразветвленного полимера на основе этилендиаминовой центральной части путем полимеризации азиридина показан на Схеме 2.
Схема 2. Синтез ПЭИ сверхразветвленного полимера. На Схеме 2: ПЭИ сверхразветвленный полимер является 4-й генерацией, содержащей этан-1,2-диаминовую центральную часть (М.м.=56 Да). * указывает примеры положений, где могут быть добавлены дополнительные азиридиновые мономеры.

Синтез иллюстративного ППИ дендримера на основе бутан-1,4-диаминовой центральной части путем полимеризации акрилонитрила показан на Схеме 3.
Схема 3. Синтез ППИ дендримера. На схеме 3: ППИ дендример является 3-й генерацией, содержащей бутан-1,4-диаминовую центральную часть (М.м.=84 Да).

Молекулы сверхразветвленного полимера, пригодные для настоящего изобретения, обычно имеют молекулярную массу примерно от 1,500 до 1,000,000 Да, более предпочтительно примерно от 10,000 до 300,000 Да, например около 25,000-200,000 Да. Молекулы сверхразветвленного полимера, пригодные для настоящего изобретения, предпочтительно являются по существу сферическими по форме. Обычно они имеют диаметр примерно от 2 до 100 нм, например от 2 до 30 нм, в особенности около 5-30 нм, как определяют по результатам лазерного светорассеяния.
Когда сверхразветвленный полимер является ПАМАМ дендримером, он обычно имеет молекулярную массу примерно от 5,000 до 1,000,000 Да, более предпочтительно примерно от 12,000 до 125,000 Да, и диаметр примерно от 1 до 20 нм, например от 2 до 10 нм, особенно около 4-9 нм.
В сверхразветвленных полимерах для применения в соответствии с настоящим изобретением отношение общей молекулярной массы к молекулярной массе центрального фрагмента составляет по меньшей мере 80:1, например по меньшей мере 100:1, например по меньшей мере 200:1, например по меньшей мере 500:1, например по меньшей мере 1000:1. Это отношение обычно меньше 20,000:1, например меньше 10,000:1, например меньше 5,000:1. Например, отношение составляет от 80:1 до 20,000:1, например от 200:1 до 5,000:1, например от 200:1 до 1600:1, например от 400:1 до 1600:1.
Во избежание неопределенности общая молекулярная масса упоминаемого здесь сверхразветвленного полимера включает массу любого ковалентно присоединенного антикоагулянтного объекта, или любого полезного агента.
Указанное отношение определяется молекулярной массой центральной части и общей молекулярной массой сверхразветвленного полимера. Расчетное отношение варьируется в зависимости от центральной части (а именно ее химического состава и молекулярной массы) и в зависимости от изменений молекулярной массы генераций (а именно молекулярной массы мономеров и числа мономеров, присоединенных в каждой генерации).
Для ПАМАМ дендримеров предпочтительной является центральная часть, полученная из этан-1,2-диамина, а число генераций предпочтительно составляет от 3 до 10, более предпочтительно от 4 до 7, т.е. 4, 5, 6 или 7.
Для ПАМАМ сверхразветвленных полимеров предпочтительной является центральная часть, полученная из этилендиамина, а число встроенных реактивных мономеров (метилакрилат, М.м.=56 Да, и этилендиамин, М.м.=57 Да) в сверхразветвленном полимере составляет примерно от 50 до 9,000, например от 100 до 5,000, например от 100 до 2,000 из каждого мономера.
Для ПЭИ сверхразветвленных полимеров предпочтительной является центральная часть, полученная из этилендиамина, а число встроенных азиридиновых мономеров (М.м.=42 Да) в сверхразветвленном полимере составляет примерно от 110 до 20,000, например от 110 до 10,000, например от 110 до 3,000 мономеров.
Для ППИ сверхразветвленных полимеров предпочтительной является центральная часть, полученная из бутан-1,4-диамина, а число встроенных акронитриловых мономеров (М.м.=56 Да) в сверхразветвленном полимере составляет примерно от 120 до 17,000, например от 120 до 4,000, например от 120 до 1,000 мономеров.
В устройстве по настоящему изобретению множество молекул катионного сверхразветвленного полимера может быть необязательно поперечно сшито друг с другом на поверхности устройства. Поперечную сшивку можно осуществлять до или после нанесения молекул сверхразветвленного полимера на поверхность устройства и до или после прикрепления к нему антикоагулянтных объектов (см. Фиг.5, 6).
В случае если молекулы сверхразветвленного полимера являются поперечно сшитыми, число поперечно сшитых молекул, формирующих агрегированный сверхразветвленный полимер составляет две или более, например от 2 до 500, например 2-10, например 2-5; и каждая молекула может быть прикреплена к другой молекуле в агрегате посредством одной или нескольких поперечных связей, например до 10 поперечных связей.
Агрегаты из 2 или нескольких молекул сверхразветвленного полимера, пригодных для целей настоящего изобретения, обычно имеют молекулярную массу примерно от 3,000 до 2,000,000 Да, более предпочтительно примерно от 50,000 до 500,000 Да. Агрегаты сверхразветвленного полимера, пригодные в настоящем изобретении, обычно имеют диаметр примерно от 5 до 100 нм, особенно от 20 до 100 нм.
Модификация молекул сверхразветвленного полимера антикоагулянтными объектами
Молекулы сверхразветвленного полимера имеют большое число концевых функциональных групп, которые могут вступать в реакцию с антикоагулянтными объектами, такими как гепарин (см. Фиг.4). Концевые функциональные группы могут быть одного и того же типа или нескольких разных типов, там где это уместно. Таким образом, одним из преимуществ настоящего изобретения является то, что можно сконструировать молекулу так, чтобы она имела необходимое число концевых функциональных групп со специфической функциональностью. Это делает возможным проведение селективной иммобилизации необходимого количества антикоагулянтных компонентов на поверхности устройства, не мешая при этом построению нижележащих слоев.
Разветвленная структура сверхразветвленной молекулы позволяет получить большую поверхностную плотность антикоагулянтных объектов, чем это было возможно с использованием по существу линейных полимерных структур, и при этом сохранить достаточное разделение антикоагулянтных объектов с сохранением биодоступности каждого объекта, по сравнению с тем, что достигалось с использованием предшествующими известными покрытиями; или даже повысить эту биодоступность.
Другой полезной характеристикой сверхразветвленных полимеров является то, что большинство из реакционноспособных концевых функциональных групп находится на поверхности сверхразветвленной молекулы, и, таким образом, по существу все антикоагулянтные объекты доступны на поверхности сверхразветвленного полимера. Указанный эффект особенно заметен в случае дендримеров, в которых все доступные функциональные группы находятся на поверхности. Это свойство обеспечивает особенно значительное преимущество над обычными полимерными покрытиями, в которых многие из реакционноспособных функциональных групп могут быть скрыты во внутренней части структуры, а не находиться на поверхности. Это означает, что антикоагулянтный объект, реагирующий с функциональными группами в таких обычных полимерных покрытиях, будет иммобилизован в промежутках полимерной поверхности, и не будет биодоступным.
Структура модифицированного сверхразветвленного полимера обеспечивает более однородное распределение антикоагулянтных объектов в слоях, в которые они встроены, таких как внешний слой покрытия, что может, в принципе, привести к повышению стабильности при износе. Далее, возможность выбора и регулировки плотности антикоагулянта на сверхразветвленном полимере обеспечивает более устойчивое и прогнозируемое распределение антикоагулянта в устройстве. Предварительное получение конъюгата сверхразветвленного полимера и антикоагулянтного объекта также обеспечивает снижение изменчивости от серии к серии, поскольку легче регулировать степень замещения сверхразветвленного полимера антикоагулянтными объектами (например, гепарином) в растворе, а не на поверхности.
В другом аспекте настоящего изобретения описывается молекула катионного сверхразветвленного полимера, характеризующаяся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1) и (iv) концевыми функциональными группами, где к одной или нескольким указанным концевым группам ковалентно присоединен антикоагулянтный объект.
В зависимости от числа антикоагулянтных объектов, присоединенных к концевым функциональным группам, а также от их заряда (например, отрицательного заряда в случае использования в качестве антикоагулянтного объекта гепарина), катионный сверхразветвленный полимер может иметь положительный или отрицательный результирующий заряд.
Предпочтительно, антикоагулянтный объект ковалентно связан только с одной концевой функциональной группой на одной молекуле сверхразветвленного полимера, и не связан ни с какой другой молекулой. Антикоагулянтный объект не соединяется с центральной частью сверхразветвленного полимера, но только с концевой функциональной группой сверхразветвленного полимера.
Число концевых функциональных групп, ковалентно связывающих антикоагулянтный объект, составляет одну или несколько, например 2 или больше, например 2-200, например 10-100, однако никакого особенного верхнего предела этого числа нет. Число прикрепленных объектов зависит от числа доступных концевых групп, что является функцией размера молекулы катионного сверхразветвленного полимера. Число концевых функциональных групп, ковалентно связывающих антикоагулянтный объект, может составлять, например, от 1 до 95%, например 5-95%, например 10-80%, например 10-50% от доступных концевых функциональных групп. Число концевых функциональных групп, ковалентно связывающих антикоагулянтный объект, может составлять, например, от 5 до 50%, например 5-40%, например 5-30%, например около 25% от доступных концевых функциональных групп. Когда антикоагулянтные объекты являются анионными (например, в случае гепариновых компонентов), число прикрепленных объектов также зависит от того, нужно ли, чтобы полученный модифицированный сверхразветвленный полимер имел результирующий положительный (в этом случае нельзя иметь слишком много ковалентно связанных анионных антикоагулянтных объектов) или результирующий отрицательный заряд.
Присоединение антикоагулянтного объекта к катионному сверхразветвленному полимеру
Обычно каждый антикоагулянтный объект ковалентно присоединяется к катионному сверхразветвленному полимеру через линкер и, необязательно, один или несколько спейсеров. Линкер формируется в результате реакции концевой функциональной группы на сверхразветвленном полимере с функциональной группой антикоагулянтного объекта. В Таблице 3 и на Схеме 4 показаны примеры некоторых типов линкеров, подходящих для прикрепления антикоагулянтного объекта к сверхразветвленному полимеру вместе с функциональной группой, из которой сформирован линкер, и типом используемой реакции. См., например, ссылку (ISBN: 978-0-12-370501-3, Bioconjugate techniques, 2nd ed. 2008. Однако могут также использоваться радикальные реакции присоединения.
Для каждого линкера одна из концевых функциональных групп находится на сверхразветвленном полимере, а другая находится на антикоагулянтном объекте. В принципе, возможен любой путь, например, со ссылкой на Таблицу 3, функциональные группы 1 и 2 могут находиться на сверхразветвленном полимере и на антикоагулянтном объекте, соответственно, или могут находиться на антикоагулянтном объекте и на сверхразветвленном полимере, соответственно.
В некоторых случаях антикоагулянтный объект и сверхразветвленный полимер могут быть соединены линкером, включающим более одной функциональной группы. Например, в случае, когда линкер является тиоэфиром, бифункциональная молекула (например, имеющая SH группу на каждом конце) может быть каждым концом присоединена, соответственно, к алкин/алкен-функционализированному антикоагулянтному объекту, и к алкин/алкен-функционализированному сверхразветвленному полимеру, что приводит к получению линкера, содержащего два тиоэфира. В альтернативном варианте бис-алкиновая/алкеновая молекула может быть на каждом конце присоединена, соответственно, к тиол-функционализированному антикоагулянтному объекту и тиол-функционализированному сверхразветвленному полимеру, что также приводит к получению линкера, содержащего два тиоэфира. Аналогичные возможности существуют и для других типов линкеров, как видно из Таблицы 3. Сверхразветвленный полимер также может нести две или более различных функциональных групп, например аминовую и алкиновую функциональность, так что антикоагулянтные объекты могут присоединяться к функциональным концевым группам сверхразветвленного полимера через более чем один тип линкеров, однако авторы изобретения предпочитают прикреплять антикоагулянтные объекты с использованием одного типа линкера.
Линкерный компонент обычно имеет молекулярную массу примерно от 14 до 200, например от 14 до 100 Да.
Иллюстративные реагенты, показанные в таблице 3 и на схеме 4, обсуждаются ниже.
-C-NH-C- линкер
Восстановительное аминирование. Восстановительное аминирование, также известное как восстановительное алкилирование, является формой аминирования, включающей превращение карбонильной группы в аминовый линкер через промежуточный имин (основание Шиффа). Карбонильная группа чаще всего является кетоном или альдегидом.
Схема 4. Восстановительное аминирование

-C-NH-CHR-CHR-C(=O)-линкер
Реакция Михаэля. Реакция Михаэля или присоединение по Михаэлю является нуклеофильным добавлением карбаниона или другого нуклеофила (например, первичного амина или тиола) к альфа, бета-ненасыщенному карбонильному соединению. Она принадлежит к большому классу реакций присоединения конъюгатов. Это один из наиболее удобных способов мягкого формирования C-C связей.
-C-S-C-линкер
Тио-бромо. Тиоэфирные связи обычно получают путем алкилирования тиолов. Тиолы могут реагировать с бромидными соединениями с получением тиоэфирных связей. Такие реакции обычно проводят в присутствии основания, которое превращает тиол в более нуклеофильный тиоат.
Тиол-ен и тиол-ин. В альтернативном варианте тиоэфирные связи могут быть получены посредством реакции первого соединения, содержащего тиольную группу, со вторым соединением, содержащим алкеновую или алкиновую группу. Каждое из первого и второго соединений может быть молекулой сверхразветвленного полимера и антикоагулянтным объектом, соответственно.
Предпочтительно реакцию проводят в присутствии восстанавливающего агента, такого как трис(2-карбоксиэтил)фосфин гидрохлорид, или в альтернативном варианте дитиотреитол или натрия борогидрид, чтобы избежать или обратить эффект нежелательного соединения двух тиольных групп в результате окисления.
В одном варианте осуществления изобретения реакцию инициируют радикальным инициатором. Примером радикального инициатора является 4,4'-азобис(4-циановалериановая кислота). Другими примерами являются калия персульфат, 2,2'-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлорид, азобисизобутиронитрил (АИБН), 1,2-бис(2-(4,5-дигидро-1Н-имидазол-2-ил)пропан-2-ил)диазен дигидрохлорид, 2,2'-(диазен-1,2-диил)бис(2-метил-1-(пирролидин-1-ил)пропан-1-имин)дигидрохлорид, 3,3'-((диазен-1,2-диилбис(1-имино-2-метилпропан-2,1-диил))бис(азандиил))дипропановой кислоты тетрагидрат, бензофенон и производные бензофенона, такие как 4-(триметиламмонийметил)бензофенон хлорид. Другим примером является персульфат аммония.
В другом варианте осуществления изобретения реакция не инициируется радикальным инициатором. Вместо этого используют высокие значения pH (например, pH 8-11). Этот тип реакции более пригоден, когда для реакции с тиолом используют активированный алкен или алкин.
Реакцию между первым соединением, содержащим тиольную группу, и вторым соединением, содержащим алкиновую группу, можно представить следующим образом:

где один из Ra и Rb является сверхразветвленным полиамином, а другой является антикоагулянтным объектом.
Когда образуется алкен-содержащий линкер, соединение может подвергаться дальнейшей химической трансформации, например с тиолом (как показано в Таблице 3) или амином.
Когда происходит дериватизация второго соединения с алкеном, в одном варианте осуществления изобретения используют активированный алкен. Примером подходящего активированного алкена является производное малеимида.
Реакция между первым соединением, содержащим тиольную группу, и вторым соединением, содержащим малеимидную группу, может быть представлена следующим образом:

где один из Ra и Rb является полимером, а другой является антикоагулянтным объектом. Реакцию обычно проводят в присутствии трис(2-карбоксиэтил)фосфин гидрохлорида в качестве восстанавливающего агента, и 4,4'-азобис(4-циановалериановой кислоты) в качестве радикального инициатора, и в кислых условиях.
Триазольный линкер (CuAAC присоединение)
Азид-алкин: 1,2,3-триазольные связи можно получать посредством реакции алкина и азидо соединения. Реакция с образованием линкера может происходить между алкиновой группой, расположенной на антикоагулянтном объекте или на молекуле сверхразветвленного полимера, и азидо группой, расположенной на другом из них. Методы осуществления этой реакции подобны методам, описанным в WO 2010/029189.
Реакцию между азидной и алкиновой группами можно проводить при повышенных температурах (T>60°C) или в присутствии металлического катализатора, например меди, например Cu(I) катализатора, с применением таких условий реакции, которые обычно используются в циклоприсоединении Хьюсгена (1,3-диполярном циклоприсоединении азида и концевого алкина с получением 1,2,3-триазола). Cu(I) катализатор можно, если нужно, получать in situ, например путем восстановления соответствующего Cu(II) соединения, например с использованием аскорбата натрия. Реакцию можно также, если это необходимо, проводить в поточном режиме.
CuAAC реакцию можно, например, проводить при температуре примерно от 5 до 80°C, предпочтительно примерно при комнатной температуре. Значение pH реакции может составлять примерно 2-12, предпочтительно примерно 4-9, и наиболее предпочтительно около 7. Подходящие растворители включают те, в которых растворим объект, прикрепленный к азиду или алкину, например диметилсульфоксид, диметилформамид, тетрагидрофуран и, предпочтительно, вода или смеси воды с одним из вышеуказанных растворителей. Долю объекта на поверхности можно регулировать для обеспечения необходимой плотности объекта на поверхности.
-C(=O)-N-линкер
Амидирование. Амиды обычно получают посредством реакции карбоновой кислоты с амином. Карбоновые кислоты и производные карбоновых кислот могут подвергаться многим химическим трансформациям, обычно путем атаки по карбонилу с разрывом карбонильной двойной связи и формированием тетраэдрического промежуточного продукта. Хорошо известно, что в качестве нуклеофилов могут выступать тиолы, спирты и амины. Амиды являются менее реактивными в физиологических условиях, чем сложные эфиры.
Амидирование с использованием активированной кислоты. Активированные амиды (в основном сложные эфиры с подходящей уходящей группой, например NHS-активированные кислоты) могут реагировать с аминами с получением амидных линкеров, в условиях, когда нормальная карбоновая кислота сразу образует соль.
-C-S-S-CH2-CH2-C(=O)-N-линкер
Соединение с использованием SPDP реагентов. N-сукцинимидил 3-(2-пиридилдитио)пропионат (SPDP) и его аналоги принадлежат к уникальной группе реагентов, образующих амин- и тиол-реактивные гетеробифункциональные связи, обеспечивающие дисульфид-содержащие связи.
Реакции восстановительного аминирования, Михаэля, тио-бромо, амидирования с использованием NHS-активированной кислоты, присоединения с использованием SPDP, присоединение CuAAC и тиол-еновое присоединение, все подходят, позволяют получить условия, благоприятные для присоединения и получения линкера с высоким выходом.
Группировки, показанные в Таблице 3, приведены только с целью иллюстрации, и вместо них могут использоваться альтернативные функциональные группы также. Например, аминогруппы могут быть расположены на вторичном углероде, или проиллюстрированные алифатические цепи могут быть замещены ароматическими группами.
Реакции, инициируемые свободными радикалами
Как вкратце упоминалось выше, концевые функциональные группы молекулы сверхразветвленного полимера могут быть соединены с антикоагулянтным объектом посредством линкера, сформированного с помощью реакции, инициированной свободными радикалами. Радикалы могут быть получены, например, посредством нагревания, пиролиза (например, реакций Норриша I и/или II типа), ионизации, окисления, плазменных или электрохимических реакций. Например, когда молекулу сверхразветвленного полимера, содержащую свободные первичные аминогруппы, обрабатывают бензофеноном, образуются такие радикалы, как, например, углеродные или кислородные радикалы, которые могут участвовать в реакциях, инициируемых радикалами (таких, как реакция с алкенами).
В одном варианте осуществления изобретения ковалентный линкер содержит вторичную аминовую связь. В частности, линкер может содержать -NH-группу;
В другом варианте осуществления изобретения ковалентный линкер содержит амидную связь. В частности, линкер может содержать -NH-C(O)-группу;
В другом варианте осуществления изобретения ковалентный линкер содержит тиоэфирную связь.
В другом варианте осуществления изобретения ковалентный линкер содержит 1,2,3-триазольную связь.
Термин «тиоэфирный линкер» относится к соединению между серой и двумя углеродными атомами. Это соединение также иногда называется «сульфид». Сера может быть прикреплена к двум насыщенным углеродным атомам (т.е. -C-S-C-), или она может быть прикреплена к насыщенному и ненасыщенному углеродному атому (т.е. -C-S-C=).
Термин «тиол» относится к -S-H компоненту.
Термин «вторичный аминовый линкер» относится к соединению между NH группой и двумя углеродными атомами, т.е. -C-NH-C-.
Термин «амидный линкер» относится к соединению между двумя углеродными атомами типа -C-C(O)NH-C-.
В одном варианте осуществления изобретения линкер между антикоагулянтным объектом, таким как гепариновый компонент, и концевой функциональной группой из молекулы сверхразветвленного полимера является неразветвленным линкером.
Линкер может быть биодеградируемым или небиодеградируемым, но для целей настоящего изобретения более пригоден небиодеградируемый, чтобы покрытое устройство было нетромбообразующим в течение длительного периода времени.
Там, где возможно множество линкеров, некоторые или все из них могут относиться к различным типам.
В одном варианте осуществления изобретения все линкеры относятся к одному типу.
Спейсеры
В наиболее простом примере ковалентное соединение между концевой функциональной группой молекулы сверхразветвленного полимера и антикоагулянтным объектом осуществляется через линкер, как, например, показано в Таблице 3.
Однако, линкер необязательно может быть отделен от поверхности или от антикоагулянтного компонента, или от того и другого спейсером.
Назначение спейсера, если он используется, обычно заключается в значительном увеличении промежутка между молекулой сверхразветвленного полимера и антикоагулянтным объектом, т.е. в значительном увеличении расстояния между поверхностью устройства и антикоагулянтным объектом. Например, молекулярная масса спейсера может составлять от 50 до 106 Да, обычно от 100 до 106 Да, например от 100 до 104 Да. Длина спейсера может составлять, например, от 10 до 103 Å. Предпочтительно, чтобы спейсер был прямой цепью. В некоторых вариантах осуществления спейсер является гидрофильным, например он может содержать ПЭГ цепь. В одном аспекте изобретения ковалентное соединение между концевой функциональной группой молекулы сверхразветвленного полимера и антикоагулянтным объектом можно рассматривать как имеющее три части: «спейсер A» между концевой функциональной группой молекулы сверхразветвленного полимера и линкерным компонентом, линкерный компонент и «спейсер B» между линкерным компонентом и объектом. В одном варианте осуществления изобретения молекулярная масса спейсера A составляет от 50 до 103 Да. В другом варианте осуществления молекулярная масса спейсера B составляет от 50 до 103 Да. В одном варианте осуществления спейсер A содержит одно или несколько ароматических колец. В другом варианте осуществления спейсер A не содержит ароматических колец. В одном варианте осуществления спейсер B содержит одно или несколько ароматических колец. В другом варианте осуществления спейсер B не содержит ароматических колец. В одном варианте осуществления спейсер A является гидрофильным. В другом варианте осуществления спейсер B является гидрофильным. В одном варианте осуществления спейсер A содержит ПЭГ цепь. В другом варианте осуществления спейсер B содержит ПЭГ цепь. В одном варианте осуществления спейсеры A и B являются гидрофильными, например каждый из них может содержать ПЭГ цепь. В настоящем изобретении ПЭГ цепь означает полимерную цепь, полученную путем полимеризации этиленоксида, обычно с массой от 100 до 106 Да. В другом аспекте изобретения ковалентное соединение может содержать два или более триазольных кольца. В другом варианте осуществления изобретения ковалентное соединение можно рассматривать как имеющее пять частей: «спейсер A» между поверхностью и первым линкерным компонентом, первый линкерный компонент, «спейсер B» между первым линкерным компонентом и вторым линкерным компонентом, второй линкерный компонент и «спейсер C» между вторым линкерным компонентом и объектом. В одном варианте осуществления изобретения молекулярная масса спейсера A составляет от 50 до 103 Да. В одном варианте осуществления изобретения молекулярная масса спейсера B составляет от 100 до 106 Да. В одном варианте осуществления изобретения молекулярная масса спейсера C составляет от 50 до 103 Да. В одном варианте спейсер A и/или спейсер B и/или спейсер C является гидрофильным, например содержащим ПЭГ цепь. Например, спейсер B (по меньшей мере) может содержать ПЭГ цепь.
Хотя спейсеры могут использоваться в настоящем изобретении, обычно они не являются обязательными, поскольку структура сверхразветвленных полимеров, благодаря своим размеру и форме, обеспечивает некоторое разделение антикоагулянтного объекта и поверхности устройства.
В случае если спейсеры присутствуют, они являются, например, спейсерами с прямой цепью примерно от 10 до 103 Å.
Специфическим преимуществом от присутствия спейсера, содержащего ПЭГ цепь (или другой гидрофильный полимер), является получение устройства с гладкими (смазывающими) свойствами.
Спейсер может быть биодеградируемым или небиодеградируемым, но предпочтительно он является небиодеградируемым, так чтобы покрытое устройство было нетромбообразующим в течение длительного периода времени (т.е. чтобы покрытое устройство сохраняло нетромбообразующие свойства).
Функционализация структурных блоков покрытия
i. Формирование линкера в случаях, когда не требуется предварительная модификация молекулы сверхразветвленного полимера или антикоагулянтного объекта
Некоторые из показанных выше в Таблице 3 линкеров могут быть получены непосредственно путем реакции концевой функциональной группы сверхразветвленного полимера, например сверхразветвленного полиамина, с содержащим альдегид антикоагулянтным объектом.
Таким образом, восстановительное аминирование, реакция Михаэля, реакция SPDP и реакция амидирования, указанные в Таблице 3, требуют присутствия концевой функциональной группы первичного амина. Сверхразветвленные молекулы, такие как сверхразветвленные полиамины, например ПАМАМ дендримеры, обладают подходящими свободными группами первичных аминов для использования в этих реакциях формирования линкеров и, таким образом, не требуют дополнительной модификации.
Таким образом, в одном варианте осуществления изобретения молекула сверхразветвленного полимера несет множество свободных групп первичных аминов в качестве концевых функциональных групп и является, например, ПАМАМ, ППИ или ПЭИ молекулой сверхразветвленного полимера.
Разрушенный азотистой кислотой гепарин и нативный гепарин несут реакционно-способные группы - альдегидную и полуацетальную группу, соответственно, на восстанавливающем конце, и, таким образом, разрушенный азотистой кислотой гепарин или нативный гепарин могут реагировать со сверхразветвленным полимером, имеющим свободные первичные аминогруппы, по реакции восстановительного аминирования, с образованием линкера, содержащего вторичную аминогруппу, как оказано в Таблице 3 и на Схеме 4 выше.
Способы получения вторичного амино линкера между поверхностью с функционализированными аминами и производным гепарина описаны, например, в EP-B-0086186, EP-B-0086187, EP-B-0495820 и US 6,461,665.
ii. Формирование линкера в случаях, когда требуется модификация сверхразветвленного полимера и/или антикоагулянтного объекта
В альтернативном варианте любой из антикоагулянтного объекта и сверхразветвленного полимера или они оба могут быть модифицированы так, чтобы они несли подходящую функциональную группу, как более подробно описано ниже.
Способы дериватизации гепарина и других антикоагулянтных объектов, например для включения алкиновой и азидной групп, описаны в WO 2010/029189, который во всей своей полноте включен в настоящий документ посредством ссылки.
Таким образом, для некоторых из описанных выше в Таблице 3 линкеров необходимо предварительно подготовить функционализированные производные молекулы сверхразветвленного полимера и антикоагулянтного объекта или обоих из них.
Молекулу сверхразветвленного полимера можно функционализировать с использованием методик, известных в данной области техники. Первичные аминогруппы на ПАМАМ дендримере или аналогичном сверхразветвленном полимере можно использовать в качестве точек для прикрепления подходящих для формирования выбранной ковалентной связи функциональных групп, например алкеновой, алкиновой, тиольной, гало или азидогрупп. Таким образом, сверхразветвленные полиамины можно функционализировать так, чтобы они несли алкеновые, алкиновые, тиольные, гало или азидогруппы, путем обычных средств, например путем реакции боковых первичных аминогрупп полиамина с активированной карбоновой кислотой (например, N-гидроксисукцинимидным производным карбоновой кислоты), содержащей алкеновую, алкиновую, тиольную, гало или азидную группу.
Таким образом, чтобы ввести подходящие алкеновые или алкиновые группы, молекула, несущая ряд первичных аминогрупп, представленных как:
R''-NH2,
где R'' является остатком сверхразветвленного полиамина;
может реагировать с соединением формулы:

где n является целым числом от 1 до 8, например от 1 до 4;
с получением малеимид-функционализированного полиамина формулы:

где R'' и n являются такими, как указано выше.
В альтернативном варианте сверхразветвленный полиамин может реагировать с активированной алкинсодержащей группой формулы:

где n является целым числом от 1 до 8, например от 1 до 4;
с получением алкин-функционализированного сверхразветвленного полиамина формулы:
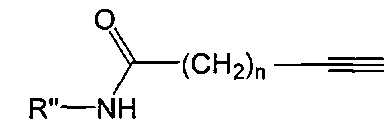
где R'' и n являются такими, как определено выше.
Аналогичным образом, сверхразветвленный полимер, имеющий свободные первичные амины в качестве концевых функциональных групп, может быть модифицирован с использованием тиольной группы. В этом случае сверхразветвленный полиамин, такой как ПАМАМ дендример, несущий ряд первичных аминогрупп и представленный как:
R''-NH2,
где R'' является таким, как указано выше;
может реагировать с тиолсодержащей активированной карбоновой кислотой, например соединением формулы:

где n является целым числом от 1 до 8, например от 1 до 4;
с получением модифицированного полимера формулы:

где R'' и n являются такими, как указано выше.
Галогруппы можно вводить в молекулу сверхразветвленного полимера аналогичным образом.
Можно рассмотреть и другие реакции амидирования, включающие использование SPDP или 1-этил-3-(3-диметиламинопропил)-карбодиимида (ЭДК) для получения такой же функционализации.
Антикоагулянтный объект, например гепарин, несущий алкен, альдегид, алкин, тиол, азо, амин, галид, активированную карбоновую кислоту, малеимидный эфир или α,β-ненасыщенную карбонильную группу, можно получать с помощью обычных способов, как таковых известных в уровне техники. Например, антикоагулянтный объект, например гепарин, несущий алкиновую/алкеновую группу, можно получать путем реакции алкоксиамина формулы:
R1-O-NH2,
где R1 является алкин/алкенсодержащей группой; с альдегидной или полуацетальной группой на антикоагулянтном объекте с использованием обычных методик, известных в данной области техники, см. Примеры 3a, 3b и 3c из WO 2010/029189. Реакции этого типа протекают через формирование окси-иминовой функциональности с получением соединения формулы:
R1-O-N=R',
где R1 является таким, как указано выше, а R' является остатком антикоагулянтного объекта.
Разрушенный азотистой кислотой гепарин и нативный гепарин несут реакционно-способные группы - альдегидную группу и полуацетальную группу, соответственно, на своем восстанавливающем конце, который также может быть соединен указанным способом.
Аналогично, антикоагулянтный объект, модифицированный с использованием тиольной группы, может быть сформирован путем реакции альдегидной или полуацетальной группы на антикоагулянтном объекте с соединением формулы:
HS-X-NH2,
где X является углеводородным спейсером, например (CH2)n, где n составляет от 1 до 8, например от 1 до 4, в котором одна или несколько (например, 1 или 2) метиленовых групп необязательно замещены O; или X содержит ПЭГ цепь, содержащую 1-100 (например, 1-50, например 1-10) этиленгликольных единиц;
с получением продукта формулы:
R'-CH2-NH-X-SH,
где X является таким, как указано выше, а R'-CH2- является остатком антикоагулянтного объекта.
Пример осуществления такой процедуры приведен в Примере 4.2 ниже.
Похожий способ можно использовать для введения азидогруппы или гало группы, такой как фторо, хлоро, или бромо.
Как обсуждалось выше, одной из причин модификации сверхразветвленного полимера является необходимость введения некоторых функциональных групп с целью обеспечения связывания с антикоагулянтным объектом. Когда сверхразветвленный полимер имеет некоторые концевые функциональные группы, например первичные аминогруппы, они могут быть превращены в другие функциональные группы, например азидные или алкиновые группы. Все или, обычно, некоторые (например, от 0,5 до 25%) из функциональных групп могут быть превращены для достижения этой цели.
Также для некоторых других целей может быть необходимо ввести новые функциональные группы. Например, некоторые (например, от 0,5 до 25%) из существующих концевых функциональных групп (например, первичных аминогрупп) могут быть превращены в другие функциональные группы, например азидные или алкиновые группы, для обеспечения прикрепления необходимых агентов, например упомянутых ниже лубрикантов.
Покрытие поверхности
Устройство по изобретению имеет поверхность, содержащую слоистое покрытие, образованное из одного или нескольких слоев. Такое устройство, а особенно медицинское устройство, может иметь одну или несколько частей, содержащих полости или поры. Поры могут находиться внутри устройства и/или могут быть частью по меньшей мере одной поверхности устройства. Примером пористого медицинского устройства является пористый политетрафторэтилен (пПТФЭ). Поры могут содержать или не содержать слой покрытия.
Предпочтительно, на часть устройства (которая должна обладать нетромбообразующими свойствами) или на все устройство нанесено покрытие.
Поверхность устройства может содержать один или несколько слоев покрытия (например, 2 или более, или 3, или 4, или 5, например до 20 слоев покрытия), и термин «внешний слой покрытия» относится к слою покрытия, который на медицинском устройстве находится в контакте с тканями пациента или находится в контакте с жидкостями организма, или в устройстве для анализа или разделения приводится в контакт с веществом, подлежащим анализу, разделению или обработке. Таким образом, внешний слой покрытия может быть слоем покрытия на внешней и/или внутренней поверхности полого устройства или открытой структуры, такой как стент. Слой, который не является внешним слоем покрытия, обозначается как «подлежащий слой».
В настоящем изобретении внешний слой покрытия содержит множество молекул катионного сверхразветвленного полимера, к которым через концевые функциональные группы ковалентно прикреплены один или несколько антикоагулянтных объектов.
В целом, большинство, или даже все молекулы катионного сверхразветвленного полимера из внешнего слоя покрытия своими их концевыми функциональными группами ковалентно связывают множество антикоагулянтных объектов.
Оптимальное число слоев зависит от типа материала, из которого изготовлено устройство, и предполагаемой области применения поверхностного покрытия. Число и природу слоев, необходимых для обеспечения полного покрытия поверхности устройства, может легко определить специалист в данной области техники. Поверхностное покрытие, при необходимости, может быть изготовлено послойно.
Например, слой(и) покрытия может быть образован путем адсорбции на поверхности устройства катионного полимера, с последующим нанесением раствора анионного полимера, например анионного полисахарида, например декстран сульфата или функционализированного катионного сверхразветвленного полимера с результирующим отрицательным зарядом, с получением по меньшей мере одного адсорбированного слоя анионного полимера. См. «Multilayer Thin Films» ISBN: 978-3-527-30440-0. Таким образом, поверхность может содержать слой катионного полимера и слой анионного полимера, например полисахарида или функционализированного катионного сверхразветвленного полимера с результирующим отрицательным зарядом. В целом, поверхностное покрытие может содержать один или несколько двойных слоев покрытия из катионного полимера и анионного полимера. Обычно самый внутренний слой (т.е. слой, нанесенный на обнаженную поверхность устройства, например металлическую, пластиковую или керамическую поверхность) является слоем катионного полимера.
Как более подробно обсуждается ниже, внешний слой покрытия, содержащий множество молекул катионного сверхразветвленного полимера, к которым через концевые функциональные группы ковалентно прикреплены один или несколько антикоагулянтных объектов, можно нанести с помощью одного или нескольких способов. В соответствии с первым способом молекулы катионного сверхразветвленного полимера с общим положительным зарядом можно наносить на анионный полимер на поверхности устройства. Затем молекулы сверхразветвленного полимера модифицируют для связывания с антикоагулянтными объектами. В соответствии со вторым способом молекулы катионного сверхразветвленного полимера, к которым через их концевые функциональные группы ковалентно присоединены один или несколько антикоагулянтных объектов, можно наносить на анионный или катионный полимер на поверхности устройства, в зависимости от того, имеют ли функционализированные молекулы сверхразветвленного полимера результирующий положительный или отрицательный заряд.
В некоторых случаях молекулы катионного сверхразветвленного полимера могут быть поперечно сшиты с полимерным поверхностным покрытием посредством реакционноспособных функциональных групп. Если катионный сверхразветвленный полимер сшит с поверхностью устройства или с подлежащими слоями покрытия перед реакцией с антикоагулянтным объектом, необходимо обеспечить достаточное число аминогрупп (или других введенных реакционно-способных групп), доступных для связывания с необходимым количеством антикоагулянтного объекта на внешнем слое покрытия. В альтернативном варианте молекулы катионного сверхразветвленного полимера могут реагировать с антикоагулянтными объектами перед нанесением на поверхность устройства или на слой покрытия, а после этого могут быть поперечно сшиты. Обычно поперечной сшивки непосредственно между антикоагулянтным объектом и поверхностным покрытием нет.
Для подлежащих слоев можно применять ряд катионных полимеров. Иллюстративным катионным полимером является полиамин (например, описанный в EP 0086187, Larsson and Golander). Такие полимеры могут иметь прямую цепь, но обычно они являются полимерами с разветвленной цепью или, альтернативно, сверхразветвленными полимерами, необязательно поперечно сшитыми. В альтернативном варианте один или несколько (например, все) из слоев катионного полимера, отличающихся от внешнего слоя покрытия, могут содержать (или могут быть сформированы из) молекулы катионного сверхразветвленного полимера, те же, что применяются во внешнем слое покрытия, или подобные им. Необязательно, они тоже могут быть поперечно сшитыми.
Процедуру нанесения покрытия можно осуществлять по существу так, как описано в EP-B-0495820, и в этом случае только внешний слой покрытия будет содержать антикоагулянтный объект.
Однако процедуру из EP-B-0495820 можно модифицировать так, чтобы внешний слой был анионным полимером, который затем связывается, как описано ниже, с катионным сверхразветвленным полимером, к которому прикреплен один или несколько антикоагулянтных объектов (но который при этом сохранял бы результирующий положительный заряд), или связывался с катионным сверхразветвленным полимером с концевой функциональной группой(ами), способной реагировать с функциональными группами на антикоагулянтном объекте с образованием компонента ковалентного линкера, как описано выше.
В соответствии с одним из вариантов осуществления изобретения описывается устройство, в котором один или несколько слоев слоистого покрытия, отличающихся от внешнего слоя покрытия, содержит молекулы катионного сверхразветвленного полимера, характеризующиеся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, и (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) концевыми функциональными группами, необязательно модифицированными, например с использованием одного или нескольких антикоагулянтных объектов.
В соответствии с одним из вариантов осуществления изобретения, когда подлежащие слои содержат катионные полимеры, они могут включать молекулы катионного сверхразветвленного полимера, характеризующиеся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп. В этом варианте осуществления указанные молекулы катионного сверхразветвленного полимера могут быть теми же, что и применяемые во внешнем слое покрытия (но без прикрепленного антикоагулянтного объекта), или же они могут быть другими молекулами сверхразветвленного полимера. В любом случае иллюстративные молекулы катионного сверхразветвленного полимера включают те, что описаны в настоящем документе по отношению к тем молекулам катионного сверхразветвленного полимера, которые могут применяться в изготовлении внешнего слоя покрытия.
Например, все подлежащие слои, содержащие катионные полимеры, могут включать молекулы катионного сверхразветвленного полимера, характеризующиеся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп.
Анионный полимер может быть функционализированным катионным сверхразветвленным полимером с результирующим отрицательным зарядом.
В соответствии с одним вариантом осуществления изобретения, если подлежащие слои содержат анионные полимеры, то они могут включать молекулы катионного сверхразветвленного полимера, характеризующиеся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп, где одна или несколько из указанных концевых функциональных групп ковалентно связаны с анионным антикоагулянтным объектом, обеспечивая, таким образом, результирующий отрицательный заряд молекулы.
Например, все подлежащие слои, содержащие анионные полимеры, могут включать молекулы катионного сверхразветвленного полимера, характеризующиеся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп, где одна или несколько из указанных концевых функциональных групп ковалентно связаны с антикоагулянтным объектом, обеспечивая, таким образом, результирующий отрицательный заряд молекулы.
В соответствии с одним из вариантов осуществления изобретения покрытие на поверхности устройства состоит из (a) молекул катионного сверхразветвленного полимера, характеризующихся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп, или (b) молекул катионного сверхразветвленного полимера, характеризующихся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп, в которых одна или несколько из указанных функциональных концевых групп ковалентно связаны с анионным антикоагулянтным объектом, обеспечивая, таким образом, результирующий отрицательный заряд молекулы.
Одним из преимуществ такого варианта является то, что число различных компонентов в слоях покрытия сводится к минимуму.
Перед нанесением первого слоя покрытия (т.е. самого внешнего слоя) поверхность устройства можно очистить для улучшения адгезии и охвата поверхности. Подходящие очищающие агенты включают такие растворители, как этанол или изопропанол (ИПА), растворы с высоким значением pH, такие как растворы, содержащие смесь спирта и водного раствора гидроксидного соединения (например, гидроксида натрия), раствор гидроксида натрия как таковой; растворы, содержащие тетраметиламмония гидроксид (ТМАГ), основный раствор пираньи (аммиак и перекись водорода), кислый раствор пираньи (смесь серной кислоты и перекиси водорода) и другие окислительные агенты, включая комбинации серной кислоты и перманганата калия или различные типы растворов пероксисерной кислоты или пероксидисерной кислоты (а также солей аммония, натрия и калия).
Таким образом, один из аспектов настоящего изобретения относится к устройству, имеющему поверхностное покрытие, содержащее одно или несколько двухслойных покрытий из катионного полимера и анионного полимера, где внешний слой покрытия содержит множество молекул катионного сверхразветвленного полимера, характеризующихся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и (iv) наличием концевых функциональных групп, где одна или несколько из указанных концевых групп ковалентно связаны с антикоагулянтным объектом.
Формирование внешнего слоя покрытия
Как вкратце описано выше, гепариновый компонент или другой антикоагулянтный объект можно присоединять к молекулам сверхразветвленного полимера до или после нанесения молекул сверхразветвленного полимера на поверхность устройства. Поверхность устройства, на которое наносят внешний слой покрытия, может необязательно содержать один или несколько подлежащих слоев. См. Фиг.7.
Таким образом, в первом аспекте настоящего изобретения описывается способ получения устройства, как оно описано выше, включающий, в любом порядке:
i) реакцию множества концевых функциональных групп молекул сверхразветвленного полимера с антикоагулянтными объектами, так что каждая молекула сверхразветвленного полимера оказывается ковалентно связана с множеством антикоагулянтных объектов, и
ii) прикрепление молекул сверхразветвленного полимера к поверхности устройства.
Как описано выше, антикоагулянтные объекты присоединяются к молекулам сверхразветвленного полимера посредством ковалентной связи, и в некоторых случаях может быть необходимо выполнить дополнительный этап модификации молекул сверхразветвленного полимера и/или антикоагулянтного объекта до этапа (i), чтобы ввести подходящие функциональные группы для формирования ковалентной связи между молекулами сверхразветвленного полимера и антикоагулянтным объектом.
Подходящие ковалентные связи и способы модификации сверхразветвленного полимера и/или антикоагулянтного объекта подробно обсуждаются ниже. Как отмечалось выше, линкер может необязательно отделяться от поверхности и/или антикоагулянтного компонента спейсером. Таким образом, описываемый способ может необязательно включать модификацию поверхности и/или антикоагулянтного компонента путем введения спейсера.
Когда первый этап способа является этапом (i), присоединение антикоагулянтных объектов к молекулам сверхразветвленного полимера может быть осуществлено в растворе при подходящих реакционных условиях с подходящими растворителями, например ТГФ, ДХМ, ДМФ, ДМСО, ИПА, метанол, этанол и вода, включая их смеси.
Когда этап (i) является вторым этапом способа (т.е. первым этапом способа является этап (ii)), внешний слой покрытия устройства обычно приводится в контакт с раствором антикоагулянтного объекта при подходящих реакционных условиях. Подходящими растворителями для антикоагулянтного объекта являются, например, ИПА, этанол, ТГФ, ДМФ, ДМСО, ДХМ и особенно вода, включая их смеси.
В одном варианте осуществления изобретения, как уже упоминалось, две или более молекул сверхразветвленного полимера могут быть агрегированы путем поперечной сшивки.
Таким образом, вышеуказанный способ может дополнительно включать этап поперечной сшивки двух или более молекул сверхразветвленного полимера друг с другом. Две или более молекул сверхразветвленного полимера могут быть агрегированы путем поперечной сшивки до или после функционализации молекул сверхразветвленного полимера одним или несколькими антикоагулянтными объектами. Порядок выполнения поперечной сшивки может зависеть от устройства, например от геометрии устройства. Предпочтительно, поперечную сшивку осуществляют после функционализации. Кроме того, такой этап поперечной сшивки может осуществляться до или после прикрепления молекул сверхразветвленного полимера к поверхности устройства.
Описываемый способ может также включать этап поперечной сшивки одной или нескольких молекул сверхразветвленного полимера с поверхностью устройства. Например, молекулы сверхразветвленного полимера, к которым прикреплены один или несколько антикоагулянтных объектов, на внешнем слое покрытия могут быть поперечно сшиты с катионным или анионным полимером из слоя, лежащего под внешним слоем покрытия.
Этот этап поперечной сшивки может быть частью вышеописанного этапа (ii), или, в альтернативном варианте, этап поперечной сшивки может быть проведен после этапа (ii), чтобы укрепить адгезию молекул сверхразветвленного полимера к поверхности устройства и повысить стабильность покрытия.
Если поперечную сшивку между двумя или более молекулами сверхразветвленного полимера, или между молекулами сверхразветвленного полимера и поверхностью, осуществляют перед дериватизацией, то необходимо обеспечить наличие на молекуле сверхразветвленного полимера достаточного для прикрепления подходящего числа антикоагулянтных объектов количества свободных функциональных групп. В альтернативном варианте, если сначала осуществляют дериватизацию, то степень дериватизации должна быть такой, чтобы оставались свободные функциональные группы для поперечной сшивки.
В целом, этап (i) предпочтительно осуществляют перед этапом (ii), поскольку так легче контролировать количество антикоагулянтного объекта, связанного с молекулами сверхразветвленного полимера, и, кроме того, в таком случае сводится к минимуму потеря антикоагулянтного объекта, в частности, когда реакцию проводят в растворе, как описано выше.
В одном аспекте настоящего изобретения раскрывается устройство, полученное вышеупомянутым способом.
Другой аспект изобретения относится к нетромбообразующему устройству, полученному способом, включающим:
(a) обработку устройства для получения поверхностного покрытия, содержащего внешний слой покрытия, содержащий молекулы катионного сверхразветвленного полимера, характеризующиеся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, наличием концевых функциональных групп, и (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1);
(b) реакцию одной или нескольких из указанных концевых функциональных групп с функционализированными молекулами антикоагулянтного объекта, несущими группы, способные реагировать с реакционно-способными функциональными группами на сверхразветвленном катионном полимере;
с прикреплением, таким образом, антикоагулянтного объекта к сверхразветвленному катионному полимеру.
Другой аспект изобретения относится к нетромбообразующему устройству, полученному с помощью способа, включающего:
(a) обработку устройства для получения поверхностного слоя положительно заряженного полимера;
(b) ассоциацию указанного поверхностного слоя полимера с молекулами функционализированного катионного сверхразветвленного полимера, характеризующимися (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, и (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и несущими множество (например, 2 или 10, или 50, или 100, или 500, или более, в зависимости от числа доступных концевых функциональных групп) отрицательно заряженных антикоагулянтных объектов, таких как гепариновые компоненты, и где указанный функционализированный сверхразветвленный полимер имеет результирующий отрицательный заряд.
Другой аспект изобретения относится к нетромбообразующему устройству, полученному с помощью способа, включающего:
(a) обработку устройства для получения поверхностного слоя отрицательно заряженного полимера;
(b) ассоциацию указанного поверхностного слоя полимера с молекулами функционализированного катионного сверхразветвленного полимера, характеризующимися (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, и (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1 (например, по меньшей мере 100:1), и несущими один или несколько отрицательно заряженных антикоагулянтных объектов, таких как гепариновые компоненты, и где указанный функционализированный сверхразветвленный полимер имеет результирующий положительный заряд.
Например, устройство обрабатывают для получения поверхности, содержащей анионный полимер, например полисахарид, такой как декстран сульфат, его производные, или функционализированный катионный сверхразветвленный полимер с результирующим отрицательным зарядом.
Поперечная сшивка
Как описано в настоящем документе, молекулы сверхразветвленного полимера из внешнего слоя покрытия необязательно могут быть поперечно сшиты с другими молекулами сверхразветвленного полимера из внешнего слоя покрытия, или могут быть поперечно сшиты с молекулами (например, молекулами сверхразветвленного полимера) подлежащего слоя. Молекулы полимера в подлежащих слоях необязательно могут быть поперечно сшитыми.
Подходящие агенты для поперечной сшивки, которые можно использовать для этих целей, можно выбрать в соответствии с необходимой реакцией связывания. В принципе, можно использовать любой би-, три-, или многофункциональный агент для поперечной сшивки, такой как функционализированные ПЭГи и Джеффамины. Для поперечной сшивки аминов целесообразно использовать бифункциональные альдегиды, такие как кротоновый альдегид или глутаровый альдегид. В некоторых случаях можно применять эпихлоргидрин.
Поперечная сшивка позволяет создать ковалентную связь между концевой функциональной группой молекулы сверхразветвленного полимера из внешнего слоя покрытия и концевой функциональной группой другой молекулы сверхразветвленного полимера из другого слоя покрытия, или молекулой (например, молекулой сверхразветвленного полимера или молекулой катионного или анионного полимера) из подлежащего слоя. Такая поперечная сшивка предпочтительно не включает антикоагулянтный объект. Таким образом, антикоагулянтный объект ковалентно связан только с одной молекулой сверхразветвленного полимера, но не связан ни с какой другой молекулой. Соответственно, поперечная сшивка одной молекулы сверхразветвленного полимера с другой молекулой сверхразветвленного полимера включает использование тех концевых функциональных групп молекулы сверхразветвленного полимера, которые не участвуют в образовании связи с антикоагулянтным объектом. В одном варианте осуществления изобретения указанные функциональные группы, используемые в поперечной сшивке, формируются путем рефункционализации исходных концевых функциональных групп молекулы сверхразветвленного полимера.
Устройства
Устройство по изобретению может быть любым устройством, к которому необходимо присоединить антикоагулянтные объекты, например медицинским устройством, аналитическим устройством или устройством для разделения.
Для целей настоящего изобретения термин «медицинское устройство» относится к имплантируемым или неимплантируемым устройствам, но предпочтительно к имплантируемым медицинским устройствам. Примеры имплантируемых медицинских устройств, которые могут быть постоянно или временно имплантируемыми медицинскими устройствами, включают катетеры; стенты, включая вилкообразные стенты, раскрываемые баллоном стенты, самораскрывающиеся стенты; стент-имплантаты, включая вилкообразные стент-имплантаты; имплантаты, включая сосудистые имплантаты, вилкообразные имплантаты; искусственные кровеносные сосуды, постоянные устройства для мониторинга крови, искусственные сердечные клапаны, электроды водителя ритма, проволочные направители, сердечные электроды, контуры для сердечно-легочного шунтирования, канюли, пробки, устройства для доставки лекарств, баллоны, тканевые пластыри и насосы для крови.
Примерами неимплантируемых медицинских устройств являются экстракорпоральные устройства, например экстракорпоральные устройства для обработки крови и устройства для трансфузии.
Устройства по изобретению могут иметь, среди прочего, неврологическое, периферическое, кардиологическое, ортопедическое, дерматологическое и гинекологическое применение.
Медицинское устройство может иметь один или несколько слоев покрытия, и термин «внешний слой покрытия» относится к слою покрытия, который, когда устройство применяется или имплантировано в пациента, находится в контакте с тканями пациента, или с жидкостями организма, например с кровью. Таким образом, внешний слой покрытия может быть слоем покрытия на внешней и/или внутренней поверхности полого устройства или устройства с открытой структурой, такого как стент.
Аналитическое устройство может быть, например, твердым носителем, используемым в аналитическом процессе, таком как хроматография, или в иммунологическом анализе, реакционной химии или катализе.
Примеры таких устройств включают пластины, бусы, луночные планшеты, мембраны и т.д. Устройство для разделения может быть, например, твердым носителем для осуществления процесса разделения, такого как очистка белков, аффинная хроматография или ионный обмен. Примеры таких устройств включают фильтры и колонки и т.д. Как и медицинское устройство, устройство для анализа или разделения может также иметь множество слоев покрытия, и термин «внешний слой покрытия» относится к слою покрытия, контактирующему с подлежащим анализу, разделению или обработке веществом.
В некоторых случаях может быть необходимо регулировать свойства покрытия, и в этом случае к сверхразветвленному полимеру, в дополнение к антикоагулянтному объекту, могут быть прикреплены один или несколько дополнительных объектов. Например, если необходимо повысить гидрофобность сверхразветвленного полимера, дополнительные объекты могут содержать одну или несколько ПЭГ цепей.
В настоящем изобретении термин «ПЭГ цепь» относится к полимерной цепи, полученной путем полимеризации этиленоксида, обычно с массой от 102 до 106 Да.
Покрытие устройства может содержать чередующиеся слои катионного полимера и анионного полимера. Катионный полимер может быть полимером с прямой цепью, но чаще он является полимером с разветвленной цепью, сверхразветвленным полимером или полимером, содержащим множество молекул (катионного) сверхразветвленного полимера, в котором на внешнем слое покрытия к указанным молекулам сверхразветвленного полимера через их концевые функциональные группы ковалентно прикреплены один или несколько антикоагулянтных объектов.
Таким образом, в одном варианте осуществления изобретения один или несколько слоев покрытия, отличающихся от внешнего слоя, могут быть сформированы из одних и тех же молекул сверхразветвленного полимера, что и во внешнем слое, или из аналогичных молекул сверхразветвленного полимера. Характеристики таких суб-слоев могут быть такими, как описано для внешнего слоя, см. Пример 2.2 и 3.3.
Устройство по изобретению может содержать или может быть сформировано из, среди прочего, металла или из синтетического или натурального органического или неорганического полимера или керамического материала.
Таким образом, например, оно может быть сформировано из синтетического или природного органического или неорганического полимера или такого материала, как полиэтилен, полипропилен, полиакрилат, поликарбонат, полисахарид, полиамид, полиуретан (ПУ), поливинилхлорид (ПВХ), полиэфирэфиркетон (ПЭЭК), целлюлоза, силикон или каучук (полиизопрен), пластические материалы, металлы, стекло, керамика и другие известные медицинские материалы или комбинации таких материалов. Другие подходящие материалы субстратов включают фторполимеры, например экпандированный политетрафторэтилен (пПТФЭ), политетрафторэтилен (ПТФЭ), фторированный этилен-пропилен (ФЭП); перфторуглеродные сополимеры, например сополимеры тетрафторэтилена-перфторалкилвинилового эфира (ТФЭ/ПАВЭ), сополимеры тетрафторэтилена (ТФЭ) и перфторметилвинилового эфира (ПМВЭ) и комбинации вышеуказанного, с поперечной сшивкой между цепями полимеров или без нее.
Подходящие металлы включают сплав никеля и титана (нитинол), нержавеющую сталь, титан, кобальт-хром, золото и платину. Предпочтительными являются нитинол и нержавеющая сталь. Также предпочтительным является титан.
Более предпочтительно подходящие металлы включают металлические материалы и славы, такие как сплав кобальта и хрома (ELGILOY), нержавеющую сталь (316L), нержавеющую сталь с высоким содержанием азота, кобальто-хромовый сплав L-605, MP35N, MP20N, тантал, никелево-титановый сплав, нитинол, платиново-иридиевый сплав, золото, магний, и их комбинации.
Предпочтительно покрытая поверхность, к которой прикреплен антикоагулянтный объект (например, гепарин или другой гепариновый компонент) является такой, что она сохраняет нетромбообразующие свойства после стерилизации, например после стерилизации оксидом этилена (ОЭ).
Стерилизацию можно проводить различными способами, известными в данной области техники. Предпочтительным способом стерилизации является использование газообразного оксида этилена. В альтернативном варианте можно использовать и другие способы, такие как облучение, например облучение электронным пучком или гамма-облучение, где такое облучение не разрушает объект, покрытие или и то, и другое.
Предпочтительный вариант осуществления настоящего изобретения относится к предназначенному для имплантации, например постоянной имплантации или другого размещения в анатомическом участке, медицинскому устройству с покрытием. Другие предпочтительные варианты осуществления изобретения включают устройства для временного применения, такие как катетеры и экстракорпоральные контуры. Примеры являются стерильными (например, стерилизованными) медицинскими устройствами для размещения внутри анатомической структуры, имеющей пустое пространство или полость, для укрепления анатомической структуры или поддержки этого пустого пространства. Соответственно, прикрепленный антикоагулянтный объект, например гепарин или другой гепариновый компонент, не элюируется в какой-либо существенной степени и остается на устройстве. Например, после 15 часов промывания NaCl (0,15 М) перед анализом, AT-связывающая способность оставалась достаточной (например, более 1, или 2, или 4, или 5, или 10 пкмоль/см2), и/или при тестировании крови с использованием контура (см. Пример 6) со свежей кровью от здорового донора снижение количества тромбоцитов в крови после теста было существенно ниже при контакте крови с покрытой поверхностью по настоящему изобретению, чем при контакте с непокрытым контролем (например, снижение количества тромбоцитов после анализа крови, контактирующей с покрытой поверхностью, составляет менее 20%, предпочтительно менее 15%, и более предпочтительно менее 10%).
Нетромбообразующий характер устройств по настоящему изобретению можно исследовать с использованием разных способов. Например, нетромбообразующий характер может быть связан с наличием высокой антитромбин-связывающей активности, особенно по сравнению с устройствами, имеющими необработанные поверхности.
Например, предпочтительно, чтобы поверхность устройства, например медицинского устройства, имела антитромбин (AT)-связываюшую способность по меньшей мере 1 (например, по меньшей мере 5) пикомоль AT на квадратный сантиметр (пмоль/см2) поверхности. В других вариантах осуществления изобретения AT-связывающая способность составляет по меньшей мере 6 пмоль/см2, по меньшей 7 пмоль/см2, по меньшей 8 пмоль/см2, по меньшей 9 пмоль/см2 или по меньшей 10 пмоль/см2 поверхности. В некоторых вариантах осуществления изобретения AT-связывающая способность составляет по меньшей мере 100 пмоль/см2 поверхности. АТ-связывающую способность можно измерить методами, известными в данной области техники, например такими, какие описаны в Pasche., et al., «Binding of antithrombin to immobilized heparin under varying flow conditions)) Artif. Organs 15: 481-491 (1991) и US 2007/0264308. Для сравнения, из Sanchez et al (1997) J. Biomed. Mater. Res. 37(1) 37-42, см. Фиг.1, можно заключить, что значения AT около 2,7-4,8 пмоль/см2 (в зависимости от экспериментальной установки) или больше, судя по всему, не вызывают существенной тромбогенной ферментативной активности при контакте с плазмой.
В альтернативном варианте или в качестве дополнения, предпочтительно, чтобы поверхность была нетромбообразующей благодаря высокой способности к подавлению коагуляции и других защитных систем, как показано в контурном тесте анализа крови, описанном в Примере 6. В соответствии с этим анализом, исследуемую поверхность наносили на ПВХ трубку, которую промывали в течение 15 часов с 0,15 М NaCl перед анализом свежей крови.
Тромбогенность непокрытой контрольной поверхности определяли по снижению количества тромбоцитов в контактировавшей крови после анализа. Нетромбообразующие свойства поверхности, приготовленной в соответствии со способом по изобретению, определяли по снижению числа тромбоцитов в крови на существенно меньшую величину (например, снижение количества тромбоцитов после анализа крови, контактировавшей с покрытой поверхностью, составляет менее 20%, предпочтительно менее 15%, и более предпочтительно менее 10%).
Другие похожие способы исследования крови, отличающиеся от контурной модели анализа крови, могут осуществляться специалистом в данной области техники для оценки тромбогенности/нетромбогенности.
Количество антикоагулянтного объекта, связанного с заданной площадью поверхности, можно легко контролировать и регулировать путем выбора определенных размеров и количеств сверхразветвленных молекул для покрытия.
Распределение антикоагулянтного объекта по поверхности можно проанализировать с помощью известных методик окрашивания, например распределение гепарина можно определить с помощью толуидинового синего.
Полезные агенты в покрытии
Слоистое покрытие устройства по изобретению, в частности медицинского устройства, может содержать один или несколько полезных агентов помимо антикоагулянтных объектов. Примеры полезных агентов включают молекулы лекарств и лубриканты. Полезный агент может быть введен в подлежащие слои или во внешний слой покрытия.
Полезные агенты могут быть присоединены к поверхности посредством ковалентной связи, которая может быть деградируемой и обеспечивать возможность миграции (т.е. элюции) полезного агента из полимерной поверхности, или может быть недеградируемой, если требуется длительное действие. В альтернативном варианте они могут быть адсорбированы на поверхности покрытия или встроены в нее (например, в любой из ее слоев) без ковалентной связи.
В медицинских устройствах может оказаться предпочтительным прикреплять молекулы лекарств к сверхразветвленному полимеру в слоистом покрытии (например, сверхразветвленному полимеру из внешнего слоя покрытия) в дополнение к антикоагулянтному объекту. В одном из вариантов осуществления изобретения связь между молекулами лекарства и покрытием является расщепляемой ковалентной связью, обеспечивающей возможность миграции (т.е. элюции) молекул лекарства из полимерной поверхности. В альтернативном варианте лекарство может быть адсорбировано на поверхности покрытия или встроено в нее без ковалентной связи. Лекарства могут быть также встроены в полости сверхразветвленного полимера перед его использованием в получении покрытия. Гидрофобные лекарства могут, в частности, быть встроены с гидрофобные полости сверхразветвленного полимера. Специфической областью применения для такого варианта являются стенты, элюирующие лекарства. Иллюстративные лекарства, которые можно применять в данном варианте осуществления, включают лекарства, предотвращающие рестеноз, такие как анти-ангиогенные или анти-пролиферативные лекарства, такие как паклитаксел и сиролимус. Другой областью применения является применение элюируемого гепарина или других антикоагулянтных объектов. В другом варианте осуществления изобретения к покрытию, в дополнение к антикоагулянтному объекту, может быть присоединено антимикробное лекарственное средство.
Когда полезные агенты ковалентно присоединены к молекуле покрытия, этого можно добиться путем ковалентного прикрепления полезного агента(ов) к молекулам катионного сверхразветвленного полимера, как это описано в настоящем документе, посредством концевых функциональных групп, которые не вовлечены в образование связи с антикоагулянтным объектом. Эти концевые функциональные группы могут иметь исходную функциональность (например, первичный амин), или же их функциональность может быть изменена перед прикреплением к полезному агенту. Присоединение полезных агентов можно осуществлять аналогично тому, что описано выше для присоединения антикоагулянтных объектов.
Полезные агенты могут быть присоединены к сверхразветвленным полимерам по настоящему изобретению перед связыванием с антикоагулянтными объектами, однако обычно их присоединяют после такого связывания.
В целом, слоистое покрытие устройства по настоящему изобретению (например, медицинского устройства) может необязательно содержать по меньшей мере один полезный агент, выбранный из группы, содержащей паклитаксел, таксан или другой аналог паклитаксела; эстроген или производные эстрогена; гепарин или другой ингибитор тромбина, гирудин, гирулог, апиразу, аргатробан, D-фенилаланил-L-поли-L-аргинил-хлорометилкетон или другой антитромботический агент или их смеси; урокиназу, стрептокиназу, тканевой активатор плазминогена или другой тромболитический агент или их смеси; фибринолитический агент; ингибитор вазоспазма; блокатор кальциевых каналов, нитрат, оксид азота, стимулятор оксида азота или другой вазодилятатор; аспирин, тиклопидин или другой антитромбоцитарный агент; фактор роста эндотелия сосудов (ФРЭС) или его аналоги; колхицин или другое антимитотическое средство; или другой ингибитор микротрубочек; цитохалазин или другой ингибитор актина; ингибитор ремоделирования; дезоксирибонуклеиновую кислоту, антисмысловой нуклеотид или другой агент для молекулярного генетического вмешательства; ингибитор клеточного цикла (такой как белковый продукт гена-супрессор ретинобластомы), или его аналоги; GP IIb/IIIa, GP Ib-IX или другой ингибитор поверхностного гликопротеинового рецептора; метотрексат или другой антиметаболит или антипролиферативный агент; агент для противораковой химиотерапии; дексаметазон, дексаметазона натрия фосфат, дексаметазона ацетат или другое производное дексаметазона, или другой противовоспалительный стероид; простагландин, простациклин или их аналоги; иммуносупрессивный агент (такой как циклоспорин или рапамицин (также известный как сиролимус) и их аналоги); антимикробный агент (например, соединения, выбранные из группы, состоящей из диамидинов, йода и йодофоров, пероксигенов, фенолов, бисфенолов, галофенолов, бигуанидов, соединений серебра, триклозана, хлоргексидина, триклокарбана, гексахлорофена, дибромопропамидина, хлороксиленола, фенола и крезола, или их комбинаций); антибиотик, эритромицин или ванкомицин; дофамин,
бромокриптина мезилат, перголида мезилат или другой агонист дофамина; или другой агент для радиотерапии; йод-содержащие соединения, барий-содержащие соединения, золото, тантал, платину, вольфрам или другой тяжелый металл, выступающий в качестве радионепроницаемого агента; пептид, белок, фермент, компонент экстрацеллюлярного матрикса, клеточный компонент или другой биологический агент; катоприл, эналаприл или другой ингибитор ангиотензин-превращающего фермента (АПФ); аскорбиновую кислоту, альфа-токоферол, супероксид-дисмутазу, деферроксамин, 21-аминостероид (лазароид) или другой акцептор свободных радикалов, хелатор железа или антиоксидант; ангиопептин;14C-,3H-,131I-,32P or36S-радиоактивно маркированные формы или другая радиоактивно маркированная форма любого из вышеизложенного; или смесь любых из этих соединений.
Другие полезные агенты, которые можно встроить в поверхность устройства по настоящему изобретению, включают лубриканты, включая полимеры, такие как гидрофильные или гидрогелевые полимеры, содержащие полярные или заряженные функциональные группы, обеспечивающие растворимость в воде. Эти агенты включают полярные группы, обладающие аффинностью к молекулам воды в растворе, и они повсеместно классифицируются как гидрогели. Может также быть уместно присоединять лубриканты к покрытию в дополнение к антикоагулянтному объекту. В одном варианте осуществления изобретения связь между лубрикантом и другим слоем покрытия может быть ковалентной. В альтернативном варианте лубрикант может быть адсорбирован посредством ионной связи или физическим способом или встроен в поверхность покрытия без ковалентной связи. Примерами лубрикантов являются гиалуроновая кислота, производные гиалуроновой кислоты, поли-N-винилирролидон, производные поли-N-винилирролидона, полиэтиленоксид, производные полиэтиленоксида, полиэтиленгликоль, производные полиэтиленгликоля, поливиниловый спирт, производные поливинилового спирта, полиакриловая кислота, производные полиакриловой кислоты, силикон, производные силикона, полисахарид, производные полисахарида, сульфонированный полистирол, производные сульфонированного полистирола, полиаллиламин, производные полиаллиламина, полиэтиленимин, производные полиэтиленимина, полиоксазолин, производные полиоксазолина, полиамин, производные полиамина, и их комбинации, лубриканты не ограничиваются только указанными веществами. Такие полезные агенты могут, например, быть ковалентно связаны с молекулами сверхразветвленного полимера во внешнем слое покрытия.
Когда устройство по изобретению имеет несколько поверхностей, полезный агент(ы) может быть встроен в любую поверхность, пригодную для получения полезного эффекта. Например, полезный агент(ы) может быть встроен в поверхность трубчатого устройства на любой или на обеих из люминальной или аблюминальной сторон. Когда встраивают более одного полезного агента, различные полезные агенты могут быть встроены в одну и ту же поверхность или часть поверхности, или в разные поверхности или части поверхности.
Устройства по настоящему изобретению могут иметь одно или несколько из следующих преимуществ по меньшей мере в некоторых вариантах осуществления:
- Можно контролировать количество антикоагулянтного объекта, соединенного с самым внешним слоем;
- Можно обеспечить присоединение антикоагулянтного объекта, например гепарина, по одному концу (одной точке), так и по множеству точек, хотя предпочтительным является присоединение по одному концу (особенно по восстанавливающему концу);
- Можно контролировать длину ковалентного соединения (линкера(ов) и спейсера(ов)) между объектом и сверхразветвленным полимером;
- Можно использовать гепарин полной длины, избегая, таким образом, расщепления гепарина и оптимизируя использование сырьевого гепарина;
- Применение гепарина полной длины или гепарина, присоединенного через спейсер, может улучшать биоактивность связанного гепарина;
- Можно достичь однородного распределения антикоагулянтного объекта по внешнему слою покрытия;
- Можно получить однородное покрытие, маскирующее внутренние свойства, например низкие тромбогенные свойства, устройства, независимо от материала, из которого оно изготовлено;
- Можно получить относительно гладкое и/или скользкое покрытие;
- Можно контролировать и улучшить биодоступность антикоагулянтного объекта;
- Можно получить нетромбообразующее покрытие, не высвобождающее гепарин, и имеющее, таким образом, более продолжительный срок службы;
- Можно получить покрытие, сохраняющее свои свойства при износе;
- Можно получить покрытие, сохраняющее свойства при стерилизации (например, с помощью ОЭ);
- Можно получить самовосстанавливающееся покрытие, благодаря возможности обратимого формирования ионных взаимодействий между слоями;
- Можно свести к минимуму число этапов приготовления покрытия с помощью предварительно изготовленных компонентов;
- Можно обеспечить надежный производственный процесс с применением предварительно изготовленных компонентов;
- Можно получить покрытие, в котором предварительно изготовленный конъюгат с ковалентно связанным гепарином можно использовать в процессе создания покрытия;
- Можно повысить биосовместимость полученного покрытия;
- Покрытие по настоящему изобретению может снизить потребность в системном гепарине и снизить вероятность контактной активации;
- Можно получить медицинское устройство с комбинацией свойств лубрикантности и тромборезистентности, что может быть полезно в некоторых областях применения, например в нейрососудистых областях применения;
- Можно получить медицинское устройство, имеющее комбинацию свойств элюирования лекарства и тромборезистентности, что может быть полезно в некоторых областях применения, например в стентах, элюирующих лекарства, и баллонах, элюирующих лекарства;
- Можно получить медицинское устройство, имеющее комбинацию противовоспалительных свойств и свойств тромборезистентности, что может быть полезно в некоторых областях применения, например сердечно-сосудистых областях применения;
- Можно получить устройство для анализа или разделения с улучшенной способностью связывания биомолекул; и
- Можно получить устройство для анализа или разделения с увеличенным временем сохранения активности гепарина.
Данное изобретение проиллюстрировано (но не в порядке его ограничения) следующими примерами.
Примеры
Все образцы Lupasol получали от BASF. Lupasol® WF (этилендиаминовый центральный фрагмент) имел молекулярную массу 25 кДа по результатам экспериментов по светорассеянию. Декстран-сульфат получали от pK Chemicals A/S (РКС), а ПАМАМ дендримеры (этилендиаминовый центральный фрагмент) получали от Sigma Aldrich и Dendritech. ПАМАМ-G6.0-NH2 является ПАМАМ дендримером (6-я генерация) с молекулярной массой около 60 кДа. PAMAM-G8.0-NH2 является ПАМАМ дендримером (8-я генерация) с молекулярной массой около 230 кДа. ППИ G5 дендример (бутан-1,4-диаминовый центральный фрагмент) получали от Aldrich. ППИ G5 является дендримером (5-я генерация) с молекулярной массой около 7 кДа. Полиамин Epomin Р-1050 (этилендиаминовый центральный фрагмент) был получен от Nippon Shokubai и имел среднюю молекулярную массу 70 кДа. Полиамин G-35 был получен от Wuhan Bright Chemicals и имел среднюю молекулярную массу 70 кДа. Все маточные растворы полиаминов имели концентрацию 5 масс.% в воде. Маточный раствор декстран-сульфата имел концентрацию 6 масс.% в воде. Перед использованием растворы надлежащим образом разбавляли. Промывание водой, где это необходимо, проводили между каждыми этапами обработки.
Заголовки экспериментов
1. Получение подлежащего слоя
2. Получение нетромбообразующего покрытия, содержащего сверхразветвленный полимер во внешнем слое покрытия
3. Получение нетромбообразующего покрытия, содержащего сверхразветвленный полимер, функционализированный предварительно полученным гепарином во внешнем слое покрытия
4. Модифицированные гепариновые объекты
5. Модифицированные сверхразветвленные полимеры
6. Оценка плотности гепарина и потери тромбоцитов крови
7. Получение промежуточных веществ
8. Получение гидрофильных и лубрикантных покрытий
9. Получение покрытий, элюирующих лекарства
10. Исследования биосовместимости
11. Гемосовместимость ОЭ-стерилизованных покрытий, содержащих сверхразветвленные полимеры
Пример 1. Получение подлежащего слоя
Пример 1.1. Получение подлежащего слоя, содержащего Lupasol® SN
ПВХ поверхность предварительно обрабатывали с использованием способа, описанного Larm et al. в EP-B-0086186 в EP-495820 (послойно, взаимодействиями зарядов полиэлектролитов), с завершающим слоем из сульфатированного полисахарида.
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SN, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая сульфатированным полисахаридом.
Пример 1.2. Получение подлежащего слоя, содержащего Lupasol® WF
ПВХ поверхность предварительно обрабатывали с использованием способа, описанного Larm et al. в EP-B-0086186 в EP-495820 (послойно, взаимодействиями зарядов полиэлектролитов), с завершающим слоем из сульфатированного полисахарида.
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® WF, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая сульфатированным полисахаридом.
Пример 1.3. Получение подлежащего слоя, содержащего ПАМАМ-G6.0-NH2 дендример
На кристаллы кварцевых микровесов (QCM), покрытые золотом (QSX 301, Q-Sense), наносили покрытие в соответствии с Примером 1.1 с использованием 5 масс.% МеОН ПАМАМ-G6.0-NH2 (мл/л) с получением покрытия из трех двойных слоев, состоящих из чередующихся слоев ПАМАМ-G6.0-NH2 и сульфатированного полисахарида (6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Промывали водой в течение 2 минут между каждыми этапами адсорбции. Золотую поверхность грунтовали 3 двойными слоями, заканчивая сульфатированным полисахаридом.
Пример 1.4. Получение подлежащего слоя, содержащего Lupasol® SK и ПАМАМ-G6.0-NH2 дендример, функционализированный гепарином
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SK, 5 масс.% в воде, 10 минут) и отрицательно заряженного конъюгата ПАМАМ-гепарина (400 мг/л, из Примера 5.2, 20 минут). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и конъюгата ПАМАМ-гепарина называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая конъюгатом ПАМАМ-гепарина из Примера 5.2.
Пример 1.5. Получение подлежащего слоя с использованием Lupasol® WF и ПАМАМ-G6.0-NH2 дендримера, функционализированного гепарином
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SK, 5 масс.% в воде, 10 минут) и отрицательно заряженного конъюгата ПАМАМ-гепарина (400 мг/л, из Примера 5.2, 20 минут). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и конъюгата ПАМАМ-гепарина называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая конъюгатом ПАМАМ-гепарина из Примера 5.2.
Пример 1.6. Получение подлежащего слоя, содержащего G-35
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (G-35, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая сульфатированным полисахаридом.
Пример 1.7. Получение подлежащих слоев с использованием Lupasol® SK
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SK, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая сульфатированным полисахаридом.
Пример 1.8. Получение подлежащих слоев с применением Epomin P-1050
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Epomin P-1050, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, заканчивая сульфатированным полисахаридом.
Пример 2. Получение нетромбообразующего покрытия, содержащего сверхразветвленный полимер во внешнем слое покрытия
Пример 2.1. Получение внешнего слоя покрытия, содержащего Lupasol® WF, на подлежащем слое, содержащем Lupasol® SN
Раствор Lupasol® WF адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.1, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.2. Получение внешнего слоя покрытия, содержащего Lupasol® WF, на подлежащем слое, содержащем Lupasol® WF
Раствор Lupasol® WF (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.2, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.3. Получение внешнего слоя покрытия, содержащего ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем Lupasol® SN
Раствор ПАМАМ-G6.0-NH2 (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.1, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.4. Получение внешнего слоя покрытия, содержащего ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем ПАМАМ-G6.0-NH2 дендример
Раствор ПАМАМ-G6.0-NH2 (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.3, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.5. Получение внешнего слоя покрытия, содержащего G-35, на подлежащем слое, содержащем Lupasol® SN
Раствор G-35 (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.1, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.6. Получение внешнего слоя покрытия, содержащего G-35, на подлежащем слое, содержащем G-35
Раствор G-35 (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.6, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.7. Получение внешнего слоя покрытия, содержащего 10 масс.% Lupasol® WF и 90 масс.% Lupasol® SN, на подлежащем слое, содержащем Lupasol® SN
Смесь 10 масс.% Lupasol® WF (5 масс.%) и 90 масс.% Lupasol® SN (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.1, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, при соединенного ионной связью.
Пример 2.8. Получение внешнего слоя покрытия, содержащего 10 масс.% Lupasol® WF и 90 масс.% Lupasol® SK, на подлежащем слое, содержащем Lupasol® SK
Смесь 10 масс.% Lupasol® WF (5 масс.%) и 90 масс.% Lupasol® SK (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.7, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.9. Получение внешнего слоя покрытия, содержащего Lupasol® WF, на подлежащем слое, содержащем Lupasol® SK
Раствор Lupasol® WF (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.7, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.10. Получение внешнего слоя покрытия, содержащего Epomin Р-1050, на подлежащем слое, содержащем Lupasol® SN
Раствор Epomin Р-1050 (5 масс.%) адсорбировали в течение 10 минут на предварительно подготовленной поверхности покрытия из Примера 1.1, затем в течение 1 часа выполняли этап связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрид, 2,5 масс.% в воде). Промывку водой в течение 2 минут проводили между каждыми этапами адсорбции. Полученное нетромбообразующее покрытие перед оценкой его нетромбообразующих свойств обрабатывали раствором бората/фосфата для удаления гепарина, присоединенного ионной связью.
Пример 2.11. Получение внешнего слоя покрытия, содержащего гепаринизированный Lupasol® WF, на подлежащем слое, содержащем Lupasol® SN
Lupasol® WF (5 масс.% в воде) адсорбировали на подлежащем слое, который по существу соответствовал описанному в примере 1.1, получая положительно заряженную поверхность. Затем гепарин-натрий (325 мг/л) связывали с положительно заряженным слоем с использованием 1-этил-3-(3-диметиламинопропил)карбодиимида (ЭДК) (23,35 мг/л) при комнатной температуре в течение 60 минут, с последующей промывкой раствором бората/фосфата для удаления несвязавшегося гепарина перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 2.12. Получение внешнего слоя покрытия, содержащего функционализированный апиразой Lupasol® WF, на подлежащем слое, содержащем Lupasol® SN
Апиразу (более 200 единиц/мг белка) из картофеля получали от Sigma-Aldrich. Содержание карбоксильных групп в апиразе составило примерно 90 моль COOH на 1 моль апиразы, на основе аминокислотного анализа, проведенного Aminosyraanalyscentralen, Швеция. Карбоксильные группы в нетромбообразующих агентах, таких как апираза, можно использовать для связывания с амин-содержащими сверхразветвленными полимерами с использованием ЭДК или ЭДК-подобных реагентов, по существу как описано в Примере 2.11.
Пример 3. Получение нетромбообразующего покрытия, содержащего предварительно полученный сверхразветвленный полимер, функционализированный гепарином, во внешнем слое покрытия
Пример 3.1. Получение внешнего слоя покрытия, содержащего функционализированный гепарином ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем Lupasol® SN
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SN, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями и одним слоем Lupasol® SN. Функционализированный гепарином ПАМАМ-G6.0-NH2 дендример (150 мг/л) из Примера 5.2 наносили на положительно заряженное покрытие из Lupasol® SN в течение 1 часа, с последующей промывкой раствором бората/фосфата для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 3.2. Получение внешнего слоя покрытия, содержащего функционализированный гепарином ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем Lupasol® SK, Lupasol® WF и функционализированный гепарином ПАМАМ-G6.0-NH2 дендример
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SK, 5 масс.% в воде) и отрицательно заряженного конъюгата ПАМАМ-гепарин (400 мг/л, из Примера 5.2). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и конъюгата ПАМАМ-гепарин называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, как уже было описано (см. также Пример 1.4). Функционализированный гепарином ПАМАМ-G6.0-NH2 дендример (400 мг/л) из Примера 5.2 наносили на положительно заряженное покрытие из Lupasol® WF в течение 20 минут, с последующей промывкой водой для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 3.3. Получение внешнего слоя покрытия, содержащего функционализированный гепарином ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем Lupasol® WF и функционализированный гепарином ПАМАМ-G6.0-NH2 дендример
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® WF, 5 масс.% в воде) и отрицательно заряженного конъюгата ПАМАМ-гепарин (400 мг/л, из Примера 5.2). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и конъюгата ПАМАМ-гепарин называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями, как уже было описано (см. также Пример 1.5), а затем одним слоем Lupasol® WF. Функционализированный гепарином ПАМАМ-G6.0-NH2 дендример (400 мг/л) из Примера 5.2 наносили на положительно заряженное покрытие из Lupasol® WF в течение 20 минут, с последующей промывкой водой для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 3.4. Получение внешнего слоя покрытия, содержащего функционализированный гепарином ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем Lupasol® SN
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SN, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями и одним слоем Lupasol® SN. Функционализированный гепарином ПАМАМ-G6.0-NH2 дендример (425 мг/л) из Примера 5.2 наносили на положительно заряженное покрытие из Lupasol® SN в течение 1 часа, с последующей промывкой раствором бората/фосфата для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 3.5. Получение внешнего слоя покрытия, содержащего функционализированный гепарином Lupasol® WF, на подлежащем слое, содержащем Lupasol® SN
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SN, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями и одним слоем Lupasol® SN. Функционализированный гепарином Lupasol® WF (425 мг/л) из Примера 5.3 наносили на положительно заряженное покрытие из Lupasol® SN в течение 1 часа, с последующей промывкой раствором бората/фосфата для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 3.6. Получение внешнего слоя покрытия, содержащего функционализированный гепарином ПАМАМ-G6.0-NH2 дендример, на подлежащем слое, содержащем Lupasol® SN
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SN, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями и одним слоем Lupasol® SN. Функционализированный гепарином ПАМАМ-G6.0-NH2 дендример (425 мг/л) из Примера 5.6 наносили на положительно заряженное покрытие из Lupasol® SN в течение 1 часа, с последующей промывкой раствором бората/фосфата для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 3.7. Получение внешнего слоя покрытия, содержащего функционализированный ППИ G5 дендример, на подлежащем слое, содержащем Lupasol® SN
Люминальную поверхность ПВХ трубки (внутренний диаметр 3 мм) промывали изопропанолом и окислительным агентом. Грунтовку проводили путем поочередной адсорбции положительно заряженного полиамина (Lupasol® SN, 5 масс.% в воде) и отрицательно заряженного сульфатированного полисахарида (декстран-сульфат, 6 масс.% в воде). Полиамин поперечно сшивали бифункциональным альдегидом (кротоновым альдегидом). Каждую пару из полиамина и сульфатированного полисахарида называли одним двойным слоем. ПВХ поверхность грунтовали 3 двойными слоями и одним слоем Lupasol® SN. Функционализированный гепарином ППИ G5 дендример (425 мг/л) из Примера 5.7 наносили на положительно заряженное покрытие из Lupasol® SN в течение 1 часа, с последующей промывкой раствором бората/фосфата для удаления несвязавшегося гепаринового конъюгата перед оценкой нетромбообразующих свойств полученного покрытия.
Пример 4. Модифицированные гепариновые объекты
Пример 4.1. Получение гепарина, функционализированного альдегидом в концевой точке
Гепарин, функционализированный альдегидом, готовили по существу так, как описано в Примере 2 из USP 4,613,665.
Пример 4.2. Получение гепарина, функционализированного тиолом в концевой точке

Гепарин, деполимеризованный под действием азотистой кислоты, с альдегидными группами (приготовленный по существу так, как в Примере 2 из US 4,613,665) (5,00 г, 1,0 ммоль), гидрохлорид цистеамина (0,57 г, 5,0 ммоль) и натрия хлорид (0,6 г) растворяли в очищенной воде. Значение pH доводили до 6,0 с помощью 1 М NaOH (в воде) и 1 М HCl (в воде). К раствору добавляли 3,1 мл 5% водного раствора NaCNBH3 (0,16 г, 2,5 ммоль), и реакцию проводили при перемешивании в течение ночи при комнатной температуре. Значение pH доводили до 11,0 с помощью 1 М NaOH (водным раствором), и полученный продукт диализовали с очищенной водой с использованием диализной мембраны SpectraPor (HOMM 1 кД, размер 45 мм) в течение трех суток. Реакционную смесь концентрировали и лиофилизировали с получением 2,6 г белого легкого порошка.
Пример 4.3. Получение гепарина, функционализированного алкином в концевой точке
Функционализированный алкином гепарин, деполимеризованный под действием азотистой кислоты, готовили по существу так, как в Примере 3a из WO 2010/029189.
Пример 4.4. Получение нативного гепарина, функционализированного алкином в концевой точке
Функционализированный алкином нативный гепарин готовили по существу так, как в Примере 3b из WO 2010/029189.
Пример 4.5. Получение гепарина, функционализированного азидом в концевой точке, и нативного гепарина, функционализированного азидом
Функционализированный азидом гепарин, деполимеризованный под действием азотистой кислоты, и функционализированный азидом нативный гепарин готовили по существу так, как в Примере 4 из WO 2010/029189.
Пример 5. Модифицированные сверхразветвленные полимеры
Пример 5.1. Получение ПАМАМ-G6.0-NH2 дендримера, функционализированного алкеном
Готовили маточный раствор с 3,75 мг NHS-активированной 5-гексеновой кислоты/мл MeOH. См. Пример 7.1 по приготовлению NHS-активированного алкена.
2 мл 5 масс.% раствора ПАМАМ-G6.0-NH2 в MeOH добавляли к 1 мл маточного раствора (3,75 мг NHS-активированной 5-гексеновой кислоты) и 9 мл MeOH (0°C). Реакцию проводили в течение ночи. Растворитель выпаривали с помощью роторного испарителя и вакуумной печи. Высокую чистоту полученного материала подтверждали методами1H и13C ЯМР. Достигали степени функционализации 2% (5-6 алкенов на дендример).
Пример 5.2. Получение функционализированного гепарином ПАМАМ-G6.0-NH2 дендримера с сохранением специфической активности

Гепарин, функционализированный альдегидом в концевой точке, из Примера 4.1 (5,0 г; 0,56 ммоль) растворяли в 15 мл ацетатного буферного раствора (pH 5,0) при интенсивном перемешивании. 2 мл 5 масс.% раствора ПАМАМ-G6.0-NH2 дендримера (этилендиаминовый центральный фрагмент) (80,6 мг; 1,39 моль) в MeOH добавляли к раствору гепарина с последующим добавлением 10 мл цианоборогидрида натрия (2,5 масс.% в H2O). Раствор оставляли при перемешивании в вытяжном шкафу в течение ночи при комнатной температуре. Раствор переносили в диализный мешок (HOMM 50,000 Да) и тщательно диализовали. Содержимое диализного мешка затем переносили в круглодонную колбу и лиофилизировали в течение ночи. Масса сухого вещества в содержимом колбы составила 830 мг (~60 гепариновых цепей/ПАМАМ-G6.0-NH2 дендример или 23% функционализация первичных аминов в ПАМАМ-G6.0-NH2). Специфическая активность связанного с ПАМАМ гепарина в конъюгате составила более 100 МЕ/мг. Используемый в методике гепарин перед связыванием имел специфическую активность примерно 100 МЕ/мг.
Пример 5.3. Получение функционализированного гепарином Lupasol® WF с сохраненной специфической активностью
Функционализированный гепарином Lupasol® WF готовили по существу так, как описано в Примере 5.2.
Пример 5.4. Получение функционализированного азидом Lupasol® WF
Функционализированный азидом Lupasol® WF можно приготовить по существу так, как описано для Lupasol® SN в Примере 2а из WO 2010/029189.
Пример 5.5. Получение функционализированного алкином Lupasol® WF
Функционализированный алкином Lupasol® WF можно приготовить по существу так, как описано для Lupasol® SN в Примере 2b из WO 2010/029189.
Пример 5.6. Получение функционализированного гепарином ПАМАМ-G6.0-NH2 дендримера с сохранением специфической активности
Функционализированный гепарином ПАМАМ-G6.0-NH2 дендример готовили по существу так, как описано в Примере 5.2.
Пример 5.7. Получение функционализированного гепарином ППИ G5 дендримера с сохранением специфической активности
Функционализированный гепарином ППИ G5 дендример готовили по существу так, как описано в Примере 5.2.
Пример 5.8. Получение функционализированных сверхразветвленных полимеров
Специалист в данной области техники может приготовить сверхразветвленные полимеры с химическими группами, или функциональностями, выбранными из Таблицы 3 (Функциональные группы 1 и 2).
Специалист в данной области техники может приготовить нетромбообразующие частицы (например, гепарин) с химическими группами, или функциональностями, выбранными из Таблицы 3 (Функциональные группы 1 и 2).
Специалист в данной области техники может провести реакцию функционализированных сверхразветвленных полимеров с функционализированным нетромбообразующим объектом (например, гепарином) с получением сверхразветвленного полимера, модифицированного нетромбообразующим объектом (например, гепарином).
Пример 6. Оценка плотности гепарина и снижения количества тромбоцитов крови
Анализ плотности гепарина (для измерения содержания гепарина в покрытии)
Количественное определение иммобилизованного гепарина проводили по существу так, как описано в Smith R.L. and Gilkerson E (1979), Anal. Biochem., 98, 478-480.
Тест с окраской толуидиновым синим (для оценки распределения гепарина)
Распределение гепарина оценивали с использованием красящих растворов толуидинового синего. Раствор готовили путем растворения 200 мг толуидинового синего в 1 л воды. Образцы подвергали окрашиванию раствором в течение 2 минут перед тщательной промывкой водой. Синее/фиолетовое окрашивание указывало на то, что отрицательно заряженные гепариновые молекулы однородно распределены во внешнем слое покрытия, как показано на Фиг.9, часть B.
Контурный тест оценки крови (для измерения потери тромбоцитов)
Контурный тест оценки крови проводили на покрытых образцах, чтобы продемонстрировать сохраненную биоактивность гепарина на нетромбообразующей поверхности. Вначале люминальную сторону покрытой трубки промывали 0,15 М NaCl в течение 15 часов со скоростью потока 1 мл/мин для обеспечения удаления несвязавшегося гепарина и получали стабильную поверхность. Затем промытые трубки инкубировали в модели с контуром Chandler, по существу в соответствии с Andersson et al. (Andersson, J.; Sanchez, J.; Ekdahl, K.N.; Elgue, G.; Nilsson, В.; Larsson, R. J Biomed Mater Res A 2003, 67 (2), 458-466) при 20 об./мин. Тромбоциты из свежей крови и крови, собранной из контура, подсчитывали в гемоцитометре для измерения потери тромбоцитов, указывающей на тромбоз.
Пример 6.1. Свойства покрытия с точки зрения плотности гепарина и потери тромбоцитов после контакта нетромбообразующей поверхности с кровью
Число тромбоцитов, присутствующих после контакта крови с нетромбообразующим покрытием поверхности, рассчитывали в виде процентного отношения к числу тромбоцитов до контакта крови с нетромбообразующим покрытием поверхности и представляли графически для различных образцов на Фиг.8.
Как видно выше на Фиг.8, почти никакой потери тромбоцитов (потеря тромбоцитов указывает на тромбоз) для тестируемых покрытий, содержащих гепарин, не наблюдается. Непокрытая ПВХ трубка и поверхность с внешним слоем сульфатированных полисахаридов («контроль свертывания») показали значительный тромбоз в этом эксперименте.
Пример 6.2. Окрашивание нетромбообразующей поверхности с использованием Толуидинового синего
Трубки из Примера 2.2 подвергали окрашиванию раствором толуидинового синего (200 мг/л воды) путем погружения в раствор на 2 минуты с последующей интенсивной промывкой водой. Наблюдаемый синий/фиолетовый цвет на люминальной поверхности трубки указывал на ковалентное концевое присоединение функционализированного гепарина.
Пример 6.3. Окрашивание нетромбообразующей поверхности толуидиновым синим
Трубки из Примера 3.2 подвергали окрашиванию раствором толуидинового синего (200 мг/л воды) путем погружения в раствор на 2 минуты с последующей интенсивной промывкой водой. Наблюдаемый синий/фиолетовый цвет на люминальной повехности трубки указывал на ковалентное концевое присоединение функционализированного гепарина в конъюгате ПАМАМ-гепарин. Окрашивание люминальной поверхности ПВХ трубки можно видеть на Фиг.9.
Пример 6.4. Окрашивание нетромбообразующей поверхности толуидиновым синим
Трубки из Примера 3.3 подвергали окрашиванию раствором толуидинового синего (200 мг/л воды) путем погружения в раствор на 2 минуты с последующей интенсивной промывкой водой. Наблюдаемый синий/фиолетовый цвет на люминальной поверхности трубки указывал на ковалентное концевое присоединение функционализированного гепарина в конъюгате ПАМАМ-гепарин.
Пример 7. Получение промежуточных веществ
Пример 7.1. Синтез NHS-активированной 5-гексеновой кислоты

Гексеновую кислоту (1,00 г, 8,76 ммоль) и гидроксисукцинимид (1,01 г, 8,76 ммоль) растворяли в 10 мл ДХМ и перемешивали при 0°C. Раствор ДЦК (1,81 г, 8,76 ммоль) в ДХМ (3 мл) медленно добавляли по каплям в реакционную смесь при 0°C. Реакцию оставляли перемешиваться в течение ночи, после чего побочные продукты удаляли фильтрацией, и оставшийся раствор концентрировали с использованием роторного испарителя и сушили под вакуумом в печи. Высокую чистоту полученного материала подтверждали методами1H и13C ЯМР.
Пример 8. Получение гидрофильных и лубрикантных покрытий
Пример.8.1. Гидрофильные и лубрикантные покрытия, содержащие Lupasol® SK и Lupasol® WF
QCM кристаллы покрывали в соответствии с Примером 1.7 с использованием Lupasol® SK с получением трехслойного покрытия, состоящего из чередующихся слоев Lupasol® SK и сульфатированного полисахарида. Затем на сульфатированный полисахарид наносили слой Lupasol® WF с получением покрытия с катионным сверхразветвленным полимером в качестве наружного слоя. Проводили 2-минутную промывку водой между каждым этапом адсорбции. Полученные покрытия анализировали, определяя угол смачивания (УС). Стационарный УС 53,0° (среднее значение по результатам для двух образцов) свидетельствовал о том, что получено гидрофильное и лубрикантное покрытие.
Пример 8.2. Гидрофильное и лубрикантное покрытие, содержащее Lupasol® SK, Lupasol® WF и гепарин
QCM кристаллы покрывали в соответствии с Примером 1.7 с использованием Lupasol® SK с получением трехслойного покрытия, состоящего из чередующихся слоев Lupasol® SK и сульфатированного полисахарида. Затем на сульфатированный полисахарид наносили слой Lupasol® WF с последующим 1-часовым этапом связывания с гепарином, деполимеризованным под действием азотистой кислоты (325 мг/л), из Примера 4.1, с использованием восстанавливающего агента (натрия цианоборогидрида, 2,5 масс.% в воде). Проводили 2-минутную промывку водой между каждым этапом адсорбции. Полученное лубрикантное покрытие обрабатывали раствором бората/фосфата для удаления возможного гепарина, присоединенного посредством ионной связи, перед анализом угла смачивания (УС). Стационарный УС 53,0° (среднее значение по результатам для двух образцов) свидетельствовал, что получено гидрофильное и лубрикантное покрытие.
Пример 9. Получение покрытий, элюирующих лекарства
Пример 9.1. Включение доксорубицина в гепаринизированное покрытие
Доксорубицин встраивали в покрытие на QCM кристаллах, приготовленное по существу, как в Примере 2.3, путем помещения QCM кристаллов в водный раствор доксорубицина (1 мг/25 мл воды). После этапа загрузки проводили тщательную промывку покрытия с загруженным лекарством водой перед флуоресцентным исследованием покрытия. Перед флуоресцентным анализом кристаллы сушили в вакуумной печи. Интенсивная красная флуоресценция указывала на то, что доксорубицин успешно встроен в покрытие.
Пример 9.2. Включение доксорубицина и его последующее высвобождение из покрытия, содержащего гепаринизированный ПАМАМ-G6.0-NH2 дендример, Lupasol® SK и Lupasol® WF
Доксорубицин встраивали в покрытие на QCM кристаллах, приготовленное по существу, как в Примере 3.2, путем помещения QCM кристаллов в водный раствор доксорубицина (1 мг/25 мл воды). После этапа загрузки проводили тщательную промывку покрытия с загруженным лекарством водой перед флуоресцентным исследованием покрытия. Перед флуоресцентным анализом кристаллы сушили в вакуумной печи. Интенсивная красная флуоресценция указывала на то, что доксорубицин успешно встроен в покрытие. Оболочку с загруженным лекарством подвергали воздействию 2 М раствора NaCl и окончательно промывали водой с последующей сушкой в вакуумной печи перед дополнительным анализом посредством флуоресцентной микроскопии. Отсутствие красной флуоресценции указывало на то, что доксорубицин элюировался из покрытия.
Пример 9.3. Включение доксорубицина и последующее его высвобождение из покрытия, содержащего гепаринизированный ПАМАМ-G6.0-NH2 дендример и Lupasol® WF
Доксорубицин может быть встроен в QCM кристаллы, приготовленные по существу, как в Примере 3.3, путем помещения QCM кристаллов в водный раствор доксорубицина (1 мг/25 мл воды), с последующей тщательной промывкой покрытия с загруженным лекарством водой перед флуоресцентным исследованием покрытия. Интенсивная красная флуоресценция указывает на то, что доксорубицин успешно встроен в покрытие. Оболочку с загруженным лекарством подвергали воздействию 2 М раствора NaCl с последующей сушкой в вакуумной печи перед дополнительным анализом посредством флуоресцентной микроскопии. Отсутствие красной флуоресценции указывало на то, что доксорубицин элюировался из покрытия.
Пример 10. Исследование биосовместимости
Получение биосовместимой поверхности на ПЭВП (полиэтилене высокой плотности)
Листы ПЭВП высокой плотности (30 см2, эталонный стандарт Фармакопеи США) очищали путем промывки изопропанолом и окислительным способом. Затем листы грунтовали, как в Примере 1, 3 двойными слоями, заканчивая сульфатированным полисахаридом. Осуществляли реакцию грунтованных слоев, как в Примере 2, со сверхразветвленным полиамином, с последующим этапом связывания, на котором присоединяли функционализированный гепарин, или, как в Примере 3, вначале с полиаминовым слоем, а затем со сверхразветвленным полимером, функционализированным гепарином, с отрицательным результирующим зарядом. Покрытие получали, погружая материалы в покрывающие растворы. Было установлено, что покрытия являются нетоксичными в анализе цитотоксичности с использованием теста элюирования в минимальной питательной среде (MEM), как описано в ISO 10993 (см. Пример 10.1). Результаты показали нетоксичные биосовместимые свойства исследуемой поверхности.
Пример 10.1. Таблица биосовместимости
Пример 11. Гемо-совместимость ОЭ-стерилизованных покрытий, содержащих сверхразветвленные полимеры ОЭ стерилизация
Субстраты с различными покрытиями со сверхразветвленным полимером, функционализированным гепарином, во внешнем слое покрытия, приготовленные, как описано в Примерах 2 или 3, подвергали стерилизации путем обработки оксидом этилена (ОЭ). ОЭ-стерилизацию проводили с использованием стандартного способа стерилизации, используемого для медицинских устройств.
Контурный тест оценки крови (для определения потери тромбоцитов)
ОЭ-стерилизованные и промытые трубки инкубировали в модельном контуре Chandler, выполненном по существу в соответствии с Andersson et al. (Andersson, J.; Sanchez, J.; Ekdahl, K.N.; Elgue, G.; Nilsson, В.; Larsson, R. J Biomed Mater Res A 2003, 67 (2), 458-466), см. Пример 6.
Как видно в таблице внизу, практически никакой потери тромбоцитов (потеря тромбоцитов указывает на тромбоз) при использовании ОЭ-стерилизованных гепариновых покрытий с сверхразветвленные гепариновые конъюгатами, приготовленными в соответствии с Примерами 2 и 3, не наблюдается. Для необработанной ПВХ трубки и контроля свертывания (поверхности с внешним слоем из сульфатированных полисахаридов, не связывающих антитромбин) отмечен значительный тромбоз в этом эксперименте.
Пример 11.1. Стабильность покрытия с точки зрения потери тромбоцитов крови после ОЭ стерилизации
Эти результаты показали, что нетромбообразующие свойства стабильных поверхностей, приготовленных в соответствии с настоящим изобретением, сохраняются, несмотря на воздействие жестких условий стерилизации.
На протяжении всего описания и формулы настоящего изобретения, если из контекста не следует иное, выражение «включать» и «содержать» и их варианты, такие как «включает», «содержит» и «включающий», «содержащий» следует понимать как включение указанного числа, этапа, множества чисел или этапов, но не как исключение других чисел, этапов, групп чисел или этапов.
Все патенты и патентные заявки, упомянутые в описании настоящего изобретения, настоящим включены в настоящее описание во всей своей полноте посредством ссылки.
Настоящее изобретение охватывает все комбинации предпочтительных и наиболее предпочтительных, подходящих и наиболее подходящих групп и указанных выше вариантов осуществления.
Реферат
Группа изобретений относится к медицине. Описано устройство, имеющее поверхность, содержащую слоистое покрытие, в котором внешний слой покрытия содержит множество молекул катионного сверхразветвленного полимера, характеризующихся (i) наличием центрального фрагмента с молекулярной массой 14-1,000 Да, (ii) общей молекулярной массой 1,500-1,000,000 Да, (iii) отношением общей молекулярной массы к молекулярной массе центрального фрагмента по меньшей мере 80:1; и (iv) наличием концевых функциональных групп, где одна или несколько из указанных концевых функциональных групп ковалентно связаны с антикоагулянтным объектом. Устройство включает материал, который обладает большей стабильностью во времени. 5 н. и 16 з.п. ф-лы, 10 ил., 3 табл., 11 пр.





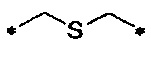

















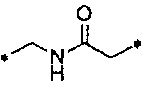







Комментарии